Органическая химия в пищевой промышленности
Органическая химия в пищевой промышленности
Содержание.
- Что такое органическая химия?
- Открытие органической химии.
- Роль органической химии в пищевой промышленности
- Органические красители
- Органические красители
- Процесс производства органических красителей.
- Химический состав пищи.
- Белки.
- Жиры.
- Углеводы.
Что такое органическая химия?
- Органическая химия , наука, изучающая соединения углерода с другими элементами (органические соединения), а также законы их превращений. Название «органическая химия» возникло на ранней стадии развития науки, когда предмет изучения ограничивался соединениями углерода растительного и животного происхождения. Не все соединения углерода классифицируются как органические. Например, СО 2 , HCN, CS 2 традиционно относят к неорганическим.

Открытие органической химии
В 1822 г. Вёлер открыл циановую кислоту и определил ее состав, оказавшийся идентичным составу «гремучей кислоты» – соединения с другими свойствами, исследованного почти одновременно Ю. Либихом. Явление было названо изомерией, а сами вещества – изомерами. В 1828 г. Вёлер доказал возможность получения мочевины упариванием водного раствора цианата аммония, что было истолковано как первый в истории науки искусственный синтез органического вещества. Это открытие сыграло большую роль в ниспровержении идей витализма (существования т.н. жизненной силы).
Фридрих Вёлер (1800-1882)
Роль органической химии в пищевой промышленности
Органическая химия далеко проникла в пищевую промышленность. Во многие пищевые продукты добавляют химически соединения, прежде всего для придания привлекательного вида, приятного запаха, для консервирования и придания большей стойкости к окислению кислородам воздуха.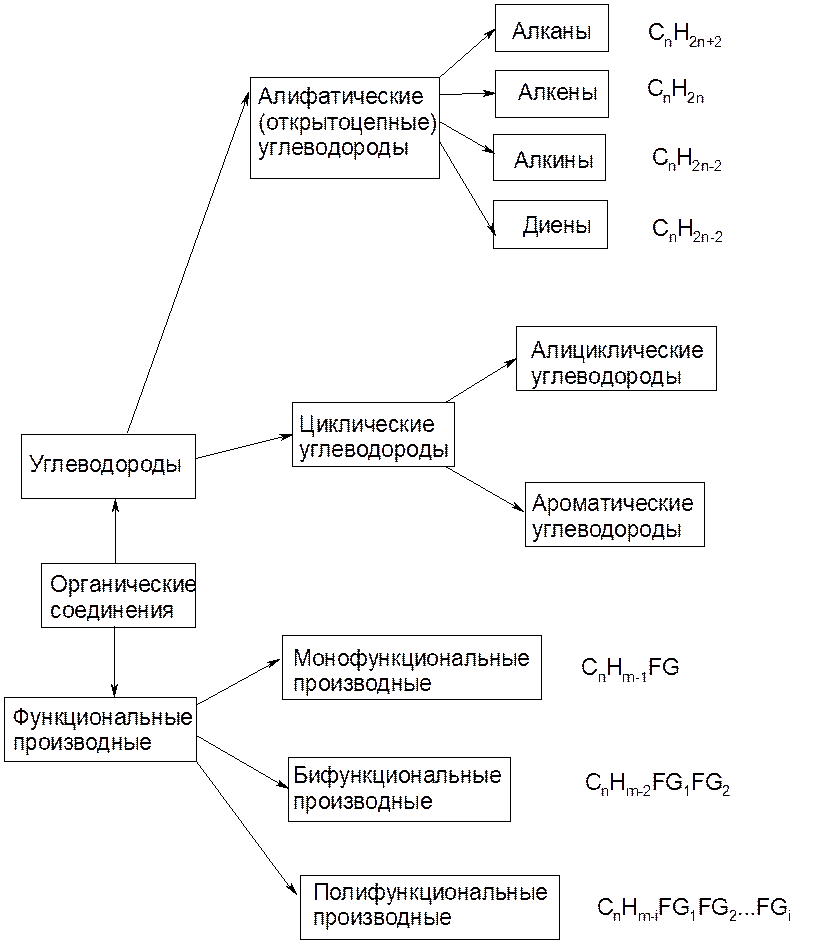 Многие из этих добавок органические соединения. К этим веществам относятся и различные витамины, необходимые для здоровья человека. Все эти добавки подвергаются строгим испытания , и при малейшем подозрении на вредность для человека они исключаются из употребления.
Многие из этих добавок органические соединения. К этим веществам относятся и различные витамины, необходимые для здоровья человека. Все эти добавки подвергаются строгим испытания , и при малейшем подозрении на вредность для человека они исключаются из употребления.
Современная органическая химия и химические процессы, протекающие при хранении и переработке продовольственных товаров. Таковы, например, процессы высыхания, прогоркания и омыления жиров и масел; процессы брожения, наблюдающиеся при хранении некоторых продуктов, а также широко используемые в хлебопечении, при квашении овощей, получении спиртных напитков, уксуса, в производстве молочных продуктов и т. п. Большую роль сыграло также открытие и изучение ферментов — сложных органических соединений, являющихся биологическими катализаторами, вызывающими процессы брожения, расщепления жиров, белков и т. п. Ферменты содержатся в ряде пищевых продуктов. Многие из них применяются в пищевой промышленности.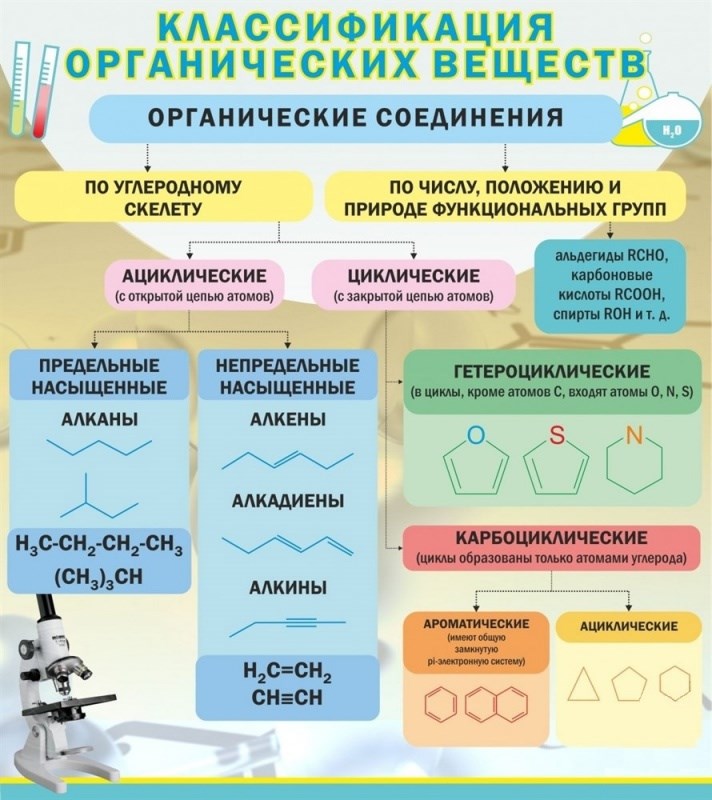
Органические красители
Красители повсеместно добавляются в пищевые продукты для восстановления природной окраски, утраченной в процессе обработки или хранения, повышения её интенсивности и окрашивания бесцветных продуктов, а также для придания продуктам привлекательности и разнообразия.
Хотя не так давно для придания продуктам более аппетитного вида в них добавляли исключительно натуральные красители . Их добывали из овощей, фруктов, ягод, листьев, корнеплодов. Поэтому польза таких красителей очевидна (в допустимых концентрациях), ведь их состав включает органические кислоты и витамины.
Из истории красителей
Использование природных красителей было известно еще за 3000 лет дон.э. Красители везли в Грецию из Индии, где их добывали из растения рода Indigofera (индиго).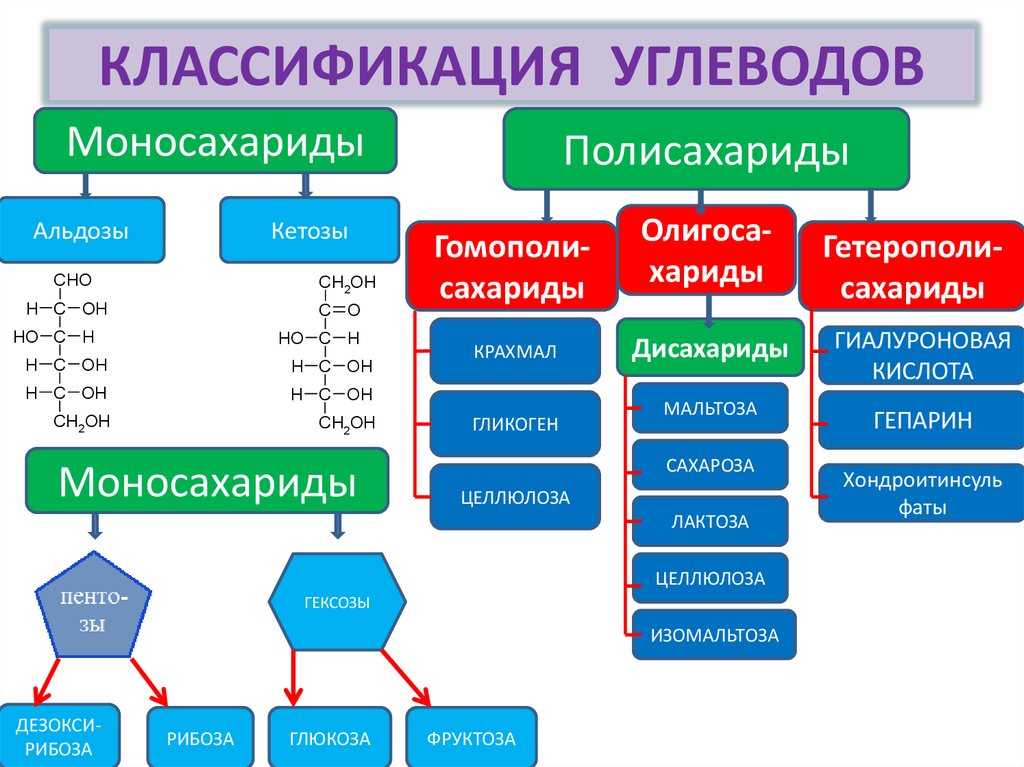 В Европе и в России индиго получали из растений вида Isatis tinctoria. Яркий и прочный цвет тканей,окрашенных индиго, придавал этому красителю большую ценность. Один из древнейших красителей – пурпур, который еще в X в. до н.э. финикийцы получали из улиток-багрянок (murex brandalis). Для получения одного грамма пурпура нужно было обработать 10 000 улиток! Пурпур в течение нескольких веков был самым ценным из всех красителей
В Европе и в России индиго получали из растений вида Isatis tinctoria. Яркий и прочный цвет тканей,окрашенных индиго, придавал этому красителю большую ценность. Один из древнейших красителей – пурпур, который еще в X в. до н.э. финикийцы получали из улиток-багрянок (murex brandalis). Для получения одного грамма пурпура нужно было обработать 10 000 улиток! Пурпур в течение нескольких веков был самым ценным из всех красителей
Процесс производства Органических красителей
Технология изготовления органических красителей из различных природных материалов: оксидов металлов, цветных глин, красящих веществ самых разных растений существовала вплоть до конца 19 века. За это время люди научились применять для окрашивания тканей плоды, коренья, кору и другие части растений. Примечателен тот факт, что большая часть растений, которые можно использовать для изготовления органических красителей всегда завозилась из южных теплых стран.
На пример:
Красные и розовые красители получают из соков ягод, таких как клубника, малина, клюква, кизил, смородина, брусника, различных красных сиропов, варенья и красного вина. Также для красного цвета подходят красный перец, темно-красные помидоры, краснокочанная капуста, кипяченый гранатовый сок и порошок сладкой паприки.
Также для красного цвета подходят красный перец, темно-красные помидоры, краснокочанная капуста, кипяченый гранатовый сок и порошок сладкой паприки.
Синий и фиолетовый красители получают из сока черники, сока свежей или вареной красной капусты, сока из кожи замороженных баклажанов, сока ежевики и сока винограда, как черного, так и фиолетового сортов.
Химический состав пищи
Зачастую пища содержит смесь различных компонентов, однако встречаются виды пищи состоящие из какого-либо одного компонента или его явного преобладания, например, углеводистая пища.
Белки
Белки́ — высокомолекулярные органические вещества , состоящие из соединённых в цепочку пептидной связью альфа-  Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям , которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс .
Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям , которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс .
Жиры.
Жиры́ , или с химической точки зрения триглицери́ды — природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот (входят в класс липидов). Наряду с углеводами и белками , жиры являются одним из основных источников энергии для млекопитающих, одним из главных компонентов питания. Эмульгирование жиров в кишечнике (необходимое условие их всасывания) осуществляется при участии солей жёлчных кислот. Энергетическая ценность жиров примерно в 2 раза выше, чем углеводов, при условии их биологической доступности и здорового усвоения организмом.
В растениях жиры содержатся в сравнительно небольших количествах, за исключением семян масличных растений, в которых содержание жиров может быть более 50 %. Насыщенные жиры расщепляются в организме на 25—30 %, а ненасыщенные жиры расщепляются полностью.
Животные жиры чаще всего содержат стеариновую и пальмитиновую кислоты, ненасыщенные жирные кислоты представлены в основном олеиновой, линолевой и линоленовой кислотами. Физико-химические и химические свойства данной категории жиров в значительной мере определяются соотношением входящих в их состав насыщенных и ненасыщенных жирных кислот.
Физико-химические и химические свойства данной категории жиров в значительной мере определяются соотношением входящих в их состав насыщенных и ненасыщенных жирных кислот.
Углеводы
Углево́ды — весьма обширный класс органических соединений, среди них встречаются вещества с сильно различающимися свойствами. Это позволяет углеводам выполнять разнообразные функции в живых организмах. Соединения этого класса составляют около 80 % сухой массы растений и 2—3 % массы животных. Организмы животных не способны самостоятельно синтезировать углеводы из неорганических веществ. Они получают их из растений с пищей и используют в качестве главного источника энергии, получаемой в процессе окисления. Таким образом, в суточном рационе человека и животных преобладают углеводы. Травоядные получают крахмал, клетчатку, сахарозу. Хищники получают гликоген с мясом. Для человека главными источниками углеводов из пищи являются: хлеб, картофель, макароны, крупы, сладости. Чистым углеводом является сахар. Мёд, в зависимости от своего происхождения, содержит 70—80 % глюкозы и фруктозы.
Чистым углеводом является сахар. Мёд, в зависимости от своего происхождения, содержит 70—80 % глюкозы и фруктозы.
СПАСИБО ЗА ВНИМАНИЕ!
Ее Величество органическая химия – StudyWay
Многие из вас задавались вопросом: почему одна неорганика и общая? А где, она? Где моя горячо любимая химия углерода? Почему до сих пор не было ни одной статьи по органической химии? Отвечаем: потому что нельзя приступать к органике, не уяснив себе азы общей химии, и нельзя работать с органикой, не зная основных свойств неорганических соединений.
Но, мы надеемся, что ваши знания уже достаточны. Чтобы приступить к самому сложному курсу химии: органике. Половина вопросов ЕГЭ по химии посвящены органической химии, а значит готовиться необходимо серьезно.
Мы начнем изучение курса с самых основных, фундаментальных понятий, со стереохимии и номенклатуры.
Органическая химия – это химия соединений углерода. Хотя само по себе названия «органическая» несколько сбивает с толку. Оно сохранилось со времен, когда химические соединения разделяли на два вида в соответствии со способом их получения: неорганические получали из минералов, а органические соединения –это соединения образованные и полученные в/из животных и растительных организмов.
Оно сохранилось со времен, когда химические соединения разделяли на два вида в соответствии со способом их получения: неорганические получали из минералов, а органические соединения –это соединения образованные и полученные в/из животных и растительных организмов.
Такая классификация существовала вплоть до середины девятнадцатого столетия. Ученые придерживались мнения, что органические соединения могут образовываться только в живых организмах и их невозможно синтезировать из неорганических веществ. Что же общего было у всех органических соединений, полученных их живых организмов? Правильно, углерод. Они абсолютно все до единого содержали в своем составе этот элемент. Даже спустя время, когда было доказано. Что органические соединения совсем не обязательно получать из живых организмов, а можно синтезировать в лабораториях, название «органика» или «органическая химия» сохранилось. И по сей день мы имеем два класса соединений органические и неорганические.
На сегодняшний день, добыча соединений углерода уже практически полностью производится посредством лабораторного синтеза.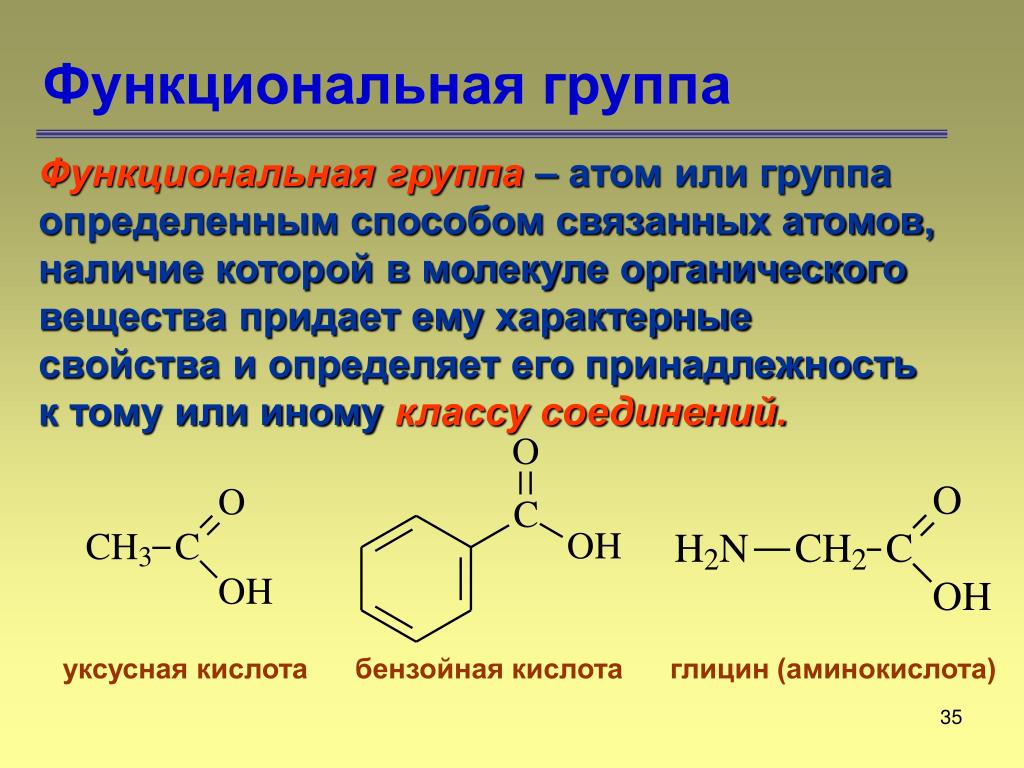 В качестве исходных продуктов синтеза применяют иногда неорганические соединения (цианиды, карбонаты), но в основном синтез осуществляется из других органических соединений. Есть два колоссальных источника (природных источника), из которых получают простейшие орг.соединеия. Нефть и уголь. И то и другое относим к природным, поскольку это продукты разложения животных и растительных организмов. Далее из этих простейших органических соединений и синтезируем более сложные.
В качестве исходных продуктов синтеза применяют иногда неорганические соединения (цианиды, карбонаты), но в основном синтез осуществляется из других органических соединений. Есть два колоссальных источника (природных источника), из которых получают простейшие орг.соединеия. Нефть и уголь. И то и другое относим к природным, поскольку это продукты разложения животных и растительных организмов. Далее из этих простейших органических соединений и синтезируем более сложные.
Какие же основные характеристики соединений углерода? Почему мы отделяем их от прочих соединений элементов периодической таблицы?
- Число соединений углерода многократно превышает количество соединений, не содержащих в своем составе углерод
- Органические соединения подразделяются на классы, которые не имеют аналогий среди неорганики.
- Расположение и количество атомов в соединении. Самая сложная и важная задача химика: определить расположение атомов в молекуле, то есть установить строение соединения.

- Определение реакции. Да-да, львиная доля органической химии приходится на определение той или иной реакции и практического ее применения в органическом синтезе.
- Уникальная способность углерода образовывать огромное число соединений. Атомы углерода могут соединиться друг с другом так, как не соединяются ни одни атомы остальных элементов. Образований цепей из тысячи атомов, колец, разных размеров и с ответвлениями. Соединения с атомами иных элементов в цепях.
- Каждое расположение атомов отвечает своему отдельному соединению с уникальными свойствами как физическими, так и химическими.
- Идет постоянный синтез новых и новых соединений. Химия углерода уникальна и неисчерпаема в своём развитии.
Теория строения
Тория строения органики позволила систематизировать и объединить сотни тысяч, а может и миллионы разрозненных фактов о миллионах отдельных соединений. Теория строения органических соединений – это положения о том, как атомы образуют молекулы. И вот тут нам как раз и пригодится общая химия с ее учением о химической связи атомов и электронов, а размерах молекул и распределением электронов между атомами.
И вот тут нам как раз и пригодится общая химия с ее учением о химической связи атомов и электронов, а размерах молекул и распределением электронов между атомами.
Давайте с вами вспомним основные постулаты химической связи – сил удерживающих атомы в молекуле.
В начале 20х годов прошлого столетия были подробно описаны два типа химической связи: ковалентная и ионная. Все было основано на известной концепции атома. Она заключалась в том, что положительно заряженное ядро атома окружено электронами, которые располагаются на определенных энергетических уровнях. На каждом уровне есть не может находится электронов больше, определенного числа – максимума возможного для этого уровня. Их может быть два на первом энергетическом уровне, восемь на втором, восемь или восемнадцать на третьем и так далее. Самыми стабильными соединениями считаются те, что имеют заполненную внешнюю оболочку по принципу инертного газа. Поэтому и ковалентная и ионная связи возникают в результате стремления атомов к образованию стабильной конфигурации электронов.
Ионная связь образуется в ходе переноса электрона. К примеру, есть молекула галогенида, допустим фторид лития (да мы рассмотрим «классический пример» на котором все понятно становится). Так вот у нас атом лития счастливый обладатель двух электронов на первом уровне и одного электрона на втором, он же внешний, энергетическом уровне. Это валентный электрон. При его потере литий остается с заполненным внешним слоем с двумя электронами. А что со фтором? А атом фтора обладает двумя электронами на первом уровне и семью на втором. То есть если Фтор добудет себе всего на всего один недостающий электрон на внешний энергетический уровень, то все, он добьётся состояния инертного газа. Так что образование фторида лития у нас происходит с переходом одного валентного электрона лития к фтору, в результате чего литий обладает положительный заряд, а фтор отрицательный. Ионная связь = это электростатическое притяжение между противоположно заряженными ионами.
Ковалентная связь – связь, образуемая в результате обобществления электронов. Пример: молекула водорода, где каждый атом имеет один электрон и при обобществлении электронов каждый атом дополняет свою оболочку до двух электронов. Именно ковалентная связь характерна для всех соединений углерода. Она основная в органической химии.
Пример: молекула водорода, где каждый атом имеет один электрон и при обобществлении электронов каждый атом дополняет свою оболочку до двух электронов. Именно ковалентная связь характерна для всех соединений углерода. Она основная в органической химии.
Квантовая механика в химии
В 1926 году Шредингер предложил квантово-механическую теория, адаптированную для химиков. Было выведено математическое выражение – волновое уравнение-, описывающее движение энергии в зависимости от энергии последнего. Далее был разработан метод приближенных решений – волновых функций. Именно квантовая механика применяется для объяснения и понимания структуры атомов и молекул сегодня.
Атомные орбитали
При помощи волнового уравнения можно рассчитать вероятность нахождения электрона в любой определенной точке.
Орбиталь – элемент пространства, в котором наиболее вероятно расположен электрон. Есть разные варианты орбиталей с разыми размерами, формами и расположением около атомного ядра. Тип орбитали, которую занимает электрон зависит о его энергии. Формы орбитали, которую занимает электрон и расположение их относительно друг друга определяют пространственное расположение атомов в молекуле и помогают в определении химических свойств. Электрон графически изображают в форме облака – форма облака – это и есть форма орбитали. Облако представляет собой неоднородную структуру с различной плотностью, та часть облака, где плотность наибольшая там и наибольшая вероятность нахождения электрона. Такое облако получило название распределение заряда. Давайте рассмотрим с вами формы атомных орбиталей. Орбиталь с самым низким энергетическим уровнем именуется 1s-орбиталь и имеет вид сферы, в центре которого расположено ядро атома. У орбитали нет четкой границы, так как есть малая доля вероятности нахождения электрона на значительном расстоянии от ядра атома.
Тип орбитали, которую занимает электрон зависит о его энергии. Формы орбитали, которую занимает электрон и расположение их относительно друг друга определяют пространственное расположение атомов в молекуле и помогают в определении химических свойств. Электрон графически изображают в форме облака – форма облака – это и есть форма орбитали. Облако представляет собой неоднородную структуру с различной плотностью, та часть облака, где плотность наибольшая там и наибольшая вероятность нахождения электрона. Такое облако получило название распределение заряда. Давайте рассмотрим с вами формы атомных орбиталей. Орбиталь с самым низким энергетическим уровнем именуется 1s-орбиталь и имеет вид сферы, в центре которого расположено ядро атома. У орбитали нет четкой границы, так как есть малая доля вероятности нахождения электрона на значительном расстоянии от ядра атома.
Далее идет 2s-орбиталь, уже с более высокой энергией, также имеет сферический вид, в центре сферы расположено ядро атома. Размеры сферы больше чем у сферы 1s-орбитали. Если у нас большая энергия, то и меньше стабильность, что вытекает из большего расстояния между электроном и ядром и как следствия уменьшения электростатического притяжения.
Размеры сферы больше чем у сферы 1s-орбитали. Если у нас большая энергия, то и меньше стабильность, что вытекает из большего расстояния между электроном и ядром и как следствия уменьшения электростатического притяжения.
Потом у нас идут три орбитали с одинаковой энергией – 2р-орбитали. Каждая из которой имеет форму гантели и между частями такой гантели располагается ядро атома.
11.S: Органическая химия (Резюме) – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 83140
Чтобы убедиться, что вы поняли материал этой главы, вам следует просмотреть значения следующих выделенных жирным шрифтом терминов в резюме и спросить себя, как они относятся к темам этой главы.
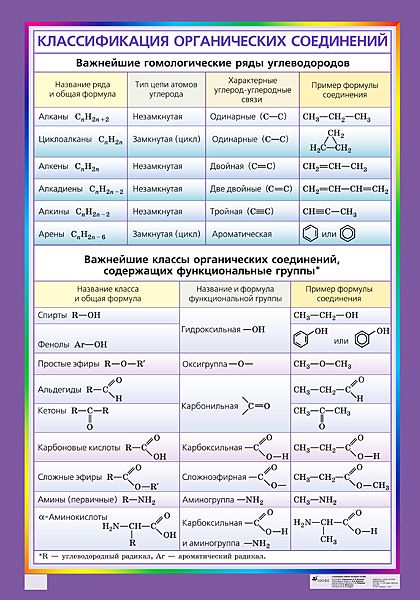
Органическая химия — химия соединений углерода, а неорганическая химия — химия всех остальных элементов. Атомы углерода могут образовывать прочные ковалентные связи с другими атомами углерода и с атомами других элементов, и это свойство позволяет образовывать десятки миллионов органических соединений. Углеводороды содержат только атомы водорода и углерода.
Углеводороды, в которых каждый атом углерода связан с четырьмя другими атомами, называются алканы или насыщенные углеводороды . Они имеют общую формулу C n H 2 n + 2 . Любой данный алкан отличается от следующего в ряду единицей CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором, называется гомологическим рядом .
Атомы углерода в алканах могут образовывать прямые или разветвленные цепи. Два или более соединений, имеющих одинаковую молекулярную формулу, но разные структурные формулы, изомеров друг друга. Для трех самых маленьких алканов нет изомерных форм; начиная с C 4 H 10 , все остальные алканы имеют изомерные формы.
Два или более соединений, имеющих одинаковую молекулярную формулу, но разные структурные формулы, изомеров друг друга. Для трех самых маленьких алканов нет изомерных форм; начиная с C 4 H 10 , все остальные алканы имеют изомерные формы.
Структурная формула показывает все атомы углерода и водорода и то, как они связаны друг с другом. Сокращенная структурная формула показывает атомы водорода рядом с атомами углерода, к которым они присоединены. Формула угла линии — это формула, в которой атомы углерода подразумеваются в углах и концах линий. Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи.
Циклоалканы представляют собой насыщенные углеводороды, молекулы которых представляют собой замкнутые кольца, а не прямые или разветвленные цепи. Кольца ограничивают вращение, поэтому, если есть два неводородных заместителя у разных атомов углерода циклогексана, могут существовать два цис-транс изомера (или геометрические изомеры) .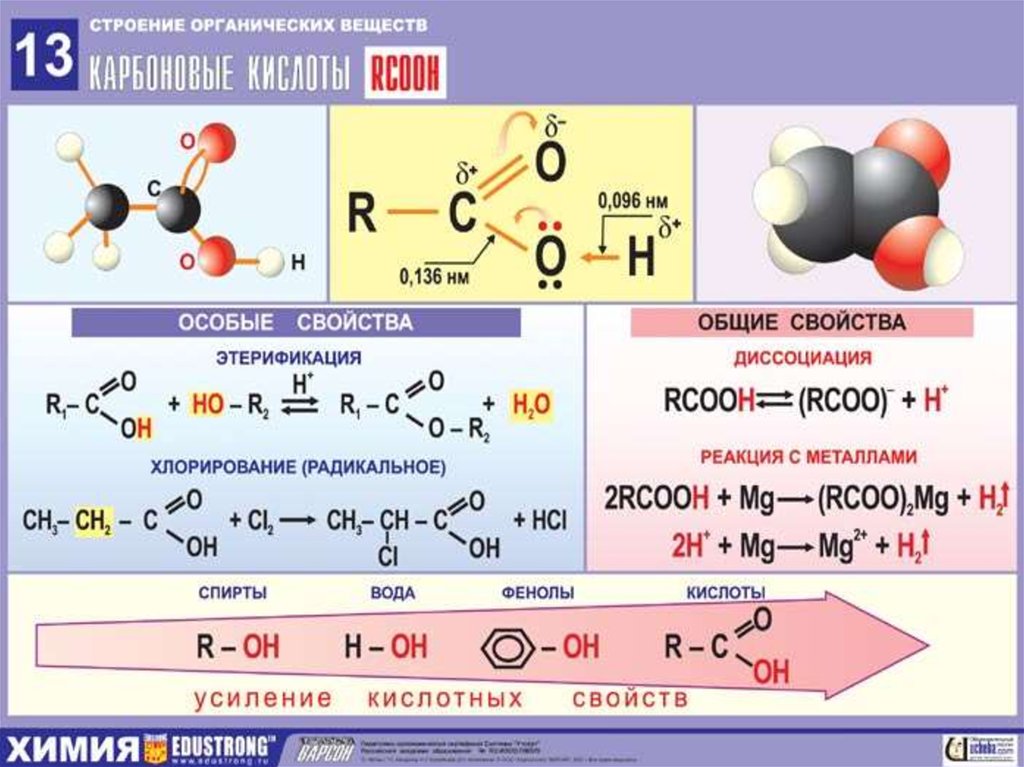
Любой углеводород, содержащий двойную или тройную связь, является ненасыщенным углеводородом . Алкены имеют двойную углерод-углеродную связь. Общая формула алкенов с одной двойной связью: C n H 2 n . Двойные связи не могут вращаться, поэтому, если на каждом из атомов углерода с двойной связью есть один неводородный заместитель, могут существовать два цис-транс-изомера. Алкины имеют тройную углерод-углеродную связь. Общая формула алкинов: C n H 2 n – 2 .
Физические свойства углеводородов отражают тот факт, что молекулы неполярны. Углеводороды нерастворимы в воде и менее плотны, чем вода. Размер и наличие полярных функциональных групп могут влиять на растворимость в воде, температуру плавления и температуру кипения органических соединений. Система номенклатуры ИЮПАК содержит правила для обозначения органических соединений.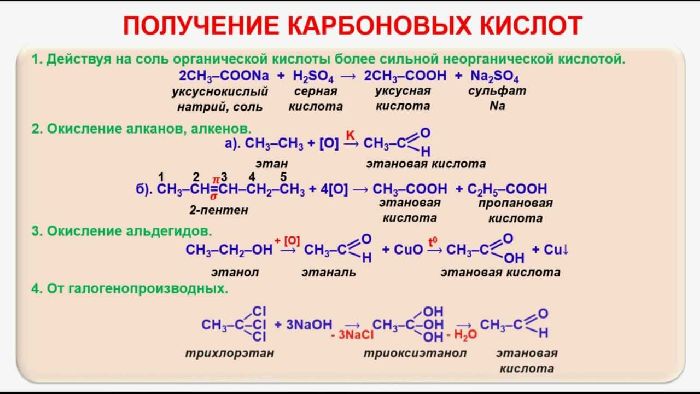 Алкильная группа представляет собой единицу, образованную удалением одного атома водорода из алкана.
Алкильная группа представляет собой единицу, образованную удалением одного атома водорода из алкана.
A функциональная группа – это любой атом или группа атомов, придающая характерные свойства семейству соединений. Алканы обычно не реагируют с лабораторными кислотами, основаниями, окислителями и восстановителями; они горят в кислороде (проходят реакций горения ). Алкены и алкины более реакционноспособны, восприимчивы, например, к присоединению галогенов или воды. 9Функциональные группы 0028 Карбоксил являются слабыми кислотами, а функциональные группы амина являются слабыми основаниями.
11.S: Organic Chemistry (Summary) распространяется в соответствии с лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Органическая химия: очень краткое введение
Иконка Цитировать Цитировать
Разрешения
- Делиться
- Твиттер
- Подробнее
Cite
Patrick, Graham,
Organic Chemistry: A Very Short Introduction
, Very Short Introductions
(
Oxford,
2017;
online edn,
Oxford Academic
, 23 Mar.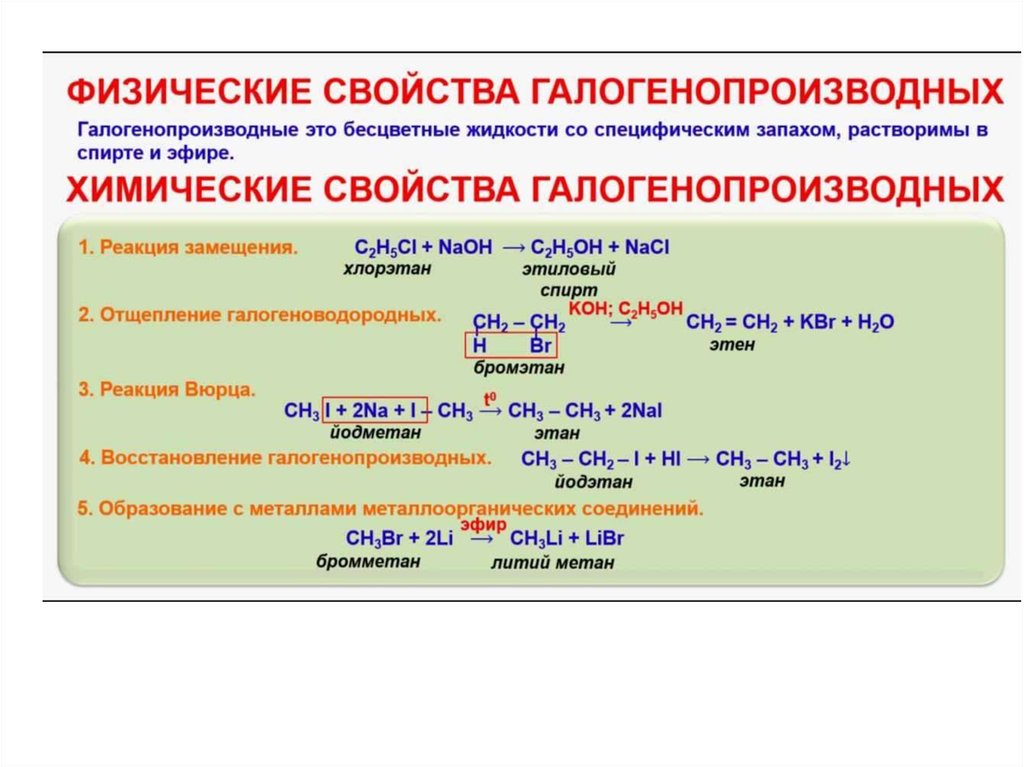 2017
2017
), https://doi.org/10.1093/actrade/9780198759775.001.0001,
, по состоянию на 26 января 2023 г.
Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации Oxford AcademicОрганическая химия: очень краткое введениеОчень краткое введениеБиохимияОрганическая химияФармакологияПолимерыКнигиЖурналы Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicОрганическая химия: очень краткое введениеОчень краткое введениеБиохимияОрганическая химияФармакологияПолимерыКнигиЖурналы Термин поиска на микросайте
Расширенный поиск
Abstract
Органическая химия — это химия соединений углерода.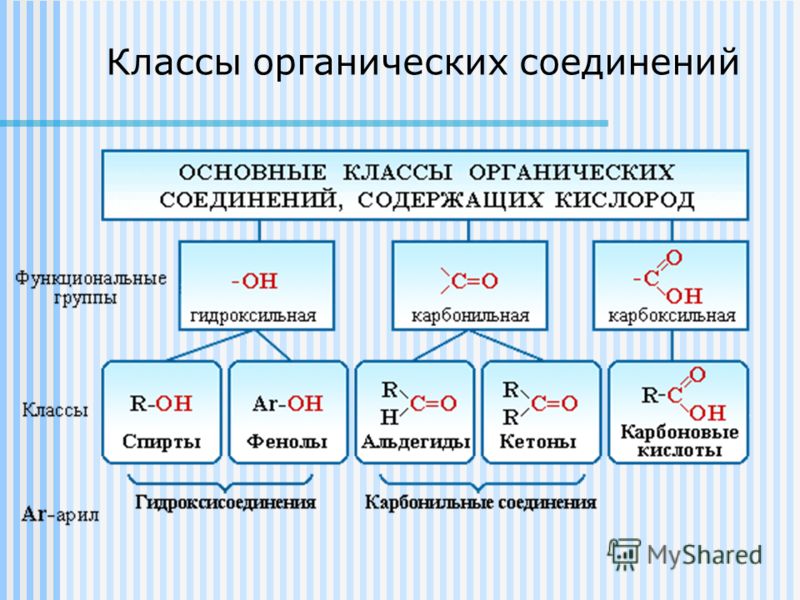 Помимо того, что органические соединения играют центральную роль в жизни в форме больших молекул, таких как нуклеиновые кислоты и белки, они необходимы во многих областях промышленности. Органическая химия: очень краткое введение охватывает весь спектр органических соединений и их роль. Начиная со структуры и свойств основных групп органических соединений, он продолжает рассматривать органические соединения в области фармацевтики, полимеров, продуктов питания и напитков, нефтехимии и нанотехнологий. В нем исследуется, как новые материалы, такие как графен, открывают новые захватывающие возможности для приложений, а также обсуждаются особые проблемы работы с углеродными соединениями, многие из которых бесцветны.
Помимо того, что органические соединения играют центральную роль в жизни в форме больших молекул, таких как нуклеиновые кислоты и белки, они необходимы во многих областях промышленности. Органическая химия: очень краткое введение охватывает весь спектр органических соединений и их роль. Начиная со структуры и свойств основных групп органических соединений, он продолжает рассматривать органические соединения в области фармацевтики, полимеров, продуктов питания и напитков, нефтехимии и нанотехнологий. В нем исследуется, как новые материалы, такие как графен, открывают новые захватывающие возможности для приложений, а также обсуждаются особые проблемы работы с углеродными соединениями, многие из которых бесцветны.
Ключевые слова: анализ, углерод, нанотехнологии, органическая химия, нефтехимия, синтез
Тема
Органическая химияПолимерыБиохимияФармакология
Серия
Краткие введения
Содержание
Передняя часть
- Страница авторского права
- Список иллюстраций
- 1 Вступление
- Расширять 2
Основы
- Расширять 3
Синтез и анализ органических соединений
- Расширять 4
Химия жизни
- Расширять 5
Фармацевтика и медицинская химия
- Расширять 6
пестициды
- Расширять 7
Химия чувств
- Расширять 8
Полимеры, пластмассы и текстиль
- Расширять 9
Нанохимия
Конец Материи
- дальнейшее чтение
- Индекс
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Нажмите Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи, в которой выполнен вход, и доступ к функциям управления учетной записью.




 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic.