Российские ученые намерены открыть новые элементы таблицы Менделеева
https://ria.ru/20210209/elementy-1596685632.html
Российские ученые намерены открыть новые элементы таблицы Менделеева
Российские ученые намерены открыть новые элементы таблицы Менделеева – РИА Новости, 09.02.2021
Российские ученые намерены открыть новые элементы таблицы Менделеева
Специалисты Объединенного института ядерных исследований (Дубна, Московская область) могут в 2022 году приступить к работам по синтезу новых сверхтяжелых… РИА Новости, 09.02.2021
2021-02-09T15:10
2021-02-09T15:10
2021-02-09T15:10
наука
россия
российская академия наук
объединенный институт ядерных исследований
дубна
наука
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn24.img.ria.ru/images/155212/99/1552129914_0:0:1251:703_1920x0_80_0_0_cb52a7dcd8c57344a20f196f95eb9ae4.jpg
МОСКВА, 9 фев – РИА Новости.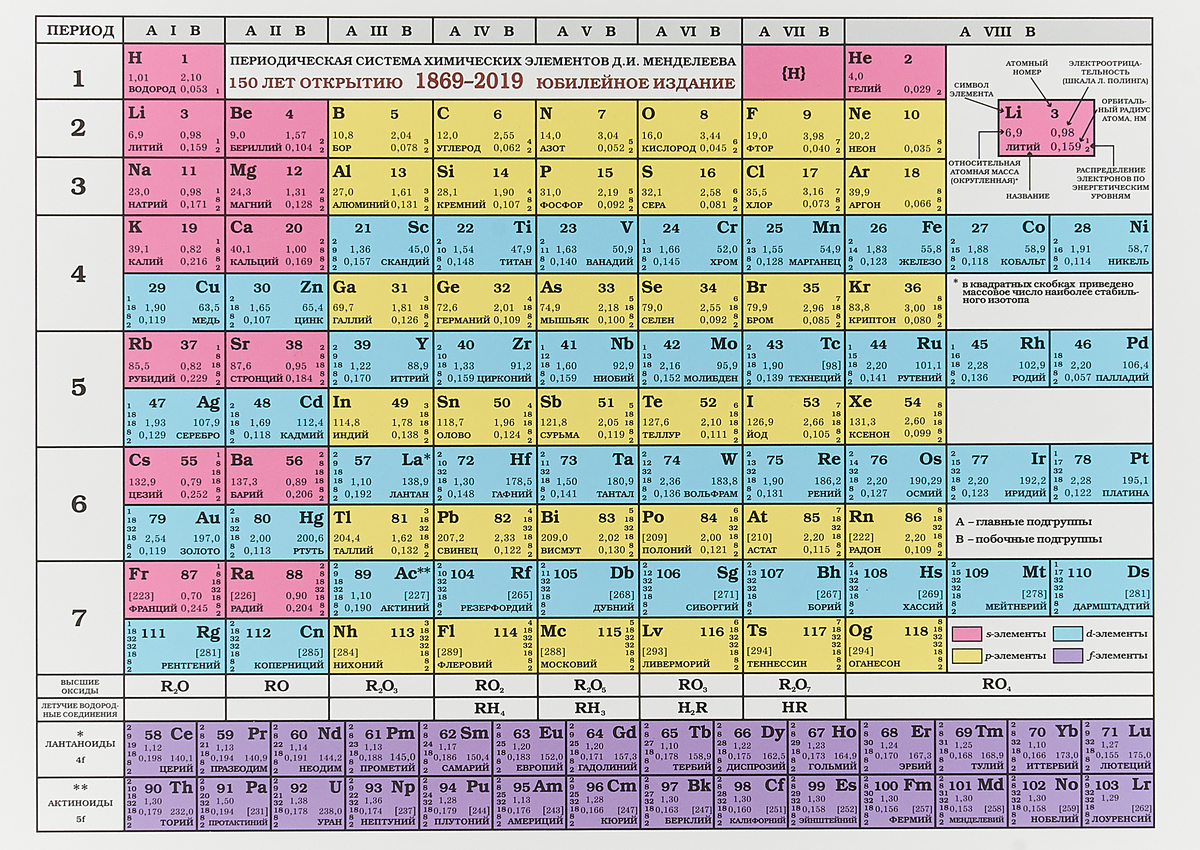 Специалисты Объединенного института ядерных исследований (Дубна, Московская область) могут в 2022 году приступить к работам по синтезу новых сверхтяжелых элементов таблицы Менделеева, заявил директор ОИЯИ академик РАН Григорий Трубников.”Главная наша задача (в 2021 году) – наработать максимальную статистику с тем, чтобы понимать, где искать новые элементы – 119-й, 120-й, 121-й, и какие у них будут свойства”, – добавил он.Трубников пояснил, что на химические свойства сверхтяжелых элементов сильно влияют так называемые релятивистские эффекты, являющиеся следствием теории относительности. “Релятивистские эффекты сказываются таким образом, что по периодическому закону это должен быть газ, а он ведет себя как металл. И очень интересно, что же за границей оганесона – 118-го элемента, самого тяжелого элемента на данный момент”, – добавил директор ОИЯИ.Все элементы тяжелее урана получают в ядерных реакторах или с помощью ускорителей при столкновении ядер других элементов. А сверхтяжелые элементы ученые синтезируют только на ускорителях путем бомбардировки тяжелыми ионами мишеней из трансплутониевых элементов.
Специалисты Объединенного института ядерных исследований (Дубна, Московская область) могут в 2022 году приступить к работам по синтезу новых сверхтяжелых элементов таблицы Менделеева, заявил директор ОИЯИ академик РАН Григорий Трубников.”Главная наша задача (в 2021 году) – наработать максимальную статистику с тем, чтобы понимать, где искать новые элементы – 119-й, 120-й, 121-й, и какие у них будут свойства”, – добавил он.Трубников пояснил, что на химические свойства сверхтяжелых элементов сильно влияют так называемые релятивистские эффекты, являющиеся следствием теории относительности. “Релятивистские эффекты сказываются таким образом, что по периодическому закону это должен быть газ, а он ведет себя как металл. И очень интересно, что же за границей оганесона – 118-го элемента, самого тяжелого элемента на данный момент”, – добавил директор ОИЯИ.Все элементы тяжелее урана получают в ядерных реакторах или с помощью ускорителей при столкновении ядер других элементов. А сверхтяжелые элементы ученые синтезируют только на ускорителях путем бомбардировки тяжелыми ионами мишеней из трансплутониевых элементов. При слиянии ядер мишени и “снаряда” на короткое время возникает ядро сверхтяжелого элемента.К настоящему времени ученые из разных стран получили ряд сверхтяжелых химических элементов, заканчивающийся 118-м элементом. Наибольший вклад в достижение этих результатов внесли российские специалисты из ОИЯИ под руководством выдающегося мирового ученого академика Юрия Оганесяна. В его честь 118-й элемент назван “оганесон”.Ранее Оганесян не исключил, что в будущем, по мере синтеза новых сверхтяжелых элементов и изучения их свойств, таблица Менделеева может изменить свой нынешний привычный вид.Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, который назвали “большой гонкой”. В Дубне намерены первыми получить новые элементы. В ОИЯИ работает уникальная по мировым меркам научная установка — так называемая “Фабрика сверхтяжелых элементов”. Ее центральной частью стал ускоритель заряженных частиц — циклотрон DC-280. Благодаря этой новой технике эффективность экспериментов по синтезу сверхтяжелых элементов многократно повышается.
При слиянии ядер мишени и “снаряда” на короткое время возникает ядро сверхтяжелого элемента.К настоящему времени ученые из разных стран получили ряд сверхтяжелых химических элементов, заканчивающийся 118-м элементом. Наибольший вклад в достижение этих результатов внесли российские специалисты из ОИЯИ под руководством выдающегося мирового ученого академика Юрия Оганесяна. В его честь 118-й элемент назван “оганесон”.Ранее Оганесян не исключил, что в будущем, по мере синтеза новых сверхтяжелых элементов и изучения их свойств, таблица Менделеева может изменить свой нынешний привычный вид.Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, который назвали “большой гонкой”. В Дубне намерены первыми получить новые элементы. В ОИЯИ работает уникальная по мировым меркам научная установка — так называемая “Фабрика сверхтяжелых элементов”. Ее центральной частью стал ускоритель заряженных частиц — циклотрон DC-280. Благодаря этой новой технике эффективность экспериментов по синтезу сверхтяжелых элементов многократно повышается.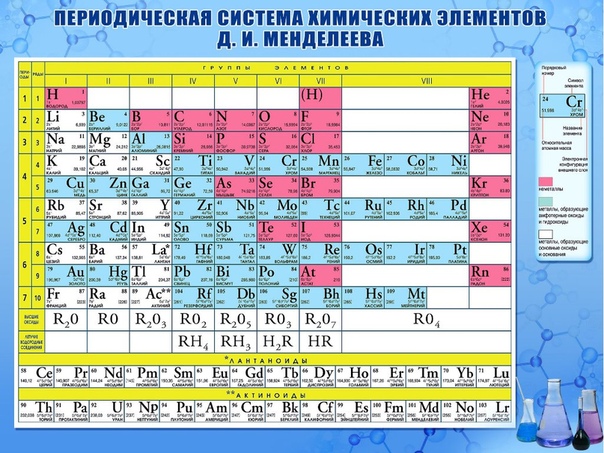 В декабре 2020 года на этой “фабрике” начат цикл экспериментов по синтезу сверхтяжелых элементов.”Думаю, что… за полгода-год мы бы наработали статистику по сверхтяжелым элементам, которую все человечество нарабатывало последние 20-30 лет во всех лабораториях мира – от Японии до Америки. Ну разве это не достижение? Это абсолютно точно укрепляет Россию не просто в первых рядах, а на первом месте в этой физике”, – отметил Трубников.
В декабре 2020 года на этой “фабрике” начат цикл экспериментов по синтезу сверхтяжелых элементов.”Думаю, что… за полгода-год мы бы наработали статистику по сверхтяжелым элементам, которую все человечество нарабатывало последние 20-30 лет во всех лабораториях мира – от Японии до Америки. Ну разве это не достижение? Это абсолютно точно укрепляет Россию не просто в первых рядах, а на первом месте в этой физике”, – отметил Трубников.
https://ria.ru/20190201/1550209465.html
https://ria.ru/20201225/nauka-1590929104.html
https://ria.ru/20210111/phosagro-1592528485.html
россия
дубна
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.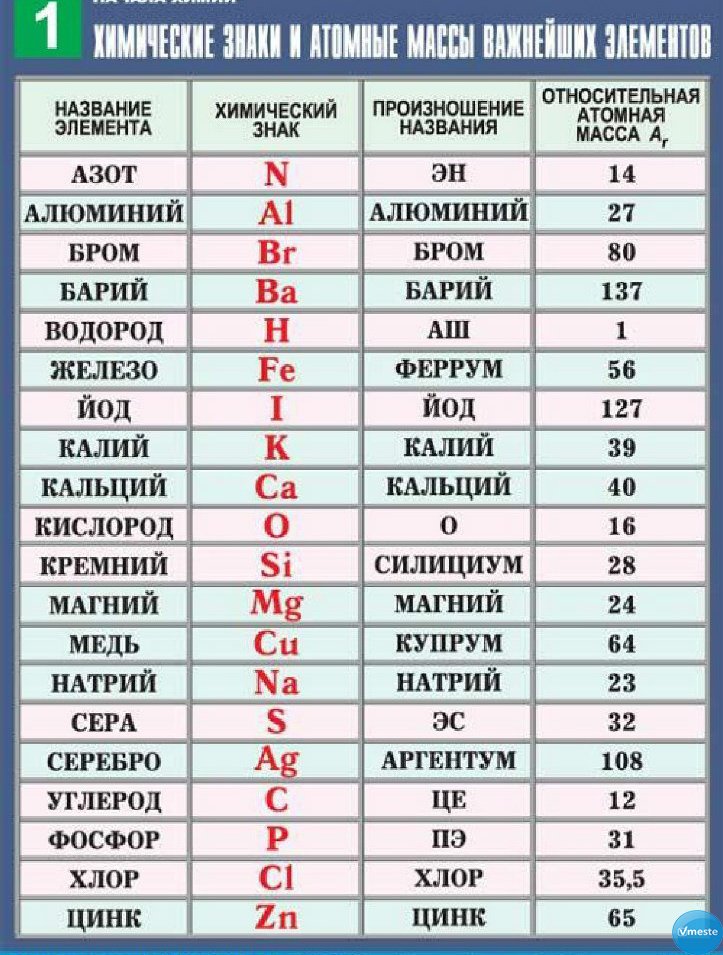 ru/docs/about/copyright.html
ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn24.img.ria.ru/images/155212/99/1552129914_156:0:1093:703_1920x0_80_0_0_9121e1ef07331941bbf5d2da6b48f554.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
россия, российская академия наук, объединенный институт ядерных исследований, дубна, наука
МОСКВА, 9 фев – РИА Новости. Специалисты Объединенного института ядерных исследований (Дубна, Московская область) могут в 2022 году приступить к работам по синтезу новых сверхтяжелых элементов таблицы Менделеева, заявил директор ОИЯИ академик РАН Григорий Трубников. “Этот год мы посвятим исследованию свойств 114-го, 115-го и 118-го элементов с тем, чтобы в следующем году попробовать открыть новые элементы – 119-й, 120-й и 121-й”, – сказал Трубников во вторник на пресс-конференции в Москве.1 февраля 2019, 08:00Наука”Борода Менделеева”: где кончается периодическая таблица элементов
“Этот год мы посвятим исследованию свойств 114-го, 115-го и 118-го элементов с тем, чтобы в следующем году попробовать открыть новые элементы – 119-й, 120-й и 121-й”, – сказал Трубников во вторник на пресс-конференции в Москве.1 февраля 2019, 08:00Наука”Борода Менделеева”: где кончается периодическая таблица элементов“Главная наша задача (в 2021 году) – наработать максимальную статистику с тем, чтобы понимать, где искать новые элементы – 119-й, 120-й, 121-й, и какие у них будут свойства”, – добавил он.
Трубников пояснил, что на химические свойства сверхтяжелых элементов сильно влияют так называемые релятивистские эффекты, являющиеся следствием теории относительности. “Релятивистские эффекты сказываются таким образом, что по периодическому закону это должен быть газ, а он ведет себя как металл. И очень интересно, что же за границей оганесона – 118-го элемента, самого тяжелого элемента на данный момент”, – добавил директор ОИЯИ.
Все элементы тяжелее урана получают в ядерных реакторах или с помощью ускорителей при столкновении ядер других элементов. А сверхтяжелые элементы ученые синтезируют только на ускорителях путем бомбардировки тяжелыми ионами мишеней из трансплутониевых элементов. При слиянии ядер мишени и “снаряда” на короткое время возникает ядро сверхтяжелого элемента.
А сверхтяжелые элементы ученые синтезируют только на ускорителях путем бомбардировки тяжелыми ионами мишеней из трансплутониевых элементов. При слиянии ядер мишени и “снаряда” на короткое время возникает ядро сверхтяжелого элемента.
25 декабря 2020, 14:54
Путин подписал указ о проведении Года науки и технологийК настоящему времени ученые из разных стран получили ряд сверхтяжелых химических элементов, заканчивающийся 118-м элементом. Наибольший вклад в достижение этих результатов внесли российские специалисты из ОИЯИ под руководством выдающегося мирового ученого академика Юрия Оганесяна. В его честь 118-й элемент назван “оганесон”.
Ранее Оганесян не исключил, что в будущем, по мере синтеза новых сверхтяжелых элементов и изучения их свойств, таблица Менделеева может изменить свой нынешний привычный вид.
Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, который назвали “большой гонкой”. В Дубне намерены первыми получить новые элементы.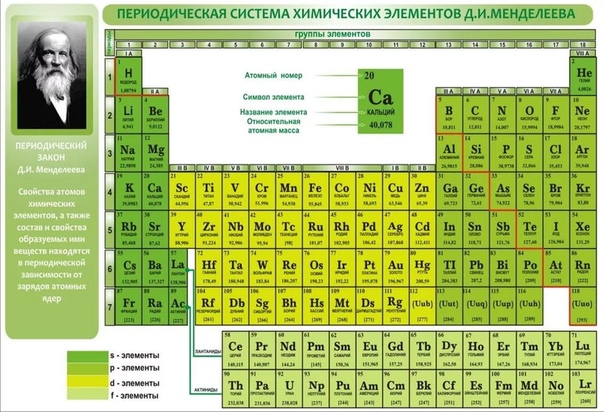 В ОИЯИ работает уникальная по мировым меркам научная установка — так называемая “Фабрика сверхтяжелых элементов”. Ее центральной частью стал ускоритель заряженных частиц — циклотрон DC-280. Благодаря этой новой технике эффективность экспериментов по синтезу сверхтяжелых элементов многократно повышается. В декабре 2020 года на этой “фабрике” начат цикл экспериментов по синтезу сверхтяжелых элементов.
В ОИЯИ работает уникальная по мировым меркам научная установка — так называемая “Фабрика сверхтяжелых элементов”. Ее центральной частью стал ускоритель заряженных частиц — циклотрон DC-280. Благодаря этой новой технике эффективность экспериментов по синтезу сверхтяжелых элементов многократно повышается. В декабре 2020 года на этой “фабрике” начат цикл экспериментов по синтезу сверхтяжелых элементов.
11 января, 11:12
Зеленая химия: безопасные химические катализаторыГрантовая программа финансовой и научной поддержки перспективных ученых-химиков от компании “ФосАгро”Таблица химических элементов – Справочник химика 21
Таблица химических элементов [c.
 133]
133]Из данных о строении ядра следует, что однозначным признаком химического элемента является заряд ядра 2, определяемый числом протонов в ядре и равный атомному номеру элемента в периодической таблице химических элементов Д. И. Менделеева. Относительные атомные массы элементов, приводимые в периодической таблице, представляют собой усредненные значения из отно- [c.28]
Кто из нас в студенческие годы или даже в зрелом возрасте не задумывался над тем, почему Таблица химических элементов Д. И. Менделеева не может вместить в себя лантаноиды и актиноиды Выходит, одни химические элементы для нее “сынки”, а другие — “пасынки” Нет, естественной ее можно назвать только с натяжкой. [c.5]
Анализ первой таблицы химических элементов Д. И. Менделеева [c.52]
Тем временем поиски продолжались. В 1913 г. К. Фаянс и, независимо от него, Ф.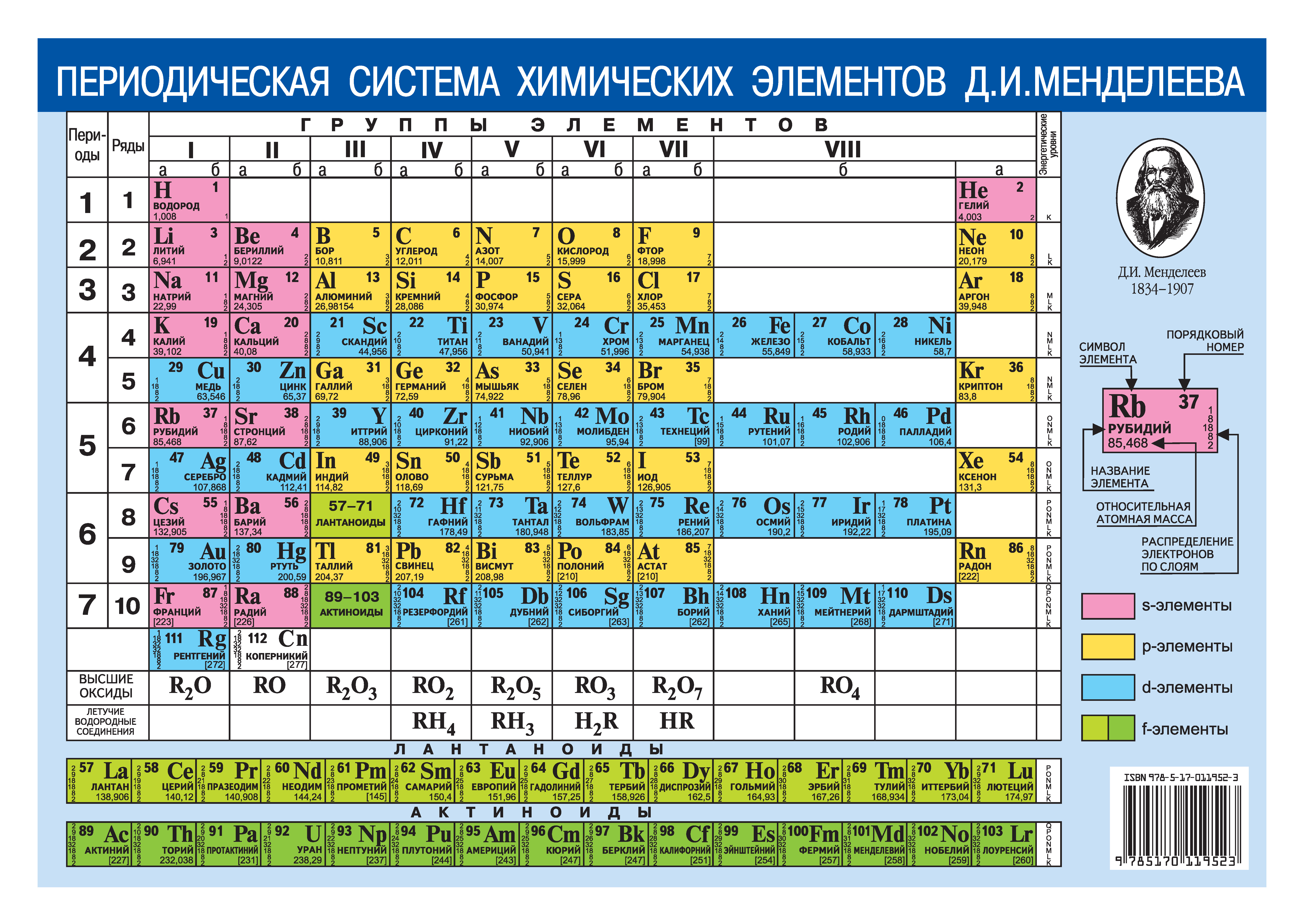 Содди дали первую формулировку Правила радиоактивного смещения. Имеется в виду смещение в таблице химических элементов. Кроме того, К. Фаянс ввел термин “плеяда” для атомов одного и того же химического зле мента, а Ф. Содди предложил назвать их “изотопами”, (Его рука оказалась “легче” — термин “изотопы” неплохо устроился в научной терминологии). Хотя оба эти термина по объему смысла дублируют термин “вид атомов”. Так, ато-“мы подвида, под сфабрикованным названием “изотопы” все крепче привязывались к Таблице химических элементов, теряя свой суверенитет.
Содди дали первую формулировку Правила радиоактивного смещения. Имеется в виду смещение в таблице химических элементов. Кроме того, К. Фаянс ввел термин “плеяда” для атомов одного и того же химического зле мента, а Ф. Содди предложил назвать их “изотопами”, (Его рука оказалась “легче” — термин “изотопы” неплохо устроился в научной терминологии). Хотя оба эти термина по объему смысла дублируют термин “вид атомов”. Так, ато-“мы подвида, под сфабрикованным названием “изотопы” все крепче привязывались к Таблице химических элементов, теряя свой суверенитет.
Хотя закон радиоактивных смещений рассматривается применительно к таблице химических элементов, по своей [c.98]
Нет возможности, да и нет смысла анализировать их в данной работе. Все они (круговые, мозаичные, пирамидальные, лестничные, радиальные, спиральные и др.) являются разными рекомбинациями все той же таблицы химических элементов Д. И. Менделеева. Эти изображения, как и таблица, не выходят за пределы плоских фигур и базируются все на тех же двух основаниях, которые использовал Д.
ПЕРИОДИЧЕСКАЯ СИСТЕМА АТОМОВ КАК ОСНОВА ПОНИМАНИЯ ТАБЛИЦЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В СВЕТЕ УЧЕНИЯ ОБ ИНДИВИДУАЛЬНЫХ, СПЕЦИФИЧЕСКИХ И ОБЩИХ ИХ ХАРАКТЕРИСТИКАХ [c.5]
Полудлинная форма таблицы химических элементов Л. Мейера [c.83]
Исследование таблицы химических элементов теперь почти завершено и маловероятно, чтобы был открыт совершенно новый элемент — металл с выдающимися свойствами. [c.217]
Современная таблица химических элементов составлена таким образом, что при переходе от какого-либо атома к следующему заряд увеличивается на единицу и к оболочке добавляется один электрон. Заряд ядра определяет порядковый номер элемента. [c.33]
Чтобы уяснить причину замеченного сходства, обратимся к таблице химических элементов Менделеева, где [c. 247]
247]
В таблице химические элементы сгруппированы по максимальной чувствительности обнаруживания их в пробах. Для элементов, принадлежащих по чувствительности к разным группам, одинаковые почернения спектральных линий в баллах отвечают различному процентному содержанию.
Какие же границы можно провести в периодической таблице химических элементов Какие имеются в таблице области, объединяющие наиболее близкие между собой химические элементы [c.264]
В 1870 г. Д. И. Менделеев [26] предсказал возможность обнаружения в природе элемента с порядковым номером 87, который должен разместиться в периодической таблице химических элементов в первой группе 10-го ряда. Предсказанный для него атомный вес лежал в пределах 210—230. Элемент должен образовывать окисел МегО и быть аналогом цезия. Первое сообщение об открытии 87-го элемента появилось в 1925 г. [9]. Вплоть до 1937 г. многие исследователи пытались искать этот элемент в различных природных объектах минералах, золе сигар, сена и грибов, в свекловичной патоке, в морской и минеральных водах.
Открытие зависимости формы соединений от атомного веса и уточнение атомных весов элементов дали возможность Менделееву составить в 1870 г. новую таблицу химических элементов, названную м естественной системой элементов.
Как показали исследования, различия между изотопами определяются числом нейтронов в ядрах атомов. Число нейтронов может изменяться на несколько единиц, тогда как число электронов, связанных с ядром, остается постоянным. Рассмотрим это на примере атома углерода. Атом углерода содержит 6 протонов и 6 нейтронов. Заряд ядра зависит от числа протонов и, следовательно, равен шести. Такой атом обозначим бС , где 6 порядковый номер в таблице химических элементов, а 12 — массовое число. Однако наряду с этим существует и другой углерод с порядковым номером 6, но имеющий в ядре 7 нейтронов — бС . Следовательно, заряд его остался прежним, а атомный вес увеличился на единицу (точнее — на массу одного нейтрона). Природный углерод представляет собой смесь двух изотопов бС и вС . В настоящее время искусственно получены изотопы бС> и бС”. Эти изотопы радиоактивны и неустойчивы. Период полураспада для бС равен 21 мин.
Такой атом обозначим бС , где 6 порядковый номер в таблице химических элементов, а 12 — массовое число. Однако наряду с этим существует и другой углерод с порядковым номером 6, но имеющий в ядре 7 нейтронов — бС . Следовательно, заряд его остался прежним, а атомный вес увеличился на единицу (точнее — на массу одного нейтрона). Природный углерод представляет собой смесь двух изотопов бС и вС . В настоящее время искусственно получены изотопы бС> и бС”. Эти изотопы радиоактивны и неустойчивы. Период полураспада для бС равен 21 мин.
После открытия периодического закона таблица химических элементов пополнилась новыми элементами. Это были, во-первых, элементы, предсказанные Менделеевым (галлий, скандий, германий), некоторые редкоземельные элементы, предсказать которые было довольно трудно, и, наконец, инертные газы, о существовании которых в природе можно было только догадываться (Д. И. Менделеев, Н. А.

Встреченная вначале недоверчиво большинством ученых периодическая система в 80-х годах прошлого столетия получила всеобщее признание. В этот период некоторые иностранные ученые (Лотар Мейер, Ньюлендс),не имея на то достаточных оснований,поставили вопрос о соавторстве в ее открытии. Не может быть, однако, никакого сомнения в приоритете Д. И. Менделеева. До него многие авторы пытались составлять таблицы химических элементов и объединять элементы в группы, но никто до Д. И. Менделеева не формулировал периодического закона. Точно так же никто до Д. И. Менделеева не дерзал на основании сопоставления свойств различных элементов исправлять атомные веса, а тем болое предугадывать существование и свойства еще не открытых э.лементов.
Известно несколько вариантов кодовых таблиц химических элементов, в большинстве которых используется прямой код. Так, в инструкции РЖМ рекомендуется располагать элементы по алфавиту, связывая отверстия перфокарты с группами периодической системы элементов Д.
VI групп, примыкающие к диагонали бор — астат,— типичные полупроводники (т. е. их электрическая проводимость с повышением температуры увеличивается, а не уменьшается). Характерная черта этих элементов — образование амфотерных гидроксидов (с. 151). Наиболее многочисленны d-металлы. В периодической таблице химических элементов Д. И. Менделеева они расположены между S- и р-элементами и получили название переходных металлов. У атомов d-элементов происходит достройка d-орбиталей. Каждое семейство состоит из десяти d-элементов. Известны четыре d-семейства 3d, 4d, 5d, и 6d. Кроме скандия и цинка, все переходные металлы могут иметь несколько степеней окисления. Максимально возможная степень окисления d-металлов +8 (у осмия, например, OsOj).
Об этом же говорит лингвистический анализ сложного греческого термина изотоп — одинаковоместный (“изос” — одинаковый, “топос” — место) [4, с. 261]. Конкретнее — одинаковоместный в таблице химических элементов, т. е. находящийся в одной клетке с другими атомами. А, как нам известно, каждая клетка таблицы закреплена за одним (конкретным) химическим элементом..jpg) И опять получается то же самое изотопы — это атомы одного химического элемента. (Братья — дети одной семьи). Зачем два названия одному и тому же понятию — вид атомов [c.84]
И опять получается то же самое изотопы — это атомы одного химического элемента. (Братья — дети одной семьи). Зачем два названия одному и тому же понятию — вид атомов [c.84]
Попытки построения единой системы химических элементов вещества и антивещества были предприняты Е. И. Ахумо-вым. В 1962 г. в развитие его идей появляется статья [14], в которой приводится “расширенный вариант Периодической системы элементов Д. И. Менделеева, включающий атомы, составленные из античастиц”. Система состоит из двух зеркальных половин. Подход чисто формальный. По существу, вторая зеркальная половина общей системы химических элементов вещества и антивещества является симметричной только таблице химических элементов вещества, а не выражением физической симметрии строения атомов. Такое решение проблем не может быть научно убедительным, так как не раскрывает генетической сути перехода материи из вещества в антивещество и обратно. Но концептуально она верна. Генетическая же ее суть может быть понята только на уровне атомных переходов, на примере построения “сопряженных” систем атомов вещества и антивещества, что мы и видим на рис. 13. Квадранты I и II этой системы являются, по существу, единым “шахматным полем”, где действуют единые (сквозные) правила игры. [c.135]
13. Квадранты I и II этой системы являются, по существу, единым “шахматным полем”, где действуют единые (сквозные) правила игры. [c.135]
Формально Д. Н. Трифонов признает, что взгляд на Периодическую систему, как на нечто законченное, глубоко ошибочен, ибо оказывается отражением слишком упрощенного понимания явления периодичности . Такое заявление автора можно было бы только приветствовать, если бы он сам следовал ему на деле. В действительности же, его вполне устраивает Периодическая таблица, надо только наглухо закрыть ее верхнюю границу . Такой вывод с определенностью вытекает из следующего заявления Д. Н. Трифонова … всю предшествующую историю системы можно рассмат-ривагь как цепь последовательных шагов, направленных на все более детальное упорядочение множества химических элементов. Менделеевский Опыт системы,.. был первым звеном в этой длинной цепи. На ее другом конце мы видим современную структуру системы . Автор однозначно определил свою позицию относительно другого конца — это таблица химических элементов. Он даже склонен канонизировать [c.167]
Он даже склонен канонизировать [c.167]
Таблица химических элементов была составлена Мейером в 1870 г. вслед за Менделеевым). По словам самого Мейера, эта таблица в существенном идентична данной Менделеевым [Семшин В. И. Периодическая система химических элементов Д. И. Менделеева. — М Наука, 1972, с. 40 Кемпбелл Дж. Современная общая химия. Т. 1. — М. Мир. 1975].- Прим. перев. [c.343]
К переходным элементам периодической таблицы химических элементов Д. И. Менделеева относят те из них, у которых заполняется предвнешняя й-оболочка. За исключением цинка, кадмия и ртути, все они имеют недостроенную -оболочку. Цинк, кадмий и ртуть относят к переходным элементам, поскольку они близки им по ряду свойств. Отличаются же они проявлением единственной степени окисления + 2 и в этом отношении похожи на з-элемен-ты — щелочноземельные металлы, с которыми они находятся в одной группе. Как отмечалось в предыдущей главе, переходные элементы побочной подгруппы III группы также имеют одну степень окисления +3. Все же остальные переходные элементы отличает разнообразие проявляемых степеней окисления, обилие окислительновосстановительных реакций, широкое изменение кислотно-основных свойств в соединениях. Наличие неспаренных й-электронов приводит к проявлению широкого круга магнитных, электрических и оптических свойств этих элементов. [c.154]
Все же остальные переходные элементы отличает разнообразие проявляемых степеней окисления, обилие окислительновосстановительных реакций, широкое изменение кислотно-основных свойств в соединениях. Наличие неспаренных й-электронов приводит к проявлению широкого круга магнитных, электрических и оптических свойств этих элементов. [c.154]
Автор указывает положение переходных металлов в соответствии с развернутой (длинной) формой периодической таблицы (табл. 5.1). В принятой таблице химических элементов Д. И. Менделеева (воспроизведенной иа форзаце книги) переходные металлы расположены иначе железо и платиновые металлы занимают правую часть таблицы (У1Пб группа), медь, цинк, галлий и родственные им металлы — левую часть, а титан, ванадий, хром и марганец со своими аналогами находятся в средней части (группы 1Уб, Уб, У1б, УИб). О природе переходных металлов см. также разд. 16.2. — Прим.. перев. [c.543]
От этого недостатка свободна так называемая укороченная периодическая таблица химических элементов. Она построена из неукороченной” таблицы с иГзъятием из нее лантаноидов и актиноидов и переносом концов восемнадцатиэлементных периодов (по восемь элементов) под начало этих же периодов. Таким образом, медь (Си), серебро (Ag) и золото (Аи) попадают под соответствующие щелочные элементы — медь под калий, серебро под рубидий и золото под цезий. Аналогично дело обстоит и с остальными перенесенными элементами. Поскольку до переноса они располагались в концах восемнадцатиэлементных периодов, то естественно, что они по своим свойствам отличаются от тех элементов, под которые попадают после переноса. Поэтому перенесенные элементы располагают не точно под теми элементами той группы, в которую они попадают, а несколько сбоку. Таким образом, возникают группы элементов, расположенных в вертикальных столбцах, и каждая группа состоит из двух подгрупп главной и побочной. Так, в первую группу попадают щелочные металлы и подгруппа меди (Си, Ад, Аи). Во вторую группу входят бериллий, магний и щелочноземельные металлы, а также элементы подгруппы цинка (2п, С(1, Hg), затем в третью группу — подгруппы бора (В, А1, Оа, 1п, Т1) и подгруппа скандия (5с, У, Ьа, Ас) и т.
Она построена из неукороченной” таблицы с иГзъятием из нее лантаноидов и актиноидов и переносом концов восемнадцатиэлементных периодов (по восемь элементов) под начало этих же периодов. Таким образом, медь (Си), серебро (Ag) и золото (Аи) попадают под соответствующие щелочные элементы — медь под калий, серебро под рубидий и золото под цезий. Аналогично дело обстоит и с остальными перенесенными элементами. Поскольку до переноса они располагались в концах восемнадцатиэлементных периодов, то естественно, что они по своим свойствам отличаются от тех элементов, под которые попадают после переноса. Поэтому перенесенные элементы располагают не точно под теми элементами той группы, в которую они попадают, а несколько сбоку. Таким образом, возникают группы элементов, расположенных в вертикальных столбцах, и каждая группа состоит из двух подгрупп главной и побочной. Так, в первую группу попадают щелочные металлы и подгруппа меди (Си, Ад, Аи). Во вторую группу входят бериллий, магний и щелочноземельные металлы, а также элементы подгруппы цинка (2п, С(1, Hg), затем в третью группу — подгруппы бора (В, А1, Оа, 1п, Т1) и подгруппа скандия (5с, У, Ьа, Ас) и т.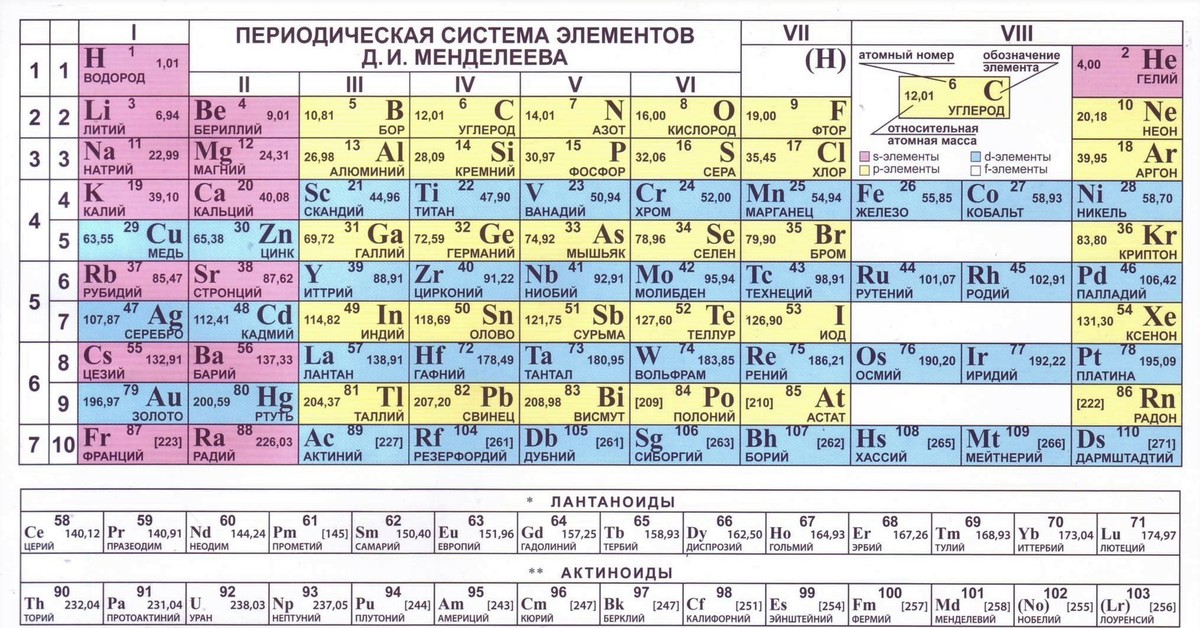 д. Совершенно естественно, что в седьмую группу попадают галогены (Р, С1, Вг, I, А1) и столь отличные от них по свойствам элементы подгруппы марганца (Мп, Тс, Ке). Особый интерес вызывает к себе восьмая группа. Очевидно, в нее должны входить инертные газы и элементы подгруппы железа (Ре, Ки, Об). Вне какой-либо группы остаются элементы кобальт и никель, родий и палладий, иридий и платина. Ранее считали, что железо, кобальт, никель и платиновые металлы (рутений, родий, палладий и осмий, ири- нй, платина) образуют восьмую группу, а инертные газы вы- [c.11]
д. Совершенно естественно, что в седьмую группу попадают галогены (Р, С1, Вг, I, А1) и столь отличные от них по свойствам элементы подгруппы марганца (Мп, Тс, Ке). Особый интерес вызывает к себе восьмая группа. Очевидно, в нее должны входить инертные газы и элементы подгруппы железа (Ре, Ки, Об). Вне какой-либо группы остаются элементы кобальт и никель, родий и палладий, иридий и платина. Ранее считали, что железо, кобальт, никель и платиновые металлы (рутений, родий, палладий и осмий, ири- нй, платина) образуют восьмую группу, а инертные газы вы- [c.11]
Пример первого из них рассмотрен в работе Ю. Б. Ру-мера и А. И. Фета [11], едва ли не единственной в своем роде. В ней авторы приходят к таблице химических элементов, полученной без использования модели Резерфорда, из общих принципов симметрии, разработанных в теории адронов . Рассматривая атом как бесструктурную частицу (как бы не имеющую ядра и электронных оболочек) и применяя к нему общие принципы физики симметрии (кулоновское поле в развиваемую теорию входит неявно), Ю. Б. Румер и А. И. Фет показывают, что состояния такого бесструктурного атома должны изображаться векторами пространства, где определено некоторое представление группы Spin (4) . В результате математически очень сложного вывода получается модель, описывающая совокупность состояний бесструктурного атома , причем эта модель без сколь-либо заметных отклонений соответствует структуре периодической системы элементов. Чрезвычайно существенно, что исходным пунктом рассуждений является представление об атоме как [c.36]
Б. Румер и А. И. Фет показывают, что состояния такого бесструктурного атома должны изображаться векторами пространства, где определено некоторое представление группы Spin (4) . В результате математически очень сложного вывода получается модель, описывающая совокупность состояний бесструктурного атома , причем эта модель без сколь-либо заметных отклонений соответствует структуре периодической системы элементов. Чрезвычайно существенно, что исходным пунктом рассуждений является представление об атоме как [c.36]
Японские ученые разработали новую таблицу элементов — Российская газета
Сообщение о создании учеными Киотского университета новой периодической системы химических элементов сразу облетело мировые СМИ. Что и понятно. Ведь когда-то таблица Менделеева стала одним из величайших открытий в химии. Она внесла удивительный порядок в, казалось бы, хаотическое нагромождение разнообразных элементов. Наш великий соотечественник расположил элементы так, чтобы соседи по столбцу имели схожие химические свойства.
Что же нового придумали японцы? Здесь важно подчеркнуть, что, создавая свою таблицу, Менделеев ничего не знал ни о строении атома, ни о его ядре, ни о том, что электроны расположены на оболочках. А самое главное, что в одном столбце его таблицы находятся элементы с одним и тем же числом электронов на последней электронной оболочке. Все это было открыто через много лет. Можно сказать, что Менделеев совершил свое открытие не только во сне, но с завязанными глазами. И очередной раз можно только поразиться его предвидению.
У японцев ситуация принципиально иная. У них глаза широко раскрыты. Их таблица создана на основе уже имеющихся знаний о ядре атомов, состоящих из протонов и нейтронов. Еще в 1963 году была присуждена Нобелевская премия за модель, согласно которой протоны и нейтроны в ядре тоже расположены на оболочках. Ядро, у которого последняя протонная нейтронная оболочка полностью заполнена, особенно устойчиво, не вступает в ядерные реакции. Но практически не вступают в химические реакции и инертные газы, у которых полностью заполнена последняя электронная оболочка.
Аналогия очевидна. Именно на ней японские ученые и построили свою периодическую таблицу, взяв за основу не электронные, а протонные оболочки атомных ядер. И подход очевиден: надо “плясать от печки” – от ядер с полностью заполненными протонными оболочками. Это гелий, кислород, кальций, никель, олово, свинец и флеровий. Число протонов в их ядрах составляет 2, 8, 20, 28, 50, 82 и 114, соответственно. Эти числа называют магическими за ту особую устойчивость, которую они придают ядрам.
Именно эти элементы японские ученые расположили в одном столбце, аналогичном столбцу инертных газов в таблице Менделеева. На основе такого столбца они и создали свою таблицу, расположив в строках элементы слева направо по мере заполнения оболочек.
Великий Менделеев создал свою таблицу, когда наука вообще не имела никакого представления ни о строении атома, ни об электронах
Исследователи надеются, что предложенный ими альтернативный способ представления химических элементов даст возможность другим ученым по-новому взглянуть на уже известные химические и физические закономерности и приведет к новым открытиям.
Описание новой таблицы японские ученые опубликовали в журнале Foundations of Chemistry.
Комментарий
Алексей Хохлов, академик РАН:
Некоторые СМИ уже сравнивают эту таблицу с той, что была создана великим Менделеевым. Говорят,что она может привести к новым открытиям.
Алексей Хохлов: Подобные заявления могут делать только те, кто плохо в школе учил химию. Таблица Менделеева связана не с ядром атома, а с электронами. Они определяют практически все химические связи и химические закономерности. Японские ученые проиллюстрировали некоторые уже известные факты, связанные со строением атомного ядра. Но особенности строения ядра на химические свойства почти не влияют, это не та епархия. Разве что имеют отношение к радиоактивному распаду.
Если для химиков эта работа не имеет значения, может, для физиков она станет откровением, даже стимулирует на озарения?
Алексей Хохлов: Вряд ли. Ведь структура атомного ядра давно известна, известны различные ядерные модели, авторам которых присуждена Нобелевская премия. А тем, кто сравнивает эту работу японских ученых и Дмитрия Ивановича Менделеева, хочу напомнить, что он создал свою таблицу, когда наука вообще не имела никакого представления ни о строении атома, ни об электронах. Только через 50 с лишним лет появилась квантовая механика, которая все это объяснила, в том числе строение атома и электронных оболочек. Периодический закон следует из квантовой физики. Так что если бы в то время таблицы Менделеева не было, то она могла бы быть предложена просто как следствие фундаментальных квантовых законов.
Ведь структура атомного ядра давно известна, известны различные ядерные модели, авторам которых присуждена Нобелевская премия. А тем, кто сравнивает эту работу японских ученых и Дмитрия Ивановича Менделеева, хочу напомнить, что он создал свою таблицу, когда наука вообще не имела никакого представления ни о строении атома, ни об электронах. Только через 50 с лишним лет появилась квантовая механика, которая все это объяснила, в том числе строение атома и электронных оболочек. Периодический закон следует из квантовой физики. Так что если бы в то время таблицы Менделеева не было, то она могла бы быть предложена просто как следствие фундаментальных квантовых законов.
Именно это сейчас произошло с таблицей японских ученых. Если есть желание и время, можно ее использовать в педагогических целях, но ничего нового вы не узнаете. Так что эту таблицу элементов можно назвать изящной игрушкой. Но, повторяю, для обучения студентов она может быть вполне полезна.
Интерактивная таблица химических элементов поясняет, для чего нужен каждый из них
Сергей Грэй
09 ноября 2016, 12:57
Не все из нас отлично разбираются в химии, поэтому название некоторых химических элементов из таблицы Менделеева для нас являются всего лишь «чем-то из области серьёзной науки». Вряд ли вы знаете, где в нашей жизни используется, например, церий или празеодим. Именно для таких далёких от науки людей на сайте elements.wlonk.com и была опубликована красочная интерактивная периодическая таблица, поясняющая на живых примерах, для чего нужен тот или иной химический элемент. Очень познавательная вещь, скажу я вам!
Вряд ли вы знаете, где в нашей жизни используется, например, церий или празеодим. Именно для таких далёких от науки людей на сайте elements.wlonk.com и была опубликована красочная интерактивная периодическая таблица, поясняющая на живых примерах, для чего нужен тот или иной химический элемент. Очень познавательная вещь, скажу я вам!
Первоначальный вариант периодической системы химических элементов был разработан русским учёным Дмитрием Ивановичем Менделеевым в 1869-1871 годах. Система является графическим выражением периодического закона, установленного Менделеевым в 1869 году. Закон этот устанавливает зависимость свойства химических элементов от их атомной массы. Получившуюся двухмерную таблицу часто называют «таблицей Менделеева» в честь её создателя. Каждый её столбец определяет основные физико-химические свойства, а строки представляют собой периоды.
Цинком или медью современного человека удивить вряд ли получится. Практически каждый знает, где именно применяются эти элементы в повседневной жизни. А вот о таких веществах, как европий или прометий мы знаем не так много. Из редкого металла европия, например, делают светящиеся краски, а также используют его при создании цветных телевизоров и лазеров. А прометием покрывают светящиеся стрелки электронных приборов и часов. Без гольмия была бы невозможной лазерная хирургия, а без эрбия мы бы так и не познали счастье оптоволоконной связи. Предлагаем вам самостоятельно ознакомиться с этой интерактивной таблицей и расширить свой кругозор.
Практически каждый знает, где именно применяются эти элементы в повседневной жизни. А вот о таких веществах, как европий или прометий мы знаем не так много. Из редкого металла европия, например, делают светящиеся краски, а также используют его при создании цветных телевизоров и лазеров. А прометием покрывают светящиеся стрелки электронных приборов и часов. Без гольмия была бы невозможной лазерная хирургия, а без эрбия мы бы так и не познали счастье оптоволоконной связи. Предлагаем вам самостоятельно ознакомиться с этой интерактивной таблицей и расширить свой кругозор.
Источник: Hi-News.ru
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Новости о науке, технике, вооружении и технологиях.
Подпишитесь и будете получать свежий дайджест лучших статей за неделю!
Email*
Подписаться
Улучшенная версия таблицы Менделеева
Как легко определять свойства элементов и их соединений
Не так уж часто удается написать заметку о том, что не просто войдет в школьные учебники будущего, а станет одной из базовых картинок-иллюстраций. Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, “Коту” рассказал профессор Сколтеха Артем Оганов.
Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, “Коту” рассказал профессор Сколтеха Артем Оганов.
Артем Оганов – кристаллограф-теоретик, создатель ряда новых материалов, а главное, методов, которые позволяют открывать новые материалы. Решил считавшуюся нерешаемой задачу предсказания кристаллической структуры вещества на основе его химического состава. Создал программу USPEX, способную предсказывать устойчивые химические соединения по набору исходных элементов. Один из самых цитируемых в мире ученых.
Я хорошо помню, как мне пришло в голову решение этой задачи. Мы с семьей садились в самолет. У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
Эта проблема волновала меня последние 15 лет. В 1984 году британский физик Дэвид Петтифор опубликовал работу, в которой ввел понятие менделеевских чисел, – с их помощью он сгруппировал элементы в порядке изменения их химических свойств. В таблице Менделеева свойства элементов меняются скачками. Так, после самого химически активного неметалла фтора идет инертный неон, а сразу за ним – активнейший металл натрий. Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Петтифор предложил решение – выстроил элементы в некоторой последовательности, приписав им некие числа Менделеева. Но как приписал, не объяснил. И тем более не объяснил, какой у них физический смысл. Эти числа не расчет, а произвол, хотя и основанный на наблюдениях за свойствами бинарных соединений – веществ, состоящих из двух разных атомов. Скажем, если NaCl и KCl похожи, то и натрий с калием должны стоять рядом. Все это время ученые модифицировали и улучшали менделеевские числа, но что это такое, так никто и не объяснил.
У химических элементов есть разные характеристики, которые влияют на их свойства. Прежде всего размер атома (его радиус), валентность, поляризуемость*, электроотрицательность**. Но валентность – параметр непостоянный, у разных элементов могут быть разные валентности, а мы неоднократно открывали химические соединения, которые с точки зрения привычных представлений о валентности не могли бы существовать. Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
*Поляризуемость – способность атома или молекулы становиться электрически полярными во внешнем электромагнитном поле. Поляризуемость показывает, насколько легко может возникнуть заряженная частица (ион) или новая химическая связь.
**Электроотрицательность – способность атома оттягивать электроны других атомов в химических соединениях. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (F, O, N, Cl), низкая – у активных металлов (Li, Na, K).
Получается, что для определения фундаментальных свойств атомов можно использовать только атомный радиус и электроотрицательность. И если по оси Х – радиус, а по оси Y – электроотрицательность, мы получаем плоскость, на которой сильно вытянутым облаком располагаются элементы. Внутри этого облака, воспользовавшись несложным математическим приемом, можно провести линию, вдоль которой элементы встанут в порядке максимально плавного изменения свойств.
Так мы открыли физический и химический смысл менделеевских чисел: это наилучшее представление всех химических свойств атома одним числом. Но мы предложили не только объяснение, но и улучшенную версию чисел Менделеева, в которой нет места субъективности – только расчеты на основе фундаментальных характеристик атомов. Мы назвали это “Универсальной последовательностью элементов”, по-английски Universal Sequence Of Elements, сокращенно USE. И действительно, наша последовательность удобна в применении: она предсказывает свойства химических соединений лучше, чем петтифоровские менделеевские числа и их позднейшие модификации.
Если расположить элементы на осях, то на плоскости будут бинарные соединения – молекулы и кристаллы, состоящие из двух типов атомов. Мы обнаружили, что на этом поле – его можно назвать химическим пространством – возникают области соединений с близкими свойствами, например твердостью кристаллов, магнетизмом, энергией связи. Известно, например, что алмаз, состоящий только из углерода, – самый твердый из кристаллов.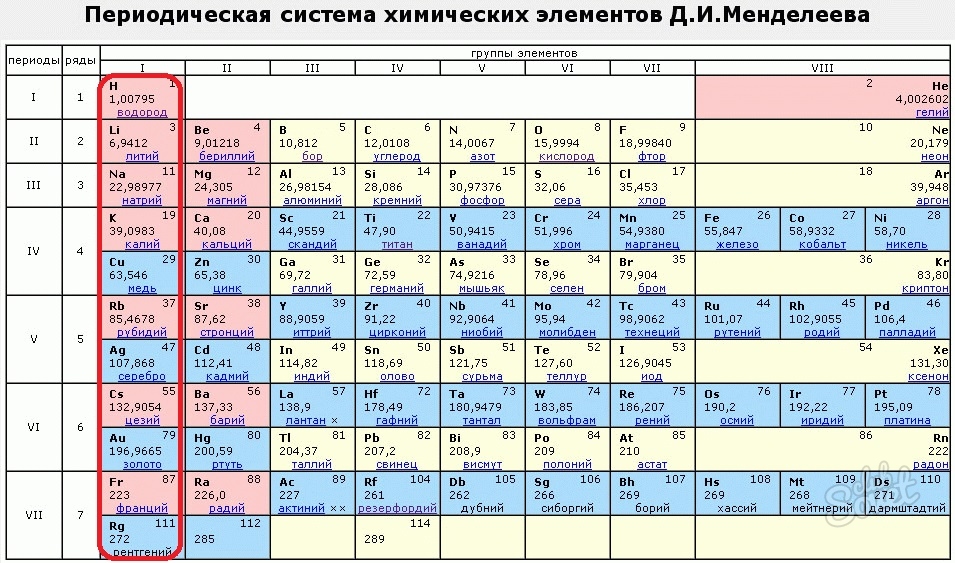 А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
Улучшенные менделеевские числа помогут находить новые соединения с полезными свойствами и смогут прояснить некоторые вопросы, связанные с привычной таблицей Менделеева. Например, уже сейчас можно ставить точку в споре, где должен находиться водород: над литием или над фтором. Согласно менделеевским числам, водород ближе к галогенам, чем к щелочным металлам.
Ссылка: Zahed Allahyari and Artem R. Oganov, Nonempirical Definition of the Mendeleev Numbers: Organizing the Chemical Space: J. Phys. Chem. C 2020, 124, 43, 23867-23878.
Как создавалсь таблица химических элементов — Хакасская Республиканская Детская Библиотека
Как создавалась таблица химических элементовВ 1668 г. Роберт Бойль – выдающийся учёный своей эпохи – опубликовал книгу, в которой развенчал немало мифов об алхимии. Главной идеей этого труда была мысль о необходимости поиска неразложимых химических элементов. С этого момента начался поиск не только этих элементов, но и принципов их упорядочения.
С этого момента начался поиск не только этих элементов, но и принципов их упорядочения.
В своей работе Роберт Бойль привёл список неразложимых химических элементов. Было их на тот момент всего пятнадцать. При этом учёный не утверждал, что кроме перечисленных им элементов больше не существует, и вопрос об их количестве оставался открытым.
Через 100 лет французский химик Антуан Лавуазье составил новый список из известных науке элементов. В его реестр попали 35 химических веществ, из которых 23 были впоследствии признаны теми самыми неразложимыми элементами. Работа по поиску новых элементов велась химиками во всём мире и продвигалась вполне успешно.
Открытие Дмитрием Менделеевым периодической таблицы химических элементов в марте 1869 г. стало настоящим прорывом в химии. Российскому учёному удалось систематизировать знания о химических элементах и представить их в виде таблицы, которую и сейчас обязательно изучают школьники на уроках химии. Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история её открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история её открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
Попытки классифицировать и систематизировать известные химические элементы предпринимались задолго до Дмитрия Менделеева. Свои системы элементов предлагали такие известные учёные, как Иоганн Деберейнер, Джон Ньюлендс, Юлиус Мейер и другие. Однако, из-за нехватки данных о химических элементах и их правильных атомных массах, предложенные системы были не совсем достоверными. История открытия таблицы Менделеева начинается в 1869 г., когда российский учёный на заседании Русского химического общества рассказал своим коллегам о сделанном им открытии. В предложенной учёным таблице химические элементы располагались в зависимости от их свойств, обеспечивающихся величиной их молекулярной массы. Интересной особенностью таблицы Менделеева было также наличие пустых клеток, которые в будущем были заполнены открытыми химическими элементами, предсказанными учёным (германий, галлий, скандий). После открытия периодической таблицы, в неё много раз вносились добавления и поправки. Совместно с шотландским химиком Уильямом Рамзаем, Менделеев добавил в таблицу группу инертных газов (нулевую группу). В дальнейшем история периодической таблицы Менделеева была напрямую связана с открытиями в другой науке – физике.
После открытия периодической таблицы, в неё много раз вносились добавления и поправки. Совместно с шотландским химиком Уильямом Рамзаем, Менделеев добавил в таблицу группу инертных газов (нулевую группу). В дальнейшем история периодической таблицы Менделеева была напрямую связана с открытиями в другой науке – физике.
Работа над таблицей периодических элементов продолжается до сих пор, и современные учёные – химики добавляют новые химические элементы по мере их открытия. Значение периодической системы Дмитрия Менделеева сложно переоценить, так как благодаря ей систематизировались знания о свойствах уже открытых химических элементов, появилась возможность прогнозирования открытия новых химических элементов, начали развиваться такие разделы физики, как физика атома и физика ядра. Существует множество вариантов изображения химических элементов согласно периодическому закону, однако наиболее известный и распространённый вариант – это привычная для каждого таблица Менделеева.
Самым распространённым заблуждением в истории открытия таблицы Менделеева является то, что учёный увидел её во сне. На самом деле, сам Дмитрий Менделеев опроверг этот миф и заявил, что размышлял над периодическим законом на протяжении многих лет. Чтобы систематизировать химические элементы он выписывал каждый из них на отдельную карточку и многократно комбинировал их между собой, расставляя в ряды в зависимости от их схожих свойств.
Миф о «вещем» сне учёного можно объяснить тем, что Менделеев работал над систематизацией химических элементов сутками напролёт, прерываясь на непродолжительный сон. Однако только упорный труд и природный талант учёного дал долгожданный результат и обеспечил Дмитрию Менделееву всемирную известность. Многих учащихся в школе, а иногда и в университете, заставляют заучивать или хотя бы примерно ориентироваться в таблице Менделеева. Для этого человек должен не только иметь хорошую память, но и логически мыслить, связывая элементы в отдельные группы и классы. Изучение таблицы легче всего даётся тем людям, которые постоянно поддерживают мозг в тонусе.
Изучение таблицы легче всего даётся тем людям, которые постоянно поддерживают мозг в тонусе.
Хочешь узнать больше? Читай книгу Сэма Кина «Исчезающая ложка, или Удивительные истории из жизни периодической таблицы Менделеева».
Путешествие по таблице элементов: от водорода до оганесона
Периодическая таблица химических элементов по праву считается одним из величайших достижений химической науки. Сегодня она насчитывает почти вдвое больше элементов, чем полтора века назад, когда Дмитрий Иванович Менделеев опубликовал свой «Опыт системы элементов, основанный на их атомном весе и химическом сродстве».
Химический состав человеческого тела, масс.%
Удивительно красивая молекула фуллерена — одной из аллотропных форм углерода, открытой в 1985 году
Ртуть — единственный металл, который находится в жидком состоянии при нормальных условиях — температуре 25°С и давлении 1 атм. Фото Александра Понамова/ Wikimedia Commons/ CC BY-SA 3. 0.
0.
Серебро испокон веков используется при изготовлении зеркал. Сегодня этим металлом покрывают зеркала телескопов — как правило, с большим диаметром. Это, например, телескоп «Кеплер» и два восьмиметровых телескопа обсерватории Джемини. Фото: www.gemini.edu.
‹
›
Представим себе, что мы смогли проникнуть в наномир и познакомиться с элементами, «населяющими» современную таблицу. В этом случае периодическая система предстала бы в виде высотного здания, имеющего семь «этажей» (периодов), 18 «блок-секций» (групп) которого насчитывают 118 уютных «квартир» (клеток). Некоторые из жильцов — элементы-рекордсмены, многие могут рассказать о себе немало интересного, не без основания претендуя на звание «самый-самый».
В квартире под номером один живёт удивительный элемент — водород H. Он рекордсмен сразу в нескольких номинациях. Это и самый простой, и самый распространённый в природе элемент. На него приходится более 90% всех атомов видимой Вселенной. В обычных условиях он существует в виде самого лёгкого газа: один литр его весит меньше 0,09 г. При охлаждении до -253°С водород переходит в жидкое состояние, превращаясь в самую лёгкую жидкость: десятилитровое ведро такой жидкости весило бы всего 708 г. Водород — единственный химический элемент, все семь братьев-изотопов которого имеют собственные имена. Наиболее известные из них — протий (1H), дейтерий (2H или D) и тритий (3H или T). Имена других тяжёлых изотопов водорода сегодня редко используются. В недрах звёзд водород превращается в гелий. В результате этой реакции выделяется огромное количество энергии, ничтожная часть которой (одна двухмиллиардная!) попадает на Землю. Благодаря этой энергии и существует жизнь на нашей планете, существуем мы.
В обычных условиях он существует в виде самого лёгкого газа: один литр его весит меньше 0,09 г. При охлаждении до -253°С водород переходит в жидкое состояние, превращаясь в самую лёгкую жидкость: десятилитровое ведро такой жидкости весило бы всего 708 г. Водород — единственный химический элемент, все семь братьев-изотопов которого имеют собственные имена. Наиболее известные из них — протий (1H), дейтерий (2H или D) и тритий (3H или T). Имена других тяжёлых изотопов водорода сегодня редко используются. В недрах звёзд водород превращается в гелий. В результате этой реакции выделяется огромное количество энергии, ничтожная часть которой (одна двухмиллиардная!) попадает на Землю. Благодаря этой энергии и существует жизнь на нашей планете, существуем мы.
Сосед водорода, занимающий квартиру номер два, инертный газ гелий He. Несмотря на то что элемент назван в честь греческого бога Солнца, вещество, состоящее из его атомов, — самая холодная жидкость на Земле: его температура кипения (-269°С) лишь на четыре градуса выше абсолютного нуля. Это единственное простое вещество, температура плавления которого неизвестна: даже при абсолютном нуле оно остаётся жидким и переходит в твёрдое состояние лишь при давлении около 25 атм. Гелий — обладатель самого маленького атома: его радиус всего 31 пм (1 пикометр = 1•10-12 м). Напротив, самыми «пышными формами» может похвастаться цезий Cs, проживающий в квартире номер 55. Его атомный радиус почти на порядок больше — 298 пм. К тому же цезий — самый мягкий металл, да ещё и редкого светло-золотистого цвета (как правило, все металлы серые). Впрочем, и самый твёрдый металл хром Cr имеет голубовато-серебристый цвет. Способность цезия легко отдавать электрон внешнего энергетического уровня делает его ещё и самым активным металлом.
Это единственное простое вещество, температура плавления которого неизвестна: даже при абсолютном нуле оно остаётся жидким и переходит в твёрдое состояние лишь при давлении около 25 атм. Гелий — обладатель самого маленького атома: его радиус всего 31 пм (1 пикометр = 1•10-12 м). Напротив, самыми «пышными формами» может похвастаться цезий Cs, проживающий в квартире номер 55. Его атомный радиус почти на порядок больше — 298 пм. К тому же цезий — самый мягкий металл, да ещё и редкого светло-золотистого цвета (как правило, все металлы серые). Впрочем, и самый твёрдый металл хром Cr имеет голубовато-серебристый цвет. Способность цезия легко отдавать электрон внешнего энергетического уровня делает его ещё и самым активным металлом.
Самый лёгкий металл расположился этажом ниже под водородом. Это литий Li. Его плотность составляет всего 0,534 г/см3, он почти в два раза легче воды. Самый тяжёлый металл — осмий Os — занимает квартиру номер 76. Изготовленный из него куб с ребром 1 м весил бы 22,59 т. Он на сотые доли процента опережает своего соседа из квартиры 77 (иридий Ir) в борьбе за звание элемента с самой высокой плотностью.
Он на сотые доли процента опережает своего соседа из квартиры 77 (иридий Ir) в борьбе за звание элемента с самой высокой плотностью.
Путешествуя по таблице элементов, мы непременно должны постучаться в дверь с номером шесть. Это апартаменты самого важного для жизни на Земле элемента — углерода C. Не случайно его называют «королём элементов» Периодической таблицы. Именно углерод — основа всех органических соединений: от простеньких молекул углеводородов до сложнейших белковых нитей или двойной спирали ДНК. Этот химический элемент имеет несколько аллотропных модификаций — хорошо знакомые алмаз, графит, графен и фуллерены. Среди последних наиболее знаменит бакминстерфуллерен, известный в мире под именами футболен, бакибол или просто фуллерен. Благодаря своей безукоризненной симметрии он, возможно, самая красивая молекула Вселенной. Фантастическая красота углеродного кластера C60 настолько ослепительна, что поначалу ни физики, ни химики просто не могли поверить, что такая высокосимметричная молекула вообще может существовать. В 1996 году первооткрыватели фуллерена — Роберт Кёрл, Харольд Крото и Ричард Смолли — были удостоены Нобелевской премии по химии. А полтора десятилетия спустя фуллерены были обнаружены в космическом пространстве. Сегодня это самые большие молекулы из всех, которые когда-либо находили за пределами Земли. Как знать, может быть, именно фуллерен принёс на Землю атомы или молекулы, благодаря которым зародилась жизнь на нашей планете.
В 1996 году первооткрыватели фуллерена — Роберт Кёрл, Харольд Крото и Ричард Смолли — были удостоены Нобелевской премии по химии. А полтора десятилетия спустя фуллерены были обнаружены в космическом пространстве. Сегодня это самые большие молекулы из всех, которые когда-либо находили за пределами Земли. Как знать, может быть, именно фуллерен принёс на Землю атомы или молекулы, благодаря которым зародилась жизнь на нашей планете.
Две соседние с углеродом квартиры занимают рекордсмены по распространённости. Азот N (элемент номер семь) — самый распространённый элемент в атмосфере (чуть более 78% по объёму). Появившийся в атмосфере нашей планеты около двух миллиардов лет назад кислород (элемент номер восемь) держит пальму первенства по распространённости в литосфере (почти 49% по массе) и гидросфере Земли (86% веса всех океанов), а также в теле человека (около двух третей по массе). Так, в 70-килограммовом представителе вида Homo Sapiens на долю кислорода O приходится почти 45 кг. Согласно данным журнала New Scientist, опубликованным в декабре 2005 года, эмпирическая формула человеческого тела имеет вид:
h25750 N310 O6500 C2250 Ca63 P48 K15 S15 Na10 Cl6 Mg3 Fe1.
В ней кислород уступает водороду по количеству атомов, но значительно превосходит его по массе.
Антиподы азота и кислорода занимают квартиры под номерами 85 и 86. Имя первого — астат At (от греческого αστατος — неустойчивый) — говорит само за себя: все его изотопы — короткоживущие (период полураспада самого устойчивого 210At составляет чуть более восьми часов). Именно поэтому астат самый редкий природный элемент Периодической таблицы. По разным данным, его содержание в земной коре в любой конкретный момент времени не превышает одного грамма. Радон Rn, занимающий 86-ю квартиру, самый редко встречающийся в атмосфере элемент — его содержание в ней всего около 0,0000000000000000001%. При стандартных температуре и давлении радон — самый тяжёлый из газообразных простых веществ: 1 литр его весит 9,73 г.
Несмотря на то что квартиры двух других элементов расположены на одной площадке (во втором периоде), их хозяева являют собой полную противоположность друг другу. В девятой квартире проживает самый электроотрицательный и самый активный из всех элементов-неметаллов — фтор F. Даже благородные газы — ксенон Xe и криптон Kr — пасуют перед этим химическим монстром. В его атмосфере горит, казалось бы, самое несгораемое вещество — вода. Сила фтора как окислителя настолько велика, что кислород окисляется в его атмосфере, образуя фториды OF2, O2F2 и O3F2! Напротив, сосед фтора, проживающий в десятой квартире, — неон Ne славится своим олимпийским спокойствием и с недавних пор носит титул самого инертного химического элемента. Это звание закрепилось за ним после того, как в марте 2018 года журнал American Scientist опубликовал ошеломляющую статью о способности гелия образовывать соединения с некоторыми элементами. Причём это происходит без образования классической химической связи, то есть без участия валентных электронов. Напротив, ни одного устойчивого соединения неона до сих пор идентифицировать не удалось.
В девятой квартире проживает самый электроотрицательный и самый активный из всех элементов-неметаллов — фтор F. Даже благородные газы — ксенон Xe и криптон Kr — пасуют перед этим химическим монстром. В его атмосфере горит, казалось бы, самое несгораемое вещество — вода. Сила фтора как окислителя настолько велика, что кислород окисляется в его атмосфере, образуя фториды OF2, O2F2 и O3F2! Напротив, сосед фтора, проживающий в десятой квартире, — неон Ne славится своим олимпийским спокойствием и с недавних пор носит титул самого инертного химического элемента. Это звание закрепилось за ним после того, как в марте 2018 года журнал American Scientist опубликовал ошеломляющую статью о способности гелия образовывать соединения с некоторыми элементами. Причём это происходит без образования классической химической связи, то есть без участия валентных электронов. Напротив, ни одного устойчивого соединения неона до сих пор идентифицировать не удалось.
Квартиру номер 26 занимает один из семи металлов древности. Вероятно, железо Fe — самый первый металл, с которым познакомился человек. Это единственный химический элемент, имя которого по праву запечатлено в названии целой исторической эпохи — железного века. Да и сегодня, в период широкого использования полимеров и искусственных материалов, железо по-прежнему верно служит человеку. По данным Королевского химического общества, его доля среди всех получаемых металлов достигает 90%. Бóльшая часть железа идёт на производство стали.
Вероятно, железо Fe — самый первый металл, с которым познакомился человек. Это единственный химический элемент, имя которого по праву запечатлено в названии целой исторической эпохи — железного века. Да и сегодня, в период широкого использования полимеров и искусственных материалов, железо по-прежнему верно служит человеку. По данным Королевского химического общества, его доля среди всех получаемых металлов достигает 90%. Бóльшая часть железа идёт на производство стали.
Чемпион по тугоплавкости при нормальных условиях — вольфрам W — проживает в квартире номер 74. Он начинает плавиться при 3422°С. Вольфрам — обладатель и самой высокой температуры кипения (5555°С), сравнимой с температурой поверхности Солнца. Неподалёку от самого тугоплавкого расположился самый легкоплавкий металл ртуть Hg, находящийся в жидком состоянии при температуре выше -39°С. Это самый загадочный и необыкновенный металл, известный человеку с незапамятных времён. Алхимики рассматривали ртуть как главное действующее начало философского камня. На протяжении тысячелетий ртуть пленяла и продолжает очаровывать людей своей красотой. Не случайно её нередко называют живым серебром (по-латыни — argentum vivum).
На протяжении тысячелетий ртуть пленяла и продолжает очаровывать людей своей красотой. Не случайно её нередко называют живым серебром (по-латыни — argentum vivum).
А настоящее серебро Ag расположилось в квартире номер 47. Благодаря наивысшей электропроводности и отражательной способности серебро давно с успехом используется в электронике, электротехнике и при изготовлении зеркал. По данным Института серебра (The Silver Institute, USA), мировой спрос на серебро в 2018 году вырос на 4%, а его добыча достигла почти 30 тысяч тонн.
На земле весь род людской
Чтит один кумир священный,
Он царит над всей Вселенной,
Тот кумир — телец златой!
Вряд ли кому не известна ария Мефистофеля из оперы Шарля Гуно «Фауст». Это всё о нём, о жильце квартиры 79, именуемом золотом Au. Оно самое романтичное и самое кровавое, самое почитаемое и самое презренное, самое желанное и самое прóклятое. Получать золото, превращая в него другие металлы, было заветной мечтой алхимиков. Недаром они называли его «царём металлов», обозначая символом Солнца. Причины такой магической притягательной силы золота связаны с его уникальными свойствами: оно химически стойко, обладает удивительной ковкостью (из кусочка золота массой 1 г можно вытянуть тончайшую проволоку длиной почти 3,5 км), имеет привлекательный цвет и практически вечно сохраняет блеск. Никакой другой металл не может сравниться в этом отношении с золотом! Справедливости ради нужно отметить, что золото не столь благородно и при определённых условиях способно реагировать с некоторыми простыми веществами, а также со щелочами, с кислотами или их смесями, например с царской водкой — смесью (3:1 по объёму) концентрированных соляной и азотной кислот. Самый стойкий к кислотам металл — иридий Ir, что проживает в квартире 77: до сих пор неизвестно ни одной кислоты или их смеси, способных его растворить.
Недаром они называли его «царём металлов», обозначая символом Солнца. Причины такой магической притягательной силы золота связаны с его уникальными свойствами: оно химически стойко, обладает удивительной ковкостью (из кусочка золота массой 1 г можно вытянуть тончайшую проволоку длиной почти 3,5 км), имеет привлекательный цвет и практически вечно сохраняет блеск. Никакой другой металл не может сравниться в этом отношении с золотом! Справедливости ради нужно отметить, что золото не столь благородно и при определённых условиях способно реагировать с некоторыми простыми веществами, а также со щелочами, с кислотами или их смесями, например с царской водкой — смесью (3:1 по объёму) концентрированных соляной и азотной кислот. Самый стойкий к кислотам металл — иридий Ir, что проживает в квартире 77: до сих пор неизвестно ни одной кислоты или их смеси, способных его растворить.
Бесспорно, золото издревле было и остаётся символом красоты, власти и богатства. Однако самым престижным считается его сосед, занимающий квартиру 78. Серебристо-белая «госпожа» платина Pt входит в элитный клуб благородных металлов, будучи королевой ювелирного дела. По спросу платина опережает даже золото. Это связано с её высокой химической устойчивостью к сильным кислотам и коррозии даже при высоких температурах. Именно поэтому она широко востребована и в научных исследованиях, и в промышленности.
Серебристо-белая «госпожа» платина Pt входит в элитный клуб благородных металлов, будучи королевой ювелирного дела. По спросу платина опережает даже золото. Это связано с её высокой химической устойчивостью к сильным кислотам и коррозии даже при высоких температурах. Именно поэтому она широко востребована и в научных исследованиях, и в промышленности.
Несмотря на то что серебро, золото и платина — мерила богатства, по стоимости они не идут ни в какое сравнение с некоторыми искусственно полученными металлами. Самым дорогим химическим элементом считается один из изотопов калифорния 252Cf, за один грамм которого придётся выложить 27 миллионов долларов США! Его ежегодное производство составляет около 40 мкг, а общий мировой запас, вероятно, не превышает 8 г. Уникальность калифорния ещё и в том, что он является очень мощным источником нейтронов, что позволяет использовать его в медицине и ядерной физике.
Что за волшебные звуки льются из квартиры номер 51? Здесь живёт известный с глубокой древности самый музыкальный химический элемент — сурьма Sb. В отличие от большинства металлов, сурьма при кристаллизации расплава расширяется. Но любопытна другая её особенность: оказывается, при медленном охлаждении и застывании расплавленная сурьма издаёт восхитительные низкочастотные звуки, напоминающие «пение» тибетских колоколов и чаш или чарующее пение сирен.
В отличие от большинства металлов, сурьма при кристаллизации расплава расширяется. Но любопытна другая её особенность: оказывается, при медленном охлаждении и застывании расплавленная сурьма издаёт восхитительные низкочастотные звуки, напоминающие «пение» тибетских колоколов и чаш или чарующее пение сирен.
Химический элемент менделевий Md с порядковым номером 101, синтезированный в 1955 году в Калифорнийской национальной лаборатории имени Эрнеста Лоуренса в Беркли и названный в честь создателя одного из первых вариантов Периодической таблицы, претендует на шутливое звание самого хулиганистого. Дело в том, что рождения желанного атома ждут месяцами и даже годами, по эмоциональному состоянию оно сродни рождению ребёнка. Поэтому легко понять радость коллектива исследователей во главе с Гленном Сиборгом, которому при бомбардировке изотопа эйнштейния 253Es ядрами гелия удалось получить семнадцать (!) атомов менделевия Md. При этом американские учёные позволили себе такую шутку: счётчик, фиксирующий рождение атома нового элемента, они подсоединили к пожарной сигнализации, которая, естественно, срабатывала каждый раз, как только желаемая частица появлялась в реакторе. Так продолжалось до тех пор, пока пожарная служба не пресекла это «хулиганство».
Так продолжалось до тех пор, пока пожарная служба не пресекла это «хулиганство».
Завершающий на сегодняшний день седьмой период таблицы элемент, имеющий порядковый номер 118, не только самый тяжёлый (по массе), но, вероятно, и самый скандальный. Дело в том, что его рождение связано с крупным научным скандалом. В мае 1999 года физики всё той же лаборатории в Беркли опубликовали в журнале Physical Review Letters статью, в которой сообщили о получении желанного элемента. Когда их коллегам из Германии и Японии (а затем и в самом Беркли) не удалось воспроизвести результаты, возникли подозрения в достоверности полученных данных. Два года спустя результаты были признаны сфальсифицированными, статья отозвана, а фальсификатор уволен.
Успешный синтез нового элемента осуществлён в 2002 и 2005 годах совместно американскими и российскими физиками под руководством Юрия Оганесяна. Три его атома просуществовали менее одной тысячной доли секунды. В ноябре 2016 года новорождённому дано название «оганесон» Og. Так были отмечены заслуги академика Оганесяна в открытии сверхтяжёлых элементов, а оганесон стал вторым (после сиборгия) элементом, названным в честь здравствующего учёного («Наука и жизнь» писала об этом в январе 2017 года, статья «Унуноктий стал оганесоном»).
Так были отмечены заслуги академика Оганесяна в открытии сверхтяжёлых элементов, а оганесон стал вторым (после сиборгия) элементом, названным в честь здравствующего учёного («Наука и жизнь» писала об этом в январе 2017 года, статья «Унуноктий стал оганесоном»).
Сегодня физики и химики спорят, есть ли граница у периодической системы и сколько химических элементов может она содержать. Мнения разделились: кто-то полагает, что таблица близка к завершению, кто-то надеется, что могут существовать элементы, имеющие порядковые номера 170 и более. Сейчас начинается строительство восьмого этажа. Как знать, скольким новосёлам ещё предстоит обживать новые квартиры!
Периодическая таблица элементов – Введение в химию – 1-е канадское издание
Дэвид В. Болл
Глава 17 Приложение: Периодическая таблица элементов
В этой главе мы приводим некоторые данные о химических элементах. В периодической таблице, представленной в главе 3 «Атомы, молекулы и ионы», перечислены все известные химические элементы, упорядоченные по атомному номеру (то есть количеству протонов в ядре). Периодическая таблица Менделеева, возможно, лучший инструмент во всей науке; никакая другая отрасль науки не может резюмировать свои фундаментальные составляющие так кратко и полезно.Многие физические и химические свойства элементов известны или понятны в зависимости от их положения в периодической таблице. Доступны периодические таблицы с различными химическими и физическими свойствами, указанными в поле каждого элемента. Далее следует более сложная версия таблицы Менделеева, чем та, что была представлена в главе 3 «Атомы, молекулы и ионы». Интернет – отличное место для поиска периодических таблиц, содержащих дополнительную информацию.
Периодическая таблица Менделеева, возможно, лучший инструмент во всей науке; никакая другая отрасль науки не может резюмировать свои фундаментальные составляющие так кратко и полезно.Многие физические и химические свойства элементов известны или понятны в зависимости от их положения в периодической таблице. Доступны периодические таблицы с различными химическими и физическими свойствами, указанными в поле каждого элемента. Далее следует более сложная версия таблицы Менделеева, чем та, что была представлена в главе 3 «Атомы, молекулы и ионы». Интернет – отличное место для поиска периодических таблиц, содержащих дополнительную информацию.
Одним из пунктов большинства периодических таблиц является атомная масса каждого элемента.Для многих приложений для атомной массы необходимы только один или два десятичных знака. Однако в некоторых приложениях (особенно в ядерной химии; см. Главу 15 «Ядерная химия») требуется больше десятичных знаков. Атомные массы в Таблице 17.1 «Основы элементов Периодической таблицы» представляют количество десятичных знаков, признанных Международным союзом чистой и прикладной химии, всемирной организацией, которая разрабатывает стандарты для химии. Атомные массы некоторых элементов известны очень точно, с точностью до большого числа десятичных знаков.Атомные массы других элементов, особенно радиоактивных, точно не известны. Некоторые элементы, такие как литий, могут иметь различные атомные массы в зависимости от того, как изолированы их изотопы.
Атомные массы некоторых элементов известны очень точно, с точностью до большого числа десятичных знаков.Атомные массы других элементов, особенно радиоактивных, точно не известны. Некоторые элементы, такие как литий, могут иметь различные атомные массы в зависимости от того, как изолированы их изотопы.
Интернет предлагает множество интерактивных ресурсов по периодической таблице. Например, см. Http://www.ptable.com.
Таблица 17.1 Основы элементов Периодической таблицы
| Имя | Атомный символ | Атомный номер | Атомная масса | Сноски | |
|---|---|---|---|---|---|
| актиний * | Ac | 89 | |||
| алюминий | Al | 13 | 26.9815386 (8) | ||
| америций * | Am | 95 | |||
| сурьма | Сб | 51 | 121,760 (1) | г | |
| аргон | Ar | 18 | 39,948 (1) | г, р | |
| мышьяк | Как | 33 | 74.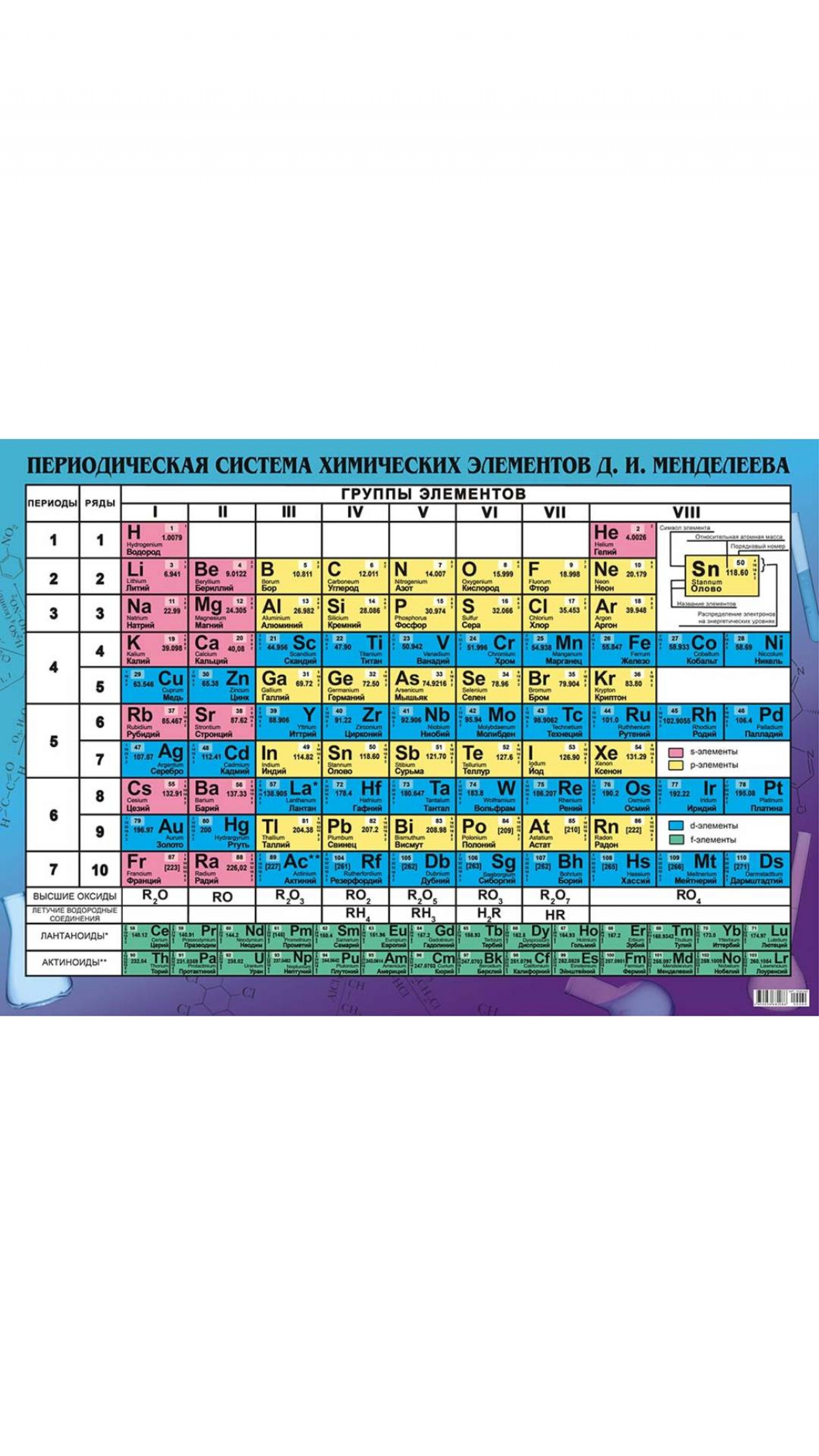 | (2)||
| астатин * | в | 85 | |||
| барий | Ba | 56 | 137.327 (7) | ||
| берклий * | Bk | 97 | |||
| бериллий | Be | 4 | 9.012182 (3) | ||
| висмут | Bi | 83 | 208.98040 (1) | ||
| бориум * | Bh | 107 | |||
| бор | B | 5 | 10.811 (7) | г, м, r | |
| бром | руб. | 35 | 79,904 (1) | ||
| кадмий | Кд | 48 | 112.411 (8) | г | |
| цезий (цезий) | CS | 55 | 132. | 19 (2) | |
| кальций | Ca | 20 | 40,078 (4) | г | |
| калифорний * | Cf | 98 | |||
| углерод | С | 6 | 12. 0107 (8) 0107 (8) | г, р | |
| церий | CE | 58 | 140.116 (1) | г | |
| хлор | Класс | 17 | 35,453 (2) | г, м, r | |
| хром | Cr | 24 | 51,9961 (6) | ||
| кобальт | Co | 27 | 58. | 5 (5)||
| коперниций * | Cn | 112 | |||
| медь | Cu | 29 | 63.546 (3) | r | |
| кюрий * | см | 96 | |||
| дармштадций * | DS | 110 | |||
| дубний * | Дб | 105 | |||
| диспрозий | Dy | 66 | 162 500 (1) | г | |
| эйнштейний * | Es | 99 | |||
| эрбий | Er | 68 | 167. 259 (3) 259 (3) | г | |
| европий | Eu | 63 | 151.964 (1) | г | |
| фермий * | Fm | 100 | |||
| фтор | F | 9 | 18.9984032 (5) | ||
| франций * | Fr | 87 | |||
| гадолиний | Gd | 64 | 157.25 (3) | г | |
| галлий | Ga | 31 | 69,723 (1) | ||
| германий | Ge | 32 | 72,64 (1) | ||
| золото | Au | 79 | 196.966569 (4) | ||
| гафний | Hf | 72 | 178,49 (2) | ||
| хассий * | HS | 108 | |||
| гелий | He | 2 | 4. 002602 (2) 002602 (2) | г, р | |
| гольмий | Ho | 67 | 164. | (2)||
| водород | H | 1 | 1,00794 (7) | г, м, r | |
| индий | В | 49 | 114,818 (3) | ||
| йод | I | 53 | 126. | (3) | |
| иридий | Ir | 77 | 192.217 (3) | ||
| утюг | Fe | 26 | 55,845 (2) | ||
| криптон | Кр | 36 | 83,798 (2) | г, м | |
| лантан | La | 57 | 138. | г | |
| лоуренсий * | Lr | 103 | |||
| свинец | Пб | 82 | 207.2 (1) | г, р | |
| литий | Li | 3 | [6,941 (2)] † | г, м, r | |
| лютеций | Лю | 71 | 174. 967 (1) 967 (1) | г | |
| магний | мг | 12 | 24,3050 (6) | ||
| марганец | Мн | 25 | 54. | 5 (5)||
| мейтнерий * | млн т | 109 | |||
| менделевий * | Md | 101 | |||
| ртуть | рт. Ст. | 80 | 200.59 (2) | ||
| молибден | Пн | 42 | 95,94 (2) | г | |
| неодим | Nd | 60 | 144,242 (3) | г | |
| неон | Ne | 10 | 20,1797 (6) | г, м | |
| нептуний * | Np | 93 | |||
| никель | Ni | 28 | 58.6934 (2) | ||
| ниобий | Nb | 41 | 92. | (2)||
| азот | N | 7 | 14,0067 (2) | г, р | |
| нобелий * | Нет | 102 | |||
| осмий | Ос | 76 | 190,23 (3) | г | |
| кислород | O | 8 | 15.9994 (3) | г, р | |
| палладий | Pd | 46 | 106,42 (1) | г | |
| фосфор | -П, | 15 | 30,973762 (2) | ||
| платина | Pt | 78 | 195.084 (9) | ||
| плутоний * | Pu | 94 | |||
| полоний * | Po | 84 | |||
| калий | К | 19 | 39.0983 (1) | ||
| празеодим | Pr | 59 | 140. | (2) | |
| прометий * | вечера | 61 | |||
| протактиний * | Па | 91 | 231.03588 (2) | ||
| радий * | Ra | 88 | |||
| радон * | Rn | 86 | |||
| рентген * | Rg | 111 | |||
| рений | Re | 75 | 186.207 (1) | ||
| родий | Rh | 45 | 102, | (2)||
| рубидий | руб. | 37 | 85,4678 (3) | г | |
| рутений | Ру | 44 | 101,07 (2) | г | |
| резерфорд * | Rf | 104 | |||
| самарий | см | 62 | 150.36 (2) | г | |
| скандий | SC | 21 | 44.955912 (6) | ||
| сиборгий * | Sg | 106 | |||
| селен | Se | 34 | 78,96 (3) | r | |
| кремний | Si | 14 | 28,0855 (3) | r | |
| серебро | Ag | 47 | 107.8682 (2) | г | |
| натрий | Na | 11 | 22.98976928 (2) | ||
| стронций | Sr | 38 | 87,62 (1) | г, р | |
| сера | S | 16 | 32,065 (5) | г, р | |
| тантал | Ta | 73 | 180.94788 (2) | ||
| технеций * | TC | 43 | |||
| теллур | Te | 52 | 127.60 (3) | г | |
| тербий | Тб | 65 | 158. | (2) | |
| таллий | Tl | 81 | 204,3833 (2) | ||
| торий * | Чт | 90 | 232.03806 (2) | г | |
| тулий | ТМ | 69 | 168. | (2)||
| банка | Sn | 50 | 118.710 (7) | г | |
| титан | Ti | 22 | 47,867 (1) | ||
| вольфрам | Вт | 74 | 183,84 (1) | ||
| унунгексий * | Uuh | 116 | |||
| унунокций * | Uuo | 118 | |||
| унунпентиум * | Uup | 115 | |||
| унункадиум * | Uuq | 114 | |||
| унантриум * | Уут | 113 | |||
| уран * | U | 92 | 238.02891 (3) | г, м | |
| ванадий | В | 23 | 50.9415 (1) | ||
| ксенон | Xe | 54 | 131,293 (6) | г, м | |
| иттербий | Yb | 70 | 173,04 (3) | г | |
| иттрий | Я | 39 | 88, | (2) | |
| цинк | Zn | 30 | 65.409 (4) | ||
| цирконий | Zr | 40 | 91,224 (2) | г | |
| * Элемент не содержит стабильных нуклидов. Однако три таких элемента (Th, Pa и U) имеют характерный земной изотопный состав, и для них атомная масса сведена в таблицу. | |||||
| † Имеющиеся в продаже материалы Li имеют атомный вес в диапазоне от 6,939 до 6,996; если требуется более точное значение, оно должно быть определено для конкретного материала. | |||||
| г Известны геологические образцы, в которых изотопный состав элемента выходит за пределы нормального материала. Разница между атомной массой элемента в таких образцах и массой, приведенной в таблице, может превышать указанную погрешность. | |||||
| m Модифицированные изотопные композиции могут быть обнаружены в коммерчески доступном материале, поскольку он был подвергнут нераскрытому или непреднамеренному изотопному фракционированию. Возможны существенные отклонения атомной массы элемента от указанной в таблице. | |||||
| r Диапазон изотопного состава нормального земного материала не позволяет дать более точное значение A r (E); Табличные значения и погрешность A r (E) должны применяться к нормальному материалу. | |||||
Источник: по материалам Pure and Applied Chemistry 78, no. 11 (2005): 2051–66. © IUPAC (Международный союз теоретической и прикладной химии).
единиц чтения: Периодическая таблица элементов
Различные элементы организованы и отображены в периодической таблице.В таблице, разработанной русским химиком Дмитрием Менделеевым (1834–1907) в 1869 году, сгруппированы элементы, которые, хотя и являются уникальными, имеют общие химические свойства с другими элементами. Свойства элементов определяют их физическое состояние при комнатной температуре: они могут быть газами, твердыми телами или жидкостями. Элементы также обладают определенной химической реакционной способностью, способностью объединяться и химически связываться друг с другом.
В периодической таблице, показанной на рисунке 1, элементы организованы и отображаются в соответствии с их атомными номерами и расположены в серии строк и столбцов на основе общих химических и физических свойств.В периодической таблице Менделеева указывается не только атомный номер каждого элемента, но и его атомная масса. Например, если посмотреть на углерод, появляются его символ (C) и название, а также его атомный номер шесть (в верхнем левом углу) и его атомная масса 12,11.
Рис. 1. В периодической таблице показаны атомная масса и атомный номер каждого элемента. Атомный номер отображается над символом элемента, а приблизительная атомная масса – под ним.
В периодической таблице элементы сгруппированы по химическим свойствам.Различия в химической активности между элементами основаны на количестве и пространственном распределении электронов в атоме. Атомы, которые химически реагируют и связываются друг с другом, образуют молекулы. Молекулы – это просто два или более атомов, химически связанных вместе. По логике вещей, когда два атома химически связываются, образуя молекулу, их электроны, которые образуют крайнюю область каждого атома, сначала объединяются, поскольку атомы образуют химическую связь.
Посмотрите это видео, чтобы получить более подробное представление о таблице Менделеева:
Периодическая таблица элементов и химия
Ключ периодической таблицы
X | X | X | X | Щелочные металлы | Щелочноземельные металлы | Переходные металлы | Прочие металлы | Металлоиды | Прочие неметаллы | Галогены | Благородные газы | Лантаноиды |
Периодическая таблица
«Если все элементы расположены в порядке их атомного веса, получается периодическое повторение свойств.Это выражается законом периодичности ».Дмитрий Менделеев, Основы химии, Vol. 2, 1902, П. Ф. Кольер, стр. 17. “У нас есть доказательство того, что в атоме есть фундаментальная величина, которая постепенно увеличивается при переходе от одного элемента к другому. Эта величина может быть только зарядом центрального положительного ядра, существование которого у нас уже есть определенное доказательство ».
Генри Мозли, Philosophical Magazine, Vol. 26, 1913, стр. 1030. «Химический состав атома зависит только от количества электронов, которое равно количеству протонов и называется атомным номером.Химия – это просто числа, идея, которая понравилась бы Пифагору. Если вы атом с одним протоном, вы водород; два, гелий; ….. ”
Карл Саган, Космос, 1980, Рэндом Хаус, стр. 223. Фото: НАСА.
Автор: Дуг Стюарт
Периодическая таблица, которую мы используем сегодня, основана на таблице, разработанной и опубликованной Дмитрием Менделеевым в 1869 году.
Менделеев обнаружил, что может расположить 65 элементов, известных на тот момент, в сетке или таблице так, чтобы каждый элемент имел:
1.Атомный вес выше, чем у того, что слева. Например, магний (атомный вес 24,3) помещен справа от натрия (атомный вес 23,0):
Истинная основа Периодической таблицы
В 1913 году химия и физика были перевернуты вверх ногами. Некоторые крупные нападающие, в том числе Менделеев, серьезно говорили об элементах легче водорода и элементах между водородом и гелием. Визуализация атома была общедоступной, и оправдание Менделеева периодической таблицы, основанной на атомных весах, разваливалось по швам.
Это история о том, как Генри Мозли принес свет во тьму.
2. Подобные химические свойства с другими элементами в том же столбце – другими словами, аналогичные химические реакции. Магний, например, помещается в колонку щелочноземельных металлов вместе с другими элементами, чьи реакции аналогичны:
Менделеев понял, что стол перед ним лежит в самом сердце химии. Более того, Менделеев увидел, что его таблица неполная – были места, где должны были быть элементы, но их никто не обнаружил.
Точно так же, как можно сказать, что Адамс и Леверье открыли планету Нептун на бумаге, Менделеев можно было сказать, что он открыл германий на бумаге. Он назвал этот новый элемент эка-кремний , после наблюдения зазора в периодической таблице между кремнием и оловом:
Аналогичным образом Менделеев открыл галлий ( eka -алюминий) и скандий ( eka -бор) на бумаге, потому что он предсказал их существование и их свойства еще до их фактических открытий.
Изображение периодической таблицы
Щелкните изображение, чтобы увеличить
Хотя Менделеев совершил решающий прорыв, он почти не продвинулся дальше. Оглядываясь назад, мы знаем, что периодическая таблица Менделеева была основана на ложных рассуждениях. Менделеев ошибочно полагал, что химические свойства определяются атомным весом. Конечно, это было вполне разумно, если принять во внимание научное знание 1869 года.
В 1869 году сам электрон не был открыт – этого не происходило еще 27 лет.
Фактически, потребовалось всего 44 года, чтобы найти правильное объяснение закономерностей в периодической таблице Менделеева …
Подробнее … Продолжение периодической таблицы
Таблица химических элементов
См. интерактивную таблицу Менделеева.
| Элемент | Sym- bol | Atomic no. | Атомарный мас. | Удельная плотность | Температура плавления C | Температура кипения C | No.из изотопов 1 | Discoverer | Год | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Актиний | Ac | 89 | 227 2 | 10.07 3 | 1051 | 82 319834 | 1899/1902 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алюминий | Al | 13 | 26.981538 | 2.6989 | 660,32 | 2519 | 8 | Whler | 1827 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Amium3 900 2 | 13.67 | 1176 | 2011 | 13 4 | Seaborg et al. | 1944 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сурьма | Sb | 51 | 121,76 | 6,61 | 630,63 | 1587 | 29 | Ранние исторические времена | ? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Аргон | Ar | 18 | 39,948 | 1,7837 5 | -189,35 | -185,85 | 8 | Рэлей и Рамзи | 189478 Assen | 1894
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
