Периодическая система химических элементов (таблица Менделеева)
https://ria.ru/20190129/1550014194.html
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов (таблица Менделеева) – РИА Новости, 29.01.2019
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. РИА Новости, 29.01.2019
2019-01-29T04:51
2019-01-29T04:51
2019-01-29T04:51
справки
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn23.img.ria.ru/images/99408/72/994087230_0:105:2000:1230_1920x0_80_0_0_b528d261d40438ab5524fc6ad7f580a3.jpg
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица “Опыт системы элементов, основанной на их атомном весе и химическом сходств”, составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге “Основы химии” Менделеевым была включена “Естественная система элементов Д. Менделеева” – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og).
Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица “Опыт системы элементов, основанной на их атомном весе и химическом сходств”, составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге “Основы химии” Менделеевым была включена “Естественная система элементов Д. Менделеева” – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов.
Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики. По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn23.img.ria.ru/images/99408/72/994087230_112:0:1889:1333_1920x0_80_0_0_597a34ca28aa89475eedcbd63e1a68a3.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.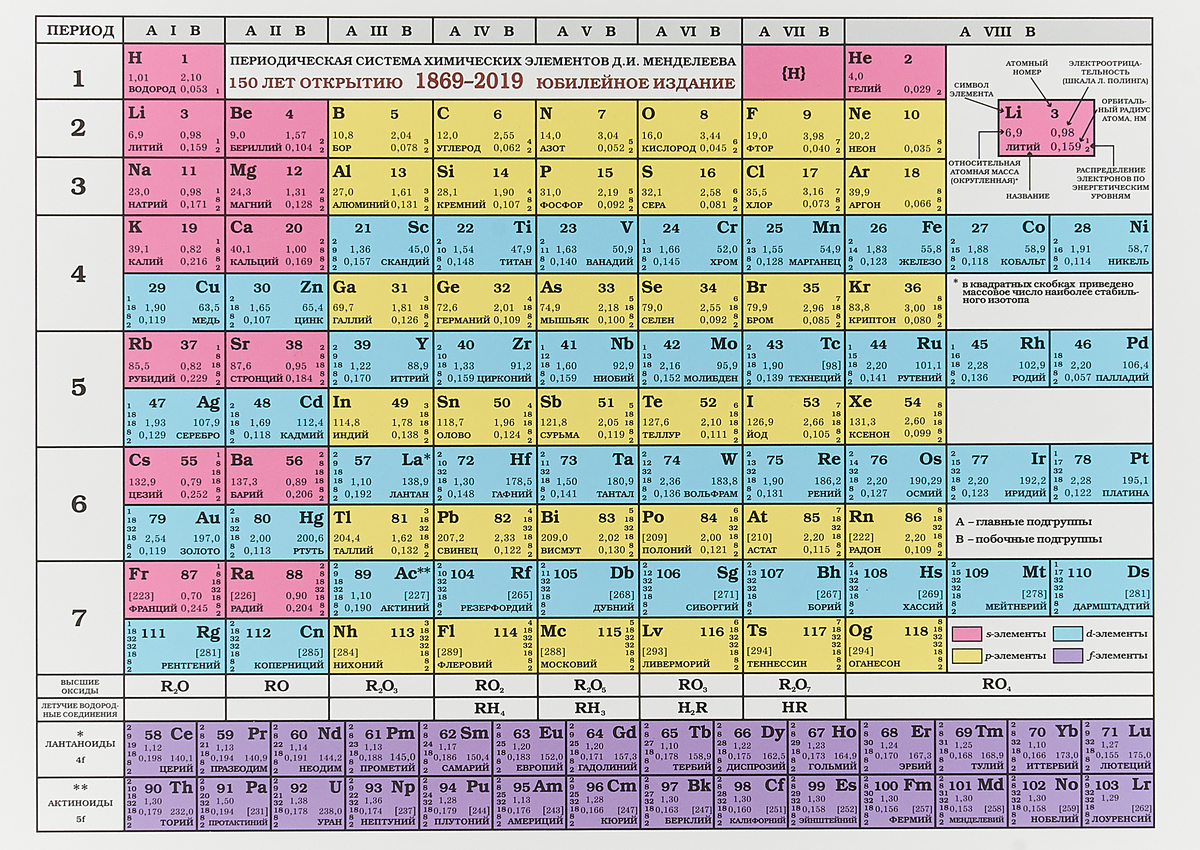 xn--p1ai/awards/
xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
справки
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация.
Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица “Опыт системы элементов, основанной на их атомном весе и химическом сходств”, составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге “Основы химии” Менделеевым была включена “Естественная система элементов Д. Менделеева” – первая классическая короткая форма Периодической системы химических элементов.
Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).
Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.
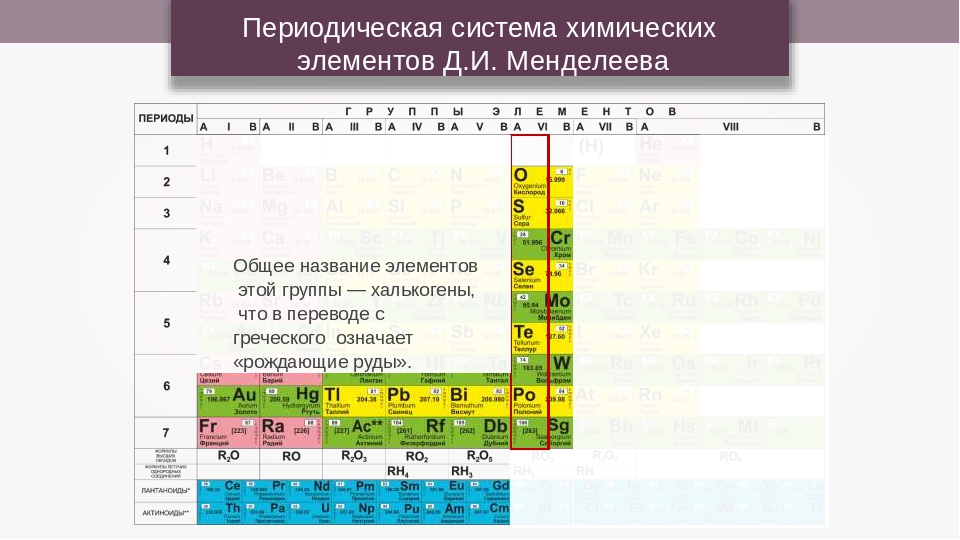
Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Первый период содержит два элемента – водород и гелий.
Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов.
Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов.
Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.
Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.
Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
Формы периодической таблицы
Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая», «длинная», «сверхдлинная».
В «короткой» форме записи четвертый и последующие периоды занимают по 2 строчки.
В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «сверхдлинном» варианте каждый период занимает одну строчку.
В качестве основного варианта IUPAC утвердил длинный вариант Периодической таблицы. Короткая форма таблицы, содержащая восемь групп элементов, официально отменена ИЮПАК еще в 1989 г.
Нильсом Бором разработана лестничная (пирамидальная) форма периодической системы.
Существует несколько сотен вариантов, редко или вовсе не используемых, но весьма оригинальных, способов графического или табличного отображения Периодического закона, при этом учёные предлагают всё новые варианты.
Познакомиться с разнообразием Периодических таблиц химических элементов, собранных со всего мира, можно на выставке, посвященной открытию Международного года Периодической таблицы, проводимой под эгидой ЮНЕСКО и Правительства Российской Федерации, при поддержке Российской Академии Наук, Московского государственного университета имени М.В. Ломоносова и Российского химико-технологического университета им. Д.И. Менделеева.
Всего предложено несколько сотен вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.).
Самая большая Периодическая таблица была установлена на стенах химического факультета в Университете Мурсии в Испании. В общей сложности она занимает в общей сложности 150 м Она состоит из 118 металлических квадратов размером 75×75 см. В неё включены все известные химические элементы, каждый из которых занимает отдельный квадрат.
Она состоит из 118 металлических квадратов размером 75×75 см. В неё включены все известные химические элементы, каждый из которых занимает отдельный квадрат.
В 2006 г. в Чикаго (США) временно была организована восьмиэтажная периодическая таблица выполненная с помощью плакатов.
Памятник Менделееву перед химическим факультетом Словацкого технологического университета в Братиславе:
В 2003 году студенты университета Уэйк Форест спроектировали стол и скамью для пикника в форме таблицы Менделеева.
На стене ВНИИ метрологии имени Д.И. Менделева в Санкт-Петербурге размещено мозаичное панно – Периодическая таблица химических элементов. В 1932 году рядом со зданием был установлен памятник великому русскому химику.
группы, периоды, атомная масса и иные свойства периодической системы
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.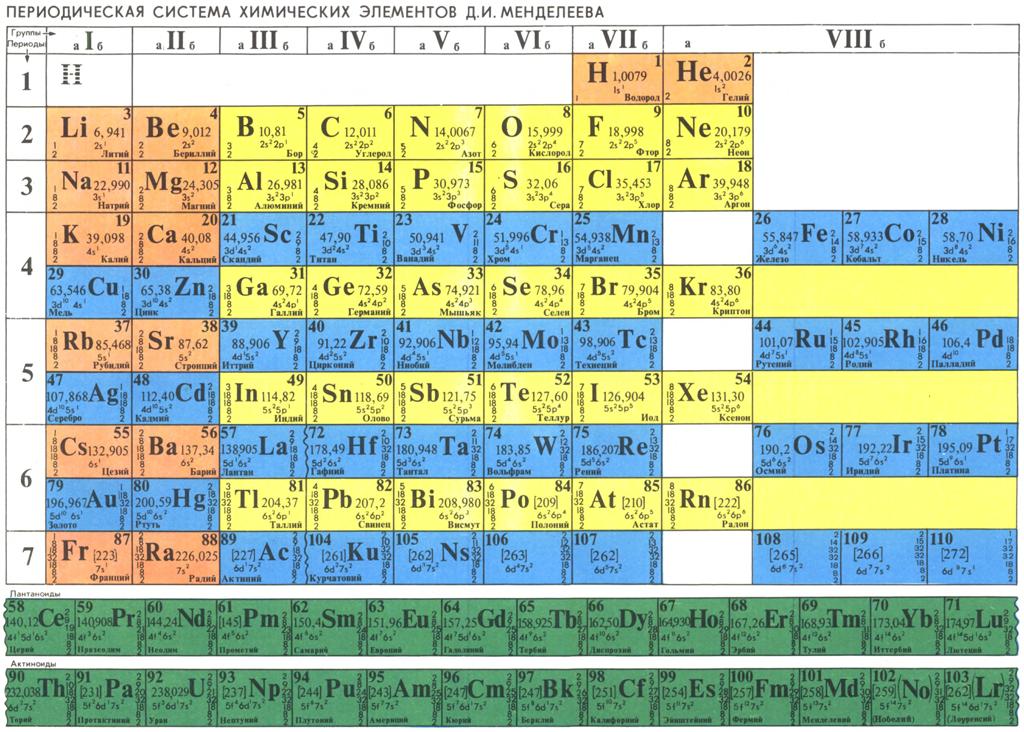
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
Периодическая таблица химических элементовНа настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.

В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду
CHEMISTRY892020 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.Щелочноземельные металлы
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA).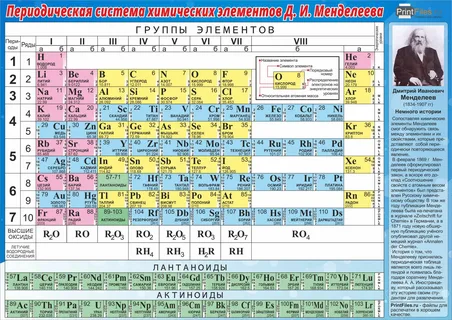 Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
1.3. Таблица Менделеева – Азбука химии
[МУЗЫКА] [МУЗЫКА] [МУЗЫКА] Я думаю, что если у десяти случайных прохожих спросить, с чем у них ассоциируется химия, то девять однозначно ответят: с периодической системой Дмитрия Ивановича Менделеева. Давайте познакомимся с этой таблицей подробнее. Итак, сейчас известно 118 элементов, и все они имеют свои названия. Последние элементы получили названия в конце 2016 года. Все элементы расположены в периодической системе в порядке возрастания заряда ядра. Однако Менделеев изначально располагал элементы в порядке возрастания атомных масс элементов. Однако уже при жизни Менделеева были открыты инертные газы, которые не имели в первоначальном варианте таблицы своего положения. Эту проблему очень легко разрешил Дмитрий Иванович: он сказал, что необходимо добавить еще одну группу и пошел на нарушение своего собственного принципа — он расположил аргон, имеющего атомную массу 40, перед калием, у которого атомная масса 39. Дело в том, что Менделеев ориентировался не только на атомный вес, но также еще и на сходство химических свойств. Как же устроена периодическая система? Мы ее называем периодической, поскольку в ней есть периоды. Период — это последовательность химических элементов по возрастанию заряда ядра их атома, в которых происходит заполнение внешних электронных оболочек. Существуют два варианта периодической системы в зависимости от того, как изображены периоды. Длинный периодный вариант, рекомендованный IUPAC, в нем все элементы одного периода располагаются в одну строчку. Или короткопериодный вариант — этот вариант особенно популярен на территории России. В этом варианте один период может записываться в две строки. Такая табличка получается более компактной и в чем-то даже более удобной для использования. Кроме того, в периодической системе есть еще и группы. Группы — это тоже последовательность атомов по возрастанию заряда ядра, однако эти атомы обладают однотипным электронным строением. То есть в них происходит заполнение однотипных атомных орбиталей. В короткопериодном варианте периодической системы группы дополнительно разделяются на главную и побочную подгруппу. Дело в том, что в главной подгруппе заполняются только s- или p-электроны, а в побочных подгруппах также d-электроны. Некоторые группы элементов имеют собственные групповые названия. Так, первая A группа, то есть главная подгруппа первой группы периодической системы, или просто первая в длиннопериодном варианте периодической таблицы, имеет название «Щелочные металлы». Там расположены элементы металлы, которые могут образовывать сильные основания — щелочи. Вторая A группа, то есть главная подгруппа второй группы, — это щелочно-земельные элементы. Пятая A группа, или 15-я группа в длиннопериодном варианте, — это элементы пниктогены. Однако такое название редко используется. Шестая A группа, или 16-я группа в длиннопериодном варианте — это элементы халькогены, то есть рождающие руду. Седьмая A группа — галогены, то есть рождающие соли. И наконец восьмая A группа — это инертные, или благородные, газы. Помимо разделения элементов на группы и периоды, можно выделять еще и отдельные семейства элементов. Самым естественным разделением элементов на семейства является разделение их по электронному строению. Так, можно выделить электронное семейство s-элементов, p-элементов, d-элементов и f-элементов. Особенно ярко они появляются в длиннопериодном варианте таблицы, потому что здесь эти элементы занимают отдельные прямоугольные блоки. В короткопериодном варианте эти элементы начинают пересекаться, однако при определенной сноровке и тренировке вы сможете легко отличить s- и p-элементы от d-элементов в периодической системе в короткопериодной ее форме. По общности химических свойств часто объединяют некоторые и другие элементы. Например, выделяют триаду железа, которая содержит железо, кобальт и никель. И платиновые металлы: рутений, родий, палладий, осмий, иридий и платина. Если к ним добавить серебро и золото, то такое семейство можно назвать благородные металлы. Переходными металлами называют d-элементы за исключением последних d-элементов. Всего можно выделить несколько переходных рядов. Первый переходный ряд — это элементы от скандия до меди, а второй — от иттрия до серебра, третий — от лантана до золота. Это обусловлено тем, что у них некоторые особые свойства, которые отличают их от свойств непереходных элементов. С этими свойствами мы будем знакомиться в нашем курсе. Наконец можно выделить трансурановые элементы. Общим для них является то, что это искусственные элементы. Они все сильно радиоактивны и крайне неустойчивы. Как же связано строение атома в его положением в периодической системе? Химические элементы расположены в таблице не хаотично, а в строгом соответствии со строением их атомов. Так, количество электронных уровней определяет номер периода, а количество электронов на валентных подуровнях определяет номер группы. Последний по правилам заполнения электрон определяет принадлежность элемента к определенному электронному семейству. Давайте проиллюстрируем эти правила на нескольких примерах. Возьмем, например, натрий: это 11-й по счету элемент. Всего в электронной оболочке атомов натрия три электронных уровня, поэтому натрий расположен в третьем периоде. Его электронная конфигурация 1s2 2s2 2p6 3s1. На внешнем электронном слое один электрон, 3s1 — внешний электронный слой. Поэтому натрий расположен в первой группе. Этот электрон относится к s-электронам, поэтому натрий относится к s-электронному семейству элементов. Это щелочной металл. Кислород — это восьмой по счету элемент. Его электронная конфигурация — 1s2 2s2 2p4. Всего два электронных уровня, поэтому кислород располагается во втором периоде. На внешнем слое у кислорода шесть электронов 2s2 2p4, поэтому кислород принадлежит к шестой группе элементов. И последний по правилам заполнения электрон — это p-электрон, поэтому кислород относится к p-электронному семейству элементов. Железо. Железо расположено в четвертом периоде. Его электронная конфигурация (я назову ее в краткой форме): это [Ar] 4s2 3d6. Всего у железа четыре электронных уровня, на которых есть электроны, поэтому железо находится в четвертом периоде. На внешнем электронном слое восемь электронов 4s2 3d6, поэтому железо находится в восьмой группе. Ну и последний по правилам заполнения электрон — это d-электрон, поэтому и железо тоже — d-элемент. Дмитрий Иванович Менделеев сформулировал свой закон следующим образом: «Свойства простых тел, а также формы и свойства соединения элементов, а потому и свойства образуемых или простых и сложных тел стоят в периодической зависимости от их атомного веса». Пользуясь этим законом, Дмитрий Иванович Менделеев предсказал свойства неизвестных на тот момент элементов. Эти элементы — некоторые из них — были открыты уже при жизни самого Дмитрия Ивановича Менделеева, которые подтвердили верность его закона. Именно это отличает открытие Дмитрия Ивановича Менделеева от попыток других многочисленных ученых систематизировать химические элементы. Однако, конечно, в XX веке ученым удалось раскрыть строение атома, и в этот периодический закон пришлось внести одну, но очень важную, существенную корректировку. Все-таки свойства простых тел, а также формы и свойства соединения элементов находятся в периодической зависимости не от атомного веса, а от заряда ядер атомов химических элементов. Какие же свойства находятся в такой периодической зависимости? Давайте разберем некоторые из них. Одно из главнейших свойств — это радиус атомов элементов. Радиус атомов увеличивается в группах и уменьшается в периодах. Уменьшение радиуса атомов в периодах связано с тем, что количество энергетических уровней не изменяется, тогда как заряд ядра возрастает. Это означает, что внешние электроны начинают с большей силой притягиваться к ядру, и поэтому радиус атома уменьшается, а в группах происходит нарастание количества энергетических уровней. Мы помним, что номер энергетического уровня, то есть главное квантовое число, связано с размером атомной орбитали: чем больше номер, тем больше размер. Поэтому в группах радиус атомов увеличивается. Очень важное свойство химических элементов — это электроотрицательность, то есть способность атомов химических элементов притягивать к себе свои собственные электроны, а также электроны химических связей. Наибольшей электроотрицательностью обладает атом фтора, а наименьшей — цезий и рубидий. Электроотрицательность увеличивается в периодах и уменьшается в группах. Способность атомов притягивать к себе электроны обуславливает их многие химические свойства. Так, элементы-галогенам, которым недостает до заполнения своей электронной конфигурации всего лишь одного электрона, то есть до получения ими электронной конфигурации инертного газа, обладают высокой электроотрицательностью, высокой способностью притянуть к себе еще один хотя бы электрончик. А вот щелочным металлам гораздо проще избавиться от своего единственного электрона, чтобы принять очень устойчивую электронную конфигурацию инертного газа. Поэтому у щелочных газов наименьшая электроотрицательность. Другие важные свойства — это металлические и неметаллические свойства. Металлические, или восстановительные, свойства возрастают в группах и уменьшаются в периодах. Это означает, что наиболее выраженными металлическими свойствами обладают элементы, расположенные в левом нижнем углу периодической системы. А вот, напротив, неметаллические, или окислительные, свойства возрастают в периодах и уменьшаются в группах. Это означает, что наиболее характерные элементы-неметаллы расположены в правой верхней части периодической системы. Можно провести условную диагональ металличности/неметалличности в периодической системе. Тогда выше этой диагонали будут расположены элементы-неметаллы, а ниже — элементы-металлы. Вдоль такой диагонали будут расположены амфотерные элементы. Поэтому такую диагональ часто называют диагональ амфотерности. Итак, как же реагируют элементы друг с другом? Они вступают во взаимодействие, которое непременно приводит к тому, что электроны, принадлежащие атомам, становятся общими электронами. В этом заключается основной принцип образования химических связей. Давайте рассмотрим это в следующей лекции.
Где искать самую старую таблицу Менделеева?
Об этом в рамках открытой лекции «150 лет Периодической системе химических элементов Д. И. Менделеева. История создания» школьникам рассказал Евгений Олегович Калинин, старший преподаватель СПбГУ (кафедра радиохимии). «Данный демонстрационный вариант был изготовлен по указанию самого Дмитрия Ивановича в 1876 году. Недавно средства массовой информации писали о якобы найденной в Сент-Эндрюсском университете самой старой в мире Периодической таблице химических элементов. Так вот, это не так, — рассказывает Евгений Калинин. — Как выяснили эксперты, настенная таблица, обнаруженная в Шотландии, была напечатана в 1880-х годах. И хотя это, безусловно, интересная находка, по-настоящему ценный демонстрационный вариант Периодической системы находится в СПбГУ, в Большой химической аудитории».
Евгений Калинин обратил внимание школьников на разницу в датах между формулированием Периодического закона в 1869 году и созданием его графического образа в виде таблицы в 1876 году. Что происходило в течение семи лет? Почему первый публичный вариант таблицы не был создан раньше?
Когда Дмитрий Иванович сформулировал Периодическую систему, он еще и сам не был уверен в том, в каком окончательном виде следует ее подавать. На осмысление этого вопроса у него ушло несколько лет.
Старший преподаватель СПбГУ Евгений Калинин
Представленный в аудитории СПбГУ вариант не соответствует тому, к которому мы все привыкли. По словам химика, в этой таблице, например, не хватает восьмой (VIII) группы химических элементов — благородных газов. «Они к моменту создания данного варианта таблицы еще не были открыты, и, честно сказать, ни сам Менделеев, ни его современники, конечно, не предполагали, что благородные газы вообще существуют в природе. Поэтому для них места в этом варианте не отведено», — поясняет Евгений Калинин.
Нет в этой таблице и некоторых химических элементов. На их местах стоят прочерки. Эти элементы тогда еще не были открыты, но Дмитрий Иванович Менделеев был убежден, что они должны быть. «На это указывает и тот факт, что в некоторых клеточках нет символа химических элементов, но указан атомный вес. Например, рядом с Са стоит прочерк и цифра 44. Химического элемента нет, но четко указана, какая у него должна быть масса», — объясняет Евгений Калинин.
Менделеев не просто разложил химические элементы по полочкам в зависимости от их атомного веса и химических свойств. Он еще и предсказал, что нужно работать не только с известными на тот момент элементами, но и вести поиск новых.
Старший преподаватель СПбГУ Евгений Калинин
Лекция прошла в аудитории, которая носит название Большой химической. Она находится в здании, построенном в 1894 году по инициативе Дмитрия Ивановича Менделеева. По словам Евгения Калинина, в конце XIX века ежегодно химию в Университете изучали почти 400 человек. При этом больших аудиторий и лабораторий для занятий не было. Поэтому Дмитрий Иванович в 1880-х годах предложил построить специальный лабораторный корпус для преподавания химии в Университете. Правда, сам Менделеев в нем лекции уже не читал, но председательствовал на заседаниях Русского физико-химического общества.
Открытая лекция для школьников прошла в рамках цикла мероприятий, посвященных 150-летию открытия Периодического закона и 185-летию со дня рождения Дмитрия Ивановича Менделеева. На ней присутствовали учащиеся Волховской средней общеобразовательной школы № 1 и лицея № 554 Приморского района Санкт-Петербурга. Следующая лекция состоится 22 февраля.
Элементы под рукой
В этом году мир отмечает 150-летний юбилей со дня открытия периодической системы элементов. Недавно в честь него мы предлагали пройти тест на знание названий химических элементов, которые по тем или иным причинам в таблицу Менделеева не попали. Однако споры вокруг названий элементов — далеко не единственные разногласия, которые были связаны с периодической системой за полтора века ее истории. На этот раз мы расскажем об альтернативных вариантах формы таблицы элементов, которые в большом количестве предлагались за это время, но в итоге так и не стали широко использоваться.
Многие из этих таблиц по-своему интересны, информативны, красивы или смешны, но речь сейчас пойдет не о них. Мы предлагаем вам познакомиться с теми формами периодической системы элементов, которые принципиально отличаются от ее традиционного представления. Эти системы включают те же самые элементы, но для наглядности физических принципов, на которых основана периодичность их свойств, или просто для удобства использования ученые в разное время пытались представить их не в виде привычной нам таблицы из восемнадцати столбцов и семи строчек, а как-то иначе. Для этого они меняли направление периодов и групп, наматывали последовательность элементов на цилиндр и представляли их в виде ветвящихся деревьев.
Периодичность свойств
Чтобы разобраться, почему для периодической таблицы химических элементов предлагали так много разных способов графического представления, сначала кратко напомним о физических основах периодического закона.
В любой версии таблицы элементы расположены по увеличению заряда ядра: у первого элемента — водорода — он самый маленький и равен (по модулю) заряду одного электрона, а у самого тяжелого из известных на данный момент оганесона, расположенного в нижнем правом углу таблицы, он равен (тоже по модулю) заряду сразу 118 электронов. Поскольку заряд ядра определяется количеством в нем протонов, то вместе с зарядом растет и его масса (редкие исключения возможны из-за непостоянного соотношения между числом протонов и нейтронов в ядре), а периодичность свойств связана со структурой электронных оболочек атомов.
Грубо говоря, орбитали, на которых могут находиться электроны вокруг ядра атома, расположены «слоями». Эти слои отличаются между собой по размеру, энергии и форме. Первыми из них заполняются электронами те, которые расположены ближе всего к ядру, а если на них все места уже заняты, то электроны выбирают оболочки подальше от ядра и, соответсвенно, побольше. При этом вместе с увеличением радиуса растет и их энергия, и разнообразие форм: так, у самого близкого к ядру электронного слоя есть только одна сферическая s-орбиталь, а следующий слой состоит уже из четырех орбиталей: к одной сферической присоединяются еще три гантелевидные p-орбитали.
На следующих периодах появляются еще пять крестообразных d-орбиталей, а затем еще и 7 f-орбиталей. Подробнее о физических принципах, на которых основана периодичность химических свойств, вы можете прочитать в нашем материале «Элемент неожиданности».
От того, на каком слое находится «самый дальний» от ядра электрон, и зависит, в каком периоде окажется элемент, а каждый переход к новому слою (когда все более маленькие оказываются занятыми) означает переход к новому периоду в таблице. При этом последовательность заполнения электронных оболочек важна для формирования структуры таблицы и определяется значениями главного и орбитального квантового чисел электронов и формулируется как правило Клечковского (оно же правило Маделунга): сначала заполняется уровень с наименьшим значением суммы этих двух чисел, а при равенстве этих сумм приоритет оказывается у оболочки с меньшим значением главного числа.
Схема заполнения электронами энергетических уровней согласно правилу Клечковского
Wikimedia commons
Логичный вопрос — как всю эту сложную периодическую систему с большим разнообразием электронных орбиталей, увеличением их числа и типов на каждом новом уровне представить графически: куда стоит помещать те или иные элементы, в каком направлении должно происходить увеличение массы атома, как лучше всего продемонстрировать периодичность и сходство свойств, как связать положение элементов с их электронной структурой.
Самый простой пример возникающих сложностей можно найти в самом начале таблицы Менделеева — это водород. С одной стороны, у него на внешнем уровне всего один электрон, что сразу делает его похожим на щелочные металлы: литий, натрий или калий, — а с другой стороны, того же одного электрона водороду не хватает до конфигурации инертного газа, из-за чего для него характерны и некоторые свойства галогенов — фтора или хлора.
В результате в течение долгого времени водород метался между первой группой и седьмой, а в некоторых вариантах таблицы занимал одновременно две позиции в первом периоде таблицы. Подобных коллизий — как фундаментального, так и эстетического характера — за историю периодической таблицы возникало немало.
Вертикально или горизонтально
Например, один из первых вопросов, который задаст учитель химии школьнику, только что познакомившемуся с таблицей элементов, — где в ней находятся периоды, а где группы, кто из них располагается по вертикали, а кто по горизонтали? Прилежному восьмикласснику ответить на этот вопрос никакого труда не составит: конечно, периоды расположены в строках таблицы, а группы — в столбцах.
А вот сам Менделеев уверен в этом не был и в какой-то момент мог ответить на этот вопрос иначе. Самая первая версия таблицы, которую он в 1869 году сначала нарисовал у себя в дневнике, а затем опубликовал в журнале Русского химического общества, была вертикальной: каждый новый период располагался в новом столбце, а похожие по химическим свойствам элементы из одной и той же группы располагались по горизонтальным рядам. В результате 63 известных на тот момент элемента занимали 6 столбцов и 19 строчек.
Рукопись Д. И. Менделеева 1869 года, на которой приведена одна из первых версий периодической таблицы элементов в вертикальной форме
Музей-архив Д. И. Менделеева при СПбГУ
Французский экземпляр «Опыта системы элементов» с вертикальной версией таблицы, разосланный Менделеевым иностранным ученым в 1869 году
Музей-архив Д. И. Менделеева при СПбГУ
Уже в следующем году Менделеев предложил горизонтальную версию таблицы (такую форму имеет и найденная недавно в Сент-Эндрюсском университете одна из старейших сохранившихся копий настенных периодических таблиц, напечатанная в 1885 году, и таблица в аудитории СПбГУ, изготовленная по указанию самого ученого в 1876 году). Тем не менее, вплоть до конца XIX века вертикальные таблицы и их модифицированные версии продолжали использоваться наряду с горизонтальными.
Вопрос о старейшем экземпляре таблицы Менделеева для N + 1 прокомментировал заведующий Музеем-архивом Д. И. Менделеева при СПбГУ Игорь Дмитриев:«Насколько можно судить по сохранившимся документам, Менделеев размышлял о систематике химических элементов по крайне мере с 1867 года, а в активную фазу работа по систематике элементов вошла в начале 1869 года. Провыв наступил 17 февраля (1 марта по новому стилю) 1869 года — именно этим числом датирован и один из сохранившихся набросков. На нем сверху рукою Менделеева написано: “Опыт системы элементов, основанной на их атомном весе и химическом сходстве, Д. Менделеева”. Этот вариант систематики элементов вскоре был отпечатан в виде отдельного листка тиражом 200 экземпляров и разослан русским и иностранным химикам».
Подробнее о самых старых копиях таблицы Менделеева читайте в нашем блоге «Дело не в таблице».
Компактно или наглядно
Количество периодов в периодической таблице за 150 лет увеличилось с шести до семи (и этот факт вопросов не вызывает), а вот насчет «правильного» количества столбцов в таблице до сих пор спорят. Большинство читателей в ответ на вопрос о возможных вариантах таблицы Менделеева наверняка сразу вспомнят про короткопериодную и длиннопериодную версии.
В первом случае d-элементы, у которых появляются электроны на d-орбиталях и которые присутствуют в таблице начиная с 4 периода, записываются в две строчки. Такая запись возможна благодаря сходству степеней окисления у элементов главной группы (то есть p-элементов) и расположенных над ними переходных металлов из d-блока таблицы.
Горизонтальная короткопериодная таблица Менделеева, опубликованная в 1871 году
Wikimedia commons
Короткая запись таблицы получается весьма компактной, но, например, некоторые из металлов в такой системе целыми тройками оказываются как будто бы в той же группе, что и инертные газы, хотя по своим химическим свойствам совершенно на них не похожи. В результате в 1989 году ИЮПАК официально отменил короткий вариант таблицы и сейчас она используется редко, а основной версией таблица стала «длиннопериодная».
В ней все элементы из одного периода записываются одной строкой. С одной стороны, это позволяет избежать некоторой путаницы, но с другой — таблица при этом становится значительно менее компактной и резко увеличивается по ширине. Поэтому чтобы избежать дальнейшего разрастания таблицы элементов в горизонтальном направлении, все f-элементы — лантаноиды и актиноиды — в обоих вариантах таблицы выносятся в отдельные секции в нижней части таблицы.
Несмотря на избыточную ширину даже такого варианта таблицы, физик Гленн Сиборг решил, однако, на нем не останавливаться и в 1969 году предложил свою версию сверхрасширенной таблицы. В этой версии таблицы без переносов строки включаются не только d-элементы, но и f-элементы, то есть лантаноиды и актиноиды (которые сейчас всегда выносятся в отдельную секцию), а также g-элементы, ни один из которых на данный момент не получен. Всего в таблице оказалось 218 элементов — даже сейчас таблица ровно на сто элементов короче, а в тот момент их было синтезировано еще меньше.
Стоит отметить, что насчет научной ценности такой таблицы у ученых возникают сомнения. Во-первых, это просто неудобно — полная версия таблицы будет занимать несколько разворотов книги (да и на экран монитора не уместится). Во-вторых, у большинства химиков вопросы вызывает сохранение периодических закономерностей для химических свойств у настолько тяжелых элементов — при такой массе их свойства сильнее зависят от состава ядра, чем от заполненности электронных оболочек. Эта проблема становится актуальной уже для актиноиодов, а недавно было показано, что и оганесон — последний элемент седьмого периода — не так уж сильно похож на инертный газ.
«Левосторонняя» таблица элементов Шарля Жане 1928 года
Charles Janet / Imprimerie De ́partementale de l’Oise, Beauvais, 1928
Справа или слева
Попытка уместить каждый период в единственную строчку, вплоть до абсурдных вариантов с 50 столбцами, — на самом деле самый простой и безобидный способ изменить внешний вид таблицы, чтобы сделать ее нагляднее. Эти таблицы почти не отличаются от традиционных, и перестроиться на них труда не составит. Значительно сложнее это сделать при работе со некоторыми другими периодическими системаи.
Например, одна из наиболее известных версия альтернативного способа заполнения — это так называемая «левосторонняя» таблица Шарля Жане, которую он предложил в 1928 году. Жане опубликовал за один год две работы, в которых предложил сразу три модификации такой таблицы, остановившись на наиболее наглядной версии.
В отличие от традиционной таблицы, блоки s- и p-элементов в ней расположены в обратном порядке: s-блок (щелочные и щелочноземельные металлы) справа, а p-блок — слева от него. При этом заполняется эта таблица, как и традиционная, слева направо, поэтому переход от одного периода к другому происходит между 2-й и 13-й (или 3-й в короткопериодном варианте) группами. Таким образом, s-элементы в таблице оказываются расположены около правого края, слева от них — инертные газы и весь p-блок, еще левее — d-элементы.
Основное преимущество подобного расположения элементов состоит в том, что с помощью него в «длиннопериодном» варианте таблицы удается избежать разрывов между s- и p-элементами, благодаря чему можно с ходу, практически не задумываясь, определить электронную конфигурацию атома того или иного элемента в незаряженном состоянии, просто отсчитывая нужные блоки с правой стороны.
Другая необычная версия таблицы — это «древовидная» таблица, которую предложил Эдвард Мазурс в 1967 году. В ней не только новый период, а каждый новый блок элементов (s-, p-, d- и f-блоки), начинается на новой строчке. Каждый из них выравнивается по центру, в результате чего образуется структура, напоминающая рисунок елки, треугольные уровни у которой перевернуты вверх ногами. «Ствол» это дерева состоит из s-элементов, над ними находятся p-элементы, затем d- и f-металлы (если они в периоде есть).
Эта таблица также позволяет быстро определить электронную структуру элементов, а для облегчения восприятия, как и в традиционных вариантах, ее ячейки подкрашивают тем или иным цветом.
Древовидная периодическая таблица Эдварда Мазурса, опубликованная на форзаце его книги 1974 года
E. G. Mazurs, Graphic Representation of the Periodic System during One Hundred Years, 1974
Таблица или дерево
При этом далеко не все варианты альтернативных периодических систем, предложенных за 150 лет их истории, представляли собой таблицы. Например, в конце XIX века и начале XX века на основе первоначального вертикального варианта Менделеева ученые пытались построить всевозможные ветвящиеся структуры, которые должны были, по мысли авторов, лучше описывать периодичность свойств, чем таблица из столбцов и строчек.
Как и значительно более поздний вариант Мазурса, эти таблицы тоже напоминают разрастающиеся деревья, но состоят не из отдельных ячеек, а представляют собой элементы, связанные между собой веточками, определяющими родство свойств.
Разветвленная система элементов Бэйли 1882 года
G. N. Quam and Mary Bettell Quam / Journal of Chemical Education, 1934
Во всех этих вариантах ученые использовали идею увеличения длины периода с ростом массы элемента — на каждом следующем шаге между щелочными металлами и галогенами (инертные газы на момент публикации большинства этих вариантов еще не были известны) встраивается все большее число новых элементов.
Ветвистые структуры из элементов, соединенных палочками, иногда принимали довольно необычные формы. Например, в периодической системе Старека 1932 года элементы сгруппированы по сходству физических свойств и образуют зигзагообразную систему с диагональным выравниванием элементов, напоминающую проекцию какой-то сложной трехмерной структуры.
Периодическая система, предолженная Стареком в 1932 году
G. N. Quam and Mary Bettell Quam / Journal of Chemical Education, 1934
Строчки или витки
Пожалуй, самой популярной альтернативой табличному представлению за всю историю периодической системы элементов оказались всевозможные модификации спиральных структур. Основная проблема формы таблицы — прерывистость ее структуры. Чтобы перейти в ней от одного периода к другому, так или иначе нужно перескакивать с конца предыдущей строки к началу новой. Такой скачок, однако, противоречит постепенному росту заряда ядра — при переходе от инертного газа к щелочному металлу следующего периода нужно увеличить заряд ядра на заряд всего одного протона — так же, как и при переходе к следующему элементу в середине периода.
Наиболее очевидной геометрической структурой, которая позволяет показать одновременно и периодичность системы, и последовательность роста атомной массы, оказалась именно спираль. Спиральные формы для систем элементов начали предлагать еще в конце XIX века, а одну из первых значимых с научной точки зрения спиралей элементов предложил в 1902 году Гуго Эрдманн. В предложенной им системе цепочка с последовательностью элементов наматывается на архимедову спираль, при этом короткие периоды (без переходных металлов) проходят один оборот, а длинные — два.Спиральная периодическая система Гуго Эрдманна 1902 года
G. N. Quam and Mary Bettell Quam / Journal of Chemical Education, 1934
В начале XX века было предложено еще несколько «спиралей Менделеева», а значительный шаг в их улучшении сделал тот же Шарль Жане. После публикации своей «левосторонней» версии таблицы он в том же 1928 году начал работать над спиральными версиями структуры. Жане разработал несколько версий объемных и плоских спиралей, что, помимо прочего, помогло ему фактически прийти к верному правилу последовательности заполнения электронных орбиталей на шесть лет раньше Маделунга и на 21 год раньше Клечковского.
Повторные обороты на длинных периодах Жане заменил петлями — покороче для d-элементов и подлиннее — для f-элементов, так что структура в зависимости от формы записи стала напоминать голову кролика или кактус.
Вторая версия спиральной периодической системы Шарля Жане 1928 года
Charles Janet, La classification hélicoïdale des elements chimiques, 1928
Спиральная система Шарля Жане в форме лемнискаты
E. G. Mazurs / Graphic Representation of the Periodic System during One Hundred Years, 1974
Спиральная периодическая система Гордона Ирвина 1939 года
K. Gordon Irwin / Journal of Chemical Education, 1939
Спиральная периодическая система Теодора Бенфея, опубликованная в 1964 году
Wikimedia commons
Подобные плоские спирали продолжали дорабатываться и дополняться в течение еще нескольких десятков лет, но стать полноценной заменой таблицам так и не смогли.
Плоская или объемная
Интересно, что не так мало альтернативных версий периодической системы элементов были не плоскими, а объемными. И в основе большинства из них тоже оказывались спиральные структуры. Обычно цепочки последовательностей элементов предлагали «наматывать» на цилиндр или конус (в последнем случае таблица становится похожа на гирлянду на новогодней елке).
Однако из-за невозможности нормально работать с изображениями этих спиралей на бумаге и небольшой наглядности все эти варианты остались лишь экспериментами.
Модель спиральной периодической системы в форме восьмерки, предложенная Круксом в 1898 году
G. N. Quam and Mary Bettell Quam / Journal of Chemical Education, 1934
При этом, кроме научно значимых попыток создания объемных структур, ученые и художники наносили периодическую таблицу и на другие объемные фигуры. Например, в начале XX века появилась сферическая версия таблицы элементов, которая заполнялась сверху вниз, при этом на нижнюю половину сферы должны были попадать все неустойчивые элементы. Или совсем экстравагантные варианты, такие как таблица Менделеева на ленте Мёбиуса, которая имеет, правда, лишь эстетическую ценность.
Из-за того, что многочисленные версии таблиц элементов стали возникать сразу же после формулировки периодического закона, уже с конца XIX века появились и первые обзорные статьи, которые сравнивали эти варианты между собой, определяя наиболее удобные, наглядные и подходящие для дальнейшего использования версии. Сейчас новые подобные публикации в форме отдельных статей и целых монографий все еще продолжают появляться, хотя носят уже скорее исторический интерес.
Александр Дубов
Литература
1. G. N. Quam and Mary Battel Quam, Types of Graphic Classifications of the Elements, Journal of Chemical Education, 1934.2. Edward G. Mazurs, Graphic Representations of the Periodic System During One Hundred Years, University of Alabama Press, 1974.
3. Eric Scerri, The Periodic Table: Its Story and Its Significance, Oxford University Press, 2006.
В периодическую таблицу Менделеева внесены четыре новых элемента, два из которых связаны с Россией
В подмосковной Дубне приступили к изучению свойств новых химических элементов: открытые совместно с зарубежными учеными, два из четырех элементов получили названия, которые напрямую говорят о связи с Россией. Сегодня таблица Менделеева уже другая.
Для большинства из нас понять, что именно открыли и как это может быть использовано в жизни, настолько трудно, что мы можем только верить исследователям, представляя, как многое вообще еще неизвестно. Это категории высшей материи!
Так выглядит таблица Менделеева, которую можно купить в магазинах сегодня: в седьмом периоде зияют дыры. Теперь это все придется перепечатывать. 113, 115, 117 и 118 элементы официально открыты и получили названия. Три из них признаны открытиями ученых из Объединенного института ядерных исследований в подмосковной Дубне.
«Московий – в честь земли московской; ливерморий – это наши коллеги из Ливермора, которые работали вместе с нами, приезжали сюда, все эксперименты делаются здесь; то же самое теннессин – из Теннесси наши коллеги; ну а 118 – домашний, наш, родной», – рассказывает научный руководитель Лаборатории ядерных реакций им. Г.Н. Флерова, академик РАН Юрий Оганесян.
118 элемент для Юрия Оганесяна не просто родной. Он назван в его честь – оганесон. Это второй случай в мировой истории, когда элемент периодической таблицы называется в честь ученого при жизни. Такой вариант названия предложили его коллеги из лаборатории ядерных исследований.
Больше 20 лет Юрий Цолакович стоит во главе российско-американской группы ученых, синтезирующих и исследующих сверхтяжелые элементы периодической системы.
«Охота за этими элементами – это такая сегодня совершенно важная часть современной экспериментальной ядерной физики. И тут надо сказать, что наши ученые, в частности, во главе с академиком Оганесяном, они здесь занимают самые передовые позиции», – отмечает президент Российской Академии Наук Владимир Фортов.
На вопросы журналистов «каково это, когда твое имя вписывается в историю на века», ученый отвечал скромно.
«Не ищите каких-то сверхчувств, поставьте себя на мое место. Я благодарен своим коллегам, своим товарищам, с которыми прошел этот долгий путь, и очень рад, конечно, что он кончился вот этим открытием, доказательством этому является не один, а на самом деле семь элементов. Один из них вот так назван, но это уже не столь важно, как он назван, а важно то, что это есть», – говорит ученый.
Сначала считалось, что периодическая таблица вообще должна закончиться на сотом элементе. Каждое новое открытие переворачивало весь научный мир. И именно Лаборатория ядерных исследований Дубнинского института — признанный мировой лидер по заполнению таблицы Менделеева. 105 элемент назван дубнием, а 114 – флеровием в честь основателя лаборатории Георгия Флерова. Теперь – московий и оганесон.
«За эти 60 лет в стенах этой Лаборатории, в стенах нашего института, усилиями многонациональных коллективов Лаборатории было открыто 11 сверхтяжелых элементов, доселе неизвестных миру, неизвестных науке, и это, конечно, я сказал бы, выдающийся результат», – сказал директор Объединенного института ядерных исследований Виктор Матвеев.
О практическом применении последних открытий речи пока не идет. Это дело науки будущего. Хотя ученые говорят: для того, чтобы синтезировать новый элемент, нужно уже совершить много технических открытий и инноваций. Ускорители, которые располагаются в Дубне, не имеют аналогов. На циклотроне У400 и были синтезированы самые тяжелые элементы.
Частицы кальция-48 проходят по каналу. Для синтеза нового элемента нужно, чтобы они попали точно в мишень. Обычно это уран, плутоний или калифорний. Мишень находится за стеной. Каждую секунду по ней выпускается 10 триллионов частиц, эксперимент идет несколько месяцев и за все это время рождается всего несколько ядер.
Ученые из Дубны уже поставили перед собой следующую задачу: синтез 119, 120 и последующих элементов. Специально для этого здесь строится так называемая «фабрика сверхтяжелых элементов».
Сердцем этой фабрики станет новый ускоритель, превосходящий по мощности все мировые аналоги в 10 раз. Именно в пространстве дубнинского циклотрона частицы будут разгоняться по спирали до скорости, близкой к скорости света.
Если во время предыдущих экспериментов ядра новых элементов образовывались раз в несколько месяцев, то теперь это будет происходить каждый день. Поставить научные открытия на поток – вот в чем смысл названия «фабрика». Первый запуск этого комплекса сверхтяжелых элементов намечен уже на ноябрь 2017 года.
About – Ptable
About – PtableКак мне процитировать это в своей библиографии?
APA
Дая, М. (1997, 1 октября). Периодическая таблица – Таблица . Таблица. https://ptable.comMLA
Дая, Майкл. Периодическая таблица – Таблица . Ptable, 1 октября 1997 г., ptable.com. Дата обращения 2 июня 2021 г.Чем отличается Ptable?
- Настоящее веб-приложение
- Многие другие периодические таблицы используют слово «интерактивные» для описания самих себя, не предлагая ничего, кроме ссылок на страницы с данными об элементах.Рецензии великолепны, и Ptable передает их тщательно отобранной и быстро пересматриваемой Википедии. Ptable сияет, когда используется как настоящее приложение, более интерактивное и динамичное, чем любое другое приложение. Продолжайте читать, чтобы узнать обо всех интересных вещах, которые вы можете делать с помощью Ptable, чтобы оживить творение Менделеева.
- Боковая панель или верхняя панель
- Если вы предпочитаете данные над таблицей, рядом с ней или предпочитаете видеть таблицу отдельно, Ptable поможет вам.Выберите кнопки верхней или боковой панели в правом верхнем углу или щелкните логотип Ptable, чтобы скрыть все свойства.
- Темный режим
- Глаза горят от того, что вы смотрите в свой ноутбук во время ночного домашнего задания? Щелкните значок темного режима в правом верхнем углу, чтобы немного облегчить себе жизнь в ночи.
- Устанавливаемое приложение для автономного использования
- Как на мобильном устройстве, так и на настольном компьютере, вы можете установить Ptable с помощью команды «добавить на рабочий стол» или на рабочем столе 🕀 справа в адресной строке.Вы сможете просматривать свойства, изотопы и смешивать соединения в автономном режиме.
- Читайте во время просмотра
- Хотите читать об элементах, просматривая таблицу? Окна записи могут быть оторваны или прикреплены к краям (в зависимости от настроек блокировщика всплывающих окон), чтобы можно было одновременно использовать таблицу во время чтения.
- Мгновенное изменение макетов
- Используйте флажки в верхней части страницы для динамического переключения между простым , с именами , с электронной конфигурацией и встроенными внутренними переходными металлами .Когда вы изменяете размер своего браузера, размер Ptable изменяется вместе с ним.
- Страницы свойств
- Наведите указатель мыши на любой элемент на , мгновенно обновите свойства , а также увеличьте изображение этого элемента с его электронной конфигурацией. При необходимости доступны единицы преобразования.
- Выберите данные
- Хотите видеть электронные конфигурации для всех элементов одновременно? Любое выбранное свойство заменяет атомный вес для всех элементов в таблице.
- Визуализируйте тенденции
- Увеличивается или уменьшается атомный радиус с группой? Выберите его, и цвет всех элементов изменится пропорционально их значениям.
- Надежные исходные данные
- Данные получены из первоисточников и тщательно подобранных библиотек, таких как превосходный Wolfram | Alpha. Макет и представление были проверены ведущим в мире академиком Менделеева Периодической таблицы Эриком Шерри и соответствуют официальному макету, предложенному IUPAC, еще одним органом по стандартизации, с которым Ptable поддерживает новые стандартные атомные веса. Значимые цифры сохраняются. в показаниях, когда позволяет место. Однако переводы и неанглийские названия элементов следует считать не более надежными, чем Википедия.
- Ползунок состояния вещества
- Перетащите ползунок над неметаллами и просмотрите состояние вещества каждого элемента при этой температуре.
- Машина времени
- Выберите год открытия, чтобы использовать ползунок для возврата во времени, и отобразит только элементы, обнаруженные к этому году.
- Подмножества свойств
- После выбора свойства в области ползунка отображаются связанные подмножества. После выбора радиуса доступны ковалентные, эмпирические, расчетные и ван-дер-ваальсовы радиусы. В целом, область ползунка демонстрирует еще 17 свойств в дополнение к показанным 15, не считая первых 30 энергий ионизации, что позволяет эффективно функционировать на нескольких уровнях и в нескольких измерениях.
- Орбитали
- Полное считывание орбиталей для основного состояния каждого элемента, квантовых чисел, состояний окисления и диаграммы в соответствии с правилами Хунда .Наведите указатель мыши на каждую пару электронов, чтобы получить трехмерное изображение этой орбиты , которую вы можете перетащить, чтобы повернуть, или наведите указатель мыши на элемент, чтобы увидеть его самую высокую занятую атомную орбиталь.
- Изотопы
- Щелкните элемент в виде изотопов, чтобы наложить на выбранные или все известные изотопы . Наведите курсор на , пролистайте как колоду карт , поскольку обновляются 12 свойств, включая период полураспада. Границы указывают на основной режим распада. Перетащите их, чтобы лучше расположить.
- Смешивание соединений
- Щелкните элементы на вкладке соединений, чтобы увидеть возможные соединения, которые они образуют, вместе со статьями Википедии, если они доступны. По мере того, как вы сужаете область поиска, другие элементы, которые не образуют соединения с выбранными вами элементами, будут тускнеть. Элементы, которые действительно объединяются, покажут количество потенциальных соединений в области их атомной массы. Цвета имитируют цвета стандартных моделей клюшек и мячей.
- Поиск соединения
- Введите номер CAS или название соединения, чтобы найти все подходящие соединения.Во время поиска элементы, не входящие в состав соответствующих компонентов, будут тускнеть. Набрав
acidв поле поиска области ползунка, затемнятся все, кроме неметаллов. Глядя на числа в области атомной массы, мы видим, что существует около 300-400 кислот, и большинство из них содержат водород, углерод и кислород.
- Поиск формулы
- Введите формулу в поле поиска области ползунка, чтобы найти все соединения, соответствующие этим элементам, независимо от порядка их ввода. Требуйте точную формулу, отрегулировав миниатюрные элементы в области ползунка или введя номера нижних индексов формулы.
- Десятки языков
- Названия элементов на десятках языков. Если ваш браузер отправляет заголовок на совместимом языке, будет автоматически обслуживать сайт на том языке, который вы предпочитаете . Установите другой язык в раскрывающемся списке. Почему важно, чтобы периодическая таблица Менделеева была представлена на стольких языках?
- Происхождение символа
- Почему свинец Pb и ртуть Hg? Выберите латинский перевод, чтобы увидеть происхождение символов элементов.
- Мгновенный поиск
- Не можете найти элемент? Введите его имя, символ или атомный номер в поле вверху справа, и мгновенно выделит . Вы даже можете выполнить расширенный поиск. Если ввести
~ 200на первой вкладке, будет найден элемент с атомным весом, ближайшим к 200. При поиске= 3в Орбиталях будут выделены все элементы со степенью окисления +3. Даже такие выражения, как> 1000или400-800, ограничивают результаты этими диапазонами для каждого свойства на каждой вкладке, включая разветвленные изотопы.
- Для мобильных устройств и планшетов
- Макеты для телефона и планшета позволяют просматривать на ходу как в портретной, так и в альбомной ориентации.
- Глубокие ссылки
- Хотите сохранить URL-адрес для конкретной визуализации или отправить кому-нибудь ссылку на список просматриваемых вами сложных результатов поиска? Просто отправьте им URL-адрес в адресной строке, и они увидят то, что вы видите.
- Версия для печати
- Распечатайте любой вид или визуализацию, которые вы можете увидеть.Таблица стилей печати позаботится об удалении постороннего беспорядка. Просто не забудьте распечатать фоновые цвета, выбрать альбомную ориентацию и минимизировать поля.
- Последние новые элементы
- В день открытия или синтеза нового элемента мы предоставим вам подробную информацию. Мы даже следим за новыми, более точными относительными атомными весами, поскольку IUPAC публикует их, и поддерживаем связь с известными учеными-химиками и органами по стандартизации относительно компоновки таблицы и категоризации элементов, которые намного более гибкие, чем вы можете себе представить.
- Маленький и быстрый
- Созданный с нуля, чтобы быть чрезвычайно быстрым и эффективным, Ptable – это чистый JavaScript, созданный без фреймворков или библиотек. Сила других сайтов и их скорость по-прежнему основаны на мире, построенном на библиотеках. Из-за этого они никогда не будут такими мощными и быстрыми, как Ptable.
- Доступна клавиатура
- Не пользуетесь мышью? Клавиши вкладки и стрелки на клавиатуре открывают полную функциональность сайта .Enter и Escape открывают и закрывают окно Википедии, веерные изотопы или фиксируют элементы на месте, как и следовало ожидать.
- Гибкий интерфейс
- Если вы предпочитаете навести указатель мыши или щелкнуть мышью для просмотра данных, сайт подойдет вам, предложив интерфейс щелчка для блокировки на вкладках «Свойства» и «Электроны». Наведение обеспечивает доступ к большей части интерактивности до первого щелчка, который блокирует любой просматриваемый элемент на месте до тех пор, пока не будет щелкнуть другой или тот же элемент не будет нажат снова, чтобы вернуться в режим наведения.Наведение никогда не требуется для отображения данных или интерактивности; щелчки делают все, что важно для планшетов и интерактивных досок, таких как SMART Board.
Можно купить плакат?
Да! Наш плакат с периодической таблицей доступен и разработан для удобочитаемости на расстоянии. Он отлично сочетается с нашими бесплатными распечатками и планами уроков.
Можно распечатать?
PDF-файл можно распространять в печатном виде без разрешения при условии, что он или все, что в него включено, не продано ни за какие деньги.Он также должен быть предложен в оригинальной форме без дополнительной или удаленной торговой марки. Свяжитесь со мной, если это неясно, или чтобы узнать о включении этого в публикуемые материалы. Скорее всего, я позволю вам использовать его, но запрошу копию всего, что он делает, но только если вы попросите.
Можно ссылку на него?
Пожалуйста, сделайте! Ссылки других людей сделали его достаточно популярным в поисковых системах, чтобы вы смогли его найти.
Могу ли я загрузить его на свой сайт?
Вы можете создать или встроить сайт во фрейм, используя (меняя высоту и ширину по желанию), но не сохраняет сайт или какую-либо его часть, а затем предлагает их другим через электронные средства , включая, помимо прочего, веб-сайт, компакт-диск , или флэш-накопитель. Хотя сама таблица Менделеева является общественным достоянием, авторское право на созданное мной веб-приложение и его дизайн принадлежат мне, а Ptable является охраняемым законом товарным знаком и защищен международным законом об авторском праве, действующим во всем мире.
Вторичный воспроизведение в образовательном контексте разрешено.Например, допустимо записывать и комментировать видео с сайта, чтобы проиллюстрировать периодические тенденции, а затем загружать его на YouTube.
Я научился программировать много лет назад, просматривая исходники и видя, как создаются сайты. Если вам действительно интересно, как работает Ptable, свяжитесь со мной, и я предоставлю вам соответствующий не запутанный источник для изучения.
Когда это было сделано?
Ptable имеет богатую историю, уходящую корнями в сентябрь 1997 года, за год до основания Google.Он был представлен как часть обложки HTML и опубликован в Интернете 1 октября 1997 года. Простые описания элементов словаря были добавлены позже в декабре. Версия, использующая HTML 4 и CSS, была представлена в марте 1999 года (революционная в то время) и заменила исходную версию в сентябре 2004 года. В августе 2005 года появилась интеграция с Википедией и добавление других языков. Позже в сентябре было добавлено динамическое переключение макета. Первый макет, который не требовал прокрутки, был доступен только в октябре 2006 года.В течение лета 2007 года интерактивность была радикально усилена за счет свойств, электронов и изотопов, а затем в 2012 году были добавлены соединения. Карантин 2020 года был потрачен на полную реконструкцию, и улучшения продолжаются в наш нынешний период времени. Наслаждайтесь историческими версиями или просмотрите журнал последних изменений.
Этот веб-сервер хранит только стандартные журналы доступа. Они не передаются никаким организациям, и никакая личная информация не собирается. Google Analytics также отслеживает посещения и пользователей, а Bugsnag используется для отчетов об ошибках.Файлы cookie хранят настройки сайта, такие как макет и тема.
Пожертвования
Если вы не являетесь поклонником одного рекламного баннера, вы можете сделать пожертвование на Patreon или купить мне кофе. Также будет полезно, если вы купите плакат и оставите положительный отзыв. Хотите еще больше? Напишите мне письмо, в котором расскажите, что вам нравится или не нравится в Ptable, как он вам помог и что бы вы хотели добавить. Вы также можете отправить Ptable открытку. Вы даже можете получить в ответ что-нибудь забавное.
PtablePO Box 10002
Knoxville, TN
- Около
- Что нового
- Вопросы
- Продукты
- Плакат
- Планы уроков
- Убрать рекламу
- Редакции
- Таблица Менделеева
- Печать PDF
- Изображение
- Задействовать
- Discord
- Твиттер
- Контакт
Contact – Ptable
Contact – PtableЧто у тебя на уме? Включите свой адрес электронной почты, чтобы получить личный ответ.Скорее позвонить или написать? Наш номер +1 (740) 4-PTABLE.
Предложить функциюЕсть идея улучшить Ptable? Я хотел бы услышать ваши идеи о новых функциях, предложениях по улучшению или даже неприятности, которые вы бы хотели, чтобы исчезли.
Послать сообщение- Гелий не является твердым телом при абсолютном нуле.
- Ползунок температуры показывает точки плавления и кипения при стандартном давлении. В отличие от любого другого элемента, гелий остается жидким до абсолютного нуля при нормальном давлении.Это прямой эффект квантовой механики: в частности, энергия нулевой точки системы слишком высока, чтобы допустить замерзание. При 2,5 МПа, очень высоком давлении, он затвердеет. Опять же, то же самое будет почти со всеми остальными элементами.
- Вы неправильно написали цезий / алюминий.
- Когда США подчинялись надзору Международного союза чистой и прикладной химии (что позволило им иметь некоторые названия для элементов 104–111, но не все), были достигнуты компромиссы. Алюминий – это британское написание, как и цезий.В обмен на это американское написание серы (по сравнению с серой) стало международным стандартом.
- Где римские цифры группы чисел, такие как VIIB? Римские цифры
- для групп были отменены в 1990 году ИЮПАК, потому что они разные и противоречивые в США и Великобритании. Если вы видите их в другом месте, этот источник не обновлялся уже 30 лет.
- Числа валентности, показанные в разделе «Свойства», не соответствуют моим ожиданиям.
- Официальное определение валентности ИЮПАК: «Максимальное количество одновалентных атомов (первоначально атомов водорода или хлора), которые могут объединяться с атомом рассматриваемого элемента, или с фрагментом, или для которых атом этого элемента может быть заменен. .”Вместо этого вы можете захотеть, чтобы степени окисления отображались на вкладке” Орбитали “.
- Это должна быть атомная масса, а не вес.
- Атомный вес – это официальный термин, используемый ИЮПАК для обозначения относительных атомных масс, опубликованных специально для включения в периодические таблицы. Этот термин используется, потому что они представляют собой взвешенных средних .
- Разве это не должно быть Lanthan ide , а не – oid ?
- Нет, не согласно IUPAC [PDF] (IR-3.5).
- Неправильная электронная конфигурация элемента. Таблица
- Ptable показывает истинные экспериментальные значения электронной конфигурации. Метод рисования стрелок, который вы изучили в классе, – это упрощенный метод, который работает большую часть времени, но имеет около 20 исключений.
- Около
- Что нового
- Вопросы
- Продукты
- Плакат
- Планы уроков
- Убрать рекламу
- Редакции
- Таблица Менделеева
- Печать PDF
- Изображение
- Задействовать
- Discord
- Твиттер
- Контакт
| 7 | 87 223.02 Франций | 88 226,03 Радий | ** | 103 262,11 Лоуренсий | 104 267,12 Резерфордий | 105 270.13 Дубний | 106 269,13 Сиборгий | 107 270,13 Бориум | 108 269,13 Калий | 109 278,16 Мейтнерий | 110 281.17 Дармштадтиум | 111 281,17 Рентген | 112 285,18 Копернициум | 113 286,18 Нихоний | 114 289.19 Флеровий | 115 289,20 Московий | 116 293,20 Ливерморий | 117 293,21 Теннессин | 118 294.21 Оганессон | ** Актиноиды | ** | 89 227,03 Актиний | 90 232,04 Торий | 91 231,04 Протактиний | 92 238.03 Уран | 93 237,05 Нептуний | 94 244,06 Плутоний | 95 243,06 Америций | 96 247.07 Кюрий | 97 247.07 Берклий | 98 251,08 Калифорний | 99 252,08 Эйнштейний | 100 257,10 Фермий | 101 258.10 Менделевий | 102 259,10 Нобелий |
|---|
Периодическая таблица элементов и химия
Ключ периодической таблицы
X | X | X | X | Щелочные металлы | Щелочноземельные металлы | переходные металлы | Прочие металлы | Металлоиды | Прочие неметаллы | Галогены | Благородные газы | Лантаноиды |
Периодическая таблица
«Если все элементы расположены в порядке их атомного веса, получается периодическое повторение свойств.Это выражается законом периодичности ».Дмитрий Менделеев, Основы химии, Vol. 2, 1902, П. Ф. Кольер, стр. 17. “У нас есть доказательство того, что в атоме есть фундаментальная величина, которая постепенно увеличивается при переходе от одного элемента к другому. Эта величина может быть только зарядом центрального положительного ядра, существование которого у нас уже есть определенное доказательство ».
Генри Мозли, Philosophical Magazine, Vol. 26, 1913, стр. 1030. «Химический состав атома зависит только от количества электронов, которое равно количеству протонов и называется атомным номером.Химия – это просто числа, идея, которая понравилась бы Пифагору. Если вы атом с одним протоном, вы водород; два, гелий; ….. ”
Карл Саган, Космос, 1980, Рэндом Хаус, стр. 223. Фото: НАСА.
Автор: Дуг Стюарт
Таблица Менделеева, которую мы используем сегодня, основана на таблице, разработанной и опубликованной Дмитрием Менделеевым в 1869 году.
Менделеев обнаружил, что может расположить 65 элементов, известных на тот момент, в сетке или таблице так, чтобы каждый элемент имел:
1.Атомный вес выше, чем у того, что слева. Например, магний (атомный вес 24,3) помещен справа от натрия (атомный вес 23,0):
Истинная основа Периодической таблицы
В 1913 году химия и физика были перевернуты вверх ногами. Некоторые крупные нападающие, в том числе Менделеев, серьезно говорили об элементах легче водорода и элементах между водородом и гелием. Визуализация атома была общедоступной, и оправдание Менделеева периодической таблицы, основанной на атомных весах, разваливалось по швам.
Это история о том, как Генри Мозли принес свет во тьму.
2. Подобные химические свойства с другими элементами в том же столбце – другими словами, аналогичные химические реакции. Магний, например, помещается в колонку щелочноземельных металлов вместе с другими элементами, чьи реакции аналогичны:
Менделеев понял, что стол перед ним лежит в самом сердце химии. Более того, Менделеев увидел, что его таблица неполная – были места, где должны были быть элементы, но их никто не обнаружил.
Точно так же, как можно сказать, что Адамс и Леверье открыли планету Нептун на бумаге, Менделеев можно было сказать, что он открыл германий на бумаге. Он назвал этот новый элемент eka-Silicon , после наблюдения зазора в периодической таблице между кремнием и оловом:
Аналогичным образом Менделеев открыл галлий ( эка -алюминий) и скандий ( эка -бор) на бумаге, потому что он предсказал их существование и их свойства еще до их фактических открытий.
Изображение периодической таблицы
Щелкните изображение, чтобы увеличить
Хотя Менделеев совершил решающий прорыв, он почти не продвинулся дальше. Оглядываясь назад, мы знаем, что периодическая таблица Менделеева была основана на ложных рассуждениях. Менделеев ошибочно полагал, что химические свойства определяются атомным весом. Конечно, это было вполне разумно, если принять во внимание научное знание 1869 года.
В 1869 году сам электрон не был открыт – этого не происходило еще 27 лет.
Фактически, потребовалось все 44 года, чтобы найти правильное объяснение закономерностей в периодической таблице Менделеева …
Подробнее … Продолжение таблицы Менделеева
Периодическая таблица элементов | Живая наука
Периодическая таблица элементов объединяет все известные химические элементы в информативный массив. Элементы расположены слева направо и сверху вниз в порядке увеличения атомного номера. Порядок обычно совпадает с увеличением атомной массы.
Строки называются точками. По данным Лос-Аламосской национальной лаборатории, номер периода элемента означает наивысший уровень энергии, который занимает электрон в этом элементе (в невозбужденном состоянии). Число электронов в периоде увеличивается по мере движения вниз по таблице Менделеева; следовательно, по мере увеличения энергетического уровня атома количество энергетических подуровней на каждый энергетический уровень увеличивается.
Элементы, которые занимают один и тот же столбец в периодической таблице (называемые «группой»), имеют идентичные валентные электронные конфигурации и, следовательно, ведут себя аналогичным образом химически.Например, все элементы группы 18 – инертные газы. [По теме: Как сгруппированы элементы?]
«Отец» периодической таблицы
Дмитрий Менделеев, русский химик и изобретатель, считается «отцом» периодической таблицы, согласно Королевскому химическому обществу. В 1860-х годах Менделеев был популярным лектором в университете в Санкт-Петербурге, Россия. Поскольку в то время на русском языке не существовало современных учебников органической химии, Менделеев решил написать их и одновременно заняться проблемой неупорядоченных элементов.
Расставить элементы в любом порядке оказалось бы довольно сложно. В то время было известно менее половины элементов, и по некоторым из них были даны неверные данные. Это было похоже на работу над действительно сложным пазлом, состоящим только из половины частей, а некоторые из них деформированы.
Менделеев в конечном итоге написал окончательный учебник химии своего времени, названный «Основы химии» (два тома, 1868–1870 гг.), Согласно Ханской академии. Работая над этим, он натолкнулся на важное открытие, которое внесет большой вклад в разработку действующей таблицы Менделеева.Написав свойства элементов на карточках, он начал упорядочивать их, увеличивая атомный вес, согласно Королевскому химическому обществу. Именно тогда он заметил, что регулярно появляются определенные типы элементов. После интенсивной работы над этой «головоломкой» в течение трех дней Менделеев сказал, что ему приснился сон, в котором все элементы встали на свои места, как и требовалось. Проснувшись, он сразу же записал их на листе бумаги – исправление показалось ему необходимым только в одном месте, как он позже сказал.
Менделеев расположил элементы по атомному весу и валентности. Он не только оставил место для элементов, которые еще не были обнаружены, но и предсказал свойства пяти из этих элементов и их соединений. В 1869 году он представил результаты Российскому химическому обществу. Его новая периодическая система была опубликована в немецком химическом журнале Zeitschrift fϋr Chemie (Химический журнал).
Чтение таблицы
Периодическая таблица содержит огромное количество важной информации:
Атомный номер: Число протонов в атоме называется атомным номером этого элемента.Количество протонов определяет, что это за элемент, а также определяет химическое поведение элемента. Например, атомы углерода имеют шесть протонов, атомы водорода – один, а атомы кислорода – восемь.
Атомный символ : Атомный символ (или символ элемента) – это сокращение, выбранное для обозначения элемента («C» для углерода, «H» для водорода и «O» для кислорода и т. Д.). Эти символы используются во всем мире и иногда бывают неожиданными. Например, символ вольфрама – «W», потому что другое название этого элемента – вольфрам.Кроме того, атомный символ золота – «Au», потому что слово для золота на латыни – aurum .
Атомный вес : Стандартный атомный вес элемента – это средняя масса элемента в атомных единицах массы (а.е.м.). Отдельные атомы всегда имеют целое число атомных единиц массы; однако атомная масса в периодической таблице указана как десятичное число, потому что это среднее значение различных изотопов элемента. Среднее количество нейтронов для элемента можно найти, вычитая количество протонов (атомный номер) из атомной массы.
Атомный вес для элементов 93-118: Для природных элементов атомный вес рассчитывается путем усреднения весов естественного содержания изотопов этого элемента. Однако для созданных в лаборатории трансурановых элементов – элементов с атомным номером выше 92 – нет «естественного» содержания. Условие состоит в том, чтобы указать атомный вес самого долгоживущего изотопа в периодической таблице. Эти атомные веса следует рассматривать как предварительные, поскольку в будущем может быть получен новый изотоп с более длительным периодом полураспада.
В эту категорию входят сверхтяжелые элементы или элементы с атомными номерами выше 104. Чем крупнее ядро атома, которое увеличивается с увеличением количества протонов внутри, тем более нестабильным является этот элемент в целом. Таким образом, по данным Международного союза чистой и прикладной химии (IUPAC), эти негабаритные элементы мимолетны, действуют всего несколько миллисекунд, прежде чем распасться на более легкие элементы. Например, сверхтяжелые элементы 113, 115, 117 и 118 были проверены IUPAC в декабре 2015 года, заполнив седьмую строку или точку в таблице.Несколько разных лабораторий производили сверхтяжелые элементы. Атомные номера, временные названия и официальные названия:
Классическая Периодическая таблица упорядочивает химические элементы в соответствии с количеством протонов, которые каждый имеет в своем атомном ядре. (Изображение предоставлено: Карл Тейт, участник Livescience.com)Дополнительный отчет Трейси Педерсен, участник Live Science
Периодическая таблица элементов – IUPAC
Последний выпуск Периодической таблицы (от 1 декабря 2018 г.) включает самые последние обновления, выпущенные в июне 2018 г. Комиссией IUPAC по изотопному содержанию и атомным весам (CIAAW) ( см. Соответствующие новости , выпущенные 5 июня 2018 г.), и, в частности, для аргона, назначение интервала для нового стандартного атомного веса, который отражает обычное возникновение вариаций атомных весов элемента в обычных земных материалах.Интервал в квадратных скобках обеспечивает нижнюю и верхнюю границы стандартного атомного веса для этого элемента. Для пользователей, которым требуется значение атомной массы для неопределенного образца без учета погрешности, предоставляются стандартные значения. Не указаны значения для элементов, для которых отсутствуют изотопы с характерным изотопным содержанием в природных образцах суши. См. PAC для получения более подробной информации или посетите Commission II.1 @ ciaaw.org
Загрузите версию для печати (PDF) (формат Letter или A4) или версию A3 (PDF) или посмотрите более ранние версии
Ознакомьтесь со СПЕЦИАЛЬНЫМ Chem Int Январь 2019 г. – Международный год Периодической таблицы Менделеева (IYPT) – при участии Яна Ридейка, Натальи Тарасовой, Г.Дж. Ли, Сигурд Хофманн, Эрик Шерри, Юрис Мейджа, Норман Э. Холден, Тайлер Б. Коплен, Питер Махаффи, Ян Миллс, Роберто Марквардт и другие.
Периодическая таблица элементов и изотопов ИЮПАК (IPTEI) для образовательного сообщества
Благодаря своей работе с химическими элементами, ИЮПАК может выпускать периодическую таблицу, которая является современной. Участие ИЮПАК охватывает различные аспекты таблицы и данных, которые он раскрывает, и несколько отчетов и рекомендаций, некоторые из которых совсем недавно, подтверждают этот вклад.
В частности, IUPAC принимает непосредственное участие в следующих делах:
- устанавливает критерии для обнаружения нового элемента
- , определяющий структуру временного имени и символа
- оценка претензий, приводящая к проверке и присвоению обнаруженного элемента
- координирует именование нового элемента, включает исследовательскую лабораторию и допускает публичные комментарии
- устанавливает точные правила для как назвать новый элемент
- , определяющий Группы 1-18 и коллективные имена
- определение того, какие элементы относятся к группе 3
- регулярно пересматривает стандартных атомных веса
Стол ваш, чтобы использовать .Подробная информация о последней версии представлена выше . Подробности ниже содержат многочисленные ссылки на журнал IUPAC в Pure and Applied Chemistry ( PAC ) и журнал Chemistry International ( CI ).
- Критерии обнаружения нового элемента
Оценка того, был ли элемент «обнаружен» – непростая задача. Изучая профили открытия элементов трансфермиума в начале 90-х годов, IUPAC и IUPAP установили ряд критериев, которые должны быть удовлетворены для признания открытия элемента.См. Подробности в PAC 1991, Vol. 63, No. 6, pp. 879-886 (https://dx.doi.org/10.1351/pac199163060879) и PAC 1993, Vol. 65, No. 8, pp. 1757-1814 (https://dx.doi.org/10.1351/pac199365081757)
В ноябре 2018 года IUPAC / IUPAP выпустил предварительный отчет ОБ ОТКРЫТИИ НОВЫХ ЭЛЕМЕНТОВ. Представлены критерии и руководящие принципы для установления приоритета обнаружения потенциальных новых элементов. – узнать больше
- Временное наименование и символ
Хотя элемент может быть заявлен, до подтверждения утверждения и до формального имени элемент имеет временное имя и символ.Соответствующие рекомендации по созданию этой систематической номенклатуры были опубликованы в 1978 г .; см. PAC 1979, Vol. 51, No. 2, pp. 381-384; https://dx.doi.org/10.1351/pac197951020381
В результате в марте 2016 года 113-й элемент был назван унунтриумом или символом Уут.
История трехбуквенных символов описана в статье, подготовленной Ларсом Эрстремом и Норманом Холденом и опубликованной в Chem Int 2016, Vol. 38, вып.2, стр. 4-8; https://dx.doi.org/10.1515/ci-2016-0204
- Проверка и присвоение обнаружения элемента
В научной литературе время от времени появляются заявления об открытии новых элементов. IUPAC вместе с IUPAP участвует в оценке этих требований. В результате выпускаются технические отчеты ИЮПАК, в которых рассматриваются все относящиеся к делу ссылки и признаются лаборатории, утверждения которых соответствуют согласованным критериям.
В 2016 году было выпущено два таких отчета, которые охватывают элементы 113, 115, 117 и элемент 118; См. PAC 2016, Vol. 88, № 1-2, стр. 139–153; https://dx.doi.org/10.1515/pac-2015-0502 и PAC 2016, Vol. 88, № 1-2, с. 155–160; https://dx.doi.org/10.1515/pac-2015-0501
- Обозначение нового элемента
Когда открытие нового элемента было подтверждено и был назначен приоритет для его обнаружения, можно начинать процесс присвоения имен.Лаборатории, которой было поручено открытие, предлагается предложить название и символ. Затем IUPAC рассмотрит предложение и, если будет согласовано, после дополнительного 5-месячного публичного рассмотрения, официально закрепит название. Самый последний пример таких рекомендаций был опубликован в 2012 году для названий и символов элементов 114 и 116; См. PAC 2012, Vol. 84, No. 7, pp. 1669–1672; https://dx.doi.org/10.1351/PAC-REC-11-12-03
Краткий обзор текущих процедур опубликован в недавней статье Джона Кориша; См. CI 2016, Vol.38, No. 2, pp. 9-11; https://dx.doi.org/10.1515/ci-2016-0205
8 июня 2016 года ИЮПАК опубликовал предварительные названия для последних 4 элементов 113, 115, 117 и 118 – см. Релиз, а 28 ноября 2016 года ИЮПАК объявил утвержденные имена и символы – см. Релиз.
Об опыте присвоения имен элементам в 2016 г. см. Chem Int Apr 2017, pp. 30-21, Jan Reedijk; https://doi.org/10.1515/ci-2017-0222
- Как назвать новый элемент
И снова у IUPAC есть набор руководящих принципов, определяющих, какое имя может носить элемент.И корень, и окончание должны соответствовать согласованным рекомендациям. Подробные рекомендации были опубликованы в 2002 году, а пересмотренная версия опубликована в 2016 году для лучшего включения элементов в группы 17 и 18. См. PAC 2002, Vol. 74, No. 5, pp. 787-791; https://dx.doi.org/10.1351/pac200274050787 и PAC 2016, Vol. 88, No. 4, pp. 401–405 https://dx.doi.org/10.1515/pac-2015-0802 (или https://iupac.org/project/2015-031-1-200)
- Группы 1-18 и коллективные наименования
С 1988 года ИЮПАК рекомендовал группам ( i.e . столбцы) должны быть просто пронумерованы от 1 до 18. ( PAC 1988, Vol. 60, No. 3, pp 431-436; https://dx.doi.org/10.1351/pac198860030431)
Лантаноиды и актиноиды – собирательные названия, также рекомендованные IUPAC. Лантаноиды (от La до Lu) предпочтительнее лантаноидов, и хотя лантаноид означает «подобный лантану» и поэтому не должен включать лантан, тем не менее, лантан стал широко использоваться. Актиноиды включают от Ac до Lr.
- Группа 3
Время от времени обсуждается вопрос о том, какие именно элементы следует поместить в группу 3.Недавно был инициирован проект IUPAC для решения этого вопроса. Будет ли группа 3 состоять из Sc, Y, Lu и Lr или она будет состоять из Sc, Y, La и Ac?
Следите за обновлениями и смотрите https://iupac.org/project/2015-039-2-200 и CI 2016, Vol. 38, No. 2, pp. 22-23; https://dx.doi.org/10.1515/ci-2016-0213
- Стандартный атомный вес
Одной из задач Комиссии по изотопному содержанию и атомному весу (CIAAW) является периодический обзор определений атомного веса.Самый последний отчет «Атомные веса элементов 2013» был опубликован в PAC в марте 2016 г. ( PAC 2016, Vol. 88, No. 3, pp. 265–291; https: //dx.doi. org / 10.1515 / pac-2015-0305). Совсем недавно, 5 июня 2018 года, CIAAW рекомендовал изменить стандартные атомные веса 14 химических элементов – см. Релиз.
Комиссия была создана в 1899 г. (да, в восемнадцати девяносто девяти) и сейчас действует при Отделе неорганической химии ИЮПАК. (см. www.ciaaw.org) Он также регулярно рассматривает изотопные составы элементов; последняя компиляция также опубликована в PAC в марте 2016 г. ( PAC 2016, Vol. 88, No. 3, pp. 293–306; https://dx.doi.org/10.1515/pac-2015-0503) )
Ваш
Хотя ИЮПАК не дает рекомендаций для конкретной формы периодической таблицы Менделеева, то есть . Формат с 18 или 32 столбцами, версия, представленная здесь, имеет обычную длинную форму, и вы можете использовать ее.
Ознакомьтесь с более ранними версиями.
Известная российская лаборатория пытается расширить возможности таблицы Менделеева и открыть новые экзотические элементы | Наука
Юрий Оганесян внес настолько большой вклад в периодическую таблицу Менделеева, что 118-й элемент назван в его честь. Теперь он хочет найти еще более тяжелые элементы.
МАКС АГИЛЕРА ХЕЛЛВЕГСэм Кин, 911 13 января.30 января 2019 г., 14:30
ДУБНА, РОССИЯ— С определенных углов Лаборатория ядерных реакций им. Флерова больше похожа на авторемонтную мастерскую, чем на легендарный научный институт. Ученые в грязных синих халатах ходят вокруг, пока масляный насос выдает техно-ритм. Столы завалены болтами и чистящими жидкостями, включая бутылку водки, наполовину заполненную этанолом. А запасные части повсюду – мусорные ведра, полки, целые стены, забитые металлом в любом ветхом состоянии.
Связанное содержание
Все это обслуживает шесть ускорителей частиц лаборатории, некоторые из которых напоминают огромных механических гусениц, с десятками зеленых сегментов трактора, вьющихся в целые комнаты. Или несколько комнат: когда оборудование не подходит, исследователи пробивают дыры в стенах и продевают предметы через бетон. Чтобы увидеть акселератор в целом, нужна серьезная гимнастика , взбираться по опасно крутой лестнице и уворачиваться от анаконд висящих проводов.На трубах, под которыми вы ныряете, есть предупреждающие знаки, на которые следует обратить внимание – не за головой, а за оборудованием. У Флерова преимущественное право проезда имеют частицы.
Заслуженно. В различных итерациях эти ускорители произвели девять новых элементов периодической таблицы за последние полвека, в том числе пять самых тяжелых из известных элементов, до номера 118.
Эту работу возглавляет физик Юрий Оганесян, который находится во Флерове с тех пор, как Никита Хрущев подписал в 1956 году приказ о создании секретной ядерной лаборатории в березовых лесах здесь, в 2 часах езды к северу от Москвы.85-летний Оганесян – невысокий мужчина с густыми седыми волосами, чей голос пищит, когда он возбужден. Он хотел изучать архитектуру в колледже, пока бюрократическая неразбериха не отвлекла его на физику. Он все еще скучает по своей первой любви: «Мне действительно нужно что-то визуальное в моей науке. Я чувствую этот дефицит».
Соответственно, ни один живой человек не сформировал архитектуру таблицы Менделеева больше, чем он сам, поэтому элемент 118 называется оганессон. И он еще не закончил. Чтобы продвинуть планку вперед, лаборатория построила новый объект стоимостью 60 миллионов долларов, получивший название «Фабрика сверхтяжелых элементов» (SHEF), который этой весной начнет охоту за элементом 119, 120 или обоими.
Некоторые ученые утверждают, что открытие новых элементов не стоит денег, особенно когда эти атомы по своей природе нестабильны и исчезнут в мгновение ока. «Мне лично как ученому не интересно производить больше короткоживущих элементов», – говорит Витольд Назаревич, физик, изучающий структуру ядра в Университете штата Мичиган в Ист-Лансинге.
Но для охотников за элементами расплата очевидна. Новые элементы расширили бы таблицу – теперь уже семь строк в глубину – до восьмой строки, где, согласно некоторым теориям, появятся экзотические черты.Элементы в этой строке могут даже нарушить саму периодичность таблицы, потому что химические и физические свойства могут больше не повторяться через равные промежутки времени. Переход к восьмому ряду также может ответить на вопросы, над которыми ученые боролись со времен Дмитрия Менделеева: сколько элементов существует? И как далеко заходит стол?
Решение построить SHEF было до некоторой степени трудным. Помимо высокой стоимости, строительство «фабрики» означало отказ от старых ускорителей, которые производили так много новых элементов, в пользу других проектов.«Эмоционально, – говорит Оганесян, – нелегко оставить что-то [в автономном режиме], что дало вам много. Но другого пути вперед нет».
Самый тяжелый элемент, который можно найти в любом заметном количестве в природе, – это уран с атомным номером 92. (Атомный номер относится к числу протонов в ядре атома.) Помимо этого, ученые должны создавать новые элементы в ускорителях, обычно путем разбивания луча. легких атомов в мишень из тяжелых атомов. Время от времени ядра легких и тяжелых атомов сталкиваются и сливаются, и рождается новый элемент.Например, при попадании неона (элемент 10) в уран образуется нобелий (102).
Но шансы на слияние (и выживание) заметно снижаются по мере того, как атомы становятся тяжелее из-за увеличения отталкивания между положительно заряженными ядрами, среди других факторов. Поэтому создание большинства элементов в сверхтяжелой сфере (свыше 104) требует особых уловок. Оганесян разработал один в 1970-х: холодный синтез. Не связанный с печально известной ядерной энергетикой 1980-х годов, холодный синтез Оганесяна включает объединение атомов пучка и мишени, которые более похожи по размеру, чем при традиционном производстве элементов.И вместо того, чтобы разбивать их вместе, «мы объединяем два ядра, так что это« мягкое прикосновение »», – говорит Оганесян. Сделать это сложнее, чем кажется, потому что и пучок, и ядра-мишени заряжены положительно и поэтому отталкиваются друг от друга. Поступающим атомам требуется достаточная скорость, чтобы преодолеть это отталкивание, но не настолько, чтобы они разорвали образовавшееся сверхтяжелое ядро.
Изготовитель элементов
Завод сверхтяжелых элементов (SHEF) стоимостью 60 миллионов долларов в Дубне, Россия, нацелен на создание новых элементов, расширяющих периодическую таблицу, путем столкновения пучка ядер с мишенью.По сравнению с предыдущими ускорителями, SHEF имеет более интенсивный луч, который ускоряется примерно до одной десятой скорости света в ограниченном пространстве.
Луч атомаФольгаСверхтяжелый атом Разделенные частицы Детектор Альфачастица Обнаруженный сверхтяжелый атом Целевой атом Луч разделяется и перенаправляется на цель, сепаратор и детектор в другой комнате (ниже). Создание, разделение и обнаружение1 После ускорения атом луча врезается в целевой атом, сидящий на тонкой фольге ). 2 Если происходит синтез, образовавшийся сверхтяжелый атом пролетает через фольгу и отделяется от посторонних атомов пучка.3 Атомы на детекторе. 4 Атом испускает альфа-частицы, которые этот или вторичный детектор может уловить, что позволяет ученым восстановить идентичность атома. Принудительный брак Производит 6 триллионов лучевых атомов в секунду. 1 Источник ионов Поворачивает луч на 90 ° и направляет его в циклотрон. в спиральную траекторию, поскольку они ускоряются внутри циклотрона.3 Магнитная катушка 123 12 34С. БИКЕЛЬ / НАУКА
Команда из GSI Helmholtz Center for Heavy Ion Research в Дармштадте, Германия, усовершенствовала технику Оганесяна и использовала ее для создания элементов со 107 по 112.Но этот метод столкнулся с ограничениями, поскольку шансы на слияние и выживание резко упали. Начиная с 2003 года, команда из института RIKEN в Вако, Япония, пыталась использовать холодный синтез для создания элемента 113, обжигая цинк (элемент 30) на висмуте (83). В следующем году они получили один атом, а в 2005 году – еще один, который они отметили в своей диспетчерской с приветствиями, пивом и саке.
Затем началась агония. Потребовался еще один атом для подтверждения открытия, и команда RIKEN повторно провела эксперимент в 2006 и 2007 годах.Ничего не появилось. Они попробовали еще раз в 2008 и 2009 годах. Ничего. Лишь в 2012 году – 7 лет спустя – они обнаружили еще одну. «Честно говоря, мы чувствовали, что нам не повезет», – вспоминает химик-ядерщик RIKEN Хиромицу Хаба. «Только Бог знает статистику». Ни один из атомов не выжил более 5 миллисекунд до распада.
Чтобы выйти за пределы 113, потребовался другой подход – горячий синтез, который ученые Флерова разработали в конце 1990-х годов. Горячий синтез использует более высокие энергии пучка и использует специальный изотоп с большим избытком нейтронов – кальций-48.(Нейтроны стабилизируют сверхтяжелый атом, ослабляя отталкивающую силу протонов, которая в противном случае разорвала бы ядро на части.) Кальций-48 стоит дорого – его необходимо с трудом выделять из природных источников кальция – по цене 250 000 долларов за грамм. Но вложения окупились. RIKEN 9 лет потел, чтобы найти три атома 113. Дубна поймала это множество атомов 114 за 6 месяцев – открытие, которое Оганесян и его коллеги отметили в своей диспетчерской аплодисментами, пивом и уколами крепких напитков.
На тот момент создание следующих нескольких супертяжелых машин было в основном арифметическим.Кальций – это элемент 20, а кальций плюс америций (элемент 95) дает элемент 115. Кальций плюс кюрий (96) дает элемент 116 и так далее. К 2010 году Дубна – в сотрудничестве с учеными Ливерморской национальной лаборатории Лоуренса в Калифорнии и Окриджской национальной лаборатории в Теннесси – заполнила седьмую строку периодической таблицы.
Однако после 118 года все снова остановилось. Для синтеза требуется несколько миллиграммов целевого элемента, а производство достаточного количества эйнштейния (элемент 99), чтобы сделать элемент 119 невозможным с помощью сегодняшних технологий.Некоторые исследователи предложили заменить кальций-48 титаном-50, который имеет еще два протона, а затем запустить его на элементы 97 и 98, чтобы получить 119 и 120 соответственно. Но по техническим причинам вероятность синтеза титана всего в двадцатую часть выше, чем у кальция. Для большинства ускорителей это снижает шансы на успех до уровня экспериментов RIKEN по созданию 113 – статистики Бога снова и снова.
SHEF был построен для преодоления этих препятствий. В отличие от «жирной обезьяны» на старых ускорителях Flerov, SHEF остается нетронутым: пузырчатая пленка по-прежнему покрывает дверные ручки, а полы пока безупречны.
В офисе Лаборатории ядерных реакций им. Флерова в Дубне, Россия, хранятся инструменты, которым уже несколько десятилетий, а также устаревшая таблица Менделеева.
МАКС АГИЛЕРА ХЕЛЛВЕГВ целом, SHEF – это сочетание мускулистого и утонченного. Луч исходит от ионного источника и ускорителя, который возвышается на два этажа, больше, чем некоторые дачи в городе.Источник ионов выстреливает 6 триллионов атомов в секунду, что в 10-20 раз больше, чем у других ускорителей по производству элементов. После нескольких поворотов на 90 ° – самого компактного устройства в ограниченном пространстве – луч падает в массивный циклотрон, само присутствие которого здесь примечательно. 1000-тонный магнит циклотрона был изготовлен в 2014 году в Краматорске, Украина, недалеко от линии фронта недавней войны с Россией, говорит физик Флеров Александр Карпов. Тогда город подвергся сильному обстрелу и другим военным действиям, и Карпов говорит, что сотрудники лаборатории нервничали, что магнит будет поврежден или разрушен.
После ускорения луча примерно до одной десятой скорости света циклотрон направляет его к тонкой части операции: металлической фольге микрометровой толщины с нанесенными на нее атомами мишени. Эти пленки устанавливаются на диск размером примерно с компакт-диск, который вращается для охлаждения. В противном случае луч прожарил бы в нем дыру.
Если происходит синтез, образовавшийся сверхтяжелый атом проходит сквозь фольгу. К сожалению, фольга настолько тонкая, что сквозь нее проскальзывают и другие частицы, производя метель посторонних шумов.Вот тогда и вступает в игру разделитель. Он состоит из пяти магнитов, окрашенных в такой же ярко-красный цвет, что и пожарная машина, и все вместе весит вдвое больше одного – 64 тонны. Несмотря на большой размер, магниты выровнены с точностью до 0,01 миллиметра, а их поля достаточно точны, чтобы отфильтровать более легкие атомы, включая почти все атомы пучка, направляя их в устройство, называемое дампом пучка.
Разделитель, как и источник луча, дает SHEF преимущество. Ранее сепараторы были настроены на сверхтяжелые атомы с узким диапазоном скорости, заряда и направления; те, которые слишком сильно отклонялись, попадали в дамп балки.Новый разделитель более щедрый, пропускает в два-три раза больше сверхтяжелых атомов.
После прохождения через сепаратор атом попадает в кремниево-германиевый детектор, который регистрирует положение и время прибытия атома, а затем начинает его отслеживать. Сверхтяжелые атомы распадаются, испуская серию альфа-частиц – связки из двух протонов и двух нейтронов. Освобождение альфа меняет идентичность атома: элемент 118 становится 116, который становится 114, и так далее.
Эта цепочка распада позволяет ученым задним числом определить, какой элемент они создали.Каждая альфа-частица в цепочке улетает с характерной энергией. Поэтому, если детектор обнаруживает альфу с нужной энергией – и, что особенно важно, видит, что она вышла из той же точки на детекторе, где только что приземлился сверхтяжелый атом, – он начинает внимательно следить за новыми альфами.
Чтобы облегчить этот поиск, детектор автоматически отключает циклотронный луч, чтобы уменьшить количество летающего мусора. Выключение также вызывает громкий звуковой сигнал в диспетчерской SHEF, где будут сидеть несколько, вероятно, скучающих ученых.(Во время недавнего посещения другой диспетчерской здесь двое аспирантов смотрели пошлый научно-фантастический фильм о монстрах.) Звонок – момент возбуждения среди монотонности.
Тоже лишнее. Внутри детектора атом будет продолжать испускать альфы: на самом деле, несколько событий в цепочке распада уже произойдут до того, как ученые зарегистрируют звук. С супертяжелыми снарядами трудно прийти, легко уйти. Только позже, когда ученые проанализируют необработанные данные и сопоставят каждую обнаруженную альфа-частицу с конкретным элементом в цепочке распада, они смогут восстановить, какой элемент они создали изначально.
Более прочная балка и более щедрый разделитель теоретически должны нейтрализовать более низкие шансы синтеза титана-50. Это вселяет в дубненскую команду надежду на то, что скоро обнаружатся атомы 119 или 120. Команда RIKEN также ищет 119, хотя и использует другой и, возможно, более сложный метод (сжигание ванадия, элемента 23, на кюрий). Между двумя лабораториями ученые уверены, что 119 и 120 появятся где-то в течение примерно 5 лет.
Если вы оглянетесь на несколько десятилетий назад, люди делали примерно один новый элемент, может быть, каждые 3 года – до сих пор.
Пекка Пююкко, Хельсинкский университет
Это следующие 5 лет беспокоят людей. Создание элементов тяжелее 120 может быть невозможно с помощью горячего плавления. Обнаружить их будет так же сложно: если ожидаемое время жизни упадет слишком низко, атомы могут не пережить 1-микросекундный переход через сепаратор. Вместо этого они могли распадаться в полете – призрачные атомы, бесследно исчезающие.
Таким образом, выход за пределы 120 потребует новых подходов.«Реакции многонуклонного переноса» будут включать в себя выстрелы, скажем, ураном по кюрию на относительно низких скоростях – еще одно «мягкое прикосновение». Их ядра не слились бы полностью, но часть одного из них может отломиться и налететь на другую. В зависимости от размера куска ученые могут даже перейти к гораздо более высоким номерам элементов вместо того, чтобы постепенно продвигаться по одному атомному номеру за раз.
Однако такие методы остаются недоказанными. «Ученые, занимающиеся тяжелыми элементами, любят работать по одному, – говорит Джеклин Гейтс, руководитель группы тяжелых элементов в Национальной лаборатории Лоуренса Беркли в Калифорнии.И намного больше, чем 120, говорит она: «Мы не знаем достаточно, чтобы даже знать, что искать – какой период полураспада искать, какие свойства распада искать».
Учитывая эти трудности, некоторые ученые предлагают отказаться от ускорителей. Согласно одному подходу, ядерные взрывы малой мощности могут вызвать реакции синтеза в атомах-мишенях. Это не так безумно, как кажется: элементы 99 и 100 были впервые обнаружены в результате испытаний атмосферной атомной бомбы. Тем не менее, большинство ученых скептически относятся к этому подходу, учитывая очевидную радиационную опасность и короткое время жизни сверхтяжелых атомов, которые могут истечь до того, как их удастся отсеять от ядерного мусора.
Другие ученые предлагают находить новые элементы по старинке: охотясь за ними в природе. На самом деле это было популярным развлечением несколько десятилетий назад, когда физики исследовали космические лучи, метеориты, лунные камни и даже зубы древних акул на предмет сверхтяжелости. Из этих проектов ничего не вышло. В настоящее время акцент сместился на взрывы сверхновых и аномальные звезды, такие как звезда Пшибыльского, спектр которой показывает признаки эйнштейния, который никогда не встречается в природе. Возможно, в горячем и плотном интерьере звезды есть еще более тяжелые элементы.
Тем не менее, нет никакой гарантии, что сверхтяжелые элементы существуют в природе. А длительный период засухи – с 2010 года не было создано никаких новых элементов – беспокоит некоторых исследователей.
«Если вы оглянетесь на несколько десятилетий назад, – говорит Пекка Пююкко, химик-теоретик из Хельсинкского университета, – люди производили примерно один новый элемент, может быть, каждые 3 года – до сих пор». Сегодняшнее бесплодие может стать новой нормой.
Заполнение таблицы
В последние десятилетия лаборатории нескольких стран расширили стол искусственными элементами.Можно создать больше (серый цвет) из 172. Расчеты химика Пекки Пюккё из Хельсинкского университета предсказывают, что периодичность таблицы в определенных местах нарушится, в результате чего элементы, такие как 139 и 140, будут не в порядке номеров.
HLiNaMgKCaScTiVCrMnFeCoNiCuZnGaGeAsSeBrKrAlSiPSClArBCNOFNeHeNbMoTcRuRhPdAgCdInSnSbTeIXeYZrTaWReOsIrPtAuHgTIPbBiPoAtRnHfCePrNdPmSmEuGdTbDyHoErTmYbLuLaRbSrCsBa1571581591601611621631641391401671681691701711721561165166BeHypotheticalRussiaRussia и Соединенные Штаты (независимо друг от друга) United StatesJapanGermany142143144145146147148149150151152153141154155122123124125126127128129130131132133121134135136137138FrRaDbSgBhHsMtDsRgCnFlMcLvTsOgRfUNpPuAmCmBkCfEsFmMdNoLrThPaAcNh57-7189-103121-3111121920543536533132333413151617185678950515281828384858611411511611711811322232425262728293041424344454647484074757677787980721051061071081011112104213937385556487885859606162636465666768697071579293949596979890110210391473Н.DESAI / НАУКА
Даже если ученые смогут преодолеть техническую проблему создания новых элементов, остаются другие вопросы: сколько элементов может существовать, даже гипотетически? Как далеко может зайти таблица Менделеева?
Одна известная теория предсказывает конец на элементе 172. Никто не знает, что произойдет выше этой точки, но по квантово-механическим причинам ядро атома может начать поглощать электроны и сливать их с протонами, производя нейтроны в качестве побочного продукта.Этот процесс будет продолжаться до тех пор, пока количество протонов не упадет до 172, что обеспечит жесткое ограничение атомного номера. (И если это звучит странно, что ж, это квантовая механика.)
Другое исследование предполагает, что элементы закончатся задолго до 172. По мере увеличения ядер сила отталкивания между протонами становится непреодолимой. По общему мнению, ядро должно просуществовать не менее 10 – 14 секунд, чтобы считаться новым элементом. Учитывая, насколько хрупкими являются элементы в 110-х годах, более тяжелым элементам может быть сложно удержаться даже так долго.Некоторые ученые предсказывают, что ядра могут преодолеть эту проблему, скручиваясь в экзотические формы – полые пузыри или даже решетчатые шары. Но другие ученые сомневаются, что эти формы будут стабильными.
Что очень жаль, потому что в 130-е или 140-е годы могли произойти интересные вещи. В частности, sine qua non периодической таблицы Менделеева – ее периодичность – может полностью выйти из строя.
Как правило, все элементы в одном столбце таблицы имеют схожие химические и физические свойства.Но эта тенденция не может сохраняться вечно. Ученым со всего мира удалось исследовать свойства отдельных сверхтяжелых атомов, изучая, как они прикрепляются к различным материалам. И связь между колонками и химическим поведением, кажется, уже разрушается в 110-е годы.
Элемент 114, например, действует как газ при комнатной температуре, даже несмотря на то, что элемент над ним, свинец, является самым негазоподобным веществом, которое только можно вообразить. Точно так же, хотя элемент 118 попадает в столб благородных газов, теория предсказывает, что он будет легко притягивать электроны – чего не делает ни один другой благородный газ.Эти аномалии возникают из-за релятивистских эффектов: высокий концентрированный заряд сверхтяжелого ядра искажает орбиты окружающих электронов, что влияет на их поведение и образование связей.
Как говорит Хаба, «химические свойства сверхтяжелых элементов очень уникальны, и мы не можем просто экстраполировать». И хотя 114 и 118, кажется, лишь незначительно отклоняются от ожиданий, даже более тяжелые элементы могут иметь совершенно неожиданные свойства, потому что релятивистские эффекты будут только усиливаться по мере того, как элементы набирают вес.Так куда же должны деваться аномальные элементы? В столбец, в котором указаны их атомные номера, или в столбец с элементами аналогичных свойств?
Ответ зависит от того, кого вы спрашиваете. Для некоторых ученых таблица в первую очередь касается основной атомной структуры, а не химического поведения. Поэтому отклонения не допускаются. Другие исследователи более прагматичны. «Таблица Менделеева более полезна для того, чтобы рассказать мне, каков химический состав элемента, поэтому я бы поспорил за ее изменение», – говорит Гейтс.
Pyykkö довел идею аномальных элементов до крайности, вычислив теоретические свойства для всех элементов через 172 и расположив их в футуристической таблице. Результат ошеломляющий: в какой-то момент последовательность атомных чисел перескакивает назад со 164 на 139 и 140, прежде чем перейти к 169 (см. Таблицу слева). Причудливый стол теперь висит на стене его офиса. «Когда я читаю лекции, – говорит он, – я обычно шучу, что этой таблицы Менделеева должно хватить на остаток этого столетия.«
Помимо разделения по структуре таблицы, существует более глубокий разрыв между людьми, которые думают, что поиск новых элементов стоит того, и теми, кто считает это пустой тратой времени и ресурсов. Гейтс выражает свой скептицизм: «Для элементов 119 или 120, с нашей нынешней технологией, вы смотрите на годы пучка потенциально для одного атома – и о чем это вам говорит?»
Тем не менее, она понимает, почему некоторые лаборатории ищут новые элементы: «Новый элемент – это то, что вызывает у людей интерес.… И это действительно помогает получить финансирование. Я просто не думаю, что экспериментами движет наука. Это политика ». Действительно, 9-летнее стремление RIKEN к элементу 113 привело к хорошему увеличению бюджета. А поскольку 113 был первым элементом, созданным в Азии, ученые стали народными героями в Японии. Кто-то даже опубликовал мангу-комикс об их работе
Дубненские ученые утверждают, что их работа – это не просто трофейная охота. Карпов, который владеет четырьмя спортивными куртками и носит на каждой из них различные значки на лацкане с элементами русской тематики (дубний, флеровий, московий и оганессон), говорит, что создание новых элементов может подтвердить теоретические предположения об их периоде полураспада и других свойствах.
Он и его коллеги также попытаются во время некоторых экспериментов добавить нейтроны к существующим сверхтяжелым элементам и создать их более долгоживущие версии. Назаревич, скептически относящийся к созданию новых элементов, видит в этом ценность. «Я бы хотел, чтобы мы стали более стабильными», – говорит он. Работа с существующими элементами может даже позволить ученым достичь острова стабильности – предполагаемой области долгоживущих сверхтяжелых элементов – и изучить свойства этих элементов. По крайней мере, технологии, используемые для создания новых элементов, могут помочь в производстве радиоизотопов для медицины и проверить, насколько хорошо компоненты спутников выдерживают бомбардировку частицами.
В конечном счете, однако, поиск новых элементов – это отдельная награда – l’art pour l’art . «В увеличении количества протонов есть величие», – говорит Карпов. «Это естественно – доходить до предела» и пытаться выйти за его пределы. К тому же, говорит он с улыбкой, его московская булавка на лацкане блестит, «иногда хорошо сказать, что ты сделал что-то первым».
.