Контрольная работа №1 по теме «Строение и классификация органических соединений, химические реакции в органической химии»
Контрольная работа №1 по теме
«Строение и классификация органических соединений,
химические реакции в органической химии»
Вариант 1
1. Тип химической связи между атомами углерода в молекуле веществ, формулы которых С3Н4 и СН4
А. Одинарная и двойная Б. Двойная и одинарная
В. Тройная и двойная Г. Тройная и одинарная
2. Общая формула СnН2n соответствует:
А. Алканам Б. Алкенам. В. Алкинам. Г. Аренам. Д. Циклоалканам
3. Молекулярная формула углеводорода с относительной плотностью по водороду равна 28:
А. С4Н10. Б. С4Н8. В. С4Н6. Г. С3Н8. Д. С3Н6
4. Вещества, формулы которых СН2 = СН2 и СН2 = СН – СН2 – СН3, являются:
А.
В. Изомерами. Г. Одним и тем же веществом.
5. Установите соответствие.
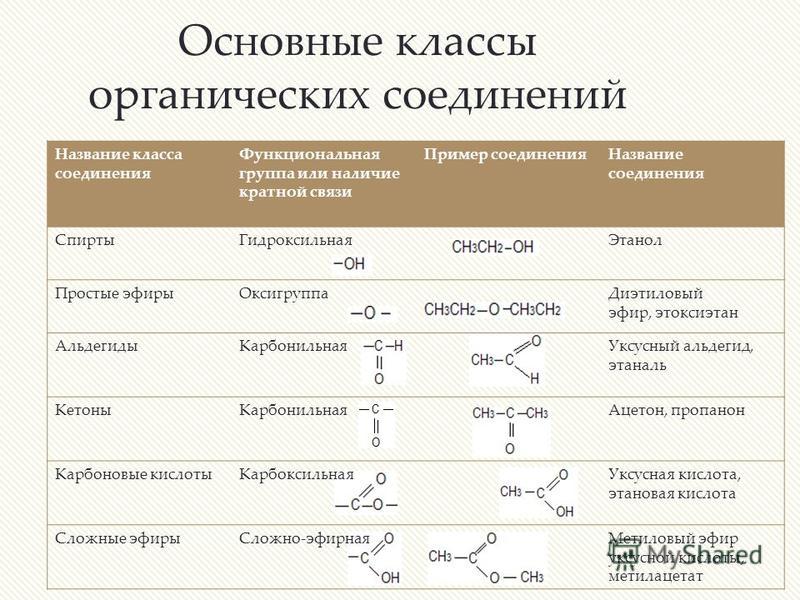
Формула соединения | Класс соединения |
А. С17Н35СООН | 1. Алканы |
Б. С6Н6 | 2. Алкены |
В. НСНО | 3. Алкины. |
Г. С2Н5ОН | 4. Арены |
Д. С5Н10 | 5. Альдегиды |
Е.СН4 | 6. Карбоновые кислоты |
Ж.С3Н4 | 7. Спирты |
6. Реакция дегидрирования – это….
Реакция дегидрирования – это….
7. Массовая доля углерода в пропилене С3Н6 равна:
А. 18,8%. Б. 40%. В. 60%. Г. 85,71%.
8. Количество вещества этана массой 1,6 г равно:
А. 1,5 моль. Б. 1 моль. В. 0,05 моль. Г. 0,1 моль.
9.
10. Выведите истинную формулу органического соединения, содержащего 40,03% С, 6,67% Н, и 53,30% О. Молярная масса данного соединения равна 180 г/моль. Назовите вещество.
11. К какому типу относят реакцию, уравнение которой приведено ниже?
СН3 –СН3Ch3 =Ch3 + h3
12. Составьте структурные формулы изомеров состава С5Н10. Назовите вещества.
Контрольная работа №1 по теме
«Строение и классификация органических соединений,
химические реакции в органической химии»
Вариант 2
1. Тип химической связи между атомами углерода в молекуле вещества, формула которого С2Н6 и С2Н4
Тип химической связи между атомами углерода в молекуле вещества, формула которого С2Н6 и С2Н4
А. Одинарная и двойная. Б. Двойная и тройная.
В. Тройная и одинарная Г. Одинарная и тройная
2. Общая формула СnН2n–2 соответствует:
А. Алканам. Б. Алкенам. В. Алкинам. Г. Аренам. Д. Алкадиенам
3. Молекулярная формула углеводорода с относительной плотностью по воздуху равна 1,034:
А. С2Н6. Б. С3Н8. В. С4Н8. Г. С5Н12. Д.С2Н2
4. Вещества, формулы которых СН3 – СН2ОН и СН3 – СНО, являются:
А. Веществами разных классов. Б. Гомологами.
В. Изомерами. Г. Одним и тем же веществом.
5. Установите соответствие.
Формула соединения | Класс соединения |
А. | 1. Алканы |
Б. СН3СН2СООН | 2. Алкены |
В. СН3ОН | 3. Алкины. |
Г. С3Н8 | 4. Арены |
Д. С6Н6 | 5. Альдегиды |
Е. С2Н4О | 6. Карбоновые кислоты |
Ж. С5Н10 | 7. Спирты |
6. Реакция дегидратации это-
7. Массовая доля водорода в ацетилене С2Н
А. 7,7%. Б. 83,3%. В. 92,3%. Г. 93,2%.
8. Количество вещества метана массой 16 г. равно:
А. 1 моль. Б. 2,5 моль. В. 0,1 моль. Г. 250 моль.
9. Выведите молекулярную формулу вещества по следующим данным: массовые доли углерода, кислорода и водорода соответственно равны 38,7%, 51,6% и 9,7%. Относительная плотность паров этого вещества по водороду равна 31. Назовите вещество.
Выведите молекулярную формулу вещества по следующим данным: массовые доли углерода, кислорода и водорода соответственно равны 38,7%, 51,6% и 9,7%. Относительная плотность паров этого вещества по водороду равна 31. Назовите вещество.
10. Массовая доля углерода в углеводороде 90%, относительная плотность по водороду равна 20.
11. Взаимодействие этилена с хлором является реакцией? Напишите ее.
А. Замещения. Б. Изомеризации.
В. Присоединения. Г. Элиминирования.
12. Составьте структурные формулы изомеров состава С6Н12. Назовите вещества.
Ответы
Контрольная работа №1 по теме
«Строение и классификация органических соединений,
химические реакции в органической химии»
1 вариант 1. г 2. б, д 3. 4. б 5. а 6, б 4,в 5,г 7,д 2,е 1,ж 3. 6. отщепление 2-х атомов водорода 7. г 8. в 9. С3Н6 10.С6Н12О6 11. дегидрирования 12. пентен-1, Пентен-2,2-метилбутен1, 3-метилбутен 2 и т.д | 2 вариант 1. а 2. в, д 3. а 4. а 5. а 3, б 6, в 7, г 1, д 4, е 5, ж 2. 6. отщепление молекулы воды 7. а 8. а 9. С2Н6О2 10. С3Н4 11. в 12. гексен 1,гексен 2, гексен3, 2-метилпентен 1, 3-метил пентен1. и тд. |
Опубликовано в группе «УРОК.РФ: группа для участников конкурсов»
Контрольные работы, коллоквиумы и типовые экзаменационные задачи по органической химии (часть I) – книга
Контрольные работы, коллоквиумы и типовые экзаменационные задачи по органической химии (часть I)книга
- Авторы:
Алексеев Р.
 С.,
Ливанцов М.В.,
Ливанцова Л.И.,
Теренин В.И.
С.,
Ливанцов М.В.,
Ливанцова Л.И.,
Теренин В.И. - Год издания: 2015
- Место издания: Филиал МГУ им. М.В. Ломоносова в г. Баку
- Объём: 148 страниц (17,09 печатных листов)
- Тираж: 40 экз.
- Учебник
- Учебно-методическая литература
- Учебное пособие без грифа
- Аннотация:
В первой части пособия предлагаются задачи и вопросы, знакомящие студентов с основными понятиями органической химии, с механизмами многих органических реакций и методами их доказательства.
 Подробно рассматриваются методы получения и химические свойства таких классов органических соединений, как алифатические углеводороды, галогеналканы, спирты, простые эфиры и оксираны, карбонильные соединения (альдегиды и кетоны), карбоновые кислоты и их производные.
Подробно рассматриваются методы получения и химические свойства таких классов органических соединений, как алифатические углеводороды, галогеналканы, спирты, простые эфиры и оксираны, карбонильные соединения (альдегиды и кетоны), карбоновые кислоты и их производные. - Добавил в систему: Алексеев Роман Сергеевич
Прикрепленные файлы
| № | Имя | Описание | Имя файла | Размер | Добавлен |
|---|---|---|---|---|---|
| 1. | Uchebnik_I.pdf | Uchebnik_I. pdf pdf | 1,2 МБ | 26 сентября 2015 [AlekseyevRS] |
викторин и резюме по органической реакции
викторина и резюме по органической реакции Мы решили использовать конкретные примеры, а не обозначение R-группы, чтобы вы могли увидеть реакции в контексте реальной, но простой молекулы. Обратите внимание, что каждая реакция должна происходить дважды в этом обзоре, один раз до “реакции” и один раз под “синтез” ; для вашего удобства функциональные группы разделены на семестровые группы, но некоторые реакции могут происходить по одному разу в каждой. Реакции, для которых механизм или стереохимия являются важной частью вашего обучения, имеют механизм ! или Стереохимия! выделено. Советы по изучению этого профессора и успешного студента Университета Тоусона; подсказки, предоставленные для курса биохимии, также применимы, поскольку навыки одинаковы.
Мы решили использовать конкретные примеры, а не обозначение R-группы, чтобы вы могли увидеть реакции в контексте реальной, но простой молекулы. Обратите внимание, что каждая реакция должна происходить дважды в этом обзоре, один раз до “реакции” и один раз под “синтез” ; для вашего удобства функциональные группы разделены на семестровые группы, но некоторые реакции могут происходить по одному разу в каждой. Реакции, для которых механизм или стереохимия являются важной частью вашего обучения, имеют механизм ! или Стереохимия! выделено. Советы по изучению этого профессора и успешного студента Университета Тоусона; подсказки, предоставленные для курса биохимии, также применимы, поскольку навыки одинаковы.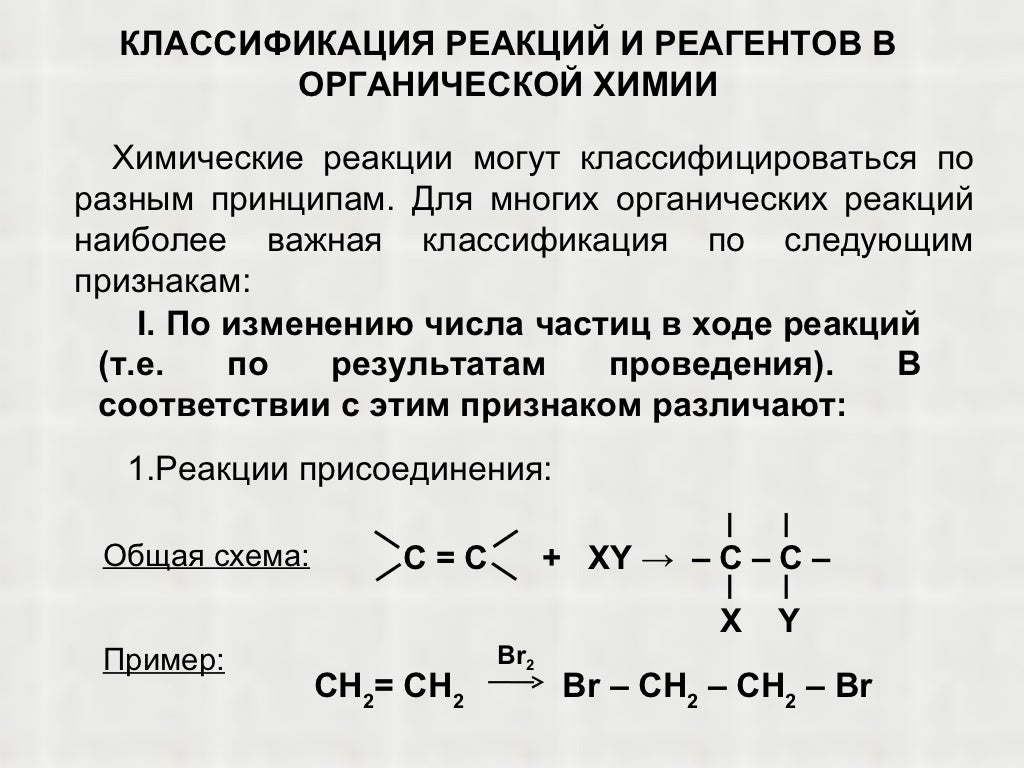 Пролистайте вниз, чтобы увидеть выбор .
Или выберите другие учебные пособия по органической химии, включая ссылки на другие полезные сайты, здесь.
Пролистайте вниз, чтобы увидеть выбор .
Или выберите другие учебные пособия по органической химии, включая ссылки на другие полезные сайты, здесь.| Органический 1 Функциональные группы | ||||
|---|---|---|---|---|
| спирт (первичный, вторичный, третичный) | реакций | синтез | органическая викторина | неорганические викторины |
| алкан | реакций | синтез | органическая викторина | неорганические викторины |
| алкен | реакций | синтез | органическая викторина | неорганические викторины |
| алкилгалогенид | реакций | синтез | органическая викторина | неорганические викторины |
| алкин | реакций | синтез | органическая викторина | неорганические викторины |
| эфир | реакций | синтез | органическая викторина | неорганические викторины |
| Органический 2 функциональные группы | ||||
|---|---|---|---|---|
| альдегид и кетон | реакций | синтез | органическая викторина | неорганические викторины |
| амид, карбоксамид | реакций | синтез | органическая викторина | неорганические викторины |
| амин (первичный, вторичный, третичный) | реакций | синтез | органическая викторина | неорганические викторины |
| ароматические соединения | реакций | органическая викторина | неорганические викторины | |
| сложный эфир карбоновой кислоты | реакций | синтез | органическая викторина | неорганические викторины |
| карбоновая кислота | реакций | синтез | органическая викторина | неорганические викторины |
| хлорангидрид и ангидрид карбоновой кислоты | реакций | синтез | органическая викторина | неорганические викторины |
| соль карбоновой кислоты | реакций | органическая викторина | неорганическая викторина | |
| 1,3-диен | реакций | органическая викторина | неорганические викторины | |
| енолят | реакций | синтез | органическая викторина | неорганические викторины |
Общие реагенты
| Кислоты / электрофилы | оснований/нуклеофилов | Окислители | Переходники |
Чтобы использовать эти категории реагентов более эффективно, вы можете просмотреть кислоты и основания, окисление и восстановление в целом, или узнать или просмотреть, как рассчитать степени окисления и уравнения баланса для органических соединений.
Советы по обучению
Каждый учащийся должен сделать личное резюме в стиле, который подходит ему или его собственному стилю обучения – делайте это так, как вам удобно. Несколько методов оказались успешными для обучения реакциям:
- Карточки с реагентами на одной стороне и продуктами на другой;
- Карточки с органическим и неорганическим реагентом на одной стороне и органическим реагентом и продуктом на другой; эти карты дают вам две викторины на карту;
- Для каждой функциональной группы страница со списком реакций (и примеров) и страница со списком методов синтеза;
 Тесты в файлах выше являются упражнениями и менее сложны, чем тесты в тексте или на экзаменах.
Тесты в файлах выше являются упражнениями и менее сложны, чем тесты в тексте или на экзаменах.Вернуться в меню Органическая химия
Вернуться на домашнюю страницу доктора Свитинга
Предложения по улучшению следует направлять по электронной почте на адрес [email protected]. Джастин Д. Чендлер является соавтором этих страниц, и нам помогали Адеола Адейе, Ар Лам, Натаниэль МакКерли, Брайан Борнфренд, Кит Лидбеттер и Шеннон Дивайн. Если вы хотите принять участие (еще многое предстоит сделать, например, масштабировать изображения реагентов и добавить другие тексты), свяжитесь с доктором Свитингом.
6.4: Химические тесты — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 254975
- Лиза Николс
- Колледж Бьютт
До того, как спектроскопический анализ (ИК, ЯМР) стал обычным явлением в лаборатории органической химии, химические тесты широко использовались для поддержки идентификации соединений. Химический тест обычно представляет собой быструю реакцию, проводимую в пробирке, которая дает визуальную подсказку (изменение цвета, осадок или образование газа) в качестве доказательства химической реакции.
Химический тест обычно представляет собой быструю реакцию, проводимую в пробирке, которая дает визуальную подсказку (изменение цвета, осадок или образование газа) в качестве доказательства химической реакции.
- 6.4A: Обзор химических тестов
- Химический тест обычно представляет собой быструю реакцию, проводимую в пробирке, которая дает визуальную подсказку (изменение цвета, осадок или образование газа) в качестве доказательства химической реакции. Например, добавление оранжевого реагента хромовой кислоты к некоторым соединениям вызывает изменение цвета реагента хрома на сине-зеленый цвет. Это считается «положительным» результатом теста и в данном случае указывает на наличие функциональной группы, способной к окислению (спирта или альдегида).
- 6.4B: Блок-схемы
- В некоторых учебных лабораториях для определения неизвестного используется комбинация спектроскопии и химических тестов.
 Инфракрасный спектрометр, если он доступен, очень полезен для определения возможных функциональных групп, присутствующих в неизвестном веществе. Следующие блок-схемы обобщают ключевые сигналы, присутствующие в ИК-спектре, и химические тесты, которые можно использовать для поддержки или уточнения структурной идентификации.
Инфракрасный спектрометр, если он доступен, очень полезен для определения возможных функциональных групп, присутствующих в неизвестном веществе. Следующие блок-схемы обобщают ключевые сигналы, присутствующие в ИК-спектре, и химические тесты, которые можно использовать для поддержки или уточнения структурной идентификации.
- 6.4C: Резюме химических испытаний
- Ниже приводится визуальная сводка различных химических тестов. Процедуры и подробные сведения о каждом из них приведены в следующем разделе.
- 6.4D: Индивидуальные тесты
- Тест Бейльштейна подтверждает наличие галогена в растворе, хотя он не различает хлор, бром или йод. Медную проволоку погружают в галогенсодержащий раствор и бросают в пламя. Оксид меди на проводе вступает в реакцию с органическим галогенидом с образованием соединения галогенида меди, которое придает пламени сине-зеленый цвет.
Эта страница под названием 6.

 С2Н2
С2Н2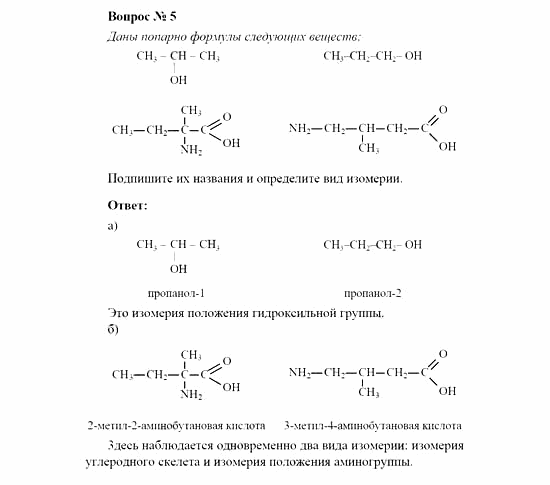 б
б С.,
Ливанцов М.В.,
Ливанцова Л.И.,
Теренин В.И.
С.,
Ливанцов М.В.,
Ливанцова Л.И.,
Теренин В.И. Подробно рассматриваются методы получения и химические свойства таких классов органических соединений, как алифатические углеводороды, галогеналканы, спирты, простые эфиры и оксираны, карбонильные соединения (альдегиды и кетоны), карбоновые кислоты и их производные.
Подробно рассматриваются методы получения и химические свойства таких классов органических соединений, как алифатические углеводороды, галогеналканы, спирты, простые эфиры и оксираны, карбонильные соединения (альдегиды и кетоны), карбоновые кислоты и их производные. Инфракрасный спектрометр, если он доступен, очень полезен для определения возможных функциональных групп, присутствующих в неизвестном веществе. Следующие блок-схемы обобщают ключевые сигналы, присутствующие в ИК-спектре, и химические тесты, которые можно использовать для поддержки или уточнения структурной идентификации.
Инфракрасный спектрометр, если он доступен, очень полезен для определения возможных функциональных групп, присутствующих в неизвестном веществе. Следующие блок-схемы обобщают ключевые сигналы, присутствующие в ИК-спектре, и химические тесты, которые можно использовать для поддержки или уточнения структурной идентификации.