Контрольная работа “Общая характеристика химических элементов и химических реакций” для 9 класса
Контрольная работа№1 по химии. 9 класс.
1 вариант
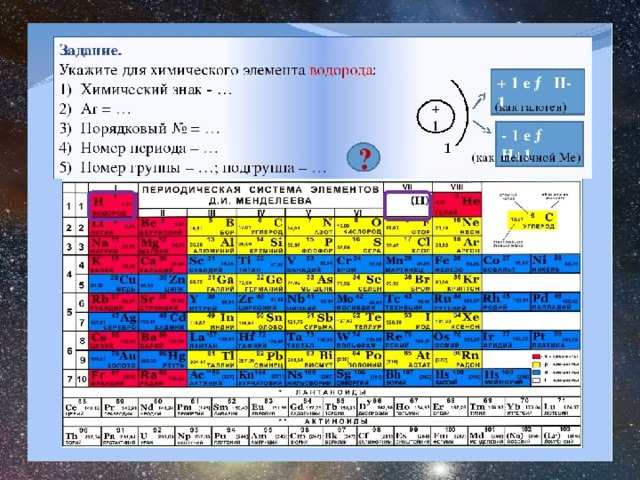
1. О химическом элементе водород говориться в выражении:
1) водород самый лёгкий газ 2) водород реагирует с кислородом
3) водородом наполняют шары-зонды 4) водород входит в состав воды
2. Выберите простое вещество: 1) H2O 2)CaO 3) Cl2 4) NaOH
3. Ряд чисел соответствующий распределению электронов в атоме серы:
1)2,8,4 2)2,8,6 3)6,8,2 4)2,6,8
4. Номер химического элемента в ПСХЭ – 3S23P3: 1) 13 2) 15 3) 5 4) 7
5. Количество валентных электронов в атоме серы: 1) 6 2) 4 3)16 4) 2
6. Степень окисления фосфора в фосфорной кислоте: 1)+3 2)+5 3)-3 4)-5
7. Номер периода в ПСХЭ соответствует количеству:
1)электронов 2)протонов 3)валентных электронов 4)энергетических уровней
8. Количество нейтронов в атоме меди: 1) 64 2) 29 3) 35 4) 93
9. Коэффициент перед формулой кислорода в реакции C2H6 + O2 CO2 + H2O:
Коэффициент перед формулой кислорода в реакции C2H6 + O2 CO2 + H2O:
1)7 2)6 3)4 4)2
10. Атомы, которые отдают электроны в ОВР, называются:
1)окислитель 2)восстановитель 3)окисление 4)восстановление
11. Процесс присоединения электронов атомами в ОВР, называется:
1)окислитель 2)восстановитель 3)окисление 4)восстановление
12. Соли кремниевой кислоты называются:
1) силикаты 2)сульфаты 3) сульфиты 4) карбонаты
13. Сульфидами называют соли кислоты: 1)серной 2) сернистой 3)сероводородной 4)соляной
14. Тип химической реакции: Zn(OH)2+ 2HCl ZnCl2 + 2H2O
1) соединения 2) разложения 3) замещения 4) обмена
15. Определите тип химической реакции, в которой из одного сложного вещества образуются два или более простых или сложных веществ: 1) соединения 2) разложения 3) замещения 4) обмена
Контрольная работа№1 по химии. 9 класс.
9 класс.
2 вариант
1. О химическом элементе кислород говориться в выражении:
1) кислород входит в состав воды 2) кислород поддерживает горение
3) кислород образуется при фотосинтезе 4) кислород входит в состав воздуха
2. Выберите сложное вещество: 1) H2 2)CaO 3) Cl2 4) Р4
3. Ряд чисел соответствующий распределению электронов в атоме хлора:
1)2,7,8 2)8,7,2 3)7,8,2 4)2,8,7
4. Номер химического элемента в ПСХЭ – 2S22P3: 1) 5 2) 2 3) 7 4) 15
5. Количество валентных электронов в атоме фосфора: 1) 15 2) 5 3)31 4) 3
6. Степень окисления серы в серной кислоте: 1)+6 2)+4 3)-4 4)-2
7. Номер химического элемента в ПСХЭ соответствует количеству:
1)нейтронов 2)протонов 3)валентных электронов 4)энергетических уровней
8. Количество нейтронов в атоме железа: 1) 30 2) 26 3) 56 4) 82
9. Коэффициент перед формулой кислорода в реакции C4H10 + O2 CO2 + H2O:
1)4 2)5 3)9 4)13
10. Атомы, которые присоединяют электроны в ОВР, называются:
Атомы, которые присоединяют электроны в ОВР, называются:
1)окислитель 2)восстановитель 3)окисление 4)восстановление
11. Процесс отдачи электронов атомами в ОВР, называется:
1)окислитель 2)восстановитель 3)окисление 4)восстановление
12. Соли угольной кислоты называются:
1) силикаты 2)сульфаты 3) сульфиды 4) карбонаты
13. Сульфитами называют соли кислоты: 1)серной 2) сернистой 3)сероводородной 4)соляной
14. Тип химической реакции: Zn+ 2HCl ZnCl2 + H2
1) соединения 2) разложения 3) замещения 4) обмена
15. Определите тип химической реакции, в которой из двух или более простых или сложных веществ образуется одно сложное: 1) соединения 2) разложения 3) замещения 4) обмена
16. Химическая связь в хлориде кальция:
1) КПС 2) КНПС 3)ИС 4) Металлическая
17. Ковалентная неполярная связь в соединении:
1) СО2 2) H2 3) HCl 4) NaF
18. Из перечисленных веществ выберите амфотерный гидроксид:
1) Mg(OH)2 2)KOH 3) Al(OH)3 4)Ba(OH)2
19. Расположите элементы в порядке увеличения радиуса атома:
Расположите элементы в порядке увеличения радиуса атома:
1)S 2)Si 3)Cl 4)P
20. Расположите формулы веществ в следующем порядке: основный оксид, кислотный оксид, кислота, щёлочь, амфотерное основание, соль:
1)KOH 2)CO2 3)H3PO4 4)Na2O 5)Na2CO3 6)Al(OH)3
Задания без выбора ответа
21. Уравняйте, напишите реакцию в ионном и сокращённом ионном виде:
А) Al2(SO4)3 + BaCl2 AlCl3 + BaSO4
Б) гидроксид натрия + фосфорная кислота фосфат натрия + вода
22. Уравняйте, расставьте степени окисления, укажите восстановитель и окислитель, покажите переход электронов:
А) Аl + HCl AlCl3 + H2
Б) барий + фосфорная кислота фосфат бария +водород
23. Уравняйте ОВР, используя метод электронного баланса, определите восстановитель и окислитель и укажите переход электронов:
Fe + H 2SO4 Fe 2 (SO4)3 + SO2 + H2O
24. Напишите уравнения реакции по схеме: P P 2O5Ca 3 (PO4)2
Напишите уравнения реакции по схеме: P P 2O5Ca 3 (PO4)2
16. Химическая связь в оксиде серы (IV):
1) КПС 2) КНПС 3)ИС 4) Металлическая
17. Ионная связь в соединении:
1) СО2 2) H2 3) HCl 4) NaF
18. Из перечисленных веществ выберите амфотерный оксид:
1) Na2O 2)Al2O3 3) MgO 4)SO3
19. Расположите элементы в порядке увеличения неметаллических свойств:
1)S 2)Si 3)Cl 4)P
20. Расположите формулы веществ в следующем порядке: амфотерное основание, соль, кислотный оксид, кислота, основный оксид, щёлочь:
1)KOH 2)CO2 3)H3PO4 4)Na2O 5)Na2CO3 6)Al(OH)3
Задания без выбора ответа
21. Уравняйте, напишите реакцию в ионном и сокращённом ионном виде:
А) Fe2(SO4)3 + NaOH Fe(OH)3 + Na2SO4
Б) силикат натрия + фосфорная кислота кремниевая кислота + фосфат натрия
22. Уравняйте, расставьте степени окисления, укажите восстановитель и окислитель, покажите переход электронов:
Уравняйте, расставьте степени окисления, укажите восстановитель и окислитель, покажите переход электронов:
А) Zn + HCl ZnCl2 + H2
Б) Алюминий + серная кислота сульфат алюминия +водород
23. Уравняйте ОВР, используя метод электронного баланса, определите восстановитель и окислитель и укажите переход электронов:
Fe + HNO3 Fe (NO3)3 + NO2 + H2O
24. Напишите уравнения реакции по схеме: Ca CaOCa 3 (PO4)2
Контрольная работа № 1 по химии в 9 классе
«Повторение изученного материала в 8 классе»
1 вариант
1 вариант | |||
1 | 4 | 11 | 4 |
2 | 3 | 12 | 1 |
3 | 2 | 13 | 3 |
4 | 2 | 14 | 4 |
5 | 1 | 15 | 2 |
6 | 2 | 16 | 3 |
7 | 4 | 17 | 2 |
8 | 3 | 18 | 3 |
9 | 1 | 19 | 3142 |
10 | 2 | 20 | 423165 |
Задания без выбора ответа
21
Al2(SO4)3+ 3BaCl2 2AlCl3 + 3BaSO4 ↓
2Al3+ +3SO42- +3Ba2+ + 6Cl– 2Al3+ + 6Cl–+3BaSO4↓
3SO42- +3Ba2+ 3BaSO4↓
3NaOH+ H3PO4 Na3PO4 + 3H2O
3Na+ +3OH– +3H+ + PO43- 3Na+ + PO43-+3H2O
3OH– +3H+ 3H2O↓
22
2Аl + 6HCl 2AlCl3 + 3H2
3Ba+2H3PO4 Ba3(PO4)2+3H2
23
2Fe0 + 6H 2S+6O4 Fe 2 +3(SO4)3 + 3S+4O2 + 6H2O
2Fe0 – 6ē Fe2 +3 6 1
S+6 + 2ē S+4 3
24
4P + 5O2 2P2O5
P2O5 + 3CaO Ca3 (PO4 )2
2 вариант
2 вариант | |||
1 | 1 | 11 | 3 |
2 | 2 | 12 | 4 |
3 | 4 | 13 | 2 |
4 | 3 | 14 | 3 |
5 | 2 | 15 | 1 |
6 | 1 | 16 | 1 |
7 | 2 | 17 | 4 |
8 | 1 | 18 | 2 |
9 | 4 | 19 | 2413 |
10 | 1 | 20 | 652341 |
Задания без выбора ответа
21
Fe2(SO4)3 + 6NaOH 2Fe (OH)3↓ + 3Na2SO4
2Fe3++ 3SO42- + 6Na+ + 6OH– 2Fe (OH)3↓ + 6Na+ + 3SO42-
2Fe3++ 6OH– 2Fe (OH)3↓
3Na2SiO3 + 2H3PO4 2Na3 PO4+ 3H2SiO3↓
6Na++ 3SiO32- + 6H+ + 2PO43- + 6Na+ + 2PO43- +3H2SiO3↓
3SiO32-+ 6H+ 3H2SiO3
22
Zn + 2 HCl ZnCl2+H2
2Al + 3 H2SO4 Al2(SO4)3+3H2
23
Fe0 + 6HN+5O3 Fe+3 (NO3)3 + 3N+4O2 + 3H2O
Fe0 – 3ē Fe+3 3 1
N+5 + 1ē N+4 3
24
2Ca + O2 2CaO
3CaO + P2O5 Ca3 (PO4 )2
или
3CaO + 2H3PO4 Ca3 (PO4 )2 +3H2O
Поиск материала «Тесты по химии, 9 класс, Общая характеристика химических элементов и химических реакций, Металлы, Рябов М.
 А., 2016» для чтения, скачивания и покупки
А., 2016» для чтения, скачивания и покупкиНиже показаны результаты поиска поисковой системы Яндекс. В результатах могут быть показаны как эта книга, так и похожие на нее по названию или автору.
Search results:
- Тесты по химии. 9 класс. Общая характеристика химических…
Пособие включает тесты, охватывающие две темы учебника О.С. Габриеляна “Химия. 9 класс”, от общей характеристики химических элементов до металлов. Тесты по остальным темам, завершающим курс химии 9 класса “Неметаллы” и “Обобщение знаний по химии за курс основной школы. Подготовка к Основному государственному экзамену” можно найти в другой книге тестов по химии, изданной в издательстве “Экзамен”, того же автора. Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.
11klasov.net
- Тесты по химии.
 9 класс
9 классСОДЕРЖАНИЕ Предисловие 5 ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ХИМИЧЕСКИХ РЕАКЦИЙ 7 Тест 1. Характеристика химического элемента на основании положения в Периодической системе Д.И. Менделеева 7 Задания базового уровня 7 Задания повышенного уровня 10 Тест 2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды….
to.alleng.org
-
Купить эту книгу
- Канцтовары
Канцтовары: бумага, ручки, карандаши, тетради. Ранцы, рюкзаки, сумки. И многое другое.
my-shop.ru
- Тесты по химии. 9 класс. Общая характеристика химических.
 ..
..Пособие включает тесты, охватывающие две темы учебника О.С. Габриеляна “Химия. 9 класс”, от общей характеристики химических элементов до металлов. Тесты по остальным темам, завершающим курс химии 9 класса “Неметаллы” и “Обобщение знаний по химии за курс основной школы. Подготовка к Основному государственному экзамену” можно найти в другой книге тестов по химии, изданной в издательстве “Экзамен”, того же автора. Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.
psschool.ru
- Тесты по химии. 9 класс. Общая характеристика химических…
Пособие включает тесты, охватывающие две темы учебника О.С. Габриеляна “Химия. 9 класс”, от общей характеристики химических элементов до металлов. Тесты по остальным темам, завершающим курс химии 9 класса “Неметаллы” и “Обобщение знаний по химии за курс основной школы.

uchebniki.org.ua
- Тесты по химии. 9 класс. Общая характеристика химических…
Смотреть, скачать: Ссылки удалены по требованию издательства. СОДЕРЖАНИЕ Предисловие 5 ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ХИМИЧЕСКИХ РЕАКЦИЙ 7 Тест 1. Характеристика химического элемента на основании положения в Периодической системе Д.И. Менделеева 7 Задания базового уровня 7 Задания повышенного уровня 10 Тест 2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды….
alleng.alleng.me
- Рябов химия 9 класс тесты 2016
Тесты по химии “Общая характеристика химических элементов и химических реакций” под авторством М.

gdz-online.ws
- Тесты по химии. 9 класс. Общая характеристика химических…
Смотреть, скачать: Ссылки удалены по требованию издательства. СОДЕРЖАНИЕ Предисловие 5 ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ХИМИЧЕСКИХ РЕАКЦИЙ 7 Тест 1. Характеристика химического элемента на основании положения в Периодической системе Д.И. Менделеева 7 Задания базового уровня 7 Задания повышенного уровня 10 Тест 2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды….
uchebniki.alleng.me
- Тесты по химии.
 9 класс. Общие свойства металлов – Боровских…
9 класс. Общие свойства металлов – Боровских…Общие свойства металлов – Боровских Т.А. Данное пособие полностью соответствует новому образовательному стандарту (второго поколения). Пособие, включающее тренировочные и контрольные тесты, является необходимым современным дополнением к известному школьному учебнику Г.Е. Рудзитиса и Ф.Г. Фельдмана «Химия. 9 класс», допущенному Министерством образования и науки Российской Федерации и включенному в Федеральный перечень учебников. Тесты составлены в формате государственной итоговой аттестации (в новой форме) и ЕГЭ.
11klasov.net
- Тесты по химии. 9 класс. Неметаллы. Обобщение знаний по…
Пособие включает тесты, охватывающие две темы учебника О.С. Габриеляна “Химия. 9 класс”, от неметаллов до обобщения знаний по химии за курс основной школы и подготовки к Основному государственному экзамену.

11klasov.net
- Тесты по химии. 9 класс. Общая характеристика химических…
Пособие включает тесты, охватывающие две темы учебника О.С. Габриеляна “Химия. 9 класс”, от общей характеристики химических элементов до металлов. Тесты по остальным темам, завершающим курс химии 9 класса “Неметаллы” и “Обобщение знаний по химии за курс основной школы. Подготовка к Основному государственному экзамену” можно найти в другой книге тестов по химии, изданной в издательстве “Экзамен”, того же автора. Тесты являются необходимым дополнением к школьному учебнику О.

school-textbook.com
- Рябов М.А. Тесты по химии.
Автор: Рябов М.А. Название: Тесты по химии. 9 класс. Общая характеристика химических элементов и химических реакций. Металлы Формат: PDF Размер: 1 Мб Язык: Русский.
9 класс”, от общей характеристики химических элементов до металлов. Тесты по остальным темам, завершающим курс химии 9 класса “Неметаллы” и “Обобщение знаний по химии за курс основной школы. Подготовка к Основному государственному экзамену” можно найти в другой книге тестов по химии, изданной в издательстве “Экзамен”, того же автора.
www.psyoffice.ru
- Тесты по химии.
 ..
..Пособие включает тесты, охватывающие две темы учебника О.С. Габриеляна “Химия. 9 класс”, от общей характеристики химических элементов до металлов. Тесты по остальным темам, завершающим курс химии 9 класса “Неметаллы” и “Обобщение знаний по химии за курс основной школы. Подготовка к Основному государственному экзамену” можно найти в другой книге тестов по химии, изданной в издательстве “Экзамен”, того же автора. Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.
- Тесты по химии. 9 класс. Общая характеристика химических…
Пособие включает тесты, охватывающие две темы учебника О.С. Габриеляна “Химия. 9 класс”, от общей характеристики химических элементов до металлов. Тесты по остальным темам, завершающим курс химии 9 класса “Неметаллы” и “Обобщение знаний по химии за курс основной школы.
 Подготовка к Основному государственному экзамену” можно найти в другой книге тестов по химии, изданной в издательстве “Экзамен”, того же автора. Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.
Подготовка к Основному государственному экзамену” можно найти в другой книге тестов по химии, изданной в издательстве “Экзамен”, того же автора. Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.cdnpdf.com
- Тест по химии для 9 класса
овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций; развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями; воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры
multiurok.ru
- Входные контрольные работы по химии, 9-11 классы
Проверке подлежит материал основных химических блоков, на которые распределено содержание школьного курса химии: «Строение атома химического элемента», «Полная характеристика химического элемента» «Номенклатура неорганических веществ», «Типы химических реакций», «Реакции ионного обмена», «Составление химических реакций по схеме», «Решение химических задач с использованием понятия примеси», «Решение химических задач на растворы».

xn--j1ahfl.xn--p1ai
- Тесты по химии 9 класс | Материал для подготовки к ЕГЭ…
А. Свойства химических элементов и образованных ими веществ находятся в перио-. дической зависимости от числа электронов на внешнем уровне атома. Б. Период – это горизонтальный ряд химических элементов, начинающийся и закан-. чивающийся инертным газом.
системы химических элементов Д.И. Менделеева. 2) Щелочные металлы используют для производства проводов. 3) В химических реакциях щелочные металлы проявляют сильные восстано
nsportal.ru
- ГДЗ по химии 9 класс Рябов тесты Металлы решебник
Онлайн ответы из решебника по химии за 9 класс автора Рябова М.А. Учебное пособие включает в себя готовые задания по двум разделам: «Общая характеристика химических элементов и химических реакций» и «Металлы».
 В каждом разделе издания находятся уже готовые тестовые работы, раскрывающие отдельные пункты темы. В первом разделе раскрыты темы о периодическом законе и периодической системе химических элементов, химических реакциях, катализаторах и катализе, химической организации природы и др.
В каждом разделе издания находятся уже готовые тестовые работы, раскрывающие отдельные пункты темы. В первом разделе раскрыты темы о периодическом законе и периодической системе химических элементов, химических реакциях, катализаторах и катализе, химической организации природы и др.GDZ.me
- Тема: Общая характеристика химических элементов…
характеристика химических элементов и химических реакций» с целью определения уровня знаний учащихся и направления дальнейшей работы учителя над повышением качества знаний учащихся 9 класса по химии в рамках мониторинга достижения планируемых результатов освоения ООП ООО гимназии №10 г.Челябинска. 2.Характеристика структуры и содержание работы Каждый вариант диагностической работы состоит из 15 заданий. Задания№ 1-10 с выбором одного правильного ответа из 4-х предложенных.
www.gimn10.ru
- Химия 9 класс.
 Тесты, тренажеры, контрольные работы
Тесты, тренажеры, контрольные работыХарактерные химические свойства неорганических веществ. В учебных целях использованы цитаты из учебного пособия «Тесты по химии: 9 кл.: к учебнику О. С. Габриеляна «Химия. 9 класс». ФГОС (к новому учебнику) / М. А. Рябов.— М. : Издательство «Экзамен»».
Сборник задач, упражнений и тестов по химии. 8-9 классы. Свердлова Н.Д. (2021, 288с.) Текущий и итоговый контроль по курсу «Химия. 9 класс» Новошинский И.И., Новошинская Н.С. (2013, 192с.) Зачётные работы по химии.
xn--80aneebgncbebxz7l.xn--p1ai
- Контрольная работа №1 по химии 9 класс "Общая…
Контрольная работа №1 «Общая характеристика химических элементов и химических реакций». 9 класс. Вариант 1. 1. Дать характеристику элемента с Z=20 по его положению в ПСХЭ Д.И. Менделеева. Составить генетический ряд этого элемента. Свойства соединений подтвердить уравнениями реакций в молекулярной и ионной форме.
 2. Осуществить цепочку превращений: Si SiO2 Na2SiO3 h3SiO3 Li2SiO3. Охарактеризовать все соединения. Рассмотреть одну реакцию как ОВР. Составить молекулярные и ионные уравнения реакций.
2. Осуществить цепочку превращений: Si SiO2 Na2SiO3 h3SiO3 Li2SiO3. Охарактеризовать все соединения. Рассмотреть одну реакцию как ОВР. Составить молекулярные и ионные уравнения реакций.nsportal.ru
- Тест по химии Химические свойства металлов 9 класс
9. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
13. Методом электронного баланса поставьте коэффициенты в уравнении реакции по схеме
1. Установите соответствие между металлом и его способностью реагировать с кислородом.
Версия формата PDF Тест Химические свойства металлов 9 класс (133 Кб).
testytut.ru
- Контрольные работы. 9 класс. Химия | Учебно-методический…
1. Состав и строение атома элемента № 33. 2. Составить генетический ряд элемента № 6, указать классы веществ, назвать веществ.
 Работа № 1 «Общая характеристика химических элементов и химических реакций».
Работа № 1 «Общая характеристика химических элементов и химических реакций».Данная контрольная работа предназначена для проверки уровня усвоения знаний учащимися за курс «Органическая химия» 9 класс.Задания составлены в форме теста. Тест содержит 16 вопросов с выбором одного …
nsportal.ru
- Контрольная работа по химии “Общая характеристика…”
«Общая характеристика. химических элементов». Подготовила: Унковская Светлана Андреевна. учитель химии МБОУ СОШ №18 г. Ставрополя. г. Ставрополь – 2015. Контрольная работа по химии «Общая характеристика химических элементов», является вводным контролем по химии для учащихся 9-х классов. Она состоит из 2 частей: 1 часть – тест, 15 вопросов с 1 правильным ответом; 2 часть – 5 заданий которые можно оформить в свободной форме (установить соответствие, ОВР, ионное уравнение, цепочка превращений, задача).
www.
 UchMet.ru
UchMet.ru - Тест по химии Классификация химических реакций для 9 класса
Тест включает 10 заданий с выбором ответа. 1. Какая реакция может.
9. Какой металл не может вступать в реакцию замещения с серной кислотой?
Версия формата PDF Тест Классификация химических реакций для 9 класса (129 Кб).
Тест по химии Общая характеристика элементов ПА группы для 9 класса.
testytut.ru
- Тесты по химии. 9 класс. Неметаллы. Обобщение знаний по…
Пособие включает тесты, охватывающие две темы учебника О.С. Габриеляна “Химия. 9 класс”, от неметаллов до обобщения знаний по химии за курс основной школы и подготовки к Основному государственному экзамену. Тесты по предыдущим темам, начинающим курс химии 9 класса “Общая характеристика химических элементов и химических реакций” и “Металлы”, можно найти в другой книге тестов для 9 класса, того же автора.
 Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.
Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.to.alleng.org
- Тест “Металлы, строение и физические свойства” 9 класс скачать
9 класс Тест по теме. «Металлы, строение и физические свойства». Вариант 1. 1. Восстановительные свойства сильнее выражены у металла
г) уменьшается радиус атомов. д) усиливаются металлические свойства. 9 класс Тест по теме. «Металлы, строение и физические свойства». Вариант2. 1. В атоме натрия распределение электронов по электронным слоям. соответствует ряду чисел
uchitelya.com
- Тесты по химии. 9 класс. Общая характеристика химических…
Третьяковская Галерея №3, 2008 Цветок №14, июль 2021 4×4 Club №9-10, сентябрь – октябрь 2021.

cdnpdf.com
- Самостоятельная работа по химии Характеристика химических…
4. Приведите уравнения реакций, с помощью которых можно осуществить следующие превращения: Rb → RbOH → Rb2CО3 → ВаСО3 → СО2 → СаСО3. Ответы на самостоятельную работу по химии Характеристика химических элементов и их соединений по положению в Периодической системе химических элементов Д.И. Менделеева Вариант 1. 1. Si, SiO2 — кислотный оксид, h3SiO3 — кислота, Sih5 — кислотно-основных свойств не проявляет. SiO2 + 2NaOH = Na2SiO3 + Н2O; h3SiO3 + 2NaOH = Na2SiO3 + Н2O.
testschool.ru
- Контрольно-измерительный материал по химии 9 класс
Контрольно-измерительный материал по химии в 9 классе составитель учитель химии Межакова НА учитель МАОУ”СОШ№5 г.Челябинска” контрольные работы разработаны ко всему курсу химии 9 класс к основным темам и разделам с Кодификатором и спецификацией элементов содержания и требований к уровню подготовки обучающихся для проведения контрольных работ по всем основным темам.

znanio.ru
- Тесты по химии (9 класс) с ответами, итоговые и тренировочные
Часть вопросов подкреплена иллюстративным материалом. Для экономии времени к тестам уже даны правильные ответы, которые можно использовать как подсказки. Вопросы можно скачать или просматривать онлайн с любых устройств, имеющихся под рукой. Итоговый тест по химии (9 класс) позволяет быстро и качественно оценить знания данной темы, это отличный помощник для тех, кто хочет подтянуть предмет. Тренировочные задания можно использовать для подготовки к тематической контрольной и итоговой проверке знаний.
obrazovaka.ru
- Рябов М.А. Тесты по химии. 9 класс. Неметаллы. Обобщение…
Пособие включает тесты, охватывающие две темы учебника О.С. Габриеляна “Химия.
 9 класс”, от неметаллов до обобщения знаний по химии за курс основной школы и подготовки к Основному государственному экзамену. Тесты по предыдущим темам, начинающим курс химии 9 класса “Общая характеристика химических элементов и химических реакций” и “Металлы”, можно найти в другой книге тестов для 9 класса, того же автора. Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.
9 класс”, от неметаллов до обобщения знаний по химии за курс основной школы и подготовки к Основному государственному экзамену. Тесты по предыдущим темам, начинающим курс химии 9 класса “Общая характеристика химических элементов и химических реакций” и “Металлы”, можно найти в другой книге тестов для 9 класса, того же автора. Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.www.psyoffice.ru
- Рябов Михаил Алексеевич “Тесты по химии. 9 класс. Общая…”
Пособие включает тесты, охватывающие две темы учебника О.С. Габриеляна "Химия. 9 класс", от неметаллов до обобщения знаний по химии за курс основной школы и подготовки к Основному государственному экзамену. Тесты по предыдущим темам, начинающим курс химии 9 класса "Общая характеристика химических элементов и химических реакций" и "Металлы", можно найти в другой книге тестов для 9 класса, того же автора.

m.market.yandex.ru
На данной странице Вы можете найти лучшие результаты поиска для чтения, скачивания и покупки на интернет сайтах материалов, документов, бумажных и электронных книг и файлов похожих на материал «Тесты по химии, 9 класс, Общая характеристика химических элементов и химических реакций, Металлы, Рябов М.А., 2016»
Для формирования результатов поиска документов использован сервис Яндекс.XML.
Нашлось 18 млн ответов. Показаны первые 32 результата(ов).
Дата генерации страницы:
МИНИСТЕРСТВО СПОРТА И ТУРИЗМА РЕСПУБЛИКИ БЕЛАРУСЬ Учреждение образования “БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ФИЗИЧЕСКОЙ КУЛЬТУРЫ” Институт повышения квалификации и переподготовки руководящих работников и специалистов физической культуры, спорта и туризма Кафедра оздоровительной и адаптивной физической культуры КОНТРОЛЬНАЯ РАБОТА На тему: Общая характеристика химического состава организма. Исполнитель: Змитрук Марина Николаевна Группа № 15 – 01 Руководитель: к. м. н., доцент Кобзев В. Ф. Минск 2015 ОГЛАВЛЕНИЕ ВВЕДЕНИЕ Многим химикам известны крылатые слова, сказанные в 40-х годах текущего столетия немецкими учеными Вальтером и Идой Ноддак, что в каждом булыжнике на мостовой присутствуют все элементы Периодической системы. Вначале эти слова были встречены далеко не с единодушным одобрением. Однако, по мере того как разрабатывались всё более точные методы аналитического определения химических элементов, учёные всё больше убеждались в справедливости этих слов. Если согласиться с тем, что в каждом булыжнике содержатся все элементы, то это должно быть справедливо и для живого организма. Все живые организмы на Земле, в том числе и человек, находятся в тесном контакте с окружающей средой. Жизнь требует постоянного обмена веществ в организме. Поступлению в организм химических элементов способствуют питание и потребляемая вода. Предположения некоторых учёных идут еще дальше. Они считают, что в живом организме не только присутствуют все химические элементы, но каждый из них выполняет определённую биологическую функцию. Вполне возможно, что эта гипотеза не подтвердится. Однако, по мере того как развиваются исследования в данном направлении, выявляется биологическая роль всё большего числа химических элементов. [2] Наука не стоит на месте: она динамически развивается, обогащается новыми знаниями и теориями. И то, что еще вчера было лишь догадкой, теорией, завтра становится научно доказанным фактом. Со временем ученые смогут пролить свет и на такой важный вопрос как биологическая роль конкретного химического элемента в организме человека. ХИМИЧЕСКИЙ СОСТАВ ОРГАНИЗМА ЧЕЛОВЕКА И ОСНОВНЫЕ СОСТАВЛЯЮЩИЕ ЕГО ЭЛЕМЕНТЫ 1. Общая характеристика химического состава организма В различных живых организмах, как было отмечено выше, содержатся почти все известные химические элементы. Правда, одни из них в качестве обязательных обнаруживаются во всех без исключения живых организмах, тогда как другие характерны только для отдельных видов и поэтому в составе живой материи встречаются значительно реже. Любой живой организм в качестве обязательных всегда содержит такие химические элементы, как C, N, H, O, S, P, K, Na, Ca, Mg, Mn, Zn, Fe, Cu, Co. K категории реже встречающихся относятся Mo, B, Cl, I и некоторые другие. Более 70% массы живых организмов приходится на долю воды. Наблюдается взаимное влияние структурированной в организмах воды на свойства ее молекул и молекул растворенных в ней соединений. В отличие от многих других растворителей вода имеет высокую температуру кипения, замерзания и теплоту испарения. Содержание воды в разных тканях существенно различается: в ткани кости, не содержащей костного мозга, на ее долю приходится 22,5 %. Содержание воды снижается также при накоплении жира [5, с. 13]. Известно, что организм человека состоит на 60% из воды, 34% приходится на органические вещества и 6% – на неорганические. Основными компонентами органических веществ являются углерод, водород, кислород, в их состав входят также азот, фосфор и сера. В неорганических веществах организма человека обязательно присутствуют 22 химических элемента: Ca, P, O, Na, Mg, S, B, Cl, K, V, Mn, Fe, Co, Ni, Cu, Zn, Mo, Cr, Si, I, F, Se. Например, если вес человека составляет 70 кг, то в нём содержится (в граммах): кальция – 1700, калия – 250, натрия – 70, магния – 42, железа – 5, цинка – 3. Таблица 1: Химический состав некоторых органов и тканей, % (по Раппопорту С. М.). Орган, ткань Вода Белки Липиды Минеральные вещества Кожа 58 27 14 0,6 Кости 28 20 25 27 Мышцы 70 22 6 1 Жировая ткань 23 6 71 0,2 Печень 71 22 3 1,4 Мозг 75 11 12 1,4 Большинство биомолекул состоят в основном из углерода, кислорода, водорода и азота (таблица 2). Важным компонентом нуклеиновых кислот и других молекул является фосфат; в ионизированной форме он широко представлен в организме человека. Таблица 2: Приблизительный элементный состав организма человека (в процентах к сухому весу). Элемент % Элемент % Углерод 50 Сера 0,8 Кислород 20 Натрий 0,4 Водород 10 Хлор 0,4 Азот 8,5 Магний 0,1 Кальций 4 Железо 0,01 Фосфор 2,5 Марганец 0,001 Калий 1 Йод 0,00005 2. Жизненно необходимые элементы Несомненно, время внесёт коррективы в современные представления о числе и биологической роли определённых химических элементов в организме человека. В данной работе мы исходим из того, что уже достоверно известно. Роль макроэлементов, входящих в состав неорганических веществ, очевидна. Например, основное количество кальция и фосфора входит в кости (гидроксофосфат кальция Ca10(PO4)6(OH)22), а хлор в виде соляной кислоты содержится в желудочном соке. Микроэлементы вошли в отмеченный выше ряд 22 элементов, обязательно присутствующих в организме человека. Примечательно, что большинство из них – металлы, а из металлов больше половины являются d-элементами. Последние в организме образуют координационные соединения со сложными органическими молекулами. Так, установлено, что многие биологические катализаторы – ферменты содержат ионы переходных металлов (d-элементов). Например, известно, что марганец входит в состав 12 различных ферментов, железо – в 70, медь – в 30, а цинк – более чем в 100. Микроэлементы называют жизненно необходимыми, если при их отсутствии или недостатке нарушается нормальная жизнедеятельность организма. Характерным признаком необходимого элемента является колоколообразный вид кривой доза (n) – ответная реакция (R, эффект), что отображено на рисунке: |
Ответы на контрольную работу по теме «Характеристика элемента по его положению в Периодической системе химических элементов Д. И. Менделеева.
 Химические реакции»(Габриелян)
Химические реакции»(Габриелян)Первый уровень
Вариант 1
1. Дано уравнение реакции нейтрализации гидроксида натрия соляной кислотой:
NaOH + НСl = NaCl + Н20 + Q.
Дайте характеристику реакции по следующим признакам:
• число и состав исходных веществ и продуктов реакции;
• тепловой эффект;
• агрегатное состояние веществ;
• участие катализатора;
• изменение степеней окисления элементов;
• направление.
Рассмотрите данную химическую реакцию с точки зрения теории электролитической диссоциации. Запишите полное и сокращенное ионные уравнения.
NaOH + HCl = NaCl + h3O + Q
Исходные вещества: 1 моль гидроксида натрия тв.(1 атом натрия, 1 атом водорода, 1 атом кислорода), 1 моль соляной кислоты ж.(1 атом водорода, 1 атом хлора).
Продукты реакции: 1 моль хлорида натрия тв.(1 атом натрия, 1 атом хлора), 1 моль воды ж.(1 атом кислорода, 2 атом водорода).
Реакция экзотермическая
Исходные вещества и продукты находятся в растрворе.
Без катализатора
Без изменения степеней окисления
Необратимая реакция
Na+ + OH- + H+ + Cl- = Na+ + Cl- + h3O
OH- + H+ = h3O
2. Дайте характеристику химического элемента магния по плану:
• положение элемента в ПСХЭ;
• строение атома;
• формулы оксида и гидроксида, их характер.
Магний — Mg
Порядковый номер Z=12; массовое число А= 24, заряд ядра + 12, число протонов =12, нейтронов( N= A-Z= 12) 24 – 12=12 нейтронов, электронов = 12, период – 3, энергетических уровней – 3,
Строение электронной оболочки: 12 М g 2е; 8е; 2е.
12 М g ) ) )
2 8 2
Степень окисления +2;
Восстановительные свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция, что связано с увеличением радиусов атомов Ве – М g — Са;
Ион магния М g 2+
МgО – оксид магния является основным оксидом и проявляет все характерные свойства оксидов. Магний образует гидроксид Мg(ОН)2, который проявляет все характерные свойства оснований.
3. Напишите уравнения реакций оксида и гидроксида магния с соляной кислотой в молекулярном и ионном виде.
MgO+2HCl=MgCl₂ + H₂O
MgO+2H+=Mg2+ + H₂O
Mg(OН)2+2HCl= MgCl₂ + 2H₂O
Mg(OН)2+2H+= Mg2+ + 2H₂O
Вариант 2
1. Дана схема реакции горения алюминия
Аl + 02 → А1203 + Q.
Составьте уравнение данной реакции, расставив коэффициенты в нем методом электронного баланса. Укажите окислитель и восстановитель.
Дайте характеристику реакции по следующим признакам:
• число и состав исходных веществ и продуктов реакции;
• тепловой эффект;
• агрегатное состояние веществ;
• участие катализатора;
• изменение степеней окисления элементов;
• направление.
0 0 +3 –2
Al + O2 = Al2O3+Q
4Al + 3O2 = 2Al2O3
Алюминий восстановитель, а кислород – окислитель.
Исходные вещества: 4 моль алюминия, 3 моль кислорода (3 молекулы из 2 атомов кислорода). Продукт реакции: 2 моль оксида алюминия (2 атома алюминия, 3 атома кислорода в одной молекуле).
Реакция экзотермическая.
Алюминия – тв., кислород – г., оксид алюминия – тв.
Без участия катализатора
С изменением степеней окисления.
Необратимая.
2. Дайте характеристику химического элемента натрия по плану:
• положение элемента в ПСХЭ;
• строение атома;
• формулы оксида и гидроксида, их характер.
Натрий — Na
Порядковый номер Z=11; массовое число А= 23, заряд ядра + 11, число протонов =11, нейтронов( N= A-Z= 11) 23 – 11=12 нейтронов, электронов = 11, период – 3, энергетических уровней – 3,
Строение электронной оболочки: 11 Na 2е; 8е; 1е.
11 Na ) ) )
2 8 1
Степень окисления +1;
Восстановительные свойства у натрия выражены сильнее, чем у лития, но слабее, чем у калия, что связано с увеличением радиусов атомов;
Ион натрия Na +
Na 2О – оксид натрия является основным оксидом и проявляет все характерные свойства оксидов. Натрий образует гидроксид NaОН (щелочь), который проявляет все характерные свойства оснований.
3. Напишите уравнения реакций оксида и гидроксида натрия с раствором серной кислоты в молекулярном и ионном виде.
2NaOH+h3SO4=2h3O+Na2SO4
2OH-+2H+=2h3O
Na2O+h3SO4=h3O+Na2SO4
Na2O+2H+=h3O+2Na+
Вариант 3
1. Дана схема реакции получения оксида серы (VI) из оксида серы (IV)
S02 + 02 S03 + Q.
Составьте уравнение данной реакции, расставив коэффициенты в нем методом электронного баланса. Укажите окислитель и восстановитель.
Дайте характеристику реакции по следующим признакам:
• число и состав исходных веществ и продуктов реакции;
• тепловой эффект;
• агрегатное состояние веществ;
• участие катализатора;
• изменение степеней окисления элементов;
• направление.
2S+4O2 + O02 = 2S+6O-23+ Q
S+4 -2e →S+6 восстановитель
O02 +4e→2O-2 окислитель
Исходные вещества – 2 моль оксида серы 4 (в одной молекуле 1 атом серы, 2 атома кислорода) и 1 моль кислорода (в одной молекуле 2 атома кислорода).
Продукт реакции – 2 моль оксида серы 6 (в одной молекуле 1 атом серы, 3 атома кислорода)
Реакция экзотермическая.
Оксид серы 4 и кислород – газы, Оксид серы (VI) жидкость
С катализатором
С изменением степеней окисления
Обратимая.
2. Дайте характеристику химического элемента лития по плану:
• положение элемента в Периодической системе;
• строение атома;
• формулы оксида и гидроксида, их характер.
Литий Li
Порядковый номер Z=3; массовое число А= 7, заряд ядра + 3, число протонов =3, нейтронов( N= A-Z= 4) 7 – 3=4 нейтронов, электронов = 3, период – 2, энергетических уровней – 2
Строение электронной оболочки: 3 Li 2е; 1е.
3 Li ) )
2 1
Степень окисления +1;
Восстановительные свойства у лития выражены слабее, чем у натрия и калия, что связано с увеличением радиусов атомов;
Ион лития Li +
Li 2О – оксид лития является основным оксидом и проявляет все характерные свойства оксидов. Литий Li образует гидроксид Li ОН (щелочь), который проявляет все характерные свойства оснований.
3. Напишите уравнения реакций оксида и гидроксида лития с серной кислотой в молекулярном и ионном виде.
2 LiOH+h3SO4=2h3O+ Li2SO4
2OH-+2H+=2h3O
Li 2O+h3SO4=h3O+ Li 2SO4
Li 2O+2H+=h3O+2Li +
Вариант 4
1. Дано уравнение реакции цинка с соляной кислотой:
Zn + 2НСl = ZnCl2 + Н2↑ + Q.
Дайте характеристику реакции по следующим признакам:
• число и состав исходных веществ и продуктов реакции;
• тепловой эффект;
• агрегатное состояние участвующих в реакции веществ;
• участие катализатора;
• изменение степеней окисления химических элементов;
• направление.
Рассмотрите данную химическую реакцию с точки зрения теории электролитической диссоциации: запишите полное и сокращенное ионные уравнения.
2HCl+Zn=ZnCl2+h3↑ + Q
Исходные вещества: 1 моль цинк, 2 моль соляной кислоты (1 атом водорода, 1 атом хлора в молекуле). Продукты реакции: 1 моль хлорида цинка (1 атом цинка, 2 атома хлора в ФЕ), 1 моль водорода (2 атома водорода).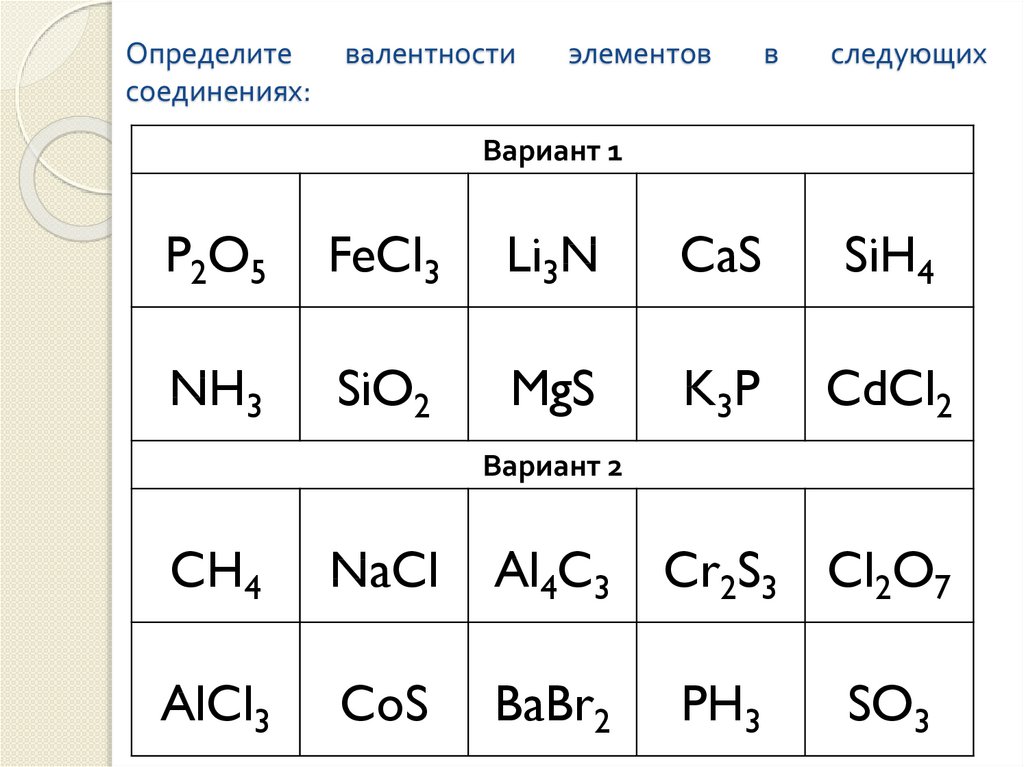
Экзотермическая реакция
Цинк – тв., соляная кислота – ж., хлорид цинка тв. (раствор), водород – г.
Без катализатора
С изменением степеней окисления
Необратимая
2H++2Cl-+Zn0=Zn2++2Cl-+h30
2H++Zn0=Zn2++h30
2. Дайте характеристику химического элемента кальция по плану:
• положение элемента в Периодической системе;
• строение атома;
• формулы высшего оксида и гидроксида, их характер.
Кальций Са
Порядковый номер Z=20; массовое число А= 40, заряд ядра + 20, число протонов =20, нейтронов( N= A-Z= 20) 40 – 20=20 нейтронов, электронов = 20, период – 4, энергетических уровней – 4,
Строение электронной оболочки: 20 М g 2е; 8е; 8е; 2е.
20 Са ) ) ) )
2 8 8 2
Степень окисления +2;
Восстановительные свойства у кальция выражены сильнее, чем у магния, но слабее, чем у стронция, что связано с увеличением радиусов атомов
Ион кальция Са 2+
Са О – оксид кальция является основным оксидом и проявляет все характерные свойства оксидов. Кальций образует гидроксид Са (ОН)2, который проявляет все характерные свойства оснований.
Кальций образует гидроксид Са (ОН)2, который проявляет все характерные свойства оснований.
3. Напишите уравнения реакций оксида и гидроксида кальция с азотной кислотой в молекулярном и ионном виде.
СаO+2HNO3= Са(NO3)₂ + H₂O
СаO+2H+= Са 2+ + H₂O
Са(OН)2+2HNO3= Са(NO3)₂ + 2H₂O
Са(OН)2+2H+= Са 2+ + 2H₂O
Второй уровень
Вариант 1
1. Дано уравнение реакции получения оксида азота (II):
N2 + 02 2NO – Q.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите данную реакцию с точки зрения ОВР. Укажите окислитель и восстановитель.
N20 + O20 2N+2O-2 – Q
N20 – 2*2е = 2N+2 восстановитель
O20+2*2е = 2O-2 окислитель
Исходные вещества: азот 1 моль, 2 атома N, кислород 1 моль (2 атома О).
Продукт реакции: 2 моль оксида азота 2 (в молекуле 1 атом азота и 1 атом кислорода).
Исходные вещества и продукты реакции – газы.
Реакция эндотермическая.
Обратимая.
Без катализатора.
С изменением степеней окисления.
2. Дайте характеристику химического элемента углерода по его положению в Периодической системе.
Углерод С – химический элемент IV группы периодической системы Менделеева: атомный номер 6, атомная масса 12,011.
Порядковый номер Z=6; массовое число А= 12, заряд ядра + 6 число протонов =6, нейтронов( N= A-Z= 6) 12 – 6=6 нейтронов, электронов = 6, период – 2, энергетических уровней – 2,
Строение электронной оболочки: 6 С 2е; 4е
6 С ) )
2 4
Степень окисления +4;
Окислительные свойства у углерода выражены сильнее, чем у бора, но слабее, чем у азота, что связано с увеличением заряда ядра.
СО2 оксид углерода является кислотным оксидом и проявляет все характерные свойства оксидов. Углерод образует кислоту Н2СО3, которая проявляет все характерные свойства кислот.
3. Составьте формулы высшего оксида и гидроксида углерода, укажите их характер. Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
СО2 + Н2О ↔ Н2СО3
СО2 + Н2О ↔ 2Н+ + СО32-
Na2O + CO2 → Na2CO3
Na2O + CO2 → 2Na+ + CO32-
2NaOH + CO2 → Na2CO3 + h3O
OH- + CO2 → CO32- + h3O
Ca(OH)2 + CO2 → CaCO3 ↓+ h3O
Ca2+ +2OH- + CO2 → CaCO3 ↓+ h3O
h3CO3 + Ca = CaCO3 + h3↑
2H+ +CO32- + Ca = CaCO3 ↓+ h3↑
h3CO3 + CaO = CaCO3 ↓+ h3O
2H+ +CO32- + CaO = CaCO3 ↓+ h3O
h3CO3 + 2NaOH = Na2CO3 + 2h3O
2H+ + CO32- + 2Na+ +OH- = 2Na++CO32- + 2h3O
2H+ +OH- = 2h3O
Вариант 2
1. Дано уравнение реакции синтеза аммиака:
N2 + 3Н2 2Nh4 + Q.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите данную реакцию с точки зрения ОВР. Укажите окислитель и восстановитель.
3h3 + N2 2Nh4 + Q
N20 +2*3е→2N-3 окислитель
h30 -2*1е→2H+1 восстановитель
Исходные вещества: 1 моль азота (молекула из 2 атомов азота), 3 моль водорода (молекула из 2 атомов водорода). Продукт реакции – аммиак, 2 моль. Молекула из 1 атома азота и 2 атомов водорода. Исходные вещества продукты реакции – газы.
Исходные вещества продукты реакции – газы.
Реакция:
Экзотермическая.
Окислительно-восстановительная.
Прямая.
Каталитическая.
Обратимая.
2. Дайте характеристику химического элемента серы по его положению в Периодической системе.
Сера – S
Порядковый номер Z=16 и массовое число А= 32, заряд ядра + 16, число протонов =16, нейтронов( N= A-Z= 12) 32 – 16=16 нейтронов, электронов = 16, период – 3, энергетических уровней – 3
16 S ) ) )
Строение электронной оболочки: 16 S 2е; 8е; 6е.
16 S ) ) )
2 8 6
Степень окисления – (-2) и (+ 2; +4; +6)
Окислительные свойства у серы выражены сильнее, чем у селена, но слабее, чем у кислорода, что связано с увеличением радиусов атомов от кислорода к селену
SО 3 – оксид серы является кислотным оксидом и проявляет все характерные свойства оксидов.
Сера образует гидроксид Н2SО4, который проявляет все характерные свойства кислот.
Сера из водородных соединений образует Н2S.
3. Составьте формулы высшего оксида и гидроксида серы, укажите их характер. Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
SO3 + h3O → h3SO4
2NaOH + SO3 → Na2SO4 + h3O
2ОН- + SO3 → SO42- + h3O
Na2O + SO3 → Na2SO4
Na2O + SO3 → 2Na+ +SO42-
Zn0 + h3+1SO4(разб) → Zn+2SO4 + h30↑
Zn0 + 2H+ → Zn2+ + h30↑
CuO + h3SO4 → CuSO4 + h3O
CuO + 2H+ → Cu2+ + h3O
h3SO4 + 2NaOH → Na2SO4 + 2h3O (реакция нейтрализации)
H+ + OH- → h3O
h3SO4 + Cu(OH)2 → CuSO4 + 2h3O
2H+ + Cu(OH)2 → Cu2+ + 2h3O
BaCl2 + h3SO4 → BaSO4↓ + 2HCl
Ba2+ + SO42- → BaSO4↓
MgCO3 + h3SO4 → MgSO4 + h3O + CO2↑
MgCO3 + 2H+ → Mg2+ + h3O + CO2¬↑
Вариант 3
1. Дано уравнение реакции хлорида меди (II) с гидроксидом натрия:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения ТЭД: запишите полное и сокращенное ионные уравнения.
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu2+ + 2OH- = Cu(OH)2↓
Исходные вещества: 1 моль хлорида меди (1 атом меди, 2 атома хлора), 2 моль гидроксида натрия (1 атом натрия, 1 атом кислорода, 1 атом водорода в ФЕ).
Продукты реакции: 1 моль гидроксида меди (1 атом меди, 2 атома кислорода, 2 атома водорода), 2 моль хлорид натрия (1 атом натрия, 1 атом хлора в ФЕ).
Продукты реакции и исходные вещества – твердые растворенные. Cu(OH)2 – твердый осадок.
Реакция:
Экзотермическая
Без изменения степеней окисления
Прямая
Без участия катализатора
Необратимая.
2. Дайте характеристику химического элемента фосфора по его положению в Периодической системе Д. И. Менделеева.
Характеристика Р (фосфор)
Элемент с порядковым №15 находится в 3 периоде 5 группе, главной подгруппы.
Атомная масса=31.Заряд ядра атома Р+15,т. к. в ядре находится 15 протонов. Схема:
15Р 2е)8е)5е)
В ядре атома 16 нейтронов . В атоме 15 электронов, т. к. их число равно числу протонов и порядковому номеру. В атоме фосфора 3 электронных слоя, т. к. Р стоит в 3 периоде. На последнем слое 5 электронов, т. к. фосфор стоит в 5 группе. Последний слой не завершен. Р-неметалл, т. к. в хим. реакции с металлами принимает 3 электрона до завершения слоя. Его оксид Р2О5-кислотный. Он взаимод. с Н2О, основаниями и основными оксидами. Его гидроксид Н3РО4-кислота. Она взаимод. с металлами, стоящими до Н (водорода), с основными оксидами, основаниями.
их число равно числу протонов и порядковому номеру. В атоме фосфора 3 электронных слоя, т. к. Р стоит в 3 периоде. На последнем слое 5 электронов, т. к. фосфор стоит в 5 группе. Последний слой не завершен. Р-неметалл, т. к. в хим. реакции с металлами принимает 3 электрона до завершения слоя. Его оксид Р2О5-кислотный. Он взаимод. с Н2О, основаниями и основными оксидами. Его гидроксид Н3РО4-кислота. Она взаимод. с металлами, стоящими до Н (водорода), с основными оксидами, основаниями.
3. Составьте формулы высшего оксида и гидроксида фосфора, укажите их характер. Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
P2O5 + 3h3O = 2h4PO4
P2O5 + 3h3O = 6H+ +2PO43-
3CaO + P2O5 = Ca3(PO4)2
3Ca(OH)2 + P2O5 = Ca3(PO4)2 + 3h3O.
3Mg + 2h4PO4 = Mg3(PO4)2↓ + 3h3↑
3Mg + 6H++ 2PO43- = Mg3(PO4)2↓ + 3h3↑
2h4PO4+3Na2CO3 = 2Na3PO4 + 3h3O + 3CO2↑
6H++ 3CO3 2-= 3h3O + 3CO2↑
3NaOH + h4PO4 = Na3PO4 + 3h3O
3OH- + 3H+= 3h3O
Вариант 4
1. Дано уравнение реакции карбоната калия с соляной кислотой:
Дано уравнение реакции карбоната калия с соляной кислотой:
К2С03 + 2НСl = 2КСl + С02↑ + Н20.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите данную реакцию с точки зрения ТЭД: запишите полное и сокращенное ионные уравнения.
K2CO3 + 2HCl = 2KCl + h3O + CO2 ↑
2К+ +СО32- + 2Н+ + 2Сl-= 2К+ 2Сl-+ h3O + CO2
СО32- + 2Н+= h3O + CO2
Исходные вещества: 1 моль карбоната калия (2 атома калия, 1 атом углерода, 3 атома кислорода) тв., 2 моль соляной кислоты (в молекуле 1 атом водорода, 1 атом хлора) жидк.
Продукты реакции: 2 моль хлорида калия (в ФЕ 1 атом калия, 1 атом хлора) тв., 1 моль воды (2 тома водорода, 1 атом кислорода) жидк., 1 моль углекислого газа (1 атом углерода, 2 атома кислорода) – газ.
Реакция:
Экзотермическая.
Без изменения степеней окисления.
Прямая.
Без участия катализатора.
Необратимая.
2. Дайте характеристику химического элемента азота по его положению в Периодической системе.
Азот N- неметалл, II период (малый) , V группа, главная подгруппа.
Атомная масса=14, заряд ядра – +7, число энергетических уровней=2
p=7, e=7,n=Ar-p=14-7=7.
Строение электронной оболочки: 7 N 2е; 5е
7 N ) )
2 5
Степень окисления +5;
Окислительные свойства выражены сильнее, чем у углерода, но слабее, чем у кислорода, что связано с увеличением заряда ядра.
N2О5 оксид азота является кислотным оксидом и проявляет все характерные свойства оксидов. Азот образует кислоту НNО3, которая проявляет все характерные свойства кислот.
Летучее водородное соединение – Nh4
3. Составьте формулы высшего оксида и гидроксида азота, укажите их характер.
Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
N2O5 + h3O = 2НNO3
N2O5 + h3O = 2Н+ +NO3-
N2O5 + BaO = Ba(NO3)2
N2O5 + BaO = Ba2+ +2NO3-
N2O5 + 2KOH (р-р) = 2KNO3 + h3O
N2O5 + 2K+ +2OH- = 2K+ +NO32- + h3O
N2O5 + 2OH- = NO32- + h3O
K2O + 2HNO3 → 2KNO3 + h3O
K2O + 2H+ + 2NO3- → 2K+ + 2NO3- + h3O
K2O + 2H+ → 2K+ + h3O
HNO3 + NaOH → NaNO3 + h3O
H+ + NO3- + Na+ + OH- → Na+ + NO3- + h3O
H+ + OH- → h3O
2HNO3 + Na2CO3 → 2NaNO3 + h3O + CO2¬
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3- + h3O + CO2¬
2H+ + СO32- → h3O + CO2¬
S0 + 6HNO3(конц) → h3S+6O4 + 6NO2 + 2h3O
B0 + 3HNO3 → h4B+3O3 + 3NO2
3P0 + 5HNO3 + 2h3O → 5NO + 3h4P+5O4
С разб.
4Zn + 9HNO3 = Nh4 ↑ + 4Zn(NO3)2 + 3h3O
4Zn + 9H+ + 9NO3- = Nh4 ↑ + 4Zn2+ + 8NO3- + 3h3O
3Cu + 8HNO3 = 2NO ↑ + 3Cu(NO3)2+ 4h3O
3Cu + 8H+ +8NO3-= 2NO ↑ + 3Cu2+ +6NO3-+ 4h3O
конц.
Zn + 4HNO3 = 2NO2↑ + 2h3O + Zn(NO3)2
Zn + 4H+ +4NO3-= 2NO2↑ + 2h3O + Zn2+ +2NO3-
Cu + 4HNO3 = 2NO2↑ + 2h3O + Cu(NO3)2
Cu + 4H+ +4NO3- = 2NO2↑ + 2h3O + Cu2+ +2NO3-
Третий уровень
Вариант 1
1. Дано уравнение реакции получения азотной кислоты:
4N02 + 02 + 2Н20 = 4HN03 + Q.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения процессов окисления-восстановления. Укажите окислитель и восстановитель.
4N+4O2 + О02 + 2h3O ↔ 4HN+5O-23
N+4 -1e = N+5 восстановитель
O20 +4e = 2O-2 окислитель
Реакция:
Экзотермическая.
С изменением степени окисления (ОВР).
Без участия катализатора.
Прямая.
Обратимая.
Исходные вещества: 4 моль оксида азота 4 (1 атом азота, 2 атома кислорода в молекуле) – газ, 1 моль кислорода (2 атома кислорода в молекуле) – газ, 2 моль воды (1 атом кислорода, 2 атома водорода в молекуле) – жидк.
Продукт реакции – 4 моль азотной кислоты (1 атом азота, 1 атом водорода, 3 атома кислорода в молекуле) – жидкость.
2. Дайте характеристику химического элемента магния по его положению в Периодической системе.
Магний – порядковый номер в Периодической системе Z = 12 и массовое число А = 24. Заряд ядра +12 (число протонов). Число нейтронов в ядре N = А – Z = 12. Число электронов = 12.
Элемент магний находится в 3-м периоде Периодической системы. Строение электронной оболочки:
12 Mg ) ) )
2 8 2
Степень окисления +2.
Восстановительные свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция (элементы IIА группы), что связано с увеличением радиусов атомов при переходе от Be к Mg и Са.
Оксид магния MgO является основным оксидом и проявляет все типичные свойства основных оксидов. В качестве гидроксида магнию соответствует основание Mg(OH)2, которое проявляет все характерные свойства оснований.
3. Составьте формулы оксида и гидроксида магния, укажите их характер.
Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
Оксид магния MgO – основной оксид, основание Mg(OH)2 проявляет все характерные свойства оснований.
MgO + h3O = Mg(OH)2
MgO + CO2 = MgCO3
MgO + CO2 = Mg2+ +CO32-
MgO + h3SO4 = MgSO4 +h3O
MgO + 2H+ = Mg2+ +h3O
Mg(OH)2 + 2HCl = MgCl2 + 2h3O
Mg(OH)2 + 2H+ = Mg2+ + 2h3O
Mg(OH)2 + CO2 = Mg2+ +CO32- + h3O
3Mg(OH)2 + 2FeCl3 = 2Fe(OH)3 + 3MgCl2
3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3 + 3Mg2+
Mg(OH)2 + 2Nh5Cl = MgCl2 + 2Nh4 + 2h3O
Mg(OH)2 + 2Nh5+= Mg2+ + 2Nh4 + 2h3O
MgSO4 + 2NaOH = Mg(OH)2 + Na2SO4
Mg2+ + 2OH- = Mg(OH)2
Вариант 2
1. Дано уравнение реакции железа с хлором:
2Fe + 3Сl2 = 2FeCl3 + Q.
Дайте характеристику химической реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения процессов окисления-восстановления. Укажите окислитель и восстановитель.
2Fe + 3Cl2 = 2FeCl3 + Q
2
3 Fe – 3e– = Fe+III,
Cl2 + 2e– = 2Cl–I
2Fe – 6e– = 2Fe+III,
3Cl2 + 6e– = 6Cl–I.
Fe – 3e– = Fe+III восстановитель
Cl2 + 2e– = 2Cl–I окислитель
Экзотермическая
ОВР
Прямая
Необратимая
Некаталитическая
Исходные вещества: 2 моль железа – тв., 2 моль хлора (молекула из 2 атомов) – газ
Продукт: 2 моль хлорида железа (из 1 атома железа, 2 атомов хлора в ФЕ) – тв.
2. Дайте характеристику химического элемента натрия по его положению в Периодической системе Д. И. Менделеева.
Натрий — Na
Порядковый номер Z=11; массовое число А= 23, заряд ядра + 11, число протонов =11, нейтронов( N= A-Z= 11) 23 – 11=12 нейтронов, электронов = 11, период – 3, энергетических уровней – 3,
Строение электронной оболочки: 11 Na 2е; 8е; 1е.
11 Na ) ) )
2 8 1
Степень окисления +1;
Восстановительные свойства у натрия выражены сильнее, чем у лития, но слабее, чем у калия, что связано с увеличением радиусов атомов;
Ион натрия Na +
Na 2О – оксид натрия является основным оксидом и проявляет все характерные свойства оксидов. Натрий образует гидроксид NaОН (щелочь), который проявляет все характерные свойства оснований.
Натрий образует гидроксид NaОН (щелочь), который проявляет все характерные свойства оснований.
3. Составьте формулы оксида и гидроксида натрия, укажите их характер. Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
2NaOH+h3SO4=2h3O+Na2SO4
2OH-+2H+=2h3O
2NaOH + CO2 —> Na2CO3 + h3O
2OH(-) + CO2 —> CO3(2-) + h3O
2NaOH + SO2 —> Na2SO3 + h3O
2OH(-) + SO2 —> SO3(2-) + h3O
NaOH+ Al(OH)3 —> Na[Al(OH)4]
OH(-) + Al(OH)3 —> Al(OH)4 (-)
Na2O+h3SO4=h3O+Na2SO4
Na2O+2H+=h3O+2Na+
Na2O + h3O —> 2NaOH
Na2O + h3O —> 2Na+ +2OH-
Na2O + 2HCl —-> 2NaCl + h3O
Na2O + 2H+ —-> 2Na+ + h3O
Na2O + CO2 —> Na2CO3
Na2O + CO2 —> 2Na++CO32-
Na2O + SO2 —> Na2SO3
Na2O + SO2 —> 2Na++SO32-
Вариант 3
1. Дано уравнение реакции разложения нитрата калия:
2KN03 = 2KN02 + О2 – Q.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения процессов окисления-восстановления. Укажите окислитель и восстановитель.
2КNO3 = 2KNO2 + O2- Q
окислитель: N5+ + 2e− = N=3+|2| восстановление
восстановитель: O2− − 4e− = O20 |1| окисление
Исходные вещества: 2 моль нитрата калия (в ФЕ 1 атом калия, 1 атом азота, 3 атома кислорода) – тв.
Продукты реакции – 2 моль нитрита калия (в ФЕ 1 атом калия, 1 атом азота, 2 атома кислорода) – тв., 1 моль кислорода (2 атома кислорода) – газ.
Эндотермическая
ОВР
Прямая
Необратимая
Некаталитическая
2. Дайте характеристику химического элемента углерода по его положению в Периодической системе.
Углерод С – химический элемент IV группы периодической системы Менделеева: атомный номер 6, атомная масса 12,011.
Порядковый номер Z=6; массовое число А= 12, заряд ядра + 6 число протонов =6, нейтронов( N= A-Z= 6) 12 – 6=6 нейтронов, электронов = 6, период – 2, энергетических уровней – 2,
Строение электронной оболочки: 6 С 2е; 4е
6 С ) )
2 4
Степень окисления +4;
Окислительные свойства у углерода выражены сильнее, чем у бора, но слабее, чем у азота, что связано с увеличением заряда ядра.
СО2 кислотный оксид, Н2СО3 кислота.
3. Составьте формулы оксида и гидроксида углерода, укажите их характер.
Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
СО2 оксид углерода является кислотным оксидом и проявляет все характерные свойства оксидов. Углерод образует кислоту Н2СО3, которая проявляет все характерные свойства кислот.
СО2 + Н2О ↔ Н2СО3
СО2 + Н2О ↔ 2Н+ + СО32-
Na2O + CO2 → Na2CO3
Na2O + CO2 → 2Na+ + CO32-
2NaOH + CO2 → Na2CO3 + h3O
OH- + CO2 → CO32- + h3O
Ca(OH)2 + CO2 → CaCO3 ↓+ h3O
Ca2+ +2OH- + CO2 → CaCO3 ↓+ h3O
h3CO3 + Ca = CaCO3 + h3↑
2H+ +CO32- + Ca = CaCO3 ↓+ h3↑
h3CO3 + CaO = CaCO3 ↓+ h3O
2H+ +CO32- + CaO = CaCO3 ↓+ h3O
h3CO3 + 2NaOH = Na2CO3 + 2h3O
2H+ + CO32- + 2Na+ +OH- = 2Na++CO32- + 2h3O
2H+ +OH- = 2h3O
Ca(OH)2 + h3CO3 → CaCO3 ↓+ 2h3O
Ca2+ +2OH- + 2H+ +CO32- → CaCO3 ↓+ 2h3O
Вариант 4
1. Дано уравнение реакции образования гидроксида железа (III):
Дано уравнение реакции образования гидроксида железа (III):
4Fe(OH)2 + 2Н20 + 02 = 4Fe(OH)3.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения процессов окисления-восстановления. Укажите окислитель и восстановитель.
4Fe(OH)2 + O2 + 2h3O = 4Fe(OH)3↓
Fe2+ -1е→ Fe3+ восстановитель
O20 + 4е→ 2O2- окислитель
Исходные вещества: 4 моль гидроксида железа 2 (в ФЕ 1 атом железа, 2 атома кислорода, 2 атома водорода) – тв., 1 моль кислорода (2 атома кислорода) – газ, 2 моль воды (2 атома водорода, 1 атом кислорода в молекуле) – ж.
Продукт реакции – 4 моль гидроксида железа 3 (в ФЕ 1 атом железа, 3 атома кислорода, 3 атома водорода) – тв.
Экзотермическая
ОВР
Прямая
Необратимая
Некаталитическая.
2. Дайте характеристику химического элемента фосфора по его положению в Периодической системе.
Характеристика Р (фосфор)
Элемент с порядковым №15 находится в 3 периоде 5 группе, главной подгруппы.
Атомная масса=31.Заряд ядра атома Р+15,т. к. в ядре находится 15 протонов.
Схема 15Р 2е)8е)5е)
В ядре атома 16 нейтронов . В атоме 15 электронов, т. к. их число равно числу протонов и порядковому номеру. В атоме фосфора 3 электронных слоя, т. к. Р стоит в 3 периоде. На последнем слое 5 электронов, т. к. фосфор стоит в 5 группе. Последний слой не завершен. Р-неметалл, т. к. в хим. реакции с металлами принимает 3 электрона до завершения слоя. Его оксид Р2О5-кислотный. Он взаимод. с Н2О, основаниями и основными оксидами. Его гидроксид Н3РО4-кислота. Она взаимод. с металлами, стоящими до Н (водорода), с основными оксидами, основаниями.
3. Составьте формулы оксида и гидроксида фосфора, укажите их характер.
Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
P2O5 + 3h3O = 2h4PO4
P2O5 + 3h3O = 6H+ +2PO43-
3CaO + P2O5 = Ca3(PO4)2
3Ca(OH)2 + P2O5 = Ca3(PO4)2 + 3h3O.
3Mg + 2h4PO4 = Mg3(PO4)2↓ + 3h3↑
3Mg + 6H++ 2PO43- = Mg3(PO4)2↓ + 3h3↑
2h4PO4+3Na2CO3 = 2Na3PO4 + 3h3O + 3CO2↑
6H++ 3CO3 2-= 3h3O + 3CO2↑
3NaOH + h4PO4 = Na3PO4 + 3h3O
3OH- + 3H+= 3h3O
Страница не найдена — Муниципальное бюджетное общеобразовательное учреждение лицей №5 города Каменск-Шахтинского
Страница не найдена — Муниципальное бюджетное общеобразовательное учреждение лицей №5 города Каменск-ШахтинскогоПерейти к содержимому
По данному адресу ничего не найдено. Попробуйте воспользоваться одной из ссылок ниже или поиском.
Попробуйте воспользоваться одной из ссылок ниже или поиском.
Архивы
Архивы Выберите месяц Май 2022 Март 2022 Январь 2022Рубрики
РубрикиВыберите рубрикуБез рубрикиСтраницы
- #13774 (без названия)
- …
- 01.02.2022
- 01.03.2022
- 01.09.2022
- 01.09.21021
- 01.10.2021
- 01.12.2021
- 02.03.2022
- 02.04.2021
- 02.09.2021
- 02.09.2022
- 02.12.2021
- 03.03.2022
- 03.09.2021
- 03.10.2022
- 03.12.2021
- 04.03.2021
- 04.03.2022
- 04.05.2022
- 04.10.2021
- 05.03.2022
- 05.04.2021
- 05.05.2022
- 05.09.2022
- 05.10.2021
- 06.04.2021
- 06.04.2022
- 06.09.2021
- 06.09.2022
- 06.10.2021
- 06.12.2021
- 07.04.2021
- 07.04.2022
- 07.09.2021
- 07.09.2023
- 07.10.2021
- 07.12.2021
- 08.
 04.2021
04.2021 - 08.04.2022
- 08.09.2021
- 08.09.2022
- 08.10.2021
- 08.12.2021
- 09.02.2022
- 09.03.2021
- 09.03.2022
- 09.04.2021
- 09.09.2021
- 09.09.2022
- 09.12.2021
- 10.02.2022
- 10.03.2021
- 10.03.2022
- 10.09.2021
- 10.12.2021
- 11.02.2022
- 11.03.2021
- 11.03.2022
- 11.04.2022
- 11.05.2021
- 11.05.2022
- 11.10.2021
- 12.03.2021
- 12.04.2021
- 12.04.2022
- 12.05.2021
- 12.05.2022
- 12.09.2022
- 12.10.2021
- 13.01.2022
- 13.04.2021
- 13.04.2022
- 13.05.2021
- 13.05.2022
- 13.09.2021
- 13.09.2022
- 13.12.2021
- 14.01.2022
- 14.02.2022
- 14.03.2022
- 14.04.2021
- 14.04.2022
- 14.09.2021
- 14.09.2022
- 14.10.2021
- 14.12.2021
- 15.02.2022
- 15.03.
 2021
2021 - 15.03.2022
- 15.04.2021
- 15.04.2022
- 15.09.2021
- 15.09.2022
- 15.10.2021
- 15.11.2021
- 15.12.2021
- 16.02.2022
- 16.03.2021
- 16.03.2022
- 16.04.2021
- 16.05.2022
- 16.09.2021
- 16.09.2022
- 16.11.2021
- 16.12.2021
- 17.01.2022
- 17.02.2022
- 17.03.2021
- 17.03.2022
- 17.05.2021
- 17.05.2022
- 17.09.2021
- 17.11.2021
- 17.12.2021
- 18.01.2022
- 18.02.2022
- 18.03.2021
- 18.03.2022
- 18.04.2022
- 18.05.2022
- 18.10.2021
- 18.11.2021
- 19.03.2021
- 19.04.2021
- 19.04.2022
- 19.05.2021
- 19.05.2022
- 19.09.2022
- 19.10.2021
- 19.11.2021
- 20.01.2022
- 20.04.2021
- 20.04.2022
- 20.05.2021
- 20.05.2022
- 20.09.2021
- 20.09.2022
- 20.10.2020
- 20.
 12.2021
12.2021 - 21.01.2022
- 21.02.2022
- 21.03.2022
- 21.04.2021
- 21.04.2022
- 21.05.2021
- 21.09.2021
- 21.09.2022
- 21.10.2021
- 21.12.2021
- 22.02.2022
- 22.03.2021
- 22.03.2022
- 22.04.2021
- 22.04.2022
- 22.09.2021
- 22.09.2022
- 22.10.2021
- 22.11.2021
- 22.12.2021
- 23.03.2021
- 23.03.2022
- 23.04.2021
- 23.05.2022
- 23.09.2021
- 23.09.2022
- 23.11.2021
- 23.12.2021
- 24.01.2022
- 24.02.2022
- 24.03.2022
- 24.05.2021
- 24.05.2022
- 24.09.2021
- 24.11.2021
- 24.12.2021
- 25.01.2022
- 25.02.2022
- 25.03.2022
- 25.04.2022
- 25.05.2021
- 25.05.2022
- 25.10.2021
- 25.11.2021
- 26.01.2022
- 26.04.2021
- 26.04.2022
- 26.09.2022
- 26.10.2021
- 26.11.
 2021
2021 - 27.01.2022
- 27.04.2021
- 27.04.2022
- 27.09.2021
- 27.09.2022
- 27.10.2021
- 27.12.2021
- 28.01.2022
- 28.02.2022
- 28.04.2021
- 28.04.2022
- 28.09.2021
- 28.09.2022
- 28.10.2021
- 28.12.2021
- 29.04.2021
- 29.04.2022
- 29.09.2021
- 29.09.2022
- 29.10.2021
- 29.11.2021
- 29.12.2021
- 30.04.2021
- 30.09.2021
- 30.09.2022
- 30.11.2021
- 30.12.2021
- 31.01.2022
- ASDFGH
- FHJKLKDGHJK
- food
- ugoihkh
- Адаптированные рабочие программы для обучающихся с ОВЗ 2018-2019
- Адаптированные рабочие программы для обучающихся с ОВЗ 2020-2021 уч.г.
- Анкета получателя образовательных услуг
- Аннотации к РП НОО 2018-2019
- Аннотации к РП НОО 2019-2020
- Аннотации к РП НОО 2020-2021
- Аннотации к РП НОО 2021-2022
- Аннотации к РП ООО 2018-2019
- Аннотации к РП ООО 2019-2020
- Аннотации к РП ООО 2020-2021
- Аннотации к РП ООО 2021-2022
- Аннотации к РП СОО 2018-2019
- Аннотации к РП СОО 2019-2020
- Аннотации к РП СОО 2020-2021
- Аннотации к РП СОО 2021-2022
- Антикоррупционное просвещение граждан
- Антитеррор
- Архив рабочих программ
- Аттестация педагогических работников
- Безопасность
- Безопасность на каникулах
- Безопасный путь в школу
- Бесплатная юридическая помощь
- Бесплатное горячее питание для 1-4 классов
- В помощь родителям
- ВcОШ
- Вакантные места для приема (перевода)
- Взаимодействие с образовательной организацией
- Взаимодействие участников ОП с организацией по телефону
- Взаимодействие участников ОП с организацией по электронной почте
- Взаимодействие участников ОП с организацией(личный прием)
- Возможность внесения предложений
- Воспитываем вместе
- ВПР
- Вход
- ВшСОКО
- Выбор модуля ОРКСЭ
- ГИА
- Главная
- Горячее питание для 1-4 классы
- Горячие линии
- Гражданско-патриотическое воспитание
- Детские безопасные сайты
- Директор школы
- Дистанционное обучение
- Для вас, ребята
- Для Вас, родители!
- Для выпускников 11 классов
- Для выпускников 9 классов
- Доклад омбудсмена
- Документы ПФХД
- Документы школы
- Дополнительное образование
- Достижения
- Достижения педагогов
- Доступная среда
- Занятия «Разговоры о важном»
- Здоровое питание
- Здоровое питание
- Инклюзивное образование
- Инклюзия.
 Документы
Документы - Инновационная деятельность
- Интерактивная карта потенциально опасных мест для отдыха детей
- Информационные памятки в период дистанционного обучения
- Информация и отчёты
- Информация о наличие диетического меню в образовательной организации
- Информация о приеме в 1 класс
- Информация о результатах рассмотрения обращений
- Информация о численности обучающихся
- Итоговое собеседование по русскому языку
- Итоговое сочинение
- Кабинет психолога
- Как успешно сдать ГИА
- Каталог сайтов
- Классное руководство
- Комиссия по соблюдению требований к служебному поведению и урегулированию конфликта интересов
- Контакты
- Куда обратиться?
- Личный прием граждан
- Локальные акты
- Льготное питание
- Материалы базовой площадки
- Материально-техническое обеспечение и оснащенность образовательного процесса
- Медалисты
- Медицинский кабинет
- Международное сотрудничество
- Меню
- Мероприятия ГИА
- Мероприятия ГИА архив
- Мероприятия по борьбе с наркоманией
- Мероприятия по гражданско-патриотическому воспитанию
- Мероприятия по правовому воспитанию
- Мероприятия по профилактике экстремизма
- Мероприятия по профориентация
- Мероприятия пришкольный лагерь
- Методическая служба
- Методические материалы
- Методические материалы
- Методические рекомендации
- Методические рекомендации
- Методические рекомендации педагогам
- МО учителей
- Молодому гражданину
- Муниципальный порядок обеспечения питанием обучающихся
- Навстречу нормам ГТО
- Начало 2020-2021 учебного года
- Нормативные документы
- Нормативные документы
- Нормативные документы ФГОС
- Нормативные правовые и иные акты в сфере противодействия коррупции
- О библиотеке
- О доступе к информационным системам и информационно-телекомуникацонным сетям
- О методических и об иных документах, разработанных образовательной организацией для обеспечения образовательного процесса
- О правильном питании
- О средствах обучения и воспитания
- Об использовании при реализации образовательных программ электронного обучения и дистанционных образовательных технологий
- Об объектах для проведения практических занятий
- Об объектах спорта
- Об противодействии коррупции
- Об условиях охраны здоровья обучающихся
- Об условиях питания обучающихся
- Образование
- Образовательные стандарты
- Обратная связь для сообщения о фактах коррупции
- Обращение граждан госуслуги
- Обращение граждан.

- Олимпиады и ЕГЭ.
- Омбудсмен
- Опрос
- Организация образовательного процесса в условиях распространения новой коронавирусной инфекции
- ОРКСЭ
- Основные сведения
- Ответственность родителей
- Отдел образования г.Каменск-Шахтинский
- Отзывы об ОО
- Охрана здоровья
- Охрана здоровья
- Охрана прав детства
- Памятки по охране здоровья
- Памятки по профилактике экстремизма
- Паспорт безопасности
- ПДД
- Педагоги
- Перечень юридических лиц, оказывающих услуги по питанию
- ПЕРСОНАЛЬНЫЙ СОСТАВ ПЕДАГОГИЧЕСКИХ РАБОТНИКОВ.
- Письменные обращения
- Платные образовательные услуги
- Поддержка семей, имеющих детей
- Полезное видео
- Права и обязанности
- Правила внутреннего распорядка для обучающихся
- Правовое воспитание
- Правовое воспитание
- Правоустанавливающие документы
- Предметные недели
- Предписания и отчеты
- Президентские спортивные игры.
 Президентские состязания.
Президентские состязания. - Прием в школу
- Присмотр и уход за детьми
- Пришкольный лагерь
- Программа производственного контроля МБОУ лицея 5
- Программа развития
- Проект «Навигатор детства»
- Проект «Навигатор детства»
- Противодействие коррупции
- Профилактика экстремизма
- Профилактические прививки
- Профориентация
- Публикации педагогов
- Рабочие программы внеурочной деятельности начального общего образования 2018-2019
- Рабочие программы внеурочной деятельности начального общего образования 2019-2020
- Рабочие программы внеурочной деятельности начального общего образования 2020-2021
- Рабочие программы внеурочной деятельности начального общего образования 2021-2022
- Рабочие программы внеурочной деятельности основного общего образования 2018-2019
- Рабочие программы внеурочной деятельности основного общего образования 2019-2020
- Рабочие программы внеурочной деятельности основного общего образования 2020-2021
- Рабочие программы внеурочной деятельности основного общего образования 2021-2022
- Рабочие программы внеурочной деятельности среднего общего образования 2019-2020
- Рабочие программы внеурочной деятельности среднего общего образования 2020-2021
- Рабочие программы внеурочной деятельности среднего общего образования 2021-2022
- Рабочие программы по предметам начального общего образования 2018-2019
- Рабочие программы по предметам начального общего образования 2019-2020
- Рабочие программы по предметам начального общего образования 2020-2021
- Рабочие программы по предметам начального общего образования 2021-2022 учебного года
- Рабочие программы по предметам основного общего образования 2018-2019
- Рабочие программы по предметам основного общего образования 2019-2020
- Рабочие программы по предметам основного общего образования 2020-2021
- Рабочие программы по предметам основного общего образования 2021-2022
- Рабочие программы по предметам среднего общего образования 2018-2019
- Рабочие программы по предметам среднего общего образования 2019-2020
- Рабочие программы по предметам среднего общего образования 2020-2021
- Рабочие программы по предметам среднего общего образования 2021-2022
- Расписание внеурочной деятельности
- Расписание уроков
- Регистрация
- Редактировать профиль
- Режим работы
- Результаты
- Результаты самообследования
- Результаты спецоценки условий труда
- Результаты учебно-воспитательной работы
- Родительский контроль
- Руководитель образовательной организации.
 Заместители руководителя образовательной организации.
Заместители руководителя образовательной организации. - Руководство. Педагогический состав.
- Сайты для подготовки к экзамену.
- Сайты педагогов
- Система воспитательной работы
- Служба школьной медиации
- Современная школа
- Спорт
- Стипендии и иные виды материальной поддержки
- Структура и органы управления образовательной организацией
- Сценарный отдел
- Традиционные мероприятия
- Трудоустройство выпускников
- Условия для получения образования обучающимися с ограниченными возможностями здоровья и детьми-инвалидами.
- Условия охраны здоровья обучающихся
- Успех каждого ребенка
- Участие в конкурсах
- Учитель будущего
- Федеральные документы
- Финансово-хозяйственная деятельность
- Форма для обращения
- Форма обратной связи
- Формы документов, связанных с противодействием коррупции, для заполнения
- Фотоальбом «Из жизни столовой»
- Фотоальбомы
- Фотографии пищеблоков
- Цифровая школа
- Часто задаваемые вопросы родителей по питанию и ответы на них
- Что такое энтеровирусная инфекция
- Школьная библиотека
- Школьная форма
- Школьное видео
- Школьный автобус
- Школьный музей
- Школьный наркопост
- Школьный сайт
- Школьный спортивный клуб «Атлет»
- Школьный театр «Школьные ступеньки»
- Школьный форум
- Электронная приемная
- Электронные адреса педагогов
- Электронные образовательные ресурсы
- Электронный дневник
- ЭОР
- ЮИД в действии!
- Юридическая консультация
химический элемент | Определение, происхождение, распространение и факты
химический элемент
Посмотреть все СМИ
- Ключевые люди:
- Лотар Мейер Антуан Лавуазье Дмитрий Менделеев Луи Бернар Гайтон де Морво Джозеф Лошмидт
- Похожие темы:
- редкоземельный элемент изотоп переходный металл периодическая таблица водород
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
химический элемент , также называемый элемент , любое вещество, которое не может быть разложено на более простые вещества с помощью обычных химических процессов. Элементы — это основные материалы, из которых состоит вся материя.
Элементы — это основные материалы, из которых состоит вся материя.
В этой статье рассматривается происхождение элементов и их изобилие во Вселенной. Подробно рассмотрено геохимическое распространение этих элементарных веществ в земной коре и недрах, их нахождение в гидросфере и атмосфере. В статье также рассматривается периодический закон и основанное на нем табличное расположение элементов. Для получения подробной информации о соединениях элементов, см. химическое соединение.
Редакторы Британской энциклопедии
Общие наблюдения
В настоящее время известно 118 химических элементов. Около 20% из них не существуют в природе (или присутствуют лишь в следовых количествах) и известны только потому, что получены синтетическим путем в лаборатории. Из известных элементов 11 (водород, азот, кислород, фтор, хлор и шесть инертных газов) являются газами при обычных условиях, два (бром и ртуть) являются жидкостями (еще два, цезий и галлий, плавятся при температуре около или около выше комнатной температуры), а остальные – твердые вещества. Элементы могут соединяться друг с другом, образуя широкий спектр более сложных веществ, называемых соединениями. Количество возможных соединений почти бесконечно; известно, возможно, миллион, и каждый день открываются новые. Когда два или более элемента объединяются, образуя соединение, они теряют свою самостоятельную идентичность, и продукт приобретает характеристики, совершенно отличные от характеристик составляющих его элементов. Газообразные элементы водород и кислород, например, с совершенно разными свойствами, могут соединяться, образуя сложную воду, свойства которой совершенно отличаются от кислорода или водорода. Вода явно не является элементом, потому что она состоит из двух веществ, водорода и кислорода, и может быть химически разложена на них; эти два вещества, однако, являются элементами, потому что они не могут быть разложены на более простые вещества ни одним известным химическим процессом. Большинство образцов природного вещества представляют собой физические смеси соединений.
Элементы могут соединяться друг с другом, образуя широкий спектр более сложных веществ, называемых соединениями. Количество возможных соединений почти бесконечно; известно, возможно, миллион, и каждый день открываются новые. Когда два или более элемента объединяются, образуя соединение, они теряют свою самостоятельную идентичность, и продукт приобретает характеристики, совершенно отличные от характеристик составляющих его элементов. Газообразные элементы водород и кислород, например, с совершенно разными свойствами, могут соединяться, образуя сложную воду, свойства которой совершенно отличаются от кислорода или водорода. Вода явно не является элементом, потому что она состоит из двух веществ, водорода и кислорода, и может быть химически разложена на них; эти два вещества, однако, являются элементами, потому что они не могут быть разложены на более простые вещества ни одним известным химическим процессом. Большинство образцов природного вещества представляют собой физические смеси соединений. Морская вода, например, представляет собой смесь воды и большого количества других соединений, наиболее распространенным из которых является хлорид натрия, или поваренная соль. Смеси отличаются от соединений тем, что их можно разделить на составные части с помощью физических процессов; например, простой процесс испарения отделяет воду от других соединений в морской воде.
Морская вода, например, представляет собой смесь воды и большого количества других соединений, наиболее распространенным из которых является хлорид натрия, или поваренная соль. Смеси отличаются от соединений тем, что их можно разделить на составные части с помощью физических процессов; например, простой процесс испарения отделяет воду от других соединений в морской воде.
Историческое развитие концепции элемента
Современная концепция элемента недвусмысленна, поскольку она зависит от использования химических и физических процессов в качестве средства различения элементов из соединений и смесей. Однако существование фундаментальных субстанций, из которых состоит вся материя, было основой многих теоретических предположений с самого начала истории. Древнегреческие философы Фалес, Анаксимен и Гераклит предполагали, что вся материя состоит из одного существенного начала — или элемента. Фалес считал, что этим элементом является вода; Анаксимен предложил воздух; и Гераклит, огонь. Другой греческий философ, Эмпедокл, высказывал другое мнение, что все вещества состоят из четырех элементов: воздуха, земли, огня и воды. Аристотель соглашался и подчеркивал, что эти четыре элемента являются носителями основных свойств: сухость и тепло связаны с огнем, тепло и влага с воздухом, влага и холод с водой, холод и сухость с землей. В мышлении этих философов предполагалось, что все остальные субстанции представляют собой комбинации четырех элементов, а свойства субстанций отражали их составы элементов. Таким образом, греческая мысль заключала в себе идею о том, что вся материя может быть понята с точки зрения элементарных качеств; в этом смысле сами элементы мыслились как нематериальные. Греческое понятие элемента, которое было принято почти 2000 лет, содержало только один аспект современного определения, а именно, что элементы обладают характерными свойствами.
Другой греческий философ, Эмпедокл, высказывал другое мнение, что все вещества состоят из четырех элементов: воздуха, земли, огня и воды. Аристотель соглашался и подчеркивал, что эти четыре элемента являются носителями основных свойств: сухость и тепло связаны с огнем, тепло и влага с воздухом, влага и холод с водой, холод и сухость с землей. В мышлении этих философов предполагалось, что все остальные субстанции представляют собой комбинации четырех элементов, а свойства субстанций отражали их составы элементов. Таким образом, греческая мысль заключала в себе идею о том, что вся материя может быть понята с точки зрения элементарных качеств; в этом смысле сами элементы мыслились как нематериальные. Греческое понятие элемента, которое было принято почти 2000 лет, содержало только один аспект современного определения, а именно, что элементы обладают характерными свойствами.
Викторина “Британника”
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
В конце Средневековья, когда алхимики стали более изощренными в своих знаниях о химических процессах, греческие представления о составе материи стали менее удовлетворительными. Дополнительные свойства элементов были введены для учета вновь открытых химических превращений. Таким образом, сера стала представлять качество горючести, ртуть — летучести или текучести, а соль — устойчивости к огню (или негорючести). Эти три алхимических элемента или принципа также представляли собой абстракции свойств, отражающие природу материи, а не физических субстанций.
В конце концов была понята важная разница между смесью и химическим соединением, и в 1661 году английский химик Роберт Бойль признал фундаментальную природу химического элемента. Он утверждал, что четыре греческих элемента не могут быть настоящими химическими элементами, потому что они не могут соединяться с образованием других веществ и не могут быть извлечены из других веществ. Бойль подчеркивал физическую природу элементов и связывал их с соединениями, которые они образовывали современным оперативным путем.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
В 1789 году французский химик Антуан-Лоран Лавуазье опубликовал то, что можно считать первым списком элементарных веществ, основанным на определении Бойля. Список элементов Лавуазье был составлен на основе тщательного количественного изучения реакций разложения и рекомбинации. Поскольку он не мог разработать опыты по разложению некоторых веществ или их образованию из известных элементов, Лавуазье включил в свой список элементов такие вещества, как известь, оксид алюминия и кремнезем, которые теперь известны как очень устойчивые соединения. На то, что Лавуазье все еще сохранил определенное влияние древнегреческой концепции элементов, указывает его включение света и тепла (калорийных) в число элементов.
Семь веществ, признанных сегодня элементами — золото, серебро, медь, железо, свинец, олово и ртуть — были известны древним, потому что они встречаются в природе в относительно чистом виде.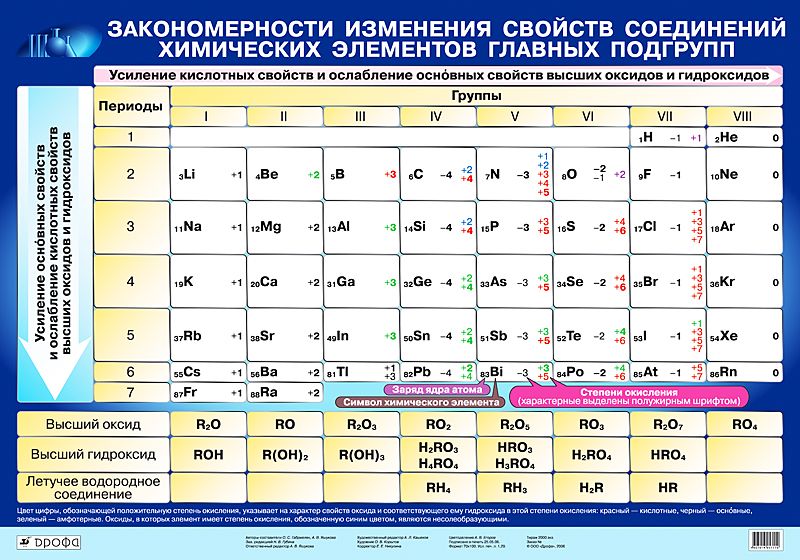 Они упоминаются в Библии и в раннем индуистском медицинском трактате Чарака-самхита . Шестнадцать других элементов были открыты во второй половине 18 века, когда стали лучше понятны методы отделения элементов от их соединений. Еще восемьдесят два последовали за введением методов количественного анализа.
Они упоминаются в Библии и в раннем индуистском медицинском трактате Чарака-самхита . Шестнадцать других элементов были открыты во второй половине 18 века, когда стали лучше понятны методы отделения элементов от их соединений. Еще восемьдесят два последовали за введением методов количественного анализа.
1.4: Классификация и свойства вещества
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 85134
- Элизабет Гордон
- Университет Фурмана
Цели обучения
- Использовать физические и химические свойства, включая фазовые, для описания вещества.
- Различать физические и химические изменения.

- Идентифицируйте образец вещества как элемент, соединение или смесь (гомогенную/гетерогенную).
- Знать физические методы разделения смесей.
Физические и химические свойства
Свойства, которые химики используют для описания вещества, делятся на две основные категории. Физические свойства – это характеристики, которые описывают материю. К ним относятся такие характеристики, как размер, форма, цвет и масса. Многие из этих свойств могут носить количественный характер. Например, количественными физическими свойствами воды будут температура кипения (100°C/212°F) и температура плавления (0°C/32°F).
Рисунок \(\PageIndex{1}\): Физические свойства. (Авторское право; https://www.slideshare.net/cfoltz/ph…cal-properties)
Химические свойства – это характеристики, которые описывают, как материя изменяет свою химическую структуру или состав. Примером химического свойства является воспламеняемость — способность материала гореть, — поскольку горение (также известное как горение) изменяет химический состав материала. Окисление, ржавление, разложение и инертность также являются химическими свойствами. Нажмите на это видео и запишите физические и химические свойства элемента натрия.
Окисление, ржавление, разложение и инертность также являются химическими свойствами. Нажмите на это видео и запишите физические и химические свойства элемента натрия.
Элементы и соединения
Любой образец вещества, имеющий одинаковые физические и химические свойства во всем образце, называется веществом. Существует два типа веществ. Вещество, которое нельзя разложить на химически более простые компоненты, называется элементом. Алюминий, который используется в банках с газировкой, является элементом. Вещество, которое можно разложить на химически более простые компоненты (поскольку оно состоит из более чем одного элемента), называется соединением (рис. \(\PageIndex{1}\)). Вода представляет собой соединение, состоящее из элементов водорода и кислорода. На сегодняшний день в известной Вселенной насчитывается 118 элементов. Напротив, на сегодняшний день ученые идентифицировали десятки миллионов различных соединений.
Иногда слово чистое добавляется к веществу, но это не обязательно. По определению, любое отдельное вещество является чистым.
Наименьшая часть элемента, сохраняющая идентичность этого элемента, называется атомом. Атомы чрезвычайно малы; чтобы сделать линию длиной 1 дюйм, вам потребуется 217 миллионов атомов железа. Наименьшая часть соединения, сохраняющая идентичность этого соединения, называется молекулой. Молекулы состоят из атомов, которые соединены вместе и ведут себя как единое целое. Ученые обычно работают с миллионами и миллионами атомов и молекул одновременно. Когда ученый работает с большим количеством атомов или молекул одновременно, он изучает макроскопическую картину Вселенной.
Ученые обычно работают с миллионами и миллионами атомов и молекул одновременно. Когда ученый работает с большим количеством атомов или молекул одновременно, он изучает макроскопическую картину Вселенной.
Рисунок \(\PageIndex{4}\): Оценка элементов, молекул и соединений.
Неорганические и органические соединения
Соединения могут быть дополнительно классифицированы как неорганические или органические. Органические соединения содержат углерод, водород и обычно еще один элемент из правой части таблицы Менделеева. Будьте осторожны, думая об органических химикатах. В реальном мире термин «органический» обычно используется для описания продуктов, которые имеют натуральные ингредиенты. В мире науки слово «органический» используется для обозначения соединений, которые имеют углеродные и водородные связи. Посмотрите на некоторые из приведенных ниже структур, чтобы получить представление об органических химических структурах.
Органические структуры
Две молекулы, показанные ниже, широко используются в фармацевтической промышленности. Соединение слева известно как гидрокодон. Это опиоидное болеутоляющее, вызывающее сильную зависимость. Его регулярно назначают при хирургической и хронической боли. Соединение справа — Adderall. Этот препарат используется для лечения СДВГ и нарколепсии. Оба эти лекарства контролируются DEA (Агентством по борьбе с наркотиками), и их хранение является незаконным, если у вас нет действительного рецепта.
Соединение слева известно как гидрокодон. Это опиоидное болеутоляющее, вызывающее сильную зависимость. Его регулярно назначают при хирургической и хронической боли. Соединение справа — Adderall. Этот препарат используется для лечения СДВГ и нарколепсии. Оба эти лекарства контролируются DEA (Агентством по борьбе с наркотиками), и их хранение является незаконным, если у вас нет действительного рецепта.
Смеси
Материал, состоящий из двух или более веществ, представляет собой смесь. В смеси отдельные вещества сохраняют свою химическую идентичность. Многие смеси представляют собой очевидные комбинации двух или более веществ, например смесь песка и воды. Такие смеси называются гетерогенными смесями . В некоторых смесях компоненты настолько тесно связаны, что действуют как единое вещество (хотя это и не так). Смеси с постоянным составом на всем протяжении называются гомогенные смеси (или растворы ). Сахар, растворенный в воде, является примером раствора. Металлический сплав, такой как сталь, является примером твердого раствора. Воздух, смесь в основном азота и кислорода, представляет собой газообразный раствор.
Смеси с постоянным составом на всем протяжении называются гомогенные смеси (или растворы ). Сахар, растворенный в воде, является примером раствора. Металлический сплав, такой как сталь, является примером твердого раствора. Воздух, смесь в основном азота и кислорода, представляет собой газообразный раствор.
Упражнение \(\PageIndex{1}\)
Как бы химик классифицировал каждый образец вещества?
- морская вода
- почва
- вода
- кислород
Раствор
- Соленая вода действует так, как если бы она была одним веществом, даже если она содержит два вещества — соль и воду. Соленая вода представляет собой однородную смесь или раствор.
- Почва состоит из мелких кусочков различных материалов, поэтому представляет собой неоднородную смесь.
- Вода — это вещество; более конкретно, поскольку вода состоит из водорода и кислорода, она является соединением.

- Кислород, вещество, является элементом.
Упражнение \(\PageIndex{2}\)
Как бы химик классифицировал каждый образец материи?
- кофе
- водород
- яйцо
- Ответить на
Кофе может быть гетерогенной или гомогенной смесью. Если нерастворимые части могут быть идентифицированы, то это будет классифицироваться как гетерогенное. Если нет, то кофе был бы однородной смесью или раствором.
- Ответ б
Водород является элементом. Его можно найти в периодической таблице.
- Ответ c
Яйцо (предположим, сырое) будет гетерогенной смесью. Желток и яичный белок — это два разных вещества, которые легко увидеть.
Фазы
Другой способ классификации вещества состоит в описании его как твердого, жидкого или газообразного, что и было сделано в примерах растворов. Эти три описания, каждое из которых подразумевает, что материя обладает определенными физическими свойствами, представляют собой три фазы материи. Твердое тело имеет определенную форму и определенный объем. Жидкости обычно имеют определенный объем, но не определенную форму; они принимают форму своих контейнеров. Газы не имеют ни определенной формы, ни определенного объема, и они расширяются, чтобы заполнить свои сосуды. Мы сталкиваемся с материей в каждой фазе каждый день; на самом деле мы регулярно встречаемся с водой во всех трех фазах: лед (твердое тело), вода (жидкость) и пар (газ).
Эти три описания, каждое из которых подразумевает, что материя обладает определенными физическими свойствами, представляют собой три фазы материи. Твердое тело имеет определенную форму и определенный объем. Жидкости обычно имеют определенный объем, но не определенную форму; они принимают форму своих контейнеров. Газы не имеют ни определенной формы, ни определенного объема, и они расширяются, чтобы заполнить свои сосуды. Мы сталкиваемся с материей в каждой фазе каждый день; на самом деле мы регулярно встречаемся с водой во всех трех фазах: лед (твердое тело), вода (жидкость) и пар (газ).
Из нашего опыта с водой мы знаем, что вещества могут переходить из одной фазы в другую при правильных условиях. Как правило, изменение температуры вещества (и, реже, давления на него) может вызвать фазовый переход — физический процесс, при котором вещество переходит из одной фазы в другую (рис. \(\PageIndex{3}\) ). Изменения фаз имеют определенные имена в зависимости от того, какие фазы задействованы, как показано в таблице \(\PageIndex{1}\).
\(\PageIndex{3}\) ). Изменения фаз имеют определенные имена в зависимости от того, какие фазы задействованы, как показано в таблице \(\PageIndex{1}\).
| Смена | Имя |
|---|---|
| из твердого в жидкое | плавка, сплав |
| твердое тело в газообразное | сублимация |
| из жидкости в газ | кипение, испарение |
| из жидкого в твердое | затвердевание, замораживание |
| газ в жидкость | конденсат |
| из газа в твердое | показания |
Рисунок \(\PageIndex{6}\): Классификация материи.
 Вещество можно классифицировать по-разному, в зависимости от его свойств. (Cc BY-NC-SA; анонимно)
Вещество можно классифицировать по-разному, в зависимости от его свойств. (Cc BY-NC-SA; анонимно)Упражнение \(\PageIndex{3}\)
- Классифицируйте каждый элемент как элемент, соединение, гетерогенную смесь или гомогенную смесь (раствор): воздух в Университете Фурмана, вода озера Фурман , медный провод и водопроводная вода «Фурман».
- В чем разница между гетерогенной смесью и гомогенной смесью? Приведите пример каждого.
- Физические изменения: сжигание топлива, переваривание пищи, растворение соли в воде, медь, проводящая электричество, и кипение воды.
- Ответить на
Будем надеяться, что воздух Фурмана представляет собой гомогенную смесь (раствор). Если в этом месте нет горения или скопления пыли, это можно с уверенностью предположить. Озеро Фурман определенно представляет собой неоднородную смесь (в некоторых местах оно может быть немного заболочено). Медная проволока является элементом.
 В природе очень мало элементов. Наконец, водопроводная вода Furman обычно представляет собой однородную смесь. В нашей водопроводной воде содержатся природные и искусственные химические вещества (поверьте мне, вам нужен хлор). В наших туалетах используется грязная вода, которая может выглядеть неоднородной (подойдет для канализации, но не для питья).
В природе очень мало элементов. Наконец, водопроводная вода Furman обычно представляет собой однородную смесь. В нашей водопроводной воде содержатся природные и искусственные химические вещества (поверьте мне, вам нужен хлор). В наших туалетах используется грязная вода, которая может выглядеть неоднородной (подойдет для канализации, но не для питья).- Ответ б
Неоднородная смесь, очевидно, представляет собой смесь, например, грязь; однородная смесь ведет себя как одно вещество, например соленая вода.
- Ответ c
Физические изменения: растворение соли в воде, медная проводка и кипение воды. Если состав не меняется, то это физическое изменение. Если есть метод физического разделения компонентов (например, кипячение, выпаривание, дистилляция, магнетизм или фильтрация), то физическое изменение произошло.
Авторы и авторство
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Элизабет Гордон
- Лицензия
- СС BY-NC-SA
- Показать страницу TOC
- нет на странице
- Теги

Селен (Se) – Химические свойства, воздействие на здоровье и окружающую среду
- Домашняя
- Периодическая таблица
- Элементы
- Selenium
Еще из «Элементов» Актиний Алюминий 30003Americium Argon Arsenic Astatine Gold Boron Barium Beryllium Bohrium Bismuth Berkelium Bromine Carbon Calcium Cadmium Cerium Калифорний Хлор Кюрий Кобальт Хром Цезий Медь Дубний Darmstadtium Dysprosium Erbium Einsteinium Europium Fluorine Iron Fermium Francium Gallium Gadolinium Germanium Hydrogen Helium Hafnium Mercury Гольмий Хассий Йод Индий Иридий Калий Криптон Lanthanum Lithium Lawrencium Lutetium Mendelevium Magnesium Manganese Molybdenum Meitnerium Nitrogen Sodium Niobium Neodymium Neon Nickel Nobelium Нептуний Кислород Осмий Фосфор Протактиний Свинец Palladium Promethium Polonium Praseodymium Platinum Plutonium Radium Rubidium Rhenium Rutherfordium Roentgenium Rhodium Radon Ruthenium Sulfur Antimony Scandium Сиборгий Кремний Самарий Олово Стронций Тантал Тербий Технеций Теллур Торий Хлор – Информация об элементе, свойства и применениеПерейти к основному содержанию У вас не включен JavaScript. Переехать в Аргон >
Символ показывает противогаз. Это связано с тем, что хлор является токсичным газом и использовался в качестве химического оружия. Хлор имеет желто-зеленый цвет, как и изображение. Желто-зеленый плотный газ с удушливым запахом. Хлор убивает бактерии – это дезинфицирующее средство. Используется для обработки питьевой воды и воды в плавательных бассейнах. Он также используется для производства сотен потребительских товаров, от бумаги до красок и от текстиля до инсектицидов. Около 20% производимого хлора используется для производства ПВХ. Это очень универсальный пластик, используемый в оконных рамах, салонах автомобилей, изоляции электропроводки, водопроводных трубах, мешках для крови и виниловых напольных покрытиях. Еще одним важным применением хлора является органическая химия. Он используется в качестве окислителя и в реакциях замещения. В прошлом хлор обычно использовался для производства хлороформа (анестезирующее средство) и четыреххлористого углерода (растворитель для химической чистки). Тем не менее, оба этих химических вещества в настоящее время строго контролируются, поскольку они могут вызвать повреждение печени. Газообразный хлор сам по себе очень ядовит и использовался в качестве химического оружия во время Первой мировой войны. Ион хлорида необходим для жизни. Он в основном присутствует в клеточной жидкости в виде отрицательного иона, чтобы уравновесить положительные ионы (в основном калий). Он также присутствует во внеклеточной жидкости (например, в крови) для уравновешивания положительных ионов (в основном натрия). Большую часть необходимого нам хлорида мы получаем из соли. Типичное ежедневное потребление соли составляет около 6 граммов, но мы могли бы справиться с половиной этого количества. Хлор не встречается в природе в чистом виде. Галит (хлорид натрия или «поваренная соль») является основным минералом, из которого добывают хлор. Хлорид натрия — это хорошо растворимая соль, которая попала в океаны за время существования Земли. Несколько соляных пластов или «озёр» найдены там, где испарились древние моря, и их можно добывать для получения хлорида. Хлор также содержится в минералах карналлите (хлорид магния калия) и сильвите (хлорид калия). Ежегодно в результате электролиза рассола (раствора хлорида натрия) производится 40 миллионов тонн газообразного хлора. Этот процесс также производит полезный гидроксид натрия. Элементы и история периодической таблицы Соляная кислота (HCl) была известна алхимикам. Сам газообразный элемент был впервые получен в 1774 году Карлом Вильгельмом Шееле в Уппсале, Швеция, путем нагревания соляной кислоты с минералом пиролюзитом, который представляет собой природный диоксид марганца, MnO 9.1030 2 . Хамфри Дэви исследовал его в 1807 году и в конце концов пришел к выводу, что это не только простое вещество, но и настоящий элемент. Он объявил об этом в 1810 году, и все же некоторым химикам потребовалось еще десять лет, чтобы наконец признать, что хлор действительно является элементом.
Нажмите здесь, чтобы посмотреть видео о хлоре Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии. Изображения и видео Visual Elements
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г. TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954. Использование и свойства John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd, New York, 2nd. 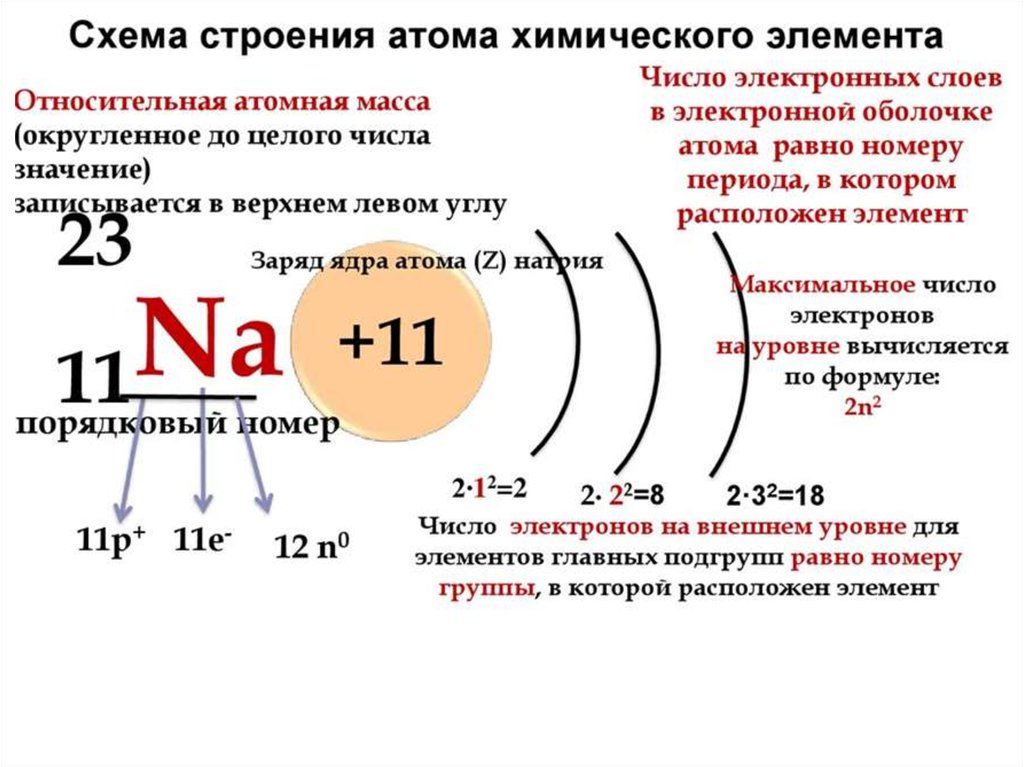 Издание 2011 г. Издание 2011 г. Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г. Периодическая таблица видео, по состоянию на декабрь 2014 г. Данные о рисках снабжения Частично получены из материалов, предоставленных Британской геологической службой © NERC. Исторический текст Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017. Podccasts , созданные The Nake Scients Scientists. . Периодическая таблица видео Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета. Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов. Исследуйте все элементы
Диспрозий – информация об элементе, свойства и использованиеПерейти к основному содержанию У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта. Перейти к гольмию >
Изображение представляет собой стилизованное изображение ядерного реактора, отражающее использование элемента в стержнях управления реактором. Яркий серебристый металлический элемент. В чистом виде мало используется, так как легко вступает в реакцию с водой и воздухом. Диспрозий в основном используется в сплавах для магнитов на основе неодима. Это связано с тем, что он устойчив к размагничиванию при высоких температурах. Это свойство важно для магнитов, используемых в двигателях или генераторах. Эти магниты используются в ветряных турбинах и электромобилях, поэтому спрос на диспрозий быстро растет. Иодид диспрозия используется в газоразрядных галогенных лампах. Соль позволяет лампам излучать очень интенсивный белый свет. Кермет из оксида диспрозия и никеля (композитный материал из керамики и металла) используется в стержнях управления ядерными реакторами. Биологическая роль диспрозия неизвестна. Обладает низкой токсичностью. Как и многие другие лантаноиды, диспрозий содержится в минералах монаците и бастнезите. Он также содержится в меньших количествах в некоторых других минералах, таких как ксенотим и фергусонит. Может быть извлечен из этих минералов путем ионного обмена и экстракции растворителем. Его также можно получить восстановлением трифторида диспрозия металлическим кальцием. Элементы и история периодической таблицы Диспрозий был открыт в 1886 году Полем-Эмилем Лекоком де Буабодраном в Париже. Его открытие произошло в результате исследования оксида иттрия, впервые проведенного в 1794 году, из которого впоследствии должны были быть извлечены другие редкоземельные элементы (также известные как лантаноиды), а именно эрбий в 1843 году, затем гольмий в 1878 году и, наконец, диспрозий. Чистые образцы диспрозия не были доступны до тех пор, пока Фрэнк Спеддинг и его коллеги из Университета штата Айова примерно в 1950 году не разработали метод ионообменной хроматографии. С тех пор стало возможным надежно и эффективно разделять редкоземельные элементы, хотя этот метод разделения в настоящее время заменен технологией обмена жидкость-жидкость.
Нажмите здесь, чтобы посмотреть видео о диспрозиуме Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии. Изображения и видео Visual Elements
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г. TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954. Использование и свойства John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd, New York, 2nd. Издание 2011 г. Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г. Периодическая таблица видео, по состоянию на декабрь 2014 г. Данные о рисках снабжения Частично получены из материалов, предоставленных Британской геологической службой © NERC.  Исторический текст Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017. Podccasts , созданные The Nake Scients Scientists. . Периодическая таблица видео Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета. Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов. Исследуйте все элементы
Типы химических опасностей и методы борьбы с ними Промышленное развитие и растущий спрос на разнообразные товары и услуги для удовлетворения растущих прихотей и потребностей человечества привели к тому, что химические вещества стали использоваться во многих продуктах и процессах. Химическая опасность в основном обусловлена характеристиками химических веществ, которые могут вызывать взрывы, пожары или коррозию; или испускают ядовитые газы или мини-частицы. Часто химические вещества отрицательно реагируют на контакт с другими материалами или химическими веществами или смешиваются с ними. Например, частицы асбеста обычно рассеиваются в атмосфере при перемещении. Пути воздействия химических веществХотя использование химических веществ в процессах, производстве и товарах приносит пользу людям во многих отношениях, эти химические вещества также являются причиной химической опасности. Существует несколько путей химического воздействия, как описано ниже. Биология человека допускает попадание химических и других токсичных веществ в организм различными путями. Наиболее распространенным является вдыхание, когда в атмосфере присутствуют вредные газы. Другой – через прямой контакт кожи с опасным веществом. Введение опасного химического или зараженного вещества возможно, если сотрудники работают в лабораториях или медицинских учреждениях, имея дело с зараженными иглами и другими инфекционными материалами. Проглатывание является четвертым методом, но это менее распространенная форма воздействия на рабочем месте. Типы химических опасностей на рабочем месте На рабочем месте существует несколько типов химических опасностей. Хотя существует несколько классификаций этих химических опасностей, многие из этих опасных химических веществ подпадают под эти 9 классификаций. Удушающие средстваХимические удушающие средства лишают организм кислорода; прерывание переноса и использования кислорода кровотоком. Примеры удушающих химических веществ : Угарный газ и цианид.
Коррозионные веществаХимические коррозионные вещества вызывают видимые и/или необратимые изменения в составе материала вследствие прямого контакта. Точно так же они также могут вызывать локальную реакцию в организме человека в месте контакта. Однако коррозионно-активные химические вещества также могут вызывать системное химическое воздействие вдали от точки контакта при смешивании с другими веществами. Коррозионно-активные химические вещества Примеры : Серная кислота и гидроксид натрия. Раздражители Опасные химические вещества, которые классифицируются как раздражители, причиняют вред глазам, коже или дыхательным путям человека. Раздражители хорошо, умеренно или слабо растворимы в воде. Химические вещества, вызывающие раздражение Примеры : хлорид никеля и хромовая кислота. Сенсибилизаторы Сенсибилизаторы также известны как аллергены, что означает, что они вызывают аллергическую реакцию у людей, подвергающихся постоянному воздействию определенных химических веществ. Реакции на химические вещества, считающиеся сенсибилизаторами, варьируются от человека к человеку и могут быть как острыми, так и хроническими. Химическое воздействие может проявиться в виде отека дыхательных путей или развиться в опасные заболевания, такие как заболевания легких. Вызывающие аллергены Химические примеры : Хлор и щелочи. КанцерогеныКанцерогены – химические вещества, вызывающие рак, и достаточно небольшого количества такого химического вещества, чтобы нанести серьезный вред здоровью человека. Опасность таких химических веществ проявится только через много лет после воздействия. Известно более 200 канцерогенов для человека. Химический канцероген Примеры : Бензол, кадмий, формальдегид и винилхлорид. МутагеныХимические вещества, классифицируемые как мутагены, вызывают генетические изменения ДНК и РНК клетки. Генетические изменения могут вызывать рак, препятствовать нормальным биологическим функциям или могут привести к нарушению работы определенного органа. Химический мутаген Примеры: Бензол, ионизирующее излучение и перекись водорода.
ТератогеныХимические тератогены могут нарушать нормальное развитие плода, вызывая врожденные дефекты и даже нормальное течение беременности. Химические тератогены Примеры : Талидомид, ионизирующее излучение и органические соединения ртути. РеактивныйХимические вещества, которые вызывают химическую опасность, такую как взрыв, при смешивании или соединении с другими химическими или нехимическими веществами, такими как вода или воздух. Реактивные химические вещества Примеры : Азотная кислота, пероксид бензоила и силан. ЛегковоспламеняющиесяМногие химические вещества характеризуются как легковоспламеняющиеся, поскольку они могут легко гореть или воспламеняться при контакте с кислородом. Горючие химические вещества Примеры : Метанол, ацетон, пропан и бутан.
Полный список химических веществ на рабочем месте и связанных с ними опасностей см. Управление химическими опасностями на рабочем местеУправление по охране труда (OSHA) рекомендует работодателям защищать сотрудников на рабочем месте от химических опасностей. Используя стратегию Иерархии контроля, разработанную Национальным институтом безопасности и гигиены труда (NIOSH), рекомендации от наиболее эффективных до наименее эффективных способов контроля химических опасностей следующие: В дополнение к внедрению иерархии средств контроля работодатели также могут извлечь выгоду из соблюдения руководящих принципов OSHA по допустимым пределам воздействия (PEL) для воздействия химических опасностей на работников. NIOSH предоставил рекомендуемые пределы воздействия (REL), в то время как Американская конференция государственных специалистов по промышленной гигиене (ACGIH) дает рекомендации в виде порогового предельного значения (TLV) и индексов биологического воздействия (BEI). Подробнее здесь. OSHA также рекомендует сообщать об опасностях в форме маркировки контейнеров, размещения знаков безопасности, использования пиктограмм и разработки паспортов безопасности. Стандарт информирования об опасностях OSHA помогает работодателям и работникам лучше понять химические опасности на рабочем месте, а также определить и внедрить методы минимизации и контроля химических опасностей на рабочем месте. Онлайн-курсы обучения химическим опасностямОбучение является важным аспектом обеспечения безопасности работников при работе с химическими опасностями. Мы предлагаем ряд учебных курсов по технике безопасности, которые могут помочь работодателям защитить своих работников во время выполнения ими рабочих задач, связанных с опасными химическими и другими веществами. Ниже приведены несколько онлайн-курсов по технике безопасности, посвященных безопасности опасных химических веществ или включающих подробные уроки по опасным химическим веществам. Эти курсы отвечают на такие вопросы, как типы химических опасностей, как свести к минимуму воздействие и риск химических опасностей, а также протоколы безопасности на рабочем месте при работе с рядом опасных химических веществ и опасных материалов в соответствии с темой учебного курса. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 9 класс
9 класс ..
..
 9 класс. Общие свойства металлов – Боровских…
9 класс. Общие свойства металлов – Боровских…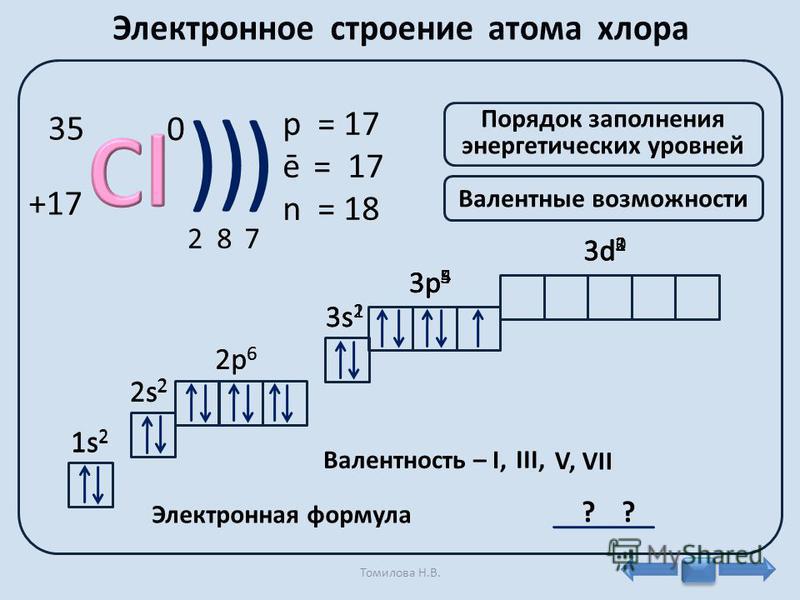

 ..
.. Подготовка к Основному государственному экзамену” можно найти в другой книге тестов по химии, изданной в издательстве “Экзамен”, того же автора. Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.
Подготовка к Основному государственному экзамену” можно найти в другой книге тестов по химии, изданной в издательстве “Экзамен”, того же автора. Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.
 В каждом разделе издания находятся уже готовые тестовые работы, раскрывающие отдельные пункты темы. В первом разделе раскрыты темы о периодическом законе и периодической системе химических элементов, химических реакциях, катализаторах и катализе, химической организации природы и др.
В каждом разделе издания находятся уже готовые тестовые работы, раскрывающие отдельные пункты темы. В первом разделе раскрыты темы о периодическом законе и периодической системе химических элементов, химических реакциях, катализаторах и катализе, химической организации природы и др. Тесты, тренажеры, контрольные работы
Тесты, тренажеры, контрольные работы 2. Осуществить цепочку превращений: Si SiO2 Na2SiO3 h3SiO3 Li2SiO3. Охарактеризовать все соединения. Рассмотреть одну реакцию как ОВР. Составить молекулярные и ионные уравнения реакций.
2. Осуществить цепочку превращений: Si SiO2 Na2SiO3 h3SiO3 Li2SiO3. Охарактеризовать все соединения. Рассмотреть одну реакцию как ОВР. Составить молекулярные и ионные уравнения реакций. Работа № 1 «Общая характеристика химических элементов и химических реакций».
Работа № 1 «Общая характеристика химических элементов и химических реакций». UchMet.ru
UchMet.ru Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.
Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.

 9 класс”, от неметаллов до обобщения знаний по химии за курс основной школы и подготовки к Основному государственному экзамену. Тесты по предыдущим темам, начинающим курс химии 9 класса “Общая характеристика химических элементов и химических реакций” и “Металлы”, можно найти в другой книге тестов для 9 класса, того же автора. Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.
9 класс”, от неметаллов до обобщения знаний по химии за курс основной школы и подготовки к Основному государственному экзамену. Тесты по предыдущим темам, начинающим курс химии 9 класса “Общая характеристика химических элементов и химических реакций” и “Металлы”, можно найти в другой книге тестов для 9 класса, того же автора. Тесты являются необходимым дополнением к школьному учебнику О.С. Габриеляна “Химия.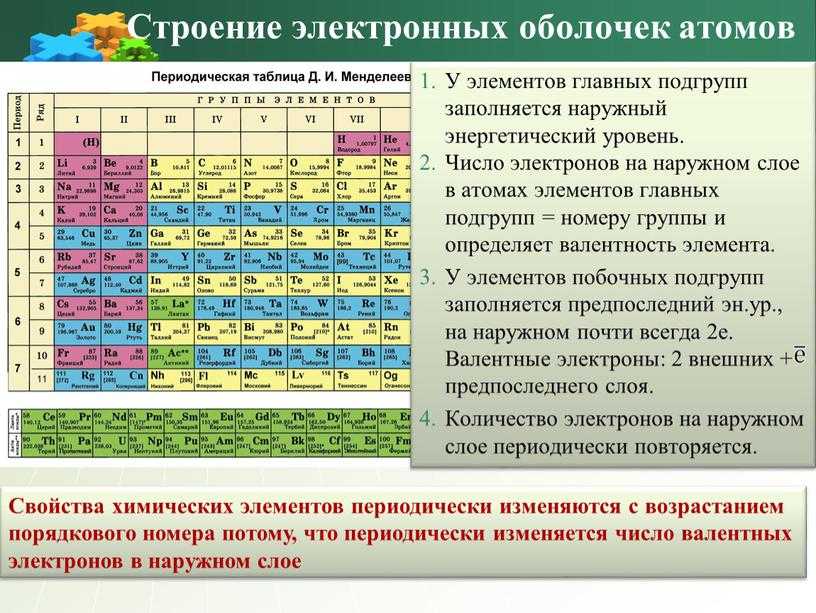
 Основные макро- и микроэлементы, входящие в состав организма.
Основные макро- и микроэлементы, входящие в состав организма. В соответствии с рекомендацией диетологической комиссии Национальной академии США ежедневное поступление химических элементов с пищей должно находиться на определённом уровне. Столько же химических элементов должно ежесуточно выводиться из организма, поскольку их содержания находятся в относительном постоянстве.
В соответствии с рекомендацией диетологической комиссии Национальной академии США ежедневное поступление химических элементов с пищей должно находиться на определённом уровне. Столько же химических элементов должно ежесуточно выводиться из организма, поскольку их содержания находятся в относительном постоянстве. Ведь свойства многих из них на данном этапе научного развития остаются нераскрытыми.
Ведь свойства многих из них на данном этапе научного развития остаются нераскрытыми. Эти свойства воды обусловлены полярной структурой ее молекул и возникающими между ними водородными связями. В воде каждые 3-4 соседние молекулы объединяются друг с другом водородными связями. Продолжительность жизни этих связей весьма незначительна, они постоянно и быстро возникают и распадаются, что определяет жидкостные свойства воды [3, с. 14].
Эти свойства воды обусловлены полярной структурой ее молекул и возникающими между ними водородными связями. В воде каждые 3-4 соседние молекулы объединяются друг с другом водородными связями. Продолжительность жизни этих связей весьма незначительна, они постоянно и быстро возникают и распадаются, что определяет жидкостные свойства воды [3, с. 14]. Учёные договорились, что если массовая доля элемента в организме превышает 10-2 %, то его следует считать макроэлементом. Доля микроэлементов в организме составляет 10-3 – 10-5 %. Если содержание элемента ниже 10-5 %, его считают ультрамикроэлементом. Конечно, такая градация условна. По ней магний попадает в промежуточную область между макро- и микроэлементами [2].
Учёные договорились, что если массовая доля элемента в организме превышает 10-2 %, то его следует считать макроэлементом. Доля микроэлементов в организме составляет 10-3 – 10-5 %. Если содержание элемента ниже 10-5 %, его считают ультрамикроэлементом. Конечно, такая градация условна. По ней магний попадает в промежуточную область между макро- и микроэлементами [2]. Ключевую роль в многочисленных биологических процессах играет кальций; этот вопрос находится в центре внимания многих современных исследований [5, с. 12].
Ключевую роль в многочисленных биологических процессах играет кальций; этот вопрос находится в центре внимания многих современных исследований [5, с. 12].
 04.2021
04.2021 2021
2021 12.2021
12.2021 2021
2021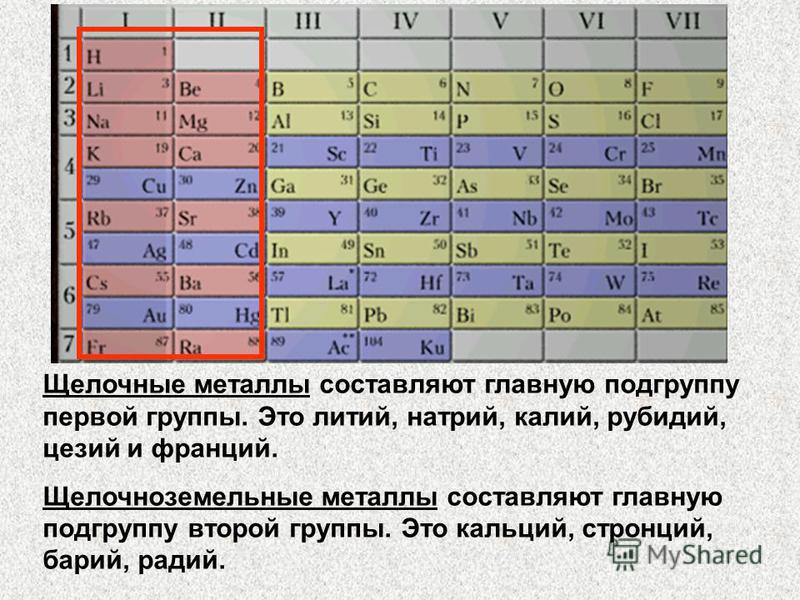 Документы
Документы
 Президентские состязания.
Президентские состязания. Заместители руководителя образовательной организации.
Заместители руководителя образовательной организации.

 В природе очень мало элементов. Наконец, водопроводная вода Furman обычно представляет собой однородную смесь. В нашей водопроводной воде содержатся природные и искусственные химические вещества (поверьте мне, вам нужен хлор). В наших туалетах используется грязная вода, которая может выглядеть неоднородной (подойдет для канализации, но не для питья).
В природе очень мало элементов. Наконец, водопроводная вода Furman обычно представляет собой однородную смесь. В нашей водопроводной воде содержатся природные и искусственные химические вещества (поверьте мне, вам нужен хлор). В наших туалетах используется грязная вода, которая может выглядеть неоднородной (подойдет для канализации, но не для питья).
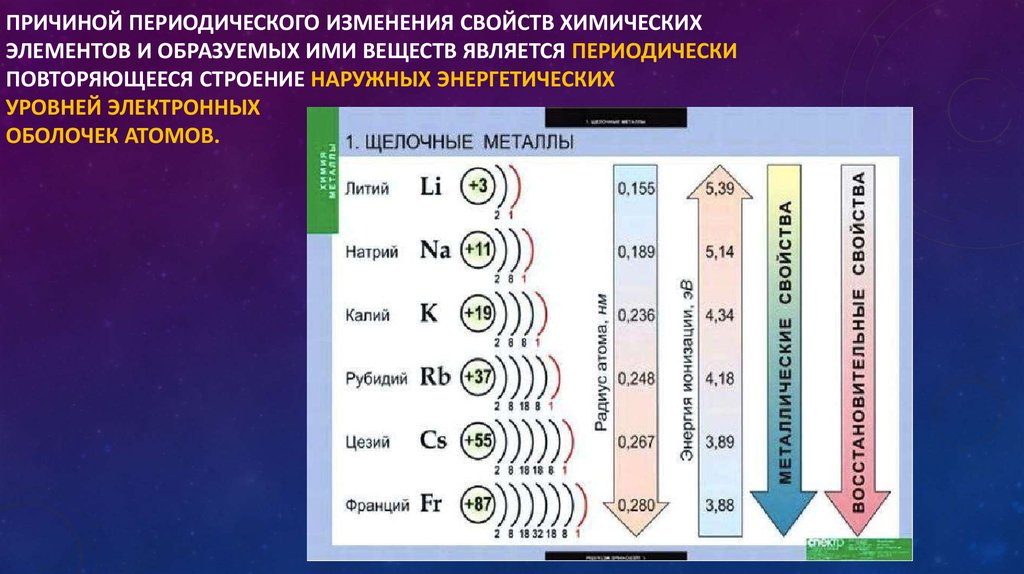 моль -1
моль -1 
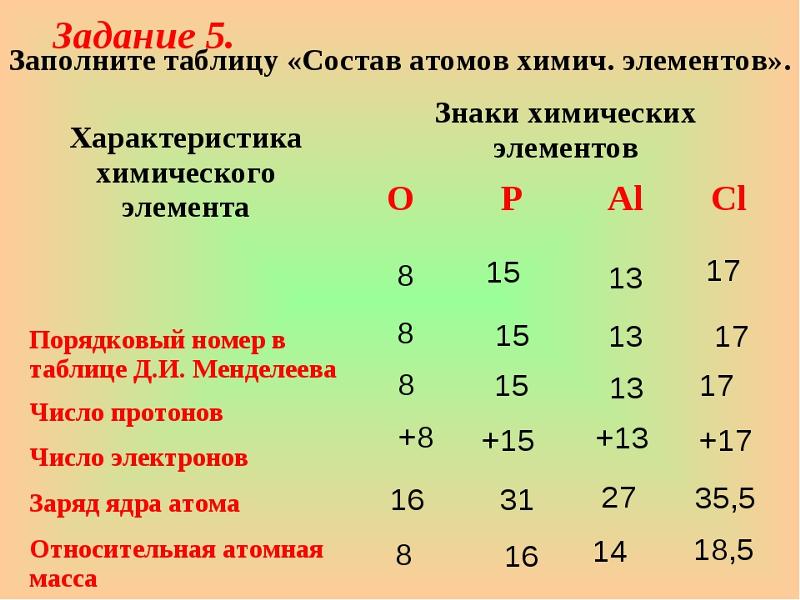
 В своей естественной форме селен не может быть создан или уничтожен, но селен обладает способностью изменять форму.
В своей естественной форме селен не может быть создан или уничтожен, но селен обладает способностью изменять форму.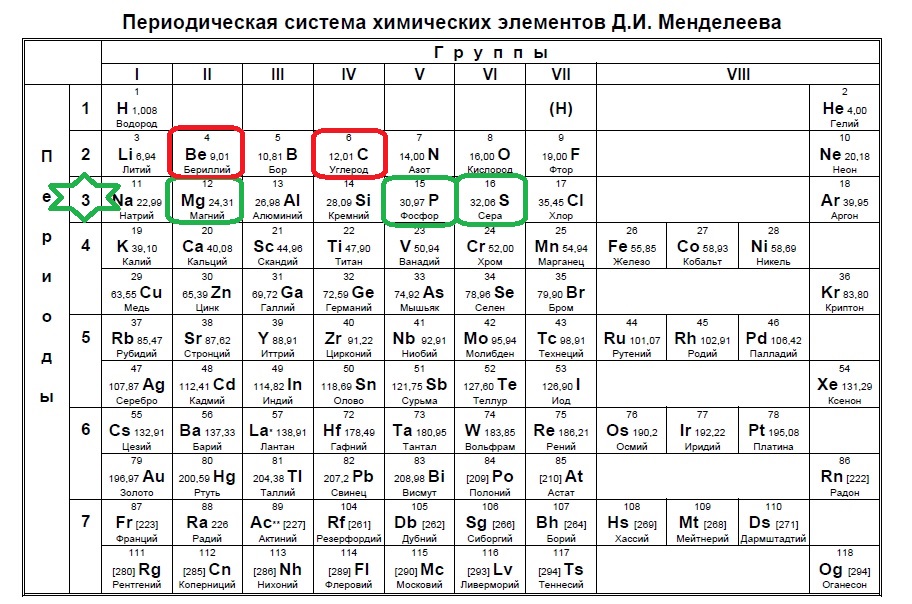 Другими словами, эти факторы определяют его подвижность.
Другими словами, эти факторы определяют его подвижность.
 Когда воздействие чрезвычайно велико, может возникнуть скопление жидкости в легких и бронхит.
Когда воздействие чрезвычайно велико, может возникнуть скопление жидкости в легких и бронхит. Селен вызывает раздражение глаз и верхних дыхательных путей, а также сенсибилизатор. Чрезмерное воздействие может привести к окрашиванию ногтей, зубов и волос в красный цвет. Диоксид селена реагирует с влагой с образованием селенистой кислоты, которая вызывает разъедание кожи и глаз. Канцерогенность. Международное агентство по изучению рака (IARC) отнесло селен к группе 3 (вещество не поддается классификации в отношении его канцерогенности для человека).
Селен вызывает раздражение глаз и верхних дыхательных путей, а также сенсибилизатор. Чрезмерное воздействие может привести к окрашиванию ногтей, зубов и волос в красный цвет. Диоксид селена реагирует с влагой с образованием селенистой кислоты, которая вызывает разъедание кожи и глаз. Канцерогенность. Международное агентство по изучению рака (IARC) отнесло селен к группе 3 (вещество не поддается классификации в отношении его канцерогенности для человека).
 Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
 85% фармацевтических препаратов используют хлор или его соединения на каком-либо этапе своего производства.
85% фармацевтических препаратов используют хлор или его соединения на каком-либо этапе своего производства.
 Выделился плотный зеленовато-желтый газ, который, по его словам, имел запах удушья и растворялся в воде с образованием кислого раствора. Он отметил, что лакмусовая бумага обесцвечивается, а листья и цветы обесцвечиваются.
Выделился плотный зеленовато-желтый газ, который, по его словам, имел запах удушья и растворялся в воде с образованием кислого раствора. Он отметил, что лакмусовая бумага обесцвечивается, а листья и цветы обесцвечиваются. 16
16 608
608 966
966 1
1


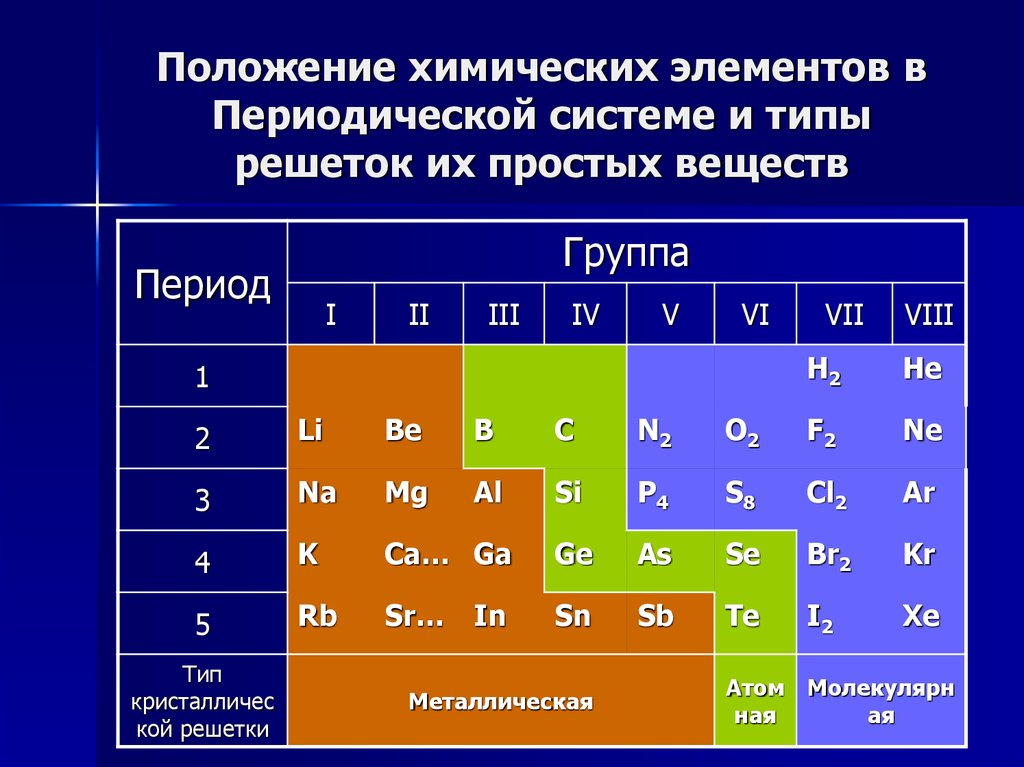
 Впервые он был использован против солдат союзников в битве при Ипре во время Первой мировой войны. Хотя его быстро заменили более смертоносными фосгеном и горчичным газом, газообразный хлор использовался в качестве оружия еще в 2007 году в Ираке во время второй войны в Персидском заливе.
Впервые он был использован против солдат союзников в битве при Ипре во время Первой мировой войны. Хотя его быстро заменили более смертоносными фосгеном и горчичным газом, газообразный хлор использовался в качестве оружия еще в 2007 году в Ираке во время второй войны в Персидском заливе. Тим Харрисон рассказывал историю об Элементе номер 17, и это хлор. Тим работает в лаборатории ChemLabs Бристольского университета. На следующей неделе штука, которая дает себе рентген.
Тим Харрисон рассказывал историю об Элементе номер 17, и это хлор. Тим работает в лаборатории ChemLabs Бристольского университета. На следующей неделе штука, которая дает себе рентген. Тем временем другие элементы доступны из Chemistry в подкасте Element, который находится в iTunes или в Интернете по адресу chemistryworld.org/elements. Я Крис Смит, большое спасибо за внимание и до свидания.
Тем временем другие элементы доступны из Chemistry в подкасте Element, который находится в iTunes или в Интернете по адресу chemistryworld.org/elements. Я Крис Смит, большое спасибо за внимание и до свидания.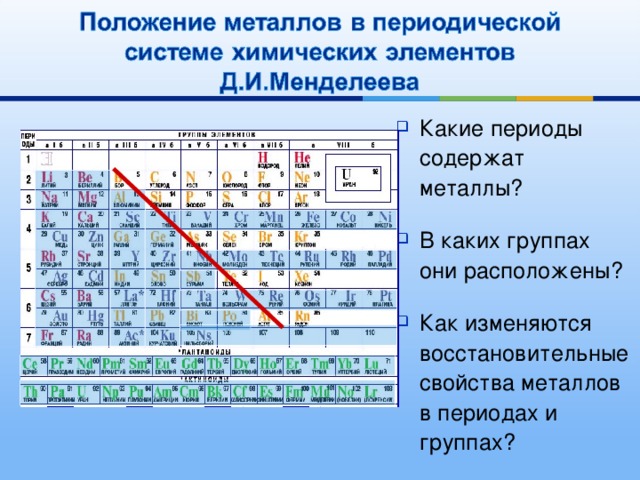
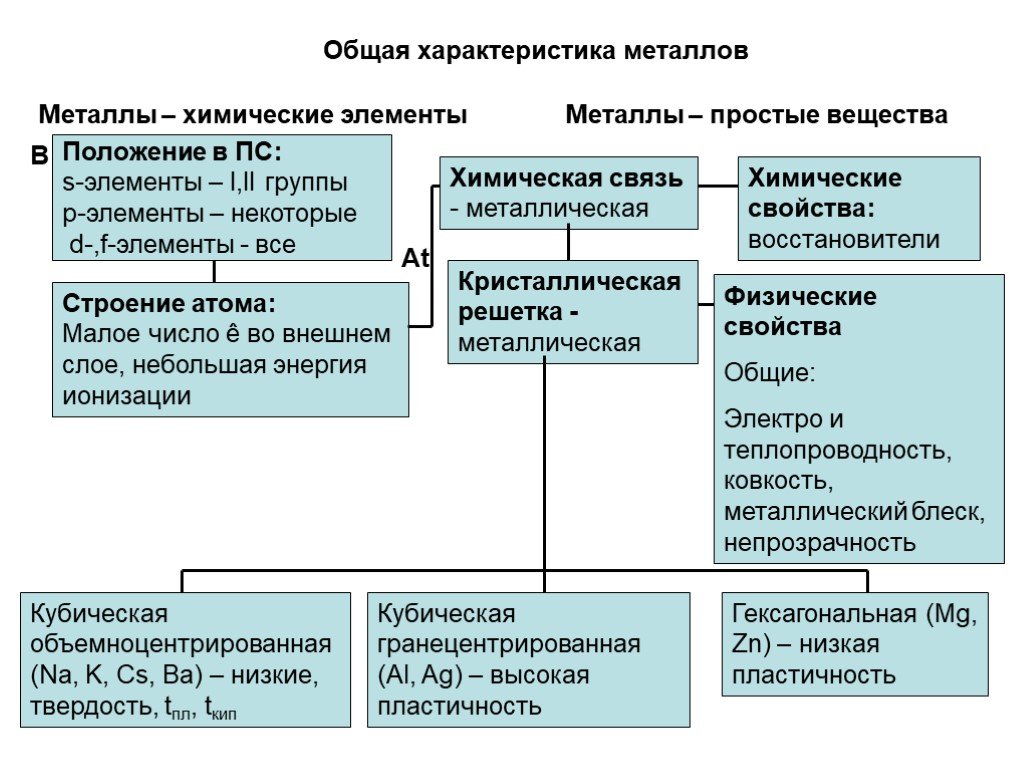
 500
500
 Он легко поглощает нейтроны и не набухает и не сжимается при бомбардировке нейтронами в течение длительного времени.
Он легко поглощает нейтроны и не набухает и не сжимается при бомбардировке нейтронами в течение длительного времени. Метод де Буабодрана включал в себя бесконечные осадки, проводимые на мраморной плите его домашнего камина.
Метод де Буабодрана включал в себя бесконечные осадки, проводимые на мраморной плите его домашнего камина. 017
017 889
889 896
896 1
1

 Поль Эмиль Лекок де Буабодран был одним из первых, кто применил эту новую технику. Он приехал из Коньяка во Франции, поэтому вы не удивитесь, узнав, что его семья производила коньяк. В 1875 году он идентифицировал галлий по двум спектроскопическим линиям в спектре образца цинковой обманки из Пиренеев и выделил этот элемент позже в том же году, заполнив таким образом один из пробелов, оставленных Менделеевым в периодической таблице. В то время ученые использовали усовершенствованные методы, такие как фракционная кристаллизация, для получения отдельных лантаноидов из смесей. В 1879 г.Лекок извлек чистый самарий из минерального самарскита, а в 1886 году он был первым, кто идентифицировал диспрозий, отделив его оксид от оксида гольмия. Для разделения он использовал осаждение аммиаком и оксалатом, проверяя фракции спектроскопически. На это у него ушло более 30 подходов, поэтому он назвал элемент соответствующим образом, от греческого слова «диспрозитос», что означает «труднодоступный».
Поль Эмиль Лекок де Буабодран был одним из первых, кто применил эту новую технику. Он приехал из Коньяка во Франции, поэтому вы не удивитесь, узнав, что его семья производила коньяк. В 1875 году он идентифицировал галлий по двум спектроскопическим линиям в спектре образца цинковой обманки из Пиренеев и выделил этот элемент позже в том же году, заполнив таким образом один из пробелов, оставленных Менделеевым в периодической таблице. В то время ученые использовали усовершенствованные методы, такие как фракционная кристаллизация, для получения отдельных лантаноидов из смесей. В 1879 г.Лекок извлек чистый самарий из минерального самарскита, а в 1886 году он был первым, кто идентифицировал диспрозий, отделив его оксид от оксида гольмия. Для разделения он использовал осаждение аммиаком и оксалатом, проверяя фракции спектроскопически. На это у него ушло более 30 подходов, поэтому он назвал элемент соответствующим образом, от греческого слова «диспрозитос», что означает «труднодоступный».
 Это привело к применению в устройствах хранения данных, таких как компакт-диски.
Это привело к применению в устройствах хранения данных, таких как компакт-диски. Ниобе пришлось нелегко. Она была достаточно глупа, чтобы предположить, что вместо того, чтобы поклоняться невидимым богам, может быть хорошей идеей ценить реальных людей для разнообразия. Греческие боги не очень-то прощали такого рода высокомерие и в наказание убили если не всех, то большую часть ее двенадцати детей – Ниобидов. В результате Ниоба бежала на гору Сипил и обратилась в камень. По сей день в Эгейском регионе Турции существует скальное образование, называемое плачущей скалой, которое напоминает женское лицо, предположительно Ниобеи. Вода просачивается сквозь пористый известняк плачущей скалы и, как говорят, напоминает непрекращающиеся слезы Ниобы над судьбой Ниобидов.
Ниобе пришлось нелегко. Она была достаточно глупа, чтобы предположить, что вместо того, чтобы поклоняться невидимым богам, может быть хорошей идеей ценить реальных людей для разнообразия. Греческие боги не очень-то прощали такого рода высокомерие и в наказание убили если не всех, то большую часть ее двенадцати детей – Ниобидов. В результате Ниоба бежала на гору Сипил и обратилась в камень. По сей день в Эгейском регионе Турции существует скальное образование, называемое плачущей скалой, которое напоминает женское лицо, предположительно Ниобеи. Вода просачивается сквозь пористый известняк плачущей скалы и, как говорят, напоминает непрекращающиеся слезы Ниобы над судьбой Ниобидов. com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements.
com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. 
 Это увеличило химическое воздействие на людей как дома, так и на рабочем месте. Таким образом, воздействие химических веществ и их вредное воздействие распространяется по всему миру угрожающими темпами, вызывая рост проблем со здоровьем и негативно влияя на безопасность работников.
Это увеличило химическое воздействие на людей как дома, так и на рабочем месте. Таким образом, воздействие химических веществ и их вредное воздействие распространяется по всему миру угрожающими темпами, вызывая рост проблем со здоровьем и негативно влияя на безопасность работников.

 Опасности могут проявляться покраснением, сыпью, воспалением, кашлем или кровотечением. Раздражители в основном представляют собой краткосрочные тяжелые заболевания, но у некоторых людей они также могут иметь длительные побочные эффекты. У людей также может быть аллергическая реакция на некоторые из этих химических материалов с долгосрочными последствиями для здоровья или даже со смертельным исходом.
Опасности могут проявляться покраснением, сыпью, воспалением, кашлем или кровотечением. Раздражители в основном представляют собой краткосрочные тяжелые заболевания, но у некоторых людей они также могут иметь длительные побочные эффекты. У людей также может быть аллергическая реакция на некоторые из этих химических материалов с долгосрочными последствиями для здоровья или даже со смертельным исходом. Некоторые заболевания, такие как астма и контактный дерматит, становятся распространенными среди людей из-за чрезмерного воздействия химических веществ.
Некоторые заболевания, такие как астма и контактный дерматит, становятся распространенными среди людей из-за чрезмерного воздействия химических веществ.
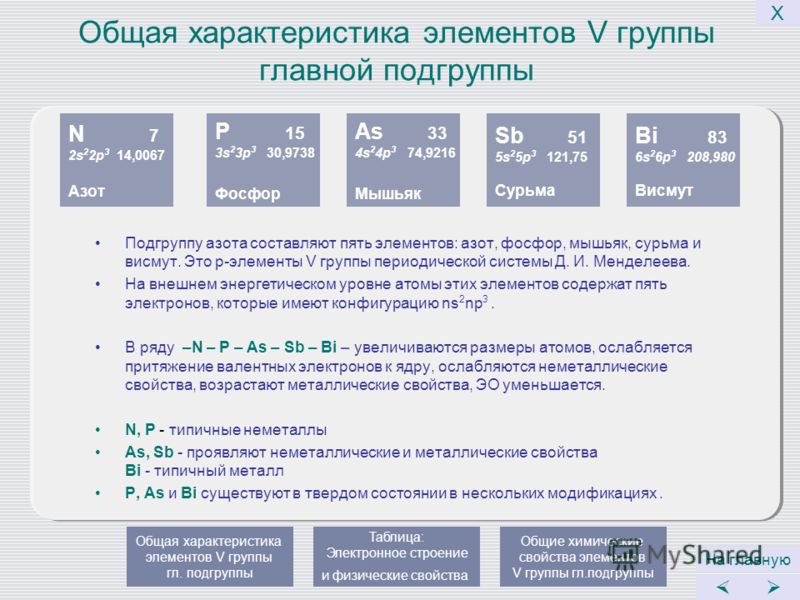 в Карманном справочнике NIOSH по химическим опасностям (NPG).
в Карманном справочнике NIOSH по химическим опасностям (NPG).
 Стандарт также рекомендует обучение сотрудников, работающих с опасными химическими веществами, в рамках их обычных рабочих задач, а также во время чрезвычайных ситуаций, когда на рабочем месте может произойти разлив или воздействие химических веществ.
Стандарт также рекомендует обучение сотрудников, работающих с опасными химическими веществами, в рамках их обычных рабочих задач, а также во время чрезвычайных ситуаций, когда на рабочем месте может произойти разлив или воздействие химических веществ.