Детские Лекарственные Формы Реферат – Telegraph
➡➡➡ ПОДРОБНЕЕ ЖМИТЕ ЗДЕСЬ!
Детские Лекарственные Формы Реферат
Вход
Помощь
Заказать работу
курсовик_по_техне..docx
— 123.44 Кб ( Скачать документ )
© 2009 — 2020 Referat911 — тысячи рефератов, курсовых и дипломных работ
Предметы
Поиск
Помощь
Автор работы: Пользователь скрыл имя, 16 Сентября 2013 в 16:56, курсовая работа
Основными признаками качества лекарств для детей являются: высокая терапевтическая эффективность; минимальное количество побочных эффектов, микробиологическая чистота и удобство применения, сочетающиеся с необходимой точностью дозирования. Огромное значение для детских пероральных лекарственных средств имеет вкус и запах. Любая из этих органолептических составляющих может привести к снижению комплайентности (приверженности к лечению), а нередко и к категорическому отказу ребенка от приема препарата. В чем же особенности детского организма, какие лекарственные формы изготавливаются в аптеках для детей, и какие требования предъявляют к изготовлению этих форм. Об этом и пойдет речь в данной курсовой работе.
В чем же особенности детского организма, какие лекарственные формы изготавливаются в аптеках для детей, и какие требования предъявляют к изготовлению этих форм. Об этом и пойдет речь в данной курсовой работе.
Введение ………………………………………………………………………….4 Ι. Обзор литературы. Современные проблемы создания детских лекарственных форм………….5 Анатомо-физиологические особенности детского организма………..…….8 1.3Особенности всасывания, распределения и выведения лекарственных веществ в детском организме……………………………………………………16 1.4 Пути введения и оптимальные лекарственные формы в педиатрии…….19 1.5. Вспомогательные вещества используемые в технологии детских лекарственных форм. Принцип подбора………………………………………..25 1.6 Особенности состава и технологии лекарственных форм для новорожденных и детей первого года жизни…………………………..………27 1.7 Контроль качества лекарственных форм для новорожденных и детей до 1 года…………………………………………………………………..……………35 1.8 Совершенствование лекарственных форм для новорожденных и детей до 1 года……………………………………………………………………. ..………40 ΙΙ. Экспериментальная часть……………………………………………..……..43 Практические примеры детских лекарственных форм………………..………43 Условия изготовления детских лекарственных форм в аптеке…….…………50 Выводы и предложения…………………………………………………………51 Список литературы. ……………………
..………40 ΙΙ. Экспериментальная часть……………………………………………..……..43 Практические примеры детских лекарственных форм………………..………43 Условия изготовления детских лекарственных форм в аптеке…….…………50 Выводы и предложения…………………………………………………………51 Список литературы. ……………………
ГОУ ВПО « Рязанский государственный
медицинский университет
Министерства здравоохранения
и социального развития Российской
Федерации.
Исполнитель: Батанина Ю.И. 5 курс
2 гр.
Место выполнения: ГП НО НОФ Аптека № 8
Нижегор. обл. г. Выкса ул. Степана Разина
д.39
Руководитель от института: Стрельцова
Р.М.
Руководитель от аптеки: Борисова
Т.С.
Руководитель аптеки: Суркова И.Б.
Курсовая работа
по фармацевтической технологии
на тему: «Детские
лекарственные формы».
Студентки 5 курса 2 гр. Батаниной
Ю.И.
Введение ………………………………………………………………………….4
1.3Особенности всасывания,
распределения и выведения лекарственных
веществ в детском организме……… ……………………………………………16
1.5. Вспомогательные вещества
используемые в технологии детских
лекарственных форм. Принцип
подбора………………………………………..25
1.6 Особенности состава и технологии
лекарственных форм для новорожденных
и детей первого года жизни…………………………..………27
1.7 Контроль качества лекарственных
форм для новорожденных и детей
до 1 года…………………………………………………………………. .……………35
1.8 Совершенствование лекарственных
форм для новорожденных и детей
до 1 года…………………………………………………………………… …………40
ΙΙ. Экспериментальная часть………………… …………………………..……..43
Практические примеры детских
лекарственных форм………………..………43
Условия изготовления детских
лекарственных форм в аптеке…….…………50
Выводы и предложения………………………… ………………………………51
Список литературы. …………………………………………………………….53
…………………………………………………………….53
Долгое время наука
о лекарствах в первую очередь
развивалась по пути создания обычных
лекарств для взрослых больных. Порой
врач испытывает большие затруднения
при назначении лекарственной терапии
детям. Долгие годы ему в помощь были
представлены только варианты изменения
доз лекарственных препаратов в
зависимости от возраста ребенка. Но
сейчас выделяют особую группу лекарственных
средств, специально предназначенных
для использования в детской
практике. К препаратам, применяемым
у детей, предъявляются особые требования.
Прежде всего, это обусловлено анатомо- физиологическими
особенностями детского организма,
которые в значительной степени
отличаются от организма взрослого.
Основные требования, выдвигаемые
к лекарственным препаратам для
детей, – это их эффективность и
безопасность. Этим вопросам посвящают
специальные доклинические исследования,
на основе которых принимаются решения
относительно возможности использования
определенного лекарственного средства
у детей различных возрастных
периодов. При отсутствии таких исследований
При отсутствии таких исследований
в инструкции к лекарственным
препаратам обычно указано, что они
противопоказаны к применению в
детском возрасте. Известно, что
реакции детского организма на прием
лекарств значительно отличаются от
реакций взрослого человека, что
обусловлено особенностями детского
организма. В связи с этим, проблема
создания лекарств для детей является
одной из самых актуальных и сложных, ее
фармацевтические аспекты ограничиваются
не только количественными характеристиками
(дозирование), но и качественными показателями
(лекарственная форма, технология и др.),
учитывающими все анатомо-физиологические
особенности организма ребенка.
Основными признаками качества
лекарств для детей являются: высокая
терапевтическая эффективность; минимальное
количество побочных эффектов, микробиологическая
чистота и удобство применения, сочетающиеся
с необходимой точностью дозирования.
Огромное значение для
детских пероральных лекарственных
средств имеет вкус и запах. Любая
из этих органолептических составляющих
может привести к снижению комплайентности
(приверженности к лечению), а нередко
и к категорическому отказу ребенка
от приема препарата. В чем же особенности
детского организма, какие лекарственные
формы изготавливаются в аптеках
для детей, и какие требования
предъявляют к изготовлению этих
форм. Об этом и пойдет речь в данной
курсовой работе.
Летом 2007 г. вступило в силу
Постановление ЕС №1901/2006 по педиатрическим
лекарственным средствам, которое должно
форсировать разработки и исследования
препаратов для лечения детей.
Предпосылки нового
регулирования. В настоящее время
медицина не располагает достаточным
арсеналом ЛС, разрешенных к применению
в детском возрасте. Наблюдается острый
дефицит данных по безопасному применению
препаратов у детей, слишком мало специфических
педиатрических лекарственных форм.
Между тем необходима фармакотерапия,
которая соответствовала бы возрастным
особенностям детей и подростков и при
этом опиралась на результаты исследований,
проведенных в соответствующих возрастных
группах. «Ребенок – это не уменьшенная
копия взрослого, для лечения детского
организма необходимы специальные знания
о действии на него ЛС и особые препараты.
Сегодня нам не хватает ни того, ни другого»,
– говорят ведущие врачи-педиатры. 1 По данным экспертов ВОЗ, для
75% детских болезней сегодня нет специальных
педиатрических ЛС. Для сравнения: в 2006
г. EMEA зарегистрировала 2593 препарата для
взрослых и 21 – для детей.
Дефицит педиатрических
ЛС заставляет врачей, выполняющих свой
долг по лечению маленьких пациентов,
рисковать, применяя препараты, не
предназначенные для лечения детей. В
первую очередь это относится к заболеваниям
раннего детского возраста и к тяжелым,
редко встречающимся у детей болезням.
Так, например, если в Германии, где правила
назначения ЛС выполняются врачами
особенно строго, примерно 13% назначений
детям делаются не в соответствии с утвержденными
показаниями для данного возраста, то
в других странах ЕС доля таких назначений
в больницах достигает 50%, а в отделениях
интенсивной терапии для недоношенных
и новорожденных доходит в среднем до
65%. Европейская комиссия оценивает долю
таких назначений более чем в 50%.
В то же время прогресс медицинской
и фармацевтической наук, уровень
развития фармпромышленности позволяют
изменить ситуацию. Имеются ресурсы
для создания эффективной «детской аптеки»,
как называют арсенал педиатрических
ЛС специалисты.
Ведущие фармкомпании-производители,
в особенности инновационные компании,
уже много лет стремятся внести свой вклад
в улучшение положения в данной области.
Каждый год они расширяют педиатрический
ассортимент на 15-20 препаратов, которые
были изучены в клинических исследованиях
с участием детей и затем разрешены
к медицинскому применению в педиатрии.
Эти препараты предназначены для лечения
различных заболеваний, причем не только
распространенных. Этому способствует,
в частности, Постановление ЕС 2000 г. по
лекарствам для лечения редких болезней,
благодаря которому был разработан
целый ряд т.н. «сиротских» или орфанных
ЛС. За 5 лет, т.е. до сентября 2006 г., Европейская
Комиссия присвоила статус «лекарство
для лечения редких болезней» почти
400 фармпродуктам, и 29 из них уже зарегистрированы
для всех стран ЕС. Примерно 2/3 этих заявок
и регистраций предусматривают применение
в детском возрасте.
Постановление, которое уже
вступило в силу под полным названием
«Постановление ЕС №1901/2006 Европейского
Парламента и Совета от 12 декабря 2006
г. о лекарственных средствах для применения
в педиатрии и об изменениях в Постановлении
№1768/92, Директив 2001/20/ЕС и 2001/83/ЕС, а
также Постановления №726/2004» опубликовано
в официальном бюллетене 27. 12.2006 L 378/1, уже
12.2006 L 378/1, уже
через неделю в дополнение к нему было
принято Постановление ЕС.
Постановление провозглашает
новые принципы разработки и внедрения
ЛС для педиатрии. До его вступления в
силу разработка ЛС для детей основывалась
на двух базовых положениях: инициаторами
разработки детских лекарств были фарминдустрия
и спонсируемые ею ученые, т.е. разработка
педиатрических лекарств была делом
добровольным; разработка лекарственных
препаратов для детей в части клинических
исследований была возможна только после
соответствующих клинических исследований
на взрослом контингенте. Это соответствует
современным научным и этическим стандартам.
Постановление
устанавливает новую систему взаимоотношений
субъектов европейского фармрынка в сегменте
педиатрических лекарственных средств.
Оно имеет целью форсировать развитие
этого сегмента и направлен решение
соответствующих задач:
Вводится
ряд новых требований и положений,
которые, несомненно, будут оказывать
решающее влияние на сферу разработки
и внедрения в клиническую практику лекарственных
средств для несовершеннолетних.
Повлияет
ли Постановление на российский рынок
клинических исследований? Постановление
по детским лекарствам уже вступило в
силу на территории ЕС. Это нормативный
акт прямого действия, т.е. для его выполнения
не требуется введения соответствующих
норм в национальные законы. Более того,
в Постановлении содержатся необходимые
положения, гармонизирующие с ним действующие
документы, в частности Директивы 2001/20/EC
по GCP и 2001/83/EC – фармкодекс.
Однако есть и
ряд факторов, которые будут сдерживать
приход детских клинических
исследований в Россию. В первую
очередь это законодательный
барьер. Как известно, Федеральный
закон «О лекарственных средствах»
гласит: «Не допускаются клинические
исследования лекарственных средств
на несовершеннолетних, за исключением
тех случаев, когда исследуемое
лекарственное средство предназначается
исключительно для лечения детских
болезней или когда целью клинических
исследований является получение
данных о наилучшей дозировке
лекарственного средства для
лечения несовершеннолетних.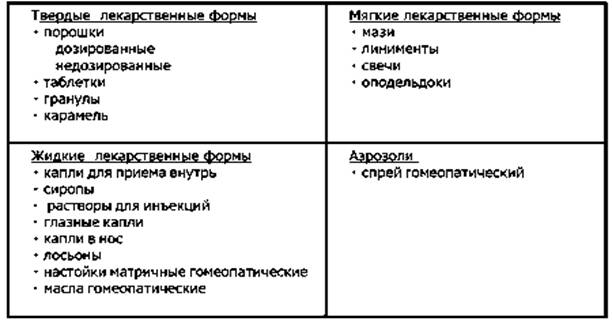 В
В
последнем случае клиническим
исследованиям лекарственного
средства на несовершеннолетних
должны предшествовать клинические
исследования его на совершеннолетних»
(п. 5 ст. 40).
Потребуется ряд условий, необходимых
для развития педиатрических исследований
в нашей стране. К ним можно отнести
следующие:
исследования, как чисто медицинские (в
т.ч. определенные условия в
клинике), так и страховые;
Между тем
стоит приложить усилия для привлечения
педиатрических клинических исследований
в нашу страну. Нам нужны новые эффективные
лекарственные препараты для лечения
детских болезней, разрешенные к
медицинскому применению, следовательно,
мы заинтересованы и в качественных клинических
исследованиях.
Таким образом, создание детских
лекарственных форм – сложная
проблема, требующая решения ряда
медико-биологических, физико-химических
и биофармацевтических задач.
Как бы ни был ребёнок
внешне похож на взрослого человека
по форме строения своего тела и
отдельных его органов, он ещё
значительно отличается от него по
многим количественным и качественным
признакам. Ребёнок вовсе не является
взрослым в миниатюре, и чем моложе
растущий и развивающийся организм,
тем значительнее его отличия
от организма взрослого.
Детские Лекарственные Формы Бесплатно Рефераты
ТЕМА: ДЕТСКИЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ — Студопедия.Нет
Детские лекарственные формы
Курсовая работа на тему: Детские лекарственные формы 11556
Детские лекарственные формы
Қазақстанның Ұлттық Инвестициялық Саясаты Эссе
Бесплатно Контрольные Работы Геометрия 7 Класс
Итоговая Контрольная Работа По Географии 9 Класс
Метание Снарядов В Легкой Атлетике Реферат
План Сочинения Егэ Фипи
Курсовая работа. Детские лекарственные формы. 1179+
Уважаемый студент!
У нас есть решение нижеприведенной работы. В интернете в свободном доступе её нет, а получить можно только у нас, она уникальна! Обратите внимание, работа 2013 года.
В интернете в свободном доступе её нет, а получить можно только у нас, она уникальна! Обратите внимание, работа 2013 года.
Если же Вам нужен любой другой вариант дипломной, курсовой, контрольной или другой работы, то смело заказывайте помощь в его написании у нас.
Наша команда авторов поможет выполнить работу любой сложности своевременно и качественно.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
ОСОБЕННОСТИ ДЕТСКОГО ОРГАНИЗМА
1.1 Периоды развития организма.
1.2. Функциональные особенности ребенка в разных возрастных группах
ПУТИ ВВЕДЕНИЯ И ЛЕКАРСТВЕННЫЕ ФОРМЫ В ПЕДИАТРИИ.
Пероральный способ введения.
Лекарственные формы для перорального применения.
Ректальный способ введения.
Парентеральный путь введения.
ПРАКТИЧЕСКИЕ ПРИМЕРЫ ДЕТСКИХ ЛЕКАРСТВЕННЫХ ФОРМ.
ЗАКЛЮЧЕНИЕ.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ.

22 стр.
Долгое время наука о лекарствах в первую очередь развивалась по пути создания обычных лекарств для взрослых больных. Порой врач испытывает большие затруднения при назначении лекарственной терапии детям. Долгие годы ему в помощь были представлены только варианты изменения доз лекарственных препаратов в зависимости от возраста ребенка. Но сейчас выделяют особую группу лекарственных средств, специально предназначенных для использования в детской практике. К препаратам, применяемым у детей, предъявляются особые требования. Прежде всего, это обусловлено анатомо-физиологическими особенностями детского организма, которые в значительной степени отличаются от организма взрослого. Основные требования, выдвигаемые к лекарственным препаратам для детей, – это их эффективность и безопасность. Этим вопросам посвящают специальные доклинические исследования, на основе которых принимаются решения относительно возможности использования определенного лекарственного средства у детей различных возрастных периодов.
Основными признаками качества лекарств для детей являются: высокая терапевтическая эффективность; минимальное количество побочных эффектов, микробиологическая чистота и удобство применения, сочетающиеся с необходимой точностью дозирования.
Огромное значение для детских пероральных лекарственных средств имеет вкус и запах. Любая из этих органолептических составляющих может привести к снижению комплайентности (приверженности к лечению), а нередко и к категорическому отказу ребенка от приема препарата. В чем же особенности детского организма, какие лекарственные формы изготавливаются в аптеках для детей, и какие требования предъявляют к изготовлению этих форм. Об этом и пойдет речь в данной курсовой работе.
В чем же особенности детского организма, какие лекарственные формы изготавливаются в аптеках для детей, и какие требования предъявляют к изготовлению этих форм. Об этом и пойдет речь в данной курсовой работе.
Детские лекарственные формы – готовая курсовая работа по цене 400 руб
Фрагмент работы Введение Содержание Список литературы
Характеристика и особенности изготовления детских лекарственных форм
Длительное время фармацевтическая технология развивалась по пути создания новых лекарственных препаратов для взрослых.
Главным требованием к изготовлению лекарственных средств для новорожденных, в независимости от способа применения, является изготовление в асептических условиях. Это объясняется тем, что даже микроорганизмы с низкой вирулентностью могут стать причиной заболеваний у детей. Как исходные вещества, так и готовые лекарственные формы должны подвергаться стерилизации. Игнорирование специфических особенностей детского организма приводит к проявлению токсических свойств лекарственных веществ и осложнениям, угрожающим жизни, вплоть до летального исхода.

В 1991 г. нормативные документы по растворам для новорожденных были впервые напечатаны в составе «Методических указаний по изго Показать все товлению стерильных растворов в аптеке».
Согласно нормативным документам, аптеки, обслуживающие детские лечебные учреждения и и родильные дома должны строго соблюдать технологический режим и проводить контроль качества в установленном порядке для всех лекарственных форм Скрыть
1. Краснюк И.И., Валевко С.А., Михайлова Г.В. и др. Фармацевтическая технология: Технология лекарственных форм: учеб. Для студ. высш. учеб. заведений/ 2-е изд., стер.
2. «Особенности детского организма» //Газета “Вестник Кипра” Выпуск № 443 от 26 марта 2004 г.
3. Будукова Л.А., Кондратьева Т.С. Лекарственные формы для новорожденных и детей до 1 года и пути повышения их качества. // Фармация, 1987 г., № 2.
4. Воропетский О.А., Птицина В.М.//Профилактика, диагностика и лечение заболеваний. – Кемерово, 1961. – с.205-206
5. Методические рекомендации аптекам г. Москвы – М., 1984. – №3 от 23.04.84, 42-21-1/58
7. Бабакина Г.С Показать все ., Березовская И.В. // Хим.-фарм. журн. – 1981. – №2 – с, 97-105
8. Тенцова А.И. Детские лекарственные формы. – М. 1977
9. Приказ МЗ РФ от 16.06.1997 года №214 «О контроле качества лекарственных средств, изготавливаемых в аптеке Скрыть
Детские лекарственные формы. Особенности состава и технологии, Медицина
Пример готового реферата по предмету: Медицина
Оглавление
Введение 3
1. Особенности строения детского организма 5
2. Требования к разрабатываемым лекарственным формам для детей 8
3. Пути введения детских лекарственных форм 10
4. Лекарственные формы для детей: их составы и технология. 11
4.1. Жидкие лекарственные формы 11
4.2. Ректальные лекарственные формы для детей 15
4.3. Мягкие лекарственные формы 19
4.4. Твердые лекарственные формы 21
5. Современные проблемы технологии лекарственных форм для детей 23
Заключение 24
Список литературы 26
Содержание
Выдержка из текста
В связи с этим, проблема создания лекарств для детей является одной из самых актуальных и сложных, ее фармацевтические аспекты ограничиваются не только количественными характеристиками (дозирование), но и качественными показателями (лекарственная форма, технология и др.), Рассмотреть особенности детского организма, которые служат основой для соблюдения особой осторожности при изготовлении детских лекарственных форм; Дать развернутую классификацию существующих детских лекарственных форм как экстемпорального производства, так и готовых лекарственных форм.
Врачам требовалось пересчитывать дозы лекарств, исходя из возраста и массы ребенка. Однако сейчас появилась новая группа лекарственных препаратов, предназначенная для использования в детской практике.
Методологической основой исследования послужил диалектический метод научного познания и системный подход. В ходе исследования использовались такие общенаучные методы, как дедукция, индукция, классификация, аналогия, наблюдение, интерпретативный анализ цитатного комплекса научных работ, учебников, элементы дефиниционного и сопоставительного анализа.
Поэтому целью исследования явилось изучение литературы и ассортимента, разработка состава, технологии и норм качества противоожогового геля с антиоксидантом и антигипоксантом натрия поли(дигидроксифенилен)-тиосульфонатом (гипоксеном).
Анализ приведенного перечня стерильных лекарственных форм, требующих асептических условий производства, показывает их практическую незаменимость. Потеря ими стерильности может кардинально ухудшить их основные лечебные свойства. Большое значение в организации производства перечисленных лекарственных форм, а именно достижении необходимой стерильности, лежит на требованиях GMP.
Определение классификационных групп таблеток, стандартизация терминов, используемых для названий этих групп, принципы формирования стандарта, регламентирующего качество препаратов в лекарственной форме “таблетки”, критерии включения показателей качества, выбор методов анализа для контроля, нормирование и интерпретация результатов испытаний, подходы к использованию стандартных образцов (СО) — все это составляет основу методологического подхода к стандартизации таблеток .
При выполнении курсовой работы необходимо выполнить некоторые задачи: изучить требования к глазным каплям согласно нормативной документации, особенности технологии данной лекарственной формы, входящие в состав глазных капель пролонгаторы и другие вещества, а также контроль качества глазных капель в аптеке.
Образование полиморфных форм одного и того же лекарственного вещества обычно происходит при замене используемых растворителей, при введении в жидкие или мягкие лекарственные формы различных вспомогательных веществ, при сушке и т. Практически, от того, в какой кристаллической модификации содержится субстанция в лекарственном препарате, зависит его стабильность и эффективность.
Следует отметить и тот факт, что некоторые мягкие лекарственные формы, в частности мази, находят все более широкое применение как средства для диагностики и предупреждения различных заболеваний и как средства, влияющие на отдельные симптомы и весь организм в целом.Мягкие лекарственные формы, такие как мази, линименты, пасты и свечи являются самой оптимальной лекарственной формой, в которой могут сочетаться компоненты, различные по химической природе, агрегатному состоянию, назначениям, биологической активностью.- изучить классификацию мягких лекарственных форм, особенности их технологии в условиях фармацевтического предприятия
Список литературы
1. Бронникова, О. Лекарственные препараты для детей: требования, особенности, информированность потребителей / О. Бронникова // Провизор. – 2005. — № 4. – С. 27.
2. Дзюба, В.Ф. Стандартизация детской лекарственной формы «суппозитории с винпоцетином» / В.Ф. Дзюба, С.А. Боева, А.А. Смирных, А.И. Сливкин // Фармация. – 2009. — № 7. – С. 14 – 16.
3. Петухова, Е.В. Быстрорастворимые гранулы для детской практики: составы и технология / Е.В. Петухова, Е.С. Ефремова, В.А. Вайнштейн // Фармация. — 2014. — № 4. — С. 39-42.
4. Потехина, Т.С. Микробиологические аспекты применения сорбита в качестве вспомогательного вещества в лекарственных препаратах для детей / Т.С. Потехина, Т.Д. Синева // Вопросы биологической, медицинской и фармацевтической химии. — 2010. -Т. 8. — № 4. — С. 43-46.
5. Синева, Т.Д. Разработка технологии и стандартизация качества сиропа сорбита как дисперсионной среды лекарственных препаратов для детей / Т.Д. Синева, Т. С. Потехина, И. Г. Витенберг // Химико-фармацевтический журнал. – 2007. –T.41. — № 12. – С. 26 – 29.
6. Ярных, Т.Г. Особенности технологии, контроля качества и фармацевтической разработки экстемпоральных лекарственных средств для детей / Т.Г. Ярных, О. А. Рухмакова // Химико-фармацевтический журнал. – 2015. — № 2. – С. 41-49.
список литературы
Технология изготовления и внутриаптечный контроль детских лекарственных форм на базе производственной практики
ФАРМАЦЕВТИЧЕСКИЙ ФИЛИАЛ
ГОСУДАРСТВЕННОГО БЮДЖЕТНОГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ
«СВЕРДЛОВСКИЙ ОБЛАСТНОЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
КУРСОВАЯ РАБОТА
Технология изготовления и внутриаптечный контроль детских лекарственных форм на базе производственной практики.
Исполнитель ФИО: Жук Екатерина Михайловна
Группа 301
Руководитель: Васиьева Альмира Анатольевна
База практики: ООО «ЦЕНТРАЛЬНАЯ АПТЕКА»
г. Нижний Тагил Улица Ленина 46
Время прохождения практики:
11.02-22.02.2019
Екатеринбург 2019
Содержание:
Введение
Глава 1. Теоретическая характеристика детских лекарственных форм
1.1 Понятие о лекарственных формах
1.2 Специфические особенности детского организма и необходимость детских лекарственных форм
1.3 Требования, предъявляемые к качеству детских лекарственных форм
1.4 Описание детских лекарственных форм
1.5 Особенности приготовления лекарственных форм для новорожденных и детей первого года жизни
1.6 Технологические мероприятия, проводимые аптекой, по повышению качества лекарственных форм
Глава 2. Практические примеры детских лекарственных форм
Заключение
Список литературы
Цель курсовой работы: рассмотреть технологию изговление детских лекарственных форм.
Целевая направленность исследования обусловила необходимость решения следующих задач:
1) изучить теоретически особенности детских лекарственных форм;
2) привести расчеты по 6 примерам детских лекарственных форм с рецептурой;
3) сформулировать выводы по работе.
Курсовая работа состоит из введения, двух глав, заключения и списка литературы. Названия глав отражают их содержание.
Глава 1. Теоретическая характеристика детских лекарственных форм
1.1 Понятие о лекарственных формах
Чтобы лекарство было легче принимать, и оно подействовало нужным образом, ему придают определенный вид. При этом применяют различные добавки, позволяющие получить и сохранить форму, изменить неприятный вкус, удлинить (пролонгировать) действие препарата и так далее. Созданные таким образом таблетки, капсулы, растворы, свечи, мази, пластыри называют лекарственной формой.
Лекарственная форма – это форма, которую придают лекарственному веществу изготовители лекарств.
Лекарственных форм великое множество. Условно их разделяют на три группы: твердые, жидкие, мягкие. К твердым лекарственным формам относят таблетки, капсулы, порошки, гранулы, драже, брикеты и тому подобные. В эту же группу входят и всевозможные сборы, составленные из нескольких видов лекарственного растительного сырья. Жидкие формы – различные растворы, суспензии, сиропы, капли, эмульсии, настойки, экстракты. Мягкие – мази, кремы, гели, линименты, пасты, свечи, пластыри; газообразные – средства для ингаляционного наркоза, аэрозоли и так далее.
Итак, какие же бывают лекарственные формы?
1) Твердые – таблетки, пилюли, порошки
2) Жидкие – микстуры, капли, полоскания
3) Мягкие – мази, пасты
Жидкие лекарственные формы:
– растворы
– суспензии
– эмульсии
– комбинированные растворы
РАСТВОРЫ – это жидкая форма, полученная путем растворения одного или нескольких веществ, предназначенных для наружного или внутреннего применения. Также существуют растворы, предназначенные для внутривенного вливания, и среди лекарственных препаратов они считаются самыми быстродействующими и эффективными средствами.
Реферат: Детские лекарственные формы. Особенности состава и технологии, цена: 880 руб.
ОглавлениеВведение 3
1. Особенности строения детского организма 5
2. Требования к разрабатываемым лекарственным формам для детей 8
3. Пути введения детских лекарственных форм 10
4. Лекарственные формы для детей: их составы и технология. 11
4.1. Жидкие лекарственные формы 11
4.2. Ректальные лекарственные формы для детей 15
4.3. Мягкие лекарственные формы 19
4.4. Твердые лекарственные формы 21
5. Современные проблемы технологии лекарственных форм для детей 23
Заключение 24
Список литературы 26
Фрагмент для ознакомления
Ректальные мазиприменяются в детской практике как с целью локального, так и резорбтивного действия. Весьма широко назначаются при нарушении дефекации у детей. Ректальные мази обычно выпускаются в тубах с наконечниками. 4.3. Мягкие лекарственные формыМягкие лекарственные формы занимают значительное место в арсенале лекарственных форм для детей и играют немаловажную роль в педиатрической практике. Наибольший интерес из них представляют капсулы и микрокапсулы.Капсулыв настоящее время являются наиболее распространенной лекарственной формой после таблеток для приема внутрь. Применяются в основном желатиновые капсулы, при производстве которых используется только чистый желатин без добавления пластификаторов и без дальнейшего парафинирования. В зависимости от формы матриц выпускают овальные, продолговатые и круглые капсулы. Оболочка из желатина может быть прозрачной, окрашенной или светонепроницаемой.Капсулы как лекарственная форма характеризуются целым рядом положительных свойств. Они защищают лекарственные вещества от механического воздействия, от света, воздуха. Больные хорошо переносят капсулы. Противопоказания к приему желатина не отмечены. Даже при тяжелых нарушениях секреции желудочного сока желатин, я вляясь натуральным продуктом, легко и быстро переваривается. Лекарственная форма имеет хороший внешний вид.Приведенные достоинства капсул определяют ее перспективность для использования в педиатрии. Сейчас многие антибиотики, витамины, сульфаниламиды, слабительные, антигельминтные, противокашлевые средства выпускаются для детей в виде капсул.Недостатки этой лекарственной формы связаны со свойствами желатина: с некоторыми лекарственными веществами он не совместим, при повышенной влажности меняет свои свойства и легко контаминируется микроорганизмами.При необходимости капсулы можно раскрыть и нужную часть порошка размешать в воде. Но когда капсулы оказываются сплошь запаянными, нельзя нарушать их оболочку. Исключение составляет витамин Е, который часто выпускается в герметичных шариках. Их можно разрезать и выдавить содержимое. Сравнительно недавно в медицинскую практику были введены микрокапсулы – капсулы микроскопических размеров от 5 до 5000 мк. Оболочка их состоит из полимера или биополимера.Содержание микрокапсулы может быть газообразным, жидким или твердым и составляет от 75 до 99% от массы капсулы. В большинстве случаев микрокапсулы с жидкостями или газами имеют сферическую форму, тогда как форма капсул с твердыми лекарственными веществами приблизительно та же, что и частичек препарата. При несомненных достоинствах микрокапсул требуется большая специальная исследовательская работа по оценке полимеров, применяющихся для изготовления оболочки микрокапсул для детей. Мази.Защитная функция кожи новорожденных детей несовершенна. Через тонкий роговой слой, сочный и рыхлый эпидермис при широко развитой сети кровеносных сосудов легко всасываются токсические вещества, микроорганизмы, в том числе и гноеродные бактерии. В липидный слой клеточных мембран по типу пассивного транспорта (без затраты энергии, в сторону меньшей концентрации) активно всасываются жирорастворимые вещества. Всасывание через кожу может вызвать токсический эффект. Известны данные о том, что всасывание глюкокортикоидов через кожу может вызвать угнетение функции коры надпочечников. Всасывание салицилатов, фенола и многих других лекарственных веществ может привести к тяжелым, нередко смертельным отравления. Опасно нанесение на кожу грудных детей присыпок и мазей, содержащих борную кислоту. Поэтому следует соблюдать осторожность и не вводить при разработке лекарственных препаратов в виде мази больших количеств раздражающих веществ, предупреждать родителей в случае их выписывания в составе прописи рецепта. Нельзя применять мази, контаминированные микроорганизмами. Изготовление мазей следует проводить строго в асептических условиях.Приказом Минздрава России «О контроле качества лекарственных средств, изготовляемых в аптеках» утверждены две прописи мазей для новорожденных: мази танина 1% и 5%Обе мази эмульсированные, так как предполагается растворение танина в минимальном объеме воды очищенной, но мазь1% – на липофильной основе (вазелине), мазь 5% – на дифильной основе (эмульсионной).Так же как в жидких лекарственных формах и порошках, не допускается изготовление суппозиториев и мазей с применением лекарственных веществ в виде таблеток. 4.4. Твердые лекарственные формыК твердым лекарственным формам относят таблетки, порошки, которые не рекомендуют для лечения детей раннего возраста.Особенностью лекарственных форм этой группы, предназначенных для детей старшего возраста, является, главным образом, возможность варьирования дозировок препарата.Среди твердых лекарственных форм для педиатрической практики широкое распространение получили гранулы.Гранулы — распространенная лекарственная форма для детей. В последние годы часто применяются также гранулированные порошки (гранулы). В них легче сбалансировать необходимые, в физиологическом отношении, лекарственные вещества. В отличие от суспензий, эмульсий и сиропов гранулы имеют ряд преимуществ:не содержат воды и органических растворителей, что замедляет прохождение в них физико-химических и микробиологических процессов;предварительное растворение их перед употреблением исключает введение вспомогательных веществ, что упрощает технологию и экономит материалы;возможность использования разовой упаковки снижает трудозатраты при хранении, транспортировке, имеет защиту от самовольного вскрытия детьми;нет необходимости комплектовать упаковку с лекарственным средством дозирующим устройством, доза может регулироваться количеством пакетиков на прием.Гранулированная лекарственная форма очень удобна для экстемпорального приготовления сиропов, суспензий, гелей.Гранулы этазол-натрия — гранулы розового цвета со специфическим запахом; выпускаются во флаконах по 60,0 г; 120,0 г или 240,0 г. Состав: этазол-натрия — 0,2 г; сахара — 5,745 г; руберозума — 0,01 г; натрия хлорида — 0,03 г; малиновой эссенции — 0,015 г.Приготовление: смесь действующих веществ и наполнителей увлажняют окрашенным сахарным сиропом, содержащим малиновую эссенцию, влажную массу гранулируют через сито с отверстиями 3 мм. После этого гранулы высушивают при 40 °С в сушильном шкафу, затем снова гранулируют через то же сито ирасфасовывают.Гранулы рекомендуются при пневмонии, дизентерии, пиелитах, циститах.Применяют внутрь, предварительно растворив содержимое банки (60 г гранул) в свежевскипяченной воде (30-40 ◦C). Уровень воды доводят до метки 100 мл.Хранят по списку Б в хорошо укупоренной таре, в защищенном от света месте. Современные проблемы технологии лекарственных форм для детейДля новорожденных детей самыми оптимальными лекарственными формами являются сиропы, гели, свечи, суспензии. Очень важно, чтобы лекарственное средство было легко дозируемо. Твердые лекарственные формы для новорожденных и детей грудного возраста применять не рекомендуется. Очень многие лекарственные средства не имеют специальной формы выпуска для детей. Это усложняет работу педиатров, усложняет правила, требующие точной дозировки. Например, ферментные лекарственные средства требуют очень точной дозировки. Если энзимы извлечь из дозировки, они тут же теряют свои свойства, начинают действовать в полости рта, а не в двенадцатиперстной кишке, как положено, таким образом, усугубляют ситуацию: расщепляют не то, что нужно, и не там, где нужно.ЗаключениеОсобенности детского организма и изменение этиологической структуры заболеваний в современных условиях обязывают искать новые подходы к наиболее адекватному выбору терапии. Конечный результат лечения зависит от правильного выбора препаратов и их форм. Таким образом, можно сделать вывод о том, что:Детские лекарственные формы нельзя отнести к самостоятельной группе лекарственных препаратов, но следует уделить ей повышенное внимание в виду биофармацевтических особенностей лекарств, действующих в детском организме.Несформировавшиеся системы и органы новорожденный детей и детей в возрасте до 7 лет способны изменить привычный для организма взрослого характер фармакокинетики и фармакодинамики препаратов.Предпочтение в детской практике отдается жидким пероральным и ректальным лекарственным формам, каждый из которых имеет свои преимущества и недостатки в этом случае.Дозирование лекарственных средств для детей должно в обязательном порядке проходить под строгим контролем врача, учитывая вес ребенка и особенности его организма.Развитие современной фармацевтической промышленности детских лекарственных форм должно быть направлено на улучшение вкуса пероральных лекарственных форм и уменьшения раздражающего действия ректальных лекарственных форм, а также на разработку совершенно новых лекарственных форм для детей, позволяющих заменить уже имеющиеся.Препараты, разрешенные для приема детям, не должны содержать эксипиентов или действующего вещества, которые влияют на рост и развитие тканей, снижают иммунитет, являются токсичными. Например, тетрациклины нарушают зубную эмаль у детей, влияют на рост костей; стрептомицин и гентамицин могут вызывать глухоту. Детям в возрасте до года запрещено принимать лекарства, которые содержат спирт.Особенности использования медицинских препаратов у детей следующие:дозировка лекарственного средства зависит от возраста и массы тела ребенка;соблюдение адекватности пути введения лекарственной формы препарата. Чаще всего в педиатрии используют пероральный, внутримышечный и ректальный пути введения препаратов, при этом наиболее приемлемый пероральный. Жидкие лекарственные формы, контактируя с большей площадью слизистой оболочки пищеварительного тракта, лучше всасываются. В связи с этим наиболее удобны для приема сиропы либо суспензии;препараты должны иметь приятные органолептические качества (вкус, запах).Необходимо помнить, что применение «взрослых» лекарственных форм при детских болезнях далеко не всегда может обеспечить достаточный клинический эффект, тогда как применение специальных детских форм приводит к большему успеху.Список литературыБронникова, О. Лекарственные препараты для детей: требования, особенности, информированность потребителей / О. Бронникова // Провизор. – 2005. – №4. – С. 27.Дзюба, В.Ф. Стандартизация детской лекарственной формы «суппозитории с винпоцетином» / В.Ф. Дзюба, С.А. Боева, А.А. Смирных, А.И. Сливкин // Фармация. – 2009. – №7. – С. 14 – 16.Петухова, Е.В. Быстрорастворимые гранулы для детской практики: составы и технология / Е.В. Петухова, Е.С. Ефремова, В.А. Вайнштейн // Фармация. – 2014. – № 4. – С. 39-42.Потехина, Т.С. Микробиологические аспекты применения сорбита в качестве вспомогательного вещества в лекарственных препаратах для детей / Т.С. Потехина, Т.Д. Синева // Вопросы биологической, медицинской и фармацевтической химии. – 2010. -Т. 8. – № 4. – С. 43-46.Синева, Т.Д. Разработка технологии и стандартизация качества сиропа сорбита как дисперсионной среды лекарственных препаратов для детей / Т.Д. Синева, Т. С. Потехина,И. Г. Витенберг // Химико-фармацевтический журнал. – 2007. –T.41. – №12. – С. 26 – 29.Ярных, Т.Г. Особенности технологии, контроля качества и фармацевтической разработки экстемпоральных лекарственных средств для детей / Т.Г. Ярных,О. А. Рухмакова // Химико-фармацевтический журнал. – 2015. – №2. – С. 41-49.
Список литературы1. Бронникова, О. Лекарственные препараты для детей: требования, особенности, информированность потребителей / О. Бронникова // Провизор. – 2005. – №4. – С. 27.
2. Дзюба, В.Ф. Стандартизация детской лекарственной формы «суппозитории с винпоцетином» / В.Ф. Дзюба, С.А. Боева, А.А. Смирных, А.И. Сливкин // Фармация. – 2009. – №7. – С. 14 – 16.
3. Петухова, Е.В. Быстрорастворимые гранулы для детской практики: составы и технология / Е.В. Петухова, Е.С. Ефремова, В.А. Вайнштейн // Фармация. – 2014. – № 4. – С. 39-42.
4. Потехина, Т.С. Микробиологические аспекты применения сорбита в качестве вспомогательного вещества в лекарственных препаратах для детей / Т.С. Потехина, Т.Д. Синева // Вопросы биологической, медицинской и фармацевтической химии. – 2010. -Т. 8. – № 4. – С. 43-46.
5. Синева, Т.Д. Разработка технологии и стандартизация качества сиропа сорбита как дисперсионной среды лекарственных препаратов для детей / Т.Д. Синева, Т. С. Потехина, И. Г. Витенберг // Химико-фармацевтический журнал. – 2007. –T.41. – №12. – С. 26 – 29.
6. Ярных, Т.Г. Особенности технологии, контроля качества и фармацевтической разработки экстемпоральных лекарственных средств для детей / Т.Г. Ярных, О. А. Рухмакова // Химико-фармацевтический журнал. – 2015. – №2. – С. 41-49.
лекарственные формы с антибиотиками. Особенности организации и стадии технологического процесса
ГБОУ ВПО «Казанского государственного медицинского университета»
Министерство здравоохранения и социального развития РФ
Фармацевтический факультет
Кафедра фармацевтической технологии
Курсы
на тему:
лекарственные формы с антибиотиками. Особенности организации и стадии технологического процесса
Казань, 2011
Содержание
Введение
1. Основные виды сырья, используемые в производстве антибиотиков
2. Аппаратурно-технологическое оформление процесса ферментации антибиотиков
. Стерилизации воздуха, аппараты и мультимедиа, подготовка устройств для зарядки
. Процессы химической очистки антибиотиков и их аппаратурно-технологическое оформление
5. Процессы сушки в производстве антибиотиков
. Частная технология антибиотиков
. Лекарственные формы антибиотиков
. Дозирования, упаковки, упаковка и маркировка готовой продукции
. Биологические методы контроля производства антибиотиков
Вывод
библиография
Введение
Срок «антибиотики» был предложен в 1942 году С. А. Ваксманом для обозначения веществ, образуемых микроорганизмами и обладающие антимикробным действием.
Впоследствии многие исследователи полагают, формулировка их, вкладывать в них, иногда, слишком ограниченное содержание или чрезмерно расширять это понятие.
Наиболее удачной с теоретической точки зрения и отражает современное состояние этой проблемы является определение, предложенное М. М. Шемякиным, А. С. Хохловым и др. (1961): «Антибиотическими веществами (антибиотиками) следует называть все продукты обмена любых организмов, способные ингибировать выборочно или убивать микроорганизмы (бактерии, грибы, вирусы и др.)».
Почти формулировки дают М. Герольд и другие (1966). В последнее время получил признание термин «противоопухолевый антибиотик», хотя он и не вписывается в рамки этого определения. [3]
Практика медицины представляет к антибиотическим веществам следующие основные требования:
“Особенности технологии изготовления детских лекарственных форм энтерального пути введения” 77545
1900
Уважаемый студент!
Представленная работа ранее уже была оценена преподавателем нашего клиента на “отлично”. Использование данного материала в качестве основы ускорит процесс подготовки Вашего собственного проекта. Можете быть уверены, что работа уникальна, предлагаем ее только мы, и в открытом доступе в интернете она не находится! Еще один плюс: готовая работа в несколько раз дешевле, чем новая.СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1 ХАРАКТЕРИСТИКА ЭКСТЕМПОРАЛЬНЫХ ЛП ДЛЯ ЭНТЕРАЛЬНОГО ПРИМЕНЕНИЯ, ПРИМЕНЯЕМЫХ У ДЕТЕЙ
- Анатомо-физиологические особенности детского организма
- Теоретические аспекты технологии изготовления детских ЛП для энтерального применения
- Направления создания ЛП для детей
- ИССЛЕДОВАНИЕ ОСОБЕННОСТЕЙ ТЕХНОЛОГИИ ИЗГОТОВЛЕНИЯ ДЕТСКИХ ЛЕКАРСТВЕННЫХ ФОРМ ЭНТЕРАЛЬНОГО ПУТИ ВВЕДЕНИЯ
- Характеристика базы исследования
- Анализ номенклатуры детских лекарственных форм для энтерального введения
- Обзор технологии изготовления детских лекарственных форм для энтерального введения
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
ПРИЛОЖЕНИЕ
ВВЕДЕНИЕ
Анализ экстемпоральной рецептуры, позволяет сделать вывод, что, несмотря на возрастающий ассортимент готовых лекарственных средств (ЛС), приготовление лекарственных препаратов (ЛП) в аптеках по рецептурным прописям и требованиям лечебно-профилактических учреждений не теряет своего значения[10].
Анализ преимуществ ЛП аптечного изготовления позволил выделить из них несколько основных: индивидуальный подход к больному; отсутствие аналогов (в некоторых случаях полное) среди готовых лекарственных препаратов; ценовая доступность экстемпоральных лекарственных препаратов[19]. Третье преимущество характерно в большей степени для России и, с точки зрения потребителей (населения и медицинских организаций), является приоритетным ввиду особенностей рынка[17].
Серьезная проблема медицины и фармации – отсутствие специальных лекарственных форм для детей, особенно для малышей до года. Это объясняется тем, что для фирм-производителей клинические испытания препаратов на малышах – очень дорогие и часто очень длительные. В этом случае, особую значимость приобретают порошки, капли, микстуры для маленьких пациентов, изготовленные в производственных отделах аптек. Детские лекарственные формы являются особой группой экстемпоральных препаратов, в отдельных случаях требующей асептических условий изготовления. По способу применения детские лекарственные формы бывают для энтерального применения (порошки, жидкие лекарственные формы для внутреннего применения, клизмы, суппозитории, мази ректальные), для для парентерального применения – присыпки, масла, растворы для наружного применения, капли глазные, растворы для инъекций и мази.
Технология изготовления лекарственных форм для детей имеет ряд особенностей, связанных с анатомо-физиологическими характеристиками, различными для каждого возраста, и позволяющими рассматривать каждый этап в жизни ребенка как совершенно иной тип организма.
Актуальность выбранной темы состоит в необходимости детального изучения технологии изготовления детских лекарственных форм энтерального пути введения ввиду того, что данная лекарственная форма является востребованной с учетом ее биофармацевтических характеристик, отсутствием промышленных аналогов и т.д.
Целью данной работы является изучение особенностей технологии детских лекарственных форм энтерального пути введения изготовления на базе конкретной аптеки.
Для достижения поставленной цели необходимо решить следующие задачи:
- Рассмотреть анатомо-физиологические особенности детского организма
- Изучить теоретические аспекты технологии изготовления детских ЛП для энтерального применения
- Рассмотреть направления создания ЛП для детей
- Провести анализ номенклатуры детских лекарственных форм для энтерального введения в аптеке ООО «Фармация»
- Исследовать технологию изготовления детских лекарственных форм для энтерального введения
Объектами исследования явились статистические данные о состоянии экстемпоральной рецептуры.
Предметом исследования является технология изготовления детских лекарственных форм для энтерального введения.
Основными теоретическими и методологическими источниками при написании данной работы служили литературные и нормативные издания, посвященные технологии изготовления и контролю качества лекарственных форм.
Практическая значимость работы заключается в том, что изготовление детских лекарственных форм для энтерального введения требует повышенной ответственности, применения индивидуальных приемов, знания физико-химических свойств лекарственных веществ, в связи, с чем изучение теории и технологии имеет большое значение для практической деятельности фармацевтического работника.
51 стр.
Если данный вариант Вам не подходит, мы поможем Вам в написании новой работы. Вы можете обратиться к нам с любыми проблемами в учебе! Кроме того, если Вам интересно разобраться в предмете, мы научим Вас самостоятельно решать задачи, подготавливать рефераты, курсовые, дипломы и т.д.
Составление лекарственных препаратов для детей
Реферат
Разработка адаптированных к возрасту лекарственных форм и маскирование вкуса горьких на вкус лекарств, принимаемых перорально для детей, являются серьезной проблемой для ученых, занимающихся разработкой рецептур. Детство – это период созревания, требующий знаний фармакологии развития для определения дозы, но способность ребенка управлять различными лекарственными формами и устройствами также меняется. Педиатрические составы должны обеспечивать точное введение дозы детям самого разного возраста и веса.Хотя пероральный путь будет предпочтительным для длительного использования, а внутривенный – для пациентов с острыми заболеваниями, многие лекарственные формы, разработанные для взрослых, такие как диспергируемые во рту таблетки, буккальные гели и трансдермальные пластыри, также будут полезны детям, если они содержат соответствующая детская доза. Возраст, в котором дети могут глотать обычные таблетки, имеет большое значение для их безопасности. Младенцам и детям младшего возраста обычно рекомендуются жидкие лекарства, поэтому способность маскировать неприятный вкус подсластителями и ароматизаторами имеет решающее значение.Могут потребоваться более сложные составы, такие как гранулы и диспергируемые во рту таблетки, но будут ограничения на выбор и концентрацию вспомогательных веществ. Есть много пробелов в наших знаниях о педиатрических составах и множество проблем для промышленности, если подходящие препараты доступны для всех диапазонов. Документ, требующий рассмотрения, скоро будет выпущен. Важны дополнительные исследования и клиническая обратная связь, потому что плохо приемлемый состав может повлиять на соблюдение, практику назначения и, в конечном итоге, на коммерческую жизнеспособность.
Ключевые слова: Состав, педиатрический, детский, лекарственная форма
Введение
В фармакологии и педиатрии при определении дозировки, клинических эффектов и побочных эффектов в фармакологии и клинической педиатрии основное внимание уделяется действующей лекарственной субстанции (или активному фармацевтическому ингредиенту (API)). реакции. Однако состав принципиально важен, поскольку на практике он определяет, может ли доза быть успешно доставлена педиатрическому пациенту. Более того, важно учитывать вспомогательные вещества в составе и возможность любых побочных эффектов в этой потенциально уязвимой возрастной группе.
Разработка рецептур, подходящих для детей, может стать серьезной проблемой для ученых-фармацевтов. В отличие от взрослых, где пероральные твердые лекарственные формы, такие как таблетки или капсулы, будут приемлемы для большинства пациентов, потенциальные педиатрические пациенты могут включать новорожденных, новорожденных, детей ясельного возраста, маленьких детей и подростков и, как таковые, будут иметь самые разные потребности. Разработка множественных лекарственных форм для разных возрастов редко будет коммерчески жизнеспособной, а жидкие составы, которые можно давать широкой возрастной группе, представляют особые фармацевтические проблемы.Например, маскировка вкуса лекарственного средства с горьким вкусом является серьезным препятствием при составлении рецептуры, которое может быть очень дорогостоящим и не всегда достижимым.
Некоторые соображения по разработке приемлемых педиатрических лекарственных форм обсуждаются ниже.
Требования к лекарственным формам
Существуют различные причины для создания лекарственных форм в соответствующих лекарственных формах; одна из самых важных связана с точным измерением дозы. Многие активные лекарства очень сильнодействующие и требуют введения всего лишь миллиграмма или микрограмма.Для детей необходимое количество препарата зависит от возраста и веса. Активные препараты необходимо разводить в носителе, который позволяет точно и удобно измерять дозу. Активные лекарственные средства также должны быть защищены от разложения в течение срока их хранения, например, кислородом и влажностью, и при пероральном введении может потребоваться защита от разложения желудочной кислотой. Может потребоваться скрыть вкус и запах и приготовить жидкие препараты нерастворимых или нестабильных лекарств. Может потребоваться регулирование скорости действия или оптимизация доставки местных или ингаляционных препаратов, а те, которые вводятся путем инъекции, должны быть стерилизованы.
Возраст и способности
Детство характеризуется периодами быстрого роста, взросления и развития. Способность справляться с изменениями активных лекарственных препаратов в детстве признана в фармакологии развития. Величина дозы, требуемой в детстве и подростковом возрасте, может быть изменена в 50 раз. Также произошли значительные изменения в способности работать с различными лекарственными формами с жидкими лекарствами небольшого объема, подходящими для перорального применения в более молодых возрастных группах; жидкие лекарственные средства и быстро растворяющиеся «тающие» составы, подходящие для большинства возрастов, а также таблетки и капсулы, более подходящие для образа жизни подростков.
В педиатрической практике требуется ряд лекарственных форм, приемлемых для разных возрастов и способностей, а также диапазон дозировок или концентраций, позволяющих вводить правильную дозу, соответствующую возрасту. Тяжелобольным детям потребуется внутривенное введение лекарств, и они предпочтут это частым внутримышечным инъекциям. Для менее серьезных заболеваний и длительного введения предпочтителен пероральный путь, но в некоторых случаях могут быть полезны другие пути, такие как буккальный, назальный, трансдермальный и ректальный.
Возраст, в котором дети принимают таблетки или капсулы, является важным фактором для их безопасности, чтобы избежать случайного вдыхания и удушья, но также имеет большое значение для производителей. Таблеточные препараты, как правило, проще и дешевле разработать, изготовить, транспортировать, хранить и распределять, чем жидкие лекарства. В литературе мало информации, но обычно считается, что традиционные таблетки могут быть приняты детьми школьного возраста, хотя это будет зависеть от размера и формы таблетки и факторов пациента, таких как вкус альтернативных жидких лекарств.Фактически, успехи в фармацевтической технологии привели к разработке многих различных типов таблеток, таких как расплавленные, жевательные и диспергируемые во рту таблетки, и технически возможно, что соответствующие составы таблеток могут быть доступны для детей большинства возрастов, но при этом стоимость.
Проблемы с пероральными жидкими препаратами
Доза и объем жидких лекарственных средств могут быть ограничены растворимостью лекарственных веществ, требующих добавления сорастворителей и поверхностно-активных наполнителей.Физическая, химическая и микробиологическая стабильность должна быть обеспечена буферными агентами, антиоксидантами и консервантами. Решающее значение имеет умение замаскировать неприятный вкус подсластителями и ароматизаторами. Если это невозможно, могут потребоваться более сложные подходы к составлению, такие как инкапсуляция частиц лекарственного средства. Эти более сложные подходы к формулированию сопряжены с более высокими техническими проблемами, и, следовательно, исследования и разработки будут более длительными и дорогостоящими.
Требуется однородность состава, и для точного дозирования могут потребоваться такие дозирующие устройства, как капельницы или шприцы.
Существуют ограничения по выбору и концентрации вспомогательных веществ для педиатрических больных.
Твердые лекарственные формы
В настоящее время доступно большое количество твердых лекарственных форм, включая порошки (например, пероральный порошок Вирасепт® (нелфинавир мезилат, Pfizer), гранулы (например, пероральные гранулы Singulair® (Монтелукаст Na, Merck) и спринклеры (например, Депакот) ® Капсулы для рассыпания (Divalproex Na, Abbott). Обычно их смешивают с определенной едой или напитком, и их легко проглотить. Вкус снова важен; существует риск неполного проглатывания и, как следствие, снижения вводимой дозы.Возможные технические проблемы включают обработку порошка, упаковку, стабильность и извлечение дозы.
Доступны разнообразные современные препараты в виде таблеток, такие как быстро диспергируемые лекарственные формы (FDDF), например Calpol Fast Melts® (Pfizer Consumer Health), Nurofen® Meltlets (Crookes Healthcare), Benadryl® таблетки, диспергируемые во рту. Ни один из продуктов в настоящее время не имеет лицензии для детей младше 6 лет, в первую очередь из-за доступных доз. Эти продукты помещаются в рот, где они «тают» на языке в небольшом количестве слюны или могут быть растворены ложкой в небольшом количестве жидкости.Их легко вводить при условии приемлемого вкуса и точности дозировки. Однако многие из этих технологий являются патентованными и, следовательно, потребуют лицензионных соглашений. Затраты на разработку выше, чем для обычных пероральных лекарственных форм. Примеры включают Zydis ™ (Scherer), OralSolv ™ (Cima), WOWtab ™ (Yamanouchi), Films (LTS Lohman)
Tan и Cranswick NE (2003) показали, что в Австралии 70–80% продуктов, подходящих для детей, не соответствуют требованиям. информация о дозировке в SPC и что в 25% продуктов, лицензированных для детей, лекарственные формы не подходят для предполагаемого возраста.Однако при наличии коммерческого стимула большого рынка для лечения распространенного заболевания, такого как боль или рвота, или для безрецептурных препаратов, может быть предоставлен полный и разнообразный портфель продуктов, как показано в парацетамоле и ондансетроне.
Идеальный состав для детей допускает минимальную дозировку и частоту; будет иметь одну лекарственную форму, подходящую для всего или полного набора; окажет минимальное влияние на образ жизни; минимум нетоксичных вспомогательных веществ и удобное, легкое и надежное применение.Он также должен быть простым в производстве, элегантным, стабильным, дешевым и коммерчески жизнеспособным. Не следует недооценивать сложность достижения этой цели.
Проблемы и пробелы в знаниях
Есть много пробелов в наших знаниях о педиатрических составах и множество проблем, с которыми придется столкнуться промышленности, если подходящие препараты будут доступны для всех возрастных категорий. Это включает
допустимые объемы и размеры доз
безопасность, например риск аспирации или удушья для твердых лекарственных форм
Приемлемость вспомогательного вещества
вкус (и как лучше всего оценить во время разработки).
Информация доступна с пунктами CHMP для рассмотрения документа о рецептуре в черновике. Несомненно, будут полезны дополнительные исследования и клиническая обратная связь, поскольку, если препарат плохо переносится пациентами, это влияет на соблюдение, практику назначения и, в конечном итоге, коммерческую жизнеспособность.
Детские препараты: проблемы и решения
Br J Clin Pharmacol. 2015 Март; 79 (3): 405–418.
Ханна К. Бэтчелор
Фармация, фармакология и терапия, Школа клинической и экспериментальной медицины, Колледж медицинских и стоматологических наук, Бирмингемский университет, Бирмингем, Соединенное Королевство
John F Marriott
Фармация, фармакология и терапия, Школа Клиническая и экспериментальная медицина, Колледж медицинских и стоматологических наук, Бирмингемский университет, Бирмингем, Соединенное Королевство
Фармация, фармакология и терапия, Школа клинической и экспериментальной медицины, Колледж медицинских и стоматологических наук, Бирмингемский университет, Бирмингем, Соединенное Королевство
Корреспонденция , д-р Ханна Бэтчелор, Отдел фармации, фармакологии и терапии, Школа клинической и экспериментальной медицины, Колледж медицинских и стоматологических наук, Здание Медицинской школы, Университет Бирмингема, Бирмингем, Эджбастон B15 2TT, Великобритания., Тел .: +44 (0) 121 414 3717, электронная почта: [email protected]Поступила в редакцию 7 августа 2013 г .; Принято 15 октября 2013 г.
Эта статья цитировалась в других статьях в PMC.Abstract
Разработка педиатрических препаратов сложна, поскольку необходимо понимать физиологические изменения развития, которые происходят в детстве, и их влияние на абсорбцию лекарств. Педиатрические корректировки дозы обычно основываются на достижении фармакокинетических или фармакодинамических профилей, эквивалентных профилям, достигнутым во взрослой популяции.Однако различия в том, как дети обращаются с продуктами для взрослых или в использовании специально разработанных педиатрических составов, могут привести к неожиданным фармакокинетическим профилям лекарств с измененной клинической эффективностью. Специалисты здравоохранения, участвующие в назначении, введении или отпуске лекарств детям, должны понимать различия в лекарственных формах, чтобы дать соответствующие рекомендации для достижения терапевтических результатов. Эта проблема не ограничивается пероральными лекарствами, но применима для всех способов введения, встречающихся в педиатрической терапии.
Ключевые слова: биоэквивалентность, биофармацевтика, лекарственные формы, педиатрия, фармакокинетика
Введение
Разработка соответствующих возрасту лекарств для детей требует не только понимания их предпочтений в отношении различных составов, вкусов и текстур продуктов, но и понимания их физические и биохимические различия между детьми и взрослыми. Наиболее очевидное различие между лекарственной терапией для взрослых и детей заключается в сложности корректировки дозы и алгоритмов, используемых для расчета дозировок, относящихся к подгруппам в общей педиатрической популяции.С точки зрения медикаментозной терапии большое внимание уделяется идиоме, что «дети – не просто маленькие взрослые». Действительно, рост и развитие – это два основных аспекта детей, которые не всегда проявляются у взрослых. Тема человеческого роста и развития обширна с множеством подробных специализированных справочных работ (например, 2, 3).
Существует несколько обзоров, в которых подробно описаны варианты составов и их пригодность для детей в возрасте от 4 до 8 лет. Также существует нормативное руководство по предпочтению рецептур с возрастом в педиатрической популяции 9–11 лет.Тем не менее, по-прежнему существует потребность в информации, основанной на доказательствах, для руководства разработкой составов, подходящих и приемлемых для детей и молодых людей.
В связи с широким возрастным диапазоном педиатрической популяции маловероятно, что одна рецептура будет подходящей для этого диапазона, что требует нескольких вариантов продукта. При разработке идеального педиатрического препарата необходимо учитывать следующие факторы: (i) оказание минимального воздействия на образ жизни ребенка, проявляющееся как наименьшая частота дозирования и приятный на вкус продукт, (ii) обеспечение индивидуального дозирования или диапазона доз, подходящего для эффективная терапия, (iii) достаточная биодоступность, (iv) нетоксичные вспомогательные вещества в составе, (v) удобное и надежное введение и (vi) надежный производственный процесс с минимальными затратами 12.
Препятствия к использованию существующих составов
Использование нелицензированных и нерекомендуемых лекарств для лечения детей широко распространено с сопутствующим риском, поскольку эти продукты не были должным образом изучены в педиатрической популяции. Медицинским работникам и родителям или опекунам часто требуется манипулировать лекарством для взрослых, чтобы получить подходящую дозу для ребенка, например, разделив таблетку, чтобы получить меньшую дозу, или, в более сложных случаях, приготовить суспензию из измельченной таблетки.Такие манипуляции увеличивают вариабельность продукта из-за неточных измерений, проблем со стабильностью или ошибок в инструкциях по манипуляциям 13. В настоящее время существуют нормативные и финансовые стимулы для разработки соответствующих возрасту лекарств для новых лекарств, однако существует значительное количество существующих лекарств, для которых необходимы соответствующие возрасту составы. Для таких лекарств существуют списки приоритетов (например, 14,15).
Составы и фармакокинетика
Фармацевтический состав может влиять на эффективность лекарственного средства, особенно в отношении продуктов, приготовленных для немедленного приема, которые вводят детям.В одном из описанных клинических случаев 16 описана значительная недостаточная доза клобазама у 3-летнего ребенка с эпилепсией. В этом случае препарат для немедленного приема, хотя и был приготовлен в правильной номинальной концентрации, не соответствовал назначению, поскольку активное лекарственное средство не было суспендировано гомогенно. Правильный введенный объем не содержал правильной дозы, что привело к субтерапевтическому лечению.
В идеале, любой педиатрический состав должен быть биоэквивалентен продукту для взрослых, чтобы свести к минимуму ошибки при назначении и обеспечить простую смену состава в соответствующем возрасте.Биоэквивалентность обычно оценивается с точки зрения пиковой концентрации в плазме ( C max ), времени до C max ( t max ) и площади под кривой времени абсорбции (AUC) на графике плазмы. концентрация против времени. Различия в скорости всасывания (быстрее или медленнее) изменят t max , но вряд ли повлияют на C max или AUC. Различия в степени абсорбции будут влиять на C max и AUC, которые обычно имеют большее клиническое значение по сравнению с изменениями t max .С точки зрения нормативных указаний, значительная разница определяется как разница, при которой 90% доверительный интервал не соответствует пределам 80–125% либо для C max , либо для AUC профиля эталонного продукта 17. Исследования биоэквивалентности обычно проводятся проводится среди взрослого населения. Был проведен поиск литературы для выявления исследований биоэквивалентности, проведенных с использованием педиатрических препаратов. Были использованы поисковые запросы «педиатрический» ИЛИ «педиатрический» И «биоэквивалентность» ИЛИ «биодоступность».Поиск был ограничен теми, где эти термины появлялись в заголовке, аннотации или ключевых словах статей в базах данных Scopus (http://www.scopus.com) и Pubmed (http://www.pubmed.com) до января. 2013. В таблице представлены исследования биоэквивалентности, опубликованные в литературе, и полученные в результате различия в фармакокинетическом профиле по сравнению со взрослыми.
Таблица 1
Фармакокинетические исследования, сравнивающие педиатрические составы
Всего было найдено 45 отчетов об исследованиях биоэквивалентности педиатрических составов.Из них 15 были проведены в педиатрической популяции, 29 – у взрослых и по одному – как у детей, так и у взрослых. Педиатрический состав не был эквивалентен эталонному продукту для взрослых в 40% случаев, включенных в этот обзор. Было 10 случаев, когда педиатрический продукт показал более высокую биодоступность и 11 случаев, когда биодоступность была снижена. Эти результаты подчеркивают необходимость понимания влияния дизайна препарата на фармакокинетические характеристики в педиатрической популяции.Обычно жидкости начинают действовать быстрее по сравнению с таблетками, поскольку отсутствует стадия распада, замедляющая абсорбцию. Поскольку педиатрические продукты, как правило, представляют собой жидкости, неудивительно, что их биодоступность во многих случаях различается. Возможно, более удивительно, что было 11 случаев, когда биодоступность была снижена в педиатрической композиции. Однако, поскольку несколько составов, перечисленных в таблице, были приготовлены экстемпорально, а не специально для детей, можно ожидать, что они могут не работать так, как продукт для взрослых.
Различия в педиатрической физиологии и анатомии также могут влиять на абсорбцию, распределение, метаболизм и выведение лекарств. Поэтому важно понимать не только состав препарата, но и то, как он может взаимодействовать с местом абсорбции, чтобы понять, связаны ли различия в фармакокинетике с составом, возрастом или комбинацией состава и возраста для педиатрических лекарственных средств.
Пути введения и соображения относительно фармакологической рецептуры
Было проведено несколько отличных обзоров по выбору педиатрических составов на основе педиатрических предпочтений (например, 4,9,64), а также обзоров физиологических и анатомических различий в педиатрической популяции и последствия при медикаментозной терапии (например,грамм. 65,66). Однако этот обзор объединяет эти аспекты, чтобы выявить проблемы в педиатрических препаратах для альтернативных путей введения.
Пероральная доставка лекарств
Лекарства, вводимые перорально, включают жидкие лекарственные формы (растворы, суспензии, сиропы и эмульсии), а также твердые лекарственные формы, включая таблетки, капсулы, гранулы / посыпки, жевательные таблетки, таблетки, диспергируемые во рту, и таблетки с контролируемым высвобождением. Пероральный путь введения является предпочтительным для пациентов любого возраста по причинам удобства и стабильности.
Жидкости для перорального применения
Считается, что горький вкус, связанный со многими лекарствами, превратился в средство предотвращения проглатывания токсичных веществ 67. Основным препятствием при разработке жидких составов для перорального применения является маскировка вкуса лекарств, поскольку более 90% педиатров в США сообщили, что вкус и привлекательность лекарственного средства были главными препятствиями на пути к завершению лечения 68. В некоторых случаях простого маскирования вкуса недостаточно, и требуются более сложные составы для инкапсулирования лекарственного средства, обеспечивающего скрывающие вкус свойства.Вспомогательные вещества, используемые при разработке продукта, должны быть безопасными и приемлемыми для использования у детей. Наполнители обычно используются для оптимизации рецептуры лекарственного средства с целью улучшения вкусовых качеств, срока хранения и / или производственных процессов. Есть определенные вспомогательные вещества, которые не следует использовать в детских лекарствах, так как они могут замедлить текущее развитие органов, например этанол, пропиленгликоль, бензиловый спирт и парабены 65. Также важно учитывать концентрацию электролита при разработке лекарств для новорожденные, у которых функция почек может быть незрелой.
Максимальный рекомендуемый объем однократной дозировки составляет 5 мл для детей в возрасте до 4 лет и 10 мл для детей в возрасте от 4 до 12 лет в соответствии с проектом руководства EMA 11. Капли жидкости для перорального применения обеспечивают механизм для доставки малых объемов или низких доз препарат для детей и особенно полезен для очень маленьких детей. Приветствуется использование соответствующих измерительных устройств с пероральными лекарствами, особенно использование пероральных шприцев, поскольку они имеют более высокую точность по сравнению с градуированными пипетками или мерными ложками 9.
Жидкости обеспечивают максимальную гибкость дозирования, и можно использовать один состав в широком возрастном диапазоне (включая новорожденных). Однако используемый объем должен быть приемлемым для пациента, а дозирующее устройство должно соответствовать назначению.
Твердые вещества для восстановления
Использование диспергируемых таблеток, порошков, гранул, пеллет или брызг для восстановления является популярной стратегией при разработке педиатрических препаратов, поскольку твердый продукт обычно имеет лучшую стабильность по сравнению с приготовленной жидкостью.Однако эти восстановленные продукты также должны маскироваться по вкусу. Восстановление может происходить либо в момент выдачи, либо в момент введения, в зависимости от продукта. Инструкции по восстановлению могут быть сложными для неподготовленных людей, но важно, чтобы конечный продукт содержал правильную дозировку для пациента. Если эти твердые вещества для восстановления вводятся в отсутствие воды, они подходят только для младенцев, которые принимают твердую пищу (обычно> 6 месяцев).Для твердых веществ с большим размером частиц минимальный возрастной диапазон может быть выше из-за риска аспирации или удушья.
Если диспергируемые продукты не восстанавливаются в соответствующем объеме жидкости, существует риск местного повреждения тканей (аналогично прилипанию таблеток к пищеводу 69) и задержка начала действия, поскольку твердый материал должен раствориться. до абсорбции. Поэтому важно учитывать общую растворимость любого лекарственного средства и то, как это может повлиять на биофармацевтические свойства.
Объем жидкости, используемой для введения диспергируемых таблеток, больше (до 20 мл), чем объемы, обычно используемые для обычных пероральных жидкостей, причем объемы до 20 мл считаются (EMA) подходящими для детей младше возраста. 4 года и объем 50 мл для лиц старше 4 лет 11.
Твердые лекарственные формы для перорального применения – обычные таблетки и капсулы
Обычные таблетки ограничены жестким составом дозы и способностью ребенка проглотить таблетку.Общее мнение таково, что дети будут принимать таблетки в зависимости от размера, тогда как таблетки меньшего размера, скорее всего, будут приемлемы. Таблетки могут быть разделены на части, чтобы уменьшить их размер, но это может привести к неточным дозировкам внутри фрагментированных таблеток 70. В проекте руководства EMA предлагается, чтобы «маленькие таблетки (т.е. таблетки от 3 до 5 мм в диаметре, ширине или длине, в зависимости от того, какая из них самая длинная). ) не будут считаться приемлемыми для детей младше 2 лет, таблетки среднего размера (т.е. таблетки от 5 до 10 мм) для детей младше 6 лет, большие таблетки (т.е. таблетки от 10 до 15 мм) для детей в возрасте до 12 лет и очень большие таблетки (т.е. таблетки от 15 мм) для детей в возрасте до 18 лет 11, однако эта рекомендация была удалена из обновленного руководящего документа 7. Исследования, посвященные использованию мини-таблеток (таблетки ≤3 мм), показали, что мини-таблетки являются потенциальной лекарственной формой, подходящей для детей от 2 до 6 лет (на основе таблеток плацебо диаметром 3 мм) 71. Кроме того, Спомер и его сотрудники обнаружили, что очень маленькие дети (6–12 месяцев) полностью способны глотать мини-таблетки диаметром 2 мм, часто предпочитая их сладким жидким составам 72.
Стандартные размеры капсул составляют от 11,1 мм (размер 5) до 23,3 мм (размер 00) в длину. Нет данных о приемлемости размера капсул у детей, хотя его следует рассматривать как эквивалент таблеток. Капсулы можно открывать и принимать содержимое для улучшения восприятия у детей. Однако это следует делать только тогда, когда это оправдано. Однако содержимое капсулы может иметь неприятный вкус, а биодоступность открытой капсулы может отличаться от биодоступности неповрежденного продукта.
Для взрослых рекомендуемый объем воды, принимаемый с таблетками и капсулами, составляет 250 мл на основании протокола клинического исследования, использованного при разработке таких продуктов 73. Использование меньших объемов может задержать начало абсорбции и снизить общую биодоступность продукта, особенно препараты, которые плохо растворимы в воде 74,75. В литературе нет сообщений о том, что такой же объем воды можно использовать для детей. Следовательно, употребление воды может увеличить вариабельность воздействия, наблюдаемую после приема таблеток у детей.
Жевательные таблетки и составы, диспергируемые во рту
Жевательные таблетки и составы, диспергируемые во рту, должны обладать хорошими органолептическими свойствами, включая хорошее ощущение во рту, на которое влияют кристаллическая структура и растворимость лекарственного средства. Следует учитывать последствия проглатывания таких таблеток целиком, и желательно, чтобы их биодоступность не изменилась. В руководстве ВОЗ предлагается разработать их так, чтобы на этикетке было указано «таблетки, которые можно жевать или глотать целиком» 9.
Таблетки, диспергируемые в ротовой полости, лиофилизаты для полости рта и пленки для перорального применения – твердые продукты, предназначенные для растворения в полости рта. Эти продукты растворяются и диспергируются в слюне для всасывания либо непосредственно из ротовой полости, либо для всасывания из желудочно-кишечного тракта после приема внутрь. Соотношение абсорбции из каждого из этих участков может быть важным, особенно для лекарств, которые демонстрируют различия в биодоступности для каждого пути, например десмопрессин 76.
Эти продукты предлагают уровень фармацевтической стабильности, связанный с твердыми лекарственными формами, и приемлемы даже для очень молодые пациенты.Однако они ограничены жесткостью дозы так же, как и обычные таблетки. Они наиболее подходят для хорошо растворимых лекарств, хотя растворимость лекарства должна быть сбалансирована с маскировкой вкуса, поскольку хорошо растворимые лекарства активируют вкусовые рецепторы на языке, если они растворяются в слюне в полости рта 77. Объем принятой жидкости с такими продуктами также следует учитывать, особенно для плохо растворимых в воде лекарств, как описано ранее.
Назальная доставка лекарств – соображения по составу
Интраназальное введение лекарств удобно с быстрым началом действия, приближающимся к внутривенной терапии, поэтому назальные лекарственные формы обычно используются в педиатрической популяции.Интраназальные препараты можно вводить несколькими способами. Капли можно закапывать из шприца, лекарства можно распылять или давать через аэрозоль под давлением. Все эти способы доставки продемонстрировали свою эффективность 78. Хотя считается, что системы дозирования обеспечивают максимальную точность и воспроизводимость доз, их простота использования может значительно различаться. Нет сообщений о различиях в носовой слизи, pH носа или мукоцилиарном клиренсе у педиатрических пациентов по сравнению со взрослыми.Поэтому предполагается, что эти свойства остаются такими же у детей, как и у взрослых. Нет сообщений о педиатрических конкретных назальных составах, которые отличаются от продуктов для взрослых. Однако сходство в анатомии и физиологии гарантирует, что продукты, вероятно, будут действовать одинаково у взрослых по сравнению с детьми с небольшим количеством сообщений о побочных эффектах после назальной доставки лекарств.
Доставка лекарств в глаза – рекомендации по составу
Многие глазные лекарства, такие как капли, мази, гели и вкладыши, используются у детей для лечения распространенных бактериальных и вирусных инфекций, воспалений и аллергии, увеита и глаукомы, а также других состояний, включая миопию. , амблиопия и косоглазие.Заболевания глаз распространены в педиатрической популяции. В Соединенном Королевстве более 5% детей имели хотя бы одно заболевание глаз к возрасту 3 лет 79.
Глаз новорожденного составляет примерно две трети его взрослого размера, достигая взрослого размера в возрасте от 3 до 4 лет. лет 80. В глазу у новорожденных и младенцев тонкие оболочки, поэтому всасывание лекарств и проникновение через роговицу могут быть более быстрыми в этих группах 81,82. Роговица новорожденного имеет 70% абсорбирующей поверхности роговицы взрослого человека, но общий внутриглазный объем составляет лишь одну треть глаза взрослого 83.Площадь контакта между задней конъюнктивой и глазным яблоком составляет около 4 см 2 у взрослых 84. У детей эта площадь будет уменьшена. Следовательно, отношение площади поверхности к внутреннему объему может привести к тому, что лекарства будут в некоторой степени сконцентрированы в глазах педиатрических пациентов.
Объем базальной слезы увеличивается с возрастом. Типичные указанные объемы составляют 0,5 мкл (диапазон 0,6–2 мкл) для новорожденных, 2,5 мкл (диапазон 1,4–7,75 мкл) для младенцев (средний возраст 7 недель) в более старшем возрасте и 6 мкл (диапазон 2.73–12,75 мкл) у взрослых 85. Возрастное уменьшение объема слезы может привести к тому, что лекарства, применяемые для местного применения, будут концентрироваться у более молодых пациентов.
Местное применение глазных препаратов может вызвать серьезные побочные эффекты в глазах или системный. Дети подвержены большему риску системных побочных эффектов, потому что глазная доза не регулируется по весу, и младенцы особенно уязвимы, особенно в случаях, когда метаболизм лекарств у молодых и / или незрелый гематоэнцефалический барьер 86.
Существуют примеры, когда местное применение офтальмологических препаратов у детей приводило к повышенным системным концентрациям лекарств или системным побочным эффектам. Примеры включают:
повышенные концентрации бримонидина в плазме 1459 пг / мл -1 и 700 пг / мл -1 после инстилляции через глаз (по сравнению с опубликованными исследованиями взрослых, которые показывают максимальную концентрацию 60 пг / мл -1 ), что приводит к сонливости или коме 86 , 87.
У пяти маленьких детей концентрация тимолола в крови варьировалась от 3 до 3.От 5 до 34 нг мл -1 , в отличие от 2,45 нг мл -1 у взрослых после местного глазного введения 88.
Системное воздействие офтальмологического раствора латанопроста 0,005% один раз в день было выше в возрастной группе <3 лет (166 пг / мл -1 ) против . другие группы (49, 16 и 26 мкг / мл -1 для возрастных групп 3– <12 лет, 12– <18 лет и ≥18 лет, соответственно 89.
Повышенное системное воздействие, наблюдаемое у педиатрических пациентов, связано с абсорбцией глазных капель в системный кровоток, где уменьшенный размер пациента приводит к более высоким плазменным концентрациям циркулирующего лекарственного средства.
Расчет дозировки для педиатрических пациентов сложен. Вес тела, площадь поверхности, развитие, метаболизм, другие принимаемые лекарства и физиологическая функция могут влиять на дозировку. Фармакокинетические модели, которые регулируют дозировку на основе объема водянистой влаги, были ранее предложены для местного применения пилокарпина 90. По оценкам, новорожденному требуется только половина взрослой дозы глазных капель для получения эквивалентной концентрации в глазах; две трети дозы для взрослых требуется в возрасте 3 лет и 90% этой дозировки в возрасте 6 лет. 83
Анатомические и физиологические различия в глазах новорожденных и младенцев делают их уязвимыми к системным эффектам местных глазных препаратов.Необходимы дальнейшие исследования, чтобы понять, как составы ведут себя в педиатрической популяции. Кроме того, может возникнуть необходимость в изготовленном на заказ педиатрическом устройстве для доставки, чтобы обеспечить меньшую дозу лекарств для местного применения.
Доставка лекарств для ушей – рекомендации по составу
Лекарства, которые действуют на ухо в педиатрической популяции, включают методы лечения наружного отита, среднего отита и удаление ушной серы. Эти лекарства чаще всего применяются в виде ушных капель и спреев.Обычно используется небольшой объем, так как излишки будут выводиться из ушного прохода.
Наружное ухо человека не полностью созревает при рождении, и с возрастом происходят различные анатомические и физиологические изменения. Наружный слуховой проход у младенца более прямой, уже и намного короче, чем у взрослого. Объем EAC увеличивается с возрастом от среднего значения 0,56 мл 91 в возрасте 4–5 лет до 0,70–0,98 мл у взрослых 92. Дозирующие устройства позволяют вводить меньшие дозы педиатрическим пациентам и поскольку нет значительного системного поглощения от Лекарства, вводимые через слух, мало предполагают различий в лечении педиатрических пациентов по сравнению со взрослыми.
Офтальмологические лекарственные формы регулярно используются в педиатрической практике. Нет сообщений о педиатрических специфических составах, которые отличались бы от продуктов для взрослых. Тем не менее, сходство в анатомии и физиологии гарантирует, что продукты, вероятно, будут действовать одинаково у взрослых по сравнению с детьми с небольшим количеством сообщений о побочных эффектах после ушной доставки лекарств
Ректальная доставка лекарств – рекомендации по составу
Ректальные препараты используются для лечения обоих местные и системные нарушения у детей.Обычно они поставляются в виде кремов, мазей, суппозиториев, пен, спреев и клизм. Ректальный способ введения особенно полезен для младенцев и детей, которым трудно глотать пероральные лекарства. Этот путь также полезен в случаях тошноты и рвоты или когда присутствующие заболевания верхних отделов кишечника могут повлиять на всасывание перорального лекарственного средства.
Диаметр, длина и объем прямой кишки изменяются в процессе развития, и взрослые размеры достигаются примерно к 10 годам 93 года.Длина прямой кишки увеличивается с возрастом с 4 см у новорожденного, 6 см в 1 год, 7 см в 5 лет, 9 см в 10 лет, 10 см в 15 лет и 10,5 см у взрослого 94. Диаметр прямой кишки у взрослых возраст детей 7 лет был приблизительно равен 21 мм Joensson и соавторами 95.
Ректальное введение парацетамола недоношенным детям исследовали van Lingen и его сотрудники. Их результаты показали, что наблюдается быстрое всасывание с более высокими концентрациями, достигнутыми у пациентов в возрасте от 28 до 32 недель по сравнению с пациентами старше 32 недель, хотя вводимая доза была рассчитана на основе –1 мг / кг 96.Более высокая абсорбция у самых маленьких пациентов может быть фактором как уменьшения толщины стенки прямой кишки, так и уменьшения толщины внешней кожи, наблюдаемого у недоношенных детей. На повышение концентрации в плазме крови может также влиять незрелость печеночного метаболизма у более молодых людей 66.
Исторически пероральные жидкие препараты или растворы для инъекций вводились ректально, когда пероральное введение было неприемлемым и не было специальных ректальных препаратов.Ректальная доставка пероральных жидких препаратов противоэпилептических агентов была исследована Graves & Kriel 97. Они обнаружили, что большинство из них хорошо переносились и продемонстрировали клиническую эффективность. Раствор диазепама для ректального введения обеспечивает быструю системную концентрацию и улучшение клинических результатов по сравнению с суппозиторием диазепама у детей 98.
Корректировка дозы у педиатрических пациентов обычно производится в зависимости от веса, роста или площади поверхности тела. С точки зрения ректальной доставки лекарств для системного действия, площадь ректальной абсорбирующей поверхности является важным фактором, который следует учитывать.Хотя корректировка дозы растворов и суспензий относительно проста, использование суппозиториев во многих случаях ограничивает простую корректировку дозы. Детские суппозитории, как правило, производятся в соответствии с размером, подходящим для детей (номинальный вес 1 г). При необходимости у педиатрических пациентов используются части суппозиториев для взрослых, поскольку предполагается, что существует равномерное распределение активного вещества в матрице суппозитория. Однако вряд ли будут какие-либо данные о точности или стабильности для такой практики, и полученная форма может не быть оптимальной для ректального введения.
Состав педиатрических лекарственных форм для ректального введения следует тем же принципам, что и для продуктов для взрослых. Для системно всасываемых ректальных продуктов необходимо тщательно рассмотреть вопрос о корректировке дозировки в педиатрической популяции. Следует учитывать размеры педиатрических суппозиториев, чтобы они были максимально приемлемы для пациентов и лиц, осуществляющих уход.
Парентеральная доставка лекарств
Внутривенные инъекции готовятся с использованием тех же принципов, что и для продуктов для взрослых, хотя может возникнуть необходимость учитывать нагрузку вспомогательными веществами, чтобы убедиться, что это подходит для детей.Главный недостаток внутривенного введения у педиатрических пациентов связан с использованием игл, а также с болью и страхом, связанными с иглами.
Внутримышечные инъекции могут обеспечить депо активного лекарственного средства, которое снижает частоту инъекций, хотя ограниченная мышечная масса новорожденных и недоношенных новорожденных ограничивает широкое использование этого типа введения в этой популяции. Однако в развивающихся странах i.m. администрация является обычным делом из-за трудностей, связанных с получением i.v. доступ и поддержание i.v. линия у детей 99.
У новорожденных наблюдается снижение кровотока в скелетных мышцах и неэффективные мышечные сокращения из-за их ограниченных движений, что может снизить скорость всасывания лекарств после внутримышечного введения 100. Однако у новорожденных и младенцев наблюдается более высокая плотность капилляров скелетных мышц по сравнению с детьми старшего возраста, что объясняет более высокую эффективность внутримышечного всасывания амикацина 101 и цефалотина 102 у детей младшего возраста.
Подкожный путь обычно используется у детей для введения широкого спектра фармакологических препаратов, включая вакцинацию, антикоагулянты, анальгетики, инсулин, гормоны роста и некоторые противораковые средства 103. Типичные объемы подкожного введения ограничиваются <2 мл для взрослых и <1 мл у детей 104. Альтернатива подкожным инъекциям включает использование безыгольных инъекционных устройств, таких как струйные инъекторы 105, которые доставляют лекарства через кожу под высоким давлением или с помощью микроигл 106.Однако существует очень ограниченное количество исследований, в которых сообщается об использовании этих технологий у детей. Обычно перечисленное преимущество заключается в уменьшении боли, обеспечиваемой такими устройствами, однако никаких значительных различий в боли между введением инсулина с помощью иглы и струей жидкости с использованием устройства Vitajet II® не было обнаружено в исследовании с участием пациентов в возрасте 9–21 лет 107.
Для парентерального введения необходимо учитывать объем дозы, чтобы гарантировать его точное измерение, а не полагаться на серийные разведения, когда ошибки более вероятны с серьезными последствиями 108.
Кожная и трансдермальная доставка
Кожа претерпевает множество изменений в процессе развития. Это необходимо учитывать при нанесении на кожу педиатрических составов как местного, так и системного действия. Роговой слой не поврежден вскоре после рождения (<1 месяца), но способ хранения и транспортировки воды становится похожим на взрослый только после первого года жизни 109. Отношение площади поверхности к массе тела у новорожденного намного выше по сравнению с со взрослым. Следовательно, объем распределения ниже на единицу площади кожи в педиатрической популяции 110.
Препараты для кожного (или кожного) введения включают жидкие препараты (лосьоны и шампуни), полутвердые препараты (мази и кремы) и твердые препараты (порошки). Хотя эти продукты обычно считаются безопасными с точки зрения абсорбции, более высокие уровни могут быть достигнуты у педиатрических пациентов или там, где кожа повреждена.
Новорожденные младенцы регулярно подвергаются воздействию широкого спектра средств местного действия, включая средства от сыпи, противомикробные средства, растворители и кожные барьеры или увлажняющие средства.Вспомогательные вещества, используемые в таких продуктах, требуют тщательного рассмотрения, поскольку трансдермальная абсорбция пропиленгликоля из антисептической повязки, используемой для недоношенного ребенка, привела к тому, что ребенок впал в состояние комы. Полное выздоровление произошло после прекращения местного лечения 111.
Коррекция дозы для детей для местных продуктов обычно относительно проста из-за характера продукта, который не связан с жесткими дозировками. Однако определение единицы дозы может быть затруднено.
Педиатрическая популяция является привлекательной мишенью для эффективного трансдермального введения лекарств, поскольку их кожа сравнительно тонкая и хорошо перфузируется. Трансдермальные пластыри используются для доставки детям таких лекарств, как скополамин, фентанил, оксибутинин и метилфенидат. В нормативных документах говорится, что «размер и форма трансдермальных пластырей и лечебных пластырей должны соответствовать размеру и форме тела ребенка и не должны мешать повседневной жизни» 11.Пластыри и пластыри обычно разрабатываются для использования в виде разовой дозы / дозировки. Хотя некоторые пластыри можно вырезать для частичного введения пластыря, разрезание других разрушает высвобождение лекарства.
Состав, используемый в трансдермальных пластырях, может быть аналогичным для взрослого и педиатрического населения при условии, что использование вспомогательных веществ подходит для лечения младенцев самого раннего возраста.
Легочная доставка лекарств
Ингаляционные лекарства обычно назначают младенцам и маленьким детям, страдающим астмой и муковисцидозом.Размер дыхательных путей, частота дыхания, скорость потока вдоха / выдоха и характер дыхания, а также объемы и емкость легких резко меняются в течение первых месяцев и лет жизни. Например, облигатное носовое дыхание является обычным явлением при рождении и может сохраняться до возраста 12 месяцев, что приводит к существенным различиям в маршрутах, по которым вдыхаемый материал попадает в легкие 112.
Устройства для доставки, используемые в педиатрической популяции, такие же, как и те, что используются в педиатрии. используются у взрослых, хотя их часто модифицируют, прикрепляя маску маленького младенца или ребенка.Нет клинических доказательств, демонстрирующих лучший клинический ответ с интерфейсами или между ними (например, маска против . Мундштук) 113,114. Поэтому выбор интерфейсов больше зависит от возраста, переносимости устройства и предпочтений пациента. Распыленные жидкости потенциально подходят для маленьких детей, которые не могут использовать дозированные ингаляторы (MDI) и ингаляторы сухого порошка (DPI). MDI могут подходить для детей с рождения в сочетании со спейсером. Спейсер избавляет пациента от необходимости координировать приведение в действие с вдохом.Лицевая маска требуется до тех пор, пока ребенок не научится обращаться с мундштуком. ПИ могут применяться у детей в возрасте от 4 до 5 лет, так как требуется минимальный инспираторный поток. DPI и MDI предпочтительнее для детей старшего возраста из-за их портативности и удобства.
Корректировка дозы для ингаляционных лекарств обычно основана на массе тела, где для детей от 3 до 12 лет допустимо экстраполяция доз для взрослых 112. Для ингаляционных лекарств дозировку контролирует устройство доставки, и это очень важно для педиатрической популяции. .Однако используемые устройства обычно такие же, как и у взрослых, адаптированные для контроля вводимой дозы.
Выводы
Педиатрические составы должны подходить для ребенка с точки зрения дозы, удобства и приемлемости, чтобы гарантировать соблюдение режима лечения. Существуют различия в детской анатомии и физиологии, которые могут повлиять на эффективность лекарственного средства, отличную от наблюдаемой у взрослых. При разработке педиатрической рецептуры необходимо учитывать эти физиологические различия, чтобы гарантировать, что фармакокинетический профиль препарата не будет нарушен.Это особенно актуально для новорожденных и младенцев, наиболее далеких по уровню развития от взрослого.
Составы препарата могут привести к различиям в фармакокинетических профилях лекарственного средства, что подчеркивает риски, связанные с использованием лекарств, не указанных по назначению, которые манипулируют для введения детям. Лица, назначающие лекарства, должны знать о последствиях манипулирования лекарственными формами, особенно для лекарств с узким терапевтическим индексом, даже при немедленном приготовлении рецептур фармацевтом, когда нет достаточных данных о качестве продукта.Кроме того, медицинские работники должны знать, что пациенты и их опекуны часто дополнительно манипулируют лекарствами, чтобы помочь в соблюдении режима лечения, особенно в педиатрической популяции, где манипулировали 19% всех лекарств, вводимых детям 115.
Вспомогательные вещества, используемые в педиатрических препаратах, должны быть подходит для возрастной группы 116–118 лет, чтобы избежать последствий токсичности наполнителя. Приемлемость лекарств педиатрическим пациентам также имеет большое значение для ребенка, получающего адекватную терапию.Известно, что приятные на вкус составы позволяют добиться большего соответствия. Следовательно, это имеет решающее значение при разработке новой педиатрической рецептуры. 119.
Конкурирующие интересы
Оба автора заполнили единую форму конкурирующих интересов на http://www.icmje.org/coi_disclosure.pdf (доступна по запросу в соответствующем автора) и заявляем, что HKB получал поддержку от Национального института исследований в области здравоохранения, Сеть исследований лекарственных средств для детей в отношении представленной работы, никаких финансовых отношений с какими-либо организациями, которые могли бы быть заинтересованы в представленной работе в предыдущие 3 года, и никаких других отношений или действий, которые могло повлиять на представленную работу.
Автор (HB) хотел бы поблагодарить Национальный институт исследований в области здравоохранения, сеть исследований лекарственных средств для детей, за поддержку этого исследования .
Ссылки
- Гиллис Дж., Лафлан П. Не только маленькие взрослые: метафоры педиатрии. Arch Dis Child. 2007; 92: 946–947. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Chamley C, Carson P, Randall D, Sandwell W. 2005. Анатомия развития и физиология детей – практический подход: Черчилль Ливингстон.
- Макинтош Н., Хелмс П.Дж., Смит Р.Л., Логан С. Форфар и учебник педиатрии Арнейла. 7 изд. Эдинбург: Эльзевир; 2008. [Google Scholar]
- Сэм Т., Эрнест ТБ, Уолш Дж., Уильямс Дж. Л. от имени Европейской педиатрической рецептуры I. Подход «соотношение пользы / риска» к выбору подходящих фармацевтических лекарственных форм. Приложение для выбора детской лекарственной формы. Int J Pharm. 2012; 435: 115–123. [PubMed] [Google Scholar]
- Strickley RG, Iwata Q, Wili S, Dahl TC.Педиатрические препараты – обзор имеющихся в продаже пероральных препаратов. J Pharm Sci. 2008; 97: 1731–1774. [PubMed] [Google Scholar]
- Брейткройц Дж., Боос Дж. Доставка и составы лекарств. Handb Exp Pharmacol. 2011; 205: 91–107. [PubMed] [Google Scholar]
- EMA. Руководство по фармацевтической разработке лекарственных средств для использования в педиатрии, Ред.1. 2013. . EMA / CHMP / QWP / 805880/2012; Доступно по адресу: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2013/01/WC500137023.pdf (последний доступ 11 октября 2013 г.)
- IOM. 2012. Безопасные и эффективные лекарства для детей: педиатрические исследования, проведенные в рамках BPCA и PREA. Консенсусный отчет; Доступно по адресу: http://www.iom.edu/Reports/2012/Safe-and-Effective-Medicines-for-Children.aspx (последний доступ 11 октября 2013 г.)
- ВОЗ. 2012. Разработка педиатрических лекарств: моменты, которые следует учитывать при разработке. Комитет экспертов ВОЗ по спецификациям для фармацевтических препаратов Серия технических отчетов ВОЗ № 970; сорок шестой отчет 197-225.
- EMA. 2011. ICH E11 Клинические исследования лекарственных препаратов в педиатрической популяции; Доступно по адресу: http://jppsg.ac.uk/racdv/resgov/Resources/271199en.pdf (последнее посещение – 11 октября 2013 г.)
- EMA. 2011. Проект руководства по фармацевтической разработке лекарственных средств для использования в педиатрии. EMA / CHMP / QWP / 180157/2011 Комитет по лекарственным средствам для человека (CHMP).
- Эдгинтон А.Н., Фотаки Н. Пероральная абсорбция лекарств в педиатрической популяции. В: Dressman J, Reppas C, редакторы.Всасывание пероральных препаратов: прогноз и оценка. 2-е изд. Нью-Йорк: Informa Healthcare; 2010. С. 108–126. [Google Scholar]
- Ричи Р., Шах У., Пик М., Крейг Дж. В., Форд Дж. Л., Баркер К. Э., Нанн А. Дж., Тернер Массачусетс. Манипуляции с лекарствами для достижения необходимой дозы являются неотъемлемой частью педиатрической практики, но не поддерживаются руководящими принципами или доказательствами. BMC Pediatr. 2013; 13: 1–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- EMA. 2013 г. Пересмотренный предварительный список приоритетов для исследований педиатрических лекарственных средств, не имеющих патента EMA / 98717/2012 Разработка и оценка лекарственных средств для человека.
- ВОЗ. 2013. Примерный перечень ВОЗ основных лекарственных средств для детей.
- Tomlin S, Cokerill H, Costello I, Griffith R, Hicks R, Sutcliffe A, Tuleu C. 2009. Повышение безопасности лекарств для детей – руководство по использованию нелицензированных лекарств у педиатрических пациентов. Справочник руководящих принципов. Сеть медсестер.
- FDA. 2002. Руководство для промышленности: исследования биодоступности пищевых продуктов и биоэквивалентности с пищей. В: CfDEaRC Министерства здравоохранения и социальных служб США, редактор.
- Фальчук Г.С., Сарантопулос Дж., Курцрок Р., Мита А.С., Фу С., Мита М.М., Чжоу Х, Милч К., Юнг Дж., Венкатакришнан К., Розен Л.С.Фаза 1 исследования относительной биодоступности прототипа перорального раствора (OS) исследуемого ингибитора киназы Aurora A (AAK) alisertib (MLN8237) в отношении препарата в форме порошка в капсуле (PIC) у пациентов с развитыми солидными опухолями. Mol Cancer Ther. 2011; 10 (11 Прил.1): B194. [Google Scholar]
- Лышкевич Д.А., Левичек З., Козер Э., Ягев Ю., Моретти М., Хард М., Корен Г. Биодоступность педиатрической суспензии амлодипина. Педиатр Нефрол. 2003. 18: 675–678. [PubMed] [Google Scholar]
- Джимде А.А., Текете М., Абдулла С., Лаймо Дж., Бассат К., Мандомандо I, Лефевр Дж., Боррманн С., Группа BS.Фармакокинетические и фармакодинамические характеристики нового педиатрического препарата артеметер-люмефантрин у африканских детей с неосложненной малярией Plasmodium falciparum . Антимикробные агенты Chemother. 2011; 55: 3994–3999. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Abdulla S, Amuri B, Kabanywanyi AM, Ubben D, Reynolds C, Pascoe S, Fitoussi S, Yeh CM, Nuortti M, Séchaud R, Kaiser G, Lefèvre G. Ранняя клиническая разработка диспергируемой таблетки артеметер-люмефантрин: три вкуса и биодоступность у здоровых людей.Малар Дж. 2010; 9: 253. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ramharter M, Kurth FM, Bélard S, Bouyou-Akotet MK, Mamfoumbi MM, Agnandji ST, Missinou MA, Adegnika AA, Issifou S, Cambon N, Heidecker JL, Kombila М, Кремснер П.Г. Фармакокинетика двух детских лекарственных форм артесуната мефлохина при лечении неосложненной малярии falciparum в Габоне. J Antimicrob Chemother. 2007. 60: 1091–1096. [PubMed] [Google Scholar]
- Гутьеррес М. М., Николас Л. Б., Донаццоло И., Дингеманс Дж.Относительная биодоступность недавно разработанного педиатрического препарата бозентана по сравнению с . формулировка для взрослых. Int J Clin Pharmacol Ther. 2013; 51: 529–536. [PubMed] [Google Scholar]
- Teng R, Hansson AC, Borjesson I. Пероральная биодоступность суспензии кандесартана цилексетила. J Pharm Technol. 2007. 23: 270–274. [Google Scholar]
- Цзоу Дж., Ди Б., Ву Ц.Й., Ху Ц., Ли Дж. Х., Чжу И, Фань Х, Сяо Д., Ван Г. Дж. Сравнение фармакокинетики и биоэквивалентности однократной дозы 100 мг порошковой суспензии и таблеток цефтерама пивоксила: открытое двухпериодное перекрестное исследование с рандомизированной последовательностью на здоровых китайских взрослых мужчинах-добровольцах.Clin Ther. 2008. 30: 654–660. [PubMed] [Google Scholar]
- Кеес Ф., Бухер М., Шведа Ф., Гшайдмайер Х., Фаербер Л., Зейферт Р. Сравнение неоиммуна и неорала: исследование биоэквивалентности на здоровых добровольцах и влияние жирной пищи на биодоступность неоиммуна . Наунин Шмидебергс Arch Exp Pathol Pharmakol. 2007; 375: 393–399. [PubMed] [Google Scholar]
- Whipple JK, Lewis KS, Weitman SD, Ausman RK, Bourne DW, Andrews W., Adams MB, Sasse EA, Quebbeman EJ. Фармакокинетическая оценка новой пероральной лекарственной формы циклоспорина.Фармакотерапия. 1994. 14: 105–110. [PubMed] [Google Scholar]
- Acott PD, Crocker JF, Renton KW. Оценка факторов эффективности, влияющих на две формы циклоспорина у детей, перенесших трансплантацию почки. Transplant Proc. 2006; 38: 2835–2841. [PubMed] [Google Scholar]
- van Mourik ID, Thomson M, Kelly DA. Сравнение фармакокинетики Неорала и Сандиммуна у стабильных педиатрических реципиентов трансплантата печени. Liver Transpl Surg. 1999; 5: 107–111. [PubMed] [Google Scholar]
- De Guchtenaere A, Van Herzeele C, Raes A, Dehoorne J, Hoebeke P, Van Laecke E, Van Laecke E, Vande Walle J.Препарат десмопрессина на основе лиофилизата для перорального применения: превосходная фармакодинамика по сравнению с таблеткой из-за низкого взаимодействия с пищей. J Urol. 2011; 185: 2308–2313. [PubMed] [Google Scholar]
- Queckenberg C, Wachall B, Erlinghagen V, Di Gion P, Tomalik-Scharte D, Tawab M, Gerbeth K, Fuhr U. Фармакокинетика, фармакодинамика и сравнительная биодоступность однократного перорального приема 2 мг дозы дексаметазона в жидких и таблетированных формах: рандомизированное контролируемое перекрестное исследование на здоровых взрослых добровольцах.Clin Ther. 2011; 33: 1831–1841. [PubMed] [Google Scholar]
- Ким К. А., Лим Дж. Л., Ким С., Пак Дж. Й. Фармакокинетическое сравнение перорально распадающихся форм и традиционных составов донепезила у здоровых корейских мужчин: рандомизированное открытое, двухпоследовательное, двухпериодное перекрестное исследование с однократной дозой. Clin Ther. 2011; 33: 965–972. [PubMed] [Google Scholar]
- ter Heine R, Scherpbier HJ, Crommentuyn KML, Bekker V, Beijnen JH, Kuijpers TW, Huitema ADR. Фармакокинетическое и фармакогенетическое исследование эфавиренца у детей: рекомендации по дозировке могут привести к субтерапевтическим концентрациям.Антивир Тер. 2008. 13: 779–787. [PubMed] [Google Scholar]
- Wire MB, Bruce J, Gauvin J, Pendry CJ, McGuire S, Qian Y, Brainsky A. Рандомизированное открытое пятипериодное сбалансированное перекрестное исследование для оценки относительной биодоступности порошок элтромбопага для пероральной суспензии (PfOS) и состав таблеток и влияние еды с высоким содержанием кальция на фармакокинетику элтромбопага при введении с или за 2 часа до или после PfOS. Clin Ther. 2012; 34: 699–709. [PubMed] [Google Scholar]
- Ван Л. Х., Визния А. А., Ратор М. Х., Читтик Г. Е., Бакши С. С., Эммануэль П. Дж., Флинн П. М..Фармакокинетика и безопасность однократных пероральных доз эмтрицитабина у детей, инфицированных вирусом иммунодефицита человека. Антимикробные агенты Chemother. 2004. 48: 183–191. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kovarik JM, Noe A., Berthier S, McMahon L, Langholff WK, Marion AS, Hoyer PF, Ettenger R, Rordorf C. биодоступность, пищевой эффект и фармакокинетика в устойчивом состоянии. J Clin Pharmacol. 2003. 43: 141–147. [PubMed] [Google Scholar]
- Мониф Т., Рао Туди Н., Кундинья Типпабхотла С., Хуроо А., Марва А., Кумар Шривастав В., Тандон М., Рагхуванши Р., Бисвал С.Одноразовое рандомизированное открытое двухпериодное перекрестное исследование биоэквивалентности педиатрической комбинации ламивудина 40 мг, невирапина 70 мг и ставудина 10 мг таблетки для пероральной суспензии с индивидуальными жидкими препаратами у здоровых взрослые добровольцы мужского пола. Clin Ther. 2007. 29: 2677–2684. [PubMed] [Google Scholar]
- Monif T, Reyar S, Tiwari HK, Tippabhotla SK, Khuroo A, Thudi NR, Ahmed S, Raghuvanshi R. Рандомизированное открытое двухпериодное перекрестное исследование биоэквивалентности с однократной дозой. сравнение педиатрической комбинации ламивудина и ставудина с фиксированной дозой для пероральной суспензии с индивидуальными жидкими препаратами у здоровых взрослых мужчин-добровольцев.Arzneimittelforschung. 2009. 59: 104–108. [PubMed] [Google Scholar]
- Liu YM LiuG-Y, Liu Y, Li SJ JiaJ-Y, Zhang MQ, Lu C, Zhang YM LiX-N, Yu C. Сравнение фармакокинетики и биоэквивалентности между перорально распадающимися формами таблеток и обычными таблетками флурбипрофена: открытое двухпериодное перекрестное исследование однократной дозы с рандомизированной последовательностью на здоровых китайских добровольцах-мужчинах. Clin Ther. 2009; 31: 1787–1795. [PubMed] [Google Scholar]
- de Montalembert M, Bachir D, Hulin A, Gimeno L, Mogenet A, Bresson JL, Macquin-Mavier I, Roudot-Thoraval F, Astier A, Galacteros F.Фармакокинетика гидроксимочевины 1000 мг хрупких таблеток, покрытых оболочкой, и капсул 500 мг у детей и взрослых пациентов с серповидно-клеточной анемией. Haematologica. 2006. 91: 1685–1688. [PubMed] [Google Scholar]
- Марселин-Хименес Дж., Анхелес-Морено А. П., Контрерас-Завала Л., Моралес-Мартинес М., Ривера-Эспиноза Л. Однодозовое трехпериодное перекрестное исследование с шестью последовательностями, сравнивающее биодоступность раствора, суспензии и таблеток вальпроата магния с энтеросолюбильным покрытием у здоровых мексиканских добровольцев в условиях голодания.Clin Ther. 2009; 31: 2002–2011. [PubMed] [Google Scholar]
- Knorr B., Hartford A, Li X, Yang AY, Noonan G, Migoya E. Биоэквивалентность 4-мг пероральных гранул и составов жевательных таблеток Монтелукаста. Arch Drug Inf. 2010; 3: 37–43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Zhang Q, Tao Y, Zhu Y, Zhu D. Сравнение биоэквивалентности и фармакокинетики двух составов микофенолятмофетила у здоровых китайских добровольцев мужского пола: открытая рандомизированная последовательность, однократное двустороннее перекрестное исследование.Clin Ther. 2010. 32: 171–178. [PubMed] [Google Scholar]
- Абдель-Рахман С.М., Джонсон Ф.К., Готье-Дюбуа Г., Вестон И.Е., Кернс Г.Л. Биоэквивалентность низатидина (Axid) в двух пероральных жидких препаратах для немедленного приема и одном коммерческом препарате по сравнению с капсулой. J Clin Pharmacol. 2003. 43: 148–153. [PubMed] [Google Scholar]
- Армандо Ю.П., Шрамм С.Г., де Фрейтас Сильва М., Кано Е.К., Куно ЕЕМ, Порта V, дос Рейс Серра СН. Анализ биоэквивалентности между перорально распадающимися формами и обычными таблетками на здоровых добровольцах.Int J Pharm. 2009; 366: 149–153. [PubMed] [Google Scholar]
- Ахмед М., Моррель Е.М., Клементе Э. Биодоступность и фармакокинетика нового жидкого препарата преднизолона в сравнении с двумя коммерчески доступными жидкими препаратами преднизолона. Curr Ther Res Clin Exp. 2001; 62: 548–556. [Google Scholar]
- Хуарес Ольгин Х., Флорес Перес С., Рамирес Мендиола Б., Барранко Гардуно Л., Сандовал Рамирес Е., Флорес Перес Дж. Сравнительная биодоступность пропафенона после введения магистральной суспензии по сравнению скоммерческие таблетки для здоровых добровольцев. Arzneimittelforschung. 2009; 59: 117–120. [PubMed] [Google Scholar]
- Huang M, Shen-Tu J, Hu X, Chen J, Liu J, Wu L. Сравнительная биодоступность диспергируемых и обычных таблеток рисперидона натощак: однократная доза, рандомизированная последовательность, открытая метка, двухпериодное перекрестное исследование на здоровых китайских добровольцах-мужчинах. Clin Ther. 2012; 34: 1432–1439. [PubMed] [Google Scholar]
- Critchley D. 1FC1.2 – новая пероральная жидкость / суспензия руфинамида для пациентов с синдромом Леннокса-Гасто.Eur J Paediatr Neurol. 2011; 15 (Приложение 1): S10. [Google Scholar]
- Mulligan S, Devane J, Martin M. Фармакокинетические характеристики нового препарата сальбутамола с контролируемым высвобождением для распыления. Eur J Drug Metab Pharmacokinet. 1991; 3 (Спец. № 3): 312–314. [PubMed] [Google Scholar]
- Гао X, Роберт Л., О’Горман М., Кук Дж. Недавно разработанный педиатрический состав revatio для педиатрических пациентов с легочной артериальной гипертензией биоэквивалентен коммерческой таблетке revatio 1X20 MG и таблетке 2X10 MG. Таблетки для клинических испытаний силденафила цитрата на здоровых взрослых добровольцах.Clin Pharmacol Ther. 2012; 91: S38–39. [Google Scholar]
- Лидерт Б., Форссманн У., Волна П., Голоб М., Ковар А. Сравнение фармакокинетики, безопасности и переносимости двух концентраций нового жидкого рекомбинантного гормона роста человека и лиофилизированного препарата. BMC Clin Pharmacol. 2010; 10: 14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Иннес С., Норман Дж., Смит П., Смэтс М., Каппарелли Э., Розенкранц Б., Коттон М. Биоэквивалентность диспергированного ставудина: дозирование в открытых и закрытых капсулах.Антивир Тер. 2011; 16: 1131–1134. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Vanprapar N, Cressey TR, Chokephaibulkit K, Muresan P, Plipat N, Sirisanthana V, Prasitsuebsai W, Hongsiriwan S, Chotpitayasunondh T., Eksaengsri A, Toye M, Eksaengsri A, Toye M, Smith Макинтош К., Каппарелли Э., Йогев Р., Team IP. Жевательная педиатрическая комбинированная таблетка с фиксированной дозой ставудина, ламивудина и невирапина: фармакокинетика и безопасность по сравнению с индивидуальными жидкими препаратами у детей, инфицированных вирусом иммунодефицита человека в Таиланде.Pediatr Infect Dis J. 2010; 29: 940–944. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- DuBois SG, Shusterman S, Reid JM, Ingle AM, Ahern CH, Baruchel S, Glade-Bender J, Ivy P, Adamson PC, Blaney SM. Переносимость и фармакокинетический профиль порошковой композиции сунитиниба у педиатрических пациентов с рефрактерными солидными опухолями: исследование детской онкологической группы. Cancer Chemother Pharmacol. 2012; 69: 1021–1027. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Campos A, Espinosa L, Medrano N, Alonso-Melgar A, Alonso L, Nuno-Almeida G, Tong H, Ramirez E, Frias-Iniesta J, Carcas-Sansuan AJ.Относительная биодоступность двух препаратов такролимуса: Прографа (нормальное высвобождение) и Адваграфа (замедленное высвобождение) у детей с трансплантацией почки. Basic Clin Pharmacol Toxicol. 2011; 109: 46. (Тезисы собрания. FI – 2371. Q2) [Google Scholar]
- Доу NC, Сантана В.М., Яконо Л.К., Фурман В.Л., Хокинс Д.Р., Хаутон П.Дж., Панетта Дж.С., Гаджар А.Дж., Стюарт К.Ф. Фаза I и фармакокинетическое исследование топотекана, вводимого перорально один раз в день в течение 5 дней в течение 2 недель подряд педиатрическим пациентам с рефрактерными солидными опухолями.J Clin Oncol. 2004. 22: 829–837. [PubMed] [Google Scholar]
- Сетчелл К.Д.Р., Галзинья Л., О’Коннелл Н., Брунетти Дж., Таушель HD. Биоэквивалентность нового жидкого препарата урсодезоксихолевой кислоты (суспензия Урсофальк) и капсул Урсофалька, измеренная с помощью фармакокинетики плазмы и обогащения желчи. Алимент Pharmacol Ther. 2005. 21: 709–721. [PubMed] [Google Scholar]
- Песковиц, доктор медицины, Джейн А., Робсон Р., Малгаонкар С., Фриман Р., Боу М.Р. Установление фармакокинетической биоэквивалентности перорального раствора валганцикловира и таблетированной формы.Transplant Proc. 2007. 39: 3111–3116. [PubMed] [Google Scholar]
- Verrotti A, Nanni G, Agostinelli S, Alleva ET, Aloisi P, Franzoni E, Spalice A, Chiarelli F, Coppola G. вальпроат. Acta Neurol Scand. 2012; 125: e14–18. [PubMed] [Google Scholar]
- Кайитаре Э., Вервет С., Нтавукулильяйо Дж. Д., Семинега Б., Ван Бортел Л., Ремон Дж. Разработка комбинированных таблеток с фиксированной дозой, содержащих зидовудин и ламивудин, для педиатрического применения.Int J Pharm. 2009; 31: 41–46. [PubMed] [Google Scholar]
- Chokephaibulkit K, Cressey TR, Capparelli E, Sirisanthana V, Muresan P, Hongsiriwon S, Ngampiyaskul C, Limwongse C, Wittawatmongkol O, Aurpibul L, Kabat B. , МакИнтош К., Йогев Р. Фармакокинетика и безопасность новой педиатрической комбинации фиксированных доз зидовудина / ламивудина / невирапина у ВИЧ-инфицированных детей. Антивир Тер. 2011; 16: 1287–1295. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kasirye P, Kendall L, Adkison KK, Tumusiime C, Ssenyonga M, Bakeera-Kitaka S, Nahirya-Ntege P, Mhute T, Kekitiinwa A, Snowden W., Burger DM , Гибб Д.М., Уокер А.С., Команда АТ.Фармакокинетика антиретровирусного препарата варьируется в зависимости от препарата в целевой группе детей с ВИЧ-1. Clin Pharmacol Ther. 2012; 91: 272–280. [PubMed] [Google Scholar]
- Эрнест Т. Б., старейшина Д. П., Мартини Л., Робертс М., Форд Дж. Л.. Разработка педиатрических лекарств: определение потребностей и признание проблем. J Pharm Pharmacol. 2007; 59: 1043–1055. [PubMed] [Google Scholar]
- Tuleu C, Breitkreutz J. Учебная статья: вопросы, связанные с формулировками в детской клинической фармакологии.Eur J Pediatr. 2013; 172: 717–720. [PubMed] [Google Scholar]
- Кернс Г.Л., Абдель-Рахман С.М., Аландер С.В., Блоуи Д.Л., Лидер Дж.С., Кауфман Р.Э. Фармакология развития – расположение, действие и терапия лекарств у младенцев и детей. N Engl J Med. 2003; 349: 1157–1167. [PubMed] [Google Scholar]
- Glendinning JI. Всегда ли реакция горького отказа адаптивна? Physiol Behav. 1994; 56: 1217–1227. [PubMed] [Google Scholar]
- Милн С.П., Брюсс Дж. Б. Экономика разработки педиатрических препаратов для лекарств, не запатентованных.Clin Ther. 2008. 30: 2133–2145. [PubMed] [Google Scholar]
- Коллинз Ф. Дж., Мэтьюз Х. Р., Бейкер С. Е., Стракова Дж. М.. Медикаментозное повреждение пищевода. BMJ. 1979; 1: 1673–1676. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Папарелла С. Выявленные риски безопасности при расщеплении и измельчении пероральных препаратов. J Emerg Nurs. 2010. 36: 156–158. [PubMed] [Google Scholar]
- Thomson SA, Tuleu C, Wong ICK, Keady S, Pitt KG, Sutcliffe AG. Минитаблетки: новый способ доставки лекарств детям дошкольного возраста.Педиатрия. 2009; 123: e235–238. [PubMed] [Google Scholar]
- Spomer N, Klingmann V, Stoltenberg I, Lerch C, Meissner T, Breitkreutz J. Прием маленьких таблеток без покрытия: результаты проспективного перекрестного исследования. Arch Dis Child. 2012; 97: 283–286. [PubMed] [Google Scholar]
- FDA. 2000. Руководство для промышленности. Отказ от In vivo Исследования биодоступности и биоэквивалентности твердых пероральных лекарственных форм с немедленным высвобождением на основе системы классификации биофармацевтики.Центр оценки и исследований лекарственных средств Министерства здравоохранения и социальных служб США (CDER).
- Sunesen VH, Vedelsdal R, Kristensen HG, Christrup L, Müllertz A. Влияние объема жидкости и потребления пищи на абсолютную биодоступность даназола, плохо растворимого препарата. Eur J Pharm Sci. 2005; 24: 297–303. [PubMed] [Google Scholar]
- Matsumoto F, Sakurai I, Morita M, Takahashi T, Mori N, Sugihara T., Sakai A, Yamaji S, Akaike Y, Yano K. Влияние количества воды и молока, потребляемых одновременно с AS-924, новый цефемный антибиотик сложноэфирного типа, о его фармакокинетике.Int J Antimicrob Agents. 2001. 18: 471–476. [PubMed] [Google Scholar]
- Lottman H, Froeling F, Alloussi S, El-Radhi AS, Rittig S, Riis A, Persson B.E. Рандомизированное сравнение перорального лиофилизата десмопрессина (MELT) и таблеток у детей и подростков с первичным ночным энурезом. Int J Clin Pract. 2007. 61: 1454–1460. [PubMed] [Google Scholar]
- Меннелла Дж. А., Спектор А. К., Рид Д. Р., Coldwell SE. Безвкусица лекарств: обзор фундаментальных исследований горького вкуса.Clin Ther. 2013; 35: 1225–1246. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Рекомендации по дозированию для детей должны включать четыре наиболее важных фармакокинетических процесса развития. Наркотики Ther Perspect. 2007; 23: 23–26. [Google Scholar]
- Cumberland PM, Pathai S, Rahi JS Когортное исследование “Тысячелетие”. Здоровье детей G. Распространенность глазных болезней в раннем детстве и связанные с ними факторы: результаты когортного исследования тысячелетия. Офтальмология. 2010; 117: 2184–2190. [PubMed] [Google Scholar]
- Изенберг С.Дж., Апт Л., Маккарти Дж., Купер Л.Л., Лим Л., Дель Синьор М.Развитие слезотечения у недоношенных и доношенных новорожденных. Arch Ophthalmol. 1998. 116: 773–776. [PubMed] [Google Scholar]
- Фридман Т.С., Паттон Т.Ф. Различия в проникновении пилокарпина в глаз у кроликов разного возраста. J Pharm Sci. 1976; 65: 1095–1096. [PubMed] [Google Scholar]
- Francoeur M, Ahmed I., Sitek S, Patton TF. Возрастные различия в распределении офтальмологических препаратов III. Роговичная проницаемость пилокарпина у кроликов. Int J Pharm. 1983; 16: 203–213. [Google Scholar]
- Паттон Т.Ф., Робинсон-младший.Рекомендации по дозированию в педиатрии в офтальмологии. J Pediatr Ophthalmol. 1976; 13: 171–178. [PubMed] [Google Scholar]
- Macdonald EA, Maurice DM. Потеря флуоресцеина через конъюнктиву. Exp Eye Res. 1991; 53: 427–430. [PubMed] [Google Scholar]
- Esmaeelpour M, Watts PO, Boulton ME, Cai J, Murphy PJ. Объем слезной пленки и анализ белка у доношенных новорожденных. Роговица. 2011; 30: 400–404. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Леви Ю., Задок Д. Системные побочные эффекты глазных капель.Clin Pediatr (Phila) 2004; 43: 99–101. [PubMed] [Google Scholar]
- Berlin RJ, Lee UT, Samples JR, Rich LF, Tang-Liu DDS, Sing KA, Steiner RD. Офтальмологические капли вызывают кому у младенца. J Pediatr. 2001. 138: 441–443. [PubMed] [Google Scholar]
- Passo MS, Palmer EA, Van Buskirk EM. Плазменный тимолол у больных глаукомой. Офтальмология. 1984; 91: 1361–1363. [PubMed] [Google Scholar]
- Raber S, Courtney R, Maeda-Chubachi T., Simons BD, Freedman SF, Wirostko B. Системное воздействие латанопроста на педиатрических и взрослых пациентов с глаукомой: открытое исследование фазы 1.Офтальмология. 2011; 118: 2022–2027. [PubMed] [Google Scholar]
- Паттон Т.Ф. Рекомендации по дозированию в педиатрии в офтальмологии – корректировка дозировки на основе соотношения объема водянистой влаги. J Pediatr Ophthalmol. 1977; 14: 254–256. [PubMed] [Google Scholar]
- Но Х, Ли Д-Х. Прямое измерение объема слухового прохода в педиатрической популяции: можем ли мы объяснить его индивидуальные вариации с точки зрения возраста и массы тела? Int J Pediatr Otorhinolaryngol. 2012. 76: 658–662. [PubMed] [Google Scholar]
- Шанкс Дж. Э., Лилли Диджей.Оценка тимпанометрических оценок объема слухового прохода. J Speech Hear Res. 1981; 24: 557–566. [PubMed] [Google Scholar]
- Woody RC, Golladay ES, Fiedorek SC. Ректальные противосудорожные препараты у пациентов с приступами, перенесших хирургические операции на желудочно-кишечном тракте. J Pediatr Surg. 1989; 24: 474–477. [PubMed] [Google Scholar]
- Валентин Дж. Основные анатомические и физиологические данные для использования в радиологической защите: контрольные значения: Публикация 89 МКРЗ. Энн МКРЗ. 2002. 32: 1–277. [PubMed] [Google Scholar]
- Йоэнссон И.М., Сиггаард С., Риттиг С., Хагстрём С., Джурхуус Дж.Трансабдоминальное УЗИ прямой кишки как средство диагностики запоров у детей. J Urol. 2008; 179: 1997–2002. [PubMed] [Google Scholar]
- van Lingen RA, Deinum JT, Quak JME, Kuizenga AJ, van Dam JG, Anand KJS, Tibboel D, Okken A. Фармакокинетика и метаболизм парацетамола, вводимого ректально у недоношенных новорожденных: частично представлены в ежегодное собрание Европейского общества педиатрических исследований, Роттердам, Нидерланды, 3–6 июля 1994 г. Arch Dis Child. 1999; 80: F59 – F63. [Google Scholar]
- Graves NM, Kriel RL.Ректальное введение противоэпилептических препаратов детям. Pediatr Neurol. 1987. 3: 321–326. [PubMed] [Google Scholar]
- Диллон С., Нгване Э., Риченс А. Ректальная абсорбция диазепама у детей с эпилепсией. Arch Dis Child. 1982; 57: 264–267. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Уолтерс MCn, Фурик Дж. Педиатрические внутримышечные инъекции для условий развивающихся стран: обзор литературы, посвященной передовому опыту. J Transcult Nurs. 2012; 23: 406–409. [PubMed] [Google Scholar]
- Greenblatt DJ.Внутримышечное введение препаратов. N Engl J Med. 1976; 295: 542–546. [PubMed] [Google Scholar]
- Кафецис Д.А., Синаниотис К.А., Пападатос С.Дж., Космидис Дж. Фармакокинетика амикацина у младенцев и детей дошкольного возраста. Acta Paediatr Scand. 1979; 68: 419–422. [PubMed] [Google Scholar]
- Шенг К.Т., Хуанг Н.Н., Промадхаттаведи В. Концентрации цефалотина в сыворотке крови у младенцев и детей и передача антибиотика через плаценту. Антимикробные агенты Chemother. 1964; 10: 200–206. [PubMed] [Google Scholar]
- Лаурсен Т., Хансен Б., Фискер С.Восприятие боли после подкожных инъекций сред, содержащих разные буферы. Basic Clin Pharmacol Toxicol. 2006; 98: 218–221. [PubMed] [Google Scholar]
- Ватт С. Безопасное введение лекарств детям: часть 2. Педиатр, мед. 2003; 15: 40–44. [PubMed] [Google Scholar]
- Brearley C, Priestley A, Leighton-Scott J, Christen M. Фармакокинетика рекомбинантного гормона роста человека, вводимого с помощью cool.click 2, нового безыгольного устройства, по сравнению с подкожным введением с использованием обычного шприц и игла.BMC Clin Pharmacol. 2007; 7: 10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Shah UU, Roberts M, Orlu Gul M, Tuleu C, Beresford MW. Безыгольная и микроигольная доставка лекарств у детей: случай применения модифицирующих болезнь противоревматических препаратов (DMARD) Int J Pharm. 2011; 416: 1–11. [PubMed] [Google Scholar]
- Шнайдер У., Бирнбахер Р., Шобер Э. Болезненность иглы и струйной инъекции у детей с сахарным диабетом. Eur J Pediatr. 1994; 153: 409–410. [PubMed] [Google Scholar]
- Бини А.М.Приготовление парентеральных лекарств в клинических областях: как можно управлять рисками – взгляд Великобритании? J Clin Nurs. 2010; 19: 1569–1577. [PubMed] [Google Scholar]
- Николовски Дж., Стаматас Г. Н., Коллиас Н., Виганд BC. Барьерная функция, водоудерживающие и транспортные свойства рогового слоя новорожденного отличаются от взрослого и продолжают развиваться в течение первого года жизни. J Invest Dermatol. 2008; 128: 1728–1736. [PubMed] [Google Scholar]
- Choonara I. Чрескожная абсорбция и введение лекарств.Arch Dis Child. 1994; 71: F73–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Пелег О., Бар-Оз Б., Арад И. Кома у недоношенного ребенка, связанная с трансдермальной абсорбцией пропиленгликоля. Acta Pædiatrica. 1998. 87: 1195–1196. [PubMed] [Google Scholar]
- Fink JB. Доставка ингаляционных лекарств для младенцев и маленьких детей: комментарий к нынешним и будущим потребностям. Clin Ther. 2012; 34: S36 – S45. [PubMed] [Google Scholar]
- Ловенталь Д., Каттан М. Лицевые маски против мундштуков для аэрозольного лечения детей с астмой.Педиатр Пульмонол. 1992; 14: 192–196. [PubMed] [Google Scholar]
- Mellon M, Leflein J, Walton-Bowen K, Cruz-Rivera M, Fitzpatrick S, Smith JA. Сравнимая эффективность введения с лицевой маской или мундштуком распыленной ингаляционной суспензии будесонида для младенцев и маленьких детей с персистирующей астмой. Am J Respir Crit Care Med. 2000. 162 (2 I): 593–598. [PubMed] [Google Scholar]
- Венейблс Р., Марриотт Дж., Стирлинг Х. УЗНАТЬ: основные проблемы с рецептурами детских лекарств … Это проблема вкуса! Int J Pharm Pract.2012; 20 (S2): 23. [Google Scholar]
- Fabiano V, Mameli C, Zuccotti GV. Детская фармакология: помните о вспомогательных веществах. Pharmacol Res. 2011; 63: 362–365. [PubMed] [Google Scholar]
- Nahata MC. Безопасность «инертных» добавок или вспомогательных веществ в педиатрических лекарствах. Arch Dis Child. 2009; 94: F392–393. [PubMed] [Google Scholar]
- Salunke S, Giacoia G, Tuleu C. База данных STEP (Безопасность и токсичность вспомогательных веществ для педиатрии). Часть 1 Исследование по оценке потребностей. Int J Pharm. 2012; 435: 101–111.[PubMed] [Google Scholar]
- Багули Д., Лим Э., Беван А., Паллет А, Фауст С.Н. Назначение детям – вкус и вкусовые качества влияют на приверженность к антибиотикам: обзор. Arch Dis Child. 2012; 97: 293–297. [PubMed] [Google Scholar]
Предпочтения детей в отношении пероральных лекарственных форм и их участие в исследованиях рецептур через EPTRI (Европейская инфраструктура педиатрических трансляционных исследований)
Предпочтения детей в отношении пероральных лекарственных форм и их участие в исследованиях рецептур через EPTRI (European Pediatric Инфраструктура трансляционных исследований)Фармацевтика (IF6.321), Дата публикации: 2021-05-15 , DOI: 10.3390 / Pharmaceutics13050730
Элиза Алессандрини, Фрэнсис Брако, Мариагиованна Скарпа, Мариангела Лупо, Донато Бонифази, Валерия Пигнатаро, Мария Каваллуфе, Орнела Кавалюла Nafria, Joana Claverol, Leen De Taeye, Eric Vermeulen, Jennifer Preston, Catherine Tuleu
Известно, что недостаток научно обоснованных данных о характеристиках лекарственных форм, предпочитаемых детьми, ограничивает разработку индивидуальных детских лекарственных форм.Европейская инфраструктура трансляционных исследований в области педиатрии (EPTRI) заказала исследование для оценки воспринимаемых предпочтений детских лекарственных форм в некоторых европейских странах и изучения возможности использования консультативных групп молодежи (YPAG) для вовлечения детей в исследование рецептур. Был разработан и переведен на шесть языков онлайн-опрос, адаптированный к возрасту. Ссылка для опроса была распространена в семи европейских странах: Албании, Италии, Нидерландах и голландскоязычной части Бельгии, Румынии, Испании и Великобритании.Воспринимаемые респондентами (n = 1172) предпочтения пероральных лекарственных форм в основном различались в зависимости от возраста, состояния здоровья и опыта. Наиболее предпочтительными были стандартные лекарственные формы, т.е. жидкость (35%), таблетки (19%) и капсулы (14%). Жидкость широко выбирали дети младше 12 лет и здоровые, редко принимающие лекарства. Монолитные твердые формы чаще всего выбирают подростки и дети с хроническими заболеваниями, часто принимающие лекарства. Было явное отсутствие знакомства с более новыми лекарственными формами (например,г., диспергируемые во рту пленки и гранулы). Примечательно, что гранулы не понравились, особенно подростками (52,8%). Чтобы рационализировать создание педиатрических форм, важно вовлекать детей в качестве активных участников и применять инструменты, оценивающие взгляды детей на лекарства, чтобы с самого начала информировать о приемлемых лекарственных формах.
Соответствующие возрасту детские лекарственные формы в Японии Информация о восприятии конечным пользователем из наблюдательного кросс-секционного исследования по оценке приемлемости перорального состава
Аналогичные ответы были получены для жидкой формы:
от 87% до 100% дети считают эту форму приемлемой.
наиболее частых ответов (значения режима) для максимального допустимого объема
составляли 1 мл для новорожденных; 2 мл для
младенцев, детей ясельного и дошкольного возраста; 5 мл для детей
младших классов; и 10 мл для детей старших классов
и подростков.
Способ применения порошковой или жидкой формы
лекарственного средства (вопрос 3)
В целом 34,4% (271/784) детей сообщили о том, что принимали лекарство-
в оригинальной форме и 48 .1% (377/784) сообщили, что
принимали лекарства, растворенные или суспендированные в воде (вопрос
3-1). Как показано в Таблице 4, частота приема
увеличивалась с возрастом, при этом большинство школьников принимали лекарства в исходной форме, а большинство детей дошкольного и младшего возраста
принимали лекарства, растворенные или приостановленные в соль-
вент. Меньшая часть респондентов сообщила, что во время госпитализации принимали лекарства
вместе с едой или напитками.В качестве растворителей в основном использовались водопроводная вода (47,1%),
минеральная вода (17,0%) и очищенная вода или стерильная очищенная вода
(5,1% и 24,8% соответственно) (вопрос 3-2). Большинство растворенных лекарств было введено в течение 15 минут после растворения (вопрос 3-3).
Из устройств, используемых для введения лекарства, наиболее распространенным был инжектор жидкости
. Частое использование инжектора жидкости
младшими возрастными группами может быть связано с использованием
зонда для кормления у этих субъектов.Использование мерной чашки
было относительно частым среди школьников и
подростков (что составляло примерно половину участников
штанов). Соска была вторым по распространенности устройством, используемым
для новорожденных и младенцев (вопрос 3-4). Ответы на этот пункт
могут включать использование устройств не только для введения лекарств в жидкой форме, но и для введения
порошков, растворенных в растворителе.Чтобы сделать прием лекарств приемлемым для детей, медперсонал использовал различные методы. Для всех возрастных групп подслащивание лекарства
простым сиропом было наиболее распространенным методом, составляющим
в 67,9% случаев. Ободрение ребенка устно и обещание вознаграждения было вторым и третьим по распространенности способом:
54,5% и 45,5% соответственно. Помещение лекарств в 1 дозовую упаковку
(42,0%) и использование вспомогательного средства для улучшения глотания
(33.9%) также практиковались. Маскировка вкуса продуктами питания
в нашей больнице нечасто (вопрос 3-5).
Обследование амбулаторных пациентов в местных аптеках
Информация об участниках в местных аптеках
Опрос был начат в местных аптеках
1 ноября 2017 г. и завершился 30 ноября 2017 г. Всего было опрошено 324
родителей в различных сообществах,
составляют 13 (4,0%) родителей младенцев, 51 (15.7%) родители
детей ясельного возраста, 116 (35,8%) родителей детей дошкольного возраста, 75
(23,2%) родителей детей младших классов, 41 (12,6%)
родителей детей старших классов, и 28 (8,6%) родителей
подростков. Родителей новорожденных не было. Каждому участвующему родителю потребовалось до
15 минут, чтобы заполнить анкеты-
анкеты, а опрос проводился в течение 1-месячного периода наблюдения
. Все 324 родителя предложили участие в нашем опросе
в аптеках, и все они в конце концов заполнили его (ответы
составили 100%).
Приемлемость лекарственных форм по возрастным группам (Вопрос 1)
Приемлемость лекарственных форм различалась в основном по возрасту, и баллы отношения
для всех лекарственных форм с возрастом увеличивались. Таблетки, капсулы и порошок
могли принимать пациенты
старше 6 лет, но были затруднены для детей дошкольного возраста
(вопросы 1-1, 1-2 и 1-3). С другой стороны, жидкая форма
была приемлема для части группы новорожденных и большинства групп старшего возраста
(вопросы 1-4).
таблетка, распадающаяся при пероральном введении, имела относительно высокую приемлемость для дошкольников, тогда как таблетки, капсулы и порошки
были неприемлемы
(вопросы 1-5). На эти вопросы процент ответов варьировался
от 44,8% до 96,9%. Частота ответа в детской группе была
, особенно низкая (n = 3/13, 23,1%) из-за небольшого опыта применения
этой формы введения лекарств. В целом, все возрастные группы
были менее знакомы с перорально распадающимися таблетками,
и относительно большое количество участников ответили
«Нет предыдущего опыта», как видно из ответа на опрос
в педиатрии. палаты (таблица 5).
Приемлемость размера, количества и объема дозировки по возрастным группам
(Вопрос 2)
Таблетки любого диаметра не были приемлемы для никого (0/3) из
младенцев, 4,8% (1/21) детей ясельного возраста, 44,9% (22/49) из
дошкольников, 80,3% (49/61) детей младших классов
, 97,3% (36/37) детей старших классов и
96,3% (26/27) подростков. Приемлемость таблетки
и максимальный диаметр глотания увеличиваются с возрастом.
Точно так же максимальный проглатываемый размер капсулы gra-
увеличивается с возрастом, без младенцев (0/3), 5,0% (1/20) из
малышей, 17,1% (7/41) дошкольников. детей, 61,9% (26/42) из
детей в младших классах, 82,8% (24/29) детей в
старших классах и 95,5% (21/22) подростков, сообщивших, что
готовы принимать лекарство в капсуле любого размера (вопрос
2-2). В случае порошковых составов (вопрос 2-3) наиболее предпочтительное максимальное количество порошка
(значение режима) составляло
между 0.25 г и 0,5 г для младенцев, 0,5 г и 1,0 г для детей младше
дней и 2,0 г для всех детей старше 3 лет. Аналогичным образом, в случае с жидкостями
(вопрос 2-4) наиболее предпочтительный максимальный объем
составлял 2 мл для младенцев и детей ясельного возраста и 10 мл для всех
детей старше 3 лет. Допустимые размеры таблеток и капсул
постепенно увеличиваются с возрастом, тогда как приемлемые объемы жидкости или порошка
увеличиваются, начиная с возраста 3
до 5 лет в нашем исследовании (таблица 6).
Метод применения порошковой или жидкой формы
лекарственного средства (Вопрос 3)
Около 43,2% (142/324) и 33,3% (108/324) участников
принимали лекарство (а) в исходная форма, суспензия или решение
соответственно (вопрос 3-1). Как показано в Таблице 7,
10 Терапевтические инновации и нормативная наука XX (X)
Манипуляции с лекарствами для достижения необходимой дозы являются неотъемлемой частью педиатрической практики, но не поддерживаются руководящими принципами или доказательствами | BMC Pediatrics
В этом исследовании использовались два взаимодополняющих подхода для изучения объема манипуляций с лекарствами для достижения предписанной дозы в неонатальной и педиатрической практике.Результаты дают обзор проблем, возникающих при проведении манипуляций. Хотя о манипуляциях чаще сообщалось из более специализированных областей, таких как отделения интенсивной терапии новорожденных и детей, они происходили во всех педиатрических стационарах. В выявленных манипуляциях был задействован широкий спектр лекарств.
Предпочтение пациента было единственной причиной 15% манипуляций, указанных в анкете. Это также было обнаружено в ходе наблюдательного исследования.Например, один ребенок предпочел принять половину таблетки, даже несмотря на то, что жидкий состав был доступен, потому что при приеме жидкости использовался большой объем жидкости, вкус которой ему не нравился.
Основное беспокойство, отмеченное респондентами анкеты, заключалось в том, сможет ли подделанное лекарство обеспечить точную дозу. Эти опасения также были описаны ранее при разделении таблеток пополам или на четверть [8, 15–17]. Подчеркивается необходимость осторожности при расщеплении таблеток с коротким периодом полураспада или низкими терапевтическими индексами [17].
Новым открытием здесь является то, что значительное количество зарегистрированных и наблюдаемых манипуляций не соответствовало половине или четверти лекарственной формы. Точность деления таблеток на другие фракции еще более непонятна, чем на половинки или четвертинки. Потенциальная неточность во время манипуляций, подразумеваемая рецептом, может означать, что фактическая доза, введенная пациенту, неизвестна. Представляется вероятным, что лица, назначающие препараты, часто не знают о лекарственной форме (и силе / концентрации), которая будет использоваться для введения требуемой дозы, или о возможной неточности, связанной с назначенными ими дозами.
Это исследование также показало, что таблетки обрабатываются путем диспергирования в жидкости и измерения пропорции. При диспергировании нерастворимых лекарств в воде возможна очень вариабельная дозировка [7]. Дисперсные таблетки также могут давать несовместимые дозы при извлечении из контейнера с разной глубиной [18].
Манипуляции с целью достижения необходимой дозы также проводятся с использованием капсул, саше, суппозиториев, небулайзеров, клизм и трансдермальных пластырей. Манипуляции с этими другими лекарственными формами ранее не исследовались.Неблагоприятные эффекты, связанные с введением подделанных лекарств или любой лекарственной формы, неизвестны. Существует необходимость в проведении исследований в отношении манипуляций с сильным воздействием, таких как те, которые включают активный ингредиент с узким терапевтическим индексом или когда физико-химические свойства активного ингредиента могут привести к значительным изменениям биодоступности после манипуляции.
Это исследование было разработано для определения характера и частоты манипуляций и определения приоритетов для дальнейших исследований.Таким образом, мы использовали подход целенаправленной выборки для максимальной вариативности наблюдательного исследования и выборки, удобной для анкетного исследования. Это исключает количественное обобщение наших результатов. Дополнительное количественное исследование показало, что манипуляции потребуются примерно в 10% случаев введения лекарств в клинических областях, изученных в наблюдательном исследовании. Тем не менее, наши методы были достаточно детализированными и прагматичными, чтобы давать данные, указывающие на необходимость действий.Доза обычно используемых лекарств обычно рассчитывалась исходя из массы тела и дозы / кг в соответствии со стандартной практикой [19] без округления для учета лекарственной формы / силы действия. Манипуляции с лекарственной формой производились с целью введения точной дозы. Если другие центры используют стандартные источники, такие как BNFC, они, вероятно, тоже проводят манипуляции. Природа выявленных нами проблем не изменилась бы, если бы данные собирались из большего числа центров. Отметим, что наши методы дали дополнительные результаты.Любое дальнейшее исследование природы проблемы потребует подходов, обеспечивающих более чем одну точку зрения.
Наши результаты показывают, что манипуляции с лекарственными формами являются неотъемлемой частью педиатрической практики. Однако не совсем понятно, кто несет ответственность за манипуляции. Есть две важные ситуации, во-первых, когда манипуляция проводится из-за недоступности подходящей лекарственной формы. Эта ситуация может возникнуть из-за отсутствия подходящей лекарственной формы на рынке, из-за того, что решение о покупке помешало выдаче подходящей лекарственной формы из аптеки или из-за того, что подходящая лекарственная форма недоступна в отделении в момент необходимости (например,грамм. ночью, когда сотрудники аптеки могут быть недоступны). Во-вторых, медсестра принимает профессиональное решение, чтобы удовлетворить предпочтения пациента при наличии лекарственной формы. Мы разработали общие рекомендации по манипуляциям с лекарственными формами у детей (их можно получить у авторов). Мы предлагаем, чтобы педиатрические отделения имели правила и процедуры, охватывающие манипуляции с лекарственными формами. Это должно гарантировать корпоративную ответственность за манипуляции. Например, при принятии решения о покупке необходимо учитывать манипуляции, которые могут возникнуть в результате выбора доступных продуктов.Медсестры должны иметь доступ к соответствующей информации и поддержку со стороны своего учреждения, чтобы делать профессиональные суждения о манипуляциях, многие из которых совершаются с лекарствами, не соответствующими этикеткам или без лицензии.
Педиатрическая пероральная доставка лекарств: проблемы и решения
Правильная дозировка для педиатрических пациентов представляет особую проблему для фармацевтических производителей, лиц, назначающих лекарства, и часто для воспитателей. Слишком легко думать, что создать подходящее лекарство для ребенка так же просто, как уменьшить дозу для взрослого по отношению к меньшей массе тела ребенка.Однако такая стратегия редко бывает успешной, поскольку при рассмотрении воздействия лекарств ребенка не следует рассматривать как маленького взрослого, а дополнительные физиологические различия между младенцами, маленькими детьми и подростками усложняются еще больше.Различия в физиологии и развитии между подгруппами педиатрической популяции усложняют задачу создания единой подходящей лекарственной формы для всех молодых пациентов. В то время как дети старшего возраста и подростки могут быть способны и счастливы проглотить таблетку или капсулу, это, конечно, не всегда относится к детям младшего возраста.Для одного продукта может потребоваться несколько разных лекарственных форм и разных вспомогательных веществ, а также диапазон размеров доз, чтобы удовлетворить всех. Поскольку педиатрическое население меньше, чем взрослое, существует ограниченная финансовая отдача от любого продаваемого продукта; Расширение и адаптация рецептур для различных педиатрических групп может привести к увеличению затрат на исследования и разработки до такой степени, что это может быть неэкономичным вариантом для владельца бренда. Это более выражено, когда заболевание не особенно распространено, что еще больше затрудняет обоснование экономической целесообразности разработки конкретной детской лекарственной формы.
Коммерческие реалии и ограничения фармацевтического бизнеса, с точки зрения времени и затрат, должны быть сбалансированы с риском того, что клинические испытания не покажут эффективности, и это хорошо понимают регулирующие органы. Поэтому фармацевтическая промышленность использует нормативно-правовую базу для принятия деловых решений в отношении педиатрических клинических испытаний, а дополнительные стимулы могут дополнительно мотивировать фармацевтическую промышленность к разработке педиатрических препаратов. 1
Регулирующие органы обеспокоены безопасностью педиатрических лекарств, и их правила служат важным руководством для отрасли при исследовании педиатрических составов.Их рекомендации и руководящие принципы за прошедшие годы неоднократно пересматривались как с целью уточнения руководящих указаний, так и с целью стимулирования компаний к проведению конкретных исследований и разработок лекарственных препаратов для детей.
Нормативные требования призваны гарантировать, что продукты доступны для младенцев и детей в различных возрастных группах, которые имеют приемлемый профиль риска и пользы, а не врачам и фармацевтам, которые должны гадать, как они могут уменьшить продукт, разработанный для взрослых.
Постановление Европейского союза о педиатрии вступило в силу в 2007 году, а это означает, что в настоящее время никакие новые лекарства не могут быть зарегистрированы в ЕС без утверждения подробного плана педиатрических исследований Европейским агентством по лекарственным средствам (EMA). В США Закон FDA о безопасности и инновациях 2012 года (FDASIA) закрепил Закон о лучших фармацевтических препаратах для детей (BPCA) и Закон о равенстве в педиатрических исследованиях (PREA) в качестве постоянного закона. Оба ранее подвергались повторной авторизации каждые пять лет.
Руководство EMA по фармацевтической разработке лекарственных средств для использования в педиатрии, выпущенное в 2014 году, касается лекарственной формы и пути введения, а также частоты дозирования, модифицированного высвобождения, безопасности наполнителей и адаптации рецептур для удовлетворения конкретных потребностей детей. 2 Он также организовал общественные консультации в 2016 году по дополнению к руководству E11 Международной конференции по гармонизации (ICH) по клиническим исследованиям лекарственных препаратов в педиатрической популяции, которое было разработано для прояснения ряда тем, актуальных для педиатрической популяции, таких как нормативные требования к планам педиатрических исследований и к порядку проведения педиатрических клинических испытаний.Интересно, что дополнительные соображения для педиатрических составов должны включать соответствующие возрасту лекарственные формы, простоту приготовления и инструкции по применению для лиц, осуществляющих уход, приемлемость (например, вкусовые качества, размер таблеток), а также выбор и количество вспомогательных веществ. Также были рекомендованы альтернативные системы доставки и соответствующая упаковка. Это дополнение впервые вступило в силу в феврале 2018 года и представляет собой обновление действующих правил. 3
По мере того как человек растет от младенца к взрослому на протяжении младенческой, детской и подростковой фаз, происходит множество изменений, которые могут повлиять на фармакокинетику (ФК) и фармакодинамику (ФД) лекарств.Различия в поведении PK / PD у детей и взрослых в значительной степени являются результатом физиологических, метаболических и физических процессов, вовлеченных в процесс роста. Для удовлетворения требований биодоступности могут потребоваться альтернативные технологии доставки лекарств, а также могут потребоваться различные вспомогательные вещества или уровни для удовлетворения требований профиля безопасности.
pH желудочного сока, например, резко меняется в первые несколько недель жизни и изменяется дальше, когда диета ребенка переходит с молока на твердую пищу.Объем и состав кишечной жидкости растут и изменяются, как и время прохождения через кишечник. Эти изменения, а также изменения желчи и секреции поджелудочной железы влияют на воздействие лекарств.
Скорость проникновения через эпителиальный слой желудочно-кишечного тракта у детей обычно ниже, и в некоторых случаях при разработке препарата для педиатрии необходимо учитывать это различие. Однако это всегда необходимо исследовать в индивидуальном порядке, поскольку отдельные API-интерфейсы ведут себя по-разному.
Проблемы с оформлением также должны быть решены. Многие факторы меняются по мере роста и созревания человека, такие как связывание с белками плазмы, метаболические ферменты и общая вода в организме. Другие проблемы включают различия в эффекте первого прохождения, клубочковой фильтрации, а также в почечной секреции и абсорбции.
Самая большая проблема, стоящая перед разработчиками твердых лекарственных форм для перорального применения для детей, – это создание удобных для применения лекарственных форм, в которых доза достаточно гибкая, чтобы обеспечить титрование в соответствии с различными потребностями детей.Также важно следить за тем, чтобы частота дозирования была минимальной. В идеале они также будут включать технологию маскировки вкуса, если это необходимо, для повышения вкусовых качеств и приемлемости.
Не следует недооценивать сложность определения подходящего метода введения, потому что вероятность того, что ребенок подавится большой таблеткой или капсулой, или аспирирует очень маленькую таблетку, вполне реальна. Тем не менее, терапевтические учебные занятия для лиц, осуществляющих уход, могут позволить свести к минимуму риск подавления выбранными таблетками для детей в возрасте от четырех лет и старше. 4
Индивидуализация дозы проще с жидким пероральным составом, но обеспечение как физической, так и химической стабильности является более сложной задачей, а вероятность микробного заражения выше. Наблюдается растущая тенденция перехода от доз на жидкой основе к гибким твердым пероральным составам. 5
Другая проблема, будь то твердая или жидкая лекарственная форма, заключается в том, чтобы правильная доза была измерена и введена пациенту лицом, осуществляющим уход. Если он слишком низкий, эффективность лекарства, скорее всего, будет неоптимальной; если он слишком высок, то токсичность может стать серьезным риском.Одно из возможных решений этой проблемы потребует использования дозирующих устройств, позволяющих измерять различные количества / объемы лекарства. Соответствующее возрасту устройство для введения (например, ручка для твердой дозировки, счетчики для множества частиц и соломинки с лекарственными препаратами) может улучшить приемлемость фармацевтических продуктов. 6
Даже выбор вспомогательного вещества сопряжен с трудностями, чтобы гарантировать отсутствие побочных эффектов. Вспомогательные вещества, которые считаются приемлемыми для использования взрослыми, не всегда подходят для использования у детей, поскольку они могут по-разному влиять на развивающиеся системы органов в зависимости от возраста и стадии развития детей. 7 Недавний консенсус со стороны промышленности, научных кругов и регулирующих органов рекомендовал перед выбором вспомогательного вещества провести поиск в литературе и базах данных, таких как база данных по безопасности и токсичности вспомогательных веществ для педиатрии (STEP), чтобы определить, была ли безопасность вспомогательного вещества достигнута. установлено, и оценить необходимость любых дополнительных исследований для оценки его безопасности. 8
Влияние пищи, то есть то, как присутствие пищи в желудочно-кишечном тракте может влиять на прямую или косвенную скорость и степень абсорбции, может вызвать неожиданные проблемы, если его не рассматривать должным образом.Если ребенок сопротивляется приему лекарств, у родителей или опекунов может возникнуть соблазн растворить дозу в соке, ароматизированном напитке или молоке или смешать ее с пищей, чтобы скрыть ее вкус. Но некоторые лекарства проявляют значительный пищевой эффект, и было проведено мало исследований, чтобы определить, с какими продуктами можно смешивать лекарство, или количественно оценить количество, которое создает пищевой эффект. 9 До сих пор нет возможности оценить риски воздействия пищи в педиатрической популяции ни в лаборатории, ни с помощью компьютерного прогнозирования.9 Кроме того, проблемы стабильности, вызванные пищевыми продуктами, такие как разложение или осаждение лекарственного средства, растворение энтеросолюбильного / защитного покрытия и повышенное / пониженное смачивание, солюбилизация, распад, растворение или диффузия, могут повлиять на биодоступность лекарственного средства. 10
Чтобы стимулировать соблюдение режима лечения, продукт должен быть достаточно вкусным, чтобы пациент не отказывался от него из-за горького вкуса. Если что-то горькое на вкус, ребенок может попробовать это один раз, понять, что это неприятно, и отказаться от этого снова.Было изучено несколько методов маскировки вкуса для преодоления проблем вкусовых качеств, от простого использования подсластителей и ароматизаторов до более сложных методов, таких как комплексообразование с ионообменной смолой и циклодекстрином, покрытие полимерной пленкой, покрытие из горячего расплава, застывание распылением, экструзия расплава или гранулирование расплава. 11
Как правило, твердые лекарственные формы были предпочтительными препаратами в фармацевтической промышленности из-за признанных преимуществ долгосрочной стабильности, простоты цепочки поставок и низкой стоимости производства.6 Однако идеальная лекарственная форма, безусловно, будет варьироваться в зависимости от возраста ребенка, и EMA рекомендует оценивать приемлемость для пациентов в рамках всех проектов разработки педиатрических продуктов. 2
Твердые лекарственные формы для перорального применения становятся все более популярными среди детей, которые достаточно взрослые, чтобы их проглотить. Разработка мини-планшетов, подходящих для малышей, дала по крайней мере одну новую возможность. Результаты клинических испытаний показывают, что дети в возрасте двух лет прекрасно могут проглотить ложку желе с фруктовым вкусом, в котором подвешено несколько мини-таблеток. 12-14 Другое исследование показало, что мини-таблетки более эффективны для новорожденных, чем сиропы. 15
Для младенцев и других лиц, которым нельзя успешно дозировать таким способом, мультичастицы или гранулы, которые включают технологии маскировки вкуса для повышения их вкусовых качеств, также могут помочь улучшить приверженность.
Есть также данные, свидетельствующие о том, что жевательные продукты и продукты, которые растворяются во рту, предпочтительнее для всех возрастов, чем составам из нескольких частиц, таким как спринки. 16
По мере того, как на педиатрическом рынке проводится все больше работы, появляется все больше данных о приемлемости различных лекарственных форм, полученных из опыта клинических испытаний у детей.
Идеальная лекарственная форма также будет легко вводить ухаживающим за пациентом. Точное измерение дозы любого лекарства для удовлетворения потребностей пациентов разного размера остается важным, даже если установлена подходящая лекарственная форма и существует множество гибких вариантов.Относительно просто изменить дозу традиционных сиропов и других жидких составов в соответствии с потребностями пациента путем изменения предписанного объема; аналогично порошки, предназначенные для восстановления, обладают встроенной гибкостью.
Для пероральной твердой лекарственной формы одним из способов решения проблемы является создание обычных составов с различными дозировками, хотя могут потребоваться изменения в составе. Альтернативой является использование счетного устройства, заполненного мини-таблетками, для выдачи соответствующего количества, соответствующего предписанной дозе.
Конечно, не существует единой технологии, которая решила бы все задачи разработки педиатрических лекарств. Однако некоторые из них более гибкие, чем другие, и такие формы, как гранулы, мини-таблетки, мини-мягкие гели, жевательные продукты и растворяющиеся во рту таблетки, по своей сути, с большей вероятностью окажутся приемлемыми для детей. 16,17
Безопасные, эффективные и соответствующие возрасту лекарства остаются важной целью фармацевтической промышленности наряду с предоставлением четкой информации об их использовании.Такие проекты, как Европейская инициатива по педиатрической рецептуре, сотрудничество между промышленностью, академическими кругами и клинической фармацией, играют важную роль в повышении осведомленности о проблемах и предоставлении рекомендаций относительно планов разработки рецептур. Новаторы также сотрудничают, чтобы получить представление и решить конкретные проблемы педиатрической рецептуры и доставки лекарств, и в 2017 году Catalent Applied Drug Delivery Institute объявил, что он вступил в сотрудничество с Департаментом фармацевтической практики Университета Рутгерса для проведения дальнейших исследований. в разработку и применение лекарств для детей.
Тщательное рассмотрение всех вариантов и изучение поведения отдельных лекарств в различных целевых возрастных группах имеют важное значение для эффективного и безопасного удовлетворения потребностей педиатрических пациентов.
Список литературы
1. Ониши Т., Цукамото К., Мацумару Н., Ваки Т. Перспективы развития педиатрических лекарственных средств в США: участие стран Европейского Союза. Терапевтические инновации и нормативная наука. 2018; 52 (1): 49-56.
2. EMA. Руководство по фармацевтической разработке лекарственных средств для педиатрического применения. 2013 г. 1 августа 2013 г. Номер контракта: EMA / CHMP / QWP / 805880/2012 Ред. 2.
3. EMA. Руководство ICH E11 (R1) по клиническим исследованиям лекарственных средств в педиатрической популяции: Шаг 5. 2017 г. 1 сентября 2017 г.
4. Rehn C, Odouard E, Poncet F, Cochat P, Breant V, Dode X. [Факторы, влияющие на приемлемость педиатрических галеновых составов]. Французские аптеки Annales. 2018.
5.Хоппу К. Пора менять парадигму детских лекарств с жидких лекарственных форм на гибкие твердые пероральные лекарственные формы. Цейлонский медицинский журнал. 2016; 61 (3): 93-5.
6. Лопес Флорида, Эрнест ТБ, Тулеу С., Гул Миссури. Подходы к составлению препаратов для пероральной доставки лекарств в педиатрии: преимущества и ограничения текущих платформ. Экспертное заключение по доставке лекарств. 2015; 12 (11): 1727-40.
7. Шмитт Г. Безопасность вспомогательных веществ в детских составах – необходимость исследований токсичности на молодых животных? Дети.2015; 2 (2): 191-7.
8. Бакли Л.А., Салунке С., Томпсон К., Баер Г., Фегли Д., Тернер М.А. Проблемы и стратегии, способствующие разработке рецептур педиатрических лекарственных препаратов: квалификация безопасности вспомогательных веществ. Международный фармацевтический журнал. 2018; 536 (2): 563-9.
9. Batchelor HK. Влияние пищи на абсорбцию педиатрических желудочно-кишечных препаратов после перорального приема: обзор. Дети (Базель, Швейцария). 2015; 2 (2): 244-71.
10. Керстен Э., Барри А., Кляйн С.Физико-химические характеристики жидкостей и мягкой пищи, часто смешанных с пероральными лекарственными формами перед введением детям. Die Pharmazie. 2016; 71 (3): 122-7.
11. Уолш Дж., Крам А., Вертц К., Брайткройц Дж., Винценбург Г., Тернер Р. и др. Игра в прятки с педиатрическими лекарствами с плохим вкусом: не забывайте о вспомогательных веществах. Расширенные обзоры доставки лекарств. 2014; 73: 14-33.
12. Клингманн В., Зейтц А., Мейснер Т., Брейткройц Дж., Моельтнер А., Боссе Х.М. Приемлемость мини-таблеток без покрытия для новорожденных – рандомизированное контролируемое исследование.Журнал педиатрии. 2015; 167 (4): 893-6.e2.
13. Спомер Н., Клингманн В., Столтенберг И., Лерх С., Мейснер Т., Брейткройц Дж. Прием мини-таблеток без оболочки у маленьких детей: результаты проспективного исследовательского перекрестного исследования. Архивы болезней в детстве. 2012; 97 (3): 283-6.
14. ван Рит-Налес Д.А., де Ниф Б.Дж., Шоббен А.Ф., Феррейра Дж.А., Эгбертс Т.С., Радемейкер СМ. Приемлемость различных пероральных форм для детей грудного и дошкольного возраста. Архивы болезней в детстве.2013; 98 (9): 725-31.
15. Клингманн В., Спомер Н., Лерх С., Столтенберг И., Фромке С., Боссе Х. М. и др. Положительное отношение к мини-таблеткам по сравнению с сиропом: рандомизированное контролируемое исследование у младенцев и детей дошкольного возраста. Журнал педиатрии. 2013; 163 (6): 1728-32.e1.
16. Ранмал С.Р., Крам А., Тулеу С. Соответствующие возрасту и приемлемые детские лекарственные формы: понимание восприятия, предпочтений и практики конечных пользователей из исследования приемлемости пероральных составов для детей (CALF).Международный фармацевтический журнал. 2016; 514 (1): 296-307.
17. Стрикли Р.Г., Ивата К., Ву С., Даль Т.С. Педиатрические препараты – обзор имеющихся в продаже пероральных препаратов. Журнал фармацевтических наук. 2008; 97 (5): 1731-74.
Акцент на переносимости парацетамола от младенцев к долгожителям
Аннотация
Введение
Приемлемость лекарств – это многогранная концепция, определяемая как характеристиками продукта, так и характеристиками пользователя.Несмотря на то, что это ключевой фактор эффективности лечения, особенно в уязвимых группах населения, знания о тех характеристиках лекарства, которые лучше всего способствуют приемлемости для индивидуального пользователя, остаются фрагментированными. Сосредоточив внимание на парацетамоле, в этом исследовании изучалась пригодность фармацевтических продуктов в различных лекарственных формах для достижения адекватной приемлемости для пациентов от младенцев до долгожителей.
Методы
Это многоцентровое проспективное обсервационное исследование проводилось в 10 больницах, 8 домах престарелых и более чем 150 общинных амбулаториях.Наблюдатели сообщили о нескольких вариантах поведения / событий, оценивающих приемлемость для 1016 различных фармацевтических продуктов в педиатрии (<18 лет) и 1288 у пожилых людей (≥65 лет). Используя отображение и кластеризацию, многомерный подход предлагал понятную справочную структуру для каждой популяции, предоставляя исчерпывающие оценки: положительно или отрицательно принимаемые.
Результаты
Среди всех оценок, подтверждающих стандарты приемлемости, было 502 отчета о потреблении продуктов парацетамола.Здесь мы сосредоточились на 5 продуктах с ≥30 оценками. Хотя пероральная суспензия и порошок для перорального раствора были положительно приняты в педиатрической группе, порошок имел более высокий уровень отрицательной реакции пациентов (p <0,001). Из тех, кто получил этот состав, 72% были в возрасте до 8 лет и, следовательно, подходили для приема более приемлемой пероральной суспензии. В пожилом возрасте пациенты с нарушениями глотания преимущественно лечились такими порошками (p <0,001), которые принимали полностью реже, чем таблетки, распадающиеся при пероральном введении (p <0.001). Даже для пациентов старше 90 лет капсульные препараты оказались наиболее приемлемым продуктом для пациентов без нарушений глотания и, таким образом, могли быть подходящей альтернативой порошку в этой популяции.
Выводы
За счет лучшего учета характеристик пациента при выборе лекарственных форм клиницисты и лица, осуществляющие уход, могут улучшить приемлемость лечения и приверженность лечению. Более того, больницы и медицинские учреждения могут оптимизировать закупки в соответствии с потребностями местного населения, распространяя информацию, чтобы помочь персоналу подобрать конкретные лекарственные формы для целевых пациентов.
Образец цитирования: Руис Ф., Валле Т., Дюфа Войчицки А., Белисса Э, Фонтан Дж. Э., де Понтуаль Л. и др. (2019) Пригодность лекарственной формы для уязвимых групп населения: акцент на переносимости парацетамола от младенцев к долгожителям. PLoS ONE 14 (8): e0221261. https://doi.org/10.1371/journal.pone.0221261
Редактор: Сатья Сурбхи, Научный центр здравоохранения Университета Теннесси, США
Поступила: 31 октября 2018 г .; Принята к печати: 4 августа 2019 г .; Опубликовано: 20 августа 2019 г.
Авторские права: © 2019 Ruiz et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Данные, лежащие в основе исследования, не могут быть общедоступными по юридическим и этическим соображениям. Законы Европейского Союза (GDPR) и Франции (Закон № 78-17 от 6 января 1978 г.) ограничивают публичный обмен личными данными.Запросы данных будут обрабатываться в соответствии с французским Кодексом поведения MR-003 контролером данных, ClinSearch, который позволяет использовать данные для воспроизведения результатов исследования. Запросы на доступ к данным для этой цели могут быть отправлены сотруднику по защите данных ClinSearch: [email protected], и исследователям за пределами Европейского Союза необходимо будет подписать соглашение о передаче.
Финансирование: ClinSearch предоставил поддержку в виде заработной платы для авторов FR и TV и предоставил финансирование для оплаты публикации Open Acess, но не имел никакой дополнительной роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации. , или подготовка рукописи.Конкретные роли этих авторов описаны в разделе «Авторский вклад».
Конкурирующие интересы: Авторы ознакомились с политикой журнала, и у авторов этой статьи есть следующие конкурирующие интересы: FR и TV являются оплачиваемыми сотрудниками ClinSearch. Это меняет нашу приверженность политике PLOS ONE в отношении обмена данными и материалами. Дополнительную информацию см. В заявлении о доступности данных. Нет никаких патентов, продуктов в разработке или продаваемых продуктов, которые можно было бы декларировать.
Введение
Сколько специалистов в области здравоохранения рассматривают все характеристики своих пациентов перед назначением или введением определенного препарата парацетамола (ацетаминофена)? Помимо противопоказаний, таких как отказ от использования шипучих таблеток с содержанием натрия у пациентов с риском гипертонии [1], или конкретных вспомогательных веществ из-за непереносимости, на рынке доступны десятки альтернатив для выбора лекарственного препарата, наиболее адаптированного для получения адекватной приемлемости для заинтересованных лиц. пациент.
В контексте применения лекарственных средств первое упоминание слова «приемлемость», которое мы нашли в Pubmed, было опубликовано в 1965 году [2]. С тех пор количество рукописей, посвященных этой концепции, неуклонно росло. Приемлемость лекарственных средств стала основным фактором соблюдения режима лечения и, следовательно, ключевым элементом эффективности лечения, особенно в уязвимых группах населения [3].
В качестве регулирующего органа Европейское агентство по лекарственным средствам (EMA) включило полный раздел, посвященный приемлемости, в свое руководство 2013 года по фармацевтической разработке лекарственных средств для педиатрического использования [4].В нем заявителям было рекомендовано интегрировать оценку приемлемости для пациентов как жизненно важную часть фармацевтических и клинических разработок. EMA определила приемлемость для пациента как «общую способность и готовность пациента использовать и его опекун назначать лекарство в соответствии с назначением» [4]. Это подразумевает взаимосвязь между пользователями (пациентами и лицами, осуществляющими уход) и их характеристиками (возраст, слабость, культура…), с одной стороны, и лекарством и его характеристиками (вспомогательные вещества, размер, текстура, доза, устройство…), с другой стороны.Комбинация всех этих характеристик должна объединиться, чтобы привести к правильному приготовлению и введению, и в целом к хорошей приемлемости лекарственного средства для пользователя.
Важность приемлемости лекарств не ограничивается педиатрией, как подчеркивается в руководстве ICH Q8 от 2009 г .: «во всех случаях продукт должен быть разработан с учетом потребностей пациентов и предполагаемых характеристик продукта» [5]. Таким образом, адекватная приемлемость имеет решающее значение для всех уязвимых пациентов, включая пациентов пожилого возраста (≥ 65 лет).EMA привлекло внимание к этой проблеме в 2017 году в черновой версии своего аналитического документа о фармацевтической разработке лекарств для пожилых людей [6]. Таким образом, производителей и клиницистов побуждают рассматривать типологию каждого пользователя индивидуально, чтобы достичь адекватной приемлемости, предлагая хорошо подходящие методы лечения.
Приемлемость – это многомерное понятие, которое одновременно определяется совокупностью факторов, принадлежащих как пользователю, так и лекарственному средству.Несмотря на многочисленные инструменты, используемые для оценки приемлемости, недавний обзор не смог определить стандартизированную методологию [7]. Более того, ни одно из упомянутых исследований одновременно не рассматривало различные аспекты приемлемости, определенные в директиве EMA [4]. Статистическая обработка приемлемости обычно ограничивалась одномерным анализом данных, даже в тех случаях, когда было собрано несколько показателей и многомерный подход был бы более подходящим [8].
В этом исследовании мы приняли такой многомерный подход, одновременно исследуя множество различных аспектов приемлемости.Сосредоточившись на парацетамоле, основном активном ингредиенте (API), наиболее часто используемом во Франции [9], который также широко используется в Европе и во всем мире [10, 11], мы наблюдали и анализировали приемлемость многих лекарственных препаратов с различными лекарственные формы для пациентов от младенцев до долгожителей.
Методы
Для оценки многогранной концепции приемлемости (рис. 1) мы использовали новый многофакторный подход: CAST – ClinSearch Acceptability Score Test [12–14].
На основе реальных наблюдаемых данных анкета исследует следующее наблюдаемое содержание:
- результаты приема (необходимая доза полностью, частично или совсем не принимается),
- реакция пациента во время введения (положительная, нейтральная или отрицательная реакция),
- время, необходимое для подготовки (от открытия любой упаковки до получения необходимой дозы лекарства, готовой к использованию, включая все обращения и модификации),
- время, необходимое для введения необходимой дозы лекарства (от необходимой дозы лекарства, готовой к употреблению, до конца приема),
- обращение к методам облегчения / достижения введения (разделение приема дозы, которая не может быть принята в целом, изменение предполагаемого использования [изменение лекарственной формы, такой как измельченная таблетка или открытая капсула; использование устройства, не входящего в комплект поставки; использование другого пути / способ применения], употребление пищи / напитков для маскировки вкуса или облегчения глотания, поощрение пациента, использование сдержанности).
На основании распределения данных и опыта авторов в клинической практике время подготовки и введения (точность 10 секунд) было классифицировано как короткое, среднее или долгое. Эти оценки были определены как менее 20 секунд, от 21 секунды до 1 минуты или более 1 минуты в пожилых стационарных пациентах [14], и менее 1 минуты, от 1 до 2,5 минут или более 2,5 минут, у педиатрических больных [12].
Каждая оценка одного лекарственного препарата, проведенная одним пациентом, соответствовала определенной комбинации наблюдаемых мер.
Анализ множественных соответствий (MCA) суммировал ключевую информацию, содержащуюся в данных на трехмерной карте приемлемости, затем процесс иерархической кластеризации по основным компонентам (HCPC) собирал оценки в кластеры. «Положительно принятые» оценки, естественно, возникли в другом кластере, чем «отрицательно принятые», определяя два разных профиля приемлемости. Эта эталонная система приемлемости, предложенная для целевой группы населения, позволяет проводить стандартизированную оценку для лекарственных средств, а также оценку влияния характеристик как пользователя, так и лекарственного средства на оценки приемлемости.
В этом наблюдательном исследовании использовались две эталонные рамки приемлемости: одна для пожилых пациентов, а вторая – для педиатрической популяции. Данные в этом исследовании были исключены из рассмотрения наблюдательным советом учреждения, что было подтверждено одним комитетом по этике (Comité de Protection des Personnes Ile de France VII). Одобрения были получены от Консультативного комитета по обработке данных в исследованиях в области здравоохранения (CCTIRS – “Comité Consultatif sur le Traitement de l’Information en matière de Recherche dans le domaine de la Santé”) и Французского управления по защите данных (CNIL – “Национальная комиссия” de l’Informatique et des Libertés “).Свободно предоставленное информированное согласие было получено от каждого субъекта (или законного представителя) до участия в исследовании.
Эти схемы были основаны на больших наборах оценок использования лекарственных средств, собранных в период с мая 2015 года по август 2018 года. Пациенты были набраны случайным образом на добровольной основе многими врачами и фармацевтами из десяти больниц, восьми домов престарелых и более чем 150 сообществ. диспансеры по всей Франции. Возраст был единственным критерием отбора. Мы также исключили любые инфузии, вводимые, когда катетер уже был на месте, учитывая, что введение катетера, которое относится к последовательности введения лекарства, будет отсутствовать в собранных данных.После включения в исследование лицо, осуществляющее уход за амбулаторными пациентами, или медицинский работник для стационарных пациентов, заполнило анкету, касающуюся наблюдаемого использования лекарственного средства. В случае полимедикации наблюдали только первое назначенное лечение.
Чтобы изучить факторы, влияющие на приемлемость, мы сосредоточили свое внимание в этом исследовании на лекарственных препаратах парацетамола.
Когда конкретный лекарственный препарат оценивался не менее чем 30 пациентами в группе оценок, центр тяжести этих оценок располагался на карте приемлемости.Оценка приемлемости была структурирована профилем приемлемости их барицентра и долей принадлежащих ему доверительных эллипсов, как описано ранее [12–14]. Аналогичным образом изучалась приемлемость этих лекарственных препаратов в субпопуляциях пациентов.
Статистические тесты были использованы для оценки значимости различий, наблюдаемых между переменными для каждого отдельного лекарственного препарата парацетамола. Критерий хи-квадрат Пирсона использовался, когда было минимальное ожидание 5 для 80% ячеек без какого-либо нулевого ожидания [15].Когда наблюдений за пациентами было меньше, точный тест Фишера предоставил альтернативу для преодоления этой трудности.
ИспользовалисьR и SAS. Пакеты R FactoMineR [16] и MissMDA [17] использовались для выполнения MCA и HCPC, а также для обработки недостающих данных. Анализ данных в R и результаты были проверены с помощью SAS 9.4 для пациентов с полными данными.
Результаты
Население и лекарственные средства парацетамола
В общей сложности 2304 оценки, описывающих использование многих различных лекарственных средств, подтверждают нормативную базу приемлемости, которая была создана для каждой группы населения (1016 в педиатрии и 1288 для пожилых людей).Среди этих оценок было 502 отчета наблюдателей о потреблении отдельным пациентом одного продукта парацетамола. Из 37 оцениваемых лекарственных препаратов парацетамола пять имели ≥30 оценок.
Педиатрия.
Среди 283 лекарственных препаратов, оцененных в 1016 оценках, поддерживающих нормативную базу приемлемости в педиатрии (таблицы S1 и S2), было 18 различных препаратов парацетамола. Они включали восемь различных концентраций (2.4 г / 100 мл, 3 г / 100 мл, 100 мг, 150 мг, 200 мг, 300 мг, 500 мг и 1000 мг) и девять лекарственных форм (пероральная суспензия, пероральный раствор, порошок для перорального раствора, суппозиторий, капсула, таблетка, таблетка с покрытием, шипучая таблетка и пероральный лиофилизат ), произведенного четырьмя разными держателями регистрационных удостоверений. В таблице 1 представлены те лекарственные средства, которые оценивались более чем у пяти пациентов. Все представленные ниже продукты были произведены одним держателем регистрационного удостоверения.
Пожилое население.
Среди 315 лекарственных средств, оцененных в рамках 1288 оценок, поддерживающих нормативную базу приемлемости для пожилых пациентов (таблицы S3 и S4), было 19 различных продуктов парацетамола. Было три дозировки (10 мг / 1 мл, 500 мг и 1000 мг), семь составов (капсула, таблетка, таблетка с покрытием, шипучая таблетка, таблетка, распадающаяся при пероральном введении (ODT), порошок для перорального раствора и раствор для инъекций) и восемь держателей регистрационного удостоверения. В таблице 2 представлены те продукты парацетамола, которые оценивались более чем у пяти пациентов, все эти три продукта парацетамола имели одного и того же держателя регистрационного удостоверения.
Оценка приемлемости лекарственных средств парацетамола
На рис. 2 представлены оценки приемлемости двух лекарственных препаратов парацетамола, которые оценивались более 30 раз в педиатрической популяции: 2,4% пероральная суспензия и 300 мг порошка для перорального раствора.
Наибольшее количество оценок было получено для 2,4% пероральной суспензии, 77% были собраны в зоне «положительно принятого» профиля по сравнению с 74% для порошка 300 мг для перорального раствора.Барицентры их оценок были отнесены к профилю «положительно принятого», а также к 100% -ным эллипсам уверенности.
На рис. 3 представлены оценки приемлемости трех лекарственных препаратов парацетамола для пожилого населения, которые оценивались более 30 раз. Это были капсулы по 500 мг, таблетки для перорального разложения по 500 мг и порошок для приготовления перорального раствора на 500 мг.
Наибольшее количество оценок было получено для капсулы, 89% были собраны в зону «положительно принятого» профиля по сравнению с 88% для ODT и 73% для порошка для перорального раствора.Барицентры всех их оценок были отнесены к «положительно принятому» профилю вместе со 100% -ными эллипсами уверенности, за исключением небольшой части эллипса в третьем измерении для порошка для перорального раствора.
Лекарственные препараты парацетамола, оцениваемые в этом исследовании, оказались приемлемыми в обеих исследуемых популяциях, поскольку барицентр вместе со всеми эллипсами уверенности, за исключением порошка для перорального раствора для пожилых людей, принадлежал к “положительно принятым” “профиль.Эти лекарственные формы кажутся подходящими для пациентов этих двух групп.
Возможны объективные сравнения этих различных «положительно принятых» продуктов; их положение центра тяжести на карте позволяет ранжировать. В этом исследовании, хотя порошок для перорального раствора был классифицирован как положительно принятый педиатрами и почти схожий для пожилых людей, он не был лучшим принятым форматом дозировки ни для того, ни для другого. Его барицентр попал в крайнюю границу зоны положительно обозначенных категорий на карте.Для пожилых стационарных пациентов ODT, как правило, воспринималась более положительно, чем порошок для перорального раствора, но ODT представляла более низкий профиль приемлемости, чем капсулы в этой популяции. Эти результаты отражают различия в измерениях.
Другие составы не были представлены на карте, но даже в этих случаях при менее чем 30 оценках наблюдались некоторые тенденции. Порошок для перорального раствора с более высокой концентрацией (500 мг), принимаемый детьми старшего возраста, располагался на карте ближе к положительно обозначенным категориям, в то время как более низкая дозировка (100 мг), принимаемая детьми младшего возраста, располагалась дальше от них.Для пациентов младше 3 лет, хотя суппозиторий 100 мг и 150 мг имел лучший результат, чем порошок 100 мг для перорального раствора, 2,4% пероральная суспензия парацетамола была расположена ближе всего к идеальному положению на карте.
Определяющие переменные
Каждая оценка отражает отношение конкретного лечения к конкретному пользователю. Барицентр оценок суммирует в одном пункте вариативность использования; он принимает во внимание комбинации оценок, которые сами по себе состоят из комбинаций показателей.
В таблице 3 представлено распределение соответствующих наблюдательных мер по каждому лечению.
Таким образом, наблюдения должны учитывать эти различия в каждой популяции, как показано в таблицах 1 и 2. Дети, которым вводили лекарственную форму пероральной суспензии 2,4%, были значительно моложе детей, которым вводили порошок для перорального раствора (p <0,001). В самой старшей популяции пациенты, которым вводили каждый из трех лекарственных препаратов парацетамола, различались по нескольким характеристикам.Пациенты, страдающие расстройствами глотания, были недостаточно представлены в группе капсул, и их предпочтительно лечили порошком для перорального раствора (p <0,001). Более того, в домах престарелых капсулы были единственной лекарственной формой, наблюдаемой пять или более раз. У пациентов, получавших ODT, было меньше случаев мышечных (p = 0,03) нарушений памяти (p <0,001), чем у пациентов, получавших две другие лекарственные формы, и они чаще были наивны к предыдущему воздействию (p <0,001). Этот последний вывод, вероятно, связан с недавним появлением этой лекарственной формы на одном из пунктов приема на работу.
Основываясь на наблюдениях за использованием лекарственного средства, порошок для перорального раствора показал более низкую норму полностью принятой дозы и более высокую частоту отрицательных реакций в обеих популяциях. Капсула и ODT были двумя препаратами, которые систематически полностью принимались пожилыми людьми, в то время как порошок для перорального раствора принимался полностью реже (p <0,001). Более чем в 50% оценок использования пероральной суспензии наблюдатели сообщили о положительной реакции пациента. Эта пероральная суспензия приправлена клубникой и используется в основном у детей в возрасте до 6 лет. 89% педиатрических пациентов лечились этим лекарственным средством.
У пожилых стационарных пациентов время приготовления и введения каждого лекарственного препарата значительно различались. На это указывает наблюдаемое среднее время: 30 секунд для капсулы, 55 секунд для порошка для перорального раствора и 115 секунд для ODT.
Парадоксальным образом предписанная доза наиболее приемлемой лекарственной формы в обеих популяциях разделилась значительно чаще, чем в других формах (p <0,001 в педиатрической популяции; p = 0,003 в пожилом населении).В самой молодой популяции это особенно наблюдалось в больнице: один флакон пероральной суспензии использовался для нескольких пациентов, но шприц систематически менялся. Таким образом, среди вариантов анкетирования методов, используемых для облегчения / достижения введения, медсестры указали, что шприц, предоставленный производителем, не использовался. Однако во время анализа данных было решено не рассматривать это как изменение предполагаемого использования: процедура была четко установлена персоналом больницы из гигиенических соображений.Более того, это облегчит международные сравнения, поскольку во многих странах шприцы не поставляются с пероральными суспензиями. Напротив, в случаях, когда родители сообщали об использовании дома шприца с другим лекарственным средством, это кодировалось как изменение предполагаемого использования.
В пожилом стационаре, чтобы избежать ошибки интерпретации, связанной с различиями в предписанной дозе, мы проверили отсутствие значимых различий в каждой группе. Соотношение пациентов с рецептом на 2 или более единиц (капсула, саше или таблетки) было высоким для всех трех групп: 89% с капсулой (MD: 15), 77% с ODT (MD: 8) и 86% с порошком. для перорального раствора (md: 2) (p = 0.34). Таким образом, при интерпретации наблюдаемого количества разделенных доз необходимо учитывать, что большинство пациентов были вынуждены принимать 2 стандартные дозы для каждого приема.
Об изменении лекарственного средства перед введением сообщалось только у пожилых пациентов. Для двух пациентов, лечившихся в доме престарелых, содержимое их капсул было смешано один раз с кофе с молоком, а во втором случае – с яблочным пюре. У другого пациента, находящегося на лечении в больнице, содержимое его капсулы было смешано с водой.Четвертый отчет об изменении касался пациента, который держал капсулу во рту в ожидании ее растворения. Для одного пациента сообщалось об использовании другого пути / способа введения, действительно, ODT был проглочен. Ни у одного из этих пациентов не было диагностировано нарушений глотания.
Еда или напитки, принимаемые непосредственно перед или после приема для маскировки вкуса или облегчения глотания, чаще использовались в педиатрической популяции для порошка для перорального раствора, но не среди пожилых пациентов.Принимая во внимание, что сдержанность была значительно преувеличена с порошком для перорального раствора в нашем наборе данных от пожилого населения (p = 0,006), на самом деле наблюдатели чаще сообщали, что пациенты должны были заставить себя выпить раствор.
Обсуждение
Профили приемлемости пяти лекарственных препаратов с одним основным активным ингредиентом, парацетамолом, в четырех различных лекарственных формах были проанализированы в двух популяциях на каждом конце жизненного цикла, включая пациентов от младенцев до долгожителей.Также были собраны данные о других лекарственных средствах, что дало предварительные результаты для определенных подгрупп пациентов. Исходные условия, по-видимому, были основным стимулом для лиц, осуществляющих уход, и медицинских работников при выборе наиболее подходящей лекарственной формы для пожилых пациентов, в то время как возраст, по-видимому, больше всего повлиял на выбор, сделанный педиатрическими пациентами. Из пяти проанализированных полных профилей лекарственных средств порошок для перорального раствора был наименее приемлемым в обеих популяциях.Среди пациентов пожилого возраста наиболее приемлемой лекарственной формой была капсула; его даже использовали у тех 11 (14%) пациентов старше 95 лет, которые все еще могли принимать 2 единицы за один присест. Среди тех 13% пожилых стационарных пациентов, у которых были нарушения глотания, по-видимому, предпочтительнее прописывали порошок для перорального раствора (50%). Но поскольку расстройство глотания можно выявить с помощью теста на глотание воды, неудивительно, что люди, неспособные выпить полстакана воды без перерывов или затруднений, были менее восприимчивы к введению 1000 мг парацетамола, растворенного в полстакане. воды.Ограниченный набор данных относительно недавно представленной лекарственной формы ODT предполагает, что эта форма введения может представлять интересную альтернативу с точки зрения приемлемости для пациентов с расстройствами глотания. В педиатрии пероральная суспензия парацетамола имела наилучший профиль переносимости. Тем не менее, детей старше пяти лет довольно часто переводили на порошок для перорального раствора, хотя переносимость не улучшалась, особенно в больнице. Это говорит о том, что медицинские работники и лица, осуществляющие уход, относили определенные лекарственные формы к определенным возрастным группам в педиатрической популяции.Однако в этом случае сводка характеристик продукта (SmPC) для пероральной суспензии парацетамола указывает на то, что она подходит для детей весом от 3 кг до 26 кг (примерно от рождения до девяти лет), обеспечивая, таким образом, единую хорошо воспринимаемую жидкость. лекарственная форма, которую можно использовать до тех пор, пока пациент не перейдет непосредственно на капсулы.
Используя наш многовариантный подход, мы смогли проверить приемлемость различных лекарственных средств одного и того же API, одновременно учитывая индивидуальные характеристики пациента.Многофакторный исследовательский анализ данных обеспечил глубокое понимание приемлемости с учетом нюансов. Учитывая аналогичный размер выборки, больший эллипс достоверности для порошка для перорального раствора выявил большую неоднородность оценок пациентов по сравнению с другими лекарственными формами парацетамола. Эта вариабельность подразумевала, что можно выделить подгруппы пациентов. В этом случае нарушения глотания присутствовали у 30% пожилого населения, получавшего порошок для лекарственной формы раствора для приема внутрь, и предварительные результаты пациентов, которым вводили лекарственную форму ODT, предполагают, что это может быть более приемлемой альтернативой.Однако, поскольку это было обсервационное исследование, мы не смогли повлиять на использование какой-либо конкретной лекарственной формы, и в настоящее время для адекватной проверки этой гипотезы потребуются дополнительные данные от пациентов с дисфагией в пожилом возрасте. Точно так же порошок для перорального раствора не был оптимальным для педиатрической популяции; опять же из-за неинтервенционного дизайна исследования и уважения существующей практики медицинских работников и лиц, осуществляющих уход, в нашем исследовании отсутствуют необходимые оценки альтернативных лекарственных форм для сравнения их приемлемости в целевом возрастном диапазоне.Следует также отметить, что исследуемое здесь пожилое население состояло исключительно из пациентов в учреждениях, где лечение на единицу дозы распределялось внутренней аптекой. Таким образом, адекватность первичной и вторичной упаковки для этих пациентов не оценивалась; Пациенты не читали листовки с инструкциями, так как лекарственные препараты готовили медицинские работники. В этой контролируемой среде некоторые потенциальные злоупотребления, которые могли произойти в доме, возможно, не были зафиксированы.Важно отметить, что профили приемлемости необходимо учитывать применительно к исследуемой популяции в контекстной среде. Таким образом, эти результаты нельзя напрямую экстраполировать на более старое домашнее население, конкретные наблюдения, относящиеся к этим пациентам, продолжаются, но набор на работу значительно медленнее.
В свете двух обзоров тестирования приемлемости в педиатрической и гериатрической группах в 2017 г. [18, 19], насколько нам известно, это первое исследование, изучающее приемлемость различных составов API в реальных условиях для обоих из них. возрастные группы.Современный обзор, посвященный методологии, используемой для оценки приемлемости пероральных педиатрических препаратов [7], еще раз подтверждает это. По словам Драмонда, только «в 10 исследованиях использовались четко определенные протоколы и конечные точки наблюдения для определения пригодности пациентов». Инструменты оценки результатов лечения пациентами (PRO), которые не рекомендуются для использования с детьми до 6 лет и сомнительными до 12 лет [20], использовались во многих педиатрических исследованиях приемлемости, собранных в этих обзорах.В качестве альтернативы прокси-анкеты, которые не принимаются Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) [21], использовались в других цитируемых исследованиях. Кроме того, исследования, разработанные с использованием единственного гедонистического критерия, были подвержены ошибочным интерпретациям. Например, во всей популяции пожилых пациентов, поддерживающих стандарт приемлемости (n = 1288), положительные реакции пациентов были чрезмерно представлены (55%) только в одном классе методов лечения, ATC N02AA или природных алкалоидах опия (n = 66).После опроса вовлеченных медсестер мы поняли, что эта положительная реакция была вызвана объявлением об их прибытии с опиоидом пациента, предшествующим лечению. Следовательно, гедонистические критерии измеряли не приемлемость лечения в отношении состава, а скорее приемлемость ожидаемого эффекта лечения. Мы также обнаружили в педиатрической популяции, что пероральная суспензия парацетамола 2,4% была единственным лекарственным средством с большинством положительных реакций.Это, безусловно, связано со склонностью этой группы населения к клубничному аромату этой лекарственной формы. Поскольку это может привести к непреднамеренному введению, органы здравоохранения предпочитают нейтральную реакцию. Благодаря сбору множества различных переменных для анализа без взвешивания этот многомерный подход может одновременно улавливать ряд факторов, входящих в концепцию приемлемости. Трехмерное отображение этих результатов помещает их барицентрическое положение в профиль кластера, который опирается на эталонную структуру, тогда как в литературе приемлемость часто ограничивается последовательными сравнениями каждого конкретного критерия [18].В то время как руководство EMA по фармацевтической разработке лекарственных средств для использования в педиатрии гласит, что «адекватная приемлемость пациента не должна пониматься как 100% приемлемость лекарства» [4], порог 80%, по-видимому, обычно используется до настоящего времени [7] . Использование совокупной оценки критериев приемлемости, представленных в этом исследовании, лучше облегчает принятие решений относительно каждого лекарственного средства. Если мы примем во внимание это исследование, процент многомерных оценок на лекарственный препарат, попадающий в кластер «положительно принятых», не смог достичь этого 80% -ного порога в трех из пяти случаев.Поскольку положения барицентров и эллипсы уверенности всех пяти из этих дозированных формул относятся к кластеру «положительно принятые», мы считаем, что эти многомерные анализы позволяют избежать необходимости назначать искусственный порог приемлемости, который может потребоваться при рассмотрении одномерных критериев.
Парацетамол, 124 лекарственных препарата, продаваемых во Франции, подчеркивает эти проблемы. Медицинские работники должны соответствовать оптимальному набору характеристик, чтобы выбрать лекарственную форму, наилучшим образом адаптированную для отдельных пациентов разного возраста, и у каждой из них свой набор основных состояний.В этом исследовании мы намеревались привлечь внимание врачей и медицинских учреждений к определенным факторам, представляющим особый интерес. На институциональном уровне мы выявили более 16 лекарственных препаратов парацетамола, указанных в больничных списках рецептов, некоторые из которых были плохо адаптированы для населения, на которое нацелено соответствующее учреждение. Как обсуждалось выше, порошок для перорального раствора часто вводили пациентам из пожилого стационарного населения с расстройством глотания, тогда как наши результаты показывают, что это может быть не самая подходящая лекарственная форма.В рамках прагматического подхода, чтобы лучше понять включение таких лекарственных форм в больничные диспансеры, необходимо проконсультироваться с рабочими группами, включающими всех участников больницы (то есть медсестер, врачей, фармацевтов, администрацию и представителей пациентов). Затем могут быть проведены обсервационные исследования, чтобы проверить, могут ли какие-либо родственные или альтернативные лекарственные формы быть более приемлемыми для целевой группы, и подтвердить их присутствие в списке рецептов. Эти лекарственные формы, определенные для удовлетворения неудовлетворенных потребностей определенной подгруппы населения, впоследствии могут быть интегрированы в стандартную практику учреждения посредством внутренней коммуникации и обучения.Наше исследование также выявило несоответствие в использовании устройств администрирования. Из гигиенических соображений дополнительные шприцы для перорального введения приобретались отдельно: в одной больнице их объем уступал исходному устройству, охватывая пациента с массой тела от 3 до 8 кг вместо 3 до 13 кг. К сожалению, 43% (n = 32/74) доз, вводимых в этой больнице, были назначены пациентам с массой тела более 8 кг. Выбор этого устройства потребовал дополнительных затрат времени на медперсонал и, что более важно, привел к появлению нового фактора риска ошибки дозировки.Мы не смогли исследовать процесс покупки этого шприца, но предварительная консультация мультидисциплинарной группы могла бы улучшить окончательный процесс введения пероральной суспензии в этой обстановке.
Ряд наблюдений, сделанных в этом неинтервенционном исследовании, требует дальнейшего изучения. Предварительные наблюдения здесь показали, что ODT, как правило, более подходит, чем порошок для перорального раствора для пациентов с расстройствами глотания, частой жалобой у пожилых пациентов [22, 23].Несмотря на более длительное время введения, эта лекарственная форма в основном относилась к положительно обозначенным категориям, но требуются дополнительные исследования у этих пациентов с нарушениями глотания. В идеале этот вариант лечения избавит людей с дисфагией от приема порошка для жидкого раствора для перорального применения. Однако, поскольку некоторые ODT содержат натрий, необходимо учитывать потенциальные противопоказания к сердечно-сосудистому риску среди пожилого населения, прежде чем выбирать, какой ODT парацетамола запасать.Параллельно с этим у двух третей пожилых пациентов, получавших порошок для перорального раствора, не было нарушения глотания, нам было бы интересно проверить приемлемость капсульной лекарственной формы в этой популяции. Если исходить из государственных цен во Франции, это сократит бюджет этих пациентов на парацетамол до 25%. В педиатрической популяции место порошка для перорального раствора также может быть поставлено под сомнение: в этом исследовании эта лекарственная форма применялась у детей старше девяти лет, которые должны быть способны глотать капсулы, и у детей в возрасте от трех до пяти лет, подходящих для лечения. с более приемлемой пероральной суспензией.Чтобы ответить на эти вопросы, мы запланировали интервенционное исследование, которое будет проведено в больницах для обеих групп населения. Назначение рандомизированной адаптированной лекарственной формы парацетамола населению без противопоказаний будет чередоваться в разные дни недели с использованием перекрестной методологии.
Выводы
Надлежащее назначение лекарств выходит за рамки API и уровней дозировки. Хотя любое количество лекарственных форм API может быть приемлемо для населения в целом, необходимо уделять особое внимание интеграции индивидуальных характеристик пациента при назначении для уязвимых групп населения.Выбор подходящей адаптированной лекарственной формы позволяет медицинским работникам улучшить ее переносимость. В случае парацетамола учреждениям может быть оказана помощь в сокращении количества лекарственных препаратов, хранящихся в их аптеках, при сохранении необходимых альтернативных лекарственных форм для уязвимых подгрупп населения. Дальнейшие хорошо спланированные исследования будут иметь жизненно важное значение для облегчения этих процессов и улучшения обслуживания этих пациентов.
Благодарности
Авторы выражают благодарность всем пациентам за участие.Мы хотели бы поблагодарить всех членов рабочей группы R2G («Rencontres Galénique & Gériatrie») за их постоянную поддержку и помощь в сборе данных, а также всех медицинских специалистов, работающих в больницах (Hôpital Jean-Verdier – 93140 Bondy; Hôpital Ротшильд – 75012 Париж; Госпиталь Жоффре Дюпюитрена – 91210 Дравей; Госпиталь Брока – 75013 Париж; Госпиталь Сент-Перин – 75016 Париж; Госпиталь Вожирар – 75015 Париж; Госпиталь Фернан Видаль – 75010 Париж; Госпиталь Опиталь Рене Севране-93270 Мюретранест – 93270 – 88300 Neufchâteau; Centre Hospitalier de Versailles André Mignot – 78150 Le Chesnay), дома престарелых (Résidence Degommier – 91590 Cerny; Résidence Vauban Fondation Claude Pompidou –
Belfort; Maison de retraite protestante – 75013 Paris du parterc); Резиденция Джона Леннона – 95370 Монтиньи-ле-Кормей; Кориан Ле Аркад – 75012 Париж; Кориан Нимфеас Блеус – 27200 Вернон; Кориан Самаробрива – 80000 Амьен), а также общинные диспансеры, участвовавшие в исследовании. dy.
Кроме того, мы хотели бы поблагодарить научных сотрудников ClinSearch, которые участвовали в сборе данных, и Кристофера Джарвиса, медицинского писателя в ClinSearch, за лингвистические изменения.
Ссылки
- 1. Джордж Дж., Маджид В., Маккензи И.С., Макдональд TM, Вей Л. Связь между сердечно-сосудистыми событиями и натрийсодержащими шипучими, диспергируемыми и растворимыми препаратами: вложенное исследование случай-контроль. BMJ: Британский медицинский журнал. 2013; 347.
- 2.Джонс Д. Д., Кронемер Н. Ответ родителей на исследование лекарств: клиническое исследование приемлемости и эффективности детских форм эритромицина. Клиническая педиатрия. 1965; 4 (3): 137–40.
- 3. Лю Ф., Ранмал С., Бэтчелор Х. К., Орлу-Гул М., Эрнест Т. Б., Томас И. В. и др. Ориентированный на пациента фармацевтический дизайн для повышения приемлемости лекарств: сходства и различия в педиатрической и гериатрической популяциях. Наркотики. 2014; 74 (16): 1871–89. pmid: 25274536
- 4.Европейское медицинское агентство. Руководство по фармацевтической разработке лекарственных средств для педиатрического применения. 2013.
- 5. Международный совет по гармонизации. Фармацевтическая разработка Q8 (R2). 2009.
- 6. Европейское медицинское агентство. Проект – аналитический документ по фармацевтической разработке лекарств для пожилых людей. 2017.
- 7. Мистри П., Бэтчелор Х. Доказательства приемлемости пероральных педиатрических лекарств: обзор.J Pharm Pharmacol. 2017; 14 (10): 12610.
- 8. Ранмал С.Р., О’Брайен Ф., Лопес Ф., Руис Ф., Орлу М., Тулеу С. и др. Методологии оценки приемлемости пероральных составов среди детей и пожилых людей: систематический обзор. Drug Discov сегодня. 2018; 22 (17): 30477–4.
- 9. Национальное агентство безопасности медикаментов и продуктов санте. [Анализируйте медицинские учреждения во Франции в 2013 году]. 2014.
- 10. Мур Р.А., Мур Н. Парацетамол и боль: проблема килотонн.Европейский журнал больничной аптеки. 2016.
- 11. Ли ВМ. Гепатотоксичность ацетаминофена (APAP). Не пора ли отказаться от APAP? J Hepatol. 2017; 67 (6): 1324–31. pmid: 28734939
- 12. Руис Ф., Валле Т., Пенс-Леритье А.М., Ауссат А. Стандартизированный метод оценки приемлемости лекарств: акцент на педиатрической популяции. J Pharm Pharmacol. 2017; 69 (4): 406–16. pmid: 27109018
- 13.
Валле Т., Руис Ф., Лавард М., Пенс-Леритье А.М., Ауссат А.Стандартизированная оценка приемлемости лекарств в педиатрической популяции: надежность модели. J Pharm Pharmacol. 2018; 70 (1): 42–50. pmid: 2
21
- 14. Vallet T, Belissa E, Laribe-Caget S, Chevallier A, Chedhomme FX, Leglise P и др. Инструмент поддержки принятия решений, облегчающий разработку лекарств для оптимальной приемлемости для пожилых людей. Фармацевтические исследования. 2018; 35 (7): 136. pmid: 29736594
- 15. Кокран В. Некоторые методы усиления общих критериев χ2.Биометрия. 1954. 10 (4): 417–51.
- 16. Le S, Josse J, Husson F. FactoMineR: пакет R для многомерного анализа. Журнал статистического программного обеспечения. 2008. 25 (1): 1–18.
- 17. Josse J, Husson F. missMDA: пакет для обработки пропущенных значений в многомерном анализе данных. Журнал статистического программного обеспечения. 2016; 70 (1): 1–31.
- 18. Драмонд Н., ван Рит-Налес Д.А., Карапинар-Каркит Ф., Стегеманн С. Пригодность, приемлемость, применимость и предпочтения пациентов в отношении фармацевтических препаратов: результаты обзора литературы по клиническим доказательствам.Int J Pharm. 2017. Epub 2017/02/24.
- 19. Уолш Дж., Ранмал С.Р., Эрнест ТБ, Лю Ф. Приемлемость, безопасность и доступ пациентов: баланс для выбора соответствующих возрасту пероральных лекарственных форм для педиатрической и гериатрической групп населения. Int J Pharm. 2017; 11 (17): 30616–6.
- 20. Маца Л.С., Патрик Д.Л., Райли А.В., Александр Дж.Дж., Раджмил Л., Плейл А.М. и др. Инструменты исследования результатов педиатрических пациентов для поддержки маркировки медицинских продуктов: отчет рабочей группы ISPOR PRO о передовых исследованиях по оценке детей и подростков.Цените здоровье. 2013; 16 (4): 461–79. pmid: 23796280
- 21. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. Руководство для отрасли: показатели результатов, сообщаемые пациентами: использование при разработке медицинских продуктов для подтверждения заявлений на этикетке. 2009.
- 22. Stegemann S, Gosch M, Breitkreutz J. Дисфункция глотания и дисфагия – непризнанная проблема для пероральной лекарственной терапии. Международный фармацевтический журнал. 2012. 430 (1): 197–206.
- 23. Боатенг Дж. Инновации в доставке лекарств для решения глобальных проблем здравоохранения для педиатрического и гериатрического населения (за счет улучшения соблюдения пациентами).
