Молекулярная физика и термодинамика
Имея уравнение состояния (1.7) идеального газа, мы найдем совершаемую им работу при некоторых типичных процессах. Заодно определим количество теплоты, получаемое от внешнего источника.
1. Изохорный процесс. При изохорном нагревании или охлаждении (соответственно, прямые 1–2 и 1–3 на рис. 2.7) работа просто равна нулю, поскольку объем не меняется.
Рис. 2.7. определению работы в изохорном процессе
Получаемое количество теплоты (обозначим Q12при V = const через Q12V) полностью идет на изменение внутренней энергии газа (см. (1.19))
|
|
(2.6) |
|
|
(2. |
2. Изобарный процесс. Поскольку в этом процессе р = const, то давление можно вынести из-под знака интеграла в (2.3). Тогда получаем (рис. 2.8)
|
|
|
(2.8) |
Рис. 2.8. Работа в изобарном процессе
Изменение внутренней энергии газа следует из (1.17) – (1.19) 1.17
1.18
1.19:
|
|
(2. |
Складывая (2.8) и (2.9), находим количество теплоты, переданное газу в этом процессе:
|
|
(2.10) |
Пример 1. Пусть система получила при постоянном давлении определенное количество теплоты Q. Найдем, какая часть расходуется на совершение работы А,
Из формул (2.8) и (2.9) сразу следует, что
Чем больше g, тем большая часть тепла переходит в работу: для одноатомных газов
для двухатомных (без учета колебаний ядер, при двух вращательных степенях свободы)
и для многоатомных газов (без учета колебаний ядер, при трех вращательных степенях свободы)
Заметим, что мы излагаем достаточно общий подход, который применим не только к идеальным газам.
|
|
(2.11) |
Найдем выражение для работы такой системы при изменении ее температуры от Т1до
Используя уравнение состояния (2.11), находим отсюда
3. Изотермический процесс расширения (или сжатия) газа может происходить в условиях, когда теплообмен между газом и внешней средой осуществляется при постоянной разности температур. Для этого теплоемкость внешней среды должна быть достаточно велика, и процесс расширения (или сжатия) должен происходить достаточно медленно. Диаграмма изотермического расширения представлена на рис. 2.9.
Для этого теплоемкость внешней среды должна быть достаточно велика, и процесс расширения (или сжатия) должен происходить достаточно медленно. Диаграмма изотермического расширения представлена на рис. 2.9.
Рис. 2.9. Работа при изотермическом расширении системы
Используя уравнение состояния и выражение (2.2) для элементарной работы, находим
|
|
(2.12) |
Далее используем общее выражение (2.3) для работы при конечном изменении объема
|
|
(2. |
Поскольку объем обратно пропорционален давлению, тот же результат можно представить в виде
|
|
|
Так как внутренняя энергия идеального газа не меняется при изотермическом процессе, в работу преобразовалась вся теплота, полученная от источника:
Пример 2. Расширяясь, водород совершил работу 6 кДж. Найдем количество теплоты, подведенное к газу, если процесс протекал: а) изобарно; б) изотермически.
Рассмотрим сначала изобарное расширение. Из формул (2.8) и (2.10) следует связь количества теплоты и совершенной работы:
Мы использовали значение g = 7/5 для двухатомного газа.
Видео 2.1. Работа нагретого газа над вертушкой.
Дополнительная информация
http://kvant.mirror1.mccme.ru/ — Журнал Квант, 2004, № 3, стр. 32–33, А. Леонович «А так ли хорошо знакома вам теплопередача?», — попробуйте ответить на оригинальные вопросы, связанные с теплообменом.
4) Работа идеального газа. Внутренняя энергия и теплоемкость (молярная и удельная) идеального газа.
Работа идеального газа в изопроцессах.
Первый закон термодинамики (закон сохранения энергии для тепловых процессов) определяет количественное соотношение между изменением внутренней энергии системы дельта U, количеством теплоты Q, подведенным к ней, и суммарной работой внешних сил A, действующих на систему.
Первый закон термодинамики – Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее:
Первый закон термодинамики – количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
Частные случаи первого закона термодинамики для изопроцессов
При изохорном
процессе объем газа остается постоянным,
поэтому газ не совершает работу.
При изотермическом процессе количество теплоты, переданное газу от нагревателя, полностью расходуется на совершение работы:
Q=A’
При изобарном расширении газа подведенное к нему количество теплоты расходуется как на увеличение его внутренней энергии и на совершение работы газом:
Адиабатный процесс – термодинамический процесс в теплоизолированной системе.
Теплоёмкость идеального
газа —
отношение количества
теплоты,
сообщённого газу, к изменению
Молярная теплоёмкость — теплоёмкость 1 моля идеального газа.
Адиабатический[править | править исходный текст]
В адиабатическом
процессе теплообмена
с окружающей средой не происходит, то
есть .
Однако, объём, давление и
температура меняются, то есть .
Следовательно, теплоёмкость идеального газа в адиабатическом процессе равна нулю: .
Изотермический[править | править исходный текст]
В изотермическом процессе постоянна температура, то есть . При изменении объёма газу передаётся (или отбирается) некоторое количество тепла. Следовательно, теплоёмкость идеального газа равна бесконечности:
Изохорный[править | править исходный текст]
В изохорном процессе постоянен объём, то есть . Элементарная работа газа равна произведению изменения объёма на давление, при котором происходит изменение (). Первое Начало Термодинамики для изохорного процесса имеет вид:
А для идеального газа
Таким образом,
где — число степеней свободы частиц газа.
Другая формула: , где γ — показатель адиабаты, R — универсальная газовая постоянная.
Согласно Первому началу
термодинамики существует два способа
изменения внутренней энергии тела (в
нашем случае идеального газа): передать
ему некоторое количество теплоты или
совершить над ним работу.
dU=δQ+δA, где δA — работа внешних сил над газом.
δAвнеш.сил=-δAгаза
δQ=dU+δAгаза
В расчете на 1 моль:
С=δQ/ΔT=(ΔU+pΔV)/ΔT
ΔU=CV*ΔT
C=CV+(pΔV/ΔT)в данном процессе
Внутренняя энергия идеального газа
Исходя из определения идеального газа, в нем отсутствует потенциальная составляющая внутренней энергии (отсутствуют силы взаимодействия молекул, кроме ударного). Таким образом, внутренняя энергия идеального газа представляет собой только кинетическую энергию движения его молекул. Ранее (уравнение 2.10) было показано, что кинетическая энергия поступательного движения молекул газа прямо пропорциональна его абсолютной температуре
Используя выражение универсальной газовой постоянной (4.6), можно определить величину константы α
Таким образом, кинетическая энергия поступательного движения одной молекулы идеального газа будет определяться выражением
(4. |
В соответствии с кинетической теорией, распределение энергии по степеням свободы равномерное. У поступательного движения 3 степени свободы. Следовательно, на одну степень свободы движения молекулы газа будет приходиться 1/3 ее кинетической энергии
(4.11) |
Для двух, трех и многоатомных молекул газа кроме степеней свободы поступательного движения есть степени свободы вращательного движения молекулы. Для двухатомных молекул газа число степеней свободы вращательного движения равно 2, для трех и многоатомных молекул – 3.
Поскольку распределение энергии движения молекулы по всем степеням свободы равномерное, а число молекул в одном киломоле газа равняется Nμ, внутреннюю энергию одного киломоля идеального газа можно получить, умножив выражение (4.11) на число молекул в одном киломоле и на число степеней свободы движения молекулы данного газа
(4. |
где Uμ – внутренняя энергия киломоля газа в Дж/кмоль, i – число степеней свободы движения молекулы газа.
Для 1-атомного газа i = 3, для 2-атомного газа i = 5, для 3-атомного и многоатомного газов i = 6 (рис. 4.1).
Для многоатомного газа i=6, так как существуют 3 степени свободы поступательного движения и 3 степени свободы вращательного движения молекул. Может быть еще колебательное движение атомов в молекуле, но его обычно учитывают для реальных газов, используя экспериментальные данные. Для идеальных газов колебательное движение атомов в молекулах тоже может быть учтено при расчете внутренней энергии, об этом будет сказано в разделе “Зависимость теплоемкостей идеальных газов от температуры”. На данном этапе изложения материала будем руководствоваться молекулярно-кинетической теорией идеального газа. В соответствии с ней атомы в молекулах идеального газа имеют жесткие связи, т.е. колебательного движения атомов в молекулах нет.
Для
одного килограмма идеального газа
удельная внутренняя энергия в Дж/кг
определяется делением выражения (4. 12)
на молярную массу газа
12)
на молярную массу газа
(4.13) |
Для произвольного количества газа внутренняя энергия определяется как произведение его массы на удельную внутреннюю энергию этого газа
(4.14) |
где m – масса газа в кг,
U – полная внутренняя энергия идеального газа.
Если система состоит из нескольких различных по физическим свойствам газов, то, подчиняясь закону сложения (аддитивности), его полная внутренняя энергия будет определяться суммой внутренних энергий компонентов газовой смеси
(4.15) |
где n – число компонентов газа в системе.
Полученные
уравнения внутренней энергии идеального
газа (4. 12) – (4.15) указывают на то, что
внутренняя энергия идеального газа
зависит только от абсолютной температуры
газа и числа степеней свободы движения
его молекул
12) – (4.15) указывают на то, что
внутренняя энергия идеального газа
зависит только от абсолютной температуры
газа и числа степеней свободы движения
его молекул
или
термодинамика – Работа, совершаемая идеальным газом
Вопрос
Изменено 5 лет, 8 месяцев назад
Просмотрено 12 тысяч раз
$\begingroup$
В наших учебниках указано, что работа, совершаемая газом, равна
$$dW = P_{external}\space dV$$
Но почему она не может быть
$$dW = P_{gas} \space dV $$
Почему при расчете работы идеального газа мы учитываем внешнее давление, а не давление газа в сосуде?
- термодинамика
- работа
- определение
$\endgroup$
1
$\begingroup$
Если процесс необратим , давление газа внутри цилиндра неравномерно и меняется в зависимости от пространственного положения. На силу на единицу площади на торце поршня (где совершается работа) $\sigma_f$ также влияют вязкие напряжения (которых нет при обратимом процессе). Таким образом, в необратимом процессе работа, совершаемая газом над окружающей средой, определяется выражением $$W=\int{\sigma_f dV}=\int{P_{ext} dV}$$, где $\sigma_f$ — сжимающая напряжение, создаваемое газом на поверхности поршня. Это сжимающее напряжение включает в себя термодинамическое давление $p_f$ (оцениваемое при местных удельных объемах и температурах газа, как, например, рассчитанных по закону идеального газа) плюс вязкое напряжение, определяемое локальной скоростью деформации газа в окрестности поверхность поршня: $$\sigma_f=p_f+\sigma_{vf}$$Обратите внимание, что согласно 3-му закону Ньютона сжимающее напряжение $\sigma_f$, действующее на поверхность поршня со стороны газа, равно $P_{ext}$, сжимающее напряжение, действующее на газ со стороны поршня.
На силу на единицу площади на торце поршня (где совершается работа) $\sigma_f$ также влияют вязкие напряжения (которых нет при обратимом процессе). Таким образом, в необратимом процессе работа, совершаемая газом над окружающей средой, определяется выражением $$W=\int{\sigma_f dV}=\int{P_{ext} dV}$$, где $\sigma_f$ — сжимающая напряжение, создаваемое газом на поверхности поршня. Это сжимающее напряжение включает в себя термодинамическое давление $p_f$ (оцениваемое при местных удельных объемах и температурах газа, как, например, рассчитанных по закону идеального газа) плюс вязкое напряжение, определяемое локальной скоростью деформации газа в окрестности поверхность поршня: $$\sigma_f=p_f+\sigma_{vf}$$Обратите внимание, что согласно 3-му закону Ньютона сжимающее напряжение $\sigma_f$, действующее на поверхность поршня со стороны газа, равно $P_{ext}$, сжимающее напряжение, действующее на газ со стороны поршня.
Если процесс протекает обратимо, то вязкие напряжения пренебрежимо малы, а термодинамическое давление одинаково во всем газе, так что $$\sigma_{vf}=0$$ и $$p_f=p$$, где p определяется из общего объема и температуры газа, как, например, из уравнения состояния типа закона идеального газа. Итак, для обратимого процесса $$\sigma_f=P_{ext}=p$$ и $$W=\int{P_{ext}dV}=\int{pdV}$$
Вот ссылка на статью, которую я написал, которая объясняет разницу между обратимым и необратимым расширением газа (и работой сжатия) с точки зрения близкой аналогии с механической системой пружины-демпфера: https://www.physicsforums.com/insights/ обратимое-против-необратимого-сжатия-расширения-газа/
Итак, для обратимого процесса $$\sigma_f=P_{ext}=p$$ и $$W=\int{P_{ext}dV}=\int{pdV}$$
Вот ссылка на статью, которую я написал, которая объясняет разницу между обратимым и необратимым расширением газа (и работой сжатия) с точки зрения близкой аналогии с механической системой пружины-демпфера: https://www.physicsforums.com/insights/ обратимое-против-необратимого-сжатия-расширения-газа/
$\endgroup$
$\begingroup$
Честно говоря, не имеет значения, какое давление вы считаете, потому что работа, совершаемая газом, численно равна работе, совершаемой внешним давлением (сохранение энергии).
$$W_{ext} = -W_{gas}$$
Мы рассматриваем то давление, которое наиболее подходит в данной ситуации. Рассмотрим следующий пример:
В следующей задаче газ совершает работу, толкая поршень (предположим, наружу). При этом давление газа постоянно меняется.
Любая работа, совершаемая газом, так же хороша, как работа, совершаемая внешним давлением в противоположном направлении (может быть отрицательной работой).
Сравним оба способа расчета работы.
Метод 1 (с использованием внутреннего давления): $$dW = P_{gas}\space dV$$
Давление газа постоянно меняется, поэтому для решения дифференциального уравнения нам потребуется получить функцию/уравнение, описывающее, как давление изменяется с объемом.
Способ 2 (с использованием внешнего давления): $$dW = P_{ext} \space dV$$
В нашей задаче внешнее давление постоянно, поэтому дифференциальное уравнение решается легко.
$$\int dW = \int P_{ext} dV$$ $$W = P_{ext} \int dV$$ $$ W = P_{ext} \Delta V $$
Обратите внимание, что работа, рассчитанная двумя методами, дает один и тот же результат в числовом выражении (одна и та же величина), но с разными знаками.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
домашнее задание и упражнения – Расчет работы идеального газа
$\begingroup$
Я пытаюсь рассчитать работу идеального газа в поршневом устройстве, температура которого поддерживается постоянной. Мне даны объем, давление и температура. 9{V_2}_{V_1} p(V)dV$$
, но я не понимаю, как использовать это уравнение, чтобы помочь мне рассчитать проделанную работу, я думаю, что меня смущает тот факт, что мне нужно иметь $ p(V)$, но я не уверен, что это такое. Если бы вы могли помочь мне понять это, это было бы здорово
- домашние задания и упражнения
- термодинамика
- энергия
- идеальный газ
$\endgroup$
1
$\begingroup$
9{V_2} p_{ext} dV$$
Обратите внимание на $p_{ext}$. Это внешнее давление, потому что выполнение работы эквивалентно подъему веса в гравитационном поле Земли.

 7)
7)
 13)
13) 10)
10)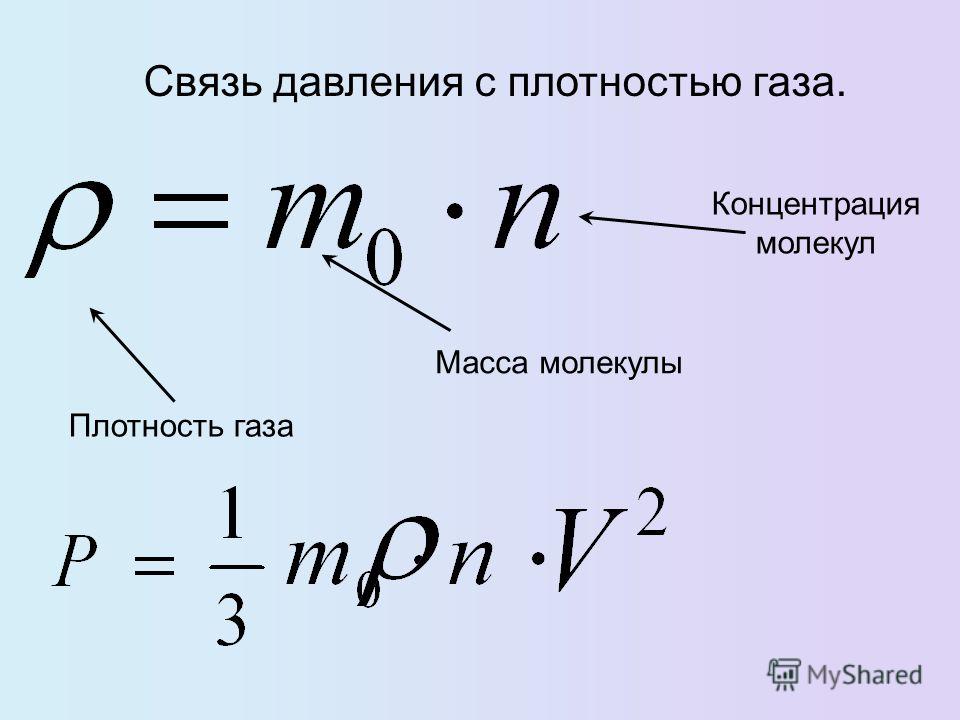 12)
12)