Курсовая работа по фармацевтической химии
ГБОУ ВПО «Пермская государственная фармацевтическая академия» Министерства здравоохранения Российской Федерации |
Кафедра фармацевтической химии факультета очного обучения |
Курсовая работа по фармацевтической химии «Анализ многокомпонентного лекарственного препарата аптечного изготовления» |
Исполнитель: ____________________
(ФИО студента полностью)
______________________
______________________
(группа)
Руководитель: _____________________
(ФИО преподавателя)
Пермь – 2013 г
Состав лекарственного препарата 2
Обоснование прописи. 2
Условия хранения ЛП. 2
Описание ЛП. 2
Реакции подлинности. 3
Количественное определение. 5
Виды внутриаптечного контроля. 8
Список литературы. 9
Analginum0,25
Phenobarbitalum0,02
С точки зрения химической совместимости: ЛС совместимы, т.к. не происходит химического взаимодействия компонентов, которое могло бы привести к снижению или утрате терапевтической активности ЛП.
С точки зрения физической совместимости: ЛС совместимы по анализу их физических характеристик.
С точки зрения фармакологической совместимости.
Фармакологическая несовместимость лекарственных средств обуславливается сочетанием ЛС, которые действуют как антагонисты или взаимно усиливают побочное или токсическое действие друг друга. В данном ЛП, анальгин оказывает обезболивающее действие, а фенобарбитал в малых дозах – седативное действие и потенцирует эффект анальгина. ЛП может применятся при болевых синдромах различного генеза: зубная боль, головная боль, боли в мышцах и суставах и др.
Хранить надо в хорошо укупоренной таре, в банках из темного стекла в защищенном от света месте. При действии света может происходить окисление анальгина.
Белый кристаллический порошок, без запаха. Растворим в воде, трудно растворим в спирте.
Требуется разделение ЛС. Для этого ЛП промывают на фильтре эфиром (фенобарбитал растворяется в эфире, следовательно будет находится в растворе; анальгин не растворим в эфире – на фильтре). Эфир отгоняют и проводят реакции на фенобарбитал. На анальгин проводят реакции после растворения остатка на фильтре в воде.
Фенобарбитал
Реакция комплексообразования с раствором кобальта (II) нитрата.
Основана на свойстве ЛС подвергаться имидо-имидольной таутомерии; имидольная таутомерная форма образует комплекс с кобальта (II) нитратом.
Данная реакция неспецифична, её дают все ЛС барбитуровой кислоты.
Эффект реакции: фиолетовое окрашивание.
Методика: на воронку с фильтром помещают 0,1 г. порошка, промывают 3-5 мл. эфира. Эфир отгоняют. К остатку прибавляют по 5 капель 95% этанола, 1% спиртового раствора кобальта (II) нитрата и водно-спиртового раствора аммиака. Появляется фиолетовое окрашивание.
2.Анальгин
1)реакция с раствором хлорамина в кислой среде
Основана на восстановительных свойствах анальгина.
Эффект реакции: синее окрашивание.
Методика: к 4-5 каплям фильтрата прибавляют 2-3 капли разведенной серной кислоты и 1-2 капли раствора хлорамина. Появляется синее окрашивание.
2)реакция с аммония ванадатом
Основана на восстановительных свойствах анальгина.
Эффект реакции: интенсивное синее окрашивание.
Методика: к 4-5 кап. фильтрата прибавляют 0,5 мл. воды, 0,005 г. Аммония ванадата и 1 кап. концентрированной серной кислоты. Появляется интенсивное синее окрашивание.
Проводится разделение компонентов.
Фенобарбитал
Алкалиметрический метод нейтрализации.
Прямое титрование.
Метод основан на кислотных свойствах имидной группы фенобарбитала.
Метод специфичен (определение проводится по фармакологически активной части молекулы), достоверен (высока степень близости результата анализа к действительному содержанию вещества), воспроизводим, неселективен (нельзя количественно определить в присутствии других веществ, обладающих кислотными свойствами), экономичен, прост в выполнении (не требуется специальной сложной аппаратуры), не длителен во времени.
Метод индикации: используется индикатор – тимолфталеин
Переход окраски:
Методика: обрабатывают 0,5 г. порошка эфиром 4 раза по 5 мл., фильтруя в сухую колбу, и эфир отгоняют (остаток на фильтрате сохраняют для определения анальгина). Остаток после отгонки эфира растворяют в 5 мл. 96% этанола, нейтрализованного по смешанному индикатору (спиртовые растворы тимолового синего и фенолфталеина 1:1), и титруют 0,1 моль/л раствором гидроксида натрия до слабо-фиолетового окрашивания.
Анальгин
Йодометрический метод. Прямое титрование.
Метод основан на окислении серы (IV) в серу (VI), в присутствии этанола для предотвращения предварительного гидролиза анальгина и соляной кислоты (для разложения анальгина и предотвращения окисления выделившегося альдегида).
Метод специфичен (определение проводится по фармакологически активной части молекулы), достоверен (высока степень близости результата анализа к действительному содержанию вещества), воспроизводим, неселективен (нельзя количественно определить в присутствии других веществ, обладающих восстановительными свойствами), экономичен, прост в выполнении (не требуется специальной сложной аппаратуры), не длителен во времени.
Метод индикации: титрование без индикатора до появления слабого желтого окрашивания, не исчезающего в течение 30 сек.
Методика: остаток на фильтрате растворяют в 10 мл воды (фильтр прокалывают стеклянной палочкой, порошок ссыпают в колбу и оставшийся на фильтре анальгин смывают водой в ту же колбу), прибавляют 5 мл этилового спирта, 1 мл разведенной хлороводородной кислоты и титруют 0,1 н. раствором йода до появления желтой окраски раствора, не исчезающей в течение 30 секунд.
1 мл 0,1 н. раствора йода соответствует 0,01757 г анальгина.
Обязательные виды контроля:
Письменный
Паспорт письменного контроля заполняется сразу после изготовления ЛФ по памяти на латинском языке, в соответствии с последовательностью технологических операций. В паспорте указывают: дату изготовления, номер рецепта, наименование ЛС и их количества, число доз, подписи изготовившего и проверившего ЛФ. Все расчеты производятся до изготовления лекарственной формы и записываются на обратной стороне ППК.
Органолептический
Данный вид контроля заключается в проверке ЛФ по показателям
Контроль при отпуске
Проверяется соответствие:
Упаковки ЛФ в соответствии физико-химическим свойствам входящим в него ЛС
Указанных в рецепте доз сильнодействующих ЛС возрасту больного
Номера на рецепте и номера на этикетке; фамилии больного на квитанции, фамилии на рецепте и этикетке
Выборочные виды контроля
Физический. Отклонения, допустимые в массе ЛФ (приказ №305)
Химический. Полный качественный и количественный анализ.
Опросный
Проводится после изготовления фармацевтом не более 5 ЛФ. При проведении опросного контроля провизор-технолог называет первое входящее в ЛФ вещество, после чего фармацевт называет все взятые ЛС и их количества.
Кулешова М.И., T.H. Гусева,O.K. Сивицкая. Анализ лекарственных форм, изготовляемых в аптеках /– Пособие, 2-е изд., перераб. и доп. – М.: Медицина, 1989. – 288 с.
Лекции по фармацевтической химии VIкурсIиIIчасть.
Максютина Н.П. Методы анализа лекарств / Н.П. Максютина, Ф.Е. Каган, JI.A. Кириченко и др. – К.: Здоровья, 1984. – 224 с.
Машковский М.Д. Лекарственные средства: В 2-х томах. Т.1 и 2 (последние издания).
Погодина Л.И. Анализ многокомпонентных лекарственных форм.- Минск: Высш. шк., 1985.- 240 с.
Фармацевтический анализ по функциональным группам: Учебно-методическое пособие для студентов очного факультета.- Пермь, ПГФА, 2002.- 55 с.
studfiles.net
«Методы анализа лекарственных средств производных арилалкиламинов»
Подобный материал:- Курсовая работа по технологии лекарств тема: «Законодательные основы нормирования производства, 628.18kb.
- Тематический план срс модуля 2 по фармацевтической химии для студентов 3 курсу фармацевтического, 35.44kb.
- Методические указания по проведению лекций и семинарско-практических занятий дисциплина, 919.56kb.
- Реферат тема: «Стандартизация и сертификация лекарственных средств», 215.3kb.
- «Дни фармацевтической промышленности. Инновационные решения для производства и обеспечения, 144.39kb.
- Научно-практическая конференция для специалистов фармацевтической отрасли в рамках, 50.59kb.
- Полномочия, 47.68kb.
- Кафедра фармацевтической и токсикологической химии медицинского факультета Фармацевтическая, 361.13kb.
- Готовления препаратов из лекарственных средств и вспомогательных веществ путем придания, 256.6kb.
- Тематический план лекций по фармацевтической химии, 76.43kb.
КУРСОВАЯ РАБОТА
по фармацевтической химии
тема:
«Методы анализа лекарственных средств производных арилалкиламинов»
СОДЕРЖАНИЕ
СОДЕРЖАНИЕ 2
ВВЕДЕНИЕ 3
ЛИТЕРАТУРНЫЙ ОБЗОР 5
Глава 1. ФАРМАКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ АРИЛАЛКИЛАМИНОВ 5
1.1. ФАРМАКОЛОГИЯ АДРЕНАЛИНА 5
1.2. ФАРМАКОЛОГИЯ НОРАДРЕНАЛИНА. 11
1.3. ФАРМАКОЛОГИЯ ЭФЕДРИНА 15
Глава 2. МЕТОДЫ АНАЛИЗА 18
2.1. ПЛОСКОСТНАЯ ХРОМАТОГРАФИЯ 18
2.2. ИК и УФ спекторофотометрия 21
2.3. ЛЮМИНЕСЦЕНЦИЯ 22
2.4. БИОЛОГИЧЕСКИЙ МЕТОД 27
Глава 3. ФАРМАКОПЕЙНЫЕ ПРЕПАРАТЫ 29
3.1. Solutio Adrenalini hydrochloride 0,1% 29
3.2. Noradrenalini hydrotartas.
Норадреналина гидротартрат 30
3.3. Solutio Noradrenolini hydrotartratis 0,2% pro injektionibus.
Раствор норадреналина гидротартрата 0,2% для инъекций 31
3.4. Ephedrine hydrochloridum
Эфедрина гидрохлорид 32
3.5. Solutio Eppedrini hydrochloridi 5% pro injektionibus
Раствор эфедрина гидрохлорида 5% для инъекций 33
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 35
Глава 1. КАЧЕСТВЕННЫЙ АНАЛИЗ 35
1.1. АНАЛИЗ АДРЕНАЛИНА 35
1.2. АНАЛИЗ НОРАДРЕНАЛИНА 37
1.3. АНАЛИЗ ЭФЕДРИНА 38
Глава 2. КОЛИЧЕСТВЕНЫЙ АНАЛИЗ 39
2.1. АНАЛИЗ АДРЕНАЛИНА 39
2.2. АНАЛИЗ НОРАДРЕНАЛИНА 39
2.3. АНАЛИЗ ЭФЕДРИНА 39
ВЫВОДЫ: 41
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ: 42
ВВЕДЕНИЕ
Лекарственное средство может иметь три основных названия:
- Химическое название, отражающее состав и структуру лекарственного вещества. Химическое название редко употребляется в практическом здравоохранении, но часто приводима в аннотациях на лекарственные препараты и содержатся в социальных справочных изданиях.
- Международное непатентованное название (МНН, International Nonproprietary Name, INN). Это название лекарственного вещества, рекомендованное Всемирной Организацией Здравоохранения (ВОЗ), принятое для использования во всем мире в учебной и научной литературе с целью удобства идентификации препарата по принадлежности к определенной фармакологической группе и для того, чтобы избежать предвзятости и ошибок. Синонимом МНН является термин генерическое, или дисенерическое название. Иногда МНН отражает химическое строение лекарственного вещества, например: ацетилсалициловая кислота.
- Патентованное коммерческое название (Brand name). Оно присваивается фармацевтическими фирмами, производящими данный конкретный оригинальный лекарственный препарат и является их коммерческой собственностью (торговой маркой), охраняемой патентом. Например, торговое название ацетилсалициловой кислоты – аспирин, фурасемида – лазикс, диклофенана – вольтарен. Торговые названия используются фирмами – производителями для маркетинговых целей, для продвижения и конкуренции лекарственных препаратов на рынке.
Когда у фирмы разработчика заканчивается срок действия патента, то другие компании могут производить данное лекарственное средство и продавать его под международным названием. Такие препараты называют воспроизведенными лекарственными средствами, или дигенерическими препаратами. Препараты дисенерики обычно дешевле оригинальных, так как затраты на их разработку и клинические испытания не включены в цену.
Одно и то же лекарственное вещество может содержатся в одинаковых дозах в препаратах одной лекарственной формы имеющих разные торговые названия (препараты синонимы). Поэтому провизор может предложить пациенту заменить один препарат (при отсутствии его в аптеке), другим препаратом – синонимом.
Целью данной работы является:
- Изучить наиболее широко используемые методы анализа лекарственных средств ариалкиламинов.
- Определить доброкачественность и эффективность исследуемых препаратов.
ЛИТЕРАТУРНЫЙ ОБЗОР
Глава 1. ФАРМАКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ АРИЛАЛКИЛАМИНОВ
1.1. ФАРМАКОЛОГИЯ АДРЕНАЛИНА
Адреналин – один из наиболее мощных гипертензивных агентов. Как правило, при применении этого препарата систолическое давление возрастает в гораздо большей степени, чем диастолическое. Вслед за повышением артериальное давление становится ниже исходного уровня, а затем возвращается к нормальным показателям. Тахифилаксия к адреналину не развивается. Действие препарата на ССС определяется по существу алгебраической суммой эффектов, возникающих в результате воздействия препарата на - и β-адренарецепторы. В механизме гипертензивного действия адреналина существенную роль играет повышение силы сердечных сокращений и увеличение их числа. Эти эффекты связывают с воздействием β-адренорецепторов сердца. При действии адреналина на сердечно-сосудистую систему решающее значение имеет сокращение артериол многих сосудистых областей, особенно кожи, слизистых и органов брюшной полости. Брадикардия, возникающая в экспериментах на животных, предупреждается перерезкой блуждающих нервов или введением атропина. Следовательно, урежение пульса имеет рефлекторную природу и связано с компенсаторным повышением тонуса вагуса в ответ на подъем артериального давления. В малых дозах в опытах на животных адреналин снимает артериальное давление, что объясняют большей чувствительностью к нему β-адренорецепторов. Плотность последних велика в мышечных сосудах и сосудах печени. В клинике при введении адреналина под кожу всасывание его происходит очень медленно вследствие спазма на месте инъекции сосудов подкожной клетчатки. В этом случае систолическое давление умеренно возрастает, но диасталическое обычно понижается. Общее периферическое сопротивление сосудов уменьшается, что объясняют возбуждением β-адренорецепторов сосудов скелетных мышц. В связи с тем, что при клиническом применении адреналина артериальное давление возрастает не столь сильно, компенсаторные рефлексы, реализующиеся через блуждающий нерв, не предупреждают прямое действие препарата на сердце. Число сердечных сокращений, ударный и минутный объем сердца, а также работа левого желудочка существенно возрастают. Этому способствуют также и увеличение венозного возврата к сердцу. Учащение сердцебиений, наблюдаемое при применении адреналина, объясняют прямым действием препарата на сино-аурикулярный узел. Увеличение минутного объема кровообращения не является простым результатом тахикардии, так как кроме этого препарат значительно повышает силу сердечных сокращений. Такие данные были получены в экспериментах на собаках, а также в наблюдениях на людях. При применении адреналина давление в правом предсердии повышается. Увеличивается также венозное давление. Следует подчеркнуть, что в этом случае возрастает давление в легочных сосудах. В повышении давления в малом круге кровообращения значительную роль играет перераспределение крови в легочной циркуляции. Передозировка адреналина может сопровождаться гибелью больного вследствие развития отека легких. Механизм последнего достаточно ложен, однако большую роль в его генезе играет резкое повышение фильтрационного давления в капиллярах легких.
Как известно, адреналин в зависимости от дозы, состояния и локализации сосудов может вызвать их расширение или сужение. Однако в целостном организме в сумме преобладают сосудорасширяющие эффекты над сосудосуживающими и подъем систолического давления в основном обусловлен усилением работы сердца. В связи с этим периферическое сопротивление и диасталическое давление или не претерпевают изменений, или слегка возрастают. Действие адреналина на сосуды проявляется главным образом по отношению к мелким артериалам и прекапиллярным сфинктерам, хотя препарат в определенной степени влияет и на вены, и на крупные артерии. Веноконстрикторное действие показано в наблюдениях на людях с нормальным давлением и в условиях гипотензии. Сосуды различных областей неодинаково реагируют на адреналин. Сосуды кожи, слизистых и почек суживаются, в то время как сосуды скелетных мышц расширяются. При проведении исследований в клинике было показано, что под влиянием препарата кровоток в сосудах скелетных мышц усиливается, а в сосудах кожи и слизистых оболочках уменьшается. Кроме того, снижается также и почечный кровоток, церебральный, коронарный и печеночный – возрастают.
Адреналин оказывает весьма выраженное влияние на тонус терминальных сосудов. Многими исследователями в области микроциркуляции было доказано, что чувствительность микрососудов к адреналину обратно пропорциональна их диаметру и меняется в следующем порядке: прекапиллярные сфинктеры > метартериолы > прекапиллярные артериолы > посткапиллярные венулы.
В 1960 году было установлено, что адреналин введенный внутривенно в дозе 10 – 30 мкг/кг веса, вызывал выраженное тотальное сокращение прекапиллярных сосудов брыжейки крыс, уменьшая скорость кровотока и вызывал стаз крови в венулах, хотя диаметр последних не изменялся.
На резкое повышение тонуса мелких артерий, артериол и метаартериол с замедлением кровотока в сосудах аппендикса крыс при введении адреналина указывала ученая Н.И. Храброва. Эти явления наблюдались ею как в обычных условиях, так и в различные периоды травматического шока.
Если мнения отдельных исследователей о влиянии адреналина на микрососуды аппендикса сходятся, то обратное отличается в отношении действия препарата на терминальные сосуды мягкой мозговой оболочки. Так, одни придерживались мнения, что введение адреналина не вызывает изменения просвета пиальных сосудов. Другие отмечали кратковременное сужение артериол с последующим их расширением после нанесения раствора адреналина. Большинство же авторов указывают, что аппликация адреналина сопровождается уменьшением просвета артерий диаметром более 100 мк, причем эти изменения диаметра сосудов мягкой мозговой оболочки не превышают 4 – 8% исходной величины.
Необходимо подчеркнуть, что чувствительность терминальных сосудов к вазоактивным веществам, в том числе к адреналину, существенно меняется в процессе развития травматического шока.
В силу перечисленных свойств адреналин, как правило, почти не используется в клинике в качестве прессорного агента для терапии острых гипотензий, однако он назначается с целью повышения артериального давления, когда последнее снижается в результате остановки сердца. В ряде случаев в таких ситуациях с помощью адреналина удается достичь положительных эффектов.
В экспериментах на собаках было показано, что адреналин значительно увеличивает выживаемость животных после гипоксической остановки сердца.
Адреналин оказывает значительное влияние на метаболические процессы, в частности на кислородный режим организма, углеводный, жировой и другие виды обмена веществ. Данные о влиянии адреномиметиков на тканевое дыхание довольно противоречивы. Некоторые исследователи не наблюдали увеличения потребления кислорода отдельными тканями при применении адреналина. Другие исследователи обнаружили увеличение потребления кислорода тканями под влиянием адреналина.
Аналогичные факты отметил Парий (1972 г.) в опытах на крысах. Им было установлено, что под влиянием адреналина увеличивается потребление кислорода тканями сердца, скелетной мышцы, печени и почек по сравнению с аналогичными результатами контрольной серии опытов соответственно на 25, 19, 19 и 21%. В этих же условиях не наблюдалось выраженных изменений со стороны потребления кислорода тканями аорты. Параллельно со сдвигами потребления кислорода отмечались и изменения выделения углекислого газа тканями исследуемых органов. При применении адреналина выделение CO2 увеличивалось в сердце на 52%, скелетной мышце – на 51%, печени на 54%, и почек – на 34%. Выделение CO2 аортой тоже возрастало, но эти изменения были статистически незначительными. При сопоставлении степени увеличения потребления кислорода и выделения CO2 нетрудно увидеть, что возрастание выделения CO2 было более интенсивным, чем активация потребления O2. Это явление и определило сдвиг со стороны дыхательного коэффициента. Последний увеличивается в сердце, скелетной мышце и печени соответственно на 27, 18 и 52% по сравнению с таковым у контрольных животных.
Общеизвестны и другие метаболические сдвиги, обычно возникающие при применении адреналина, которые сводятся к активации фосфорилазы, накоплению глюкозы и молочной кислоты, усилению распада жиров и окислению жирных кислот, изменению обмена электролитов. Многими исследователями описана способность адреналина увеличивать содержание сахара в крови. Аналогичные результаты получил Парий в экспериментах на кроликах без наркоза. При внутривенном введении адреналина в дозе 0,01 мг/кг он наблюдал выраженную гиперлейкемию. На 30-й минуте после введения препарата содержание глюкозы в крови доходило до 142±3,6 мг %, что составляет 136% от исходного. Хотя в дальнейшем адреналиновая гиперлейкемия снималась, она оставалась статистически значимо повышенной до конца наблюдения.
Механизм действия адреналина на углеводный обмен сводится к усилению распада гликогена в печени и мышцах. Усиление гликолитических процессов является следствием активизации перехода неактивной фосфорилозы β в ее активную форму . Эта активизация осуществляется опосредованно через циклический 3,5 аденозинмонофосфат, образование которого стимулирует адреналин. Таким образом, пусковым моментом в механизме действия адреналина на углеводный обмен является стимуляция образования 3,5-АМФ при наличии аденилатциклазы.
Как уже указывалось, под влиянием адреналина существенно возрастает концентрация свободных мирных кислот в крови, что вероятно, объясняется активацией липазы. Последняя способствует превращению триглицеридов в жировых тканях в глицерол и свободные жирные кислоты. Возможно, за счет повышения содержания свободных мерных кислот в крови жир деионизируется в мышцах и печени. Трудно установить, с возбуждением каких типов рецепторов связаны эти эффекты адреналина, так как блокада и β-рецепторов предупреждает описанные превращения.
Большое значение в жизнедеятельности организма придают SH-группам.
Сульфидрильные группы, образуя разнообразные химические связи внутри белковой молекулы, имеют большое значение в создании и поддержании нативной структуры белка, благодаря чему определяются его функциональные свойства. Изучая в экспериментах на крысах влияние адреналина на содержание сульфидрильных групп в некоторых биологических субстратах, Арий установил, что после применения препарата общие сульфидрильные группы крови возрастают на 36%, причем это увеличение более выражено для белковых (на 40%), чем небелковых сульфидрильных группах (на 14%). В тканях головного мозга и сердца такие наблюдения изменения общих сульфидрильных групп в сторону их увеличения соответственно на 18 и 16%, однако статистически значимо возросло только содержание белковых сульфидрильных групп.
Полученные результаты увеличения количества сульфидрильных групп в крови под влиянием адреналина подтверждают широко распространенное мнение о роли этих групп в механизме мышечного сокращения и поддержания сосудистого тонуса.
Следует подчеркнуть, что между снижением содержания сульфидрильных групп сывороточных белков и снижением артериального давления отличается параллелизм. Этот факт дал авторам право предположить, что обнаруженные явления находятся в определенной взаимосвязи. Если при сниженном артериальном давлении ввести донатор сульфгидрильных групп – унитиол, – то наряду с возрастанием количества тиоловых групп в крови наблюдается и некоторое повышение артериального давления.
geum.ru
Типовая тематика курсовых работ по фармацевтической химии — КиберПедия
1. Обзор статей журнала «Фармация» по фармацевтическому анализу за определенный год.
2. Библиографический поиск по предложенной теме.
3. Реферативная работа по предложенной теме.
4. УФ – спектрофотометрия (или другой метод) в количественном анализе лекарственных веществ определенной группы.
5. ИК – спектроскопия (или другой метод) в анализе лекарственных веществ определенной группы.
6. Электротитриметрические методы (или другие методы) лекарственных веществ определенной группы.
7. Поиск новых лекарственных средств из в ряду производных пуринов (или из другой группы).
8. Направленный синтез лекарственных веществ на примере производных бензимидазола (или другого класса).
9. Анализ лекарственных веществ, содержащих альдегидную и кетонную (или другую функциональную) группу.
10. Анализ лекарственных веществ, содержащих: барий, кальций, магний (или другие элементы).
11. Методы и особенности анализа мазей и мазевых основ (или других лекарственных форм).
12. Внутриаптечный контроль качества лекарственных веществ определенной группы.
13. Внутриаптечный контроль качества определенного лекарственного средства.
14. Фармацевтический анализ лекарственных веществ определенной группы.
15. Фармацевтический анализ определенного лекарственного вещества.
16. Разработка методов анализа нового лекарственного средства.
17. Методы определения подлинности лекарственных веществ определенной группы.
18. Методы определения подлинности определенного лекарственного вещества.
19. Методы количественного определения лекарственных веществ определенной группы.
20. Методы количественного определения определенного лекарственного вещества.
21. Методы определения чистоты лекарственных веществ определенной группы.
22. Методы определения чистоты определенного лекарственного вещества.
23. Реакции комплексообразования (или другие) в фармацевтическом анализе лекарственных веществ определенной группы.
24. Комплексонометрическое (или другое) титрование лекарственных веществ определенной группы.
25. Особенности качественного анализа многокомпонентных лекарственных форм.
26. Особенности количественного анализа многокомпонентных лекарственных форм.
27. Способы разделения в анализе многокомпонентных лекарственных форм.
Приложение 6
РАСПРЕДЕЛЕНИЕ КУРСОВЫХ РАБОТ
по вариантам для студентовна 2011-2012 учебный год
Тема курсовой работы:
«Обзор статей журнала «Фармация»
по фармацевтическому анализу за(по шифру)год»
Год издания журнала «Фармация» совпадает с последней цифрой шифра
5 КУРСА ОЧНОГООТДЕЛЕНИЯ:
| Последняя цифра шифра | |||||||||||
| Год издания журнала |
5 КУРСА ЗАОЧНОГО ОТДЕЛЕНИЯ:
| Последняя цифра шифра | |||||||||||
| Год издания журнала |
Приложение 7.
Список рекомендуемой литературы
1. Государственная фармакопея Российской Федерации ХII издание / Изд-во «Научный центр экспертизы средств медицинского применения», 2008. – 704 с.
2. Государственная фармакопея СССР ХI издание, М.: «Медицина», 1987 г. (выпуск 1), 1989 г. (выпуск 2).
3. Казицина Л.И., Куплетская Н.Б. Применение УФ -, ИК -, ЯМР – спектроскопии в органической химии. М., МГУ, 1970 г.
4. Кулешова М.Н. и др. Анализ лекарственных форм, изготавливаемых в аптеках. М., 1989 г.
5. Лакин К.Н., Крылов Ю.Ф. Биотрансформация лекарственных веществ. М., Медицина, 1981 г.
6. Максютина Н.П. и др. Методы анализа лекарств. Киев, 1984 г.
7. Погодина Л.Н. Анализ многокомпонентных лекарственных форм, Минск, 1986 г.
8. Полюдек-Фабини Р., Бейрих Т. Органический анализ. Химия, 1981 г.
9. Рубцов М.В., Байчиков А.Г. Синтетические химико-фармацевтические препараты. М., 1971 г.
10. Справочник провизора-аналитика. Под ред. Н.П. Максютина, М., 1988 г.
11. Шрайнер Р. и др. Идентификация органических соединений. М., Мир, 1983 г.
12. Яхонтов Л.Н., Глушков Р.Г. Синтетические лекарственные средства. М., Медицина, 1983 г.
13. Журная “Фармация”
14. Химико-фармацевтический журнал
15. Журнал «Вопросы биологической, медицинской и фармацевтической химии».
Приложение 8
ГРАФИК
cдачи зачетапо производственной практике ККЛС
студентами 5 курса очного отделения фармацевтического факультета
2011-2012уч.году
| Группа | Дата сдачи | Время | Место |
| I поток | 16.05.12 г. | 900 -1400 | Кафедра фармацевтической химии с курсами аналитической и токсикологической химии (Затон) 415 аудитория |
| IIпоток | 28.03.12 г. | 900 -1400 |
Студенты, выполняющие дипломные работы
| Группа | Дата сдачи | Время | Место |
| I поток | 7.03.12г. | 900-1400 | Кафедра фармацевтической химии с курсами аналитической и токсикологической химии (Затон) 415 аудитория |
| II поток | 22.02.12г. | 900-1400 |
I пересдача зачета – 23.05.12.
II пересдачазачета–по расписанию деканата
Во время прохождения производственной практики по ККЛС студенты должны каждую субботу с 900-1300 (по согласованию с куратором базы практики) приходить на кафедру фармацевтической химии для проверки правильности ведения дневника и консультации по выполнению курсовой работы.
График сдачи зачета
по производственной практике по ККЛС
для студентов 5 курса заочного отделения
А) студенты, проживающие в г. Уфе
| Группа | Дата сдачи | Время | Место |
| ФЗ – 501 А, Б ФЗ – 502 А, Б ФЗ – 505 А | 10.03.12 г. | 900-1400 | Кафедра фармацевтической химии с курсами аналитической и токсикологической химии (Затон) |
| ФЗ – 503 А, Б ФЗ – 504 А, Б ФЗ – 505 Б | 17.03.12 г. | 900-1400 |
Б) иногородние студенты – сдают зачет в период весенней сессии.
ПЕРЕСДАЧА ЗАЧЕТА:
1 пересдача состоится на итоговом занятии весеннего семестра
2 пересдача – 12.05.12 г.
cyberpedia.su
Курсовая работа по фармацевтической химии «Анализ многокомпонентного лекарственного препарата аптечного изготовления»
ГБОУ ВПО «Пермская государственная фармацевтическая академия»Министерства здравоохранения Российской Федерации
Кафедра фармацевтической химии факультета очного обучения
Курсовая работа по фармацевтической химии
«Анализ многокомпонентного лекарственного препарата аптечного изготовления»
Исполнитель: Лесникова Вероника Ильинична
44 группа
Руководитель: Курбатов Евгений РаисовичПермь 2013
Оглавление
Состав лекарственного препарата 3
Совместимость лекарственных средств 3
Описание.. 3
Условия хранения. 3
Реакции подлинности 4
Натрия бромид: 4
Кодеин фосфат: 5
Количественное определение 6
Натрия бромид 6
Кодеина фосфат 8
Список литературы 12
Состав лекарственного препарата
Кодеина фосфата 0,2
Адонизида 6 мл
Натрия бромида 4,0
Водыочищенной 200 мл
Codeini phosphatis 0,2
Adonisidi 6 ml
Natrii bromidi 4,0
Aqae purificatae 200 ml
Совместимость лекарственных средств
Ингредиенты химически и физически инертны по отношению друг к другу:
Кодеина фосфат проявляет слабые восстановительные свойства.
Кодеина фосфат обладает противокашлевым действием.
Натрия бромид используют как седативное средство.
Адонизид обладаеткардиотоническим, антиаритмическим действием.
Описание.
ЛП представляет собой прозрачный раствор слегка желтоватого цвета жидкость со своеобразным запахом.
Условия хранения.
Хранят в хорошо укупоренной таре, предохраняющей от действия света, в прохладном, сухом месте в склянке из темного стекла.
Реакции подлинности
Натрия бромид:
Реакции на катионы:
Na+:
1. Соли натрияокрашивают бесцветное пламя в желтый цвет.
2. Микрокристаллическая реакция с кислотой пикриновой. Реакция основана на образовании осадка пикрата натрия желтого цвета в виде игольчатых кристаллов, выходящих из одной точки.
Методика: на предметное стекло наносят по одной капле исследуемого раствора и раствора кислоты пикриновой, капли соединяют стеклянной палочкой. Форму образовавшихсякристаллов рассматривают под микроскопом: длинные желтые иглы, выходящие из одного центра кристаллизации.
Br-:
1. Для доказательства бромид-иона в качестве окислителя используют раствор хлорамина в присутствии кислоты хлороводородной разведенной. Метод основан на способности бромид-иона окисляться раствором хлорамина до свободного брома:
Методика: к 0,5 мл раствораприбавляют 2-3 капли кислоты хлороводородной разведенной, 3-5 капель раствора хлорамина, 1 мл хлороформа и взбалтывают. Хлороформный слой окрашивается в желто-оранжевый цвет.
Кодеин фосфат:
1. Извлечение кодеина фосфата хлороформом из щелочной среды. Реакция окислительной конденсации с реактивом Марки: протекает за счет атома водород в орто-положении по отношению к алкоксигруппе:
Методика: к 1 мл.микстуры прибавляют 1-2 кап. раствора натрия гидроксида, 2-3 мл эфира и взбалтывают 1 мин. Эфирный слой отделяют и эфир отгоняют. К остатку добавляют 1-2 кап. формальдегида в конц. серной кислоте. Появляется сине-фиолетовое окрашивание.
2. Реакция с реактивом Фреде ( )
Основана на восстановительных свойствах кодеина фосфата.
Методика: 0, 5 микстуры помещают вфарфоровую чашку, прибавляют 3-5 кап. аммония молибдата и бензидина, 0,2-0,5 натрия ацетата. Появляется сине-зеленое окрашивание.
Количественное определение
Натрия бромид
Аргентометрия. Вариант Мора, прямое титрование
Основан на свойстве бромид – иона количественно осаждаться серебра нитратом с образованием бромида серебра. Титрант – серебра нитрат. Индикатор калия хромат. Среда –нейтральная. Титруют до оранжево – желтого окрашивания.
NaBr + AgNO3 AgBr + NaNO3
Индикация: 2AgNO3 +K2CrO4 Ag2CrO4 + 2KNO3
fэкв(NaBr)- 1
Методика: 1 мл лекарственной формы помещают в колбу для титрования, прибавляют 5 капель раствора калия хромата и титруют раствором серебра нитрата (0,05 моль/л) до оранжево-желтого окрашивания. М.м.натрия бромида – 102,90. 1…
www.skachatreferat.ru
Типовая тематика курсовых работ по фармацевтической химии
1. Обзор статей журнала «Фармация» по фармацевтическому анализу за определенный год.
2. Библиографический поиск по предложенной теме.
3. Реферативная работа по предложенной теме.
4. УФ – спектрофотометрия (или другой метод) в количественном анализе лекарственных веществ определенной группы.
5. ИК – спектроскопия (или другой метод) в анализе лекарственных веществ определенной группы.
6. Электротитриметрические методы (или другие методы) лекарственных веществ определенной группы.
7. Поиск новых лекарственных средств из в ряду производных пуринов (или из другой группы).
8. Направленный синтез лекарственных веществ на примере производных бензимидазола (или другого класса).
9. Анализ лекарственных веществ, содержащих альдегидную и кетонную (или другую функциональную) группу.
10. Анализ лекарственных веществ, содержащих: барий, кальций, магний (или другие элементы).
11. Методы и особенности анализа мазей и мазевых основ (или других лекарственных форм).
12. Внутриаптечный контроль качества лекарственных веществ определенной группы.
13. Внутриаптечный контроль качества определенного лекарственного средства.
14. Фармацевтический анализ лекарственных веществ определенной группы.
15. Фармацевтический анализ определенного лекарственного вещества.
16. Разработка методов анализа нового лекарственного средства.
17. Методы определения подлинности лекарственных веществ определенной группы.
18. Методы определения подлинности определенного лекарственного вещества.
19. Методы количественного определения лекарственных веществ определенной группы.
20. Методы количественного определения определенного лекарственного вещества.
21. Методы определения чистоты лекарственных веществ определенной группы.
22. Методы определения чистоты определенного лекарственного вещества.
23. Реакции комплексообразования (или другие) в фармацевтическом анализе лекарственных веществ определенной группы.
24. Комплексонометрическое (или другое) титрование лекарственных веществ определенной группы.
25. Особенности качественного анализа многокомпонентных лекарственных форм.
26. Особенности количественного анализа многокомпонентных лекарственных форм.
27. Способы разделения в анализе многокомпонентных лекарственных форм.
Приложение 6
РАСПРЕДЕЛЕНИЕ КУРСОВЫХ РАБОТ
по вариантам для студентовна 2011-2012 учебный год
Тема курсовой работы:
«Обзор статей журнала «Фармация»
по фармацевтическому анализу за(по шифру)год»
Год издания журнала «Фармация» совпадает с последней цифрой шифра
5 КУРСА ОЧНОГООТДЕЛЕНИЯ:
| Последняя цифра шифра | |||||||||||
| Год издания журнала |
5 КУРСА ЗАОЧНОГО ОТДЕЛЕНИЯ:
| Последняя цифра шифра | |||||||||||
| Год издания журнала |
Приложение 7.
Список рекомендуемой литературы
1. Государственная фармакопея Российской Федерации ХII издание / Изд-во «Научный центр экспертизы средств медицинского применения», 2008. – 704 с.
2. Государственная фармакопея СССР ХI издание, М.: «Медицина», 1987 г. (выпуск 1), 1989 г. (выпуск 2).
3. Казицина Л.И., Куплетская Н.Б. Применение УФ -, ИК -, ЯМР – спектроскопии в органической химии. М., МГУ, 1970 г.
4. Кулешова М.Н. и др. Анализ лекарственных форм, изготавливаемых в аптеках. М., 1989 г.
5. Лакин К.Н., Крылов Ю.Ф. Биотрансформация лекарственных веществ. М., Медицина, 1981 г.
6. Максютина Н.П. и др. Методы анализа лекарств. Киев, 1984 г.
7. Погодина Л.Н. Анализ многокомпонентных лекарственных форм, Минск, 1986 г.
8. Полюдек-Фабини Р., Бейрих Т. Органический анализ. Химия, 1981 г.
9. Рубцов М.В., Байчиков А.Г. Синтетические химико-фармацевтические препараты. М., 1971 г.
10. Справочник провизора-аналитика. Под ред. Н.П. Максютина, М., 1988 г.
11. Шрайнер Р. и др. Идентификация органических соединений. М., Мир, 1983 г.
12. Яхонтов Л.Н., Глушков Р.Г. Синтетические лекарственные средства. М., Медицина, 1983 г.
13. Журная “Фармация”
14. Химико-фармацевтический журнал
15. Журнал «Вопросы биологической, медицинской и фармацевтической химии».
Приложение 8
ГРАФИК
cдачи зачетапо производственной практике ККЛС
студентами 5 курса очного отделения фармацевтического факультета
2011-2012уч.году
| Группа | Дата сдачи | Время | Место |
| I поток | 16.05.12 г. | 900 -1400 | Кафедра фармацевтической химии с курсами аналитической и токсикологической химии (Затон) 415 аудитория |
| IIпоток | 28.03.12 г. | 900 -1400 |
Студенты, выполняющие дипломные работы
| Группа | Дата сдачи | Время | Место |
| I поток | 7.03.12г. | 900-1400 | Кафедра фармацевтической химии с курсами аналитической и токсикологической химии (Затон) 415 аудитория |
| II поток | 22.02.12г. | 900-1400 |
I пересдача зачета – 23.05.12.
II пересдачазачета–по расписанию деканата
Во время прохождения производственной практики по ККЛС студенты должны каждую субботу с 900-1300 (по согласованию с куратором базы практики) приходить на кафедру фармацевтической химии для проверки правильности ведения дневника и консультации по выполнению курсовой работы.
График сдачи зачета
по производственной практике по ККЛС
для студентов 5 курса заочного отделения
А) студенты, проживающие в г. Уфе
| Группа | Дата сдачи | Время | Место |
| ФЗ – 501 А, Б ФЗ – 502 А, Б ФЗ – 505 А | 10.03.12 г. | 900-1400 | Кафедра фармацевтической химии с курсами аналитической и токсикологической химии (Затон) |
| ФЗ – 503 А, Б ФЗ – 504 А, Б ФЗ – 505 Б | 17.03.12 г. | 900-1400 |
Б) иногородние студенты – сдают зачет в период весенней сессии.
ПЕРЕСДАЧА ЗАЧЕТА:
1 пересдача состоится на итоговом занятии весеннего семестра
2 пересдача – 12.05.12 г.
studopedya.ru
Курсовая работа по фармацевтической химии тема: «Методы анализа лекарственных средств производных арилалкиламинов» – Курсовая
КУРСОВАЯ РАБОТА
по фармацевтической химии
тема:
«Методы анализа лекарственных средств производных арилалкиламинов»
СОДЕРЖАНИЕ
ЛИТЕРАТУРНЫЙ ОБЗОР 5
Глава 1. ФАРМАКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ АРИЛАЛКИЛАМИНОВ 5
1.1. ФАРМАКОЛОГИЯ АДРЕНАЛИНА 5
1.2. ФАРМАКОЛОГИЯ НОРАДРЕНАЛИНА. 11
1.3. ФАРМАКОЛОГИЯ ЭФЕДРИНА 15
Глава 2. МЕТОДЫ АНАЛИЗА 18
2.1. ПЛОСКОСТНАЯ ХРОМАТОГРАФИЯ 18
2.2. ИК и УФ спекторофотометрия 21
2.3. ЛЮМИНЕСЦЕНЦИЯ 22
2.4. БИОЛОГИЧЕСКИЙ МЕТОД 27
Глава 3. ФАРМАКОПЕЙНЫЕ ПРЕПАРАТЫ 29
3.1. Solutio Adrenalini hydrochloride 0,1% 29
3.2. Noradrenalini hydrotartas.
Норадреналина гидротартрат 30
3.3. Solutio Noradrenolini hydrotartratis 0,2% pro injektionibus.
Раствор норадреналина гидротартрата 0,2% для инъекций 31
3.4. Ephedrine hydrochloridum
Эфедрина гидрохлорид 32
3.5. Solutio Eppedrini hydrochloridi 5% pro injektionibus
Раствор эфедрина гидрохлорида 5% для инъекций 33
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 35
Глава 1. КАЧЕСТВЕННЫЙ АНАЛИЗ 35
1.1. АНАЛИЗ АДРЕНАЛИНА 35
1.2. АНАЛИЗ НОРАДРЕНАЛИНА 37
1.3. АНАЛИЗ ЭФЕДРИНА 38
Глава 2. КОЛИЧЕСТВЕНЫЙ АНАЛИЗ 39
2.1. АНАЛИЗ АДРЕНАЛИНА 39
2.2. АНАЛИЗ НОРАДРЕНАЛИНА 39
2.3. АНАЛИЗ ЭФЕДРИНА 39
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ: 42
ВВЕДЕНИЕ
Лекарственное средство может иметь три основных названия:
Химическое название, отражающее состав и структуру лекарственного вещества. Химическое название редко употребляется в практическом здравоохранении, но часто приводима в аннотациях на лекарственные препараты и содержатся в социальных справочных изданиях.
Международное непатентованное название (МНН, International Nonproprietary Name, INN). Это название лекарственного вещества, рекомендованное Всемирной Организацией Здравоохранения (ВОЗ), принятое для использования во всем мире в учебной и научной литературе с целью удобства идентификации препарата по принадлежности к определенной фармакологической группе и для того, чтобы избежать предвзятости и ошибок. Синонимом МНН является термин генерическое, или дисенерическое название. Иногда МНН отражает химическое строение лекарственного вещества, например: ацетилсалициловая кислота.
Патентованное коммерческое название (Brand name). Оно присваивается фармацевтическими фирмами, производящими данный конкретный оригинальный лекарственный препарат и является их коммерческой собственностью (торговой маркой), охраняемой патентом. Например, торговое название ацетилсалициловой кислоты – аспирин, фурасемида – лазикс, диклофенана – вольтарен. Торговые названия используются фирмами – производителями для маркетинговых целей, для продвижения и конкуренции лекарственных препаратов на рынке.
Когда у фирмы разработчика заканчивается срок действия патента, то другие компании могут производить данное лекарственное средство и продавать его под международным названием. Такие препараты называют воспроизведенными лекарственными средствами, или дигенерическими препаратами. Препараты дисенерики обычно дешевле оригинальных, так как затраты на их разработку и клинические испытания не включены в цену.
Одно и то же лекарственное вещество может содержатся в одинаковых дозах в препаратах одной лекарственной формы имеющих разные торговые названия (препараты синонимы). Поэтому провизор может предложить пациенту заменить один препарат (при отсутствии его в аптеке), другим препаратом – синонимом.
Целью данной работы является:
Изучить наиболее широко используемые методы анализа лекарственных средств ариалкиламинов.
Определить доброкачественность и эффективность исследуемых препаратов.
ЛИТЕРАТУРНЫЙ ОБЗОР
Глава 1. ФАРМАКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ АРИЛАЛКИЛАМИНОВ
1.1. ФАРМАКОЛОГИЯ АДРЕНАЛИНА
Адреналин – один из наиболее мощных гипертензивных агентов. Как правило, при применении этого препарата систолическое давление возрастает в гораздо большей степени, чем диастолическое. Вслед за повышением артериальное давление становится ниже исходного уровня, а затем возвращается к нормальным показателям. Тахифилаксия к адреналину не развивается. Действие препарата на ССС определяется по существу алгебраической суммой эффектов, возникающих в результате воздействия препарата на - и β-адренарецепторы. В механизме гипертензивного действия адреналина существенную роль играет повышение силы сердечных сокращений и увеличение их числа. Эти эффекты связывают с воздействием β-адренорецепторов сердца. При действии адреналина на сердечно-сосудистую систему решающее значение имеет сокращение артериол многих сосудистых областей, особенно кожи, слизистых и органов брюшной полости. Брадикардия, возникающая в экспериментах на животных, предупреждается перерезкой блуждающих нервов или введением атропина. Следовательно, урежение пульса имеет рефлекторную природу и связано с компенсаторным повышением тонуса вагуса в ответ на подъем артериального давления. В малых дозах в опытах на животных адреналин снимает артериальное давление, что объясняют большей чувствительностью к нему β-адренорецепторов. Плотность последних велика в мышечных сосудах и сосудах печени. В клинике при введении адреналина под кожу всасывание его происходит очень медленно вследствие спазма на месте инъекции сосудов подкожной клетчатки. В этом случае систолическое давление умеренно возрастает, но диасталическое обычно понижается. Общее периферическое сопротивление сосудов уменьшается, что объясняют возбуждением β-адренорецепторов сосудов скелетных мышц. В связи с тем, что при клиническом применении адреналина артериальное давление возрастает не столь сильно, компенсаторные рефлексы, реализующиеся через блуждающий нерв, не предупреждают прямое действие препарата на сердце. Число сердечных сокращений, ударный и минутный объем сердца, а также работа левого желудочка существенно возрастают. Этому способствуют также и увеличение венозного возврата к сердцу. Учащение сердцебиений, наблюдаемое при применении адреналина, объясняют прямым действием препарата на сино-аурикулярный узел. Увеличение минутного объема кровообращения не является простым результатом тахикардии, так как кроме этого препарат значительно повышает силу сердечных сокращений. Такие данные были получены в экспериментах на собаках, а также в наблюдениях на людях. При применении адреналина давление в правом предсердии повышается. Увеличивается также венозное давление. Следует подчеркнуть, что в этом случае возрастает давление в легочных сосудах. В повышении давления в малом круге кровообращения значительную роль играет перераспределение крови в легочной циркуляции. Передозировка адреналина может сопровождаться гибелью больного вследствие развития отека легких. Механизм последнего достаточно ложен, однако большую роль в его генезе играет резкое повышение фильтрационного давления в капиллярах легких.
Как известно, адреналин в зависимости от дозы, состояния и локализации сосудов может вызвать их расширение или сужение. Однако в целостном организме в сумме преобладают сосудорасширяющие эффекты над сосудосуживающими и подъем систолического давления в основном обусловлен усилением работы сердца. В связи с этим периферическое сопротивление и диасталическое давление или не претерпевают изменений, или слегка возрастают. Действие адреналина на сосуды проявляется главным образом по отношению к мелким артериалам и прекапиллярным сфинктерам, хотя препарат в определенной степени влияет и на вены, и на крупные артерии. Веноконстрикторное действие показано в наблюдениях на людях с нормальным давлением и в условиях гипотензии. Сосуды различных областей неодинаково реагируют на адреналин. Сосуды кожи, слизистых и почек суживаются, в то время как сосуды скелетных мышц расширяются. При проведении исследований в клинике было показано, что под влиянием препарата кровоток в сосудах скелетных мышц усиливается, а в сосудах кожи и слизистых оболочках уменьшается. Кроме того, снижается также и почечный кровоток, церебральный, коронарный и печеночный – возрастают.
Адреналин оказывает весьма выраженное влияние на тонус терминальных сосудов. Многими исследователями в области микроциркуляции было доказано, что чувствительность микрососудов к адреналину обратно пропорциональна их диаметру и меняется в следующем порядке: прекапиллярные сфинктеры > метартериолы > прекапиллярные артериолы > посткапиллярные венулы.
В 1960 году было установлено, что адреналин введенный внутривенно в дозе 10 – 30 мкг/кг веса, вызывал выраженное тотальное сокращение прекапиллярных сосудов брыжейки крыс, уменьшая скорость кровотока и вызывал стаз крови в венулах, хотя диаметр последних не изменялся.
На резкое повышение тонуса мелких артерий, артериол и метаартериол с замедлением кровотока в сосудах аппендикса крыс при введении адреналина указывала ученая Н.И. Храброва. Эти явления наблюдались ею как в обычных условиях, так и в различные периоды травматического шока.
Если мнения отдельных исследователей о влиянии адреналина на микрососуды аппендикса сходятся, то обратное отличается в отношении действия препарата на терминальные сосуды мягкой мозговой оболочки. Так, одни придерживались мнения, что введение адреналина не вызывает изменения просвета пиальных сосудов. Другие отмечали кратковременное сужение артериол с последующим их расширением после нанесения раствора адреналина. Большинство же авторов указывают, что аппликация адреналина сопровождается уменьшением просвета артерий диаметром более 100 мк, причем эти изменения диаметра сосудов мягкой мозговой оболочки не превышают 4 – 8% исходной величины.
Необходимо подчеркнуть, что чувствительность терминальных сосудов к вазоактивным веществам, в том числе к адреналину, существенно меняется в процессе развития травматического шока.
В силу перечисленных свойств адреналин, как правило, почти не используется в клинике в качестве прессорного агента для терапии острых гипотензий, однако он назначается с целью повышения артериального давления, когда последнее снижается в результате остановки сердца. В ряде случаев в таких ситуациях с помощью адреналина удается достичь положительных эффектов.
В экспериментах на собаках было показано, что адреналин значительно увеличивает выживаемость животных после гипоксической остановки сердца.
Адреналин оказывает значительное влияние на метаболические процессы, в частности на кислородный режим организма, углеводный, жировой и другие виды обмена веществ. Данные о влиянии адреномиметиков на тканевое дыхание довольно противоречивы. Некоторые исследователи не наблюдали увеличения потребления кислорода отдельными тканями при применении адреналина. Другие исследователи обнаружили увеличение потребления кислорода тканями под влиянием адреналина.
Аналогичные факты отметил Парий (1972 г.) в опытах на крысах. Им было установлено, что под влиянием адреналина увеличивается потребление кислорода тканями сердца, скелетной мышцы, печени и почек по сравнению с аналогичными результатами контрольной серии опытов соответственно на 25, 19, 19 и 21%. В этих же условиях не наблюдалось выраженных изменений со стороны потребления кислорода тканями аорты. Параллельно со сдвигами потребления кислорода отмечались и изменения выделения углекислого газа тканями исследуемых органов. При применении адреналина выделение CO2 увеличивалось в сердце на 52%, скелетной мышце – на 51%, печени на 54%, и почек – на 34%. Выделение CO2 аортой тоже возрастало, но эти изменения были статистически незначительными. При сопоставлении степени увеличения потребления кислорода и выделения CO2 нетрудно увидеть, что возрастание выделения CO2 было более интенсивным, чем активация потребления O2. Это явление и определило сдвиг со стороны дыхательного коэффициента. Последний увеличивается в сердце, скелетной мышце и печени соответственно на 27, 18 и 52% по сравнению с таковым у контрольных животных.
Общеизвестны и другие метаболические сдвиги, обычно возникающие при применении адреналина, которые сводятся к активации фосфорилазы, накоплению глюкозы и молочной кислоты, усилению распада жиров и окислению жирных кислот, изменению обмена электролитов. Многими исследователями описана способность адреналина увеличивать содержание сахара в крови. Аналогичные результаты получил Парий в экспериментах на кроликах без наркоза. При внутривенном введении адреналина в дозе 0,01 мг/кг он наблюдал выраженную гиперлейкемию. На 30-й минуте после введения препарата содержание глюкозы в крови доходило до 142±3,6 мг %, что составляет 136% от исходного. Хотя в дальнейшем адреналиновая гиперлейкемия снималась, она оставалась статистически значимо повышенной до конца наблюдения.
Механизм действия адреналина на углеводный обмен сводится к усилению распада гликогена в печени и мышцах. Усиление гликолитических процессов является следствием активизации перехода неактивной фосфорилозы β в ее активную форму . Эта активизация осуществляется опосредованно через циклический 3,5 аденозинмонофосфат, образование которого стимулирует адреналин. Таким образом, пусковым моментом в механизме действия адреналина на углеводный обмен является стимуляция образования 3,5-АМФ при наличии аденилатциклазы.
Как уже указывалось, под влиянием адреналина существенно возрастает концентрация свободных мирных кислот в крови, что вероятно, объясняется активацией липазы. Последняя способствует превращению триглицеридов в жировых тканях в глицерол и свободные жирные кислоты. Возможно, за счет повышения содержания свободных мерных кислот в крови жир деионизируется в мышцах и печени. Трудно установить, с возбуждением каких типов рецепторов связаны эти эффекты адреналина, так как блокада и β-рецепторов предупреждает описанные превращения.
Большое значение в жизнедеятельности организма придают SH-группам.
Сульфидрильные группы, образуя разнообразные химические связи внутри белковой молекулы, имеют большое значение в создании и поддержании нативной структуры белка, благодаря чему определяются его функциональные свойства. Изучая в экспериментах на крысах влияние адреналина на содержание сульфидрильных групп в некоторых биологических субстратах, Арий установил, что после применения препарата общие сульфидрильные группы крови возрастают на 36%, причем это увеличение более выражено для белковых (на 40%), чем небелковых сульфидрильных группах (на 14%). В тканях головного мозга и сердца такие наблюдения изменения общих сульфидрильных групп в сторону их увеличения соответственно на 18 и 16%, однако статистически значимо возросло только содержание белковых сульфидрильных групп.
Полученные результаты увеличения количества сульфидрильных групп в крови под влиянием адреналина подтверждают широко распространенное мнение о роли этих групп в механизме мышечного сокращения и поддержания сосудистого тонуса.
Следует подчеркнуть, что между снижением содержания сульфидрильных групп сывороточных белков и снижением артериального давления отличается параллелизм. Этот факт дал авторам право предположить, что обнаруженные явления находятся в определенной взаимосвязи. Если при сниженном артериальном давлении ввести донатор сульфгидрильных групп – унитиол, – то наряду с возрастанием количества тиоловых групп в крови наблюдается и некоторое повышение артериального давления.
1.2. ФАРМАКОЛОГИЯ НОРАДРЕНАЛИНА.
Норадреналин, подобно адреналину, оказывает прямое действие на эффекторные клетки. Эти вещества отличаются друг от друга в основном по степени преимущественного влияния на - или β-адренорецепторы. Норадреналин оказывает влияние главным образом на -адренорецепторы и значительно слабее на β-адренорецепторы, исключая β1-адренорецепторы сердца. В активности по отношению к -адреналинорецепторам нарадреналин уступает адреналину и в большинстве случаев требуются сравнительно большие его дозы, чтобы получить эффект, соответствующий тому, который возникает после введения адреналина. На метаболические процессы норадреналин действует значительно слабее, чем адреналин.
Под влиянием норадреналина возрастает как систолическое, так и диасталическое давление. Пульсовое давление тоже несколько увеличивается. Минутный объем кровообращения не изменяется или даже может несколько уменьшаться. Последнее явление частично объясняют урежением сердечных сокращений, которое возникает благодаря компенсаторным рефлексам вагусного происхождения. Периферическое сопротивление в большинстве сосудистых областей возрастает. Кровоток через почки, мозг и печень уменьшается. Как правило, аналогичное явление наблюдается и в кровотоке через скелетные мышцы. Уменьшение церебрального кровотока сопровождается снижением потребления кислорода мозгом. Под влиянием норадреналина лизентериальные сосуды суживаются. Уменьшается также почечный кровоток. За счет расширения коронарных сосудов и повышения артериального давления увеличивается кровоток через коронарные сосуды. Благодаря тому, что норадреналин в большей степени влияет на -адренорецепторы, в отличии от адреналина в малых дозах он не вызывает расширения сосудов и вторичного снижения артериального давления в первой фазе действия. На фоне применения веществ, блокирующих -адренорецепторы, прессорные эффекты норадреналина подавляются, но не извращаются. Следует заметить, что необходимы большие дозы -адренорецепторов, чтобы полностью предупредить вазоконстрикторное действие норадреналина. При использовании норадреналина вследствие посткапиллярной вазоконтрикции повышается давление в капиллярном русле и жидкая часть крови, не связанная с беками, проникает в гастроцелюлярное пространство. По этой причине объем циркулирующей крови может несколько уменьшаться. При экстракардиаграфических исследованиях регистрируется синусная брадикардия, связанная с рефлекторным повышением тонуса блуждающего нерва. В определенных условиях при назначении норадреналина может возникать желудочная тахикардия и фибрилляция.
Сила гипертензивного эффекта норадреналина меняется при патологических процессах, например, при шоке. Характерно, что в данном случае препарат был более эффективным на ранних стадиях этого патологического состояния. Следует подчеркнуть, что норадреналин усиливает централизацию кровообращения. В частности, норадреналин, улучшал мозговой кровоток и повышал коэффициент утилизации кислорода мозгом, ограничивает кровоток в других органах (конечности, почки), приводя тем самым к развитию гипоксии в них.
Выраженное вазоконстрикторное действие норадреналина способствует значительному увеличению возврата венозной крови и повышению давления в правом предсердии, легочной артерии и капиллярного давления в малом круге кровообращения. При заболеваниях сердца это может повлечь за собой отек легких. Сужение легочных сосудов в данном случае играет второстепенную роль. При попадании раствора норадреналина в подкожную клетчатку сосуды столь резко суживаются, что возникает тканевая апоксия с последующими некротическими явлениями. Следует отличить, что Путов, Митюнин и Селезнев, Бами и Грефнович наблюдали некроз клетчатки и кожи, окружающей вену, не связанный с паравенозным введением норадреналина. Проверив данное явление в эксперименте, Митюнин и Селезнев полагают, что длительные вливания норадреналина вызывают спазм мелких сосудов и ишемию стенки вен. В результате этого повышается проницаемость сосудов, и раствор адреномиметика, проникая в окружающие ткани, вызывает их ишемию, а затем и некроз. В экспериментах на собаках при длительной инфузии норадреналина обнаружили очаги массовых поражений, локализованные в сердце, желудке, диафрагме, кишках, мочевом и желчном пузыре.
После первоначального подъема артериальное давление постепенно снижается и достигает уровня ниже исходного. При длительном внутривенном введении норадреналина может развиваться своеобразное состояние, напоминающее геморрагический или травматический шок. Ученные установили, что у собак возникает сердечная недостаточность, если им в течении 30-60’ вливать раствор норадреналина со скоростью 2-4 мин/кг. Описанная сердечная недостаточность частично обусловлена кровоизменениями, распространенными очагами некроза и дегенерацией миофибралл миокарда. Такие повреждения сердечной мышцы могут наблюдаться и в клинике при ишемической болезни сердца. По-видимому, катехоламины играют существенную роль в генезе коронарной болезни. Эту гипотезу подтверждают такие факты, как улучшение течения коронарной болезни, наблюдаемое при истощении запасов катехоломинов и при применении β-адреноблокатов.
После неоднократного использования препарата может развиваться тахифилаксия, хотя не столь выраженная, как в случае эфедрина. Ряд авторов полагает, что норадреналин накапливается в избыточных количествах в адренергических синапсах заменяется неактивными или менее активными метаболитами. Другие исследователи считают, что развитию тахифилаксии способствует системный ацидоз, обусловленный апоксией, гипотензией и циркуляторным стазом. Однако, необходимо отметить, что восстановление нормального кислотно-щелочного баланса крови при ацидозе, вызванном норадреналином, мало влияет на развитие тахифилаксии к данному препарату. Более убедительна гипотеза, по которой предполагается, что рецепторы при длительном применении норадреналина в избытке насыщены медиатором, в результате чего возникает блокада и рефрактерность мышц сосудов.
При клиническом применении норадреналина может возникать гиперкалиемия и метаболический ацидоз с повышением содержания свободных аминокислот.
1.3. ФАРМАКОЛОГИЯ ЭФЕДРИНА
Эфедрин содержится в различных растениях, которые использовались в древней медицине около 5 тыс. лет тому назад. В современной медицине он был введен в практику в 1924г. Синтез алкалоида осуществлен в 1927г. Эфедрин стимулирует как -, так и β-адренорецепторы. В механизме его действия существенную роль играет способность освобождать норадреналин. Таким образом, это препарат относится к непрямым адреномиметикам. Однако, не исключается и прямое влияние эфедрина на адренорецепторы. Возникающие при применении данного адреномиметика тахифилаксию объясняют истощением запасов катехоламинов. В связи с тем, что препарат возбуждает оба типа адренорецепторов, для него характерно стимулирующее действие на сердце и смешанный эффект на сосуды.
Предполагают, что сердечный компонент в механизме гипертензивного действия препарата имеет доминирующее значение. В связи с возбуждением адренорецепторов сердца возникает тахикардия, увеличение ударного и минутного объемов. Несмотря на выражены инотропный эффект, случаи аритмии при использовании эфедрина во время общего обезболивания встречаются относительно нечасто. Сердечный компонент в механизме гипертензивного действия эфедрина и прямой сосудосуживающий эффект препарата обнаружены как в экспериментах на животных, так и в наблюдениях на людях. Под влиянием эфедрина повышается систолическое давление и незначительно меняется диастолическое. В связи с этим возрастает пульсовое давление. Кровоток через почки и органы брюшной полости уменьшается. Мозговой кровоток и кровоток через скелетные мышцы увеличиваются.
Наблюдения на добровольцах показали, что при инфузии эфедрина со скоростью от 24 до 200 мг/кг/мин возникает вазоконстрикция, которая, по-видимому, осуществляется за счет освобождения катахоламинов из симпатических нервных окончаний. Во второй фазе наблюдается вазодилятация, которая очевидна связаны с прямым действием эфедрина на β-адренарецепторы. Необходимо указать, что истощение запасов катахоламинов под влиянием эфедрина подтвердилось не во всех наблюдениях. Например гипертензивный эффект эфедрина отмечали при использовании его у больных с дегенерацией отдельных вегетативных нервов. Эти факты свидетельствуют о том, что эфедрин помимо непрямого, обладает прямым действием на сосуды.
Имеются данные о том, что эфедрин в малых дозах усиливает эффекты катахоламинов с прямым действием на фосфорилазу «Q» в сердце, а в больших дозах препарат ослабляет этот процесс. В этом случае можно говорить о двух механизмах действия эфедрина. С одной стороны, он блокирует обратный транспорт катахоламинов, а с другой β-адренорецепторы.
В отличие от адреналина, эфедрин хорошо всасывается из кишечника, действует более длительно, но уступает по активности первому. Кроме того для него характерно выраженное центральное действие. Препарат в меньшей степени, чем адреналин повышает уровень сахара в крови. В опытах Парий (1970), выполненных на крысах без наркоза, было установлено, что при внутрибрюшинном введении эфедрина в дозе 5 мг/кг отмечается выраженное повышение потребления кислорода животными. По наблюдениям этого же автора препарат обладает довольно выраженным гипертермическим действием.
Как известно, при спинальной и эпидуральной анестезии часто назначаются гипертензивные препараты. При этих видах обезболивания снимается общее периферическое сопротивление сосудов, значительно увеличивается объем крови в венах, снижается минутный объем сердца, а также сила и частота сердечных сокращений. Применяемый в этих условиях эфедрин можно расценивать как физиологический антогонист. Однако не всегда удается с помощь данного препарата достичь удовлетворительного прессорного эффекта. Кроме того, тахифелаксия ограничивает возможность повторных инъекций эфедрина.
refdb.ru
Курсовая работа – Фармацевтический анализ производных фенотиазина
Курсовая работа
«Фармацевтический анализ производных фенотиазина»
Введение
Фенотиазины — исторически первый класс антипсихотических средств — по своей химической структуре представляют собой трициклические молекулы.
Все фенотиазины подразделяются на три основных подтипа:
1. алифатические,
2. пиперидиновые,
3. пиперазиновые производные.
Фенотиазины с алифатическими боковыми цепями (например, хлорпромазин) в основном являются низкопотентными соединениями (то есть для достижения терапевтического эффекта необходимо использовать более высокие дозы препарата). Пиперидиновые производные обладают антихолинергическими свойствами и в меньшей степени способны вызывать развитие экстрапирамидных расстройств (например, тиоридазин, мезоридазин). Пиперазиновые фенотиазины (например, перфеназин, трифлюоперазин, флуфеназин) являются наиболее мощными антипсихотическими соединениями.
Связь «структура-действие»
В основе химической структуры данной группы препаратов лежит гетероциклическая система, состоящая из шестичленного гетероцикла тиазина, конденсированного с двумя ядрами бензола (рис. 1).
Препараты, производные фенотиазина, представляют собой сходные по химической структуре соединения, отличающиеся только заместителями в положении 2 и 10 фенотиазинового кольца, причем между структурой заместителей и фармакологическим действием проявляется четкая зависимость: если в 10 положении находится липофильная группировка, содержащая третичный азот во 2’ или 3’ положении, то препарат оказывает нейролептическое, седативное и противоаллергическое действие. Если же эта группировка гидрофильная (карбоксильная группа), то препарат оказывает коронарорасширяющее и антиаритмическое действие.
Фармацевический анализ фенотиазина
Фенотиазин
Получение
Фенотиазин получают нагреванием дифениламина с S при 180-250 0C в высококипящих растворителях в присутствии I2 или AlCl3. Общий метод получения фенотиазина и его производных — циклизация 2′-замещенных производных 2-аминодифенил-сульфида в присутствии сильных оснований:
1. Описание.
Представляет собой желтые кристаллы.
2. Растворимость.
Хорошо растворим при нагревании в этаноле, уксусной кислоте, плохо — в диэтиловом эфире и бензоле. В холодной серной кислоте растворим с выделением SO2 .
3. Качественный анализ.
3.1. Химические свойства.
Имеет похожие свойства ароматических соединений. Является хорошим донором электронов и с различными акцепторами образует комплексы с переносом заряда. Легко вступает в электрофильное замещение, которое направляется в первую очередь в положения 3 и 7 и часто сопровождается окислением.
3.2. Реакционная способность
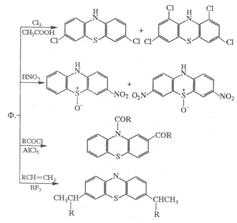
Бромирование фенотиазина в нитробензоле протекает с образованием 1,2,3,7,8,9-гексабромпроизводного, аналогичное хлорирование — с образованием продукта глубокого (до 11 атомов Cl) хлорирования и потерей ароматичности одного из колец.
Окисление фенотиазина действием h3 O2 или KMnO4 приводит к фенотиазин-5-оксиду или фенотиазин-5,5-диоксиду. Реакции протекают в виде последовательных стадий с промежуточным образованием катиона, в котором положение 3 чувствительно к атаке нуклеофильных реагентов, например:
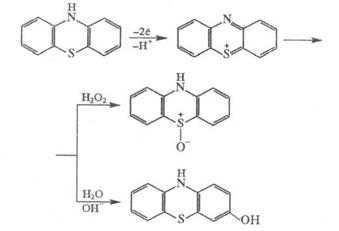
4. Примеси.
5. Количественный анализ.
Хранение.
Хранить их следует в банках из оранжевого стекла, плотно закрытых пробками, залитыми парафином, в сухом месте (это связано с легкоокисляемостью, и высокой гигроскопичностью).
Применение
Фенотиазин используется в качестве инсектицида, антигельминта, антиоксиданта смазочных масел.
Фармацевтический анализ производных фенотиазина
1. Аминазин
2. Трифтазин
3. Дипразин
1. Описание.
По внешнему виду все эти препараты сходны между собой. Это в большинстве своем белые или белые с кремоватым оттенком кристаллические порошки, некоторые имеют зеленовато-желтоватый цвет (трифтазин, мепазин).
Гораздо большее значение имеют производные фенотиазина, имеющие заместителя (R) в положениях 2 и 10 цикла. Чаще R10 представляет собой остаток 3-диалкиламинопропанола
2. Растворимость.
Очень легко растворимы в воде, легко — в 95% спирте, хлороформе; практически нерастворимы в эфире и бензоле.
3. Качественный анализ.
3.1. Химические свойства.
Из химических свойств производных фенотиазина наиболее характерным является способность их к окислению. В зависимости от характера окислителя (бромная вода, азотная и серная кислоты, хлорид окисного железа и др.) образуются различного цвета продукты окисления. Поэтому эти реакции используются для идентификации препаратов фенотиазинового ряда.
3.2. Реакционная способность.
Местом наибольшей реакционной способности в молекуле фенотиазина и его производных является атом серы, которая может окисляться до S4+ и S6+ .
Окисление фенотиазина или его производных бромом в уксусной кислоте или другим окислителем, например перекисью водорода, приводит к образованию S-оксида (I) и диоксида-сульфона (II).
За счет третичного азота в молекуле производные феноти-азина могут вступать в реакции с общеалкалоидными реактивами (см. «Алкалоиды»).
Все препараты фенотиазинового ряда применяются в виде гидрохлоридов, поэтому после выделения основания щелочью в фильтрате обнаруживается хлор-ион с раствором нитрата серебра.
4. Примеси.
Из возможных примесей в препаратах ГФ X допускает сульфаты, тяжелые металлы и фенотиазин в пределах эталонов. Определяется также предел кислотности.
5. Количественное определение.
Методы количественного определения препаратов фенотиазинового ряда разнообразны и базируются на свойствах соединений. Фармакопейным методом является метод кислотно-основного титрования в неводных средах. Препарат растворяют в ледяной уксусной кислоте или ацетоне, добавляют ацетат окисной ртути и титруют хлорной кислотой по индикатору кристаллический фиолетовый или метиловый оранжевый.
Фармакопейным методом является и обычный метод нейтра: лизации с дифференцирующими растворителями. Этот метод ГФ X рекомендует для раствора и таблеток дипразина. Определение азота по методу Кьельдаля ГФХ рекомендует для количественного определения аминазина в растворе.
Хранение.
Хранить их следует в банках из оранжевого стекла, плотно закрытых пробками, залитыми парафином, в сухом месте, так как производные фенотиазина темнеют на свету (это связано с их способностью легко окисляться, а еще они гигроскопичны).
Меры предосторожности.
При работе с производными фенотиазина нужно исключить возможность попадания порошка и растворов на кожу и слизистые оболочки, так как они вызывают сильное раздражение, отечность кожи век, понижение артериального давления.
Использованные литературные источники
фенотиазин химический фармацевтический производный
1. Гетероциклические соединения, под ред. P. Эльдерфидда, пер. с англ., т. 6, M., 1960, с. 568-91;
2. Общая органическая химия, пер. с англ., т. 9, M., 1985, с. 627-35. Г.А. Швехгеймер, В.И. Келарев;
3. ru.wikipedia.org
4. Мелентьева
www.ronl.ru
