Первый закон термодинамики
На рисунке 3.9.1 условно проиллюстрированы энергетические потоки между выделенной термодинамической системой и окружающими телами. В случае, если тепловой поток направлен к термодинамической системе, то некоторая величина Q>0, если же система совершает положительную работу над окружающими ее объектами, то справедливо неравенство A>0.
Рисунок 3.9.1. Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Состояние системы меняется, когда происходит процесс ее обмена теплом с окружающими объектами, и она совершает положительную или отрицательную работу. Изменяются макроскопические параметры системы, такие как температура, объем и давление. По причине того, что внутренняя энергия U всецело определяется макроскопическими параметрами, которые характеризуют состояние системы, процессы совершения работы и теплообмена провоцируют изменения внутренней энергии данной системы ΔU.
Определение 1-го закона термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
∆U=Q-A.
Определение 1Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
Формула первого закона термодинамики, зачастую записывается в ином виде:
Q=∆U+A.
Определение 2Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая ΔU своей внутренней энергии.
В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая ΔU своей внутренней энергии.
Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
Определение 3В изохорном процессе, то есть в условиях неизменного объема (V=const), газ не совершает работы, A=0.
В этом случае справедливой будет формула внутренней энергии газа:
Q=∆U=U(T2)-U(T1).
В данном выражении U(T1) и U(T2) представляют внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит лишь от температуры, что исходит из закона Джоуля. При изохорном нагревании газ поглощает тепло (Q>0), чем провоцирует увеличение его внутренней энергии. В условиях охлаждения тепло отдается внешним объектам (Q<0).
В изобарном процессе, предполагающем постоянность значения давления (p=const), работа, совершаемая газом, выражается в виде соотношения:
A=p(V2-V1)=p∆V.
Первый закон термодинамики для изобарного процесса дает:
Q=U(T2)-U(T1)+p(V2-V1)=∆U+p∆V.
При изобарном расширении Q>0 тепло поглощается газом, и он совершает положительную работу. При изобарном сжатии Q<0 тепло переходит внешним телам. В таком случае A<0. При изобарном сжатии уменьшаются температура газа T2<T1 и значение внутренней энергии ΔU<0.
В изотермическом процессе температура газа не меняет своей величины, следовательно, не изменяется и внутренняя энергия газа, ΔU=0.
Первый закон термодинамики для изотермического процесса выражается соотношением
Q=A
Теплота Q, приобретенная газом в процессе изотермического расширения, превращается в работу, совершаемую над внешними объектами. И наоборот, изотермическое сжатие приводит к преобразованию уже работы внешних сил, произведенной над газом, в передающееся окружающим телам тепло.
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Определение 6Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Нужна помощь преподавателя?
Опиши задание — и наши эксперты тебе помогут!
Описать задание Определение 7Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
Рисунок 3.9.2. Модель адиабатического процесса.
В адиабатическом процессе Q=0. По данной причине первый закон термодинамики принимает вид:
A=–ΔU.
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Определение 9Расширение или сжатие газа на плоскости p, V проиллюстрирована кривой, называемой адиабатой.
В процессе адиабатического расширения газом совершается положительная работа A>0, что является причиной понижения значения внутренней энергии ΔU<0. Данное явление провоцирует падение его температуры. Исходя из этого, можно заявить, что величина давления газа при адиабатическом расширении понижается быстрее, чем это происходит в изотермическом (рис. 3.9.3).
Данное явление провоцирует падение его температуры. Исходя из этого, можно заявить, что величина давления газа при адиабатическом расширении понижается быстрее, чем это происходит в изотермическом (рис. 3.9.3).
Рисунок 3.9.3. Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
В условиях координат (p, V) выводящееся в термодинамике уравнение адиабатического процесса для идеального газа принимает следующий вид:
pVγ=const.
Данное выражение, в котором γ=CpCV – показатель адиабаты, Cp и CV – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом, называется уравнением Пуассона. В условиях одноатомного газа γ=53=1,67, двухатомного γ=75=1,4, многоатомного γ=1,33.
Работа газа в адиабатическом процессе выражается через температуры начального T1 и конечного T2 состояний и принимает вид:
A=CV(T2-T1)
Адиабатический процесс относится к изопроцессам.
В термодинамике важное место занимает физическая величина, называемая энтропией. Изменение энтропии в том или ином квазистатическом процессе эквивалентно некоторому обретенному системой теплу ΔQT. Так как на каждом участке адиабатического процесса ΔQ=0, энтропия в нем не претерпевает изменений.
Изменение энтропии в том или ином квазистатическом процессе эквивалентно некоторому обретенному системой теплу ΔQT. Так как на каждом участке адиабатического процесса ΔQ=0, энтропия в нем не претерпевает изменений.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
Примером неквазистатического процесса, в котором промежуточные состояния не находятся в состоянии равновесия, служит расширение газа в пустоту. На рисунке 3.9.3 иллюстрируется жесткая адиабатическая оболочка, состоящая из двух разделенных вентилем K сообщающихся емкостей. В изначальном состоянии газом заполнен один из сосудов, в это же время во втором находится лишь вакуум. Открытие вентиля запускает процесс расширения газа. Он заполняет оба сосуда, и устанавливается новое равновесное состояние.
Открытие вентиля запускает процесс расширения газа. Он заполняет оба сосуда, и устанавливается новое равновесное состояние.
В таком процессе Q=0, по той причине, что исключен теплообмен с окружающими телами, и A=0, так как оболочка недеформируема. Первый закон термодинамики позволяет сказать, что ΔU=0, то есть внутренняя энергия газа не претерпела никаких изменений. Так как внутренняя энергия идеального газа зависит лишь от температуры, температура газа в начальном и конечном состояниях одинакова. Изображающие эти состояния точки на плоскости (p, V) лежат на одной изотерме. Все промежуточные состояния газа не являются равновесными и не могут быть изображены на диаграмме.
Пример 2Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Рисунок 3.9.4. Расширение газа в пустоту.
Формула первого закона термодинамики
Основные законы, которые являются основой термодинамики, называют началами. В основании термодинамики лежат три начала. Первое начало термодинамики является законом сохранения энергии для термодинамических процессов. В интегральном виде формула первого начала термодинамики выглядит как:
В основании термодинамики лежат три начала. Первое начало термодинамики является законом сохранения энергии для термодинамических процессов. В интегральном виде формула первого начала термодинамики выглядит как:
что означает: количество теплоты, подводимое к термодинамической системе, идет на совершение данной системой работы и изменение ее внутренней энергии. Условлено считать, что если теплота к системе подводится, то она больше нуля () и если работу выполняет сама термодинамическая система, то она положительна ().
Первое начало термодинамики можно представить в дифференциальном виде, тогда формула для него будет:
где – бесконечно малое количество теплоты, подводимое к системе; – элементарная работа системы; – малое изменение внутренней энергии системы.
Если исследуемой термодинамической системой является идеальный газ, то работа выполняемая им связана с изменением объема (), в таком случае формулой первого начала термодинамики (в дифференциальном виде) можно считать выражение:
Следует напомнить, что первое начало термодинамики не указывает направление, в котором происходит термодинамический процесс. Формула первого начала отображает только изменение параметров системы, если процесс происходит. В термодинамике за указание на направление процесса отвечает второе начало.
Формула первого начала отображает только изменение параметров системы, если процесс происходит. В термодинамике за указание на направление процесса отвечает второе начало.
Формулы первого начала термодинамики для процессов
Будем считать, что все далее рассматриваемые процессы происходят в идеальном газе.
Для процесса, происходящего в некоторой массе газа при постоянной температуре (изотермический процесс), формула первого начала термодинамики преобразуется к виду:
Из выражения (4) следует, что вся теплота, которую получает термодинамическая система, расходуется на совершение этой системой работы.
Формулой первого начала термодинамики для изохорного процесса служит выражение:
При изохорном процессе, все тепло, полученное системой, идет на увеличение ее внутренней энергии.
В изобарном процессе формула первого закона термодинамики остается без изменения (3).
Адиабатный процесс отличается тем, что он происходит без обмена теплотой с окружающей средой. В формуле для первого начала термодинамики это отражается так:
В формуле для первого начала термодинамики это отражается так:
В адиабатическом процессе газ совершает работу за счет своей внутренней энергии.
Примеры решения задач по теме «Первый закон термодинамики»
Первый закон термодинамики простыми словами
- Определение первого закона термодинамики
- Формула первого закона термодинамики
- Процессы первого закона термодинамики
- Первый закон термодинамики для изохорного процесса
- Первый закон термодинамики для изобарного процесса
- Применение первого закона термодинамики
- Первый закон термодинамики, видео
содержание:
Определение первого закона термодинамики
Простую формулировку первого закона термодинамики может звучать примерно так: изменение внутренней энергии той или иной системы возможно только при внешнем воздействии. То есть другими словами, чтобы в системе произошли какие-то изменения необходимо приложить определенные усилия извне. В народной мудрости своеобразным выражением первого закона термодинамики могут служить пословица – «под лежачий камень вода не течет», «без труда не вытащишь рыбку из пруда», и тому подобное. То есть на примере пословица про рыбку и труд, можно представить, что рыбка и наша условно закрытая система, в ней не произойдет никаких изменений (рыбка сама себя не вытянет из пруда) без нашего внешнего воздействия и участия (труда).
То есть другими словами, чтобы в системе произошли какие-то изменения необходимо приложить определенные усилия извне. В народной мудрости своеобразным выражением первого закона термодинамики могут служить пословица – «под лежачий камень вода не течет», «без труда не вытащишь рыбку из пруда», и тому подобное. То есть на примере пословица про рыбку и труд, можно представить, что рыбка и наша условно закрытая система, в ней не произойдет никаких изменений (рыбка сама себя не вытянет из пруда) без нашего внешнего воздействия и участия (труда).
Интересный факт: именно первый закон термодинамики устанавливает, почему потерпели неудачу все многочисленные попытки ученых, исследователей, изобретателей изобрести «вечный двигатель», ведь его существование абсолютно невозможным согласно этому же закону, почему, смотрите абзац выше.
В начале нашей статьи было максимального простое определение первого закона термодинамики, в действительности в академической науке существует целых четыре формулировка сути данного закона:
- Энергия ниоткуда не появляется и ни куда не пропадает, она лишь переходит из одного вида в другой (закон сохранения энергии).

- Количество теплоты, полученной системой, идет на совершение ее работы против внешних сил и изменение внутренней энергии.
- Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе, и не зависит от способа, которым осуществляется этот переход.
- Изменение внутренней энергии неизолированной термодинамической системой равна разнице между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Формула первого закона термодинамики
Формулу первого закона термодинамики можно записать следующим образом:
Q = ΔU + A
Количество теплоты Q, передается системе равен сумме изменения ее внутренней энергии ΔU и работы A.
Процессы первого закона термодинамики
Также первый закон термодинамики имеет свои нюансы в зависимости от имеющихся термодинамических процессов, которые могут быть изохронными и изобарно, и ниже мы подробно опишем каждый из них.
Первый закон термодинамики для изохорного процесса
Изохорным процессом в термодинамике называют процесс, происходящий при постоянном объеме. То есть, если любом в газе или жидкости нагреть вещество в сосуде, состоится изохорный процесс, так как объем вещества останется неизменным. Это условие влияет и на первый закон термодинамики, проходит при изохорном процессе.
В изохорном процессе объем V является константой, следовательно, газ работы не оказывает A = 0
Из этого следует следующая формула:
Q = ΔU = U (T2) – U (T1).
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q> 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q <0).
Первый закон термодинамики для изобарного процесса
Аналогично изобарным процессом называется термодинамический процесс, происходящий в системе при постоянном давлении и массе газа. Итак, в изобарном процессе (p = const) работа, совершаемая газом, выражается следующим уравнением первого закона термодинамики:
Итак, в изобарном процессе (p = const) работа, совершаемая газом, выражается следующим уравнением первого закона термодинамики:
A = p (V2 – V1) = p ΔV.
Изобарный первый закон термодинамики дает:
Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV.
При изобарном расширении Q> 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q
Применение первого закона термодинамики
Первый закон термодинамики имеет практическое применение в различных процессах в физике, например, позволяет вычислить идеальные параметры газа при различных тепловых и механических процессах. Кроме чисто практического применения можно этому закону найти применение и философское ведь что ни говори, но первый закон термодинамики является выражением одного из наиболее общих законов природы – закон сохранения энергии. Еще Экклезиаст писал, что ничто ниоткуда не появляется и никуда не уходит, все находится вечно, постоянно трансформируясь, в этом и кроется вся суть первого закона термодинамики.
Первый закон термодинамики, видео
И в завершение нашей статьи вашему вниманию образовательное видео первый законе термодинамики и внутреннюю энергию.
Эта статья доступна на английском языке –
First Law of Thermodynamics.
Первый закон термодинамики. Просто!
В данной статье мы разберемся с первым законом термодинамики. Объясним на простых и понятных примерах, как работает первый закон термодинамики.
Первый закон термодинамики является базовым. Его еще называют первым началом термодинамики. Правильное его понимание позволяет решать множество задач.
Первый закон термодинамики гласит:
Изменение внутренней энергии системы происходит за счет работы и теплоты, переданной системы.
Формулу первого закона термодинамики в большинстве источников записывают так:
ΔU = A + Q
, где ΔU — изменение внутренней энергии.
А — работа
Q – теплота
Данная формулировка для многих не совсем понятна, поэтому давайте рассмотрим более простой для восприятия вариант первого закона термодинамики.
По сути, тот же самый закон можно записать:
Q = ΔU + A
Сам закон в данном случае будет гласить:
Если мы подводим к телу теплоту, то она может тратиться на изменение его внутренней энергии(нагрев) и на совершение работы данным телом(за счет изменения его объема).
Эта самая простая формулировка для восприятия, на наш взгляд.
Чтобы стало еще понятнее, рассмотрим данный закон на простом примере.
У нас есть обычная пустая банка, закрытая пластиковой крышкой.
Если мы подведем к банке тепло, то она начнет нагреваться. В тоже время воздух находящийся в ней при нагревании начнет расширяться и откроет крышку, совершив при этом работу.
Таким образом, то тепло, которое мы подвели к банке, потратиться на изменение её внутренней энергии (банка и воздух в ней нагреются) и совершение работы (откроется крышка).

Как видите, понять первый закон термодинамики достаточно несложно. Если основной физический смысл в том, что энергия не берется из ниоткуда и не исчезает в никуда. Именно поэтому не существует и не может существовать вечного двигателя. Такого двигателя, который смог совершать работу постоянно, не черпая при этом энергию извне.
Для правильного интуитивного восприятия давайте рассмотрим еще одну интересную аналогию.
Возьмем вас, как тело, совершающее работу, в виде какого-либо физического труда.
Когда вы совершаете работу, вы расходуете внутреннюю энергию и при этом согреваетесь (повышается температура вашего тела).
То и для вас применима формула ΔU = A + Q,
То есть, за счет того, что вы тратите энергию, которую получили из пищи, вы двигаетесь, совершая работу, и при этом вы также согреваетесь и отдаете тепло своего тела окружающей среде.
Интересный случай первого закона термодинамики — работа холодильника.
Ранее, рассматривая ситуацию с нагреванием банки, мы затрагивали совершение работы при расширении газа.
 Интересно, что, если за счет нагрева газ расширяется и совершает работу, то совершив работу по сжатию газа, мы получим обратную реакцию — охлаждение.
Интересно, что, если за счет нагрева газ расширяется и совершает работу, то совершив работу по сжатию газа, мы получим обратную реакцию — охлаждение.Цикл работы холодильника таков. По замкнутой системе циркулирует хладагент (специальный газ), циркуляция и давление для сжатия обеспечивается за счет работы компрессора. В месте, где нам нужно получить охлаждение меняется диаметр трубок, по которым циркулирует газ. За счет того, что газ расширяется, не совершая при этом работы, он забирает тепло из пространства внутри холодильника и далее переносит это тепло в окружающую среду. Отдав тепло окружающей среде, он снова сжимается компрессором, гонится по кругу и цикл повторяется.
Работа двигателя внутреннего сгорания автомобиля также описывается первым законом термодинамики. За счет сгорания топлива в цилиндрах, совершается работа по перемещению поршней и движение автомобиля в конечном итоге.
Также, при работе двигатель нагревается, отдавая тепло окружающей среде.
 К слову сказать, основная задача многих конструкторов сократить тепловые потери, тем самым увеличив так называемый коэффициент полезного действия. На нем мы подробно останавливаться не будем и оставим тему КПД для будущих статей.
К слову сказать, основная задача многих конструкторов сократить тепловые потери, тем самым увеличив так называемый коэффициент полезного действия. На нем мы подробно останавливаться не будем и оставим тему КПД для будущих статей.Подводя итог, хочется сказать о важности знания и понимания первого начала термодинамики.
Именно первый закон термодинамики является основополагающим в решение многих задач физики.
Очень надеемся, что данный материал оказался для вас интересным и полезным.
Пишите свои вопросы в комментариях, если они у вас остались.
И удачи в учебе!
Если материал был полезен, вы можете отправить донат или поделиться данным материалом в социальных сетях:
Первый закон (начало) термодинамики (№1) | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
То, что внутреннюю энергию системы можно изменить двумя способами — благодаря выполнению работы или вследствие теплопередачи, побудило ученых искать взаимосвязь между соответствующими величинами. Сначала в 1842 году немецкий естествоиспытатель Р. Майер теоретически установил, а со временем английский физик Дж. Джоуль в 1843 году экспериментально доказал эквивалентность количества теплоты и работы как меры внутренней энергии.
Сначала в 1842 году немецкий естествоиспытатель Р. Майер теоретически установил, а со временем английский физик Дж. Джоуль в 1843 году экспериментально доказал эквивалентность количества теплоты и работы как меры внутренней энергии.
Теоретическим исследованиям Р. Майера и фундаментальным опытам Дж. Джоуля предшествовали наблюдения Б. Румфорда относительно получения теплоты за счет трения при сверлении пушечных стволов.
Суть опытов Джоуля состояла в том, что в калориметре перемешивалась ртуть или вода (рис. 2.4). Вследствие трения их температура повышалась. Джоуль сделал так, что опыт можно было повторять много раз, поскольку изменение температуры воды за один цикл было незначительным (после 10—20 опусканий разновесов температура воды повышалась лишь на 0,5 °С). Так, стержень с лопатками, помешенный в калориметр, приводился в движение силами, возникающими вследствие действия силы тяготения разновесов. Их перемещения измерялись с помощью шкалы. Учитывая по возможности разные потери энергии, ученый получил значение механического эквивалента теплоты, равное 4.19. Оно отличается от ныне принятого лишь на 0,5%.
Учитывая по возможности разные потери энергии, ученый получил значение механического эквивалента теплоты, равное 4.19. Оно отличается от ныне принятого лишь на 0,5%.
| Рис. 2.4. Опыт Джоуля |
| Вид калориметра в разрезе |
Научное значение опытов Дж. Джоуля заключалось в том, что по его результатам были сделаны обобщения относительно сохранения энергии в природе:
Энергия в природе не возникает из ничего и никуда не исчезает; она лишь переходит с одной формы в другую.
Позднее этот фундаментальный закон природы приобрел логическую форму первого закона термодинамики.
Первый закон термодинамики. Переход термодинамической системы из одного состояния в другое характеризуется изменением ее внутренней энергии, которая равна сумме работы внешних сил и количества теплоты, получаемого (отдаваемого) системой:
Переход термодинамической системы из одного состояния в другое характеризуется изменением ее внутренней энергии, которая равна сумме работы внешних сил и количества теплоты, получаемого (отдаваемого) системой:
ΔU = A + Q.
Первый закон термодинамики является законом сохранения энергии.
Конечно, в любом состоянии тело имеет определенную внутреннюю энергию. Тем не менее неправильно будет утверждать, что оно имеет определенное количество теплоты или работы. Независимо от того, каким образом происходит изменение состояния тела, это состояние однозначно определяет внутренняя энергия. Так, газ может нагреться за счет предоставления ему определенного количества теплоты или вследствие выполнения внешними силами работы (например, сжимание газа). Однако нельзя однозначно ответить, благодаря какому из процессов — выполнению работы или теплопередаче — состоялось нагревание газа.
Внутренняя энергия является однозначной функцией состояния тела. Ее изменение обусловлено переходом тела из одного состояния в другое за счет выполнения работы и теплопередачи. Материал с сайта http://worldofschool.ru
Если система сама выполняет работу вследствие теплопередачи, то первый закон термодинамики приобретает другой вид:
Q = ΔU + pΔV.
Количество теплоты, предоставленное термодинамической системе, ведет к изменению ее внутренней энергии или выполнению ею работы либо того и другого одновременно.
Последняя формулировка важна с точки зрения отрицания возможности создания вечного двигателя:
нельзя создать машину, которая бы неограниченно выполняла работу, не получая энергию извне.
Ведь если количество теплоты Q = 0, то A’ = —ΔU, то есть работа выполняется за счет уменьшения внутренней энергии, которая не безгранична.
Еще в 1775 году Французская академия наук приняла решение не рассматривать проекты вечных двигателей.
На этой странице материал по темам:Опыт джоуля подтверждающий первое начало термодинамики
Первый закон термодинамики шпаргалки
Опыт джоуля,подтверждающий первое начало термодинамики
Выберите формулировки первого закона термодинамики:
Следствия из первого закона термодинамики кратко
В чем состоит сущность опытов Дж. Джоуля?
Каким фундаментальным законом природы является первый закон термодинамики?
Сформулируйте первый закон термодинамики.
Какое важное следствие вытекает из первого закона термодинамики?
Первый закон термодинамики и его следствия
Эта формула, являющаяся следствием первого закона термодинамики, будет выведена в главе IV. [c.33]
[c.33]Из законов сохранения прежде всего используется закон сохранения материи (массы) и закон сохранения энергии в его общем виде (первый закон термодинамики) и в форме теоремы кинетической энергии (для механических систем). В ряде случаев, как следствие второго закона Ньютона, применяется теорема сохранения количества движения. [c.7]
Однако условие взаимной компенсации всегда выполняется для пограничного слоя в целом. Это прямое следствие первого закона термодинамики стенка стремится затормозить поток вязкой жидкости, что проявляется в виде работы сил трения, которая приводит к некоторому уменьщению кинетической энергии потока. Поскольку стенка неподвижна, то вся произведенная силами трения работа переходит в теплоту. Указанные превращения можно выразить формулой [c.190]
КПД энергетической установки всегда меньше единицы. При КПД = 1 вся подводимая к системе энергия превращается в работу. Возможно ли практически получить такой КПД Да, но только не в циклическом процессе. Примером может служить изотермическое расширение газа. Оно может идти лишь до того момента, пока давление не станет равным атмосферному. Можно ли осуществить циклическую последовательность процессов, для которой Q = и AU=0 Первому закону термодинамики это не противоречит, но осуществление такого цикла привело бы к интересным следствиям. Можно было бы, например, извлекать теплоту из любого источника, скажем, мирового океана, и превращать его в работу в двигателях судов. Это очень похоже на вечный двигатель, который пытались создать в прошлом веке. Реализовать эту идею, как в любой другой тип вечного двигателя, не удастся по одной и той же причине. Это противоречит закону природы, который носит название второго закона термодинамики.
[c.53]
Возможно ли практически получить такой КПД Да, но только не в циклическом процессе. Примером может служить изотермическое расширение газа. Оно может идти лишь до того момента, пока давление не станет равным атмосферному. Можно ли осуществить циклическую последовательность процессов, для которой Q = и AU=0 Первому закону термодинамики это не противоречит, но осуществление такого цикла привело бы к интересным следствиям. Можно было бы, например, извлекать теплоту из любого источника, скажем, мирового океана, и превращать его в работу в двигателях судов. Это очень похоже на вечный двигатель, который пытались создать в прошлом веке. Реализовать эту идею, как в любой другой тип вечного двигателя, не удастся по одной и той же причине. Это противоречит закону природы, который носит название второго закона термодинамики.
[c.53]
Читатель, вероятно, уже заметил, что термин адиабатический неоднократно употребляется нами без объяснений. Его можно было бы и опустить, когда рассматриваются законы сохранения массы. Однако такое ограничение условиями стационарного адиабатического смешения необходимо при включении в число сохраняемых свойств энтальпии смеси. Этот вопрос наряду с другими следствиями первого закона термодинамики рассматривается ниже, в 3-7.
[c.91]
Однако такое ограничение условиями стационарного адиабатического смешения необходимо при включении в число сохраняемых свойств энтальпии смеси. Этот вопрос наряду с другими следствиями первого закона термодинамики рассматривается ниже, в 3-7.
[c.91]
Следствия принятых ограничений 1. В рассматриваемых здесь смесях типичными являются четыре вещества топливо, окислитель, продукты и инертные. Следуя первому закону термодинамики, базовые состояния инертных и двух других веществ можно выбрать произвольно. Для сокращения алгебраических выкладок в последующем анализе будут сделаны следующие приемлемые допущения [c.105]
Уравнения (7.6а) и (7.66) часто рассматриваются как формулировки первого закона термодинамики. В то же время полученное в разд. 4.2 следствие 1 закона устойчивого равновесия также рассматривалось как формулировка первого закона, но только нециклическая. Поэтому уравнения (7.6а) и (7.66) можно назвать циклической формулировкой этого закона , хотя сам по себе он не может называться законом, так как возникает в результате логического развития представлений, основанных на фундаментальном законе устойчивого равновесия.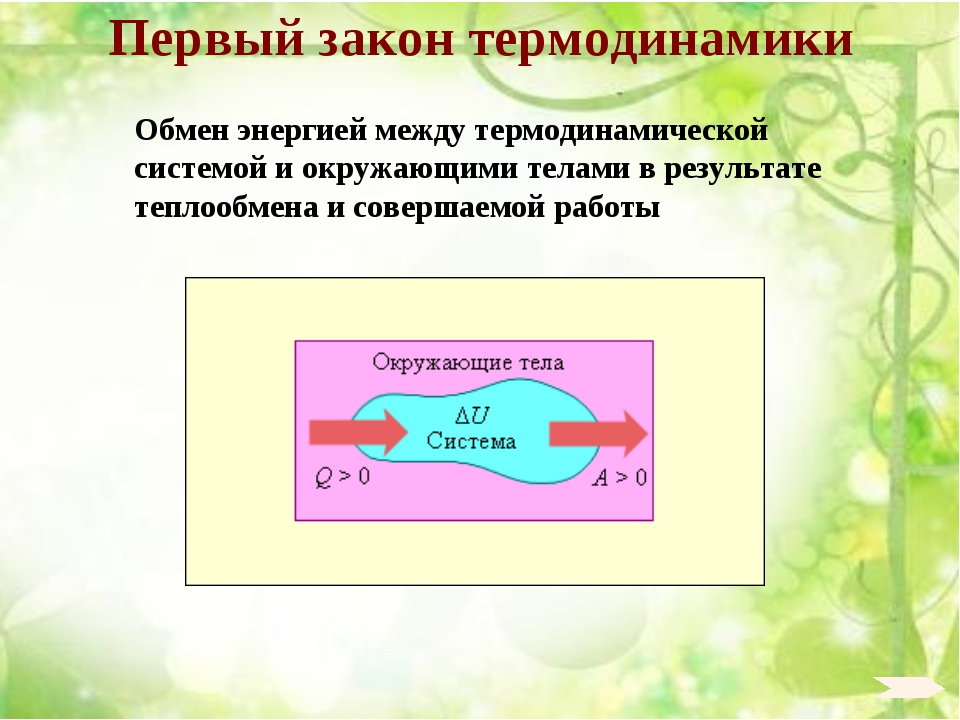 [c.84]
[c.84]
В разд. 4.2 и 7.4 было показано, что утверждение, которое обычно рассматривали как закон, называемый первым законом термодинамики, в действительности может быть получено как следствие закона устойчивого равновесия (разд. 2.11). По этой причине в названии гл. 4 слово закон было взято в кавычки. По той же причине это слово приводится в кавычках и в названии данной главы. [c.107]
Аналогичные процессы. Уравнение теплопроводности является прямым следствием закона сохранения, представленного первым законом термодинамики, и пропорциональности плотности потока градиенту температуры [см. (3.1)]. Существует множество других физических процессов, при которых соответствующая плотность потока некоторой величины пропорциональна градиенту этой величины и для которых существует закон сохранения. Отсюда следует, что эти процессы будут описываться дифференциальными уравнениями, аналогичными (3. 2). К подобным процессам можно отнести диффузию химических компонент, движение заряженных частиц в электромагнитном поле, течение в пористых материалах, потенциальные течения, перенос тепла и влаги в почве, а также полностью развитые течение и теплообмен в каналах. Построив вычислительную процедуру для решения уравнения (3.2), мы сможем применить ее и для любого аналогичного процесса, просто придавая новый смысл величинам Т, к, Sfj и др. Например, можно интерпретировать Т как концентрацию, к как коэффициент диффузии, как скорость химической реакции и т.п. Удобнее работать с таким обобщенным дифференциальным уравнением, так как уравнение теплопроводности и другие аналогичные уравнения станут его частными случаями. В дальнейшем будем основываться на подобном обобщенном дифференциальном уравнении.
[c.66]
2). К подобным процессам можно отнести диффузию химических компонент, движение заряженных частиц в электромагнитном поле, течение в пористых материалах, потенциальные течения, перенос тепла и влаги в почве, а также полностью развитые течение и теплообмен в каналах. Построив вычислительную процедуру для решения уравнения (3.2), мы сможем применить ее и для любого аналогичного процесса, просто придавая новый смысл величинам Т, к, Sfj и др. Например, можно интерпретировать Т как концентрацию, к как коэффициент диффузии, как скорость химической реакции и т.п. Удобнее работать с таким обобщенным дифференциальным уравнением, так как уравнение теплопроводности и другие аналогичные уравнения станут его частными случаями. В дальнейшем будем основываться на подобном обобщенном дифференциальном уравнении.
[c.66]
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ И ЕГО СЛЕДСТВИЯ [c.48]
Следствие первого закона. Запишем первый закон термодинамики, используя понятие о теплоемкости. Решив уравнение (4-5) относительно dq, получим количество тепла, сообщенное 1 кг газа при бесконечно малом изменении его температуры
[c.38]
Решив уравнение (4-5) относительно dq, получим количество тепла, сообщенное 1 кг газа при бесконечно малом изменении его температуры
[c.38]
Учебник проф. А. А. Радцига по многим особенностям заслуживает большого к себе внимания и подробного рассмотрения. Он содержит 299 страниц среднего формата, 144 рисунка, данных в приложении, и 18 решенных примеров. Учебник имеет 15 глав следующего наименования гл. 1—физические величины, входящие в уравнение термодинамики, их определения и измерения гл. 2— свойства идеальных газов гл. 3 — первый закон термодинамики гл. 4 — общие следствия из закона сохранения энергии гл. 5 —приложение первого закона к изучению свойств газа гл. 6 — второй закон термодинамики гл. 7 — приложение второго закона термодинамики гл. 8 — свойства насыщенных паров гл. 9 — частные случаи изменения состояния насыщенных паров гл. 10 — свойства перегретых паров процессы изменения состояния перегретого пара гл. 11 — необратимые процессы смешение паров истечение паров перетекание пара из одного сосуда в другой торможение пара гл. 12 — термодинамика идеальной паровой машины гл. 13 — влияние стенок цилиндра гл. 14 — расход пара в паровых машинах зависимость его от условий работы машины гл. 15 — воздушные газовые двигатели двигатель Дизеля.
[c.97]
12 — термодинамика идеальной паровой машины гл. 13 — влияние стенок цилиндра гл. 14 — расход пара в паровых машинах зависимость его от условий работы машины гл. 15 — воздушные газовые двигатели двигатель Дизеля.
[c.97]
Учебник Покровского, содержащий 368 страниц, имеет следующие наименования отдельных глав гл. 1—понятие о процессах. основы графического изображения процессов, работа процессов гл. 2— энергия и ее свойства гл. 3—учение об обратимости процессов гл. 4— понятие о машинах, приложение первого закона термодинамики к цикла.м гл. 5—учение о постоянных газах гл. 6— газовые машины и цикл Карно, к. п. д. мапшн гл. 7— основная формулировка второго закона термодинамики и вытекающие из нее следствия гл. 8— о физической сущности второго закона термодинамики гл. 9—учение о парах гл. 10—влажный воздух гл. И—течение упругих жидкостей. Течение без сопротивления. [c.242]
Дифференциальным следствием первого закона термодинамики (36) является уравнение [c.
 644]
644]Первый закон термодинамики появляется просто как следствие условия сохранения энергии. Если представить себе, что системы ансамбля получают дополнительную энергию или над ними производится работа, то изменение II находится из рассмотрения условия сохранения энергии. Второй закон термодинамики вытекает из отождествления —кН с энтропией 8. Согласно Я-теореме для ансамбля, состоящего из изолированных систем, величина Н уменьшается до своего минимального значения. Определение (1.7) энтропии позволяет сделать вывод, что 5 должна быть монотонной функцией Н. Равенство 5 = —кН можно получить, если вычислить дифференциал Н и сравнить его с уравнением (1.10). Подставляя выражение (5.37) для р в (5.32), получим [c.212]
Термохимия представляет собой раздел химии или физической химии, изучающий выделение или поглощение энергии при химических реакциях. Исторически термохимия начала формироваться раньше, чем химическая термодинамика, но все ее законы, полученные в результате экспериментальных исследований, являются следствиями первого закона термодинамики. [c.181]
[c.181]
Полученное свойство Т1 цикла Карно есть следствие первого закона термодинамики. [c.228]
Первый закон термодинамики является, так сказать, самоочевидным следствием динамических законов, из которых вытекает закон сохранения энергии. Внутренняя энергия Л системы без учета механической энергии является не чем иным, как энергией Е системы и поэтому есть функция состояния. [c.31]
Подставляя найденное в соответствии с уравнением (1.147), в уравнение (1.135), получим полезное для дальнейшего следствие первого и второго законов термодинамики [c.31]
Первое начало термодинамики представляет собой частный случай общего закона сохранения энергии. Причина, по которой в термодинамике предпочитают употреблять выражение первое начало термодинамики , а не закон сохранения энергии , заключается в том, что следствием сохранения [c.27]
Закон Гесса, как это ясно из предыдущего, является следствием первого начала термодинамики и представляет собой выражение этого начала для превращений энергии в химических реакциях. Исторически закон Гесса был открыт до того, как был сформулирован закон сохранения энергии.
[c.487]
Исторически закон Гесса был открыт до того, как был сформулирован закон сохранения энергии.
[c.487]
На основе уравнения (4.3) можно рассчитать и калорические свойства газа Ван-дер-Ваальса и, h, s, Ср и v. В основе такого расчета лежит уравнение (3.21), являющееся следствием первого и второго законов термодинамики. [c.105]
Постоянная / в уравнении (10.43) может быть определена на основе третьего закона термодинамики, однако вначале рассмотрим некоторые следствия из первых двух законов. Поскольку AG = AH—TAS, то lim (AG— [c.255]
Приведенные формулировки второго закона термодинамики, отражающие специфическую особенность теплоты, проявляющуюся при ее превращении, являются эквивалентными. Действительно, если допустить возможность самопроизвольного перехода теплоты от холодного источника к горячему, то последнему можно вернуть неиспользованную теплоту, и горячий источник расходовал бы всего удельной теплоты /а = /д, т. е. вся теплота, отнятая от теплоот-датчика, была бы превращена в круговом процессе в работу. Но это противоречило бы другим формулировкам второго закона. Следует еще раз подчеркнуть, что все формулировки второго закона термодинамики являются следствием наблюдений, т. е. второй закон, как и первый, является экспериментальным.
[c.36]
е. вся теплота, отнятая от теплоот-датчика, была бы превращена в круговом процессе в работу. Но это противоречило бы другим формулировкам второго закона. Следует еще раз подчеркнуть, что все формулировки второго закона термодинамики являются следствием наблюдений, т. е. второй закон, как и первый, является экспериментальным.
[c.36]
Подобно первому и второму законам, третий закон термодинамики имеет несколько различных по форме, но равноправных по существу формулировок, в каждой из которых подчеркивается то или иное следствие общего принципа. Одна из современных формулировок третьего закона термодинамики утверждает, что в любом равновесном изотерм-ном процессе в конденсированной системе при температуре стремящейся к абсолютному нулю, изменение энтропии стремится к нулю формулировка Нернста — Симона). [c.362]
Следует заметить, что этот закон был установлен Г. И. Гессом независимо от закона сохранения энергии и имел тогда особенно большое практическое значение. Теперь мы рассматриваем его как логическое следствие первого начала термодинамики.
[c.475]
Теперь мы рассматриваем его как логическое следствие первого начала термодинамики.
[c.475]
Второй закон термодинамики часто, хотя и совершенно незаслуженно, окружается неким мистическим ореолом, который теперь должен быть развеян путем перевода этого закона на роль подчиненного закону устойчивого равновесия, следствием которого он является. Ни одна другая важная отрасль науки не держалась на столь большом числе недоказанных постулатов, представленных в форме так называемых нулевого, первого и второго законов, и то обстоятельство, что в настоящее время термодинамическая наука не нуждается в такого рода подпорках, должно вызывать лишь удовлетворение. [c.14]
Благодаря адиабатической формулировке первого закона из вершины генеалогического древа термодинамики (а именно из закона устойчивого равновесия) выросла первая ветвь в виде следствия 1. Теперь на этом древе появилась еще одна ветвь, соответствующая принципу состояния (рис. 5.3).
[c. 72]
72]
В настоящей главе в виде следствия 3 мы установили третье ответвление от вершины генеалогического древа термодинамики, т. е. от закона устойчивого равновесия. Первое ответвление (следствие 1) дало нам в гл. 4 обычную нециклическую формулировку первого закона . В гл. 5 второе ответвление (следствие 2) позволило установить принцип состояния. Слияние этих ответвлений в гл. 7 привело к известному уравнению сохранения энергии для системы, которое далее позволило получить общепринятую циклическую формулировку первого закона (интересно отметить, что эта формулировка во многих учебниках принимается в качестве отправной точки при изложении классической термодинамики). [c.117]
Можно было бы и наоборот вывести уравнение баланса энергии (16) из первого начала и теоремы об изменении кинетической энергии, не основываясь на законе о сохранении энергии движущегося газа. В этом смысле закон сохранения энергии представляет первое начало термодинамики, примененное к движущемуся газу, так как уравнение изменения кинетической энергии является простым следствием уравнений динамики газа. [c.144]
Уравнение (4-6) представляет собой общий вид уравнения Бернулли для установившегося notoKa К Оно является следствием законов механики, открытых Ньютоном за 150 лет до провозглашения первого закона термодинамики или, иначе, закона сохранения энергии. [c.26]
Алымов ие учитывал, что третье положение есть следствие первого (первого закона термодинамики), так как внутренняя энергия есть функция состояния вещества. Но надо за.метить, что хотя третье положение и не является самостоятельным, оно все же имеет весьма важное значение, поскольку определяет понятия того времени о сущности и основных особенностях внутренией энергии, высказанные к тому же Алымовы.м с исключительной определенностью и ясностью. [c.40]
В гл. 3 и 4 приводятся опытные данные, доказывающие первый закон термодинамики и его ближайшие следствия. Дальше говорится о термическом эквиваленте работы и опытах по его определению. Здесь записано При всяком преобразовании между теплотой и работой отношение между участвующими в преобразовании количествами теплоты и работы будет одно и то же. Это может быть проверено опытом. Отношение между работой и получаемой теплотой именуется механическим эквивалентом теплоты . После этого рассматривается общее выражение ирвого закона термодинамики и устанавливается его аналитическое выражение. Останавливаясь на полученном выражении Вышнеградский пишет Количество теплоты, нужное для того, чтобы перевести тело из одного состояния в другое, не определяется этими состояниями, оно зависит еще от того, как переходит тело из одного состояния в другое . [c.52]
В разделах учебников по технической термодинамике, посвященных термохимии, в основном рассматриваются следующие вопросы первый закон термодинамики в применении к химическим процессам закон Гесса и закон Кирхгофа второй закон термодинамики в примепении к химическим процессам максимальная работа в изохорио-изотермических и изобарно-изотермических процессах уравнение максимальной работы химическое равновесие, закон действия масс константа скорости химической реакции и константа равновесия зависимость между константой химического равновесия и максимальной работой влияние на химическое равновесие давления и температуры принцип Ле-Шателье тепловая теорема Нернста и ее следствия вычисление константы интегрирования в уравнении константы равновесия газовых реакций влияние температуры на скорость химической реакции и др. [c.338]
Первый закон термодинамики является частны.м случаем общего закона сохранения и превращения энергии в применении к тепловым явлениям. С точки зрения диалектического материализма закон сохранения и превращения энергии является очевидным факто.м как следствие особенности материи, которой присущи вечное движение и превращение. Сущность закона сохранения и преврапгения энергии с исключительной глубиной устанавливается многими высказываниями Ф. Энгельса в книге Диалектика природы . [c.379]
Подобная постановка теории дифференциальных уравнений, ие обладая какими-либо достоинствами, имеет существенные недостатки. В этом случае теория дифференциальных уравнений дается не как нечто целое, объединенное общими задачами и методами исследования, а искусственно разбивается на две части, расположенные в разных разделах учебника. Заметим, что при такой постановке первая часть этой теории не имеет даже самостоятельного значения и, не являясь законченной, не имеет практического значения. Единс1-венной целью такой постановки является лишь стремление изложить в разделе, посвященном первому закону термодинамики, все вытекающие из него следствия. Такая постановка не может быть признана целесообразной, так как при ней проигрывают не только теории дифференциальных уравнений термодинамики, но и общая теория первого закона, так как она при этом перегружается дополнительными вопросами. При такой постановке нарушается основная сущность теории дифференциальных уравнений, предназначенной для аналитического обобщения первого и второго законов термодинамики. [c.420]
Когда Больцман начинал свою работу, кинетическая теория газов была для того временн уже достаточно разработана такими пионерами этой науки, как Клаузиус и Максвелл. Успешно были рассмотрены явления диффузии, теплопроводности, вязкости и т. д. Если считать,, что все элементарные процессы носят чисто механический характер, то для приверженцев кинетической теории теплоты первый закон термодинамики, как было показано Гельмгольцем, становится просто следствием известного закона механики — закона сохранения кинетической энергии ( Prinzip der lebendigen Krafte ). Тогда Больцман задал себе вопрос не лежит ли п в основе второго закона термодинамики какой-либо чисто механический принцип [c.67]
Уравнения (111)—(114) называются дифференциальными соотиб-щениями термодинамики или соотиошепиями взаимности Максвелла и широко используются в термодинамическом анализе. Эти соотношения, ЯВЛЯЯС15 следствием первого и второго законов термодинамики, в такой же степени достоверны, как и сами основные законы. [c.67]
По мере того как мы, исходя из фундаментального закона устойчивого равновесия, будем глава за главой развивать понятия и теоремы, читатель увидит, что утверждения, получившие названия первого и второго законов термодинамики, принимают характер следствий и тем самым теряют право называться самостоятельными фундаментальнЪши законами . Кроме того, оказывается, что нет необходимости и в так называемом нулевом законе . Чтобы читателю было легче следить за логическим развитием длинной цепи идей, образующих фундамент термодинамической науки, мы будем строить генеалогическое древо термодинамики , показывая его рост в конце каждой главы. Это позволит более ясно представить логическую структуру нашей довольно абстрактной отрасли науки. [c.14]
Закон термодинамики – Энциклопедия по машиностроению XXL
Если снять ограничение о постоянной плотности, то термодинамическое уравнение состояния примет вид соотношения между плотностью, давлением и температурой. Появление температурной переменной требует, чтобы одновременно решалось и уравнение баланса энергии (первый закон термодинамики), которое в свою очередь вводит две новые переменные — тепловой поток и внутреннюю энергию. Закон Фурье (связывающий тепловой поток с распределением температуры) и энергетическое уравнение состояния замыкают систему уравнений, приведенную в табл. 1-2. [c.14]Принцип сохранения энергии, т. е. первый закон термодинамики, можно записать следующим образом. Пусть V — внутренняя энергия, приходящаяся на единицу массы, а gz — потенциальная энергия на единицу массы g z = — g). Тогда имеем [c.50]
Приведенные рассуждения способствуют дальнейшему разъяснению точки зрения, высказанной в разд. 1-9 и касающейся вывода уравнения Бернулли на основании первого закона термодинамики, который часто встречается в руководствах по гидродинамике. На самом деле, если предположить справедливость реологического уравнения состояния (1-9.1), то диссипативный член т Vv обращается в нуль, т. а. в идеальных жидкостях не происходит диссипации энергии. Если первоначально принять это положение как интуитивное, то можно прямо записать уравнение (1-10.14) с нулевым последним членом в правой части и вычесть его из уравнения баланса энергии (1-10.13). Разумеется, при этом получим уравнение (1-10.6) (с V V. х = 0), т. е. уравнение Бернулли. Очевидно, что при таком подходе принимается предположение, что в некоторой точке вдоль линии тока нет диссипации. Несмотря на это, указанный подход имеет столь глубокие традиции, что используется всюду в гидромеханике ньютоновских жидкостей, хотя он не только логически небезупречен, но даже приводит к неправильным результатам ). [c.52]
И наконец, следует рассмотреть требование, не являющееся требованием инвариантности. Оно состоит в том, чтобы не нарушался второй закон термодинамики. Для ньютоновской жидкости это требование весьма просто удовлетворяется тем, что вязкость считается неотрицательной величиной, так что уравнение (1-10.16) всегда определяет положительную диссипацию. Для более сложных реологических предположений этот вопрос может решаться и не столь непосредственно второй закон термодинамики накладывает ограничения как на реологическое, так и на энергетическое уравнения состояния. Эту весьма сложную проблему пытался решить Колеман в недавней работе 15], что будет обсуждаться в гл. 4. [c.60]
При обычном подходе некоторый вид представления первого и второго законов термодинамики приводит к так называемым уравнениям Максвелла, из которых мы рассмотрим здесь в качестве примера лишь следующее А — свободная энергия Гельм- [c.147]
Уравнения (4-4.4) — (4-4.6) получаются на основании первого и второго законов термодинамики, применяемых к материалам, состояние которых (давление, свободная энергия и т. п.) определяется только текущими значениями Г и F. Уравнения (4-4.5) и (4-4.6) представляют собой ограничения, налагаемые законами термодинамики на допущения о состоянии материала в том смысле, что запрещается постулировать такие уравнения состояния, скажем, для А -а Р, которые не удовлетворяют (4-4.5). В последующем рассмотрении увидим, как получаются соответствующие уравнения (или ограничения) для материалов с памятью. Мы столкнемся с тем дополнительным осложнением, что напряженное состояние нельзя, вообще говоря, рассматривать как изотропное. [c.149]
Роль второго закона термодинамики [c.149]
В разд. 1-1 было показано, что первый закон термодинамики (т. е. уравнение баланса энергии) является одним из основных уравнений, необходимых для того, чтобы иметь возможность решить — по крайней мере в принципе — любую проблему механики жидкости. Оно рассматривается наряду с уравнениями баланса массы и импульса. Одновременно с этим необходимо совместно рассматривать три уравнения состояния одно — для полного напряжения (которое можно разложить на давление и девиаторную часть напряжения), другое — для теплового потока (которое не обязательно выражается в виде простой формы закона Фурье) и третье — для внутренней энергии (см. табл. 1-2). [c.149]
Второй закон термодинамики играет совсем иную роль. Действительно, предположим, что энергия добавлена к списку переменных в табл. 1-2, так же как и энтропийное уравнение состояния — к числу уравнений (т. е. имеется уравнение, задающее энтропию S как функцию каких бы то ни было относящихся к делу переменных) предположим, кроме того, что рассматривается второй закон термодинамики в какой-либо подходящей формулировке. [c.149]
Из этой таблицы видно, что второй закон термодинамики делает задачу переопределенной, поскольку число уравнений в ней на единицу больше числа переменных. Следовательно, это приводит к заключению, что второй закон термодинамики налагает некоторые ограничения, природу которых необходимо выяснить ). [c.150]
Здесь возникает тонкий вопрос, поскольку с первого взгляда можно выделить две различные точки зрения. Можно полагать, что второй закон термодинамики налагает некоторые ограничения на допустимые процессы, т. е. его выполнение потребовало бы, чтобы некоторые превращения данного материала были бы запретными. С другой стороны, можно полагать, что ограничения налагаются на уравнения состояния как будет показано ниже, правильна вторая точка зрения. [c.150]
Начнем с первого закона термодинамики, который будет записан в общем виде, позволяющем учесть как сжимаемость, так и радиационный приток энергии. Пусть Р — удельная работа напряжения , т, е. производимая внутренними напряжениями работа, [c.150]
Можно заметить, что, хотя второй закон термодинамики выражен в виде неравенства, а не уравнения, его выполнение действительно налагает некоторые ограничения. [c.150]
Второй закон термодинамики будет записан в форме неравенства Гиббса — Дюгема [8] [c.151]
Теперь мы в состоянии формализовать несколько неопределенное понятие диссипации энергии, которое содержится во втором законе термодинамики. Определим скорость диссипации энергии D как [c.153]
Глава вторая ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ [c.11]
АНАЛИТИЧЕСКОЕ ВЫРАЖЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ [c.14]
Первый закон термодинамики представляет собой частный случай всеобщего закона сохранения и превращения энергии применительно к тепловым явлениям. В соответствии с уравнением Эйнштейна Е = тс надо рассматривать единый закон сохранения и превращения массы и энергии. Однако в технической термодинамике мы имеем дело со столь малыми скоростями объекта, что дефект массы равен нулю, и поэтому закон сохранения энергии можно рассматривать независимо. [c.14]
Полученное уравнение является математическим выражением первого закона термодинамики. Каждый из трех членов этого соотношения может быть положительным, отрицательным или равным нулю. Рассмотрим некоторые частные случаи. [c.14]
Проинтегрировав уравнения (2.7) и (2.11) для некоторого процесса, получим выражение первого закона термодинамики в интегральной форме [c.15]
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ [c.19]
Несмотря на эквивалентность теплоты и работы, процессы их взаимного превращения неравнозначны. Опыт показывает, что механическая энергия может быть полностью превращена в теплоту, например, путем трения, однако теплоту полностью превратить в механическую энергию в периодически повторяющемся процессе нельзя. Многолетние попытки осуществить такой процесс не увенчались успехом. Это связано с существованием фундаментального закона природы, называемого вторым законом термодинамики. Чтобы выяснить его сущность, обратимся к принципиальной схеме теплового двигателя (рис. 3.2). [c.21]
Применим первый закон термодинамики к циклу, который совершает I кг рабочего тела [c.21]
Таким образом, второй закон термодинамики можно сформулировать в виде следующего утверждения Вечный двигатель второго рода невозможен . В более расшифрованном виде эту формулировку в 1851 г. дал В. Томсон Невозможна периодически действующая тепловая машина, единственным результатом действия которой было бы получение работы за счет отнятия теплоты от некоторого источника . [c.22]
Являясь следствием второго закона термодинамики, формула для КПД цикла Карно, естественно, отражает его содержание. Из нее видно, что теплоту горячего источника можно было бы полностью превратить в работу, т. е. получить КПД цикла, равный единице, лишь в случае, когда Т – оо либо Гг- -О Оба значения температур недостижимы, (Не- [c.23]
Используя обратный цикл Карно, рассмотрим еще одну формулировку второго закона термодинамики, которую в то же время, что и В. Томсон, предложил Р. Клаузиус теплота не может самопроизвольно (без компенсации) переходить от тел с более низкой к телам с более высокой температурой. [c.26]
Ранее было показано, что для равновесных процессов справедливо соотношение ds = 6q/T. Разобранный пример достаточно наглядно показывает, что в неравновесных процессах ds> bq/Т, если бисточника теплоты. Обе записи являются аналитическими выражениями второго закона термодинамики [c.27]
Если Af велико, то Др/р 0 и самопроизвольное повышение давления в соответствии со вторым законом термодинамики отсутствует, Если же рассматривать сильно разреженный газ или очень малый объем, в котором содержится, например, всего 100 молекул, то Др/р=1/10, В таком объеме наблюдаются заметные самопроизвольные пульсации давления (в среднем на 10 % от среднего), а следовательно, второй закон термодинамики нарушается, Поэтому учитывать флуктуации нужно лишь в том случае, когда число частиц в рассматриваемой системе мало. Но для та- [c.28]
Так как 1 = 0, то в соответствии с первым законом термодинамики Au = q и [c.31]
Количество подведенной (или отведенной) в процессе теплоты можно определить с помощью уравнения первого закона термодинамики q = (u2 — [c.33]
Работа расщирения определяется из первого закона термодинамики [c.39]
Если в потоке мысленно выделить замкнутый объем рабочего тела и наблюдать за изменением его параметров в процессе перемещения, то для описания его поведения будут пригодны все полученные выше термодинамические соотношения и, в частности, первый закон термодинамики в обычной записи q = = Ди + /. [c.44]
Подставив полученные значения q и I в уравнение первого закона термодинамики, получим [c.44]
Применим первый закон термодинамики к различным типам тепломеханического оборудования. [c.45]
Согласно второму закону термодинамики самопроизвольный процесс переноса теплоты в пространстве возникает под действием разности температур и направлен в сторону уменьшения температуры. [c.69]
В соответствии с уравнением (5.3) первого закона термодинамики, количество теплоты, отдаваемой потоком газов в теплообменнике, равно разности энтальпий газов до и после теплообменника (изменением скоростного напора можно пренебречь, а техническая работа не совершается). Поэтому основой тепловых расчетов топливоиспользующих устройств является энтальпия продуктов сгорания, которую принято рассчитывать на единицу количества топлива, из которого получились эти продукты , т, е. [c.128]
Предположим, что адиабаты пересекаются в точке с. Проведем между ними изотермический процесс аЬ, получим цикл аЬс, в котором совершается работа (эквивалентная заштрихованной площади) за счет охлаждения одного источника теплоты, что противоречит второму закону термодинамики. [c.209]
В соответствии с первым законом термодинамики для закрытых систем, в которых протекают равновесные процессы, 6q = du-irpdv. [c.15]
Из первого закона термодинамики следует, что взаимное превращение тепловой и механической энергии в двигателе должно осуществляться в строго эквивалентных количествах./Дамгатель, который позволял бы получать работу без энергетических затрат, называется вечным двигателем первого ро-д а. Ясно, что такой двигатель невозможен, ибо он противоречит первому закону термодинамики. Поэтому первый закон можно сформулировать в виде следующего утверждения вечный двигатель первого рода невозможен. В 1755 г. французская Академия наук раз и навсегда объявила, что не будет больше принимать на рассмотрение какие-либо проекты вечных двигателей. [c.20]
Уравнения первого закона термодинамика для адиабатного процесса принимают вид pdT vdp = Q dT- — -pdv = Q. Поделив первое уравнение на второе, получим [c.32]
Работа расширения при адиабатном процессе согласно первому закону термодинамики совершается за счет уменьшения внутренней энер1ии и может быть вычислена по одной из следующих формул [c.33]
Выше было указано, что к замкнутому объему рабочего тела, выделенному в потоке, применимо выражение первого закона термодинамики для закрытой системы, т. е. 6 = б внет + 6(/тр = /1 vdp, откуда 6qmeш = dll — vdp — бl f. [c.44]
С другой стороны, для объема рабочего тела, движущегося в потоке без трения, применимо выражение первого закона термодинамики для закрытой системы 6qsiKm = dh — vdp. [c.45]
Согласно уравнению первого закона термодинамики для потока (5.3) в случае, когда 2 = l и [c.54]
1-й закон термодинамики
1-й закон термодинамики гласит, что энергия не создается и не разрушается, поэтому энергия Вселенной постоянная . Однако энергия может быть передана из одной части Вселенной в другую. Чтобы решить термодинамические проблемы, нам нужно будет изолировать определенную часть Вселенной, систему, от остальной части Вселенной, окружающей среды.
Передача энергии между различными системами может быть выражена как:
E 1 = E 2 (1)
, где
E 1 = начальная энергия
E 2 = конечная энергия
Внутренняя энергия включает:
- Кинетическая энергия, связанная с движениями атомов
- Потенциальная энергия, запасенная в химических связях молекул
- Гравитационная энергия системы
Первый закон является отправной точкой для науки термодинамики и инженерного анализа.
На основе типов обмена, который может иметь место, мы определим три типа систем:
- изолированные системы : без обмена материей или энергией
- закрытые системы: без обмена материей, но некоторый обмен энергией
- открытые системы : обмен как веществом, так и энергией
Первый закон использует ключевые концепции внутренней энергии , тепла и работы системы .Он широко используется при обсуждении тепловых двигателей .
Внутренняя энергия Внутренняя энергия определяется как энергия, связанная со случайным, неупорядоченным движением молекул. Она отделена по масштабу от макроскопической упорядоченной энергии, связанной с движущимися объектами; это относится к невидимой микроскопической энергии на атомном и молекулярном уровне. Например, стакан воды комнатной температуры, стоящий на столе, не имеет видимой энергии, ни потенциальной, ни кинетической.Но в микроскопическом масштабе это бурлящая масса высокоскоростных молекул. Если бы воду перебросили через комнату, эта микроскопическая энергия не обязательно изменилась бы, когда мы наложили упорядоченное крупномасштабное движение на воду в целом. |
Тепло Тепло можно определить как энергию, передаваемую от высокотемпературного объекта к низкотемпературному объекту. Объект не обладает «теплом»; подходящим термином для микроскопической энергии в объекте является внутренняя энергия.Внутренняя энергия может быть увеличена путем передачи энергии объекту от объекта с более высокой температурой (более горячего) – это называется нагревом. |
Работа Когда работа выполняется термодинамической системой, обычно эту работу выполняет газ. Работа, совершаемая газом при постоянном давлении, равна W = p dV, где W – работа, p – давление, а dV – изменение объема. |
Тепловые двигатели Холодильники, тепловые насосы, цикл Карно, цикл Отто |
Изменение внутренней энергии системы равно напору, добавленному в систему, за вычетом работы, выполненной система:
dE = Q – W (2)
где
dE = изменение внутренней энергии
Q = тепло, добавленное в систему
W = работа, выполненная Закон системы
1 st не дает информации о направлении процессов и не определяет конечное состояние равновесия.Интуитивно мы знаем, что энергия течет от высокой температуры к низкой. Таким образом, закон 2 nd необходим для определения направления процессов .
Энтальпия – это «термодинамический потенциал», используемый в химической термодинамике реакций и нециклических процессов. Энтальпия определяется как
H = U + PV (3)
, где
H = энтальпия
U = внутренняя энергия
P = давление
V = объем
Энтальпия тогда является точно измеряемой переменной состояния, поскольку она определяется в терминах трех других точно определяемых переменных состояния.
Перейти к международно согласованным ключевым значениям Thermodyamics, Стандартное состояние и энтальпия образования, свободная энергия Гиббса образования, энтропия и теплоемкость и стандартная энтальпия образования, энергия Гиббса образования, энтропия и молярная теплоемкость органических веществ для списка значения для множества неорганических и органических веществ.
Энтропия используется для определения недоступной энергии в системе. Энтропия определяет относительную способность одной системы взаимодействовать с другой.Когда все движется к более низкому энергетическому уровню, когда человек менее способен воздействовать на окружающую среду, считается, что энтропия увеличивается. Энтропия связана со вторым началом термодинамики.
Для Вселенной в целом энтропия увеличивается.
Первый закон термодинамики
Термодинамика – это раздел физики который имеет дело с энергией и работой системы. Термодинамика имеет дело только с крупномасштабный ответ системы, которую мы можем наблюдать и измерять в экспериментах.Маломасштабные газовые взаимодействия описывается кинетической теорией газов. Есть три основных законы термодинамики, которые описаны на отдельных слайдах. Каждый закон приводит к определению термодинамические свойства которые помогают нам понять и спрогнозировать работу физического система. Мы представим несколько простых примеров этих законов и свойства для множества физических систем, хотя нас больше всего интересует термодинамика двигательные установки а также высокоскоростные потоки. К счастью, многие из Классические примеры термодинамики включают газовую динамику.
По нашим наблюдениям за проделанной работой, или газом, мы обнаружили, что объем работы зависит не только от начального и конечного состояний газа но также и в процессе или пути, который производит конечное состояние. Точно так же количество тепла, переданное в, или от газа также зависит от начального и конечного состояний и процесс , который производит конечное состояние. Многие наблюдения реальных газов показали, что разница теплового потока в газ а работа, проделанная газом, зависит только от начального и конечного состояния газа и не зависит от процесса или пути который производит конечное состояние.Это говорит о существовании дополнительная переменная, называемая внутренней энергией газа, который зависит только от состояния газа, а не от какого-либо процесса. Внутренняя энергия – это переменная состояния, как и температура или давление. Первый закон термодинамики определяет внутреннюю энергия (E) равна разности теплопередачи (Q) в система и работа (W), выполненная по системе.
E2 – E1 = Q – W
Мы подчеркнули слова «в» и «по» в определении.Отвод тепла из системы будет присвоен отрицательный знак в уравнении. Аналогично работаю Сделанному в системе присваивается отрицательный знак.
Внутренняя энергия – это просто форма энергии, подобная потенциальной энергия объекта на некоторой высоте над землей, или кинетическая энергия движущегося объекта. Точно так же, как и потенциальная энергия может быть преобразован в кинетическую энергию при сохранении полной энергии системы, внутренняя энергия термодинамической системы может быть преобразуется либо в кинетическую, либо в потенциальную энергию.Как потенциал энергия, внутренняя энергия может храниться в системе. Обратите внимание, однако, что тепло и работы не могут храниться или сохраняться независимо, поскольку они зависят от о процессе. Первый закон термодинамики допускает многие возможные состояния системы, но только определенные состояния обнаружено, что существует в природе. В второй закон термодинамики помогает объясните это наблюдение.
Если система полностью изолирована от внешней среды, она возможно изменение состояния, при котором тепло не передается в система.Ученые называют процесс, в котором нет тепла. перенос как адиабатический процесс . Реализация первого закона термодинамики для газов вводит еще один полезная переменная состояния, называемая энтальпией который описан на отдельной странице.
Деятельности:
Экскурсии с гидом
- Термодинамика:
Навигация ..
- Руководство для начинающих Домашняя страница
Первый закон термодинамики – веб-формулы
Согласно первому закону термодинамики, можно создавать или разрушать энергию, но энергия переходит из одной формы в другую, и общее количество энергии во Вселенной остается постоянным.Он основан на сохранении энергии.Внутренняя энергия системы может быть изменена путем добавления тепла к системе или удаления тепла из системы и выполнения работы с системой или работы, выполняемой системой.
Он занимается обменом энергией между системой и ее окружением. Полная внутренняя энергия в системе – это сумма всех кинетических энергий и потенциальных энергий ее частиц.
Предположим,
Внутренняя энергия системы = E 1
Внутренняя энергия системы после химической реакции = E 2
Тепло, полученное или потерянное системой = q
Работа, проделанная в системе или системой = w
Итак:
E 2 = E 1 + q + w
E 2 – E 1 = q + w
ΔE = q + w (1)
Это уравнение является символической формой первого закона термодинамики.
Когда в систему добавляется тепло = значение q положительно (эндотермическая реакция q положительна)
Система теряет тепло = значение q отрицательно (экзотермическая реакция q отрицательна)
Таким же образом:
Работа, проделанная в системе = w положительна
Работа, выполненная системой = w отрицательна
Однако работа, выполняемая в системе, и работа, выполняемая системой, зависит от объема системы, особенно для газообразных соединений.
Объем системы уменьшается = работа выполняется в системе
Объем системы увеличивается = работа, проделанная системой
Предположим, что.
Начальный объем системы = V 1
Конечный объем после реакции = V 2
Внешнее давление = P (атмосферное давление – постоянное)
Тогда работа, выполненная системой,
-w = P (V 2 -V 1 )
-w = P ΔV
w = – P ΔV (2)
Согласно первому закону термодинамики значение w заменяется в уравнении (1), тогда
ΔE = q – P ΔV
Теперь нет изменения объема во время химической реакции тогда ΔV = 0, так что: ΔE = q
Таким образом, изменение энергии системы равно теплу, полученному или потерянному системой при постоянном объеме.
Первый закон термодинамики – обзор
5.1 Введение
Первый закон термодинамики обычно считается наименее сложным для понимания, поскольку он является расширением закона сохранения энергии, означающим, что энергия может быть ни создано, ни уничтожено. Сколько бы энергии ни было в начале Вселенной, она будет и в конце. Однако термодинамика – тонкая тема, и первый закон гораздо интереснее, чем можно было бы предположить из этого замечания.Более того, подобно нулевому закону, который послужил толчком к введению свойства «температура» и его уточнению, первый закон мотивирует введение и помогает прояснить смысл неуловимого понятия «энергия».
Энергетический баланс, основанный на первом законе термодинамики, разработан, чтобы лучше понять любой процесс, облегчить проектирование и контроль, указать на потребности в улучшении процесса и обеспечить возможную оптимизацию. Степень совершенства в использовании энергии процесса или его отдельных частей позволяет сравнивать степень совершенства и соответствующие параметры процесса с таковыми в других аналогичных процессах.Особенно важно сравнение с достижимыми в настоящее время значениями в наиболее эффективных системах. Могут быть установлены приоритеты для требуемых попыток оптимизации системы или ее компонентов. Такие приоритеты могут осуществляться либо на основе чрезмерного потребления энергии, либо на основе особо низкой степени совершенства.
Однако энергетический подход имеет некоторые недостатки. Как правило, энергообмен нечувствителен к предполагаемому направлению процесса, например, анализ энергии позволяет самопроизвольно переносить тепло в направлении повышения температуры.Энергия также не различает ее качество, например, 1 Вт тепла равен 1 Вт работы или электричества.
Первый закон термодинамики гласит, что полная энергия системы остается постоянной, даже если она преобразуется из одной формы в другую. Например, кинетическая энергия – энергия, которой обладает объект при движении, – преобразуется в тепловую энергию, когда водитель нажимает на тормоз автомобиля, чтобы замедлить его движение. Первый закон термодинамики связывает различные формы кинетической и потенциальной энергии в системе с работой, которую система может выполнять, и с передачей тепла.Этот закон иногда принимают за определение внутренней энергии , а также вводит дополнительную переменную состояния, энтальпию . Первый закон термодинамики допускает существование многих возможных состояний системы. Однако опыт показывает, что бывают только определенные состояния. В конечном итоге это приводит ко второму закону термодинамики и определению другой переменной состояния, называемой энтропией .
Работа – это движение против противоположной силы. Чтобы поднять вес против силы тяжести, нужно потрудиться.Величина работы зависит от массы объекта, силы гравитационного воздействия на него и высоты, на которую он поднимается. Работа – это основная основа термодинамики и, в частности, первого закона. Любая система способна работать. Например, сжатая или растянутая пружина может выполнять такую работу, как та, которая используется для подъема веса. Электрическая батарея способна выполнять работу, поскольку ее можно подключить к электродвигателю, который, в свою очередь, можно использовать для подъема груза.Это не совсем очевидный момент, но когда электрический ток проходит через нагреватель, он воздействует на нагреватель, так как тот же ток можно использовать для подъема веса, пропуская его через электродвигатель, а не через нагреватель. Тогда, почему нагреватель называется «нагреватель », а не « рабочий », очевидно из концепции тепла, которая была определена в главе 4.
Первый закон термодинамики обычно называют сохранением энергии. В курсах элементарной физики при изучении закона сохранения энергии особое внимание уделяется изменениям механической кинетической и потенциальной энергии и их взаимосвязи с работой.Более общая форма сохранения энергии включает эффекты теплопередачи и изменения внутренней энергии. Эту более общую форму обычно называют первым законом термодинамики . Также могут быть включены другие формы энергии, такие как электростатическая, магнитная, деформационная и поверхностная энергия.
Чтобы понять и лучше понять работу с точки зрения термодинамики, необходим термин, обозначающий способность системы выполнять работу. Этот термин – энергия .Полностью растянутая пружина обладает большей способностью выполнять работу, чем та же самая пружина, только слегка растянутая. Литр горячей воды имеет большую энергию, чем литр холодной воды. Следовательно, понятие энергии – это всего лишь мера способности системы выполнять работу.
Первый закон термодинамики гласит, что энергия не может быть ни создана, ни разрушена, а только изменена в форме . Для любой системы передача энергии связана с пересечением массой контрольной границы, внешней работой или теплопередачей через границу.Это приводит к изменению запасенной энергии в контрольном объеме. Массовый расход жидкости связан с кинетической, потенциальной, внутренней энергией и энергиями «потока», которые влияют на общий энергетический баланс системы. Обмен внешней работы и тепла завершает энергетический баланс. Вот почему первый закон термодинамики упоминается как принцип сохранения энергии , что означает, что энергия не может быть ни создана, ни уничтожена , а скорее преобразована в различные формы по мере изменения жидкости в контрольном объеме.Система – это область в пространстве (контрольный объем), через которую рабочая жидкость может проходить или не проходить. Затем наблюдаются различные энергии, связанные с жидкостью, когда они пересекают границы системы, и устанавливается баланс. Как обсуждалось в главе 1, система может быть одного из трех типов:
- 1.
Изолированная система;
- 2.
Закрытая система;
- 3.
Открытая система.
Открытая система, самая общая из трех, позволяет массе, теплу и внешней работе пересекать границу контроля.Баланс выражается в работе, поскольку все энергии в системе равны всем энергиям, выходящим из системы, плюс изменение накопления энергий внутри системы.
Система может быть механическим устройством, биологическим организмом или определенным количеством материала, например хладагентом в кондиционере или паром, расширяющимся в турбине. Термодинамическая система – это система, которая может взаимодействовать (и обмениваться энергией) со своим окружением или окружающей средой, по крайней мере, двумя способами, одним из которых является передача тепла.Знакомый пример – количество ядер попкорна в кастрюле с крышкой (рис. 5.1). Когда кастрюлю ставят на плиту, попкорну добавляется энергия за счет теплопроводности; Когда попкорн лопается и расширяется, он действительно работает, поскольку он оказывает восходящее усилие на крышку и смещает ее.
Рисунок 5.1. Попкорн в горшочке – это термодинамическая система. В показанном здесь термодинамическом процессе к системе добавляется тепло, и система воздействует на окружающую среду, поднимая крышку кастрюли.
Состояние попкорна изменяется в этом процессе, так как объем, температура и давление попкорна изменяются по мере его лопания.Такой процесс, как этот, при котором происходят изменения состояния термодинамической системы, называется термодинамическим процессом. В термодинамических системах важно с самого начала четко определить, что именно входит в систему, а что нет. Только тогда можно будет однозначно описать перенос энергии. Например, в примере с попкорном система была определена так, чтобы включать попкорн, но не кастрюлю, крышку или плиту.
Первый закон термодинамики для замкнутых систем – Термодинамика
Мы рассматриваем Первый закон термодинамики, примененный к стационарным замкнутым системам, как принцип сохранения энергии.Таким образом, энергия передается между системой и окружающей средой в виде тепла и работы, что приводит к изменению внутренней энергии системы. Изменение внутренней энергии можно рассматривать как меру молекулярной активности, связанной с изменением фазы или температуры системы, и уравнение энергии представляется следующим образом:
Уравнение энергии для стационарных замкнутых систем
Разделив каждый член на массу системы m [кг], мы получим конкретную форму уравнения энергии:
Энергия, передаваемая через границу системы в виде тепла, всегда является результатом разницы температур между системой и ее непосредственным окружением.Мы не будем рассматривать способ передачи тепла, будь то теплопроводность, конвекция или излучение, поэтому количество тепла, передаваемого во время любого процесса, будет либо указано, либо оценено как неизвестное в уравнении энергии. По соглашению, положительное тепло – это тепло, передаваемое из окружающей среды в систему, что приводит к увеличению внутренней энергии системы.
В этом курсе мы рассматриваем три режима передачи работы через границу системы, как показано на следующей диаграмме:
Рассматриваются три формы работы:
a) Поршень с граничной работой – цилиндр
b) Рабочее колесо с валом
c) Время электрической работы в вольтах (амперах)
В этом курсе нас в первую очередь интересует Граничная работа из-за сжатия или расширения системы в устройстве поршень-цилиндр, как показано выше.Во всех случаях мы предполагаем идеальное уплотнение (отсутствие массового расхода в системе и из нее), отсутствие потерь из-за трения и квазиравновесные процессы, в которых для каждого постепенного движения поршня поддерживаются условия равновесия. По соглашению, положительная работа – это работа, выполняемая системой над окружением, а отрицательная работа – это работа, выполняемая окружением над системой. Таким образом, поскольку отрицательная работа приводит к увеличению внутренней энергии системы, это объясняет отрицательный знак в приведенном выше уравнение энергии.
Граничная работа оценивается путем интегрирования силы F, умноженной на приращение расстояния dx между начальным состоянием (1) и конечным состоянием (2). Обычно мы имеем дело с устройством поршень-цилиндр, поэтому сила может быть заменена площадью поршня A, умноженной на давление P, что позволяет нам заменить Adx изменением объема dV следующим образом:
Это показано на следующей схематической диаграмме, где мы напоминаем, что интегрирование может быть представлено областью под кривой.
(площадь под кривой)
Обратите внимание, что выполненная работа – это функция пути , а не свойство, поэтому она зависит от пути процесса между начальным и конечным состояниями. Напомним, что в главе 1 мы представили несколько представляющих интерес типичных путей процесса:
- Изотермический (процесс с постоянной температурой)
- Изохорный или Изометрический (процесс постоянного объема)
- Изобарический (процесс с постоянным давлением)
- Адиабатический (отсутствие теплового потока в систему или из нее во время процесса)
Иногда удобно оценить конкретную проделанную работу, которую можно представить диаграммой P-v , таким образом, если масса системы равна m [кг], в итоге мы имеем:
где: P – давление [кПа], V – объем [м 3 ]
м – масса [кг], v – удельный объем
Вт – проделанная работа [кДж], w – проделанная работа
Отметим, что работа, выполняемая системой с окружением (процесс расширения), является положительной, а работа, выполняемая системой со стороны окружения (процесс сжатия), отрицательна.
Наконец, для закрытой системы Работа на валу (из-за лопастного колеса) и Электрическая работа (из-за напряжения, приложенного к электрическому резистору или двигателю, приводящему в движение лопаточное колесо) всегда будет отрицательным (работа выполняется в системе) . Положительные формы работы вала, например, из-за турбины, будут рассмотрены в Глава 4 , когда мы будем обсуждать открытые системы.
Третий компонент нашего уравнения энергии замкнутой системы – это изменение внутренней энергии в результате передачи тепла или работы.Поскольку удельная внутренняя энергия является свойством системы, она обычно представлена в таблицах свойств, например, в таблицах пара.
В следующих тематических исследованиях мы обнаруживаем, что одно из основных приложений уравнения энергии замкнутой системы – это процессы теплового двигателя, в которых система аппроксимируется идеальным газом, поэтому мы разработаем соотношения для определения внутренней энергии идеального газа. газ. Мы также обнаружим, что новое свойство под названием Enthalpy будет полезно как для закрытых систем, так и, в частности, для открытых систем, таких как компоненты паровых электростанций или холодильных систем.Энтальпия не является фундаментальным свойством, однако представляет собой комбинацию свойств и определяется следующим образом:
Энтальпия [кДж]:
Удельная энтальпия:
В качестве примера его использования в закрытых системах рассмотрим следующий процесс постоянного давления:
Применяя уравнение энергии, получаем:
Однако, поскольку давление постоянно на протяжении всего процесса:
Подставляем в уравнение энергии и упрощаем:
(процесс постоянного давления)
Значения удельной внутренней энергии (u) и удельной энтальпии (h) доступны в таблицах пара, однако для идеальных газов необходимо разработать уравнения для Δu и Δh в терминах удельной теплоемкости.Мы разработаем эти уравнения в терминах дифференциальной формы уравнения энергии в следующем разделе этой главы (Удельная теплоемкость идеального газа).
Решенный пример
Два килограмма воды при 25 ° C помещаются в поршневой цилиндр под давлением 3,2 МПа, как показано на диаграмме (Состояние (1)). К воде добавляется тепло при постоянном давлении, пока температура пара не достигнет 350 ° C (состояние (2)). Определите работу, совершаемую жидкостью (W), и тепло, передаваемое жидкости (Q) во время этого процесса, используя уравнения энергии, затем сравните это значение Q со значением, полученным из изменения энтальпии системы.
Подход к решению:
Сначала мы рисуем диаграмму процесса, включающую все соответствующие данные, как показано ниже:
Что?
Масса?
Энергия?
Обратите внимание на четыре вопроса справа от диаграммы, которые мы всегда должны задавать, прежде чем пытаться решить любую термодинамическую задачу. С чем мы имеем дело – жидкостью? чистая жидкость, например пар или хладагент? идеальный газ? В данном случае это пар, поэтому мы будем использовать таблицы пара для определения различных свойств в различных состояниях.Дана масса или объем? В таком случае мы будем уточнять и оценивать уравнение энергии в килоджоулях, а не в конкретных количествах.
Поскольку работа включает интеграл от Pdv, мы считаем удобным набросать схему P-v задачи следующим образом:
пограничные работы
Обратите внимание на диаграмму P-v , как мы определяем конкретную выполненную работу как площадь под кривой процесса. Мы также заметили, что в области сжатой жидкости линия постоянной температуры по существу вертикальна.Таким образом, все значения свойств в Состоянии (1) (сжатая жидкость при 25 ° C) могут быть определены из табличных значений насыщенной жидкости при 25 ° C.
Состояние (1) – Сжатая жидкость
Состояние (2) – Перегретый пар
Технологическая энергия
Теперь сравним это значение со значением, полученным с использованием изменения энтальпии. Из таблиц пара мы получаем удельные значения энтальпии для воды (104.8) и для пара (3110.45). Затем мы умножаем разницу этих двух значений на 2 кг, чтобы получить наше решение:
(1)
Для простой системы внутренняя энергия (u) является функцией двух независимых переменных, поэтому мы предполагаем, что она является функцией температуры T и удельного объема v, следовательно:
Подставляя уравнение (2) в уравнение энергии (1) и упрощая, получаем:
Теперь для процесса постоянного объема (dv = 0):
где: C v – удельная постоянная объемная теплоемкость
То есть, удельная теплоемкость системы с постоянным объемом является функцией только ее внутренней энергии и температуры.В своем классическом эксперименте 1843 года Джоуль показал, что внутренняя энергия идеального газа является функцией только температуры, а не давления или удельного объема. Таким образом, для идеального газа частные производные могут быть заменены обычными производными, а изменение внутренней энергии может быть выражено как:
Рассмотрим теперь энтальпию. По определению h = u + Pv, продифференцируя таким образом, получаем:
Опять же для простой системы энтальпия (h) является функцией двух независимых переменных, поэтому мы предполагаем, что она является функцией температуры T и давления P, следовательно:
Подставляя уравнение (6) в уравнение энергии (5) и упрощая:
Следовательно, для процесса с постоянным давлением, поскольку dP = 0:
где: C p – удельная теплоемкость при постоянном давлении
То есть удельная теплоемкость системы при постоянном давлении зависит только от ее энтальпии и температуры.Сейчас по определению:
Теперь, поскольку для идеального газа Джоуль показал, что внутренняя энергия является функцией только температуры, из приведенного выше уравнения следует, что энтальпия является функцией только температуры. Таким образом, для идеального газа частные производные могут быть заменены обычными производными, а дифференциальные изменения энтальпии могут быть выражены как:
Наконец, из определения энтальпии для идеального газа имеем:
Определить: (отношение удельных теплоемкостей)
Значения R, C P , C v и k для идеальных газов представлены (при 300 K) в таблице свойств различных идеальных газов.Обратите внимание, что значения C P , C v и k постоянны с температурой только для одноатомных газов, таких как гелий и аргон. Для всех других газов их температурная зависимость может быть значительной и ее необходимо учитывать. Мы считаем удобным выразить эту зависимость в табличной форме и предоставили таблицу удельных теплоемкостей воздуха.
Концептуально двигатель Стирлинга является самым простым из всех тепловых двигателей. Он не имеет клапанов и включает пространство с внешним обогревом и пространство с внешним охлаждением.Его изобрел Роберт Стирлинг, а на интересном веб-сайте Боба Сиера есть фотография Роберта Стирлинга, его оригинальный патентный рисунок 1816 года и анимированная модель оригинального двигателя Стирлинга.
В своей первоначальной форме с одним цилиндром рабочий газ (обычно воздух или гелий) запечатан внутри цилиндров с помощью поршня и перемещается между горячим и холодным пространством с помощью вытеснителя. Связь, приводящая в движение поршень и вытеснитель, будет перемещать их так, что газ будет сжиматься, когда он в основном находится в холодном пространстве сжатия, и расширяться в горячем пространстве расширения.Это ясно показано в соседней анимации, созданной Ричардом Уилером (Зефирис) из Википедии.
См. Также анимацию, созданную Мэттом Кевени на его веб-сайте анимации двигателя Стирлинга. Поскольку газ имеет более высокую температуру и, следовательно, давление, во время его расширения, чем во время его сжатия, во время расширения вырабатывается больше энергии, чем реабсорбируется во время сжатия, и эта чистая избыточная мощность является полезной выходной мощностью двигателя. Обратите внимание, что здесь нет клапанов или прерывистого сгорания, который является основным источником шума в двигателе внутреннего сгорания.Один и тот же рабочий газ используется снова и снова, что делает двигатель Стирлинга герметичной системой с замкнутым циклом. Все, что добавляется в систему, – это устойчивое высокотемпературное тепло, и все, что удаляется из системы, – это низкотемпературное (отходящее) тепло и механическая энергия.
Афины, штат Огайо, являются рассадником деятельности в области машин цикла Стирлинга, как двигателей, так и охладителей, и включают в себя научно-исследовательские и производственные компании, а также всемирно признанных консультантов в области компьютерного анализа цикла Стирлинга.Материнской компанией этого направления является Sunpower, Inc. Она была основана Уильямом Билом в начале 1970-х годов, главным образом на основе его изобретения двигателя Стирлинга со свободным поршнем, который мы описываем ниже. Обновление (январь 2013 г.) : Sunpower недавно была приобретена AMETEK, Inc. в Пенсильвании, однако продолжает разработку машин для цикла Стирлинга в Афинах, штат Огайо. Обновление (ноябрь 2013 г.) : Sunpower недавно представила комплект разработчика Стирлинга мощностью 1 кВт, основанный на свободнопоршневом двигателе Стирлинга, работающем на пропане или природном газе.
Некоторые примеры одноцилиндровых двигателей Стирлинга: Stirling Technology Inc. является дочерней компанией Sunpower и была создана для продолжения разработки и производства двигателя ST-5 Air мощностью 5 кВт. Этот большой одноцилиндровый двигатель сжигает топливо из биомассы (например, гранулы из опилок или рисовую шелуху) и может работать в качестве когенерационной установки в сельской местности. Это не свободнопоршневой двигатель, в нем используется коленчатый кривошипный механизм для обеспечения правильной фазировки буйка. Другой важный ранний двигатель Стирлинга – машина Леманна, на которой Гусав Шмидт провел первый разумный анализ двигателей Стирлинга в 1871 году.Энди Росс из Колумбуса, штат Огайо, построил небольшую рабочую копию машины Lehmann, а также модель воздушного двигателя.
Когенерация солнечного тепла и электроэнергии: В связи с нынешним энергетическим кризисом и кризисом глобального потепления возродился интерес к системам возобновляемой энергии, таким как ветровая и солнечная энергия, а также к распределенным системам когенерации тепла и электроэнергии. Cool Energy, Inc. из Боулдера, штат Колорадо, в настоящее время находится на продвинутой стадии разработки полной системы когенерации солнечного тепла и энергии для домашнего использования, включающей технологию двигателя Стирлинга для выработки электроэнергии.Это уникальное приложение включает солнечные тепловые коллекторы с вакуумными трубками, аккумуляторы тепла, нагреватели горячей воды и помещения, а также двигатель / генератор Стирлинга.
Идеальный анализ: Обратите внимание, что следующий анализ двигателей цикла Стирлинга является идеальным и предназначен только в качестве примера анализа первого закона для закрытых систем. В реальном мире мы не можем ожидать, что реальные машины будут работать лучше, чем 40-50% идеальных машин. Анализ реальных машин цикла Стирлинга чрезвычайно сложен и требует сложного компьютерного анализа (см., Например, примечания к курсу: Анализ машины цикла Стирлинга.)
Двигатель Стирлинга со свободным поршнем, разработанный Sunpower, Inc, уникален тем, что отсутствует механическое соединение между поршнем и буйком, поэтому правильное фазирование между ними происходит за счет давления газа и сил пружины. Электроэнергия снимается с двигателя постоянными магнитами, прикрепленными к поршню, приводящему в действие линейный генератор переменного тока. По сути, идеальный двигатель Стирлинга подвергается 4 различным процессам, каждый из которых может быть проанализирован отдельно, как показано на диаграмме P-V ниже.Сначала мы рассматриваем работу, проделанную во время всех четырех процессов.
- Процесс 1-2 – это процесс сжатия, при котором газ сжимается поршнем, в то время как вытеснитель находится в верхней части цилиндра. Таким образом, во время этого процесса газ охлаждается, чтобы поддерживать постоянную температуру T C . Работа W 1-2 , необходимая для сжатия газа, показана как область под кривой P-V и оценивается следующим образом.
Процесс сжатия
- Процесс 2-3 – это процесс вытеснения постоянного объема, при котором газ перемещается из холодного пространства в горячее пространство расширения.Никакая работа не выполняется, однако, как мы увидим ниже, значительное количество тепла Q R поглощается газом из матрицы регенератора.
- Процесс 3-4 – это процесс изотермического расширения. Работа W 3-4 выполняется системой и показана как область под диаграммой PV , в то время как тепло Q 3-4 добавляется в систему от источника тепла, поддерживая постоянную температуру газа. Т Н .
Процесс расширения
- Наконец, процесс 4-1 представляет собой процесс вытеснения постоянного объема, который завершает цикл.Еще раз мы увидим ниже, что тепло Q R отводится рабочим газом в матрицу регенератора.
Чистая работа W net , выполненная в течение цикла, определяется как: W net = (W 3-4 + W 1-2 ), где работа сжатия W 1-2 отрицательный (работа в системе).
Теперь рассмотрим тепло, передаваемое во время всех четырех процессов, что позволит нам оценить тепловой КПД идеального двигателя Стирлинга.Напомним из предыдущего раздела, что для того, чтобы провести анализ идеального газа по Первому закону для определения передаваемого тепла, нам потребовалось разработать уравнения для определения изменения внутренней энергии Δu с точки зрения удельной теплоемкости идеального газа.
Два процесса с постоянным объемом образуются путем удержания поршня в фиксированном положении и перемещения газа между горячим и холодным пространством с помощью вытеснителя. Во время процесса 4-1 горячий газ отдает свое тепло Q R , проходя через матрицу регенератора, которое впоследствии полностью восстанавливается в процессе 2-3.
Постоянные процессы 1, 2 и 3 4
Теперь из Первого Закона для цикла:
Таким образом, тепловой КПД:
Обратите внимание: таким образом, мы находим, что:
Мы найдем в Глава 5 , что это максимальный теоретический КПД, который может быть достигнут от теплового двигателя, и обычно обозначается как КПД Карно .
Обратите внимание, что если регенератор отсутствует, тепло QR должно подаваться нагревателем. Таким образом, эффективность будет значительно снижена до. Кроме того, тогда охладитель должен будет отводить тепло, которое обычно поглощается регенератором, таким образом, охлаждающая нагрузка будет увеличена до Q из + Q R . Напомним, что Q 2-3 = Q R = -Q 4-1 .
Обратите внимание, что практический цикл Стирлинга имеет много связанных с ним потерь и на самом деле не включает изотермические процессы или идеальную регенерацию.Кроме того, поскольку цикловые машины Стирлинга со свободным поршнем связаны с синусоидальным движением, диаграмма P-V имеет овальную форму, а не острые края, определенные на вышеприведенных диаграммах. Тем не менее, мы используем идеальный цикл Стирлинга, чтобы получить первоначальное представление о его характеристиках.
Один из важных аспектов машин цикла Стирлинга, который мы должны учитывать, заключается в том, что цикл может быть обращен вспять – если мы добавим в цикл чистую работу, то его можно будет использовать для перекачки тепла от низкотемпературного источника в высокотемпературный сток.Sunpower, Inc. принимает активное участие в разработке холодильных систем цикла Стирлинга и производит криогенные охладители цикла Стирлинга для сжижения кислорода. В 1984 году Sunpower разработала дуплексную машину Стирлинга со свободным поршнем, имеющую всего три движущихся части, включая один поршень и два вытеснителя, в которой газовый двигатель Стирлинга приводил в действие охладитель цикла Стирлинга. Global Cooling, Inc. была основана в 1995 году как дочернее предприятие Sunpower и была образована в основном для разработки свободно-поршневых охладителей цикла Стирлинга для домашних холодильников.Эти системы, помимо того, что они значительно более эффективны, чем обычные парокомпрессионные холодильники, имеют дополнительное преимущество, заключающееся в том, что они являются компактными портативными установками, в которых в качестве рабочей жидкости используется гелий (а не хладагенты HFC, такие как R134a, с потенциалом глобального потепления 1300). . Совсем недавно Global Cooling решила сконцентрировать свои усилия на разработке систем, в которых практически нет конкурирующих систем – охлаждение от -40 ° C до -80 ° C, и они учредили новое название компании: Stirling Ultracold.
Нам повезло, что мы получили два оригинальных кулера M100B от Global Cooling. Один используется в качестве демонстрационного устройства и показан в действии на следующей фотографии. Второй блок настроен как проект ME Senior Lab, в котором мы оцениваем фактическую производительность машины при различных заданных нагрузках и температурах.
Стандартный дизельный цикл Air – идеальный цикл для поршневых двигателей с воспламенением от сжатия (CI), впервые предложенных Рудольфом Дизелем более 100 лет назад.Следующая ссылка от Kruse Technology Partnership описывает четырехтактный дизельный цикл, включая краткую историю Рудольфа Дизеля. Четырехтактный дизельный двигатель обычно используется в автомобильных системах, тогда как в более крупных морских системах обычно используется двухтактный дизельный цикл. И снова у нас есть отличная анимация, созданная Мэттом Кевени, демонстрирующая работу четырехтактного дизельного цикла.
Фактический цикл ХИ чрезвычайно сложен, поэтому в первоначальном анализе мы используем идеальное «стандартное для воздуха» допущение, в котором рабочая жидкость представляет собой фиксированную массу воздуха, проходящего полный цикл, который рассматривается как идеальный газ.Все процессы идеальны, горение заменяется добавлением тепла к воздуху, а выхлоп заменяется процессом отвода тепла, который восстанавливает воздух до исходного состояния.
Идеальный дизельный двигатель с воздушным стандартом подвергается 4 различным процессам, каждый из которых может быть проанализирован отдельно, как показано на диаграммах P-V ниже. Два из четырех процессов цикла – это адиабатических процессов (адиабатический = отсутствие передачи тепла), поэтому, прежде чем мы сможем продолжить, нам нужно разработать уравнения для адиабатического процесса идеального газа следующим образом:
Адиабатический процесс идеального газа (Q = 0)
Результаты анализа представлены в следующих трех общих формах, представляющих адиабатический процесс:
где k – коэффициент теплоемкостей и имеет номинальное значение 1.4 при 300К для воздуха.
Процесс 1-2 – это процесс адиабатического сжатия. Таким образом, температура воздуха увеличивается в процессе сжатия, и при большой степени сжатия (обычно> 16: 1) он достигает температуры воспламенения впрыскиваемого топлива. Таким образом, учитывая условия в состоянии 1 и степень сжатия двигателя, для определения давления и температуры в состоянии 2 (в конце процесса адиабатического сжатия) мы имеем:
Работа W 1-2 , необходимая для сжатия газа, показана как площадь под кривой P-V и оценивается следующим образом.
Процесс адиабатического сжатия
Альтернативный подход, использующий уравнение энергии, использует преимущество адиабатического процесса (Q 1-2 = 0) приводит к гораздо более простому процессу:
Во время процесса 2-3 топливо впрыскивается и сгорает, что выражается в процессе расширения при постоянном давлении. В состоянии 3 («прекращение подачи топлива») процесс расширения продолжается адиабатически с понижением температуры до тех пор, пока расширение не будет завершено.
Процесс 3-4, таким образом, представляет собой процесс адиабатического расширения. Общая работа расширения составляет W exp = (W 2-3 + W 3-4 ) и отображается как площадь под диаграммой P-V и анализируется следующим образом:
: расширение при постоянном давлении
: адиабатическое расширение
Наконец, процесс 4-1 представляет собой процесс отвода тепла с постоянным объемом. В реальном дизельном двигателе газ просто выпускается из цилиндра и вводится свежий воздух.
Чистая работа W net , выполненная за цикл, определяется следующим образом: W net = (W exp + W 1-2 ), тогда как работа до сжатия W 1-2 отрицательна (работа сделал по системе ).
В двигателе с дизельным циклом Air-Standard тепловложение Q в происходит за счет сжигания топлива, которое впрыскивается контролируемым образом, что в идеале приводит к процессу расширения 2-3 при постоянном давлении, как показано ниже. При максимальном объеме (нижняя мертвая точка) сгоревшие газы просто отводятся и заменяются свежим зарядом воздуха.Это представлено эквивалентным процессом отвода тепла с постоянным объемом Q out = -Q 4-1 . Оба процесса анализируются следующим образом:
Расширение при постоянном давлении
На этом этапе мы можем удобно определить КПД двигателя по тепловому потоку следующим образом:
Снова из Первого закона для цикла:
Таким образом, тепловой КПД:
Цикл Отто Air Standard – идеальный цикл для двигателей внутреннего сгорания с искровым зажиганием (SI), впервые предложенных Николаусом Отто более 130 лет назад и который в настоящее время используется в большинстве автомобилей.Следующая ссылка Kruse Technology Partnership представляет описание четырехтактного цикла Отто, включая краткую историю Николауса Отто. И снова у нас есть отличные анимации, созданные Мэттом Кевени, демонстрирующие работу как четырехтактного, так и двухтактного двигателя внутреннего сгорания с искровым зажиганием.
Анализ цикла Отто очень похож на анализ дизельного цикла, который мы анализировали в предыдущем разделе. В нашем анализе мы будем использовать идеальное «стандартное» допущение.Таким образом, рабочая жидкость представляет собой фиксированную массу воздуха, проходящего полный цикл, которая рассматривается на всем протяжении как идеальный газ. Все процессы идеальны, горение заменяется добавлением тепла к воздуху, а выхлоп заменяется процессом отвода тепла, который восстанавливает воздух до исходного состояния.
Наиболее существенное различие между идеальным циклом Отто и идеальным дизельным циклом – это способ воспламенения топливно-воздушной смеси. Напомним, что в идеальном дизельном цикле чрезвычайно высокая степень сжатия (около 18: 1) позволяет воздуху достигать температуры воспламенения топлива.Затем впрыскивается топливо, так что процесс воспламенения происходит при постоянном давлении. В идеальном цикле Отто топливно-воздушная смесь вводится во время такта впуска и сжимается до гораздо более низкой степени сжатия (около 8: 1), а затем воспламеняется от искры. Сгорание приводит к внезапному скачку давления, в то время как объем остается практически постоянным. Продолжение цикла, включая процессы расширения и выхлопа, по существу идентичны таковому в идеальном дизельном цикле.
Принципиальная схема, сопровождаемая анимированной схемой кулера (обе любезно предоставлены Global Cooling), показаны ниже:
Концептуально охладитель представляет собой чрезвычайно простое устройство, состоящее всего из двух движущихся частей – поршня и вытеснителя. Вытеснитель перемещает рабочий газ (гелий) между пространством сжатия и расширения. Фазирование между поршнем и вытеснителем таково, что, когда большая часть газа находится в окружающем пространстве сжатия, поршень сжимает газ, отводя тепло в окружающую среду.Затем вытеснитель вытесняет газ через регенератор в холодное пространство расширения, а затем как вытеснитель, так и поршень позволяют газу расширяться в этом пространстве, поглощая тепло при низкой температуре.
Энергия, энтальпия и первый закон термодинамики
Энергия, энтальпия и первый закон Термодинамика
Химическая термодинамика
Термодинамика определяется как отрасль науки, которая занимается взаимосвязь между теплом и другими формами энергии, такими как работа.Часто бывает обобщены в виде трех законов, которые описывают ограничения на то, как различные формы энергии могут быть взаимопревращенными. Химическая термодинамика – это раздел термодинамики, относится к химическим реакциям.
Законы термодинамики Первый закон: Энергия сохраняется; его нельзя ни создать, ни уничтожить. Второй закон: В изолированной системе естественные процессы являются спонтанными, когда они приводят к увеличение беспорядка или энтропии. Третий закон: энтропия идеального кристалла равна нулю, когда температура кристалл равен абсолютному нулю (0 К).
Было много попыток построить устройство, нарушающее законы термодинамика. Все потерпели неудачу. Термодинамика – одна из немногих областей науки в мире. для которых нет исключений.
Система и окружение
Одно из основных предположений термодинамики – это идея, что мы можем произвольно разделите вселенную на систему и ее окружение .В граница между системой и ее окружением может быть такой же реальной, как стенки стакана который отделяет решение от остальной вселенной (как на рисунке ниже).
Или он может быть таким же воображаемым, как набор точек, которые просто разделяют воздух. над поверхностью металла от остальной атмосферы (как на рисунке ниже).
Внутренняя энергия
Одним из термодинамических свойств системы является ее внутренняя энергия , E , который представляет собой сумму кинетической и потенциальной энергий частиц, которые образуют систему.Внутреннюю энергию системы можно понять, исследуя самая простая из возможных систем: идеальный газ. Поскольку частицы в идеальном газе не взаимодействуют, эта система не имеет потенциальной энергии. Внутренняя энергия идеального газа равна следовательно, сумма кинетических энергий частиц в газе.
Кинетическая молекулярная теория предполагает, что температура газа равна прямо пропорциональна средней кинетической энергии его частиц, как показано на рисунок ниже.
Следовательно, внутренняя энергия идеального газа прямо пропорциональна температура газа.
E sys = 3 / 2 RT
В этом уравнении R – идеальная газовая постоянная в джоулях на моль. кельвин (Дж / моль-К), а T – температура в кельвинах.
Внутренняя энергия систем более сложных, чем идеальный газ нельзя измерить напрямую. Но внутренняя энергия системы по-прежнему пропорциональна его температура. Таким образом, мы можем отслеживать изменения внутренней энергии системы с помощью наблюдая, что происходит с температурой системы. Когда температура системы увеличивается, мы можем сделать вывод, что внутренняя энергия системы также повысился.
Предположим на время, что термометр, погруженный в стакан с водой на плите – 73.5 o C, как показано на рисунке ниже. Это измерение может описывать только состояние системы в данный момент времени. Он не может сказать нам, воду нагревали непосредственно от комнатной температуры до 73,5 o C или нагревали из комнатной температуру до 100–90–145 o– 90–146 ° C, а затем дают остыть.
Таким образом,Температура является функцией состояния . Это зависит только от состояние системы в любой момент времени, а не путь, по которому система штат.Поскольку внутренняя энергия системы пропорциональна ее температуре, внутренняя энергия также является функцией состояния. Любое изменение внутренней энергии системы равна разнице между его начальным и конечным значениями.
E sys = E f – E i
Первый закон термодинамики
Первый закон термодинамики можно выразить в следующем уравнении: который утверждает, что энергия Вселенной постоянна.Энергию можно передавать от систему в ее окружение или наоборот, но она не может быть создана или уничтожена.
Первый закон термодинамики : E унив. = E системный + E surr = 0
Более полезная форма первого закона описывает, как сохраняется энергия.Это говорит, что изменение внутренней энергии системы равно сумме тепла полученные или утраченные системой, а также работа, выполненная системой или в ней.
Первый закон термодинамики : E sys = q + w
Знаковое соглашение о соотношении внутренней энергии систему и тепло, получаемое или теряемое системой, можно понять, подумав о конкретный пример, такой как стакан с водой на горячей плите.Когда плита повернута при включении система получает тепло от окружающей среды. В результате и температура, и внутренняя энергия системы увеличивается, а E составляет положительная . Когда конфорка выключена, вода теряет тепло в окружающую среду при охлаждении до комнатной температуры, и E имеет значение отрицательное значение .
Связь между внутренней энергией и работой можно понять с помощью Рассмотрим другой конкретный пример: вольфрамовая нить внутри лампочки.Когда работаешь осуществляется в этой системе путем пропускания электрического тока через вольфрамовую проволоку, система нагревается и E , следовательно, положительный . (В конце концов, проволока становится достаточно горячей светиться.) И наоборот, E отрицательное значение , когда система работает со своим окружением.
Условные обозначения для тепла, работы и внутренней энергии кратко изложены в рисунок ниже. Внутренняя энергия и температура системы уменьшаются ( E <0), когда система либо теряет тепло, либо работает со своим окружением.И наоборот, внутренняя энергия и повышение температуры ( E > 0), когда система получает тепло от окружающей среды или когда она работает в системе.
Система и работа
Система обычно определяется как химическая реакция, а граница контейнер, в котором протекает реакция.В ходе реакции тепло либо испускается или поглощается системой. Кроме того, система либо работает на нем. окружение или какие-то работы, сделанные в его окрестностях. Любое из этих взаимодействий может влияют на внутреннюю энергию системы.
E sys = q + w
С химической реакцией обычно связаны два вида работы: электрическая работа и работа работа расширения .Химические реакции могут повлиять на их окружение, пропуская электрический ток по внешнему проводу. Реакции тоже делают работать с их окружением, когда объем системы увеличивается в течение реакция Количество работы расширения, совершаемой реакцией, равно произведению давление, против которого система расширяется, умноженное на изменение объема система.
w = – PV
Знаковое соглашение для этого уравнения отражает тот факт, что внутреннее энергия системы уменьшается, когда система действительно работает со своим окружением.
Энтальпия относительно внутренней энергии
Что произойдет, если мы создадим набор условий, при которых работа не будет что делает система в своем окружении или, наоборот, во время химической реакции? Под В этих условиях тепло, выделяемое или поглощаемое реакцией, будет равно изменение внутренней энергии системы.
E sys = q (если и только если w = 0)
Самый простой способ достичь этих условий – запустить реакцию при постоянный объем, при котором работа расширения невозможна.При постоянном объеме тепло выделяется или поглощается реакцией, равно изменению внутренней энергии, которая происходит во время реакции.
E sys = q v (при постоянном объеме)
На рисунке ниже показан калориметр, в котором реакции могут проводиться при постоянный объем. Однако большинство реакций проводят в открытых колбах и лабораторных стаканах. Когда это сделано, объем системы не является постоянным, потому что газ может входить или выходить из контейнер во время реакции.Однако система находится под постоянным давлением, поскольку общее давление внутри контейнера всегда равно атмосферному давлению.
Если во время реакции из колбы выходит газ, система работать над его окрестностями. Если в результате реакции газ втягивается в колбу, окружающая среда работать над системой. Мы все еще можем измерить количество тепла, выделяемого или поглощаемого во время реакции, но она больше не равна изменению внутренней энергии система, потому что часть тепла была преобразована в работу.
E sys = q + w
Эту проблему можно обойти, введя понятие энтальпии ( H ), который представляет собой сумму внутренней энергии системы плюс произведение давление газа в системе, умноженное на объем системы.
H sys = E sys + PV
Для простоты индекс “sys” будет опущен. символ внутренней энергии системы и энтальпии системы из сейчас на.Поэтому мы будем сокращать соотношение между энтальпией системы и внутренняя энергия системы следующим образом.
H = E + PV
Изменение энтальпии системы во время химической реакции равно равна изменению его внутренней энергии плюс изменение произведения давления раз больше объема системы.
H = E + ( PV )
Предположим, что реакция протекает в стакане из пенополистирола, как показано на рисунок ниже.
Поскольку реакция протекает при постоянном давлении, изменение энтальпия, возникающая во время реакции, равна изменению внутренней энергии система плюс произведение постоянного давления на изменение объема система.
H = E + PV (при постоянном давлении)
Подстановка первого закона термодинамики в это уравнение дает следующий результат.
H = ( q p + w ) + PV
Предполагая, что единственная работа, совершаемая реакцией, – это работа расширения дает уравнение, в котором исключаются члены PV .
H = ( q p – PV ) + PV
Таким образом, тепло, выделяемое или поглощаемое во время химической реакции при постоянное давление равно изменению энтальпии системы.
H = q p (при постоянном давлении)
Связь между изменением внутренней энергии системы во время химической реакции и энтальпию реакции можно резюмировать следующим образом.
1. Тепло, выделяемое или поглощаемое при протекании реакции при константе объем равен изменению внутренней энергии системы.
E sys = q v
2.Тепло, выделяемое или поглощаемое при протекании реакции при константе давление равно изменению энтальпии системы.
H sys = q p
3. Изменение энтальпии системы во время химической реакции равно равна изменению внутренней энергии плюс изменение произведения давления количества газа в системе и его объема.
H sys = E системный + ( PV )
4.Разница между E и H для системы небольшая для реакций, в которых участвуют только жидкости и твердые вещества, потому что изменений практически нет в объеме системы во время реакции. Разница может быть относительно большой, однако для реакций, в которых участвуют газы, при изменении количества молей газ в процессе реакции.
| Практическая задача 1: Какая из следующих процессы выполняются с постоянным объемом, а какие – при постоянном давлении? (а) кислотно-основное титрование (б) разложение CaCo 3 нагреванием известняка в тигле с бунзеном. горелка (c) реакция между металлическим цинком и водным раствором ионов Cu 2+ до образуют металлическую медь и ионы Zn 2+ (d) измерение калорий в 1 унции.подача хлопьев для завтрака путем сжигания хлопьев в калориметре бомбы Нажмите здесь, чтобы проверить свой ответ на «Практика» Задача 1. |
Что такое второй закон термодинамики? | Наука
Термодинамика – это изучение тепла и энергии. В его основе лежат законы, описывающие, как энергия движется внутри системы, будь то атом, ураган или черная дыра. Первый закон описывает, как энергия не может быть создана или уничтожена, а просто преобразована из одного вида в другой.Однако второй закон, вероятно, более известен и даже более глубок, поскольку он описывает пределы того, что может делать Вселенная. Этот закон о неэффективности, вырождении и упадке. Он говорит нам, что все, что мы делаем, по своей сути расточительно и что во Вселенной происходят необратимые процессы. Он указывает нам стрелку на время и говорит о том, что наша вселенная неизбежно ждет мрачная и безрадостная судьба.
Несмотря на эти несколько обескураживающие идеи, идеи термодинамики были сформулированы во время большого технологического оптимизма – промышленной революции.В середине 19 века физики и инженеры создавали паровые машины для механизации работы и транспорта и пытались придумать, как сделать их более мощными и эффективными.
Многие ученые и инженеры, в том числе Рудольф Клаузиус, Джеймс Джоуль и лорд Кельвин, внесли свой вклад в развитие термодинамики, но отцом этой дисциплины был французский физик Сади Карно. В 1824 году он опубликовал «Размышления о движущей силе огня» , в которых изложил основные принципы, почерпнутые из наблюдений за тем, как энергия перемещается вокруг двигателей и как связаны потраченное впустую тепло и полезная работа.
Второй закон можно выразить несколькими способами, самый простой из которых состоит в том, что тепло естественным образом перетекает от более горячего тела к более холодному. В ее основе лежит свойство термодинамических систем, называемое энтропией – в приведенных выше уравнениях она представлена буквой S – в общих чертах, мерой степени беспорядка в системе. Это можно представить по-разному, например, в расположении молекул – молекулы воды в кубике льда более упорядочены, чем те же самые молекулы после того, как они были нагреты до газа.В то время как молекулы воды находились в четко определенной решетке в кубике льда, они непредсказуемо плавают в газе. Следовательно, энтропия кубика льда ниже, чем у газа. Точно так же энтропия тарелки выше, когда она лежит кусками на полу по сравнению с тем, когда она находится в раковине целиком.
Более формальное определение энтропии при движении тепла вокруг системы дается в первом из уравнений. Бесконечно малое изменение энтропии системы (dS) рассчитывается путем измерения количества тепла, поступившего в замкнутую систему (δQ), деленного на общую температуру (T) в точке, где произошла теплопередача.
Второе уравнение – это способ выразить второй закон термодинамики через энтропию. Формула гласит, что энтропия изолированной природной системы всегда будет оставаться неизменной или увеличиваться – другими словами, энергия во Вселенной постепенно приближается к беспорядку. Наше первоначальное утверждение второго закона вытекает из этого уравнения: тепло не может спонтанно течь от холодного объекта (низкая энтропия) к горячему объекту (высокая энтропия) в замкнутой системе, потому что это нарушило бы уравнение.(Холодильники, по-видимому, нарушают это правило, поскольку они могут замораживать предметы до гораздо более низких температур, чем окружающий их воздух. Но они не нарушают второй закон, потому что они не являются изолированными системами, требующими постоянного ввода электрической энергии для откачки тепла из их Холодильник нагревает комнату вокруг себя и, если его отключить от сети, естественным образом вернется к тепловому равновесию с комнатой.)
Эта формула также задает направление времени; в то время как любой другой известный нам физический закон будет работать одинаково независимо от того, идет ли время вперед или назад, это неверно для второго закона термодинамики.Как бы долго вы ни стояли, кипящая вода вряд ли когда-нибудь превратится в глыбу льда. Разбитая пластина никогда не сможет собрать себя заново, поскольку это уменьшит энтропию системы в нарушение второго закона термодинамики. Некоторые процессы, как заметил Карно, необратимы.
Карно исследовал паровые машины, которые работают, сжигая топливо, нагревая цилиндр, содержащий пар, который расширяется и толкает поршень, чтобы затем сделать что-то полезное. Часть энергии топлива, которая извлекается и используется для чего-то полезного, называется работой, а оставшаяся часть – это потраченная впустую (и неупорядоченная) энергия, которую мы называем теплом.Карно показал, что теоретический максимальный КПД паровой машины можно предсказать, измерив разницу температур пара внутри цилиндра и воздуха вокруг него, известных в термодинамических терминах как горячий и холодный резервуары системы соответственно.
Тепловые двигатели работают, потому что тепло естественным образом перетекает из горячих мест в холодные. Если бы не было холодного резервуара, к которому он мог бы двигаться, не было бы теплового потока и двигатель не работал бы. Поскольку в холодном резервуаре всегда выше абсолютного нуля, ни один тепловой двигатель не может быть эффективен на 100%.
Поэтому двигатели с наилучшей конструкцией нагревают пар (или другой газ) до максимально возможной температуры, а затем выпускают выхлоп при минимально возможной температуре. Самые современные паровые двигатели могут достигать КПД около 60%, а дизельные двигатели в автомобилях – около 50%.

