Периодической таблице Менделеева добавили элементов
Четыре новых элемента – нихоний, московий, теннессин и оганесон – встали на свои места.
В декабре 2015 года Международный союз теоретической и прикладной химии IUPAC (International Union of Pure and Applied Chemistry) объявил, что четыре новых элемента удовлетворяют критериям для включения в таблицу Менделеева: 113, 115, 117, 118. Дело оставалось за малым: выбрать названия для новых элементов. В июне IUPAC предложил ориентировочные названия, и после обсуждений и голосования была наконец официально опубликована обновлённая версия таблицы Менделеева, в которой нихоний (113 Nh), московий (115 Mc), теннессин (117 Тs) и оганесон (118 Og) завершают 7-й ряд.
Логотип IUPAC. (Фото Wikipedia.)
Памятник периодической таблице Менделева в Словацком Техническом Университете в Братиславе. (Фото Wikipedia.)
Образец берклиума для синтеза теннессина (Фото Wikipedia. )
)
‹
Открыть в полном размере
Напомним, что каждый химический элемент характеризуется количеством протонов и нейтронов в ядре. Число протонов равно числу электронов, поскольку атом в целом электронейтрален, а вот количество нейтронов может меняться. Атомы с одинаковым количеством протонов, но разным количеством нейтронов (и, следовательно, разной ядерной массой), хотя и относятся к одному элементу, тем не менее, отличаются своими химическими и физическими свойствами – такие «вариации» называются изотопами. Элементы, чей номер в периодической таблице превышает 92, соответствующий урану, называют трансурановыми. Одна из их важнейших характеристик – период полураспада: время, после которого вероятность радиоактивного распада ядра составляет 50%.
Все новые четыре элемента, как и большая часть сверхтяжёлых трансурановых элементов, слишком нестабильны, и поэтому в природе их не найти. Период полураспада в их ряду уменьшается от нескольких секунд до миллисекунд, и все они были получены за счёт ядерного синтеза, при котором ядра более лёгких элементов объединяются в одно массивное ядро.
Итак, давайте познакомимся поближе с «новенькими» периодической таблицы, а заодно и выясним, как они получили свои названия. (Как известно, по правилам IUPAC название элемента должно происходить либо от мифического концепта или персонажа, либо от астрономических объектов, минералов или схожих субстанций, либо же из свойств самого элемента, от географических названий, или, наконец, от фамилий исследователей).
Нихоний – элемент с неоднозначной историей. Одними из первых его получили в лаборатории ядерных реакций им. Г. Н. Флёрова при Объединённом институте ядерных исследований (ОИЯИ) в Дубне, сотрудники которой вместе с коллегами из Ливерморской национальной лаборатории в Беркли опубликовали свои результаты в 2003 году; российские физики настаивали на том, чтобы новый элемент назывался беккерелиум. Тем не менее, эта публикация не убедила IUPAC, и пальма первенства досталась японским исследователям из Института физико-химических исследований (RIKEN), которые синтезировали 113-й элемент в 2004 году методом «холодного слияния».
Нихоний входит в группу бора, но ведёт себя скорее как переходный металл. Согласно расчётам, температура плавления и кипения нихония составляет 430°С и 1100°С, что делает его непохожим на «одногруппников», которые плавятся и кипят при существенно более низких температурах. Причиной тому служат релятивистские поправки к энергии электронов нихония, которые за счёт большой массы и размера ядра весьма существенны.
Период полураспада наиболее стабильного изотопа нихония Nh-286 составляет 20 секунд, и среди других изотопов элемента он настоящий долгожитель. Объяснить такой большой период полураспада можно тем, что ядра с определённым количеством протонов и нейтронов более устойчивы, чем другие. Согласно теории оболочечного строения атомного ядра, которую разработали Мария Гёпперт-Майер и Ханс Йенсен, количество нуклонов (протонов и нейтронов) влияет на энергию связи внутри ядра. У элементов, ядра которых состоят из 2, 8, 20, 28, 50, 82 и 126 нуклонов, заполнены все ядерные оболочки, и поэтому они более стабильны. Последовательность «2, 8, 20…» и т. д. называется «магическими числами», что указывает на эмпирический характер теории. Она также предсказывает существование так называемого острова стабильности для трансурановых элементов. Для тех, кто оказывается в этом острове, характерен существенно больший период полураспада, чем у соседей по периодической таблице, и нихоний-286, видимо, сидит где-то неподалёку.
Физики-ядерщики из ОИЯИ в Дубне в сотрудничестве всё с той же Ливерморской Национально Лабораторией синтезировали ещё один новый элемент – 115-й, названный московием. Существование московия экспериментально подтвердили лаборатории в Лундте и Дармштадте. На данный момент в общей сложности было получено около 100 его атомов. Московий чрезвычайно радиоактивен: его период полураспада составляет 220 миллисекунд. Несмотря на близость к острову стабильности, известные на сегодня изотопы московия нестабильны. Впрочем, изотопы с большим количеством нейтронов распадаются медленнее, по-видимому, приближаясь к острову стабильности.
Московий входит в группу пниктогенов (группа азота): ближайший к нему элемент той же группы – висмут. Московий предположительно является плотным металлом, вторым в группе после висмута. По физическим свойствам он напоминает нихоний, поскольку электроны московия также испытывают сильное спин-орбитальное взаимодействие. По химическим свойствам московий скорее напоминают щелочной таллий.
Теннессин – самый «молодой» элемент, полученный в 2010 году физиками из Дубны, Национальной Лабораторией Окридж и Ливерморской национальной лабораторией в США. На сегодняшний день было синтезировано 15 атомов теннессина, его период полураспада составляет 118 миллисекунд. Он принадлежит к галогенам, стоя в их группе сразу после йода и астата. Тем не менее, в его поведении преобладают металлические свойства. Расчёты показывают, что температура плавления и кипения теннессина существенно ниже, чем у других элементов этой же группы – он должен кипеть около 210–350°С, поскольку, в отличие от других галогенов, способен существовать в одноатомной форме, без образования типичных для галогенов двухатомных молекул.
Его история впечатляет: чтобы синтезировать теннессин, нужна мишень из берклиума-249, для которого, в свою очередь, нужен калифорний-252. И тот и другой очень сложно и дорого получить, поэтому физики ждали несколько лет, пока достаточное количество калифорния произведут в коммерческих целях, чтобы из остатков можно было получить берклиум. Период полураспада берклиума-249 – меньше года, и материал для эксперимента нужно было доставить из США в Подмосковье как можно скорее. Образец, защищённый несколькими слоями бетона (типичный способ защитить окружающую среду от радиации), прилетел в Москву, но из-за сложностей на таможне его не пропустили через границу, и за несколько следующих дней образец совершил несколько трансантлантических перелётов, пока его, наконец, не пропустили через российсскую границу. К счастью, берклиум попал в Дубну вовремя, и эксперимент по синтезу теннессина состоялся.
Период полураспада берклиума-249 – меньше года, и материал для эксперимента нужно было доставить из США в Подмосковье как можно скорее. Образец, защищённый несколькими слоями бетона (типичный способ защитить окружающую среду от радиации), прилетел в Москву, но из-за сложностей на таможне его не пропустили через границу, и за несколько следующих дней образец совершил несколько трансантлантических перелётов, пока его, наконец, не пропустили через российсскую границу. К счастью, берклиум попал в Дубну вовремя, и эксперимент по синтезу теннессина состоялся.
Четвёртый элемент назван в честь Юрия Цолаковича Оганесяна – академика РАН, профессора ядерной физики и научного руководителя уже упоминавшейся Лаборатории ядерных реакций им. Г.Н. Флёрова в Объединённом институте ядерных исследований в Дубне. Это второй случай в истории, когда химический элемент назван в честь всё ещё живущего исследователя – таким образом IUPAC отметил вклад Юрия Цолаковича в физику сверхтяжёлых ядер и в том числе в экспериментальное подтверждение существования острова стабильности.
Юрий Цолакович разработал теорию «холодного слияния», и под его руководством были впервые синтезированы элементы с 100-го по 108-й, а потом и со 113-го по 118-й. При его участии было спроектировано и построено несколько уникальных ускорителей тяжёлых ионов, и во многом благодаря ему ОИЯИ начал активно сотрудничать с другими исследовательскими центрами ядерной физики по всему миру.
Существование оганесона предсказывал в 1922 году ещё Нильс Бор, один из отцов атомной физики и квантовой механики, но открыли новый элемент только в 2002 году. Это самый тяжёлый химический элемент с периодом полураспада, равным приблизительно одной миллисекунде. Окончание «-он» в названии указывает на принадлежность оганесона к группе благородных газов, однако сам он, согласно расчётам – вовсе не газ, а твёрдое вещество. Причиной тому служат релятивистские квантово-химические эффекты и спин-орбитальное взаимодействие. Предполагаемая температура кипения оганесона равна 80°С. Более того, оганесон, скорее всего, весьма активен химически, поскольку энергия связи электронов внешней оболочки с ядром не очень велика: сказывается размер атома.
Более того, оганесон, скорее всего, весьма активен химически, поскольку энергия связи электронов внешней оболочки с ядром не очень велика: сказывается размер атома.
Хотя заполнение периодической таблицы Менделеева является фундаментальной задачей, у этих исследований есть важные прикладные «последствия». Например, благодаря развитию ускорителей и лучшему пониманию ядерной физики возможны такие методы лечения рака, как радиотерапия. Впрочем, прагматика прагматикой, а пока мы просто поздравляем физиков из лаборатории ядерных реакций им. Г.Н. Флёрова и Юрия Цолаковича Оганесяна с тем, что их выдающиеся достижения помогли обновить таблицу Менделеева!
Менделеев и его система – спецпроект Тюменской линии
13:16 31 декабря 2019 Создание “Долины Менделеева” в России начнется в 2020 году
Разработка отечественных технологий и новых продуктов в области малотоннажной химии, агрохимии, тонком органическом синтезе, фармацевтике, радиохимии, нефтехимии, а также подготовка специалистов по …
16:11 01 октября 2019 Дмитрий Менделеев в Тобольске теперь есть и на фасаде здания
Два стрит-арт объекта на тему 150-летия Периодической таблицы Менделеева появились в Тобольске, сообщает городская администрация. Художники украсили фасады тобольского многопрофильного техникума на …
Художники украсили фасады тобольского многопрофильного техникума на …
09:26 30 сентября 2019 Более шестидесяти тюменских нефтяных месторождений содержат промышленные запасы серы
Сера (sulfur) S, химический элемент VI группы периодической системы Менделеева. Атомный номер 16. Атомная масса 32,06. Сера в самородном состоянии, а также в виде сернистых соединений известна с …
08:47 20 сентября 2019 Тюменцы смогут сделать батарейки из лимона на фестивале «Nauka 0+»
Работающие батарейки из лимона смогут создать на интерактивной площадке посетители IX Всероссийского фестиваля науки «Nauka 0+», который откроется в тюменском технопарке (ул. Республики, …
10:59 19 сентября 2019 И в коллекцию, и в буровой раствор пригодны уральские бариты
Барий (baryum), Вa, химический элемент ii группы периодической системы Менделеева. Атомный номер 56. Атомная масса 137,34. Серебристо-белый металл.
Одно из природных соединений бария (Baryum), а …
Атомный номер 56. Атомная масса 137,34. Серебристо-белый металл.
Одно из природных соединений бария (Baryum), а …
09:42 19 сентября 2019 Граффити к 150-летию таблицы Дмитрия Менделеева создадут в Тобольске
Граффити к 150-летию периодической таблицы Дмитрия Менделеева украсят фасады двух зданий Тобольска, сообщает администрация города Авторами сюжетов будущих настенных картин стали тоболяки – …
09:12 12 сентября 2019 Тюменские геологи нашли марганцевые руды на Полярном Урале
Марганец ( manganum), Mn, химический элемент VII группы периодической системы Менделеева. Атомный номер 25. Атомная масса 54,9380. Тяжелый серебристо-белый металл. O соединении марганца, о его …
15:49 10 сентября 2019 Западно-Сибирский научно-образовательный центр может прирасти Тобольской научной станцией
Депутат Тюменской областной думы Юрий Конев предлагает включить Тобольскую научную станцию Уральского отделения Российской академии наук в будущий Западно-Сибирский научно-образовательный центр. С …
С …
16:54 02 сентября 2019 Горное фосфатное сырье является главным источником производства фосфорных удобрений
Фосфор (phosphorus), Р, химический элемент V группы периодической системы Менделеева. Атомный номер 15. Атомная масса 30,97376. Неметалл. Обычно датой открытия фосфора считается 1669 год, однако …
17:27 20 августа 2019 На один из юбилеев Менделееву подарили весы, изготовленные из чистого алюминия
Алюминий (aluminium), Аl, химический элемент III группы периодической системы Менделеева. Атомный номер 13. Атомная масса 26,9815. Серебристо-белый легкий металл. Вяжущие вещества, содержащие …
16:10 13 августа 2019 В Тюменской области большие запасы уникальной горной породы известняка
Кальций (calcium), Сa, химический элемент II группы периодической системы Менделеева. Атомный номер 20. Атомная масса 40,08. Серебряно-белый легкий металл.
Название кальций произошло от латинского …
Атомная масса 40,08. Серебряно-белый легкий металл.
Название кальций произошло от латинского …
16:22 05 августа 2019 На йодобромных источниках Тюменской области построены санатории республиканского значения
На йодобромных источниках Тюменской области построены санатории республиканского значения. Бром (bromum), Br, химический элемент VII группы периодической системы Менделеева, относится к галогенам. …
Главная новость
Актуальные темы
- 15:56 04.10.2022Мобилизованные из трех регионов проходят боевое слаживание под Тюменью
- 13:02 04.10.202220 незрячих тюменцев учатся готовить в школе тифлокулинарии
- 12:06 04.10.2022Школа на 1 тыс. 200 мест на улице Арктической в Тюмени откроется 1 сентября 2023 года
- 09:32 04.10.2022В Тобольске пройдет Первый национальный форум преподавателей истории
Все новости
Видеоновость
Тюмень впервые приняла Западно-Сибирский тур “Романсиады” Все видеоСпецпроекты
Архив новостей
Таблица Менделеева пополнилась четырьмя новыми элементами
9 марта, 11:00 0 18104
Шесть важных правил для пользователя в эпоху интернет-хаоса
9 марта, 09:50 8 10177
ЦБ ввел временный порядок обращения наличной валюты
9 марта, 09:30 38 9020
Coca-Cola и PepsiCo приостанавливают бизнес в России
9 марта, 09:09 11 8478
Данные по коронавирусу в Якутии на 9 марта
9 марта, 08:00 112 20142
США без российской нефти, Россия без McDonald’s и чемпионата мира: пять событий в стране и мире, которые произошли, пока в Якутске была ночь
9 марта, 00:00 212 35649
Ситуация в Украине и санкции против России. Главные события 8 марта на 24:00. Онлайн
Главные события 8 марта на 24:00. Онлайн
8 марта, 21:00 53 15519
Организаторы заявили, что концерт Валерия Леонтьева в Якутске не отменяется. Ранее СМИ написали, что певец улетел в США
8 марта, 20:00 24 16825
Женщины в форме. Сотрудницы УФСИН — о том, почему нельзя испытывать жалость к осужденным, как найти подход к каждому из них и в чем они находят вдохновение
8 марта, 18:00 11 7047
Прогноз погоды в Якутске на среду, 9 марта
8 марта, 17:00 27 9670
Как бухгалтер стала визажистом. Нинель Данилова — о своем пути к творчеству, фотопроектах, опубликованных в модных журналах, и секретах ухода за кожей лица
8 марта, 14:45 127 45501
Умерла якутская певица Ирина Елизарова
8 марта, 13:30 33 8754
Был ли в Якутии матриархат? Ученые СВФУ — о роли женщин в якутском традиционном обществе и эмансипации
8 марта, 12:34 117 15511
YouTube удалил основной и резервный каналы «Соловьев Live»
8 марта, 12:30 61 19548
ВидеоАйсен Николаев подарил на 8 Марта своей жене и дочерям ювелирное украшение, сделанное своими руками
8 марта, 10:58 11 6545
С 8 Марта! Видеопоздравления от известных мужчин Якутии с Международным женским днем
8 марта, 10:40 17 5399
Данные по коронавирусу в Якутии на 8 марта. Количество новых случаев продолжает снижаться
Количество новых случаев продолжает снижаться
8 марта, 10:30 61 21080
Путин: с 1 апреля устанавливаются новые выплаты на детей 8–16 лет для семей с невысокими доходами
8 марта, 09:00 56 9171
Переговоры без результата, РПЛ без легионеров, «ВКонтакте» без иностранцев: пять событий в стране и мире, которые произошли, пока в Якутии была ночь
7 марта, 23:59 148 28159
Ситуация в Украине и санкции против России. Главные события 7 марта на 24:00. Онлайн
7 марта, 21:58 10 6532
7 марта: задержание ФСБшника, в DNS заявили, что повышения цен не будет, репортаж из единственного пункта техосмотра — итоги дня за одну минуту
- Сегодня
- Неделя
- Месяц
Происшествия
Умерла якутская певица Ирина Елизарова
Сегодня, 8 марта, скончалась известная певица Ирина Елизарова.
8 марта, 14:45 127 45501
Политика
Ситуация в Украине и санкции против России. Главные события 8 марта на 24:00. Онлайн
Редакция News.Ykt.Ru продолжает онлайн-хронику событий, связанных с военной операцией в Украине и введением санкций против России.
9 марта, 00:00 212 35649
Мир
США без российской нефти, Россия без McDonald’s и чемпионата мира: пять событий в стране и мире, которые произошли, пока в Якутске была ночь
Этой ночью редакция News.Ykt.Ru следила за российскими и мировыми новостями — для нашего традиционного утреннего дайджеста мы отобрали пять важных и примечательных событий.
9 марта, 08:00 112 20142
Общество
Айсен Николаев подарил на 8 Марта своей жене и дочерям ювелирное украшение, сделанное своими руками
Глава Якутии Айсен Николаев рассказал в соцсетях, что на 8 Марта решил подарить жене и дочерям кулон, сделанный своими руками.
8 марта, 12:30 61 19548
Мир
Шесть важных правил для пользователя в эпоху интернет-хаоса
В последние недели ситуация с интернетом в России существенно осложнилась: заблокированы Facebook и сайты многих СМИ, случаются перебои с доступом к тем или иным ресурсам, у многих провайдеров снизилась скорость загрузки, публикуется много фейков и т.д. Давайте разберемся, как действовать в этой ситуации обычному пользователю.
9 марта, 11:00 0 18104
Общество
Водительские права некоторых водителей стали недействительны на сайте ГИБДД. В ведомстве призвали не волноваться
2 марта в адрес редакции News.Ykt.Ru поступило несколько сообщений от взволнованных читателей. Они проверили свои водительские удостоверения на официальном сайте Госавтоинспекции гибдд.рф и обнаружили, что у некоторых статус прав недействителен. В основном это коснулось водителей, которые получили удостоверения до 2020 года, с более поздними сроками проблем не наблюдалось.
В основном это коснулось водителей, которые получили удостоверения до 2020 года, с более поздними сроками проблем не наблюдалось.
2 марта, 12:11 16 188909
Якутия
«Ситуация не была такой критической даже в 1998 году». Предприниматели Якутска — о завозе продуктов и товаров первой необходимости
Как могут отразиться последние события в стране на ценах на продукты и продовольственные товары в Якутии, для News.Ykt.Ru рассказывает журналист Виталий Обедин.
2 марта, 20:56 219 51619
Происшествия
Умерла якутская певица Ирина Елизарова
Сегодня, 8 марта, скончалась известная певица Ирина Елизарова.
8 марта, 14:45 127 45501
Политика
Ситуация в Украине и санкции против России. Главные события 3 марта. Онлайн
Главные события 3 марта. Онлайн
Редакция News.Ykt.Ru продолжает онлайн-хронику событий, связанных с военной операцией в Украине и введением санкций против России.
3 марта, 21:10 152 43273
Политика
Ситуация в Украине и санкции против России. Главные события 2 марта. Онлайн
Редакция News.Ykt.Ru продолжает онлайн-хронику событий, связанных с военной операцией в Украине и введением санкций против России.
2 марта, 21:00 208 40280
Общество
Водительские права некоторых водителей стали недействительны на сайте ГИБДД. В ведомстве призвали не волноваться
2 марта в адрес редакции News.Ykt.Ru поступило несколько сообщений от взволнованных читателей. Они проверили свои водительские удостоверения на официальном сайте Госавтоинспекции гибдд.рф и обнаружили, что у некоторых статус прав недействителен. В основном это коснулось водителей, которые получили удостоверения до 2020 года, с более поздними сроками проблем не наблюдалось.
В основном это коснулось водителей, которые получили удостоверения до 2020 года, с более поздними сроками проблем не наблюдалось.
2 марта, 12:11 16 188909
Криминал
«Три миллиона — и не заводим дело». История врача, у которого вымогали деньги Сусанна Рожина и ее сообщники
В деле Сусанны Рожиной о вымогательстве появляются новые потерпевшие. News.Ykt.Ru рассказывает историю одного из них — врача, которому Сусанна Рожина и ее сообщники угрожали закрытием клиники.
14 февраля, 13:00 501 59845
Мир
Военная операция на Украине. Главные события. Онлайн
Редакция News.Ykt.Ru ведет онлайн-хронику событий, связанных с военной операцией на Украине.
24 февраля, 15:48 255 57168
Общество
Стали известны подробности задержания блогера Сусанны Рожиной
Блогера и журналиста Сусанну Рожину задержали днем 9 февраля в гостинице «Азимут» (бывшая «Полярная звезда»), сообщила News. Ykt.Ru директор агентства недвижимости РЦНиК Гульнара Уварова.
Ykt.Ru директор агентства недвижимости РЦНиК Гульнара Уварова.
9 февраля, 19:36 465 54382
Общество
Черный четверг. Эксперт Владимир Данилов рассказал, чего ждать россиянам после обвала российского рынка акций и падения курса рубля
На фоне новостей о боевых действиях на границе с Украиной обвалились индексы российских компаний на бирже и курс рубля по отношению к иностранным валютам. Чем это может грозить, редакция News.Ykt.Ru узнала у директора представительства банка МФК в Республике Саха (Якутия) Владимира Данилова.
24 февраля, 19:00 95 52845
Четыре новых химических элемента официально добавлены в Периодическую таблицу Менделеева. Элементы с атомными номерами 113, 115, 117 и 118 верифицированы Международным союзом теоретической и прикладной химии (IUPAC).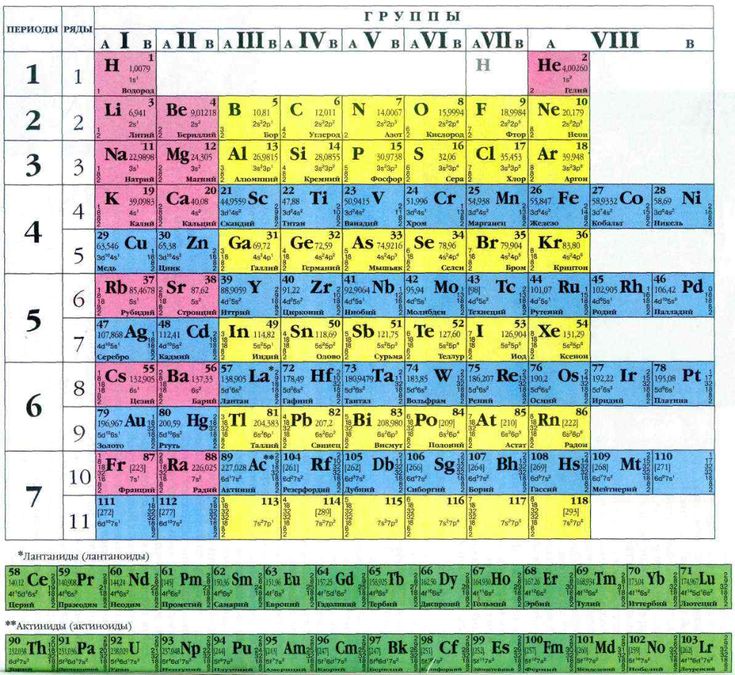
Честь открытия 115-го, 117-го и 118-го элементов присуждена команде российских и американских ученых из Объединенного института ядерных исследований в Дубне, Ливерморской национальной лаборатории в Калифорнии и Окриджской национальной лаборатории в Теннесси.
Открывателями 113-го элемента признаны ученые из японского Института естественных наук (RIKEN). В честь этого элемент получил название японий. Право придумать названия остальным новым элементам принадлежит их первооткрывателям, на что отводится пять месяцев, после чего их официально утвердит совет IUPAC.
Все четыре новых элемента были синтезированы искусственно. В природе, как правило, наблюдаются химические элементы с атомным номером (количеством протонов в ядре) не выше 92 (уран). Элементы с количеством протонов от 93 до 100 можно получить в реакторах, выше 100 — на ускорителях частиц.
Последний раз периодическая таблица расширялась в 2011 году, когда были добавлены 114-й и 116-й элементы, названные флеровием и ливерморием.
Источник: Lenta.Ru
Нашли ошибку? Выделите ее и нажмите Ctrl+Enter
Рейтинг статьи: 14
Женщины в форме. Сотрудницы УФСИН — о том, почему нельзя испытывать жалость к осужденным, как найти подход к каждому из них и в чем они находят вдохновение
Как бухгалтер стала визажистом. Нинель Данилова — о своем пути к творчеству, фотопроектах, опубликованных в модных журналах, и секретах ухода за кожей лица
Был ли в Якутии матриархат? Ученые СВФУ — о роли женщин в якутском традиционном обществе и эмансипации
С 8 Марта! Видеопоздравления от известных мужчин Якутии с Международным женским днем
Переговоры без результата, РПЛ без легионеров, «ВКонтакте» без иностранцев: пять событий в стране и мире, которые произошли, пока в Якутии была ночь
Какие подарки выбрать на 8 марта в Якутске: головоломка в честь Международного женского дня
16 баз отдыха вблизи Якутска, где можно отдохнуть и весело провести время
Вышло расписание Смарта на март: впереди тематический месяц
Видео
Полет над Чочур Мураном — видео в блоге Yakut-10
20 3105
Политика
В постпредство Якутии обращаются родственники ребят, задержанных во время несанкционированных акций
86 20120
Якутия
Фотофакт: машина заехала прямо на территорию сквера возле Талого озера
33 11315
Якутия
«Я видела домового». Якутские мистические истории в блоге Сизого Носика
Якутские мистические истории в блоге Сизого Носика
13 4650
Якутия
Истории в багете: «Женщина новой Якутии»
1 2234
Якутия
День рождения отмечает мастер якутской национальной кухни Иннокентий Тарбахов
12 8147
Общество
Цены на Крестьянском рынке перед 8 Марта — в блоге Николая Барамыгина
42 7854
Якутия
Не женская работа: с какими трудностями в работе сталкиваются девушки-геологи?
8 7445
Нет опыта работы? Подходящие для вас вакансии здесь
Культура
Коллекция якутского дизайнера «Хранительница вечной мерзлоты»
8 4528
Новым элементам таблицы Менделеева дали названия
Технологии
Новые элементы таблицы Менделеева назвали «флеровий» (Fl) и «ливерморий» (Lv) / Агентство «Фото ИТАР-ТАСС»
Новые элементы таблицы Менделеева получат сегодня в Москве официальные названия. Церемония пройдет в Центральном доме ученых РАН.
Церемония пройдет в Центральном доме ученых РАН.
В 2000-х годах физики из Дубны (Московская область) совместно с американскими коллегами из Ливерморской национальной лаборатории получили 114-й и 116-й элементы.
Элементы будут названы в честь лабораторий, где они были созданы. 114-й элемент получил название “флеровий” – в честь Лаборатории ядерных реакций им. Г.Н. Флерова Объединенного института ядерных исследований, где был синтезирован данный элемент. 116-й элемент назвали “ливерморий” – в честь ученых из Ливерморской национальной лаборатории, которые его открыли.
Международный союз теоретической и прикладной химии обозначил новые элементы как Fl и Lv.
Мы позвонили в Объединенный институт ядерных исследований.
– Никого нет, – сообщили пресс-секретарь инстиута Борис Старченко. – Все уехали в Академию Наук и вернутся только завтра.
– Все уехали в Академию Наук и вернутся только завтра.
– Скажите, а такая радость в институте впервые?
– Нет, такая радость у нас не впервые. Пятнадцать лет назад 105-му элементу системы элементов Д.И. Менделеева присвоили название “Дубний”. Раньше этот элемент назвался Нильсборий, но его переименовали, потому что именно наши ученые сумели получить элемент на нашем ускорителе.
Борис Михайлович очень спешил на торжественную церемонию, но прежде чем положить трубку, он успел сказать, что помимо 105, 114 и 116 элементов ученые из Дубны впервые в мире синтезировали новые, долгоживущие сверхтяжелые элементы с порядковыми номерами 113, 115,117 и 118.
МНЕНИЕ СПЕЦИАЛИСТА
Так ли важно это событие для российской науки? Не фикция ли это, вроде фильтров Петрика и прочих псевдодостижений нашей научной мысли? Об этом мы спросили у Евгения Гудилина, заместителя декана факультета наук о материалах МГУ.
– Что вы, это не фикция, а большое событие в российской науке. Обнаружение этих элементов и присвоение им имен – это вопрос престижа. Вы только представьте себе. Эти имена впечатываются в таблицу Менделеева. Навсегда. Их будут в школе изучать.
– Скажите, а почему имена присвоили лишь 114 и 116 элементу? Куда пропал 115-й?
– На самом деле, учеными из Дубны получены и 115, и 117, и еще 113 и 118 элементы. Им тоже когда-нибудь присвоят имена. Проблема в том, что процедура присвоения имен – очень долгая. Она длится годами. По правилам, прежде, чем признать нового «члена» таблицы Менделеева, его должны открыть в двух других лабораториях мира.
– Это очень сложный процесс?
– Очень. В природе существуют только первые 92 элемента системы Менделеева. Остальные получают искусственно в ядерных реакциях. Например, ускоритель в Дубне разгонял атомы до скоростей, близких к скорости света. После столкновения ядра слипались в более крупные образования. Эти образования живут они очень недолго. Несколько долей секунды. За это время удается получить кое-какие сведения об их свойствах.
Эти образования живут они очень недолго. Несколько долей секунды. За это время удается получить кое-какие сведения об их свойствах.
– Скажите, а зачем выделять новые элементы? Моя учительница по химии говорила о том, что, в принципе, все свойства элементов давно предсказаны физиками и потому совершенно необязательно получать их “вживую”…
– Ну, скажем так, учительница утрировала. Рассчитать химические свойства элементов можно лишь с невысокой точностью. Молекулы с тяжелыми ядрами плохо поддаются описанию.
– Но если элемент существует доли секунды – как можно успеть описать его свойства за это время?
– Этого времени бывает достаточно, чтобы доказать, что элемент похож на тот или иной аналог.
– Скажите, а существует ли предел таблицы Менделеева или ее можно расширять до бесконечности?
– Предел есть.Существует такое красивое понятие “остров стабильности”. Этот термин вывели наши ученые из Дубны. Элементы, находящиеся в этом “острове” обладают сравнительно долгим временем жизни. За те несколько долей секунды, которые они живут, можно успеть “опознать” и охарактеризовать их. Сейчас ученые получили практически все элементы из острова стабильности. Но есть подозрения, что существует еще один остров стабильности. Он расположен дальше 164 номера…
За те несколько долей секунды, которые они живут, можно успеть “опознать” и охарактеризовать их. Сейчас ученые получили практически все элементы из острова стабильности. Но есть подозрения, что существует еще один остров стабильности. Он расположен дальше 164 номера…
КСТАТИ
В Периодической системе Менделеева имеется ряд элементов, названных в честь российских ученых.
Рутений, элемент с порядковым номером 44. Назван в честь России. Ruthenia — латинское название Руси. Открыт профессором Казанского университета Карлом Клаусом в 1844 году. Клаус выделил его из уральской платиновой руды.
Дубний, элемент с порядковым номером 105, переименовывали трижды. Впервые его выделили в 1967 году ученые из Дубны. Двумя месяцами позже элемент открыла Радиационная лаборатория имени Эрнста Лоуренса в Беркли (США). Ученые из Дубны назвали элемент Нильсборием в честь Нильса Бора. Американские коллеги предложили имя Ганий в честь Отто Гана. Под именем “ганий” 105 элемент фигурирует в американской системе Менделеева. В 1997 году Международное общество чистой и прикладной химии устранила расхождения в названии элементов. 105-й элемент стал дубнием в честь Дубны, места своего происхождения.
Под именем “ганий” 105 элемент фигурирует в американской системе Менделеева. В 1997 году Международное общество чистой и прикладной химии устранила расхождения в названии элементов. 105-й элемент стал дубнием в честь Дубны, места своего происхождения.
Курчатовий. Этим именем должен был бы назваться 104 элемент системы. Советские химики получили его в 1964 году и предложили имя в честь великого Игоря Васильевича Курчатова. Однако международный союз теоретической и прикладной химии название отклонил. Американцев не устроило, что элемент назван в честь создателя атомной бомбы. Теперь 104 элемент в системе Менделеева носит название “Резерфордий”.
Менделеевий, 101-й элемент системы, выделили американцы в 1955 году. По правилам, право дать имя новому элементу принадлежит тем, кто его открыл. В знак признания заслуг великого Менделеева, ученые предложили назвать элемент Менделеевием. Почти десять лет синтез этого элемента считался вершиной экспериментального мастерства.
Начиная с 1960 годов между Университетом Калифорнии (США) и институтом в Дубне ведутся споры по поводу наименований элементов, следующих в таблице Менделеева за фермием, который занимает номер 100. Как следует из отечественных научно-популярных изданий по химии, “в приоритетном конфликте наших и американских ученых по поводу открытия элементов №102…105 до сих пор все еще нет компетентного и независимого третейского судьи. Вопрос об окончательном и справедливом наименовании самых тяжелых химических элементов пока остается нерешенным”.
Список элементов периодической таблицы
| № | * | А. вес | Имя | Сим. | М.П. (°С) | лет назад (°С) | Плотность* (г/см 3 ) | Земля (%)* | Группа* | Электрон конфиг. | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1.008 | Hydrogen | H | -259 | -253 | 0.09 | 0.14 | 1 | 1s 1 | |||||||
| 2 | 4.003 | Helium | He | -272 | -269 | 0.18 | 18 | 1s 2 | ||||||||
| 3 | 6.941 | Lithium | Li | 180 | 1,347 | 0.53 | 1 | [He] 2s 1 | ||||||||
| 4 | 9.012 | Beryllium | Be | 1,278 | 2,970 | 1.85 | 2 | [He] 2s 2 | ||||||||
| 5 | 10.811 | Boron | B | 2,300 | 2,550 | 2.34 | 13 | [He] 2s 2 2p 1 | ||||||||
| 6 | 12. 011 011 | Carbon | C | 3,500 | 4,827 | 2.26 | 0.09 | 14 | [He] 2s 2 2p 2 | |||||||
| 7 | 14.007 | Nitrogen | N | -210 | -196 | 1.25 | 15 | [He] 2s 2 2p 3 | ||||||||
| 8 | 15.999 | Oxygen | O | -218 | -183 | 1.43 | 46.71 | 16 | [He] 2s 2 2p 4 | |||||||
| 9 | 18.998 | Fluorine | F | -220 | -188 | 1.70 | 0.03 | 17 | [He] 2s 2 2p 5 | |||||||
| 10 | 20.180 | Neon | Ne | -249 | -246 | 0.90 | 18 | [He] 2s 2 2p 6 | ||||||||
| 11 | 22.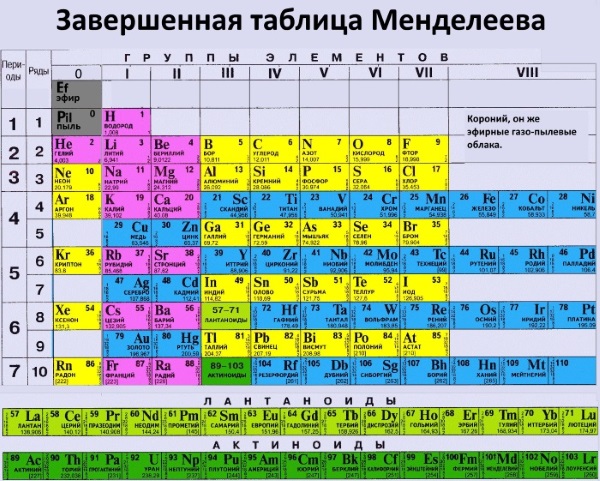 990 990 | Sodium | Na | 98 | 883 | 0.97 | 2.75 | 1 | [Ne] 3s 1 | |||||||
| 12 | 24.305 | Magnesium | Mg | 639 | 1,090 | 1.74 | 2.08 | 2 | [Ne] 3s 2 | |||||||
| 13 | 26.982 | Aluminum | Al | 660 | 2,467 | 2.70 | 8.07 | 13 | [Ne] 3s 2 3p 1 | |||||||
| 14 | 28.086 | Silicon | Si | 1,410 | 2,355 | 2.33 | 27.69 | 14 | [Ne] 3s 2 3p 2 | |||||||
| 15 | 30.974 | Phosphorus | P | 44 | 280 | 1.82 | 0.13 | 15 | [Ne] 3s 2 3p 3 | |||||||
| 16 | 32. 065 065 | Sulfur | S | 113 | 445 | 2.07 | 0.05 | 16 | [Ne] 3s 2 3p 4 | |||||||
| 17 | 35.453 | Chlorine | Cl | -101 | -35 | 3.21 | 0.05 | 17 | [Ne] 3s 2 3p 5 | |||||||
| 18 | 39.948 | Argon | Ar | -189 | -186 | 1.78 | 18 | [Ne] 3s 2 3p 6 | ||||||||
| 19 | 39.098 | Potassium | K | 64 | 774 | 0.86 | 2.58 | 1 | [Ar] 4s 1 | |||||||
| 20 | 40.078 | Calcium | Ca | 839 | 1,484 | 1.55 | 3.65 | 2 | [Ar] 4s 2 | |||||||
| 21 | 44. 956 956 | Scandium | Sc | 1,539 | 2,832 | 2.99 | 3 | [Ar] 3d 1 4s 2 | ||||||||
| 22 | 47.867 | Titanium | Ti | 1,660 | 3,287 | 4.54 | 0.62 | 4 | [Ar] 3d 2 4s 2 | |||||||
| 23 | 50.942 | Vanadium | V | 1,890 | 3,380 | 6.11 | 5 | [Ar] 3d 3 4s 2 | ||||||||
| 24 | 51.996 | Chromium | Cr | 1,857 | 2,672 | 7.19 | 0.04 | 6 | [Ar ] 3d 5 4s 1 | |||||||
| 25 | 54.938 | Manganese | Mn | 1,245 | 1,962 | 7.43 | 0. 09 09 | 7 | [Ar] 3d 5 4s 2 | |||||||
| 26 | 55.845 | Iron | Fe | 1,535 | 2,750 | 7.87 | 5.05 | 8 | [Ar] 3d 6 4s 2 | |||||||
| 27 | 58.933 | Cobalt | Co | 1,495 | 2,870 | 8.90 | 9 | [Ar] 3d 7 4s 2 | ||||||||
| 28 | 58.693 | Nickel | Ni | 1,453 | 2,732 | 8.90 | 0.02 | 10 | [Ar] 3d 8 4s 2 | |||||||
| 29 | 63.546 | Copper | Cu | 1,083 | 2,567 | 8.96 | 11 | [Ar] 3d 10 4s 1 | ||||||||
| 30 | 65. 390 390 | Zinc | Zn | 420 | 907 | 7.13 | 12 | [Ar] 3d 10 4s 2 | ||||||||
| 31 | 69.723 | Gallium | Ga | 30 | 2,403 | 5.91 | 13 | [Ar] 3d 10 4s 2 4p 1 | ||||||||
| 32 | 72.640 | Germanium | Ge | 937 | 2,830 | 5.32 | 14 | [Ar] 3d 10 4s 2 4p 2 | ||||||||
| 33 | 74.922 | Arsenic | As | 81 | 613 | 5.72 | 15 | [Ar] 3d 10 4s 2 4p 3 | ||||||||
| 34 | 78.960 | Selenium | Se | 217 | 685 | 4. 79 79 | 16 | [Ar] 3d 10 4s 2 4p 4 | ||||||||
| 35 | 79.904 | Bromine | Br | -7 | 59 | 3.12 | 17 | [AR] 3D 10 4S 2 4P | ||||||||
| 36 | 83,8009142 | 36 | 83.80092 | KRY.0042 | 3.75 | 18 | [Ar] 3d 10 4s 2 4p 6 | |||||||||
| 37 | 85.468 | Rubidium | Rb | 39 | 688 | 1.63 | 1 | [Kr] 5s 1 | ||||||||
| 38 | 87.620 | Strontium | Sr | 769 | 1,384 | 2.54 | 2 | [Kr] 5s 2 | ||||||||
| 39 | 88.906 | Yttrium | Y | 1,523 | 3,337 | 4. 47 47 | 3 | [Kr] 4d 1 5s 2 | ||||||||
| 40 | 91.224 | Zirconium | Zr | 1,852 | 4,377 | 6.51 | 0.03 | 4 | [Kr] 4d 2 5s 2 | |||||||
| 41 | 92.906 | Niobium | Nb | 2,468 | 4,927 | 8.57 | 5 | [Kr] 4d 4 5s 1 | ||||||||
| 42 | 95.940 | Molybdenum | Mo | 2,617 | 4,612 | 10.22 | 6 | [Kr] 4d 5 5s 1 | ||||||||
| 43 | * | 98.000 | Technetium | Tc | 2,200 | 4,877 | 11.50 | 7 | [Kr] 4d 5 5s 2 | |||||||
| 44 | 101. 070 070 | Ruthenium | Ru | 2,250 | 3,900 | 12.37 | 8 | [Kr] 4d 7 5s 1 | ||||||||
| 45 | 102.906 | Rhodium | Rh | 1,966 | 3,727 | 12.41 | 9 | [Kr] 4d 8 5s 1 | ||||||||
| 46 | 106.420 | Palladium | Pd | 1,552 | 2,927 | 12.02 | 10 | [Kr] 4d 10 | ||||||||
| 47 | 107.868 | Silver | Ag | 962 | 2,212 | 10.50 | 11 | [Kr] 4d 10 5s 1 | ||||||||
| 48 | 112.411 | Cadmium | Cd | 321 | 765 | 8.65 | 12 | [Kr] 4d 10 5s 2 | ||||||||
| 49 | 114. 818 818 | Indium | In | 157 | 2,000 | 7.31 | 13 | [Kr] 4d 10 5s 2 5p 1 | ||||||||
| 50 | 118.710 | Tin | Sn | 232 | 2,270 | 7.31 | 14 | [Kr] 4d 10 5s 2 5p 2 | ||||||||
| 51 | 121.760 | Antimony | Sb | 630 | 1,750 | 6.68 | 15 | [Kr] 4d 10 5s 2 5p 3 | ||||||||
| 52 | 127.600 | Tellurium | Te | 449 | 990 | 6.24 | 16 | [Kr] 4d 10 5s 2 5p 4 | ||||||||
| 53 | 126.905 | Iodine | I | 114 | 184 | 4. 93 93 | 17 | [Kr] 4d 10 5s 2 5p 5 | ||||||||
| 54 | 131.293 | Xenon | Xe | -112 | -108 | 5.90 | 18 | [Kr] 4d 10 5s 2 5p 6 | ||||||||
| 55 | 132.906 | Cesium | Cs | 29 | 678 | 1.87 | 1 | [Xe] 6s 1 | ||||||||
| 56 | 137.327 | Barium | Ba | 725 | 1,140 | 3.59 | 0.05 | 2 | [Xe] 6s 2 | |||||||
| 57 | 138.906 | Lanthanum | La | 920 | 3,469 | 6.15 | 3 | [Xe] 5d 1 6s 2 | ||||||||
| 58 | 140. 116 116 | Cerium | Ce | 795 | 3,257 | 6.77 | 101 | [Xe] 4f 1 5d 1 6s 2 | ||||||||
| 59 | 140.908 | Praseodymium | Pr | 935 | 3,127 | 6.77 | 101 | [Xe] 4f 3 6s 2 | ||||||||
| 60 | 144.240 | Neodymium | Nd | 1,010 | 3,127 | 7.01 | 101 | [Xe] 4f 4 6s 2 | ||||||||
| 61 | * | 145.000 | Promethium | Pm | 1,100 | 3,000 | 7.30 | 101 | [Xe] 4f 5 6s 2 | |||||||
| 62 | 150.360 | Samarium | Sm | 1,072 | 1,900 | 7. 52 52 | 101 | [Xe] 4f 6 6s 2 | ||||||||
| 63 | 151.964 | Europium | Eu | 822 | 1,597 | 5.24 | 101 | [Xe] 4f 7 6s 2 | ||||||||
| 64 | 157.250 | Gadolinium | Gd | 1,311 | 3,233 | 7.90 | 101 | [Xe] 4f 7 5d 1 6s 2 | ||||||||
| 65 | 158.925 | Terbium | Tb | 1,360 | 3,041 | 8.23 | 101 | [Xe] 4f 9 6s 2 | ||||||||
| 66 | 162.500 | Dysprosium | Dy | 1,412 | 2,562 | 8.55 | 101 | [Xe] 4f 10 6s 2 | ||||||||
| 67 | 164. 930 930 | Holmium | Ho | 1,470 | 2,720 | 8.80 | 101 | [Xe] 4f 11 6s 2 | ||||||||
| 68 | 167.259 | Erbium | Er | 1,522 | 2,510 | 9.07 | 101 | [Xe] 4f 12 6s 2 | ||||||||
| 69 | 168.934 | Thulium | Tm | 1,545 | 1,727 | 9.32 | 101 | [Xe] 4f 13 6s 2 | ||||||||
| 70 | 173.040 | Ytterbium | Yb | 824 | 1,466 | 6.90 | 101 | [Xe] 4f 14 6s 2 | ||||||||
| 71 | 174.967 | Lutetium | Lu | 1,656 | 3,315 | 9.84 | 101 | [Xe] 4f 14 5d 1 6s 2 | ||||||||
| 72 | 178. 490 490 | Hafnium | Hf | 2,150 | 5,400 | 13.31 | 4 | [Xe] 4f 14 5d 2 6s 2 | ||||||||
| 73 | 180.948 | Tantalum | Ta | 2,996 | 5,425 | 16.65 | 5 | [Xe] 4f 14 5d 3 6s 2 | ||||||||
| 74 | 183.840 | Tungsten | W | 3,410 | 5,660 | 19.35 | 6 | [Xe] 4f 14 5d 4 6s 2 | ||||||||
| 75 | 186.207 | Rhenium | Re | 3,180 | 5,627 | 21.04 | 7 | [Xe] 4f 14 5d 5 6s 2 | ||||||||
| 76 | 190.230 | Osmium | Os | 3,045 | 5,027 | 22. 60 60 | 8 | [Xe] 4f 14 5d 6 6s 2 | ||||||||
| 77 | 192.217 | Iridium | Ir | 2,410 | 4,527 | 22.40 | 9 | [Xe] 4f 14 5d 7 6s 2 | ||||||||
| 78 | 195.078 | Platinum | Pt | 1,772 | 3,827 | 21.45 | 10 | [Xe] 4f 14 5d 9 6s 1 | ||||||||
| 79 | 196.967 | Gold | Au | 1,064 | 2,807 | 19.32 | 11 | [Xe] 4f 14 5d 10 6s 1 | ||||||||
| 80 | 200.590 | Mercury | Hg | -39 | 357 | 13.55 | 12 | [Xe] 4f 14 5d 10 6s 2 | ||||||||
| 81 | 204.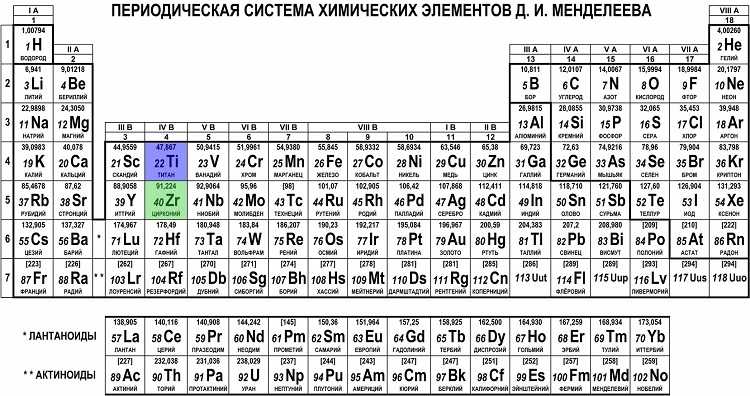 383 383 | Thallium | Tl | 303 | 1,457 | 11.85 | 13 | [Xe] 4f 14 5d 10 6s 2 6p 1 | ||||||||
| 82 | 207.200 | Lead | Pb | 327 | 1,740 | 11.35 | 14 | [Xe] 4f 14 5d 10 6s 2 6p 2 | ||||||||
| 83 | 208.980 | Bismuth | Bi | 271 | 1,560 | 9.75 | 15 | [Xe] 4f 14 5d 10 6s 2 6p 3 | ||||||||
| 84 | * | 209.000 | Polonium | Po | 254 | 962 | 9.30 | 16 | [Xe] 4f 14 5d 10 6s 2 6p 4 | |||||||
| 85 | * | 210.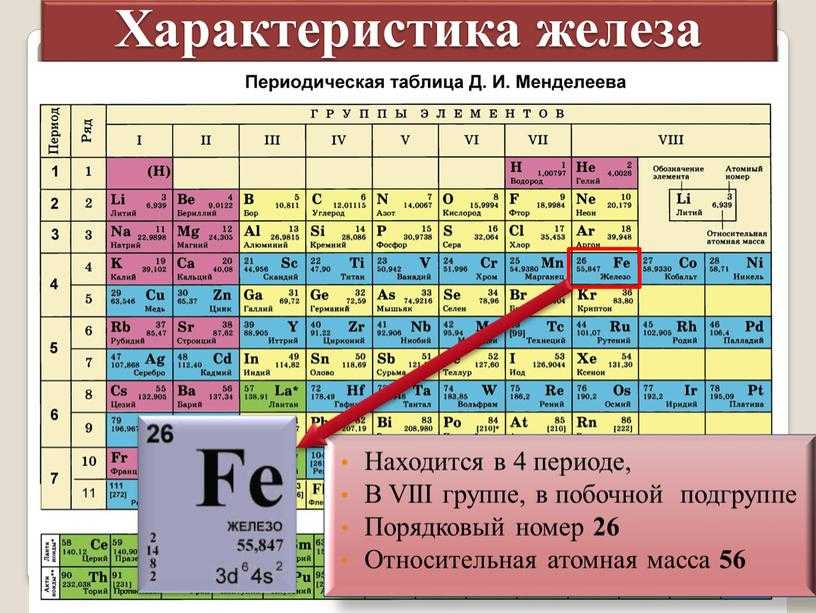 000 000 | Astatine | At | 302 | 337 | 0.00 | 17 | [Xe] 4f 14 5d 10 6s 2 6p 5 | |||||||
| 86 | * | 222.000 | Radon | Rn | -71 | -62 | 9.73 | 18 | [Xe] 4f 14 5d 10 6s 2 6p 6 | |||||||
| 87 | * | 223.000 | Francium | Fr | 27 | 677 | 0.00 | 1 | [Rn] 7s 1 | |||||||
| 88 | * | 226.000 | Radium | Ra | 700 | 1,737 | 5.50 | 2 | [Rn] 7s 2 | |||||||
| 89 | * | 227.000 | Actinium | Ac | 1,050 | 3,200 | 10. 07 07 | 3 | [Rn] 6d 1 7s 2 | |||||||
| 90 | 232.038 | Thorium | Th | 1,750 | 4,790 | 11.72 | 102 | [Rn] 6d 2 7s 2 | ||||||||
| 91 | 231.036 | Protactinium | Pa | 1,568 | 0 | 15.40 | 102 | [Rn] 5f 2 6d 1 7s 2 | ||||||||
| 92 | 238.029 | Uranium | U | 1,132 | 3,818 | 18.95 | 102 | [Rn] 5f 3 6d 1 7s 2 | ||||||||
| 93 | * | 237.000 | Neptunium | Np | 640 | 3,902 | 20.20 | 102 | [Rn] 5f 4 6d 1 7s 2 | |||||||
| 94 | * | 244. 000 000 | Plutonium | Pu | 640 | 3,235 | 19.84 | 102 | [Rn] 5f 6 7s 2 | |||||||
| 95 | * | 243.000 | Americium | 994 | 2,607 | 13,67 | 102 | 13.67 | 13,67 | .0042 | ||||||
| 96 | * | 247.000 | Curium | Cm | 1,340 | 0 | 13.50 | 102 | ||||||||
| 97 | * | 247.000 | Berkelium | Bk | 986 | 0 | 14.78 | 102 | ||||||||
| 98 | * | 251.000 | Californium | Cf | 900 | 0 | 15.10 | 102 | ||||||||
| 99 | * | 252.000 | Einsteinium | Es | 860 | 0 | 0. 00 00 | 102 | ||||||||
| 100 | * | 257.000 | Fermium | Fm | 1,527 | 0 | 0.00 | 102 | ||||||||
| 101 | * | 258.000 | Mendelevium | Md | 0 | 0 | 0.00 | 102 | ||||||||
| 102 | * | 259.000 | Nobelium | No | 827 | 0 | 0.00 | 102 | ||||||||
| 103 | * | 262.000 | Lawrencium | Lr | 1,627 | 0 | 0.00 | 102 | ||||||||
| 104 | * | 261.000 | Rutherfordium | Rf | 0 | 0 | 0.00 | 4 | ||||||||
| 105 | * | 262.000 | Dubnium | Db | 0 | 0 | 0.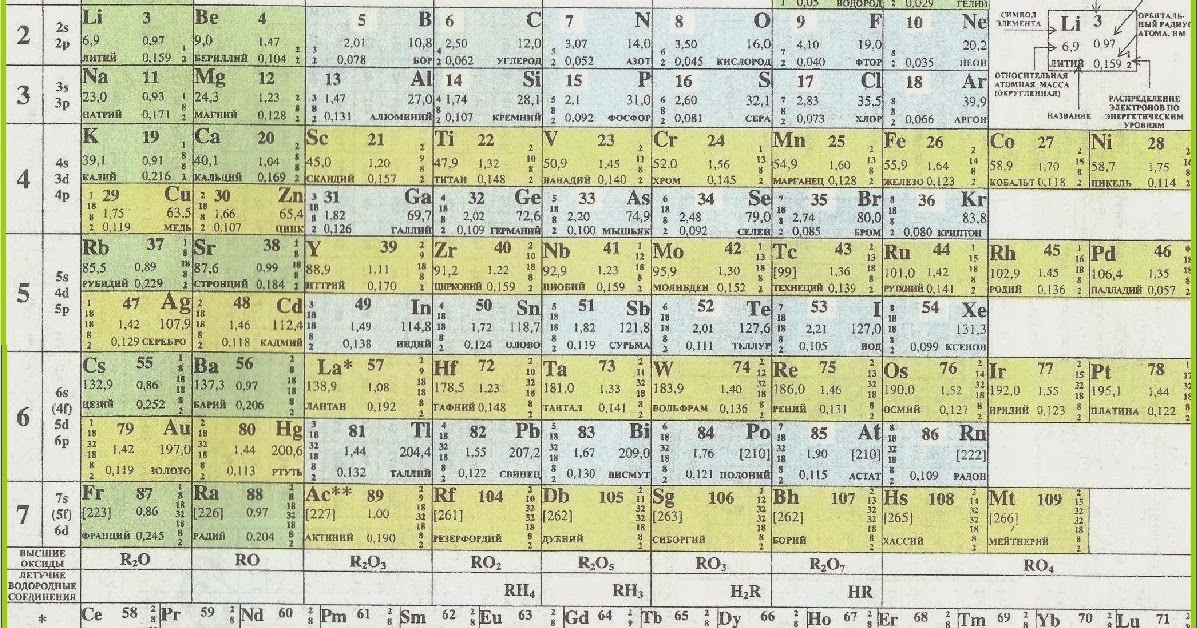 00 00 | 5 | ||||||||
| 106 | * | 266.000 | Seaborgium | Sg | 0 | 0 | 0.00 | 6 | ||||||||
| 107 | * | 264.000 | Bohrium | Bh | 0 | 0 | 0.00 | 7 | ||||||||
| 108 | * | 277.000 | Hassium | Hs | 0 | 0 | 0.00 | 8 | ||||||||
| 109 | * | 268.000 | Meitnerium | Mt | 0 | 0 | 0,00 | 9 | ||||||||
| № | А. вес | Имя | Сим. | М.П. | лет назад | Плотность* | Земля* | Группа* | Электронная конфигурация |
↑ Начало таблицы
Сноски:
- Плотность элементов с температурой кипения ниже 0°C указана в г/л.
 В отсортированном списке эти элементы показаны перед другими элементами с температурой кипения >0°C.
В отсортированном списке эти элементы показаны перед другими элементами с температурой кипения >0°C. - Средние значения состава земной коры взяты из отчета Ф. В. Кларка и Х. С. Вашингтона, 1924 г. Элементный состав пород земной коры различается в разных местах (см. статью).
- Группа : В периодической таблице есть только 18 групп, которые составляют столбцы таблицы. Лантаноиды и актиноиды пронумерованы как 101 и 102, чтобы разделить их при сортировке по группам.
- Элементы, отмеченные звездочкой (во 2-м столбце), не имеют стабильных нуклидов. Для этих элементов указанное значение веса представляет собой массовое число самого долгоживущего изотопа элемента.
- Год открытия элементов см. в списке с названиями на английском и иврите.
Сокращения и определения:
№ – атомный номер; А. вес – атомный вес; член парламента – Температура плавления; Б.П. – Температура кипения
Атомный номер: Количество протонов в атоме.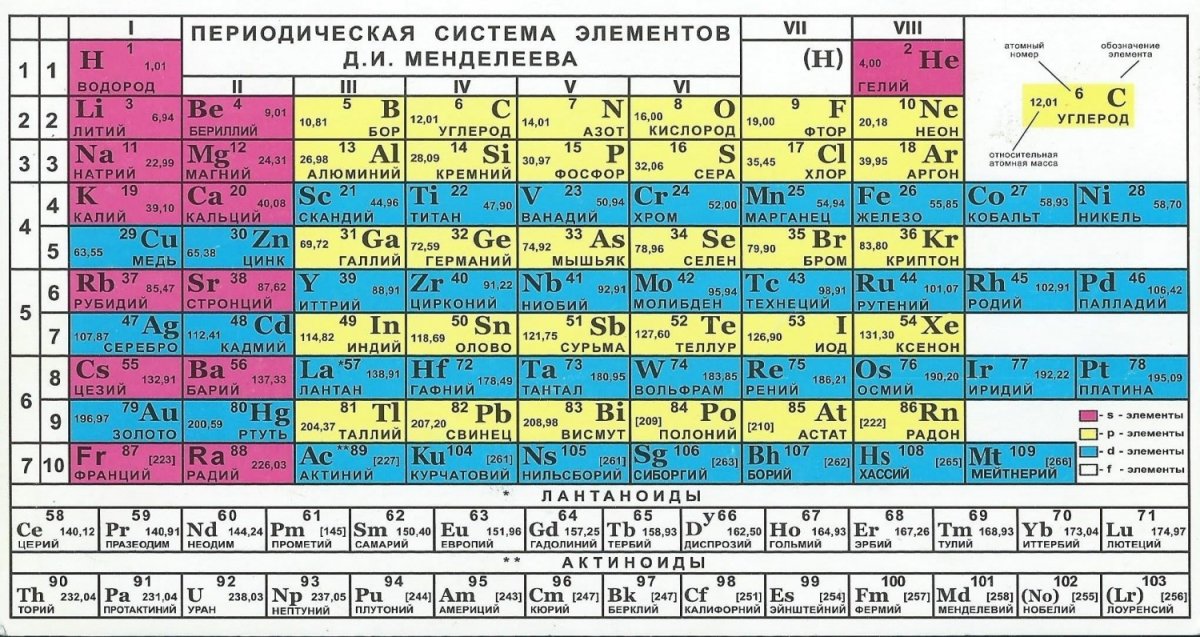 Каждый элемент однозначно определяется своим атомным номером.
Каждый элемент однозначно определяется своим атомным номером.
Атомная масса: Масса атома в первую очередь определяется количеством протонов и нейтронов в его ядре. Атомная масса измеряется в единицах атомной массы (а.е.м.), которые масштабируются относительно углерода, 12 C, который принят за стандартный элемент с атомной массой 12. Этот изотоп углерода имеет 6 протонов и 6 нейтронов. Таким образом, каждый протон и каждый нейтрон имеют массу около 1 а.е.м.
Изотоп: Атомы одного и того же элемента с одинаковым атомным номером, но с разным числом нейтронов. Изотоп элемента определяется суммой количества протонов и нейтронов в его ядре. Элементы имеют более одного изотопа с различным количеством нейтронов. Например, два распространенных изотопа углерода, 12 C и 13 C имеют 6 и 7 нейтронов соответственно. Содержание каждого изотопа зависит от источника материалов. Относительное содержание изотопов в природе см. в справочнике по атомным весам и изотопным составам.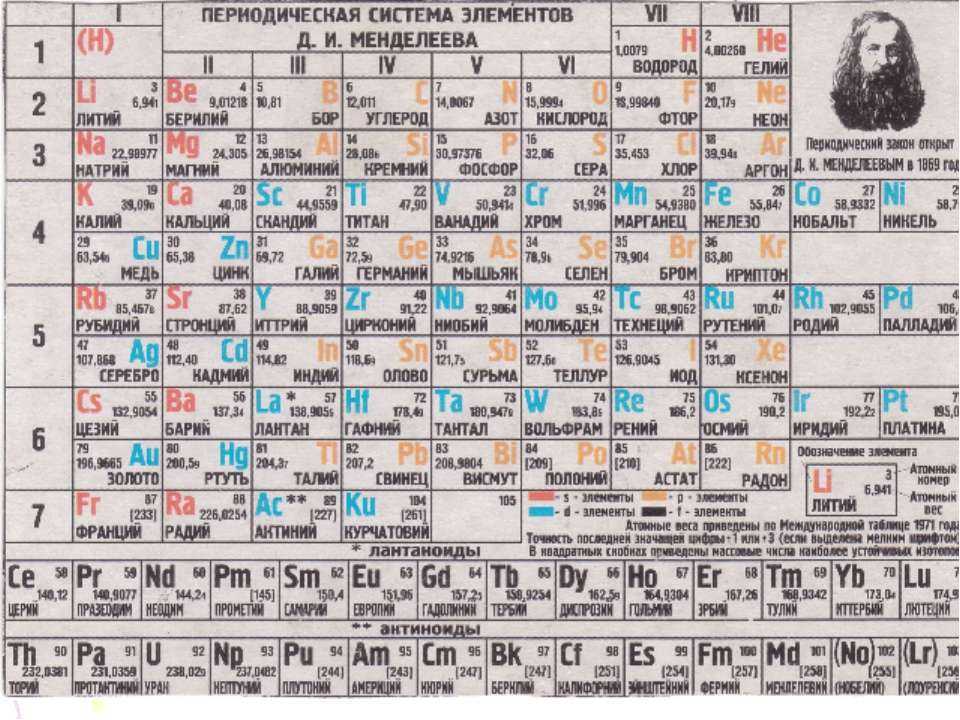
Атомный вес: Значения атомного веса представляют собой средневзвешенных масс всех встречающихся в природе изотопов элемента. Показанные здесь значения основаны на определениях Комиссии IUPAC (Pure Appl. Chem. 73:667-683, 2001). Элементы, отмеченные звездочкой, не имеют стабильных нуклидов. Для этих элементов значение веса представляет собой массовое число самого долгоживущего изотопа элемента.
Электронная конфигурация: См. следующую страницу для объяснения электронной конфигурации атомов.
Другие ресурсы, связанные с Периодической таблицей
- Список элементов Периодической таблицы на иврите
- Химическая эволюция Вселенной
- Атомные справочные данные для расчетов электронной структуры
- Многоязычный словарь и этимология элементов периодической таблицы
- Атомные массы элементов (из IUPAC)
- История открытия того, что элементы рождаются в звездах
Ссылка на страницу
Химический справочник Израиля. (2022, 05 октября). «Сортируемый список элементов Периодической таблицы». Получено с https://www.science.co.il/elements/
(2022, 05 октября). «Сортируемый список элементов Периодической таблицы». Получено с https://www.science.co.il/elements/
элемент группы азота | Свойства, использование и список
- Связанные темы:
- азот фосфор мышьяк висмут сурьма
См. все связанные материалы →
элемент группы азота , любой из химических элементов, составляющих группу 15 (Va) периодической таблицы. Группа состоит из азота (N), фосфора (P), мышьяка (As), сурьмы (Sb), висмута (Bi) и московия (Mc). Элементы имеют определенное общее сходство в химическом поведении, хотя химически они четко отличаются друг от друга, и это сходство отражает общие черты электронной структуры их атомов.
Наверное, никакая другая группа элементов не знакома неспециалисту так, как эта группа. Хотя шесть элементов вместе составляют менее 0,2 процента веса земной коры, их значение далеко не соответствует их изобилию. Особенно это относится к элементам азоту и фосфору, которые составляют соответственно 2,4 и 0,9 процента от общей массы тела человека.
Элементы азота имеют, пожалуй, самый широкий диапазон физического состояния среди всех групп периодической таблицы. Азот, например, представляет собой газ, который сжижается при температуре около -200 °C и замерзает при температуре около -210 °C, тогда как висмут представляет собой твердое вещество, плавящееся при 271 °C и кипящее при температуре около 1560 °C. широк, азот и фосфор являются типичными неметаллами; мышьяк и сурьма, металлоиды; и висмут, металл. Даже по внешнему виду эти элементы отличаются большим разнообразием. Азот бесцветен как в газообразном, так и в жидком состоянии. Фосфор существует в различных физических модификациях или аллотропных формах, включая известную белую высокореактивную форму, которую необходимо хранить под водой, чтобы предотвратить воспламенение на воздухе; гораздо менее реактивная красная или фиолетовая форма; и черная модификация, которая, хотя и наименее известна, кажется наиболее стабильной из всех. Мышьяк существует в основном в виде тускло-серого металлического твердого вещества, но также известна более реакционноспособная желтая твердая форма, и есть признаки того, что при определенных условиях существуют и другие формы. Сурьма представляет собой серебристое, металлическое на вид, но несколько хрупкое твердое вещество; а висмут — серебристо-белый металл с оттенком розового в блеске.
Сурьма представляет собой серебристое, металлическое на вид, но несколько хрупкое твердое вещество; а висмут — серебристо-белый металл с оттенком розового в блеске.
Вместе с углеродом, водородом, кислородом и серой первые два члена этой группы, азот и фосфор, являются основными химическими элементами, входящими в состав живых систем. Азот и фосфор легко удаляются из почвы при росте растений и поэтому являются чрезвычайно важными компонентами растительной пищи. Такие обозначения, как «5–10–5» на коммерческих удобрениях, представляют собой соответствующий массовый процентный состав материала с точки зрения азота, оксида фосфора и оксида калия (калий является третьим основным элементом, необходимым для здорового роста растений). Азот в удобрениях может быть в виде нитратов натрия или калия, аммиака, солей аммония или различных органических соединений. Фосфор поставляется главным образом в виде неорганического фосфата.
Викторина “Британника”
Периодическая таблица элементов
Проверьте свою связь с периодической таблицей элементов в этой викторине по всем 118 химическим элементам и их символам. Вы можете быть знакомы с химическими символами водорода и кислорода, но можете ли вы сопоставить такие низкопрофильные элементы, как гадолиний и эрбий, с соответствующими символами?
Вы можете быть знакомы с химическими символами водорода и кислорода, но можете ли вы сопоставить такие низкопрофильные элементы, как гадолиний и эрбий, с соответствующими символами?
Те же самые элементы, азот и фосфор, могут быть использованы менее полезными для человека способами. Взрывчатые вещества в обычной войне сильно зависят от содержания в них соединений азота, а смертоносные нервно-паралитические газы состоят из органических соединений фосфора.
С другой стороны, мышьяк, известный своей токсичностью, наиболее полезен в сельском хозяйстве, где его соединения помогают бороться с вредными насекомыми-вредителями. Сурьма и висмут используются в основном в металлических сплавах, потому что они придают этим сплавам уникальные и желаемые свойства.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Сравнительная химия
Электронные конфигурации
Сходства в орбитальном расположении
В периодической таблице каждый из элементов группы азота занимает пятую позицию среди основных элементов группы своего периода, позицию, обозначенную 15. Что касается электронной конфигурации его атомов, каждый элемент группы азота имеет самую внешнюю оболочку из пяти электроны. В каждом случае они полностью занимают внешнюю s орбиталь (с двумя электронами) и вносят по одному электрону на каждую из трех внешних p орбиталей (орбитали представляют собой электронные области внутри атома и буквенные обозначения, s, p, d и f , используемые для обозначения различных классов орбиталей). Таким образом, расположение внешних электронов в атомах элементов азота обеспечивает три наполовину заполненных внешних орбиталей, которые при взаимодействии с наполовину заполненными орбиталями атомов других элементов могут образовывать три ковалентные связи. Другие атомы могут притягивать общие электроны сильнее или слабее, чем атомы группы азота; поэтому последние могут приобретать как положительные, так и отрицательные заряды и существовать в своих соединениях в степенях окисления +3 или -3. В этом отношении азотистые элементы схожи.
Что касается электронной конфигурации его атомов, каждый элемент группы азота имеет самую внешнюю оболочку из пяти электроны. В каждом случае они полностью занимают внешнюю s орбиталь (с двумя электронами) и вносят по одному электрону на каждую из трех внешних p орбиталей (орбитали представляют собой электронные области внутри атома и буквенные обозначения, s, p, d и f , используемые для обозначения различных классов орбиталей). Таким образом, расположение внешних электронов в атомах элементов азота обеспечивает три наполовину заполненных внешних орбиталей, которые при взаимодействии с наполовину заполненными орбиталями атомов других элементов могут образовывать три ковалентные связи. Другие атомы могут притягивать общие электроны сильнее или слабее, чем атомы группы азота; поэтому последние могут приобретать как положительные, так и отрицательные заряды и существовать в своих соединениях в степенях окисления +3 или -3. В этом отношении азотистые элементы схожи.
Еще одно сходство между азотистыми элементами заключается в существовании неподеленной, или одинокой, пары электронов, которая остается после образования трех ковалентных связей или их эквивалента. Эта неподеленная пара позволяет молекуле действовать как донор электронной пары при образовании молекулярных аддитивных соединений и комплексов. Доступность неподеленной пары зависит от различных факторов, таких как относительный размер атома, его частичный заряд в молекуле, пространственные характеристики других групп в молекуле и еще плохо изученное явление, называемое «инертной парой». эффект.” Этот эффект состоит из тенденции к парному s электронов на внешней оболочке более тяжелых атомов основной группы остаются химически неактивными. Из-за этого способность элементов группы азота отдавать электронные пары неравномерна по всей группе; он, вероятно, больше всего с азотом, меньше с промежуточными элементами и не существует с висмутом.
фосфор | Определение, использование и факты
фосфор
См. все среды
все среды
- Ключевые люди:
- Йохан Готтлиб Ган Хенниг Брэнд Иоганн Кункель фон Левенстьерн
- Похожие темы:
- круговорот фосфора белый фосфор фосфор-32 красный фосфор черный фосфор
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
фосфор (P) , неметаллический химический элемент семейства азота (группа 15 [Va] периодической таблицы), который при комнатной температуре представляет собой бесцветное, полупрозрачное, мягкое воскообразное твердое вещество, светящееся в темноте.
| atomic number | 15 |
|---|---|
| atomic weight | 30.9738 |
| melting point (white) | 44.1 °C (111.4 °F) |
| boiling point ( белый) | 280 °C (536 °F) |
| плотность (белый) | 1,82 г/см 3 при 20 °C (68 °F) |
| 0 9,0010 9,0010, 5 | |
| electron configuration | 1 s 2 2 s 2 2 p 6 3 s 2 3 p 3 |
История
Знать об истории мочи в алхимии и ее химических экспериментах
Посмотреть все видео к этой статье Арабские алхимики 12 века могли случайно выделить элементарный фосфор, но записи неясны. Фосфор был открыт в 1669 году Хеннигом Брандом, немецким купцом, увлекавшимся алхимией. Бранд оставил 50 ведер с мочой стоять до тех пор, пока они не разлагались и не «заводили червей». Затем он уварил мочу до состояния пасты и нагрел ее с песком, тем самым отделив из смеси элементарный фосфор. Бранд сообщил о своем открытии в письме Готфриду Вильгельму Лейбницу, и после этого демонстрации этого элемента и его способности светиться в темноте или «фосфоресцировать» вызвали общественный интерес. Фосфор, однако, оставался химическим диковинным до тех пор, пока примерно столетие спустя не оказалось, что он входит в состав костей. При переваривании костей азотной или серной кислотой образовывалась фосфорная кислота, из которой путем нагревания с древесным углем можно было отогнать фосфор. В конце 1800-х годов Джеймс Берджесс Ридман из Эдинбурга разработал метод производства элемента из фосфатной породы в электрической печи, который, по сути, используется и сегодня.
Фосфор был открыт в 1669 году Хеннигом Брандом, немецким купцом, увлекавшимся алхимией. Бранд оставил 50 ведер с мочой стоять до тех пор, пока они не разлагались и не «заводили червей». Затем он уварил мочу до состояния пасты и нагрел ее с песком, тем самым отделив из смеси элементарный фосфор. Бранд сообщил о своем открытии в письме Готфриду Вильгельму Лейбницу, и после этого демонстрации этого элемента и его способности светиться в темноте или «фосфоресцировать» вызвали общественный интерес. Фосфор, однако, оставался химическим диковинным до тех пор, пока примерно столетие спустя не оказалось, что он входит в состав костей. При переваривании костей азотной или серной кислотой образовывалась фосфорная кислота, из которой путем нагревания с древесным углем можно было отогнать фосфор. В конце 1800-х годов Джеймс Берджесс Ридман из Эдинбурга разработал метод производства элемента из фосфатной породы в электрической печи, который, по сути, используется и сегодня.
Возникновение и распространение
Фосфор — очень широко распространенный элемент — 12-й по распространенности в земной коре, в которой он составляет около 0,10 весовых процентов. Его космическое содержание составляет около одного атома на 100 атомов кремния, эталона. Его высокая химическая активность гарантирует, что он не встречается в свободном состоянии (за исключением нескольких метеоритов). Фосфор всегда присутствует в виде иона фосфата. Основными комбинированными формами в природе являются фосфатные соли. Было обнаружено, что около 550 различных минералов содержат фосфор, но из них основным источником фосфора является ряд апатита, в котором ионы кальция существуют наряду с ионами фосфата и переменными количествами ионов фтора, хлорида или гидроксида, в соответствии с формулой [Ка 10 (PO 4 ) 6 (F, Cl или OH) 2 ]. Другими важными фосфорсодержащими минералами являются вавеллит и вивианит. Обычно атомы таких металлов, как магний, марганец, стронций и свинец, замещают кальций в минерале, а силикат, сульфат, ванадат и подобные анионы заменяют ионы фосфата. Очень крупные осадочные месторождения фторапатита обнаружены во многих частях Земли.
Его космическое содержание составляет около одного атома на 100 атомов кремния, эталона. Его высокая химическая активность гарантирует, что он не встречается в свободном состоянии (за исключением нескольких метеоритов). Фосфор всегда присутствует в виде иона фосфата. Основными комбинированными формами в природе являются фосфатные соли. Было обнаружено, что около 550 различных минералов содержат фосфор, но из них основным источником фосфора является ряд апатита, в котором ионы кальция существуют наряду с ионами фосфата и переменными количествами ионов фтора, хлорида или гидроксида, в соответствии с формулой [Ка 10 (PO 4 ) 6 (F, Cl или OH) 2 ]. Другими важными фосфорсодержащими минералами являются вавеллит и вивианит. Обычно атомы таких металлов, как магний, марганец, стронций и свинец, замещают кальций в минерале, а силикат, сульфат, ванадат и подобные анионы заменяют ионы фосфата. Очень крупные осадочные месторождения фторапатита обнаружены во многих частях Земли. Фосфат кости и зубной эмали – гидроксиапатит. (Принцип уменьшения кариеса с помощью фторирования зависит от превращения гидроксиапатита в более твердый, более устойчивый к кариесу фторапатит.)
Фосфат кости и зубной эмали – гидроксиапатит. (Принцип уменьшения кариеса с помощью фторирования зависит от превращения гидроксиапатита в более твердый, более устойчивый к кариесу фторапатит.)
Основным коммерческим источником является фосфорит, или фосфатная порода, нечистая массивная форма карбонатсодержащего апатита. По оценкам, общее количество фосфоритов в земной коре составляет в среднем около 65 000 000 000 тонн, из которых Марокко и Западная Сахара содержат около 80 процентов. Эта оценка включает только руду, которая достаточно богата фосфатами для преобразования в полезные продукты с помощью настоящих методов. Также существуют огромные количества материала с более низким содержанием фосфора.
Британская викторина
118 Названия и символы Периодической таблицы Викторина
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Единственным встречающимся в природе изотопом фосфора является изотоп с массой 31. Другие изотопы с массой от 24 до 46 были синтезированы с помощью соответствующих ядерных реакций. Все они радиоактивны с относительно коротким периодом полураспада. Изотоп с массой 32 имеет период полураспада 14,268 дней и оказался чрезвычайно полезным в исследованиях индикаторов, связанных с поглощением и перемещением фосфора в живых организмах. 9
Промышленное производство и использование 2923
Основной метод преобразования фосфатной породы в пригодные для использования материалы включает подкисление измельченной породы серной или фосфорной кислотой с образованием неочищенных гидрофосфатов кальция, которые, будучи водорастворимыми, являются ценными добавками к удобрениям. Большая часть продукции сжигается до фосфорного ангидрида и затем обрабатывается водой с образованием фосфорной кислоты, H 3 PO 4 . Около 95% фосфоритов, добываемых в США, используется для производства удобрений или пищевых добавок для животных. Однако возникли опасения по поводу использования фосфора. Большая часть фосфора тратится впустую на пути от добычи полезных ископаемых до употребления в пищу людьми, а потерянный фосфор попадает в водные пути, где он может вызвать цветение водорослей. Еще одна проблема заключается в том, что увеличение использования фосфора приведет к истощению невозобновляемых запасов фосфоритов.
Однако возникли опасения по поводу использования фосфора. Большая часть фосфора тратится впустую на пути от добычи полезных ископаемых до употребления в пищу людьми, а потерянный фосфор попадает в водные пути, где он может вызвать цветение водорослей. Еще одна проблема заключается в том, что увеличение использования фосфора приведет к истощению невозобновляемых запасов фосфоритов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Узнайте, как зажигается спичка на химическом уровне
Просмотреть все видео к этой статье Только около 5 процентов фосфора, ежегодно потребляемого в Соединенных Штатах, используется в элементарной форме. Пиротехнические применения элемента включают трассеры, зажигательные вещества, фейерверки и спички. Часть используется в качестве легирующего агента, часть используется для уничтожения грызунов, а остальное используется в химическом синтезе. Большое количество превращается в сульфиды, используемые в спичках и при производстве инсектицидов и присадок к маслам. Большая часть остатка превращается в галогениды или оксиды для последующего использования в синтезе органических соединений фосфора.
Большая часть остатка превращается в галогениды или оксиды для последующего использования в синтезе органических соединений фосфора.
Объяснение урока: Группа 15 | Nagwa
В этом объяснителе мы научимся описывать и объяснять свойства и экономическое значение элементов группы 15.
В правой части периодической таблицы, как показано ниже, мы находим группу 15. элементы, также известные как пниктогены.
Группа 15 содержит шесть элементов, которые идут от азота до московия вниз Периодическая таблица:
- Азот, N
- Фосфор, P
- Мышьяк, As
- Сурьма, Sb
- Висмут, Bi
- Московий, Mc
- Na
- N
- Ni
- Ne
- Nb
Ответ
Группа 15 находится в правой части таблицы Менделеева и состоит из
элементы азот, фосфор, мышьяк, сурьма, висмут и московий. Вопрос представляет нам ряд вариантов в виде химических
символы. Все эти символы начинаются с буквы N , потенциально пытаясь сбить нас с толку, когда мы
рассмотрим азот, единственный элемент группы 15, символ которого начинается с Н .
Все эти символы начинаются с буквы N , потенциально пытаясь сбить нас с толку, когда мы
рассмотрим азот, единственный элемент группы 15, символ которого начинается с Н .
Мы можем определить, что B является правильным ответом либо путем припоминания фактов или поэтапный процесс ликвидации. На является символом натрия, Ni является символом для никеля Ne является символом для неона, и Nb является символом для ниобия. Итак правильный ответ Б.
Азот и фосфор находятся в верхней части 15-й группы периодической таблицы. столбец, и оба они неметаллы. Мышьяк и сурьма являются металлоидами. их можно найти в периодической таблице под элементами азота и фосфор.
Пятый элемент, принадлежащий к группе 15, — висмут. Висмут – это металл, но, необычно для металла, это не особенно эффективный проводник электричество.
Московий — синтетический элемент, впервые синтезированный в
2003 г. группой ученых в России,
И только в IUPAC он был признан официальным химическим элементом.
2015. Московиум — чрезвычайно
радиоактивный элемент, и нам удалось произвести лишь приблизительно
100 атомов московия
в течение последних двух десятилетий. Мы не будем покрывать
moscovium многое в этом объяснителе.
группой ученых в России,
И только в IUPAC он был признан официальным химическим элементом.
2015. Московиум — чрезвычайно
радиоактивный элемент, и нам удалось произвести лишь приблизительно
100 атомов московия
в течение последних двух десятилетий. Мы не будем покрывать
moscovium многое в этом объяснителе.
В целом, по мере того, как мы спускаемся по группе 15, элементы становятся более металлическими.
Пример 2. Определение пары элементов группы 15, которые классифицируются как Металлоиды
Какие из следующих пар являются металлоидами, включенными в группу 15 элементов?
- Фосфор и висмут
- Висмут и мышьяк
- Сурьма и мышьяк
- Фосфор и мышьяк
- Сурьма и висмут
По мере того, как мы спускаемся по группе 15, свойства элементов меняются от неметаллов
в металлоиды, а затем в металлы. Правильный порядок элементов в группе
15 сверху вниз — азот, фосфор, мышьяк, сурьма, висмут и
московиум.
Азот и фосфор считаются неметаллами, а висмут считается металл. Это оставляет нам элементы мышьяк и сурьму, так как оба являются металлоиды. Таким образом, мы можем сделать вывод, что правильный ответ С.
Азот является самым распространенным из элементов 15 группы. Его можно найти в соединениях составляют часть континентальной коры Земли. Однако азот является в основном встречается в воздухе. Как основной компонент атмосферы азот составляет около 78% атмосферного воздуха.
Другие элементы этой группы не встречаются в больших количествах в земной коры и уменьшаться в изобилии по мере спуска по группе. приблизительное процентное содержание каждого из этих элементов указано в Таблица ниже.
| Элемент | Процентное содержание элемента в континентальной коре Земли and in Sea |
|---|---|
| Phosphorus | 0.105 |
| Arsenic | 0. 00018 00018 |
| Antimony | 0.00002 |
| Bismuth | 0.0000085 |
Phosphorous is the most abundant of group 15 elements found в земной коре. Фосфор можно найти во многих различных минералах как часть фосфатной группы. (ПО) 43–. Пример таких так называемых фосфатные породы – это апатит, который представляет собой фосфатный минерал, имеющий формулу Ca(PO)(F,Cl,OH)543 и показан в следующем фигура.
Мышьяк является высокотоксичным элементом для человека из-за воздействия, которое он может оказывать на
аденозинтрифосфат (АТФ). АТФ представляет собой молекулу запаса энергии, присутствующую в
все клетки человека. При распаде АТФ высвобождается энергия, которая используется для выполнения
необходимые биологические процессы. Мышьяк токсичен для человека, поскольку разрушает
процессы, в которых образуются молекулы АТФ. Без достаточного количества АТФ наши клетки не могут функционировать
и в конечном итоге это может быть фатальным.
Также известно, что мышьяк является загрязняющим веществом и обладает канцерогенными свойствами.
Мышьяк встречается в природе в форме элемента и в виде минерала. Общий мышьяксодержащие минералы включают арсенопирит (FeAsS) и раммельсбергит (НиАс)2. Его также можно найти в сульфиде. соединения, такие как AsS23, который присутствует в минеральный аурипигмент.
В земной коре мало сурьмы; тем не менее, он встречается в более более 100 различных видов минералов. Стибнит представляет собой мягкий кристалл серого сульфида минерала. имеет химическую формулу SbS23. Стибнит – это самый важный источник сурьмы.
Наконец, висмут, элемент, который встречается примерно в два раза чаще, чем золото, наиболее часто встречается в висмутините (BiS)23 и бисмит (BiO)23.
Элементы группы 15 очень важны с экономической точки зрения и имеют множество применений. Эти широкие приложения частично связаны с тем, что они способны
существует в нескольких степенях окисления в диапазоне от -3 до
+5. Например, элементы 15 группы способны реагировать
с водородом с образованием гидридов, таких как аммиак (NH)3. В этих гидридах элемент 15 группы имеет степень окисления
−3. Другие примеры соединений элементов группы 15 с различными
степени окисления можно увидеть в таблице ниже.
Например, элементы 15 группы способны реагировать
с водородом с образованием гидридов, таких как аммиак (NH)3. В этих гидридах элемент 15 группы имеет степень окисления
−3. Другие примеры соединений элементов группы 15 с различными
степени окисления можно увидеть в таблице ниже.
| Compound | Formula | Oxidation State |
|---|---|---|
| Stibine | Sbh4 | −3 |
| Diphosphane | Ph34 | −2 |
| Hydroxylamine | NHOh3 | −1 |
| Фосфор | P4 | 0 |
| Гипофосфорная кислота | HPO32 | +1 | AsS44 | +2 |
| Bismuth oxide | BiO23 | +3 |
| Hypophosphoric acid | HPO426 | +4 |
| Antimony pentafluoride | SbF5 | +5 |
Азот сам по себе может находиться в степени окисления в диапазоне от
от −3 до +5. Большинство из этих степеней окисления возникают
в соединениях, содержащих водород или кислород, как показано в таблице
ниже.
Большинство из этих степеней окисления возникают
в соединениях, содержащих водород или кислород, как показано в таблице
ниже.
| Compound | Formula | Oxidation State |
|---|---|---|
| Ammonia | Nh4 | −3 |
| Hydrazine | Nh34 | −2 |
| Hydroxylamine | NHOh3 | −1 |
| Азот, тетраазот | N2, N4 | 0 |
| Закись азота | NO2 | +1 |
| Nitric oxide | NO | +2 |
| Nitrogen trioxide | NO23 | +3 |
| Nitrogen dioxide | NO2 | +4 |
| Nitrogen pentoxide | NO25 | +5 |
Атомы фосфора, мышьяка и сурьмы могут независимо связываться друг с другом в
различные способы получения различных типов аллотропов.
Определение: аллотропы
Аллотропы – это разные структурные формы одного и того же элемента, но в одном и том же физическое состояние.
Фосфор имеет несколько различных аллотропов. Белый и красный фосфор являются наиболее распространены аллотропные формы, но также существуют фиолетовые и черные аллотропы. Белый фосфор представляет собой воскообразное твердое вещество, имеющее химическую формулу P4 и состоит из тетрамерных молекул. Четыре атома фосфора ковалентно связаны друг с другом и образуют тетраэдрическая структура, которая показана на диаграмме ниже. Красный, фиолетовый, а черные аллотропы имеют более сложную молекулярную структуру.
Мышьяк имеет три распространенные аллотропные формы, известные как серый, желтый и черный мышьяк. Известно, что серая форма встречается чаще остальных.
Известно, что сурьма образует один стабильный металлический аллотроп и еще три
различные метастабильные формы, известные как взрывоопасные, черные и желтые. Следующее
На рисунке показан блестящий металлический вид наиболее стабильной сурьмы.
аллотроп.
Следующее
На рисунке показан блестящий металлический вид наиболее стабильной сурьмы.
аллотроп.
Пример 3. Выбор трех аллотропных форм мышьяка из списка потенциальных Аллотропы
Какие существуют три аллотропные формы мышьяка?
- Красный, черный и серый
- Красный, черный и фиолетовый
- Синий, черный и красный
- Фиолетовый, красный и серый
- Желтый, черный и серый Вопрос
Ответ
В то время как азот и висмут не имеют устойчивых аллотропных форм, мышьяк, фосфор и сурьма имеют несколько стабильных аллотропов.
Сурьма и мышьяк имеют желтые аллотропы, в то время как единственный элемент
имеющий красный и фиолетовый аллотропы — это фосфор.
Обладая этим знанием, мы можем методом исключения правильно идентифицировать Е как правильный ответ: мышьяк имеет аллотропные формы желтого, черного, и серый.
Таким образом, правильный ответ – E.
На приведенном ниже графике показаны температуры плавления и кипения для элементов группы 15.
Температуры плавления и кипения имеют тенденцию к увеличению по мере продвижения вниз по группе 15; однако висмут является явным исключением из этого общего правила. При атмосферном давление, мышьяк возгоняется, переходя непосредственно из твердого состояния в газообразное. Азот не возгоняется, но разница между его температурой плавления и кипения составляет очень маленький.
Некоторые элементы группы 15 могут образовывать газообразные молекулы, но не все они имеют
такое же количество атомов. В газовой фазе молекулы азота обычно содержат
всего два атома (N)2, хотя ученые
также удалось выделить молекулу тетраазота
(Н)4.
Фосфор, мышьяк и сурьма могут существовать в виде тетрамерных молекул в газе фаза с химической формулой P4, As4 и Sb4. Молекулы тетрамера стабильны при комнатной температуре, но начинают разлагаются, когда температура становится слишком высокой для образования двухатомных молекул (П2, As2 или Sb2), очень похоже на азот.
Висмут можно считать очень похожим на азот в том смысле, что оба этих элемента могут образовывать газы, состоящие из двухатомных молекул. Это необычно, так как металлы в газовой фазе часто состоят только из одного атомы.
Все элементы группы 15 имеют пять валентных электронов, а это означает, что они многие схожие химические свойства. Электронные конфигурации этих элементы представлены в таблице ниже. Мы видим, что все элементы группы 15 содержат три валентных электрона в р-подоболочке.
| Атомная номер | Элемент | Электроны на оболочку | Электронная конфигурация | |||||
|---|---|---|---|---|---|---|---|---|
| 7 | азот | 2, 5 | [HE] 22SP | 2, 5 | [HE] 22sp | 2 | . 2, 8, 5 2, 8, 5 | [Ne]33sp |
| 33 | Arsenic | 2, 8, 18, 5 | [Ar]344dsp | |||||
| 51 | Antimony | 2, 8, 18, 18, 5 | [KR] 455DSP | |||||
| 83 | Bismuth | 2, 8, 18, 32, 18, 5 | [XE] 45666FDSP |
Какое из следующих утверждений правильно указывает на сходство между мышьяк и сурьма?
- Их обоих больше в земной коре, чем фосфора.
- Оба являются металлоидами.
- Они оба содержат по 4 электрона на последнем р орбиталь.
- Они оба менее плотные, чем азот.
- Они оба образуют двухатомные молекулы в стандартных условиях.

Ответ
В этом вопросе мы должны оценить, какое утверждение правильно связывает мышьяк и сурьма.
Заявление A описывает содержание мышьяка и сурьмы по отношению к что фосфора. Содержание элементов группы 15 уменьшается с течением времени. ниже по группе, поэтому фосфора больше, чем мышьяка и сурьма. Следовательно, утверждение А неверно.
Утверждение B говорит нам, что оба элемента являются металлоидами. При спуске группа 15, характеристики элементов меняются от неметаллов до металлоидов, а затем в металлы. Мышьяк имеет азот неметаллов и фосфор над ним, а сурьма имеет металлический висмут под ним. Заявление Б может быть правильным ответом.
Утверждение C говорит нам, что они оба содержат четыре электрона в последнем
р-орбиталь; однако все элементы группы 15 имеют пять
электронов на своих валентных оболочках, три из которых находятся в
р орбиталь. Итак, утверждение С неверно.
Итак, утверждение С неверно.
Заявление D описывает мышьяк и сурьму как менее плотные, чем азот. Это маловероятно, поскольку и мышьяк, и сурьма являются твердыми веществами. более плотный, чем азот, который является газом.
Утверждение E предполагает, что и мышьяк, и сурьма образуют двухатомные молекулы. в стандартных условиях, аналогично азоту. Это не правда, как они оба твердых вещества при комнатной температуре.
Оценив все варианты, мы видим, что правильный ответ это Б.
Элементы группы 15 способны образовывать множество различных типов оксидов соединения, потому что они могут существовать в различных степенях окисления. Оксидные соединения группы 15 имеют тенденцию быть более основными, когда они содержат атомы группы 15 элементов с более высокими атомными номерами. Это можно понять, сравнив пятиокись азота с оксидом сурьмы (III) и висмута (III) оксид:
- Пятиокись азота (NO)25
является кислым.

- Оксид сурьмы(III) (SbO)23 является амфотерным.
- Оксид висмута(III) (BiO)23 является основным.
В следующей таблице показаны некоторые другие молекулы оксидов, которые могут образовываться по элементам группы 15.
| Элемент | Формула оксида |
|---|---|
| Азот | NO2, НЕТ, №23, NO2, №24, №25, №4, Н(НО)23 |
| Фосфор | PO23, ПО25, ПО47, ПО48, ПО49, ПО, PO26 |
| Мышьяк | AsO23, AsO24, AsO25 |
| Сурьма | SbO24, SbO23, SbO25, SbO613 |
| Висмут | BiO23 |
Элементы группы 15 также обладают способностью образовывать простые молекулы гидрида, которые
имеют химическую формулу Xh4, где
X представляет собой атом элемента группы 15.
Вероятно, мы уже хорошо знакомы с гидридом азота, иначе известный как аммиак (NH)3. Однако мышьяк и фосфор также может образовывать гидриды, известные как арсин. (AsH)3 и фосфин (ПН)3.
Растворимость гидридов группы 15 в воде имеет тенденцию к уменьшению с увеличением атомный номер. Так, растворимость аммиака в воде больше, чем у фосфин, тогда как стибин (Sbh4) мало растворим в воде.
На следующей структурной диаграмме Льюиса показано, как эти гидриды имеют тенденцию образовывать три ковалентные связи с атомами водорода, а также имеют одну неподеленную пару несвязанные электроны.
NHHH
Электроотрицательность элементов группы 15 уменьшается вниз по периодической таблице. Гидриды группы 15 имеют менее полярные связи и в целом менее полярны, когда они
содержат атомы группы 15
с более высокими атомными номерами. Более легкие гидриды группы 15
такие как аммиак, более растворимы в воде, чем более тяжелые гидриды, такие как
Сbh4 и
Bih4, потому что вода является полярным растворенным веществом. Молекулы легче растворяются в воде, если они сильно полярны.
Молекулы легче растворяются в воде, если они сильно полярны.
Термическая стабильность гидридов группы 15 снижается по мере спуска по группе. Аммиак и фосфин стабильны до температуры в несколько сотен градусов. Цельсия, в то время как стибин, как известно, самопроизвольно разлагается при комнатная температура.
Гидриды группы 15 имеют различную термическую стабильность, поскольку термическая стабильность зависит от прочности связи и связи между атомом водорода и группой 15 атом становится слабее по мере увеличения атомного радиуса атома 15 группы.
Следующее уравнение показывает, как молекулы гидрида мышьяка могут разрушаться и образуют газообразный водород и продукты мышьяка: 2AsH()3H()+2As()32ggs
Пример 5. Понимание того, как могут измениться физические свойства элементов группы 15 по мере движения вниз по периодической таблице
Какое из следующих свойств не верно для группы 15 элементов?
- Температуры плавления уменьшаются вниз по группе.

- Электроотрицательность уменьшается вниз по группе.
- Металлические свойства увеличиваются вниз по группе.
- Атомные радиусы увеличиваются вниз по группе.
- Энергия ионизации уменьшается вниз по группе.
Ответ
Этот вопрос спрашивает, какое из этих свойств не верно для группы 15 элементов.
Утверждение A говорит нам, что температура плавления снижается вниз по группе. Однако, если бы это было так, то все остальные элементы в группе 15 были бы газов так же, как и азот. Поскольку это не так, то этот выбор вполне может быть правильным ответом, но мы исключим другие быть уверенным.
Утверждение B говорит, что электроотрицательность уменьшается вниз по группе. Мы знаем
что азот является одним из самых электроотрицательных элементов и что
электроотрицательность увеличивается по периодической таблице слева направо и
вверх по периодической таблице снизу. Поэтому, когда мы спускаемся по группе 15,
электроотрицательность уменьшается, поэтому утверждение Б верно и, следовательно, не является
правильный ответ.
Поэтому, когда мы спускаемся по группе 15,
электроотрицательность уменьшается, поэтому утверждение Б верно и, следовательно, не является
правильный ответ.
При перемещении элементов группы 15 вниз их характеристики меняются с неметаллов в металлоиды, а затем в металлы. В результате оператор C также верно и, следовательно, неверно.
Утверждение D также верно, так как атомный радиус увеличивается с атомным номером. Каждый элемент находится в разном периоде таблицы Менделеева, поэтому число увеличивается при спуске группы.
Наконец, энергия ионизации также уменьшается вниз по группе, как и в случае увеличивая атомный радиус и усиливая экранирование, валентные электроны требуется меньше энергии для удаления. Таким образом, мы можем заключить, что утверждение E также верно.
Утверждение A — правильный ответ.
После оценки широкого спектра различных химических и физических свойств
элементов группы 15, мы можем изучить некоторые из распространенных применений этих
элементы.
Азот важен для производства аммиака, а аммиак является важным компонентом многих удобрений. Удобрения используются различными обществами по всему миру. мир для улучшения роста и производства различных видов продовольственные культуры.
Фосфор — еще один важный элемент 15-й группы, поскольку его можно использовать для производства удобрения. Его также можно комбинировать с другими элементами для создания композита. сплавы, в состав которых входят такие материалы, как фосфористая бронза.
Мышьяк обычно используется в качестве консерванта для древесины из-за его токсичности можно использовать для уменьшения ущерба от насекомых, бактерии и грибки.
Сурьма может быть использована для производства различных типов сплавов и полупроводников, в то время как висмут можно использовать для изготовления сплавов, когда он смешивается со свинцом. и кадмий.
В следующей таблице показаны некоторые другие важные области применения элементов группы 15.
| Элемент | Использование и применение |
|---|---|
| Азот | – Используется в производстве аммиака. – Используется в производстве азотных удобрений. – обеспечивает инертную атмосферу для таких продуктов, как картофельные чипсы. – Используется для накачивания шин гоночных автомобилей и самолетов. – Используется в качестве хладагента для криоконсервации. |
| Фосфор | – Используется в производстве спичек. – Используется в производстве удобрений NPK. — используется в таких сплавах, как сталь и фосфористая бронза, содержит медь, олово и фосфор. – Фосфорная кислота содержится в газированных напитках. |
| Мышьяк | – Средство для защиты древесины. – Триоксид мышьяка используется для лечения рака. – Используется в сплавах со свинцом при производстве свинцовых деталей для автомобильные аккумуляторы.  |
| Сурьма | – Трехокись сурьмы используется в качестве антипирена. – Используется в производстве различных сплавов, таких как сплав свинца и сурьмы, используемый в батареях. – Это стабилизатор и катализатор для производства обычных пластик полиэтилентерефталат (ПЭТ). – Он используется в полупроводниках для использования в инфракрасных детекторах и диодах. |
| Висмут | – Висмута субсалицилат используется как противодиарейный препарат. – Используется в сплавах, которые можно использовать в качестве припоя из-за более низкой плавкости. точка. – Ванадат висмута – желтый пигмент. |
Подведем итог тому, что мы узнали об элементах группы 15.
Ключевые моменты
- Элементы группы 15 (также известные как пниктогены) состоят из азота, фосфор, мышьяк, сурьма, висмут и московий.
- Элементы группы 15 имеют сходные электронные конфигурации, причем каждый элемент
с пятью валентными электронами.

- При нисходящей группе 15 элементы из неметаллов превращаются в металлоиды а затем к металлам.
- Некоторые элементы группы 15, такие как фосфор, мышьяк и сурьма, могут образуют разные аллотропы.
- Содержание элементов группы 15 уменьшается при движении вниз по группа.
- Элементы группы 15 могут образовывать оксиды, и эти оксиды, как правило, более основные, когда они содержат элементы группы 15, которые имеют более высокие атомные номера.
- Элементы группы 15 могут образовывать гидриды, растворимость в воде и термодинамическая стабильность имеет тенденцию к снижению при движении вниз по группе.
- Элементы группы 15 имеют множество экономически важных применений, и эти включают использование элементов азота и фосфора для получения удобрений.
Смертоносные, живительные и преходящие элементы, составляющие группу 15 периодической таблицы
Когда вы видите периодическую таблицу, что приходит вам на ум? Кусочки на доске для скрэбла? Может быть, вы думаете о школьном уроке химии. Может быть, вы думаете о красочном столе, наклеенном на стену лекционного зала в колледже. Может быть, вы помните, как ваш любимый учитель поджег что-то перед классом. Я доцент кафедры химии Ричмондского университета, и когда я слышу фразу «таблица Менделеева», я думаю о жизни.
Может быть, вы думаете о красочном столе, наклеенном на стену лекционного зала в колледже. Может быть, вы помните, как ваш любимый учитель поджег что-то перед классом. Я доцент кафедры химии Ричмондского университета, и когда я слышу фразу «таблица Менделеева», я думаю о жизни.
Я думаю о том, что молекулы и химические вещества, которые окружают нас и определяют нашу повседневную деятельность, состоят из элементов на этом столе — они поддерживают нашу жизнь, приносят красоту миру и жизненно необходимы в медицине.
Вот таблица Менделеева со всеми заблокированными элементами, кроме элементов в группе 15. Джули Поллок, CC BY-SA Каждый столбец периодической таблицы называется группой. Каждый член группы имеет одинаковое расположение электронов, что может привести к схожим химическим свойствам. Элементы группы 15 — азот, фосфор, мышьяк, сурьма, висмут и московий — интересны мне из-за их ключевой роли в жизни, а также в моей исследовательской лаборатории. Одним из элементов, который мы изучаем, является фосфор из-за его неотъемлемой роли в судьбе клеток.
Одним из элементов, который мы изучаем, является фосфор из-за его неотъемлемой роли в судьбе клеток.
Но прежде чем мы углубимся в эти детали, давайте кратко рассмотрим каждый из элементов группы 15. Они представляют собой уникальный набор по своей истории, использованию и свойствам.
Группа 15 – дает жизнь и вызывает смерть
Азот (N) в атмосферной форме (N₂) составляет примерно 78% воздуха, которым мы дышим. Когда бактерии, живущие в корнях растений, преобразуют его в пригодную для использования форму посредством процесса, называемого фиксацией азота, эта элементарная форма азота включается во многие соединения, необходимые для жизни, например в белки и ДНК. Внизу столбца находится московиум (Mc), который интересен тем, что в действительности не существует в природе. Это радиоактивный элемент, который может быть получен только в лаборатории и сохраняется менее секунды.
Мышьяк (As) может быть вам знаком из-за его ассоциации с отравлениями. В 1494 году Пико делла Мирандола, итальянский философ-гуманист эпохи Возрождения, был отравлен мышьяком, хотя подробности его ранней смерти до сих пор обсуждаются. Долгое время считалось, что Наполеон Бонапарт умер от воздействия мышьяка в 1821 году, но после тщательного сравнения сохранившихся образцов волос с разных этапов его жизни исследователи пришли к выводу, что повышенный уровень мышьяка, скорее всего, был связан с методами консервации того времени. По недавним оценкам Всемирной организации здравоохранения, загрязненная мышьяком питьевая вода в Бангладеш привела к гибели более 9 человек.000 смертей в 2001 году. Как мышьяк отравляет и убивает, до конца не изучено, но нет никаких сомнений в том, что этот элемент вызывает разрушение жизненно важных органов в организме человека.
Долгое время считалось, что Наполеон Бонапарт умер от воздействия мышьяка в 1821 году, но после тщательного сравнения сохранившихся образцов волос с разных этапов его жизни исследователи пришли к выводу, что повышенный уровень мышьяка, скорее всего, был связан с методами консервации того времени. По недавним оценкам Всемирной организации здравоохранения, загрязненная мышьяком питьевая вода в Бангладеш привела к гибели более 9 человек.000 смертей в 2001 году. Как мышьяк отравляет и убивает, до конца не изучено, но нет никаких сомнений в том, что этот элемент вызывает разрушение жизненно важных органов в организме человека.
Когда элемент сурьма (Sb) соединяется с тремя атомами кислорода с образованием триоксида сурьмы, он широко используется в качестве антипирена для мебели, ковров, штор, резины, пластика и клеев. Количество этой молекулы в этих бытовых продуктах, как правило, очень мало, и такие уровни сурьмы считаются безопасными.
Количество этой молекулы в этих бытовых продуктах, как правило, очень мало, и такие уровни сурьмы считаются безопасными.
Висмут (Bi) — металл, находящийся в той же строке периодической таблицы, что и ряд токсичных металлов; однако соединения, содержащие висмут, безвредны. Соединения висмута можно найти в косметике из-за их характерного и желательного серебристого мерцания. Даже если вы никогда не использовали висмутсодержащие средства личной гигиены, вы, вероятно, встречали его в известном антациде Пептобисмол®, которым лечат расстройство желудка, или в День четвертого июля, когда вы смотрите фейерверк. Это соединение висмута, которое вызывает потрескивающие звуки фейерверков драконьего яйца.
Последним, но не менее важным элементом группы 15 является фосфор (P). Он был открыт в 1669 году алхимиком Хеннигом Брандтом и назван от греческого слова «фосфорос», что означает «несущий свет». Это потому, что когда элементарная форма взаимодействует с атмосферным кислородом, она производит яркий свет. Химики придумали, как использовать силу этой реакции для получения спичек. Красный кончик спички до сих пор содержит форму фосфора.
Химики придумали, как использовать силу этой реакции для получения спичек. Красный кончик спички до сих пор содержит форму фосфора.
Фосфаты – регулируют судьбу раковых клеток
Помимо искр, генерируемых элементом, фосфор содержится в соединении, известном как фосфат: фосфор связан с четырьмя атомами кислорода. В клетках, когда молекула фосфата присоединяется к белку, она может включать или активировать белок, чтобы он мог выполнять свою функцию в клетке — например, стимулировать рост.
Когда фосфат больше не связан с белком, клетки перестают расти. Вы можете думать об этом почти как о спичках, описанных выше: когда есть фосфат, спичка может загореться, и бизнес может продолжаться. Когда фосфат удаляется, спичка становится просто палкой, и света нет; не так много работы может произойти в темноте.
В раковых клетках фосфатный статус выходит из-под контроля. Представьте себе много зажженных спичек и очень светлую комнату, что может привести к всплеску активности. Эта деятельность может иметь серьезные последствия для клеток. Например, нерегулируемый рост и миграция могут привести к раку.
Эта деятельность может иметь серьезные последствия для клеток. Например, нерегулируемый рост и миграция могут привести к раку.
В моей лаборатории в Ричмондском университете мы заинтересованы в изучении этих фосфатов и, в частности, одного белка, который с ними взаимодействует. Этот белок, называемый MEMO1, содержится в больших количествах у больных раком молочной железы и помогает фосфатам всегда оставаться связанными с белками. Мы пытаемся понять, как MEMO1 взаимодействует с этими фосфатами, и разрабатываем стратегии, чтобы разрушить эти взаимодействия.
Мы надеемся, что наша работа найдет способ помочь удалить фосфаты, чтобы остановить неконтролируемый рост клеток – другими словами, задуть спички.
Так что в следующий раз, когда вы услышите слова «таблица Менделеева», подумайте, пожалуйста, о жизни. Подумайте о молекулах, с которыми вы сталкиваетесь каждое мгновение каждого дня, подумайте о лекарстве, которое сохраняет ваше здоровье, и подумайте о тех из нас, кто работает над тем, чтобы понять, как сохранить вас такими.
Подумайте о молекулах, с которыми вы сталкиваетесь каждое мгновение каждого дня, подумайте о лекарстве, которое сохраняет ваше здоровье, и подумайте о тех из нас, кто работает над тем, чтобы понять, как сохранить вас такими.
Группа 15 элементов | bartleby
Что входит в группу 15?
3-й группой элементов p-блока является группа 15. Элементы иначе называются семейством азота/пниктогеном. Элементами, которые являются компонентами семейства азота, являются азот, фосфор, мышьяк, сурьма и висмут. Элементы семейства азота названы репрезентативными элементами, поскольку они находятся в правой части основной периодической таблицы. Природа элементов, обнаруженных в семействе азота, представляет собой металлы, металлоиды и неметаллы. Причина, по которой эта группа называется семейством азота, поскольку первым элементом, присутствующим в этой группе, является азот.
Где встречаются элементы группы 15?
Элементы 15 группы – фосфор, азот, висмут, сурьма, мышьяк. Наиболее распространенным элементом, присутствующим в воздухе, является азот, а процентное содержание азота в воздухе составляет 78%. В свободном состоянии элементарный азот присутствует в виде двухатомного газа (N 2 ). В органическом веществе, полученном от растений и животных, преобладающим элементом является фосфор. В нуклеиновых кислотах присутствуют фосфатные группы. Фосфаты также содержатся в зубах и костях. Другие элементы мышьяк, висмут и сурьма встречаются в виде сульфидов. Арсенопирит, висмутовый блеск и антимонит являются примерами сульфидов мышьяка, висмута и сурьмы соответственно.
Наиболее распространенным элементом, присутствующим в воздухе, является азот, а процентное содержание азота в воздухе составляет 78%. В свободном состоянии элементарный азот присутствует в виде двухатомного газа (N 2 ). В органическом веществе, полученном от растений и животных, преобладающим элементом является фосфор. В нуклеиновых кислотах присутствуют фосфатные группы. Фосфаты также содержатся в зубах и костях. Другие элементы мышьяк, висмут и сурьма встречаются в виде сульфидов. Арсенопирит, висмутовый блеск и антимонит являются примерами сульфидов мышьяка, висмута и сурьмы соответственно.
Элементы 15-й группы периодической таблицы
Азот
Первый элемент – азот. Его атомный номер семь, и он выглядит как газ, который не имеет ни вкуса, ни цвета, ни запаха. Он выглядит неметаллическим и занимает 78% атмосферы по объему. 1s 2 2s 2 2p 3 является электронной структурой этого элемента, d-орбитали не видны. В двухатомном азоте аллотропных форм не наблюдается. Несколько соединений азота образуются из необычно стабильного N 2 (г). Среди атомов азота связь представляет собой тройную ковалентную связь, которую нелегко разорвать. Двуокись азота, закись азота и окись азота являются ковалентными соединениями. Важнейшим азотсодержащим соединением является NaNO 3 . +5, +3 и -3 — степени окисления.
Несколько соединений азота образуются из необычно стабильного N 2 (г). Среди атомов азота связь представляет собой тройную ковалентную связь, которую нелегко разорвать. Двуокись азота, закись азота и окись азота являются ковалентными соединениями. Важнейшим азотсодержащим соединением является NaNO 3 . +5, +3 и -3 — степени окисления.
Фосфор
В семействе азота вторым элементом является фосфор, который является неметаллом. -3 — известная степень окисления. Электронная структура фосфора [Ne]3s 2 3п 3 . Соединения фосфора получают из горных пород, содержащих фосфор. Белый фосфор и красный фосфор являются двумя аллотропными типами фосфора. Белое твердое воскообразное вещество, которое можно разделить на кусочки с помощью ножа, представляет собой белый фосфор. Тетраэдрическая молекула образована фосфором. Белый фосфор нестабилен в природе. Цепочка, близкая к полимерной структуре, представляет собой красный фосфор. Стабильность последнего выше, чем у первого. При сравнении реакционной способности красный фосфор имеет низкую реакционную способность. Красный фосфор не токсичен, а белый фосфор токсичен. Фосфорная кислота используется в качестве удобрения и является важным соединением фосфора.
При сравнении реакционной способности красный фосфор имеет низкую реакционную способность. Красный фосфор не токсичен, а белый фосфор токсичен. Фосфорная кислота используется в качестве удобрения и является важным соединением фосфора.
Мышьяк
Третий член группы 15 — мышьяк. Это металлоид, чрезвычайно ядовитый. Электронная структура: [Ar]3d 10 4s 2 4p 3 . Из-за своих металлоидных свойств плотность высока, теплопроводность минимальна и обладает минимальной способностью проводить электричество. +5, +3, +2, +1 и -3 – степени окисления этого элемента. Желтый мышьяк, серый мышьяк и черный мышьяк являются аллотропными формами. Среди этих аллотропных форм серый мышьяк является известным аллотропом. Использование соединений мышьяка – сплавы, убийцы сорняков и инсектициды. При нагревании мышьяка, состоящего из сульфидов, можно получить элемент мышьяк.
Сурьма
Четвертый член группы 15 – сурьма. Этот элемент относится к металлоидам. Электронная структура: [Kr]4d 10 5s 2 5p 3 . +5, +3 и -3 – это степени окисления. Руды сульфидов сурьмы используются для получения сурьмы и при низких температурах легко испаряются. С помощью сурьмы и мышьяка можно было делать сплавы. Полупроводники, которые используются в электронных гаджетах, сделаны из сурьмы и мышьяка.
Электронная структура: [Kr]4d 10 5s 2 5p 3 . +5, +3 и -3 – это степени окисления. Руды сульфидов сурьмы используются для получения сурьмы и при низких температурах легко испаряются. С помощью сурьмы и мышьяка можно было делать сплавы. Полупроводники, которые используются в электронных гаджетах, сделаны из сурьмы и мышьяка.
Висмут
Пятый элемент 15 группы – висмут. Этот элемент – металл. [Xe]4f 14 5d 10 6s 2 6p 3 — это электронная конфигурация. Подобно сурьме и мышьяку, висмут обладает плохими металлическими свойствами. Соединения висмута используются в медицине и косметике. Из-за низкой энергии ионизации и наименьшей электроотрицательности электрон теряется легче, чем другие элементы группы 15. Это указывает на причину металлической природы висмута.
Периодические тренды элементов группы 15
Периодические тренды элементов группы 15, найденные в p-блоке, даны как:
Атомные радиусы
радиуса, что связано с добавлением новых орбиталей. Но от мышьяка к висмуту увеличение ионного радиуса очень мало из-за полностью заполненных d- или f-орбиталей.
Но от мышьяка к висмуту увеличение ионного радиуса очень мало из-за полностью заполненных d- или f-орбиталей.
Электронная конфигурация
Поведение элемента можно предсказать по электронной структуре внешней оболочки. Для элементов группы 15 электронная структура внешней оболочки имеет вид ns 2 np 3 . Расположение всех элементов одинаковое, и благодаря одинаковому расположению они обладают сходными свойствами. В группе 15 s-орбитали полностью заполнены, а дополнительная стабильность достигается за счет p-орбиталей, которые заполнены наполовину.
Энтальпия ионизации
Количество энергии, необходимое для удаления электрона с валентной орбиты атома, называется энергией ионизации. Когда электрон находится рядом с ядром, удержание сильнее, и необходимая энергия будет выше. При движении к основанию группы атомный радиус будет увеличиваться; энергия ионизации уменьшается.
Электроотрицательность
При увеличении размера атома электроотрицательность уменьшается при движении нижней части группы.
Точки плавления и кипения
Из-за постоянного увеличения размера ядра температура плавления начинает повышаться от азота до мышьяка. Из-за дискретных двухатомных молекул азота температура плавления азота низкая. Существует снижение температуры плавления от мышьяка к сурьме. Наличием свободного прессования частиц объясняется меньшая температура плавления сурьмы по сравнению с мышьяком. Поскольку в висмуте атомы свободно упакованы металлическими связями, температура плавления висмута ниже по сравнению с сурьмой.
Температура кипения повышается от азота до висмута. Кроме того, плотность повышается по мере продвижения вниз по группе.
Свойства элементов группы 15
В этой группе пять элементов являются многоатомными по своей природе. Азот существует в виде газа, спускающегося вниз по группе; будет увеличение металлической природы. Неметаллические элементы — фосфор и азот, металлический элемент — висмут, металлоиды — мышьяк и сурьма. Помимо азота, элементы баланса существуют в аллотропных формах. При перемещении в нижнюю часть группы стабильность степени окисления +5 снижается, тогда как стабильность степени окисления +3 повышается из-за эффекта инертной пары.
При перемещении в нижнюю часть группы стабильность степени окисления +5 снижается, тогда как стабильность степени окисления +3 повышается из-за эффекта инертной пары.
Контекст и приложения
Эта тема важна для курсов бакалавриата, особенно для бакалавров по химии и других конкурсных экзаменов, таких как олимпиадные экзамены.
Практические задачи
Вопрос 1: Какой из перечисленных элементов находится в моноатомном состоянии?
- Азот
- Мышьяк
- Висмут
- Фосфор
Ответ: Верен вариант (3).
Объяснение: Висмут виден в моноатомном состоянии, потому что его склонность к катетенации слаба.
Вопрос 2: Назовите элемент, который входит в группу 15 элементов.
- Уран
- Ксенон
- Московий
- Радон
Ответ: Верен вариант (3).
Объяснение : Московий входит в группу 15 в дополнение к азоту, сурьме, висмуту, фосфору и мышьяку.

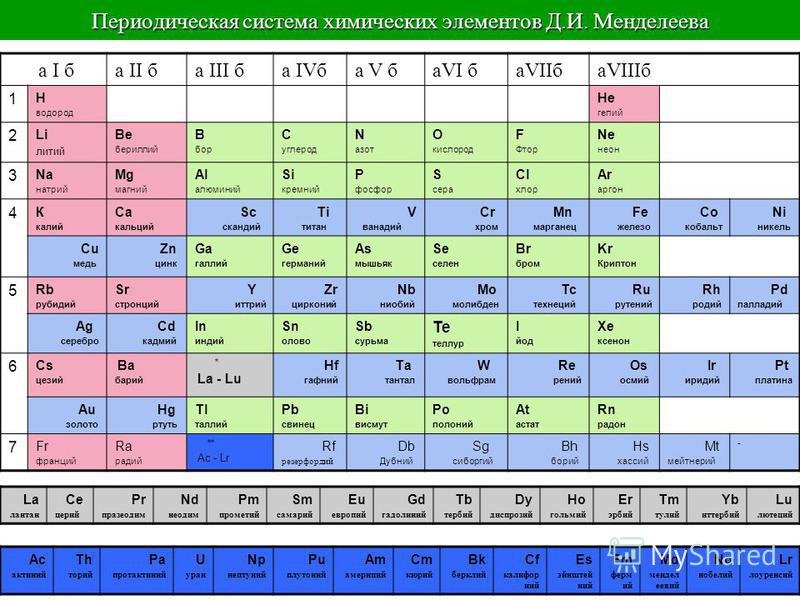 В отсортированном списке эти элементы показаны перед другими элементами с температурой кипения >0°C.
В отсортированном списке эти элементы показаны перед другими элементами с температурой кипения >0°C.