Элемент неожиданности
Недавно вышедшая новость об измерении потенциала ионизации лоуренсия, 103-го элемента периодической системы породила новую волну споров о его положении в таблице Менделеева. С одной стороны он принадлежит к группе актинидов, f-элементов, но целый ряд химиков предпочитает выделять его отдельно. Почему это такой важный вопрос? И как обстоит ситуация с соседями лоуренсия по таблице, другими актинидами?
Периодический закон, а, следовательно и периодическая таблица, появились не сразу. До Менделеева было множество ошибочных теорий. Например, триады Дёберейнера предполагали объединение элементов в тройки по похожести их свойств, а таблица Мейера группировала элементы по валентностям.
Менделеев в
основу своей таблицы положил распределение элементов в порядке возрастания
атомной массы. Эта идея не была принципиально новой, но предыдущие авторы
сталкивались с двумя проблемами.
Во-первых, атомные массы некоторых элементов
были определены на тот момент неправильно, а во-вторых, отнюдь не все элементы
были открыты.
С открытием строения атома в XX веке стало понятно, что порядок расположения элементов в периодической таблице определяется не атомной массой, а зарядом ядра. Кроме того, удалось выделить отдельные блоки элементов по их электронным свойствам – для того, чтобы разобраться с этим получше, стоит обратиться к строению атомов и выяснить, чем, к примеру, отличается атом водорода от атома лития или углерода.
Главная масса атома сосредоточена в ядре – можно представить его как шарик, состоящий из частиц двух видов, нейтронов и протонов. Протоны – носители положительного заряда, в то время как нейтроны зарядом не обладают. Вокруг ядра на некотором отдалении находятся электроны, заряженные отрицательно. Из курса школьной физики мы знаем, что заряды разных знаков притягиваются друг к другу – подобные силы и удерживают электроны около ядра.
Вокруг ядра на некотором отдалении находятся электроны, заряженные отрицательно. Из курса школьной физики мы знаем, что заряды разных знаков притягиваются друг к другу – подобные силы и удерживают электроны около ядра.
Важно заметить, что электрон является элементарной частицей, и из-за неопределенности Гейзенберга определить его положение в пространстве и скорость одновременно невозможно. Поэтому для электрона не существует понятия траектории и нельзя точно определить его орбиту. Вместо этого ученые оперируют понятием орбиталь – область пространства с высокой вероятностью обнаружения электрона (скажем, 90% шанс обнаружить его в этой области).
Рассмотрим для начала самый простой атом, атом водорода. В его центре находится всего один протон. Все атомы электронейтральны, поэтому чтобы скомпенсировать заряд протона в атоме водорода есть один электрон. Форма орбитали, на которой он находится сферическая, она обозначается символом s.
Следующим после водорода в таблице
Менделеева идет гелий, у него в ядре уже два протона (и два нейтрона, но они
нас сейчас не так важны), а значит вокруг них вращается уже два электрона, по
все той же сферической орбитали. Сколько электронов может находиться на одной орбитали
– довольно серьезный вопрос. В согласии с фундаментальным запретом, сформулированным
Вольфгангом Паули, строго не больше двух. Это связанно с тем, что электроны
относятся к такому типу частиц как фермионы – два одинаковых фермиона попросту
не уживаются вместе. Два электрона на одной орбитали оказываются способными
сосуществовать лишь благодаря различию в условном направлении собственного
вращения – в спине.
Сколько электронов может находиться на одной орбитали
– довольно серьезный вопрос. В согласии с фундаментальным запретом, сформулированным
Вольфгангом Паули, строго не больше двух. Это связанно с тем, что электроны
относятся к такому типу частиц как фермионы – два одинаковых фермиона попросту
не уживаются вместе. Два электрона на одной орбитали оказываются способными
сосуществовать лишь благодаря различию в условном направлении собственного
вращения – в спине.
Переходя от
гелия к литию, мы получаем атом с уже тремя электронами, которым на одной
орбитали «тесно» – нам требуется новая сферическая орбиталь, лежащая на большем
расстоянии от ядра чем предыдущая, назовем ее «относящейся ко второму слою».
Казалось бы, мы сможем представить себе такую луковичную структуру, которая
сможет вместить в себя сколько угодно электронов, но природа устроена сложнее. С
каждым новым слоем возникает один дополнительный вид орбиталей: на первом слое
орбитали только одного типа – сферические (1s), на втором – сферические (2s) и
гантелеобразные (2p), на третьем сферические (3s), гантелеобразные (3p) и похожие
на объемные диагонали куба (3d) и так далее.
Главной характеристикой орбиталей, кроме их геометрической формы, является их энергия. Чем в более внешнем слое находится орбиталь, тем меньше электрон связан с ядром и тем легче его оторвать. При этом, если в более глубоком слое есть вакантные места, то электроны свободно туда проваливаются. Из-за этого заполнение орбиталей идет по порядку, соответствующему их энергиям – он отличается от послойного заполнения (см. изображения). 3d-орбиталь (d-орбиталь третьего энергетического уровня) оказывается энергетически ниже, чем 4s (s-орбиталь четвертого энергетического уровня), а 4f (f-орбиталь четвертого уровня) даже ниже чем 6s.
Даже из
этого правила есть исключения, связанные со стремлением электронных
оболочек
атомов к симметрии. К примеру, атом меди должен обладать двумя
электронами на 4s орбитали (полностью заполненный
уровень) и девятью электронами на 3d орбиталях (не хватает одного до
полного заполнения). Но более симметричным состоянием является полностью
заполненный 3d-уровень,
поэтому один электрон с s-оболочки уходит на казалось бы
менее выгодный уровень.
Деление элементов периодической системы на блоки происходит по следующему принципу: s-блок или s-элементы – элементы, в которых происходит заполнение сферической орбитали, p-элементы – в них происходит заполнение p-орбитали и так далее. К s-блоку относятся щелочные и щелочноземельные металлы, такие как натрий, калий, магний, кальций и их соседи снизу по таблице, а также водород. Более обширен p-блок, в него входят подгруппы бора, углерода, азота, кислорода, фтора и благородные газы (кроме гелия).
В рамках школьной
программы блок d-элементов обычно рассматривается очень поверхностно –
из всего разнообразия металлов рассматривается только железо, марганец, хром,
медь и серебро, а об f-элементах большинство знает лишь
то, что они выделены в отдельные полосы, расположенные под основным материалом
таблицы. Первая полоса соответствует элементам от церия до лютеция, вторая – от
тория до лоуренсия. Скандий и иттрий, а также элементы от лантана до лютеция
вместе образуют группу редкоземельных элементов, очень важных для современной
микроэлектронной и оптической промышленности.
Тривиальные (обиходные) название f-элементов – лантаниды и актиниды, дословно «идущие за лантаном/актинием», однако вопросы, связанные с этими элементами, возникают уже на моменте их названия. В русскоязычной литературе, особенно относящейся ко второй половине XX века чаще всего можно встретить названия лантаноиды и актиноиды. Греческая приставка e
Интересно, что для моделирования свойств тяжелых элементов необходимо
учитывать поправки, связанные со специальной теорией относительности. Из-за больших радиусов атомов, «скорости»
электронов приближаются к скорости света, что приводит к необходимости
использовать релятивистские поправки. Для актинидов эти поправки по
своей
величине становятся сопоставимыми с результатами классических
квантово-химических
расчетов, тем самым сильно влияя на модель.
Из-за больших радиусов атомов, «скорости»
электронов приближаются к скорости света, что приводит к необходимости
использовать релятивистские поправки. Для актинидов эти поправки по
своей
величине становятся сопоставимыми с результатами классических
квантово-химических
расчетов, тем самым сильно влияя на модель.
Конкретным примером может послужить лоуренсий – у его предшественника, нобелия, полностью заполнены 7s и 5f орбитали и следующей на очереди должна быть 6d-орбиталь, однако из-за релятивистских эффектов заполненной оказывается 7p-орбиталь. Из таких соображений, лоуренсий можно отнести к p-элементам, однако результаты недавних исследований вызывают спор об отнесении его к f- или d-элементам. По схожим причинам в электронном строении других актинидов также наблюдаются серьезные отклонения от привычного порядка заполнения орбиталей.
Недавно были
опубликованы результаты исследования, в рамках которого ученые выяснили
экспериментально потенциал ионизации лоуренсия. Эта величина является энергией,
необходимой для отрыва внешнего электрона от атома.
Эта величина поразительно мала, пятая среди всех изученных элементов – лишь калий, рубидий, цезий и франций легче отдают свой электрон. При этом, она является важным показателем химических свойств, в частности, позволяет судить о том, что лоуренсий проявляет сильные металлические свойства.
Исходя из
того, что группировка элементов в блоки сообразна их химическим свойствам,
становится принципиальным вопрос отрыва лоуренсия от основного f-блока и
помещение в блок d-элементов. На кого он больше похож, на остальные актиниды
или на скандий и иттрий? С точки зрения одного из авторов оригинального исследования,
низкий потенциал ионизации поддерживает мнение об его отношении к f-блоку
(потенциал значительно отличается от Sc (6. 54 eV) и Y (6.38 eV). Однако, одновременно с этим он
нарушает тенденцию, характерную для актинид – в среднем они обладают более
высокой энергией отрыва первого электрона от ядра по сравнению с их соседями
сверху, лантанидами. Потенциал же лютеция (располагается над лоуренсием) равен
5,31 eV.
54 eV) и Y (6.38 eV). Однако, одновременно с этим он
нарушает тенденцию, характерную для актинид – в среднем они обладают более
высокой энергией отрыва первого электрона от ядра по сравнению с их соседями
сверху, лантанидами. Потенциал же лютеция (располагается над лоуренсием) равен
5,31 eV.
Вопрос о существовании отдельно выделенной группы актинидов в таблице Менделеева поднимался давно. В первую очередь это связанно с серьезными отличиями в их химических свойствах в целом. К примеру, все лантаниды преимущественно обладают степенью окисления +3 в своих соединениях, другие степени окисления являются скорее исключениями из правил: церий также устойчив в степени окисления +4, а европий в степени окисления +2. Для актинидов же наиболее стабильные степени окисления сильно варьируются, особенно в первой половине их списка: торий +4, протоактиний +5, уран +6, нептуний +5, плутоний +4, америций +3. Вторая половина актинидов преимущественно обладает степенью окисления +3.
Связано
подобное разнообразие с нестандартным заполнением электронных оболочек
актинидов. Сравнивая оболочки первой половины актинидов с соответствующими
лантанидами, получается найти гораздо больше отличий, нежели сходств. Отсюда же
становится понятно, почему вторая половина актинидов гораздо больше похожа между
собой – их оболочки очень похожи на соответствующие оболочки соседей сверху.
Сравнивая оболочки первой половины актинидов с соответствующими
лантанидами, получается найти гораздо больше отличий, нежели сходств. Отсюда же
становится понятно, почему вторая половина актинидов гораздо больше похожа между
собой – их оболочки очень похожи на соответствующие оболочки соседей сверху.
Долгое время после открытия f-элементов их пытались помещать в основные группы таблицы Менделеева. Например, торий оказывался в четвертой группе с цирконием и гафнием, а уран – в шестой, вместе с хромом, вольфрамом и молибденом. Исследование же свойств трансурановых элементов поначалу вызвало желание разместить их вместе с ураном в шестой группе (и нептуний и плутоний способны проявлять степень окисления +6, хотя она и не самая устойчивая), создавая аналог «триады железа». Однако пример последующих элементов – америция, кюрия и берклия показал, что определенное сходство между этими элементами есть.
Любопытно,
что также предпринимались попытки рассматривать f-блок как семейство тория, поскольку
многие из них проявляют степень окисления +4.
Несмотря на то, что все актиниды – радиоактивные элементы, у них находилось неожиданно много бытовых и полубытовых применений. Например, изотопы америция (Am-241) и плутония (Pu-239) оказались эффективными источниками ионизирующего излучения в датчиках дыма (выпускались, соответственно в США и СССР). Сейчас такие датчики уже не выпускаются. Другим применением америция-241 являются датчики толщины стальных и алюминиевых листов, основываясь на поглощении ими мягкого гамма-излучения, испускаемого изотопом. Уран, пожалуй, один из самых известных актинидов, применялся в составе красок (в виде ураната натрия). Многим химикам уран может быть знаком еще по аналитическому реактиву на соли натрия, уранил ацетату цинка, дающему характерные золотистые кристаллы.
Спектр же
основных применений радиоактивных элементов известен – в первую очередь это
ядерная энергетика. На основе кюрия-244 и плутония-238 изготавливают
радиоизотопные термоэлектрические генераторы, работающие батарейками для
космических зондов, 235-ый уран является важным топливом для атомных реакторов,
постепенно разрабатываются реакторы, работающие на тории. И если на сегодняшний
день из всех f-элементов
наиболее широким применением обладают лантаниды, то может со временем, в свете
приближающегося энергетического кризиса, именно актиниды станут незаменимым
сырьем в промышленности.
И если на сегодняшний
день из всех f-элементов
наиболее широким применением обладают лантаниды, то может со временем, в свете
приближающегося энергетического кризиса, именно актиниды станут незаменимым
сырьем в промышленности.
Владимир Королёв
Женщины периодической таблицы – Science in School
Author(s): Аннет Ликкнес [Annette Lykknes], Бригит Ван Тиггелен [Brigitte Van Tiggelen]
Перевод выполнен Надей Фёдоровой (Nadia Fedorova). Познакомьтесь со вкладом женщин-учёных в изучение химических элементов – и как это влияет на наше понимание природы…
В марте 1869 года русский химик Дмитрий Менделеев впервые докладывал об изобретённый им периодической системе химических элементов в Российской Академии Наук (Gordin, 2004). Менделеев разработал свою систему на основании сформулированного им же периодического закона, утверждающего что свойства элементов стоят в периодической зависимости от их атомного веса. Система Менделеева, достигшая полуторавековой годовщины, доказала свою устойчивость в свете новых научных открытий, начиная с открытия благородных газов и радиоактивных элементов и кончая квантовой физикой.
Система Менделеева, достигшая полуторавековой годовщины, доказала свою устойчивость в свете новых научных открытий, начиная с открытия благородных газов и радиоактивных элементов и кончая квантовой физикой.
Впрочем история периодической таблицы элементов началась задолго до 1869 года, так же как и научный вклад внесённый в разработку периодической теории женщинами-учёными. История научных открытий часто представляется с точки зрения основных понятий и теорий, и упускает огромное количество экспериментальных работ и случайных наблюдений благодаря которым были разработаны эти понятия и теории. Именно эту забытую и неоценённую работу часто выполняли женщины. Желая изменить эту тенденцию, в год объявленный Международным Годом Периодической Таблицыw1, мы хотим рассказать истории нескольких женщин-учёных, чьи работы внесли важный вклад в изучение элементов периодической таблицы.
XVIII век
Мария-Анна Лавуазье и новая идея химического элемента
Портрет Марии-Анны иАнтуана Лавуазье [Marie-
Anne and Antoine Lavoisier]
(1788) (нажмите на
фотографию для
увеличения)
Жак-Луи Давид [Jacques-Louis
David], свободный доступ
Революция в химии, происшедшая во Франции в восьмидесятых годах восемнадцатого века, часто отмечается как начало современной химической науки.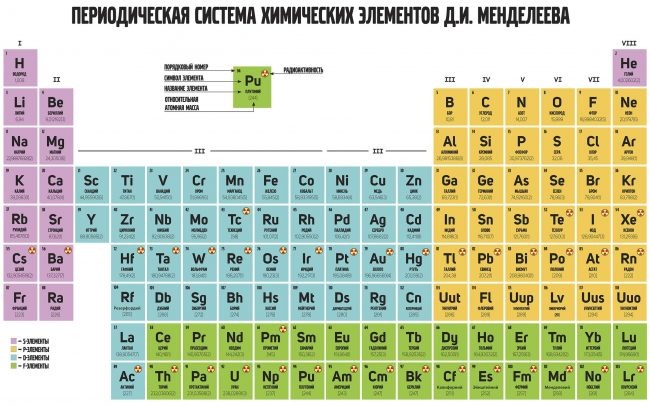 Центральной фигурой в этом процессе выступал французский аристократ Антуан Лавуазье [Antoine Lavoisier]. В своей работе Méthode de nomenclature chimique (1787), Лавуазье и его коллеги присвоили новые систематические имена всем известным в то время химическим элементам и разработали правила наименование химических соединений которые используются по сей день. Лавуазье также определил химический элемент как элементарную субстанцию которая не поддается разложению во время химического анализа, и составил таблицу содержащую 33 элемента. Хотя не все они признаются элементами в современной химии, работы Лавуазье положили конец эпохе в которой выделялись только четыре элемента, земля, воздух, огонь, и вода.
Центральной фигурой в этом процессе выступал французский аристократ Антуан Лавуазье [Antoine Lavoisier]. В своей работе Méthode de nomenclature chimique (1787), Лавуазье и его коллеги присвоили новые систематические имена всем известным в то время химическим элементам и разработали правила наименование химических соединений которые используются по сей день. Лавуазье также определил химический элемент как элементарную субстанцию которая не поддается разложению во время химического анализа, и составил таблицу содержащую 33 элемента. Хотя не все они признаются элементами в современной химии, работы Лавуазье положили конец эпохе в которой выделялись только четыре элемента, земля, воздух, огонь, и вода.
На известной картине Лавуазье изображён со своей женой Марией-Анной: он занят работой а она представлена в виде его музы-вдохновительницы. На самом деле, их отношения этим не ограничивались. Мария-Анна принимала активное участие в научной работе мужа. Она помогала ему в лаборатории, вела его корреспонденцию, принимала иностранных учёных в своём салоне, переводила зарубежные научные статьи на французский, и иллюстрировала научные книги. Кроме того, она сыграла большую роль в распространении новых химических идей, особенно идеи кислорода, когда она перевела и снабдила критическими комментариями работу ирландского химика Ричарда Кирвана [Richard Kirwan], скептически относившегося к идее синтеза воздуха из кислорода и водорода и придерживавшегося теории ‘флогистона’.
Кроме того, она сыграла большую роль в распространении новых химических идей, особенно идеи кислорода, когда она перевела и снабдила критическими комментариями работу ирландского химика Ричарда Кирвана [Richard Kirwan], скептически относившегося к идее синтеза воздуха из кислорода и водорода и придерживавшегося теории ‘флогистона’.
XIX век
Джейн Марсе знакомит широкую публику с химическими элементами
В 1806 году, спустя несколько десятилетий после революции в химической науке, швейцарка из Лондона по имени Джейн Марсе [Jane Marcet] написала учебник по химии который выдержал 16 английских и по меньшей мере 23 американских издания и был переведён на французский, немецкий и итальянский языки (Dreifuss & Sigrist, 2012).
Учебник был написан в форме диалога и предназначен для женской аудитории, и его широкий успех сделал химию изысканным и благородным предметом интереса для широкой публики, включая женщин и девочек. Марсе включила в учебник новейшие на то время открытия в химии: взяв за основу таблицу химических элементов Лавуазье, она добавила в неё только-что открытые Хэмфри Дэви [Humphry Davy] щелочные и щелочноземельные металлы (Na, K, Mg, Ca, Sr, Ba). Кроме того в учебнике были упомянуты элементы теоретически предсказанные или практически полученные Йёнсом Якобом Берце́лиусом [Jöns Jacob Berzelius] и его учениками (Ce, Th, Se, Si, Zr, Li, La, Er, Tb, V), а также элементы открытые Уильямом Хайдом Волластоном [William Hyde Wollaston] (Rh, Pd), Смитсоном Теннантом [Smithson Tennant] (Os, Ir), и Чарльзом Хэтчеттом [Charles Hatchett] (колумбий, сейчас известный как Nb). Марсе вращалась в Лондонском научном обществе, и через своих знакомых она знала о многих открытиях которые ещё не стали достоянием общественности. Не смотря на это, первые издания её учебника были опубликованы анонимно.
Кроме того в учебнике были упомянуты элементы теоретически предсказанные или практически полученные Йёнсом Якобом Берце́лиусом [Jöns Jacob Berzelius] и его учениками (Ce, Th, Se, Si, Zr, Li, La, Er, Tb, V), а также элементы открытые Уильямом Хайдом Волластоном [William Hyde Wollaston] (Rh, Pd), Смитсоном Теннантом [Smithson Tennant] (Os, Ir), и Чарльзом Хэтчеттом [Charles Hatchett] (колумбий, сейчас известный как Nb). Марсе вращалась в Лондонском научном обществе, и через своих знакомых она знала о многих открытиях которые ещё не стали достоянием общественности. Не смотря на это, первые издания её учебника были опубликованы анонимно.
Национальная медицинская библиотека США [US National Library of Medicine/archive.
 org], свободный доступ
org], свободный доступЮлия Лермонтова и редкие платиновые металлы
Портрет Юлии Лермонтовой[Julia Lermontova]
А Карвэйн [A Karvain]/Institut
Mittag-Leffler
Положение Юлии Лермонтовой [Julia Lermontova] намного отличалось от её предшественниц. Русская женщина-химик стала первой женщиной в Германии (и одной из первых в мире) получившей докторскую степень в химии в 1874 году. Современница Менделеева, она училась в Гейдельберге [Heidelberg] у Роберта Бунзена [Robert Bunsen], работала с Августом Вильгельмом фон Гофманом [Wilhelm von Hoffman] и получила свою докторскую степень в Гёттингене [Göttingen]. Лермонтова взяла на себя тяжёлую и кропотливую работу по определению места в периодической таблице для элементов платиновой группы (Ru, Rh, Pd, Os, Ir, Pt). Эти элементы очень близки друг к другу по своим свойствам и атомному весу. Необходимость точно определить их атомный вес требовала приготовления абсолютно чистых химических субстанций, для чего было необходимо точно повторять сложные аналитические измерения много раз подряд. Понятно что такая работа не пользовалась интересом у большинства учёных и обычно доставалась “пехотинцам от науки”, таким как Лермонтова. Научный вклад таких лабораторных химиков, многие из которых были женщинами и от которых требовалось получение чистых элементов или измерение точного атомного веса, огромен, но в большинстве своём забыт. Однако именно эта кропотливая работа ярко иллюстрирует проблемы с которыми сталкивались Менделеев и его современники в своих усилиях сгруппировать все известные элементы в осмысленную систему. Неопубликованные работы Лермонтовой, долгое время остававшиеся неизвестными, были обнаружены в архиве Менделеева почти сто лет спустя.
Понятно что такая работа не пользовалась интересом у большинства учёных и обычно доставалась “пехотинцам от науки”, таким как Лермонтова. Научный вклад таких лабораторных химиков, многие из которых были женщинами и от которых требовалось получение чистых элементов или измерение точного атомного веса, огромен, но в большинстве своём забыт. Однако именно эта кропотливая работа ярко иллюстрирует проблемы с которыми сталкивались Менделеев и его современники в своих усилиях сгруппировать все известные элементы в осмысленную систему. Неопубликованные работы Лермонтовой, долгое время остававшиеся неизвестными, были обнаружены в архиве Менделеева почти сто лет спустя.
XX век
Мария Склодовская-Кюри и радиоактивные элементы
Мария и Пьер Кюри [Marieand Pierre Curie] в своей
лаборатории, около 1900
года
Wellcome Collection,CC BY 4.0
Не смотря на то что научные работы Марии Склодовской-Кюри [Marie Curie] хорошо известны, их научный вклад всё равно поражает воображение.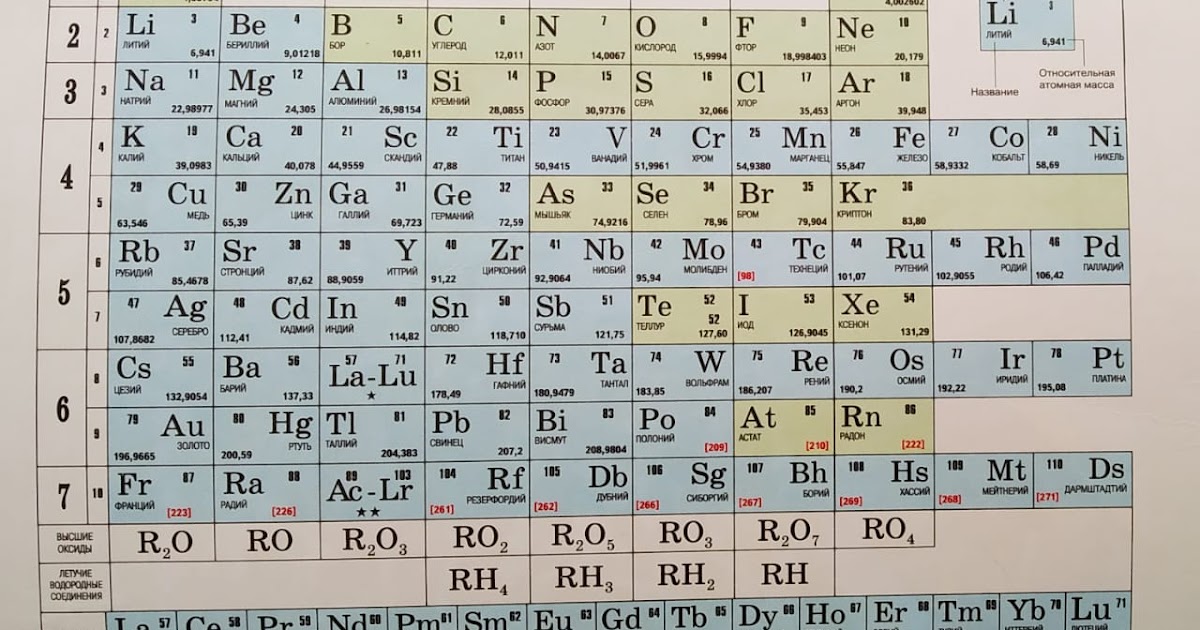 С тех пор как Мария, вместе с мужем Пьером и сотрудником Густавом Бемонтом [Gustave Bémont], открыла полоний и радий в 1898 году, они должны были проделать огромную работу, подвергая тонны минеральной смолы тщательному химическому анализу, чтобы получить 0.1 г хлорида радия в 1902 году (Quinn, 1995). Хотя Мария была женой Пьера, они работали независимо друг от друга до тех пор пока Пьер не осознал огромную важность работы жены и не присоединился к её лаборатории. Любопытно что в данном случае забытым учёным оказалась не женщина а мужчина, Бемонт.
С тех пор как Мария, вместе с мужем Пьером и сотрудником Густавом Бемонтом [Gustave Bémont], открыла полоний и радий в 1898 году, они должны были проделать огромную работу, подвергая тонны минеральной смолы тщательному химическому анализу, чтобы получить 0.1 г хлорида радия в 1902 году (Quinn, 1995). Хотя Мария была женой Пьера, они работали независимо друг от друга до тех пор пока Пьер не осознал огромную важность работы жены и не присоединился к её лаборатории. Любопытно что в данном случае забытым учёным оказалась не женщина а мужчина, Бемонт.
Ида Ноддак-Такке и рений
Ида Ноддак-Такке [IdaNoddack—Tacke] регулирует
рентгеновский
спектрометер в своей
лаборатории, 1944 год
Архив Католического
Университета в Левене
[Universiteitsarchief Katholieke
Universiteit te Leuven]
Немецкому химику Иде Ноддак-Такке [Ida Noddack-Tacke] пришлось проделать ту же изнуряющую работу что и Марии Склодовской-Кюри когда она трудилась над получением одного из самых редких металлов на земле, рения (Van Tiggelen, 2001).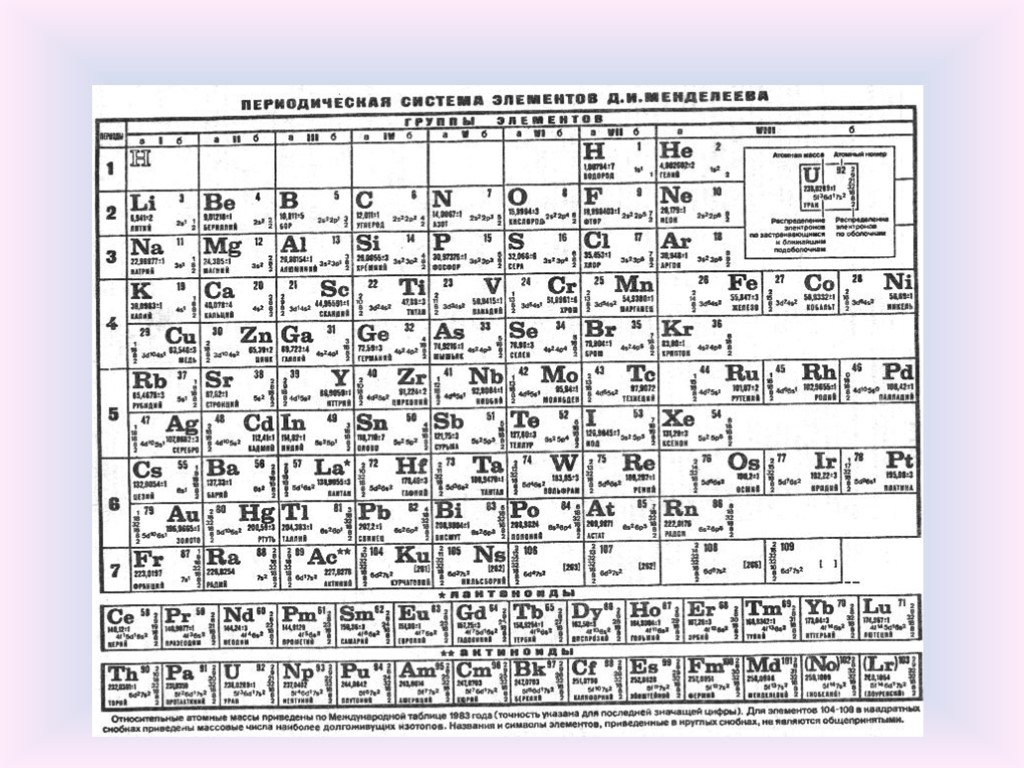 Открытие рения было объявлено Идой (вместе с её женихом Вальтером Ноддаком [Walter Noddack] и сотрудником Отто Бергом [Otto Berg], ещё одним забытым учёным) в 1925 году, но прошло ещё три года прежде чем были получены первые 120мг чистого рения, а его атомный вес был измерен только в 1929 году. Столько времени Иде и Вальтеру потребовалось чтобы найти места с богатыми залежами рениевой руды и проанализировать тысячи образцов для получения чистого элемента. Осталось большое количество лабораторных записей свидетельствующих о кропотливой и однообразной работе которая часто не приносила успеха. Несмотря на то что Ноддаки, также как Кюри, помогали друг другу в научной работе, Ида оставалась в финансовой зависимости от мужа и её академическая карьера полностью зависела от Вальтера.
Открытие рения было объявлено Идой (вместе с её женихом Вальтером Ноддаком [Walter Noddack] и сотрудником Отто Бергом [Otto Berg], ещё одним забытым учёным) в 1925 году, но прошло ещё три года прежде чем были получены первые 120мг чистого рения, а его атомный вес был измерен только в 1929 году. Столько времени Иде и Вальтеру потребовалось чтобы найти места с богатыми залежами рениевой руды и проанализировать тысячи образцов для получения чистого элемента. Осталось большое количество лабораторных записей свидетельствующих о кропотливой и однообразной работе которая часто не приносила успеха. Несмотря на то что Ноддаки, также как Кюри, помогали друг другу в научной работе, Ида оставалась в финансовой зависимости от мужа и её академическая карьера полностью зависела от Вальтера.
Стефани Хоровиц и доказательство радиоактивных изотопов
Стефани Хоровиц [StefanieHorovitz] в Институте Радия
[The Radium Institute] в
Вене, 1915 год
Австрийская Центральная
Физическая Библиотека
[Austrian Central Library for
Physics], Вена
Работа польского химика еврейского происхождения Стефани Хоровиц [Stefanie Horovitz] обеспечила первое авторитетное доказательство существования изотопов. Идея изотопов, элементов которые могут существовать в состоянии разного атомного веса, была изначально предложена английским химиком Фредериком Содди [Frederick Soddy] в 1913 году. Содди, в свою очередь, использовал термин предложенный английским доктором Маргарэт Тодд [Margaret Todd]. К этому времени было открыто около 35 радиоактивных элементов – намного больше чем количество пустых мест в периодической таблице. Существование изотопов разрешало эту проблему, так как многие вновь открытые радиоактивные элементы позже оказались изотопами ранее известных. Однако эта идея была вначале встречена скептически.
Идея изотопов, элементов которые могут существовать в состоянии разного атомного веса, была изначально предложена английским химиком Фредериком Содди [Frederick Soddy] в 1913 году. Содди, в свою очередь, использовал термин предложенный английским доктором Маргарэт Тодд [Margaret Todd]. К этому времени было открыто около 35 радиоактивных элементов – намного больше чем количество пустых мест в периодической таблице. Существование изотопов разрешало эту проблему, так как многие вновь открытые радиоактивные элементы позже оказались изотопами ранее известных. Однако эта идея была вначале встречена скептически.
Чтобы доказать существование изотопов, Содди выдвинул идею для экспериментального анализа: если свинец может существовать в виде разных изотопов, тогда атомный вес свинца полученного из урана будет отличаться от обычного свинца. В 1914 году эта работа была поручена Хоровиц её научным руководителем, Отто Хёнигшмидом [Otto Hönigschmid] из Венского Института Радия. Много дней Стефани провела в лаборатории изолируя образцы чистейшего свинца из радиоактивной урановой руды и измеряя их атомный вес с помощью точнейших гравиметрических методов. Её измерения показали разницу в атомном весе превышающую экспериментальную ошибку, тем самым раз и навсегда доказав существование изотопов.
Её измерения показали разницу в атомном весе превышающую экспериментальную ошибку, тем самым раз и навсегда доказав существование изотопов.
Кроме того, вместе с Хёнигшмидом, она помогла опровергнуть существование предположительно нового элемента названного ионием. Они доказали что ионий имел те-же спектроскопические и химические свойства что и торий, отличаясь от тория только атомным весом. В результате ионий был классифицирован как изотоп тория (Th-230).
Эллен Гледич и не радиоактивные изотопы
Портрет Эллен Гледич [EllenGleditsch], 1927 год
Крис Кох [Chris Koch]
Хотя Эллен Гледич [Ellen Gleditsch] родилась и выросла в Норвегии, она получила первый опыт работы с радиоактивными элементами в лаборатории Марии Кюри в Париже (Lykknes, 2005). После этого она уехала в Америку, где её работа в Йельском Университете [Yale University] помогла установить точную величину периода полураспада радия (позднее классифицированного как изотоп RA-226). Эта работа, опубликованная в 1915 году, дала науке важную константу так как радий считался эталоном в этой исследовательской области.
Эта работа, опубликованная в 1915 году, дала науке важную константу так как радий считался эталоном в этой исследовательской области.
Позднее, работая в Гарвардском Университете [Harvard University], Гледич (как и Хоровиц) увлеклась работой с изотопами. Тогда уже было известно что атомный вес радиоактивных элементов (или продуктов радиоактивного распада) может меняться в зависимости от их геологической природы. Например, в рудах богатых природным торием, изобилие свинца-208 повышает атомный вес свинца, тогда как в урановых рудах (откуда получают свинец-206) атомный вес свинца будет ниже. Эта изменчивость изначально приписывалась только радиоактивным элементам.
Но изобретение масс-спектрографа, совершённое Фрэнсисом Астоном [Francis Aston] в 1919 году, опровергло это убеждение. Масс-спектрограф позволил произвести исключительно аккуратную классификацию элементов на основании их атомного веса и электрического заряда. Когда Астон объявил что он обнаружил два отдельных атомных веса хлора (35 и 37) со средним атомным весом в 35. 46, это было встречено скептически – получалось что и в этом случае изотопный состав зависит от геологической природы. Вся концепция постоянства атомного веса, на базе которой была построена периодическая система, оказалась под сомнением.
46, это было встречено скептически – получалось что и в этом случае изотопный состав зависит от геологической природы. Вся концепция постоянства атомного веса, на базе которой была построена периодическая система, оказалась под сомнением.
Когда Гледич и её сотрудники исследовали хлор полученный из разных источников, они обнаружили что изотопный состав хлора на самом деле не меняется от источника к источнику. Несмотря на то что Ирэн Кюри [Irène Curie] (дочь Пьера и Марии) получила противоположные результаты, Гледич заключила что образцы Кюри были загрязнены. В конце концов атомный вес хлора оказался постоянным и угроза стабильности атомного веса была предотвращена.
Комплексность и сотрудничество
На протяжение всего существования периодической системы женщины внесли значительный научный вклад в её развитие: в салонах VIII века; как переводчики научных трактатов; как авторы учебников и распространительницы знаний; как жёны, сёстры и дочери учёных, помогавшие им в научных исследованиях; как лаборанты, учителя, и профессора; в лабораториях, школах, в семьях, и на заводах (Watts, 2007). Истории отдельных женщин, которые обогатили науку периодической системы элементов, доказывают что научная работа сложна и многогранна и что она основана на взаимном сотрудничестве. Кроме того, эти истории не только знакомят нас с мало известным научным вкладом многих женщин (и мужчин): они также открывают перед нами истинную природу науки и научных исследований.
Истории отдельных женщин, которые обогатили науку периодической системы элементов, доказывают что научная работа сложна и многогранна и что она основана на взаимном сотрудничестве. Кроме того, эти истории не только знакомят нас с мало известным научным вкладом многих женщин (и мужчин): они также открывают перед нами истинную природу науки и научных исследований.
Благодарности
Авторы хотят поблагодарить всех кто предоставил статьи о женщинах-учёных и химических элементах в предстоящий том “Женщины в своей стихии: Вклад отдельных женщин в развитие периодической системы” [Women in their Element: Selected Women’s Contributions to the Periodic System] (публикуется World Scientific, Август 2019). Особенная благодарность следующим авторам: Патрис Брет [Patrice Bret] и Кейко Кавашима [Keiko Kawashima], Жизела Боек [Gisela Boeck], Питер Чайлдс [Peter Childs], Джон Хадсон [John Hudson], Мерилин и Джофри Рэйнер-Кэнем [Marelene and Geoffrey Rayner-Canham], и Кзэвиер Рок [Xavier Roqué].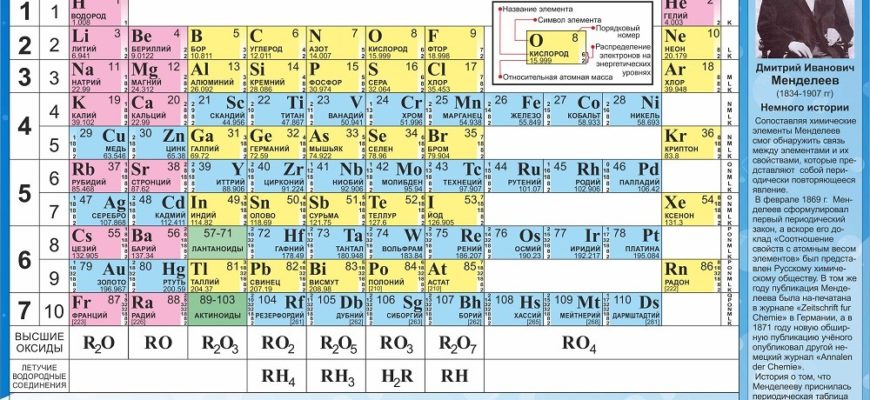
References
- Dreifuss JJ, Sigrist NT (2012) The making of a bestseller: Alexander and Jane Marcet’s Conversations on Chemistry. In Lykknes A, Opitz DL, Van Tiggelen B (eds) For Better or For Worse? Collaborative Couples in the Sciences pp 19–32. Basel, Switzerland: Birkhäuser/Springer. ISBN: 3034802854
- Gordin MD (2004) A Well-Ordered Thing: Dmitrii Mendeleev and the Shadow of the Periodic Table. New York, USA: Basic Books. ISBN: 046502775X
- Lykknes A (2005) Ellen Gleditsch: Professor, Radiochemist, and Mentor. PhD thesis, Department of Chemistry, Norwegian University of Science and Technology, Trondheim, Norway.
- Quinn S (1995) Marie Curie: A Life. Cambridge, USA: Perseus Books. ISBN: 0201887940
- Van Tiggelen B (2001) The discovery of new elements and the boundary between physics and chemistry in the 1920s and 1930s. The case of elements 43 and 75. In Reinhardt C (ed) Chemical Sciences in the 20th Century: Bridging Boundaries pp 131–145.
 Weinheim, Germany: Wiley-VCH. ISBN: 3527302719
Weinheim, Germany: Wiley-VCH. ISBN: 3527302719 - Watts R (2007) Women in Science: A Social and Cultural History. London, UK: Routledge. ISBN: 0415253071
Web References
Resources
- Узнайте больше о Международном Годе Периодической Таблицы на сайте IYPT2019.
- Прочитайте больше о Джейн Марсе и написанном ей учебнике в этой статье Chemistry World.
- Прочитайте краткие биографии Марии Склодовской-Кюри, Антуана Лавуазье и Джейн Марсе на сайте Института Научной Истории [Science History Institute].
- Исследуйте историю периодической таблицы прочитав об альтернативных путях расположения элементов. Смотрите:
- Lorch M (2019) Arranging the elements: the evolving design of the periodic table. Science in School 47: 26-29.
Author(s)
Аннет Ликкнес [Annette Lykknes] — профессор химического образования в Норвежском Университете Науки и Техники [Norwegian University of Science and Technology] в Норвегии.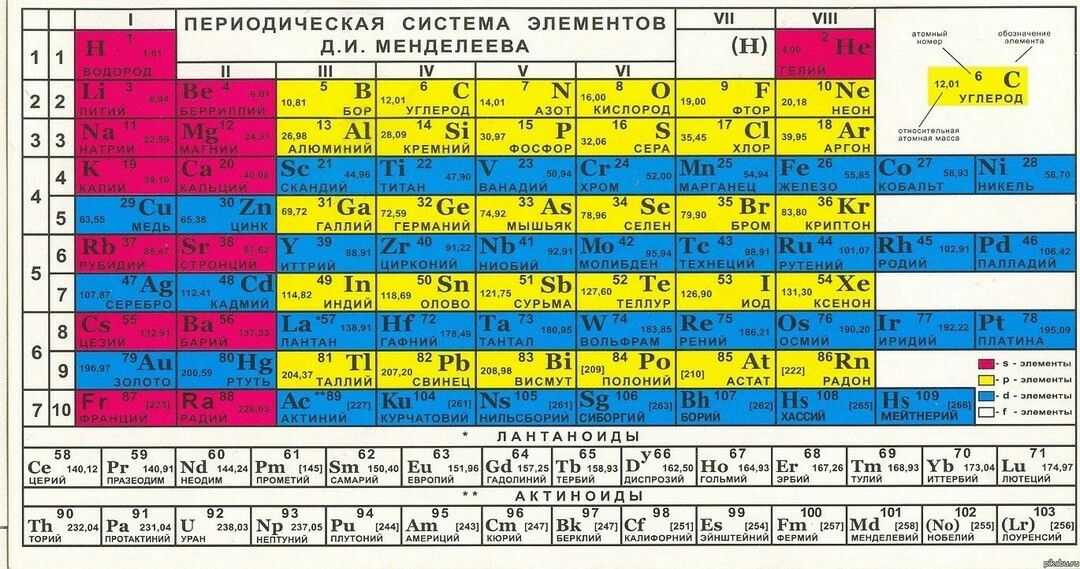 Она имеет степень магистра в области химического образования и докторскую степень по истории химии. С 2005 года она готовит преподавателей естественных наук. Ее научные интересы включают историю химии, научный вклад женщин и семейных пар, историю учебников по химии (как старых так и современных), природу науки, и преподавание естественных наук в школах через культуру и практику.
Она имеет степень магистра в области химического образования и докторскую степень по истории химии. С 2005 года она готовит преподавателей естественных наук. Ее научные интересы включают историю химии, научный вклад женщин и семейных пар, историю учебников по химии (как старых так и современных), природу науки, и преподавание естественных наук в школах через культуру и практику.
Бригит Ван Тиггелен [Brigitte Van Tiggelen] является директором по европейским операциям и старшим научным сотрудником Центра Исторических Исследований Института Истории Науки [Center for Historical Research at the Science History Institute] в Филадельфии, Пенсильвания, США. Она также является членом Центра Исторических Наук Католического Университета [Centre de Recherche en Histoire des Sciences, Université Catholique de Louvain] в Лувене, Бельгия. Она изучала физику и историю, и написала докторскую диссертацию по истории химии. Ее исследовательские интересы включают научный вклад семейных пар и женщин, историю отечественной науки и бельгийской химии. Она основала Mémosciences с целью популяризации истории науки, в особенности среди учителей средних школ.
Она основала Mémosciences с целью популяризации истории науки, в особенности среди учителей средних школ.
Review
Большинство людей, если их попросят назвать женщин внёсших научный вклад в развитие периодической таблицы, не смогут назвать ни одной. Эта статья даёт короткое но исключительно интересное представление о развитие этого фундаментального химического принципа, а также знакомит со многими забытыми учёными (как женщинами так и мужчинами) выполнившими большую научную работу но не получившими должного признания.
Эта статья может помочь стимулировать дискуссию, или послужить как материал для дополнительного чтения при изучении химии. Рекомендуется также делать меж-предметные ссылки в другие области науки где роль женщин недооценивается, например вычислительная техника, математика, и исследование космоса. Статья будет хорошим ресурсом для организованного классного чтения или как упражнение на понимание. Возможны следующие вопросы:
- Опишите роль Марии-Анны Лавуазье в установлении современной концепции химического элемента.

- Объясните почему учебник Джейн Марсе был успешным в популяризации химических элементов.
- Почему определение правильного расположения некоторых элементов в периодической таблице оказалось трудной задачей?
Кэрин Ховард [Caryn Howard], руководитель отдела химии, Школа Святой Марии [St Mary’s School], Калн, Великобритания
License
CC-BY
Download
Download this article as a PDF
Группа 16: Семейство кислорода (халькогены)
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 567
Семейство кислорода, также называемое халькогенами, состоит из элементов, находящихся в 16-й группе периодической таблицы, и считается одним из основных элементов группы. Он состоит из элементов кислорода, серы, селена, теллура и полония. Они встречаются в природе как в свободном, так и в связанном состоянии.
Он состоит из элементов кислорода, серы, селена, теллура и полония. Они встречаются в природе как в свободном, так и в связанном состоянии.
- Группа 16: Общие свойства и реакции
- Семейство кислорода, также называемое халькогенами, состоит из элементов, находящихся в группе 16 периодической таблицы, и считается одним из основных элементов группы. Он состоит из элементов кислорода, серы, селена, теллура и полония. Они встречаются в природе как в свободном, так и в связанном состоянии. Элементы группы 16 тесно связаны с жизнью.
- Oxygen Group (Group VIA) Тенденции
- Химия кислорода (Z=8)
- Кислород — это элемент, который широко известен широкой публике из-за его большой роли в поддержании жизни. Без кислорода животные не могли бы дышать и, следовательно, умирали бы. Кислород не только важен для поддержания жизни, но и играет важную роль во многих других химических реакциях.
 Кислород является наиболее распространенным элементом в земной коре и составляет около 20% воздуха, которым мы дышим.
Кислород является наиболее распространенным элементом в земной коре и составляет около 20% воздуха, которым мы дышим. - Озон
- Важные свойства озона
- Озоновый слой и озонового отверстия
- Химия серы (Z = 16)
- Sulfur является химическим элементом, который представлен с помощью химической химии, символа символа символа символа символа символа символа символа символа символа символа символа символа символа символа символа символа символа символа символа символа символа символа символа. ” и атомный номер 16 в периодической таблице. Поскольку сера составляет 0,0384% земной коры, она является семнадцатым по распространенности элементом после стронция. Сера также принимает различные формы, включая элементарную серу, сероорганические соединения в нефти и угле, h3S(g) в природном газе, минеральные сульфиды и сульфаты.
- Химия селена (Z=34)
- Элемент номер 34, селен, был открыт шведским химиком Йонсом Якобом Берцелиусом в 1817 году.
 Селен является неметаллом, и химически его можно сравнить с другим неметаллом. аналоги из группы 16: семейство кислорода, такие как сера и теллур.
Селен является неметаллом, и химически его можно сравнить с другим неметаллом. аналоги из группы 16: семейство кислорода, такие как сера и теллур.
- Химия теллура (Z=52)
- Открытый фон Райхенштейном в 1782 году, теллур представляет собой относительно редко встречающийся хрупкий металлоид. Название происходит от латинского слова «tellus» — «земля». Теллур может быть легирован с некоторыми металлами для повышения их обрабатываемости и является основным ингредиентом в производстве капсюлей-детонаторов. Элементарный теллур иногда встречается в природе, но чаще извлекается из различных золотых руд.
- Химия полония (Z=84)
- Полоний был открыт в 1898 году Марией Кюри и назван в честь ее родной страны Польши. Открытие было сделано путем извлечения оставшихся радиоактивных компонентов настурана после удаления урана. На тонну руды приходится всего около 10-6 г! Текущее производство для исследовательских целей включает синтез элемента в лаборатории, а не его извлечение из минералов.
 Это достигается за счет производства Би-210 из имеющегося в наличии Би-209..
Это достигается за счет производства Би-210 из имеющегося в наличии Би-209..
- Химия ливермория (Z=116)
- В мае 2012 г. ИЮПАК утвердил название «Ливермориум» (символ Lv) для элемента 116. Новое название дано в честь Ливерморской национальной лаборатории им. Лоуренса (1952 г.). Группа сотрудников этой Лаборатории совместно с исследовательской группой тяжелых элементов Лаборатории ядерных реакций имени Флерова принимала участие в работах, проводившихся в Дубне по синтезу сверхтяжелых элементов, в том числе элемента 116.
Миниатюра: образец серы член кислородной группы элементов. (Общественное достояние; Бен Миллс).
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Глава
- Показать страницу TOC
- № на стр.

- Теги
элемент кислородной группы | группа химических элементов
таблица Менделеева
Просмотреть все СМИ
- Похожие темы:
- сера кислород селен теллур полоний
См. все связанные материалы →
элемент группы кислорода , также называемый халькоген , любой из шести химических элементов, составляющих группу 16 (VIa) периодической классификации, а именно кислород (O), сера (S), селен (Se), теллур (Te), полоний (Po) и ливерморий (Lv). Отношения между первыми тремя членами группы были признаны еще в 1829 году; теллур занял свое место к 1865 г., а полоний был открыт в 189 г.8. В 2000 году российские и американские физики создали ливерморий, шестой член группы 16, на ускорителе частиц.
Оценки пропорций различных видов атомов во Вселенной ставят кислород на четвертое место по распространенности после водорода, гелия и неона, но важность такого ранжирования невелика, поскольку атомы водорода составляют почти 94 процента от общего количества атомов. и гелий для большинства остальных. Примерно три атома из 10 000 являются кислородом, но поскольку масса атома кислорода примерно в 16 раз больше массы атома водорода, кислород составляет большую часть массы Вселенной, хотя и составляет лишь около 0,5 процента. Однако в районах, обычно доступных человеку, т. е. в пределах нескольких километров от поверхности Земли, кислород является наиболее распространенным элементом: по массе он составляет около 20% воздуха, около 46% твердой коры. Земли и около 89процентов воды.
Кислород представлен химическим символом O. В воздухе кислород существует в основном в виде молекул, каждая из которых состоит из двух атомов (O 2 ), хотя небольшое количество озона (O 3 ), в котором три атома кислород составляют каждую молекулу, присутствуют в атмосфере. Кислород представляет собой бесцветный газ без запаха и вкуса, необходимый для живых организмов, который поглощается животными и превращает его в углекислый газ; растения, в свою очередь, используют углекислый газ в качестве источника углерода и возвращают кислород в атмосферу. Кислород образует соединения при взаимодействии практически с любым другим элементом, а также при реакциях вытеснения элементов из их соединений друг с другом; во многих случаях эти процессы сопровождаются выделением тепла и света и в таких случаях называются горениями.
Кислород представляет собой бесцветный газ без запаха и вкуса, необходимый для живых организмов, который поглощается животными и превращает его в углекислый газ; растения, в свою очередь, используют углекислый газ в качестве источника углерода и возвращают кислород в атмосферу. Кислород образует соединения при взаимодействии практически с любым другим элементом, а также при реакциях вытеснения элементов из их соединений друг с другом; во многих случаях эти процессы сопровождаются выделением тепла и света и в таких случаях называются горениями.
По распространенности в космосе сера занимает девятое место среди элементов, составляя только один атом из каждых 20 000–30 000. Сера встречается в несвязанном состоянии, а также в сочетании с другими элементами в широко распространенных горных породах и минералах, хотя и относится к второстепенным компонентам земной коры, в которых ее доля оценивается в пределах от 0,03 до 0,06%. На основании того, что некоторые метеориты содержат около 12 процентов серы, было высказано предположение, что более глубокие слои Земли содержат гораздо большую долю. Морская вода содержит около 0,09процентов серы в виде сульфата. Наиболее важным источником являются подземные месторождения очень чистой серы, присутствующие в куполообразных геологических структурах, где считается, что сера образовалась в результате воздействия бактерий на минеральный ангидрит, в котором сера соединяется с кислородом и кальцием. Залежи серы в вулканических регионах, вероятно, возникли из газообразного сероводорода, образовавшегося под поверхностью Земли и превратившегося в серу в результате реакции с кислородом воздуха.
Морская вода содержит около 0,09процентов серы в виде сульфата. Наиболее важным источником являются подземные месторождения очень чистой серы, присутствующие в куполообразных геологических структурах, где считается, что сера образовалась в результате воздействия бактерий на минеральный ангидрит, в котором сера соединяется с кислородом и кальцием. Залежи серы в вулканических регионах, вероятно, возникли из газообразного сероводорода, образовавшегося под поверхностью Земли и превратившегося в серу в результате реакции с кислородом воздуха.
Викторина «Британника»
Периодическая таблица элементов
Проверьте свою связь с периодической таблицей элементов в этой викторине по всем 118 химическим элементам и их символам. Вы можете быть знакомы с химическими символами водорода и кислорода, но можете ли вы сопоставить такие низкопрофильные элементы, как гадолиний и эрбий, с соответствующими символами?
Сера существует в обычных условиях в виде бледно-желтого кристаллического неметаллического твердого вещества; он не имеет запаха и вкуса, горюч и нерастворим в воде. Его химический символ S. Он реагирует со всеми металлами, кроме золота и платины, образуя сульфиды; он также образует соединения с некоторыми неметаллическими элементами. Ежегодно производится несколько миллионов тонн серы, в основном для производства серной кислоты, которая широко используется в промышленности.
Его химический символ S. Он реагирует со всеми металлами, кроме золота и платины, образуя сульфиды; он также образует соединения с некоторыми неметаллическими элементами. Ежегодно производится несколько миллионов тонн серы, в основном для производства серной кислоты, которая широко используется в промышленности.
Элемент селен (символ Se) встречается гораздо реже, чем кислород или сера, и составляет примерно 90 частей на миллиард в земной коре. Иногда он встречается в несвязанном виде вместе с самородной серой, но чаще встречается в сочетании с тяжелыми металлами (такими как медь, ртуть, свинец или серебро) в некоторых минералах. Основным коммерческим источником селена является побочный продукт рафинирования меди; его основные области применения – производство электронного оборудования, пигментов и стекла. Серая металлическая форма элемента наиболее устойчива в обычных условиях; эта форма обладает необычным свойством значительно увеличивать электропроводность при воздействии света.


 Кислород является наиболее распространенным элементом в земной коре и составляет около 20% воздуха, которым мы дышим.
Кислород является наиболее распространенным элементом в земной коре и составляет около 20% воздуха, которым мы дышим. Селен является неметаллом, и химически его можно сравнить с другим неметаллом. аналоги из группы 16: семейство кислорода, такие как сера и теллур.
Селен является неметаллом, и химически его можно сравнить с другим неметаллом. аналоги из группы 16: семейство кислорода, такие как сера и теллур. Это достигается за счет производства Би-210 из имеющегося в наличии Би-209..
Это достигается за счет производства Би-210 из имеющегося в наличии Би-209..