Названия химических элементов
Названия химических элементовНазвания химических элементов
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| S | Sulfur | Сера | |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| Ga | Gallium | Галлий | |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Krypton | Криптон | |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| Nb | Niobium | Ниобий | |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| Pm | Promethium | Прометий | |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113* | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115* | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117* | Ts | Tennessine | Тенессин |
| 118* | Og | Oganesson | Оганессон |
Символы и названия элементов даны по материалам 2009
г. IUPAC (International Union of Pure and Applied Chemistry) (см. Pure Appl. Chem., 2011, 83,
359-396).
IUPAC (International Union of Pure and Applied Chemistry) (см. Pure Appl. Chem., 2011, 83,
359-396).
ATOMIC WEIGHTS OF THE
ELEMENTS 2009
Имена flerovium (Fl) для 114-го элемента и livermorium (Lv) для 116-го элемента
были одобрены (см. Pure Appl. Chem., 2012, 84,
1669-1672)
* После утверждения открытия этих элементов, первооткрывателям было предложено дать им имена. Отдел неорганической химии IUPAC рассмотрел эти предложения и рекомендует их для принятия. До официального утверждения имен советом IUPAC, проходит пятимесячного публичное обсуждение, которое закончится 8 ноября 2016 года.(см. http://iupac.org/elements.html)
Периодическая система химических элементов (таблица Менделеева)
https://ria.ru/20190129/1550014194.html
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов (таблица Менделеева) – РИА Новости, 29.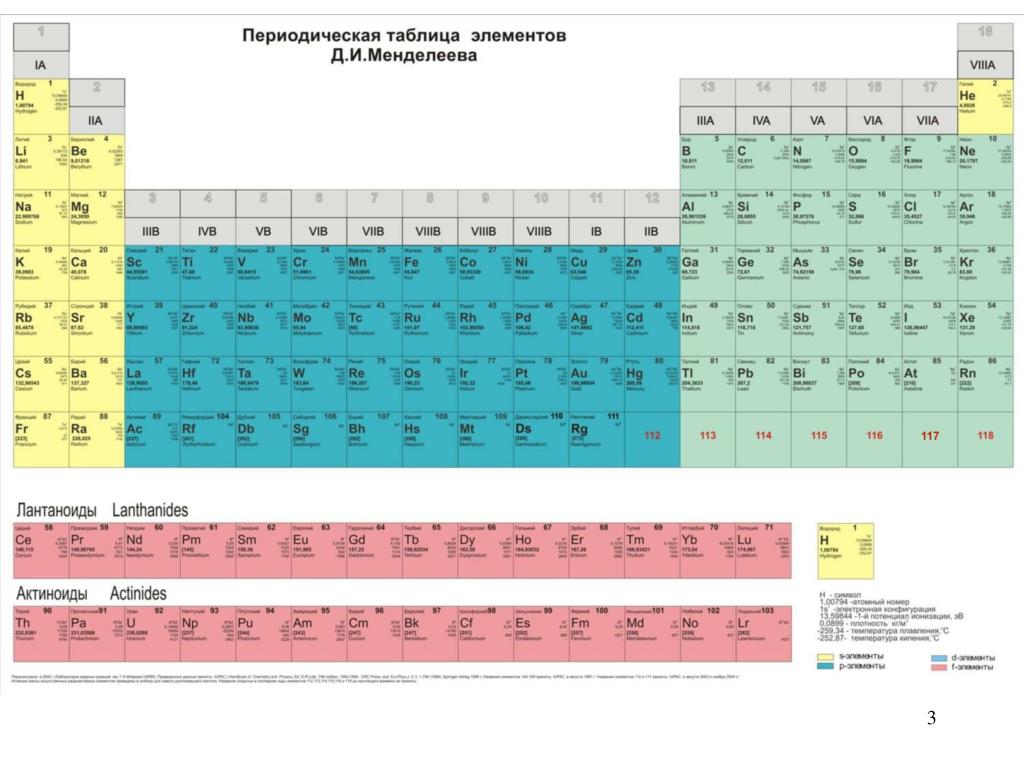 01.2019
01.2019
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. РИА Новости, 29.01.2019
2019-01-29T04:51
2019-01-29T04:51
2019-01-29T04:51
справки
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn23.img.ria.ru/images/99408/72/994087230_0:105:2000:1230_1920x0_80_0_0_b528d261d40438ab5524fc6ad7f580a3.jpg
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица “Опыт системы элементов, основанной на их атомном весе и химическом сходств”, составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге “Основы химии” Менделеевым была включена “Естественная система элементов Д. Менделеева” – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры.
По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге “Основы химии” Менделеевым была включена “Естественная система элементов Д. Менделеева” – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).
Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).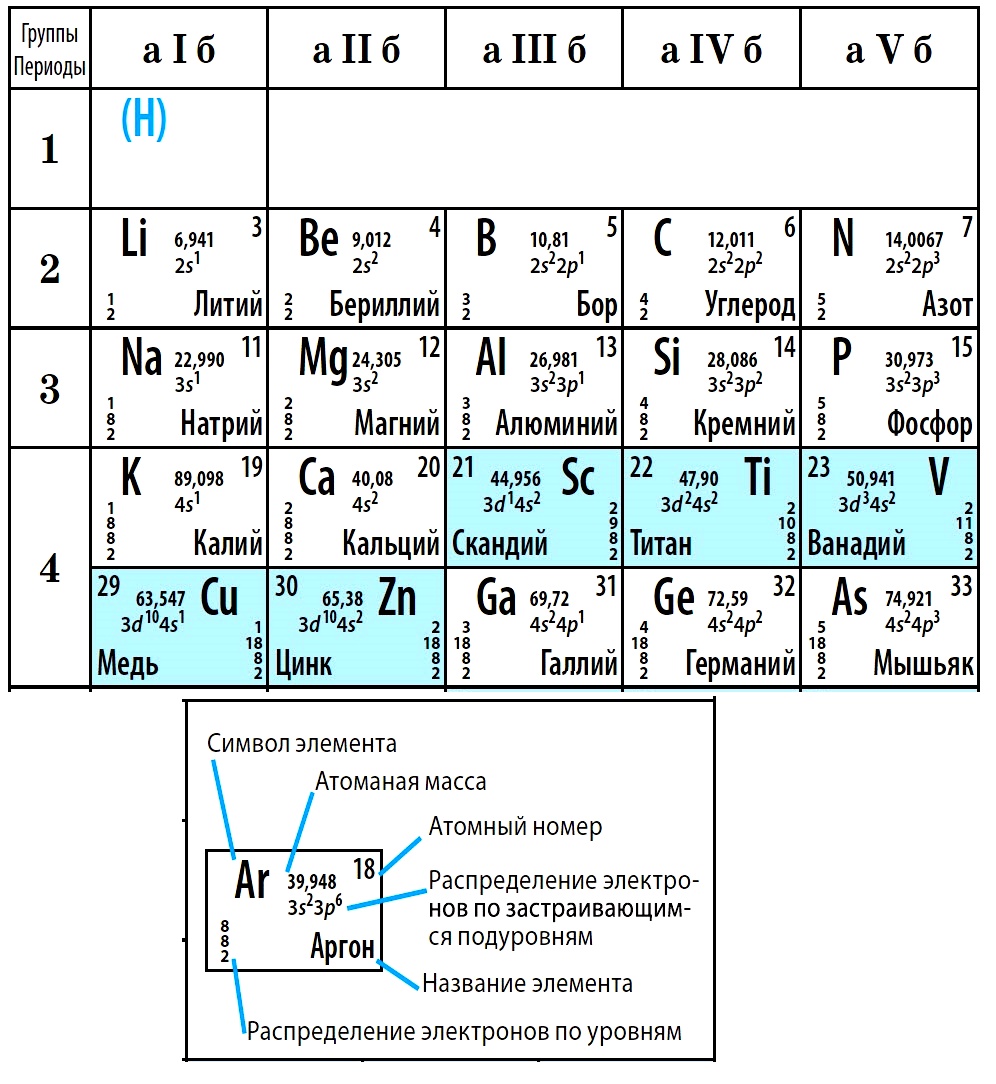 В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии.
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
internet-group@rian. ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn23.img.ria.ru/images/99408/72/994087230_112:0:1889:1333_1920x0_80_0_0_597a34ca28aa89475eedcbd63e1a68a3.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
справки
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация.
Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне.
Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.
Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Первый период содержит два элемента – водород и гелий.
Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов.
Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов.
Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.
Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.
Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
В периодическую таблицу Менделеева внесены четыре новых элемента, два из которых связаны с Россией
В подмосковной Дубне приступили к изучению свойств новых химических элементов: открытые совместно с зарубежными учеными, два из четырех элементов получили названия, которые напрямую говорят о связи с Россией. Сегодня таблица Менделеева уже другая.
Для большинства из нас понять, что именно открыли и как это может быть использовано в жизни, настолько трудно, что мы можем только верить исследователям, представляя, как многое вообще еще неизвестно. Это категории высшей материи!
Так выглядит таблица Менделеева, которую можно купить в магазинах сегодня: в седьмом периоде зияют дыры. Теперь это все придется перепечатывать. 113, 115, 117 и 118 элементы официально открыты и получили названия. Три из них признаны открытиями ученых из Объединенного института ядерных исследований в подмосковной Дубне.
Теперь это все придется перепечатывать. 113, 115, 117 и 118 элементы официально открыты и получили названия. Три из них признаны открытиями ученых из Объединенного института ядерных исследований в подмосковной Дубне.
«Московий – в честь земли московской; ливерморий – это наши коллеги из Ливермора, которые работали вместе с нами, приезжали сюда, все эксперименты делаются здесь; то же самое теннессин – из Теннесси наши коллеги; ну а 118 – домашний, наш, родной», – рассказывает научный руководитель Лаборатории ядерных реакций им. Г.Н. Флерова, академик РАН Юрий Оганесян.
118 элемент для Юрия Оганесяна не просто родной. Он назван в его честь – оганесон. Это второй случай в мировой истории, когда элемент периодической таблицы называется в честь ученого при жизни. Такой вариант названия предложили его коллеги из лаборатории ядерных исследований.
Больше 20 лет Юрий Цолакович стоит во главе российско-американской группы ученых, синтезирующих и исследующих сверхтяжелые элементы периодической системы.
«Охота за этими элементами – это такая сегодня совершенно важная часть современной экспериментальной ядерной физики. И тут надо сказать, что наши ученые, в частности, во главе с академиком Оганесяном, они здесь занимают самые передовые позиции», – отмечает президент Российской Академии Наук Владимир Фортов.
На вопросы журналистов «каково это, когда твое имя вписывается в историю на века», ученый отвечал скромно.
«Не ищите каких-то сверхчувств, поставьте себя на мое место. Я благодарен своим коллегам, своим товарищам, с которыми прошел этот долгий путь, и очень рад, конечно, что он кончился вот этим открытием, доказательством этому является не один, а на самом деле семь элементов. Один из них вот так назван, но это уже не столь важно, как он назван, а важно то, что это есть», – говорит ученый.
Сначала считалось, что периодическая таблица вообще должна закончиться на сотом элементе. Каждое новое открытие переворачивало весь научный мир. И именно Лаборатория ядерных исследований Дубнинского института — признанный мировой лидер по заполнению таблицы Менделеева. 105 элемент назван дубнием, а 114 – флеровием в честь основателя лаборатории Георгия Флерова. Теперь – московий и оганесон.
105 элемент назван дубнием, а 114 – флеровием в честь основателя лаборатории Георгия Флерова. Теперь – московий и оганесон.
«За эти 60 лет в стенах этой Лаборатории, в стенах нашего института, усилиями многонациональных коллективов Лаборатории было открыто 11 сверхтяжелых элементов, доселе неизвестных миру, неизвестных науке, и это, конечно, я сказал бы, выдающийся результат», – сказал директор Объединенного института ядерных исследований Виктор Матвеев.
О практическом применении последних открытий речи пока не идет. Это дело науки будущего. Хотя ученые говорят: для того, чтобы синтезировать новый элемент, нужно уже совершить много технических открытий и инноваций. Ускорители, которые располагаются в Дубне, не имеют аналогов. На циклотроне У400 и были синтезированы самые тяжелые элементы.
Частицы кальция-48 проходят по каналу. Для синтеза нового элемента нужно, чтобы они попали точно в мишень. Обычно это уран, плутоний или калифорний. Мишень находится за стеной. Каждую секунду по ней выпускается 10 триллионов частиц, эксперимент идет несколько месяцев и за все это время рождается всего несколько ядер.
Ученые из Дубны уже поставили перед собой следующую задачу: синтез 119, 120 и последующих элементов. Специально для этого здесь строится так называемая «фабрика сверхтяжелых элементов».
Сердцем этой фабрики станет новый ускоритель, превосходящий по мощности все мировые аналоги в 10 раз. Именно в пространстве дубнинского циклотрона частицы будут разгоняться по спирали до скорости, близкой к скорости света.
Если во время предыдущих экспериментов ядра новых элементов образовывались раз в несколько месяцев, то теперь это будет происходить каждый день. Поставить научные открытия на поток – вот в чем смысл названия «фабрика». Первый запуск этого комплекса сверхтяжелых элементов намечен уже на ноябрь 2017 года.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ • Большая российская энциклопедия
ПЕРИОДИ́ЧЕСКАЯ СИСТЕ́МА ХИМИ́ЧЕСКИХ ЭЛЕМЕ́НТОВ, упорядоченное множество химич. элементов и их естеств. классификация. Является табличным представлением периодического закона, открытого Д. И. Менделеевым. Прообразом П. с. х. э. служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленная Менделеевым в 1869 (рис. 1). По мере совершенствования этой таблицы Менделеев развил представления о периодах и группах элементов и о месте каждого элемента в системе. К 1871 в кн. «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классич. короткая форма П. с. х. э. Опираясь на неё, Менделеев выполнил впоследствии оправдавшийся прогноз существования и свойств неизвестных в то время элементов (Ga, Sc, Ge).
И. Менделеевым. Прообразом П. с. х. э. служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленная Менделеевым в 1869 (рис. 1). По мере совершенствования этой таблицы Менделеев развил представления о периодах и группах элементов и о месте каждого элемента в системе. К 1871 в кн. «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классич. короткая форма П. с. х. э. Опираясь на неё, Менделеев выполнил впоследствии оправдавшийся прогноз существования и свойств неизвестных в то время элементов (Ga, Sc, Ge).
Рис. 1. Таблица, составленная Д. И. Менделеевым 1. 3.1869.
Физич. смысл периодичности в свойствах элементов стал ясен после появления планетарной модели атома (Э. Резерфорд, 1911) и было показано (нидерл. физик А. ван ден Брук и Г. Мозли, 1913–14), что порядковый номер элемента в П. с. х. э. равен положительному заряду (Z) ядра атома. Теория П. с. х. э. в осн. создана Н. Бором (1913–21) на базе квантовой модели атома. Бор разработал схему построения электронных конфигураций атомов по мере возрастания Z, опирающуюся на определённую последовательность заполнения электронами оболочек и подоболочек в атомах с ростом числа Z.
физик А. ван ден Брук и Г. Мозли, 1913–14), что порядковый номер элемента в П. с. х. э. равен положительному заряду (Z) ядра атома. Теория П. с. х. э. в осн. создана Н. Бором (1913–21) на базе квантовой модели атома. Бор разработал схему построения электронных конфигураций атомов по мере возрастания Z, опирающуюся на определённую последовательность заполнения электронами оболочек и подоболочек в атомах с ростом числа Z.
Совр. П. с. х. э. включает более ста химич. элементов. Наиболее тяжёлые элементы получены ядерным синтезом. Порядок заполнения электронами уровней в атомах определяется правилами, совокупность которых называют «принципом построения»: заполнение атомных орбиталей (АО) происходит в порядке увеличения энергии орбиталей: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 6d и т. д.; согласно Паули принципу, каждая АО (характеризуется квантовыми числами n, l, m) может содержать не более 2 электронов; АО с одинаковыми l и n заполняются так, чтобы суммарный спин электронов был максимален (т. е. заполняется макс. число АО с разными m по Хунда правилу).
е. заполняется макс. число АО с разными m по Хунда правилу).
Рис. 2. Короткий вариант периодической системы химических элементов Д. И. Менделеева (в соответствии с данными ИЮПАК на 1973).
Согласно (n+l)-правилу Клечковского, построение электронных конфигураций гл. обр. происходит в соответствии с последовательным увеличением суммы (n+l). При этом в пределах каждой такой суммы сначала заполняются подоболочки с бóльшими l и меньшими n, затем с меньшими l и бóльшими n.
Опубликовано св. 500 вариантов П. с. х. э., что связано с попытками поиска решения некоторых частных проблем её структуры. Наиболее распространены две табличные формы П. с. х. э.: короткая (рис. 2) и длинная (разрабатывалась Д. И. Менделеевым, усовершенствована в 1905 А. Вернером; рис. 3). В структуре П. с. х. э. выделяют периоды (горизонтальные ряды) и группы (вертикальные столбцы) элементов.
выделяют периоды (горизонтальные ряды) и группы (вертикальные столбцы) элементов.
Рис. 3. Длинная форма периодической системы химических элементов (в соответствии с данными ИЮПАК на 2013).
Совр. форма П. с. х. э. (в 1989 ИЮПАК рекомендована длинная форма П. с. х. э.) состоит из 7 периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма П. с. х. э. – из 8 групп. Число элементов в периодах, начиная со второго, попарно повторяется: 8, 8, 18, 18, 32, 32,… (первый период содержит два элемента). Номер группы элементов короткого варианта П. с. х. э. соответствует числу валентных электронов во внешней электронной оболочке атомов. В длиннопериодном варианте П. с. х. э. номер группы в бoльшей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химич. свойствам, их атомы характеризуются одинаковым строением внешних электронных оболочек. Элементы некоторых групп имеют собств. тривиальные названия: щелочные металлы (группа 1 длинной формы П. с. х. э.), щёлочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В П. с. х. э. для каждого элемента указывается его символ, название, порядковый номер и значение относит. атомной массы.
Первый период содержит два элемента – Н и Не. Водород имеет некоторое сходство как со щелочными элементами, так и с галогенами. В связи с этим символ Н помещают либо в подгруппу Iа, либо в подгруппу VIIa короткого варианта П. с. х. э., либо в обе одновременно.
Второй и третий периоды (Li – Ne; Na – Ar) содержат по 8 элементов, причём характер изменения химич. свойств вертикальных аналогов во многом близок. Элементы первых трёх периодов относятся к гл. подгруппам короткого варианта периодич. системы химич. элементов.
Элементы групп 1 и 2 длинной формы называются s-элементами, групп 13–18 – p-элементами, групп 3–12 – d-элементами; d-элементы (за исключением цинка, кадмия и ртути) называют также переходными элементами.
Четвёртый период (K–Kr) содержит 18 элементов. После K и Са (s-элементы) следует ряд из десяти (Sc – Zn) 3d-элементов (побочные подгруппы короткого варианта П. с. х. э.). Переходные элементы проявляют высшие степени окисления, в осн. равные номеру группы короткого варианта П. с. х. э. (исключая Co, Ni и Cu). Элементы от Ga до Kr относятся к гл. подгруппам (р-элементы).
Пятый период (Rb – Xe) построен аналогично четвёртому; в нём также имеется «вставка» из десяти переходных 4d-элементов (Y – Cd). Особенности изменения свойств в этом периоде: в триаде Ru – Rh – Pd рутений проявляет макс. степень окисления +8, родий +6, палладий +5; все элементы гл. подгрупп, включая Хе, проявляют высшие степени окисления, равные номеру группы.
Шестой период (Сs – Rn) содержит 32 элемента. В него, помимо десяти 5d-элементов (La, Hf – Hg), входит семейство из четырнадцати 4f-элементов – лантаноидов (лантанидов, Ln). В степени окисления +3, +4 они являются химич. аналогами актиноидов, в степени окисления +2 – щёлочноземельных элементов. Лантаноиды размещены в группе 3 длинной формы, клетка La, и для удобства вынесены под таблицу. Особенностью элементов шестого периода является то, что в триаде Os – Ir – Pt два элемента – осмий и иридий – проявляют степень окисления +8, платина +6 (для Ir – данные 2010).
Седьмой период, подобно шестому, содержит 32 элемента. Актиний – аналог лантана. После Ас следует семейство из четырнадцати 5f-элементов – актиноидов (актинидов, An) (Z= 90–103). В П. с. х. э. их размещают в клетке Ас и, подобно Ln, записывают отд. строкой под таблицей. Этот приём предполагает наличие существенного химич. сходства элементов двух f-семейств. Именно на этом основывалась «актинидная концепция» Г. Сиборга (1944), сыгравшая ведущую роль при разработке методов разделения продуктов деления урана и поиске новых элементов. Однако эта концепция справедлива лишь для трёх- и четырёхвалентных An. Актиноиды же проявляют степени окисления от +2 до +7 (последняя характерна для Np, Pu, Am) и +8 (для плутония). Для наиболее тяжёлых An характерна стабилизация низших степеней окисления (+2 или даже +1 для Md).
Эксперим. оценки химии элементов с Z=104 (резерфордий) и Z=105 (дубний) позволили заключить, что они являются аналогами соответственно Hf и Та, т. е. 6d-элементами (должны располагаться в IVб и Vб подгруппах короткой формы). Химич. идентификация элементов с Z=106–118 не проводилась из-за слишком коротких «времён жизни» синтезированных изотопов, но в соответствии со структурой П. с. х. э. можно считать, что элементы Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn относятся к 6d-элементам, элементы c Z=113–118 близки соответственно вертикальным аналогам. Это же следует из совр. квантовохимич. расчётов.
П. с. х. э. является важным звеном эволюции атомно-молекулярного учения, способствует уточнению представлений о простых веществах и соединениях, оказала значит. влияние на разработку теории строения атомов. С П. с. х. э. связана постановка проблемы прогнозирования в химии, что проявилось в предсказании как существования неизвестных элементов и их свойств, так и особенностей химич. поведения известных элементов. П. с. х. э. – основа неорганич. химии; служит задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, в частности сверхпроводников и полупроводников, подбору специфич. катализаторов для разл. химич. процессов и др. П. с. х. э. – науч. база преподавания общей и неорганич. химии, а также некоторых разделов атомной физики.
Периодическая таблица через 150 лет
Ю. Ц. Оганесян
По материалам доклада на Научной сессии Общего собрания членов РАН, посвященной закрытию Международного года Периодической таблицы 14 ноября 2019 г. В варианте статьи журнала «Вестник Российской академии наук» № 4 2020 г.
К началу 2019 г., провозглашенного ООН и ЮНЕСКО Международным годом Периодической таблицы химических элементов, 7-й период таблицы был уже заполнен новыми, самыми тяжелыми элементами. Согласно предсказаниям теории, изотопы сверхтяжелых элементов, обладающие повышенной стабильностью, образуют на карте нуклидов большую зону в виде острова с вершиной, расположенной вблизи «магических» чисел протонов Z=114 и нейтронов N=184. Новые элементы с атомными номерами от 114 до 118 были синтезированы в Лаборатории ядерных реакций им. Г.Н. Флёрова Объединённого института ядерных исследований (ОИЯИ) в Дубне в 2000–2012 гг. в реакциях слияния ядер мишени – тяжёлых изотопов актиноидов (Z = 94–98) – с бомбардирующими ионами кальция-48. Из полученных экспериментальных результатов следует, что могут существовать ядра/элементы с атомными номерами более 118 и массами более 300 а.е.м. Для исследования ядерной и электронной структур новых элементов, а также их химических свойств, равно как и синтеза элементов начала 8-го периода Периодической таблицы, в Дубне создан новый экспериментальный комплекс Фабрика сверхтяжелых элементов (Фабрика СТЭ), где уже состоялся пуск нового ускорителя DC-280 и в ближайшее время начнутся эксперименты. Вводная и заключительная части моего выступления на Научной сессии Общего собрания членов РАН относились к открытию периодического закона, опубликованного Д.И. Менделеевым 150 лет назад. Действие этого закона в свойствах тяжелейших элементов представляет и сегодня одну из актуальных и интересных задач естествознания.
Ключевые слова: Периодическая таблица Д.И. Менделеева, сверхтяжёлые элементы, “остров” стабильности, Фабрика сверхтяжёлых элементов, спонтанное деление.
ПРОЛОГ
Предание гласит, что всё началось с письма, которое сэр Мартин Поляков, профессор Ноттингемского университета (Великобритания) и иностранный член РАН, направил 28 июля 2016 г. президенту Международного союза чистой и прикладной химии (ИЮПАК) члену-корреспонденту РАН Наталии Павловне Тарасовой:
«Уважаемая Наталия,
надеюсь, что Вы в порядке.
Как я понимаю, 2019 год станет 150-й годовщиной публикации Менделеевым Периодической таблицы. Было бы интересно знать, можно ли поднять вопрос о том, чтобы объявить 2019 год Международным годом Периодической таблицы. Чувствую, что это предложение может получить большую поддержку. Как Вы думаете?
С наилучшими пожеланиями,
Мартин Поляков»
Н.П. Тарасова поставила этот вопрос на заседании Исполнительного комитета ИЮПАК, который, как ей показалось, со здоровым скептицизмом поддержал идею Международного года Периодической таблицы и предложил России воплотить её в жизнь через ЮНЕСКО. Начиная с этого момента, вся деятельность по данному вопросу, проводимая Международным союзом чистой и прикладной химии в течение 18 месяцев, легла на плечи президента ИЮПАК и её коллег.
Российская академия наук и российские химики с большим воодушевлением взялись за дело: написали обращение Менделеевского съезда (2016) и Российского химического общества к мировой научной общественности, президент РАН академик В.Е. Фортов направил письмо министру иностранных дел России С.В. Лаврову, РАН обратилась в ИЮПАК, Н.П. Тарасова написала письмо Генеральному директору ЮНЕСКО и пр. К этому времени подошло другое событие, непосредственно связанное с Периодической таблицей химических элементов. После включения в 2012 г. в таблицу 114-го и 116-го элементов ИЮПАК принял название и утвердил символы ещё четырех химических элементов, в их числе двух самых тяжёлых. Это случилось 28 ноября 2016 г. Все четыре элемента со своими названиями и символами заполнили и замкнули 7-й период Периодической таблицы Д.И. Менделеева. На инаугурации новых химических элементов, состоявшейся 2 марта 2017 г. в Доме учёных РАН, три директора сотрудничающих лабораторий – академик РАН Виктор Матвеев (ОИЯИ, Дубна, Россия), профессор Томас Мейсон (Ок-Риджская национальная Лаборатория, Oк-Ридж, США) и профессор Вильям Гольдштейн (Ливерморская национальная лаборатория, Ливермор, США) – направили совместное письмо в ЮНЕСКО в поддержку юбилейного года Периодической таблицы. И это далеко не полный перечень шагов, предпринятых научным сообществом в преддверии 2018 г.
А 20 декабря 2017 г. с интересной и необычной формулировкой – “признавая важность глобального расширения знаний о том, как химия способствует устойчивому развитию в области энергетики, образования, сельского хозяйства и здоровья,” – Генеральная Ассамблея ООН, затем и ЮНЕСКО провозгласили 2019-й Международным годом Периодической таблицы химических элементов – IYPT-2019.
НОВЫЕ ОБИТАТЕЛИ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
В 1928 г. Георгий Антонович Гамов, наш соотечественник, выпускник Ленинградского государственного университета, уже известный к тому времени советский физик, предложил первую теоретическую модель атомного ядра в виде капли заряженной жидкости с плотностью, на 15 порядков превышающей плотность воды [1]. В новой науке, ядерной физике, этой работе суждено было сыграть большую роль. На основе капельной модели ядра Гамов создал теорию альфа-распада (1928) [2], Карл Фридрих фон Вайцзеккер предложил свою знаменитую формулу для расчёта энергии связи ядер (1935) [3], а Нильс Бор и Джон А. Уилер создали теорию ядерного деления (1939) [4]*.
Согласно Бору и Уилеру, тяжёлое ядро предохраняет от разделения на две части потенциальный барьер. Высота барьера деления ядра урана составляет 6 МэВ. Поэтому если в ядро внести энергию более чем 6 МэВ (например, энергию захвата ядром нейтрона), оно моментально разделится на две части. В этом процессе выделяется энергия около 200 МэВ, что используется в атомных электростанциях. Однако ядро урана может разделиться самопроизвольно (спонтанно) без вноса в ядро дополнительной энергии. Для этого, как было впервые измерено Г.Н. Флёровым и К.А. Петржаком (1940) [6], потребуется огромное время: 1016 лет! По мере удаления от урана в область более тяжелых ядер, высота барьера деления быстро уменьшается, что приводит к резкому увеличению вероятности спонтанного деления. При исчезновении барьера деления ядро будет испытывать спонтанное деление за время около 10-19 с. В теории Бора и Уилера подобная критическая ситуация наступает при подходе к элементам с атомным номером 100. По сути, это и есть предел существования ядер.
Ещё 60 лет назад такое макроскопическое, и в этом смысле классическое, описание процесса деления не вызывало сомнений. Особенно после синтеза первых искусственных элементов тяжелее урана, прекрасно подтверждающих капельную теорию деления: от урана (Z = 92) до калифорния (Z = 98) период полураспада относительно спонтанного деления уменьшился в 1014 раз [7]! Сомнения в прогнозах капельной модели деления возникли позже, после открытия в Лаборатории ядерных реакций им. Г.Н. Флёрова ОИЯИ спонтанно-делящихся изомеров (1962) [8]. Оказалось, что внутренняя структура ядра, наблюдаемая в основных состояниях, сохраняется и в сильно деформированных конфигурациях на пути к делению, продолжая играть важную роль в вероятности спонтанного деления тяжёлых ядер. Теперь уже более сложное описание коллективного движения в новой микроскопической теории давало одновременно также и новые предсказания границы масс ядер. Результаты оказались весьма неожиданными. Согласно прогнозам, резкое падение стабильности трансурановых нуклидов относительно спонтанного деления должно смениться резким подъёмом в области сверхтяжёлых элементов при подходе к “магическим” ядрам с числом протонов Z = 114 и нейтронов N = 184. Эти нуклиды, обладающие большим избытком нейтронов, более связаны. Они отделены от известной области ядер. Их достаточно много. На карте ядер они представляют собой подобие некого “острова” весьма тяжёлых (сверхтяжёлых) элементов, у которых могут быть очень долгоживущие изотопы. В научных статьях и докладах начала 1970-х годов можно найти различные иллюстрации, подобные той, что представлена на рис. 1.
Рис. 1. Периоды полураспада ядер с Z ≥ 96 относительно спонтанного деления. Черные кружки – экспериментальные значения для актиноидов и изотопов 104 элемента. Открытые кружки – один из вариантов предсказаний для ядер c Z ≥ 106 и N ≥ 150. С правой стороны: периоды спонтанного деления изотопов 114-го элемента, рассчитанные в макро – микроскопической модели ядра. |
Многие лаборатории мира буквально ринулись на поиски этих долгоживущих тяжеловесов. Но, к сожалению, все экстенсивные попытки найти их в природе, космических лучах и даже путём искусственного синтеза сверхтяжёлых элементов, предпринятые в течение 15 лет (1970–1985), не дали результатов. Оставляя пока вопрос о вероятности образования ядер с массой около 300 в процессах природного ядерного синтеза, отметим, что время жизни сверхтяжёлых долгожителей заметно меньше возраста Солнечной системы (4.5∙109 лет) и они не дожили до наших дней. Что же касается искусственного синтеза, то все методы синтеза двадцати известных к тому времени искусственных элементов тяжелее урана, к сожалению, не пригодны для этих целей. Они “не дотягивают” до “острова” стабильности прежде всего из-за дефицита нейтронов в системе сливающихся ядер.
После 1985 г. мы кардинально изменили подход к синтезу сверхтяжёлых элементов. Для того чтобы добраться до “острова” и увидеть резкий подъём стабильности, предсказанный теорией, пришлось существенно усложнить эксперимент. Теперь вместо использования стабильных ядер в качестве материала мишени были выбраны тяжёлые изотопы трансурановых элементов (такие как плутоний-244 или кюрий-248), полученные в высокопоточном ядерном реакторе. Мишени из этих материалов подвергались бомбардировке ускоренными ионами кальция-48, исключительно редкого и дорогого изотопа природного кальция. Содержание кальция-48 в естественной смеси по отношению к основному изотопу кальцию-40 составляет всего 0.2%. Преимущества этой реакции прямо следуют из сравнения результатов экспериментов по синтезу 113-го элемента Nh, проведённого в RIKEN (Япония) и 114-го элемента Fl – в ОИЯИ (Дубна). Элемент Nh был синтезирован при слиянии ядер висмута-209 и цинка-70 [9]. Составная система после слияния двух атомных ядер содержит 113 протонов и 165 нейтронов. В этой реакции в течение девяти лет были получены три атома 113-го элемента. Элемент Fl (Z = 114), полученный в Дубне в реакции плутоний-244 + кальций-48, имел в составном ядре 114 протонов и 178 нейтронов [10] – на 13 нейтронов больше, чем в предыдущем случае. Эти 13 нейтронов, как следует из дальнейшего, и сыграли решающую роль.
Высадка на берег “острова” в северо-западной его части была действительно впечатляющей. Вероятность образования тяжёлого изотопа 114-го элемента оказалась примерно в 500 раз выше, чем 113-го элемента, полученного в RIKEN. Еще более сильное отличие наблюдалось в свойствах ядер, в частности, во временах жизни, измеряемых обычно периодами полураспада. Повышение числа нейтронов на 8 единиц в ядрах, синтезированных с ионами кальция-48, увеличило их период полураспада примерно в 100 тысяч раз! Оба фактора: рост вероятности образования и стабильности ядер демонстрируют сильный эффект “магической” структуры N = 184, даже несмотря на то, что синтезированный изотоп 114-го элемента содержит всего 175 нейтронов. После первых результатов по исследованию изотопов 114-го и 116-го элементов в реакциях с ионами кальция-48 (2000–2002) последующие эксперименты по синтезу других элементов с атомными номерами 115, 117 и 118 были проведены по той же методике с мишенями из америция-243, берклия-249 и калифорния-249 соответственно [11-13]. За 15 лет работы (около 100 тыс. часов облучения мишеней пучком ионов кальция-48) были синтезированы 52 новых изотопа [14] от 104-го до 118-го элементов (рис. 2, а). На карте нуклидов они простираются до ядер массой 294 а.е.м. (рис. 2, б). Это предельно тяжёлое ядро было получено в виде двух изобар: как чётно-чётный изотоп 118-го элемента с периодом полураспада около 0.5 миллисекунд и как нечётно-нечётный изотоп 117-го элемента с периодом полураспада около 50 миллисекунд. Оба периода полураспада в ядерном масштабе – огромные времена! Учитывая, что после образования нового ядра за время 10-14–10-13 секунды вокруг него выстраивается вся электронная система атома, то подобный вывод можно сделать и о существовании элементов. Из данных экспериментов следует, что мы не дошли до предела масс ядер. Определённо, ядра могут иметь массу более 300 а.е.м., а количество элементов может быть свыше 118.
Рис. 2, а. Таблица Менделеева (площадь 150 м2). на фасаде химического факультета Университета в городе Мурсия (Испания, 2017). В красной рамке показаны элементы, полученные с пучком кальция-48. |
Рис. 2, б. Область конца карты нуклидов: показаны изотопы от свинца до элемента 118. Красными квадратами обозначены самые тяжелые ядра: с массой 252 а.е.м. (No, 1962) и 294 а.е.м. (Og, 2004), полученные впервые в Лаборатории ядерных реакций ОИЯИ. Желтым цветом показана область ядер, полученных в реакциях с использованием мишеней из свинца и висмута. Розовое поле – область ядер синтезированных в реакциях с пучком ионов кальция-48. Фон – карта потенциальной энергии ядер в зависимости от содержания протонов и нейтронов, полученная в расчетах макро-микроскопической модели. Цифры и цвет указывают амплитуду структурной поправки (в МэВ) к жидко-капельной энергии ядра. |
Заключая краткий экскурс в мир сверхтяжёлых, можно отметить, что уйдя от висмута, последнего стабильного элемента, в область больших масс и зарядов, мы наблюдаем удивительную живучесть атомных ядер. В области предельных кулоновских сил дополнительные связи протонов и нейтронов структурного свойства создают в тяжёлом ядре барьер деления и делают тем самым возможным существование сверхтяжёлых элементов.
Эксперименты проводились в Дубне на ускорителе У400 Лаборатории ядерных реакций им. Г.Н. Флерова (ОИЯИ) в сотрудничестве с ВНИИЭФ (Саров, Россия), НИИАР (Димитровград, Россия), а также с Ливерморской и Ок-Риджской национальными лабораториями (США), взявшими на себя труд по наработке мишенного материала и участвовавшими в ряде экспериментов.
ТЯЖЕЛЕЙШИЕ АТОМЫ И ХИМИЯ СВЕРХТЯЖЁЛЫХ ЭЛЕМЕНТОВ
На фотографии (см. рис. 2, а) изображена самая большая (150 м2) Периодическая таблица химических элементов, встроенная в фасад химического факультета Университета г. Мурсия (Испания).** На ней красной рамкой выделены сверхтяжёлые элементы от 112-го до 118-го, полученные в реакциях с кальцием-48, когда в качестве материала мишени использовались тяжёлые изотопы от урана (Z = 92) до калифорния (Z = 98), соответственно***.
В белой рамке находятся дочерние нуклиды – продукты альфа-распада ядер из красной рамки. Они заполняют практически все оставшиеся клетки 7-го периода, вплоть до резерфордия (Z = 104). Дочерние ядра, берущие начало от нейтронно-избыточных материнских изотопов сверхтяжёлых элементов, тоже обогащены нейтронами, что значительно повышает их период полураспада и открывает широкие возможности для исследования химических свойств транс-актиноидов. Подобные исследования элементов, особенно конца 7-го периода, представляют большой интерес. Их химическое поведение может отличаться от более лёгких гомологов из-за релятивистского возрастания массы электронов с ростом заряда ядра. В более лёгких элементах релятивистский эффект проявляется в свойствах благородных металлов: золото – мягкий металл жёлтого цвета – не окисляется, ртуть тоже металл, но жидкий при комнатной температуре. Благородные металлы способны взаимодействовать друг с другом и создавать соединения типа ртуть/золото (амальгама ртути и золота). С увеличением атомного номера элемента и приближением скорости электронов к скорости света эффект будет быстро возрастать, вследствие чего химическое поведение сверхтяжёлых элементов, например, 112-го элемента (Cn), может отличаться от своего лёгкого гомолога – ртути (Hg). В первом эксперименте, проведённом в Дубне (2007), исследовалась именно эта пара гомологов [15]. Измерялась адсорбция Cn и Hg на поверхности золота (Au) при различной температуре на предмет наблюдения различия в образовании соединений [Au-Hg] и [Au-Cn]. Наблюдаемое смещение пика адсорбции в область более низких температур было первым прямым экспериментальным наблюдением релятивистского эффекта в транс-актиноидах. В целом, 112-ый элемент продемонстрировал свою принадлежность 12-й группе Таблицы Менделеева. Но из результатов этого эксперимента и проведенных недавно расчетов [16] были выявлены также отличия физико-химических свойств Cn и Hg, в частности, в температурах их фазовых переходов. Как известно, температура плавления ртути составляет -38.8 °С, температура кипения 353.7 °С, в то время как расчетные значения для Сn заметно отличаются: 10 °С и 67 °С, соответственно. При комнатной температуре, с учетом погрешности измерений, 112-ый элемент будет либо сильно летучей жидкостью, либо газообразным.
Но это первый звонок. Дальнейшее увеличение заряда ядра будет более ощутимым. Поэтому, спустя 100 лет после открытия Вильямом Рамзаем радона (1904) [17], последнего до 2004 года представителя семейства благородных газов 18 группы таблицы, мы задаемся сегодня вопросом: а будет ли 118-ый элемент благородным газом? Релятивистский эффект сильнее проявляется на ближайших к ядру электронах, скорость которых максимальна [18-20], что приводит к сжатию внутренних орбит (рис. 3, а). Для внешних электронов “релятивистское сжатие” приводит к экранированию положительного заряда ядра. В этой ситуации необходимо учитывать (пока в виде малых поправок) взаимодействие внешних электронов друг с другом, которое мало в природных элементах и которым пренебрегают в нерелятивистских расчётах. Нетрудно предвидеть, что роль этих поправок будет быстро возрастать с увеличением атомного номера в сверхтяжёлых элементах. Сам расчёт поправок – по сути, задача многих тел – требует огромных вычислительных мощностей. Большие надежды здесь связаны с квантовым компьютером. А пока доступными средствами в различном приближении отрабатываются методы расчёта на известных атомах, которые затем используются для предельно тяжёлых систем. Релятивистский расчёт элементов 18-й группы показывает, что пространственное распределение внешних электронов 118-го элемента [21] существенно размыто по сравнению с радоном и тем более с ксеноном (рис. 3, б). Подобная картина воспроизводится в расчётах В.М. Шабаева и его коллег [22], но указывается одновременно, что 118-й элемент на 94% будет благородным газом. Возможно, и не газом, а твёрдым телом при комнатной температуре [16,23].
Рис. 3, а. Расчетная плотность электронов 118-го элемента (Og) в зависимости от радиуса (логарифмическая шкала) в двух вариантах расчета: в релятивистском (синяя кривая) и не релятивистском (красный пунктир) приближениях. Цифрами на графике указаны электронные оболочки (периоды). Видно сильное сжатие внутренних электронных оболочек, в то время как средний радиус внешних (валентных) электронов мало меняется |
Рис. 3, б. Пространственные распределения (функции локализации) электронов 118-го элемента (Og), полученные в работе [20]. Хорошо видно размытие внешних электронов в сравнении с его гомологами — радоном и ксеноном |
На примере 118-го элемента можно видеть, что в конце 7-го периода у элементов, именуемых сегодня сверхтяжёлыми, появляются отличные от лёгких гомологов признаки. Экспериментальные данные, к сожалению, весьма скудны прежде всего из-за малого количества сверхтяжёлых элементов и короткого времени их жизни. Одно из направлений будущих исследований нацелено на изучение атомной структуры и химических свойств уже синтезированных сверхтяжёлых элементов на новом оборудовании (см. далее).
Пока не видно принципиальных ограничений для синтеза 119-го и 120-го элементов – начала 8-го периода таблицы. Несмотря на то, что попытки их получения на старых установках в реакциях с ионами титана, хрома и даже железа, предпринятые в разных лабораториях, не увенчались успехом [24-26], это остаётся делом техники. Сложнее будет изучать их химические свойства из-за короткого периода полураспада, исчисляемого долями миллисекунды. Но здесь не ожидается сюрпризов. Большой скачок в химии будет иметь место при переходе от 118-го к 119-му элементу (от последней колонки таблицы к первой). По всей вероятности, 120-й элемент также в целом будет следовать своим лёгким гомологам второй колонки. Отклонения начнутся, скорее всего, после 121-го элемента с различными сценариями дальнейшего продолжения таблицы (рис. 4). Элемент 122 либо откроет новую серию так называемых супер-актиноидов [27], включающую ещё 33 элемента вплоть до 155-го, либо 122-й элемент и все последующие продолжат 8-й период. Но в этом случае групповое различие элементов начнёт быстро исчезать (размываться). Пока же остается только гадать, как будет выглядеть химия атомных гигантов за пределами периодического закона.
Рис. 4. Таблица Д.И. Менделеева с различными вариантами релятивистских расчетов. В синей рамке – сверхтяжёлые элементы, полученные в реакциях с пучком ионов кальция-48. |
ФАБРИКА СВЕРХТЯЖЁЛЫХ ЭЛЕМЕНТОВ
После открытия новых элементов, расположенных на “острове” стабильности, дальнейшее развитие исследований в этой области связано прежде всего с получением сверхтяжёлых нуклидов в значительно бóльших количествах. Спустя 10 лет после первых экспериментов по синтезу 114-го и 116-го элементов по результатам, полученным в опытах с пучком ионов кальция-48, а также в связи с общим прогрессом в смежных областях науки и техники стало ясно, что светимость экспериментов может быть существенно увеличена. Поэтому с 2012 г. мы сильно сократили экспериментальную программу на действующих установках и стали строить новую лабораторию – Фабрику cверхтяжёлых элементов, которая пока не имеет мировых аналогов. Она определяет и тем самым отражает технический уровень всех этапов работы по получению сверхтяжёлых элементов от создания мишеней из трансурановых элементов до доставки сверхтяжёлых нуклидов к экспериментальным физическим и химическим установкам. По достижению проектных параметров возможности Фабрики СТЭ будут превосходить современный уровень в 50–100 раз.
Новый комплекс с инфраструктурой для работы с высокорадиоактивными материалами расположен в отдельном строении (рис. 5, а). Там же находится новый сильноточный ускоритель тяжелых ионов – циклотрон DC-280 [28], пуск которого состоялся в марте 2019 года (рис. 5, б). Ускоритель доставляет пучки ионов в три экспериментальных зала, где размещаются сепарирующие каналы, химические и физические установки, а также другое экспериментальное оборудование. В настоящее время идет наладка нового сепаратора и подготовка первого эксперимента.
Рис. 5, а. Строение ускорительного комплекса «Фабрики СТЭ» |
Рис. 5, б. Ускоритель тяжелых ионов — циклотрон DC-280 |
ЭПИЛОГ
За прошедшие 80 лет после открытия нептуния и плутония (1940) – первых искусственных элементов – Периодическая таблица пополнилась ещё 24 рукотворными элементами. Пять самых тяжёлых из них заняли своё место в таблице в последние семь лет. Искусственных элементов, как известно, в природе нет. А сверхтяжёлых элементов, скорее всего, не было и при зарождении Солнечной системы. Они получены в лабораториях в совершенно других условиях (реакциях), чем природные химические элементы. Однако все известные сегодня 118 элементов располагаются в единой таблице в строгом соответствии с периодическим законом, открытым Дмитрием Ивановичем Менделеевым 150 лет назад.
Между тем Международный год Периодической таблицы — IYPT2019, начавший своё шествие в ЮНЕСКО 29 января 2019 г., закончился в Токио (Япония) 5 декабря. Огромное количество статей в научных, научно-популярных и совсем не научных изданиях, удивительный всплеск очень интересных работ в области ядерной физики, химии, атомной физики, астрофизики, истории науки – все посвященные 150-летию открытия Периодической таблицы химических элементов. Год был встречен с невероятным энтузиазмом не только научным миром, но и широкой общественностью. Форумы, конференции, симпозиумы, лекции, собрания научных обществ, академий наук многих стран мира, везде по-разному, но всегда одухотворенно и очень интересно.
Что-то объединяет людей. Быть может, также великие открытия и любовь к науке.
* В то же время в нашей стране теорию ядерного деления независимо развивал Я.И. Френкель [5].
** С 2019 года самая большая периодическая Таблица элементов (660 м2) находится в Австралии в государственном университете Эдит Коуэн (ECU) в г. Перт.
*** К сожалению, калифорний – самый тяжёлый элемент, который может быть получен в ядерном реакторе в количестве, необходимом для изготовления мишени. Для синтеза 119 элемента и более тяжелых придется увеличивать массу и заряд бомбардирующих ионов.
Литература
1. Gamov G. Discussion оn the structure of atomic nuclei// Proc. of the Royal Society A. 1929. № 123. P. 386–387.
2. Gamov G. Zur Quantentheorie des Atomkernes // Zeitschrift fur Physik. 1928. V. 51. № ¾. P. 204–212.
3. Von Weizsäcker C.F. Zur Theorie der Kernmassen// Zeitschrift fur Physik. 1935. V. 96. P. 431.
4. Bohr N., Weeler J.A. The Mechanism of Nuclear Fission // Phys. Rev. 1939. V. 56. P. 426–450.
5. Френкель Я.И. Электрокапиллярная теория расщепления тяжёлых ядер медленными нейтронами // ЖЭТФ. 1939. № 6. С. 641–653.
6. Flerov , Petrjak . Spontaneous Fission of Uranium // Phys. Rev. 1940. V. 58. Р. 89.
7. Seaborg G.T., Loveland W.D. Transuranium Nuclei // Treatise on Heavy-Ion Science / Edited by D.A. Bromley. V. 4. P. 289. N.Y.: Plenum Press, 1985.
8. Polikanov S.M., Druin A.V., Karnaukhov V.A. et al. Spontaneous fission with an anomalously short period // Soviet Physics JETP-USSR. 1962. № 15(6). P.1016–1021.
9. Morita K., Morimoto K., Kaji D. et al. Experiment on the Synthesis of Element 113 in the Reaction 209Bi (70Zn,n)278113 // J. Phys. Soc. Jpn. 2004. V.73. P. 2593–2596.
10. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al., Synthesis of Superheavy Nuclei in the 48Ca+244Pu Reaction // Phys. Rev. Lett. 1999. V. 83. P. 3154–3157.
11. Oganessian Yu.Ts., Utyonkoy V.K., Lobanov Yu.V. et al. Experiments on the synthesis of element 115 in the reaction 243Am(48Ca,xn)291−x115 // Phys. Rev. C. 2004. V. 69. № 021601(R).
12. Oganessian Yu.Ts., Abdullin F.Sh., Bailey P.D. et al. Synthesis of a New Element with Atomic Number Z=117 // Phys. Rev. Lett. 2010. V. 104. № 142502.
13. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al. Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions // Phys. Rev. C. 2006. V. 74. № 044602.
14. Oganessian Yu.Ts., Utyonkov V.K. Super-heavy element research // Rep. Prog. Phys. 2015. V. 78. № 036301.
15. Eichler R., Aksenov N.V., Belozerov A.V. et al. Chemical characterization of element 112 // Nature. 2007. V. 447. P. 72–75.
16. Mewes J.-M., Smits O. R., Kresse G. et al. Copernicium: A Relativistic Noble Liquid // Angew. Chem. Int. Ed.2019. V.58, P.17964 – 17968
17. Ramsay W., Soddy F. Further Experiments on the Production of Helium from Radium // Proceedings of the Royal Society of London (1854–1905). 1904. V. 73. P. 346–358.
18. Pershina V. Relativity in the electronic structure of the heaviest elements and its influence on periodicities in properties // Radiochimica Acta. 2019. V. 107. Р. 833–864.
19. Eliav E., Borschevsky A., Kaldor U. Electronic Structure at the Edge of the Periodic Table // Nuclear Physics News. 2019. V. 29. Р. 16–20.
20. Lackenby B.G.C., Dzuba V.A, Flambaum V.V. Atomic structure calculations of superheavy noble element oganesson (Z=118) // Phys.Rev. A. 2018. V. 98. P. 042512.
21. Jerabek P., Schuetrumpf B., Schwerdtfeger P., Nazarewicz W. Electron and Nucleon Localization Functions of Oganesson: Approaching the Thomas-Fermi Limit// Phys. Rev. Lett. 2018. V. 120. Р. 053001.
22. Shabaev V.M., Tupitsyn I.I., Kaygorodov M.Y., Kozhedub Y.S. Localisation of electron states of Oganesson atoms // The 4th International Symposium on Superheavy Elements (SHE2019). Hakone, Japan. Dec.1–5, 2019
23. Giuliani S. A., Matheson Z., Nazarewicz W. et al., Colloquium: Superheavy elements: Oganesson and beyond// Rev. Mod. Phys. 2019. V. 91. No. 1. P.01100.
24. Düllmann C.E. Superheavy Element Research at TASCA at GSI // Fission and Properties of Neutron-Rich Nuclei. 2013. V. 44. Р. 271–277.
25. Hofmann S., Heinz S., Mann R. et al. Review of even element super-heavy nuclei and search for element 120 // Eur. Phys. J. A. 2016. V. 52. Р. 180.
26. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al. Attempt to produce element 120 in the 244Pu+58Fe reaction // Phys. Rev. C. 2009. V. 79. Р. 024603.
27. Borschevsky A., Pershina V., Eliav E., Kaldor U. Ab initio predictions of atomic properties of element 120 and its lighter group-2 homologues // Phys. Rev. A. 2013. V. 87. P. 022502.
28. Gulbekian G.G., Dmitriev S.N., Itkis M.G. et al. Start-Up of the DC-280 Cyclotron, the Basic Facility of the Factory of Superheavy Elements of the Laboratory of Nuclear Reactions at the Joint Institute for Nuclear Research // Physics of Particles and Nuclei Letters. 2019. V. 16(6). Р. 866–875.
Как легко определять свойства элементов и их соединений — Российская газета
Не так уж часто удается написать заметку о том, что не просто войдет в школьные учебники будущего, а станет одной из базовых картинок-иллюстраций. Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, “Коту” рассказал профессор Сколтеха Артем Оганов.
Артем Оганов – кристаллограф-теоретик, создатель ряда новых материалов, а главное, методов, которые позволяют открывать новые материалы. Решил считавшуюся нерешаемой задачу предсказания кристаллической структуры вещества на основе его химического состава. Создал программу USPEX, способную предсказывать устойчивые химические соединения по набору исходных элементов. Один из самых цитируемых в мире ученых.
Я хорошо помню, как мне пришло в голову решение этой задачи. Мы с семьей садились в самолет. У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
Эта проблема волновала меня последние 15 лет. В 1984 году британский физик Дэвид Петтифор опубликовал работу, в которой ввел понятие менделеевских чисел, – с их помощью он сгруппировал элементы в порядке изменения их химических свойств. В таблице Менделеева свойства элементов меняются скачками. Так, после самого химически активного неметалла фтора идет инертный неон, а сразу за ним – активнейший металл натрий. Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Петтифор предложил решение – выстроил элементы в некоторой последовательности, приписав им некие числа Менделеева. Но как приписал, не объяснил. И тем более не объяснил, какой у них физический смысл. Эти числа не расчет, а произвол, хотя и основанный на наблюдениях за свойствами бинарных соединений – веществ, состоящих из двух разных атомов. Скажем, если NaCl и KCl похожи, то и натрий с калием должны стоять рядом. Все это время ученые модифицировали и улучшали менделеевские числа, но что это такое, так никто и не объяснил.
У химических элементов есть разные характеристики, которые влияют на их свойства. Прежде всего размер атома (его радиус), валентность, поляризуемость*, электроотрицательность**. Но валентность – параметр непостоянный, у разных элементов могут быть разные валентности, а мы неоднократно открывали химические соединения, которые с точки зрения привычных представлений о валентности не могли бы существовать. Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
*Поляризуемость – способность атома или молекулы становиться электрически полярными во внешнем электромагнитном поле. Поляризуемость показывает, насколько легко может возникнуть заряженная частица (ион) или новая химическая связь.
**Электроотрицательность – способность атома оттягивать электроны других атомов в химических соединениях. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (F, O, N, Cl), низкая – у активных металлов (Li, Na, K).
Получается, что для определения фундаментальных свойств атомов можно использовать только атомный радиус и электроотрицательность. И если по оси Х – радиус, а по оси Y – электроотрицательность, мы получаем плоскость, на которой сильно вытянутым облаком располагаются элементы. Внутри этого облака, воспользовавшись несложным математическим приемом, можно провести линию, вдоль которой элементы встанут в порядке максимально плавного изменения свойств.
Так мы открыли физический и химический смысл менделеевских чисел: это наилучшее представление всех химических свойств атома одним числом. Но мы предложили не только объяснение, но и улучшенную версию чисел Менделеева, в которой нет места субъективности – только расчеты на основе фундаментальных характеристик атомов. Мы назвали это “Универсальной последовательностью элементов”, по-английски Universal Sequence Of Elements, сокращенно USE. И действительно, наша последовательность удобна в применении: она предсказывает свойства химических соединений лучше, чем петтифоровские менделеевские числа и их позднейшие модификации.
Если расположить элементы на осях, то на плоскости будут бинарные соединения – молекулы и кристаллы, состоящие из двух типов атомов. Мы обнаружили, что на этом поле – его можно назвать химическим пространством – возникают области соединений с близкими свойствами, например твердостью кристаллов, магнетизмом, энергией связи. Известно, например, что алмаз, состоящий только из углерода, – самый твердый из кристаллов. А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
Улучшенные менделеевские числа помогут находить новые соединения с полезными свойствами и смогут прояснить некоторые вопросы, связанные с привычной таблицей Менделеева. Например, уже сейчас можно ставить точку в споре, где должен находиться водород: над литием или над фтором. Согласно менделеевским числам, водород ближе к галогенам, чем к щелочным металлам.
Ссылка: Zahed Allahyari and Artem R. Oganov, Nonempirical Definition of the Mendeleev Numbers: Organizing the Chemical Space: J. Phys. Chem. C 2020, 124, 43, 23867-23878.
Универсальная последовательность элементов (USE)
Журнал “Кот Шрёдингера”
Как вычисляются числа Менделеева
Универсальная последовательность элементов определяется их проекцией на линию, обозначенную синим цветом. Журнал “Кот Шрёдингера”
история открытия, интересные факты и байки – Москва 24, 24.10.2012
Фото: ИТАР-ТАСС
Открытие таблицы периодических химических элементов стало одной из важных вех в истории развития химии как науки. Первооткрывателем таблицы стал российский ученый Дмитрий Менделеев. Неординарный ученый с широчайшим научным кругозором сумел объединить все представления о природе химических элементов в единую стройную концепцию.
Об истории открытия таблицы периодических элементов, интересных фактах, связанных с открытием новых элементов, и народных байках, которые окружали Менделеева и созданную им таблицу химических элементов, М24.RU расскажет в этой статье.
История открытия таблицы
К середине XIX века было открыто 63 химических элемента, и ученые всего мира не раз предпринимали попытки объединить все существовавшие элементы в единую концепцию. Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
В 1863 году свою теорию предложил химик и музыкант Джон Александр Ньюленд, который предложил схему размещения химических элементов, схожую с той, что открыл Менделеев, но работа ученого не была принята всерьез научным сообществом из-за того, что автор увлекся поисками гармонии и связью музыки с химией.
В 1869 году Менделеев опубликовал свою схему периодической таблицы в журнале Русского химического общества и разослал извещение об открытии ведущим ученым мира. В дальнейшем химик не раз дорабатывал и улучшал схему, пока она не приобрела привычный вид.
Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов, свойства начинают повторяться. Так, калий похож на натрий, фтор – на хлор, а золото схоже с серебром и медью.
В 1871 году Менделеев окончательно объединил идеи в периодический закон. Ученые предсказал открытие нескольких новых химических элементов и описал их химические свойства. В дальнейшем расчеты химика полностью подтвердились – галлий, скандий и германий полностью соответствовали тем свойствам, которые им приписал Менделеев.
Байки о Менделееве
Гравюра, на которой изображен Менделеев. Фото: ИТАР-ТАСС
Об известном ученом и его открытиях ходило немало баек. Люди в то время слабо представляли себе химию и считали, что занятия химией – это что-то вроде поедания супа из младенцев и воровства в промышленных масштабах. Поэтому деятельность Менделеева быстро обросла массой слухов и легенд.
Одна из легенд гласит, что Менделеев открыл таблицу химических элементов во сне. Случай не единственный, точно также говорил о своем открытии Август Кекуле, которому приснилась формула бензольного кольца. Однако Менделеев только смеялся над критиками. “Я над ней, может быть, двадцать лет думал, а вы говорите: сидел и вдруг … готово!”, – как-то сказал ученый о своем открытии.
Другая байка приписывает Менделееву открытие водки. В 1865 году великий ученый защитил диссертацию на тему “Рассуждение о соединении спирта с водою”, и это сразу дало повод для новой легенды. Современники химика посмеивались, мол ученый “неплохо творит под действием спирта, соединенного с водой”, а следующие поколения уже называли Менделеева первооткрывателем водки.
Посмеивались и над образом жизни ученого, а особенно над тем, что Менделеев оборудовал свою лабораторию в дупле огромного дуба.
Также современники подтрунивали над страстью Менделеева к чемоданам. Ученый в пору своего невольного бездействия в Симферополе вынужден был коротать время за плетением чемоданов. В дальнейшем он самостоятельно мастерил для нужд лаборатории картонные контейнеры. Несмотря на явно “любительский” характер этого увлечения, Менделеева часто называли “чемоданных дел мастером”.
Открытие радия
Одна из наиболее трагичных и в то же время известных страниц в истории химии и появления новых элементов в таблице Менделеева связана с открытием радия. Новый химический элемент был открыт супругами Марией и Пьером Кюри, которые обнаружили, что отходы, остающиеся после выделения урана из урановой руды, более радиоактивны, чем чистый уран.
Поскольку о том, что такое радиоактивность, тогда еще никто не знал, то новому элементу молва быстро приписала целебные свойства и способность излечивать чуть ли не от всех известных науке болезней. Радий включили в состав пищевых продуктов, зубной пасты, кремов для лица. Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для улучшения потенции и снятия стресса.
Подобное “производство” продолжалось целых двадцать лет – до 30-х годов двадцатого века, когда ученые открыли истинные свойства радиоактивности и выяснили насколько губительно влияние радиации на человеческий организм.
Мария Кюри умерла в 1934 году от лучевой болезни, вызванной долговременным воздействием радия на организм.
Небулий и короний
Фото: ИТАР-ТАСС
Таблица Менделеева не только упорядочила химические элементы в единую стройную систему, но и позволила предсказать многие открытия новых элементов. В то же время некоторые химические “элементы” были признаны несуществующими на основании того, что они не укладывались в концепцию периодического закона. Наиболее известна история с “открытием” новых элементов небулия и корония.
При исследовании солнечной атмосферы астрономы обнаружили спектральные линии, которые им не удалось отождествить ни с одним из известных на земле химических элементов. Ученые предположили, что эти линии принадлежат новому элементу, который получил название короний (потому что линии были обнаружены при исследовании “короны” Солнца – внешнего слоя атмосферы звезды).
Спустя несколько лет астрономы сделали еще одно открытие, изучая спектры газовых туманностей. Обнаруженные линии, которые снова не удалось отождествить ни с чем земным, приписали другому химическому элементу – небулию.
Открытия подверглись критике, поскольку в периодической таблице Менделеева уже не оставалось места для элементов, обладающих свойствами небулия и корония. После проверки обнаружилось, что небулий является обычным земным кислородом, а короний – сильно ионизированное железо.
Отметим, что сегодня в московском Центральном доме ученых РАН торжественно присвоят имена двум химическим элементам, открытым учеными из подмосковной Дубны.
Материал создан на основе информации из открытых источников. Подготовил Василий Макагонов @vmakagonov
Argon – Информация об элементе, свойства и использование
Расшифровка:
Химия в ее стихии: аргон
(Promo)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет, на этой неделе элемент настолько ленив, что ученые одно время думали, что он ни с чем не отреагирует, но в химическом мире лень может иметь свое преимущества, особенно если это сверхтихие автомобильные шины или безопасный химикат для накачки вашего гидрокостюма, который вам нужен.
Вот Джон Эмсли.
Джон Эмсли
Ленивый, трудолюбивый, бесцветный, красочный – это аргон!
Название Аргона происходит от греческого слова argos , означающего «ленивый», и действительно, более ста лет после его открытия химики не могли заставить его соединяться с другими элементами. Но в 2000 году химики из Хельсинкского университета во главе с Маркку Рясяненом объявили о первом в истории соединении: фторгидриде аргона.Они сделали это путем конденсации смеси аргона и фтороводорода на иодид цезия при -265 o C и воздействия ультрафиолетового света. При потеплении выше -246 o C он снова превратился в аргон и фтористый водород. И никакой другой процесс никогда не заставлял аргон реагировать – [действительно ленивый элемент].
В атмосфере Земли циркулирует 50 триллионов тонн аргона, и он медленно накапливается в течение миллиардов лет, почти все это происходит в результате распада радиоактивного изотопа калия-40 с периодом полураспада 12 .7 миллиардов лет. Хотя аргон составляет 0,93% атмосферы, он не был открыт до 1894 года, когда его идентифицировали физик лорд Рэлей и химик Уильям Рамзи. В 1904 году Рэлей получил Нобелевскую премию по физике, а Рамзи получил Нобелевскую премию по химии за свои работы.
История его открытия началась, когда Рэлей обнаружил, что азот, извлеченный из воздуха, имеет более высокую плотность, чем полученный при разложении аммиака. Разница была небольшой, но реальной. Рамзи написал Рэли, предлагая поискать более тяжелый газ в азоте, полученном из воздуха, в то время как Рэли должен искать более легкий газ из аммиака.Рамзи удалил весь азот из своего образца, многократно пропуская его над нагретым магнием, с которым азот реагирует с образованием нитрида магния. Ему оставили один процент, который не вступил в реакцию, и он обнаружил, что он плотнее азота. В его атомном спектре появились новые красные и зеленые линии, подтверждающие, что это новый элемент. Хотя на самом деле в нем были следы и других благородных газов.
Аргон был впервые выделен Генри Кавендишем в 1785 году в Клэпхэме, Южный Лондон. Он пропустил электрические искры через воздух и поглотил образующиеся газы, но был озадачен тем, что остался нереактивный 1%.Он не осознавал, что наткнулся на новый газообразный элемент.
Большая часть аргона идет на производство стали, где он продувается через расплавленное железо вместе с кислородом. Аргон перемешивает, а кислород удаляет углерод в виде диоксида углерода. Он также используется, когда необходимо исключить доступ воздуха для предотвращения окисления горячих металлов, например, при сварке алюминия и производстве титана, чтобы исключить доступ воздуха. Сварка алюминия выполняется с помощью электрической дуги, для которой требуется поток аргона со скоростью 10-20 литров в минуту.Топливные элементы атомной энергии защищены атмосферой аргона во время очистки и переработки.
Ультратонкие металлические порошки, необходимые для изготовления сплавов, получают путем направления струи жидкого аргона на струю расплавленного металла.
Некоторые плавильные заводы предотвращают попадание токсичной металлической пыли в окружающую среду, выпуская ее через аргонную плазменную горелку. При этом атомы аргона электрически заряжаются до температуры 10 000 ° C, а частицы токсичной пыли, проходящие через них, превращаются в сгусток расплавленного лома.
Для газа, который является химически ленивым, аргон оказался в высшей степени применимым. Световые знаки светятся синим цветом, если они содержат аргон, и ярко-синим, если также присутствует небольшое количество паров ртути. Двойное остекление еще более эффективно, если зазор между двумя стеклами заполнен аргоном, а не только воздухом, потому что аргон является худшим проводником тепла. Теплопроводность аргона при комнатной температуре (300 K) составляет 17,72 мВт · м -1 K -1 (милливатт на метр на градус), тогда как для воздуха она составляет 26 мВт · м -1 K -1 . По той же причине аргон используется для надувания водолазных костюмов. Старые документы и другие вещи, подверженные окислению, можно защитить, храня их в атмосфере аргона. Лазеры на синем аргоне используются в хирургии для сварки артерий, разрушения опухолей и исправления дефектов глаз.
Наиболее экзотично аргон используется в шинах роскошных автомобилей. Он не только защищает резину от воздействия кислорода, но и снижает шум в шинах при движении автомобиля на высокой скорости. В случае с этим элементом может пригодиться лень.В его высоких технологиях используются самые разные технологии – от двойного остекления и лазерной хирургии глаза до освещения вашего имени.
Крис Смит
Джон Эмсли раскрывает секреты благородного газа аргона тяжелее воздуха. На следующей неделе вы бы вышли замуж за этого человека?
Steve Mylon
Это почти никогда не случается с популярными элементами из-за их полезности и интересного химического состава. Но для золота и серебра все так поверхностно. Они популярнее, потому что красивее.Моя жена, например, не химик, и не мечтала носить медное обручальное кольцо. Возможно, это связано с тем, что оксид меди имеет раздражающую привычку окрашивать вашу кожу в зеленый цвет. Но если бы она только нашла время, чтобы узнать о меди, узнать немного о ней; возможно, тогда она отвернется от других и с гордостью наденет его.
Крис Смит
Стив Майлон скрестит вашу ладонь с медью на следующей неделе “Химия в ее элементе”. Надеюсь, вы присоединитесь к нам.Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
аргона | Свойства, использование, атомный номер и факты
Аргон (Ar) , химический элемент, инертный газ группы 18 (благородные газы) периодической таблицы, самый распространенный и наиболее часто используемый в промышленности благородный газ. Бесцветный, без запаха и вкуса газ аргон был выделен (1894 г.) из воздуха британскими учеными лордом Рэли и сэром Уильямом Рамзи.Генри Кавендиш, исследуя атмосферный азот («флогистированный воздух»), в 1785 году пришел к выводу, что не более 1 / 120 части азота может быть инертным компонентом. Его работа была забыта до тех пор, пока лорд Рэлей, более века спустя, не обнаружил, что азот, полученный путем удаления кислорода из воздуха, всегда примерно на 0,5 процента плотнее, чем азот, полученный из химических источников, таких как аммиак. Более тяжелый газ, оставшийся после удаления из воздуха кислорода и азота, был первым из благородных газов, обнаруженных на Земле, и был назван в честь греческого слова argos , «ленивый», из-за своей химической инертности.(Гелий был спектроскопически обнаружен на Солнце в 1868 году.)
аргонСвойства аргона.
Британская энциклопедия, Inc.Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
По количеству в космосе аргон занимает примерно 12-е место среди химических элементов. Аргон составляет 1,288 процента атмосферы по весу и 0,934 процента по объему и обнаружен в скальных породах. Хотя стабильные изотопы аргон-36 и аргон-38 составляют почти следы этого элемента во Вселенной, третий стабильный изотоп, аргон-40, составляет 99,60 процента аргона, обнаруженного на Земле. (Аргон-36 и аргон-38 составляют 0,34 и 0,06 процента аргона Земли соответственно.Большая часть земного аргона производилась с момента образования Земли в калийсодержащих минералах в результате распада редкого, естественно радиоактивного изотопа калия-40. Газ медленно просачивается в атмосферу из горных пород, в которых он все еще формируется. Производство аргона-40 из распада калия-40 используется в качестве средства определения возраста Земли (калиево-аргоновое датирование).
Аргон выделяется в больших масштабах путем фракционной перегонки жидкого воздуха. Применяется в газонаполненных электрических лампах, радиолампах и счетчиках Гейгера.Он также широко используется в качестве инертной атмосферы для дуговой сварки металлов, таких как алюминий и нержавеющая сталь; для производства и изготовления металлов, таких как титан, цирконий и уран; и для выращивания кристаллов полупроводников, таких как кремний и германий.
Газообразный аргон конденсируется в бесцветную жидкость при -185,8 ° C (-302,4 ° F) и в кристаллическое твердое вещество при -189,4 ° C (-308,9 ° F). Газ нельзя сжижать под давлением, превышающим температуру -122,3 ° C (-188,1 ° F), и в этот момент для его сжижения требуется давление не менее 48 атмосфер.При 12 ° C (53,6 ° F) 3,94 объема газообразного аргона растворяются в 100 объемах воды. Электрический разряд через аргон при низком давлении выглядит бледно-красным, а при высоком – стальным синим.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасВнешняя (валентная) оболочка аргона имеет восемь электронов, что делает ее чрезвычайно стабильной и, следовательно, химически инертной. Атомы аргона не соединяются друг с другом; также не наблюдалось их химического соединения с атомами какого-либо другого элемента.Атомы аргона были механически захвачены в клетчатых полостях между молекулами других веществ, как, например, в кристаллах льда или органическом соединении гидрохиноне (называемом клатратами аргона).
| атомный номер | 18 | ||
|---|---|---|---|
| атомный вес | [39,792, 39,963] | ||
| точка плавления | −189,2 °146 | точка | −185,7 ° C (−302.3 ° F) |
| плотность (1 атм, 0 ° C) | 1,784 г / литр | ||
| степень окисления | 0 | ||
| электронная конфигурация. | 1 с 2 2 с 2 2 p 6 3 с 2 3 p 6 |
благородный газ | Определение, элементы, свойства, характеристики и факты
Благородный газ , любой из семи химических элементов, составляющих 18-ю группу (VIIIa) периодической таблицы Менделеева.Элементами являются гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe), радон (Rn) и оганессон (Og). Благородные газы – это негорючие газы без цвета, запаха и вкуса. Их традиционно относили к группе 0 в периодической таблице, потому что в течение десятилетий после их открытия считалось, что они не могут связываться с другими атомами; то есть их атомы не могут соединяться с атомами других элементов с образованием химических соединений. Их электронная структура и открытие, что некоторые из них действительно образуют соединения, привело к более подходящему обозначению – Группа 18.
интерактивная таблица МенделееваСовременная версия периодической таблицы элементов. Чтобы узнать название элемента, атомный номер, электронную конфигурацию, атомный вес и многое другое, выберите элемент из таблицы.
Encyclopædia Britannica, Inc.Когда члены группы были обнаружены и идентифицированы, они считались чрезвычайно редкими, а также химически инертными, и поэтому были названы редкими или инертными газами. Однако теперь известно, что некоторые из этих элементов довольно распространены на Земле и в остальной части Вселенной, поэтому обозначение редкий вводит в заблуждение.Точно так же использование термина , инертный имеет тот недостаток, что он означает химическую пассивность, предполагая, что соединения Группы 18 не могут образовываться. В химии и алхимии слово благородный издавна обозначало нежелание металлов, таких как золото и платина, подвергаться химической реакции; в том же смысле это применимо к рассматриваемой здесь группе газов.
Содержание благородных газов уменьшается с увеличением их атомных номеров. Гелий – самый распространенный элемент во Вселенной, кроме водорода.Все благородные газы присутствуют в атмосфере Земли, и, за исключением гелия и радона, их основным коммерческим источником является воздух, из которого они получаются путем сжижения и фракционной перегонки. Большая часть гелия коммерчески добывается из некоторых скважин с природным газом. Радон обычно выделяют как продукт радиоактивного разложения соединений радия. Ядра атомов радия спонтанно распадаются, испуская энергию и частицы, ядра гелия (альфа-частицы) и атомы радона. Некоторые свойства благородных газов перечислены в таблице.
| гелий | неон | аргон | криптон | ксенон | радон | ununoctium | |
|---|---|---|---|---|---|---|---|
| * При 25,05 атмосфер. | |||||||
| ** hcp = гексагональная плотноупакованная, fcc = гранецентрированная кубическая (кубическая плотноупакованная). | |||||||
| *** Самый стабильный изотоп. | |||||||
| атомный номер | 2 | 10 | 18 | 36 | 54 | 86 | 118 |
| атомный вес | 4.003 | 20,18 | 39,948 | 83,8 | 131,293 | 222 | 294 *** |
| точка плавления (° C) | -272,2 * | -248,59 | −189,3 | -157,36 | −111.7 | −71 | – |
| точка кипения (° C) | −268,93 | -246,08 | −185,8 | -153,22 | −108 | −61,7 | – |
| плотность при 0 ° C, 1 атмосфера (грамм на литр) | 0.17847 | 0,899 | 1,784 | 3,75 | 5,881 | 9,73 | – |
| растворимость в воде при 20 ° C (кубические сантиметры газа на 1000 граммов воды) | 8,61 | 10,5 | 33,6 | 59.4 | 108,1 | 230 | – |
| изотопное содержание (наземные, в процентах) | 3 (0,000137), 4 (99,999863) | 20 (90,48), 21 (0,27), 22 (9,25) | 36 (0,3365), 40 (99,6003) | 78 (0,35), 80 (2,28), 82 (11,58), 83 (11,49), 84 (57), 86 (17.3) | 124 (0,09), 126 (0,09), 128 (1,92), 129 (26,44), 130 (4,08), 131 (21,18), 132 (26,89), 134 (10,44), 136 (8,87) | – | – |
| радиоактивные изотопы (массовые числа) | 5–10 | 16–19, 23–34 | 30–35, 37, 39, 41–53 | 69–77, 79, 81, 85, 87–100 | 110–125, 127, 133, 135–147 | 195–228 | 294 |
| цвет света, излучаемого газоразрядной трубкой | желтый | красный | красный или синий | желтый зеленый | синий к зеленому | – | – |
| теплота плавления (килоджоули на моль) | 0.02 | 0,34 | 1.18 | 1,64 | 2.3 | 3 | – |
| теплота испарения (калорий на моль) | 0,083 | 1,75 | 6.5 | 9.02 | 12.64 | 17 | – |
| удельная теплоемкость (джоули на грамм Кельвина) | 5,1931 | 1.03 | 0,52033 | 0,24805 | 0,15832 | 0,09365 | – |
| критическая температура (K) | 5.19 | 44,4 | 150,87 | 209,41 | 289,77 | 377 | – |
| критическое давление (атмосферы) | 2,24 | 27,2 | 48,34 | 54,3 | 57.65 | 62 | – |
| критическая плотность (граммы на кубический сантиметр) | 0,0696 | 0,4819 | 0,5356 | 0,9092 | 1,103 | – | – |
| теплопроводность (ватт на метр по Кельвину) | 0.1513 | 0,0491 | 0,0177 | 0,0094 | 0,0057 | 0,0036 | – |
| магнитная восприимчивость (единицы cgs на моль) | −0,0000019 | −0,0000072 | -0,0000194 | −0.000028 | −0,000043 | – | – |
| Кристальная структура** | hcp | fcc | fcc | fcc | fcc | fcc | – |
| радиус: атомный (ангстремы) | 0.31 год | 0,38 | 0,71 | 0,88 | 1.08 | 1.2 | – |
| радиус: ковалентный (кристалл) оценен (ангстремы) | 0,32 | 0,69 | 0,97 | 1.1 | 1.3 | 1,45 | – |
| статическая поляризуемость (кубические ангстремы) | 0,204 | 0,392 | 1,63 | 2,465 | 4.01 | – | – |
| потенциал ионизации (во-первых, электрон-вольт) | 24.587 | 21,565 | 15,759 | 13,999 | 12,129 | 10,747 | – |
| электроотрицательность (Полинг) | 4.5 | 4.0 | 2,9 | 2,6 | 2.25 | 2.0 | – |
История
В 1785 году английский химик и физик Генри Кавендиш обнаружил, что воздух содержит небольшую часть (чуть менее 1 процента) вещества, которое химически менее активно, чем азот. Спустя столетие английский физик лорд Рэлей выделил из воздуха газ, который, по его мнению, был чистым азотом, но обнаружил, что он плотнее, чем азот, который был получен путем выделения его из его соединений.Он рассудил, что его воздушный азот должен содержать небольшое количество более плотного газа. В 1894 году сэр Уильям Рамзи, шотландский химик, сотрудничал с Рэлеем в выделении этого газа, который оказался новым элементом – аргоном.
выделение аргонаАппарат, использованный для выделения аргона английским физиком лордом Рэли и химиком сэром Уильямом Рамзи, 1894 г. Воздух содержится в пробирке (A), стоящей над большим количеством слабой щелочи (B), и электрическим Искра передается по проводам (D), изолированным U-образными стеклянными трубками (C), проходящими через жидкость и вокруг горловины пробирки.Искра окисляет азот в воздухе, а оксиды азота поглощаются щелочью. После удаления кислорода в пробирке остается аргон.
Британская энциклопедия, Inc. Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасПосле открытия аргона и по инициативе других ученых в 1895 году Рамзи исследовал газ, выделяющийся при нагревании минерала клевита, который считался источником аргона.Вместо этого газом был гелий, который в 1868 году был обнаружен спектроскопически на Солнце, но не был обнаружен на Земле. Рамзи и его коллеги искали родственные газы и путем фракционной перегонки жидкого воздуха обнаружили криптон, неон и ксенон – все в 1898 году. Радон был впервые обнаружен в 1900 году немецким химиком Фридрихом Дорном; он был основан как член группы по изучению благородных газов в 1904 году. Рэлей и Рамзи получили Нобелевские премии в 1904 году за свою работу.
В 1895 году французский химик Анри Муассан, открывший элементарный фтор в 1886 году и получивший за это открытие в 1906 году Нобелевскую премию, потерпел неудачу в попытке вызвать реакцию между фтором и аргоном.Этот результат был значительным, потому что фтор – самый реактивный элемент в периодической таблице. Фактически, все попытки получить химические соединения аргона в конце 19 – начале 20 века провалились. Отсутствие химической активности, вызванное этими неудачами, имело значение для развития теорий атомной структуры. В 1913 году датский физик Нильс Бор предположил, что электроны в атомах расположены в последовательных оболочках, имеющих характерные энергии и емкости, и что емкости оболочек для электронов определяют количество элементов в строках периодической таблицы.На основе экспериментальных данных, связывающих химические свойства с распределением электронов, было высказано предположение, что в атомах благородных газов тяжелее гелия электроны расположены в этих оболочках таким образом, что самая внешняя оболочка всегда содержит восемь электронов, независимо от того. сколько других (в случае радона, 78 других) расположены внутри внутренних оболочек.
В теории химической связи, выдвинутой американским химиком Гилбертом Н. Льюисом и немецким химиком Вальтером Косселем в 1916 году, этот октет электронов считался наиболее стабильным расположением внешней оболочки любого атома.Хотя только атомы благородных газов обладали таким расположением, это было условием, к которому атомы всех других элементов стремятся в своей химической связи. Некоторые элементы удовлетворяли эту тенденцию, приобретая или сразу теряя электроны, тем самым становясь ионами; другие элементы разделяют электроны, образуя стабильные комбинации, связанные друг с другом ковалентными связями. Таким образом, пропорции, в которых атомы элементов объединяются с образованием ионных или ковалентных соединений (их «валентности»), контролируются поведением их внешних электронов, которые по этой причине были названы валентными электронами.Эта теория объясняла химическую связь реакционноспособных элементов, а также относительную неактивность благородных газов, которая стала рассматриваться как их главная химическая характеристика. ( См. Также химическая связь: Связи между атомами.)
Оболочечная модель атомаВ оболочечной модели атома электроны занимают разные энергетические уровни или оболочки. Оболочки K и L показаны для атома неона.
Encyclopædia Britannica, Inc.Защищенные от ядра промежуточными электронами, внешние (валентные) электроны атомов более тяжелых благородных газов удерживаются менее прочно и могут быть легче удалены (ионизированы) из атомов, чем могут электроны более легких благородных газов.Энергия, необходимая для удаления одного электрона, называется энергией первой ионизации. В 1962 году, работая в Университете Британской Колумбии, британский химик Нил Бартлетт обнаружил, что гексафторид платины удаляет электрон (окисляет) молекулярный кислород с образованием соли [O 2 + ] [PtF 6 – ]. Первая энергия ионизации ксенона очень близка к энергии кислорода; таким образом, Бартлетт думал, что соль ксенона могла образоваться аналогичным образом.В том же году Бартлетт установил, что действительно можно удалить электроны из ксенона химическими средствами. Он показал, что взаимодействие паров PtF 6 в присутствии газообразного ксенона при комнатной температуре дает желто-оранжевое твердое соединение, которое затем сформулировано как [Xe + ] [PtF 6 – ]. (Это соединение теперь известно как смесь [XeF + ] [PtF 6 – ], [XeF + ] [Pt 2 F 11 – ] и PtF 5 .) Вскоре после первоначального сообщения об этом открытии две другие группы химиков независимо подготовили и впоследствии сообщили о фторидах ксенона, а именно, XeF 2 и XeF 4 . Вскоре за этими достижениями последовало получение других соединений ксенона и фторидов радона (1962 г.) и криптона (1963 г.).
В 2006 году ученые Объединенного института ядерных исследований в Дубне (Россия) объявили, что следующий благородный газ – оганессон – был получен в 2002 и 2005 годах на циклотроне.(Большинство элементов с атомными номерами больше 92, т. Е. Трансурановые элементы, должны производиться в ускорителях частиц.) Никакие физические или химические свойства оганессона не могут быть непосредственно определены, поскольку было произведено всего несколько атомов оганессона.
Благородные газы (группа 18)
Цель обучения
- Определите свойства благородных газов.
Ключевые моменты
- Благородные газы – это негорючие газы без цвета, запаха и вкуса при стандартных условиях.
- В периодической таблице благородные газы расположены в соответствии с их температурой кипения.
- Благородные газы широко используются в различных областях, от ламп накаливания до эксимерных лазеров.
- Ксенон используется в качестве анестетика из-за его высокой растворимости в липидах, что делает его более сильным, чем обычная закись азота, и потому, что он легко выводится из организма, что способствует более быстрому выздоровлению.
- Ксенон находит применение в медицинской визуализации легких с помощью гиперполяризованной МРТ.
- Радон, который очень радиоактивен и доступен только в незначительных количествах, используется в лучевой терапии.
Условия
- инерт Вещество, не вступающее в химическую реакцию.
- реакционная способность Относительная восприимчивость к химической реакции.
- одноатомный элемент, состоящий из одного атома в молекуле; например: благородные газы. Примечание: строго говоря, в молекуле не менее двух атомов.
- валентный электрон: Самые удаленные электроны атома и единственные электроны, которые участвуют в химической связи.Атомы с полной валентной электронной оболочкой стабильны.
Благородные газы – это группа химических элементов, составляющих 18-ю группу периодической таблицы Менделеева. Все эти газы имеют схожие свойства при стандартных условиях: все они одноатомные газы без запаха, цвета и очень низкой химической активности. В природе встречаются шесть благородных газов: гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn).
Свойства благородных газов
Свойства благородных газов могут быть хорошо объяснены современными теориями строения атомов.Внешняя оболочка валентных электронов в благородных газах считается «полной», что не дает им возможности участвовать в химических реакциях. Было возможно приготовить всего несколько сотен соединений благородных газов. В случае Неона (Ne), например, обе оболочки с n = 1 и n = 2 являются законченными, и, следовательно, это стабильный одноатомный газ в условиях окружающей среды.
Электронная конфигурация неона Электронная конфигурация Неона (Ne) с двумя полными уровнями энергии, 1s 2 и 2s 2 2p 6 .Точки плавления и кипения (физические свойства) благородного газа близки друг к другу и отличаются менее чем на 10 ° C (18 ° F), то есть они являются жидкостями только в небольшом диапазоне температур.
Физические свойства благородных газов Физические свойства благородных газов четко сгруппированы.Благородные газы обладают слабыми межатомными взаимодействиями и, следовательно, имеют очень низкие температуры плавления и кипения. Все они являются одноатомными газами при стандартных условиях, включая газы с большей атомной массой, чем многие другие элементы, являющиеся твердыми веществами при стандартных условиях.
Электронные конфигурации в благородных газах
Атомы благородных газов, как и атомы в большинстве других групп периодической таблицы, неуклонно увеличиваются в атомном радиусе от одного периода к другому из-за увеличения количества электронов. Размер атома связан с несколькими свойствами. Например, потенциал ионизации уменьшается с увеличением радиуса, потому что валентные электроны в более крупных благородных газах находятся дальше от ядра и поэтому не удерживаются вместе атомом так сильно.Благородные газы обладают наибольшим потенциалом ионизации среди элементов каждого периода. Это отражает стабильность их электронной конфигурации и еще раз указывает на их относительное отсутствие химической активности.
Потенциал ионизации для благородных газов Благородные газы обладают наибольшим потенциалом ионизации для элементов в соответствующие периоды.Инертные газы
Благородные газы первоначально также назывались «инертными газами», поскольку считалось, что они не вступают в реакцию с другими элементами с образованием соединений.Однако в последние годы этот термин потерял популярность, хотя иногда вы можете встретить его в более ранней литературе. Ученые обнаружили, что, поскольку более тяжелые атомы благородных газов удерживаются вместе электромагнитными силами в меньшей степени, чем более легкие благородные газы, такие как гелий, внешние электроны этих более тяжелых атомов могут быть легче удалены. Из-за этого фактически могут образовываться многие соединения газов ксенон, криптон и радон. Из шести благородных газов только криптон, ксенон и радон обладают способностью образовывать стабильные соединения.Они используются как окислители.
Применение благородных газов
Благородные газы светятся отличительными цветами при использовании внутри газоразрядных ламп, таких как неоновые лампы. Ксенон обычно используется в ксеноновых дуговых лампах, которые присутствуют в кинопроекторах и автомобильных фарах из-за их почти непрерывного спектра, напоминающего дневной свет.
Очень распространенное использование благородных газов При правильных условиях ярко освещенные и красочные знаки могут быть сделаны с использованием благородных газов.«Неоновые огни» – это общий термин, но можно использовать любой из благородных газов.Благородные газы также используются в эксимерных лазерах, в основе которых лежат короткоживущие электронно-возбужденные молекулы, известные как эксимеры. Эксимеры, используемые для лазеров, могут быть димерами благородных газов, такими как Ar 2 , Kr 2 или Xe 2 , или, чаще, благородный газ объединен с галогеном в эксимерах, таких как ArF, KrF, XeF. , или XeCl. Эти лазеры излучают ультрафиолетовый свет, который благодаря своей короткой длине волны (193 нм для ArF и 248 нм для KrF) позволяет получать изображения с высокой точностью.Эксимерные лазеры находят множество промышленных, медицинских и научных применений. Они используются для микролитографии и микротехнологии, которые необходимы для изготовления интегральных схем; и для лазерной хирургии, включая лазерную ангиопластику и хирургию глаза.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Список элементов Периодической таблицы
Щелкните заголовок столбца, например «Имя», чтобы отсортировать таблицу по этому элементу.
SEE Примечания в нижней части таблицы.
| № | | Атомный вес | Имя | Sym. | М.П. (° С) | Б.П. (° С) | Плотность * (г / см 3 ) | Земля кора (%) * | Discovery (Год) | Группа * | Электронная конфигурация | Ионизация Энергия (эВ) | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1.008 | Водород | H | -259 | -253 | 0,09 | 0,14 | 1776 | 1 | 1s 1 | 13,60 | |||||||||||||||||||
| -272 | -269 | 0,18 | 1895 | 18 | 1с 2 | 24,59 | ||||||||||||||||||||||||
| 3 | 9014 9014 9014 9014 9014 9014 9014 9014 | 0.53 | 1817 | 1 | [He] 2s 1 | 5,39 | ||||||||||||||||||||||||
| 4 | 9,012 | Бериллий | Be | 2 | [He] 2s 2 | 9,32 | ||||||||||||||||||||||||
| 5 | 10,811 | Бор | B | 2300 | 2,550 | 2,34 | 2,34 | 908 4 | 2 2п 1 | 8.30 | ||||||||||||||||||||
| 6 | 12,011 | Углерод | C | 3,500 | 4,827 | 2,26 | 0,09 | древний | 14 | 3 | 900 2 900 2 900 2 900 2 900 14 | |||||||||||||||||||
| 7 | 14.007 | Азот | N | -210 | -196 | 1,25 | 1772 | 15 | 3 2 144 2sp.53 | |||||||||||||||||||||
| 8 | 15,999 | Кислород | O | -218 | -183 | 1,43 | 46,71 | 1774 | 16 | 900 4 900 He44 900 2 144 900 4 900 Hex145 | 13,62 | |||||||||||||||||||
| 9 | 18,998 | Фтор | F | -220 | -188 | 1,70 | 0,03 | 1886 | 900] He 2 2 4 3 900 He 2 900] 2 0144 | 17.42 | ||||||||||||||||||||
| 10 | 20,180 | Неон | Ne | -249 | -246 | 0,90 | 1898 | 18 | 43 2 He] 2sp 2sp||||||||||||||||||||||
| 11 | 22,990 | Натрий | Na | 98 | 883 | 0,97 | 2,75 | 1807 | 1 | 43 1 Ne4 900 [Ne] 3s14|||||||||||||||||||||
| 12 | 24,305 | Магний | Mg | 639 | 1,090 | 1,74 | 2,08 | 1755 | 2 | 7 | 1326,982 | Алюминий | Алюминий | 660 | 2,467 | 2,70 | 8,07 | 1825 | 13 | [Ne] 3s 2 514 1 599 | ||||||||||
| 14 | 28,086 | кремния | Si | 1410 | 2355 | 2,33 | 27,69 | 1824 | 14 | [Ne] 3s 2 3p 2 | 8,15 | |||||||||||||||||||
| 15 | 30,974 | Фосфор | P | 44 | 280 | 1,82 | 0,13 | 1669 | 15 | 900 3 900 3 900 4 900 3 900 | 49 | |||||||||||||||||||
| 16 | 32,065 | Сера | S | 113 | 445 | 2,07 | 0,05 | древний | 16 | 3 | 3 | 3 [Ne] | ||||||||||||||||||
| 17 | 35,453 | Хлор | Cl | -101 | -35 | 3,21 | 0,05 | 1774 | 17 | 90sp4 3 Neo 12.97|||||||||||||||||||||
| 18 | 39,948 | Аргон | Ar | -189 | -186 | 1,78 | 1894 | 18 | 4 43 2 Ne44 900 3s||||||||||||||||||||||
| 19 | 39.098 | Калий | K | 64 | 774 | 0,86 | 2,58 | 1807 | 1 | [Ar] 4s34 | ||||||||||||||||||||
| 20 | 40,078 | Кальций | Ca | 839 | 1,484 | 1,55 | 3,65 | 1808 | 2 | 9014 | 900 21 | 44,956 | Скандий | Sc | 1,539 | 2,832 | 2,99 | 1879 | 3 | [Ar] 3d 1 4s 9014 2 6.56 | ||||||||||
| 22 | 47,867 | Титан | Ti | 1,660 | 3,287 | 4,54 | 0,62 | 1791 | 4 | 1791 | 4 | 4 62 9014 4 | ||||||||||||||||||
| 23 | 50,942 | Ванадий | V | 1,890 | 3,380 | 6,11 | 1830 | 5 | [Ar] 4s. 375 | |||||||||||||||||||||
| 24 | 51,996 | Хром | Cr | 1,857 | 2,672 | 7,19 | 0,04 | 1797 5 | 6 | |||||||||||||||||||||
| 25 | 54,938 | Марганец | Mn | 1,245 | 1,962 | 7,43 | 0,09 | 1774 2 | 7 | 7 | 43 | |||||||||||||||||||
| 26 | 55,845 | Железо | Fe | 1,535 | 2,750 | 7,87 | 5,05 | древний | 8 | 8 | 900 4 2 900 4 900 4 900 4 900 4 900 4 9 4 900 4 9 0145 | |||||||||||||||||||
| 27 | 58,933 | Кобальт | Co | 1,495 | 2,870 | 8,90 | 1735 | 9 2 | [Ar] 4s 8 | |||||||||||||||||||||
| 28 | 58,693 | Никель | Ni | 1,453 | 2,732 | 8,90 | 0,02 | 1751 | 10 | 7 900 4 900 4 900 4 900 4 2 9 4 2 9 4 900 4 3 9 4 3 9 4 900 4 3 9 4 3 9 4 3 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 014 4 9 014 4 9 0144|||||||||||||||||||||
| 29 | 63,546 | Медь | Cu | 1,083 | 2,567 | 8,96 | древний | 11 | [Ar] 4s.73 | |||||||||||||||||||||
| 30 | 65,390 | Цинк | Zn | 420 | 907 | 7,13 | древний | 12 | [Ar] 4s43 9 2 4 [Ar] | |||||||||||||||||||||
| 31 | 69,723 | Галлий | Ga | 30 | 2,403 | 5,91 | 1875 | 13 | [Ar] 3d 2 4sp.00 | |||||||||||||||||||||
| 32 | 72.640 | Германий | Ge | 937 | 2,830 | 5,32 | 1886 | 14 2 | 9014 9 3dp 4s7,90 | |||||||||||||||||||||
| 33 | 74,922 | Мышьяк | As | 81 | 613 | 5,72 | древний | 15 | древний | 15 | 3 10 900 44 900 4 900 4 900 44 900 4 900 4 900 4 900 4 900 44 900 4 900 44 900 4 900 44 | 9.79 | ||||||||||||||||||
| 34 | 78.960 | Селен | Se | 217 | 685 | 4,79 | 1817 | 16 2 | 9014 4 3dp 4s 9004 90049,75 | |||||||||||||||||||||
| 35 | 79,904 | Бром | Br | -7 | 59 | 3,12 | 1826 | 17 | 9004 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 9 0144 | 11.81 | ||||||||||||||||||||
| 36 | 83.800 | Криптон | Kr | -157 | -153 | 3,75 | 1898 | 18 | 900p3 10 44 900 4 44 900 4 44 900 [Ar] | 14,00 | ||||||||||||||||||||
| 37 | 85,468 | Рубидий | Rb | 39 | 688 | 1,63 | 1861 | 1 | 18||||||||||||||||||||||
| 38 | 87,620 | Стронций | Sr | 769 | 1,384 | 2,54 | 1790 | 2 | ||||||||||||||||||||||
| 88.906 | Иттрий | Y | 1523 | 3,337 | 4,47 | 1794 | 3 | [Kr] 4d 1 5s 4 2 | 90.22||||||||||||||||||||||
| 40 | 91,224 | Цирконий | Zr | 1,852 | 4,377 | 6,51 | 0,03 | 1789 | 900 4 | 900 4 | 900 4 | 900 4 9014 4 | ||||||||||||||||||
| 41 | 92,906 | Ниобий | Nb | 2,468 | 4,927 | 8,57 | 1801 | 5 | 3 | 3 | 900 4 900 4 900 4 900 4 900 4 76 | |||||||||||||||||||
| 42 | 95,940 | Молибден | Mo | 2,617 | 4,612 | 10,22 | 1781 | 6 | 9014 900 1 Kr 5]||||||||||||||||||||||
| 43 | * | 98,000 | Технеций | Tc | 2,200 | 4,877 | 11,50 | 1937 | 7 | [Kr] 4d14 528 | ||||||||||||||||||||
| 44 | 101,070 | Рутений | Ru | 2,250 | 3,900 | 12,37 | 1844 | 8 | 3 | 900 4 900 4 | 3 [Kr] | |||||||||||||||||||
| 45 | 102,906 | Родий | Rh | 1,966 | 3,727 | 12,41 | 1803 | 9 | 7d14 | |||||||||||||||||||||
| 46 | 106,420 | Палладий | Pd | 1,552 | 2,927 | 12,02 | 1803 | 10 | 9014 9014 9014 9014 9014 8,34 900 4d | 107,868 | Серебро | Ag | 962 | 2,212 | 10,50 | древний | 11 | [Kr] 4d 10 5s 1 | 7.58 | |||||||||||
| 48 | 112.411 | Кадмий | Cd | 321 | 765 | 8,65 | 1817 | 12 | 3 | 900 4 900 4 9 4d | ||||||||||||||||||||
| 49 | 114.818 | Индий | In | 157 | 2,000 | 7,31 | 1863 | 13 | [Kr] 4d 10 4 5sp | |||||||||||||||||||||
| 50 | 118.710 | Олово | Sn | 232 | 2,270 | 7,31 | древний | 14 | [Kr] 5sp 900 2 [Kr] 4d 10| 7,34 | | ||||||||||||||||||||
| 51 | 121,760 | Сурьма | SB | 630 | 1,750 | 6,68 | древний | 15 | 4 900 4 900 4 900 Kr 2 433 900 4 900 Kr 2 433 900 4 900 Kr 2 433 900 4 900 Kr 2 433 900 4 9008.61 | |||||||||||||||||||||
| 52 | 127,600 | Теллур | Te | 449 | 990 | 6,24 | 1783 | 16 10 | 5ds 5ds 5ds | 9,01 | ||||||||||||||||||||
| 53 | 126,905 | Йод | I | 114 | 184 | 4,93 | 1811 | 17 | 900 44 900 4 900 44 900 4 900 4 900d 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900d | 10.45 | ||||||||||||||||||||
| 54 | 131,293 | Ксенон | Xe | -112 | -108 | 5,90 | 1898 | 18 | 9004 900 44 900 4 900 4 900 4 900 4 | 12,13 | ||||||||||||||||||||
| 55 | 132,906 | Цезий | Cs | 29 | 678 | 1,87 | 1860 | 1 | 89||||||||||||||||||||||
| 56 | 137,327 | Барий | Ba | 725 | 1,140 | 3,59 | 0,05 | 1808 | 2 | 900,21 | 900,21 57 | 138.906 | Лантан | La | 920 | 3469 | 6,15 | 1839 | 3 | [Xe] 5d 1 614 2 458 | ||||||||||
| 58 | 140.116 | Церий | Ce | 795 | 3,257 | 6,77 | 1803 | 101 | 43 1 900 44 900 4 900 44 900 4 900 4 900 4 900 4 900 4 9445,54 | |||||||||||||||||||||
| 59 | 140,908 | Празеодим | Pr | 935 | 3,127 | 6,77 | 1885 | 101 9014e | 9004 900 4 900 4 900 4 4 4 4 9 4 9 4 4 4 4 4 4 4 9 4 4 4 4 4 7 7 7 8 9 4 4 время47||||||||||||||||||||||
| 60 | 144.240 | Неодим | Nd | 1010 | 3,127 | 7,01 | 1885 | 101 | 9004 900 4 900 4 900 4 9144 900 4 900 4 900 4 900 4 9145 | 900 4 900 4 900 4 9145 | ||||||||||||||||||||
| 61 | * | 145,000 | Прометий | Pm | 1,100 | 3,000 | 7,30 | 1945 | 101 | [Xe14 4f14 9005 943 5144 9005 4f148 | ||||||||||||||||||||
| 62 | 150.360 | Самарий | Sm | 1,072 | 1,900 | 7,52 | 1879 | 101 | 9004 900 5,64 900 4 900 4 9 4 8 9 4 9 4 9 4 4 4 9 4 9 4 9 4 8 9 4 8 9 4 8 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 6 7 8 9 9 8 9 9 9 8 9 9 9 9 8 9 9 9 9 9 9 9 9 9 9 по котной | |||||||||||||||||||||
| 63 | 151,964 | Европий | Eu | 822 | 1,597 | 5,24 | 1901 | 101 | [Xe] 4f14 | 6s67 | | ||||||||||||||||||||
| 64 | 157,250 | Гадолиний | Gd | 1,311 | 3,233 | 7,90 | 1880 | 101 | 9004 9004 7 | 10145 | 900 4 900 4 900 4 900 4 900 4 4 4 8 9 4 9 4 8 9 4 9 4 9 4 8 9 4 8 9 4 9 4 8 8 9 8 9 8 9 8 9 8 9 8 9 9 8 9 8 9 8 9 9 8 9 8 9 8 8 9 8 8 9 9 8 9 8 9 8 9 8 9 8 9 8 | 6,15 | ||||||||||||||||||
| 65 | 158,925 | Тербий | Tb | 1,360 | 3,041 | 8,23 | 1843 | 101 | 900 4 900 4 944 9 4 4 9 4 9 4 4 9 4 9 4 4 9 4 4 9 4 4 4 9 4 4 4 9 4 4 4 случае86 | |||||||||||||||||||||
| 66 | 162,500 | Диспрозий | Dy | 1,412 | 2,562 | 8,55 | 1886 | 101 | 900 4 900 144 | 900 4 900 4 900 144 900 4 900 144 900 4 900 144 900 4 900 4 900 4 900 4 900 14 4 900 4 944 | ||||||||||||||||||||
| 67 | 164,930 | Гольмий | Ho | 1,470 | 2,720 | 8,80 | 1867 | 101 | [Xe] 4f14 43 11 6s02 | |||||||||||||||||||||
| 68 | 167,259 | Эрбий | Er | 1,522 | 2,510 | 9,07 | 1842 | 101 | 900 144 900 4 900 4 900 4 900 4 900 4 9014 4 900 14 4 900 4 914 | |||||||||||||||||||||
| 69 | 168,934 | Тулий | Tm | 1,545 | 1,727 | 9,32 | 1879 | 101 | [Xe] 4f14 13 2 | [Xe] 4f14 13 2 18 | ||||||||||||||||||||
| 70 | 173.040 | Иттербий | Yb | 824 | 1,466 | 6.90 | 1878 | 101 | 4 900 144 900 144 900 144 900 144 900 144 900 143 9144 900 143 9144 900 144 900 144 900 143 9144 | |||||||||||||||||||||
| 71 | 174,967 | Лютеций | Lu | 1,656 | 3,315 | 9,84 | 1907 | 101 | [Xe14 5fd14 149004 1 1 1 944 900 43 14 45 43 14 43 14 | |||||||||||||||||||||
| 72 | 178,490 | Гафний | Hf | 2,150 | 5,400 | 13,31 | 1923 | 4 | 1923 | 4 | 9004 900 4 900 4 900 4 900 4 900 4 943 900 44 900 4 900 4 943 900 44 900 4 900 4 900 4 900 4 900 4 943 9446,83 | |||||||||||||||||||
| 73 | 180,948 | Тантал | Ta | 2,996 | 5,425 | 16,65 | 1802 | 5 | 900 445 9004 900 4 X 145 900 4 900 4 900 4 900 4 900 4 4 4 4 9 4 8 9 4 8 9 4 9 4 9 4 4 4 4 4 8 9 4 9 4 4 4 4 4 4 4 4 5 9 7 8 9 9 8 9 9 9 8 9 9 9 9 8 9 9 8 9 9 9 97.55 | |||||||||||||||||||||
| 74 | 183,840 | Вольфрам | W | 3,410 | 5,660 | 19,35 | 1783 | 6 | 6 | 900 4 900 4 900 4 900 4 900 4 900 4x | 7,86 | |||||||||||||||||||
| 75 | 186.207 | Рений | Re | 3,180 | 5,627 | 21,04 | 1925 | 7 | 5144 5 0145 900 4 900 4 900 44 4 9145 5 900 44 4 91457.83 | |||||||||||||||||||||
| 76 | 190,230 | Осмий | Os | 3,045 | 5,027 | 22.60 | 1803 | 8 | 9004 | 8,44 | ||||||||||||||||||||
| 77 | 192,217 | Иридий | Ir | 2,410 | 4,527 | 22,40 | 1803 | 9 | 9004 900 4 900 4 4 4 4 9 4 4 4 900 4 4 4 9 4 4 4 9 4 4 9 4 4 4 9 4 4 9 4 4 4 9 4 4 4 4 4 4 случае8.97 | |||||||||||||||||||||
| 78 | 195,078 | Платина | Pt | 1,772 | 3,827 | 21,45 | 1735 | 10 | 900 44 900 4 900 4 900 4 900 4 900 4 900 4 9 4 9 4 9 4 9 4 4 4 9 4 4 9 4 4 4 9 4 4 9 4 9 4 4 8 9 9 9 8 | 8.96 | ||||||||||||||||||||
| 79 | 196.967 | Золото | Au | 1064 | 2,807 | 19.32 | древний | 11 | 9.23 | |||||||||||||||||||||
| 80 | 200,590 | Меркурий | Hg | -39 | 357 | 13,55 | древний | 12 | 4 9004 943 1044 5f014510,44 | |||||||||||||||||||||
| 81 | 204,383 | Таллий | Tl | 303 | 1,457 | 11,85 | 1861 | 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 943 6п 1 | 6.11 | |||||||||||||||||||||
| 82 | 207.200 | Свинец | Pb | 327 | 1,740 | 11,35 | древний | 14 | 9004 943 143 1044 9004 900 4f 2 | 7,42 | ||||||||||||||||||||
| 83 | 208,980 | Висмут | Bi | 271 | 1,560 | 9,75 | древний | 9004 900 4 900 X 144 | 900 4 900 X 144 | 900 6s 2 6p 3 | 7.29 | |||||||||||||||||||
| 84 | * | 209,000 | Полоний | Po | 254 | 962 | 9,30 | 1898 | 16 | 9004 9004 900 4 900 4 900 4 900 4 4 9 4 8 9 8 9 8 9 8 9 8 9 8 9 8 9 8 9 9 8 9 8 9 9 9 30 9 30 6p 4 | 8,42 | |||||||||||||||||||
| 85 | * | 210,000 | Астатин | При | 302 | 337 | 0,00 | |||||||||||||||||||||||
| 900 144 | 1940 [ | ] 5d 10 6s 2 6p 5 | 9.30 | |||||||||||||||||||||||||||
| 86 | * | 222,000 | Радон | Rn | -71 | -62 | 9,73 | 1900 | 18 | 900 4f4 900 X4 900 X 943 X 943 900 4 900 X 943 X 944 2 6p 610,75 | ||||||||||||||||||||
| 87 | * | 223,000 | Франций | Fr | 27 | 677 | 0,00 | 1939 9014 9014 | 9014 9014 9014 9014 900 14.07 | |||||||||||||||||||||
| 88 | * | 226,000 | Радий | Ra | 700 | 1,737 | 5,50 | 1898 | 2 | 89 | * | 227,000 | Актиний | Ac | 1050 | 3,200 | 10.07 | 1899 | 3 | [Rn] 6d 431 7s.17 | ||||||||||
| 90 | 232.038 | Торий | Th | 1,750 | 4,790 | 11,72 | 1829 | 102 | 9014 900 6,32 900 2 Rn 2 | 900 2 Rn 2 | ||||||||||||||||||||
| 91 | 231.036 | Протактиний | Па | 1,568 | 0 | 15.40 | 1913 | 102 | [Rn14] 5 7d14 2 2 [Rn14] 5 7d14 2 89 | |||||||||||||||||||||
| 92 | 238,029 | Уран | U | 1,132 | 3,818 | 18,95 | 1789 | 102 | 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 900 4 9 4 4 9 4 9 4 9 4 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 9 4 8 9 8 9 8 9 9 9 8 9 9 9 8 9 9 9 8 9 8 9 9 9 9 8 9 9 9 9 8 9 8 9 9 | 6,19 | ||||||||||||||||||||
| 93 | * | 237,000 | Нептуний | Np | 640 | 3,902 | 20,20 | 1940 | 102 | 900 1 R 900 445 26.27 | ||||||||||||||||||||
| 94 | * | 244,000 | Плутоний | Pu | 640 | 3,235 | 19,84 | 1940 | 102 | 900 6144 900 4 900 6 7 8 8 8 9 4 9 4 8 8 9 8 8 8 8 8 9 8 9 4 9 4 9 4 9 4 8 8 8 8 8 8 8 8 8 8 8 8 8 8 8 9 8 8 9 0145|||||||||||||||||||||
| 95 | * | 243,000 | Америций | Am | 994 | 2,607 | 13,67 | 1944 | 102 | 900 2 Rn 2 | 900 2 Rn 4 900 4 900 7 8144 | |||||||||||||||||||
| 96 | * | 247,000 | Кюрий | Cm | 1,340 | 0 | 13,50 | 1944 | 102 | 9014 9014 9014 9014 9014 9014 9014 9014Berkelium | Bk | 986 | 0 | 14,78 | 1949 | 102 | 6,20 | |||||||||||||
| 98 | * | 251.000 | Калифорний | Cf | 900 | 0 | 15,10 | 1950 | 102 | 6,28 | ||||||||||||||||||||
| 99 | * | 9014 9014 9014 9014 9014 9014 9014 9014 Es0,00 | 1952 | 102 | 6,42 | |||||||||||||||||||||||||
| 100 | * | 257,000 | Фермий | Fm | 1,527 | 0144 0144 1,527 | 014400 | 1952 | 102 | 6,50 | ||||||||||||||||||||
| 101 | * | 258,000 | Менделевий | Md | 0 | 0,00 | ||||||||||||||||||||||||
| 102 | * | 259,000 | Nobelium | № | 827 | 0 | 0,00 | 1958 | 102 | 6.65 | ||||||||||||||||||||
| 103 | * | 262,000 | Лоуренсий | Lr | 1,627 | 0 | 0,00 | 1961 | 102 | 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 | Резерфордий | Rf | 0 | 0 | 0,00 | 1964 | 4 | 0,00 | ||||||||||||
| 105 | * | 262.000 | Дубний | Db | 0 | 0 | 0,00 | 1967 | 5 | 0,00 | ||||||||||||||||||||
| 106 | * | 9014 | 9014 9014 9014 9014 9014 9014 9014 9014 | 0,00 | 1974 | 6 | 0,00 | |||||||||||||||||||||||
| 107 | * | 264,000 | Bohrium | Bh | 0 | 0 | 0.00 | 1981 | 7 | 0,00 | ||||||||||||||||||||
| 108 | * | 277,000 | Калий | Hs | 0 | 0 | 1984||||||||||||||||||||||||
| 109 | * | 268,000 | Meitnerium | Mt | 0 | 0 | 0,00 | 1982 | 9 | 0.00 | ||||||||||||||||||||
| № | | Атомный вес | Имя | Sym. | М.П. (° С) | Б.П. (° С) | Плотность * (г / см 3 ) | Земная кора (%) * | Discovery (Год) | Группа * | Электронная конфигурация | Ионизация Энергия (эВ) |
Примечания:
• Плотность элементов с температурой кипения ниже 0 ° C дана в г / л.В отсортированном списке эти элементы отображаются перед другими элементами с температурой кипения> 0 ° C.
• Средние значения состава земной коры взяты из отчета Ф. В. Кларка и Х. С. Вашингтона, 1924 г. Элементный состав горных пород земной коры различается в зависимости от местонахождения (см. Статью).
• Группа : В периодической таблице всего 18 групп, которые составляют ее столбцы. Лантаноиды и актиноиды пронумерованы как 101 и 102, чтобы разделить их при сортировке по группам.
• Элементы, отмеченные звездочкой (во 2-м столбце), не содержат стабильных нуклидов. Для этих элементов указанное значение веса представляет собой массовое число наиболее долгоживущего изотопа элемента.
Сокращения и определения:
№ – атомный номер; М.П. – температура плавления; Б.П. – точка кипения
Атомный номер: Число протонов в атоме. Каждый элемент однозначно определяется своим атомным номером.
Атомная масса: Масса атома в первую очередь определяется количеством протонов и нейтронов в его ядре.Атомная масса измеряется в единицах атомной массы (а.е.м.), которые масштабируются относительно углерода, 12 C, что считается стандартным элементом с атомной массой 12. Этот изотоп углерода имеет 6 протонов и 6 нейтронов. Таким образом, каждый протон и нейтрон имеют массу около 1 а.е.м.
Изотоп: Атомы одного и того же элемента с одинаковым атомным номером, но разным числом нейтронов. Изотоп элемента определяется суммой количества протонов и нейтронов в его ядре.Элементы имеют более одного изотопа с различным количеством нейтронов. Например, есть два общих изотопа углерода, 12 C и 13 C, которые имеют 6 и 7 нейтронов соответственно. Содержание различных изотопов элементов различается по своей природе в зависимости от источника материалов. Относительное содержание изотопов в природе см. В разделе «Атомный вес и изотопный состав».
Атомный вес: Значения атомного веса представляют средневзвешенных масс всех встречающихся в природе изотопов элемента.Показанные здесь значения основаны на определениях Комиссии ИЮПАК (Pure Appl. Chem. 73: 667-683, 2001). Элементы, отмеченные звездочкой, не содержат стабильных нуклидов. Для этих элементов указанное значение веса представляет собой массовое число наиболее долгоживущего изотопа элемента.
Электронная конфигурация: См. Следующую страницу для объяснения электронной конфигурации атомов.
Энергия ионизации (IE): Энергия, необходимая для удаления самого удаленного электрона от атома или положительного иона на его основном уровне.В таблице перечислены только первые IE в единицах эВ. Чтобы преобразовать в кДж / моль, умножьте на 96,4869. Ссылка: Справочная таблица NIST по основным состояниям и энергиям ионизации нейтральных атомов. IE уменьшается при движении вниз по столбцу периодической таблицы и увеличивается слева направо подряд. Таким образом, щелочные металлы имеют самый низкий IE за период, а редкие газы – самый высокий.
Другие ресурсы, связанные с Периодической таблицей
Цитата для страницы
Израильский справочник химии.(2021 г., 8 июня). «Сортируемый список элементов Периодической таблицы». Получено с https://www.science.co.il/elements/
.10 фактов об аргоне – Ar или атомное число 18
Аргон имеет атомный номер 18 в периодической таблице с символом элемента Ar. Вот коллекция полезных и интересных фактов об элементе аргона.
10 фактов об аргоне
- Аргон – бесцветный благородный газ без запаха и запаха. В отличие от некоторых других газов он остается бесцветным даже в жидком и твердом виде.Негорючий и нетоксичный. Однако, поскольку аргон на 38% плотнее воздуха, он представляет опасность удушья, поскольку может вытеснять насыщенный кислородом воздух в закрытых помещениях.
- Символ элемента для аргона раньше был A. В 1957 году Международный союз теоретической и прикладной химии (IUPAC) изменил символ аргона на Ar, а символ менделевия с Mv на Md.
- Аргон был первым обнаруженным благородным газом. Генри Кавендиш подозревал существование этого элемента в 1785 году, изучая образцы воздуха.Независимое исследование, проведенное Х. Ф. Ньюоллом и У. Н. Хартли в 1882 году, выявило спектральную линию, которая не могла быть отнесена к какому-либо известному элементу. Элемент был изолирован и официально обнаружен в воздухе лордом Рэли и Уильямом Рамзи в 1894 году. Рэлей и Рамзи удалили азот, кислород, воду и углекислый газ и исследовали оставшийся газ. Хотя в остатке воздуха присутствовали другие элементы, они составляли очень небольшую часть общей массы образца.
- Название элемента «аргон» происходит от греческого слова argos , что означает неактивный.Это относится к устойчивости элемента к образованию химических связей. Аргон считается химически инертным при комнатной температуре и давлении.
- Большая часть аргона на Земле образуется в результате радиоактивного распада калия-40 на аргон-40. Более 99% аргона на Земле состоит из изотопа Ar-40.
- Самый распространенный изотоп аргона во Вселенной – это аргон-36, который образуется, когда звезды с массой примерно в 11 раз больше, чем Солнце, находятся в фазе горения кремния. На этом этапе альфа-частица (ядро гелия) добавляется к ядру кремния-32, чтобы получить серу-34, которая добавляет альфа-частицу, чтобы стать аргоном-36.Некоторое количество аргона-36 добавляет альфа-частицу, чтобы стать кальцием-40. Во Вселенной аргон встречается довольно редко.
- Аргон – самый распространенный благородный газ. На его долю приходится около 0,94% атмосферы Земли и около 1,6% марсианской атмосферы. Тонкая атмосфера планеты Меркурий примерно на 70% состоит из аргона. Не считая водяного пара, аргон является третьим по распространенности газом в атмосфере Земли после азота и кислорода. Его получают путем фракционной перегонки жидкого воздуха. Во всех случаях наиболее распространенным изотопом аргона на планетах является Ar-40.
- Аргон имеет множество применений. Он содержится в лазере, плазменных шарах, лампочках, ракетном топливе и светящихся трубках. Он используется в качестве защитного газа для сварки, хранения чувствительных химикатов и защиты материалов. Иногда аргон под давлением используется в качестве пропеллента в аэрозольных баллончиках. Радиоизотопное датирование аргоном-39 используется для определения возраста проб грунтовых вод и ледяных кернов. Жидкий аргон используется в криохирургии для разрушения раковых тканей. Лучи аргоновой плазмы и лазерные лучи также используются в медицине.Аргон можно использовать для приготовления дыхательной смеси под названием Argox, чтобы помочь удалить растворенный азот из крови во время декомпрессии, например, при глубоководных погружениях. Жидкий аргон используется в научных экспериментах, включая нейтринные эксперименты и поиск темной материи. Хотя аргон – элемент в большом количестве, его биологические функции неизвестны.
- Аргон при возбуждении излучает сине-фиолетовое свечение. Лазеры на аргоне имеют характерное сине-зеленое свечение.
- Поскольку атомы благородных газов имеют полную валентную электронную оболочку, они не очень реактивны.Аргон плохо образует соединения. Неизвестны стабильные соединения при комнатной температуре и давлении, хотя фторгидрид аргона (HArF) наблюдался при температурах ниже 17 К. Аргон образует клатраты с водой. Были замечены ионы, такие как ArH + , и комплексы в возбужденном состоянии, такие как ArF. Ученые предсказывают, что стабильные соединения аргона должны существовать, хотя они еще не синтезированы.
Атомные данные аргона
| Имя | Аргон |
| Символ | Ar |
| Атомный номер | 18 |
| Атомная масса | 39.948 |
| Точка плавления | 83,81 К (-189,34 ° С, -308,81 ° F) |
| Температура кипения | 87,302 К (-185,848 ° С, -302,526 ° F) |
| Плотность | 1,784 грамма на кубический сантиметр |
| Фаза | газ |
| Группа элементов | благородный газ, группа 18 |
| Период элемента | 3 |
| Окислительное число | 0 |
| Ориентировочная стоимость | 50 центов за 100 грамм |
| Электронная конфигурация | 1 с 2 2 с 2 2п 6 3 с 2 3 пол. 6 |
| Кристаллическая структура | кубическая с гранью (fcc) |
| Фаза на STP | газ |
| Степень окисления | 0 |
| Электроотрицательность | без значения по шкале Полинга |
Бонусная аргонная шутка
Почему я не рассказываю анекдоты по химии? Всем доброго аргона!
Источники
- Эмсли, Джон (2011). Строительные блоки природы: Путеводитель по элементам от А до Я . Издательство Оксфордского университета. ISBN 978-0-19-960563-7.
- Greenwood, Norman N .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- Хаммонд К. Р. (2004). “Элементы.” Справочник по химии и физике (81-е изд.). CRC Press. ISBN 978-0-8493-0485-9.
- Вист, Роберт (1984). CRC Справочник по химии и физике . Бока-Ратон, Флорида: Издательство Chemical Rubber Company. ISBN 0-8493-0464-4.
Информация об элементе аргона: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История аргона
Элемент аргон был открыт лордом Рэли в год. 1894 г. в Соединенном Королевстве . Аргон получил свое название от греческого слова argos, что означает «праздный».
Присутствие аргона: изобилие в природе и вокруг нас
В таблице ниже показано содержание аргона во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура аргона
Твердотельная структура аргона – гранецентрированная кубическая.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| б | с | |
|---|---|---|
| 525.6 | 525,6 | 525,6 вечера |
и углы между ними Решетки Углы (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства аргона
Атомы аргона имеют 18 электронов и структура электронной оболочки [2, 8, 8] с символом атомного члена (квантовые числа) 1 S 0 .
Оболочечная структура аргона – количество электронов на энергию уровень
| n | с | с. | д | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | M | 2 | 6 |
Основное состояние электронной конфигурации аргона – нейтраль Атом аргона
Электронная конфигурация нейтрального атома аргона в основном состоянии [Ne] 3с2 3п6.Часть конфигурации аргона, которая эквивалентна благородному газу предыдущий период сокращенно обозначается как [Ne]. Для атомов с большим количеством электронов это нотация может стать длинной, поэтому используются сокращенные обозначения. валентные электроны 3s2 3p6, электроны в внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального аргона
Полная электронная конфигурация основного состояния для атома аргона, полная электронная конфигурация
1с2 2с2 2п6 3с2 3п6
Атомная структура аргона
Атомный радиус аргона 71 пм, а его ковалентный радиус 97 пм.
Атомный спектр аргона
Химические свойства аргона: Энергии ионизации аргона и сродство к электрону
Электронное сродство аргона составляет 0 кДж / моль.
Энергия ионизации аргона
Энергия ионизации аргона
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 1520.6 |
| 2 | 2665,8 |
| 3 | 3931 |
| 4 | 5771 |
| 5 | 7238 |
| 6 | 8781 |
| 7 | 11995 |
| 8 | 13842 |
| 9 | 40760 |
| 10 | 46186 |
Физические свойства аргона
Физические свойства аргона см. В таблице ниже.
| Плотность | 1.784 г / л |
| Молярный объем | 22,39 23766816 см3 |
Эластичные свойства
Твердость аргона – Испытания для измерения твердости элемента
Электрические свойства аргона
Аргон не является источником электричества. Ссылаться на Таблица ниже электрические свойства аргона
Теплопроводность аргона
Магнитные свойства аргона
Оптические свойства аргона
Акустические свойства аргона
Термические свойства аргона – энтальпии и термодинамика
Термические свойства аргона
см. В таблице ниже.Энтальпии аргона
Изотопы аргона – ядерные свойства аргона
Изотопы родия.Природный аргон имеет 3 стабильный изотоп – 36Ar, 38Ar, 40Ar.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 30Ar | ||||
| 31Ar | ||||
| 32Ar | ||||
| 33Ar | ||||
| 34Ar | ||||
| 35Ar | ||||
| 36Ar | 0.3365% | Стабильный | N / A | |
| 37Ar | ||||
| 38Ar | 0.0632% | Стабильный | N / A | |
| 39Ar | ||||
| 40Ar | 99.6003% | Стабильный | N / A | |
| 41Ar | ||||
| 42Ar | ||||
| 43Ar | ||||
| 44Ar | ||||
| 45Ar | ||||
| 46Ar | ||||
| 47Ar | ||||
| 48Ar | ||||
| 49Ar | ||||
| 50Ar | ||||
| 51Ar | ||||
| 52Ar | ||||
| 53Ar |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
.