24-й элемент Менделеева 4 буквы
Ad
Ответы на сканворды и кроссворды
Хром
24-й элемент Менделеева 4 буквы
НАЙТИ
Похожие вопросы в сканвордах
- 95-й элемент таблицы Менделеева, четвёртый синтезированный трансплутониевый элемент 8 букв
- 96-й элемент таблицы Менделеева, синтезированный трансурановый элемент 5 букв
- Элемент главной подгруппы второй группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 4. Обозначается символом Be. Высокотоксичный элемент. Простое вещество бериллий 8 букв
Похожие ответы в сканвордах
- Хром – Желтой краски 4 буквы
- Хром – Химический элемент твердый светло-серый блестящий металл 4 буквы
- Хром – Сорт мягкой тонкой кожи 4 буквы
-
- Хром – Металл 4 буквы
- Хром – Краска 4 буквы
- Хром – Какой химический элемент (атомный номер 24) обозначается символом Cr 4 буквы
- Хром – Кожа 4 буквы
- Хром – Краска; кожа; химический элемент 4 буквы
- Хром – Металл, название которого можно рассмотреть как краткое прилагательное, описывающее человека с дефектом ноги 4 буквы
-
- Хром – Разновидность желтой краски 4 буквы
- Хром – Химический элемент, твердый светло-серый блестящий металл 4 буквы
- Хром – Химический элемент с атомной массой 52 4 буквы
- Хром – Химический элемент, твердый металл серо-стального цвета 4 буквы
-
Хром – Химический элемент, твердый серебристый металл, употребляемый при изготовлении твердых сплавов, красок и т.

- Хром – Элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr. Простое вещество хром 4 буквы
- Хром – И название металла, и краткое прилагательное, приложимое как к людям, так и к животным 4 буквы
- Хром – Между ванадием и марганцем в таблице 4 буквы
- Хром – 24-й в таблице химическ. элементов 4 буквы
- Хром – 24-й в ряду химических элементов 4 буквы
- Хром – 24-й химический элемент 4 буквы
- Хром – 24-й “подопечный” Менделеева 4 буквы
- Хром – 24-й элемент Менделеева 4 буквы
- Хром – Металл с блеском 4 буквы
- Хром – Компонент нержавейки 4 буквы
-
- Хром – Кожа для сапог 4 буквы
- Хром – И металл, и кожа 4 буквы
- Хром – Род жёлтой краски 4 буквы
- Хром – Мягкая тонкая кожа 4 буквы
- Хром – Что делает рубин красным? 4 буквы
-
Хром – Менделеев его назначил 24-м по счету.

- Хром – Химическ. элемент для сапог офицеров 4 буквы
- Хром – Менделеев назначил его 24-м 4 буквы
- Хром – До марганца в таблице 4 буквы
- Хром – Химический элемент, металл 4 буквы
- Хром – Твёрдый светло-серый блестящий металл 4 буквы
- Хром – Менделеев его назначил 24-м в таблице 4 буквы
- Хром – Металл который содержит нержавейка 4 буквы
- Хром – Серебристо белый металл с высокой твердостью и температурой плавления 4 буквы
“Крестины” 114-го и 116-го элементов таблицы Менделеева состоятся в Москве 24 октября
Торжественная церемония присвоения наименований 114-му и 116-му элементам таблицы Менделеева состоится в Москве 24 октября, сообщил РИА Новости Сергей Дмитриев, директор Лаборатории ядерных реакций имени Флерова, где они были получены.
Элементы с атомными номерами 114 и 116 были впервые синтезированы на циклотроне Лаборатории ядерных реакций имени Флерова в Объединенном институте ядерных исследований (ОИЯИ) в подмосковной Дубне.
Эти эксперименты проводила группа ученых ЛЯР ОИЯИ под руководством академика Юрия Оганесяна при участии американских коллег из Ливерморской национальной лаборатории.
Элемент под номером 114 был получен в 2000 году путем бомбардировки на ускорителе мишени из плутония-242 ядрами кальция-48, а 116-й элемент – в 2004 году в реакции кальция-48 и кюрия-245.
В мае 2012 года Международный союз теоретической и прикладной химии (ИЮПАК) принял предложения, внесенные первооткрывателями в декабре 2011 года и присвоил 114-му элементу наименование “флеровий”, а 116-му – “ливерморий”, закрепил за новыми элементами химическим обозначения Fl и Lv.
В среду, 24 октября, в Москве в Центральном Доме ученых РАН состоится официальная церемония “имянаречения”.
Георгий Флеров – советский физик-ядерщик, специалист в области деления ядер, синтеза новых химических элементов, новых видов радиоактивности. Участник создания советского ядерного оружия. В 1940 году совместно с Константином Петржаком открыл новый тип радиоактивных превращений – спонтанное деление ядер урана. Благодаря идеям Флерова в ОИЯИ был получен целый ряд химических элементов.
Ливерморий (Livermorium, Lv) предложено назвать в честь Ливерморской национальной лаборатории им. Лоуренса и места ее расположения, города Ливермор в штате Калифорния. Его ученые уже более 20 лет участвуют в экспериментах по синтезу новых элементов, проводимых в Дубне.
Новая совместная рабочая группа, учрежденная бюро ИЮПАК, начала работу по установлению приоритета в получении других пока безымянных сверхтяжелых элементов – 113-го, 115-го, 117-го и 118-го.
Официально признанные первооткрыватели получат право предлагать для них названия.
В июне нынешнего года ученые из Дубны подали заявку в ИЮПАК на признание 113, 115, 117 и 118 элементов – все они были впервые синтезированы в ОИЯИ.
Новые химические элементы таблицы менделеева.
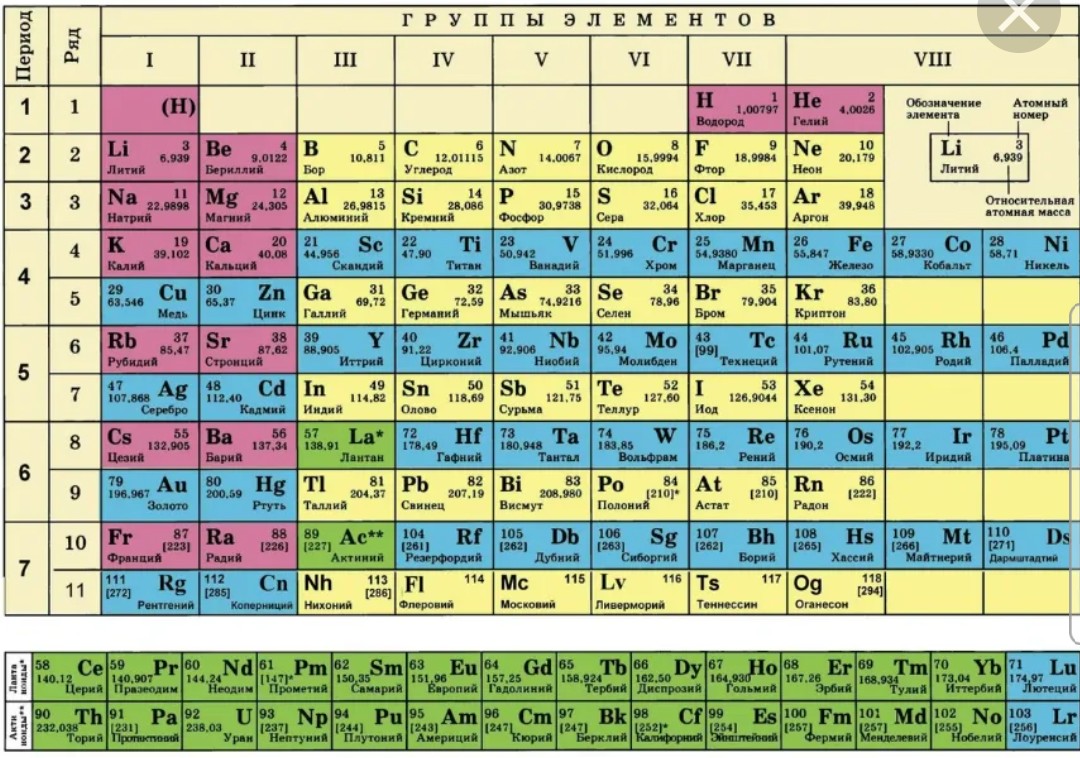
Одной из самых популярных таблиц в мире является таблица Менделеева. В каждой ячейке вписаны названия химических элементов. Для ее разработки было приложено много усилий. Ведь это не просто список веществ. Они упорядочены согласно своим свойствам и особенностям. А сколько элементов в таблице Менделеева мы сейчас и узнаем.
История создания таблицыМенделеев не был первым ученым, который решил структурировать элементы. Пытались многие. Вот только никто не мог сопоставить все в одной слаженной таблице. Датой открытия периодического закона мы можем назвать 17 февраля 1869 года. В этот день Менделеев показал свое творение – целую систему элементов, упорядоченных на основе атомного веса и химических особенностях.
Стоит отметить, что гениальная мысль не пришла ученому в один удачный вечер во время работы. Он действительно трудился около 20 лет. Снова и снова перебирал карточки с элементами, изучал их характеристики. В это же время трудились и другие ученые.
В это же время трудились и другие ученые.
Химик Канниццаро предложил от своего имени теорию атомного веса. Он утверждал, что именно эти данные могут построить все вещества в нужном порядке. Дальше ученые Шантуркуа и Ньюлендс, работая в разных точках мира, пришли к умозаключению, что размещая элементы по атомному весу, они начинают дополнительно объединяться и по другим свойствам.
В 1869 году вместе с Менделеевым были представлены другие примеры таблиц. Но сегодня мы даже не помним имена их авторов. Почему так? Все дело в превосходстве ученого над своими конкурентами:
- Таблица имела большее количество открытых элементов, чем у других.
- Если какой-то элемент не подходил по атомному весу, ученый помещал его на основе других свойств. И это было правильным решением.
- В таблице было много пустых мест. Менделеев сделал пропуски осознано, забрав тем самым частичку славы тех, кто в будущем найдет эти элементы. Он даже дал описание некоторых еще неведомых веществ.

Самое главное достижение в том, что эта таблица неразрушима. Она создано так гениально, что любые открытия в будущем будут ее только дополнять.
Сколько элементов в таблице МенделееваКаждый человек хотя бы раз в жизни видел эту таблицу. Но вот назвать точное количество веществ сложно. Правильных ответов может быть два: 118 и 126. Сейчас мы разберемся, почему так.
В природе люди обнаружили 94 элемента. Они ничего с ними не делали. Только изучали их свойства и особенности. Большая часть из них была в первоначальной периодической таблице.
Другие 24 элемента были созданы в лабораториях. Всего получается 118 штук. Еще 8 элементов являются лишь гипотетическими вариантами. Их пытаются изобрести или получить. Так что на сегодняшний день и вариант с 118 элементами, и с 126 элементами можно смело называть.
- Ученый был семнадцатым ребенком в семье. Восемь из них погибли еще в раннем возрасте. Отец рано ушел из жизни. Но мать продолжала бороться за будущее своих детей, так что смогла пристроить их в хорошие учебные заведения.

- Всегда отстаивал свое мнение. Был уважаемым педагогом в университетах Одессы, Симферополя и Санкт-Петербурга.
- Он никогда не изобретал водку. Алкогольный напиток был создан задолго до ученого. Но его докторская была посвящена спирту, отсюда и развилась легенда.
- Периодическая система никогда не снилась Менделееву. Она стала результатом тяжелой работы.
- Он любил делать чемоданы. И довел свое хобби до высокого уровня мастерства.
- За всю свою жизнь Менделеев 3 раза мог получить Нобелевскую премию. Но все закончилось лишь номинациями.
- Многих это удивит, то работы в области химии занимают лишь 10% всех занятий ученого. Также он изучал аэростаты и кораблестроение.
Таблица Менделеева – это удивительная система всех элементов, которые когда-либо были обнаружены людьми. Она делится на ряды и столбцы, чтобы упростить изучение всех элементов.
P.S. Статья — Сколько элементов в таблице Менделеева, опубликована в рубрике — .
По его словам, ученые работали над открытием трех сверхтяжелых элементов 115, 117 и 118 более 15 лет. Первые результаты специалисты получили в 1999 году, однако заявили о своем открытии в 2015 году.
«Всегда предполагалось, что в природе таких тяжелых не должно быть, но в 1969 году появилась новая ядерная теория, которая допустила существование очень тяжелых и весьма стабильных элементов» , — пояснил академик.
Что касается процедуры присвоения наименований элементам периодической таблицы, для этого необходимо несколько этапов. Сначала комиссия экспертов в области физики и химии подтверждает факт открытия и определяет, каким ученым принадлежит его приоритет. Затем информация об открытии публикуется, обсуждается, после чего подтверждается официально.
Определением наименования занимается номенклатурная комиссия Международного союза теоретической и прикладной химии (ИЮПАК), которая запрашивает предлагаемые названия у авторов открытий. Название элемента должно иметь одинаковое произношение на 130 языках мира, а его символ должен быть удобным, добавил Оганесян.
Как ранее сообщало ИА REGNUM , официальные наименования четырех элементов таблицы Менделеева, открытых в период с 2003 по 2009 год, были утверждены ИЮПАК. 113-й химический элемент, открытый специалистами японского института естественных наук «Рикэн», получил название нихоний.
Элементы 115 и 117 получили названия московий (Mc) и теннессин (Ts) в соответствии с предложениям ОИЯИ, а также Национальной лаборатории Ок-Ридж, Университета Вандербильта и Ливерморской национальной лаборатории в США.
Эти элементы дополнили седьмой период таблицы
Источник изображения: Wikimedia Commons
Сегодня стали известны официальные названия четырех новых химических элементов, открытых ранее. Названия присвоил Международный союз теоретической и прикладной химии (ИЮПАК). Речь идет о химических элементах 115, 117, 118 и 113. Их открытие было Международным союзом теоретической и прикладной химии в декабре прошлого года.
115 и 117 элементы таблицы были открыты Российским Объединенным институтом ядерных исследований (ОИЯИ), Ливерморской национальной лабораторией (США) и Окриджской национальной лабораторией (США). Первооткрывателями 118 элемента названы ОИЯИ и Ливерморская национальная лаборатория. 113 элемент открыли специалисты из японского института RIKEN (хотя на его открытие претендовала та же международная исследовательская группа, которая открыла 115 и 117 элементы). Официальное подтверждение открытия названных элементов заняло более 10 лет. Теперь седьмой период таблицы Менделеева заполнен полностью.
Первооткрывателями 118 элемента названы ОИЯИ и Ливерморская национальная лаборатория. 113 элемент открыли специалисты из японского института RIKEN (хотя на его открытие претендовала та же международная исследовательская группа, которая открыла 115 и 117 элементы). Официальное подтверждение открытия названных элементов заняло более 10 лет. Теперь седьмой период таблицы Менделеева заполнен полностью.
Что касается названий , то 113 элемент получил название нихоний (Nihonium, Nh), 115 – московий (Moscovium, Mc), 117 – теннесин (Tennessine, Ts), 118 – оганессоном (Oganesson, Og).
Почему выбраны именно такие наименования? Дело в том, что на японском языке Nihon означает «Страна восходящего солнца». А поскольку элемент 113 был открыт японскими учеными, то он и получил такое название. Это первый химический элемент, который был синтезирован и обнаружен в азиатской стране. Московий и теннесин получили названия в соответствии с географическим положением мест, где эти элементы были впервые синтезированы. Ну а Оганессон назвали в честь Юрия Оганесяна – ученого из России, который ведет активные исследования в сфере синтеза новых элементов. Сразу после открытия три из четырех элементов получили другие названия: японий, флеровий и ливерморий.
Ну а Оганессон назвали в честь Юрия Оганесяна – ученого из России, который ведет активные исследования в сфере синтеза новых элементов. Сразу после открытия три из четырех элементов получили другие названия: японий, флеровий и ливерморий.
«Приятно видеть, что различные места, названия и имена (страна, штат, город и ученый), имеющие отношения к новым элементам, были отражены в этих четырех наименованиях. Хотя выбор может выглядеть несколько эгоистичным в глазах некоторых людей, все наименования полностью соответствуют правилам ЮИПАК», – прокомментировал присвоение названий элементам Ян Редейк (Jan Reedijk), представитель ИЮПАК. Он также добавил, что названия уже одобрены руководством, но в таблицу элементов «новички» с присвоенными названиями попадут в ноябре этого года. Сейчас в таблице до сих пор значатся предварительные наименования элементов.
Уже сейчас многие научные организации со всего мира работают над синтезированием элементов из 8 периода таблицы. Также ученые планируют в скором времени закрепить наименование «коперниций» (112-й элемент, впервые синтезирован 9 февраля 1996 года в Институте тяжёлых ионов) и более тяжелых элементов.
Последний раз таблица химических элементов пополнялась в 2011 году, когда в нее добавили элементы 114 и 116.
В подмосковной Дубне приступили к изучению свойств новых химических элементов: открытые совместно с зарубежными учеными, два из четырех элементов получили названия, которые напрямую говорят о связи с Россией. Сегодня таблица Менделеева уже другая.
Для большинства из нас понять, что именно открыли и как это может быть использовано в жизни, настолько трудно, что мы можем только верить исследователям, представляя, как многое вообще еще неизвестно. Это категории высшей материи!
Так выглядит таблица Менделеева, которую можно купить в магазинах сегодня: в седьмом периоде зияют дыры. Теперь это все придется перепечатывать. 113, 115, 117 и 118 элементы официально открыты и получили названия. Три из них признаны открытиями ученых из Объединенного института ядерных исследований в подмосковной Дубне.
«Московий – в честь земли московской; ливерморий – это наши коллеги из Ливермора, которые работали вместе с нами, приезжали сюда, все эксперименты делаются здесь; то же самое теннессин – из Теннесси наши коллеги; ну а 118 – домашний, наш, родной», – рассказывает научный руководитель Лаборатории ядерных реакций им. Г.Н. Флерова, академик РАН Юрий Оганесян.
Г.Н. Флерова, академик РАН Юрий Оганесян.
118 элемент для Юрия Оганесяна не просто родной. Он назван в его честь – оганесон. Это второй случай в мировой истории, когда элемент периодической таблицы называется в честь ученого при жизни. Такой вариант названия предложили его коллеги из лаборатории ядерных исследований.
Больше 20 лет Юрий Цолакович стоит во главе российско-американской группы ученых, синтезирующих и исследующих сверхтяжелые элементы периодической системы.
«Охота за этими элементами – это такая сегодня совершенно важная часть современной экспериментальной ядерной физики. И тут надо сказать, что наши ученые, в частности, во главе с академиком Оганесяном, они здесь занимают самые передовые позиции», – отмечает президент Российской Академии Наук Владимир Фортов.
На вопросы журналистов «каково это, когда твое имя вписывается в историю на века», ученый отвечал скромно.
«Не ищите каких-то сверхчувств, поставьте себя на мое место. Я благодарен своим коллегам, своим товарищам, с которыми прошел этот долгий путь, и очень рад, конечно, что он кончился вот этим открытием, доказательством этому является не один, а на самом деле семь элементов.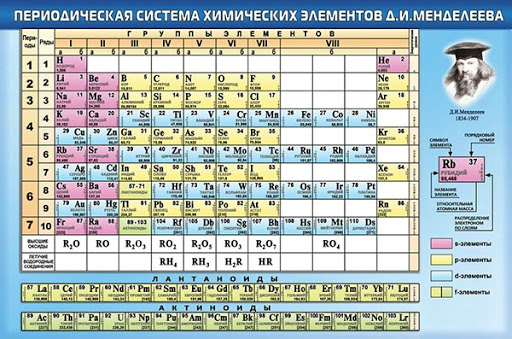 Один из них вот так назван, но это уже не столь важно, как он назван, а важно то, что это есть», – говорит ученый.
Один из них вот так назван, но это уже не столь важно, как он назван, а важно то, что это есть», – говорит ученый.
Сначала считалось, что периодическая таблица вообще должна закончиться на сотом элементе. Каждое новое открытие переворачивало весь научный мир. И именно Лаборатория ядерных исследований Дубнинского института – признанный мировой лидер по заполнению таблицы Менделеева. 105 элемент назван дубнием, а 114 – флеровием в честь основателя лаборатории Георгия Флерова. Теперь – московий и оганесон.
«За эти 60 лет в стенах этой Лаборатории, в стенах нашего института, усилиями многонациональных коллективов Лаборатории было открыто 11 сверхтяжелых элементов, доселе неизвестных миру, неизвестных науке, и это, конечно, я сказал бы, выдающийся результат», – сказал директор Объединенного института ядерных исследований Виктор Матвеев.
О практическом применении последних открытий речи пока не идет. Это дело науки будущего. Хотя ученые говорят: для того, чтобы синтезировать новый элемент, нужно уже совершить много технических открытий и инноваций. Ускорители, которые располагаются в Дубне, не имеют аналогов. На циклотроне У400 и были синтезированы самые тяжелые элементы.
Ускорители, которые располагаются в Дубне, не имеют аналогов. На циклотроне У400 и были синтезированы самые тяжелые элементы.
Частицы кальция-48 проходят по каналу. Для синтеза нового элемента нужно, чтобы они попали точно в мишень. Обычно это уран, плутоний или калифорний. Мишень находится за стеной. Каждую секунду по ней выпускается 10 триллионов частиц, эксперимент идет несколько месяцев и за все это время рождается всего несколько ядер.
Ученые из Дубны уже поставили перед собой следующую задачу: синтез 119, 120 и последующих элементов. Специально для этого здесь строится так называемая «фабрика сверхтяжелых элементов».
Сердцем этой фабрики станет новый ускоритель, превосходящий по мощности все мировые аналоги в 10 раз. Именно в пространстве дубнинского циклотрона частицы будут разгоняться по спирали до скорости, близкой к скорости света.
Если во время предыдущих экспериментов ядра новых элементов образовывались раз в несколько месяцев, то теперь это будет происходить каждый день.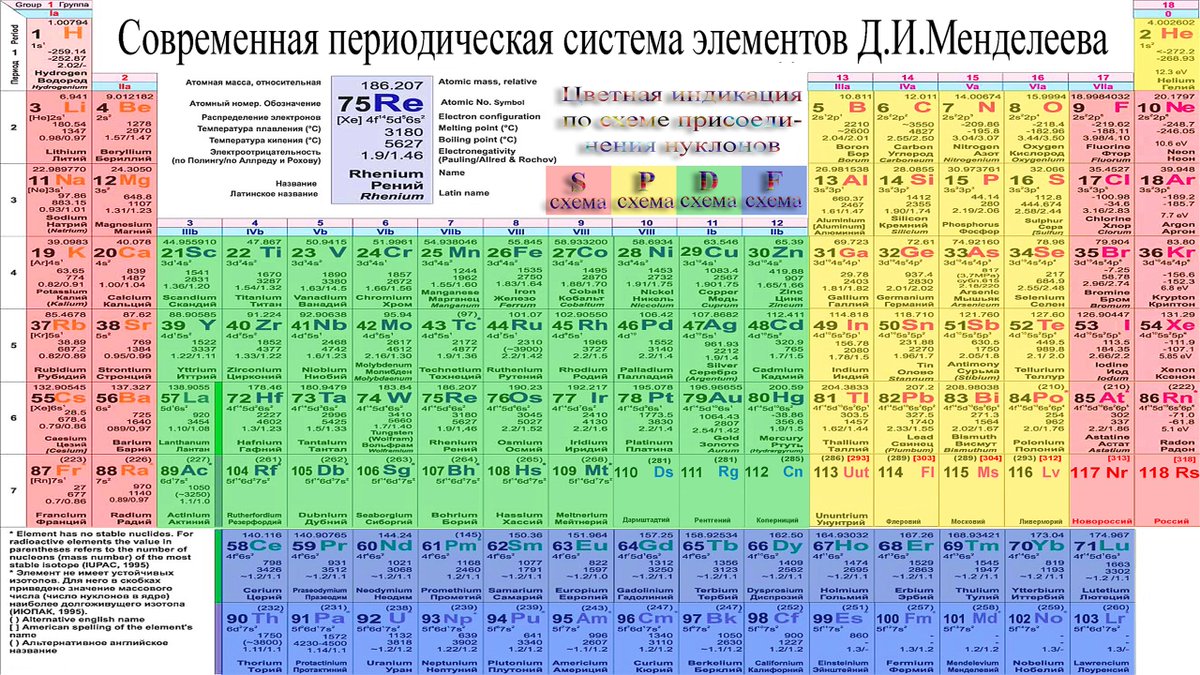 Поставить научные открытия на поток – вот в чем смысл названия «фабрика». Первый запуск этого комплекса сверхтяжелых элементов намечен уже на ноябрь 2017 года.
Поставить научные открытия на поток – вот в чем смысл названия «фабрика». Первый запуск этого комплекса сверхтяжелых элементов намечен уже на ноябрь 2017 года.
Поделитесь статьей с друзьями:
Похожие статьи
ООН провозгласила 2019 год годом таблицы Менделеева
КАКОВА ХИМИЯ—ТАКОВА И ЖИЗНЬ
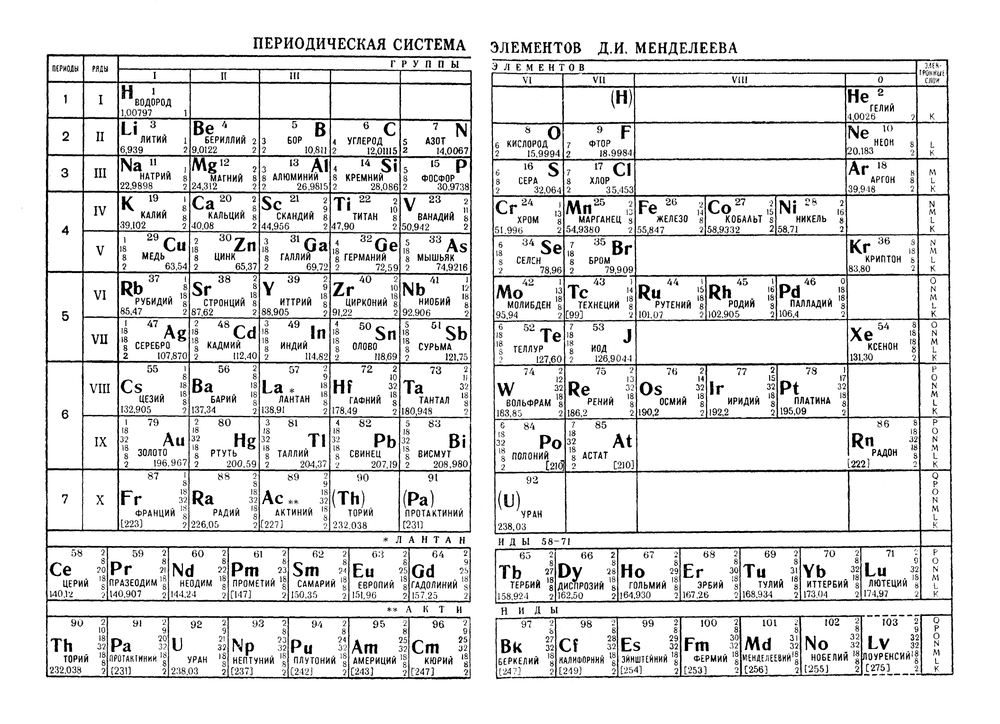
Состоявшийся в сентябре 2016 г. в Екатеринбурге XX Менделеевский съезд обратился к президенту РАН, министерству иностранных дел России, международным организациям с просьбой объявить 2019 г. «Международным годом Периодической таблицы химических элементов». 20 декабря 2017 г. Генеральной Ассамблеей Организации Объединенных Наций 2019 г. объявлен Международным годом Периодической таблицы химических элементов и посвящен 150-летию открытия Д.И. Менделеевым периодического закона.
Как это часто бывает в науке, приоритет открытия оспаривается. На первенство в открытии закона претендовали многие ученые. Это англичанин Ньюлендс, француз Шанкуртуа и другие. Пожалуй, наиболее близок к открытию был немецкий ученый Л. Мейер. После многолетних споров приоритет в установлении периодической системы был признан за Дмитрием Ивановичем Менделеевым. Как было отмечено многими учеными, Менделеев учитывал экспериментальную погрешность в значениях и, во-вторых, указал на то, что периодическая система позволяет установить соответствие между самыми различными свойствами окислов и многих других соединений, кислотно-основными свойствами элементов, их плотностью, температурами кипения и плавления, строением кристаллов, реакционной способностью, объемами грамм-атомов. Более того, Менделеев был настолько убежден в открытом им периодическом законе, что оставил в таблице пустые места для еще не открытых элементов и правильно предсказал их свойства, что в точности подтвердилось впоследствии.
На первенство в открытии закона претендовали многие ученые. Это англичанин Ньюлендс, француз Шанкуртуа и другие. Пожалуй, наиболее близок к открытию был немецкий ученый Л. Мейер. После многолетних споров приоритет в установлении периодической системы был признан за Дмитрием Ивановичем Менделеевым. Как было отмечено многими учеными, Менделеев учитывал экспериментальную погрешность в значениях и, во-вторых, указал на то, что периодическая система позволяет установить соответствие между самыми различными свойствами окислов и многих других соединений, кислотно-основными свойствами элементов, их плотностью, температурами кипения и плавления, строением кристаллов, реакционной способностью, объемами грамм-атомов. Более того, Менделеев был настолько убежден в открытом им периодическом законе, что оставил в таблице пустые места для еще не открытых элементов и правильно предсказал их свойства, что в точности подтвердилось впоследствии.
Д.И. Менделеев много лет тому назад говорил: «Периодическая законность первая дала возможность видеть неоткрытые еще элементы в такой дали, до которой невооруженное этой законностью химическое зрение до тех пор не достигало, и при этом новые элементы ранее их открытия рисовались с целой массой свойств». Эти предсказания блестяще оправдались. И в наши дни открытие новых элементов продолжается. Этому свидетельствуют публикации Ю.Ц. Оганесяна и С.Н. Дмитриева об открытии новых сверхтяжелых элементов с атомными номерами 113 – 118 периодической таблицы Д.И. Менделеева. Открытие новой области стабильности сверхтяжелых элементов поставило целый ряд новых вопросов, и в частности, где границы периодической таблицы Д.И. Менделеева. Например, как поведут себя химические элементы в условиях сверхвысоких давлений. При этом резко меняются их свойства. В ближайшие годы возможно и открытие химических элементов, не вписывающихся в таблицу Менделеева, что, несомненно, заставит расширить границы познания. Недавно, наконец, был решен вопрос, и один из вновь открытых элементов теперь будет носить имя Оганесяна. Так же решен вопрос о присвоении имени одному из новых элементов – московий (в честь Московского региона (г. Дубна), где расположен Объединенный институт ядерных исследований, в котором совместно с Ливерморской национальной лабораторией (США) были проведены эксперименты для обнаружения новых элементов).
Эти предсказания блестяще оправдались. И в наши дни открытие новых элементов продолжается. Этому свидетельствуют публикации Ю.Ц. Оганесяна и С.Н. Дмитриева об открытии новых сверхтяжелых элементов с атомными номерами 113 – 118 периодической таблицы Д.И. Менделеева. Открытие новой области стабильности сверхтяжелых элементов поставило целый ряд новых вопросов, и в частности, где границы периодической таблицы Д.И. Менделеева. Например, как поведут себя химические элементы в условиях сверхвысоких давлений. При этом резко меняются их свойства. В ближайшие годы возможно и открытие химических элементов, не вписывающихся в таблицу Менделеева, что, несомненно, заставит расширить границы познания. Недавно, наконец, был решен вопрос, и один из вновь открытых элементов теперь будет носить имя Оганесяна. Так же решен вопрос о присвоении имени одному из новых элементов – московий (в честь Московского региона (г. Дубна), где расположен Объединенный институт ядерных исследований, в котором совместно с Ливерморской национальной лабораторией (США) были проведены эксперименты для обнаружения новых элементов).
Российское химическое общество им. Д.И. Менделеева в конце апреля 2018 г. обратилось ко всем региональным организациям провести в 2018 и 2019 г.г. научные мероприятия. Несомненно, такие мероприятия пройдут и в крупнейшем химическом регионе, коим является Тульский регион, в котором работают Щекинское п/о «Азот», Ефремовский завод СК, Алексинский химзавод, Тульский госуниверситет, Тульский педагогический университет и многие другие. И обязательно участие в научных мероприятиях примет крупнейший химград России – г. Новомосковск, где работают АО «НАК «АЗОТ», ООО «Полипласт», ООО «Проктер энд Гембл», ООО «КНАУФ ГИПС», ООО «Аэрозоль», филиал РХТУ им. Д.И. Менделеева, ООО «НИАП-КАТАЛИЗАТОР» и др.
Информация о праздновании 150-летия открытия Периодического закона незамедлительно нами была выслана всем, и не только химическим предприятиям города, вузам, школам, колледжам, в комитеты по образованию и культуре, в фонд Андрея Мельниченко («ЕвроХим»), депутатам городского собрания, руководству города. С просьбой дать информацию о юбилее закона обратились в городские газеты и телевидение.
С просьбой дать информацию о юбилее закона обратились в городские газеты и телевидение.
К сожалению, газеты находятся на хозрасчете и не больно рвутся бесплатно печатать любые материалы. А у общественных организаций нет финансовых возможностей оплачивать публикации. Ну, это отдельная страница, на мой взгляд, государственной недальновидности по отношению к районным и городским газетам. С просьбой о помощи в проведении мероприятий обратились в Российскую инженерную академию (РИА), Международную академию наук экологии, безопасности человека и природы (МАНЭБ), Российский Союз научных и инженерных общественных объединений (РосСНИО).
Без раскачки и проблем, как обычно, отозвалась городская газета «Деловой посредник», имеющая большой тираж (главный редактор Альберт Абдуллаев), напечатавшая интервью со мною, где были сообщены уже поступившие за короткое время первые планы по проведению научных мероприятий. Надеюсь в ближайшее время подключится и газета Новомосковская неделя ( главный редактор Михаил Ракитин)
Планируются сообщения на постоянно действующем городском семинаре «Катализ. Катализаторы. Охрана окружающей среды» (осень 2018 г. или весна 2019 г.), на ежегодной экологической конференции школьников города на базе школы № 25 (апрель 2019 г.).
Катализаторы. Охрана окружающей среды» (осень 2018 г. или весна 2019 г.), на ежегодной экологической конференции школьников города на базе школы № 25 (апрель 2019 г.).
В феврале 2019 г. проведет мероприятия научной и научно-исследовательской направленности, посвященные юбилею открытия закона, и наш лицей.
С 2017 г. активно работает в Новомосковске с одаренными школьниками, интересующимися химией, Центр детского научного и инженерно-технического творчества «Квант» (руководитель Т.Ф. Кононова). Аналогичные центры созданы благотворительным фондом Андрея Мельниченко («ЕвроХим») в Барнауле, Кемерово, Рубцовске, Ленинске-Кузнецком. В Невинномысске благодаря фонду и руководству этого города занятия химиков, физиков, математиков и др. уже проводятся в реконструированном отдельном здании. В Новомосковске занятия проводятся на базе школы № 4. Специальное же большое здание после реконструкции планируется передать «Кванту» в сентябре 2019 г. Хорошо бы сроки ввода здания для талантливых школьников убыстрить!
А мероприятия, связанные с юбилеем Периодического закона намечены Центром «Квант» в Новомосковске в конце 2018 г.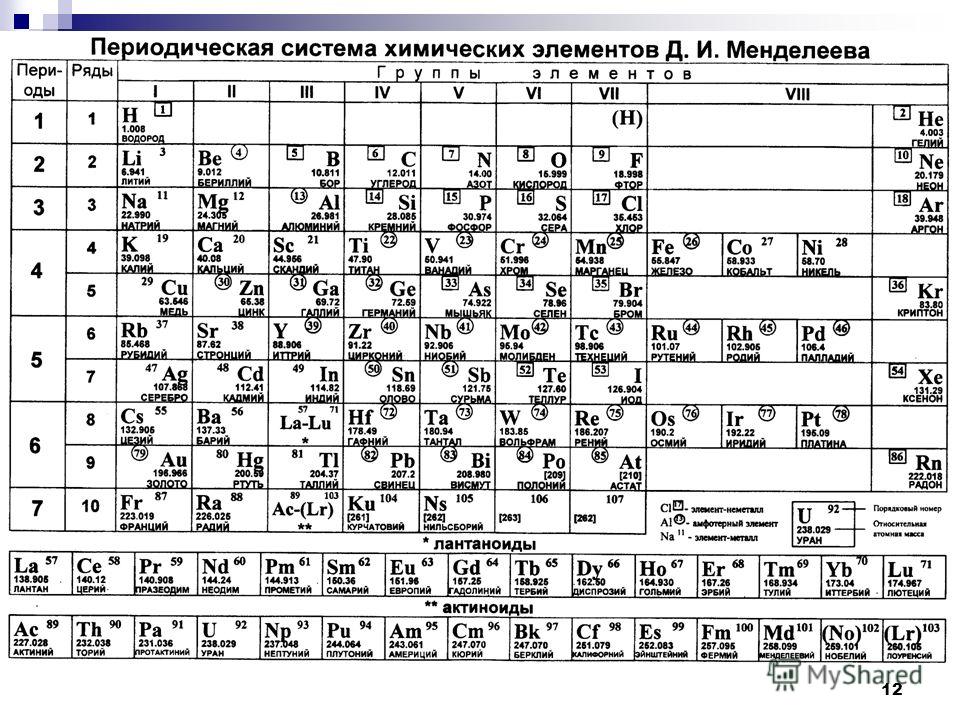 , начале 2019 г.
, начале 2019 г.
То, что активное участие в юбилее принимают школьники, несомненно, отрадно.
Сейчас в первую очередь ждем и предложения по мероприятиям от наших химических гигантов и филиала Менделеевского университета. Все уже собранные в Новомосковске предложения переданы в оргкомитет РХО им. Д.И. Менделеева.
Крупнейшим событием в праздновании 150-летия открытия закона является проведение в 2019 г. Менделеевского съезда, который естественно по праву пройдет в Санкт-Петербурге, в городе, в котором все знаменательные события и произошли.
Мне посчастливилось в жизни участвовать в нескольких Менделеевских съездах в Ленинграде, Минске, Москве, Волгограде… Самым незабываемым конечно было участие в Х Менделеевском съезде в Ленинграде в 1969 г., который был посвящен 100-летию открытия Дмитрием Ивановичем Менделеевым периодической таблицы. Я тогда молодой научный сотрудник, как говорится, с открытым ртом смотрел на знаменитых организаторов и участников съезда, проводившегося в Таврическом дворце Ленинграда. В X съезде приняли участие 2000 человек, и в том числе много иностранных гостей. Назову несколько фамилий: Нобелевский лауреат Н.Н. Семенов, академики С.И. Вольфкович, Н.М. Жаворонков, зам. председателя Совета министров В.А. Кириллин, министр образования В.П. Елютин и десятки известнейших ученых мира. А какие доклады сделали открыватели новых элементов – легенда науки академик Г.Н. Флеров (открыл 104 элемент – резерфордий, и в честь Флерова 114 элемент назван флеровий), председатель комиссии по атомной энергии США Г. Сиборг (синтезировал плутоний, а совместно с другими учеными открыл америций, кюрий, берклий, калифорний, эйнштейний, фермий, менделевий – в 1997 г. в честь Сиборга назван 106-й элемент – сиборгий). А доклады министра химической промышленности Л.А. Костандова, директора Института катализа академика Г.К. Борескова. Предполагаю, что осталось не так много участников этого знаменательного съезда.
В X съезде приняли участие 2000 человек, и в том числе много иностранных гостей. Назову несколько фамилий: Нобелевский лауреат Н.Н. Семенов, академики С.И. Вольфкович, Н.М. Жаворонков, зам. председателя Совета министров В.А. Кириллин, министр образования В.П. Елютин и десятки известнейших ученых мира. А какие доклады сделали открыватели новых элементов – легенда науки академик Г.Н. Флеров (открыл 104 элемент – резерфордий, и в честь Флерова 114 элемент назван флеровий), председатель комиссии по атомной энергии США Г. Сиборг (синтезировал плутоний, а совместно с другими учеными открыл америций, кюрий, берклий, калифорний, эйнштейний, фермий, менделевий – в 1997 г. в честь Сиборга назван 106-й элемент – сиборгий). А доклады министра химической промышленности Л.А. Костандова, директора Института катализа академика Г.К. Борескова. Предполагаю, что осталось не так много участников этого знаменательного съезда.
Конечно, был бы счастлив, участвовать и в Менделеевском съезде в 2019 г. и вновь посетить блестящий музей-квартиру Д. И. Менделеева, основанный в 1911 г. Полагаю, что ни один химик, физик, металлург, медик, метролог, нефтяник, полярник, угольщик, экономист, метеоролог, школьный учитель, преподаватель вуза, научный сотрудник, художник, композитор, скульптор, воздухоплаватель, школьник, студент не может не зайти в музей энциклопедиста, гения науки.
И. Менделеева, основанный в 1911 г. Полагаю, что ни один химик, физик, металлург, медик, метролог, нефтяник, полярник, угольщик, экономист, метеоролог, школьный учитель, преподаватель вуза, научный сотрудник, художник, композитор, скульптор, воздухоплаватель, школьник, студент не может не зайти в музей энциклопедиста, гения науки.
И в заключение, вслед за титаном российского химпрома Леонидом Костандовым хочется повторить: «Какова химия – такова и жизнь».
Евгений Голосман, Член Центрального Правления РХО имени
Менделеева ,зам. председателя правления химического общества, вице-президент СНИОО Тульской обл, главный научный сотрудник «НИАП-КАТАЛИЗАТОР» г. Новомосковск
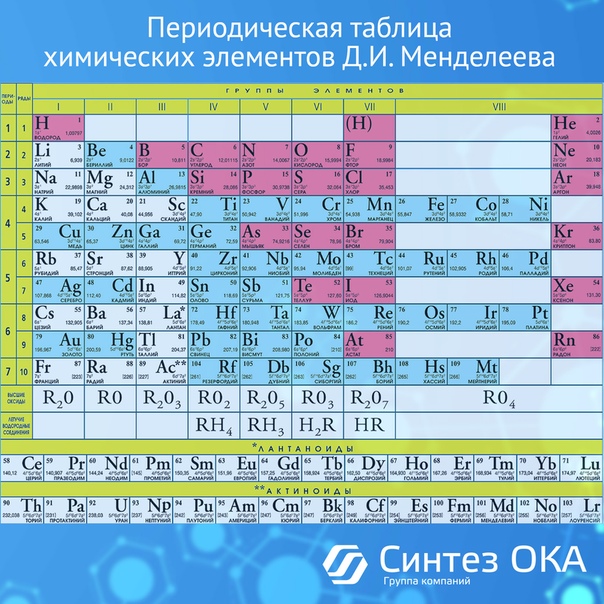
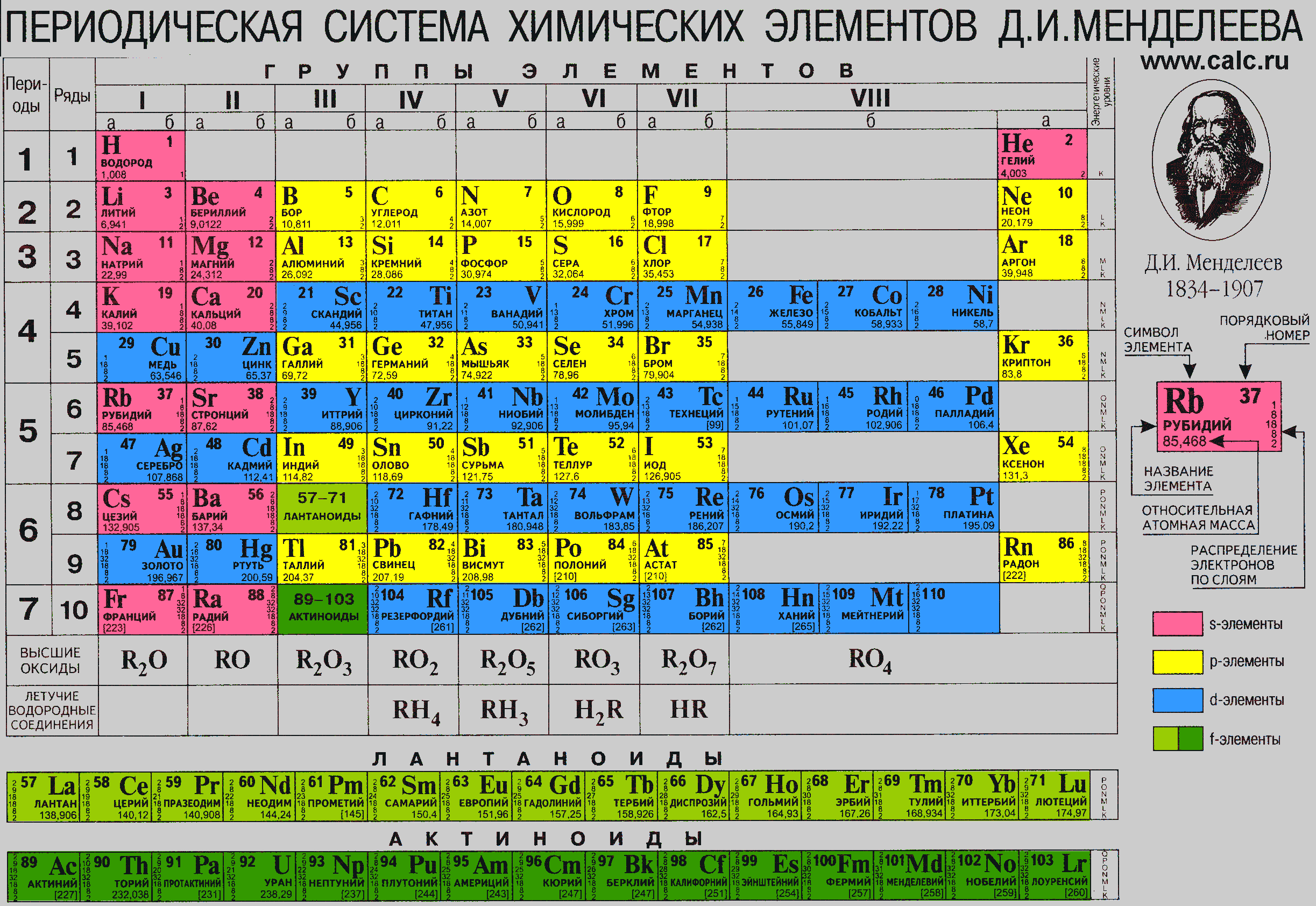
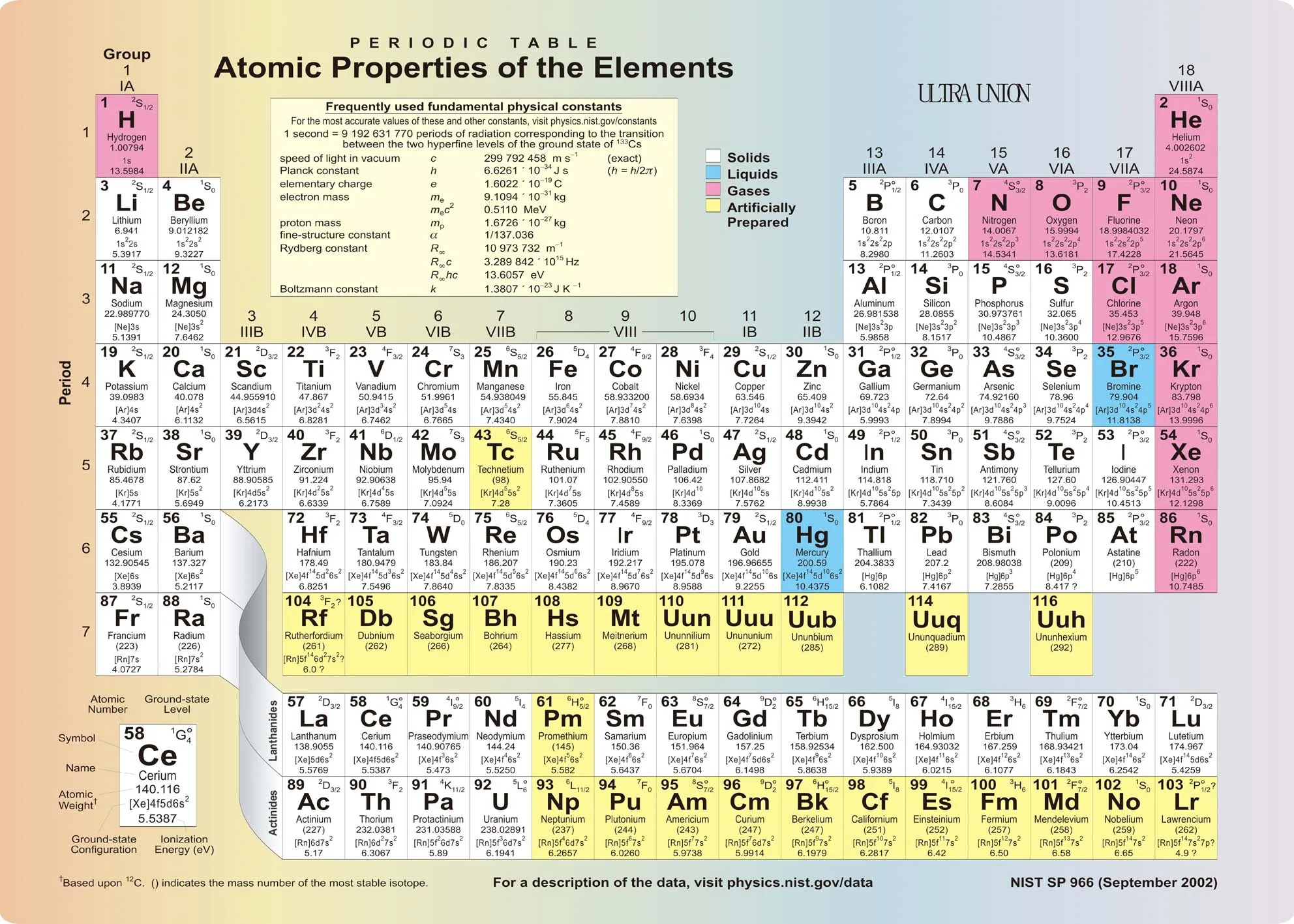
Периодическая таблица Д И Менделеева Элемент 24
Периодическая таблица Д. И. Менделеева Элемент № 24 ХРОМ Учитель химии Стасенко О. А.
Группы элементов периоды ряды I 1 II 2 III 3 IV V VI VII 4 5 6 7 8 9 10 I II IV 52 VI VIII Характеристика Cr +24 V ХРОМ 1. 2. лат. Cromium 3. Минерал хромит (хромистый железняк) – Fe. Cr 2 O 4 Открыл 1799 г. Ф. Тассер. 4. Cr +2 – основной, Cr +3 – амфотерный, Cr +6 – кислотный 5. Основные потребители: Металлургия, химическая промышленность, текстильная промышленность, медицина, наука
2. лат. Cromium 3. Минерал хромит (хромистый железняк) – Fe. Cr 2 O 4 Открыл 1799 г. Ф. Тассер. 4. Cr +2 – основной, Cr +3 – амфотерный, Cr +6 – кислотный 5. Основные потребители: Металлургия, химическая промышленность, текстильная промышленность, медицина, наука
хром 1. Электронное строение 1 s 22 p 63 s 23 p 63 d 54 s 1 52 Cr +24 2 8 13 1 p = 24 e = 24 n = 28 С. О. от +1 до +6
Месторождения хрома • В земной коре хрома довольно много – 0, 03%. • Хромовая руда носит название хромитов или хромистого железняка (потому, что почти всегда содержит и железо). • Наша страна обладает огромными запасами хромитов. • Одно из самых больших месторождений находится в Казахстане, в районе Актюбинска; оно открыто в 1936 г. • Значительные запасы хромовых руд есть и на Урале. • Большими запасами хромитов располагают Куба, Югославия, многие страны Азии и Африки.
Физические свойства • В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой; • Температура плавления – 1855 0 С; • Хром (с примесями) является одним из самых твердых металлов, легко царапает стекло, уступая лишь вольфраму (твердость по шкале Мооса 8. 5). • Очень чистый хром достаточно хорошо поддаётся механической обработке. • Электро – теплопроводность небольшая
5). • Очень чистый хром достаточно хорошо поддаётся механической обработке. • Электро – теплопроводность небольшая
Химические свойства Степень окисления +2 Оксид Cr. O (чёрный) Гидроксид Cr(OH)2 Характер Основный Cr 2+ (соли голубого цвета) Амфотерный Cr 3+ (cоли зеленого цвета) +3 Cr 2 O 3 (зелёный) +6 H 2 Cr. O 4 (хромовая кислота) Cr. O 3(красный) Кислотный H 2 Cr 2 O 7 ( дихромовая кислота) Cr(OH)3 Преобладающи е формы в растворах Примечания Очень сильный восстанови тель амфотерные свойства (окислитель, восстанови тель) Cr. O 42 (хроматы, желтые) Сильный Cr 2 O 72 окислитель (дихроматы, оранжевые)
Получение • В промышленности получают как чистый хром, так и его сплав с железом (феррохром). Чистый хром получают восстановлением его оксида алюминием: • Сг 2 О 3 + 2 Аl = 2 Сr + Аl 2 O 3. • Феррохром бывает 2 -х видов: содержащий и не содержащий углерод. Первый получают восстановлением хромистого железняка коксом: • Fе. О * Сr 2 О 3 + 4 С = Fе + 2 Сr + 4 СО
Применение Ø Использование хрома основано на его жаропрочности, твердости и устойчивости против коррозии. Ø Больше всего хрома применяют для выплавки хромистых сталей. Ø Значительное количество хрома идет на декоративные коррозионно-стойкие покрытия. ØШирокое применение получил порошковый хром в производстве металлокерамических изделий и материалов для сварочных электродов. ØХром в виде иона Cr 3+ – примесь в рубине, который используется как драгоценный камень и лазерный материал. Ø Соединениями хрома протравливают ткани при крашении. Ø Из смеси хромита и магнезита изготовляют хромомагнезитовые огнеупорные изделия.
Ø Больше всего хрома применяют для выплавки хромистых сталей. Ø Значительное количество хрома идет на декоративные коррозионно-стойкие покрытия. ØШирокое применение получил порошковый хром в производстве металлокерамических изделий и материалов для сварочных электродов. ØХром в виде иона Cr 3+ – примесь в рубине, который используется как драгоценный камень и лазерный материал. Ø Соединениями хрома протравливают ткани при крашении. Ø Из смеси хромита и магнезита изготовляют хромомагнезитовые огнеупорные изделия.
Наглядное применение
Роль хрома в живых организмах Ø Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови. Ø В конце 1950 -х гг. два исследователя, Шварц и Мерц, сообщили, что у крыс, которые были на рационе, дефицитном по хрому, развивалась непереносимость сахара; при добавлении же хрома в рацион их состояние нормализовалось. Это было первым подтверждением, что хром необходим животным для нормальной жизни. С тех пор исследователи поняли, что хром играет такую же роль и для здоровья человека.
Это было первым подтверждением, что хром необходим животным для нормальной жизни. С тех пор исследователи поняли, что хром играет такую же роль и для здоровья человека.
Продукты, содержащие хром • пшеничные ростки, печень, мясо, сыр, бобы, горох, цельное зерно, черный перец, мелисса, пивные дрожжи.
Основная роль хрома в организме – это регуляция сахара в крови. Ø Хром работает вместе с инсулином по перемещению сахара из крови в ткани организма для использования или сохранения. Этот микроэлемент настолько важен для переносимости сахара, что сильная его недостаточность приводит к развитию диабетоподобного заболевания. Ø Уровень хрома снижается при детском диабете, при коронарном артериальном заболевании (склерозировании артерий, ведущим к сердцу). Ø Хром необходим для нормального метаболизма жиров ( «сжигания жиров» ) в организме и его недостаток однозначно ведет к излишнему весу, ожирению.
Информация об элементе хромаCr: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История хрома
Элемент Хром был открыт Луи Николя Воклен в году
1797 г. во Франции
.
Хром
получил свое название от греческого слова chroma, означающего «цвет».
во Франции
.
Хром
получил свое название от греческого слова chroma, означающего «цвет».
Присутствие хрома: изобилие в природе и вокруг нас
В таблице ниже показано содержание хрома во Вселенной, Солнце, метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура хрома
Твердотельная структура хрома – это телесно-центрированная кубическая форма.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
и углы между ними. Углы решетки (альфа, бета и гамма).
Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства хрома
Атомы хрома имеют 24 электрона и
структура электронной оболочки [2, 8, 13, 1] с символом атомного члена (квантовые числа) 7 S 3 .
Оболочечная структура хрома – количество электронов на энергию уровень
| n | с | с. | г | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 6 | 5 | |
| 4 | N | 1 |
Основное состояние электронной конфигурации хрома – нейтраль Атом хрома
Электронная конфигурация нейтрального атома хрома в основном состоянии
[Ar] 3d5 4s1. Часть конфигурации хрома, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3d5 4s1, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации хрома, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3d5 4s1, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального Хрома
Полная электронная конфигурация основного состояния для атома хрома, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d5 4с1
Атомная структура хрома
Атомный радиус хрома составляет 166 пм, а его ковалентный радиус 127 пм.
Атомный спектр хрома
Химические свойства хрома: Энергии ионизации хрома и сродство к электрону
Сродство к электрону хрома составляет 64,3 кДж / моль.
Энергия ионизации хрома
Энергии ионизации хрома
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 652.9 |
| 2 | 1590,6 |
| 3 | 2987 |
| 4 | 4743 |
| 5 | 6702 |
| 6 | 8744,9 |
| 7 | 15455 |
| 8 | 17820 |
| 9 | 20190 |
| 10 | 23580 |
| 11 | 26130 |
| 12 | 28750 |
| 13 | 34230 |
| 14 | 37066 |
| 15 | 97510 |
| 16 | 1. 058 × 105 058 × 105 |
| 17 | 1,143 × 105 |
| 18 | 1,253 × 105 |
| 19 | 1,347 × 105 |
| 20 | 1.443 × 105 |
| 21 | 1,577 × 105 |
Физические свойства хрома
Физические свойства хрома указаны в таблице ниже.
| Плотность | 7.14 г / см3 |
| Молярный объем | 7.28236694678 см3 |
Эластичные свойства
Твердость хрома – Испытания для измерения твердости элемента
Электрические свойства хрома
Хром – проводник электричества. Ссылаться на
Таблица
ниже электрические свойства хрома
Ссылаться на
Таблица
ниже электрические свойства хрома
Теплопроводность и теплопроводность хрома
Магнитные свойства хрома
Оптические свойства хрома
Акустические свойства хрома
Термические свойства хрома – энтальпии и термодинамика
Термические свойства хрома
см. В таблице ниже.Энтальпия хрома
Изотопы хрома – ядерные свойства хрома
Изотопы родия.Встречающийся в природе хром имеет 4 стабильный изотоп – 50Cr, 52Cr, 53Cr, 54Cr.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 42Cr | ||||
| 43Cr | ||||
| 44Cr | ||||
| 45Cr | ||||
| 46Cr | ||||
| 47Cr | ||||
| 48Cr | ||||
| 49Cr | ||||
| 50Cr | 4.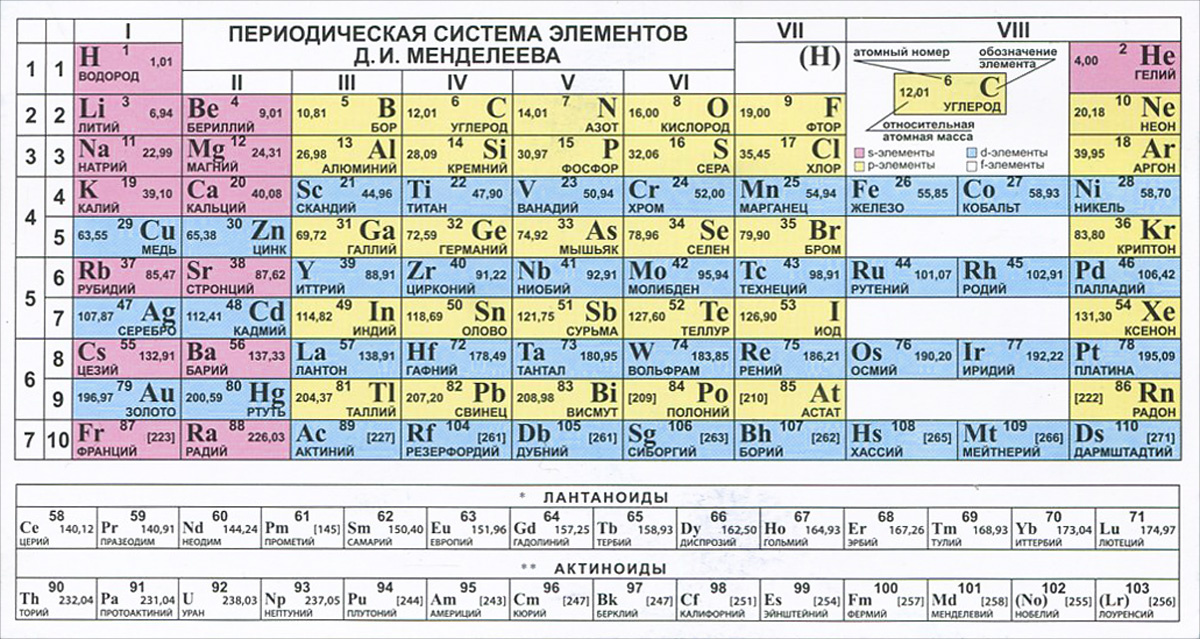 345% 345% | Стабильный | Нет данных | |
| 51Cr | ||||
| 52Cr | 83. 789% 789% | Стабильный | Нет данных | |
| 53Cr | 9. 501% 501% | Стабильный | Нет данных | |
| 54Cr | 2. 365% 365% | Стабильный | Нет данных | |
| 55Cr | ||||
| 56Cr | ||||
| 57Cr | ||||
| 58Cr | ||||
| 59Cr | ||||
| 60Cr | ||||
| 61Cr | ||||
| 62Cr | ||||
| 63Cr | ||||
| 64Cr | ||||
| 65Cr | ||||
| 66Cr | ||||
| 67Cr |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Хром: промышленное и повседневное использование
Что такое хром?
Прежде чем мы начнем, давайте немного поговорим о хроме. Хром – это металл, который находится в группе 6 и периоде 4 периодической таблицы Менделеева. Атомный номер хрома 24, что означает, что в его ядре 24 протона. Обозначение хрома – Cr .
Использование хрома
Хром – это универсальный металл, имеющий множество применений.Если вы водите более старую машину, бампер мог быть хромированным. Вилка из нержавеющей стали, которой вы едите, содержит хром. Если вы рисуете, многие красители и пигменты содержат хром. Давайте узнаем больше об этих приложениях.
Гальваника
Хром может быть нанесен гальваническим способом на другой металл или даже пластик. Гальваника – это просто процесс, в котором электричество используется для осаждения небольшого слоя атомов на поверхности. Хромированный бампер – это металл, на который нанесено гальваническое покрытие хромом.Хромирование не только придает бамперу блестящий вид, но и увеличивает его долговечность, поскольку он очень устойчив к коррозии.
Хромированный бампер – это металл, на который нанесено гальваническое покрытие хромом.Хромирование не только придает бамперу блестящий вид, но и увеличивает его долговечность, поскольку он очень устойчив к коррозии.
Нержавеющая сталь
Хром смешивается с другими металлами с образованием сплава под названием нержавеющая сталь . Сплав – это просто смесь металлов, обладающих улучшенными свойствами по сравнению с каждым из отдельных компонентов. Нержавеющая сталь устойчива к ржавчине и очень проста в уходе. Благодаря этим свойствам он используется в кухонной технике, а также в столовом серебре.
Пигменты
Хром также входит в состав многих пигментов , используемых художниками для рисования. Хромат свинца (II), известный как хромово-желтый, дает ярко-желтый цвет, похожий на цвет школьного автобуса.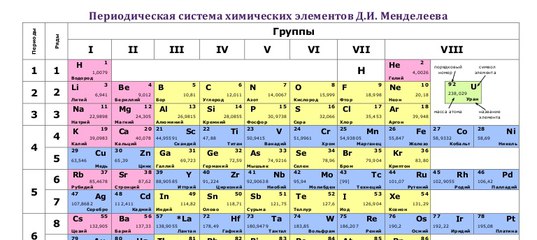 Из-за токсичности свинца и того факта, что цвет со временем потемнел, желтый хром больше не используется в качестве пигмента.
Из-за токсичности свинца и того факта, что цвет со временем потемнел, желтый хром больше не используется в качестве пигмента.
Хром находится в двух зеленых пигментах. Первый – это оксид хрома, известный как хромовый зеленый. Это дает очень темно-зеленый цвет.
Второй известен как виридиан и представляет собой дигидрат оксида хрома. Винсент Ван Гог использовал виридиановый зеленый цвет, чтобы нарисовать Cafe Terrace at Night .
Синтетические рубины
Если вы хотите сделать рубин , вам понадобится хром.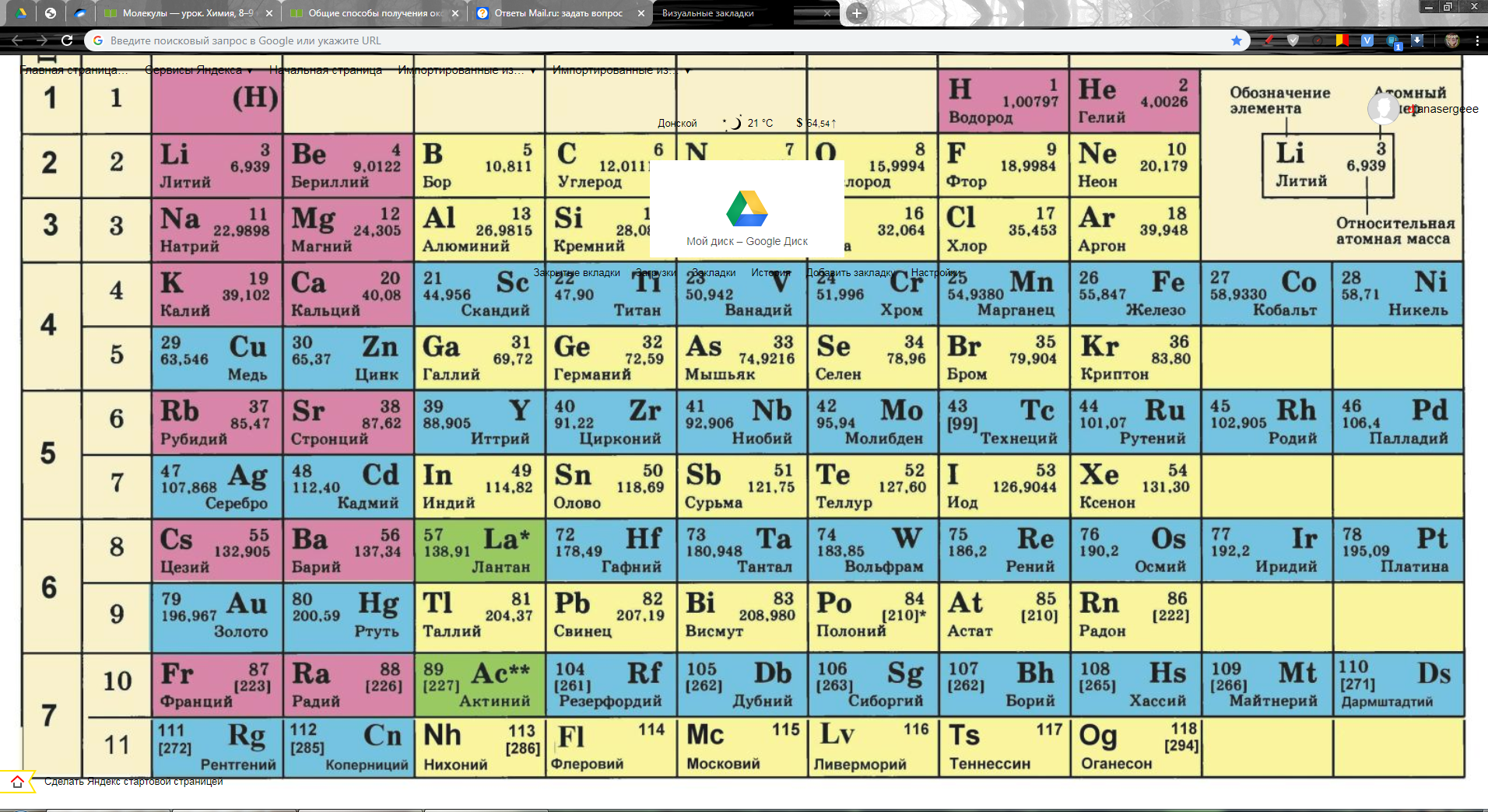 Настоящие рубины – это кристаллы оксида алюминия с разбросанными по всей поверхности атомами хрома. Красный цвет на самом деле происходит от атомов хрома. Рубины можно создать в лаборатории путем смешивания оксида алюминия и хрома.
Настоящие рубины – это кристаллы оксида алюминия с разбросанными по всей поверхности атомами хрома. Красный цвет на самом деле происходит от атомов хрома. Рубины можно создать в лаборатории путем смешивания оксида алюминия и хрома.
Краткое содержание урока
Хром – это металл с 24 протонами и символом элемента Cr .
Он используется во многих промышленных приложениях, таких как:
- Гальваника – тонкий слой хрома наносится на металл или пластик. Хром хромированных бамперов нанесен гальваническим способом на металл бампера.
- Нержавеющая сталь – сплав хрома. Этот сплав устойчив к ржавчине и легко чистится. Многие кухонные принадлежности, например, столовое серебро, изготовлены из нержавеющей стали.
- Пигменты – хромовый желтый (хромат свинца (II)), хромовый зеленый (оксид хрома) и виридиан (дигидрат оксида хрома) – все пигменты, содержащие хром.
 Винсент Ван Гог использовал виридиановый зеленый цвет, чтобы нарисовать Cafe Terrace at Night .
Винсент Ван Гог использовал виридиановый зеленый цвет, чтобы нарисовать Cafe Terrace at Night . - Синтетические рубины – рубины могут быть созданы в лаборатории путем смешивания хрома с оксидом алюминия.Атомы хрома – причина того, что рубины имеют красный цвет.
| 1 | Найдите количество нейтронов | H | |
| 2 | Найдите массу 1 моля | H_2O | |
| 3 | Весы | H_2 (SO_4) + K (OH) → K_2 (SO_4) + H (OH) | |
| 4 | Найдите массу 1 моля | H | |
| 5 | Найдите количество нейтронов | Fe | |
| 6 | Найдите количество нейтронов | Tc | |
| 7 | Найдите электронную конфигурацию | H | |
| 8 | Найдите количество нейтронов | Ca | |
| 9 | Весы | СН_4 + O_2 → H_2O + CO_2 | |
| 10 | Найдите количество нейтронов | С | |
| 11 | Найдите число протонов | H | |
| 12 | Найдите количество нейтронов | O | |
| 13 | Найдите массу 1 моля | CO_2 | |
| 14 | Весы | C_8H_18 + O_2 → CO_2 + H_2O | |
| 15 | Найдите атомную массу | H | |
| 16 | Определить, растворимо ли соединение в воде | H_2O | |
| 17 | Найдите электронную конфигурацию | Na | |
| 18 | Найдите массу отдельного атома | H | |
| 19 | Найдите количество нейтронов | Nb | |
| 20 | Найдите количество нейтронов | Au | |
| 21 | Найдите количество нейтронов | Пн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | O | |
| 24 | Найдите массовые проценты | H_2O | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую / простейшую формулу | H_2O | |
| 27 | Найдите числа окисления | H_2O | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | мг | |
| 30 | Найдите электронную конфигурацию | Ca | |
| 31 | Найдите количество нейтронов | Rh | |
| 32 | Найдите количество нейтронов | Na | |
| 33 | Найдите количество нейтронов | Pt | |
| 34 | Найдите количество нейтронов | Be | Be |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | H_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Fe | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Cu | |
| 41 | Найдите количество нейтронов | S | |
| 42 | Найдите числа окисления | H | |
| 43 | Весы | СН_4 + O_2 → CO_2 + H_2O | |
| 44 | Найдите атомную массу | O | |
| 45 | Найдите атомный номер | H | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | Os | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | O | |
| 50 | Найдите электронную конфигурацию | Fe | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Na | |
| 55 | Найдите количество нейтронов | N | |
| 56 | Найдите количество нейтронов | Li | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов | N | |
| 59 | Упростить | H ^ 2O | |
| 60 | Упростить | ч * 2o | |
| 61 | Определить, растворимо ли соединение в воде | H | |
| 62 | Найдите плотность на STP | H_2O | |
| 63 | Найдите числа окисления | NaCl | |
| 64 | Найдите атомную массу | He | He |
| 65 | Найдите атомную массу | мг | |
| 66 | Найдите число электронов | H | |
| 67 | Найдите число электронов | O | |
| 68 | Найдите число электронов | S | |
| 69 | Найдите количество нейтронов | Pd | |
| 70 | Найдите количество нейтронов | Hg | |
| 71 | Найдите количество нейтронов | B | |
| 72 | Найдите массу отдельного атома | Li | |
| 73 | Найдите эмпирическую формулу | H = 12%, C = 54%, N = 20 | “ |
| 74 | Найдите число протонов | Be | Be |
| 75 | Найдите массу 1 моля | Na | |
| 76 | Найдите электронную конфигурацию | Co | |
| 77 | Найдите электронную конфигурацию | S | |
| 78 | Весы | C_2H_6 + O_2 → CO_2 + H_2O | |
| 79 | Весы | H_2 + O_2 → H_2O | |
| 80 | Найдите электронную конфигурацию | P | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Al | |
| 83 | Найдите электронную конфигурацию | Ar | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | H_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | P | |
| 88 | Найдите количество нейтронов | мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | na + cl | |
| 92 | Определить, растворимо ли соединение в воде | H_2SO_4 | |
| 93 | Найдите плотность на STP | NaCl | |
| 94 | Найдите числа окисления | C_6H_12O_6 | |
| 95 | Найдите числа окисления | Na | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Класс | |
| 98 | Найдите атомную массу | Fe | |
| 99 | Найдите эмпирическую / простейшую формулу | CO_2 | |
| 100 | Найдите количество нейтронов | Mt |
Хром Cr (элемент 24) Периодической таблицы
24 Cr (элемент хрома)
Флэш-карта Chromium
Хром – серебристо-серый, блестящий, твердый и хрупкий металл. Который хорошо полируется и не тускнеет на воздухе. Но при нагревании образует зеленый оксид хрома.
Который хорошо полируется и не тускнеет на воздухе. Но при нагревании образует зеленый оксид хрома.
Он нестабилен в кислороде, сразу образует тонкий оксидный слой, непроницаемый (не позволяющий жидкости проходить) для кислорода и защищающий металл внизу.
Кусочки чистого хрома
Идентификационный номер
Номер CAS: CAS7440-47-3
Номер CID: CID23976
Класс опасности DOT: 4.1
Номер DOT: 3089
Номер RTECS: RTECSGB4200000
Внешний вид: серебристый металлик
Массовый номер: 52
Стандартный атомный вес: 51.996 г / моль
Атомный номер (Z): 24
Электронов: 24
Протонов: 24
Нейтронов: 28
Период: 4
Группа: 6
Блок: d
Категория элемента: Переходный металл
Электронов на оболочку: K2, L8 , M13, N1
Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
Хромовая электронная конфигурация
Термические свойства хрома Фаза: твердое вещество
Точка плавления: 2180 K (1907 o C, 3465 o F)
Точка кипения: 2944 K (2671 o C, 4840 o F)
Температура Дебая: 460 K (186 .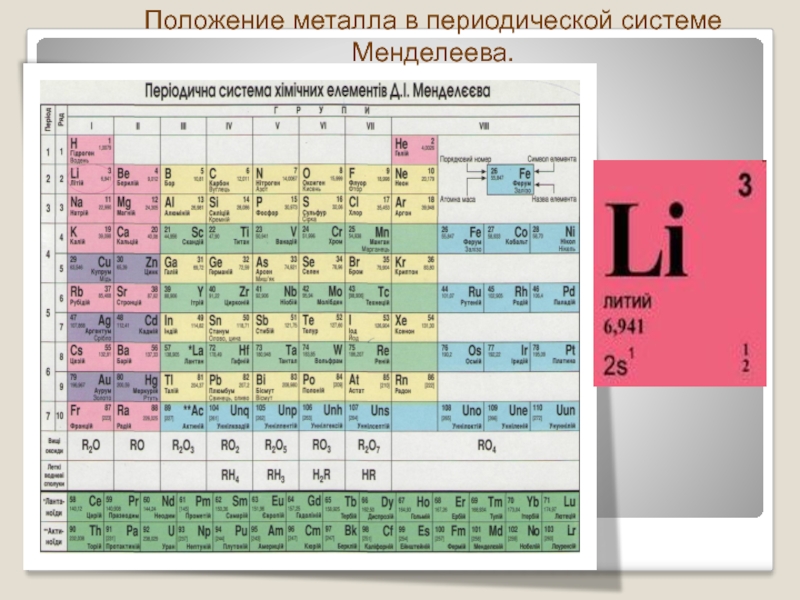 85 o C, 368,33 o F)
85 o C, 368,33 o F)
Теплота плавления: 21,0 кДж / моль
Теплота испарения: 347 кДж / моль
Удельная теплоемкость: 448 Дж / (кг K)
Молярная теплоемкость: 23,34 Дж / (моль. K)
Тепловое расширение: 4,9 мкм / (м ∙ K)
Теплопроводность: 93,9 Вт / (м ∙ K)
Точка Нееля (температура магнитного упорядочения) T N : 393 K (Температура, выше которой антиферромагнитный материал становится парамагнитный)
Электропроводность: 7.9 × 10 6 См / м
A Удельное электрическое сопротивление: 125 нОм ∙ м
A Электрический тип: проводник
A Магнитный тип: антиферромагнитный
Магнитная восприимчивость (x моль ): + 280 × 10 -6 см 3 / моль
Объемная магнитная восприимчивость: 0,0003177
Массовая магнитная восприимчивость: 44,5 × 10 -9 м 3 / кг
Молярная магнитная восприимчивость: 2,314 × 10 -9 м 3 / моль
Плотность: 7.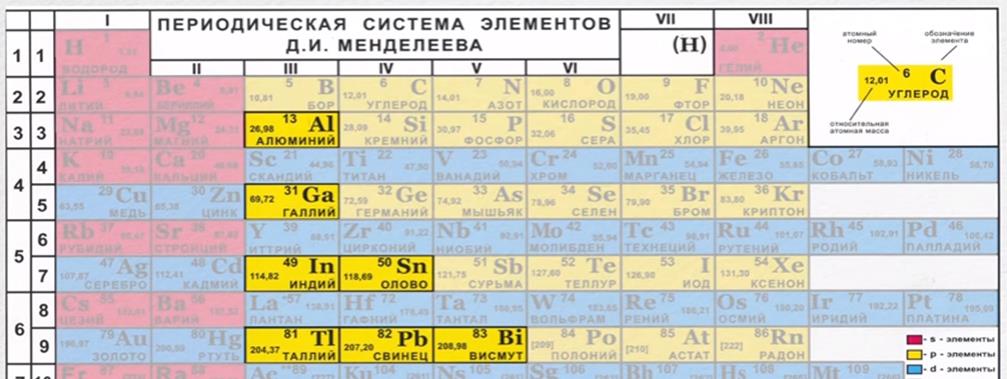 19 г / см 3 (в твердом состоянии) 6,3 г / см 3 (в жидкости при MP)
19 г / см 3 (в твердом состоянии) 6,3 г / см 3 (в жидкости при MP)
Молярный объем: 0,0000072317 м 3 / моль
Модуль Юнга: 278 ГПа
Модуль упругости: 115 ГПа
Твердость по Моосу : 8,5
Объемный модуль: 160 ГПа
Коэффициент Пуассона: 0,21
Твердость по Виккеру: 1060 МПа
Твердость по Бринеллю: 687-6500 МПа
Скорость звука: 5940 м / с
Степени окисления: -4, -2, -1, 1, 2, 3 , 4, 5, 6
Валентные электроны: 3d 5 4s 1
Заряд ионов: Cr 3+ Cr 2+
Ионизационный потенциал атома: 6.74
Энергия ионизации: 1-я: 653,89 кДж моль 2-я: 1590,59 кДж / моль 3-я: 2987 кДж / моль
Ионный радиус: 52 пм
Атомный радиус: 128 пм (эмпирический)
Ван-дер-Ваальс: 189 Pm
Ковалентный радиус: 139 ± 5 пм
Орбиталь заполнения: 3d 5
Кристаллическая структура: объемно-центрированная кубическая
Углы решетки: π / 2, π / 2, π / 2
Постоянная решетки: 288,5, 288,5, 288,5 пм
Параметры сетки: a = 2,885 Å
Имя космической группы: Im_3m
Номер космической группы: 229
Телоцентрированный куб (BCC)
Реакционная способность хрома Электроотрицательность: 1. 66 (шкала Паулинга)
66 (шкала Паулинга)
Валентность: +6
Сродство к электрону: 64,3 кДж / моль
Half Life: Stable (Infinity)
Lifetime: Stable (Infinity)
Квантовое число: 7 S 3
Нейтронное сечение (Brans): 3,1
Массовое поглощение нейтронов: 0,0021
Изотопы: 50 Cr 51 Cr 52 Cr 53 Cr 54 Cr
| Изотоп | Обилие (%) | Атомная масса г / моль | Период полураспада (t 1/2 ) |
| 50 Кр | 4.345 | 49,946 | Конюшня |
| 51 Cr | Syn | – | 27,70 г |
| 52 Кр | 83,789 | 51.941 | Конюшня |
| 53 Кр | 9,501 | 52,941 | Конюшня |
| 54 Кр | 2,365 | 53,939 | Конюшня |
A Хром не реагирует с воздухом, и водой, при нормальной температуре.
Хром непосредственно реагирует с фтором (F 2 ) при 400 ° C и атмосферном давлении 200-300, образуя:
Cr (s) + 3 F 2 (g) → CrF 6 (s ) [желтый] (фторид хрома (VI))
В более мягких условиях он образовал:
2 Cr (s) + 5 F 2 (g) → 2 CrF 5 (s) [красный] (хром (V ) фторид)
В более мягких условиях металл реагирует с галогенами и образует тригалогениды хрома:
2 Cr (s) + 3 F 2 (g) → 2 CrF 3 (s) [зеленый] (хром ( III) фторид)
2 Cr (тв) + 3 Cl 2 (г) → 2 CrCl 3 (т) [красно-фиолетовый] (хлорид хрома (III))
2 Cr (тв) + 3 Br 2 (г) → 2 CrBr 3 (т) [очень темно-зеленый] (бромид хрома (III))
2 Cr (т) + 3 I 2 (г) → 2 CrI 3 (т) [очень темно-зеленый] (иодид хрома (III))
Металлический хром растворяется в разбавленной соляной кислоте (HCL) с образованием Cr (II) и газообразного водорода (H 2 ), и в этом водном растворе Cr (II) присутствует в виде комплексного иона [Cr (OH 2 ) 6 ] 2+ .
Cr (s) + 2 HCL (водн.) → Cr 2+ (водн.) +2 Cl – (водн.) + H 2 (г)
Аналогичные результаты наблюдаются для серной кислоты (H 2 SO 4 ), но чистые образцы хрома могут быть стойкими к атакам.
Металлический хром не реагирует с азотной кислотой ( HNO 3 ) и фактически пассивирован (делает инертным, изменяя поверхностный слой или покрывая поверхность тонким инертным слоем).
Реакция Хромат-анион (CrO 4 2- ) и Дихромат (Cr 2 O 7 2- ) анионы находятся в равновесии:
2 [CrO 4 ] 2 – + 2H + ⇌ [Cr 2 O 7 ] 2- + H 2 O
A Реакция показывает, что как хромат, так и дихромат-анионы являются сильными. → 2 Cr 3+ + 21 H 2 O [ε 0 = 1. 33 V]
33 V]
Реакция умеренного окисления при высоком pH:
CrO 4 2- + 4 H 2 O + 3 e – → Cr (OH) 3 + 5 OH – [ε 0 = -0,13 В] –
Именование: Николас Луи Воклен
Открытие и первая изоляция: Луи Николя Воклен (1794, 1797) В Париже (Франция)
Хром используется для закалки стали, для производства нержавеющей стали (содержит 10.5% хрома) и для производства нескольких полезных сплавов .
A Хром в основном используется в гальванических покрытиях для придания стали полированному серебристому цвету , зеркальное покрытие (коррозионная стойкость), а также для получения твердой красивой поверхности, которая обычно используется в хромированных деталях легковых автомобилей и , например бамперы.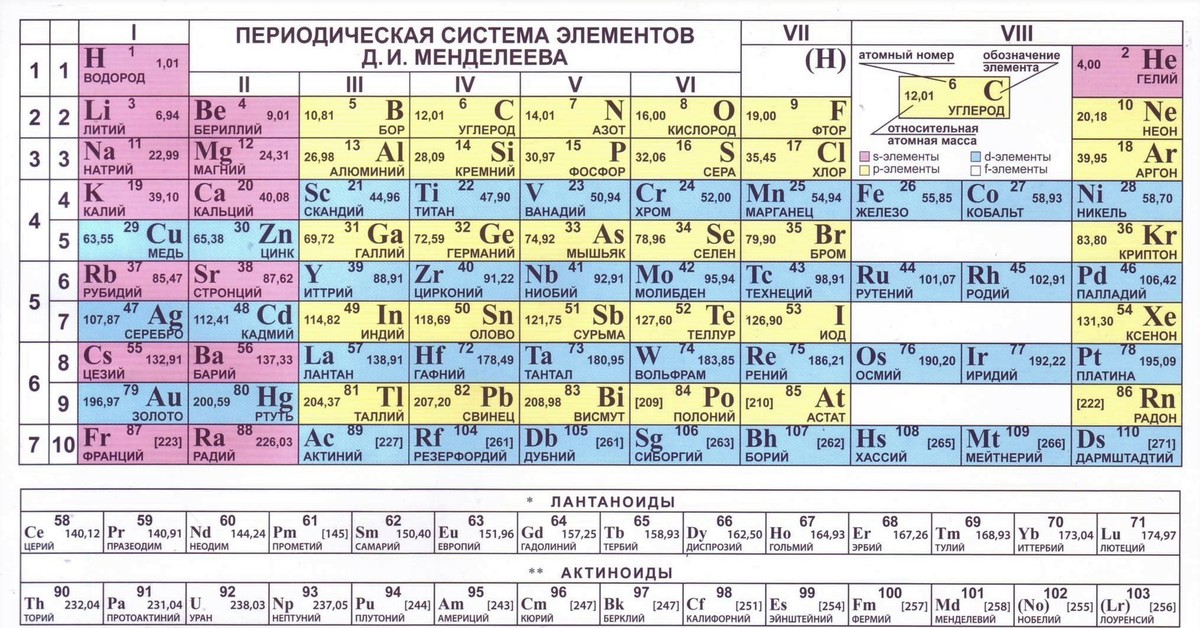
Все соединения хрома имеют цвет , и Наиболее важные хроматы – хроматы натрия и калия дихромат (Na 2 Cr 2 O 7 & K 2 Cr 2 O 7 ), а также квасцы хрома калия и аммония (сульфат калия хрома (III), KCr (SO 4 ) 2 ).
Дихроматы используются в качестве окислителей при количественном анализе, для изготовления форм для обжига кирпичей, , а также используются в дублении кожи (сточные воды токсичны, поэтому альтернативные варианты изучаются).
AC Соединения хрома широко используются в качестве промышленных катализаторов и пигментов (ярко-зеленого, красно-желтого и оранжевого цветов).
Рубины приобретают красный цвет, а стекло – изумрудно-зеленый цвет из-за хрома.
CrO 2 (Оксид хрома (IV)) используется для производства магнитной ленты .
Соединения хрома также используются в текстильной промышленности в качестве протравы , и в самолетах и других отраслях промышленности для анодирования алюминия (электрохимическим способом).
Биологическая роль хромаХром – это незаменимый микроэлемент для человека, потому что он помогает нам использовать глюкозу (в действии инсулина), мы ежедневно потребляем около 1 мг (миллиграмм).Однако это будет ядовитых, в избыточном количестве.
Пищевые продукты, такие как пивные дрожжи (Saccharomyces cerevisiae), зародыши пшеницы и почки , богаты хромом.
Соединения хрома токсичны, и с ними следует обращаться осторожно.
Шестивалентный хром (Cr (VI) или Cr 6+ ) высокотоксичен и мутаген (физический или химический агент, который изменяет генетический материал, обычно ДНК) при вдыхании
Хром содержится в основном в руде хромита (FeCr 2 O 4 ).
В промышленных масштабах металл обычно получают восстановлением оксида хрома (III) алюминием или кремнием или восстановлением хромита углеродом в электродуговой печи .
Ежегодное мировое производство составляет около 8,00 000 тонн.
0,0015% (В Вселенной )
0,3% (В Метеоритах )
0,002% (В Солнце )
0,014% (В Земной коре )
6 × 10 -8 % (В Океаны )
3 × 10 -6 % (в человек )
Хромитовый минерал
3 ведущих мировых производителя хрома 1) ЮАР
2) Казахстан
3) Индия
1) Казахстан
2) ЮАР
3) Индия
# хром
Другие элементы FlashCards
3.
 4. Атомная масса и атомный номер
4. Атомная масса и атомный номерРезультаты обучения
- Определите атомные и массовые числа.
- Определите количество протонов, нейтронов и электронов в атоме.
- Определите заряд и относительную массу субатомных частиц.
- Обозначьте расположение субатомных частиц в атоме.
- Определите массу атома на основе его субатомных частиц.
- Запись A / Z и массового символа для атома.
Атомы являются фундаментальными строительными блоками всей материи и состоят из протонов, нейтронов и электронов. Поскольку атомы электрически нейтральны, количество положительно заряженных протонов должно быть равно количеству отрицательно заряженных электронов. Поскольку нейтроны не влияют на заряд, количество нейтронов не зависит от количества протонов и будет варьироваться даже среди атомов одного и того же элемента.
Атомный номер
Атомный номер (обозначается буквой Z) элемента – это количество протонов в ядре каждого атома этого элемента . Атом можно классифицировать как конкретный элемент исключительно на основании его атомного номера. Например, любой атом с порядковым номером 8 (его ядро содержит 8 протонов) является атомом кислорода, а любой атом с другим числом протонов будет другим элементом. Таблица Менделеева (см. Рисунок ниже) отображает все известные элементы и расположена в порядке возрастания атомного номера. В этой таблице атомный номер элемента указан над символом элемента. Водород в верхнем левом углу таблицы имеет атомный номер 1.В ядре каждого атома водорода есть один протон. Следующим на столе идет гелий, атомы которого имеют в ядре два протона. Атомы лития имеют три протона, атомы бериллия – четыре и так далее.
Атом можно классифицировать как конкретный элемент исключительно на основании его атомного номера. Например, любой атом с порядковым номером 8 (его ядро содержит 8 протонов) является атомом кислорода, а любой атом с другим числом протонов будет другим элементом. Таблица Менделеева (см. Рисунок ниже) отображает все известные элементы и расположена в порядке возрастания атомного номера. В этой таблице атомный номер элемента указан над символом элемента. Водород в верхнем левом углу таблицы имеет атомный номер 1.В ядре каждого атома водорода есть один протон. Следующим на столе идет гелий, атомы которого имеют в ядре два протона. Атомы лития имеют три протона, атомы бериллия – четыре и так далее.
Поскольку атомы нейтральны, количество электронов в атоме равно количеству протонов. У всех атомов водорода есть один электрон, занимающий пространство за пределами ядра. Гелий с двумя протонами будет иметь два электрона. В химическом классе количество протонов всегда будет эквивалентно атомному номеру. Это значение не изменится, если ядро не распадется или не подвергнется бомбардировке (ядерная физика).
В химическом классе количество протонов всегда будет эквивалентно атомному номеру. Это значение не изменится, если ядро не распадется или не подвергнется бомбардировке (ядерная физика).
Массовое число
Экспериментальные данные показали, что большая часть массы атома сосредоточена в его ядре, которое состоит из протонов и нейтронов. Массовое число (обозначается буквой A) определяется как общее количество протонов и нейтронов в атоме. Рассмотрим таблицу ниже, в которой показаны данные из первых шести элементов периодической таблицы.
| Имя | Обозначение | Атомный номер (Z) | Протоны | Нейтроны | Электроны | Массовое число (A) (округлено до двух знаков после запятой) |
|---|---|---|---|---|---|---|
| водород | \ (\ ce {H} \) | 1 | 1 | 0 | 1 | 1. 01 01 |
| гелий | \ (\ ce {He} \) | 2 | 2 | 2 | 2 | 4,00 |
| литий | \ (\ ce {Li} \) | 3 | 3 | 4 | 3 | 6,94 |
| бериллий | \ (\ ce {Be} \) | 4 | 4 | 5 | 4 | 9. 01 01 |
| бор | \ (\ ce {B} \) | 5 | 5 | 6 | 5 | 10,18 |
| углерод | \ (\ ce {C} \) | 6 | 6 | 6 | 6 | 12.01 |
Рассмотрим элемент гелий.Его атомный номер 2, значит, в его ядре два протона. Его ядро также содержит два нейтрона. Поскольку \ (2 + 2 = 4 \), мы знаем, что массовое число атома гелия равно 4. Наконец, атом гелия также содержит два электрона, поскольку количество электронов должно быть равно количеству протонов. Этот пример может заставить вас поверить, что атомы имеют одинаковое количество протонов и нейтронов, но дальнейшее изучение приведенной выше таблицы покажет, что это не так. Литий, например, имеет три протона и четыре нейтрона, что дает ему массовое число 7.
Этот пример может заставить вас поверить, что атомы имеют одинаковое количество протонов и нейтронов, но дальнейшее изучение приведенной выше таблицы покажет, что это не так. Литий, например, имеет три протона и четыре нейтрона, что дает ему массовое число 7.
Рисунок \ (\ PageIndex {4} \): формат A / Z и поиск субатомных элементов для elementChromium (Авторские права; Элизабет Р. Гордон)
Зная массовое число и атомный номер атома, вы можете определить количество нейтронов, присутствующих в этом атоме, путем вычитания.
\ [\ text {Число нейтронов} = \ text {округленное массовое число} – \ text {атомный номер} \]
Атомы элемента хрома \ (\ left (\ ce {Cr} \ right) \) имеют атомный номер 24 и массовое число 52.Сколько нейтронов в ядре атома хрома? Чтобы определить это, вы должны вычесть, как показано:
\ [52 – 24 = 28 \: \ text {нейтроны в атоме хрома} \]
Состав любого атома можно проиллюстрировать сокращенной записью, называемой форматом A / Z. {52} _ {24} Cr} \]
{52} _ {24} Cr} \]
Другой способ обозначить конкретный атом – написать массовое число атома после имени, разделенное дефисом.Формат «символ-масса» для указанного выше атома будет записан как Cr-52. В этих обозначениях атомный номер не включен. Вам нужно будет обратиться к таблице Менделеева за значениями протонов.
Пример \ (\ PageIndex {1} \)
Вычислите каждую из трех субатомных частиц и дайте конкретные названия групп или периодов для каждого атома.
- ртуть
- платина
- бром
Решения
- Hg (переходный металл) – 80 электронов, 80 протонов и 121 нейтрон
- Pt (переходный металл) – 78 электронов, 78 протонов и 117 нейтронов
- Br (галоген) – имеет 35 электронов, 35 протонов и 45 нейтронов
Пример \ (\ PageIndex {2} \)
Запишите форматы A / Z и массы символа для атомов в примере \ (\ PageIndex {1} \). {80} _ {35} Бр} \) и Бр-80
{80} _ {35} Бр} \) и Бр-80
Пример \ (\ PageIndex {3} \)
Определите элементы на основании приведенных ниже утверждений.
- Какой элемент имеет 25 протонов?
- У какого элемента 0 нейтронов?
- У какого элемента 83 электрона?
Решения
а. марганец
г. водород
г. висмут
Нужна дополнительная практика?
- Перейдите к разделу 3.E настоящего ООР и ответьте на вопросы №1- №2, №4 и №8.
Авторы и авторство
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Эллисон Соулт, Ph.D. (Кафедра химии, Университет Кентукки)
Хром – Атомный номер – Атомная масса – Плотность хрома
Атомный номер хрома
Хром – это химический элемент с атомным номером 24 , что означает, что в атомной структуре 24 протона и 24 электрона. Химический знак для хрома – Cr .
Химический знак для хрома – Cr .
Так как количество электронов отвечает за химическое поведение атомов, атомный номер идентифицирует различные химические элементы.
Как атомный номер определяет химическое поведение атомов?
Атомная масса хрома
Атомная масса хрома 51,9961 ед.
Обратите внимание, что каждый элемент может содержать больше изотопов. Следовательно, эта результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их содержания.
Единицей измерения массы является единица атомной массы (а.е.м.) . Одна атомная единица массы равна 1,66 x 10 -24 граммов. Одна унифицированная атомная единица массы составляет приблизительно массы одного нуклона (либо одиночного протона, либо нейтрона) и численно эквивалентна 1 г / моль.
Для 12 C атомная масса равна 12u, поскольку от нее определяется атомная единица массы. Существует две причины разницы между массовым числом и изотопной массой, известной как дефект массы: Атомное массовое число в первую очередь определяет атомную массу атомов. Массовое число различно для каждого изотопа химического элемента. Как атомная масса определяет плотность материалов? Плотность хрома 7,14 г / см 3 . Типичные плотности различных веществ при атмосферном давлении. Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, разделенная на объем: ρ = m / V Другими словами, плотность (ρ) вещества – это общая масса (m) этого вещества. вещество, деленное на общий объем (V), занимаемый этим веществом.Стандартная единица СИ составляет килограммов на кубический метр ( кг / м 3 ). См. Также: Что такое плотность См. Также: Самые плотные материалы Земли – Хром Хром – Cr Атомы хрома Марганец – это химический элемент с символом Mn и атомным номером 25. гелий Самый тяжелый элемент по атомной массе – это элемент 118 или оганессон. Элемент с наибольшей плотностью – осмий или иридий. Тетроксид осмия смертоносен, и его можно купить в Интернете по цене менее 17 фунтов стерлингов за грамм, но эксперты говорят, что он не так опасен, как зарин, выпущенный в токийском метро в 1995 году, в результате которого 12 человек погибли и 6000 человек получили ранения. Осмий Свинец, вероятно, самый дешевый и доступный из более плотных металлов. Его можно купить в магазинах по всему миру и использовать во всем, от сантехнических и электромонтажных работ до рыболовных снастей. Проблема изготовления качественного фальшивого золота в том, что оно очень плотное.Он почти в два раза плотнее свинца и в два с половиной раза плотнее стали. Стальной стержень того же размера весит всего тринадцать с половиной фунтов. Золото называют тяжелым металлом из-за его высокой плотности, которая происходит из-за того факта, что каждый из его атомов по отдельности очень тяжел. Плотность вольфрама почти одинакова, но вольфрам твердый и хрупкий, потому что его атомы тесно связаны, и их трудно протолкнуть друг мимо друга. Атомный вес свинца больше, чем у золота (207 против 196), но плотность золота намного больше, чем у свинца (19,32 против 11,34 г / куб. См). Таким образом, данный объем золота тяжелее такого же количества свинца. В физике и химии вам нужно понимать, о чем вы просите, и быть конкретным. 40 фунтов Это означало, что цена на золото была зафиксирована на уровне 35 долларов за тройскую унцию….Сколько стоит 160 фунтов золота? 27,5 фунтов жидкое золото: преобразование цен и стоимость 1 грамм чистого золота 24 карата (999,9) поставляется в выбранном нами слитке, одобренном LBMA… .Вход в систему. 1605.44 доллара США Золото классифицируется как тяжелый металл, несмотря на его мягкость и пластичность, потому что каждый из его атомов тяжел сам по себе. Это плотный материал. имеет удельный вес 19,32. Так что алмаз не такой тяжелый, как свинец или золото. Поддельное золото кажется легче настоящего золота, потому что золото тяжелее почти всех других металлов. Под ударной вязкостью, однако, понимается сопротивление минерала разрушению. Золото очень прочное и ломается только вдоль линии пайки, в местах с очень малой шириной или на дефектных участках точечной коррозии (крошечные пузырьки воздуха из-за некачественного изготовления). Золото долговечно, золото красиво, а золото долговечно. Но не позволяйте этому обмануть вас, золото может быть повреждено. При неправильном обращении на нем могут появиться царапины и вмятины.Еще одна вещь: не позволяйте вашим золотым украшениям, особенно кольцам, контактировать с обычными бытовыми чистящими средствами, содержащими хлор. Уксус – это кислый раствор, что означает, что он медленно растворяет слой плакированного золота. Обычно золото растворяет царская водка, смесь соляной и азотной кислот, но уксус также может справиться с этой задачей, если вы проявите терпение.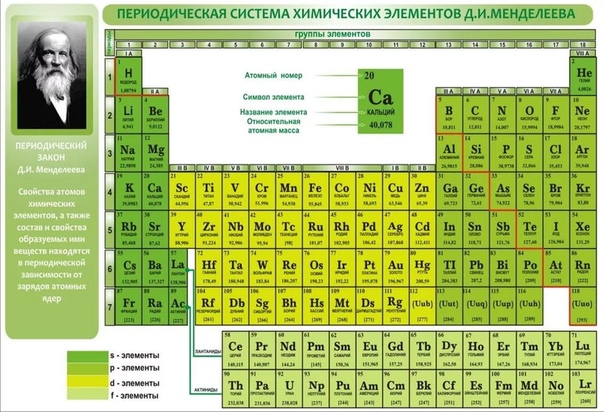 Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0.1 ед. Массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в его основном ядерном состоянии равна 62,
Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0.1 ед. Массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в его основном ядерном состоянии равна 62, ед.  Для 63 Cu, атомная масса меньше 63, поэтому это должен быть доминирующий фактор.
Для 63 Cu, атомная масса меньше 63, поэтому это должен быть доминирующий фактор. Плотность хрома
 Стандартная английская единица – фунтов массы на кубический фут ( фунт / фут 3 ).
Стандартная английская единица – фунтов массы на кубический фут ( фунт / фут 3 ). Хром – сводка свойств
Элемент Хром Атомный номер 24 24 Символ Cr Категория элемента Переходный металл Фаза в STP Твердое тело Атомная масса [а.е.м.] 51.9961 Плотность при STP [г / см3] 7,14 Электронная конфигурация [Ar] 3d5 4s1 Возможные состояния окисления +2,3 Сродство к электрону [кДж / моль] 64,3 Электроотрицательность [шкала Полинга] 1,66 Энергия первой ионизации [эВ] 6,7666 Год открытия 1797 Первооткрыватель Vauquelin Тепловые свойства Точка плавления [шкала Цельсия] 1907 Точка кипения [шкала Цельсия] 2671 Теплопроводность [Вт / м · К] 93.  7
7 Удельная теплоемкость [Дж / г К] 0,45 Теплота плавления [кДж / моль] 16,9 Теплота испарения [кДж / моль] 344,3 Хром в периодической таблице
–
– Что такое 24 в периодической таблице? – Restaurantnorman.com
Что такое 24 в таблице Менделеева?
Массовое число каких элементов равно 24?
У какого элемента 24 протона, 24 электрона и 28 нейтронов?
Что такое 25-й элемент?
Кто самый маленький элемент?
Какой элемент самый большой?
Может ли осмий убить вас?
 Но когда осмий подвергается воздействию воздуха, образуется высокотоксичный оксид четырехокиси осмия.
Но когда осмий подвергается воздействию воздуха, образуется высокотоксичный оксид четырехокиси осмия. Какой самый тяжелый минерал на Земле?
Какой самый дешевый и тяжелый материал?
Золото тяжелее стали?
Почему золото такое тяжелое?

Насколько тяжел свинец по сравнению с золотом?
Сколько весит ведро золота объемом 5 галлонов?
Сколько стоит 160 фунтов золота?
тройских фунтов USD Стоимость 161,00 3 601 847 долл. США Насколько тяжелый золотой слиток?
Сколько стоит галлон золота?
Цена за британские единицы объема 96,19 чашка 48. 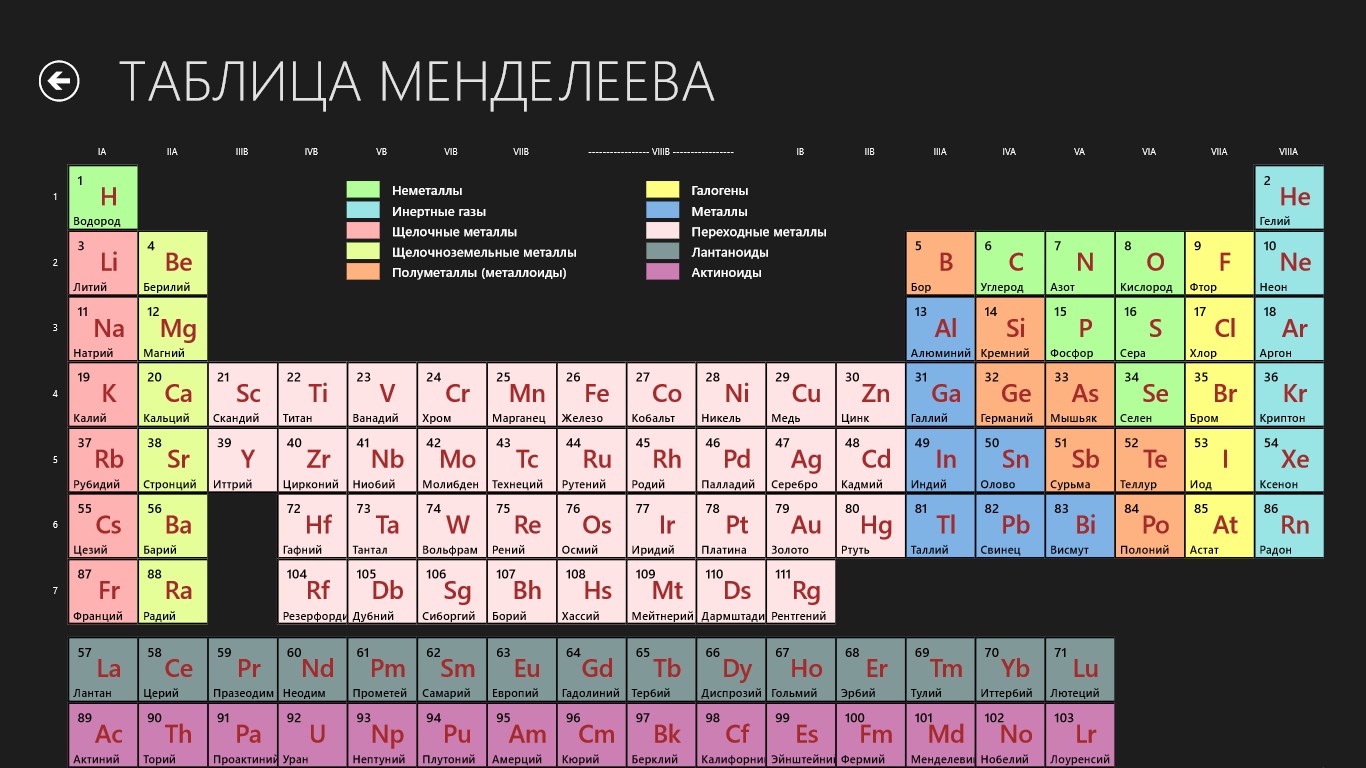 09
09 1/2 стакана 9,62 жидких унций 1,539,03 галлона Сколько стоит 1 грамм золота?
Металл Цена за унцию Цена за грамм Платина $ 1 120,00 $ 36,00 9 Сколько стоит 1 унция золота?
Золото тяжелое?
Алмаз тяжелее золота?
Золото Настоящее золото тяжелее поддельного?
Насколько сложно разбить золото?
Можете ли вы испортить золото?
Растворяет ли уксус золото?






 Винсент Ван Гог использовал виридиановый зеленый цвет, чтобы нарисовать Cafe Terrace at Night .
Винсент Ван Гог использовал виридиановый зеленый цвет, чтобы нарисовать Cafe Terrace at Night .