Элемент № 24 периодической таблицы. Хром
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
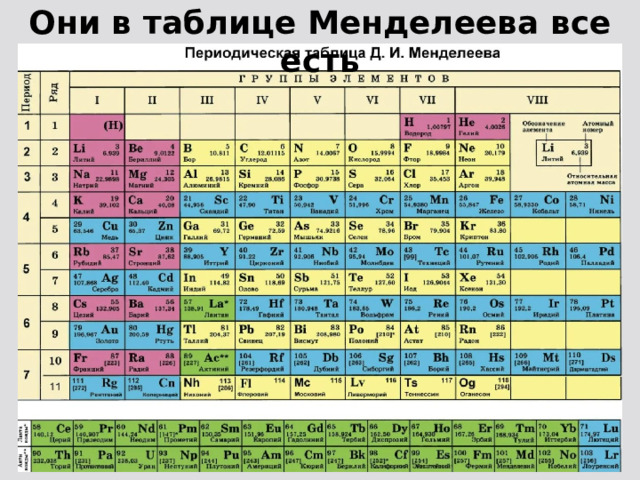
1. Периодическая таблица Д.И. Менделеева
Элемент № 24ХРОМ
Выполнил: ученик 9 кл. ГОУ СОШ № 403
Гузенко Артем
2009/2010 учебный год
3. ХРОМ
Хром (лат. Cromium), Cr,химический элемент VI группы
периодической системы Менделеева,
атомный номер 24,
атомная масса 51,996;
металл голубовато-стального цвета.
4. История открытия
В 1797 г. французский химик Л. Вокеленвпервые исследовал красноватый, тяжелый
минерал крокоизит, попавший в его руки из
далекой Сибири.

Крокоизит, чаще называемый крокоитом (от
греческого “крокос” – шафран), -редкий
минерал, найденный на Урале в 40-х года
XVIII в. и описанный М. В. Ломоносовым.
Затем он был найден в Сибири петербургским
профессором химии И. Леманом в 1762 г. От
него попал к Вокелену, который открыл в
сибирском минерале соединение нового
элемента.
Выделить этот элемент в чистом виде он
не смог. Пораженный разнообразием окрасок,
образуемых разными соединениями вновь
открытого элемента, Вокелен назвал его
хромом (от греческого слова “хрома” – цвет,
краска). В сравнительно чистом виде новый
элемент был выделен в 1799 г. Ф. Тассером.
Он представлял собой серо-стальной металл
с серебристыми блестками в изломе,
тугоплавкий (температура плавления 1800° С),
не окисляющийся при обычных условиях, с
плотностью, почти равной плотности железа.
5. Применение хрома
Использование хрома основано на его жаропрочности, твердости иустойчивости против коррозии.
Больше всего хрома применяют для выплавки хромистых сталей.
Значительное количество хрома идет на декоративные коррозионно-стойкие
покрытия.
Широкое применение получил порошковый хром в производстве
металлокерамических изделий и материалов для сварочных электродов.
Хром в виде иона Cr3+ – примесь в рубине, который используется как
драгоценный камень и лазерный материал.
Соединениями хрома протравливают ткани при крашении.
Из смеси хромита и магнезита изготовляют хромомагнезитовые огнеупорные
изделия.
Cr
В
металлургии
В
химической
промышленности
В
текстильной
промышленности
В
медицине
В науке
6. Наглядное применение хрома
7. Роль хрома в живых организмах
Важные факты:Хром — один из биогенных элементов,
постоянно входит в состав тканей растений и
животных. У животных хром участвует в обмене
липидов, белков (входит в состав фермента
трипсина), углеводов. Снижение содержания хрома
в пище и крови приводит к уменьшению скорости
роста, увеличению холестерина в крови.
В конце 1950-х гг. два исследователя, Шварц и
Мерц, сообщили, что у крыс, которые были на
рационе, дефицитном по хрому, развивалась
непереносимость сахара; при добавлении же хрома
в рацион их состояние нормализовалось. Это было
первым подтверждением, что хром необходим
животным для нормальной жизни. С тех пор
исследователи поняли, что хром играет такую же
роль и для здоровья человека.
8. Пищевые источники хрома
пшеничные ростки, печень, мясо, сыр, бобы, горох, цельное зерно, черныйперец, мелисса, пивные дрожжи.
9. Функции хрома в жизни человека
Основная роль хрома в организме – это регуляция сахара в крови.Хром работает вместе с инсулином по
перемещению сахара из крови в ткани
организма для использования или сохранения. Этот микроэлемент настолько
важен для переносимости сахара, что
сильная его недостаточность приводит
к развитию диабетоподобного заболевания.
Уровень хрома снижается при детском диабете, при коронарном артериальном заболевании (склерозировании артерий, ведущим к сердцу).

Хром необходим для нормального
метаболизма жиров («сжигания жиров»)
в организме и его недостаток однозначно
ведет к излишнему весу, ожирению.
10. Месторождения хрома
В земной коре хрома довольно много – 0,02%. Хромовая руда носитназвание хромитов или хромистого железняка (потому, что почти всегда
содержит и железо).
Наша страна обладает огромными запасами хромитов. Одно из самых
больших месторождений находится в Казахстане, в районе
Актюбинска; оно открыто в 1936 г. Значительные запасы хромовых руд
есть и на Урале.
Большими запасами хромитов располагают Куба, Югославия, многие
страны Азии и Африки.
СПАСИБО
English Русский Правила
Элемент № 24 периодической таблицы. Хром презентация, доклад
Периодическая таблица
Д.И. Менделеева
Элемент № 24
ХРОМ
Выполнил: ученик 9 кл. ГОУ СОШ № 403 Гузенко Артем
2009/2010 учебный год
ХРОМ
Хром (лат. Cromium), Cr,
Cromium), Cr,
химический элемент VI группы периодической системы Менделеева,
атомный номер 24,
атомная масса 51,996;
металл голубовато-стального цвета.
История открытия
В 1797 г. французский химик Л. Вокелен впервые исследовал красноватый, тяжелый минерал крокоизит, попавший в его руки из далекой Сибири.
Крокоизит, чаще называемый крокоитом (от греческого “крокос” – шафран), -редкий минерал, найденный на Урале в 40-х года XVIII в. и описанный М. В. Ломоносовым. Затем он был найден в Сибири петербургским профессором химии И. Леманом в 1762 г. От него попал к Вокелену, который открыл в сибирском минерале соединение нового элемента.
Выделить этот элемент в чистом виде он не смог. Пораженный разнообразием окрасок, образуемых разными соединениями вновь открытого элемента, Вокелен назвал его хромом (от греческого слова “хрома” – цвет, краска). В сравнительно чистом виде новый элемент был выделен в 1799 г.
Применение хрома
Использование хрома основано на его жаропрочности, твердости и устойчивости против коррозии.
Больше всего хрома применяют для выплавки хромистых сталей. Значительное количество хрома идет на декоративные коррозионно-стойкие покрытия.
Соединениями хрома протравливают ткани при крашении.
Из смеси хромита и магнезита изготовляют хромомагнезитовые огнеупорные изделия.
Наглядное применение хрома
Роль хрома в живых организмах
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных.
В конце 1950-х гг. два исследователя, Шварц и Мерц, сообщили, что у крыс, которые были на рационе, дефицитном по хрому, развивалась непереносимость сахара; при добавлении же хрома в рацион их состояние нормализовалось. Это было первым подтверждением, что хром необходим животным для нормальной жизни. С тех пор исследователи поняли, что хром играет такую же роль и для здоровья человека.
Важные факты:
Пищевые источники хрома
пшеничные ростки, печень, мясо, сыр, бобы, горох, цельное зерно, черный перец, мелисса, пивные дрожжи.
Функции хрома в жизни человека
Основная роль хрома в организме – это регуляция сахара в крови.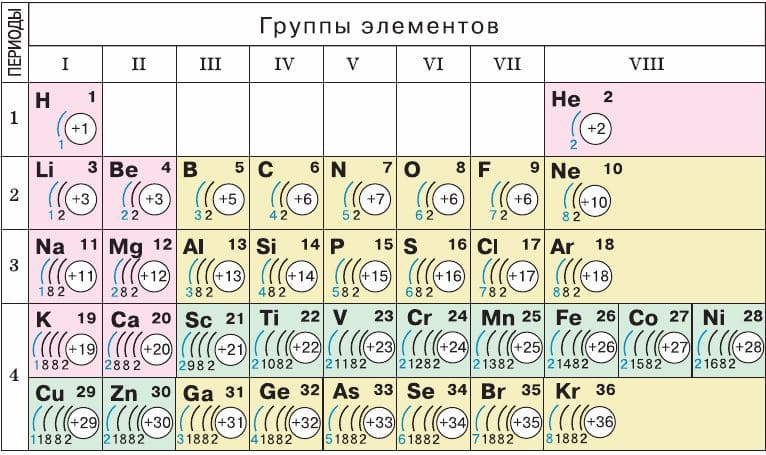
Хром работает вместе с инсулином по
перемещению сахара из крови в ткани
организма для использования или сох-
ранения. Этот микроэлемент настолько
важен для переносимости сахара, что
к развитию диабетоподобного заболевания.
Уровень хрома снижается при дет-
ском диабете, при коронарном арте-
риальном заболевании (склерозиро-
вании артерий, ведущим к сердцу).
Хром необходим для нормального
метаболизма жиров («сжигания жиров»)
в организме и его недостаток однозначно
ведет к излишнему весу, ожирению.
Месторождения хрома
В земной коре хрома довольно много – 0,02%. Хромовая руда носит название хромитов или хромистого железняка (потому, что почти всегда содержит и железо).
Наша страна обладает огромными запасами хромитов. Одно из самых больших месторождений находится в Казахстане, в районе Актюбинска; оно открыто в 1936 г.
Большими запасами хромитов располагают Куба, Югославия, многие страны Азии и Африки.
СПАСИБО
ЗА ВНИМАНИЕ
Скачать презентацию
Тот, кто гасит свет. Фейнманий и глубины таблицы Менделеева / Хабр
Попробуйте почитайте англоязычные источники по истории химии и поищите в них упоминание таблицы Менделеева. Вы будете удивлены, но все-таки убедитесь, что такая формулировка тщательно избегается. Настойчиво и как-то политкорректно пишут о «периодической системе элементов». С упоминанием не только Менделеева, но и всех причастных, акцентируя роль Мейера, Деберейнера и Шанкуртуа с не меньшим пафосом, чем определяющую роль открытия второго фронта на заключительном этапе Второй мировой войны.
Отдавая должное уважаемым западным партнерам Менделеева и лично Роберту Бунзену, у которого Дмитрий Иванович учился в 1859-1861, отметим, что Менделеев вошел в историю науки не как классификатор известного, подобно Линнею, а как визионер, сумевший спрогнозировать еще не открытые элементы и, что более важно в контексте этой статьи – правильно расположить йод и теллур, несмотря на то, что теллур тяжелее йода.
В настоящее время таблицу Менделеева замыкает оганессон (Og) № 118. Он расположен ровно под радоном (№ 86) и, по логике Менделеева, должен представлять собой благородный газ, так как замыкает седьмой период. Но с завершением этого самого удивительного, эфемерного и взрывоопасного периода, вместившего в себя уран, плутоний, менделевий, флеровий и оганессон, вновь актуализируются вопросы: а где заканчивается таблица Менделеева? И до самого ли ее предела соблюдается периодический закон? Удивительно, но впервые ответ на этот вопрос довольно уверенно дал еще Ричард Фейнман.
При этом он опирался на традиционную модель атома, предложенную Бором. Как известно, в модели Бора ядро атома окружено облаком электронов, и электроны обращаются вокруг ядра лишь по строго определенным разрешенным орбитам. Электрон не может занимать промежуточную орбиту, но может переходить с одной разрешенной орбиты на другую. Такой переход происходит мгновенно с излучением или поглощением кванта энергии и называется «квантовый скачок».
Скорость электрона в конкретном квантовом состоянии вычисляется по следующей формуле
,
где Z – атомный номер, соответствующий количеству протонов в ядре атома и, соответственно, количеству электронов, обращающихся вокруг нейтрального атома. Здесь же n – это квантовое состояние электрона, а — постоянная тонкой структуры. Постоянная тонкой структуры вычисляется по формуле
,
где e – элементарный заряд, h – постоянная Планка, а e0 – диэлектрическая постоянная, также именуемая свободной проницаемостью вакуума.
Соответственно, чем дальше от ядра находится внешняя электронная оболочка атома, тем выше скорость движущегося по ней электрона. Ричард Фейнман вычислил, что при Z = 137 скорость электрона будет чуть ниже, чем скорость света. Если следовать этой логике, элемент с атомным номером 138 существовать не может; в противном случае, его крайний электрон превысил бы скорость света.
Резерфордий и беззаконие
Тем не менее, на практике все оказывается сложнее.
Еще в 1990-е были поставлены первые эксперименты, показавшие, что резерфордий (104) и дубний (105) проявляют не те свойства, что положены им в соответствии с позициями в периодической системе. Согласно периодическому закону, они должны напоминать по свойствам те элементы, что расположены прямо над ними, соответственно, гафний и тантал. На самом же деле, резерфордий реагирует подобно плутонию, расположенному довольно далеко от него, а дубний – как протактиний. С другой стороны, сиборгий (106) и борий (107) следуют закону, выведенному Менделеевым.
Дальше – больше. Оказывается, рентгений (111) сближается по свойствам с астатом, а не с золотом, а коперниций (112) тяготеет по свойствам к благородным газам, даже сильнее, чем оганессон (118). Вероятно, теннессин (117) по свойствам скорее похож на галлий, а нихоний (113) сравним со щелочными металлами. Все эти аномалии связаны со все более выраженным проявлением релятивистских эффектов в сверхкрупных атомах.
Немного о корпускулярно-волновом дуализме
Боровская модель атома в той трактовке, согласно которой таблицу должен замыкать элемент № 137, также не вполне соответствует реальному положению вещей. Предмет квантовой физики гораздо сложнее, чем предмет классической; как правило, квантовые феномены не имеют наглядного аналога на макроуровне. Например, в соответствии с законами классической физики, электроны, обращающиеся вокруг ядра, обязаны падать на ядро, а атомы – схлопываться.
Предмет квантовой физики гораздо сложнее, чем предмет классической; как правило, квантовые феномены не имеют наглядного аналога на макроуровне. Например, в соответствии с законами классической физики, электроны, обращающиеся вокруг ядра, обязаны падать на ядро, а атомы – схлопываться.
Казалось бы, само существование атома является опровержением законов физики. Но на самом деле все иначе. Классические законы непоколебимы, но электроны не падают на ядро, поскольку, строго говоря, электрон – не частица. Электрон подчиняется корпускулярно-волновому дуализму, то есть, одновременно проявляет черты частицы и волны, и поэтому не падает на ядро. Тем не менее, даже с учетом корпускулярно-волнового дуализма скорость электрона не может превышать скорость света в вакууме.
Мистер Фейнман собственной персоной
Ричард Фейнман считал, что при атомном числе более Z =137 нейтральный атом существовать не может. Дело в том, что, согласно релятивистскому уравнению Дирака, при больших значениях Z основное энергетическое состояние электрона, ближайшего к ядру, будет выражаться мнимым числом. Однако, такая аргументация предполагает, что ядро является точечным. Если же допустить, что ядро имеет пусть минимальный, но не нулевой физический размер, то таблица Менделеева должна продолжаться до
Однако, такая аргументация предполагает, что ядро является точечным. Если же допустить, что ядро имеет пусть минимальный, но не нулевой физический размер, то таблица Менделеева должна продолжаться до Z≈173.
Что дальше
Считается, что для Z ≈ 173 1s-подоболочка под действием электрического поля ядра «погружается» в отрицательный континуум (море Дирака), что приводит к спонтанному рождению электрон-позитронных пар и, как следствие, к отсутствию нейтральных атомов выше элемента Ust (Унсепттрий) с Z = 173. Атомы с Z > Zcr 173 называются суперкритическими атомами. Предполагается также, что элементы с Z > Zcr могут существовать только в качестве ионов.
Суперкритические атомы не могут быть полностью ионизированы, поскольку на их первой электронной оболочке будет бурно происходить спонтанное рождение пар, при котором из моря Дирака всплывают электрон и позитрон, причем, электрон вплетается в атом, а позитрон улетает. Правда, поле сильного взаимодействия, окружающее атомное ядро, очень короткодействующее, так что принцип запрета Паули не допускает дальнейшего спонтанного рождения пар после заполнения тех оболочек, что погружены в море Дирака. Элементы 173–184 названы слабо суперкритическими атомами, поскольку у них в море Дирака погружена только оболочка
Правда, поле сильного взаимодействия, окружающее атомное ядро, очень короткодействующее, так что принцип запрета Паули не допускает дальнейшего спонтанного рождения пар после заполнения тех оболочек, что погружены в море Дирака. Элементы 173–184 названы слабо суперкритическими атомами, поскольку у них в море Дирака погружена только оболочка 1s; предполагается, что оболочка 2p1/2 будет полностью заполняться около элемента 185, а оболочка 2s – около элемента 245. Пока не удалось экспериментально добиться спонтанного рождения пар, пытаясь собрать суперкритические заряды путем столкновения тяжелых ядер (например, свинца с ураном, что могло бы дать Z = 174; урана с ураном, что дает Z = 184 и урана с калифорнием, что дает Z = 190). Возможно, в финале таблицы Менделеева ключевую роль будет играть ядерная нестабильность, а не нестабильность электронных оболочек.
Наконец, предполагается, что в регионе за Z > 300 может скрываться целый континент стабильности, состоящий из гипотетической кварковой материи (она же – квантово-хромодинамическая материя). Такая материя может состоять из свободных верхних и нижних кварков, а не из кварков, связанных в протоны и нейтроны. Предполагается, что это основное состояние барионной материи, обладающей большей энергией связи на барион, чем ядерная материя. Если такое состояние вещества реально, то, возможно, синтезировать его можно в ходе термоядерных реакций обычных сверхтяжелых ядер. Продукты таких реакций, благодаря высокой энергии связи, должны вполне преодолевать кулоновский барьер.
Такая материя может состоять из свободных верхних и нижних кварков, а не из кварков, связанных в протоны и нейтроны. Предполагается, что это основное состояние барионной материи, обладающей большей энергией связи на барион, чем ядерная материя. Если такое состояние вещества реально, то, возможно, синтезировать его можно в ходе термоядерных реакций обычных сверхтяжелых ядер. Продукты таких реакций, благодаря высокой энергии связи, должны вполне преодолевать кулоновский барьер.
Пока все это теория, и мы, повторимся, успели заполнить лишь 7-й период таблицы Менделеева к 150-летию открытия Периодического Закона (1869-2019). Так или иначе, период полураспада новых тяжелых элементов стремительно сокращается; если у резерфордия-267 он составляет около 1,3 часов, то у рентгения-282 – всего 2,1 минуты, а у оганессона исчисляется сотнями микросекунд. Таким образом, финал близок, а за ним может открыться сиквел или режиссерская версия материального мира. Путь туда лежит через субсветовые орбитали фейнмания.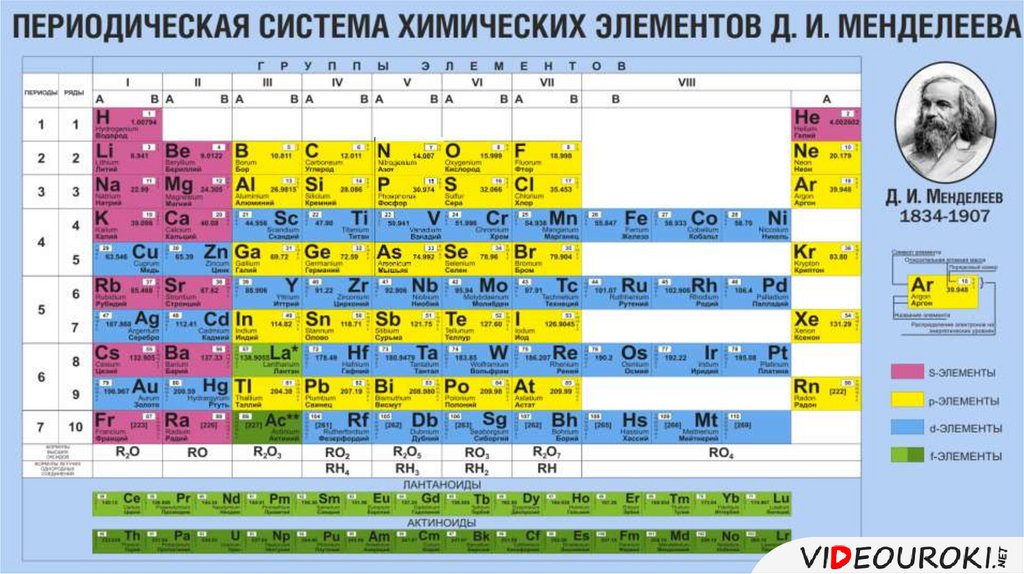
В таблице Менделеева появились новые названия
Наука 10773
Поделиться
Торжественная церемония наименования двух новых химических элементов состоялась в среду в Центральном доме ученых РАН. 114-му присвоено имя флеровий, а 116-му — ливерморий. Оба были синтезированы около десяти лет назад физиками из подмосковной Дубны.
Элемент под номером 114 был получен в 2000 году путем бомбардировки на циклотроне мишени из плутония-242 ядрами кальция-48, а 116-й элемент — в 2004 году в реакции кальция-48 и кюрия-245. Оба эксперимента проводили исследователи Объединенного института ядерных исследований, а точнее, ученые Лаборатории ядерных реакций имени Флерова под руководством академика Юрия Оганесяна. После подтверждения результатов другими независимыми лабораториями физикам дали почетное право присвоить своим элементам имена. В итоге 114-й назвали в честь академика Флёрова, а 116-й — в честь Ливерморской национальной лаборатории (США), специалисты которой помогали российским коллегам, поставляя им для опыта тяжелые радиоактивные элементы.
Как пояснили в РАН, на официальную церемонию съехались участники экспериментов по синтезу новых элементов, руководители РАН, представители Минобрнауки РФ, мэрии Москвы и Московской области, а также мэрии Ливермора. Сами «крестины» новых элементов прошли в виде информационного заседания, на котором вспомнили, как они были получены, кем подтверждены. С этого момента все вновь выходящие из печати таблицы Менделеева будут содержать названия «флеровий» и «ливерморий». Теперь на очереди — закрепление в таблице Менделеева очередных сверхтяжелых элементов, также открытых в Дубне: 113-го,115-го,117-го и 118-го.
С этого момента все вновь выходящие из печати таблицы Менделеева будут содержать названия «флеровий» и «ливерморий». Теперь на очереди — закрепление в таблице Менделеева очередных сверхтяжелых элементов, также открытых в Дубне: 113-го,115-го,117-го и 118-го.
Подписаться
Авторы:
- Наталья Веденеева
Что еще почитать
Что почитать:Ещё материалы
В регионах
Полиция задержала 50 девушек в красном на петрозаводской площади Кирова.
 ФОТО
ФОТОФото 24572
КарелияИрина Стафеева
Жительницы Улан-Удэ становятся проститутками ради уплаты долгов и помощи близким
7009
Улан-УдэРоксана Родионова
«Надо настраиваться»: стилист в Улан-Удэ предсказала возвращение моды нулевых годов
Фото 4225
Улан-УдэСэсэг Жигжитова
Костромские проблемы: в наших лесах исчезли грибы
3813
КостромаНачальник свердловского ТУ Росимущества Сергей Зубенко с молчаливого согласия федерального руководителя Вадима Яковенко тормозит развитие строительной отрасли в Екатеринбурге
Фото 3299
ЕкатеринбургМаксим Бойков
В Екатеринбурге обсудили, как повысить привлекательность казачества
Фото 2355
ЕкатеринбургВладимир Кусков
В регионах:Ещё материалы
Закон Менделеева – прообраз устройства Вселенной
В 2019 году весь мир отмечал знаковый для всего человечества 150 летний юбилей величайшего открытия фундаментального закона природы – закона периодичности свойств в системе химических элементов. Этот закон является волшебным ключом для понимания устройства мира: макрокосмического, мира, в котором мы живём, и микромира.
Этот закон является волшебным ключом для понимания устройства мира: макрокосмического, мира, в котором мы живём, и микромира.
Самыми загадочными химическими элементами являются водород и гелий, из которых состоит весь видимый нам космос на 88,6% и 11,3% соответственно. Доля других химических элементов составляет всего лишь 0,1%.
Именно с месторасположением водорода в таблице у Д.И. Менделеева были самые большие проблемы. Даже сегодня, спустя 150 лет, в разных научных школах водород располагают в разных графических комбинациях. А ведь именно с водорода началось образование не только нашей Солнечной системы, но и всего остального видимого нам бесконечного множества звёзд, их спутников, планет и других космических объектов.
Водород состоит из двух стабильных изотопов: наиболее распространённого протия (99,984%), содержащего только один протон, и дейтерия (0,0156%), имеющего кроме протона ещё и нейтрон – а также радиоактивного трития с периодом полураспада 12,32, содержащего, кроме протона, уже два нейтрона. Кроме того, известен водород как продукт искусственных ядерных реакций, с тремя, четырьмя, пятью и шестью нейтронами, которые являются очень короткоживущими изотопами. Именно водород – источник термоядерных процессов, происходящих на нашем Солнце, других звёздах и планетах. Для гелия известно на данный момент всего 8 изотопов, но только два из них стабильны.
Кроме того, известен водород как продукт искусственных ядерных реакций, с тремя, четырьмя, пятью и шестью нейтронами, которые являются очень короткоживущими изотопами. Именно водород – источник термоядерных процессов, происходящих на нашем Солнце, других звёздах и планетах. Для гелия известно на данный момент всего 8 изотопов, но только два из них стабильны.
Самым таинственным веществом, благодаря которому появилась жизнь на Земле и, возможно, других планетах, является вода. При наличии изотопов водорода и трёх изотопов кислорода химические, физические и биологические свойства воды варьируются в очень широких пределах. Именно сочетание таких уникальных характеристик воды привело к возникновению самых разнообразных форм жизни, которые так же сложны и многообразны, как и наблюдаемый нами космос.
Чудом является не возникновение самой материи, многообразных элементов таблицы Менделеева с предсказуемыми свойствами, а то, что возникла биологическая жизнь с уникальными свойствами, возможностями самопознания – разума – и, что самое непредсказуемое – интеллекта, способного не только к познанию мира, но и к его преобразованию. «Создаётся впечатление, что кто-то всё великолепно рассчитал, прежде чем создать Вселенную», — писал лауреат Нобелевской премии по физике В. Гейзенберг.
«Создаётся впечатление, что кто-то всё великолепно рассчитал, прежде чем создать Вселенную», — писал лауреат Нобелевской премии по физике В. Гейзенберг.
Строение Вселенной строго сбалансировано и коррелирует со строиением элементов и их расположением в таблице Менделеева, которая выполняет роль путеводителя в нашем безграничном мире. Каждый элемент является своеобразной моделью небесных систем в определённой космической структуре. Не случайны и не хаотичны, как может показаться, орбиты космических объектов, их формы и конфигурации, а оптимальны по взаимному влиянию друг на друга и с ядром – центром притяжения каждой галактики. Космос – саморегулирующаяся структура звёзд и планет (аналогично ядрам и электронным орбитам определённых химических элементов) с системой оптимизации сил влияния: зарождения – развития – перестройки в новую систему, исходя из нового баланса масс и энергий взаимодействия. Это постоянно перестраивающаяся система, находящаяся в мощных электромагнитных силовых полях атомов, молекул, ядер и элементов окружающего мира, которая обладает способностью к самоорганизации, саморегулируемости в гигантском пространстве Космоса, аналогично процессам химического превращения одних веществ в другие в различных фазовых состояниях.
Отдельные составляющие пространства космоса могут быть и плоские, и сферические, так же, как и различные по строению атомы химических элементов: от простых, таких как водород, гелий, литий, до самых сложных трансурановых элементов, стабильных, радиоактивных и квазистабильных, превращающихся в более лёгкие элементы.
Закон периодичности свойств химических элементов Д.И. Менделеева – это прообраз строения всего галактического мира. Строение элементов носит концептуальный характер, отражающий глобальную картину мироздания. Наблюдаемые в космосе галактики есть ни что иное, как различные элементы периодической таблицы во всём их разнообразии. Самый простой пример – базовый элемент всего, что есть: водород, который нами изучен недостаточно. Это и протий, и дейтерий, и тритий с орто- и парасостояниями. В зависимости от температуры и давления водород может находиться в газообразном, жидком и твёрдом состояниях.
Водород является основой синтеза гелия. Принимая ещё один протон, водород при высоких температурах превращается в гелий и служит практически неисчерпаемым источником для протекания термоядерных процессов, наблюдаемых на нашей звезде. Солнце в процессе своего горения выделяет гигантское количество энергии в виде квантов света всего спектра. Этот процесс очень похож на радиоактивный распад трития, которого на Земле не очень много, но он никогда не исчерпывается, постоянно генерируясь в ядре Земли.
Солнце в процессе своего горения выделяет гигантское количество энергии в виде квантов света всего спектра. Этот процесс очень похож на радиоактивный распад трития, которого на Земле не очень много, но он никогда не исчерпывается, постоянно генерируясь в ядре Земли.
Сам по себе электрон является бесконечно сложной системой. Непознаваемый до конца, он может быть и частицей, и волной. Каждая материальная субстанция представляет собой бесконечно сложное соединение, имеющее электромагнитное строение. Все элементарные частицы, атомы, молекулы обладают зарядом и находятся в постоянном движении, а следовательно, генерируют электромагнитное поле.
Элементарные частицы – электроны, протоны, нейтроны – образовали уникальное и самое распространённое триединое вещество в космосе – водород: протий-дейтерий-тритий! Это и есть базовый строительный материал для синтеза всех элементов таблицы Менделеева. Именно из водорода, у которого самое оптимальное ядро – нуклон, — образовалась наша Солнечная система.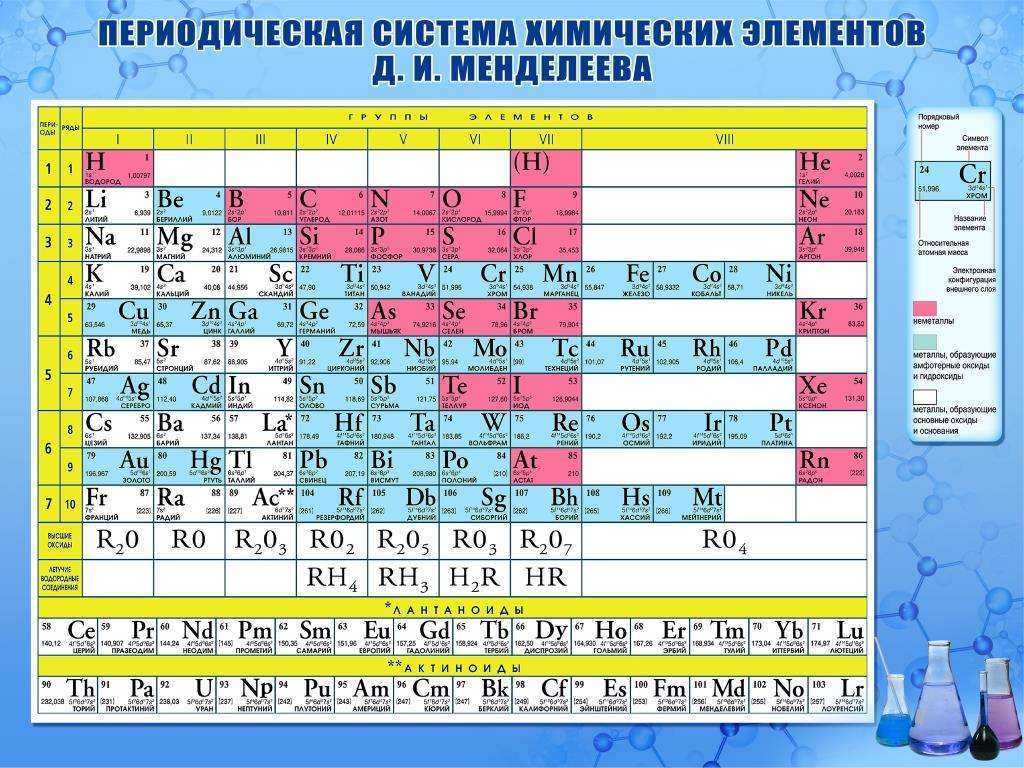 Ядро водорода – не просто протон и нейтрон, это и есть самое стабильное образование материи в космосе.
Ядро водорода – не просто протон и нейтрон, это и есть самое стабильное образование материи в космосе.
Несмотря на то, что период полураспада трития составляет около 12,32 года, его концентрация на нашей планете оставалась постоянной тысячи лет, а повысилась она за последние полвека только за счёт нашей, человеческой деятельности: в основном, атомных электростанций и ядерных реакторов.
Строение водорода – это прообраз строения всей галактики. Теория большого взрыва – ни что иное, как один из эпизодов превращения одного состояния вещества в другое так же, как в теории термоядерных процессов в нашем мире. Взорвалось гигантское, по нашим меркам, скопление энергии и образовались более мелкие миры типа нашей галактики, нашей Солнечной системы.
По моему убеждению, ядра всех космических объектов состоят из твёрдого водородного нуклона, т.е. из своего рода плазмы высокой плотности, обладающей мощным магнитным полем.
Свойства ядра Солнца и всех планет имеют одинаковую природу: это мощный термоядерный реактор гигантской внутренней плотности и давления. За счёт силы гравитации он не может взорваться. Именно вокруг твёрдого ядра в жидкой мантии происходят мощные электрокинетические процессы синтеза более тяжёлых ядер элементов периодической системы. В зависимости от размеров планет, то есть, от внутренних планетных давлений и температур, формируются все химические элементы в различной пропорции и происходит ядерный синтех веществ. Поскольку все они имеют существенно большие объёмы, чем водород, происходят процессы превращения плотной энергии в более объёмные вещества с меньшей удельной плотностью, что приводит к увеличению Солнца, Земли и всех других планет. Это естественный, нормальный процесс синтеза, когда реакции протекают с увеличением объёма полученных продуктов. На нашей планете происходили точно такие же процессы – самопроизвольное превращение одних элементов в другие, например, распад изотопов урана, который уже сейчас даёт энергию человечеству.
За счёт силы гравитации он не может взорваться. Именно вокруг твёрдого ядра в жидкой мантии происходят мощные электрокинетические процессы синтеза более тяжёлых ядер элементов периодической системы. В зависимости от размеров планет, то есть, от внутренних планетных давлений и температур, формируются все химические элементы в различной пропорции и происходит ядерный синтех веществ. Поскольку все они имеют существенно большие объёмы, чем водород, происходят процессы превращения плотной энергии в более объёмные вещества с меньшей удельной плотностью, что приводит к увеличению Солнца, Земли и всех других планет. Это естественный, нормальный процесс синтеза, когда реакции протекают с увеличением объёма полученных продуктов. На нашей планете происходили точно такие же процессы – самопроизвольное превращение одних элементов в другие, например, распад изотопов урана, который уже сейчас даёт энергию человечеству.
Внутри и вне нас существует микромир, параллельно с нами – макромир, и в воздухе, и в воде, и под землёй. Естественно, мы, жители планеты Земля, не уникальное явление в космосе. Могут быть и другие миры с подобным нашему интеллектом – как более, так и менее развитым. Но принципиально важно другое: все миры, живые и неживые (с нашей точки зрения) должны иметь одну и ту же материальную основу – только элементы периодической системы Менделеева, которых известно всего 118 (в том числе искусственно полученных).
Естественно, мы, жители планеты Земля, не уникальное явление в космосе. Могут быть и другие миры с подобным нашему интеллектом – как более, так и менее развитым. Но принципиально важно другое: все миры, живые и неживые (с нашей точки зрения) должны иметь одну и ту же материальную основу – только элементы периодической системы Менделеева, которых известно всего 118 (в том числе искусственно полученных).
Следует ещё раз подчеркнуть, что базой для синтеза всех элементов служит водород, из которого состоит всё космическое пространство. Происходит обычный ядерный и термоядерный синтез элементов внутри звёздных и планетарных образований. Благодаря мощным электромагнитным силам формируются твёрдое ядро, жидкая мантия, твёрдая оболочка: так образуется, например, углерод – ядро, электронная оболочка и частичка твёрдого вещества с аморфной или кристаллической решёткой. Одно из самых удивительных веществ, которое обнаружено почти на всех космических объектах – это вода, являющаяся универсальным растворителем и средой формирования и развития биологической жизни. Гетерофазность жидкой воды обусловлена наличием в ней кластеров. К сожалению, не создана ещё универсальная модель воды, которая могла бы объяснить все её свойства. Но только на планете Земля с содержанием примерно 150 ppm дейтерия создаются условия формирования кластеров, соизмеримых с размером живой клетки.
Гетерофазность жидкой воды обусловлена наличием в ней кластеров. К сожалению, не создана ещё универсальная модель воды, которая могла бы объяснить все её свойства. Но только на планете Земля с содержанием примерно 150 ppm дейтерия создаются условия формирования кластеров, соизмеримых с размером живой клетки.
Весь окружающий наш мир занимает некое объёмное условное пространство с определённой длиной-шириной-высотой. Обычно мы считаем его трёхмерным, опуская четвёртый фактор: время. Оно носит условный характер и не является постоянной величиной – как и в знаменитом уравнении Эйнштейна, где энергия любого вещества есть функция массы и скорости света, где все три компонента переменны и являются функцией времени. В скрытом виде она определяет скорость света, которая, в свою очередь, зависит от среды, где эта скорость измеряется.
Введенный В. Гейзенбергом и Н. Бором принцип неопределённости изменил все наши представления о мире, который мы можем рассматривать в качестве как скопления материальных частиц, так и волн. В постулировании корпускулярно-волнового состояния и заключаются основы общей теории относительности Эйнштейна. Но ровно 100 лет назад физик Теодор Калуца предложил рассматривать теорию относительности в пятимерном пространстве. Что же колеблется в космическом пространстве, если оно представляет собой электромагнитные колебания, которыми объясняются законы и всемирного тяготения, и колебательных ритмов, и мгновенных взаимодействий?!
В постулировании корпускулярно-волнового состояния и заключаются основы общей теории относительности Эйнштейна. Но ровно 100 лет назад физик Теодор Калуца предложил рассматривать теорию относительности в пятимерном пространстве. Что же колеблется в космическом пространстве, если оно представляет собой электромагнитные колебания, которыми объясняются законы и всемирного тяготения, и колебательных ритмов, и мгновенных взаимодействий?!
Все эти космические законы можно объединить в единый Закон взаимосвязанных превращений: энергия – материя – волна – поле – заряд – электромагнитные взаимодействия — …
Это и есть процесс превращения энергии в массу веществ в соответствии с основополагающим уравнением Эйнштейна. Потому за время существования Солнечной системы происходит увеличение объёмов и Солнца, и всех её планет; протуберанцы на Солнце и вулканическая деятельность Земли и других планет нашей системы.
Многомерный мир, предсказанный С. Хокингом и др. так же реален, как и наш (микрофлора, бактериофаги, одно- и многоклеточные организмы, включая человеческий), и функционирует по общим принципам и законам.
Как прототипом наших космических объектов являются атомы, молекулы и разнообразные элементы, состоящие из стабильных и нестабильных ядер с их электронными оболочками, вращающимися по различным орбитам с электромагнитными взаимодействиями, так и таблица Д.И. Менделеева может быть рассмотрена вглубь от устройства и свойств ядер с их зоной стабильности нуклонов до крупных галактических образований, их взрывов и синтезов межгалактических систем.
Физикам-теоретикам следует искать общность наблюдаемых закономерностей от чёрных дыр, где происходит синтез новых гигантских (с нашей точки зрения) образований, так и появление сверхновых звёзд и галактик, а мы – всего лишь точка-наблюдатель в микро- и макросистемах. Новых по природе элементов и элементарных частиц не будет, все законы мироздания укладываются в один закон периодичности свойств элементов Д.И. Менделеева. Он открыл этот закон и дал нам возможность пользоваться им с умом и пониманием – великим Законом биологического разума и познания мира, в котором мы живём, предсказывания как новых планет, так и не открытых ранее элементов в периодической таблице Менделеева.
Познавая историю происхождения и развития жизни на Земле, мы сможем понять и будущее нашей жизни, и возможность встречи с другими цивилизациями, которые, вероятно, уже были на нашей планете и оставили следы своего пребывания в виде артефактов и посланий Богов, описанных в Библиях.
Многоуровневый мир в бесконечно многомерных измерениях, особенно в духовном понимании – это совершенно новое качество материи: от неживого к живому и далее к духовному уровню. И в этом величие Д.И. Менделеева! Когда он открыл закон периодичности, было известно только 63 элемента, с тех пор таблица увеличилась почти вдвое: на сегодня известно 118. От достаточно небольшого количества элементов – к бесконечным комбинациям материи, как неорганической-органической до живой – и духовного состояния.
Для перехода от неживой к живой материи необходим был главный и ключевой момент: среда обитания. Это – Вода, совершенно уникальное творение природы. Только вода может одновременно находиться в трёх фазовых состояниях (жидком, твёрдом и газообразном) с бесконечным количеством всевозможных аномалий: химических, физических, биологических и функциональных, нарушающих общепринятые законы природы.
Аналогичными свойствами обладают и соединения водорода с углеродом: углеводороды, совместимые только с водой. Сверхуникальные композиции в природе – соединения водорода с кислородом и углеродом. С них началась новая эпоха изменений на Земле и в Космосе в целом.
Расширяющаяся Вселенная, которую фиксируют астрономы, свидетельствует как о едином принципе развития материального мира, так и об увеличении объёма и Солнца, и Земли, и других космических объектов. Вселенная, которую мы видим, не имеет ни начала, ни конца – жизнь продолжается.
Первое самое крупное вымирание биоты произошло в ордовикско-силлурийский период. Прокариоты – безъядерные клетки – дали начало новой биологической жизни на нашей планете. Цианобактерии начали своё развитие в восстановительной атмосфере Земли, а затем в атмосфере кислорода началась новая эпоха: появились эукариоты. Значительное количество кислорода в атмосфере возникло за счёт его синтеза внутри Земли, а также в результате фотокаталитического разложения воды под действием ультрафиолетового солнечного света в присутствии ионов – например, железа в качестве катализатора, и других компонентов и композитов. С этого момента начали бурно развиваться процессы кислородного фотосинтеза, появились эукариотные клетки и многоклеточные организмы.
С этого момента начали бурно развиваться процессы кислородного фотосинтеза, появились эукариотные клетки и многоклеточные организмы.
Таким образом, историю Земли можно разбить на этапы. Катархей и архей причисляют к докислородному этапу. Затем начинается протерозойская эра бурного развития водной и надводной биоты. Временной фактор здесь условен, так как время исчисляется в «годах» относительно периода вращения Земли вокруг Солнца. Но известно, что в тот же период (условно 4,5 млрд. лет назад) Земля делала оборот вокруг своей оси за 6 часов, а спустя некоторое время уже за 15 часов, затем за примерно 22 часа, сейчас в сутках 24 часа, через определённое количество лет вращение будет происходить в течение приблизительно 30 часов. Этот факт говорит о том, что объём Земли постоянно увеличивается вместе с её массой. За этот промежуток времени Земля увеличилась примерно на 2/3 от своего прежнего размера, о чём свидетельствует раздвигание материков.
Солнце также меняет свои параметры. Оно зажглось самопроизвольно при достижении некоторого критического давления и самовозгорания водорода. То, что мы называем термоядерным процессом с постепенным выделением гигантской энергии – самоуправляемый термоядерный синтез. Но благодаря гигантской силе притяжения в центре Солнца оно будет гореть примерно столько же, сколько уже горит, расширяясь в объёме. Примерно в тот же период началась термоядерная реакция и в центре Земли, где твёрдое её ядро – это сгусток протонов и нейтронов, порождающий элементы, из которых состоит наша Земля. Эти процессы являются нормальным, энергетически обусловленным геологическим явлением самозарождения и усовершенствования, синтеза неорганической и органической материй.
Оно зажглось самопроизвольно при достижении некоторого критического давления и самовозгорания водорода. То, что мы называем термоядерным процессом с постепенным выделением гигантской энергии – самоуправляемый термоядерный синтез. Но благодаря гигантской силе притяжения в центре Солнца оно будет гореть примерно столько же, сколько уже горит, расширяясь в объёме. Примерно в тот же период началась термоядерная реакция и в центре Земли, где твёрдое её ядро – это сгусток протонов и нейтронов, порождающий элементы, из которых состоит наша Земля. Эти процессы являются нормальным, энергетически обусловленным геологическим явлением самозарождения и усовершенствования, синтеза неорганической и органической материй.
Катархейский и следующий за ним архейский периоды – это время возникновения Земли как планеты, превращения космической энергии в водород и его превращения в последующие элементы.
Отсюда логически вытекает вывод о том, что все космические объекты начинают свою историю от скопления водорода в определённых электромагнитных геоцентрических силовых линиях в космическом пространстве, а затем, согласно закону Менделеева, происходит космический синтез последующих элементов – He, С, О, Ne, Mg, Si, S, Ar, Ca. На долю таких изотопов приходится 86,81% массы земной коры.
На долю таких изотопов приходится 86,81% массы земной коры.
Когда учёные впервые расшифровали спектры Солнца и Земли, те оказались одинаковыми по составу и свойствам. Это был тот единственный случай, когда анализ спектров выявил неизвестный на то время элемент на Земле, получивший название гелий (от греческого слова «гелиос» — Солнце).
Строение Вселенной не случайно и не хаотично, оно строго сбалансировано по силам влияния. Орбиты космических объектов, так же, как и электронные орбиты элементов таблицы Менделеева, не случайны, а оптимальны по взаимным влияниям. Теория «Большого взрыва» эфемерна. Нет в мире начала и нет в мире конца, нет точки отсчёта, а есть непрерывный процесс превращения энергии в материю любой формы её существования и наоборот. Выдающееся предвидение об устройстве мира высказал В.И. Вернадский: в начале прошлого века он отмечал, что «радиоактивный распад химических элементов – превращение одного изотопа в другой – есть не частный случай, а общее свойство земного вещества. Все химические элементы Земли находятся в радиоактивном распаде. Это основной физико-химический процесс, лежащий в основе всех геологических процессов».
Все химические элементы Земли находятся в радиоактивном распаде. Это основной физико-химический процесс, лежащий в основе всех геологических процессов».
Синтез химических элементов в недрах звёзд продолжается и поныне, а некоторые элементы – например, технеций, прочто-напросто на Земле «закончились». А прометия пока на нашли ни в космосе, ни на Земле, он синтезирован искусственно.
Процесс синтеза-распада непрерывно продолжается. В биосфере Земли происходит синтех радиоактивных и всех других элементов таблицы Менделеева как вторичный процесс после их образования в твёрдом ядре (как квазижидком ядерном реакторе) при температурах порядка 6000 градусов.
Аналогичные процессы протекают во всех других объектах нашей галактики. Только на нашей звезде – Солнце, где температура ядерного синтеза достигает миллиона градусов, из плазмы образуется энергия света. Этот процесс и является тем источником энергии, из которого рождаются все известные нам химические элементы. Кроме огромного количества элементарных частиц, которыми заполнена наша галактика, других веществ в космосе нет и быть не может.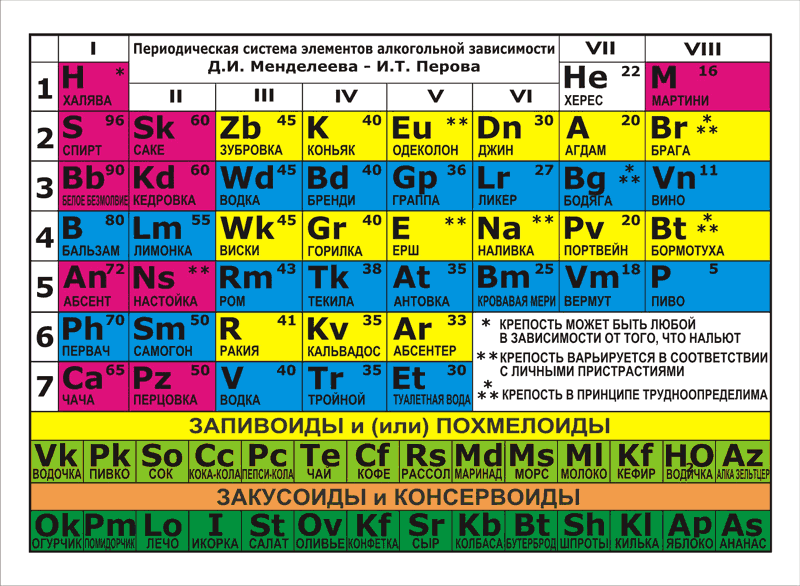 Это и есть процесс эволюции не только на нашей Земле, но и во всём космосе. Именно Закон превращения энергии в материальное вещество будет приводить к увеличеиню массы и объёма вещества, расширению Земли до тех пор, пока сила притяжения-гравитации не сравняется с силой отталкивания. Тогда произойдёт взрыв и Солнца, и его спутников, и начнётся новый этап строительства иного мира. Процесс этот бесконечен.
Это и есть процесс эволюции не только на нашей Земле, но и во всём космосе. Именно Закон превращения энергии в материальное вещество будет приводить к увеличеиню массы и объёма вещества, расширению Земли до тех пор, пока сила притяжения-гравитации не сравняется с силой отталкивания. Тогда произойдёт взрыв и Солнца, и его спутников, и начнётся новый этап строительства иного мира. Процесс этот бесконечен.
История нашей Земли свидетельствует о наличии механизма её пульсационного расширения. Оценить направление процесса и меру его хаотичности может только одна термодинамическая характеристика – энтропия. Именно направление изменения энтропии свидетельствует о пути процесса либо от хаоса к упорядоченной структуре, либо в обратном направлении: от чётко организованной структуры к хаосу.
Впервые в моей диссертационной работе «Физико-химические характеристики поверхности слоистых алюмосиликатов и их каталитические свойства в реакциях кислотно-основного типа» был сформулирован третий закон химической кинетики – закон компенсационного эффекта. Установлена количественная взаимосвязь между кинетическими характеристиками химических процессов и их термодинамическими параметрами. Именно изменения энтропии процесса вносят решающий вклад во все энергетические характеристики превращения одних веществ в другие. Сущность всех химических процессов, проистекающих на Земле, согласно законам неравновесной термодинамики, открытых И.Р. Пригожиным во «Введении в термодинамику необратимых процессов», состоит из бесконечной последовательности процессов самоорганизации. Благодаря этим законам могут спонтанно возникать новые типы структур, характеризующиеся переходом от хаоса и беспорядка к порядку и строгой организации.
Установлена количественная взаимосвязь между кинетическими характеристиками химических процессов и их термодинамическими параметрами. Именно изменения энтропии процесса вносят решающий вклад во все энергетические характеристики превращения одних веществ в другие. Сущность всех химических процессов, проистекающих на Земле, согласно законам неравновесной термодинамики, открытых И.Р. Пригожиным во «Введении в термодинамику необратимых процессов», состоит из бесконечной последовательности процессов самоорганизации. Благодаря этим законам могут спонтанно возникать новые типы структур, характеризующиеся переходом от хаоса и беспорядка к порядку и строгой организации.
Космос – это саморегулирующаяся структура с системой оптимизации сил влияния – рождения – развития – перестройки в новую систему, исходя из нового баланса масс и энергии взаимодействия. Это постоянно перестраивающаяся неисчезающая система, саморегулируемая в гигантском объёме.
Интеллект порождает новое её состояние: духовность, которая присуща только высшим формам интеллектуальной деятельности – её проявления и реализации уровня коллективного разума.
Божественность – это высшая форма интеллекта, его функция. Бог – это воплощение высшей формы духовной жизни.
Таблица Менделеева online
| H | 1 | 1 |
| 1.00794±7 | ||
| 1s1 | ||
| Водород | ||
| He | 2 | 2 |
| 4.002602±2 | ||
| 1s2 | ||
| Гелий | ||
| Li | 3 | 1 2 |
6. 941±2 941±2 |
||
| 2s1 | ||
| Литий | ||
| Be | 4 | 2 2 |
| 9.01218±1 | ||
| 2s2 | ||
| Бериллий | ||
| B | 5 | 3 2 |
| 10.811±5 | ||
| 2s22p1 | ||
| Бор | ||
| C | 6 | 4 2 |
12. 011±1 011±1 |
||
| 2s22p2 | ||
| Углерод | ||
| N | 7 | 5 2 |
| 14.0067±1 | ||
| 2s22p3 | ||
| Азот | ||
| O | 8 | 6 2 |
| 15.9994±3 | ||
| 2s22p4 | ||
| Кислород | ||
| F | 9 | 7 2 |
18. 998403±1 998403±1 |
||
| 2s22p5 | ||
| Фтор | ||
| Ne | 10 | 8 2 |
| 20.179±1 | ||
| 2s22p6 | ||
| Неон | ||
Реклама
| Na | 11 | 1 8 2 |
| 22.98977±1 | ||
| 3s1 | ||
| Натрий | ||
| Mg | 12 | 2 8 2 |
24. 305±1 305±1 |
||
| 3s2 | ||
| Магний | ||
| Al | 13 | 3 8 2 |
| 26.98154±1 | ||
| 3s23p1 | ||
| Алюминий | ||
| Si | 14 | 4 8 2 |
| 28.0855±3 | ||
| 3s23p2 | ||
| Кремний | ||
| P | 15 | 5 8 2 |
30. 97376±1 97376±1 |
||
| 3s23p3 | ||
| Фосфор | ||
| S | 16 | 6 8 2 |
| 32.066±6 | ||
| 3s23p4 | ||
| Сера | ||
| Cl | 17 | 7 8 2 |
| 35.453±1 | ||
| 3s23p5 | ||
| Хлор | ||
| Ar | 18 | 8 8 2 |
39. 948±1 948±1 |
||
| 3s23p6 | ||
| Аргон | ||
| K | 19 | 1 8 8 2 |
| 39.0983±1 | ||
| 4s1 | ||
| Калий | ||
| Ca | 20 | 2 8 8 2 |
| 40.078±4 | ||
| 4s2 | ||
| Кальций | ||
| 2 9 8 2 |
21 | Sc |
44. 95591±1 95591±1 |
||
| 3d14s2 | ||
| Скандий | ||
| 2 10 8 2 |
22 | Ti |
| 47.88±3 | ||
| 3d24s2 | ||
| Титан | ||
| 2 11 8 2 |
23 | V |
| 50.9415±1 | ||
| 3d34s2 | ||
| Ванадий | ||
| 1 13 8 2 |
24 | Cr |
51. 9961±6 9961±6 |
||
| 3d54s1 | ||
| Хром | ||
| 2 13 8 2 |
25 | Mn |
| 54.9380±1 | ||
| 3d54s2 | ||
| Марганец | ||
| 2 14 8 2 |
26 | Fe |
| 55.847±3 | ||
| 3d64s2 | ||
| Железо | ||
| 2 15 8 2 |
27 | Co |
58. 9332±1 9332±1 |
||
| 3d74s2 | ||
| Кобальт | ||
| 2 16 8 2 |
28 | Ni |
| 58.69±1 | ||
| 3d84s2 | ||
| Никель | ||
| 1 18 8 2 |
29 | Cu |
| 63.546±3 | ||
| 3d104s1 | ||
| Медь | ||
| 2 18 8 2 |
30 | Zn |
65. 39±2 39±2 |
||
| 3d104s2 | ||
| Цинк | ||
| Ga | 31 | 3 18 8 2 |
| 69.723±4 | ||
| 4s24p1 | ||
| Галлий | ||
| Ge | 32 | 4 18 8 2 |
| 72.59±3 | ||
| 4s24p2 | ||
| Германий | ||
| As | 33 | 5 18 8 2 |
74. 9216±1 9216±1 |
||
| 4s24p3 | ||
| Мышьяк | ||
| Se | 34 | 6 18 8 2 |
| 78.96±3 | ||
| 4s24p4 | ||
| Селен | ||
| Br | 35 | 7 18 8 2 |
| 79.904±1 | ||
| 4s24p5 | ||
| Бром | ||
| Kr | 36 | 8 18 8 2 |
83. 80±1 80±1 |
||
| 4s24p6 | ||
| Криптон | ||
| Rb | 37 | 1 8 18 8 2 |
| 85.4678±3 | ||
| 5s1 | ||
| Рубидий | ||
| Sr | 38 | 2 8 18 8 2 |
| 87,62±1 | ||
| 5s2 | ||
| Стронций | ||
| 2 9 18 8 2 |
39 | Y |
88. 9059±1 9059±1 |
||
| 4d15s2 | ||
| Иттрий | ||
| 2 10 18 8 2 |
40 | Zr |
| 91.224±2 | ||
| 4d25s2 | ||
| Цирконий | ||
| 1 12 18 8 2 |
41 | Nb |
| 92.9064±1 | ||
| 4d45s1 | ||
| Ниобий | ||
| 1 13 18 8 2 |
42 | Mo |
95. 94±1 94±1 |
||
| 4d55s1 | ||
| Молибден | ||
| 2 13 18 8 2 |
43 | Tc |
| 97.9072 | ||
| 4d55s2 | ||
| Технеций | ||
| 1 15 18 8 2 |
44 | Ru |
| 101.07±2 | ||
| 4d75s1 | ||
| Рутений | ||
| 1 16 18 8 2 |
45 | Rh |
102. 9055±1 9055±1 |
||
| 4d85s1 | ||
| Родий | ||
| 0 18 18 8 2 |
46 | Pd |
| 106.42±1 | ||
| 4d105s0 | ||
| Палладий | ||
| 1 18 18 8 2 |
47 | Ag |
| 107.8682±3 | ||
| 4d105s1 | ||
| Серебро | ||
| 2 18 18 8 2 |
48 | Cd |
112. 41±1 41±1 |
||
| 4d105s2 | ||
| Кадмий | ||
| In | 49 | 3 18 18 8 2 |
| 114.82±1 | ||
| 5s25p1 | ||
| Индий | ||
| Sn | 50 | 4 18 18 8 2 |
| 118.710±7 | ||
| 5s25p2 | ||
| Олово | ||
| Sb | 51 | 5 18 18 8 2 |
121. 75±3 75±3 |
||
| 5s25p3 | ||
| Сурьма | ||
| Te | 52 | 6 18 18 8 2 |
| 127.60±3 | ||
| 5s25p4 | ||
| Теллур | ||
| I | 53 | 7 18 18 8 2 |
| 126.9045±1 | ||
| 5s25p5 | ||
| Иод | ||
| Xe | 54 | 8 18 18 8 2 |
131. 29±3 29±3 |
||
| 5s25p6 | ||
| Ксенон | ||
| Cs | 55 | 1 8 18 18 8 2 |
| 132.9054±1 | ||
| 6s1 | ||
| Цезий | ||
| Ba | 56 | 2 8 18 18 8 2 |
| 137.33±1 | ||
| 6s2 | ||
| Барий | ||
| 2 9 18 18 8 2 |
57 | La* |
138. 9055±3 9055±3 |
||
| 5d16s2 | ||
| Лантан | ||
| 2 10 32 18 8 2 |
72 | Hf |
| 178.49±3 | ||
| 5d26s2 | ||
| Гафний | ||
| 2 11 32 18 8 2 |
73 | Ta |
| 180.9479±1 | ||
| 5d36s2 | ||
| Тантал | ||
| 2 12 32 18 8 2 |
74 | W |
183. 85±3 85±3 |
||
| 5d46s2 | ||
| Вольфрам | ||
| 2 13 32 18 8 2 |
75 | Re |
| 186.207±1 | ||
| 5d56s2 | ||
| Рений | ||
| 2 14 32 18 8 2 |
76 | Os |
| 190.2±1 | ||
| 5d66s2 | ||
| Осмий | ||
| 2 15 32 18 8 2 |
77 | Ir |
192. 22±3 22±3 |
||
| 5d76s2 | ||
| Иридий | ||
| 1 17 32 18 8 2 |
78 | Pt |
| 195.08±3 | ||
| 5d96s1 | ||
| Платина | ||
| 1 18 32 18 8 2 |
79 | Au |
| 196.9665±1 | ||
| 5d106s1 | ||
| Золото | ||
| 2 18 32 18 8 2 |
80 | Hg |
200. 59±3 59±3 |
||
| 5d106s2 | ||
| Ртуть | ||
| Tl | 81 | 3 18 32 18 18 8 2 |
| 204.383±1 | ||
| 6s26p1 | ||
| Таллий | ||
| Pb | 82 | 4 18 32 18 18 8 2 |
| 207.2±1 | ||
| 6s26p2 | ||
| Свинец | ||
| Bi | 83 | 5 18 32 18 18 8 2 |
208. 9804±1 9804±1 |
||
| 6s26p3 | ||
| Висмут | ||
| Po | 84 | 6 18 32 18 18 8 2 |
| 208.9824 | ||
| 6s26p4 | ||
| Полоний | ||
| At | 85 | 7 18 32 18 18 8 2 |
| 209.9871 | ||
| 6s26p5 | ||
| Астат | ||
| Rn | 86 | 8 18 32 18 18 8 2 |
222. 0176 0176 |
||
| 6s26p6 | ||
| Радон | ||
| Fr | 87 | 1 8 18 32 18 18 8 2 |
| 223.0197 | ||
| 7s1 | ||
| Франций | ||
| Ra | 88 | 2 8 18 32 18 18 8 2 |
| 226.0254 | ||
| 7s2 | ||
| Радий | ||
| 2 8 18 32 18 8 2 |
89 | Ac** |
227. 0278 0278 |
||
| 6d17s2 | ||
| Актиний | ||
| 2 10 32 32 18 8 2 |
104 | Rf |
| [261] | ||
| 6d27s2 | ||
| Резерфордий | ||
| 2 11 32 32 18 8 2 |
105 | Db |
| [262] | ||
| 6d37s2 | ||
| Дубний | ||
| 2 12 32 32 18 8 2 |
106 | Sg |
| [263] | ||
| 6d47s2 | ||
| Сиборгий | ||
| 2 13 32 32 18 8 2 |
107 | Bh |
| [262] | ||
| 6d57s2 | ||
| Борий | ||
| 2 14 32 32 18 8 2 |
108 | Hs |
| [265] | ||
| 6d67s2 | ||
| Хассий | ||
| 2 15 32 32 18 8 2 |
109 | Mt |
| [266] | ||
| 6d77s2 | ||
| Мейтнерий | ||
| 1 17 32 32 18 8 2 |
110 | Ds |
| (281) | ||
| 5f146d97s1 | ||
| Дармштадтий | ||
| 1 18 32 32 18 8 2 |
111 | Rg |
| (281) | ||
| 5f146d107s1 | ||
| Рентгений | ||
| 112 | Cn | |
| 285 | ||
| 5f146d107s2 | ||
| Коперниций | ||
| Nh | 113 | |
| (286) | ||
| 5f146d107s27p1 | ||
| Нихоний | ||
| Fl | 114 | |
| 289 | ||
| 5f146d107s27p2 | ||
| Флеровий | ||
| Mc | 115 | |
| 289 | ||
| 5f146d107s27p3 | ||
| Московий | ||
| Lv | 116 | 6 18 32 32 18 8 2 |
| 293 | ||
| 5f146d107s27p4 | ||
| Ливерморий | ||
| Ts | 117 | 2 8 18 32 32 18 7 |
| [294] | ||
| 5f146d107s27p5 | ||
| Теннессин | ||
| Og | 118 | |
| [294] | ||
| 5f146d107s27p6 | ||
| Оганесон | ||
Высшие оксиды
Летучие водородные соединения
Лантаноиды
| Ce | 58 | 2 9 19 18 8 2 |
140. 12±1 12±1 |
||
| 4f15d16s2 | ||
| Церий | ||
| Pr | 59 | 2 8 21 18 8 2 |
| 140.9077±1 | ||
| 4f36s2 | ||
| Празеодим | ||
| Nd | 60 | 2 8 22 18 8 2 |
| 144.24±3 | ||
| 4f46s2 | ||
| Неодим | ||
| Pm | 61 | 2 8 23 18 8 2 |
144. 9128 9128 |
||
| 4f56s2 | ||
| Прометий | ||
| Sm | 62 | 2 8 24 18 8 2 |
| 150.36±3 | ||
| 4f66s2 | ||
| Самарий | ||
| Eu | 63 | 2 8 25 18 8 2 |
| 151.96±1 | ||
| 4f76s2 | ||
| Европий | ||
| Gd | 64 | 2 9 25 18 8 2 |
157. 25±3 25±3 |
||
| 4f75d16s2 | ||
| Гадолиний | ||
| Tb | 65 | 2 8 27 18 8 2 |
| 159.9254±1 | ||
| 4f96s2 | ||
| Тербий | ||
| Dy | 66 | 2 8 28 18 8 2 |
| 162.50±3 | ||
| 4f106s2 | ||
| Диспрозий | ||
| Ho | 67 | 2 8 29 18 8 2 |
164. 9304±1 9304±1 |
||
| 4f116s2 | ||
| Гольмий | ||
| Er | 68 | 2 8 30 18 8 2 |
| 167.26±3 | ||
| 4f126s2 | ||
| Эрбий | ||
| Tm | 69 | 2 8 31 18 8 2 |
| 168.9342±1 | ||
| 4f136s2 | ||
| Тулий | ||
| Yb | 70 | 2 8 32 18 8 2 |
173. 04±3 04±3 |
||
| 4f146s2 | ||
| Иттербий | ||
| Lu | 71 | 2 9 32 18 8 2 |
| 174.967±1 | ||
| 4f145d16s2 | ||
| Лютеций | ||
Актиноиды
| Th | 90 | 2 10 18 32 18 8 2 |
| 232.0381±1 | ||
| 6d27s2 | ||
| Торий | ||
| Pa | 91 | 2 9 20 32 18 8 2 |
231. 0359 0359 |
||
| 5f26d17s2 | ||
| Протактиний | ||
| U | 92 | 2 9 21 32 18 8 2 |
| 238.0289±1 | ||
| 5f36d17s2 | ||
| Уран | ||
| Np | 93 | 2 9 22 32 18 8 2 |
| 237.0482 | ||
| 5f46d17s2 | ||
| Нептуний | ||
| Pu | 94 | 2 8 24 32 18 8 2 |
244. 0642 0642 |
||
| 5f67s2 | ||
| Плутоний | ||
| Am | 95 | 2 8 25 32 18 8 2 |
| 243.0614 | ||
| 5f77s2 | ||
| Амерций | ||
| Cm | 96 | 2 9 25 32 18 8 2 |
| 247.0703 | ||
| 5f7d617s2 | ||
| Кюрий | ||
| Bk | 97 | 2 9 26 32 18 8 2 |
247. 0703 0703 |
||
| 5f8d617s2 | ||
| Берклий | ||
| Cf | 98 | 2 8 28 32 18 8 2 |
| 251.0796 | ||
| 5f107s2 | ||
| Калифорний | ||
| Es | 99 | 2 8 29 32 18 8 2 |
| 252.0828 | ||
| 5f117s2 | ||
| Эйнштейний | ||
| Fm | 100 | 2 8 30 32 18 8 2 |
257. 0951 0951 |
||
| 5f127s2 | ||
| Фермий | ||
| Md | 101 | 2 8 31 32 18 8 2 |
| 258.0986 | ||
| 5f137s2 | ||
| Менделевий | ||
| No | 102 | 2 8 32 32 18 8 2 |
| 259.1009 | ||
| 5f147s2 | ||
| Нобелий | ||
| Lr | 103 | 2 9 32 32 18 8 2 |
260. 1054 1054 |
||
| 5f146d17s2 | ||
| Лоуренсий | ||
Таблица Менделеева – изображение для печати
Таблица Менделеева, (или периодическая система химических элементов) – это таблица, которая квалифицирует
химические элементы по различным свойствам, зависящим от заряда атомного ядра. Эта система выражает, в виде
таблицы, периодический закон химических элементов, который в 1869 году открыл Русский ученый химик Д.И. Менделеев.
Самый первый вариант таблицы, был разработан Менделеевым в 1869-1871 годах, он определял зависимость свойств
химических элементов, от атомной массы (в то время это называлось атомным весом). Было предложено несколько
сотен различных вариантов изображения свойств химических элементов, от аналитических кривых графиков, и до
различных геометрических фигур. Но ученые, в конце концов, сошлись во мнении, что самым удобным вариантом будет
изображение в виде двухмерной таблицы, в которой каждый столбик будет указывать на физико-химические свойства
того или иного элемента, а периоды элементов приближенных друг к другу, будут определять строки таблицы.
Химические элементы периодической таблицы, отсортированные по атомному номеру
- Главная
- Периодическая таблица
- Элементы периодической таблицы, отсортированные по атомному номеру
Элементы периодической таблицы, отсортированные по атомному номеру
нажмите для дальнейшего названия любого химического элемента свойства, данные об окружающей среде или воздействие на здоровье.
Этот список содержит 118 химических элементов.
| The chemical elements of the periodic chart sorted by: | Atomic number | Name chemical element | Symbol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Name alphabetically | 1 | Hydrogen | H | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Атомный номер | 2 | Гелий | He | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Symbol | 3 | Lithium | Li | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Atomic Mass | 4 | Beryllium | Be | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Electronegativity | 5 | Бор | B | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Плотность | C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Melting point | 7 | Nitrogen | N | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Boiling point | 8 | Oxygen | O | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Радиус Вандервальса | 9 | Фтор | F | 3– Year of discovery | 10 | Neon | Ne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Inventor surname | 11 | Sodium | Na | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Elements in земная кора | 12 | Магний | Mg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Элементы в организме человека 1 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aluminum | Al | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Covalenz radius | 14 | Silicon | Si | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – Ionization energy | 15 | Phosphorus | P | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Для студентов и преподавателей химии: таблица справа упорядочена по атомному номеру. Первым химическим элементом является водород, а последним – унуноктий. Обратите внимание, что элементы не показывают своего естественного отношения друг к другу, как в периодической системе. Там вы можете найти металлы, полупроводники, неметаллы, инертный благородный газ (ы), галогены, лантаноиды, актиноиды (редкоземельные элементы) и переходные металлы. | 16 | Сера | S | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17 | Хлор | Cl | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 18 | Argon | Ar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19 | Potassium | K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 20 | Calcium | Ca | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 21 | Скандий | Sc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 94 | 8 8 Титан0024 Ti||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 23 | Vanadium | V | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 24 | Chromium | Cr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 25 | Manganese | Mn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 26 | Железо | Fe | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 27 | Кобальт 9 00284 9 00014 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 28 | Nickel | Ni | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 29 | Copper | Cu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 30 | Zinc | Zn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 31 | Галлий | Ga | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 32 | Германий | Ge0043 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 33 | Arsenic | As | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 34 | Selenium | Se | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 35 | Bromine | Br | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 36 | Криптон | Кр | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 37 | Рубидий | Рубидий0023| 38 | Strontium | Sr | | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 39 | Yttrium | Y | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 40 | Zirconium | Zr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 41 | Ниобий | Nb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 42 | Молибден| 0013 Mo | | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 43 | Technetium | Tc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 44 | Ruthenium | Ru | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 45 | Rhodium | Rh | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 46 | Палладий | Pd | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ag | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 48 | Cadmium | Cd | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 49 | Indium | In | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 50 | Tin | Sn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 51 | Сурьма | Sb | Tellurium | Te | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 53 | Iodine | I | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 54 | Xenon | Xe | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 55 | Цезий | Cs | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 56 | Барий | Ba3|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 57 | Lanthanum | La | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 58 | Cerium | Ce | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 59 | Praseodymium | Pr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 60 | Неодим | Nd | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 61 | Прометий4028 Pm | | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 62 | Samarium | Sm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 63 | Europium | Eu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 64 | Gadolinium | Gd | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 65 | Тербий | Tb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 67 | Holmium | Ho | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 68 | Erbium | Er | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 69 | Тулий | Tm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 70 | Иттербий | Yb | 71 | Lutetium | Lu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 72 | Hafnium | Hf | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 73 | Tantalum | Ta | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 74 | Вольфрам | Вт | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 75 | Рений
Нажмите здесь: для схемы схемы. Пожалуйста, сообщите о любой случайной ошибке в приведенной выше статистике по химическим элементам Химические элементы периодической таблицы, отсортированные по атомной массе
Элементы периодической таблицы, отсортированные по атомной массеНажмите на название любого элемента для получения дополнительной информации о химических свойствах, данных об окружающей среде или влиянии на здоровье. Этот список содержит 118 химических элементов.
Атомномические и орбитальные свойства. ] с символом атомного термина (квантовые числа)7 S 3 .
Atomic Configuration of Hrom -Abomium abrom – .Сокращенная электронная конфигурация основного состояния нейтрального атома хрома: [Ar] 3d5 4s1. Часть конфигурации хрома, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3d5 4s1, электроны в самой внешней оболочке, определяют химические свойства элемента. Полная электронная конфигурация нейтрального хромаПолная электронная конфигурация основного состояния атома хрома. Полная электронная конфигурация 1s2 2s2 2p6 3s2 3p6 3d5 4s1 Электроны заполнены атомными орбиталями в порядке, определяемом принципом Ауфбау, принципом исключения Паули и правилом Хунда. Атомная структура хромаАтомный радиус хрома составляет 166 пм, а его ковалентный радиус равен 127 пм.
Atomic Spectrum of ChromiumХимические свойства хрома: Энергия ионизации хрома и сродство к электронуСродство к электрону хрома составляет 64,3 кДж/моль.
Ionization Energy of ChromiumRefer to table below for Ionization energies of Chromium
Физические свойства хрома Физические свойства хрома см. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar Volume | 7.2824 cm3/mol |
Elastic Properties
| Young Modulus | 279 |
| Shear Modulus | 115 GPa |
| Bulk Modulus | 160 GPa |
| Коэффициент Пуассона | 0,21 |
Твердость хрома – испытания для измерения твердости элемента
| Твердость по шкале Мооса | 8.5 MPa |
| Vickers Hardness | 1060 MPa |
| Brinell Hardness | 1120 MPa |
Chromium Electrical Properties
Chromium is Conductor of electricity. См. Таблицу ниже для электрических свойств OFCHROMIUM
| Электрическая проводимость | 70 С/м | |
| Устойчивость | 1,3E-7 м.0028 | – |

Optical Properties of Chromium
| Refractive Index | – |
Refer to table below for Thermal properties of Chromium
| Melting Point | 2180 K (1906.85°C, 3464.3299999999995 °F) |
| Boiling Point | 2944 K (2670.85°C, 4839.53 °F) |
| Critical Temperature | – |
| Superconducting Point | – |
Enthalpies of Chromium
| Heat of Fusion | 20. 5 kJ/mol 5 kJ/mol |
| Теплота испарения | 339 кДж/моль |
| Тепло сгорания | – |
Хромиум Изотопы – ядер. Хром имеет 4 стабильных природных изотопа.
Изотопы хрома – Встречающиеся в природе стабильные изотопы: 50Cr, 52Cr, 53Cr, 54Cr.
| Изотоп | Z | N | Isotope Mass | % Abundance | T half | Decay Mode | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 42Cr | 24 | 18 | 42 | Synthetic | |||||||||
| 43Cr | 24 | 19 | 43 | Синтетический | |||||||||
| 44CR | 24 | 20 | 44 | 44 | 44444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444449н.0023 | 45Cr | 24 | 21 | 45 | Synthetic | |||
| 46Cr | 24 | 22 | 46 | Synthetic | |||||||||
| 47Cr | 24 | 23 | 47 | Synthetic | |||||||||
| 48Cr | 24 | 24 | 48 | Synthetic | |||||||||
| 49Cr | 24 | 25 | 49 | Synthetic | |||||||||
| 50Cr | 24 | 26 | 50 | 4. 345% 345% | Stable | N/A | |||||||
| 51Cr | 24 | 27 | 51 | Синтетический | |||||||||
| 52CR | 24 | 28 | 52 | 83.789% | Стабиль0024 29 | 53 | 9.501% | Stable | N/A | ||||
| 54Cr | 24 | 30 | 54 | 2.365% | Stable | N/A | |||||||
| 55Cr | 24 | 31 | 55 | Synthetic | |||||||||
| 56Cr | 24 | 32 | 56 | Synthetic | |||||||||
| 57Cr | 24 | 33 | 57 | Synthetic | |||||||||
| 58Cr | 24 | 34 | 58 | Synthetic | |||||||||
| 59Cr | 24 | 35 | 59 | Synthetic | |||||||||
| 60Cr | 24 | 36 | 60 | Synthetic | |||||||||
| 61Cr | 24 | 37 | 61 | Synthetic | |||||||||
| 62Cr | 24 | 38 | 62 | Synthetic | |||||||||
| 63Cr | 24 | 39 | 63 | Synthetic | |||||||||
| 64Cr | 24 | 40 | 64 | Синтетик | |||||||||
| 65CR | 24 | 41 | 65 | Синтетично | 444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444н.|||||||||
| 66Cr | 24 | 42 | 66 | Synthetic | |||||||||
| 67Cr | 24 | 43 | 67 | Synthetic |
A guide to all the Elements of Периодическая таблица
Все мы знаем об элементах периодической таблицы, но какие элементы существуют? К какой группировке они относятся? Наше краткое руководство по всем элементам периодической таблицы расскажет вам немного о каждом элементе.
Реактивные неметаллы
Неметаллы — это элементы, которые образуют отрицательные ионы, принимая или приобретая электроны. Неметаллы обычно имеют 4, 5, 6 или 7 электронов на внешней оболочке.
Неметаллы – это вещества, лишенные всех металлических свойств. Они являются хорошими изоляторами тепла и электричества. В основном это газы, а иногда и жидкости. Некоторые даже твердые при комнатной температуре, такие как углерод, сера и фосфор.
Водород — химический элемент с символом H и атомным номером 1. Со стандартным атомным весом 1,008 водород — самый легкий элемент в периодической таблице. Водород — самое распространенное химическое вещество во Вселенной, составляющее примерно 75% всей барионной массы.
Углерод (от латинского: carbo «уголь») представляет собой химический элемент с символом C и атомным номером 6. Он является неметаллическим и четырехвалентным, что делает четыре электрона доступными для образования ковалентных химических связей. Углерод — один из немногих элементов, известных с древности. Это второй по распространенности элемент в организме человека по массе (около 18,5%) после кислорода.
Азот — химический элемент с символом N и атомным номером 7. Впервые он был обнаружен и выделен шотландским врачом Дэниелом Резерфордом в 1772 году. Хотя Карл Вильгельм Шееле и Генри Кавендиш независимо сделали это примерно в одно и то же время, Резерфорд обычно получает признание, потому что его работа была опубликована первой. Азот составляет 78% нашего воздуха.
Азот составляет 78% нашего воздуха.
Кислород — это химический элемент с символом O и атомным номером 8. Он является членом группы халькогенов в периодической таблице, высокореактивным неметаллом и окислителем, который легко образует оксиды с большинством элементов, а также с другими соединениями.
Фтор — это химический элемент с символом F и атомным номером 9. Это самый легкий галоген, существующий в стандартных условиях в виде высокотоксичного бледно-желтого двухатомного газа. Как самый электроотрицательный элемент, он чрезвычайно реактивен, так как реагирует почти со всеми другими элементами, кроме аргона, неона и гелия.
Фосфор — это химический элемент с символом P и атомным номером 15. Элементарный фосфор существует в двух основных формах: белый фосфор и красный фосфор, но из-за его высокой реакционной способности фосфор никогда не встречается в виде свободного элемента на Земле. .
Сера — химический элемент с символом S и атомным номером 16. Он широко распространен, многовалентен и неметалличен. В нормальных условиях атомы серы образуют циклические восьмиатомные молекулы с химической формулой S8. Элементарная сера представляет собой ярко-желтое кристаллическое твердое вещество при комнатной температуре. Сера была известна в древние времена, ее использование упоминалось в Древней Греции, Китае и Египте.
Он широко распространен, многовалентен и неметалличен. В нормальных условиях атомы серы образуют циклические восьмиатомные молекулы с химической формулой S8. Элементарная сера представляет собой ярко-желтое кристаллическое твердое вещество при комнатной температуре. Сера была известна в древние времена, ее использование упоминалось в Древней Греции, Китае и Египте.
Хлор — это химический элемент с символом Cl и атомным номером 17. Второй по легкости из галогенов, он находится между фтором и бромом в периодической таблице, и его свойства в основном занимают промежуточное положение между ними.
Селен — химический элемент с символом Se и атомным номером 34. Это неметалл (реже считающийся металлоидом) со свойствами, которые занимают промежуточное положение между элементами выше и ниже в периодической таблице, серой и теллуром, и также имеет сходство с мышьяком.
Бром — химический элемент с символом Br и атомным номером 35. Это третий по легкости галоген, дымящаяся красно-коричневая жидкость при комнатной температуре, которая легко испаряется с образованием газа аналогичного цвета. Таким образом, его свойства занимают промежуточное положение между свойствами хлора и йода.
Это третий по легкости галоген, дымящаяся красно-коричневая жидкость при комнатной температуре, которая легко испаряется с образованием газа аналогичного цвета. Таким образом, его свойства занимают промежуточное положение между свойствами хлора и йода.
Йод — это химический элемент с символом I и атомным номером 53. Самый тяжелый из стабильных галогенов, он существует в виде блестящего фиолетово-черного неметаллического твердого вещества при стандартных условиях. Этот элемент был открыт французским химиком Бернаром Куртуа в 1811 году. Два года спустя он был назван Жозефом Луи Гей-Люссаком в честь греческого ἰώδης «фиолетового цвета».
Углерод в форме угля и алмазаЩелочные металлы
Щелочные металлы, находящиеся в группе 1 периодической таблицы (ранее известной как группа IA), являются очень реакционноспособными металлами, которые не встречаются в природе в свободном виде. Эти металлы имеют только один электрон на внешней оболочке. Следовательно, они готовы потерять один электрон при ионной связи с другими элементами. Как и все металлы, щелочные металлы пластичны, пластичны и являются хорошими проводниками тепла и электричества. Щелочные металлы мягче большинства других металлов. Цезий и франций являются наиболее реакционноспособными элементами этой группы. Щелочные металлы могут взорваться при контакте с водой.
Как и все металлы, щелочные металлы пластичны, пластичны и являются хорошими проводниками тепла и электричества. Щелочные металлы мягче большинства других металлов. Цезий и франций являются наиболее реакционноспособными элементами этой группы. Щелочные металлы могут взорваться при контакте с водой.
Литий (от греческого: λίθος, латинизируется: lithos, букв. «камень») — химический элемент с символом Li и атомным номером 3. Это мягкий щелочной металл серебристо-белого цвета. В стандартных условиях это самый легкий металл и самый легкий твердый элемент.
Натрий — химический элемент с символом Na (от латинского natrium) и атомным номером 11. Это мягкий, серебристо-белый, высокореактивный металл. Натрий — это щелочной металл, относящийся к 1-й группе периодической таблицы, потому что он имеет один электрон на внешней оболочке, который легко отдает, создавая положительно заряженный ион — катион Na+. Натрий является шестым по распространенности элементом в земной коре и присутствует в многочисленных минералах, таких как полевые шпаты, содалит и каменная соль (NaCl).
Впервые натрий был выделен Гемфри Дэви в 1807 году путем электролиза гидроксида натрия.
Калий — химический элемент с символом K (от неолатинского kalium) и атомным номером 19. Калий — серебристо-белый металл, достаточно мягкий, чтобы его можно было разрезать ножом с небольшим усилием. Металлический калий быстро реагирует с кислородом воздуха с образованием чешуйчатого белого пероксида калия всего за несколько секунд воздействия. Впервые он был выделен из поташа, золы растений, откуда и произошло его название.
Рубидий — химический элемент с символом Rb и атомным номером 37. Рубидий — очень мягкий серебристо-белый металл из группы щелочных металлов. Металлический рубидий имеет сходство с металлическим калием и металлическим цезием по внешнему виду, мягкости и проводимости.
Цезий — химический элемент с символом Cs и атомным номером 55. Это мягкий серебристо-золотистый щелочной металл с температурой плавления 28,5 °C (83,3 °F), что делает его одним из пяти металлов, находящихся в жидком состоянии при комнатной температуре или близкой к ней.
Франций — это химический элемент с символом Fr и атомным номером 87. До открытия его называли экацезием. Он чрезвычайно радиоактивный; его самый стабильный изотоп, франций-223, имеет период полураспада всего 22 минуты. Это второй по электроположительности элемент после цезия и второй по редкости встречающийся в природе элемент (после астата).
Щелочноземельные металлы
Элементы первой группы периодической таблицы (за исключением водорода) известны как щелочные металлы, поскольку они образуют щелочные растворы при взаимодействии с водой. Каждый из этих элементов имеет только один валентный электрон, а это означает, что они образуют только слабые металлические связи. В результате они относительно мягкие и имеют низкую температуру плавления. Щелочные металлы также легко соединяются с элементами семнадцатой группы (хлор, фтор, бром и т. д.) с образованием стабильных ионных соединений, таких как хлорид натрия.
Бериллий — химический элемент с символом Be и атомным номером 4. Это относительно редкий элемент во Вселенной, обычно возникающий в результате расщепления более крупных атомных ядер, столкнувшихся с космическими лучами.
Это относительно редкий элемент во Вселенной, обычно возникающий в результате расщепления более крупных атомных ядер, столкнувшихся с космическими лучами.
Магний — химический элемент с символом Mg и атомным номером 12. Это блестящее серое твердое вещество, имеющее близкое физическое сходство с пятью другими элементами второго столбца (группа 2 или щелочноземельные металлы) таблицы периодическая таблица. Магний является девятым по распространенности элементом во Вселенной.
Магний необходим для здорового организма Кальций — это химический элемент с символом Ca и атомным номером 20. Как щелочноземельный металл, кальций является химически активным металлом, который образует темный оксидно-нитридный слой при воздействии воздуха. Его физические и химические свойства наиболее близки к его более тяжелым гомологам стронцию и барию. Это пятый по распространенности элемент в земной коре и третий по распространенности металл после железа и алюминия.
Стронций — химический элемент с символом Sr и атомным номером 38. Щелочноземельный металл, стронций — мягкий серебристо-белый желтоватый металлический элемент, обладающий высокой химической активностью. Металл образует темный оксидный слой, когда он подвергается воздействию воздуха. Стронций имеет физические и химические свойства, аналогичные свойствам двух его вертикальных соседей по периодической таблице, кальцию и барию.
Барий — химический элемент с символом Ba и атомным номером 56. Это пятый элемент в группе 2, мягкий щелочноземельный металл серебристого цвета. Из-за своей высокой химической активности барий никогда не встречается в природе в виде свободного элемента. Его гидроксид, известный в досовременные времена как барит, не встречается в виде минерала, но его можно получить путем нагревания карбоната бария.
Радий — это химический элемент с символом Ra и атомным номером 88. Это шестой элемент в группе 2 периодической таблицы, также известный как щелочноземельные металлы. Чистый радий серебристо-белый, но он легко реагирует с азотом (а не с кислородом) на воздухе, образуя черный поверхностный слой нитрида радия.
Чистый радий серебристо-белый, но он легко реагирует с азотом (а не с кислородом) на воздухе, образуя черный поверхностный слой нитрида радия.
Переходные металлы
Наиболее поразительное сходство между 24 рассматриваемыми элементами заключается в том, что все они являются металлами и что большинство из них твердые, прочные и блестящие, имеют высокие температуры плавления и кипения и являются хорошими проводниками тепла и электричества. . Диапазон этих свойств значителен; поэтому утверждения сравнимы с общими свойствами всех других элементов.
Скандий — химический элемент с символом Sc и атомным номером 21. Серебристо-белый металлический элемент d-блока, исторически классифицируемый как редкоземельный элемент вместе с иттрием и лантаноидами. Он был обнаружен в 1879 г.спектральным анализом минералов эвксенита и гадолинита из Скандинавии.
Иттрий — химический элемент с символом Y и атомным номером 39. Это серебристо-металлический переходный металл, химически сходный с лантаноидами, и его часто классифицируют как «редкоземельный элемент».
Титан — это химический элемент с символом Ti и атомным номером 22. Это блестящий переходный металл серебристого цвета, низкой плотности и высокой прочности. Титан устойчив к коррозии в морской воде, царской водке и хлоре. Титан был открыт в Корнуолле, Великобритания, Уильямом Грегором в 179 г.1 и был назван Мартином Генрихом Клапротом в честь титанов греческой мифологии.
Титан, обработанный на станке с ЧПУЦирконий — это химический элемент с символом Zr и атомным номером 40. Название цирконий взято из названия минерала циркона. Это блестящий, серо-белый, прочный переходный металл, очень похожий на гафний и, в меньшей степени, на титан. Цирконий в основном используется в качестве огнеупора и замутнителя, хотя небольшие количества используются в качестве легирующего агента из-за его высокой коррозионной стойкости.
Гафний — химический элемент с символом Hf и атомным номером 72. Блестящий, серебристо-серый, четырехвалентный переходный металл, гафний химически напоминает цирконий и встречается во многих минералах циркония. Его существование было предсказано Дмитрием Менделеевым в 1869 году, хотя он не был идентифицирован до 1923 года Костером и Хевеши, что сделало его последним открытым стабильным элементом.
Его существование было предсказано Дмитрием Менделеевым в 1869 году, хотя он не был идентифицирован до 1923 года Костером и Хевеши, что сделало его последним открытым стабильным элементом.
Резерфордий — синтетический химический элемент с символом Rf и атомным номером 104, названный в честь новозеландского физика Эрнеста Резерфорда. Как синтетический элемент он не встречается в природе и может быть создан только в лаборатории. Радиоактивен; самый стабильный известный изотоп, 267Rf, имеет период полураспада примерно 1,3 часа.
Ванадий — химический элемент с символом V и атомным номером 23. Это твердый, серебристо-серый, ковкий переходный металл. Элементарный металл редко встречается в природе, но после его искусственного выделения образование оксидного слоя (пассивация) несколько стабилизирует свободный металл от дальнейшего окисления.
Ниобий , ранее известный как колумбий, представляет собой химический элемент с символом Nb (ранее Cb) и атомным номером 41. Ниобий представляет собой светло-серый, кристаллический и пластичный переходный металл. Чистый ниобий имеет твердость, аналогичную чистому титану, и пластичность, аналогичную железу. Ниобий очень медленно окисляется в земной атмосфере, поэтому его применяют в ювелирных изделиях как гипоаллергенную альтернативу никелю.
Ниобий представляет собой светло-серый, кристаллический и пластичный переходный металл. Чистый ниобий имеет твердость, аналогичную чистому титану, и пластичность, аналогичную железу. Ниобий очень медленно окисляется в земной атмосфере, поэтому его применяют в ювелирных изделиях как гипоаллергенную альтернативу никелю.
Тантал — химический элемент с символом Та и атомным номером 73. Ранее известный как тантал, он назван в честь Тантала, злодея из греческой мифологии. Тантал представляет собой редкий, твердый, голубовато-серый, блестящий переходный металл, обладающий высокой коррозионной стойкостью.
Дубний представляет собой синтетический химический элемент с символом Db и атомным номером 105. Дубний является высокорадиоактивным: самый стабильный известный изотоп, дубний-268, имеет период полураспада около 28 часов. Это сильно ограничивает масштабы исследований дубния.
Хром — химический элемент с символом Cr и атомным номером 24. Это первый элемент в группе 6. Это стально-серый, блестящий, твердый и хрупкий переходный металл. Хром является основной добавкой в нержавеющей стали, придающей ей антикоррозионные свойства. Хром также высоко ценится как металл, который хорошо полируется и не тускнеет. Полированный хром отражает почти 70% видимого спектра.
Это первый элемент в группе 6. Это стально-серый, блестящий, твердый и хрупкий переходный металл. Хром является основной добавкой в нержавеющей стали, придающей ей антикоррозионные свойства. Хром также высоко ценится как металл, который хорошо полируется и не тускнеет. Полированный хром отражает почти 70% видимого спектра.
Молибден — химический элемент с символом Mo и атомным номером 42. Минералы молибдена были известны на протяжении всей истории, но этот элемент был открыт (в смысле дифференциации его как нового объекта от минеральных солей других металлов) в 1778 году Карлом Вильгельмом Шееле. Металл был впервые выделен в 1781 году Питером Якобом Хьельмом.
Вольфрам , или вольфрам, представляет собой химический элемент с символом W и атомным номером 74. Название вольфрама происходит от прежнего шведского названия вольфрамового минерала шеелита, вольфрама или «тяжелого камня». Вольфрам — это редкий металл, встречающийся в природе на Земле почти исключительно в сочетании с другими элементами в химических соединениях, а не отдельно.
Сиборгий — синтетический химический элемент с символом Sg и атомным номером 106. Он назван в честь американского химика-ядерщика Гленна Т. Сиборга. Как синтетический элемент он может быть создан в лаборатории, но не встречается в природе. Он также радиоактивен; самый стабильный известный изотоп, 269Sg, имеет период полураспада примерно 14 минут.
Марганец — это химический элемент с символом Mn и атомным номером 25. Он не встречается в природе в свободном виде; он часто встречается в минералах в сочетании с железом. Марганец является переходным металлом с многогранным спектром применения в промышленных сплавах, особенно в нержавеющей стали.
Технеций — химический элемент с символом Tc и атомным номером 43. Это самый легкий элемент, все изотопы которого радиоактивны. Почти весь технеций производится как синтетический элемент, и, по оценкам, в любой момент времени в земной коре существует только около 18 000 тонн.
Рений — химический элемент с символом Re и атомным номером 75. Это тяжелый переходный металл серебристо-серого цвета. При предполагаемой средней концентрации рения в 1 часть на миллиард (ppb) он является одним из самых редких элементов в земной коре.
Борий — синтетический химический элемент с символом Bh и атомным номером 107. Он назван в честь датского физика Нильса Бора. Как синтетический элемент он может быть создан в лаборатории, но не встречается в природе. Все известные изотопы бория чрезвычайно радиоактивны; наиболее стабильный известный изотоп — 270Bh с периодом полураспада около 61 секунды, хотя неподтвержденный 278Bh может иметь более длительный период полураспада — около 69 секунд.0 секунд.
Железо — химический элемент с символом Fe (от латинского: Ferrum) и атомным номером 26. Это металл, относящийся к первому переходному ряду и группе 8 периодической таблицы. По массе это самый распространенный элемент на Земле, образующий большую часть внешнего и внутреннего ядра Земли. Это четвертый по распространенности элемент в земной коре. Люди начали осваивать этот процесс в Евразии только около 2000 г. до н.э., а использование железных инструментов и оружия начало вытеснять медные сплавы в некоторых регионах только около 1200 г. до н.э. Это событие считается переходом от бронзового века к железному веку. В современном мире сплавы железа, такие как сталь, нержавеющая сталь, чугун и специальные стали, на сегодняшний день являются наиболее распространенными промышленными металлами из-за их высоких механических свойств и низкой стоимости.
Это четвертый по распространенности элемент в земной коре. Люди начали осваивать этот процесс в Евразии только около 2000 г. до н.э., а использование железных инструментов и оружия начало вытеснять медные сплавы в некоторых регионах только около 1200 г. до н.э. Это событие считается переходом от бронзового века к железному веку. В современном мире сплавы железа, такие как сталь, нержавеющая сталь, чугун и специальные стали, на сегодняшний день являются наиболее распространенными промышленными металлами из-за их высоких механических свойств и низкой стоимости.
Рутений — химический элемент с символом Ru и атомным номером 44. Это редкий переходный металл, принадлежащий к платиновой группе периодической таблицы. Как и другие металлы платиновой группы, рутений инертен к большинству других химических веществ. Родившийся в России ученый балтийско-германского происхождения Карл Эрнст Клаус открыл этот элемент в 1844 году в Казанском государственном университете и назвал рутением в честь России (Ruthenia — латинское название России).
Осмий (от греческого ὀσμή osme, «запах») — химический элемент с символом Os и атомным номером 76. Это твердый, хрупкий, голубовато-белый переходный металл платиновой группы, который встречается в качестве микроэлемента в сплавах. в основном в платиновых рудах. Осмий — самый плотный встречающийся в природе элемент с экспериментально измеренной (с помощью рентгеновской кристаллографии) плотностью 22,59 г/см3.
Хассий — это химический элемент с символом Hs и атомным номером 108. Известно, что он не встречается в природе и производится только в лабораториях в незначительных количествах. Хассий очень радиоактивен; самый стабильный известный изотоп, 269Hs имеет период полураспада примерно 16 секунд.
Кобальт — химический элемент с символом Co и атомным номером 27. Как и никель, кобальт встречается в земной коре только в химически связанной форме, за исключением небольших месторождений, обнаруженных в сплавах природного метеоритного железа. Свободный элемент, получаемый восстановительной плавкой, представляет собой твердый, блестящий металл серебристо-серого цвета.
Свободный элемент, получаемый восстановительной плавкой, представляет собой твердый, блестящий металл серебристо-серого цвета.
Родий — химический элемент с символом Rh и атомным номером 45. Это редкий, серебристо-белый, твердый, устойчивый к коррозии и химически инертный переходный металл. Это благородный металл, член платиновой группы. Встречающийся в природе родий обычно встречается в виде свободного металла, в виде сплава с подобными металлами и редко в виде химического соединения в таких минералах, как боуиит и родплюмсит. Это один из самых редких и ценных драгоценных металлов.
Иридий — химический элемент с символом Ir и атомным номером 77. Очень твердый, хрупкий, серебристо-белый переходный металл платиновой группы, иридий — второй по плотности металл (после осмия) с плотностью 22,56. г/см3 по данным экспериментальной рентгеноструктурного анализа.
Никель — химический элемент с символом Ni и атомным номером 28. Это серебристо-белый блестящий металл с легким золотистым оттенком. Никель твердый и пластичный. Даже чистый самородный никель содержится в земной коре лишь в незначительных количествах, обычно в ультраосновных породах и в недрах более крупных железоникелевых метеоритов, которые не подвергались воздействию кислорода вне земной атмосферы.
Это серебристо-белый блестящий металл с легким золотистым оттенком. Никель твердый и пластичный. Даже чистый самородный никель содержится в земной коре лишь в незначительных количествах, обычно в ультраосновных породах и в недрах более крупных железоникелевых метеоритов, которые не подвергались воздействию кислорода вне земной атмосферы.
Палладий — химический элемент с символом Pd и атомным номером 46. Это редкий и блестящий серебристо-белый металл, открытый в 1803 году Уильямом Хайдом Волластоном. Он назвал его в честь астероида Паллада, который сам был назван в честь эпитета греческой богини Афины, полученного ею, когда она убила Палладу.
Платина — это химический элемент с символом Pt и атомным номером 78. Это плотный, ковкий, пластичный, очень нереакционноспособный, драгоценный серебристо-белый переходный металл. Его название происходит от испанского термина platino, что означает «маленькое серебро».
Медь — это химический элемент с символом Cu (от латинского: cuprum) и атомным номером 29. Это мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет розовато-оранжевый цвет. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных металлических сплавов.
Это мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет розовато-оранжевый цвет. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных металлических сплавов.
Серебро — химический элемент с символом Ag (от латинского argentum, происходящего от протоиндоевропейского h₂erǵ: «блестящий» или «белый») и атомным номером 47. Мягкий, белый, блестящий переходный металл. , он обладает самой высокой электропроводностью, теплопроводностью и отражательной способностью среди всех металлов. Металл встречается в земной коре в чистом, свободном элементном виде («самородное серебро»), в виде сплава с золотом и другими металлами, а также в таких минералах, как аргентит и хлораргирит. Большая часть серебра производится как побочный продукт аффинажа меди, золота, свинца и цинка.
Золото — это химический элемент с символом Au (от латинского: aurum) и атомным номером 79, что делает его одним из элементов с самым высоким атомным номером, встречающихся в природе. В чистом виде это яркий, слегка красновато-желтый, плотный, мягкий, ковкий и пластичный металл.
В чистом виде это яркий, слегка красновато-желтый, плотный, мягкий, ковкий и пластичный металл.
Лантаниды
Лантаноиды — это металлы, которые связаны друг с другом своим поведением. Большинство из них медленно превращаются в свои гидроксиды, когда их помещают в воду, как щелочные металлы. Обычно они образуют оксидное покрытие при помещении на воздух, как и большинство металлов. Лантаниды вместе со скандием и иттрием называются редкоземельными элементами. Все лантаноиды представляют собой серебристо-белые мягкие металлы и быстро тускнеют на воздухе. Твердость увеличивается с увеличением атомного номера.
Лантаниды не распространены, и добываются лишь небольшие количества. Некоторые из них находят различное применение в магнитах, сверхпроводниках, химических катализаторах и оптическом оборудовании, таком как лазеры.
Лантан — химический элемент с символом La и атомным номером 57. Это мягкий, пластичный металл серебристо-белого цвета, который медленно тускнеет на воздухе и достаточно мягкий, чтобы его можно было разрезать ножом. Лантан не играет биологической роли в организме человека, но необходим для некоторых бактерий.
Лантан не играет биологической роли в организме человека, но необходим для некоторых бактерий.
Церий — химический элемент с символом Ce и атомным номером 58. Церий — мягкий, пластичный металл серебристо-белого цвета, который тускнеет на воздухе. Церий — второй элемент в ряду лантанидов. Он также считается одним из редкоземельных элементов.
Празеодим — химический элемент с символом Pr и атомным номером 59. Он является третьим членом ряда лантанидов и традиционно считается одним из редкоземельных металлов. Празеодим — мягкий, серебристый, ковкий и пластичный металл, ценимый за свои магнитные, электрические, химические и оптические свойства.
Неодим — химический элемент с символом Nd и атомным номером 60. Неодим принадлежит к ряду лантанидов и является редкоземельным элементом. Это твердый, слегка податливый металл серебристого цвета, который быстро тускнеет на воздухе и во влаге. Его сплавляют для создания мощных магнитов.
Прометий — химический элемент с символом Pm и атомным номером 61. Все его изотопы радиоактивны; он встречается крайне редко: в любой момент времени в земной коре естественным образом встречается всего около 500–600 граммов.
Самарий — химический элемент с символом Sm и атомным номером 62. Это серебристый металл средней твердости, медленно окисляющийся на воздухе. Самарий не играет значительной биологической роли, но лишь слегка токсичен.
Европий — это химический элемент с символом Eu и атомным номером 63. Европий на сегодняшний день является наиболее реакционноспособным лантанидом, который необходимо хранить в инертной жидкости для защиты от атмосферного кислорода или влаги. Европий также является самым мягким лантанидом, так как его можно помять ногтем и легко порезать ножом. Европий — один из самых редких редкоземельных элементов на Земле.
Гадолиний представляет собой химический элемент с символом Gd и атомным номером 64. Гадолиний представляет собой серебристо-белый металл после удаления окисления. Он лишь слегка податлив и представляет собой пластичный редкоземельный элемент.
Гадолиний представляет собой серебристо-белый металл после удаления окисления. Он лишь слегка податлив и представляет собой пластичный редкоземельный элемент.
Тербий — химический элемент с символом Tb и атомным номером 65. Это серебристо-белый редкоземельный металл, ковкий, пластичный и достаточно мягкий, чтобы его можно было разрезать ножом.
Диспрозий — химический элемент с символом Dy и атомным номером 66. Это редкоземельный элемент с металлическим серебряным блеском. Диспрозий никогда не встречается в природе в виде свободного элемента, хотя он встречается в различных минералах, таких как ксенотим.
Гольмий — это химический элемент с символом Ho и атомным номером 67. Часть ряда лантанидов, гольмий — редкоземельный элемент. Гольмий был открыт шведским химиком Пером Теодором Клеве. Его оксид был впервые выделен из редкоземельных руд в 1878 году.
Эрбий — химический элемент с символом Er и атомным номером 68. Серебристо-белый твердый металл, при искусственном выделении, природный эрбий всегда находится в химическом сочетании с другие элементы. Это лантанид, редкоземельный элемент, первоначально обнаруженный в гадолинитовой шахте в Иттербю в Швеции, откуда он и получил свое название.
Серебристо-белый твердый металл, при искусственном выделении, природный эрбий всегда находится в химическом сочетании с другие элементы. Это лантанид, редкоземельный элемент, первоначально обнаруженный в гадолинитовой шахте в Иттербю в Швеции, откуда он и получил свое название.
Тулий — химический элемент с символом Tm и атомным номером 69. Это тринадцатый и третий последний элемент в ряду лантанидов. В водном растворе, как и соединения других поздних лантаноидов, растворимые соединения тулия образуют координационные комплексы с девятью молекулами воды.
Иттербий — химический элемент с символом Yb и атомным номером 70. Это четырнадцатый и предпоследний элемент в ряду лантанидов. Из-за его электронной конфигурации с закрытой оболочкой его плотность, а также температуры плавления и кипения значительно отличаются от большинства других лантаноидов.
Лютеций — химический элемент с символом Lu и атомным номером 71. Это серебристо-белый металл, устойчивый к коррозии в сухом воздухе, но не во влажном. Лютеций является последним элементом в ряду лантаноидов и традиционно считается одним из редкоземельных элементов.
Это серебристо-белый металл, устойчивый к коррозии в сухом воздухе, но не во влажном. Лютеций является последним элементом в ряду лантаноидов и традиционно считается одним из редкоземельных элементов.
Металлоиды
Металлоид представляет собой химический элемент, проявляющий некоторые свойства металлов и некоторые неметаллы. В периодической таблице металлоиды образуют зубчатую зону, разделяющую элементы, имеющие явные металлические свойства, от элементов, обладающих явными неметаллическими свойствами.
Бор — это химический элемент с символом B и атомным номером 5. Образующийся исключительно в результате расщепления космических лучей и сверхновых, а не в результате звездного нуклеосинтеза, этот элемент мало распространен в Солнечной системе и в земной коре.
Кремний — химический элемент с символом Si и атомным номером 14. Это твердое и хрупкое кристаллическое вещество с сине-серым металлическим блеском; и это четырехвалентный металлоид и полупроводник. Он входит в группу 14 в периодической таблице: углерод находится над ним; а германий, олово и свинец ниже его. Он относительно нереактивен.
Он входит в группу 14 в периодической таблице: углерод находится над ним; а германий, олово и свинец ниже его. Он относительно нереактивен.
Германий — химический элемент с символом Ge и атомным номером 32. Это блестящий, твердоломкий, серовато-белый металлоид в углеродной группе, химически подобный своим соседям по группе кремнию и олову. Чистый германий представляет собой полупроводник, внешне похожий на элементарный кремний. Подобно кремнию, германий естественным образом реагирует и образует комплексы с кислородом в природе.
Мышьяк — это химический элемент с символом As и атомным номером 33. Мышьяк встречается во многих минералах, обычно в сочетании с серой и металлами, а также в виде чистого элементарного кристалла. Мышьяк является металлоидом. Он имеет различные аллотропы, но для промышленности важна только серая форма, имеющая металлический вид.
Сурьма — это химический элемент с символом Sb (от латыни: stibium) и атомным номером 51. Блестящий серый металлоид встречается в природе в основном в виде сульфидного минерала антимонита. Соединения сурьмы были известны с древних времен и применялись в виде порошка для использования в медицине и косметике, часто известной под арабским названием коль.
Блестящий серый металлоид встречается в природе в основном в виде сульфидного минерала антимонита. Соединения сурьмы были известны с древних времен и применялись в виде порошка для использования в медицине и косметике, часто известной под арабским названием коль.
Теллур — химический элемент с символом Te и атомным номером 52. Это хрупкий, умеренно токсичный, редко встречающийся серебристо-белый металлоид. Теллур химически связан с селеном и серой, все три из которых являются халькогенами. Теллур гораздо более распространен во Вселенной в целом, чем на Земле.
Астатин — радиоактивный химический элемент с символом At и атомным номером 85. Это самый редкий природный элемент в земной коре, встречающийся только как продукт распада различных более тяжелых элементов.
Актинид
Все актиниды радиоактивны и выделяют энергию при радиоактивном распаде; природный уран и торий, а также синтетически полученный плутоний являются наиболее распространенными актинидами на Земле. Они используются в ядерных реакторах и ядерном оружии. Уран и торий также имеют различные текущие или исторические применения, а америций используется в ионизационных камерах большинства современных детекторов дыма.
Они используются в ядерных реакторах и ядерном оружии. Уран и торий также имеют различные текущие или исторические применения, а америций используется в ионизационных камерах большинства современных детекторов дыма.
Актиний — химический элемент с символом Ас и атомным номером 89. Впервые он был выделен французским химиком Андре-Луи Дебьерном в 1899 году. Фридрих Оскар Гизель позже независимо выделил его в 1902 году и, не подозревая, что он уже был известен, дал ему название эманиум.
Торий — слаборадиоактивный металлический химический элемент с символом Th и атомным номером 90. Торий имеет серебристый цвет и тускнеет на воздухе, образуя диоксид тория; он умеренно твердый, пластичный и имеет высокую температуру плавления.
Протактиний (ранее протоактиний) — химический элемент с символом Pa и атомным номером 91. Это плотный серебристо-серый актинидный металл, который легко реагирует с кислородом, водяным паром и неорганическими кислотами. Из-за его дефицита, высокой радиоактивности и высокой токсичности протактиний в настоящее время не используется вне научных исследований, и для этой цели протактиний в основном извлекают из отработавшего ядерного топлива.
Из-за его дефицита, высокой радиоактивности и высокой токсичности протактиний в настоящее время не используется вне научных исследований, и для этой цели протактиний в основном извлекают из отработавшего ядерного топлива.
Уран — химический элемент с символом U и атомным номером 9.2. Это серебристо-серый металл актинидного ряда периодической таблицы. Атом урана имеет 92 протона и 92 электрона, из которых 6 валентных электронов. Уран слаборадиоактивен, потому что все изотопы урана нестабильны; период полураспада встречающихся в природе изотопов колеблется от 159 200 лет до 4,5 миллиардов лет. Его плотность примерно на 70% выше, чем у свинца, и немного ниже, чем у золота или вольфрама.
Нептуний — химический элемент с символом Np и атомным номером 9.3. Радиоактивный актинидный металл, нептуний является первым трансурановым элементом. Его положение в периодической таблице сразу после урана, названного в честь планеты Уран, привело к тому, что он был назван в честь Нептуна, следующей за Ураном планеты.
Плутоний — радиоактивный химический элемент с символом Pu и атомным номером 94. Это актинид металла серебристо-серого цвета, который тускнеет на воздухе и образует матовое покрытие при окислении. Элемент обычно имеет шесть аллотропов и четыре степени окисления.
Америций представляет собой синтетический радиоактивный химический элемент с символом Am и атомным номером 95. Он является трансурановым членом ряда актинидов, в периодической таблице расположен под лантанидным элементом европием, и, таким образом, по аналогии был назван в честь Америки. .
Кюрий — трансурановый радиоактивный химический элемент с символом Cm и атомным номером 96. Этот элемент из ряда актинидов был назван в честь Марии и Пьера Кюри — оба были известны своими исследованиями радиоактивности.
Berkelium — это трансурановый радиоактивный химический элемент с символом Bk и атомным номером 97. Он принадлежит к ряду актиноидов и трансурановых элементов. Он назван в честь города Беркли, штат Калифорния, где располагалась Национальная лаборатория Лоуренса Беркли (затем Радиационная лаборатория Калифорнийского университета), где он был обнаружен в декабре 1949 года. Берклий был пятым трансурановым элементом, открытым после нептуния, плутония, кюрия, и америций.
Он назван в честь города Беркли, штат Калифорния, где располагалась Национальная лаборатория Лоуренса Беркли (затем Радиационная лаборатория Калифорнийского университета), где он был обнаружен в декабре 1949 года. Берклий был пятым трансурановым элементом, открытым после нептуния, плутония, кюрия, и америций.
Калифорний — радиоактивный химический элемент с символом Cf и атомным номером 98. Этот элемент был впервые синтезирован в 1950 году в Национальной лаборатории Лоуренса в Беркли (затем Радиационная лаборатория Калифорнийского университета) путем бомбардировки кюрия альфа-частицами (гелия). -4 ионов). Это актинидный элемент, шестой синтезированный трансурановый элемент, и он имеет вторую по величине атомную массу из всех элементов, которые были произведены в количествах, достаточно больших, чтобы их можно было увидеть невооруженным глазом (после эйнштейния).
Эйнштейний представляет собой синтетический элемент с символом Es и атомным номером 99. Как член ряда актинидов, это седьмой трансурановый элемент. Он был обнаружен в составе обломков первого взрыва водородной бомбы в 1952 году и назван в честь Альберта Эйнштейна. Из-за небольшого количества произведенного эйнштейния и короткого периода полураспада его наиболее легко производимого изотопа в настоящее время для него почти нет практического применения, кроме фундаментальных научных исследований.
Как член ряда актинидов, это седьмой трансурановый элемент. Он был обнаружен в составе обломков первого взрыва водородной бомбы в 1952 году и назван в честь Альберта Эйнштейна. Из-за небольшого количества произведенного эйнштейния и короткого периода полураспада его наиболее легко производимого изотопа в настоящее время для него почти нет практического применения, кроме фундаментальных научных исследований.
Фермий представляет собой синтетический элемент с символом Fm и атомным номером 100. Это актинид и самый тяжелый элемент, который может быть образован нейтронной бомбардировкой более легких элементов, и, следовательно, последний элемент, который может быть получен в макроскопических количествах. Назван в честь Энрико Ферми.
Менделевий представляет собой синтетический элемент с символом Md (ранее Mv) и атомным номером 101. Металлический радиоактивный трансурановый элемент в ряду актинидов, это первый элемент по атомному номеру, который в настоящее время не может быть произведен в макроскопических количествах путем нейтронная бомбардировка более легких элементов.
Нобелий — синтетический химический элемент с символом No и атомным номером 102. Он назван в честь Альфреда Нобеля, изобретателя динамита и мецената науки. Радиоактивный металл, это десятый трансурановый элемент и предпоследний член ряда актинидов. Как и все элементы с атомным номером более 100, нобелий можно получить только в ускорителях частиц путем бомбардировки более легких элементов заряженными частицами.
Лоуренсиум представляет собой синтетический химический элемент с символом Lr (ранее Lw) и атомным номером 103. Он назван в честь Эрнеста Лоуренса, изобретателя циклотрона, устройства, которое использовалось для открытия многих искусственных радиоактивных элементов. Радиоактивный металл, лоуренсий, является одиннадцатым трансурановым элементом, а также последним членом ряда актинидов.
Постпереходные металлы
Цинк представляет собой химический элемент с символом Zn и атомным номером 30. Цинк представляет собой слегка хрупкий металл при комнатной температуре и имеет сине-серебристый цвет после удаления окисления. Цинк является 24-м наиболее распространенным элементом в земной коре и имеет пять стабильных изотопов.
Цинк является 24-м наиболее распространенным элементом в земной коре и имеет пять стабильных изотопов.
Кадмий — химический элемент с символом Cd и атомным номером 48. Этот мягкий серебристо-белый металл химически подобен двум другим стабильным металлам группы 12, цинку и ртути. Он был открыт в 1817 году одновременно Штромейером и Германом в Германии как примесь в карбонате цинка.
Ртуть — это химический элемент с символом Hg и атомным номером 80. Он широко известен как ртуть и ранее назывался гидраргирум. Тяжелый серебристый элемент d-блока, ртуть — единственный металлический элемент, который находится в жидком состоянии при стандартных условиях температуры и давления; единственный другой элемент, который в этих условиях является жидким, – это галогенбром, хотя такие металлы, как цезий, галлий и рубидий, плавятся при температуре чуть выше комнатной.
Коперниций представляет собой синтетический химический элемент с символом Cn и атомным номером 112. Его известные изотопы чрезвычайно радиоактивны и были созданы только в лаборатории. Самый стабильный известный изотоп, коперниций-285, имеет период полураспада примерно 28 секунд. Copernicium был впервые создан в 1996 году Центром исследований тяжелых ионов им. Гельмгольца GSI недалеко от Дармштадта, Германия. Он назван в честь астронома Николая Коперника.
Его известные изотопы чрезвычайно радиоактивны и были созданы только в лаборатории. Самый стабильный известный изотоп, коперниций-285, имеет период полураспада примерно 28 секунд. Copernicium был впервые создан в 1996 году Центром исследований тяжелых ионов им. Гельмгольца GSI недалеко от Дармштадта, Германия. Он назван в честь астронома Николая Коперника.
Алюминий — химический элемент с символом Al и атомным номером 13. Это серебристо-белый, мягкий, немагнитный и пластичный металл группы бора. По массе алюминий составляет около 8% земной коры, это третий по распространенности элемент после кислорода и кремния и самый распространенный металл в земной коре, хотя он менее распространен в нижней мантии. Главной рудой алюминия являются бокситы. Металлический алюминий обладает высокой реакционной способностью, поэтому природные образцы редки и ограничены экстремальными восстановительными средами. Вместо этого он встречается в более чем 270 различных минералах.
Галлий — химический элемент с символом Ga и атомным номером 31. Элементарный галлий — мягкий металл серебристо-голубого цвета при стандартной температуре и давлении; однако в жидком состоянии он становится серебристо-белым. Элементарный галлий представляет собой жидкость при температуре выше 29,76 ° C (85,57 ° F), выше комнатной температуры, но ниже нормальной температуры человеческого тела 37 ° C (99 ° F). Следовательно, металл будет таять в руках человека.
Элементарный галлий — мягкий металл серебристо-голубого цвета при стандартной температуре и давлении; однако в жидком состоянии он становится серебристо-белым. Элементарный галлий представляет собой жидкость при температуре выше 29,76 ° C (85,57 ° F), выше комнатной температуры, но ниже нормальной температуры человеческого тела 37 ° C (99 ° F). Следовательно, металл будет таять в руках человека.
Индий — химический элемент с символом In и атомным номером 49.. Индий — самый мягкий металл, не относящийся к щелочным металлам. Это серебристо-белый металл, внешне напоминающий олово. Индий был открыт в 1863 году Фердинандом Райхом и Иеронимом Теодором Рихтером спектроскопическими методами. Они назвали его за синюю линию цвета индиго в его спектре. Индий был выделен в следующем году.
Таллий — это химический элемент с символом Tl и атомным номером 81. Это серый постпереходный металл, который не встречается в природе в свободном виде. Химики Уильям Крукс и Клод-Огюст Лами независимо друг от друга открыли таллий в 1861 году в остатках производства серной кислоты.
Олово — это химический элемент с символом Sn (от латыни: stannum) и атомным номером 50. Олово — серебристый металл со слабым желтым оттенком. Олово, как и индий, достаточно мягкое, чтобы его можно было резать без особого усилия.
Свинец — это химический элемент с символом Pb (от латинского plumbum) и атомным номером 82. Это тяжелый металл, который плотнее большинства обычных материалов. Свинец мягкий и пластичный, а также имеет относительно низкую температуру плавления. В свежем виде свинец серебристый с оттенком синего. Свинец имеет самый высокий атомный номер среди всех стабильных элементов, и три его изотопа являются конечными точками основных цепочек ядерного распада более тяжелых элементов.
Висмут — химический элемент с символом Bi и атомным номером 83. Это пятивалентный постпереходный металл и один из пниктогенов, химические свойства которого напоминают его более легкие гомологи мышьяк и сурьму.
Полоний — химический элемент с символом Po и атомным номером 84. Редкий и высокорадиоактивный металл без стабильных изотопов, полоний химически подобен селену и теллуру, хотя его металлический характер напоминает свойства его горизонтальных соседей в периодическом Таблица: таллий, свинец и висмут.
Редкий и высокорадиоактивный металл без стабильных изотопов, полоний химически подобен селену и теллуру, хотя его металлический характер напоминает свойства его горизонтальных соседей в периодическом Таблица: таллий, свинец и висмут.
Благородные газы
Благородные газы являются химическими элементами 18-й группы периодической таблицы. Они наиболее стабильны из-за максимального количества валентных электронов, которые может удерживать их внешняя оболочка. Поэтому они редко реагируют с другими элементами, так как уже стабильны.
Другими характеристиками благородных газов являются то, что все они проводят электричество, флуоресцируют, не имеют запаха и цвета и используются человеком. без запаха, без вкуса, нетоксичный, инертный, одноатомный газ, первый в группе благородных газов в периодической таблице. Его температура кипения самая низкая среди всех элементов. Гелий — второй самый легкий и второй по распространенности элемент в наблюдаемой Вселенной.
Неон — химический элемент с символом Ne и атомным номером 10. Это благородный газ.[10] Неон представляет собой бесцветный инертный одноатомный газ без запаха при стандартных условиях с плотностью примерно в две трети плотности воздуха. Неон химически инертен, незаряженные соединения неона неизвестны.
Это благородный газ.[10] Неон представляет собой бесцветный инертный одноатомный газ без запаха при стандартных условиях с плотностью примерно в две трети плотности воздуха. Неон химически инертен, незаряженные соединения неона неизвестны.
Аргон — химический элемент с символом Ar и атомным номером 18. Он находится в 18-й группе периодической таблицы и является инертным газом. Аргон является третьим по распространенности газом в атмосфере Земли с его 0,934% (9340 частей на миллион по объему). Аргон — самый распространенный благородный газ в земной коре, составляющий 0,00015% земной коры.
Криптон — химический элемент с символом Kr и атомным номером 36. Это бесцветный благородный газ без запаха и вкуса, который в следовых количествах встречается в атмосфере и часто используется с другими инертными газами в люминесцентных лампах. Криптон, за редким исключением, химически инертен.
Ксенон — химический элемент с символом Xe и атомным номером 54. Это бесцветный, плотный благородный газ без запаха, обнаруженный в атмосфере Земли в следовых количествах. Хотя обычно ксенон не реагирует, он может вступать в несколько химических реакций, таких как образование гексафторплатината ксенона, первого синтезированного соединения благородного газа.
Это бесцветный, плотный благородный газ без запаха, обнаруженный в атмосфере Земли в следовых количествах. Хотя обычно ксенон не реагирует, он может вступать в несколько химических реакций, таких как образование гексафторплатината ксенона, первого синтезированного соединения благородного газа.
Радон — химический элемент с символом Rn и атомным номером 86. Это радиоактивный, бесцветный благородный газ без запаха и вкуса. Он встречается в природе в незначительных количествах как промежуточный этап в обычных цепочках радиоактивного распада, посредством которых торий и уран медленно распадаются на свинец и различные другие короткоживущие радиоактивные элементы; Сам радон является непосредственным продуктом распада радия.
Неизвестные химические свойства
Эти элементы являются относительно новыми открытиями. Об этих элементах и их свойствах известно очень мало. Некоторые элементы считались частью одной группы, а затем отображали свойства, связанные с другой группой, поэтому в настоящее время невозможно отнести их ни к одной из вышеуказанных категорий, отсюда и название.
Мейтнерий — синтетический химический элемент с символом Mt и атомным номером 109. Это чрезвычайно радиоактивный синтетический элемент (элемент, не встречающийся в природе, но может быть получен в лаборатории). Самый стабильный известный изотоп, мейтнерий-278, имеет период полураспада 4,5 секунды.
Darmstadtium — синтетический химический элемент с символом Ds и атомным номером 110. Это чрезвычайно радиоактивный синтетический элемент. Самый стабильный известный изотоп, дармштадтий-281, имеет период полураспада примерно 12,7 секунды. Дармштадт был впервые создан в 1994 Центром исследований тяжелых ионов Гельмгольца GSI недалеко от города Дармштадт, Германия, в честь которого он был назван.
Рентгений — это химический элемент с символом Rg и атомным номером 111. Это чрезвычайно радиоактивный синтетический элемент, который может быть создан в лаборатории, но не встречается в природе. Самый стабильный известный изотоп, рентгений-282, имеет период полураспада 100 секунд, хотя неподтвержденный рентгений-286 может иметь более длительный период полураспада – около 10,7 минут. Рентгений был впервые создан в 1994 в Центре исследований тяжелых ионов им. Гельмгольца GSI недалеко от Дармштадта, Германия.
Рентгений был впервые создан в 1994 в Центре исследований тяжелых ионов им. Гельмгольца GSI недалеко от Дармштадта, Германия.
Нихоний — синтетический химический элемент с символом Nh и атомным номером 113. Он чрезвычайно радиоактивен; его самый стабильный известный изотоп, нихоний-286, имеет период полураспада около 10 секунд.
Флеровий — сверхтяжелый искусственный химический элемент с символом Fl и атомным номером 114. Это чрезвычайно радиоактивный синтетический элемент. Элемент назван в честь Лаборатории ядерных реакций имени Флерова Объединенного института ядерных исследований в Дубне, Россия, где этот элемент был открыт в 1998.
Московий — синтетический химический элемент с символом Mc и атомным номером 115. Впервые он был синтезирован в 2003 году совместной группой российских и американских ученых в Объединенном институте ядерных исследований (ОИЯИ) в Дубне, Россия. . В декабре 2015 года он был признан одним из четырех новых элементов Совместной рабочей группой международных научных организаций IUPAC и IUPAP.
Ливерморий представляет собой синтетический химический элемент с символом Lv и атомным номером 116. Это чрезвычайно радиоактивный элемент, который был создан только в лаборатории и не наблюдался в природе. Известны четыре изотопа ливермория с массовыми числами от 29 до0 и 293 включительно; самым долгоживущим среди них является ливерморий-293 с периодом полураспада около 60 миллисекунд.
Теннессин — синтетический химический элемент с символом Ts и атомным номером 117. Это второй по тяжести известный элемент и предпоследний элемент 7-го периода таблицы Менделеева. Об открытии теннессина было официально объявлено в Дубне, Россия, российско-американским сотрудничеством в апреле 2010 года, что делает его самым последним открытым элементом по состоянию на 2019 год..
Оганессон — синтетический химический элемент с символом Og и атомным номером 118. Впервые он был синтезирован в 2002 г. в Объединенном институте ядерных исследований (ОИЯИ) в Дубне под Москвой, Россия, совместной группой российских и американских ученых.
Мы надеемся, что вам понравилось читать наш путеводитель по всем элементам периодической таблицы, мы уверены, что у вас есть вопросы, просто оставьте комментарий ниже, и мы сделаем все возможное, чтобы ответить на любой из них. Большое спасибо команде Википедии за помощь в составлении этого руководства.
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Весы | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Fe | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Весы | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите количество нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Весы | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найти электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | Нет | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Fe | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Весы | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Fe | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите количество нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Определение плотности на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | мг | |
| 66 | Найдите число электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите количество нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт. ст. ст. | |
| 71 | Найдите количество нейтронов | Б | |
| 72 | Найдите массу отдельного атома | Ли | |
| 73 | Найдите эмпирическую формулу | Н=12%, С=54%, N=20 | , , |
| 74 | Найдите число протонов | Быть | Быть |
| 75 | Найдите массу 1 моля | На | |
| 76 | Найдите электронную конфигурацию | Со | |
| 77 | Найдите электронную конфигурацию | С | |
| 78 | Весы | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Весы | Н_2+О_2→Н_2О | |
| 80 | Найдите электронную конфигурацию | Р | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Ал | |
| 83 | Найдите электронную конфигурацию | Ар | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | Н_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | Р | |
| 88 | Найдите количество нейтронов | мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | н/д+кл | |
| 92 | Определить, растворимо ли соединение в воде | Н_2SO_4 | |
| 93 | Определение плотности на STP | NaCl | |
| 94 | Найти степени окисления | C_6H_12O_6 | |
| 95 | Найти степени окисления | Нет | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Кл | |
| 98 | Найдите атомную массу | Fe | |
| 99 | Найдите эмпирическую/самую простую формулу | СО_2 | |
| 100 | Найдите количество нейтронов | Мт |
Хром – Атомный номер – Атомная масса – Плотность хрома
Автор
Атомный номер хрома
Хром представляет собой химический элемент с атомным номером 24 , что означает, что в атомной структуре 24 протона и 24 электрона. Химический символ для хрома — это Cr .
Поскольку количество электронов отвечает за химическое поведение атомов, атомный номер идентифицирует различные химические элементы.
Как атомный номер определяет химическое поведение атомов?
Атомная масса хрома
Атомная масса хрома 51,9961 ед.
Обратите внимание, что каждый элемент может содержать больше изотопов. Следовательно, эта результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их распространенности.
Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 х 10 -24 грамма. Одна единая атомная единица массы составляет приблизительно массы одного нуклона (либо отдельного протона, либо нейтрона) и численно эквивалентна 1 г/моль.
Одна единая атомная единица массы составляет приблизительно массы одного нуклона (либо отдельного протона, либо нейтрона) и численно эквивалентна 1 г/моль.
Для 12 C атомная масса точно равна 12u, так как по ней определяется единица атомной массы. Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0,1 ед от массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в основном ядерном состоянии равна 62, Существует две причины различия между массовым числом и изотопной массой, известной как дефект массы: Число атомной массы определяет прежде всего атомную массу атомов. Массовое число различно для каждого изотопа химического элемента. Как атомная масса определяет плотность материалов? Плотность хрома 7,14 г/см 3 . Типичные плотности различных веществ при атмосферном давлении. Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, деленная на объем: ρ = m/V вещества, деленное на общий объем (V), занимаемый этим веществом. See also: What is Density See also: Densest Materials of the Earth ед.  Ядро с большей энергией связи имеет меньшую общую энергию и, следовательно, меньшую массу в соответствии с соотношением эквивалентности массы и энергии Эйнштейна E = mc 2 . Для 63 Cu, атомная масса меньше 63, поэтому этот фактор должен быть доминирующим.
Ядро с большей энергией связи имеет меньшую общую энергию и, следовательно, меньшую массу в соответствии с соотношением эквивалентности массы и энергии Эйнштейна E = mc 2 . Для 63 Cu, атомная масса меньше 63, поэтому этот фактор должен быть доминирующим. Плотность хрома
 Стандартная единица СИ – килограммов на кубический метр ( кг/м 3 ). Стандартной английской единицей измерения является масса фунтов на кубический фут ( фунтов/фут 3 ).
Стандартная единица СИ – килограммов на кубический метр ( кг/м 3 ). Стандартной английской единицей измерения является масса фунтов на кубический фут ( фунтов/фут 3 ). Chromium – Properties Summary
Element Chromium Atomic Number 24 Символ Cr Element Category Transition Metal Phase at STP Solid Atomic Mass [amu] 51.9961 Density at STP [g/cm3] 7.14 Электронная конфигурация [AR] 3D5 4S1 Возможные состояния окисления +2,3,6 Электроновоеазаменность [KJ/MOL] 3 [KJ/MOL] 4 . 

 ФОТО
ФОТО