Галлий
| Галлий | |
|---|---|
| Атомный номер | 31 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
69,723 а. е. м. (г/моль) |
| Радиус атома | 141 пм |
|
Энергия ионизации (первый электрон) |
578,7 (6,00) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s2 4p1 |
| Химические свойства | |
| Ковалентный радиус | 126 пм |
| Радиус иона | (+3e) 62 (+1e) 81 пм |
|
Электроотрицательность (по Полингу) |
1,81 |
| Электродный потенциал | 0 |
| Степени окисления | 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 5,91 г/см³ |
| Молярная теплоёмкость | 26,07[1]Дж/(K·моль) |
| Теплопроводность | 28,1 Вт/(м·K) |
| Температура плавления | 302,93 K |
| Теплота плавления | 5,59 кДж/моль |
| Температура кипения | 2 676 K |
| Теплота испарения | 270,3 кДж/моль |
| Молярный объём | 11,8 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | a=4,519 b=7,658 c=4,526 Å |
| Отношение c/a | — |
| Температура Дебая | 240 K |
| Ga | 31 |
| 69,723 | |
|
|
|
| Галлий | |
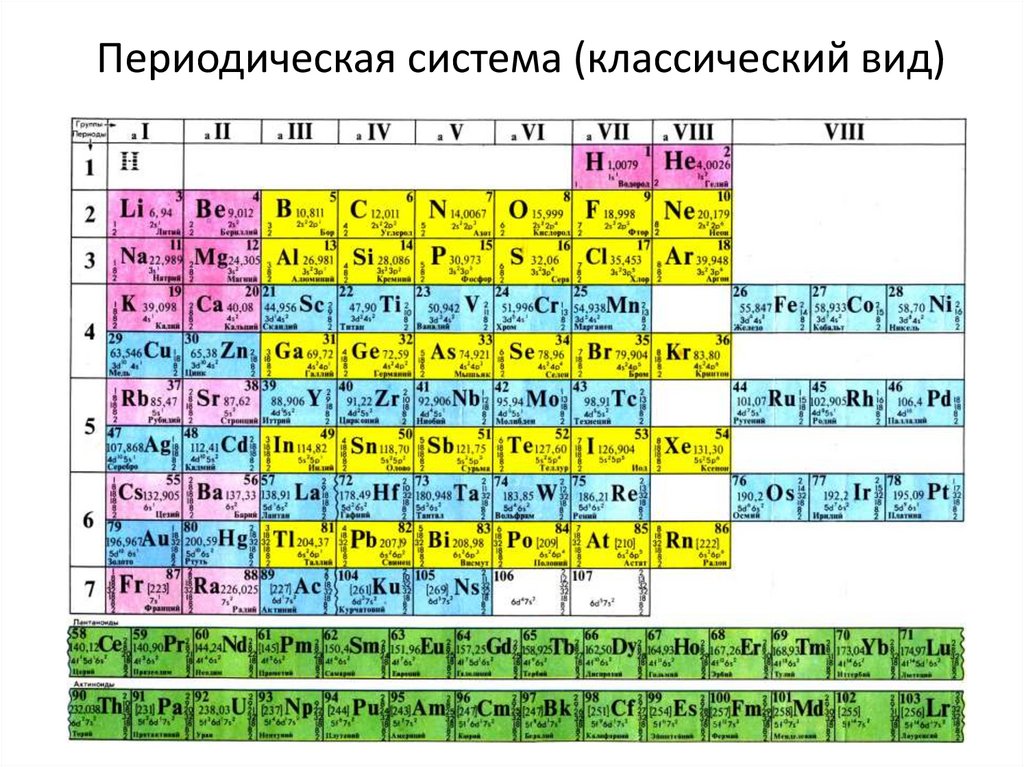
Галлий — элемент главной подгруппы третьей группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 31. Обозначается символом Ga (лат. Gallium). Относится к группе лёгких металлов. Простое вещество галлий (CAS-номер: 7440-55-3) — мягкий пластичный металл серебристо-белого (по другим данным светло-серого) цвета с синеватым оттенком.
И. Менделеева, атомный номер 31. Обозначается символом Ga (лат. Gallium). Относится к группе лёгких металлов. Простое вещество галлий (CAS-номер: 7440-55-3) — мягкий пластичный металл серебристо-белого (по другим данным светло-серого) цвета с синеватым оттенком.
История
Схема атома галлия
Французский химик Поль Эмиль Лекок де Буабодран вошел в историю как открыватель трех новых элементов: галлия (1875), самария (1879) и диспрозия (1886). Первое из этих открытий принесло ему славу.
В то время за пределами Франции он был мало известен. Ему было 38 лет, занимался он преимущественно спектроскопическими исследованиями. Спектроскопистом Лекок де Буабодран был хорошим, и это, в конечном счете, привело к успеху: все три свои элемента он открыл методом спектрального анализа.
В 1875 году Лекок де Буабодран исследовал спектр цинковой обманки, привезенной из Пьеррфита (Пиренеи). В этом спектре и была обнаружена новая фиолетовая линия.
Происхождение названия
Д. И. Менделеев в соответствии с открытым им в марте 1869 года периодическим законом предсказал существование этого элемента, назвав его эка-алюминием. Поль Эмиль Лекок де Буабодран назвал его в честь своей родины Франции, по её латинскому названию — Галлия (
 Кроме того на латыни «петух» — gallus. Открытие галлия — первое подтверждение справедливости выявленных Д. И. Менделеевым закономерностей.
Кроме того на латыни «петух» — gallus. Открытие галлия — первое подтверждение справедливости выявленных Д. И. Менделеевым закономерностей.Нахождение в природе
Нахождение в природе. Галлий — типичный рассеянный элемент, иногда его также относят и к редким. Кларк (числовая оценка среднего содержания в земной коре) галлия в земной коре довольно велик и составляет 1,5·10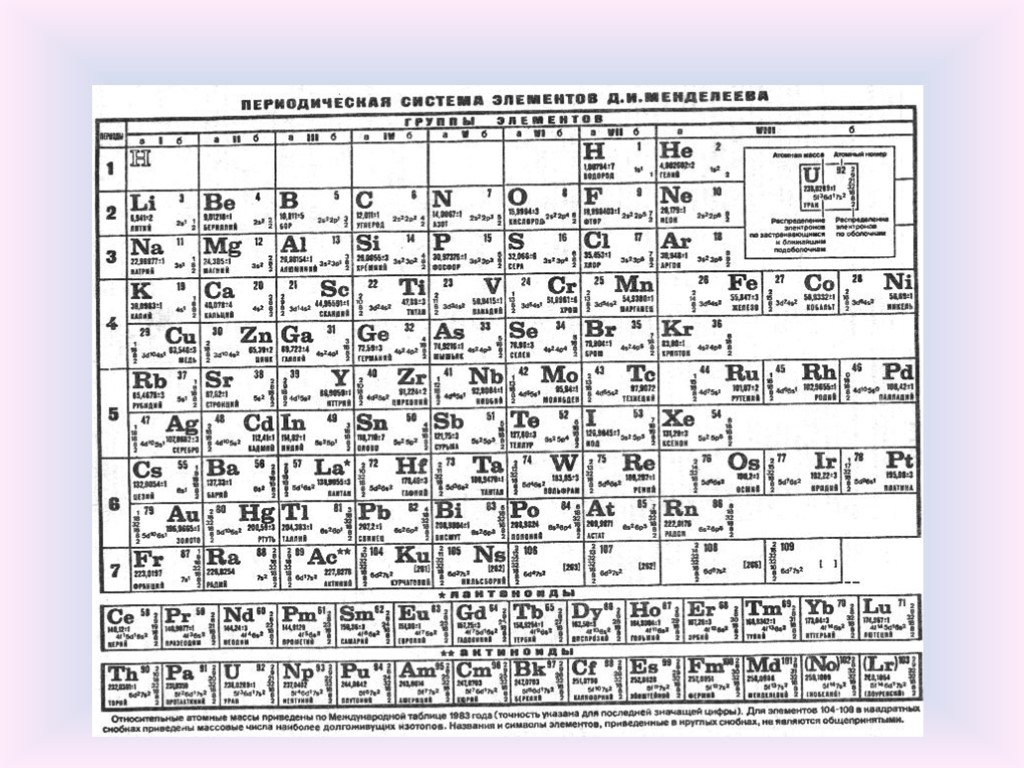

Основные мировые резервы галлия связывают с месторождениями бокситов, запасы которых настолько велики, что не будут истощены в течение многих десятилетий. Однако большая часть галлия, содержащегося в боксите, остается недоступной вследствие недостатка производственных мощностей, объем которых диктуется экономическими причинами. Реальные запасы галлия трудно поддаются оценке. По мнению специалистов U.
Получение
Галлий получают электролизом щелочного раствора галлата натрия. При электролизе одновременно с галлием на катоде выделяется водород, причем потенциалы их, как уже отмечалось, близки. Смещение потенциала галлия в отрицательную сторону с ростом щелочности раствора ведет к снижению доли тока, затрачиваемого на выделение галлия и, соответственно, возрастанию доли тока, затрачиваемого на выделение водорода. Для повышения выхода галлия по току растворы должны содержать минимальное количество щелочи.
С повышением концентрации галлия в растворе выход по току возрастает вследствие смешения потенциала в положительную сторону.
С ростом катодной плотности тока скорость выделения водорода возрастает в большей степени, чем галлия, поэтому выбирают оптимальную плотность тока, при которой обеспечивается необходимая скорость выделения галлия.
Электролит приготовляют, растворяя галлиевый концентрат или технический оксид галлия в растворе гидроксида натрия. В зависимости от состава исходного материала растворы содержат, г/л: Ga2O3 5-100, Al2О3 70-150 (при растворении концентрата), NaOH 100—200, примеси соединений Si, Pb, Zn, Си, V, Mo, Fe и др.
Электролиз проводят при 50-70 °C в прямоугольных ваннах. Катоды из нержавеющей стали и аноды (из стали или никеля) расположены последовательно, расстояние между ними 2-4 см. Жидкий галлий стекает с катода на дно ванны. Электролиз ведут при катодной плотности тока i = 0,3 + 1,5 А/см² и анодной плотности тока в 3 — 10 раз ниже катодной. При концентрации галлия 50 — 100 г/л выход по току составляет (в зависимости от плотности тока) 30-60 %. За 6 — 10 ч электролиза выделяется 97 — 99 % галлия.
Примеси Cu, Zn, Pb, Sn, Fe осаждаются вместе с галлием. Кремний и алюминий переходят в металл в малой степени. Примеси VO3 и МоО2,- восстанавливаются до низших оксидов, образующих налет на катоде, что тормозит электролиз.
Разработаны варианты проведения электролиза с жидким галлиевым катодом. В этом случае галлий выделяется при более высоком потенциале, чем на твердом катоде из нержавеющей стали. Это повышает выход по току и позволяет выделять галлий из растворов с относительно низкой его концентрацией.
Физические свойства
Кристаллический галий имеет несколько полиморфных модификаций, однако термодинамически устойчивой является только одна (I), имеющая орторомбическую (псевдотетрагональную) решётку с параметрами а = 4,5186 Å, b = 7,6570 Å, c = 4,5256 Å. Другие модификации галлия (β, γ, δ, ε) кристаллизуются из переохлаждённого диспергированного металла и являются нестабильными. При повышенном давлении наблюдались ещё две полиморфные структуры галлия II и III, имеющие, соответственно, кубическую и тетрагональную решётки [1].
Плотность галлия в твёрдом состоянии при температуре T=20 °C равна 5,904 г/см³, жидкий галлий при T=29,8 °C имеет плотность 6,095 г/см³, то есть при затвердевании объём галлия увеличивается. Температура плавления галлия немного выше комнатной и равна Tпл.=29,8 °C, кипит галлий при Tкип.=2230 °C.
Температура плавления галлия немного выше комнатной и равна Tпл.=29,8 °C, кипит галлий при Tкип.=2230 °C.
Одной из особенностей галлия является широкий температурный интервал существования жидкого состояния (от 30 и до 2230 °C), при этом он имеет низкое давление пара при температурах до 1100÷1200 °C. Удельная теплоёмкость твёрдого галлия в температурном интервале T=0÷24 °C равна 376,7 Дж/кг·К (0,09 кал/г·град.), в жидком состоянии при T=29÷100 °C — 410 Дж/кг·К (0,098 кал/г·град).
Удельное электрическое сопротивление в твёрдом и жидком состоянии равны, соответственно, 53,4·10−6 ом·см (при T=0 °C) и 27,2·10−6 ом·см (при T=30 °C). Вязкость жидкого галлия при разных температурах равна 1,612 пуаз при T=98 °C и 0,578 пуаз при T=1100 °C. Поверхностное натяжение, измеренное при 30 °C в атмосфере водорода равно 0,735 н/м. Коэффициенты отражения для длин волн 4360 Å и 5890 Å составляют 75,6 % и 71,3 %, соответственно.
Природный галлий состоит из двух изотопов 69Ga (61,2 %) и 71Ga (38,8 %). Поперечное сечение захвата тепловых нейтронов равно для них 2,1·10−28 м² и 5,1·10−28 м², соответственно.
Поперечное сечение захвата тепловых нейтронов равно для них 2,1·10−28 м² и 5,1·10−28 м², соответственно.
Химические свойства
Основные соединения
- Ga2H6 — летучая жидкость, tпл −21,4 °C, tкип 139 °C. В эфирной суспензии с гидратом лития или таллия образует соединения LiGaH4 и TlGaH4. Образуется в результате обработки тетраметилдигаллана триэтиламином. Имеются банановые связи, как и в диборане
-
Ga2O3 — белый или жёлтый порошок, tпл 1795 °C. Существует в виде двух модификаций. α-Ga2О3 — бесцветные тригональные кристаллы с плотностью 6,48 г/см³, малорастворимые в воде, растворимые в кислотах. β-Ga2О3 — бесцветные моноклинные кристаллы c плотностью 5,88 г/см³ [2], малорастворимые в воде, кислотах и щёлочах. Получают нагреванием металлического галлия на воздухе при 260 °C или в атмосфере кислорода, или прокаливанием нитрата или сульфата галлия.
 ΔH°298(обр) −1089,10 кДж/моль; ΔG°298(обр) −998,24 кДж/моль; S°298 84,98 Дж/моль*K. Проявляют амфотерные свойства, хотя основные свойства, по сравнению с алюминием, усилены:
ΔH°298(обр) −1089,10 кДж/моль; ΔG°298(обр) −998,24 кДж/моль; S°298 84,98 Дж/моль*K. Проявляют амфотерные свойства, хотя основные свойства, по сравнению с алюминием, усилены:
Ga2O3 + 6HCl = 2GaCl2Ga2O3 + 2NaOH + 3h3O = 2Na[Ga(OH)4]Ga2O3 + Na2CO3 = 2NaGaO2 + CO2
- Ga(OH)3 — выпадает в виде желеобразного осадка при обработке растворов солей трёхвалентного галлия гидроксидами и карбонатами щелочных металлов (pH 9,7). Растворяется в концентрированном аммиаке и концентрированном растворе карбоната аммония, при кипячении осаждается. Нагреванием гидроксид галлия можно перевести в GaOOH, затем в Ga2O3*H2O, и, наконец, в Ga2O3. Можно получить гидролизом солей трёхвалентного галлия.
-
GaF3 — белый порошок. tпл >1000 °C, tкип 950 °C , плотность — 4,47 г/см³. Малорастворим в воде.
 Известен кристаллогидрат GaF3*3Н2O. Получают нагреванием оксида галлия в атмосфере фтора.
Известен кристаллогидрат GaF3*3Н2O. Получают нагреванием оксида галлия в атмосфере фтора.
- GaCl3 — бесцветные гигроскопичные кристаллы. tпл 78 °C, tкип 215 °C, плотность — 2,47 г/см³. Хорошо растворим в воде. В водных растворах гидролизуется. Получают непосредственно из элементов. Применяется в качестве катализатора в органических синтезах.
- GaBr3 — бесцветные гигроскопичные кристаллы. tпл 122 °C, tкип 279 °C плотность — 3,69 г/см³. Растворяется в воде. В водных растворах гидролизуется. В аммиаке малорастворим. Получают непосредственно из элементов.
- GaI3 — гигроскопичные светло-жёлтые иглы. tпл 212 °C, tкип 346 °C, плотность — 4,15 г/см³. Гидролизуется тёплой водой. Получают непосредственно из элементов.
-
GaS3 — жёлтые кристаллы или белый аморфный порошок с tпл 1250 °C и плотностью 3,65 г/см³.
 Взаимодействует с водой, при этом полностью гидролизуется. Получают взаимодействием галлия с серой или сероводородом.
Взаимодействует с водой, при этом полностью гидролизуется. Получают взаимодействием галлия с серой или сероводородом.
- Ga2(SO4)3*18H2O — бесцветное, хорошо растворимое в воде вещество. Получается при взаимодействии галлия, его оксида и гидроксида с серной кислотой. С сульфатами щелочных металлов и аммония легко образует квасцы, например, KGa(SO4)2*12Н2О.
- Ga(NO3)3*8H2O — бесцветные, растворимые в воде и этаноле кристаллы. При нагревании разлагается с образованием оксида галлия (III). Получается действием азотной кислоты на гидроксид галлия.
Галлий образует полимерные гидриды:
4LiH + GaCl3 = Li[Gah5] + 3LiCl
Устойчивость ионов падает в ряду BH4– → AlH4– → GaH4–. Ион BH4– устойчив в водном растворе, AlH4– и GaH4– быстро гидролизуются:
Gah5— + 4h3O = Ga(OH)3 + OH- + 4h3-
При нагревании под давлением галлий реагирует с водой:
2Ga + 4h3O = 2GaOOH + 3h3-
С минеральными кислотами Ga медленно реагирует с выделением водорода:
2Ga + 6HCl = 2GaCl3 + 3h3↑
Галлий растворяется в щелочах с образованием гидроксогаллатов:
2Ga + 6h3O + 2NaOH = 2Na[Ga(OH)4] + 3h3↑
При растворении Ga(OH)3 и Ga2O3 в кислотах образуются аквакомплексы [Ga(H2O)6]3+, поэтому из водных растворов соли галлия выделяются в виде кристаллогидратов, например, хлорид галлия GaCl3*6H2O, галлийкалиевые квасцы KGa(SO4)2*12H2O. Аквакомплексы галлия в растворах бесцветны.
Аквакомплексы галлия в растворах бесцветны.
Применение
Арсенид галлия GaAs — перспективный материал для полупроводниковой электроники.
Изотоп галлий-71 является важнейшим материалом для регистрации нейтрино, и в этой связи перед техникой стоит весьма актуальная задача выделения этого изотопа из природной смеси в целях повышения чувствительности детекторов нейтрино. Так как содержание 71Ga составляет в природной смеси изотопов около 39,9 %, то выделение чистого изотопа и использование его в качестве детектора нейтрино способно повысить чувствительность регистрации в 2,5 раза.
Галлий дорог, в 2005 году на мировом рынке тонна галлия стоила 1,2 млн долларов США, и в связи с высокой ценой и в то же время с большой потребностью в этом металле очень важно наладить его полное извлечение при алюминиевом производстве и переработке каменных углей на жидкое топливо.
Галлий имеет ряд сплавов, жидких при комнатной температуре, и один из его сплавов имеет температуру плавления 3 °C, но с другой стороны галлий (сплавы в меньшей степени) весьма агрессивен к большинству конструкционных материалов (растрескивание и размывание сплавов при высокой температуре), и как теплоноситель он малоэффективен, а зачастую просто неприемлем.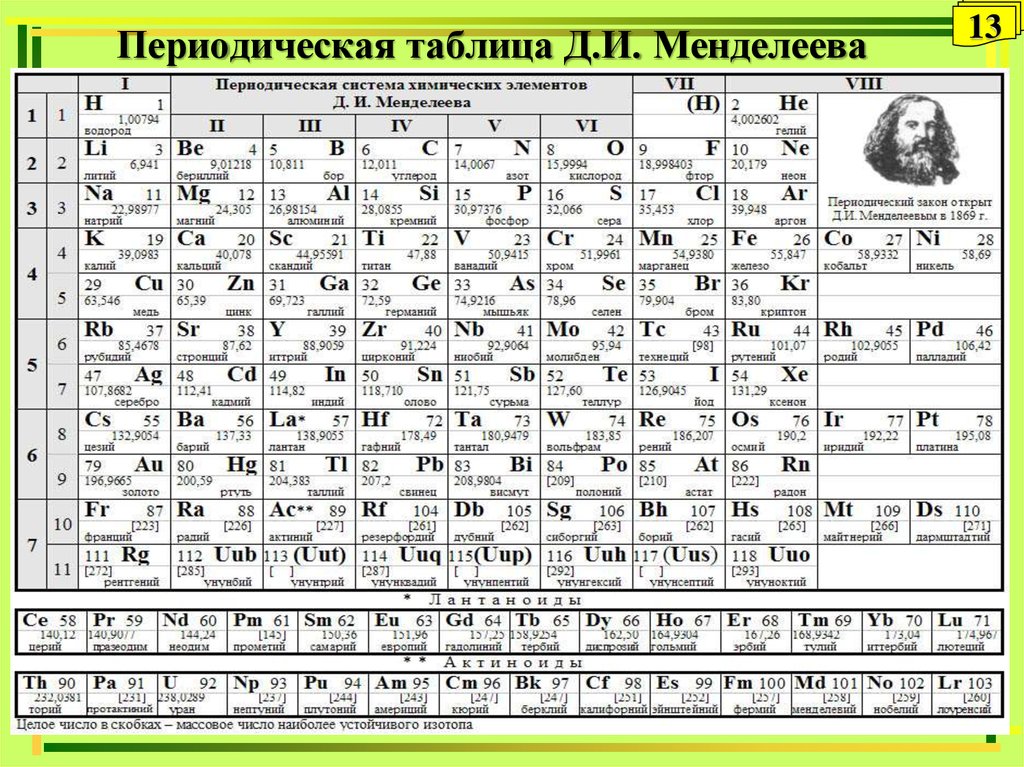
Галлий — превосходный смазочный материал. На основе галлия и никеля, галлия и скандия созданы практически очень важные металлические клеи.
Оксид галлия входит в состав ряда стратегически важных лазерных материалов группы гранатов — ГСГГ, ИАГ, ИСГГ и др.
Биологическая роль и особенности обращения
Не играет биологической роли.
Контакт кожи с галлием приводит к тому, что сверхмалые дисперсные частицы металла остаются на ней. Внешне это выглядит как серое пятно. Имелись сообщения о развитии дерматитов при контакте с галлием.
О токсичности галлия мало данных. Из-за низкой температуры плавления слитки галлия рекомендуется транспортировать в пакетах из полиэтилена, который плохо смачивается жидким галлием.
Дополнтельная информация
Категория:Соединения галлия
Галлий как химический элемент таблицы Менделеева
Г Галлий является химическим элементом таблицы Менделеева с атомным номером 31 и условным обозначением Ga. Галлий представляет собой мягкий хрупкий металл серебристо-белого цвета с синеватым оттенком.
Галлий представляет собой мягкий хрупкий металл серебристо-белого цвета с синеватым оттенком.
Содержание
- Как был открыт Галлий;
- Где и как добывают Галлий;
- Распространенность Галлия;
- Применение Галлия;
- Интересные факты
История такого химического элемента как галлий очень занимательна. Русский ученый и химик Дмитрий Иванович Менделеев в 1871 году при составлении своей элементарной таблицы предсказал наличие нового химического элемента. Он предсказал его атомную массу и некоторые свойства, и назвал его эко-алюминий. Дмитрий Иванович предсказал, что этот элемент будет обнаружен с помощью спектроскопа. Не обнаруженный на тот момент эко-алюминий не должен реагировать с воздухом и будет медленно растворяться в кислотах.
В 1875 году французский химик Поль Эмиль Лекок Буасбаудран с помощью спектроскопии открыл новый химический элемент при изучении сфалерита. Название Галлий ему было дано в честь Родины первооткрывателя. Отделил чистый элемент так же Лекок методом электролиза водного раствора гидроксида калия.
Отделил чистый элемент так же Лекок методом электролиза водного раствора гидроксида калия.
Мировое производство галлия составляет ежегодно порядка 300 тонн. Он является побочным продуктом при переработке руд других металлов, поэтому объем его добычи зависит именно от них. Основным источником при добыче галлия является боксит(руда для получения алюминия), но в гораздо меньших количествах его можно получить из сфалерита(руда для получения цинка). При переработке бокситов галлий накапливается в растворе гидроксида натрия. Из этого раствора можно извлечь элемент множеством способов.
Самый последний метод извлечения заключается в использовании ионообменной смолы. Конечная эффективность добычи зависит от того сколько галлия присутствовало в бокситной руде. Если концентрация составляла стандартное значение 50 частей на миллион, то извлечь возможно только 7.5 частей. Количество, которое можно извлечь обычно составляет около 15%. После этого методом двойного электролиза получают очищенный элемент. После первого электролиза чистота элемента получается порядка 80%.Чистота галлия после второго электролиза при использовании этого метода составяет 99.997%. Правда на выходе чистого элемента получается гораздо меньше. Из добытых 300 тонн галлия на выходе чистого элемента получается всего 180 тонн.
После этого методом двойного электролиза получают очищенный элемент. После первого электролиза чистота элемента получается порядка 80%.Чистота галлия после второго электролиза при использовании этого метода составяет 99.997%. Правда на выходе чистого элемента получается гораздо меньше. Из добытых 300 тонн галлия на выходе чистого элемента получается всего 180 тонн.
Распространенность галлия является понятием относительным. Во Вселенной этот элемент пока не оценен, потому что это сделать пока непредставляется возможным. На нашей планете он является довольно редким элементом. В земной коре его присутствие оценивается в 19 частей на миллион. Его распространенность сопоставима с литием и свинцом. Ученые оценивают мировые запасы галлия в 1.6 миллионов тонн. В свободном виде этот химический элемент в природе не встречается или пока он просто не был обнаружен. Сегодня его принято добывать из алюминиевых, цинковых и германиевых руд в качестве побочного продукта. Содержание галлия в этих рудах обычно очень низкое.
Содержание галлия в этих рудах обычно очень низкое.
В бокситах(алюминиевая руда) его содержание не превышает 0,008%. Самое высокое содержание галлий находит в германиевой руде. Его концентрация составляет в ней не более 1%. Были предприняты попытки добычи галиия из германиевой руды, но это производство оказалось нерентабельным и от этой идеи отказались. Так же галлий можно обнаружить в некоторых минералах, но они являются очень редкими. К таким минералам относится галлит, сонгеит и цумгаллит. К слову, эти минералы являются настолько редкими, что к примеру сонгеит встречается в единственном, известном на сегодняшний день, месте в мире. Сонгеит добывается только в Республике Намибия в шахте Цумеб. Пока его распространенность редкая, но, возможно, все изменится.
Применение ГаллияПрименение галлия из-за его редкости является не очень широким, но его востребованность растет с каждым годом. Его применение затрагивает в той или инной степени разные сферы деятельности. Самыми важными из них является электроника, медицина, военная и ядерная промышленность.
Самыми важными из них является электроника, медицина, военная и ядерная промышленность.
В силу своих свойств 98% применения галлия составляют полупроводниковые элементы. Для этих нужд используется высокочистый галлий(чистота 99,999%) в соединении с другими элементами и сплавами. Самыми коммерчески важными соединениями являются арсенид, антимонид, фосфид и нитрид галлия. Чтобы было понятно, арсенид галлия представляет собой соединение с мышьяком. Антимонид в свою очередь является соединением галлия с сурьмой.
Среди вышеперечисленных материалов арсенид галлия является вторым по распространенности полупроводниковым материалом после кремния. Если брать в сравнение с кремнием арсенид галлия по некоторым свойствам значительно превосходит его. Этот материал обладает более высокой пропускной способностью. Это позволяет найти ему более широкое применение в электросфере. Например, в мобильных электронных устройствах радиоприемные антенны изготавливаются именно из арсенида галлия, которые обеспечивают прием интернета и телефонной связи. Спрос на него с каждым годом только увеличивается с появлением технологий передачи данных 4G и 5G, за счет которого они и развиваются. Другие сплавы так же находят применение в печатных платах электронных устройств, в устройствах чтения компакт-дисков, светодиодах(испускают синий цвет) и многом другом.
Спрос на него с каждым годом только увеличивается с появлением технологий передачи данных 4G и 5G, за счет которого они и развиваются. Другие сплавы так же находят применение в печатных платах электронных устройств, в устройствах чтения компакт-дисков, светодиодах(испускают синий цвет) и многом другом.
В военной промышленности так же галлий находит свое применение в радиоэлектронных устройствах. В пример можно поставить исполнительные элементы связи со спутниками и марсоходами.
Так же этот элемент является компонентом исполнительных элементов солнечных батарей в качестве замены кремнию. В медицине галлий используется в медицинских термометрах(сплав галлия, олова и индия), так как использовать ртуть запретили. Радиоизотоп галлия-67 используется для обнаружения очагов воспаления таких болезней как туберкулез, остеомиелит, пневмонии и другого рода инфекции и опухолей(в том числе и раковых). В ядерной промышленности этот элемент используется в составе сплава теплообменников в ядерных реакторах.
Интересных фактов связанных с галлием из-за его редкости не так уж и много, но все же они есть. Стоит начать с самого открытия. Дело в том, что Поль Эмиль Лекок Буасбаудран назвал этот элемент галлий в честь своей Родины, но на тот момент было альтернативное предположение. Научный мир предположил, что Лекок назвал этот элемент в честь себя. Это заявление было обосновано тем, что слово «петух» на французском выглядит как «Le coq» и на латыни пишется «Gallus». В статье 1877 года французский химик опроверг это предположение.
Еще одним интересным моментом является то, что металлический галлий является сам по себе не токсичным веществом. В принципе, как и роль его в организме в качестве микроэлемента тоже пока не выяснена. Внешне он очень напоминает алюминий в твердом состоянии, но его температура плавления составляет всего 29°C. В связи с этим его свойством у химиков существует своего рода шутка. Суть ее заключается в том, чтобы вылепить из галлия чайную ложку, заварить горячий чай своему товарищу и поместить туда эту ложку.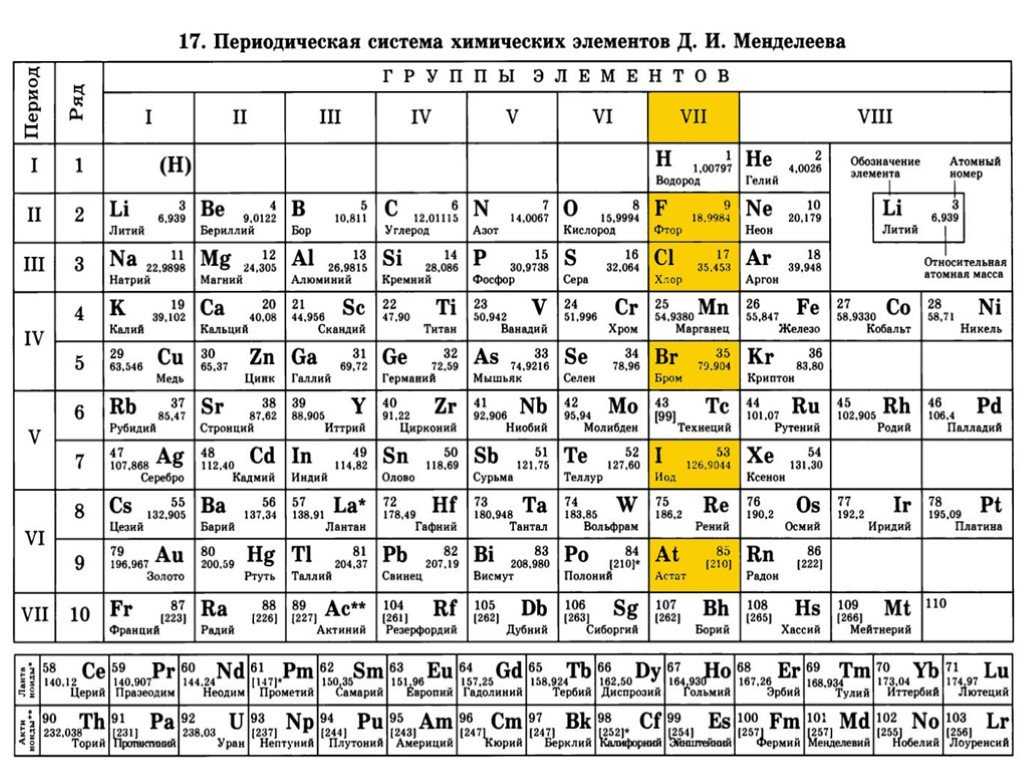 Интересной становится реакция объекта шутки, когда металлическая ложка начинает растворяться в горячем чае при помешивании.
Интересной становится реакция объекта шутки, когда металлическая ложка начинает растворяться в горячем чае при помешивании.
Химия галлия (Z=31) – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 554
Галлий — это химический элемент с атомным номером 31 и символом Ga в периодической таблице. Он находится в семействе боров (группа 13) и в периоде 4. Галлий был открыт в 1875 году Полем Эмилем Лекоком де Буабодраном. Буабодран назвал свой недавно открытый элемент в честь себя, происходящего от латинского слова «Галлия», что означает «Галлия». Элементарный галлий не существует в природе, но соль галлия (III) может быть извлечена в небольших количествах из бокситов и цинковых руд. Кроме того, известно, что он сжижается при температуре чуть выше комнатной.
Кроме того, известно, что он сжижается при температуре чуть выше комнатной.
Введение
Галлий — один из элементов, первоначально предсказанных Менделеевым в 1871 году, когда он опубликовал первую форму таблицы Менделеева. Он назвал его экаалюминием, указав, что он должен иметь химические свойства, подобные алюминию. Настоящий металл был выделен и назван (от латинского Gallia, Франция) Полом-Эмилем Лекоком де Буабодраном в 1875 году. минерал, сфалерит. Затем последовали окончательная добыча и характеристика. Сегодня большая часть галлия по-прежнему извлекается из этого минерала цинка.
Хотя галлий когда-то считался малоизвестным, он стал важным коммерческим продуктом в 70-х годах с появлением светодиодов на основе арсенида галлия и лазерных диодов. При комнатной температуре галлий мягок, как свинец, и его можно резать ножом. Его температура плавления аномально низкая, и он начнет таять на ладони теплой руки. Галлий — один из немногих металлов, расширяющихся при замерзании.
Основные химические и физические свойства
| Атомный номер | 31 |
| Атомная масса | 69,723 г/моль |
| Категория элемента | Постпереходный металл |
| Фаза | Твердый |
| Электроотрицательность | 1,6 (шкала Полинга) |
| Плотность (при 0 o С) | 5,91 г/см 3 |
| Точка плавления | 29.7646 или С |
| Точка кипения | 2204 или С |
| Атомный радиус | 135 вечера |
| Ионный радиус | 62 вечера |
| Изотопы | 2 ( 69 млрд лет; 60,11% и 71 млрд лет; 39,89%) |
| 1-я энергия ионизации | 578,8 кДж/моль |
| Потенциал электрода | -0,56 е о |
| Электропроводность | 9. 1 1 |
| Степени окисления | +3 , +2, +1 |
| Твердость | 1,5 (Моос) 60 МПа (по Бринеллю) |
| Кристаллическая структура | Ромбическая |
| Удельная теплоемкость | 25,86 Дж/мольК |
| Теплота плавления | 5,59 кДж/моль |
| Теплота испарения | 254 кДж/моль |
| Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 9 4 100970 6 | 00070
Характеристики
Галлий имеет несколько примечательных характеристик, которые кратко изложены ниже:
- В твердой фазе галлий имеет сине-серый цвет
- Плавится при температуре выше комнатной; поэтому, если вы возьмете в руку кусок галлия, он начнет разжижаться.

- Твердый галлий мягкий и легко режется ножом.
- Стабилен на воздухе и в воде, но реагирует и растворяется в кислотах и щелочах.
- При затвердевании галлий расширяется на 3,1 процента, поэтому его нельзя хранить в стекле или металле.
- Он также легко превращается в сплав со многими металлами и использовался в ядерных бомбах для стабилизации кристаллической структуры.
- Галлий — один из немногих металлов, который может заменить ртуть в термометрах, поскольку его температура плавления близка к комнатной температуре.
Видео 1 : на видео показано затвердевание жидкого галлия с 10-кратной скоростью. Плотность твердого галлия меньше плотности жидкого, поэтому при затвердевании он расширяется и разбивает бутылку.
Видео 2: На видео видно, как галлий плавится в ваших руках из-за его температуры плавления.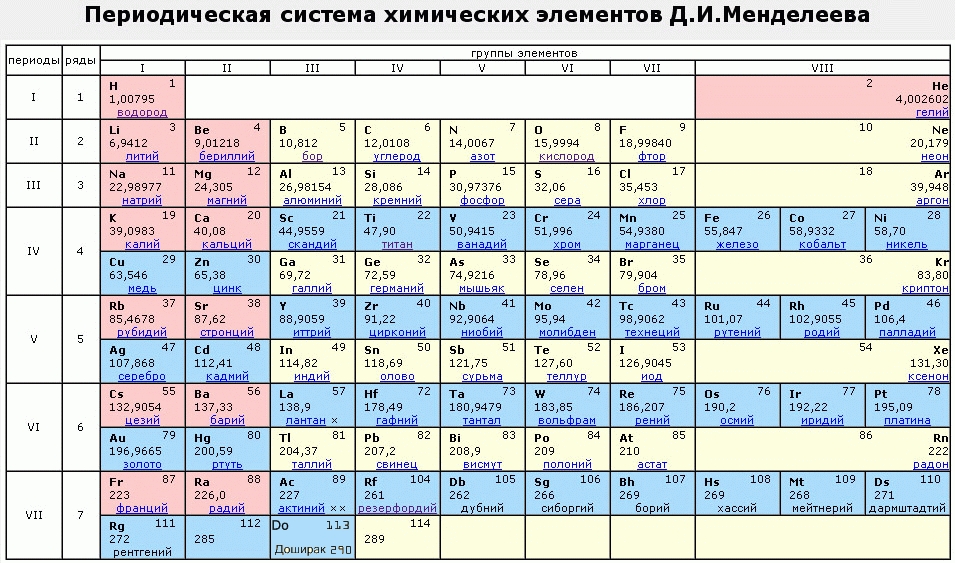
Возникновение
Галлий обычно не встречается в природе. Он существует в земной коре, где его численность составляет около 16,9частей на миллион Его добывают из бокситов и иногда из сфалерита. Галлий также можно найти в угле, диаспоре и германите.
Области применения
Здоровье : Несмотря на то, что галлий может быть обнаружен в организме человека в очень малых количествах, нет никаких доказательств того, что он наносит вред организму. Фактически, соль галлия (III) используется во многих фармацевтических препаратах для лечения гиперкальциемии, которая может привести к росту опухолей на костях. Кроме того, было даже высказано предположение, что его можно использовать для лечения рака, инфекционных и воспалительных заболеваний. Однако воздействие большого количества галлия может вызвать раздражение горла, боли в груди, а выделяемый им дым может привести к очень серьезным заболеваниям.
Полупроводники : Примерно 90-95% потребления галлия приходится на электронную промышленность. В Соединенных Штатах арсенид галлия (GaAs) и нитрид галлия (GaN) составляют примерно 98% потребления галлия. Арсенид галлия (GaAs) может напрямую преобразовывать свет в электричество. Кроме того, арсенид галлия также используется в светодиодах и транзисторах.
В Соединенных Штатах арсенид галлия (GaAs) и нитрид галлия (GaN) составляют примерно 98% потребления галлия. Арсенид галлия (GaAs) может напрямую преобразовывать свет в электричество. Кроме того, арсенид галлия также используется в светодиодах и транзисторах.
Другие области применения галлия связаны со смачиванием и улучшением качества сплава:
Галлий обладает свойством смачивать фарфоровые и даже стеклянные поверхности. В результате галлий можно использовать для создания ослепительных зеркал. Ученые используют сплав с галлием для плутониевых ям ядерного оружия, чтобы стабилизировать аллотропы плутония. В результате у некоторых возникают проблемы с элементом.
Ссылки
- Петруччи, Харвуд, Херринг и Мадура – Общая химия, 9-е издание
Проблемы
- Какова электронная конфигурация галлия?
- Как вы думаете, какие проблемы могут возникнуть у людей при использовании галлия?
- Галлий является частью какой группы и периода?
- Каковы некоторые области применения галлия?
- Назовите три свойства галлия, которые отличают его от любого другого элемента.

Ответы
- 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P
1 2 3D 10 4P 101010101010101010101010101010101101010101010100110101010101101010 109. 2 3D 10 4. 9009 1 2 3D 10 4. 9009 1 2 3D 10 4. - Использование его в ядерных бомбах.
- Галлий находится в группе 13 (семейство бора) и в периоде 4.
- Полупроводники; лечение рака; лечение гиперкальциемии; стабилизация в ядерных бомбах. См. раздел выше о применении для более подробной информации.
- 5. Подробнее см. раздел о свойствах и характеристиках выше.
- Галлий в твердой фазе имеет сине-серый цвет.
- Плавится при температуре выше комнатной
- Стабилен на воздухе и в воде, но реагирует и растворяется в кислотах и щелочах.
Авторы и ссылки
- Анджела Танг, Саранг Дэйв
Стивен Р.
 Марсден
МарсденChemistry of Gallium (Z=31) распространяется под лицензией CC BY-NC-SA 4.0, автор, ремикс и/или куратор LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- Алюминий
- экаалюминий
- Галлий
- Менделеев
- периодическая таблица
- Полупроводники
Это элементарно – Периодическая таблица элементов
The Periodic Table of Elements
The Table of Elements
The Table of Elements
1 Hydrogen H 2 Helium He 3 Lithium LI 4 БЕРЕЛЛИЯ BE 5 BORON B B 7 8 7 999999999999998. 
C 7 Nitrogen N 8 Oxygen O 9 Fluorine F 10 Neon Ne 11 Sodium Na 12 Magnesium Mg 13 Aluminum Al 14 Silicon Si 15 Phosphorus P 16 Sulfur S 17 Chlorine Cl 18 Argon Ar 19 Калий K 20 Кальций CA 21 СКАНД 21 21 21 21 21 21 21 003922 Titanium Ti 23 Vanadium V 24 Chromium Cr 25 Manganese Mn 26 Iron FE 27 Кобальт CO 28 Никель NI 9999999999988 NI 99999999999999999988 NI 99999999999999999999998888 99999999999999999999988 Copper Cu 30 Zinc Zn 31 Gallium Ga 32 Germanium Ge 33 Arsenic As 34 Selenium Se 35 Bromine Br 36 Krypton Kr 37 Rubidium Rb 38 Strontium Sr 39 Yttrium Y 40 Zirconium Zr 41 Niobium NB 42 Molybdenum MO 43 Техеде 43 .  0042
004244 Ruthenium Ru 45 Rhodium Rh 46 Palladium Pd 47 Silver Ag 48 Cadmium Cd 49 Indium In 50 Tin Sn 51 Antimony Sb 52 Tellurium Te 53 Iodine I 54 Xenon Xe 55 Cesium Cs 56 Barium Ba 57 Lanthanum La 58 Cerium Ce 59 Praseodymium Pr 60 Neodymium Nd 61 Promethium Pm 62 Samarium Sm 63 Europium EU 64 Gadolinium GD 65 ТЕРБИЯ TB 9ТЕРБИЯ TB 9TB 90037 66 Dysprosium Dy 67 Holmium Ho 68 Erbium Er 69 Thulium Tm 70 Ytterbium Yb 71 Lutetium Lu 72 Hafnium Hf 73 Tantalum Ta 74 Tungsten W 75 Rhenium Re 76 Osmium Os 77 Iridium Ir 78 Platinum Pt 79 Gold Au 80 Mercury Hg 81 Thallium Tl 82 Lead Pb 83 Bismuth Bi 84 Polonium Po 85 Astatine At 86 Radon Rn 87 Francium Fr 88 Radium Ra 89 Actinium Ac 90 Thorium Th 91 Protactinium Pa 92 Uranium U 93 NEPTUNIUM NP 94 Plutonium PU 95 8888889 95 88888888888 гг.  0039
0039Am 96 Curium Cm 97 Berkelium Bk 98 Californium Cf 99 Einsteinium Es 100 Fermium FM 101 Mendelevium MD 102 NOBATELIUM 102 NOBATELIUM 8888888888888888888 NOBA0039 103 Lawrencium Lr 104 Rutherfordium Rf 105 Dubnium Db 106 Seaborgium Sg 107 Bohrium BH 108 HASSIUM HS 109 Meitnerium MT MT MT MT MT 0037 110 Darmstadtium Ds 111 Roentgenium Rg 112 Copernicium Cn 113 Nihonium Nh 114 Flerovium Фл 115 Московиум Мк 116 Ливермориум 30038 117 Tennessine TS 118 Oganesson OG Загрузка.
 и белый: Базовый/Продвинутый
и белый: Базовый/ПродвинутыйДоступны следующие онлайн-игры, основанные на Периодической таблице элементов:
– Флэш-карты с элементами
– Элемент “Виселица”
– Сопоставление элементов
– Element Math
– Element Crossword Puzzles
– Element Concentration
– Element Balance
– Element Word Scramble
Доступны следующие бумажные задания:
– Element 2 3 – 4 Word BINGO Search 900
В дополнение к информации, содержащейся в Периодической таблице элементов, следующие статьи могут быть полезны, если вы пишете отчет об элементе или создаете модель атома:
– Как рассчитать количество протонов, нейтронов и электронов в атоме элемента
– Как сделать модель атома
– Как нарисовать атом (видео)
– Как прочитать электрон схема конфигурации
– Список тех, кто обнаружил каждый элемент
Информация на этом сайте была собрана из нескольких источников.
Информация о цитировании и размещении ссылок
По вопросам, касающимся этой страницы, обращайтесь к Стиву Ганьону.


 ΔH°298(обр) −1089,10 кДж/моль; ΔG°298(обр) −998,24 кДж/моль; S°298 84,98 Дж/моль*K. Проявляют амфотерные свойства, хотя основные свойства, по сравнению с алюминием, усилены:
ΔH°298(обр) −1089,10 кДж/моль; ΔG°298(обр) −998,24 кДж/моль; S°298 84,98 Дж/моль*K. Проявляют амфотерные свойства, хотя основные свойства, по сравнению с алюминием, усилены: Известен кристаллогидрат GaF3*3Н2O. Получают нагреванием оксида галлия в атмосфере фтора.
Известен кристаллогидрат GaF3*3Н2O. Получают нагреванием оксида галлия в атмосфере фтора. Взаимодействует с водой, при этом полностью гидролизуется. Получают взаимодействием галлия с серой или сероводородом.
Взаимодействует с водой, при этом полностью гидролизуется. Получают взаимодействием галлия с серой или сероводородом.

 Марсден
Марсден
 0042
0042 0039
0039 и белый: Базовый/Продвинутый
и белый: Базовый/Продвинутый