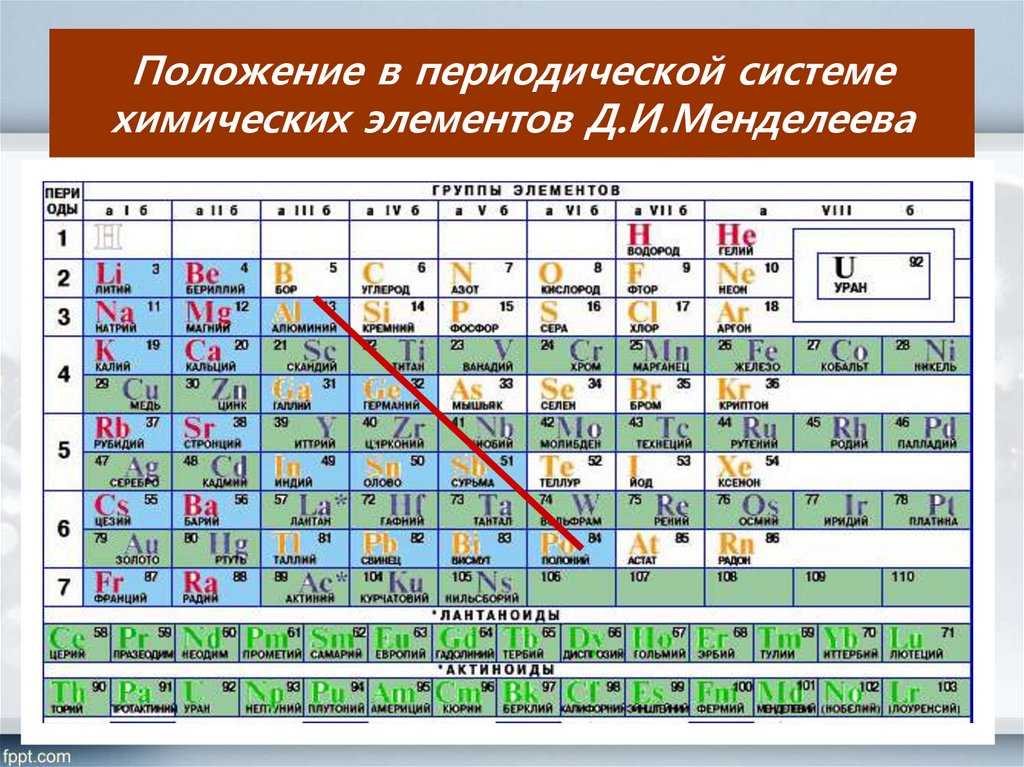
Иттрий
| Иттрий | |
|---|---|
| Атомный номер | 39 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
88,90585 а. е. м. (г/моль) |
| Радиус атома | 178 пм |
|
Энергия ионизации (первый электрон) |
615,4 (6,38) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d1 5s2 |
| Химические свойства | |
| Ковалентный радиус | 162 пм |
| Радиус иона | (+3e) 89,3 пм |
|
Электроотрицательность (по Полингу) |
1,22 |
| Электродный потенциал | 0 |
| Степени окисления | 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,47 г/см³ |
| Молярная теплоёмкость | |
| Теплопроводность | (17,2) Вт/(м·K) |
| Температура плавления | 1795 K |
| Теплота плавления | 11,5 кДж/моль |
| Температура кипения | 3 611 K |
| Теплота испарения | 367 кДж/моль |
| Молярный объём | 19,8 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,647 c=5,731 Å |
| Отношение c/a | 1,571 |
| Температура Дебая | [2] 280 K |
| Y | 39 |
| 88,90585 | |
|
[Kr]4d15s |
|
| Иттрий | |
Иттрий — элемент побочной подгруппы третьей группы пятого периода периодической системы химических элементов, атомный номер 39. Обозначается символом Y (Yttrium). Простое вещество иттрий (CAS-номер: 7440-65-5) — металл светло-серого цвета. Существует в двух кристаллических модификациях: α-Y с гексагональной решёткой типа магния, β-Y с кубической объёмноцентрированной решёткой типа α-Fe, температура перехода α↔β 1482 °C.
Обозначается символом Y (Yttrium). Простое вещество иттрий (CAS-номер: 7440-65-5) — металл светло-серого цвета. Существует в двух кристаллических модификациях: α-Y с гексагональной решёткой типа магния, β-Y с кубической объёмноцентрированной решёткой типа α-Fe, температура перехода α↔β 1482 °C.
История
Происхождение названия
Минерал иттербит, который дал имя иттрию, назван в честь деревни Иттербю (Ytterby) расположенной на острове Руслаген в Швеции. В дальнейшем, минерал иттербит изменил свое название на гадолинит в честь своего первого исследователя (и первооткрывателя иттрия) Юхана Гадолина, финского ученого.
Получение
Физические свойства
Иттрий — металл светло-серого цвета. Существует в двух кристаллических модификациях: α-Y с гексагональной решёткой типа магния (a=3,6474 Å; с=5,7306 Å; z=2; пространственная группа P63/mmc), β-Y с кубической объёмноцентрированной решёткой типа α-Fe (a=4,08 Å; z=2; пространственная группа Im3m), температура перехода α↔β 1482 °C, ΔH перехода 4,98 кДж/моль.
Изотопы
Иттрий моноизотопный элемент, в природе представлен одним стабильным нуклидом 89Y.
Химические свойства
Металл неустойчив на воздухе.
Применение
Иттриевая керамика
Керамика для нагревательных элементов
Хромит иттрия —это материал для лучших высокотемпературных нагревателей сопротивления способных эксплуатироваться в окислительной среде (воздух, кислород).
ИК — керамика
«Иттралокс»(Yttralox) — твёрдый раствор двуокиси тория в окиси иттрия. Для видимого света этот материал прозрачен, как стекло, но также он очень хорошо пропускает инфракрасное излучение, поэтому его используют для изготовления инфракрасных «окон» специальной аппаратуры и ракет, а также используют в качестве смотровых «глазков» высокотемпературных печей. Плавится «Иттрий-локс» лишь при температуре около 2207 °C.
Плавится «Иттрий-локс» лишь при температуре около 2207 °C.
Огнеупорные материалы
Оксид иттрия — чрезвычайно устойчивый к нагреву на воздухе огнеупор, упрочняется с ростом температуры (максимум при 900—1000 °C), пригоден для плавки ряда высокоактивных металлов (в том числе и самого иттрия). Особую роль оксид иттрия играет при литье урана. Одной из наиболее важных и ответственных областей применения оксида иттрия в качестве жаропрочного огнеупорного материала является производство наиболее долговечных и качественных сталеразливочных стаканов (устройство для дозированного выпуска жидкой стали), в условиях контакта с движущимся потоком жидкой стали оксид иттрия наименее размываем. Единственным известным и превосходящим по стойкости оксид иттрия в контакте с жидкой сталью является оксид скандия, но он чрезвычайно дорог.
Термоэлектрические материалы
Важным соединением иттрия является его теллурид. Имея малую плотность, высокую температуру плавления и прочность, теллурид иттрия имеет одну из самых больших термо-э.
Сверхпроводники
Один из компонентов иттрий-медь-бариевой керамики с общей формулой YBa2Cu3O7-δ — перспективного высокотемпературного сверхпроводника с температурой сверхпроводящего перехода около 90 К.
Бериллид иттрия (равно как и бериллид скандия) является одним из лучших конструкционных материалов аэрокосмической техники и плавясь при температуре около 1920 °C, начинает окисляться на воздухе при 1670 °C (!). Удельная прочность такого материала весьма высока, и при использовании его в качестве матрицы для наполнения нитевидными кристаллами (усами) можно создать материалы, имеющие фантастические прочностные и упругие характеристики.
Сплавы иттрия
Иттрий является металлом, обладающим рядом уникальных свойств, и эти свойства в значительной степени определяют очень широкое применение его в промышленности сегодня и, вероятно, ещё более широкое применение в будущем.
Легирование
Легирование алюминия иттрием повышает на 7,5 % электропроводность изготовленных из него проводов.
Иттрий имеет высокие предел прочности и температуру плавления, поэтому способен создать значительную конкуренцию титану в любых областях применения последнего (ввиду того, что большинство сплавов иттрия обладает большей прочностью, чем сплавы титана, а кроме того у сплавов иттрия отсутствует «ползучесть» под нагрузкой, которая ограничивает области применения титановых сплавов).
Иттрий вводят в жаростойкие сплавы никеля с хромом (нихромы) с целью повысить температуру эксплуатации нагревательной проволоки или ленты и с целью в 2—3 раза увеличить срок службы нагревательных обмоток (спиралей), что имеет громадное экономическое значение (использование вместо иттрия скандия ещё в несколько раз увеличивает срок службы сплавов).
Магнитные материалы
Изучается перспективный магнитный сплав — неодим-иттрий-кобальт.
Покрытия иттрием и его соединениями
Напыление (детонационное и плазменное) иттрия на детали двигателей внутреннего сгорания позволяет увеличить износостойкость деталей в 400—500 раз по сравнению с хромированием.
Люминофоры
Окись и ванадат иттрия, легированные ионами европия, используются в производстве кинескопов цветных телевизоров.
Оксосульфид иттрия, активированный европием, применяется для производства люминофоров в цветном телевидении (красная компонента), а активированный тербием — для черно-белого телевидения.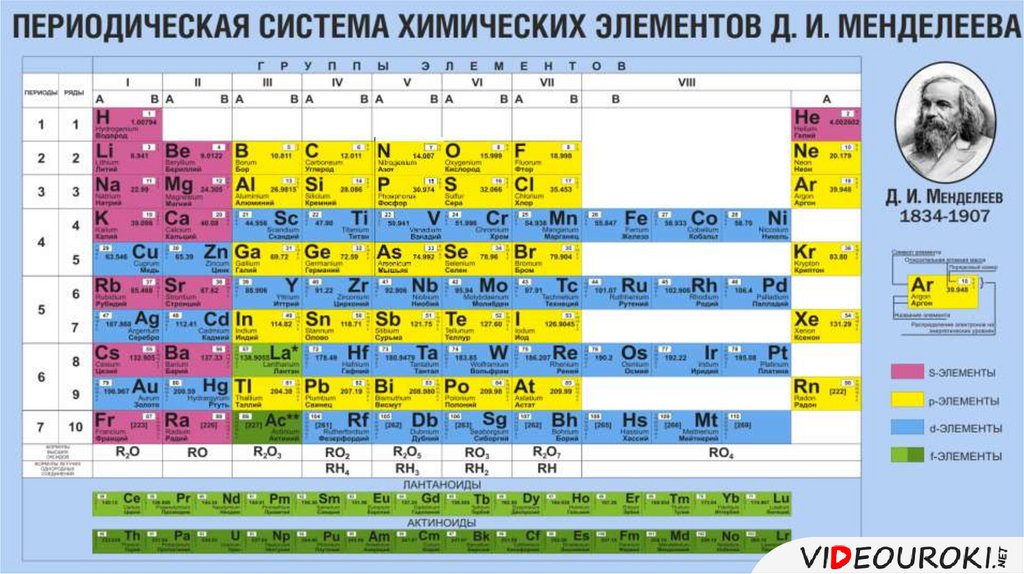
Дуговая сварка
Добавлением иттрия в вольфрам резко снижают работу выхода (у чистого иттрия 3,3 эВ), что используется для производства иттрированных вольфрамовых электродов для аргонодуговой сварки и составляет значительную статью расхода металлического иттрия.
Гексаборид иттрия имеет так же малую работу выхода (2,22 эВ) и применяется для производства катодов мощных электронных пушек (электронно-лучевая сварка и резка в вакууме).
Другие сферы применения
Тетраборид иттрия находит применение в качестве материала для управления атомным реактором (имеет малое газовыделение по гелию и водороду).
Ортотанталат иттрия синтезируется и используется для производства рентгеноконтрастных покрытий.
Синтезированны иттрий-алюминиевые гранаты («сиграны»)(ИАГ), имеющие ценные физико-химические свойства, могут применяться и в ювелирном деле, и уже довольно давно применяемые в качестве технологичных и относительно дешёвых твердотельных лазеров. Важным лазерным материалом является ИСГГ — иттрий-скандий-галлиевый гранат.
Важным лазерным материалом является ИСГГ — иттрий-скандий-галлиевый гранат.
Феррит иттрия применяется для производства супер-ЭВМ, и хотя он уступает ферриту скандия в несколько раз, он дешевле.
Гидрид иттрия-железа применяют как аккумулятор водорода с высокой емкостью и достаточно дешевый.
Цены на иттрий
чистотой 99—99,9% составляют в среднем 95—115 долл за 1 кг.[источник не указан 224 дня]
Биологическая роль
Иттрий – Знаешь как
Иттрий это очень редкое химическое вещество, открытое Йоханом Гадолином в 1794 году. Это элемент d-блока с атомным номером 39, который присутствует в 3-й группе и 5-м периоде в периодической таблице.
В последнее время в качестве основного компонента телевизоров в электронно-лучевых трубках использовался иттрий. Большая часть иттрия сосредоточена в солнечной системе в гигантской красной звезде по имени Мира.
Иттрий аналог лантаноидов, формула иттрия Y, применяется в производстве телевизоров, медицине, в производстве волокна и т. д.
д.
(Yttrium; от назв. швед, селения Иттербю), Y — хим. элемент III группы периодической системы элементов; ат. н. 39, ат. м. 88,9059; относится к редкоземельным элементам. Металл светло-серого цвета, на воздухе тускнеет.
В соединениях проявляет степень окисления + 3. Известны изотопы с массовыми числами от 82 до 97. К важнейшим долго-живущим относятся изотопы с массовыми числами 91; 90; 88 и 89.
Открытие иттрия в 1794 финск. химиком И. Гадолином. Металлический И. получил в 1828
И. в земной коре около 2,8 х 10-3%. Иттрий входит в состав лопарита, монацита , иттропаризита, эвксенита, ксенотима и др. минералов.
Полиморфен, т-ра полиморфного превращения 1490—1495° С. Кристаллическая решетка низкотемпературной модификации — гексагональная плотноупакованная типа магния, с периодами а = 3,6474 А и с = 5,7306 А, а высокотемпературной — кубическая объемноцентрированная с периодом а = 4,11 А.
Плотность 4,472 г/см3; tпл 1526° С; tкип 3340° С; коэфф. термического расширения (т-ра 25— 1000° С) 10,1 х 10-6 град»-1; теплоемкость 6,34 кал/г-атом • град; электрическое сопротивление 57 мком • см; сечение захвата тепловых нейтронов 1,31 барн; парамагнитен; работа выхода электронов 3,07 эв.
термического расширения (т-ра 25— 1000° С) 10,1 х 10-6 град»-1; теплоемкость 6,34 кал/г-атом • град; электрическое сопротивление 57 мком • см; сечение захвата тепловых нейтронов 1,31 барн; парамагнитен; работа выхода электронов 3,07 эв.
Модуль норм, упругости 6600 кгс/мм2; модуль сдвига 2630 кгс/мм2; предел прочности 31,5 кгс/мм2; предел текучести 17,5 кгс/мм2; сжимаемость 26,8 х 10—7 см2/кг; удлинение 35%; HV = 38.
Электронная конфигурация иттрияАтомный номер иттрия-39. Он имеет трехвалентность, то есть его валентность равна трем. Полная электронную конфигурацию иттрия.
1s22s22p63s23p63d104s24p64d15s2
Как правило, электронная конфигурация иттрия
Кr 4d15s2.
Иттрий обычно имеет степень окисления +3, так как он дает три валентных электрона.
Кроме того, он образует несколько соединений, таких как оксалат, гидроксид и фторид, которые нерастворимы в воде.
А такие соединения, как хлорид, сульфат, бромид и т.д., обладают высокой растворимостью в воде. Поскольку его d-и f-оболочки испытывают нехватку электронов, ион иттрия бесцветен.
Иттриевый химический элемент в таблице МенделееваЧто такое элемент Y в периодической таблице Менделеева? Y-это символ элемента периодической системы Менделеева, известного как иттрий. В противном случае он также попадает в категорию редкоземельных элементов.
Он имеет атомный номер 39 и стандартный атомный вес 88,905. Элемент имеет металлический серебристо-белый внешний вид и очень похож на лантаноиды. Чаще всего мы находим иттрий в сочетании с лантаноидами.
Он также является одним из элементов в категории переходных элементов, наряду с некоторыми важными элементами, такими как железо и серебро. Мы никогда не можем найти их как свободные элементы в природе; вместо этого они присутствуют в виде стабильных изотопов.
Это единственный изотоп в земной коре со стабильностью. Мы используем иттрий в нескольких отраслях промышленности и продуктах, таких как сверхпроводники, лазеры, электроды, телевизионные дисплеи и т.д.
Иттрий впервые появился на свет после того, как ученый по имени Карл Аксель Аррениус доказал его существование в 1787 году. Во время исследования карьера в маленьком городке Иттерби, Швеция, он наткнулся на черную скалу.
Затем он дал образец химику по имени Йохан Гадолин для анализа, думая о новом минерале. Гадолин извлек иттрий из образца, и поэтому ученые продолжали называть этот минерал иттрием по названию города.
В 18 веке один ученый по имени Карл Густав продолжил изучение минерала и обнаружил три окиси. Эти оксиды-эрбия, тербия и иттрия, широко известные сегодня как оксид иттрия, оксид тербия и оксид эрбия.
Даже после раннего открытия в 18 веке, только в последние несколько десятилетий его широкое использование в нескольких областях. Не зная, что такое y в периодической таблице? Запишем электронную конфигурацию иттрия.
Иттрий является редкоземельным элементом, он также является драгоценным металлом с металлическим серебряным внешним видом.
Этот элемент мягкий и относится к категории высококристаллических металлов. Его электроотрицательность меньше по отношению к элементам над ним в группе. Кроме того, элементы, находящиеся ниже иттрия, обладают большей электроотрицательностью.
Он появляется в d-блоке и 5-й группе периодической таблицы. Помимо того, что он является уникальным элементом, он образует как растворимые, так и нерастворимые соединения.
Иттрий — мягкий серебристый металл, обладающий меньшей электроотрицательностью.
Иттрий — очень редкий металл, который нелегко найти.
Он не может быть найден в качестве свободного элемента в земной коре, но его часто можно найти в сочетании с лантаноидом, а также в урановых рудах.

Иттрий — серебристо — белый металл , существующий в двух кристаллических видоизменениях с различными типами и параметрами решеток .
Химические свойства иттрияВ химических реакциях атом иттрия теряет по три электрона и ведёт себя как сильный восстановитель.
Качественные реакции на иттрий можно проводить органическими реагентами.
При обычных температурах поверхность его окисляется кислородом с образованием защитных плёнок .
Но при нагревании в кислороде горит и образуются оксиды Sc2O3 .
Другие окислители ( фтор , хлор , бром , йод , сера , азот , водород ) также взаимодействуют с иттрием при нагревании ( получаются галиды , сульфиды , нитриды , гидриды ) .
С водой иттрий взаимодействует медленно , образующиеся при этом гидроксиды покрывают его защитной плёнкой :
2Y + 6H2O = 2Y(OH)3↓ + 3H2↑
Из кислот иттрий легко вытесняет водород :
2Y + 3H2SO4 = Y2(SO4)3 + 3H2↑
и растворяется в кислотах .
| Группа | 3 | Температура плавления | 1522°C, 2772°F, 1795 K |
| Период | 5 | Точка кипения | 3345°C, 6053°F, 3618 K |
| Блок | d | Плотность (г см−3) | 4.47 |
| Атомный номер | 39 | Относительная атомная масса | 88.906 |
| Состояние на | 20°C | Твердые ключевые изотопы | 89Y |
| Электронная конфигурация КрKr | 4д15с2 | Номер CAS | 7440-65-5 |
Иттрий это химический элемент, который встречается почти во всех редкоземельных минералах. Анализ образцов лунных пород, полученных во время миссий Apollo, показывает, что он имеет относительно высокое содержание иттрия.
Из монацитового песка он был извлечен для коммерческих целей, который содержит около 3% иттрия, и из бастназита, который содержит около 0,2% иттрия.
В 1828 году Волер восстановлением безводного хлорида калием получил нечистый элемент. Металл в настоящее время производится коммерчески восстановлением фторида металлическим кальцием. Он также может быть получен с использованием других методов.
Иттрий в природеВстречается в виде устойчивого изотоп 89 Y (100% ) . В литосфере содержится иттрия 5 ⋅ 10⁻⁴ . Встречаются минералы достаточно богатые этим элементом , например , тортвейтит Y2Si2O7 , однако эти минералы настолько рассеяны , что переработка связана с концентрированием ( отделением больших количеств пустой породы ) , что связано с большими энергозатратами .
Поскольку иттрий имеет отрицательное значение стандартных электронных потенциалов , получают его электролизом расплавленных хлоридов или нитратов , а для понижения температур плавления добавляют соли других металлов .
Помимо электролиза его получают восстанавливая при высоких температурах из их хлоридов или фторидов наиболее активными металлами ( калием и кальцием ) :
YCl3 + 3K = Y + 3KCl
Соединения иттрияПроявляет степень окисления +3 , их ионы имеют на внешнем уровне по 8 электронов , большой заряд этих ионов Э⁺³обусловливается склонность иттрия к комплексообразованию .
Его оксиды отвечают формуле Y2O3 , бесцветны , тугоплавки , получаются разложением нитратов :
4Y(NO3)3 = 2YO3 + 12NO2↑ + 3O2↑
Он обладает основным характером , энергично реагировать с водой , образуя гидроксиды :
Y2O3 + 3H2O = 2Y(OH)3
Он мало растворим в воде , но легко растворяется в кислотах , гидроксид иттрия Y(OH)3 проявляет признаки амфотерности .
Соли иттрия из воды кристаллизуются в виде аквасоединений . Хлориды , нитраты и ацетаты растворимы в воде и гидролизуются в незначительной степени .
Мало растворимые в воде фториды , карбонаты и оксалаты иттрия переходят в раствор под действием избытка осадителя с образованием комплексных соединений .
Положительные ионы иттрия имеют координационные числа от 3 до 6 . Важнейшие лиганды в комплексе металла — это фторид — , карбонат — , сульфат — , оксалат- ионы . Ион иттрия Y⁺³ образует с фторид — ионами комплексные соединения :
KF + YF3 = K[YF4]
3KF + YF3 = K3[ScF6]
Получение иттрияПолучают иттрий металлотермическим восстановлением, действуя на его фторид кальцием при т-ре выше т-ры плавления металла.
Затем металл переплавляют в вакууме и дистиллируют, получая иттрий чистотой до 99,8-т-99,9%.
Чистоту металла повышают двух- и трехкратной дистилляцией. Иттрий выпускают в виде монокристаллов, слитков различной чистоты и массы, а также в виде сплавов с магнием и алюминием.
Чистый иттрий используют для исследовательских целей.
Применение иттрияОксид иттрия ( III ) Y2O3 высокой чистоты идёт на изготовление иттриевых ферритов . Изотоп Y использовался в медицине для лечения опухолей.
Иттрий может быть использован в производстве синтетической одежды и одежды из иттриевого железа.
Он используется для изготовления инфракрасных слоев.
Иттрий может быть использован в качестве твердого электролита, а также в качестве датчика кислорода в автомобильных выхлопных системах.
Он используется в производстве сверхпроводников.
Он полезен для лечения многих видов рака, таких как лимфома, лейкемия и рак костей.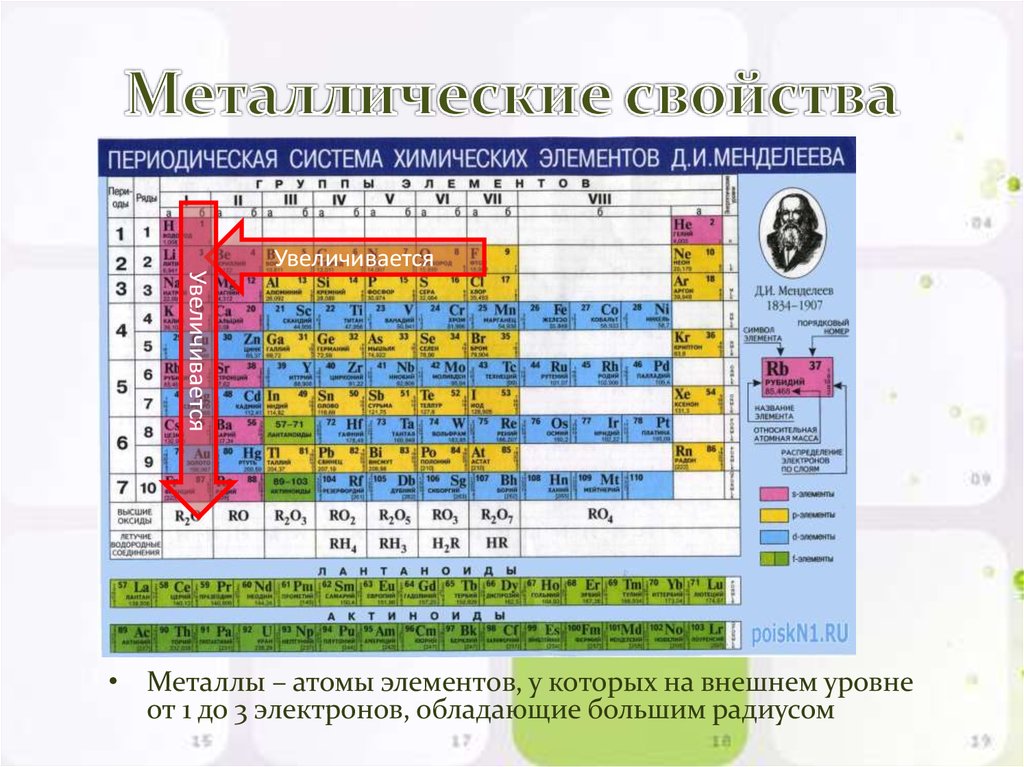
В качестве основы сплавов его применяют редко. Наиболее широко используется как легирующая и модифицирующая добавка к сплавам почти на всех основах.
Иттрий в металлургииИттрий используют при произ-ве легированной стали (его добавка уменьшает величину зерна, улучшает мех., Электр, и магн. св-ва) и модифицированного чугуна.
Он повышает жаростойкость и жаропрочность сплавов на основе никеля, хрома, молибдена и др. металлов; увеличивает пластичность тугоплавких металлов и сплавов на основе ванадия, тантала, вольфрама и молибдена; упрочняет титановые, медные, магниевые и алюминиевые сплавы; увеличивает жаропрочность магниевых и алюминиевых сплавов.
Другое применениеВ атомной энергетике иттрий используют как носитель водорода, разбавитель ядерного горючего, как конструкционный материал реакторов. Широкое применение находит в электронике и радиотехнике в качестве катодных материалов (окислы И.), геттеров (сплавы с лантаном, алюминием, цирконием), ферритов-гранатов, люминофоров.
Из тугоплавких и огнеупорных материалов на основе боридов, сульфидов и окислов изготовляют катоды для мощных генераторных установок, тигли для плавки тугоплавких металлов и др.; ортованадат иттрия — эффективный материал для цветного телевидения.
Иттрий и его окислы применяют как катализаторы органических реакций, при произв. нефти См. также
Иттрий содержащие сплавы.
Чистый иттрий легко поддается мех. обработке и деформированию. Его куют и прокатывают до лент толщиной 0,05 мм на холоду с промежуточными отжигами в вакууме при т-ре 900—1000° С.
Иттрий — химически активный металл, реагирует со щелочами и к-тами, сильно окисляется при нагревании на воздухе.
Работы с проводят в защитных камерах и высоком вакууме. Иттрий с металлами Iа, IIа и Va подгрупп, а также с хромом и ураном образует несмешивающиеся двойные системы; с титаном, цирконием, гафнием, молибденом и вольфрамом — двойные системы эвтектического типа.
С редкоземельными элементами, скандием и торием — непрерывные ряды твердых растворов и широкие области растворов; с остальными элементами — сложные системы с наличием хим. соединений .
соединений .
В чем сходство между лантаноидами и иттрием?
Лантаноиды и иттрий очень похожи друг на друга. Он настолько идентичен, что ранее он был включен в группу лантаноидов(редкоземельный элемент).
Его сходство больше соответствует элементам в группе лантаноидов, чем его группе. Если говорить о химических свойствах или реакционной способности, то он имеет тот же порядок реакции, что и лантаноиды.
А также имеет несколько других сходств, таких как почти одинаковый размер, сходное поведение, сходный атомный радиус, близкий атомный номер и т. д. Между ними есть только одно существенное различие — тривал иттрия
Какова плотность иттрия и его источников?
Стандартная плотность иттрия составляет 4,47 грамма на кубический сантиметр. Помимо места обнаружения этого элемента, он также доступен в нескольких странах.
Некоторые из основных производителей-Индия, Австралия, Китай, Малайзия и Россия. Самое последнее открытие этого элемента было сделано на острове Минамитори в Японии.
Самое последнее открытие этого элемента было сделано на острове Минамитори в Японии.
Редкоземельные металлы имеются в обширных залежах на этом острове. Он доступен только в виде сплавов или соединений.
Каковы последствия иттрия для здоровья?
Иттрий является одним из самых редких химических веществ, найденных на земле, так как он встречается в очень небольших количествах. Но это можно найти в цветных телевизорах, люминесцентных лампах, энергосберегающих лампах и стеклах. Все редкие химические вещества имеют сопоставимое количество иттрия в них.
Иттрий наиболее опасен, так как затухает и газы могут вдыхаться с воздухом. Это может вызвать проблемы, связанные с легкими, особенно при длительном воздействии. Иттрий также может привести к раку у людей, поскольку он создает место для рака легких при вдыхании.
Каковы эффекты иттрия на окружающую среду?
Иттрий является одним из токсичных химических веществ, которые могут представлять опасность для окружающей среды. Иттрий сбрасывается в окружающую среду в различных местах, главным образом в нефтедобывающей промышленности.
Иттрий сбрасывается в окружающую среду в различных местах, главным образом в нефтедобывающей промышленности.
Он также попадает в окружающую среду, когда выбрасывается домашняя утварь. Иттрий постепенно накапливается в почвах и водных почвах, и это постепенно приведет к увеличению концентраций в людях, животных и частицах почвы.
Иттрий вызывает повреждение клеточных мембран у водных животных и оказывает несколько негативных влияний на размножение и нервную систему.
Лит.: Терехова В. Ф., Савицкий Е. М. Иттрий. М.
Статья на тему Иттрий
Иттрий | химический элемент | Британика
иттрий
См. все материалы
- Связанные темы:
- химический элемент редкоземельный элемент
См. все связанные материалы →
иттрий (Y) , химический элемент, редкоземельный металл группы 3 периодической таблицы.
Иттрий — серебристо-белый, умеренно мягкий, пластичный металл. Он достаточно стабилен на воздухе; быстрое окисление начинается примерно при температуре выше 450 ° C (840 ° F), в результате чего образуется Y 2 О 3 . Металл легко реагирует с разбавленными кислотами, за исключением плавиковой кислоты (HF), в которой нерастворимый защитный слой YF 3 , образующийся на поверхности металла, предотвращает дальнейшую реакцию. Иттриевая стружка легко воспламеняется на воздухе, раскаляясь добела. Металл является парамагнитным с независимой от температуры магнитной восприимчивостью от 10 до 300 К (от -263 до 27 ° C или от -442 до 80 ° F). Он становится сверхпроводящим при 1,3 К (-271,9 ° C или -457 ° F) при давлении, превышающем 110 килобар.
Он достаточно стабилен на воздухе; быстрое окисление начинается примерно при температуре выше 450 ° C (840 ° F), в результате чего образуется Y 2 О 3 . Металл легко реагирует с разбавленными кислотами, за исключением плавиковой кислоты (HF), в которой нерастворимый защитный слой YF 3 , образующийся на поверхности металла, предотвращает дальнейшую реакцию. Иттриевая стружка легко воспламеняется на воздухе, раскаляясь добела. Металл является парамагнитным с независимой от температуры магнитной восприимчивостью от 10 до 300 К (от -263 до 27 ° C или от -442 до 80 ° F). Он становится сверхпроводящим при 1,3 К (-271,9 ° C или -457 ° F) при давлении, превышающем 110 килобар.
Викторина по Британике
Факты, которые вы должны знать: Викторина по периодической таблице
В 1794 году финский химик Йохан Гадолин выделил иттрий, новую землю или оксид металла, из минерала, найденного в Иттербю, Швеция. Иттрия, первого обнаруженного редкоземельного элемента, оказалась смесью оксидов, из которых в течение более века образовались девять элементов — иттрий, скандий (атомный номер 21) и тяжелые лантанидные металлы из тербия ( атомный номер 65) до лютеция (атомный номер 71) — разделяли. Иттрий встречается особенно в тяжелых редкоземельных рудах, из которых наибольшее значение имеют латеритные глины, гадолинит, эвксенит и ксенотим. В магматических породах земной коры этого элемента больше, чем любого другого редкоземельного элемента, кроме церия, и вдвое больше, чем свинца. Иттрий также встречается в продуктах ядерного деления.
Иттрий встречается особенно в тяжелых редкоземельных рудах, из которых наибольшее значение имеют латеритные глины, гадолинит, эвксенит и ксенотим. В магматических породах земной коры этого элемента больше, чем любого другого редкоземельного элемента, кроме церия, и вдвое больше, чем свинца. Иттрий также встречается в продуктах ядерного деления.
Стабильный иттрий-89 — единственный природный изотоп. Всего было зарегистрировано 33 (исключая ядерные изомеры) радиоактивных изотопа иттрия с массой от 77 до 109 и периодом полураспада от 41 миллисекунды (иттрий-108) до 106,63 дня (иттрий-88).
Промышленно иттрий отделяют от других редкоземельных элементов жидкостно-жидкостной или ионообменной экстракцией, а металл получают металлотермическим восстановлением безводного фторида кальцием. Иттрий существует в двух аллотропных (структурных) формах. α-фаза плотно упакована гексагонально с a = 3,6482 Å и c = 5,7318 Å при комнатной температуре. β-фаза является объемно-центрированной кубической с a = 4,10 Å при 1478 ° C (2692 ° F).
Иттрий и его соединения имеют множество применений. Основные области применения включают в себя основы для красных люминофоров для люминесцентных ламп, цветных дисплеев и экранов телевизоров, в которых используются электронно-лучевые трубки. Иттрий-алюминиевый гранат (ИАГ), легированный другими редкоземельными элементами, используется в лазерах; железо-иттриевый гранат (ЖИГ) используется для микроволновых фильтров, радаров, связи и синтетических драгоценных камней; кубический цирконий, стабилизированный оксидом иттрия, используется в датчиках кислорода, конструкционной керамике, термобарьерных покрытиях и синтетических алмазах. Основное применение иттрия – в высокотемпературной сверхпроводящей керамике, такой как YBa 9.0019 2 Cu 3 O 7 , который имеет температуру перехода в сверхпроводящее состояние 93 К (-180 ° C или -292 ° F) для линий электропередачи и сверхпроводящих магнитов. Металл используется в качестве легирующей добавки к сплавам черных и цветных металлов для повышения коррозионной стойкости и стойкости к окислению. Соединения иттрия используются в оптических стеклах и в качестве катализаторов.
Соединения иттрия используются в оптических стеклах и в качестве катализаторов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Иттрий химически ведет себя как типичный редкоземельный элемент со степенью окисления +3. Его ионный радиус близок к радиусам диспрозия и гольмия, что затрудняет отделение от этих элементов. Помимо белого полуторного оксида, иттрий образует ряд почти белых солей, включая сульфат, трихлорид и карбонат.
| атомный номер | 39 |
|---|---|
| атомный вес | 88.90585 |
| melting point | 1,522 °C (2,772 °F) |
| boiling point | 3,345 °C (6,053 °F) |
| specific gravity | 4.469 (24 °C, or 75 ° F) |
| Состояние окисления | +3 |
| Электронная конфигурация | [KR] 4 D 1 5 S 111111111111111111111111111111111111111111110111110111111101111111ЕРС
Эта статья была недавно пересмотрена и обновлена Эриком Грегерсеном. Иттрий (Y) – Атомный номер 39Произносится IT-ri-em Иттрий (Y) представляет собой серебристый металл с атомным номером 39 в периодической таблице. Это переходный металл, расположенный в группе 3 периодической таблицы. Он имеет символ Y.Иттрий классифицируется как редкоземельный элемент из-за его редкости на Земле. Он никогда не встречается в виде свободного элемента, но обычно встречается в соединении с лантаноидами. Иттрий был открыт в 1787 году Карлом Акселем Аррениусом в городе Иттербю, Швеция. В образце минерала, который проанализировал Аррениус, элементарный иттрий был выделен в 1828 году Фридрихом Вёлером. Наиболее важным применением иттрия является производство светодиодов, люминофоров и электродов. Стронций находится в группе 3 как переходный металл. Он имеет температуру плавления 1526°С и температуру кипения 29°С.30°С. Загрузите иттрий в виде изображения для печати и с полным масштабированиемПолучите бесплатную загрузку здесь (JPEG, PDF, SVG) Часто задаваемые вопросыКакова температура плавления иттрия? Точка плавления иттрия составляет 1522°C, то есть при 1522°C он превращается в жидкость. Какова температура кипения иттрия?Температура кипения иттрия составляет 3345°C, что означает, что при 3345°C он превратится в газ. Какова электроотрицательность иттрия?Электроотрицательность иттрия равна 1,22. Электроотрицательность — это мера того, насколько сильно атомы притягивают к себе связывающие электроны. Открыт Иоганном Гадолином Дата открытия 1794 Что такое Теплота испарения иттрия?Иттрий имеет теплоту испарения 363 кДж/моль. ИспользуетВ сочетании с европием для изготовления красных люминофоров для цветных телевизоров. Оксид иттрия и оксид железа объединяются, образуя кристаллический гранат, используемый в радарах. ИсточникиВстречается в таких минералах, как монацит, ксенотим и иттрий. Об автореНатан МАвтор Натан имеет степень бакалавра биомедицинской химии в Уорикском университете и степень бакалавра биомедицинских наук в Университете Вулверхэмптона, Великобритания. Цитирование“Иттрий” Опубликовано 30 декабря 2019 г.. https://breakingatom.com/elements/yttrium 39 Protons 39 Electrons 50 Neutrons Element Symbol Y Atomic Weight 88.906 Atomic Number 39 Состояние SOLIT ПЕРЕДЕЛЕНИЕ Неизвестно 1522 ° C Toper 3345 Неизвестно ° C 3345 0002 Тепла испаривания 363 Неизвестно кДж/моль Кристаллическая структура Гексагональная Термоконкурентность 0,172 UNSONKEN Вт/CMK 9000 3 9000 2 9000 8,1000 0000 000 8 000 8 000 8,1000 0000 8 000 8 000 8,1000 0000,1000 0000 8 000 8 000 8,1000 0000 8 000 8 000 8 000 8,1000 0000 8 000 8 000 8,1000 0000 8 000 8 000 000 9000 8,1000 0000 3 9000 3 Вт/CMK Вт/CMK 9000 9000 8 9000 2 9000 8 9000, Группа Переходный металл ПЕРИОД 5 Блок D Блок Орбитали [KR] 4D1 5S2 Коэффициент теплового расширения 11. |

 Кроме того, он образует несколько соединений, таких как оксалат, гидроксид и фторид, которые нерастворимы в воде.
Кроме того, он образует несколько соединений, таких как оксалат, гидроксид и фторид, которые нерастворимы в воде.