Иттрий
| Иттрий | |
|---|---|
| Атомный номер | 39 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
88,90585 а. е. м. (г/моль) |
| Радиус атома | 178 пм |
|
Энергия ионизации (первый электрон) |
615,4 (6,38) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d1 5s2 |
| Химические свойства | |
| Ковалентный радиус | 162 пм |
| Радиус иона | (+3e) 89,3 пм |
|
Электроотрицательность (по Полингу) |
1,22 |
| Электродный потенциал | 0 |
| Степени окисления | 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,47 г/см³ |
| Молярная теплоёмкость | 26,52 Дж/(K·моль) |
| Теплопроводность | (17,2) Вт/(м·K) |
| Температура плавления | 1795 K |
| Теплота плавления | 11,5 кДж/моль |
| Температура кипения | 3 611 K |
| Теплота испарения | 367 кДж/моль |
| Молярный объём | 19,8 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,647 c=5,731 Å |
| Отношение c/a | 1,571 |
| Температура Дебая | [2] 280 K |
| Y | 39 |
| 88,90585 | |
|
|
|
| Иттрий | |
Иттрий — элемент побочной подгруппы третьей группы пятого периода периодической системы химических элементов, атомный номер 39.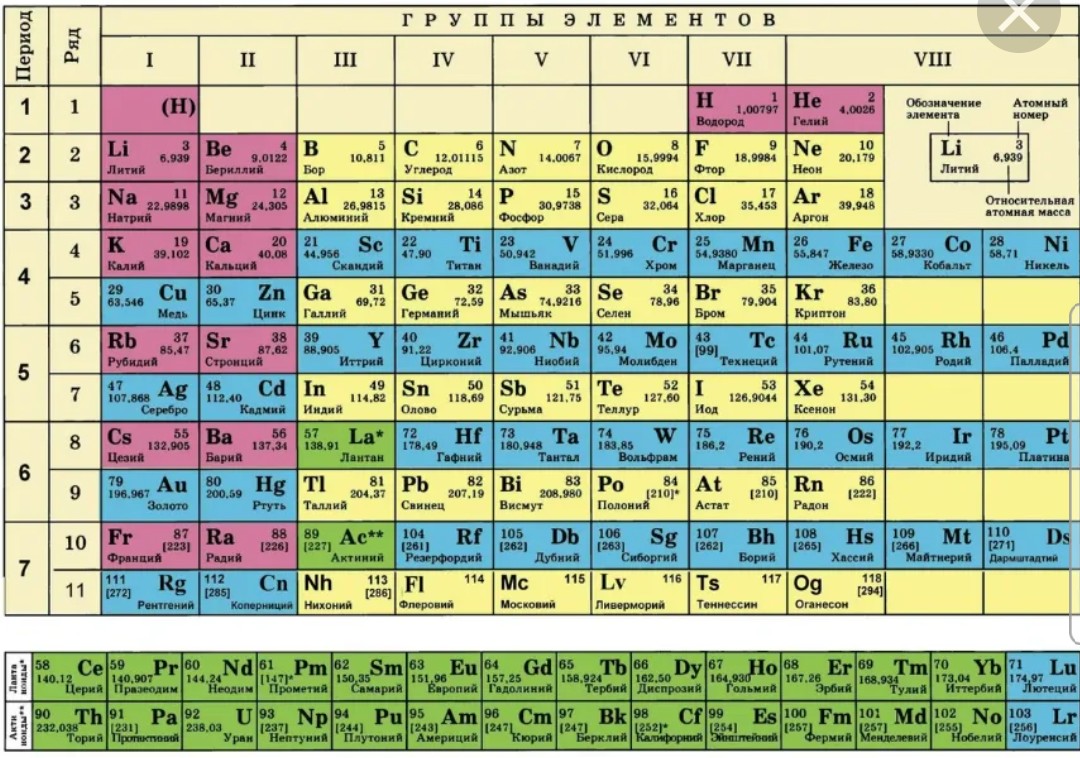 Обозначается символом Y (Yttrium). Простое вещество иттрий (CAS-номер: 7440-65-5) — металл светло-серого цвета. Существует в двух кристаллических модификациях: α-Y с гексагональной решёткой типа магния, β-Y с кубической объёмноцентрированной решёткой типа α-Fe, температура перехода α↔β 1482 °C.
Обозначается символом Y (Yttrium). Простое вещество иттрий (CAS-номер: 7440-65-5) — металл светло-серого цвета. Существует в двух кристаллических модификациях: α-Y с гексагональной решёткой типа магния, β-Y с кубической объёмноцентрированной решёткой типа α-Fe, температура перехода α↔β 1482 °C.
История
Происхождение названия
Минерал иттербит, который дал имя иттрию, назван в честь деревни Иттербю (Ytterby) расположенной на острове Руслаген в Швеции. В дальнейшем, минерал иттербит изменил свое название на гадолинит в честь своего первого исследователя (и первооткрывателя иттрия) Юхана Гадолина, финского ученого.
Получение
Физические свойства
Иттрий — металл светло-серого цвета. Существует в двух кристаллических модификациях: α-Y с гексагональной решёткой типа магния (a=3,6474 Å; с=5,7306 Å; z=2; пространственная группа P63/mmc), β-Y с кубической объёмноцентрированной решёткой типа α-Fe (a=4,08 Å; z=2; пространственная группа Im3m), температура перехода α↔β 1482 °C, ΔH перехода 4,98 кДж/моль.
Изотопы
Иттрий моноизотопный элемент, в природе представлен одним стабильным нуклидом 89Y.
Химические свойства
Металл неустойчив на воздухе.
Применение
Иттриевая керамика
Керамика для нагревательных элементов
Хромит иттрия —это материал для лучших высокотемпературных нагревателей сопротивления способных эксплуатироваться в окислительной среде (воздух, кислород).
ИК — керамика
«Иттралокс»(Yttralox) — твёрдый раствор двуокиси тория в окиси иттрия. Для видимого света этот материал прозрачен, как стекло, но также он очень хорошо пропускает инфракрасное излучение, поэтому его используют для изготовления инфракрасных «окон» специальной аппаратуры и ракет, а также используют в качестве смотровых «глазков» высокотемпературных печей. Плавится «Иттрий-локс» лишь при температуре около 2207 °C.
Плавится «Иттрий-локс» лишь при температуре около 2207 °C.
Огнеупорные материалы
Оксид иттрия — чрезвычайно устойчивый к нагреву на воздухе огнеупор, упрочняется с ростом температуры (максимум при 900—1000 °C), пригоден для плавки ряда высокоактивных металлов (в том числе и самого иттрия). Особую роль оксид иттрия играет при литье урана. Одной из наиболее важных и ответственных областей применения оксида иттрия в качестве жаропрочного огнеупорного материала является производство наиболее долговечных и качественных сталеразливочных стаканов (устройство для дозированного выпуска жидкой стали), в условиях контакта с движущимся потоком жидкой стали оксид иттрия наименее размываем. Единственным известным и превосходящим по стойкости оксид иттрия в контакте с жидкой сталью является оксид скандия, но он чрезвычайно дорог.
Термоэлектрические материалы
Важным соединением иттрия является его теллурид. Имея малую плотность, высокую температуру плавления и прочность, теллурид иттрия имеет одну из самых больших термо-э. д.с среди всех теллуридов, а именно 921 мкВ/К (у теллурида висмута например 280 мкВ/К) и представляет интерес для производства термоэлектрогенераторов с повышенным КПД.
д.с среди всех теллуридов, а именно 921 мкВ/К (у теллурида висмута например 280 мкВ/К) и представляет интерес для производства термоэлектрогенераторов с повышенным КПД.
Сверхпроводники
Один из компонентов иттрий-медь-бариевой керамики с общей формулой YBa2Cu3O7-δ — перспективного высокотемпературного сверхпроводника с температурой сверхпроводящего перехода около 90 К.
Бериллид иттрия (равно как и бериллид скандия) является одним из лучших конструкционных материалов аэрокосмической техники и плавясь при температуре около 1920 °C, начинает окисляться на воздухе при 1670 °C (!). Удельная прочность такого материала весьма высока, и при использовании его в качестве матрицы для наполнения нитевидными кристаллами (усами) можно создать материалы, имеющие фантастические прочностные и упругие характеристики.
Сплавы иттрия
Иттрий является металлом, обладающим рядом уникальных свойств, и эти свойства в значительной степени определяют очень широкое применение его в промышленности сегодня и, вероятно, ещё более широкое применение в будущем.
Легирование
Легирование алюминия иттрием повышает на 7,5 % электропроводность изготовленных из него проводов.
Иттрий имеет высокие предел прочности и температуру плавления, поэтому способен создать значительную конкуренцию титану в любых областях применения последнего (ввиду того, что большинство сплавов иттрия обладает большей прочностью, чем сплавы титана, а кроме того у сплавов иттрия отсутствует «ползучесть» под нагрузкой, которая ограничивает области применения титановых сплавов).
Иттрий вводят в жаростойкие сплавы никеля с хромом (нихромы) с целью повысить температуру эксплуатации нагревательной проволоки или ленты и с целью в 2—3 раза увеличить срок службы нагревательных обмоток (спиралей), что имеет громадное экономическое значение (использование вместо иттрия скандия ещё в несколько раз увеличивает срок службы сплавов).
Магнитные материалы
Изучается перспективный магнитный сплав — неодим-иттрий-кобальт.
Покрытия иттрием и его соединениями
Напыление (детонационное и плазменное) иттрия на детали двигателей внутреннего сгорания позволяет увеличить износостойкость деталей в 400—500 раз по сравнению с хромированием.
Люминофоры
Окись и ванадат иттрия, легированные ионами европия, используются в производстве кинескопов цветных телевизоров.
Оксосульфид иттрия, активированный европием, применяется для производства люминофоров в цветном телевидении (красная компонента), а активированный тербием — для черно-белого телевидения.
Дуговая сварка
Добавлением иттрия в вольфрам резко снижают работу выхода (у чистого иттрия 3,3 эВ), что используется для производства иттрированных вольфрамовых электродов для аргонодуговой сварки и составляет значительную статью расхода металлического иттрия.
Гексаборид иттрия имеет так же малую работу выхода (2,22 эВ) и применяется для производства катодов мощных электронных пушек (электронно-лучевая сварка и резка в вакууме).
Другие сферы применения
Тетраборид иттрия находит применение в качестве материала для управления атомным реактором (имеет малое газовыделение по гелию и водороду).
Ортотанталат иттрия синтезируется и используется для производства рентгеноконтрастных покрытий.
Синтезированны иттрий-алюминиевые гранаты («сиграны»)(ИАГ), имеющие ценные физико-химические свойства, могут применяться и в ювелирном деле, и уже довольно давно применяемые в качестве технологичных и относительно дешёвых твердотельных лазеров. Важным лазерным материалом является ИСГГ — иттрий-скандий-галлиевый гранат.
Важным лазерным материалом является ИСГГ — иттрий-скандий-галлиевый гранат.
Феррит иттрия применяется для производства супер-ЭВМ, и хотя он уступает ферриту скандия в несколько раз, он дешевле.
Гидрид иттрия-железа применяют как аккумулятор водорода с высокой емкостью и достаточно дешевый.
Цены на иттрий
чистотой 99—99,9% составляют в среднем 95—115 долл за 1 кг.[источник не указан 224 дня]
Биологическая роль
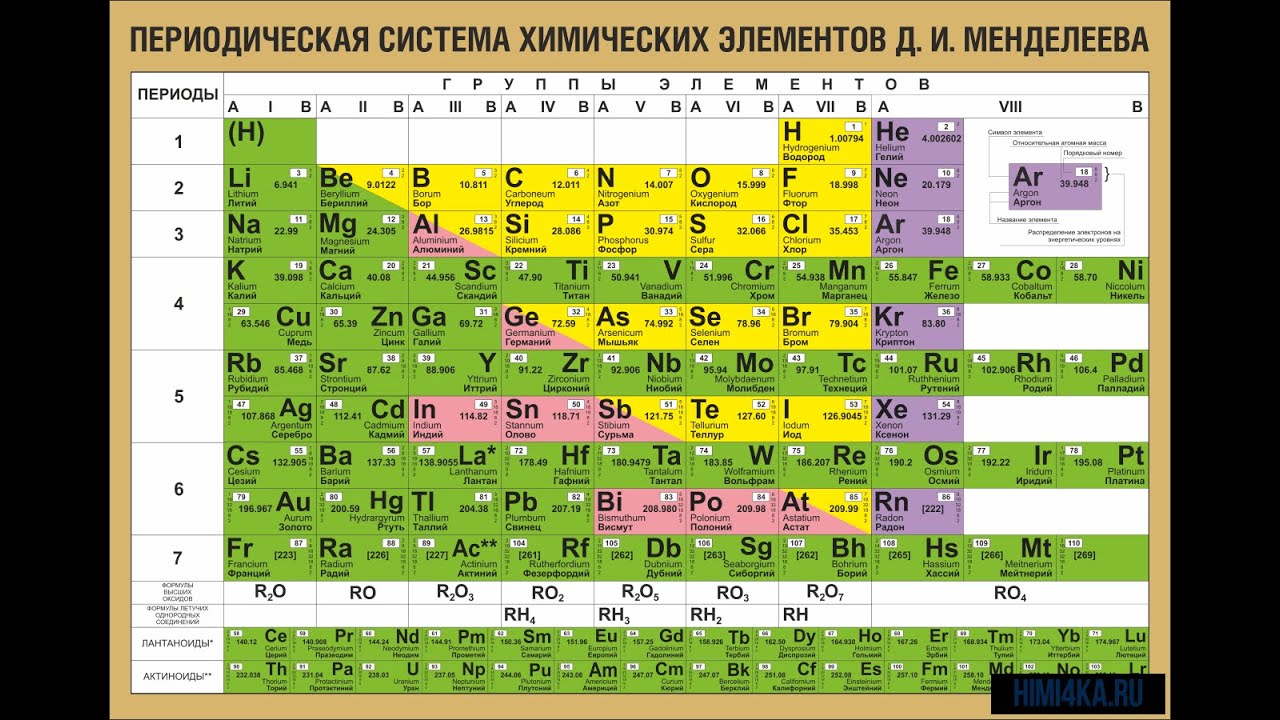
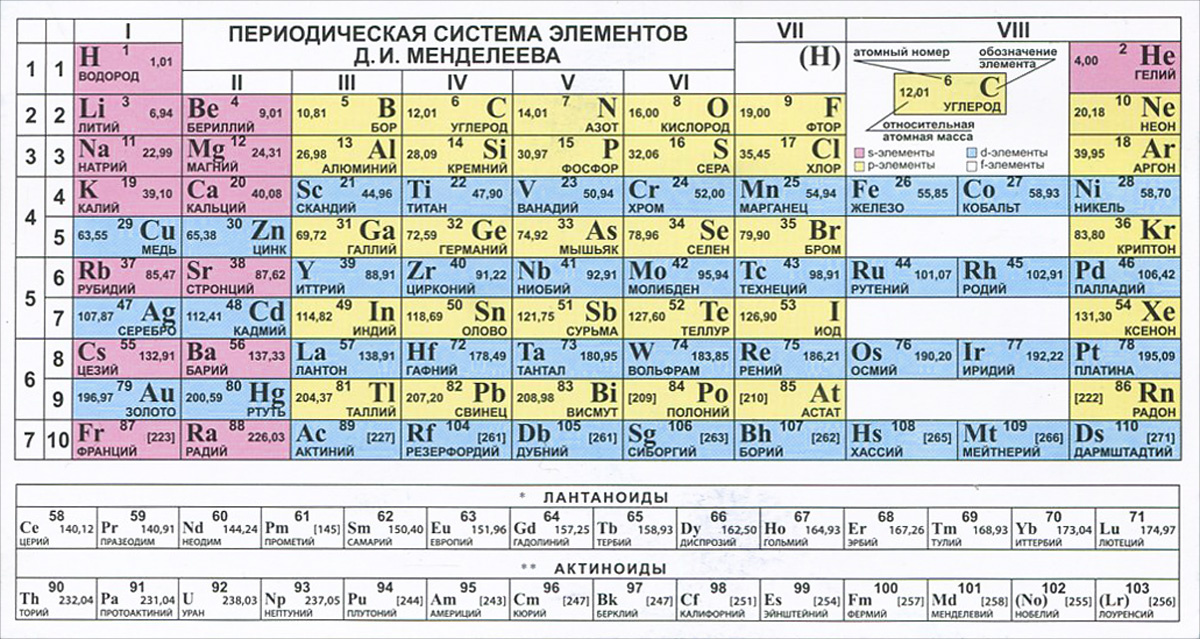
Точное место элементов в таблице Менделеева. О чем рассказывает свет
Точное место элементов в таблице Менделеева
Некоторые химические элементы стоят в таблице Менделеева не в порядке возрастания атомных весов. Таковы три группы элементов: № 18 — аргон (атомный вес 39,9) и № 19 — калий (атомный вес его меньше — 39,1), далее № 27 — кобальт (атомный вес 58,9) и № 28 — никель (атомный вес его меньше — 58,7), а также № 52 — теллур (атомный вес — 127,1) и № 53 — иод (атомный вес его меньше — 126,9).
Менделеев поставил указанные элементы в свою таблицу сообразно их химическим свойствам, в той последовательности, в какой они здесь перечислены. Атомные веса соседних элементов (например, кобальта и никеля) мало отличаются друг от друга. Среди химиков долго шли споры. Одни говорили, что в этих случаях нарушается периодический закон. Другие утверждали, что нарушения периодического закона нет, а просто у этих элементов неправильно определен атомный вес. Но сколько ни уточняли химики атомные веса этих элементов, всегда оказывалось, что аргон, кобальт и теллур соответственно тяжелее калия, никеля и иода. И все же в таблице Менделеева они стояли впереди калия, никеля и иода в нарушение стройности всей таблицы, как тогда думали.
В те времена и до конца жизни Менделеева (1910) наука еще ничего не знала ни о зарядах атомных ядер, ни о частотах рентгеновских излучений и тем более о законе возрастания этих частот с увеличением заряда атомных ядер. Закон Мозели был открыт уже после смерти Менделеева.
Когда все эти открытия были сделаны, рентгеновские спектры показали, что Менделеев совершенно правильно определил последовательность указанных элементов. Как теперь установлено, данная Менделеевым последовательность элементов соответствует возрастанию зарядов атомных ядер. Химические свойства элементов больше зависят от заряда атомных ядер, чем от атомных весов. Позднее ученые обнаружили даже такие элементы, у которых атомный вес немного отличался, но заряд ядер был один и тот же. И химические свойства их были тоже почти одинаковы. Такие элементы называют изотопами. Все изотопы стоят в одной клетке таблицы Менделеева (изотоп — слово греческое, означает «занимающий то же место»). Почти каждый элемент имеет несколько изотопов. Химики же определяли ранее не точный атомный вес элемента, а лишь средний атомный вес, т. е. атомный вес для смеси, состоящей из изотопов. Нарушив в своей таблице в трех случаях порядок возрастания атомных весов, Менделеев сохранил порядок, соответствующий закону периодичности химических свойств элементов. Но тем самым, как оказалось впоследствии, Менделеев сохранил последовательность возрастания ядерных зарядов.
Но тем самым, как оказалось впоследствии, Менделеев сохранил последовательность возрастания ядерных зарядов.
Вот замечательный пример того, как важно быть объективным в науке и не поддаваться соблазну подогнать факты (атомные веса) под «закон» (возрастания атомных весов в периодической таблице), который, казалось бы, был уже вот-вот нащупан, так как оправдывался для 97% элементов! В этой объективности проявляется сила подлинной науки и мужество настоящих ученых.
Это также и пример того, что в науке исключения из установленных ранее правил всегда ведут к раскрытию новых, более общих, закономерностей.
Уверенность Менделеева в справедливости открытого им великого закона природы — закона (периодичности химических свойств — оправдалась и в этом случае. Она была подтверждена также и спектральным анализом рентгеновских излучений.
Более полутораста лет тому
назад, в 1794 г., Гадолином (Финляндия) была открыта неизвестная
“земля”, как тогда называли окислы. Лишь в 1828 г. Ф. Велеру удалось
выделить из этого окисла новый металл. Его назвали иттрием. Это
название происходит от слова “иттерби”, имеющего своеобразную историю.
Недалеко от столицы Швеции Стокгольма, в районе небольшого городка
Иттерби, была обнаружена пегматитовая жила (пегматит – крупнозернистая
горная порода). Своеобразный рисунок на изломе пегматитовой породы
напоминает древние письмена. Но после выделения металла и изучения его свойств иттрий продолжал лежать в земле, входя в состав сложных и редких минералов. Они содержали целую группу, похожих друг на друга и трудно разделимых элементов. Поэтому иттрий, подобно скандию, относится к числу редких элементов, хотя иттрия в земной коре немногим меньше олова и в 5 раз больше свинца. Не так уже мало! И не так уж редко! Подробнее и полнее изучен
не сам иттрий; а его соединения.
|
Официально объявлено о синтезе 117-го элемента в Дубне
Периодическая таблица химических элементов им. Д. И. Менделеева официально стала на один элемент обширнее. Физики из ОИЯИ (Дубна) и Окриджской национальной лаборатории (США) опубликовали работу, в которой рассказывается об открытии элемента номер 117.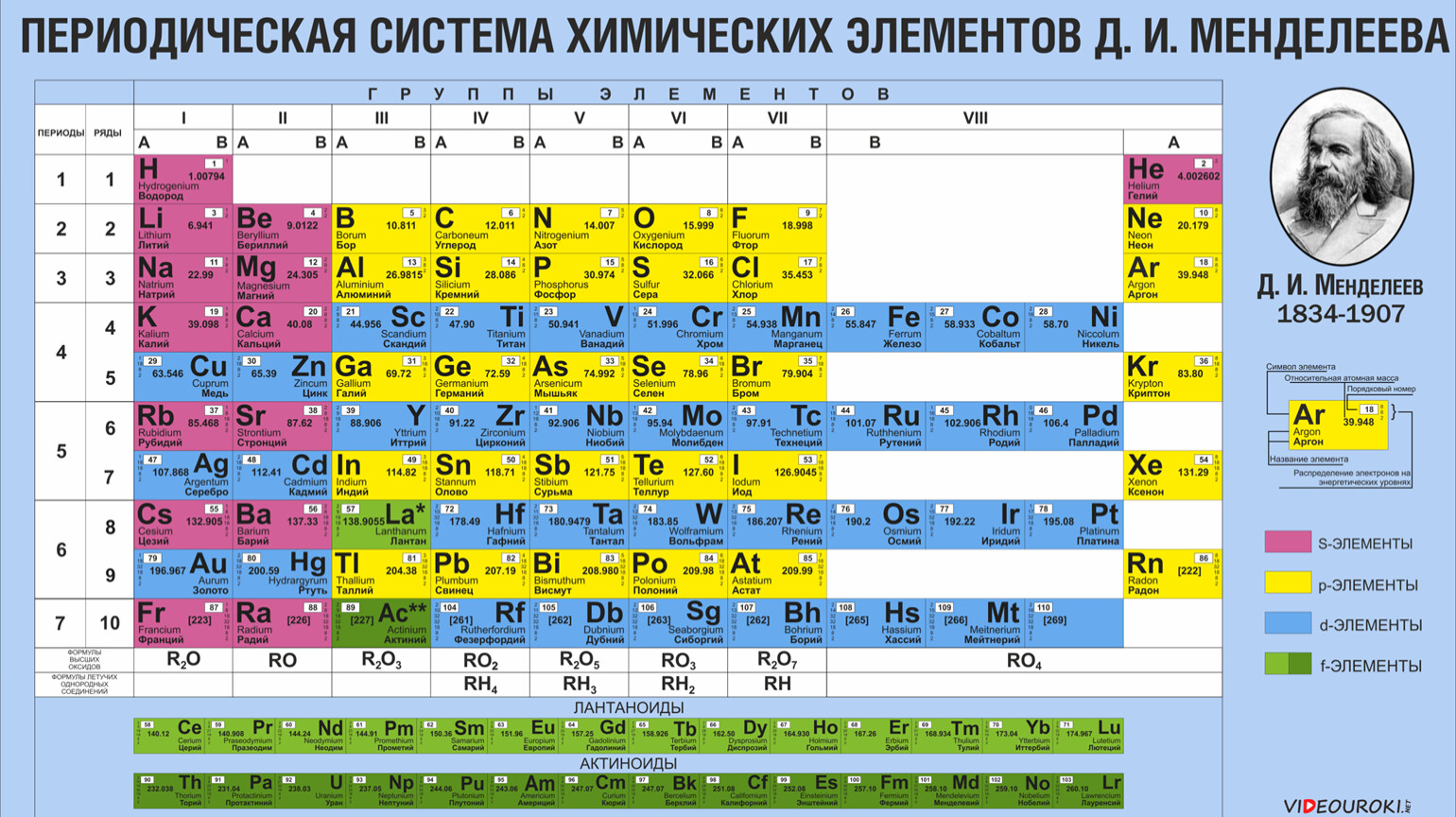
Эксперимент по синтезу 117-го элемента начался 27 июля 2009 года. Уже осенью источники в ОИЯИ рассказывали, что эксперимент идет успешно и новый элемент уже удалось надежно зарегистрировать. Однако в научной среде открытие считается официально свершившимся, когда сообщение о нем появляется на страницах официального рецензируемого научного журнала. Тогда же называлось и название журнала – Physical Review Letters, но сообщения, конечно, носили неофициальный характер.
И вот наконец получен официальный анонс – публикация, посвященная синтезу элемента номер 117, появится в следующем выпуске журнала.
Элемент, который получен российскими и американскими физиками, аномально тяжел. Только представьте – он на 40% тяжелее свинца!
Новое открытие завершает заполнение периодической системы с первого и до 118-го элемента. 118-й элемент был открыт в Дубне в 2006 году, а вот клетка 117-го оставалась до сих пор пустой.
close
100%
Время жизни элемента номер 117 относительно велико, что подтверждает теории о том, что в районе 116–118 элемента существует «островок стабильности». Все три элемента «живут» заметно дольше, чем их более легкие соседи. Насколько длинным является островок и продолжится ли тенденция к дальнейшей стабилизации, покажут только будущие исследования.
«В Лаборатории ядерных реакций (ЛЯР) им. Г. Н. Флерова Объединенного института ядерных исследований (ОИЯИ) синтезирован новый 117-й элемент Периодической таблицы Д. И. Менделеева. Эксперименты (руководитель — академик Юрий Оганесян) проводились на ускорителе тяжелых ионов ЛЯР ОИЯИ в сотрудничестве с национальными лабораториями США в Ок-Ридже и Ливерморе, с Университетом Вандербильта (США), а также с Научно-исследовательским институтом атомных реакторов (Димитровград, Россия). Синтез нового элемента осуществлен в реакции ускоренных ионов кальция-48 с уникальной мишенью из изотопа искусственного 97-го элемента — берклия-249, период полураспада которого составляет всего 320 дней.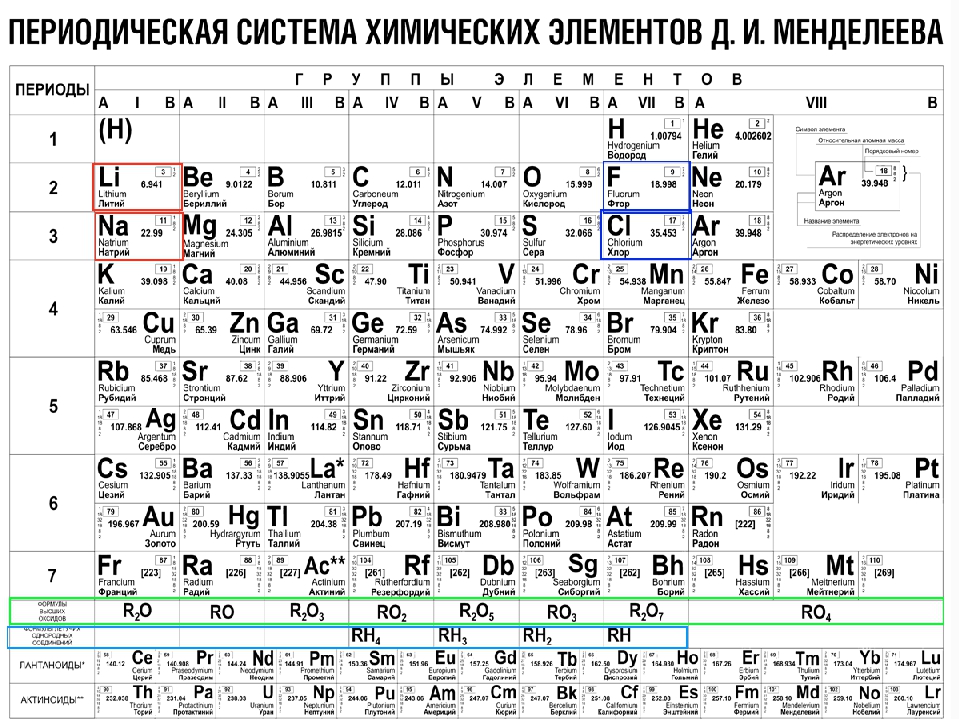 Его наработка была осуществлена на самом мощном на сегодняшний день в мире атомном реакторе HIFR Национальной лаборатории США в Ок-Ридже», — передает пресс-служба ОИЯИ слова директора института академика Алексея Сисакяна.
Его наработка была осуществлена на самом мощном на сегодняшний день в мире атомном реакторе HIFR Национальной лаборатории США в Ок-Ридже», — передает пресс-служба ОИЯИ слова директора института академика Алексея Сисакяна.
В ходе длительного (более полугода) эксперимента было зарегистрировано 6 событий «рождения» нового элемента.
close
100%
Свойства распада изотопов элемента 117 и его дочерних продуктов — изотопов элементов 115, 113, 111, 109, 107 и 105 — вместе с ранее синтезированными в Дубне изотопами элементов 112–116 и 118 являются прямым экспериментальным доказательством существования «островов стабильности» сверхтяжелых ядер.
Время жизни новых изотопов элементов 115, 113 и 111, измеряемое секундами, позволяет исследовать их химические свойства существующими экспрессными радиохимическими методами: проверяется периодичность изменения химических свойств тяжелейших элементов на основе фундаментальных законов квантовой электродинамики, описывающих электронную структуру сверхтяжелых атомов. Подобные эксперименты с открытыми ранее изотопами элементов 112 и 114 уже проводятся в ЛЯР ОИЯИ в широком сотрудничестве с ведущими радиохимическими лабораториями мира, говорится в сообщении пресс-службы.
Подобные эксперименты с открытыми ранее изотопами элементов 112 и 114 уже проводятся в ЛЯР ОИЯИ в широком сотрудничестве с ведущими радиохимическими лабораториями мира, говорится в сообщении пресс-службы.
Сотрудники Лаборатории ядерных реакций имени Флерова с 1960-х годов успешно синтезируют новые элементы. Во времена СССР здесь были получены 104, 105, 106, 107, 108 элементы. Здесь же были синтезированы впервые сверхтяжелые элементы с атомными номерами со 112 по 116 и самый тяжелый на сегодня 118-й элемент. Теперь ученым удалось заполнить «пропуск» и синтезировать 117-й элемент.
«Всего было получено шесть цепочек последовательного распада ядер 117-го элемента, причем нам удалось получить три разных изотопа нового элемента, а также новые изотопы элементов 115, 113, 111, 109, 107, 105», — сказал руководитель эксперимента Юрий Оганесян.
Хотя в обозримом будущем практического применения у сверхтяжелых короткоживущих элементов, скорее всего, найдено не будет, эксперименты по их синтезу очень важны для фундаментальной науки. В ходе таких опытов ученые проверяют существующие модели, объясняющие, как нейтроны и протоны, образующие ядро всех элементов, кроме водорода, связаны между собой. Эти модели, в свою очередь, могут объяснить феномен различного содержания тех или иных элементов в материи Вселенной, а также предсказать возможное существование экзотических сверхтяжелых элементов, являющихся достаточно стабильными для существования на Земле или в метеоритах.
В ходе таких опытов ученые проверяют существующие модели, объясняющие, как нейтроны и протоны, образующие ядро всех элементов, кроме водорода, связаны между собой. Эти модели, в свою очередь, могут объяснить феномен различного содержания тех или иных элементов в материи Вселенной, а также предсказать возможное существование экзотических сверхтяжелых элементов, являющихся достаточно стабильными для существования на Земле или в метеоритах.
Иттрий – информация об элементе, свойства и использование
Стенограмма:
Химия в ее стихии: иттрий
(Промо)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец рекламного ролика)
Мира Сентилингам
На этой неделе последний из элементов, обнаруженных в маленьком городке Иттерби и его соединениях, кажется, имеет множество применений.
Саймон Коттон
Y. Это не вопрос. Y — это символ элемента иттрия.
Примерно 20 лет назад большинство ученых ничего о нем не слышали, разве что смутно отмечали, где он находится в таблице Менделеева, ниже скандия и выше лантана. Некоторые люди могли просто знать, что это один из 4 химических элементов, названных в честь небольшого шведского городка Иттербю, наряду с иттербием, эрбием и тербием.
Затем, в 1986 году, двое ученых, работавших в IBM в Цюрихе, Георг Беднорц и Карл Мюллер, обнаружили, что оксид лантана-бария-меди становится сверхпроводящим при тогдашней почти рекордно высокой температуре, 35 градусов выше абсолютного нуля.Другими словами, ниже минус 238°С электрическое сопротивление соединения исчезало.
За это открытие Беднорц и Мюллер получили Нобелевскую премию по физике в 1987 году. Побуждение других ученых стряхнуть пыль со своих Периодических таблиц и попробовать заменить лантановую часть другими подобными металлами. Два американских профессора, Мау-Куен Ву и Пол Чу, вместе со своими исследовательскими группами в Университетах Алабамы и Хьюстона изучали оксид иттрия-бария-меди. Он имеет формулу YBa 2 Cu 3 O 7 и часто для краткости называется YBCO.Они обнаружили, что он становится сверхпроводящим при температуре 95 градусов ниже абсолютного нуля (-178 ºC).
Может показаться, что разница температур невелика, но это означало, что YBCO можно было поддерживать в сверхпроводящем состоянии с помощью жидкого азота, а не гораздо более дорогого жидкого гелия. Это вдохновило множество исследований за последние 20 лет. Конечная цель, Святой Грааль, состоит в том, чтобы найти материал, который обладал бы сверхпроводимостью при комнатной температуре, но до этого еще никто не добрался.
YBCO можно использовать во многих областях; например, сканеры МРТ можно сделать более дешевыми при более высокой температуре с использованием хладагента из жидкого азота.Однако в настоящее время существуют технические проблемы, препятствующие этим коммерческим приложениям. Одна из них заключается в том, что для сверхпроводимости при температуре 95 К YBCO должен быть слегка дефицитным по кислороду, то есть иметь немногим меньше семи атомов кислорода на атом иттрия. Точное количество имеет решающее значение, и его сложно достичь.
Одна из них заключается в том, что для сверхпроводимости при температуре 95 К YBCO должен быть слегка дефицитным по кислороду, то есть иметь немногим меньше семи атомов кислорода на атом иттрия. Точное количество имеет решающее значение, и его сложно достичь.
Другие проблемы включают приведение YBCO в нужное состояние; много исследований направлено на то, чтобы сделать из него тонкие пленки и найти способ превратить его в непрерывный провод, а не просто набор кристаллов, упакованных вместе, которые не могут проводить приличные токи.Исследователи изучают возможность нанесения YBCO на гибкую металлическую проволоку, и исследования в этом направлении продолжаются.
Помимо этого, соединения иттрия находят множество повседневных применений. В своих соединениях иттрий всегда присутствует в виде иона три плюс иттрий, что означает, что он бесцветен и не имеет неспаренных электронов; следовательно, у него нет собственных интересных магнитных или спектроскопических свойств. Положительным моментом этого является то, что соединения иттрия являются очень хорошими исходными материалами для других лантаноидов.
Наиболее известным применением является красный люминофор в электронно-лучевых трубках, используемых в традиционных цветных телевизорах. Он сделан из оксисульфида иттрия, Y2O2S, содержащего небольшое количество трехвалентных ионов европия. Точно так же иттриевые основы часто используются для размещения ионов тербия, которые представляют собой зеленые люминофоры. Такие материалы используются в люминесцентных лампах «холодного белого цвета».
Иттрий-алюминиевый гранат, также известный как YAG, является очень важным синтетическим минералом. Он используется для изготовления твердых искусственных алмазов, которые сверкают так же, как настоящие.Более того, вводя небольшие количества ионов лантанидов, можно получать материалы с рядом полезных свойств. Введите, например, небольшое количество церия, и вы получите хороший желтый люминофор. Или добавьте 1 % неодима к YAG, и вы получите наиболее широко используемый твердотельный лазерный материал. И эрбий дает вам инфракрасный лазер.
Иттрий также находит применение в топливных элементах для питания автомобилей и автобусов, компьютеров и цифровых телефонов и, возможно, в зданиях. Небольшое количество оксида иттрия добавляется к оксиду циркония для получения так называемого оксида циркония, стабилизированного оксидом иттрия (также называемого YSZ).Он обладает необычным свойством проводить ионы оксида, что делает его очень полезным в топливных элементах. YSZ также используется для изготовления лямбда-зондов, устанавливаемых на выхлопную систему вашего автомобиля. Они контролируют количество кислорода в выхлопных газах и посылают обратную связь, чтобы подавать в двигатель наилучшую топливно-воздушную смесь.
Итак, это вам иттрий. Бесцветный, невзрачный, но, несомненно, исполняющий немало важных ролей второго плана.
Мира Сентилингам
Итак, Оскар за лучшую роль второго плана достается, как вы уже догадались, Иттриуму.Это был Саймон Коттон из Уппингемской школы с многочисленными ролями и использованием иттрия. На следующей неделе у нас есть элемент, который может перенести нас в другое измерение.
На следующей неделе у нас есть элемент, который может перенести нас в другое измерение.
Hayley Birch
В 1949 году Милтон Смит опубликовал небольшой художественный труд, который он назвал «Тайна элемента 117». Настоящий элемент 117 еще предстоит открыть — это пустое место в Периодической таблице сразу после галогенов. . Однако 117 Смита был странным материалом, который можно было использовать, чтобы открыть окно в другое измерение.Он назвал это вещество магнитным монополем — таким, которое вместо полюсов во множественном числе, подобно обычному магниту, имело полюс. Единственное число. Теперь, хотя ни один уважаемый ученый не будет утверждать, что магнитный монополь может открыть межпространственный портал, его существование не выходит за рамки возможного, и, если верить недавним сообщениям, он может зависеть от обычного металлического элемента, который вы можете найти крадущийся в нижней части периодической таблицы – гольмий.
Мира Сентилингам
И Хейли Берч расскажет правду о таких мифических монополиях в выпуске «Химия в ее элементах» на следующей неделе. А пока я Мира Сентилингам, и спасибо, что выслушали.
А пока я Мира Сентилингам, и спасибо, что выслушали.
(Акция)
(Конец акции)
иттрий | химический элемент | Britannica
иттрий (Y) , химический элемент, редкоземельный металл группы 3 периодической таблицы.
Иттрий — серебристо-белый, умеренно мягкий, пластичный металл. Он достаточно стабилен на воздухе; быстрое окисление начинается примерно при температуре выше 450 ° C (840 ° F), в результате чего образуется Y 2 O 3 .Металл легко реагирует с разбавленными кислотами, за исключением плавиковой кислоты (HF), в которой нерастворимый защитный слой YF 3 , образующийся на поверхности металла, предотвращает дальнейшую реакцию. Иттриевая стружка легко воспламеняется на воздухе, раскаляясь добела. Металл является парамагнитным с независимой от температуры магнитной восприимчивостью от 10 до 300 К (от -263 до 27 ° C или от -442 до 80 ° F). Он становится сверхпроводящим при 1,3 К (-271,9 ° C или -457 ° F) при давлении, превышающем 110 килобар.
Он становится сверхпроводящим при 1,3 К (-271,9 ° C или -457 ° F) при давлении, превышающем 110 килобар.
Британская викторина
Периодическая таблица элементов
Проверьте свою связь с периодической таблицей элементов в этой викторине по всем 118 химическим элементам и их символам.Вы можете быть знакомы с химическими символами водорода и кислорода, но можете ли вы сопоставить такие низкопрофильные элементы, как гадолиний и эрбий, с соответствующими символами?
В 1794 году финский химик Йохан Гадолин выделил иттрий, новую землю или оксид металла, из минерала, найденного в Иттербю, Швеция. Иттрия, первого обнаруженного редкоземельного элемента, оказалась смесью оксидов, из которых в течение более века образовались девять элементов — иттрий, скандий (атомный номер 21) и тяжелые лантанидные металлы из тербия ( атомный номер 65) до лютеция (атомный номер 71) — разделяли. Иттрий встречается особенно в тяжелых редкоземельных рудах, из которых наибольшее значение имеют латеритные глины, гадолинит, эвксенит и ксенотим. В магматических породах земной коры этого элемента больше, чем любого другого редкоземельного элемента, кроме церия, и вдвое больше, чем свинца. Иттрий также встречается в продуктах ядерного деления.
Иттрий встречается особенно в тяжелых редкоземельных рудах, из которых наибольшее значение имеют латеритные глины, гадолинит, эвксенит и ксенотим. В магматических породах земной коры этого элемента больше, чем любого другого редкоземельного элемента, кроме церия, и вдвое больше, чем свинца. Иттрий также встречается в продуктах ядерного деления.
Стабильный иттрий-89 — единственный природный изотоп. Всего 33 (исключая ядерные изомеры) радиоактивных изотопа иттрия с массой от 77 до 109 и периодом полураспада от 41 миллисекунд (иттрий-108) до 106.Сообщалось о 63 днях (иттрий-88).
Промышленно иттрий отделяют от других редкоземельных элементов жидкостно-жидкостной или ионообменной экстракцией, а металл получают металлотермическим восстановлением безводного фторида кальцием. Иттрий существует в двух аллотропных (структурных) формах. α-фаза является гексагональной с плотной упаковкой с a = 3,6482 Å и c = 5,7318 Å при комнатной температуре. β-фаза является объемно-центрированной кубической с a = 4,10 Å при 1478 ° C (2692 ° F).
Иттрий и его соединения имеют множество применений. Основные области применения включают в себя основы для красных люминофоров для люминесцентных ламп, цветных дисплеев и экранов телевизоров, в которых используются электронно-лучевые трубки. Иттрий-алюминиевый гранат (ИАГ), легированный другими редкоземельными элементами, используется в лазерах; железо-иттриевый гранат (ЖИГ) используется для микроволновых фильтров, радаров, связи и синтетических драгоценных камней; кубический цирконий, стабилизированный оксидом иттрия, используется в датчиках кислорода, конструкционной керамике, термобарьерных покрытиях и синтетических алмазах.Основное применение иттрия – в высокотемпературной сверхпроводящей керамике, такой как YBa 2 Cu 3 O 7 , температура сверхпроводящего перехода которой составляет 93 К (-180 ° C или -292 ° F) для линии электропередачи и сверхпроводящие магниты. Металл используется в качестве легирующей добавки к сплавам черных и цветных металлов для повышения коррозионной стойкости и стойкости к окислению. Соединения иттрия используются в оптических стеклах и в качестве катализаторов.
Соединения иттрия используются в оптических стеклах и в качестве катализаторов.
Иттрий химически ведет себя как типичный редкоземельный элемент со степенью окисления +3.Его ионный радиус близок к радиусам диспрозия и гольмия, что затрудняет отделение от этих элементов. Помимо белого полуторного оксида, иттрий образует ряд почти белых солей, включая сульфат, трихлорид и карбонат.
| Атомный номер | 39 | |
|---|---|---|
| 88. | ||
| 1,522 ° C (2 772 ° F) | ||
| Точка кипения | 3,345 ° C (6053 °F) | |
| удельный вес | 4.469 (24 ° C, или 75 ° F) | |
| Состояние окисления | +3 | +3 |
| Электронная конфигурация | [KR] 4 D 1 5 S 2 |
Y Информация об элементе иттрия: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История иттрия
Элемент иттрий был открыт Йоханом Гадолином в
1794 г. в Финляндии
.Иттрий
получил свое название от Ytterby, Швеция
в Финляндии
.Иттрий
получил свое название от Ytterby, Швеция
Присутствие иттрия: изобилие в природе и вокруг нас
В таблице ниже показано содержание иттрия во Вселенной, на Солнце, в метеоритах, Земная кора, океаны и тело человека.
Кристаллическая структура иттрия
Твердотельная структура иттрия имеет вид Simple Hexagonal.
Кристаллическую структуру можно описать с точки зрения ее элементарной ячейки. Единичные клетки повторяются в три объемное пространство для формирования конструкции.
Параметры ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| и | б | с |
|---|---|---|
364. 74 74 | 364,74 | 573,06 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π/2 | №/2 | 2 π/3 |
Положения атомов внутри элементарной ячейки описываются набором положений атомов ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются понятием пространственных групп. Все возможное
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются различными.
Атомные и орбитальные свойства иттрия
атома иттрия имеют 39 электронов и структура электронной оболочки [2, 8, 18, 9, 2] с атомным термином (квантовые числа) 2 D 3/2 .
Оболочечная структура иттрия – количество электронов на единицу энергии уровень
| нет | с | р | д | ф | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | М | 2 | 6 | 10 | |
| 4 | Н | 2 | 6 | 1 | |
| 5 | О | 2 |
Электронная конфигурация иттрия в основном состоянии – нейтральная Атом иттрия
Электронная конфигурация основного состояния нейтрального атома иттрия
[Кр] 4d1 5s2.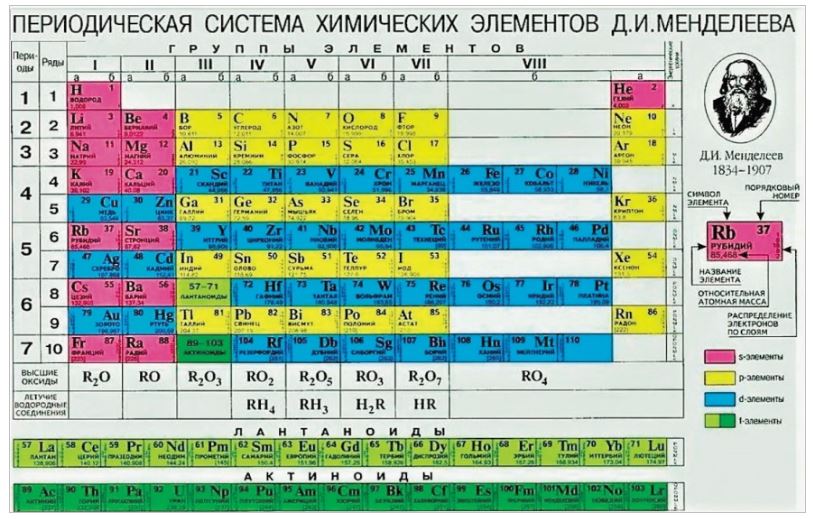 Часть конфигурации иттрия, эквивалентная благородному газу
предшествующий период обозначается аббревиатурой [Kr]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используется сокращенная нотация. Это важно, поскольку это
валентные электроны 4d1 5s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации иттрия, эквивалентная благородному газу
предшествующий период обозначается аббревиатурой [Kr]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используется сокращенная нотация. Это важно, поскольку это
валентные электроны 4d1 5s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального иттрия
Полная электронная конфигурация основного состояния для атома иттрия, Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d1 5s2
Атомная структура иттрия
Атомный радиус иттриясоставляет 212 пм, а его ковалентный радиус — 162 пм.
Атомный спектр иттрия
Химические свойства иттрия: Энергии ионизации иттрия и сродство к электрону
Сродство к электрону иттрия составляет 29,6 кДж/моль.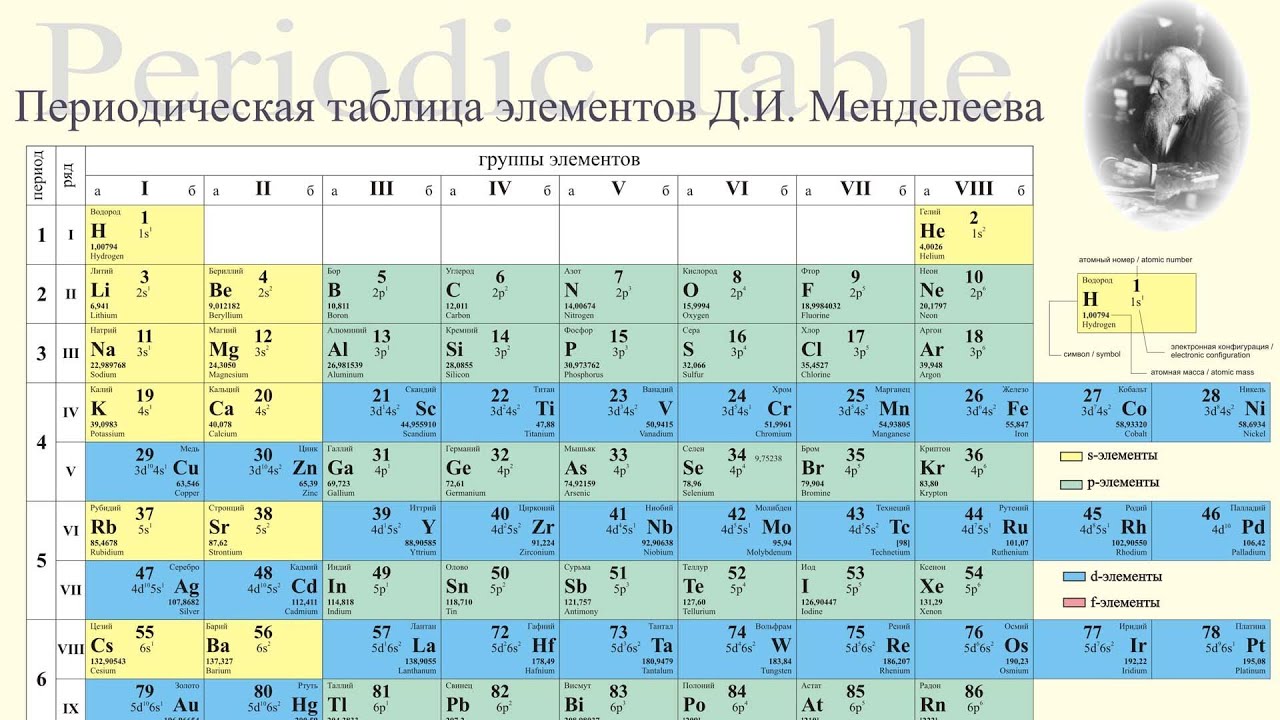
Энергия ионизации иттрия
Энергии ионизации иттрия
см. в таблице ниже.| Номер энергии ионизации | Энтальпия – кДж/моль |
|---|---|
| 1 | 600 |
| 2 | 1180 |
| 3 | 1980 |
| 4 | 5847 |
| 5 | 7430 |
| 6 | 8970 |
| 7 | 11190 |
| 8 | 12450 |
| 9 | 14110 |
| 10 | 1. 84×104 84×104 |
Физические свойства иттрия
Физические свойства иттрия см. в таблице ниже
| Плотность | 4,472 г/см3 |
| Молярный объем | 19,8805567979 см3 |
Упругие свойства
Твердость иттрия. Испытания для измерения твердости элемента
Электрические свойства иттрия
Иттрий является проводником электричества.Ссылаться на Таблица ниже для электрических свойств иттрия
Свойства теплопроводности иттрия
Магнитные свойства иттрия
Оптические свойства иттрия
Акустические свойства иттрия
Тепловые свойства иттрия – энтальпии и термодинамика
Тепловые свойства иттрия
см.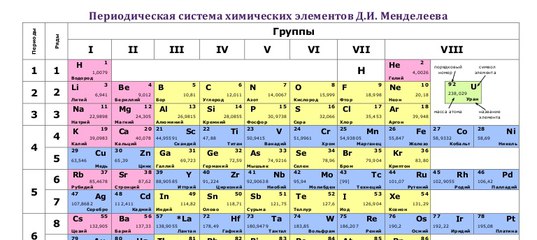 в таблице ниже.
в таблице ниже.Энтальпии иттрия
Изотопы иттрия – ядерные свойства иттрия
Изотопы родия.Встречающийся в природе иттрий имеет 1 стабильный изотоп – 89г.
| Изотоп | Масса изотопов | % Изобилие | Т половина | Режим затухания |
|---|---|---|---|---|
| 76Y | ||||
| 77Г | ||||
| 78Г | ||||
| 79Y | ||||
| 80Y | ||||
| 81Г | ||||
| 82Г | ||||
| 83Г | ||||
| 84Y | ||||
| 85г | ||||
| 86Y | ||||
| 87Y | ||||
| 88г | ||||
| 89Y | 100% | Стабильный | Н/Д | |
| 90Y | ||||
| 91Y | ||||
| 92Y | ||||
| 93Y | ||||
| 94Y | ||||
| 95Y | ||||
| 96Y | ||||
| 97Y | ||||
| 98Y | ||||
| 99Y | ||||
| 100Y | ||||
| 101Y | ||||
| 102Y | ||||
| 103Y | ||||
| 104Y | ||||
| 105Y | ||||
| 106Y | ||||
| 107Y | ||||
| 108Y |
Нормативно-правовое регулирование и здоровье – Параметры и рекомендации по охране здоровья и безопасности
Поиск по базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химических реестров
Изучите нашу интерактивную периодическую таблицу
Сравнение элементов периодической таблицы
Иттрия Y (элемент 39) периодической таблицы
39 Y (иттрий)
Карточка иттрия
Иттрий представляет собой высококристаллический железо-серый металл с серебристо-серым блеском, редкоземельный металл .
Он стабилен в воздухе , потому что он защищен образованием стабильной оксидной пленки на его поверхности, но легко окисляется при нагревании.
Реагирует с водой и минеральными кислотами.
Металлическая стружка или стружка могут воспламеняться на воздухе при температуре выше 400 °C
Мелкодисперсный иттрий очень нестабилен на воздухе.
Нитрид иттрия образуется при нагревании металла до 1000 o C в азоте.
Сублимированная чистота (99,99%) Металлические части иттрия
Идентификационный номер
Номер CAS: CAS7440-65-5
Номер CID: CID23993
Класс опасности DOT: 4.1
Номер DOT: 3089
Номер RTECS: RTECSZG2980000
Основные свойства иттрия Произношение: it-ree-am
Внешний вид: серебристо-белый
Массовый номер: 89
Стандартный атомный вес: 88,905 г/моль
Атомный номер (Z): 39
Электроны: 39
Протоны: 39
Нейтроны: 9 50 5
Группа: 3
Блок: d
Категория элемента: Переходный металл
Электроны на оболочку: K2, L8, M18, N9, O2
Электронная конфигурация: 1s 2 2s 2 2p 3 8 2909 3 3 6 3d 10 4s 2 4p 6 4d 1 5s 2
Электронная конфигурация иттрия
Термические свойства иттрия Фаза: Твердое
Температура плавления: 1799 K (1526 o C, 2779 o F)
. 85 o C, 44,33 o F)
85 o C, 44,33 o F)
Теплота плавления: 11,42 кДж/моль
Теплота испарения: 363 кДж/моль
Удельная теплоемкость: 298 Дж/(кг·К)
Молярная теплоемкость: 26,53 Дж/(моль. K)
Тепловое расширение: α поли: 596 мкм/(м∙K)
Теплопроводность: 17,2 Вт/(м∙K)
Электропроводность: 1,8×10 6 См/м
А Удельное электрическое сопротивление: α поли: 596 нОм∙м
А Электрический тип: проводник
Критическая точка (сверхпроводящая точка): 1.3 К (-271,85 o С, -457,33 o F)
Магнитный Тип: Paramagnetic
Магнитная восприимчивость (X MOL ): + 2.15 × 10 -6 см -6 / моль
Объемная магнитная восприимчивость: 0,0002978
Масса магнитной восприимчивости: 66,6 × 10 -9 м 3 /кг
Молярная магнитная восприимчивость: 5,921×10 -9 m 3 /моль
Плотность: 4.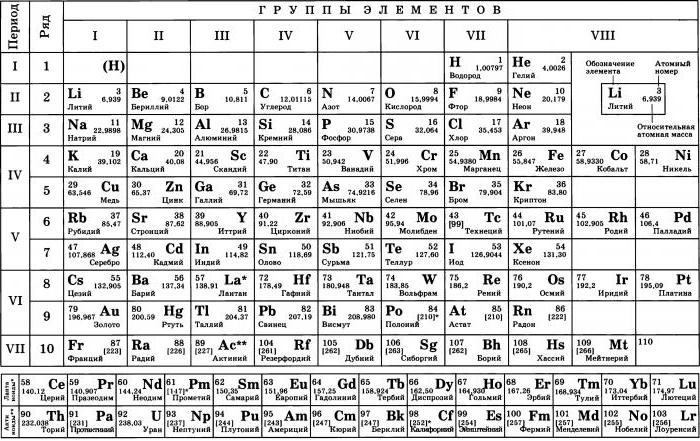 472 г / см 3 (в солидном) 4,24 г / см 3 (в жидкости)
472 г / см 3 (в солидном) 4,24 г / см 3 (в жидкости)
молярный объем: 0,000019881 м 3 / моль
Модуль молодых: 63,5 GPA
Модуль сдвига: 25.6 GPA
Модуль навала: 41.2 ГПа
Коэффициент Пуассона: 0,243
Твердость по Виккеру: 904 МПа
Твердость по Бринеллю: 200-589 МПа
Скорость звука: 3300 м/с
Степени окисления: 3 , 2, 1
Валентные электроны: 4d 1 5s 2
Заряд иона: Y 3+
Ионизационный потенциал атома: 6.5
Энергии ионизации: 1-я: 600 кДж.моль 2-я: 1180 кДж/моль 3-я: 1980 кДж/моль
Ионный радиус: 90 пм
Атомный радиус: эмпирический: 180 пм
Ван-дер-Ваальс: 219
Ковалентный радиус: 190±7 pm
Заполняющая орбиталь: 4d 1
Кристаллическая структура: гексагональная плотноупакованная
Углы решетки: π/2, π/2, 2π/3
Постоянная решетки: 364,7, 364,7, 573,1 пм
Параметры сетки: 7 a=3. c=5,731 Å
c=5,731 Å
Отношение c/a: 1,571
Название пространственной группы: P6 3 /mmc
Номер пространственной группы: 194
Шестиугольная закрытая упаковка (HCP)
Реакционная способность иттрия Электроотрицательность: шкала Полинга: 1.22
Валентность: +3
Сродство к электрону: 29,6 кДж/моль
Период полураспада: стабильный (бесконечность)
Срок службы: стабильный (бесконечность)
Квантовое число: 2 D 3/2
Нейтронное сечение (Бранс): 1,28 88 Д 89 Д 90 Д 91 Д
| Изотоп | Численность (%) | Атомная масса г/моль | Период полувыведения (t 1/2 ) |
| 87 Д | Син | – | 3. |
| 88 Д | Син | – | 106,6 д |
| 89 Д | 100 | 88.906 | Стабильный |
| 90 Д | Син | – | 2,7 д |
| 91 Д | Син | – | 58,5 д |
Металл медленно тускнеет на воздухе и легко сгорает, образует:
4 Y (т) + 3 O 2 (г) → 2 Y 2 O 3 (т) (оксид иттрия (lll))
При тонком измельчении или нагревании металлический иттрий растворяется в воде, с образованием ионов иттрия (III) и газообразного водорода:
2 Y (т) + 6 H 2 O (г) → 2 Y 3+ (водн.) + 6 OH – (водн.) + 3 H 2 (г)
Металл реагирует со всеми галогенами с образованием галогенидов иттрия (lll):
2 Y (т) + 3 F 2 (г) → 2 YF 3 (т) (иттрий (lll) фторид)
2 Y (т) + 3 Cl 2 (г) → 2 YCl 3 (т) (Иттрия (III) хлорид)
2 Y (т) + 3 Br 2 (г) → 2 YBr 3 (s) (Иттрия (lll) бромид)
2 Y (s) + 3 I 2 (g) → 2 YI 3 (s) (Иттрия (lll) йодид)
Легко растворяется в разбавленной соляной кислоте, образует водные ионы иттрия (III) и газообразный водород:
2 Y (т) + 6 HCl → 2 Y 3+ (водн. ) + 6 Cl – (водн.) + 3 H 2 ↑ (ж)
Наименование: В честь Иттерби (Швеция) и его минерала иттербита (гадолинита)
Открытие: Йохан Гадолин (1794)
Первое выделение: Генрих Роуз (1843)
Иттрий используется в качестве добавки (0.от 1 до 0,2%) для уменьшения размера зерна в хроме, цирконии, молибдене и титане и для увеличения прочности сплавов алюминия и магния .
Металл может быть использован в качестве раскислителя для ванадия и других цветных металлов .
Иттрий можно использовать в качестве катализатора для реакций полимеризации этилена.
Иттрий подходит для изготовления сверхпроводников .
A Оксид иттрия (иттрий) Является наиболее важным соединением иттрия и широко используется в производстве YVO 4 европий, и Y 2 O
9 европий 3 красный цвет в цветных телевизионных трубках.
Оксид иттрия добавляется в стекло, которое используется для изготовления объективов камер , чтобы сделать их термостойкими и ударопрочными .
Оксид иттрия также используется для производства железоиттриевых гранатов (Y 3 Fe 5 O 12 ) , которые являются очень эффективными микроволновыми фильтрами для радаров
YIG также исключительно эффективен как передатчик и преобразователь акустической энергии .
Иттрий-алюминиевый гранат (Y 3 Al 5 O 12 ) используется в лазерах , которые также могут резать металлы.
YAG с твердостью 8,5, также находит применение в качестве драгоценного камня (имитация алмаза).
Алюминий-иттрий, железный и гадолиний-гранаты обладают интересными магнитными свойствами .
90 Y — радиоактивный изотоп иттрия, используемый в области медицины (для лечения некоторых видов рака, таких как рак печени).
Изотоп- 90Y находится в равновесии со своим родителем 90 Sr (изотоп стронция), продуктом ядерных взрывов.
Биологическая роль: Его растворимые соли слаботоксичны.
Обилие иттрия Иттрий извлекается из «редкоземельных» минералов монацитового песка и бастназита, , который содержит около 3% и 0,2% соответственно.
Xenotime может содержать до 50% фосфата иттрия.
Металл производится в промышленных масштабах путем восстановления фторида металлическим кальцием.
Ежегодное мировое производство составляет около 8000 тонн.
7 × 10 -7 % (в Universe )
19 × 10 -5 % (в Метеориты )
9.9 × 10 -7 % (в солнце )
0,013% ( В Земная кора )
1,3×10 -9 % (В Океанах )
Минерал монацит
Три крупнейших в мире производителя иттрия 1) Китай
2) Россия
3) Малайзия
1) Китай
2) Страны СНГ (вкл.Россия)
3) США
# Иттрий
Карточки с дополнительными элементами
Иттрий — Key Stage Wiki
Содержание
- 1 Ключевой этап 2
- 1.1 Значение
- 2 Ключевой этап 3
- 2.1 Значение
- 2.
 2 Об иттрии
2 Об иттрии- 2.2.1 Молекулярная структура
- 2.2.2 Атомная структура
- 2.2.3 Свойства
- 3 Ключевой этап 4
- 3.1 Значение
- 3.2 Об иттрии
- 3.2.1 Молекулярная структура
- 3.2.2 Атомная структура
- 3.2.3 Свойства
Ключевой этап 2
Значение
Иттрий — это металл.
Ключевой этап 3
Значение
Химический символ иттрия.Иттрий — элемент переходного металла в Периодической таблице с атомным номером 39.
О иттрии
Молекулярная структура
- Иттрий имеет химический символ Y.
- Атомы иттрия в большом количестве соединяются вместе, образуя гигантскую молекулу металла.
Атомная структура
- Иттрий в виде 39 протонов и 50 нейтронов в ядре, что дает ему атомный номер 39 и атомную массу 89.
- Иттрий находится в периоде 5 Периодической таблицы, потому что у него 5 электронных оболочек.

Свойства
- Иттрий — это металлический элемент, поэтому он является хорошим проводником тепла и хорошим электрическим проводником.
- Иттрий представляет собой блестящее твердое вещество при комнатной температуре.
- Иттрий пластичен.
- Иттрий звонкий.
- Иттрий пластичен.
Ключевой этап 4
Химический символ иттрия.Значение
Иттрий — элемент переходного металла Периодической таблицы с 39 протонами в ядре.
О иттрии
Молекулярная структура
- Иттрий имеет химическую формулу Y.
- Атомы иттрия объединяются в гигантскую металлическую структуру.
Атомная структура
- Самый стабильный изотоп иттрия имеет 50 нейтронов в ядре, что дает ему атомную массу 89.
- Иттрий находится в периоде 5 Периодической таблицы, потому что у него 5 электронных оболочек.
- Иттрий теряет электроны с образованием положительных ионов металла.

Свойства
- Иттрий образует ионные связи с неметаллами.
- Иттрий — это металлический элемент, поэтому он является хорошим проводником тепла и хорошим электрическим проводником.
- Иттрий представляет собой блестящее твердое вещество при стандартной температуре и давлении и имеет высокую температуру плавления.
- Иттрий пластичен.
- Иттрий звонкий.
- Иттрий пластичен.
Иттрий
Химический элемент иттрий классифицируется как переходный металл и редкоземельный металл. Он был открыт в 1794 году Йоханом Гадолином.
Зона данных
| Классификация: | Иттрий представляет собой переходный металл и редкоземельный элемент | .
| Цвет: | серебристо-белый |
| Атомный вес: | 88.9059 |
| Состояние: | твердый |
| Температура плавления: | 1525 или С, 1798 К |
| Точка кипения: | 3340 или С, 3613 К |
| Электроны: | 39 |
| Протоны: | 39 |
| Нейтроны в наиболее распространенном изотопе: | 50 |
| Электронные оболочки: | 2,8,18,9,2 |
| Электронная конфигурация: | [Кр] 4d 1 5s 2 |
| Плотность @ 20 или C: | 4. |
Реакции, Соединения, Радиусы, Проводимости
| Атомный объем: | 19,8 см 3 /моль |
| Структура: | hcp: шестигранник, плотно упакованный |
| Удельная теплоемкость | 0,30 Дж г -1 К -1 |
| Теплота плавления | 11,40 кДж моль -1 |
| Теплота распыления | 423 кДж моль -1 |
| Теплота парообразования | 363.0 кДж моль -1 |
| 1 ст энергия ионизации | 615,6 кДж моль -1 |
| 2 nd энергия ионизации | 1181 кДж моль -1 |
| 3 rd энергия ионизации | 1979,9 кДж моль -1 |
| Сродство к электрону | 29,6 кДж моль -1 |
| Минимальная степень окисления | 0 |
Мин. общее окисление нет. общее окисление нет. | 0 |
| Максимальная степень окисления | 3 |
| Макс. общее окисление нет. | 3 |
| Электроотрицательность (шкала Полинга) | 1,22 |
| Объем поляризуемости | 22,7 Å 3 |
| Реакция с воздухом | энергичный, ⇒ Y 2 O 3 |
| Реакция с 15 M HNO 3 | энергичный, ⇒ Y(NO 3 ) 3 |
| Реакция с 6 М HCl | мягкий, ⇒ H 2 , YCl 3 |
| Реакция с 6 М раствором NaOH | нет |
| Оксид(ы) | Да 2 О 3 |
| Гидрид(ы) | ИХ 2 , ИХ 3 |
| Хлорид(ы) | YCl 3 |
| Атомный радиус | 180 часов |
| Ионный радиус (1+ ион) | – |
| Ионный радиус (2+ ион) | – |
| Ионный радиус (3+ ион) | 104 вечера |
| Ионный радиус (1-ион) | – |
| Ионный радиус (2-ионный) | – |
| Ионный радиус (3-ионный) | – |
| Теплопроводность | 17. 2 Вт м -1 К -1 2 Вт м -1 К -1 |
| Электропроводность | 1,8 x 10 6 м -1 |
| Температура замерзания/плавления: | 1525 или С, 1798 К |
Камера сгорания ракеты. Накладка серебристого цвета представляет собой сплав никеля, хрома, алюминия и иттрия. Фото: НАСА.
Иттрий используется во многих областях, таких как драгоценные камни из кубического циркония, компьютерные мониторы, объективы фотоаппаратов и энергосберегающее освещение.
Открытие иттрия
Доктор Дуг Стюарт
История открытия иттрия начинается в 1787 году, когда Карл Аррениус нашел углеподобный минерал в шахте полевого шпата/кварца недалеко от Иттербю, Швеция. Шахта была разработана в начале 18 века в связи с потребностями местной гончарной промышленности в минералах.
Аррениус назвал черный минерал иттербитом в честь Иттерби. Бенгт Гейер, инспектор шахт в Стокгольме, провел грубый анализ иттербита. Он сообщил, что минерал содержит железо, и предположил, что он также может содержать вольфрам. (1), (2)
Он сообщил, что минерал содержит железо, и предположил, что он также может содержать вольфрам. (1), (2)
Йохан Гадолин получил образец иттербита от Аррениуса и провел его подробный анализ в 1794 году в Финляндии. Он обнаружил, что он содержит 31% кремнезема, 19% глинозема, 12% оксида железа и 38% неизвестной земли. (3)
Результаты Гадолина были подтверждены в 1797 году шведским химиком Андерсом Экебергом. Экеберг предложил название иттрий для оксида нового земного металла, и поэтому новый металл был назван иттрием. (2)
К сожалению, Гадолин и Экеберг не осознали, что их анализ глинозема был неправильным. Вещество, которое они идентифицировали как глинозем, на самом деле было оксидом другого нового элемента, бериллия.
Бериллий был открыт годом позже, в 1798 году, французским химиком Николя Луи Вокленом. Затем Экеберг подтвердил, что оксид бериллия присутствует в иттербите, а глинозем отсутствует. (2)
Иттербит был переименован в гадолинит (минерал силиката иттрия, железа, бериллия) в 1800 году Мартином Клапротом в честь Джона Гадолина.
Гадолин подробно проверил свойства иттрия (оксида иттрия) и обнаружил, что он не плавится даже при самых высоких температурах паяльной трубки; он также образовывал прозрачное бесцветное стекло с бурой. (3) (Это должны были быть типичные свойства всех оксидов редкоземельных металлов.)
Иттрий был первым обнаруженным редкоземельным элементом. Теперь мы знаем, что иттрия Гадолина была нечистой; помимо оксида иттрия, он содержал восемь других оксидов редкоземельных металлов. Они были обнаружены отдельно в более поздние годы; этими металлами были: эрбий, тербий, иттербий, скандий, тулий, гольмий, диспрозий и лютеций.
Металлический иттрий был впервые получен в 1828 году в Берлине Фридрихом Вёлером в виде серого порошка при нагревании безводного хлорида иттрия (III) с калием. (4)
Металл высокой чистоты был получен в 1953 году Фрэнком Спеддингом в лаборатории Эймса, штат Айова, с использованием методов ионного обмена. (5)
Сверхчистый иттрий-90 используется для лечения рака. Иттрий-90 получают путем высокочистого отделения от стронция-90, продукта деления урана в ядерных реакторах.Фото: PNNL
Иттрий-90 получают путем высокочистого отделения от стронция-90, продукта деления урана в ядерных реакторах.Фото: PNNL
Углеродные нанотрубки производятся из паров углерода, содержащих небольшое количество никелевых и иттриевых катализаторов. Электрическая дуга испаряет анод, содержащий катализаторы. Фото: НАСА.
Внешний вид и характеристики
Вредное воздействие:
Водорастворимые соединения иттрия считаются малотоксичными, а его нерастворимые соединения считаются нетоксичными.
Характеристики:
Иттрий — мягкий серебристый металл.Иттрий обычно существует в виде трехвалентного иона Y 3+ в его соединениях. Большинство его соединений бесцветны.
Свойства иттрия очень похожи на свойства редкоземельных элементов ряда лантанидов. Соответственно, иттрий классифицируется как один из редкоземельных элементов.
Относительно стабилен на воздухе благодаря оксидной пленке, образующейся на его поверхности.
Мелкодисперсный металл воспламеняется на воздухе при нагревании.
Иттрий реагирует с водой с образованием гидроксида иттрия и газообразного водорода.
Интересно, что образцы горных пород и пыли, доставленные после высадки на Луну Аполлона, показывают высокое содержание иттрия. Содержание иттрия в образцах лунного грунта колебалось от 54 до 213 частей на миллион. Это сопоставимо со средним содержанием 33 частей на миллион в земной коре. (6)
Иттрий обладает исключительно высоким сродством к кислороду со свободной энергией образования оксида 1817 кДж моль -1 , вероятно, самой большой из всех элементов. Иттрий также растворяет газообразный кислород в относительно высоких концентрациях. (7), (8)
Применение иттрия
Иттрий часто используется в сплавах, повышающих прочность алюминиевых и магниевых сплавов.
Он также используется в качестве раскислителя для цветных металлов, таких как ванадий.
Иттрий используется в качестве катализатора в полимеризации этилена.
Иттрий-90, радиоактивный изотоп, используется при лечении различных видов рака и используется в прецизионных медицинских иглах для перерезания передающих боль нервов в спинном мозге.
Оксид иттрия является наиболее важным соединением иттрия. Он используется для изготовления высокотемпературного сверхпроводника YBCO (оксид иттрия-бария-меди). Это вещество становится сверхпроводящим при -178 o C (это означает, что его можно поддерживать в сверхпроводящем состоянии с помощью жидкого азота, а не более дорогого и сложного в обращении жидкого гелия).
Оксид иттриятакже используется для изготовления железоиттриевых гранатов (Y 3 Fe 5 O 12 ), которые являются очень эффективными микроволновыми фильтрами, блокируя одни микроволновые частоты, пропуская другие в устройствах связи, таких как спутники.
Иттрий, легированный европием, используется для производства люминофоров, обеспечивающих красный цвет в цветных телевизионных трубках.
Изобилие и изотопы
Содержание земной коры: 33 части на миллион по массе, 7,6 частей на миллион по молям
Изобилие солнечной системы: 10 частей на миллиард по весу, 0,1 частей на миллиард по молям
Стоимость в чистом виде: 430 долларов США за 100 г
Стоимость, оптом: $ за 100 г
Источник: иттрий встречается в урановых рудах и присутствует почти во всех «редкоземельных» минералах.Его извлекают в промышленных масштабах с помощью противоточных процессов жидкостной экстракции из монацитового песка и бастнезита. Металл можно выделить восстановлением фторида металлическим кальцием.
Изотопы: иттрий имеет 25 изотопов, период полураспада которых известен, с массовыми числами от 79 до 103. Встречающийся в природе иттрий состоит из одного стабильного изотопа, 89 Y.
Ссылки
- Пер Энгхаг, Энциклопедия элементов: технические данные, история, обработка, применение., Джон Уайли и сыновья, 2004 г.
 , стр. 433 434.
, стр. 433 434. - Джеймс Л. Маршалл и Вирджиния Р. Маршалл, Иттриум и Йохан Гадолин скачать в формате pdf.
- Пол Каро, Редкие земли., Editorial Complutense., 1998, стр. 28-29
- Мэри Эльвира Уикс, Открытие элементов., Kessinger Publishing, 2003, стр. 169.
- Джон Д. Корбетт, Фрэнк Гарольд Спеддинг Биографические мемуары. , National Academy Press 2001, стр. 22.
- Аполлон-15-Предварительный научный отчет, стр. 199.
- Лантаниды Лантанология Часть II., Molycorp, Inc. Mountain Pass, Калифорния, США, стр. 54. скачать пдф.
- Т.Х. Окабе и др., Электрохимическое раскисление иттрий-кислородных твердых растворов, Journal of Alloys and Compounds, 1996, 237, p150-154. скачать пдф.
Цитировать эту страницу
Для онлайн-ссылки скопируйте и вставьте одно из следующего:
иттрий
или

 элементов, кислоты и соли, органические и неорганические соединения
элементов, кислоты и соли, органические и неорганические соединения Отсюда второе название пегматита –
письменный гранит. В этой жиле было найдено большое количество элементов,
что принесло ей всемирную известность. По имени города ее стали называть “жилой Иттерби”. Найденные в ней новые элементы получали
“имена”, производные от слова Иттерби. Иттрий, тербий, эрбий, иттербий
– вот перечень элементов, которые найдены в Иттербийской жиле и
увековечили городок Иттерби.
Отсюда второе название пегматита –
письменный гранит. В этой жиле было найдено большое количество элементов,
что принесло ей всемирную известность. По имени города ее стали называть “жилой Иттерби”. Найденные в ней новые элементы получали
“имена”, производные от слова Иттерби. Иттрий, тербий, эрбий, иттербий
– вот перечень элементов, которые найдены в Иттербийской жиле и
увековечили городок Иттерби. Хорошо известно, что иттрий встречается
лишь в отдельных местах на земном шаре и не склонен к миграции.
Иттрий и его производные еще не находят практического применения.
Велик вред от его радиоактивного изотопа (иттрий-90).
Образуясь при взрывах атомных бомб – стронций-90, иттрий-90 поглощается
икрой рыб и, повреждая ее резко сокращает воспроизводство рыбы в
мировом океане.
Хорошо известно, что иттрий встречается
лишь в отдельных местах на земном шаре и не склонен к миграции.
Иттрий и его производные еще не находят практического применения.
Велик вред от его радиоактивного изотопа (иттрий-90).
Образуясь при взрывах атомных бомб – стронций-90, иттрий-90 поглощается
икрой рыб и, повреждая ее резко сокращает воспроизводство рыбы в
мировом океане.