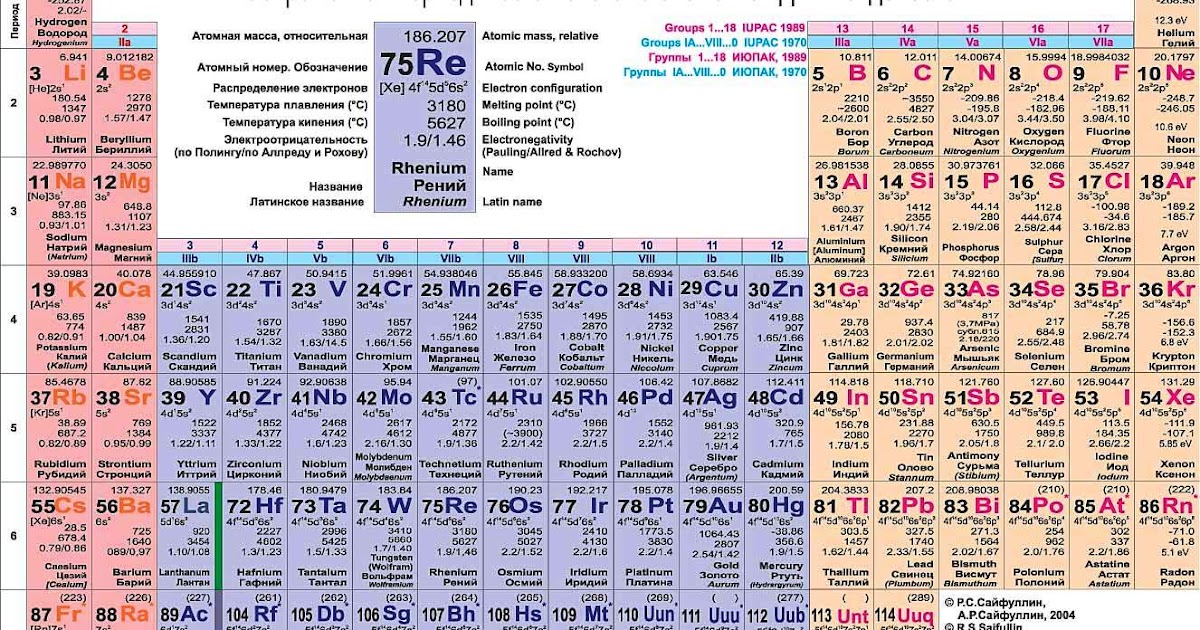
Лантан
| Лантан | |
|---|---|
| Атомный номер | 57 |
| Внешний вид простого вещества |
мягкий, ковкий, вязкий металл серебристо-белого цвета |
| Свойства атома | |
|
Атомная масса (молярная масса) |
138,9055 а.е.м. (г/моль) |
| Радиус атома | 187 пм |
|
Энергия ионизации (первый электрон) |
541,1(5,61) кДж/моль (эВ) |
| Электронная конфигурация | [Xe] 5d1 6s2 |
| Химические свойства | |
| Ковалентный радиус | 169 пм |
| Радиус иона |
101. (+3e) 6пм (+3e) 6пм |
|
Электроотрицательность (по Полингу) |
1,10 |
| Электродный потенциал | La←La3+ -2.38В |
| Степени окисления | 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 6,162 г/см³ |
| Молярная теплоёмкость | 27,11Дж/(K·моль) |
| Теплопроводность | 13,4 Вт/(м·K) |
| Температура плавления | 1194 K |
| Теплота плавления | 8,5 кДж/моль |
| Температура кипения | 3730 K |
| Теплота испарения | 402 кДж/моль |
| Молярный объём | 22,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | 3,750 Å |
| Отношение c/a | 1,619 |
| Температура Дебая | 132,00 K |
| La | 57 |
|
|
|
| [Xe]5d16s2 | |
| Лантан | |
Лантан — элемент побочной подгруппы третьей группы шестого периода периодической системы химических элементов, атомный номер 57. Обозначается символом La (лат.Lanthanum). Простое вещество лантан (CAS-номер: 7439-91-0) — металл серебристо-белого цвета. Существует в трёх кристаллических модификациях: α-La с гексагональной решёткой, β-La с кубической решёткой типа меди, γ-La с кубической объёмноцентрированной решёткой типа α-Fe, температуры переходов α↔β277°C и β↔γ861°C
Обозначается символом La (лат.Lanthanum). Простое вещество лантан (CAS-номер: 7439-91-0) — металл серебристо-белого цвета. Существует в трёх кристаллических модификациях: α-La с гексагональной решёткой, β-La с кубической решёткой типа меди, γ-La с кубической объёмноцентрированной решёткой типа α-Fe, температуры переходов α↔β277°C и β↔γ861°C
История
Лантан, как химический элемент, не удавалось открыть на протяжении 36 лет. В 1803 г. 24-летний шведский химик Йёнс Якоб Берцелиус исследовал минерал, известный теперь под названием церита. В этом минерале была обнаружена иттриевая земля и еще одна редкая земля, очень похожая на иттриевую. Ее назвали цериевой. В 1826 г. Карл Мозандер исследовал цериевую землю и заключил, что она неоднородна, что в ней, помимо церия, содержится еще один новый элемент. Доказать сложность цериевой земли Мозандеру удалось лишь в 1839 г. Он сумел выделить новый элемент, когда в его распоряжении оказалось большее количество церита.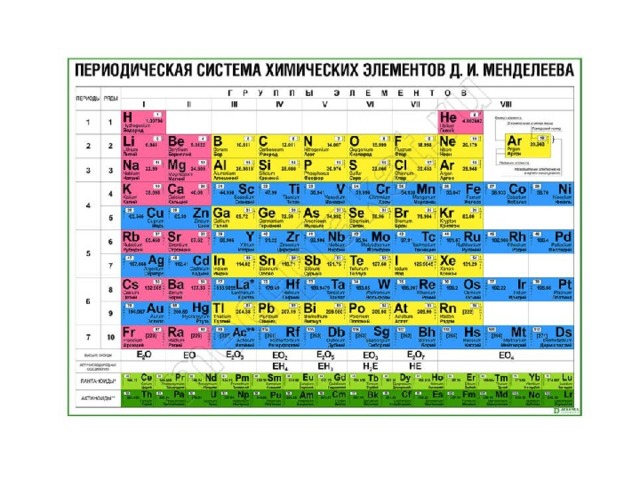
Происхождение названия
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Оно было дано в честь истории его открытия и происходит от греческого lanthanein— «скрываться», «таиться».
Получение
Получение лантана связано с разделением исходного сырья на фракции. Лантан концентрируется вместе с церием, празеодимом и неодимом. Сначала из смеси отделяют церий, затем оставшиеся элементы разделяют экстракцией.
Цены
Цены на металлический лантан чистотой 99-99,9 составляют около 2— 4долл за 1г.
Применение
Производство стекла
Оксид лантана (от 5до 40%) применяется для варки оптического стекла (лантановое стекло), для изготовления линз и призм используемых в кино и фотоаппаратуре, а также для астрономических целей.
Производство керамических электронагревателей
Хромит лантана, легированный кальцием, стронцием, магнием, используется для производства высокотемпературных печных нагревателей (температура плавления ― 2453 °C, раб. темп. — около 1780 градусов в атмосфере кислорода). С ростом температуры электрическое сопротивление хромита лантана резко уменьшается. Коэффициент термического расширения хромита лантана очень низкий и это предопределяет долговечность электронагревателей.
темп. — около 1780 градусов в атмосфере кислорода). С ростом температуры электрическое сопротивление хромита лантана резко уменьшается. Коэффициент термического расширения хромита лантана очень низкий и это предопределяет долговечность электронагревателей.
Высокотемпературная сверхпроводимость
Оксид лантана применяется для синтеза высокотемпературных сверхпроводников на основе оксидов лантана, иттрия, бария, стронция, меди и др.
Металлотермия
Изредка лантан применяют в металлотермии для восстановления редких элементов.
Специальные покрытия стекла
На основе соединений лантана производятся покрытия для оконного стекла позволяющие понижать температуру в помещении на 5-7 градусов.
Термоэлектрические материалы
Монотеллурид лантана имеет очень высокую термо-э.д.с (834 мкВ/К) и применяется в термоэлектрогенераторах с высоким кпд.
Производство металлогидридных накопителей водорода
Лантан-никелевый гидрид широко употребляется как емкий аккумулятор водорода (металлогидридное хранение водорода) для автомобилей.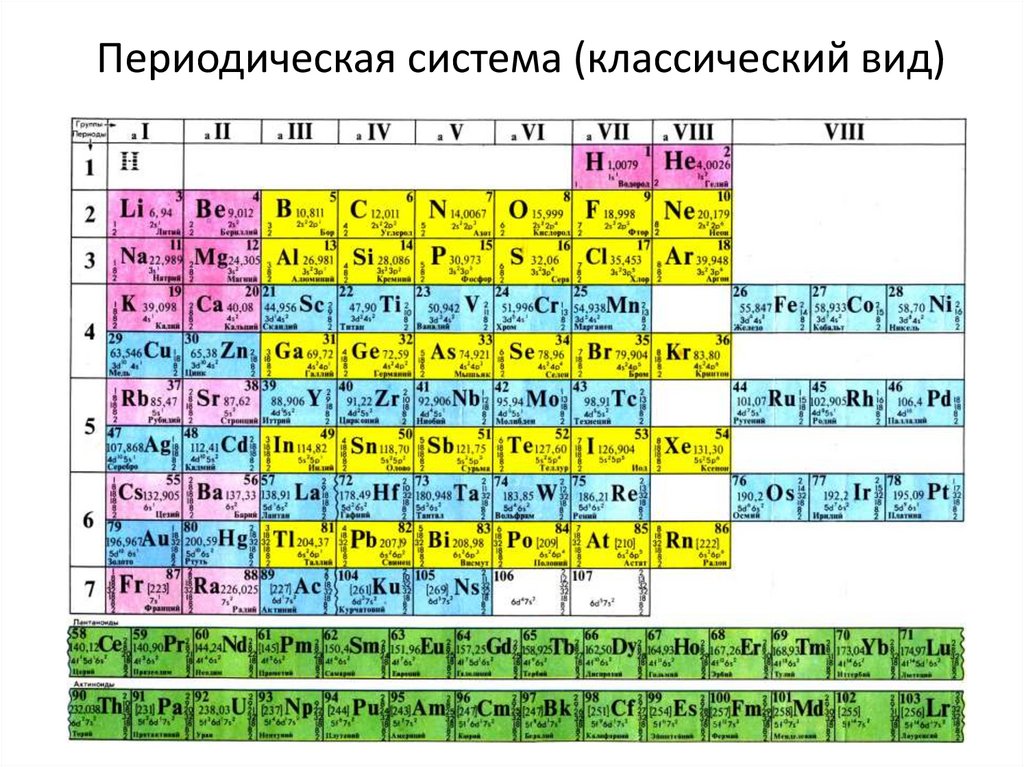
Ядерная энергетика
Совершенно исключительное значение металлический лантан высокой чистоты имеет в атомной промышленности, и конкретно в технологии переработки ядерного топлива с целью извлечения плутония. В расплавленный металлический уран имеющий в качестве примеси металлический плутоний, вмешивают расплавленный лантан. Расплавленный лантан полностью извлекает изотопы плутония из основной массы урана в сплав и всплывает над ураном не смешиваясь с ним. Полученный сплав сливают и перерабатывают методами химической технологии. Можно утверждать, что лантан держит на своих «плечах» производство ядерного оружия.
Электроника
В последние годы в значительной степени возрос интерес к молибдату лантана, обладающему высокой проводимостью.
Электронная микроскопия
Применение катодов из LaB6 (Гексаборид лантана) в электронных микроскопах позволило повысить плотность тока в 6раз и увеличить ресурс катода в 5раз (до 500 часов) по сравнению с вольфрамовыми катодами.
Химические источники тока
Весьма значительный интерес промышленности и электроники вызывают производство и исследования в области аккумуляторов с твёрдым электролитом. В этой области очень большое значение приобрёл фторид лантана в качестве электролита и с металлическим лантаном в качестве анода, катодом обычно является фторид висмута, свинца или меди. Привлекательная сторона таких источников тока— это очень высокая удельная энергоёмкость по объёму (3000 Вт·ч/дм³, практически достигнутая— 1500—2300 Вт·ч/дм³), длительный срок сохранности энергии, прочность, долговечность; в этой связи многие ведущие специалисты видят в них альтернативу любым другим видам аккумуляторов.
Биологическая роль
В середине 30-х годов советский ученый А. А. Дробков исследовал влияние редких земель на разные растения. Он экспериментировал с горохом, репой и другими культурами, вводил редкие земли вместе с бором, марганцем или без них. Результаты опытов говорили, что редкие земли нужны для нормального развития растений… Но прошла четверть века, прежде чем эти элементы стали относительно доступны.
Лантан, свойства атома, химические и физические свойства
Лантан, свойства атома, химические и физические свойства.
Поделиться в:
La 57 Лантан
138,90547(7) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 5d1 6s2
Лантан — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 57. Расположен в 3-й группе (по старой классификации — побочной подгруппе третьей группы), шестом периоде периодической системы.
Атом и молекула лантана. Формула лантана. Строение атома лантана
Изотопы и модификации лантана
Свойства лантана (таблица): температура, плотность, давление и пр.
Физические свойства лантана
Химические свойства лантана. Взаимодействие лантана. Химические реакции с лантаном
Взаимодействие лантана. Химические реакции с лантаном
Получение лантана
Применение лантана
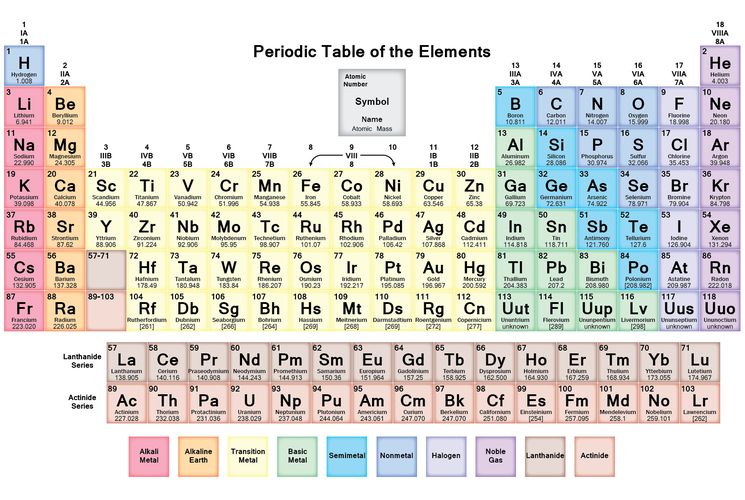
Таблица химических элементов Д.И. Менделеева
Атом и молекула лантана. Формула лантана. Строение атома лантана:
Лантан (лат. Lanthanum, от др.-греч. λανθάνω – «скрываюсь», «таюсь») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением La и атомным номером 57. Расположен в 3-й группе (по старой классификации – побочной подгруппе третьей группы), шестом периоде периодической системы.
Лантан – металл. Относится к лантаноидам, а также к группе переходных, редкоземельных, цветных металлов.
Лантан обозначается символом La.
Как простое вещество лантан при нормальных условиях представляет собой мягкий, ковкий, вязкий, блестящий металл серебристо-белого цвета.
Молекула лантана одноатомна.
Химическая формула лантана La.
Электронная конфигурация атома лантана 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 5d1 6s2 или 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f0 5s2 5p6 5d1 6s2. Потенциал ионизации (первый электрон) атома лантана равен 538,09 кДж/моль (5,5769(6) эВ).
Строение атома лантана. Атом лантана состоит из положительно заряженного ядра (+57), вокруг которого по шести оболочкам движутся 57 электронов. При этом 55 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку лантан расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья, четвертая и пятая – внутренние оболочки представлены s-, р- и d-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома лантана на 5d-орбитали находится один неспаренный электрон. На внешнем энергетическом уровне атома лантана на 6s-орбитали находятся два спаренных электрона. В свою очередь ядро атома лантана состоит из 57 протонов и 82 нейтронов. Лантан относится к элементам f-семейства.
При этом 55 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку лантан расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья, четвертая и пятая – внутренние оболочки представлены s-, р- и d-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома лантана на 5d-орбитали находится один неспаренный электрон. На внешнем энергетическом уровне атома лантана на 6s-орбитали находятся два спаренных электрона. В свою очередь ядро атома лантана состоит из 57 протонов и 82 нейтронов. Лантан относится к элементам f-семейства.
Радиус атома лантана (вычисленный) составляет: нет данных. Эмпирический радиус атома лантана составляет 195 пм.
Атомная масса атома лантана составляет 138,90547(7) а. е. м.
Лантан вместе с церием и неодимом относится к наиболее распространенным редкоземельным элементам. Содержание лантана в земной коре составляет 0,0034 %, в морской воде и океане – 3,4×10–10 %.
Содержание лантана в земной коре составляет 0,0034 %, в морской воде и океане – 3,4×10–10 %.
Лантан, свойства атома, химические и физические свойства
Изотопы и модификации лантана:
Свойства лантана (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Лантан |
| 102 | Прежнее название | |
| 103 | Латинское название | Lanthanum |
| 104 | Английское название | Lanthanum |
| 105 | Символ | La |
| 106 | Атомный номер (номер в таблице) | 57 |
| 107 | Тип | Металл |
| 108 | Группа | Лантаноид. Переходный, редкоземельный, цветной металл Переходный, редкоземельный, цветной металл |
| 109 | Открыт | Карл Густав Мосандер, Швеция, 1839 г. |
| 110 | Год открытия | 1839 г. |
| 111 | Внешний вид и пр. | Мягкий, ковкий, вязкий, блестящий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 3 аллотропные модификации: – α-лантан с двойной гексагональной плотноупакованной кристаллической решёткой, – β-лантан с кубической гранецентрированной кристаллической решёткой, – γ-лантан с кубической объёмно-центрированной кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга* | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0034 % |
| 120 | Содержание в морях и океанах (по массе) | 3,4·10-10 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 2,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 2,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000028 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 138,90547(7) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 5d1 6s2 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O9 P2 Q0 R0
|
| 204 | Радиус атома (вычисленный) | |
| 205 | Эмпирический радиус атома* | 195 пм |
| 206 | Ковалентный радиус* | 207 пм |
| 207 | Радиус иона (кристаллический) | La3+ 117,2 (6) пм, 141 (10) пм, 150 (12) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 57 электронов, 57 протонов, 82 нейтрона |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 3-я группа (по старой классификации – побочная подгруппа 3-ей группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +1, +2, +3 |
| 302 | Валентность | III |
| 303 | Электроотрицательность | 1,10 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 538,09 кДж/моль (5,5769(6) эВ) |
| 305 | Электродный потенциал | La3+ + 3e– → La, Eo = -2,522 В |
| 306 | Энергия сродства атома к электрону | 53,795(2) кДж/моль (0,557546(20) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 6,162 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) – α-лантан, 5,94 г/см3 (при температуре плавления 920 °C и иных стандартных условиях, состояние вещества – жидкость) – α-лантан |
| 402 | Температура плавления | 920 °C (1193 K, 1688 °F) |
| 403 | Температура кипения* | 3464 °C (3737 K, 6267 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 6,20 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 400 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 27,11 Дж/(K·моль) |
| 411 | Молярный объём | 22,6 см³/моль |
| 412 | Теплопроводность | 13,4 Вт/(м·К) (при стандартных условиях), 13,4 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решетка | |
| 511 | Кристаллическая решётка #1 | α-лантан |
| 512 | Структура решётки | Двойная гексагональная плотноупакованная
|
| 513 | Параметры решётки | a = 3,772 Å, c = 12,14 Å |
| 514 | Отношение c/a | 3,22 |
| 515 | Температура Дебая | 132 К |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 521 | Кристаллическая решётка #2 | β-лантан |
| 522 | Структура решётки | Кубическая гранецентрированная
|
| 523 | Параметры решётки | a = 5,296 Å |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | Fm_ 3m |
| 527 | Номер пространственной группы симметрии | 225 |
| 531 | Кристаллическая решётка #3 | γ-лантан |
| 532 | Структура решётки | Кубическая объёмно-центрированная
|
| 533 | Параметры решётки | a = 4,26 Å |
| 534 | Отношение c/a | |
| 535 | Температура Дебая | |
| 536 | Название пространственной группы симметрии | Im_ 3m |
| 537 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-91-0 |
Примечание:
205* Эмпирический радиус атома лантана согласно [1] и [3] составляет 187 пм.
206* Ковалентный радиус лантана согласно [1] и [3] составляет 207±8 пм и 169 пм соответственно.
401* Плотность лантана согласно [3] и [4] составляет 6,162-6,18 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 6,16 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
403* Температура кипения лантана согласно [3] и [4] составляет 3173,85 – 3195,85 °C (3447 – 3469 K, 5744,93 – 5784,53 °F) и 3950 °C (4223,15 K, 7142 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) лантана согласно [3] и [4] составляет 8,5 кДж/моль и 6,7 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) лантана согласно [3] и [4] составляет 402 кДж/моль и 413 кДж/моль соответственно.
Физические свойства лантана:
Химические свойства лантана. Взаимодействие лантана.
 Химические реакции с лантаном:
Химические реакции с лантаном:
Получение лантана:
Применение лантана:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29.
 Медь
Медь - 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63.
 Европий
Европий - 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96.
 Кюрий
Кюрий - 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Lanthanum
- https://de.wikipedia.org/wiki/Lanthan
- https://ru.wikipedia.org/wiki/Лантан
- http://chemister.ru/Database/properties.
 php?dbid=1&id=267
php?dbid=1&id=267 - https://chemicalstudy.ru/lantan-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
лантан атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле лантана
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 1 680
Периодическая таблица элементов: Лос-Аламосская национальная лаборатория
Вернуться к списку элементов
| Лантан | используется в объективах фотоаппаратов. |
| Атомный номер: | 57 | Атомный радиус: | 240 часов (Ван-дер-Ваальс) |
| Атомный символ: | Ла | Температура плавления: | 920 °С |
| Атомный вес: | 138,9 | Точка кипения: | 3464 °С |
| Электронная конфигурация: | [Xe]6s 2 5d 1 | Степени окисления: | 3 , 2, 1 (сильноосновной оксид) |
История
От греческого слова лантанеин , чтобы не быть замеченным. Мосандер в 1839 году выделил лантану из нечистого нитрата церия и открыл новый элемент.
Лантан был выделен в относительно чистом виде в 1923 году. Методы обмена железа и экстракции растворителем значительно упростили выделение так называемых «редкоземельных» элементов.
Источники
Лантан содержится в редкоземельных минералах, таких как церит, монацит, алланит и бастназит. Монацит и бастназит являются основными рудами, в которых лантан встречается в процентах до 25 и 38 процентов соответственно. Металл миш, используемый для изготовления кремней для зажигалок, содержит около 25 процентов лантана.
В последние годы доступность лантана и других редкоземельных элементов значительно увеличилась. Металл можно получить восстановлением безводного фторида кальцием.
Свойства
Лантан имеет серебристо-белый цвет, ковкий, пластичный и достаточно мягкий, чтобы его можно было разрезать ножом. Это один из самых реакционноспособных редкоземельных металлов. Быстро окисляется на воздухе. Холодная вода воздействует на лантан медленно, в то время как горячая вода воздействует на него гораздо быстрее.
Металл непосредственно реагирует с элементарным углеродом, азотом, бором, селеном, кремнием, фосфором, серой и с галогенами.
При 310°С лантан изменяет гексагональную структуру на гранецентрированную кубическую, а при 865°С вновь переходит в объемно-центрированную кубическую структуру.
Изотопы
Природный лантан представляет собой смесь двух стабильных изотопов, 138 La и 139 La. Известны двадцать три других радиоактивных изотопа.
Применение
Редкоземельные соединения, содержащие лантан, широко используются в угольном освещении, особенно в киноиндустрии для студийного освещения и проекции. Это приложение потребляет около 25 процентов производимых соединений редкоземельных элементов. Ла 2 O 3 повышает щелочестойкость стекла и используется при изготовлении специальных оптических стекол. Небольшие количества лантана в качестве добавки можно использовать для получения чугуна с шаровидным графитом.
В настоящее время существует интерес к сплавам водородной губки, содержащим лантан. Эти сплавы поглощают до 400 раз больше собственного объема газообразного водорода, и этот процесс является обратимым. Каждый раз, когда они поглощают газ, выделяется тепловая энергия; поэтому у этих сплавов есть возможности в системе энергосбережения.
Обращение
Лантан и его соединения имеют рейтинг острой токсичности от низкого до умеренного; поэтому следует соблюдать осторожность при обращении с ними.
Факты об элементе лантана / Химия
Зона данных | Открытие | Факты | Внешний вид и характеристики | Использование | Изобилие и изотопы | Ссылки
57
La
138,9
Химический элемент лантан классифицируется как лантанид и редкоземельный металл. Он был обнаружен в 1839 г.Карл Г. Мосандер.
Зона данных
| Классификация: | Лантан — лантанид и редкоземельный металл | .
| Цвет: | серебристо-белый |
| Атомный вес: | 138. 9055 9055 |
| Состояние: | твердый |
| Температура плавления: | 1540 или С, 1813.2 К |
| Точка кипения: | 2830 или С, 3103 К |
| Электроны: | 57 |
| Протоны: | 57 |
| Нейтроны в наиболее распространенном изотопе: | 82 |
| Электронные оболочки: | 2,8,18,18,9,2 |
| Электронная конфигурация: | [Хе] 5d 1 6s 2 |
| Плотность @ 20 o C: | 6,16 г/см 3 |
Реакции, Соединения, Радиусы, Проводимости”>Показать больше, в том числе: Теплота, Энергия, Окисление,
Реакции, Соединения, Радиусы, Проводимости
| Атомный объем: | 22,5 см 3 /моль |
| Структура: | hcp: шестигранник, плотно упакованный |
| Твердость: | 2,5 месяца |
| Удельная теплоемкость | 0,19 Дж г -1 К -1 |
| Теплота плавления | 6,20 кДж моль -1 |
| Теплота распыления | 414 кДж моль -1 |
| Теплота парообразования | 400 кДж моль -1 |
| 1 ст энергия ионизации | 538,1 кДж моль -1 |
| 2 nd энергия ионизации | 1067 кДж моль -1 |
| 3 rd энергия ионизации | 1850 кДж моль -1 |
| Сродство к электрону | 50 кДж моль -1 |
| Минимальная степень окисления | 0 |
Мин. общее окисление нет. общее окисление нет. | 0 |
| Максимальная степень окисления | 3 |
| Макс. общее окисление нет. | 3 |
| Электроотрицательность (шкала Полинга) | 1.1 |
| Объем поляризуемости | 31,1 Å 3 |
| Реакция с воздухом | энергичный, в/в ⇒ La 2 O 3 |
| Реакция с 15 M HNO 3 | мягкий, ⇒ La(NO 3 ) 3 |
| Реакция с 6 М HCl | мягкий, ⇒ H 2 , LaCl 3 |
| Реакция с 6 М NaOH | нет |
| Оксид(ы) | Ла 2 О 3 |
| Гидрид(ы) | ЛаХ 2 , ЛаХ 3 |
| Хлорид(ы) | LaCl 3 |
| Атомный радиус | 195 вечера |
| Ионный радиус (1+ ион) | – |
| Ионный радиус (2+ ион) | – |
| Ионный радиус (3+ ион) | 117,2 вечера |
| Ионный радиус (1-ион) | – |
| Ионный радиус (2-ионный) | – |
| Ионный радиус (3-ионный) | – |
| Теплопроводность | 13,4 Вт·м -1 К -1 |
| Электропроводность | 1,9 x 10 6 S m -1 |
| Температура замерзания/плавления: | 1540 или С, 1813. 2 К 2 К |
Лантан используется во многих областях, таких как студийное освещение, аккумуляторы для ноутбуков, объективы фотоаппаратов и гибридные автомобильные аккумуляторы.
Граница зерен нитрида кремния, легированная атомами лантана. Изображение № (6)
Открытие лантана
Доктор Дуг Стюарт
Лантан был открыт в 1839 году Карлом Г. Мосандером в минерале церите в Стокгольме, Швеция.
Церий (оксид церия) уже был обнаружен в 1803 году шведским химиком Якобом Берцелиусом в минерале церите. Мосандер, который был одним из учеников Берцелиуса, подозревал, что оксид церия представляет собой нечистый оксид, содержащий другие редкоземельные элементы. (1)
Мосандер взял мелко измельченный нитрат церия и добавил холодную разбавленную азотную кислоту. Часть порошка нитрата церия, растворенного в кислоте, указывает на возможное присутствие новой земли. Новый оксид был более основным, чем церий (окись церия) и, в отличие от церия, растворялся в кислоте.
Мосандер отделил раствор от осадка с помощью оксалата натрия и нагревания. Он получил бледно-кирпичный оксид нового редкоземельного элемента. (1)
Название лантана для нового оксида предложил его друг Берцелиус.
Название происходит от греческого слова «lanthano», означающего «скрывать».
Аксель Эрдманн независимо открыл лантан в том же году, что и Мосандер, в недавно найденном норвежском минерале. Эрдманн назвал новый минерал мосандритом в честь Мосандера. (2)
Мосандер получил металлический лантан с примесями из хлорида. (1)
Чистый металлический лантан был впервые получен в 1923 г. путем электролиза расплавленных галогенидов Х. Кремерсом и Р. Стивенсом.
Мосандер продолжил изучение лантана и в 1841 году объявил об открытии еще одного редкоземельного элемента, содержащегося в нем. Он назвал его «дидимий», потому что он казался «неразлучным братом-близнецом лантана». Позднее в отдельных открытиях было показано, что «дидим» представляет собой смесь неизвестных редкоземельных элементов.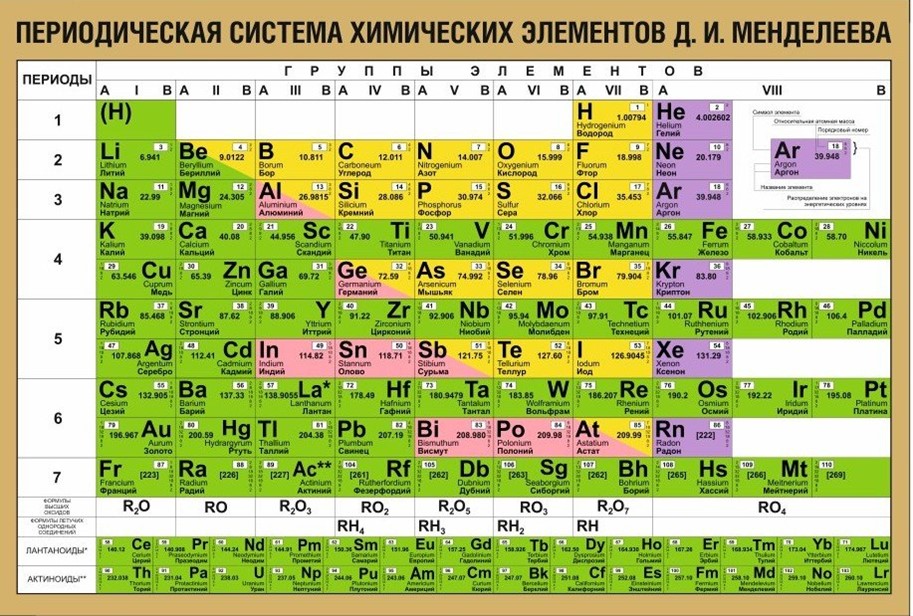 В 1879 г.Лекок де Буабодран обнаружил самарий в дидиме и отделил от него самарий. Карл Ауэр фон Вельсбах в 1885 году обнаружил, что оставшийся «дидим» на самом деле представляет собой смесь двух совершенно новых элементов: неодима и празеодима.
В 1879 г.Лекок де Буабодран обнаружил самарий в дидиме и отделил от него самарий. Карл Ауэр фон Вельсбах в 1885 году обнаружил, что оставшийся «дидим» на самом деле представляет собой смесь двух совершенно новых элементов: неодима и празеодима.
Лантан используется в некоторых продуктах для бассейнов для снижения уровня фосфатных питательных веществ, которыми питаются водоросли.
Краткое введение в лантаноиды.
Декантация лантана в лаборатории Эймса дает один из самых чистых лантанов в мире.
По часовой стрелке от верхнего центра: редкоземельные оксиды празеодима, церия, лантана, неодима, самария и гадолиния. Фото: LLNL
Внешний вид и характеристики
Вредное воздействие:
Лантан и его соединения считаются умеренно токсичными.
Характеристики:
Лантан — серебристо-белый мягкий металл, который можно резать ножом.
Это пластичный, ковкий материал, открытые поверхности которого быстро тускнеют на воздухе с образованием оксида.
Лантан реагирует с водой с образованием гидроксида лантана и газообразного водорода.
Лантан химически активен и образует соединения с углеродом, азотом, бором, селеном, кремнием, фосфором, серой и с галогенами.
Лантан обычно существует в виде трехвалентного иона La 3+ в его соединениях.
Использование лантана
Лантан используется в больших количествах в никель-металлогидридных (NiMH) аккумуляторных батареях для гибридных автомобилей. Отрицательный электрод (катод) в батареях NiMH представляет собой смесь гидридов металлов, одним из которых обычно является гидрид лантана. Активным материалом на катоде является водород, который хранится в структуре гидрида металла. Гидрид металла может, в зависимости от его состава, содержать от 1% до 7% водорода по весу. (3) Для аккумулятора Toyota Prius требуется около 10 кг лантана. (4)
(3) Для аккумулятора Toyota Prius требуется около 10 кг лантана. (4)
Лантан используется в качестве катализатора крекинга нефти, катализирующего расщепление углеводородов с длинной цепью на более короткие соединения.
Лантан используется в качестве добавки для производства чугуна с шаровидным графитом и в качестве добавки в стали.
В кремнях для зажигалок используется миш-металл (редкоземельный сплав), содержащий лантан, для получения искр при трении.
Лантан используется в сплавах водородной губки, которые поглощают до 400 раз больше собственного объема газообразного водорода.
Лантан также используется для изготовления очков ночного видения (стекло, поглощающее инфракрасное излучение).
Высококачественные линзы для камер и телескопов содержат оксид лантана (La 2 O 3 ), благодаря его высокому показателю преломления и низкой дисперсии.
Карбонат лантана используется для снижения уровня фосфатов в крови у пациентов с заболеваниями почек. (5)
(5)
Соединения лантана также используются в некоторых продуктах для бассейнов для снижения уровня фосфатных питательных веществ, которыми питаются водоросли.
Изобилие и изотопы
Изобилие в земной коре: 34 части на миллион по весу, 5 частей на миллион по молям
Изобилие в Солнечной системе: 2 части на миллиард по весу, 0,01 части на миллиард по молям
Стоимость, чистая: 800 долларов за 100 г
Стоимость, объем: $ за 100 г
Источник: Лантан не встречается в природе в свободном виде. Он содержится в основном в минералах монаците и бастнезите. В промышленных масштабах его извлекают из монацитового песка и бастнезита с использованием различных сложных методов экстракции. Чистый лантан получают восстановлением фторида металлическим кальцием.
Изотопы: Лантан имеет 31 изотоп с известным периодом полураспада с массовыми числами от 119 до 150. Из них один стабилен, 139 La. Встречающийся в природе лантан представляет собой смесь двух изотопов 138 La и .