Остров стабильности подарил новый элемент таблицы Менделеева
Открыт новый сверхтяжелый элемент, который заполнил пустовавшее место в таблице Менделеева между 116 и 118 элементами
Группа российских и американских ученых открыла новый сверхтяжелый элемент, который заполнил пустовавшее место в таблице Менделеева между 116 и 118 элементами.
По информации The Daily Mail, масса 117 элемента примерно на 40% тяжелее массы свинца. Ему дано временное название унунсептиум (Ununseptium), согласно присвоенному порядковому номеру. Официальное название может быть присвоено только после окончательного открытия – то есть только после того, как он будет синтезирован в других лабораториях, а это может занять достаточно продолжительное время.
Группа специалистов из Объединенного института ядерных исследований в Дубне и Национальной лаборатории Окриджа в США получила шесть атомов нового элемента путем обстрела атомов берклия-249 (97 элемента таблицы) ионами кальция-48. Как и все сверхтяжелые элемента, атомы элемента 117 не существуют в природе.
Для проведения этой реакции использовался ускоритель У-400, строительство которого началось еще в 1974 году, а 22 миллиграмма берклия было получено в Национальной лаборатории Окриджа.
Реакция представляет собой следующую цепь событий в ядре. Менее чем за миллисекунду после своего создания ядро элемента 118 распадается, испуская альфа-частицы, и превращается в изотоп элемента 117 с массовым числом 289, содержащий 117 протонов и 173 нейтронов. Этот элемент также распадается до изотопа элемента 114. Цепь последовательных распадов с испусканием альфа-частиц продолжается, по крайней мере, до элемента 106.
Тем не менее, исследователи заявили, что последовательность событий распада подтверждает теорию, что среди еще не открытых сверхтяжелых элементов может существовать так называемый “остров стабильности”.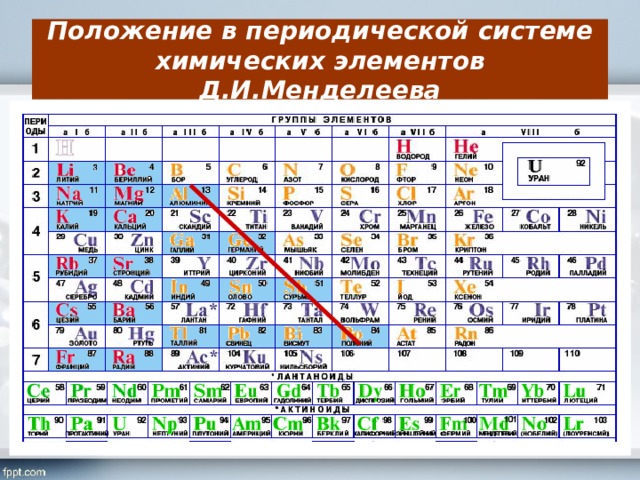
“Мы перепрыгнули через море нестабильности на островок стабильности, что теоретически было предсказано еще в 1970 году”, – отметил автор сообщения об открытии элемента в журнале Physical Review Letters, физик-ядерщик Виктор Нинов.
“Эти новые супертяжелые стабильные элементы однажды может быть использованы для создания массы странных новых материалов, которые будут использоваться в невообразимых сейчас научных и практических целях”, – заключает The New York Times.
Как сообщали ЮГА.ру, летом 2009 года очередной новый элемент таблицы Менделеева получил имя в честь известного ученого Николая Коперника. Единственный атом сверхтяжелого элемента-112 был получен группой немецких физиков под руководством профессора Зигурда Хоффмана более 10 лет назад, однако официальное признание это открытие получило лишь недавно.
Открытия ученых
Гелий – характеристики, история открытия
Запрос на оборудование
Гелий — второй порядковый элемент периодической системы химических элементов Д. И. Менделеева
, с атомным номером 2. Расположен в главной подгруппе восьмой группы, первом периоде периодической
системы. Возглавляет группу инертных газов в периодической таблице. Обозначается символом He (лат.
Helium). Простое вещество гелий (CAS-номер: 7440-59-7) — инертный одноатомный
газ без цвета, вкуса и запаха.
И. Менделеева
, с атомным номером 2. Расположен в главной подгруппе восьмой группы, первом периоде периодической
системы. Возглавляет группу инертных газов в периодической таблице. Обозначается символом He (лат.
Helium). Простое вещество гелий (CAS-номер: 7440-59-7) — инертный одноатомный
газ без цвета, вкуса и запаха.
Гелий — один из наиболее распространённых элементов во Вселенной, он занимает второе место после водорода. Также гелий является вторым по лёгкости (после водорода) химическим элементом.
Промышленный гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой.
| Внешний вид простого вещества | |
|---|---|
| инертный газ без цвета, вкуса и запаха | |
| Свойства атома | |
| Имя, символ, номер | Гелий/Helium (He), 2 |
| Атомная масса (молярная масса) | 34,002602 а. е. м. (г/моль) м. (г/моль) |
| Электронная конфигурация | 1s |
| Радиус атома | (31) пм |
| Химические свойства | |
| Ковалентный радиус | 28 пм |
| Радиус иона | 93 пм |
| Электроотрицательность | 4,5 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 0 |
| Энергия ионизации (первый электрон) | 2361,3(24,47) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,147 (при −270 °C) 0,00017846 (при +20 °C) г/см3 |
| Температура плавления | 0,95 (при 2,5 МПа) |
| Температура кипения | 4,215 (для 4He) |
| Теплота испарения | 0,08 кДж/моль |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Молярный объём | 31,8 см3/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,570; c=5,84 Å |
| Температура Дебая | 1,633 |
| Прочие характеристики | |
| Теплопроводность | (300 K) 0,152 Вт/(м·К) |
18 августа 1868
года французский учёный Пьер Жансен, находясь во время полного солнечного затмения в индийском городе
Гунтур, впервые исследовал хромосферу Солнца.
Спустя два месяца 20 октября английский астроном Норман Локьер, не зная о разработках французского коллеги,
также провёл исследования солнечного спектра. Обнаружив неизвестную жёлтую линию с длиной волны 588
нм (более точно 587,56 нм), он обозначил её D3, так как она была очень близко расположена
к Фраунгоферовым линиям D1 (589,59 нм) и D2 (588,99 нм) натрия. Спустя два года Локьер, совместно
с английским химиком Эдвардом Франкландом, в сотрудничестве с которым он работал, предложил дать
новому элементу название «гелий» (от др.-греч. ἥλιος —
«солнце»).
Спустя два года Локьер, совместно
с английским химиком Эдвардом Франкландом, в сотрудничестве с которым он работал, предложил дать
новому элементу название «гелий» (от др.-греч. ἥλιος —
«солнце»).
Интересно, что письма Жансена и Локьера пришли во Французскую Академию наук в один день — 24 октября 1868 года, однако письмо Локьера, написанное им четырьмя днями ранее, пришло на несколько часов раньше. На следующий день оба письма были зачитаны на заседании Академии. В честь нового метода исследования протуберанцев Французская академия решила отчеканить медаль. На одной стороне медали были выбиты портреты Жансена и Локьера над скрещенными ветвями лавра, а на другой — изображение мифического бога Солнца Аполлона, правящего в колеснице четверкой коней, скачущей во весь опор.
В 1881 году итальянец Луиджи Пальмиери опубликовал сообщение об открытии им гелия в вулканических
газах (фумаролах). Он исследовал светло-желтое маслянистое вещество, оседавшее из газовых
струй на краях кратера Везувия. Пальмиери прокаливал этот вулканический продукт в пламени бунзеновской
горелки и наблюдал спектр выделявшихся при этом газов. Ученые круги встретили это сообщение с недоверием,
так как свой опыт Пальмиери описал неясно. Спустя многие годы в составе фумарол действительно были найдены
небольшие количества гелия и аргона.
Пальмиери прокаливал этот вулканический продукт в пламени бунзеновской
горелки и наблюдал спектр выделявшихся при этом газов. Ученые круги встретили это сообщение с недоверием,
так как свой опыт Пальмиери описал неясно. Спустя многие годы в составе фумарол действительно были найдены
небольшие количества гелия и аргона.
Только через 27 лет после своего первоначального открытия гелий был обнаружен на Земле — в 1895
году шотландский химик Уильям Рамзай, исследуя образец газа, полученного при разложении минерала клевеита, обнаружил
в его спектре ту же ярко-жёлтую линию, найденную ранее в солнечном спектре. Образец был
направлен для дополнительного исследования известному английскому ученому-спектроскописту Уильяму
Круксу, который подтвердил, что наблюдаемая в спектре образца жёлтая линия совпадает с линией D3 гелия.
23 марта 1895 года Рамзай отправил сообщение об открытии им гелия на Земле в Лондонское
королевское общество, а также во Французскую академию через известного химика Марселена Бертло.
Pr Информация об элементе празеодима: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура празеодима
Твердотельная структура празеодима Простая гексагональная .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ребер ячейки Константы решетки (a, b и c)
| A | B | C |
|---|---|---|
| 367,25 PM | 367,25 PM | 1183,54 PM |
| alpha | beta | gamma |
|---|---|---|
| π/2 | π/2 | 2 π/3 |
The positions of the atoms inside the unit cell are described by the набор атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными).
Празодимий атомный атомный и орбитальный. 8, 2] с символом атомного термина (квантовые числа)
4 I 9/2 .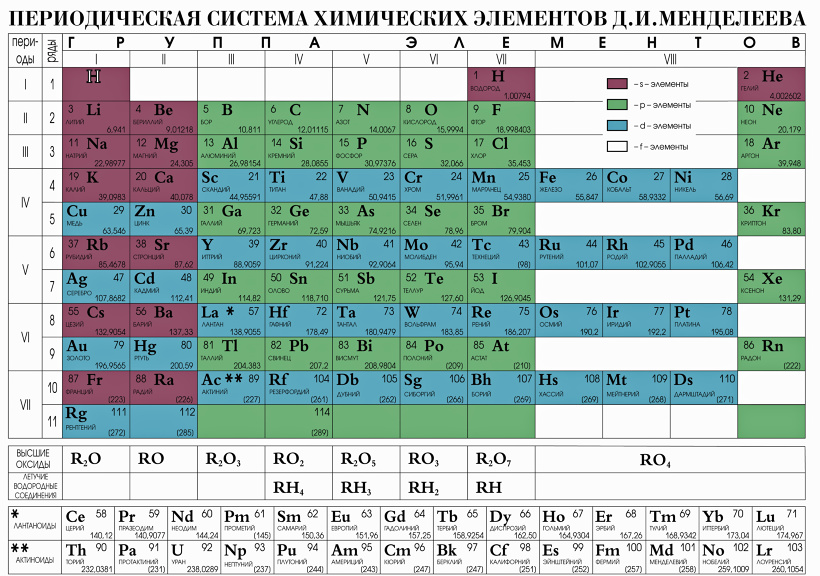
| Атомный номер | 59 |
| Число электронов (без заряда) | 59 |
| Number of Protons | 59 |
| Mass Number | 141 |
| Number of Neutrons | 82 |
| Shell structure (Electrons per energy level) | 2, 8, 18, 21, 8, 2 |
| Электронная конфигурация | [xe] 4F3 6S2 |
| Валентные электроны | 4F3 6S2 |
| Валентность (Валентность) | |
| (Валентность) | |
| (Валентность) | |
| (валентность) | |
| (валентность) | |
| (валентность) | |
| (валентность)0028 | |
| Main Oxidation States | 3 |
| Oxidation States | 0, 1, 2, 3, 4, 5 |
| Atomic Term Symbol (Quantum Numbers) | 4 I 9/2 |
Атомная модель празеодима по Бору – количество электронов на энергетический уровень
Электронная конфигурация празеодима в основном состоянии – нейтральный атом празеодима0011
Сокращенная электронная конфигурация основного состояния нейтрального атома празеодима: [Xe] 4f3 6s2. Часть конфигурации празеодима, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Xe]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4f3 6s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации празеодима, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Xe]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4f3 6s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального празеодима
Полная электронная конфигурация основного состояния атома празеодима. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f3 6s2 Принцип и правило Хунда.

Атомная структура празеодима
Атомный радиус празеодима составляет 247 пм, а его ковалентный радиус – .
| Расчетный атомный радиус | 247 пм (2,47 Å) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic Radius Empirical | 185 pm (1.85 Å) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic Volume | 20.8 cm3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent Radius | – | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals Radius | – Поглощение массы нейтронов0004Химические свойства празеодима: Энергия ионизации празеодима и сродство к электронуСродство к электрону празеодима составляет 50 кДж/моль.
Ionization Energy of PraseodymiumRefer to table below for Ionization energies of Praseodymium
Физические свойства празеодима Физические свойства празеодима см.
Elastic Properties
Praseodymium Heat and Conduction Properties
Празеодим Магнитные свойства
Optical Свойства празеодима
Акустические свойства празеодима
Термические свойства празеодимия – энтальпии и термодинамикаСм. Таблицу ниже для термических свойств | 9007
| . | |
| кипящий точке | 3563 K (3289,85 ° C, 5953,73 ° F) |
| Критическая температура | – |
| СУПЕРКОНДОВАЯ ТЕМПЫ0023 |
Enthalpies of Praseodymium
| Heat of Fusion | 6.9 kJ/mol |
| Heat of Vaporization | 330 kJ/mol |
| Heat of Combustion | – |
Praseodymium Изотопы — ядерные свойства празеодима
Празеодим состоит из 39 изотопов, содержащих от 121 до 159 нуклонов.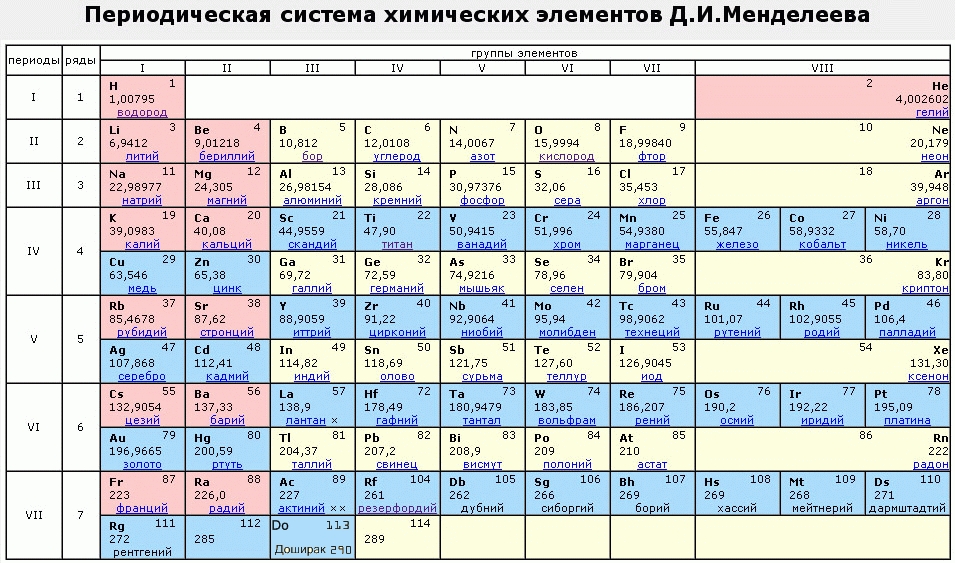 Празеодим имеет 1 стабильный природный изотоп.
Празеодим имеет 1 стабильный природный изотоп.
Изотопы празеодима – Встречающиеся в природе стабильные изотопы: 141Pr.
| Isotope | Z | N | Isotope Mass | % Abundance | T half | Decay Mode | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 121Pr | 59 | 62 | 121 | Synthetic | |||||||
| 122Pr | 59 | 63 | 122 | Синтетика | |||||||
| 123Pr | 59 | 64 | 123 | Synthetic | |||||||
| 124Pr | 59 | 65 | 124 | Synthetic | |||||||
| 125Pr | 59 | 66 | 125 | Synthetic | |||||||
| 126Pr | 59 | 67 | 126 | Synthetic | |||||||
| 127Pr | 59 | 68 | 127 | Synthetic | |||||||
| 128Pr | 59 | 69 | 128 | Synthetic | |||||||
| 129Pr | 59 | 70 | 129 | Synthetic | |||||||
| 130Pr | 59 | 71 | 130 | Synthetic | |||||||
| 131Pr | 59 | 72 | 131 | Synthetic | |||||||
| 132Pr | 59 | 73 | 132 | Synthetic | |||||||
| 133Pr | 59 | 74 | 133 | Synthetic | |||||||
| 134Pr | 59 | 75 | 134 | Synthetic | |||||||
| 135Pr | 59 | 76 | 135 | Synthetic | |||||||
| 136Pr | 59 | 77 | 136 | Synthetic | |||||||
| 137Pr | 59 | 78 | 137 | Synthetic | |||||||
| 138Pr | 59 | 79 | 138 | Синтетический | |||||||
| 139PR | 59 | 80 | 139 | 80 | 139 | 777777777777777777777777777777777777777777777777778 | 80 | 0028 | |||
| 140Pr | 59 | 81 | 140 | Synthetic | |||||||
| 141Pr | 59 | 82 | 141 | 100% | Stable | ||||||
| 142Pr | 59 | 83 | 142 | Synthetic | |||||||
| 143Pr | 59 | 84 | 143 | Synthetic | |||||||
| 144Pr | 59 | 85 | 144 | Synthetic | |||||||
| 145Pr | 59 | 86 | 145 | Synthetic | |||||||
| 146Pr | 59 | 87 | 146 | Синтетический | |||||||
| 147PR | 59 | 147 | 777777770028 | 59 | 89 | 148 | Synthetic | ||||
| 149Pr | 59 | 90 | 149 | Synthetic | |||||||
| 150Pr | 59 | 91 | 150 | Synthetic | |||||||
| 151Pr | 59 | 92 | 151 | Synthetic | |||||||
| 152Pr | 59 | 93 | 152 | Synthetic | |||||||
| 153Pr | 59 | 94 | 153 | Synthetic | |||||||
| 154Pr | 59 | 95 | 154 | Synthetic | |||||||
| 155Pr | 59 | 96 | 155 | Synthetic | |||||||
| 156Pr | 59 | 97 | 156 | Synthetic | |||||||
| 157Pr | 59 | 98 | 157 | Synthetic | |||||||
| 158Pr | 59 | 99 | 158 | Synthetic | |||||||
| 159Pr | 59 | 100 | 159 | Синтетический |
Сколько химических элементов вы можете назвать? 1 из 5 американцев не может назвать ни одного.

Когда вы покупаете по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Назовите химический элемент навскидку. Идти. (Изображение предоставлено Shutterstock)Время для курса повышения квалификации? Каждый пятый американец не может назвать ни одного элемента Периодической таблицы.
Большинство опрошенных американцев (59%) не смогли назвать более 10 элементов из 118, составляющих периодическую таблицу. Это могло быть результатом того, как был задан вопрос: американцы, вероятно, знают названия многих элементов (одним из них является золото; то же самое можно сказать и о других наименованиях, таких как серебро, олово, свинец, кислород, гелий и кальций), но могут не знать что они, по сути, являются элементами.
Новое исследование предоставлено филадельфийской некоммерческой организацией Science History Institute. Он был проведен через консалтинговую организацию YouGov, которая провела онлайн-опрос 1263 взрослых и взвесила ответы, чтобы они представляли демографию взрослого населения США. [6 важных элементов, о которых вы никогда не слышали]
[6 важных элементов, о которых вы никогда не слышали]
Учебник по периодической таблице
Элементы — это основные строительные блоки материи; вещества занимают места в Периодической таблице, потому что их нельзя разбить на что-то более простое. Эта диаграмма, которая украшает классы естественных наук по всему миру, датируется 1869 годом., когда русский химик Дмитрий Менделеев представил свой совершенно новый способ организации известных элементов по атомной массе (количество протонов и нейтронов в атоме) и валентности (максимальное количество электронов во внешней оболочке атома, доступных для связывания с другими атомами).
Последний раз периодическая таблица была обновлена в 2016 году, когда впервые появились четыре новых элемента. Для тех, кто хотел бы принять участие в следующем опросе Института истории науки, их имена – нихониум, московий, теннессин и оганесон. Эти элементы сверхтяжелые, с 113, 115, 117 и 1118 протонами в ядрах соответственно. Это означает, что они очень нестабильны.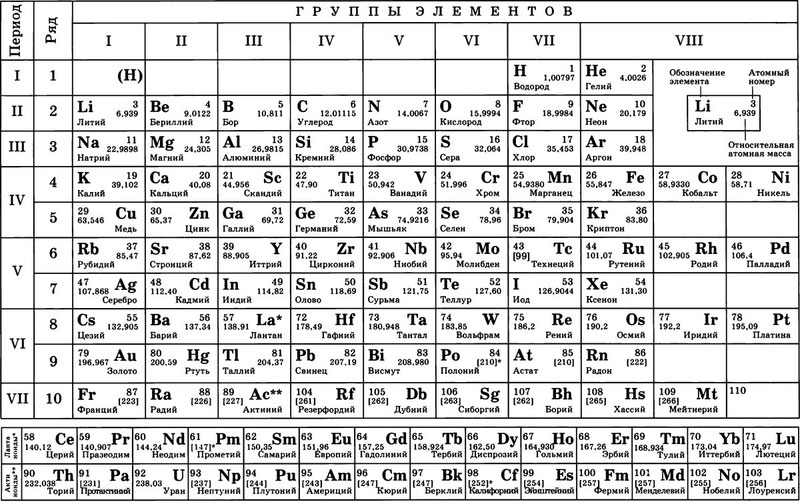 Они не встречаются в природе, и когда их создают в лаборатории, они быстро распадаются на другие, более стабильные элементы.
Они не встречаются в природе, и когда их создают в лаборатории, они быстро распадаются на другие, более стабильные элементы.
Опрос показал, что 57 процентов американцев верят в важность науки, а 45 процентов считают, что для них важно быть в курсе научных разработок. Но были пробелы в фундаментальных научных знаниях. Семнадцать процентов американцев сказали, что им страшно оставаться в курсе последних событий, а 24 процента заявили, что хотели бы, чтобы научная информация была более доступной.
Редкоземельные элементы
Исследование также указывает на недостаточное понимание редкоземельных элементов. 26% опрошенных не слышали этого термина, а 35% слышали его, но понятия не имели, что он означает.
Редкоземельные элементы — это 17 элементов с атомными номерами от 57 до 71 плюс 21 и 39. Это металлы со схожими свойствами, и они являются важными компонентами многих современных технологий, от портативной электроники до топливных элементов и лазеры. Они получили свое название, потому что редко встречаются в концентрированных отложениях, но на самом деле они довольно распространены во всем мире.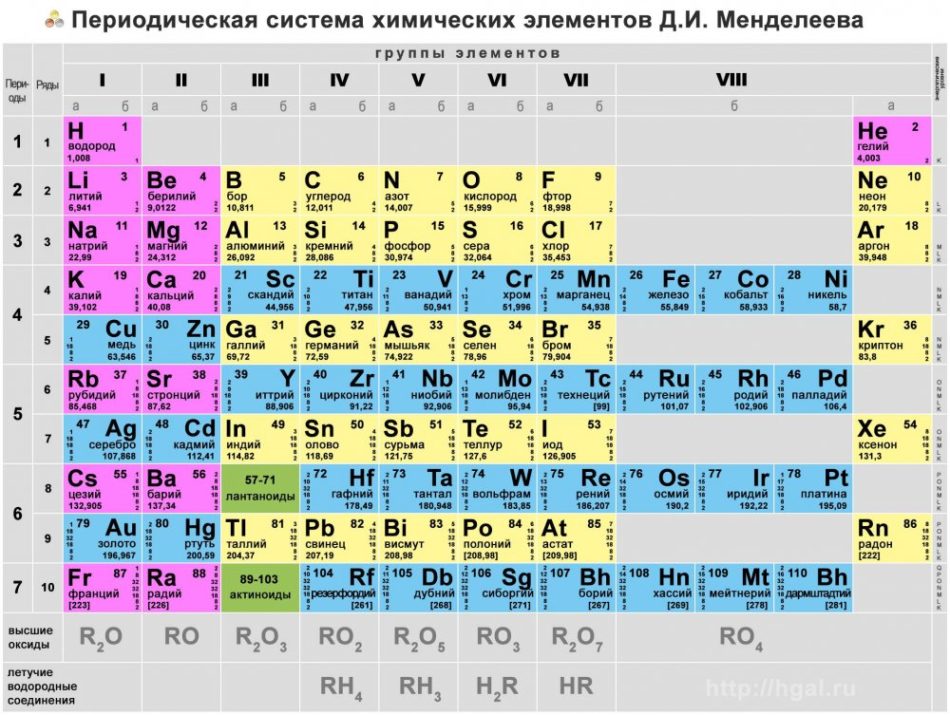 Их имена? Скандий, иттрий, лантан, церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий и лютеций (скажите, что в пять раз быстрее).
Их имена? Скандий, иттрий, лантан, церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий и лютеций (скажите, что в пять раз быстрее).
Опрос показал, что люди очень заинтересованы в технологиях, которые стали возможными благодаря этим элементам. 54% заявили, что не могут жить без Интернета, а 41% заявили, что не могут жить без своих смартфонов. Примерно каждый третий заявил, что технологии экологически чистой энергии и достижения в борьбе с изменением климата станут наиболее важными технологиями будущего, в то время как 20 процентов проголосовали за медицинские технологии и 18 процентов за коммуникационные технологии, которые окажут наибольшее влияние на будущее. Все полагаются на редкоземельные элементы.
- Элементарно, дорогой мой: 8 малоизвестных элементов
- Что это? Ответы на ваши вопросы по физике
- 18 величайших неразгаданных тайн физики
Первоначально опубликовано на Live Science .

 25 900.25 900.25 900.25 900.25 900.259.25 900.259.25 900.
25 900.25 900.25 900.25 900.25 900.259.25 900.259.25 900. в таблице ниже
в таблице ниже 23e-7 m3/kg
23e-7 m3/kg