Тунгстен или вольфрам? – Индикатор
Впрочем, другие соединения вольфрама тоже находят себе применение, а некоторые из них, как и сам вольфрам, бьют химические рекорды. Самый известный рекордсмен, конечно, – это гексафторид вольфрама. Дело в том, что это вещество – самый тяжелый газ при нормальных условиях. Литр этого газа имеет массу почти 13 граммов! Он в 143 раза тяжелее самого легкого газа – водорода.
Дисульфид вольфрама – это высокотемпературная смазка, триоксид вольфрама применяют в качестве катализатора в процессах селективного каталитического восстановления (СКВ) на тепловых электростанциях. Этот процесс призван снизить выбросы в атмосферу оксидов азота, образующихся при сгорании угля. Дителлурид же вольфрама используется для других целей – он позволяет преобразовывать напрямую тепловую энергию в электрическую благодаря эффекту Зеебека.
А вот вольфраматы, точнее – их монокристаллы нашли себе применение в ядерной физике, физике элементарных частиц, ядерной энергетике и ядерной медицине. Дело в том, что кристаллы вольфраматов свинца, кадмия и кальция – это прекрасные сцинцилляторы для рентгеновского и других типов ионизирующего излучения. Когда сквозь кристалл пролетает высокоэнергетический квант света, возникает вспышка света.
Дело в том, что кристаллы вольфраматов свинца, кадмия и кальция – это прекрасные сцинцилляторы для рентгеновского и других типов ионизирующего излучения. Когда сквозь кристалл пролетает высокоэнергетический квант света, возникает вспышка света.
Что же можно сказать о нанотехнологическом применении этого достаточно редкого и тяжелого элемента?
Наночастицы вольфрама проявляют высокую каталитическую активность и могут в перспективе служить заменой благородных металлов в химической промышленности.
Нитевидные кристаллы вольфрама (они же нановискеры, нанонити и нанопроволоки) получены в 2002 году. С тех пор их изучают и пытаются использовать в наноэлектронике, а также в качестве датчиков кислотности (pH – зонды) и газовых датчиков.
Наночастицы оксида вольфрама находит применение в биомедицине – и как антимикробный агент (интересно, что антибактериальная активность наночастиц увеличивается при освещении – и уже сейчас их используют для обеззараживания сточных вод), а кроме того – они служат контрастным агентом при компьютерной томографии. Последнее наряду с тем, что наночастицы эти обладают избирательной токсичностью к раковым клеткам, позволяет их использовать в тераностике рака – одновременной ранней его диагностике и лечении.
Последнее наряду с тем, что наночастицы эти обладают избирательной токсичностью к раковым клеткам, позволяет их использовать в тераностике рака – одновременной ранней его диагностике и лечении.
Наноструктурированный порошок карбида вольфрама находит применение как катализатор. Правда, его не так-то просто получить, поэтому химики все время ищут новые экзотические способы получения наночастиц такого прочного и тугоплавкого материала. Например – электрический взрыв. А наночастицы карбида вольфрама добавляют в твердые сплавы и увеличивают их прочность.
Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс.Новостей и читайте нас чаще.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram, Одноклассники.
Вольфрам
Вольфра́м — химический элемент таблицы Менделеева с атомным номером 74 в периодической системе, обозначается символом W (лат. Wolframium), твёрдый серый переходный металл. Главное применение — как основа тугоплавких материалов в металлургии. Крайне тугоплавок, при стандартных условиях химически стоек.
Крайне тугоплавок, при стандартных условиях химически стоек.
История и происхождение названия
Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья пена» — «Spuma lupi» на латыни, или «Wolf Rahm» по-немецки. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирает олово как волк овцу»). В настоящее время в США, Великобритании и Франции для вольфрама используют название «tungsten» (швед. tung sten — «тяжелый камень»). В 1781 знаменитый шведский химик Шееле , обрабатывая азотной кислотой минерал шеелит, получил желтый «тяжелый камень». В 1783 испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита жёлтой окиси нового металла, растворимой в аммиаке. При этом один из братьев, Фаусто, был в Швеции в 1781 и общался с Шееле. Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
Получение
Процесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Свойства
Физические Вольфрам — светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). Вольфрам является одним из наиболее тяжелых, твердых и самым тугоплавким металлом.

Источник: Википедия
Другие заметки по химии
Россия, Германия и Япония готовятся к синтезу элементов 119 и 120 / Хабр
Периодическая таблица химических элементов (на начало 2018 года)
В этом году Лаборатория ядерных реакций имени Г.Н. Флерова в Объединённом институте ядерных исследований (ОИЯИ) в Дубне запустят новый ускорительный комплекс — Фабрику сверхтяжёлых элементов. Этот комплекс станет базой для синтеза новых химических элементов.
«Мы готовимся к синтезу первых двух элементов восьмого периода — 119-го и 120-го. Планируем начать соответствующие эксперименты в 2019 году», — сказал «Известиям» учёный секретарь Лаборатории ядерных реакций ОИЯИ Александр Карпов.
Именно в Дубне на ускорительном комплексе У-400 были открыты 113-й элемент (нихоний, Nh, получился как побочный продукт при синтезе 115-го элемента), 115-й (московий, Mc), 117-й (теннесин, Ts) и 118-й (оганесон, Og).
Последний элемент назван в честь открывшего его академика Юрия Оганесяна.
 Предпоследний — в честь штата Теннесси, за вклад этого штата, в том числе Национальной лаборатории Ок-Ридж, Университета Вандербильта и Университета Теннесси в Ноксвилле, в изучение сверхтяжёлых элементов.
Предпоследний — в честь штата Теннесси, за вклад этого штата, в том числе Национальной лаборатории Ок-Ридж, Университета Вандербильта и Университета Теннесси в Ноксвилле, в изучение сверхтяжёлых элементов.Сейчас периодическая таблица химических элементов заканчивается как раз 118-м элементом. На сегодня единственным известным нуклидом элемента является 294Og с периодом полураспада в 1 мс и атомной массой 294,214(5) а. е. м.
Разумеется, искусственно синтезированный радиоактивный элемент 118 не встречается в природе. Точно так же не встречаются и новые элементы 119 и 120, которые собираются синтезировать в Дубне. Вообще, в природе не встречаются элементы, атомные числа которых превышают 94. Трансурановые элементы производятся искусственно и обычно называются в честь учёных или по местонахождению лаборатории, получившей элемент.
Элемент 119 сейчас носит временное предварительное название унуннений (Uue), а элемент 120 — унбинилий (Ubn). Согласно правилам наименования новых элементов, принятым Международным союзом теоретической и прикладной химии (ИЮПАК) в 2002 году, для обеспечения лингвистического однообразия всем новым элементам должны даваться названия, оканчивающиеся на «-ium».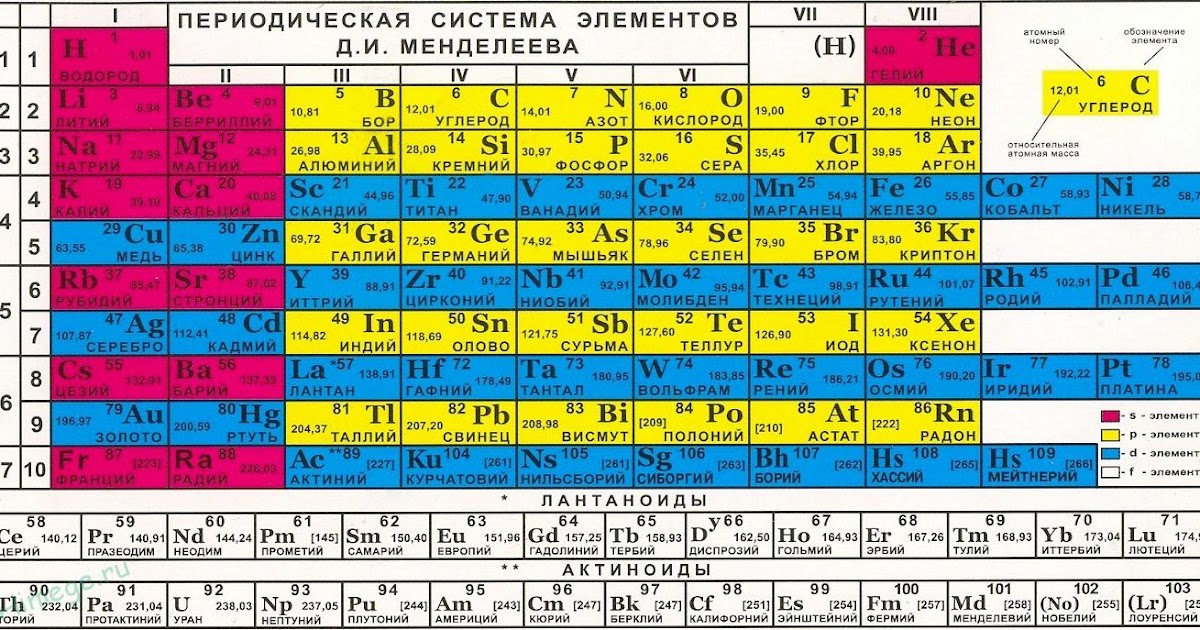
Синтез унуннения (он же эка-франций) станет значительным событием для науки. Дело в том, что элемент с атомным номером 119 и прогнозированной атомной массой 316 а. е. м. после его синтеза станет первым элементом в восьмом периоде периодической таблицы химических элементов.
Попытка синтеза элемента 119 предпринималась в 1985 году при помощи бомбардировки мишени из эйнштейния-254 ядрами кальция-48 на ускорителе SuperHILAC в Беркли. К сожалению, не удалось идентифицировать ни одного атома.
Кроме российских физиков из ОИЯИ, опыты по синтезу элемента 119 сейчас готовятся в Центре по изучению тяжёлых ионов имени Гельмгольца (Германия) и Институте физико-химических исследований (RIKEN, Япония). Так, для получения 119-го элемента японские учёные собираются соединить ядра 23-го элемента ванадия и 96-го элемента кюрия, а для получения 120-го элемента — ядра того же кюрия и 24-го элемента — хрома.
Предполагается, что унуненний будет химически активным щелочным металлом, следующим после франция в группе, и будет повторять большинство свойств более лёгких аналогов. Но ожидается, что при этом он будет проявлять некоторые специфические химические свойства, которые присущи только ему и не присущи более лёгким аналогам.
Согласно теоретическим выкладкам химиков, унуненний по химическим свойствам будет предположительно больше похож на рубидий или калий, чем на цезий или франций, игнорируя тенденцию к увеличению химической активности элемента по мере роста порядкового номера.
Новый ускорительный комплекс в Дубне позволит увеличить количество получаемых сверхтяжёлых ядер примерно в 20–50 раз по сравнению с сегодняшними возможностями: «Эти ядра нестабильны, и для их изучения очень важна статистика, то есть количество получаемых атомов. На существующей аппаратуре эксперименты, которые мы планируем делать на фабрике, проводить можно, но они займут годы, а, может быть, и десятилетия. Фабрика будет в 20–50 раз более эффективна, исследования будут укладываться в недели или месяцы», — сказал Александр Карпов.
Фабрика будет в 20–50 раз более эффективна, исследования будут укладываться в недели или месяцы», — сказал Александр Карпов.
Синтез элементов 119 и 120 поможет приблизиться к загадке «острова стабильности» — гипотетической области таблицы Менделеева, где находятся самые долгоживущие сверхтяжёлые ядра.
Презентация по теме Вольфрам W химический элемент периодической таблицы Д
Презентация по теме Вольфрам(W)химический элемент периодической таблицы Д. И. Менделеева
Вольфрам История происхождения названия Нахождение в природе Месторождения Получение Физические свойства Химические свойства
Вольфрам • Вольфра м — химический элемент с атомным номером 74 в периодической системе, обозначается символом W (лат. Wolframium), твёрдый серый переходный металл. Главное применение — как основа тугоплавких материалов в металлургии. Крайне тугоплавок, при стандартных условиях химически стоек.
История и происхождение названия • Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья пена» — «Spuma lupi» на латыни, или «Wolf Rahm» понемецки. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков ( «пожирает олово как волк овцу» ). • В настоящее время в США, Великобритании и Франции для вольфрама используют название «tungsten» (швед. tung sten — «тяжелый камень» ). • В 1781 знаменитый шведский химик Шееле , обрабатывая азотной кислотой минерал шеелит, получил желтый «тяжелый камень» . В 1783 испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита жёлтой окиси нового металла, растворимой в аммиаке. При этом один из братьев, Фаусто, был в Швеции в 1781 и общался с Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
под названием «волчья пена» — «Spuma lupi» на латыни, или «Wolf Rahm» понемецки. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков ( «пожирает олово как волк овцу» ). • В настоящее время в США, Великобритании и Франции для вольфрама используют название «tungsten» (швед. tung sten — «тяжелый камень» ). • В 1781 знаменитый шведский химик Шееле , обрабатывая азотной кислотой минерал шеелит, получил желтый «тяжелый камень» . В 1783 испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита жёлтой окиси нового металла, растворимой в аммиаке. При этом один из братьев, Фаусто, был в Швеции в 1781 и общался с Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
Нахождение в природе • Кларк вольфрама земной коры составляет (по Виноградову) 1, 3 г/т(0. 0013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0, 1, основных — 0, 7, средних — 1, 2, кислых — 1, 9. • Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO 3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца n. Fe. WO 4 * m. Mn. WO 4 — соответственно, ферберит и гюбнерит) и шеелит(вольфрамат кальция Ca. WO 4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1 -2 %.
• Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO 3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца n. Fe. WO 4 * m. Mn. WO 4 — соответственно, ферберит и гюбнерит) и шеелит(вольфрамат кальция Ca. WO 4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1 -2 %.
Месторождения • Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России и Южной Корее. Мировое производство вольфрама составляет 18 -20 тысяч тонн в год, в том числе в Китае 10, России 3, 5; Казахстане 0, 7, Австрии 0, 5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания. Также есть месторождения вольфрама в Армении и других странах.
Получение • Процесс получения вольфрама проходит через подстадию выделения триоксида WO 3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200— 1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Физические свойства • Вольфрам — светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). • Некоторые физические свойства приведены в таблице (см. выше). Другие физические свойства вольфрама: • твердость по Бринеллю 488 кг/мм². • удельное электрическое сопротивление при 20 °C 55× 10− 9 Ом·м, при 2700 °C — 904× 10− 9 Ом·м. • скорость звука в отожжённом вольфраме 4290 м/с. • Вольфрам является одним из наиболее тяжелых, твердых и самым тугоплавким металлом. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддается ковке и может быть вытянут в тонкую нить.
выше). Другие физические свойства вольфрама: • твердость по Бринеллю 488 кг/мм². • удельное электрическое сопротивление при 20 °C 55× 10− 9 Ом·м, при 2700 °C — 904× 10− 9 Ом·м. • скорость звука в отожжённом вольфраме 4290 м/с. • Вольфрам является одним из наиболее тяжелых, твердых и самым тугоплавким металлом. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддается ковке и может быть вытянут в тонкую нить.
Химические свойства • Валентность от 2 до 6. Наиболее устойчив 6 -валентный вольфрам. 3 – и 2 -валентные соединения вольфрама неустойчивы и практического значения не имеют. • Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама VI; в соляной, серной и плавиковой кислотах почти не растворим. В азотной кислоте и царской водке окисляется с поверхности. В смеси азотной и плавиковой кислоты растворяется, образуя вольфрамовую кислоту. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me 2 WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me 2 WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Элемент № 24 периодической таблицы. Хром
1. Периодическая таблица Д.И. Менделеева
Элемент № 24ХРОМ
Выполнил: ученик 9 кл. ГОУ СОШ № 403
Гузенко Артем
2009/2010 учебный год
3. ХРОМ
Хром (лат. Cromium), Cr,химический элемент VI группы
периодической системы Менделеева,
атомный номер 24,
атомная масса 51,996;
металл голубовато-стального цвета.
4. История открытия
В 1797 г. французский химик Л. Вокеленвпервые исследовал красноватый, тяжелый
минерал крокоизит, попавший в его руки из
далекой Сибири.
Крокоизит, чаще называемый крокоитом (от
греческого “крокос” – шафран), -редкий
минерал, найденный на Урале в 40-х года
XVIII в.
 и описанный М. В. Ломоносовым.
и описанный М. В. Ломоносовым.Затем он был найден в Сибири петербургским
профессором химии И. Леманом в 1762 г. От
него попал к Вокелену, который открыл в
сибирском минерале соединение нового
элемента.
Выделить этот элемент в чистом виде он
не смог. Пораженный разнообразием окрасок,
образуемых разными соединениями вновь
открытого элемента, Вокелен назвал его
хромом (от греческого слова “хрома” – цвет,
краска). В сравнительно чистом виде новый
элемент был выделен в 1799 г. Ф. Тассером.
Он представлял собой серо-стальной металл
с серебристыми блестками в изломе,
тугоплавкий (температура плавления 1800° С),
не окисляющийся при обычных условиях, с
плотностью, почти равной плотности железа.
5. Применение хрома
Использование хрома основано на его жаропрочности, твердости иустойчивости против коррозии.
Больше всего хрома применяют для выплавки хромистых сталей.
Значительное количество хрома идет на декоративные коррозионно-стойкие
покрытия.

Широкое применение получил порошковый хром в производстве
металлокерамических изделий и материалов для сварочных электродов.
Хром в виде иона Cr3+ – примесь в рубине, который используется как
драгоценный камень и лазерный материал.
Соединениями хрома протравливают ткани при крашении.
Из смеси хромита и магнезита изготовляют хромомагнезитовые огнеупорные
изделия.
Cr
В
металлургии
В
химической
промышленности
В
текстильной
промышленности
В
медицине
В науке
6. Наглядное применение хрома
7. Роль хрома в живых организмах
Важные факты:Хром — один из биогенных элементов,
постоянно входит в состав тканей растений и
животных. У животных хром участвует в обмене
липидов, белков (входит в состав фермента
трипсина), углеводов. Снижение содержания хрома
в пище и крови приводит к уменьшению скорости
роста, увеличению холестерина в крови.
В конце 1950-х гг.
 два исследователя, Шварц и
два исследователя, Шварц иМерц, сообщили, что у крыс, которые были на
рационе, дефицитном по хрому, развивалась
непереносимость сахара; при добавлении же хрома
в рацион их состояние нормализовалось. Это было
первым подтверждением, что хром необходим
животным для нормальной жизни. С тех пор
исследователи поняли, что хром играет такую же
роль и для здоровья человека.
8. Пищевые источники хрома
пшеничные ростки, печень, мясо, сыр, бобы, горох, цельное зерно, черныйперец, мелисса, пивные дрожжи.
9. Функции хрома в жизни человека
Основная роль хрома в организме – это регуляция сахара в крови.Хром работает вместе с инсулином по
перемещению сахара из крови в ткани
организма для использования или сохранения. Этот микроэлемент настолько
важен для переносимости сахара, что
сильная его недостаточность приводит
к развитию диабетоподобного заболевания.
Уровень хрома снижается при детском диабете, при коронарном артериальном заболевании (склерозировании артерий, ведущим к сердцу).

Хром необходим для нормального
метаболизма жиров («сжигания жиров»)
в организме и его недостаток однозначно
ведет к излишнему весу, ожирению.
10. Месторождения хрома
В земной коре хрома довольно много – 0,02%. Хромовая руда носитназвание хромитов или хромистого железняка (потому, что почти всегда
содержит и железо).
Наша страна обладает огромными запасами хромитов. Одно из самых
больших месторождений находится в Казахстане, в районе
Актюбинска; оно открыто в 1936 г. Значительные запасы хромовых руд
есть и на Урале.
Большими запасами хромитов располагают Куба, Югославия, многие
страны Азии и Африки.
СПАСИБО
ЗА ВНИМАНИЕ
Таблица Менделеева – Первая таблица Менделеева
Менделеева «s периодическая таблица 1869 содержала 17 колонн, с двумя почти полных периодов (последовательностей) элементов, от калия до брома и рубидия к йоду , предшествовали два частичных периодов семи элементов , каждый (лития с фтором и натрия к хлору), за которыми следуют три неполных периода. В статье 1871 года Менделеев представил новую версию таблицы из 17 групп, главным улучшением которой стало правильное расположение 17 элементов. Он, как и Лотар Мейер , также предложил таблицу с восемью столбцами, полученную путем разделения каждого из длинных периодов на период из семи, восьмую группу.содержащий три центральных элемента (таких как железо , кобальт , никель; Менделеев также включил медь , вместо того, чтобы помещать ее в группу I), и второй период из семи. Первый и второй периоды семи позже были выделены с помощью букв «a» и «b», прикрепленных к символам группы, которые были римскими цифрами.
В статье 1871 года Менделеев представил новую версию таблицы из 17 групп, главным улучшением которой стало правильное расположение 17 элементов. Он, как и Лотар Мейер , также предложил таблицу с восемью столбцами, полученную путем разделения каждого из длинных периодов на период из семи, восьмую группу.содержащий три центральных элемента (таких как железо , кобальт , никель; Менделеев также включил медь , вместо того, чтобы помещать ее в группу I), и второй период из семи. Первый и второй периоды семи позже были выделены с помощью букв «a» и «b», прикрепленных к символам группы, которые были римскими цифрами.
С открытием благородные газы гелий , неон , аргон , криптон , радон и ксенон от лорда Рэлея (Стретт) и сэр Уильям Рамзай в 1894 году и в последующие годы, Менделеев и другие предложили , что новый «нулевой» группы , чтобы приспособить их быть добавлены таблица Менделеева. «Короткопериодическая» форма таблицы Менделеева с группами 0, I, II,… VIII стала популярной и оставалась в общем использовании примерно до 1930 года.
Короткопериодическая форма периодической системы элементов, включающая элементы, известные к 1930 году. В то время не было ясно, что торий (90), протактиний (91) и уран (92) были частью ряда актинидов, и они были часто помещают в группы IVa, Va и VIa, соответственно, потому что они показывают некоторое сходство с гафнием (72), танталом (73) и вольфрамом (74).
Британская энциклопедия, Inc.Основываясь на более ранней (1882 г.) модели Т. Бэйли, Дж. Томсен в 1895 г. разработал новую таблицу. Это было интерпретировано в терминах электронной структуры атомов Нильсом Бором в 1922 году. В этой таблице есть периоды увеличения длины между благородными газами; Таким образом, таблица содержит период из 2 элементов, два из 8 элементов, два из 18 элементов, один из 32 элементов и неполный период. Элементы в каждом периоде могут быть связаны линиями связи с одним или несколькими элементами в следующем периоде. Основным недостатком этой таблицы является большое пространство, необходимое для периода в 32 элемента, и сложность отслеживания последовательности очень похожих элементов. Полезный компромисс – сжать период 32 элементов в 18 пространств, перечислив 14 лантаноидов (также называемыхлантаноидов ) и 14 актиноидов (также называемыхactinides) в специальном двойном ряду под другими периодами.
Основным недостатком этой таблицы является большое пространство, необходимое для периода в 32 элемента, и сложность отслеживания последовательности очень похожих элементов. Полезный компромисс – сжать период 32 элементов в 18 пространств, перечислив 14 лантаноидов (также называемыхлантаноидов ) и 14 актиноидов (также называемыхactinides) в специальном двойном ряду под другими периодами.
Другие версии таблицы Менделеева
Были предложены альтернативные длинные формы периодической таблицы. Один из самых ранних, описанныйА. Вернер в 1905 году делит каждый из более коротких периодов на две части, по одной на обоих концах таблицы, над элементами более длинных периодов, которые они больше всего напоминают. Таким образом, отпадает необходимость в многочисленных связующих линиях, соединяющих периоды в таблице типа Бейли. Этот класс таблиц также можно значительно упростить, если вынести лантаноидные и актиноидные элементы в отдельную область. К середине 20 века этот вариант таблицы стал наиболее распространенным.
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Открытие, сделанное Русским химиком Менделеевым, сыграло (безусловно) наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке (физика атома и ядра атома). В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, (он же атомный), есть и мера электрического заряда атомного ядра этого элемента. А номер периода (т.е. горизонтального ряда), определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, (этим самым, элементы одного ряда, обязаны сходством химических свойств).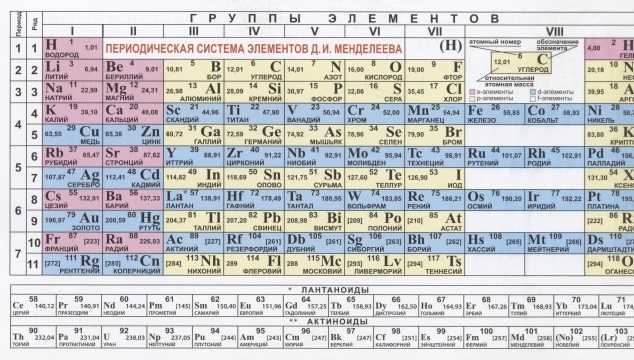
Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки. Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия.
Таблица МенделееваОдна из особенностей периодической таблицы Менделеева, состоит в том, что группа (колонка в таблице), имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, (одинаковыми), особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы. Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 (с лева, на право), согласно международной системе именования групп. В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» – для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA – это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» – после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
Многие группы получили несистематические названия травиального характера, (к примеру – «щелочноземельные металлы», или «галогены», и другие подобные названия). Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы (титановая, кобальтовая и тому подобно).
Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность, это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Среди групп, есть и такие у которых более значимыми являются горизонтальные направления (в отличии от других, у которых большее значение имеют вертикальные направления), к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности.
Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме – возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, (не считая благородных газов).
Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки.
В S-блок, входит две первые группы элементов, (щелочные и щелочноземельные металлы, водород и гелий).
В P-блок, входят шест последних групп, с 13 по 18 (согласно ИЮПАК, или по системе принятой в Америке – с IIIA до VIIIA), этот блок так же включает в себя все металлоиды.
Блок – D, группы с 3 по 12 (ИЮПАК, или с IIIB до IIB по-американски), в этот блок включены все переходные металлы.
Блок – F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды.
Открытие Дмитрием Менделеевым периодической таблицы химических элементов в марте 1869 года стало настоящим прорывом в химии. Российскому ученому удалось систематизировать знания о химических элементах и представить их в виде таблицы, которую и сейчас обязательно изучают школьники на уроках химии.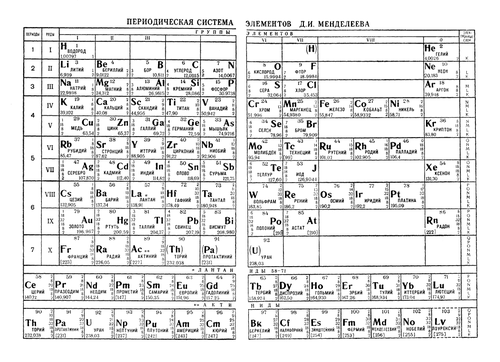 Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история ее открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история ее открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
История таблицы Менделеева: как все начиналось
Попытки классифицировать и систематизировать известные химические элементы предпринимались задолго до Дмитрия Менделеева. Свои системы элементов предлагали такие известные ученые, как Деберейнер, Ньюлендс, Мейер и другие. Однако из-за нехватки данных о химических элементах и их правильных атомных массах предложенные системы были не совсем достоверными.
История открытия таблицы Менделеева начинается в 1869 году, когда российский ученый на заседании Русского химического общества рассказал своим коллегам о сделанном им открытии. В предложенной ученым таблице химические элементы располагались в зависимости от их свойств, обеспечивающихся величиной их молекулярной массы.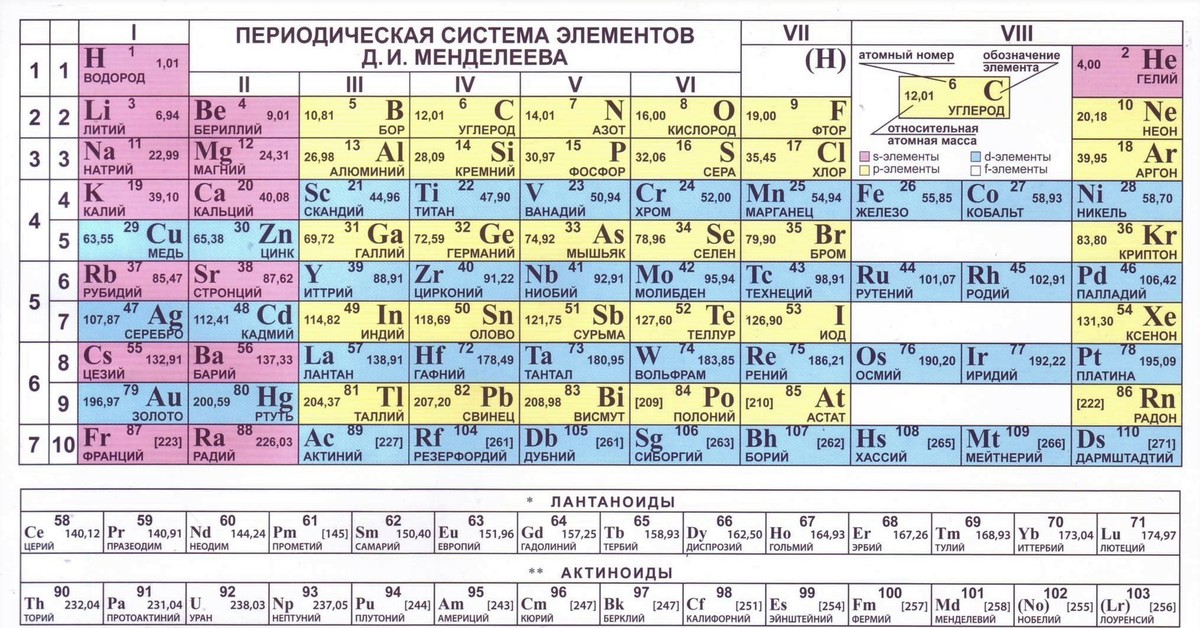
Интересной особенностью таблицы Менделеева было также наличие пустых клеток, которые в будущем были заполнены открытыми химическими элементами, предсказанными ученым (германий, галлий, скандий). После открытия периодической таблицы в нее много раз вносились добавления и поправки. Совместно с шотландским химиком Уильямом Рамзаем Менделеев добавил в таблицу группу инертных газов (нулевую группу).
В дальнейшем история периодической таблицы Менделеева была напрямую связана с открытиями в другой науке – физике. Работа над таблицей периодических элементов продолжается до сих пор, и современные ученые добавляют новые химические элементы по мере их открытия. Значение периодической системы Дмитрия Менделеева сложно переоценить, так как благодаря ей:
- Систематизировались знания о свойствах уже открытых химических элементов;
- Появилась возможность прогнозирования открытия новых химических элементов;
- Начали развиваться такие разделы физики, как физика атома и физика ядра;
Существует множество вариантов изображения химических элементов согласно периодическому закону, однако наиболее известный и распространенный вариант – это привычная для каждого таблица Менделеева.
Мифы и факты о создании периодической таблицы
Самым распространенным заблуждением в истории открытия таблицы Менделеева является то, что ученый увидел ее во сне. На самом деле сам Дмитрий Менделеев опроверг этот миф и заявил, что размышлял над периодическим законом на протяжении многих лет. Чтобы систематизировать химические элементы он выписывал каждый из них на отдельную карточку и многократно комбинировал их между собой, расставляя в ряды в зависимости от их схожих свойств.
Миф о «вещем» сне ученого можно объяснить тем, что Менделеев работал над систематизацией химических элементов сутками напролет, прерываясь на непродолжительный сон. Однако только упорный труд и природный талант ученого дал долгожданный результат и обеспечил Дмитрию Менделееву всемирную известность.
Многих учащихся в школе, а иногда и в университете, заставляютзаучивать или хотя бы примерно ориентироваться в таблице Менделеева. Для этого человек должен не только иметь хорошую память, но и логически мыслить, связывая элементы в отдельные группы и классы. Изучение таблицы легче всего дается тем людям, которые постоянно поддерживают мозг в тонусе, проходя тренинги на BrainApps.
Изучение таблицы легче всего дается тем людям, которые постоянно поддерживают мозг в тонусе, проходя тренинги на BrainApps.
Одной из самых популярных таблиц в мире является таблица Менделеева. В каждой ячейке вписаны названия химических элементов. Для ее разработки было приложено много усилий. Ведь это не просто список веществ. Они упорядочены согласно своим свойствам и особенностям. А сколько элементов в таблице Менделеева мы сейчас и узнаем.
История создания таблицыМенделеев не был первым ученым, который решил структурировать элементы. Пытались многие. Вот только никто не мог сопоставить все в одной слаженной таблице. Датой открытия периодического закона мы можем назвать 17 февраля 1869 года. В этот день Менделеев показал свое творение – целую систему элементов, упорядоченных на основе атомного веса и химических особенностях.
Стоит отметить, что гениальная мысль не пришла ученому в один удачный вечер во время работы. Он действительно трудился около 20 лет. Снова и снова перебирал карточки с элементами, изучал их характеристики. В это же время трудились и другие ученые.
Снова и снова перебирал карточки с элементами, изучал их характеристики. В это же время трудились и другие ученые.
Химик Канниццаро предложил от своего имени теорию атомного веса. Он утверждал, что именно эти данные могут построить все вещества в нужном порядке. Дальше ученые Шантуркуа и Ньюлендс, работая в разных точках мира, пришли к умозаключению, что размещая элементы по атомному весу, они начинают дополнительно объединяться и по другим свойствам.
В 1869 году вместе с Менделеевым были представлены другие примеры таблиц. Но сегодня мы даже не помним имена их авторов. Почему так? Все дело в превосходстве ученого над своими конкурентами:
- Таблица имела большее количество открытых элементов, чем у других.
- Если какой-то элемент не подходил по атомному весу, ученый помещал его на основе других свойств. И это было правильным решением.
- В таблице было много пустых мест. Менделеев сделал пропуски осознано, забрав тем самым частичку славы тех, кто в будущем найдет эти элементы.
 Он даже дал описание некоторых еще неведомых веществ.
Он даже дал описание некоторых еще неведомых веществ.
Самое главное достижение в том, что эта таблица неразрушима. Она создано так гениально, что любые открытия в будущем будут ее только дополнять.
Сколько элементов в таблице МенделееваКаждый человек хотя бы раз в жизни видел эту таблицу. Но вот назвать точное количество веществ сложно. Правильных ответов может быть два: 118 и 126. Сейчас мы разберемся, почему так.
В природе люди обнаружили 94 элемента. Они ничего с ними не делали. Только изучали их свойства и особенности. Большая часть из них была в первоначальной периодической таблице.
Другие 24 элемента были созданы в лабораториях. Всего получается 118 штук. Еще 8 элементов являются лишь гипотетическими вариантами. Их пытаются изобрести или получить. Так что на сегодняшний день и вариант с 118 элементами, и с 126 элементами можно смело называть.
- Ученый был семнадцатым ребенком в семье. Восемь из них погибли еще в раннем возрасте.
 Отец рано ушел из жизни. Но мать продолжала бороться за будущее своих детей, так что смогла пристроить их в хорошие учебные заведения.
Отец рано ушел из жизни. Но мать продолжала бороться за будущее своих детей, так что смогла пристроить их в хорошие учебные заведения. - Всегда отстаивал свое мнение. Был уважаемым педагогом в университетах Одессы, Симферополя и Санкт-Петербурга.
- Он никогда не изобретал водку. Алкогольный напиток был создан задолго до ученого. Но его докторская была посвящена спирту, отсюда и развилась легенда.
- Периодическая система никогда не снилась Менделееву. Она стала результатом тяжелой работы.
- Он любил делать чемоданы. И довел свое хобби до высокого уровня мастерства.
- За всю свою жизнь Менделеев 3 раза мог получить Нобелевскую премию. Но все закончилось лишь номинациями.
- Многих это удивит, то работы в области химии занимают лишь 10% всех занятий ученого. Также он изучал аэростаты и кораблестроение.
Таблица Менделеева – это удивительная система всех элементов, которые когда-либо были обнаружены людьми. Она делится на ряды и столбцы, чтобы упростить изучение всех элементов.
P.S. Статья — Сколько элементов в таблице Менделеева, опубликована в рубрике — .
Таблица Менделеева является одним из величайших открытий человечества, позволившим упорядочить знания об окружающем мире и открыть новые химические элементы . Она является необходимой для школьников, а так же для всех, кто интересуется химией. Кроме того, данная схема является незаменимой и в других областях науки.
Данная схема содержит все известные человеку элементы, причем они группируются в зависимости от атомной массы и порядкового номера . Эти характеристики влияют на свойства элементов. Всего в коротком варианте таблицы имеется 8 групп, элементы, входящие в одну группу, обладают весьма сходными свойствами. Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
В состав третьей группы вошли бор, алюминий, скандий, галлий, потом следуют иттрий, индий, лантан, завершается группа таллием и актинием. Четвертая группа начинается с углерода, кремния, титана, продолжается германием, цирконием, оловом и завершается гафнием, свинцом и резерфордием. В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
В седьмой группе первый элемент – фтор, потом следует хлор, марганец, бром, технеций, за ним находится йод, потом рений, астат и борий. Последняя группа является самой многочисленной . В нее входят такие газы, как гелий, неон, аргон, криптон, ксенон и радон. Так же к данной группе относятся металлы железо, кобальт, никель, родий, палладий, рутений, осмий, иридий, платина. Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов . Они обладают сходными свойствами с лантаном и актинием.
Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов . Они обладают сходными свойствами с лантаном и актинием.
Данная схема включает в себя все виды элементов, которые делятся на 2 большие группы – металлы и неметаллы , обладающие разными свойствами. Как определить принадлежность элемента к той или иной группе, поможет условная линия, которую необходимо провести от бора к астату. Следует помнить, что такую линию можно провести только в полной версии таблицы. Все элементы, которые находятся выше этой линии, и располагаются в главных подгруппах считаются неметаллами. А которые ниже, в главных подгруппах – металлами. Так же металлами являются вещества, находящиеся в побочных подгруппах . Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Отдельный список составляют и амфотерные элементы, которые обладают двойственными свойствами и могут образовывать в результате реакций 2 вида соединений. При этом у них проявляются одинаково как основные, так и кислотные свойства . Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
При этом у них проявляются одинаково как основные, так и кислотные свойства . Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
Стоит отметить, что данная схема в традиционном исполнении хорошего качества является цветной. При этом разными цветами для удобства ориентирования обозначаются главные и побочные подгруппы . А так же элементы группируются в зависимости от схожести их свойств.
Однако в настоящее время наряду с цветной схемой очень распространенной является периодическая таблица Менделеева черно белая. Такой ее вид используется для черно-белой печати. Несмотря на кажущуюся сложность, работать с ней так же удобно, если учесть некоторые нюансы. Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны. К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами .
Стоит отметить, что в одноцветном исполнении ориентироваться по схеме не очень трудно. Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Егэ сегодня является основным видом испытания по окончанию школы, а значит, подготовке к нему необходимо уделять особое внимание. Поэтому при выборе итогового экзамена по химии , необходимо обратить внимание на материалы, которые могут помочь в его сдаче. Как правило, школьникам на экзамене разрешено пользоваться некоторыми таблицами, в частности, таблицей Менделеева в хорошем качестве. Поэтому, чтобы она принесла на испытаниях только пользу, следует заблаговременно уделить внимание ее строению и изучению свойств элементов, а так же их последовательности. Необходимо научиться, так же пользоваться и черно-белой версией таблицы , чтобы на экзамене не столкнуться с некоторыми трудностями.
Помимо основной таблицы, характеризующей свойства элементов и их зависимость от атомной массы, существуют и другие схемы, которые могут оказать помощь при изучении химии. Например, существуют таблицы растворимости и электроотрицательности веществ . По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Например, существуют таблицы растворимости и электроотрицательности веществ . По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Если это буква «р», то вещество полностью растворимо в воде в нормальных условиях. При наличии буквы «м» — вещество малорастворимое, а при наличии буквы «н» — оно почти не растворяется. Если стоит знак «+», — соединение не образует осадок и без остатка реагирует с растворителем. Если присутствует знак «-», это означает, что такого вещества не существует. Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Еще одна полезная таблица – ряд активности металлов. В нем располагаются все металлы по увеличении степени электрохимического потенциала. Начинается ряд напряжения металлов с лития, заканчивается золотом. Считается, что чем левее занимает место в данном ряду металл, тем он более активен в химических реакциях. Таким образом, самым активным металлом считается металл щелочного типа литий. В списке элементов ближе к концу так же присутствует водород. Считается, что металлы, которые расположены после него, являются практически неактивными. Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Таблица Менделеева картинки в хорошем качестве
Данная схема является одним из крупнейших достижений в области химии. При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
Всего было разработано больше сотни видов таблицы , отличающихся представлением, формой и графическим представлением. Они используются в разных областях науки, либо совсем не применяются. В настоящее время новые конфигурации схемы продолжают разрабатываться исследователями. В качестве основного варианта используется либо короткая, либо длинная схема в отличном качестве.
Вольфрам – Информация об элементе, свойства и применение
Расшифровка:
Химия в ее элементе: вольфрам
(Promo)
Вы слушаете «Химию в ее стихии», представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе сверхзвуковые стали, быстрые формулы автомобилей и разочарование испанских ученых. Но о чем они спорят? Вот Кэтрин Холт.
Но о чем они спорят? Вот Кэтрин Холт.
Кэтрин Холт
Что в имени? Как мы вообще решаем, как называть элемент? Одно и то же имя элемента на всех языках? Это имеет значение? А кто решает?
Что ж, ответ на последний вопрос прост – окончательное решение о наименовании элементов принимает IUPAC – Международный союз теоретической и прикладной химии. Ответ на остальные вопросы, в основном, зависит от обстоятельств! Возьмем, к примеру, элемент 74 – или, как мы называем его по-английски, – вольфрам.Вы когда-нибудь задумывались, почему его символ – W? Химики во многих европейских странах не должны задаваться вопросом, почему – потому что они называют это Вольфрамом. Путаница двух названий возникает из ранней минералогии. Название «вольфрам» происходит от старого шведского названия «тяжелый камень» – названия известного вольфрамсодержащего минерала. Название «вольфрам» происходит от другого минерала, вольфрамита, который также имеет высокое содержание элемента, который мы называем вольфрамом.
До недавнего времени оба названия – вольфрам и вольфрам – были включены в «Номенклатуру неорганической химии – Рекомендации ИЮПАК» или «Красную книгу», как ее называют в кругах ИЮПАК.Однако в 2005 году термин «вольфрам» был исключен, и вольфрам стал единственным официальным названием этого элемента ИЮПАК. Однако вольфрам не сдался без боя! В частности, испанские химики были недовольны этим изменением – не в последнюю очередь потому, что их соотечественникам братьям Делуяр приписывают открытие элемента и его выделение из минерала вольфрамита. В своей первоначальной статье братья Делхуяр запросили название вольфрам для недавно изолированного элемента, сказав: «Мы назовем этот новый металлический вольфрам, взяв его название из материала, из которого он был извлечен.это название больше подходит, чем вольфрам … потому что вольфрамит – это минерал, который был известен задолго до …, по крайней мере, среди минералогов, а также потому, что название вольфрам принято почти во всех европейских языках . .. .. “
.. .. “
Хотя это может быть убедительным аргументом, ИЮПАК утверждает, что его рабочий язык – английский, и поэтому наиболее подходящим названием является вольфрам. символ элемента – W.То же самое верно и для ряда других элементов, таких как калий, ртуть и серебро, символы которых не имеют никакого отношения к их английским названиям.
Однако мне кажется маловероятным, что такое красочное название, как вольфрам, будет забыто. Если вам интересно, считается, что оно произошло от немецкого слова «волчья пена». Много веков назад среднеевропейские оловоплавильные фабрики заметили, что когда в оловянной руде присутствует определенный минерал, их выход олова значительно снижается. Они назвали этот минерал «волчьей пеной», потому что, по их словам, он пожирал олово так же, как волк пожирает овцу! Таким образом, со временем эта вольфрамсодержащая руда получила название «вольфрамит».
В отличие от полумифической роли вольфрама в ранней металлургии, в наши дни применение вольфрама является высокотехнологичным, благодаря его твердости, стабильности и высокой температуре плавления.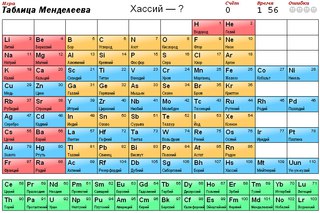 В настоящее время они используются в качестве электродов, нагревательных элементов и эмиттеров поля, а также в качестве нитей в лампочках и электронно-лучевых трубках. Вольфрам обычно используется в сплавах тяжелых металлов, таких как быстрорежущая сталь, из которых изготавливаются режущие инструменты. Он также используется в так называемых «суперсплавах» для образования износостойких покрытий.Его плотность делает его полезным в качестве балласта в самолетах и автомобилях Формулы-1 и, что еще более спорно, в качестве сверхзвуковой шрапнели и бронебойных боеприпасов в ракетах.
В настоящее время они используются в качестве электродов, нагревательных элементов и эмиттеров поля, а также в качестве нитей в лампочках и электронно-лучевых трубках. Вольфрам обычно используется в сплавах тяжелых металлов, таких как быстрорежущая сталь, из которых изготавливаются режущие инструменты. Он также используется в так называемых «суперсплавах» для образования износостойких покрытий.Его плотность делает его полезным в качестве балласта в самолетах и автомобилях Формулы-1 и, что еще более спорно, в качестве сверхзвуковой шрапнели и бронебойных боеприпасов в ракетах.
Мне кажется, что название вольфрам, или «тяжелый камень», оправдано этими применениями, в которых используются его прочность и плотность. Я рад, однако, что рождение химии в деятельности этих древних металлургов и минералогов до сих пор отмечается использованием символа W для элемента 74. Это гарантирует, что мы никогда не забудем, что было время, не так давно назад, когда многие химические процессы можно было объяснить только с помощью метафор.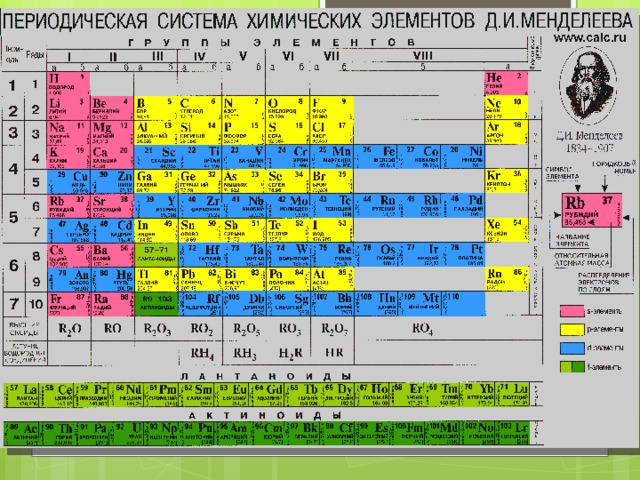
Крис Смит
Я всегда помнил, что вольфрамовая буква W означает неправильный символ, но можете ли вы вспомнить одну букву алфавита, которая не используется в периодической таблице? Теперь есть над чем задуматься. А пока большое спасибо Кэтрин Холт из UCL.
На следующей неделе мы познакомимся с элементом, который был представлен миру, справедливости ради, довольно необычным способом.
Брайан Клегг
Первый намек на существование америция был дан не в статье для известного журнала, а в детской радиовикторине 1945 года.Сиборг появился в качестве гостя на шоу MBC Quiz Kids, где один из участников спросил его, производят ли они какие-либо другие новые элементы, а также плутоний и нептуний. Поскольку пять дней спустя Сиборг должен был официально объявить об открытии америция, он отказался от его существования вместе с 96-м элементом.
Крис Смит
И Брайан Клегг расскажет историю радиоактивного элемента америция и того, как он удерживается. Я надеюсь, что вы сможете присоединиться к нам в безопасности дома на следующей неделе в Химии в ее стихии.Я Крис Смит, спасибо за внимание и до свидания.
Я надеюсь, что вы сможете присоединиться к нам в безопасности дома на следующей неделе в Химии в ее стихии.Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
вольфрам | Использование, свойства и факты
вольфрам (W) , также называемый вольфрам , химический элемент, исключительно прочный тугоплавкий металл группы 6 (VIb) периодической таблицы, используемый в сталях для повышения твердости и прочности, а также в нити ламп.
Металлический вольфрам был впервые выделен (1783 г.) испанскими химиками и минералогами Хуаном Хосе и Фаусто Эльхуяром путем восстановления углем оксида (WO 3 ), полученного из минерала вольфрамита.Ранее (1781 г.) шведский химик Карл Вильгельм Шееле открыл вольфрамовую кислоту в минерале, теперь известном как шеелит, и его соотечественник Торберн Бергман пришел к выводу, что из кислоты можно получить новый металл. Названия tungsten и wolfram использовались для металла с момента его открытия, хотя везде преобладает символ W Йена Якоба Берцелиуса. В Великобритании и США предпочтительным является вольфрам ; в Германии и ряде других европейских стран принимается вольфрам .
Названия tungsten и wolfram использовались для металла с момента его открытия, хотя везде преобладает символ W Йена Якоба Берцелиуса. В Великобритании и США предпочтительным является вольфрам ; в Германии и ряде других европейских стран принимается вольфрам .
Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 74 | ||||
|---|---|---|---|---|---|
| атомный вес | 183,85 | ||||
| точка плавления | 3410 ° C (6,152 ° F) | 1190 10,220 ° F) | |||
| плотность | 19,3 г / см 3 при 20 ° C (68 ° F) | ||||
| степени окисления | +2, +3, +4, +5, +6 | ||||
| электронная конфигурация | [Xe] 4 f 14 5 d 4 6 s 2 |
Возникновение, свойства и использование
Количество вольфрама в земной коре оценивается в 1.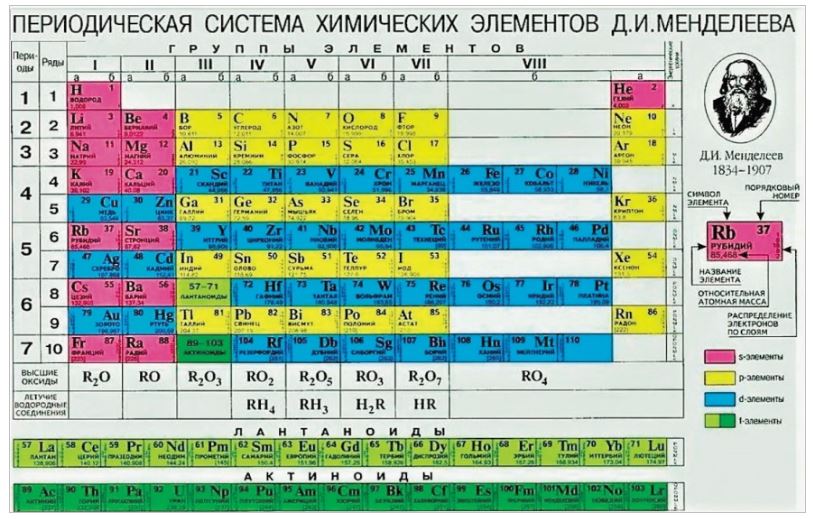 5 частей на миллион, или около 1,5 грамма на тонну породы. Китай является основным производителем вольфрама; в 2016 году он произвел более 80 процентов всего добытого вольфрама и содержал почти две трети мировых запасов. Вьетнам, Россия, Канада и Боливия производят большую часть остатка. Вольфрам не встречается в виде свободного металла. Он примерно такой же богатый, как олово или молибден, на который он похож, и наполовину менее богат, чем уран. Хотя вольфрам встречается в виде вольфрамита-дисульфида вольфрама, WS 2 , наиболее важными рудами в данном случае являются вольфраматы, такие как шеелит (вольфрамат кальция, CaWO 4 ), столзит (вольфрамат свинца, PbWO 4 ) и вольфрамит. – твердый раствор или смесь или обоих изоморфных веществ вольфрамата железа (FeWO 4 ) и марганцевого вольфрамата (MnWO 4 ).
5 частей на миллион, или около 1,5 грамма на тонну породы. Китай является основным производителем вольфрама; в 2016 году он произвел более 80 процентов всего добытого вольфрама и содержал почти две трети мировых запасов. Вьетнам, Россия, Канада и Боливия производят большую часть остатка. Вольфрам не встречается в виде свободного металла. Он примерно такой же богатый, как олово или молибден, на который он похож, и наполовину менее богат, чем уран. Хотя вольфрам встречается в виде вольфрамита-дисульфида вольфрама, WS 2 , наиболее важными рудами в данном случае являются вольфраматы, такие как шеелит (вольфрамат кальция, CaWO 4 ), столзит (вольфрамат свинца, PbWO 4 ) и вольфрамит. – твердый раствор или смесь или обоих изоморфных веществ вольфрамата железа (FeWO 4 ) и марганцевого вольфрамата (MnWO 4 ).
Для вольфрама руды концентрируются с помощью магнитных и механических процессов, а затем концентрат плавится с щелочью. Неочищенные расплавы выщелачивают водой с получением растворов вольфрамата натрия, из которых при подкислении осаждается водный триоксид вольфрама, а затем оксид сушат и восстанавливают до металла водородом.
Вольфрам довольно устойчив к воздействию кислот, за исключением смесей концентрированной азотной и плавиковой кислот, и он может быстро подвергаться воздействию щелочных окисляющих расплавов, таких как плавленые смеси нитрата калия и гидроксида натрия или пероксида натрия; водные щелочи, однако, не действуют.Он инертен по отношению к кислороду при нормальной температуре, но легко соединяется с ним при нагревании красного цвета с образованием триоксидов и подвергается действию фтора при комнатной температуре с образованием гексафторидов.
Металлический вольфрам имеет блеск от никелево-белого до сероватого цвета. Среди металлов он имеет самую высокую температуру плавления при 3410 ° C (6170 ° F), самую высокую прочность на разрыв при температурах более 1650 ° C (3002 ° F) и самый низкий коэффициент линейного теплового расширения (4,43 × 10 ). -6 на ° C при 20 ° C [68 ° F]).Вольфрам обычно хрупкий при комнатной температуре. Однако чистый вольфрам можно сделать пластичным путем механической обработки при высоких температурах, а затем из него можно получить очень тонкую проволоку. Вольфрам сначала был коммерчески использован в качестве материала нити накала лампы, а затем использовался во многих электрических и электронных устройствах. Он используется в форме карбида вольфрама для изготовления очень твердых и вязких штампов, инструментов, калибров и бит. Много вольфрама идет на производство вольфрамовой стали, а часть из них использовалась в аэрокосмической промышленности для изготовления горловин сопел ракетных двигателей и поверхностей входа на переднюю кромку.(Для получения информации о добыче, извлечении и применении вольфрама, см. обработка вольфрама.)
Вольфрам сначала был коммерчески использован в качестве материала нити накала лампы, а затем использовался во многих электрических и электронных устройствах. Он используется в форме карбида вольфрама для изготовления очень твердых и вязких штампов, инструментов, калибров и бит. Много вольфрама идет на производство вольфрамовой стали, а часть из них использовалась в аэрокосмической промышленности для изготовления горловин сопел ракетных двигателей и поверхностей входа на переднюю кромку.(Для получения информации о добыче, извлечении и применении вольфрама, см. обработка вольфрама.)
Природный вольфрам представляет собой смесь пяти стабильных изотопов: вольфрам-180 (0,12 процента), вольфрам-182 (26,50 процента), вольфрам-183 (14,31 процента), вольфрам-184 (30,64 процента) и вольфрам-186 (28,43 процента). ). Кристаллы вольфрама изометричны и, как показывает рентгеноструктурный анализ, имеют объемно-центрированную кубическую форму.
Соединения
Вольфрам относительно инертен с химической точки зрения.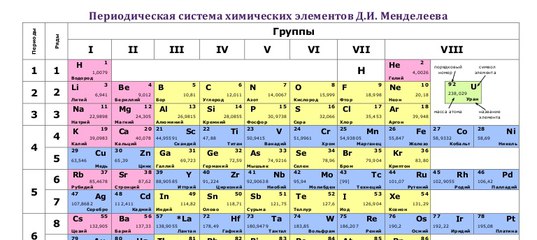 Однако были получены соединения, в которых элемент имеет степень окисления от 0 до +6. Состояния выше +2, особенно +6, являются наиболее распространенными. В состояниях +4, +5 и +6 вольфрам образует множество комплексов.
Однако были получены соединения, в которых элемент имеет степень окисления от 0 до +6. Состояния выше +2, особенно +6, являются наиболее распространенными. В состояниях +4, +5 и +6 вольфрам образует множество комплексов.
Наиболее важным соединением вольфрама является карбид вольфрама (WC), который отличается своей твердостью (9,5 по шкале Мооса, где максимум, алмаз, равен 10). Он используется отдельно или в сочетании с другими металлами для придания износостойкости чугуну и режущим кромкам пил и сверл.Вольфрам также образует твердые, тугоплавкие и химически инертные межузельные соединения с бором, азотом и кремнием при прямой реакции с этими элементами при высоких температурах.
Последней редакцией и обновлением этой статьи был Эрик Грегерсен.Вольфрам W (элемент 74) из таблицы Менделеева
74 Вт (вольфрам)
Карточка из вольфрама
Загрязненный металл является хрупким и обрабатывается с трудом, а Чистый вольфрам – это блестящий металл от серого стального до белого олова, который можно прядать, вытягивать, ковать, прессовать и резать ножовкой.
Это самый тяжелый и самый огнеупорный (жаростойкий) металл на земле .
Обладает наивысшим пределом прочности на разрыв при температуре выше 1650 o C.
Металл окисляется (химически соединяется с кислородом) в воздухе , и его необходимо защищать при повышенных температурах.
Благодаря отличной коррозионной стойкости , большинство минеральных кислот очень слабо воздействуют на металл.
Термическое расширение примерно такое же, как у стекла из боросиликатного стекла (с использованием диоксида кремния и триоксида бора), что делает металлом , пригодным для изготовления уплотнений стекло-металл.
Куб чистого вольфрама (38,02 мм) 1 кг
Идентификационный номер
Номер CAS: CAS7440-33-7
Номер CID: CID23964
Класс опасности DOT: 4.1
Номер DOT: 3089
Номер RTECS: RTECSYO7175000
Альтернативное название: Вольфрам, произносится как
Произношение: Тунг-стан
Внешний вид: Серовато-белый, блестящий
Массовый номер: 184
Стандартный атомный вес: 183. 84 г / моль
84 г / моль
Атомный номер (Z): 74
Электронов: 74
Протонов: 74
Нейтронов: 110
Период: 6
Группа: 6
Блок: d
Категория элемента: Переходный металл
Электронов на оболочку: K2, L8 , M18, N32, O12, P2
Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 10 2 5p 6 4f 14 5d 4 6s 2
Вольфрамовая электронная конфигурация
Тепловые свойства вольфрама Фаза: твердое вещество
Точка плавления: 3695 K (3422 o C, 6192 o F)
Точка кипения: 6203 K (5930 o C, 10706 o F)
Температура Дебая: 310 K (36 .85 o C, 98,33 o F)
Теплота плавления: 52,30 кДж / моль
Теплота испарения: 775 кДж / моль
Удельная теплоемкость: 132 Дж / (кг · К)
Молярная теплоемкость: 24,27 Дж / (моль. K)
K)
Тепловое расширение: 4,5 мкм / (м ∙ K)
Теплопроводность: 173 Вт / (м ∙ K)
Электропроводность: 20 × 10 6 См / м
A Удельное электрическое сопротивление: 52,8 нОм ∙ м
A Электрический тип: проводник
Критическая точка (сверхпроводящая точка): 0.015 К (-273,13 o C, -459,63 o F)
A Тип магнитного поля: парамагнитный
Магнитная восприимчивость (x моль ): + 59 × 10 -6 см 3 / моль
Объемная магнитная восприимчивость: 0,0000884
Массовая магнитная восприимчивость: 4,59 × 10 -9 м 3 / кг
Молярная магнитная восприимчивость: 0,844 × 10 -9 м 3 / моль
Плотность: 19.3 г / см 3 (в твердом состоянии) 17,6 г / см 3 (в жидкости при MP)
Молярный объем: 0,0000095501 м 3 / моль
Модуль Юнга: 411 ГПа
Модуль упругости: 161 ГПа
Твердость по Моосу : 7,5
Объемный модуль: 310 ГПа
Коэффициент Пуассона: 0,28
Твердость по Виккеру: 3430-4600 МПа
Твердость по Бринеллю: 2000-4000 МПа
Скорость звука: 4620 м / с
Степени окисления: -4, -2, -1, 0, 1, 2, 3, 4, 5, 6
Валентные электроны: 5d 4 6s 2
Заряд ионов: W 6+
Энергии ионизации: 1-я: 770 кДж. моль 2-я: 1700 кДж / моль
моль 2-я: 1700 кДж / моль
Ионный радиус: 62 пм
Атомный радиус: 139 пм (эмпирический)
Ван-дер-Ваальс: 210 пм
Ковалентный радиус: 162 ± 7 пм
Заполняющая орбиталь: 5d 4
Кристаллическая структура : Кубическая с центрированным телом
Углы решетки: π / 2, π / 2, π / 2
Постоянная решетки: 316,52, 316,52, 316,52 pm
Параметры сетки: a = 3,160 Å
Имя пространственной группы: lm_3m
Номер пространственной группы: 229
Телоцентрированный кубический (BCC)
Реакционная способность вольфрама Электроотрицательность: 2.36 (шкала Поля)
Валентность: +6
Сродство к электрону: 78,6 кДж / моль
Half Life: Stable (Infinity)
Lifetime: Stable (Infinity)
Квантовое число: 5 D 0
Нейтронное сечение (Brans): 18,4
Поглощение нейтронов по массе: 0,0036
Изотопы: 180 W 181 Вт 182 Вт 183 Вт 184 Вт 185 Вт 186 Вт
| Изотоп | Обилие (%) | Атомная масса г / моль | Период полураспада (т 1/2 ) |
| 180 Вт | 0. 12 12 | 179,946 | 1,8 × 10 18 y |
| 181 Вт | Syn | – | 121,2 д |
| 182 Вт | 26,50 | 181,949 | Конюшня |
| 183 Вт | 14,31 | 182,948 | Конюшня |
| 184 Вт | 30,64 | 183,950 | Конюшня |
| 185 Вт | Syn | – | 75 д |
| 186 Вт | 28.43 | 185,952 | Конюшня |
Мелкодисперсный металлический вольфрам пирофорный (склонен к самовозгоранию).
Металл не вступает в реакцию с воздухом при нормальной температуре, но при повышенной температуре (раскаленный докрасна) образует триоксид вольфрама:
2W (s) + 3 O 2 (г) → 2 WO 3 ( с)
Не реагирует с водой при комнатной температуре:
Реагирует напрямую с фтором при комнатной температуре. и образует фторид вольфрама (VI)):
и образует фторид вольфрама (VI)):
Вт (т) + 3 F 2 (г) → WF 6 (г) [бесцветный]
Реагирует с другими Галогены требует тепла, по крайней мере 250 o C , и он образует галогениды вольфрама (VI):
Вт (с) + 3 Cl 2 (г) → WCl 6 (с) [темно-синий] (хлорид вольфрама (VI))
2 Вт (s) + 5 Cl 2 (g) → 2 WCl 5 (s) [темно-зеленый] (хлорид вольфрама (V))
W (s) + 3 Br 2 (g) → WBr 6 (с) [темно-синий] (бромид вольфрама (VI))
Вт (с) + 3 I 2 (г) → WI 6 (с) (иодид вольфрама (VI))
Металл не реагирует с большинством кислот при нормальных условиях.
История вольфрама Наименование: Шведский язык: вольфрам (тяжелый камень): W символ от немецкого названия вольфрам, названного в честь вольфрамита.
Название: Торберн Бергман (1781)
Открытие: Карл Вильгельм Шееле (1781) в Вергаре, Испания
Первая изоляция: Хуан Хосе Эльхуяр и Фаусто Эльхуяр (1783)
Вольфрам из его сплавов широко используется в качестве нити накала электрических лампочек, электронных и телевизионных трубок, а также для испарения металлов.
Но эти виды использования были прекращены на во многих странах, поскольку они не очень энергоэффективны, даже если они производят на больше тепла, , чем света.
Вольфрам имеет наивысшую температуру плавления (3400 o C) из всех других металлов и легирован другими металлами для придания им прочности.
Он используется во многих высокотемпературных приложениях, таких как вольфрамовая дуговая сварка (TIG), электроды , нагревательные элементы в высокотемпературных печах и т. Д..
Карбид вольфрама (WC) чрезвычайно (чрезвычайно) твердый , и его получают путем смешивания порошка вольфрама и угля и нагревания до 2200 ° C.
Это очень важно для металлообрабатывающего , где он производит отличные режущие и сверлильные инструменты , включая новую «безболезненную» стоматологическую дрель, которая вращается на сверхвысоких скоростях.
Он также в основном используется в нефтяной промышленности, и горнодобывающей промышленности.
Вольфраматы магния (диоксид магния, вольфрам, MgWO 4 ) и Кальций широко используются в люминесцентном освещении.
Он также используется в рентгеновских трубках , которые имеют вольфрамовую эмиттерную катушку , где экран, используемый для просмотра рентгеновских лучей, полагается (зависит от полного доверия) на люминофорах вольфраматов кальция и магния для преобразования рентгеновских лучей в синий видимый свет.
Прочие соли вольфрама используются в химической промышленности и дублении , где дисульфид вольфрама (WS 2 ) представляет собой сухую и высокотемпературную смазку , которая устойчива до 500 o С.
Вольфрамовые бронзы и другие соединения вольфрама используются в красках .
Он также используется в технологии микрочипов и жидкокристаллических дисплеях (LCD).
Биологическая роль вольфрама Это нетоксичный металл , но его соединение может иметь основных рисков для здоровья , как и заражение кожи и глаз при контакте вдыхание пыли может вызвать раздражение легких и слизистой оболочки .
Некоторые бактерии используют вольфрам в ферменте для восстановления карбоновых кислот (органическая кислота, содержащая карбоксильную группу) до альдегидов (органическое соединение, содержащее функциональную группу со структурой –CHO).
Основными вольфрамсодержащими рудами являются вольфрамит ((Fe, Mn) WO 4 ), шеелит (CaWO 4 ) и ферберит (FeWO 4 ).
В промышленных масштабах металл получают путем восстановления оксида вольфрама (WO 2 ) углеродом или водородом.
Ежегодное мировое производство составляет около 90 000 тонн.
5 × 10 -8 % (В Вселенной )
1,2 × 10 -5 % (В Метеоритах )
4 × 10 -7 % (В Солнце )
0,00011% ( В земной коре )
1,2 × 10 -8 % (В океанах )
Минерал вольфрамит
Минеральные кристаллы шеелита (золотого), ферберита (черного) и флюорита (белого цвета)
3 ведущих мировых производителя вольфрама 1) Китай
2) Россия
3) Боловия
1) Китай
2) Россия
3) США
Вольфрам Цена: Чистый (99. 95%) Цена металла составляет около $ 149 за кг (килограмм)
95%) Цена металла составляет около $ 149 за кг (килограмм)
# Вольфрам
Другие элементы FlashCards
Вт Информация об элементе из вольфрама: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История вольфрама
Элемент Вольфрам был открыт Карлом Вильгельмом Шееле в году 1783 год в Испании . Вольфрам получил свое название от шведского слова tungsten, «тяжелый камень» (W – вольфрам, старое название вольфрамового минерала вольфрамита).
Присутствие вольфрама: изобилие в природе и вокруг нас
В таблице ниже показано содержание вольфрама во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура вольфрама
Твердотельная структура вольфрама – это кубических центрированных тел.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| б | с | |
|---|---|---|
| 316.52 | 316,52 | 316.52 м. |
и углы между ними Решетки Углы (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений (
x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства вольфрама
Атомы вольфрама имеют 74 электрона и структура электронной оболочки [2, 8, 18, 32, 12, 2] с символом атомного термина (квантовые числа) 5 D 0 .
Оболочечная структура вольфрама – количество электронов на энергию уровень
| n | с | с. | д | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | M | 2 | 6 | 10 | |
| 4 | N | 2 | 6 | 10 | 14 |
| 5 | O | 2 | 6 | 4 | |
| 6 | -П, | 2 |
Основное состояние электронной конфигурации вольфрама – нейтраль Атом вольфрама
Электронная конфигурация нейтрального атома вольфрама в основном состоянии
[Xe] 4f14 5d4 6s2. Часть конфигурации вольфрама, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Xe]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 4f14 5d4 6s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации вольфрама, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Xe]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 4f14 5d4 6s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального вольфрама
Полная электронная конфигурация в основном состоянии для атома вольфрама, Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d4 6s2
Атомная структура вольфрама
Атомный радиус вольфрама 193 пм, а его ковалентный радиус 146 пм.
Атомный спектр вольфрама
Химические свойства вольфрама: Энергии ионизации вольфрама и сродство к электрону
Электронное сродство вольфрама составляет 78,6 кДж / моль.
Энергия ионизации вольфрама.
Энергия ионизации вольфрама
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 770 |
| 2 | 1.7 × 103 |
Физические свойства вольфрама
Физические свойства вольфрама указаны в таблице ниже.
| Плотность | 19,25 г / см3 |
| Молярный объем | 9,550 12987013 см3 |
Упругие свойства
Твердость вольфрама – Испытания для измерения твердости элемента
Электрические свойства вольфрама
Вольфрам – проводник электричества. Ссылаться на
Таблица
ниже электрические свойства вольфрама
Ссылаться на
Таблица
ниже электрические свойства вольфрама
Теплопроводность и теплопроводность вольфрама
Магнитные свойства вольфрама
Оптические свойства вольфрама
Акустические свойства вольфрама
Термические свойства вольфрама – энтальпии и термодинамика
Термические свойства вольфрама
см. В таблице ниже.Энтальпии вольфрама
Изотопы вольфрама – ядерные свойства вольфрама
Изотопы родия.Встречающийся в природе вольфрам имеет 5 стабильный изотоп – 180 Вт, 182 Вт, 183 Вт, 184 Вт, 186 Вт.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 158 Вт | ||||
| 159 Вт | ||||
| 160 Вт | ||||
| 161 Вт | ||||
| 162 Вт | ||||
| 163 Вт | ||||
| 164 Вт | ||||
| 165 Вт | ||||
| 166 Вт | ||||
| 167 Вт | ||||
| 168 Вт | ||||
| 169 Вт | ||||
| 170 Вт | ||||
| 171 Вт | ||||
| 172 Вт | ||||
| 173 Вт | ||||
| 174 Вт | ||||
| 175 Вт | ||||
| 176 Вт | ||||
| 177 Вт | ||||
| 178 Вт | ||||
| 179 Вт | ||||
| 180Вт | 0. 12% 12% | Стабильный | Нет данных | |
| 181 Вт | ||||
| 182 Вт | 26. 5% 5% | Стабильный | Нет данных | |
| 183 Вт | 14. 31% 31% | Стабильный | Нет данных | |
| 184 Вт | 30. 64% 64% | Стабильный | Нет данных | |
| 185 Вт | ||||
| 186 Вт | 28. 43% 43% | Стабильный | Нет данных | |
| 187 Вт | ||||
| 188 Вт | ||||
| 189 Вт | ||||
| 190Вт | ||||
| 191 Вт | ||||
| 192 Вт |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Периодическая таблица – Годзимо
В этом разделе мы сосредоточимся на классификации элементов в периодической таблице.
Было бы удобно иметь периодическую таблицу Менделеева, на которую можно смотреть, пока вы занимаетесь этим.
В периодической таблице химические элементы упорядочены по их атомным номерам, электронным конфигурациям и повторяющимся химическим свойствам. Такой порядок позволяет нам легко определять периодические тенденции, поскольку все элементы с аналогичным поведением находятся в одной строке.
В таблице есть группы в столбцах и периоды в строках. Просто помните, что номер периода совпадает с количеством электронов во внешней энергетической оболочке элемента.
Элементы также увеличиваются в атомном номере в каждом периоде или строке на единицу. Пример – Li, Be, B, C, N, O, F, Ne (второй период).
Периодическая таблица составлена так, что каждый период представляет собой добавление электрона к каждому последовательному элементу. Мы разбиваем его на блоки s, p, d и f, которым соответствует внешняя подоболочка.
Большая часть правой части p-блока претерпевает реакции, которые характеризуются способностью принимать электроны. Следовательно, более электроотрицательные элементы p-блока более реактивны, поскольку они легче принимают электроны. Например, кислород более активен, чем сера и т. Д.
Следовательно, более электроотрицательные элементы p-блока более реактивны, поскольку они легче принимают электроны. Например, кислород более активен, чем сера и т. Д.
В таблице элементы сгруппированы в группы со схожими химическими свойствами. Металлы и неметаллы разделены лестницей.
Элементы – это вещества, состоящие только из одного типа атомов – это означает, что существует около 100 различных элементов. Однако в природе на Земле встречается только 92 элемента.Другие элементы могут существовать очень короткое время, и их нужно создавать искусственно.
Атомы с разным числом протонов должны быть разными элементами. Все атомы одного и того же элемента имеют одинаковое количество протонов – например, каждый атом кислорода имеет восемь протонов в своем ядре.
Теперь вы знаете основные правила, по которым строится таблица Менделеева, давайте рассмотрим несколько примеров!
Например, если вас попросили узнать, сколько протонов, нейтронов и электронов имеет атом вольфрама, если его массовое число равно 184, вы можете использовать периодическую таблицу, чтобы помочь вам.
Атомный номер вольфрама 74, поэтому в атоме вольфрама 74 протона. Массовое число = количество протонов + количество нейтронов = 184.
Итак, число нейтронов = относительная атомная масса – число протонов = 184 – 74 = 110. Число электронов = число протонов. Итак, количество электронов = 74.
Другой пример: фосфор входит в пятую группу периодической таблицы. Итак, как бы вы вычислили, сколько электронов имеет атом фосфора на его внешнем энергетическом уровне?
Что ж, мы знаем, что способ организации периодической таблицы означает, что элементы в одной группе имеют одинаковое количество электронов на их внешнем энергетическом уровне.
Это число равно номеру группы. Фосфор находится в пятой группе, поэтому он имеет пять электронов на внешнем энергетическом уровне. Атомный номер фосфора = 15. Итак, у фосфора 15 протонов и 15 электронов. Электронная структура = 2,8,5.
СвязанныеБиологически релевантные металлы периодической таблицы элементов
Ссылки
[1] (последний доступ 10 марта 2019 г. ). Поиск в Google Scholar
). Поиск в Google Scholar
[2] (последний доступ 10 марта 2019 г.) .Искать в Google Scholar
[3] Информация о биологическом воздействии ионов металлов содержится в серии Ионы металлов в науках о жизни ( MILS ). Последний том в серии: Основные металлы в медицине. Терапевтическое использование и токсичность ионов металлов в клинике , MILS-19 (гость: PL Carver; редакторы серии: A. Sigel, E. Freisinger, RKO Sigel), Walter de Gruyter GmbH, Берлин / Бостон, 2019 , стр. 1–412. (Рецензия на эту книгу принадлежит Х.Шмидбаур в Z. Naturforsch . 2019 , 74b , 533–534; этот выпуск) .Поиск в Google Scholar
[4] Э. Фрайзингер, RKO Sigel, Chimia 2019 , 73 , 1–9. Поиск в Google Scholar
[5] RJP Williams, JJR Fraústo da Сильва, Естественный отбор химических элементов , Clarendon Press, Oxford, 1996 , стр. 1–646. Поиск в Google Scholar
[6] W. Maret, Met.Ions Life Sci. 2019 , 19 , 231–251. Поиск в Google Scholar
Maret, Met.Ions Life Sci. 2019 , 19 , 231–251. Поиск в Google Scholar
[7] A. Sigel, H. Sigel, RKO Sigel (Eds.), Ионы щелочных металлов: их роль для жизни , MILS-16 , Springer International Publishing, Cham (Швейцария) 2016 , стр. 1–628. Поиск в Google Scholar
[8] PC Hauser, Met. Ions Life Sci. 2016 , 16 , 11–25. Искать в Google Scholar
[9] И. Бертини, А.Sigel, H. Sigel (Eds.), Handbook on Metalloproteins , Marcel Dekker, Inc., New York and Basel, 2001 , pp. 1–1182. Относительно натрия и калия см. Главу 2 (стр. 9–37) Т. М. Ларсена и Г. Х. Рида. [Сейчас доступно через Taylor & Francis, Бока-Ратон, Лондон]. Поиск в Google Scholar
[10] A. M. P. Romani, Arch. Биохим. Биофиз. 2011 , 512 , 1–23. Поиск в Google Scholar
[11] A. M. P. Romani, Met. Ions Life Sci. 2013 , 13 , 49–79. Поиск в Google Scholar
Поиск в Google Scholar
[12] См. Главу 4 (стр. 59–91) A. Matte и L. T. J. Delbaere в Ref. [9]. Искать в Google Scholar
[13] R.K.O. Sigel, H. Sigel, Compr. Неорг. Chem. II 2013 , 3 , 623–660. Поиск в Google Scholar
[14] H. Schmidbaur, H. G. Classen, J. Helbig, Angew. Chem. Int. Эд. Англ. 1990 , 29 , 1090–1103. Поиск в Google Scholar
[15] M.Брини, Д. Оттолини, Т. Кали, Э. Карафоли, Met. Ions Life Sci. 2013 , 13 , 81–137. Поиск в Google Scholar
[16] См. Главу 5 (стр. 93–152) A. Muranyi и B. E. Finn в Ref. [9]. Искать в Google Scholar
[17] M. Brini, T. Calì, D. Ottolini, E. Carafoli, Met. Ions Life Sci. 2013 , 12 , 119–168. Поиск в Google Scholar
[18] O. Kumberger, H. Schmidbaur, Chem. Unserer Zeit 1993 , 27 , 310–316.Искать в Google Scholar
[19] M. R. Buchner, Nachr. Chem . 2018 , 66 , 1137–1140. Поиск в Google Scholar
R. Buchner, Nachr. Chem . 2018 , 66 , 1137–1140. Поиск в Google Scholar
[20] М. Мюллер, М. Р. Бюхнер, Angew. Chem . Внутр. Эд. 2018 , 57 , 9180–9184. Поиск в Google Scholar
[21] NJ Birch, C. Padham, в Handbook on Metals in Clinical and Analytical Chemistry (Eds: HG Seiler, A. Sigel , H. Sigel), Marcel Dekker Inc., Нью-Йорк и Базель, 1994 , стр.255–258. Искать в Google Scholar
[22] K. M. Erikson, M. Aschner, Met. Ions Life Sci. 2019 , 19 , 253–266. Поиск в Google Scholar
[23] F. Thévenod, Met. Ions Life Sci. 2018 , 18 , 437–467. Поиск в Google Scholar
[24] Я. Гарсия, А. Барвинска-Сендра, Э. Таррант, Е. П. Скаар, К. Дж. Уолдрон, Т. Е. Кель-Фи, PLOS Pathogens 2017 , 13 , e1006125. DOI: 10.1371 / journal.ppat.1006125. 10.1371 / journal.ppat.1006125 Искать в Google Scholar
10.1371 / journal.ppat.1006125 Искать в Google Scholar
[25] R. C. Hider, X. Kong, Met. Ions Life Sci. 2013 , 13 , 229–294. Поиск в Google Scholar
[26] Дж. Тиль, Дж. М. Бирн, А. Капплер, Б. Шинк, М. Пестер, Proc. Natl. Акад. Sci. США 2019 , 116 , 6897–6902. Поиск в Google Scholar
[27] М. Р. Сепеда, Л. МакГарри, Дж. М. Пеннингтон, Дж. Кшистек, М. Э. Строуп, Biochem.Биофиз. Acta 2018 , 1866 , 933–940. Поиск в Google Scholar
[28] EN Mirts, ID Petrik, P. Hosseinzadeh, MJ Nilger, Y. Lu, Science 2018 , 361 , 1098–1101. Поиск в Google Scholar
[29] EN Mirts, A. Bhagi-Damodaran, Y. Lu, Acc. Chem. Res. 2019 , 52 , 935–944. Поиск в Google Scholar
[30] K. Yamada, Met. Ions Life Sci. 2013 , 13 , 295–320.Искать в Google Scholar
[31] B. Kräutler, Chem. Евро. J. 2019 , 25 , 4870. Поиск в Google Scholar
Kräutler, Chem. Евро. J. 2019 , 25 , 4870. Поиск в Google Scholar
[32] См. Главу 13 (стр. 603–668) Дж. М. Пратта в Ref. [9]. Искать в Google Scholar
[33] V. Cracan, R. Banerjee, Met. Ions Life Sci. 2013 , 12 , 333–374. Поиск в Google Scholar
[34] R. G. Matthews, Met. Ions Life Sci. 2009 , 6 , 53–114.Искать в Google Scholar
[35] B. Kräutler, Met. Ions Life Sci. 2009 , 6 , 1–51. Поиск в Google Scholar
[36] W. C. Winkler, R. R. Breaker, Ann. Rev. Microbiol. 2005 , 59 , 487–517. Поиск в Google Scholar
[37] С. Галло, М. Оберхубер, Р.КО Сигель, Б. Кройтлер, ChemBioChem 2008 , 9 , 1408– 1414. Поиск в Google Scholar
[38] FJ Widner, A.Д. Лоуренс, Э. Дери, Д. Хелдт, С. Франк, К. Грубер, К. Вурст, М. Дж. Уоррен, Б. Кройтлер, Angew. Chem. Int. Эд. 2016 , 55 , 11281–11286. Поиск в Google Scholar
Кройтлер, Angew. Chem. Int. Эд. 2016 , 55 , 11281–11286. Поиск в Google Scholar
[39] B. Kräutler, Chem. Евро. J. 2015 , 21 , 11280–11287. Поиск в Google Scholar
[40] J.-F. Nierengarten, Chem. Евро. J. 2019 , 25 , 16–18. Поиск в Google Scholar
[41] I. Scheiber, R.Dringen, J. F. B. Mercer, Met. Ions Life Sci. 2013 , 13 , 359–387. Поиск в Google Scholar
[42] S. Blockhuys, P. Wittung-Stafshede, Int. J. Mol. Sci. 2017 , 18 , 871. DOI: 10.3390 / ijms18040871.10.3390 / ijms18040871 Искать в Google Scholar
[43] S. Blockhuys, P. Wittung-Stafshede, Biochem. Биофиз. Res. Commun. 2017 , 483 , 301–304. Искать в Google Scholar
[44] K.Э. Вест, Х. Ф. Хашеми, П. А. Кобайн, Met. Ions Life Sci. 2013 , 12 , 451–478. Поиск в Google Scholar
Поиск в Google Scholar
[45] C. Rensing, S. F. Devitt, Met. Ions Life Sci. 2013 , 12 , 417–450. Поиск в Google Scholar
[46] A. Robert, F. Benoit-Vical, Y. Liu, B. Meunier, Met. Ions Life Sci. 2019 , 19 , 17–48. Поиск в Google Scholar
[47] См. Главы 15 (стр. 709–762), 16 (стр.763–811) и 17 (стр. 813–856) М. А. Халкроу, П. Ф. Ноулз, С. Е. В. Филлипс; П. Ф. Линдли; А. Х. Вила, К. О. Фернандес; соответственно, в работе. [9]. Поиск в Google Scholar
[48] См. Главу 18 (стр. 857–880) П. Ф. Линдли в Ref. [9] .Поиск в Google Scholar
[49] См. Главу 20 (стр. 961–1000) Дж. Э. Фолкерса, Х. Ханзавы, Р. Боеленса в Ref. [9]. Искать в Google Scholar
[50] W. Maret, Met. Ions Life Sci. 2013 , 12 , 479–501.Поиск в Google Scholar
[51] См. Главу 19 (стр. 881–959) Д. С. Олда в Ref. [9]. Искать в Google Scholar
[52] J. Lopez, D.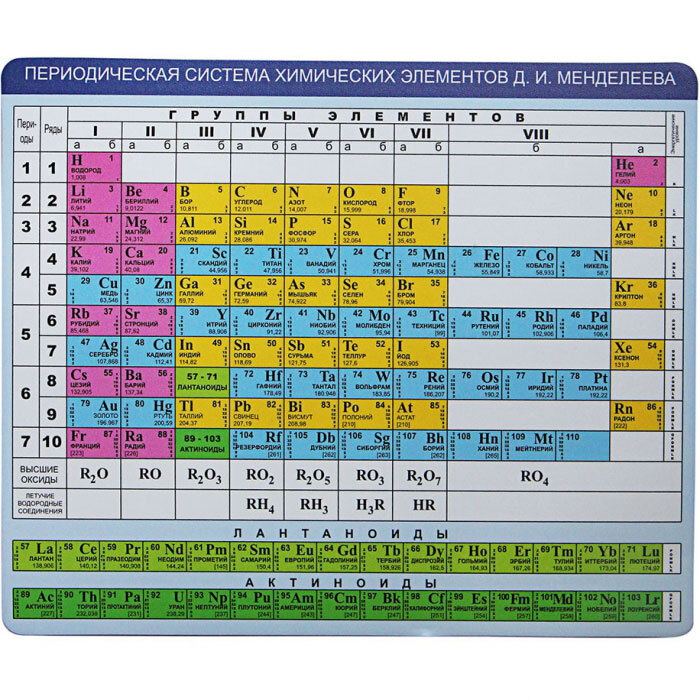 Ramchandani, L. Vahdat, Met. Ions Life Sci. 2019 , 19 , 303–330. Поиск в Google Scholar
Ramchandani, L. Vahdat, Met. Ions Life Sci. 2019 , 19 , 303–330. Поиск в Google Scholar
[53] A. Erxleben, Front. Chem. 2019 , 7 , 82. DOI: 10.33897fchem. 2019.00082.10.33897fchem. 2019.00082Поиск в Google Scholar
[54] См. Главу 21 (стр. 1001–1021) Э.Бабини, М. С. Виеццоли, в работе. [9]. Искать в Google Scholar
[55] E. Carmona, Chem. Евро. J. 2019 , 25 , 11–12. Поиск в Google Scholar
[56] См. Главу 22 (стр. 1023–1090) CD Гарнера, Р. Бэнхэма, С. Дж. Купера, Э. С. Дэвиса, Л. Дж. Стюарта в исх. [9]. Искать в Google Scholar
[57] G. Schwarz, A. A. Belaidi, Met. Ions Life Sci. 2013 , 13 , 415–450. Искать в Google Scholar
[58] R.R. Mendel, Met. Ions Life Sci. 2013 , 12 , 503–528. Поиск в Google Scholar
[59] D. Rehder, Met. Ions Life Sci. 2013 , 13 , 139–169. Поиск в Google Scholar
2013 , 13 , 139–169. Поиск в Google Scholar
[60] Д. К. Кранс, Лари Генри, Г. Кардифф, Б. И. Познер, Met. Ions Life Sci. 2019 , 19 , 203–230. Поиск в Google Scholar
[61] D. C. Crans, L. Yang, A. Haase, X. Yang, Met. Ions Life Sci. 2018 , 18 , 251–279. Поиск в Google Scholar
[62] См. Главу 6 (стр. 153–179) А. Батлера, Дж. Н. Картера, М. Т. Симпсона в работе. [9]. Искать в Google Scholar
[63] D. Sippel, O. Einsle, Nat. Chem. Биол. 2017 , 13 , 956–960. Поиск в Google Scholar
[64] J. A. L. da Silva, J. J. R. Fraústo da Silva, A. J. L. Pombeiro, Coord. Chem. Ред. 2013 , 257 , 2388–2400.Искать в Google Scholar
[65] CE Housecroft, Chimia 2019 , 73 , 96–97. Искать в Google Scholar
[66] T. Ueki, N. Yamaguchi, Romaidi, Y. Isago, Х. Танахаши, Коорд. Chem. Ред. 2015 , 301–302 , 300–308. Поиск в Google Scholar
Isago, Х. Танахаши, Коорд. Chem. Ред. 2015 , 301–302 , 300–308. Поиск в Google Scholar
[67] Д. Редер, Металломика 2015 , 7 , 730–742. Поиск в Google Scholar
[68] Д. Фатторини, А. Нотти, М. Нигро, Ф.Regoli, Environ. Sci. Загрязнение. Res. 2010 , 17 , 220–228. DOI: 10.1007 / s11356-009-0243-0.10.1007 / s11356-009-0243-0 Поиск в Google Scholar
[69] К.-Х. Шаллер, Х.-Дж. Райтель, Дж. Ангерер, в Справочнике по металлам в клинической и аналитической химии (ред .: HG Seiler, A. Sigel, H. Sigel), Marcel Dekker Inc., New York and Basel, 1994 , pp. 505 –518. Искать в Google Scholar
[70] B. Zambelli, S. Ciurli, Met.Ions Life Sci. 2013 , 13 , 321–357. Поиск в Google Scholar
[71] См. Главу 14 (стр. 669–707) С. Чурли, С. Мангани в работе. [9] .Поиск в Google Scholar
[72] А.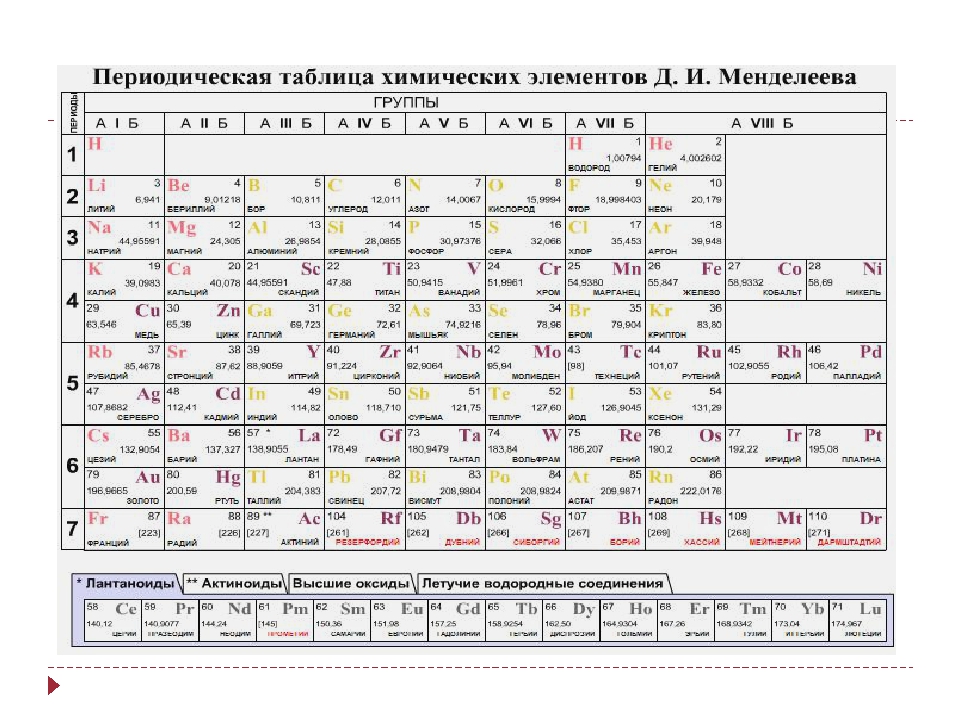 Сигель, Х. Сигель, RKO Sigel (ред.), Ионы металлов в токсикологии: эффекты, взаимодействия, взаимозависимости , MILS-8 , Королевское общество Chemistry, Cambridge, UK, 2011 , стр. 1–422. Поиск в Google Scholar
Сигель, Х. Сигель, RKO Sigel (ред.), Ионы металлов в токсикологии: эффекты, взаимодействия, взаимозависимости , MILS-8 , Королевское общество Chemistry, Cambridge, UK, 2011 , стр. 1–422. Поиск в Google Scholar
[73] NE Dixon, C. Gazzola, R.Blakely, B. Zerner, J. Am. Chem. Soc. 1975 , 97 , 4131–4132. Поиск в Google Scholar
[74] MA Ismael, AM Elyamine, MG Moussa, M. Cai, X. Zhao, C. Hu, Metallomics 2019 , 11 , 255–277. Искать в Google Scholar
[75] W. Maret, J.-M. Мулис, Met. Ions Life Sci. 2013 , 11 , 1–29. Поиск в Google Scholar
[76] F. Thévenod, W.-K. Ли, Мет.Ions Life Sci. 2013 , 11 , 415–490. Поиск в Google Scholar
[77] A. Hartwig, Met. Ions Life Sci. 2013 , 11 , 1–29. Поиск в Google Scholar
[78] A. Krężel, W. Maret, Int. J. Mol. Sci. 2017 , 18 , 1237. DOI: org / 10.3390 / ijms1861237.org / 10.3390 / ijms1861237 Искать в Google Scholar
Maret, Int. J. Mol. Sci. 2017 , 18 , 1237. DOI: org / 10.3390 / ijms1861237.org / 10.3390 / ijms1861237 Искать в Google Scholar
[79] Y. Xu, F. M. M. Morel, Met. Ions Life Sci. 2013 , 11 , 509–528.Искать в Google Scholar
[80] T. W. Lane, F. M. M. Morel, Proc. Natl. Акад. Sci. США 2000 , 97 , 4627–4631. Поиск в Google Scholar
[81] См. Главу 7 (стр. 181–192) Р. Б. Мартина в работе. [9] .Поиск в Google Scholar
[82] JW Hamilton, KE Wetterhahn, в Handbook on Toxicity of Inorganic Compounds (Eds .: HG Seiler, H. Sigel, A. Sigel), Marcel Dekker Inc., New Йорк и Базель, 1988 , стр.1–1069; см. стр. 239–250. Поиск в Google Scholar
[83] J. B. Vincent, Met. Ions Life Sci. 2013 , 13 , 171–198. Поиск в Google Scholar
[84] С. Курокава, М. Дж. Берри, Met. Ions Life Sci. 2013 , 13 , 499–534. Поиск в Google Scholar
2013 , 13 , 499–534. Поиск в Google Scholar
[85] X. Zhang, Chem. Евро. J. 2019 , 25 , 2649–2650. Поиск в Google Scholar
[86] P. L. Carver, Met.Ions Life Sci. 2019 , 19 , 1–16. Поиск в Google Scholar
[87] P. L. Carver, Met. Ions Life Sci. 2013 , 13 , 1–28. Поиск в Google Scholar
[88] K. R. Martin, Met. Ions Life Sci. 2013 , 13 , 451–473. Поиск в Google Scholar
[89] D. E. Wilcox, Met. Ions Life Sci. 2013 , 13 , 475–498. Поиск в Google Scholar
[90] G.Lunde, Environ. ЗДОРОВЬЕ . 1977 , 19 , 47–52. Поиск в Google Scholar
[91] W. R. Cullen, K. J. Reimer, Chem. Ред. . 1989 , 89 , 713–764. Искать в Google Scholar
[92] S. Shen, X. -F. Li, W.R. Cullen, M. Weinfeld, X.C. Le, Chem. Ред. . 2013 , 113 , 7769–7792. Поиск в Google Scholar
-F. Li, W.R. Cullen, M. Weinfeld, X.C. Le, Chem. Ред. . 2013 , 113 , 7769–7792. Поиск в Google Scholar
[93] С. Фостер, В. Махер, J. Environ. Sci . 2016 , 49 , 131–139. Поиск в Google Scholar
[94] A. Veis, Met. Ions Life Sci. 2008 , 4 , 1–35. Поиск в Google Scholar
[95] A. K. Davis, M. Hildebrand, Met. Ions Life Sci. 2008 , 4 , 255–294. Поиск в Google Scholar
[96] М. Шри, П. К. Сингх, М. Кидвей, Н. Гаутам, С. Дубей, Г. Верма, Д. Чакрабарти, Металломика 2019 , 11 , 519–532.Выполните поиск в Google Scholar
[97] (последний доступ 14 марта 2019 г.). Поиск в Google Scholar
[98] JI Mujika, G. Dalla Torre, E. Formoso, R. Grande-Aztatzi, SJ Grabowski, C Эксли, X. Lopez, J. Inorg. Биохим . 2017 , 181 , 111–116. Поиск в Google Scholar
[99] C. Exley, J. Alzheimer Dis. Rep. 2017 , 1 , 23–25. Поиск в Google Scholar
Exley, J. Alzheimer Dis. Rep. 2017 , 1 , 23–25. Поиск в Google Scholar
[100] S. A. Virk, G. D. Eslick, J.Профессиональная среда. Медицина 2015 , 57 , 893–896. Поиск в Google Scholar
[101] D. N. S. Kerr, M. K. Ward, Met. Ions Biol. Syst. 1988 , 24 , 217–258. Поиск в Google Scholar
[102] A. B. G. Lansdown, Met. Ions Life Sci. 2011 , 8 , 187–246 (см. Стр. 214). Искать в Google Scholar
[103] T. Kiss, K. Gajda-Schrantz, P. F. Zatta, Met. Ions Life Sci. 2006 , 1 , 371–393. Поиск в Google Scholar
[104] Дж. Далла Торре, Дж. И. Мухика, Дж. И. Лахович, М. Дж. Рамос, X. Лопес, Dalton Trans . 2019 , 48 , 6003–6018. Поиск в Google Scholar
[105] А. Сигель, Х. Сигель, RKO Sigel (Eds.), Ведущий: его влияние на окружающую среду и здоровье , Вальтер де Грюйтер GmbH, Берлин / Бостон, 2017 , стр. 1–555. Поиск в Google Scholar
1–555. Поиск в Google Scholar
[106] N.М. Рой, С. ДеВольф, Б. Карбейро, Aquat. Toxicol. 2015 , 158 , 138–148. Поиск в Google Scholar
[107] Р.А. Гойер, в Справочнике по токсичности неорганических соединений (Ред .: HG Seiler, H. Sigel, A. Sigel), Marcel Dekker Inc., Нью-Йорк и Базель, 1988 , стр. 1–1069; см. стр. 359–382. Поиск в Google Scholar
[108] К. Дейблер, П. Басу, Eur. J. Inorg. Chem. 2013 , 1086–1096. Поиск в Google Scholar
[109] J.T. Cullen, J. McAlister, Met. Ions Life Sci. 2017 , 17 , 21–48. Поиск в Google Scholar
[110] W. Maret, Met. Ions Life Sci. 2017 , 17 , 1–20. Поиск в Google Scholar
[111] K. Klotz, T. Göen, Met. Ions Life Sci. 2017 , 17 , 201–240. Поиск в Google Scholar
[112] Э. Фаркас, П. Бугльо, Мет. Ions Life Sci. 2017 , 17 , 201–240.Искать в Google Scholar
Ions Life Sci. 2017 , 17 , 201–240.Искать в Google Scholar
[113] К. Аоки, К. Мураяма, Н.-Х. Ху, Мет. Ions Life Sci. 2017 , 17 , 123–199. Поиск в Google Scholar
[114] A. Sigel, B. P. Operschall, H. Sigel, Met. Ions Life Sci. 2017 , 17 , 319–402. Поиск в Google Scholar
[115] Дж. Палоу-Мир, М. Барсело-Оливер, Р. К. О. Сигель, Мет. Ions Life Sci. 2017 , 17 , 403–434.Поиск в Google Scholar
[116] M.Villa, M. Roy, G. Bergamini, M. Gingras, P. Ceroni, Dalton Trans. 2019 , 48 , 3815–3818. Поиск в Google Scholar
[117] MJ Kelner, в Handbook on Metals in Clinical and Analytical Chemistry (Eds: HG Seiler, A. Sigel, H. Sigel ), Marcel Dekker Inc., New York and Basel, 1994 , pp. 601–610. Поиск в Google Scholar
[118] NJ Birch, Met. Ions Biol. Syst. 1982 , 14 , 257–313.Поиск в Google Scholar
Ions Biol. Syst. 1982 , 14 , 257–313.Поиск в Google Scholar
[119] NJ Birch, C. Padham, MS Hughes, в Handbook on Metals in Clinical and Analytical Chemistry (Eds .: HG Seiler, A. Sigel, H. Sigel), Marcel Dekker Inc. , New York and Basel, 1994 , pp. 441–452. Поиск в Google Scholar
[120] J. Iskra-Trifunovic, M. Szymczak, A. Jasiewicz, A. Grzywacz, J. Samochowiec, Curr . Psychopharmacol. 2014 , 3 , 73–78. Поиск в Google Scholar
[121] C.Дж. Андерсон, М. Дж. Велч, в Справочнике по металлам в клинической и аналитической химии (ред .: Х.Г. Зайлер, А. Сигель, Х. Сигель), Марсель Деккер Инк., Нью-Йорк и Базель, 1994 , стр. 371–380. Искать в Google Scholar
[122] CR Chitambar, Met. Ions Life Sci. 2018 , 18 , 281–301. Поиск в Google Scholar
[123] A. J. A. M. Sips, W. J. F. van der Vijgh, в Handbook on Metals in Clinical and Analytical Chemistry (Eds.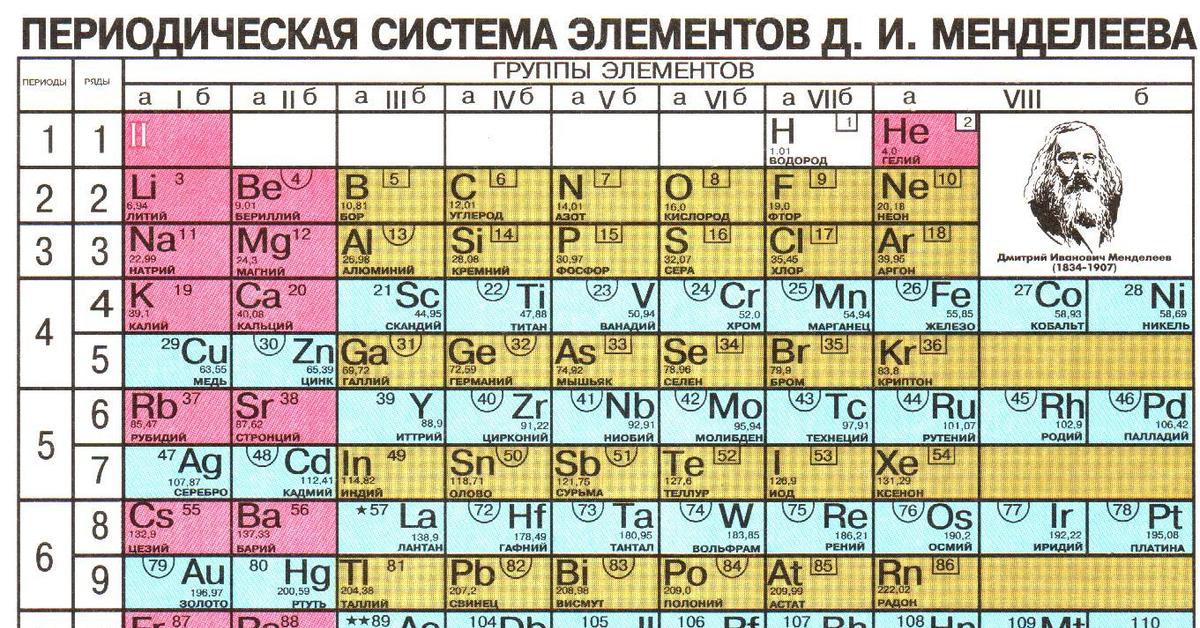 : HG Seiler, A. Sigel, H. Sigel), Marcel Dekker Inc., New York and Basel, 1994 , стр. 577–585. Поиск в Google Scholar
: HG Seiler, A. Sigel, H. Sigel), Marcel Dekker Inc., New York and Basel, 1994 , стр. 577–585. Поиск в Google Scholar
[124] PJ Meunier, C. Roux, E Симан, С. Ортолани, Дж. Э. Бадурски, Т. Д. Спектор, Дж. Канната, А. Балог, Э.-М. Леммель, С. Порс-Нильсен, Р. Риццоли, Х. К. Генант, Ж.-Й. Reginster, New Engl. J. Med. 2004 , 350 , 459–468. Поиск в Google Scholar
[125] Р. Альберто, У. Абрам, Chimia 2019 , 73 , 207–209.Поиск в Google Scholar
[126] EA Deutsch, S. Jurisson, в Handbook on Metals in Clinical and Analytical Chemistry (Eds: HG Seiler, A. Sigel, H. Sigel), Marcel Dekker Inc., New York and Basel, 1994 , pp. 587–592. Поиск в Google Scholar
[127] Д. Эрнандес-Вальдес, Р. Альберто, У. Хауреги-Хаза, RSC Adv. 2016 , 6 , 107127–107140. Поиск в Google Scholar
[128] Р. Альберто, Cosmos 2012 , 8 , 83–101.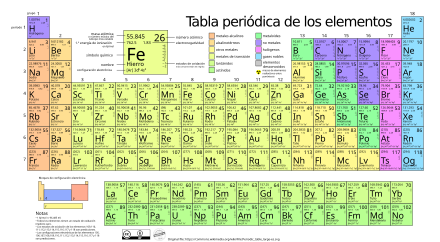 Искать в Google Scholar
Искать в Google Scholar
[129] А. Фрей, Б. Спинглер, Р. Альберто, Chem. Евро. J. 2018 , 24 , 10156–10164. Поиск в Google Scholar
[130] Н. Сильвестри-Родригес, Э. Сикаирос-Руэлас, К. П. Герба, К. Р. Брайт, Rev. Environ. Contam. Toxicol. 2007 , 191 , 23–45. Поиск в Google Scholar
[131] С. Экхардт, П. С. Брунетто, Дж. Ганьон, М. Прибе, Б. Гизе, К. М. Фромм, Chem. Ред. 2013 , 113 , 4708–4754.Искать в Google Scholar
[132] B. Rosenberg, L. Van Camp, JE Trosko, VH Mansour, Nature 1969 , 222 , 385–386. Искать в Google Scholar
[133] IA Riddell , SJ Lippard, Met. Ions Life Sci. 2018 , 18 , 1–42. Поиск в Google Scholar
[134] С. Хизал, М. Хейл, К. Юнгманн, М. А. Якупец, М. Галански, Б. К. Кепплер, Eur. J. Inorg. Chem . 2019 , 856–864. Искать в Google Scholar
Искать в Google Scholar
[135] V.Brabec, J. Kasparkova, V. Menon, N. P. Farrell, Met. Ions Life Sci. 2018 , 18 , 43–68. Поиск в Google Scholar
[136] В. Венкатеш, П. Дж. Сэдлер, Met. Ions Life Sci. 2018 , 18 , 69–108. Поиск в Google Scholar
[137] Z. Wang, Z. Deng, G. Zhu, Dalton Trans. 2019 , 48 , 2536–2544. Поиск в Google Scholar
[138] Х. Кострунова, Э. Петруццелла, Д. Гибсон, Дж.Каспаркова, В. Брабец, Chem. Евро. J. 2019 , 25 , 5235–5245. Поиск в Google Scholar
[139] K. C. Dash, H. Schmidbaur, Met. Ions Biol. Syst. 1982 , 14 , 179–205. Поиск в Google Scholar
[140] A. Casini, R. W.-Y. Sun, I. Ott, Met. Ions Life Sci. 2018 , 18 , 199–217. Поиск в Google Scholar
[141] В. Фернандес-Морейра, Р. П. Эррера, М.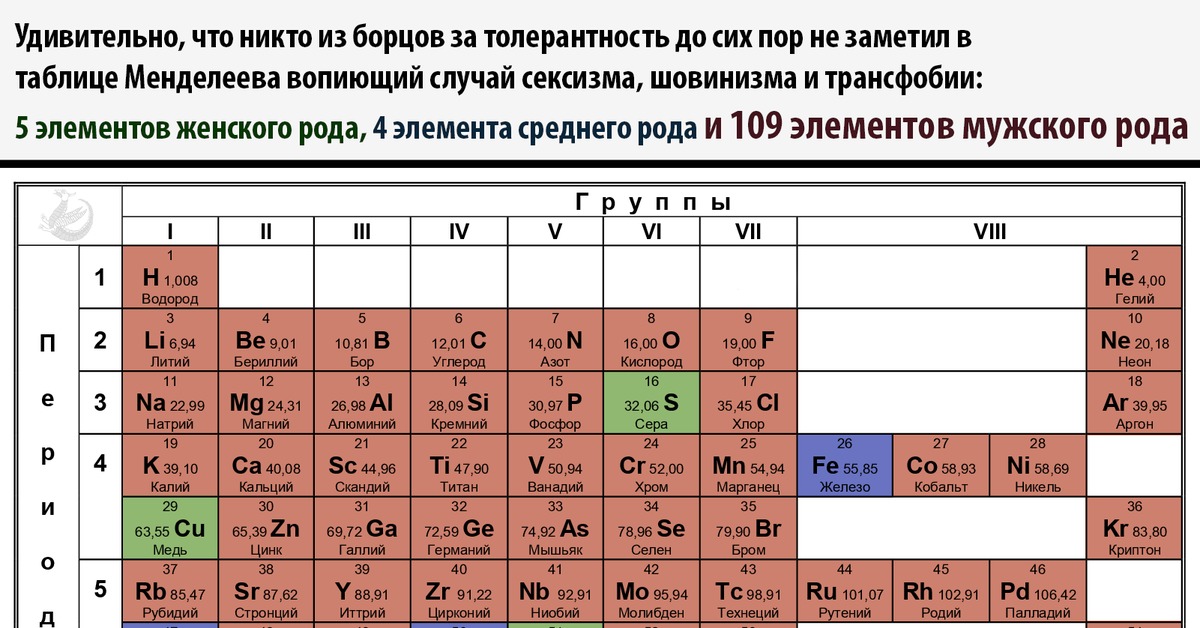 К. Химено, Pure Appl.Chem. 2019 , 91 , 247–270. Поиск в Google Scholar
К. Химено, Pure Appl.Chem. 2019 , 91 , 247–270. Поиск в Google Scholar
[142] L. M. Liz-Marzán, Chem. Евро. J. 2019 , 25 , 661. Поиск в Google Scholar
[143] J. J. Gooding, Chem. Евро. J. 2019 , 25 , 5335–5336. Поиск в Google Scholar
[144] PS D’Haese, ME De Broe, в Handbook on Metals in Clinical and Analytical Chemistry (Eds .: HG Seiler , А. Сигель, Х.Sigel), Marcel Dekker Inc., New York and Basel, 1994 , pp. 365–370. Поиск в Google Scholar
[145] B. Wagner, V. Drel, Y. Gorin, Am. J. Physiol. 2016 , 311 , F1–F11. Поиск в Google Scholar
[146] М. Ле Фур, П. Караван, Metallomics 2019 , 11 , 240–254. Искать в Google Scholar
Доступная периодическая таблица химических элементов
Периодическая таблица элементов науки о независимости Вы можете использовать команды навигации по таблице для выбранной вами программы чтения с экрана.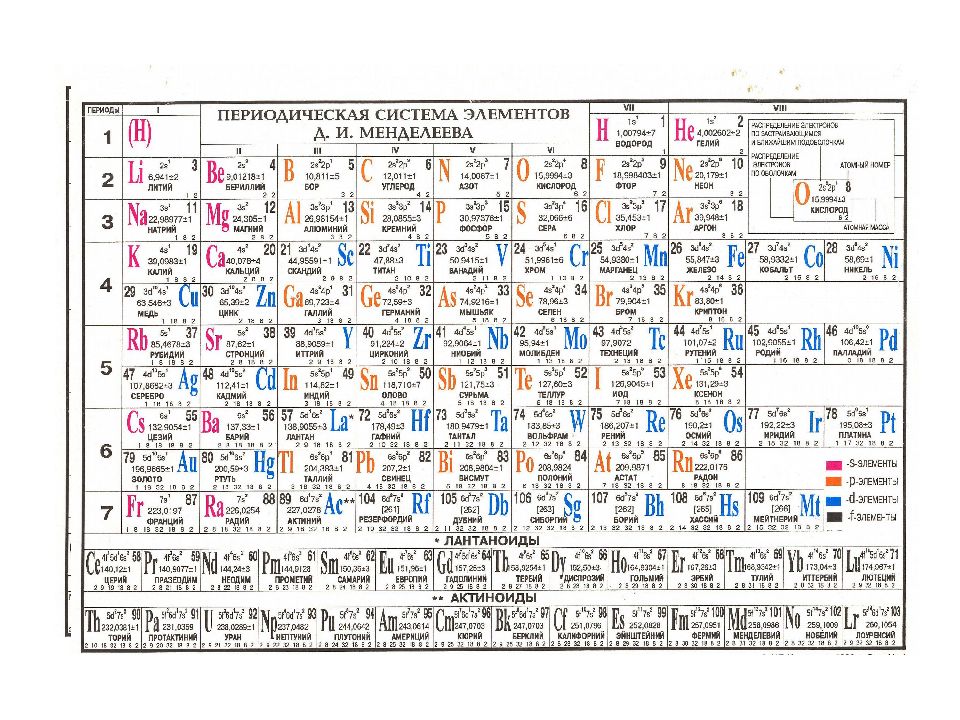
1 1А | 2 2А | 3 3B | 4 4B | 5 5B | 6 6B | 7 7B | 8 8B | 9 8B | 10 8B | 11 1B | 12 2B | 13 3А | 14 4А | 15 5А | 16 6А | 17 7А | 18 8A |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
1 ЧАС 1. | 2 He 4.00 | ||||||||||||||||
3 Li 6.94 | 4 Be 9.01 | 5 B 10,81 | 6 C 12.01 | 7 N 14.01 | 8 О 16.00 | 9 F 19.00 | 10 Ne 20,18 | ||||||||||
11 Na 22,99 | 12 Mg 24,31 | 13 Al 26. | 14 Si 28.09 | 15 п 30,97 | 16 S 32,07 | 17 Cl 35,45 | 18 Ar 39,95 | ||||||||||
19 K 39,10 | 20 Ca 40.08 | 21 год Sc 44,96 | 22 Ti 47,88 | 23 V 50,94 | 24 Cr 52.00 | 25 Mn 54,94 | 26 Fe 55,85 | 27 Co 58.93 | 28 год Ni 58,69 | 29 Cu 63,55 | 30 Zn 65,39 | 31 год Ga 69,72 | 32 Ge 72,61 | 33 В виде 74,92 | 34 Se 78.97 | 35 год Br 79,90 | 36 Kr 83,80 |
37 Руб. | 38 Sr 87,62 | 39 Y 88,91 | 40 Zr 91,22 | 41 год Nb 92.91 | 42 Mo 95.95 | 43 Tc 98.01 | 44 Ru 101.07 | 45 Rh 102.91 | 46 Pd 106.42 | 47 Ag 107.87 | 48 Cd 112.41 год | 49 В 114,82 | 50 Sn 118,71 | 51 Sb 121,76 | 52 Te 127,60 | 53 я 126,90 | 54 Xe 131,29 |
55 CS 132.91 | 56 Ба 137,33 | 57 Ла 138,91 | 73 Hf 178,49 | 73 Та 180,95 | 74 W 183,85 | 75 Re 186,21 | 76 Операционные системы 190. | 77 Ir 192,22 | 78 Pt 195,08 | 79 Au 196,97 | 80 Hg 200,59 | 81 год Tl 204,38 | 82 Pb 207,20 | 83 Би 208.91 | 84 По 208,88 | 85 В 209,99 | 86 Rn 222,02 |
87 Пт 223,01 | 88 Ра 226,03 | 89 Ac (227) | 104 Rf (261) | 105 Db (262) | 106 Sg (263) | 107 Bh (262) | 108 Hs (265) | 109 Mt (266) | 110 Ds (281) | 111 Rg (272) | 112 Cn (285) | 113 Nh (286) | 114 Fl (289) | 115 Mc (289) | 116 Ур. | 117 Ц (294) | 118 Og (294) |
58 Ce 140.11 | 59 Пр 140,91 | 60 Nd 144,24 | 61 Вечера (145) | 62 См 150,36 | 63 Евросоюз 151,96 | 64 Б-г 157,25 | 65 Tb 158.93 | 66 Dy 162,50 | 67 Хо 164,93 | 68 Э 167,26 | 69 Тм 168,93 | 70 Yb 173,04 | 71 Лу 174,97 | ||||
90 Чт 232. | 91 Па 231,04 | 92 U 238,03 | 93 Np (237) | 94 Пу (244) | 95 Являюсь (243) | 96 См (247) | 97 Bk (247) | 98 Cf (251) | 99 Es (252) | 100 FM (257) | 101 Мкр (258) | 102 Нет (259) | 103 Lr (262) |
Произведено независимой наукой и финансируется Американским химическим обществом
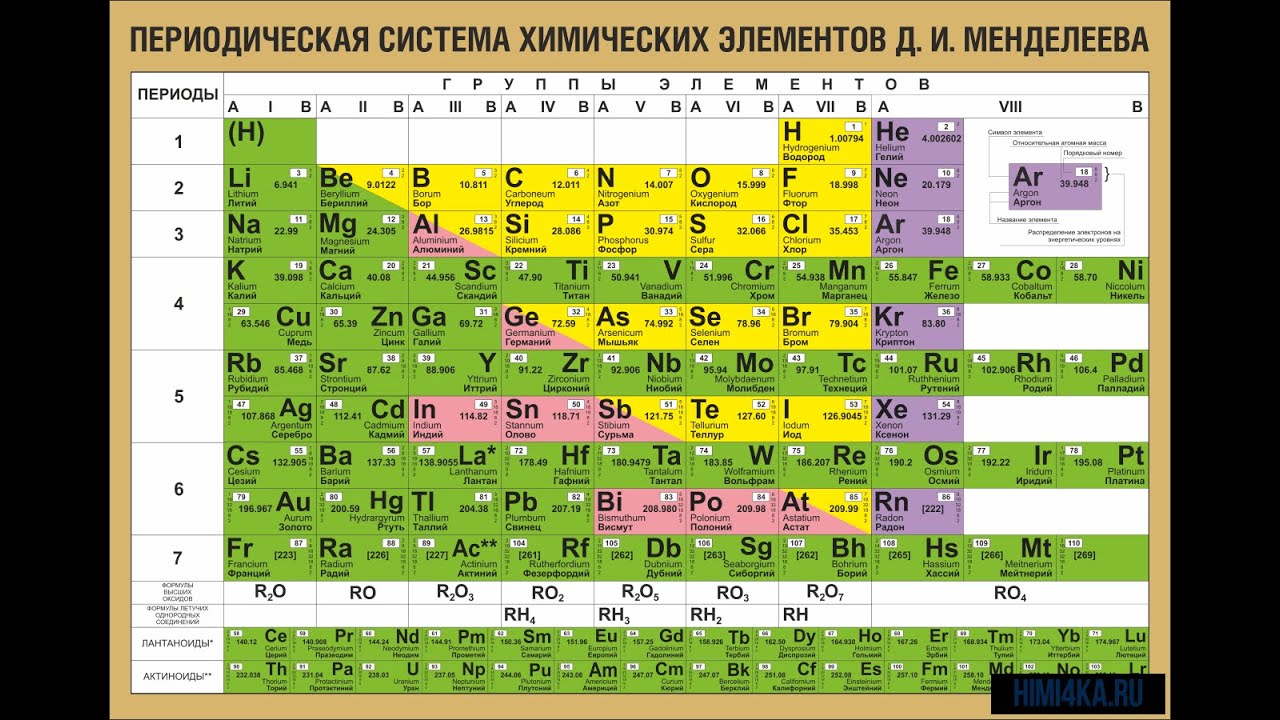

 Игнорировалась она потому, что была и есть разная у различных элементов, а значит её не могли использовать в качестве параметра для объединения в группы. Исключение составил лишь франзуский химик Александр Эмиль Шанкуртуа, он попытался расположить все элементы в трёхмерной модели по винтовой линии, но его работа не была признана научным сообществом, а модель получилась громоздкая и неудобная.
Игнорировалась она потому, что была и есть разная у различных элементов, а значит её не могли использовать в качестве параметра для объединения в группы. Исключение составил лишь франзуский химик Александр Эмиль Шанкуртуа, он попытался расположить все элементы в трёхмерной модели по винтовой линии, но его работа не была признана научным сообществом, а модель получилась громоздкая и неудобная. Подробнее об этом вы можете прочесть в статье “В чём открытие Менделеева”
Подробнее об этом вы можете прочесть в статье “В чём открытие Менделеева” После определения зарядов атомных ядер всех, известных на тот момент, элементов, выяснилось, что в периодической системе они располагаются в соответствии с зарядом ядра. А периодический закон приобрёл новый смысл, теперь он стал звучать так:
После определения зарядов атомных ядер всех, известных на тот момент, элементов, выяснилось, что в периодической системе они располагаются в соответствии с зарядом ядра. А периодический закон приобрёл новый смысл, теперь он стал звучать так: Давайте взглянем на него.
Давайте взглянем на него. Таким образом, вся таблица разбита на следующие блоки: s-блок, на котором заполняются s-электроны, d-блок, p-блок и f-блок, с заполнением d, p, и f-электронов соответственно.
Таким образом, вся таблица разбита на следующие блоки: s-блок, на котором заполняются s-электроны, d-блок, p-блок и f-блок, с заполнением d, p, и f-электронов соответственно.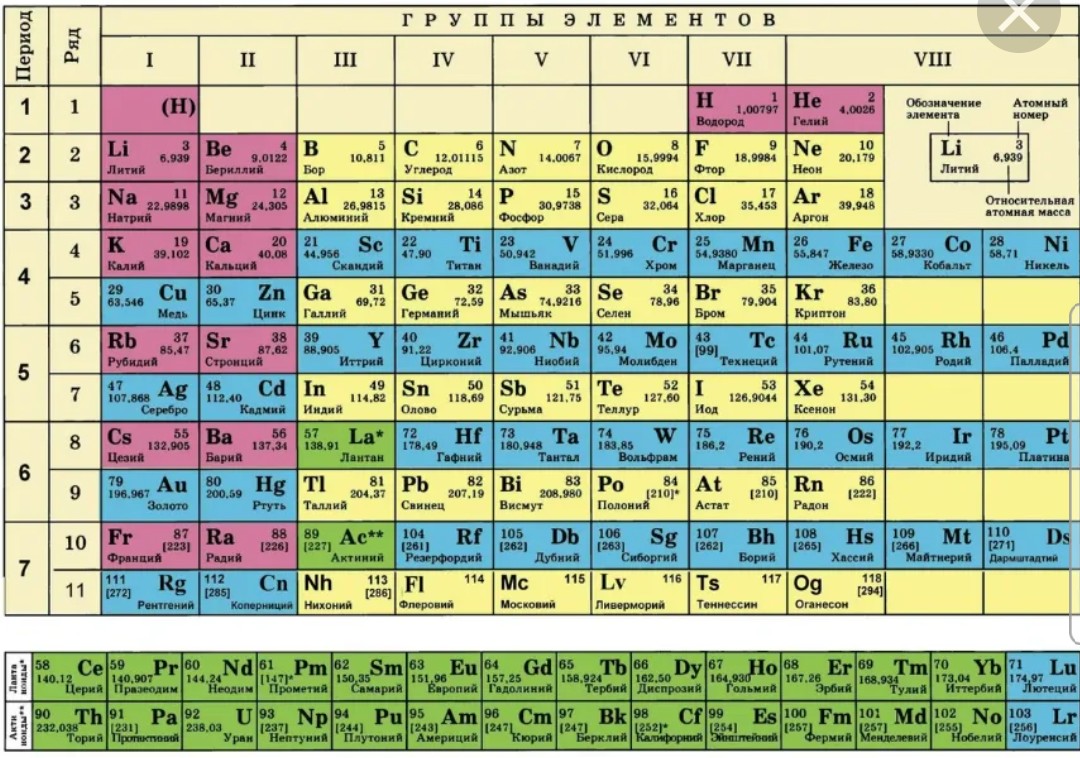 Элементы его составляющие придётся вынести вниз таблицы, подобно лантаноидам или актиноидам, либо расширить эту таблицу ещё в два раза, так что она перестанет помещаться на лист формата A4. Здесь я приведу лишь ссылку на википедию (см. Расширенная периодическая система) и не буду лишний раз повторять описание этого варианта. Кому станет интересно – сможет пройти по ссылке и ознакомиться.
Элементы его составляющие придётся вынести вниз таблицы, подобно лантаноидам или актиноидам, либо расширить эту таблицу ещё в два раза, так что она перестанет помещаться на лист формата A4. Здесь я приведу лишь ссылку на википедию (см. Расширенная периодическая система) и не буду лишний раз повторять описание этого варианта. Кому станет интересно – сможет пройти по ссылке и ознакомиться.
 Он даже дал описание некоторых еще неведомых веществ.
Он даже дал описание некоторых еще неведомых веществ.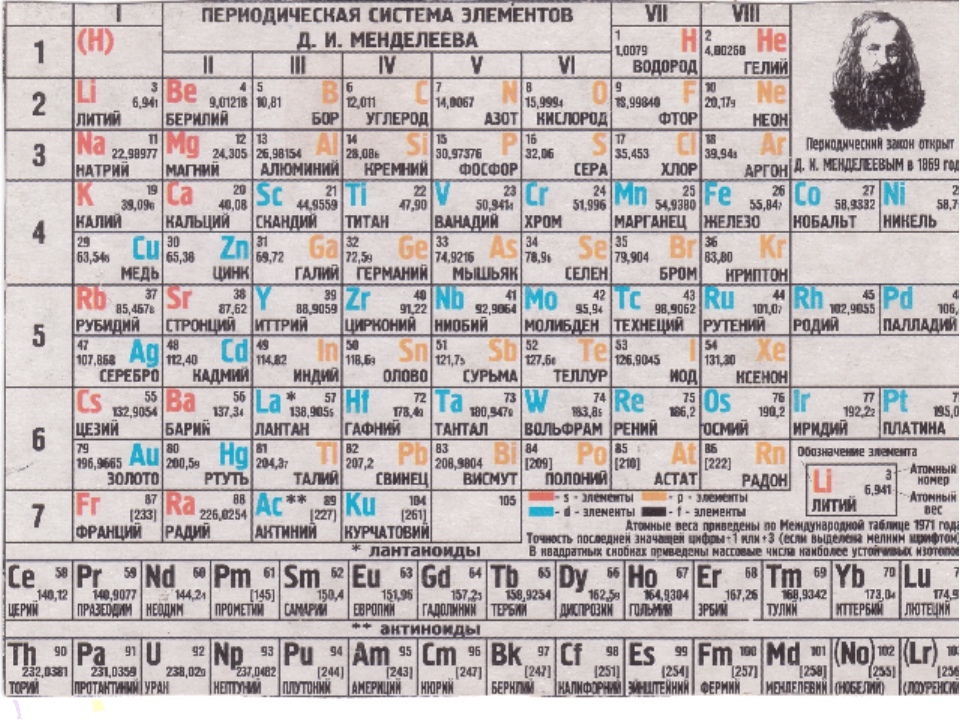 Отец рано ушел из жизни. Но мать продолжала бороться за будущее своих детей, так что смогла пристроить их в хорошие учебные заведения.
Отец рано ушел из жизни. Но мать продолжала бороться за будущее своих детей, так что смогла пристроить их в хорошие учебные заведения. 98
98
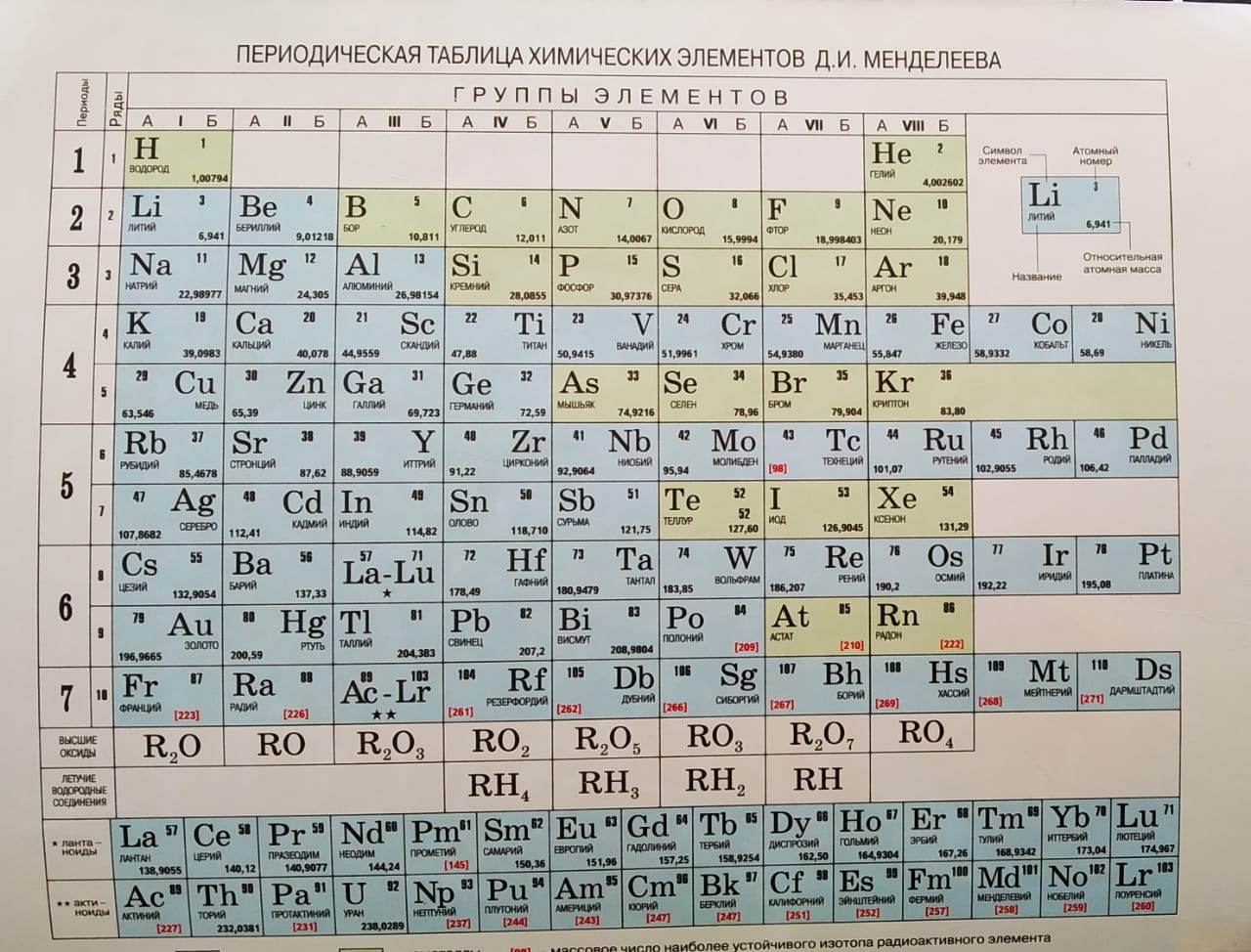 85,47
85,47
 23
23
 (293)
(293)
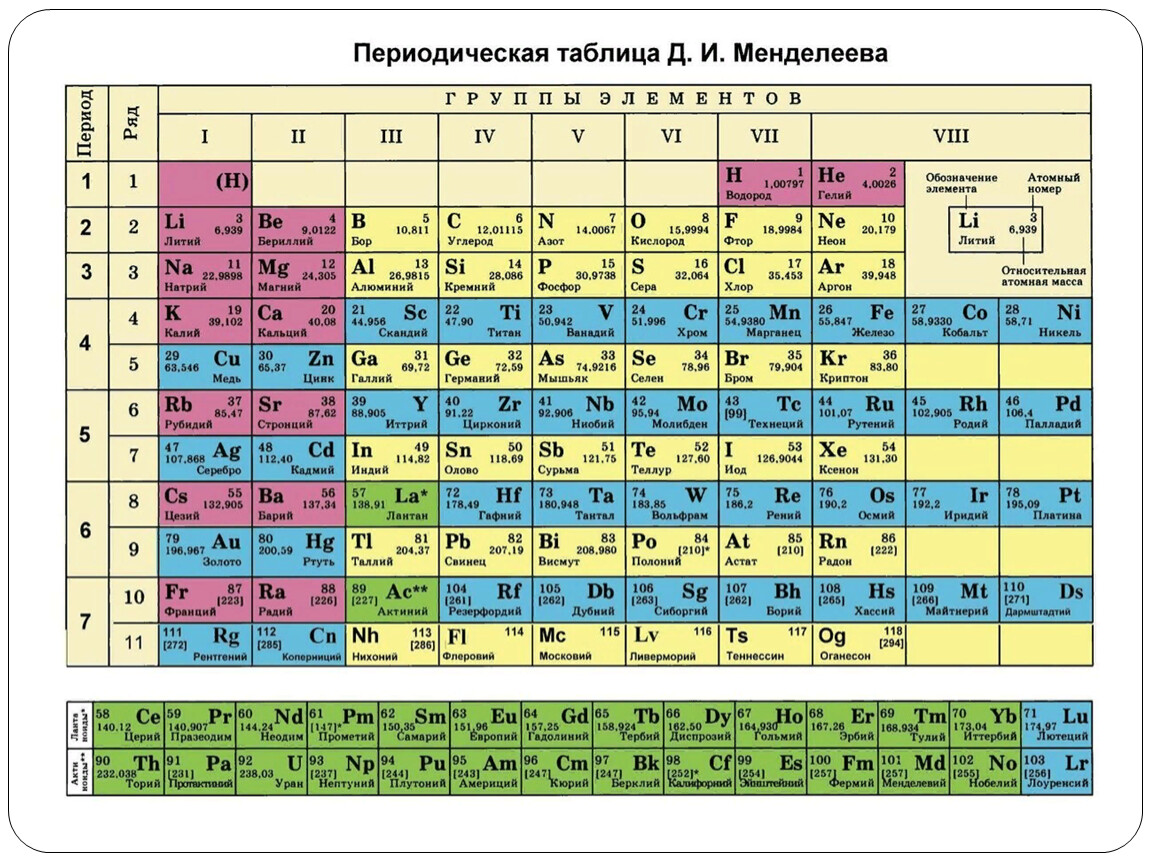 04
04