rtut-v-tablice-mendeleeva
Ртуть, как важный элемент в таблице Менделеева.
Затронем такие темы как:
1. Что такое ртуть и когда она попала в таблицу менделеева?
2. Что такое атомарная ртуть?
3. История ртути.
4. Численные параметров ртути.
5. С какими элементами реагирует ртуть.
6. Физико-химические свойства ртути.
1. Что такое ртуть?
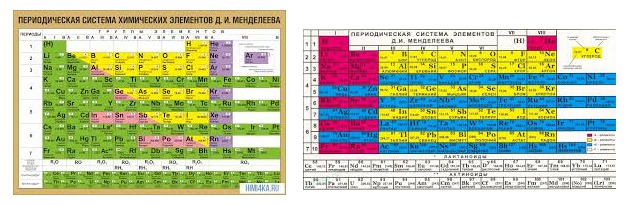
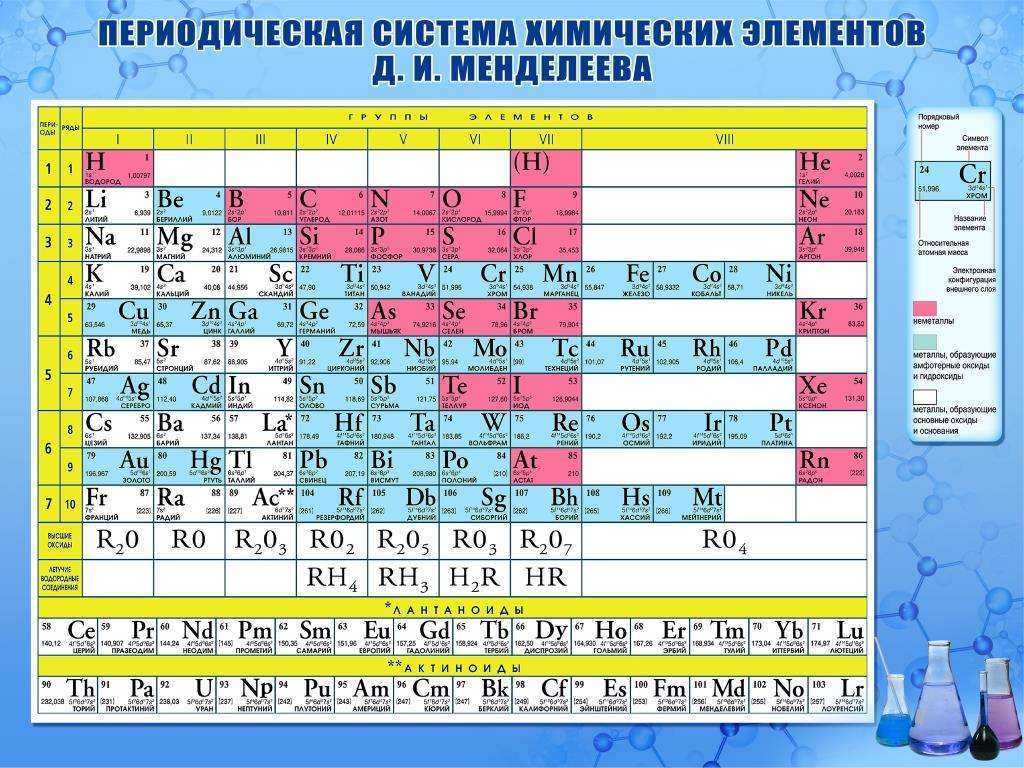
Ртуть, это металл относящийся к шестому периоду таблицы Менделеева и имеющий порядковый номер 80.
Hg имеет отношение к тяжёлым металлам, по этой причине имеет соответствующий класс ( 1-ый класс ) экологической опасности по ГОСТ 12.1.007.
Появление в таблице Менделеева.
В 1869 году Д.И. Менделеев открыл первые вариант своего периодического закона.
Именно тогда ртуть попала в его первую публикацию.
Более привычный нам вид таблицы Менделеева дополнило нам то время, когда научный мир обнаружил радиацию.
То есть в период 1898 по 2000 годы.
- Атомы и изотопы ртути
2. Атомарная ртуть. (Изотопы ртути)
Атомарная ртуть это ртуть состоящая из изотопов атомов ртути.
Изотопы ртути– это атомы ртути, которые имеют один и тот же атомарный номер, но разные атомные массы.
Это так называемая смешанная ртуть, где есть атомы с разными числами атомарной массы.
Атомная масса складывается из числа нейтронов и протонов в ядре.
Таким образом молекулярную ртуть можно представить, как атомарную ртуть и поделить на 7 видов атомов ртути.
Эти атомы (точнее изотопы) будут различимы по атомной массе.
Процент содержания каждого из изотопов ртути в основной массе ртути указан в скобках.
196Hg ( 0, 146%),
198Hg (10, 02%),
199Hg (16, 84%),
200Hg (23, 13%),
201Hg (13, 22%),
202Hg (29, 80%),
204Hg (6, 85%).
Изотопы ртути.
Существуют радиоактивные изотопы ртути.
Существование многих из этих изотопов характерно не природное появление а из задеятельности человека.
171Hg – а. м. 171,00376.
172Hg – а.м. 171,99883.
173Hg – а.м. 172,99724.
174Hg – а.м. 173,992864.
175Hg – а.м. 174,99142.
176Hg – а.м. 175,987355.
177Hg – а.м. 176,98628.
178Hg – а.м. 177,982483.
179Hg – а. м. 178,981834.
м. 178,981834.
180Hg -а.м. 179,978266.
3. история использования ртути
Древние греки и египтяне называли ртуть скифской водой.
Арабы вывели ртутно-серную теорию о происхождении металла, в которой ртуть была в роли матери металлов, а сера в качестве отца.
С этим металлом делали разные алхимические операции.
Арабские и западноевропейские алхимики хотели сделать ртуть твердой.
Они считали, что из полученного чистого серебра можно создать золото.
По латыни она называется Hydrargyrum (Hg).
Этот химический элемент является единственным металлом, который при обычных внешних условиях ( температура и давление) имеет жидкое агрегатное состояние.
Из истории относительно современной науки известно, что твердую ртуть впервые удалось получить Ломаносову в 1759 году, заморозив ее с помощью азотной кислоты.
Задолго до 20-го века, а так же до эксперемента Ломаносова люди уже умели получать этот металл в жидком виде.
Точные даты получения первой жидкой ртути и работы с ней не установлены.
В свое время, когда не было газоразрядных ламп с содержанием ртути и других технологических изобретений человечества, ртуть была, как важнейшее исходное вещество, из которого изготавливали препараты для продления жизни.
То есть ртуть использовалась знахарями для изготовления лекарства.
В 16-17-ом веке ртуть считалась основным металлом, ближайшим к золоту, еще до открытия Д.И Менделеевым его знаменитой таблицы.
Ртуть называли “меркурий”, потому что она также близко находится от золота, как эта планета от солнца.
В медицине использовали этот металл вообще с глубокой древности.
Об этом было известно китайцам, индусам и египтянам.
Мавританский король соорудил в свое время фонтан с чистой ртутью, а не водой.
Раньше людям не было неизвестно об опасных свойствах этого металла – о токсичности его паров.
Речь идет о свойстве этого металла испаряться при нормальных условиях температуры и давления в окружающую среду.
Потому многим ученным пришлось пострадать от токсичности паров ртути.
Надо отметить, что как правило, при таких отравлениях ртутными парами речь шла о десятках граммов этого жидкого металла.
В наши дни существуют некоторые способы обнаружить ртуть в бытовых условиях, не прибегая к газовым анализаторам.
- Исаак Ньютон отравился ртутью
Например И.Ньютон, когда делал опыты с ртутью, надышался ее парами и изрядно отравился.
Тем не менее, и сегодня в некоторых современных лекарственных средствах имеется в составе ртуть в небольших
Пользоваться такими лекарствами ими нужно осторожно и ни в коем случае не превышать дозы.
- Ртуть в таблице Менделеева
4. ртуть в химии
Современная химия знает, что ртуть Hg расположена в шестом периоде и второй группе таблицы Менделеева.
- – порядковый номер у ртути в этой таблице -80.
- – относительная атомарная масса ровняется 200,592 *1/N моль(-1).
- – атомный объем ртути 14,26*10-6 м3/моль.
- – последняя электронная оболочка содержит 2 электрона 6s2
- – существует 7 изотопов ртути на сей день.
- – температура плавления ртути -38,83 С.
- – температура кипения ртути 356,73 С.

5. вступает в реакции
Ртуть является достаточно нейтральным элементом, с которым способны взаимодействовать не так много других химических элементов и соединений.
Вот почему демеркуризация ртути требует специальных средств.
Тем не менее:
Для бытового применения важно знать, что ртуть реагирует с 2 важными элементами, с получением , как минимум, 3 соединений, которым присвоили свои названия.
- С чем реагирует ртуть.
йод и хлор.
С этой точки зрения есть научное подтверждение того, что демеркуризация йодом вполне работоспособна.
6. физико-химические свойства ртути.
Ртуть является не единственным жидким металлом.
Так же есть жидкий металл, как Галлий.
- Ртуть плавится (становится жидкой) при температуре 234,32 Кельвина ( -39 градусов по Цельсию)
- Ртуть испаряется со скоростью 0,002 мг/ час при комнатной температуре.
- Ртуть испаряется со скоростью 0,036 мг/ час при солнечном излучении и комнатной температуре.
- Ртуть закипает при температуре 629,88 Кельвина (356 градусов по Цельсию) и является диамагнетиком (намагничивается против направления внешнего магнитного поля )
- Ртуть способна образовать с другим металлом жидкий и твердый сплав – амальгаму.
- Ртуть обладает плотностью 13 500 кг/м3 при комнатной температуре.
- Ртуть хорошо проводит электричество
- Ртуть плохо проводит тепло.

Из-за лопнувшей энергосберегающей лампочки или разбившегося термометра возможно отравиться при определённых условиях, так как освободившаяся ртуть начинает испаряться.
Одним из таких условий интенсивного испарения ртути является случаи, когда небольшая капля ртути разбивается на множество мелких осколков.
Создается большая площадь испарения металла.
Происходит также разделение серебристого металла по мелким шарикам так же, если появится мельчайшее сотрясение, при повышенном поверхностном натяжении.
Особенно нежелательно разливать ртуть в помещении, так как трудно будет его найти.
При восьми градусной температуре начинается интенсивное испарение ртути, и ее пары расходятся по воздушному пространству.
ПДК ртути
ПДК ртути для жилых и не жилых помещений:
- – Для жилых помещения 0.003 миллиграмма на метр кубический.

- – Для производственных помещений 0.01 миллиграмма на метр кубический.
КАК САМОСТОЯТЕЛЬНО СДЕЛАТЬ ЗАМЕР ПАРОВ РТУТИ?
ГДЕ ПРЕОБРЕСТИ АНАЛИЗАТОР ПАРОВ РТУТИ?
Заявка на выезд специалиста.
В течении 10 минут мы свяжемся с Вами.
Ваш заказ получен
Яркие научные события в России 2019: Год Менделеева
В преддверии новогодних праздников “Научная Россия” рассказывает о самых ярких событиях уходящего года в отечественной науке.
2019-й год оказался очень плодотворным для российской науки, в
особенности для естественных наук. В этом году произошло
беспрецедентное по своей значимости событие: объявление 2019 года
Международным годом Периодической таблицы им.Д.И.Менделеева.
Парадоксально, что далеко не во всех странах мира Периодическая
таблица носит имя ее создателя — Дмитрия Менделеева.
Популяризация величайшего достижения в отечественной науке — Периодического закона — и имени Менделеева стала важной актуальной задачей для российских ученых. Именно поэтому российская сторона обратилась к международному сообществу с инициативой. Решение объявить 2019 год Международным годом Периодической таблицы химических элементов было принято Генеральной ассамблеей ООН. Год проходил под эгидой ЮНЕСКО в России, Франции, Германии, США, Японии и других странах мира. Провести мероприятия, посвященные 150-летию Таблицы Менделеева, решили более 80 государств, 295 городов. Имя российского ученого звучало на выставках и открытых уроках, на конференциях, научных фестивалях и других событиях, проводимых по всему земному шару.
30 января 2019 года, в Париже, в штаб-квартире ЮНЕСКО
прошла Церемония
открытия Международного года Периодической таблицы
химических элементов. Участниками и гостями открытия стали более
1300 человек из 80 стран мира. Среди них – ученые, политики,
руководители международных, научных, образовательных организаций,
представители бизнес-компаний и общественных объединений.
Среди них – ученые, политики,
руководители международных, научных, образовательных организаций,
представители бизнес-компаний и общественных объединений.
Теме 150-летия Периодической таблицы Менделеева была посвящена одна из научных сессий общего собрания РАН, которое проходило в ноябре:
“Текущий 2019-й год объявлен годом 150-летия Периодической таблицы химических элементов Д.И.Менделеева. Эта инициатива была предложена Россией и единогласно поддержана ООН. Периодическая таблица носит имя Менделеева не везде. Поэтому подобная инициатива очень важна, чтобы закрепить этот приоритет за российской наукой”, – рассказал на общем собрании президент РАН Александр Сергеев.
“В мире были проведены десятки тысяч мероприятий. Участвовали
все шесть континентов, включая Антарктиду. Это миллионы людей,
которые слушали, делали и познавали новое. Практически все
мероприятия сопровождались докладами о биографии Менделеева.
В России за год прошли сотни научно-популярных и образовательных мероприятий, посвященных 150-летию Таблицы Менделеева. Среди наиболее ярких — Всероссийский фестиваль NAUKA 0+, Всероссийский съезд учителей химии, XXI Менделеевский съезд по общей и прикладной химии и другие.
Периодическая система химических элементов Дмитрия Ивановича Менделеева — одно из величайших достижений в истории. Открытие Менделеева изменило всю мировую науку; особенно сильно, помимо химии, оно повлияло на физику, космологию, геохимию.
В честь ученого назван 101-й элемент Периодической таблицы —
менделевий (Md). 2019 год объявлен Международным годом
Периодической таблицы химических элементов
Д. И.Менделеева. Финальное закрытие Международного года
Таблицы Менделеева
состоялось в Токио 5 декабря. В России же оно проходило 28
ноября в стенах МГУ.
И.Менделеева. Финальное закрытие Международного года
Таблицы Менделеева
состоялось в Токио 5 декабря. В России же оно проходило 28
ноября в стенах МГУ.
На закрытии Международного года Периодической таблицы Менделеева в Токио ряд выступлений глав крупнейших научных союзов был посвящен тому, чтобы объявить 2022 год международным годом фундаментальной науки.
“Предварительные переговоры в ЮНЕСКО по этому предложению уже прошли. Заявку на год фундаментальной науки будут готовить несколько объединений, в том числе Международный союз чистой физики. Считаю, что в этом процессе Россия должна играть одну из ключевых ролей”, – сообщил глава РАН Александр Сергеев.
«В 1869 году Д.И. Менделеев впервые опубликовал свою первую
схему Периодической таблицы в статье «Соотношение свойств с
атомным весом элементов» в журнале Русского химического
общества. С тех пор Периодическая таблица химических элементов
является одним из самых значительных достижений в науке,
охватывая сущность не только химии, но и всех естественных
наук.
Итоги Международного года 150-летия Таблицы Менделеева
Член-корреспондент РАН Наталия Тарасова о Международном годе Периодической таблицы Менделеева
Закрытие года Таблицы Менделеева и 90-летие Химического факультета МГУ
Впечатляющая наглядность. Заслуги Менделеева не меркнут – Поиск
08.02.2020
Со школьных лет Периодическую таблицу химических элементов Дмитрия Менделеева мы помним как самое масштабное наглядное пособие – в кабинете химии она занимала целую стену. Рядом в красивой раме – портрет ее создателя.
Прошлый год был провозглашен Генеральной ассамблеей ООН Международным годом Периодической таблицы химических элементов (International Year of the Periodic Table of Chemical Elements – IYPT2019) – 150 лет назад великий русский ученый Д.И.Менделеев опубликовал ее первый вариант.
Проведение IYPT2019 поддержали более чем 80 национальных академий наук и исследовательских обществ. Открыли Международный год Периодической таблицы химических элементов 29 января 2019 года в Париже, в штаб-квартире ЮНЕСКО. В России Международный год взял старт 6 февраля на заседании в Президиуме РАН. Событие максимально приблизили к 8 февраля – дню рождения Дмитрия Ивановича и Дню российской науки.
Историки науки считают датой открытия Периодического закона 1 марта 1869 года, когда наш великий соотечественник Д.И.Менделеев завершил работу над исследованием «Опыт системы на основе элементов от их атомного веса и химического сходства». Этому событию предшествовали усилия многих выдающихся исследователей по всему миру, сделавших несколько попыток систематизации химических элементов.
Д.И.Менделеев опубликовал свой первый вариант Периодической таблицы в 1869 году в статье «Соотношение свойств с атомным весом элементов». Еще ранее – в феврале того же года – научное извещение о сделанном открытии разослал ведущим химикам мира. Таблица включала все известные в то время химические элементы (61) и была построена так, что химические свойства объяснялись атомным весом. Он также поставил под сомнение атомный вес некоторых уже известных элементов и предсказал, что есть определенные элементы, которые только предстоит обнаружить.
Недавно журнал New Yorker опубликовал статью Неймы Джахроми «Истории, скрытые в Периодической таблице», где отмечен известный факт о том, что «Менделеев точно предсказал существование тогда еще не открытых элементов, таких как галлий и германий, и предсказал их взаимодействие с другими элементами». В статье приводятся также слова Эрика Шерри из Калифорнийского университета (Лос-Анджелес), считавшего, что «русский химик был главным рассказчиком и по сравнению с Мейером и другими конкурентами более эффективным евангелистом для периодической системы».
Бытовала легенда, что идея системы химических элементов пришла к Менделееву во сне. Однако сам ученый, отвечая однажды на вопрос, как он открыл периодическую систему, сказал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сидел – и вдруг готово».
В начале 1940-х годов после открытия первых искусственных элементов – нептуния и плутония – вопрос о пределах существования элементов и свойствах распада ядер тяжелее урана вызвал исключительный интерес фундаментальной науки к строению материи и характеру ее превращений. Многие десятилетия подобные исследования проводились и проводятся в крупных научных центрах Германии, США, Японии, Франции и Лаборатории ядерных реакций имени Г.Н.Флерова Объединенного института ядерных исследований, которая была организована в 1957 году и вскоре оснащена ускорителем тяжелых ионов У-300. Это положило начало новому направлению в ядерной физике – физике тяжелых ионов. Международные союзы чистой и прикладной физики (IUPAP) и химии (IUPAC) признали приоритет Дубны в открытии 102-го и 105-го элементов, совместные с Национальной лабораторией в (Беркли, США) открытия 103-го и 104-го и отметили большой вклад коллектива ОИЯИ в открытии 106-го и 108-го элементов. В 1997 году на Генеральной Ассамблее IUPAC 105-й элемент был назван дубний.
В 1997 году на Генеральной Ассамблее IUPAC 105-й элемент был назван дубний.
К концу ХХ столетия ученым в Лаборатории ядерных реакций Дубны удалось продвинуться в синтезе сверхтяжелых элементов и понимании проблемы их стабильности. Благодаря достигнутой высокой эффективности ускорения тяжелых ионных пучков и значительному улучшению экспериментальных методов впервые в 2000-2012 годах были синтезированы самые тяжелые (сверхтяжелые) элементы с атомными номерами 113-118.
Для элемента 118 сотрудничающие команды первооткрывателей Объединенного института ядерных исследований (Россия) и Национальной лаборатории Лоуренса Ливермора (США) предложили название oganesson и символ Og. Факт, свидетельствующий о признании новаторской роли их руководителя профессора Юрия Оганесяна в исследовании трансактиноидных элементов. Его многочисленные достижения включают открытие сверхтяжелых элементов, значительные успехи в изучении физики сверхтяжелых ядер, в том числе получение экспериментальных данных о существовании предсказанного теорией «Острова стабильности» сверхтяжелых элементов. («Остров стабильности» – это группа тяжелых нуклидов, расположенных далеко от известной области ядер, время жизни которых дольше, чем у их более легких предшественников. Предполагается, что благодаря этой особенности они могут обладать высокой стабильностью и даже существовать в природе. Согласно теории, изотопы сверхтяжелых элементов, обладающие повышенной стабильностью, образуют на карте нуклидов большую зону в виде острова с вершиной, расположенной вблизи «ядра-долгожителя» с числом протонов Z=110 и нейтронов N=182. – Прим. ред.)
(«Остров стабильности» – это группа тяжелых нуклидов, расположенных далеко от известной области ядер, время жизни которых дольше, чем у их более легких предшественников. Предполагается, что благодаря этой особенности они могут обладать высокой стабильностью и даже существовать в природе. Согласно теории, изотопы сверхтяжелых элементов, обладающие повышенной стабильностью, образуют на карте нуклидов большую зону в виде острова с вершиной, расположенной вблизи «ядра-долгожителя» с числом протонов Z=110 и нейтронов N=182. – Прим. ред.)
Элемент 118 завершает 7-ю строку Периодической таблицы. Закроет ли он Периодическую таблицу элементов?
«В последние годы ученые создали сверхтяжелые элементы, которые угрожают разбить Периодическую таблицу, – пишет Н.Джахроми. – В 1998 году российские ученые создали новый элемент, который исчез спустя чуть больше секунды. Главный русский охотник за стихиями Ю.Оганесян назвал его в честь своего покойного наставника Г.Флерова. В 2016 году Ю.Оганесян получил и свое имя на атоме. Его элемент, который в настоящее время является последним в таблице Менделеева, был также короткой вспышкой в исследовательском оборудовании. «Такие элементы, как флеровий и оганесон (№114 и №118 соответственно), могут означать «конец химии, какой мы ее знаем», – приводит автор статьи слова Кита Чапмена из английского журнала Chemistry World. Первоначально предполагалось, что таблица описывает строительные блоки природы. Но поскольку охотники за элементами стали их создателями, смысл таблицы изменился. Теперь она описывает, что возможно в дополнение к тому, что просто существует».
В 2016 году Ю.Оганесян получил и свое имя на атоме. Его элемент, который в настоящее время является последним в таблице Менделеева, был также короткой вспышкой в исследовательском оборудовании. «Такие элементы, как флеровий и оганесон (№114 и №118 соответственно), могут означать «конец химии, какой мы ее знаем», – приводит автор статьи слова Кита Чапмена из английского журнала Chemistry World. Первоначально предполагалось, что таблица описывает строительные блоки природы. Но поскольку охотники за элементами стали их создателями, смысл таблицы изменился. Теперь она описывает, что возможно в дополнение к тому, что просто существует».
Технеций, первый искусственный элемент, все еще используется в лечении рака во всем мире, отмечено в New Yorker. Теоретически более новые элементы могут быть аналогичным образом полезны: например, флеровий размером с горошину «мог бы обеспечить город энергией», если бы его удалось стабилизировать.
В рамках Международного года Периодической таблицы химических элементов в России проведены более пятисот научно-популярных и образовательных мероприятий, цель которых – привлечение внимания к науке и ее достижениям. На закрытии Международного года в МГУ Александр Сергеев, президент РАН, подчеркнул, что главным результатом стало пробужденное в юных умах здорового любопытства к тому, как много значат химические элементы в нашей жизни.
На закрытии Международного года в МГУ Александр Сергеев, президент РАН, подчеркнул, что главным результатом стало пробужденное в юных умах здорового любопытства к тому, как много значат химические элементы в нашей жизни.
Оценить завершившийся Международный год Периодической таблицы химических элементов для газеты «Поиск» любезно согласился вице-президент РАН академик Алексей Хохлов:
– Проведено много мероприятий, вызвавших очень большой интерес научного сообщества, причем как в России, так и за рубежом. В том числе конференций по органической и неорганической химии, по ряду других областей науки, связанных с Периодической таблицей химических элементов, более чем в 80 странах мира, в 295 городах. Имя российского ученого звучало на выставках нового типа – интерактивных – и открытых уроках, на научных фестивалях и других мероприятиях, проводимых по всему земному шару. Во многих странах были организованы выставки, посвященные Периодической таблице, отмечался вклад в ее создание Д. И.Менделеева. Среди наиболее ярких событий Международного года – Всероссийский фестиваль NAUKA 0+, Всероссийский съезд учителей химии, XXI Менделеевский съезд по общей и прикладной химии, где приняли участие почти три тысячи исследователей из 40 стан планеты.
И.Менделеева. Среди наиболее ярких событий Международного года – Всероссийский фестиваль NAUKA 0+, Всероссийский съезд учителей химии, XXI Менделеевский съезд по общей и прикладной химии, где приняли участие почти три тысячи исследователей из 40 стан планеты.
Открытие Д.И.Менделеева, его значение для науки получили широкий резонанс,
– подчеркнул вице-президент РАН.
Итог года весьма положительный: многие молодые люди заинтересовались химией и другими науками, связанными с периодической системой химических элементов Менделеева.
Алексей Ремович, президент РАН неоднократно высказывал надежду на то, что в 2019 году Периодическая таблица официально на международном уровне получит имя Дмитрия Менделеева. Не получила.
Не соглашусь с вами. То или иное открытие связывается с именем первооткрывателя не в силу изданного кем-то «декрета», этот факт закрепляется мнением научного сообщества. В результате всех мероприятий года стала очевидной ключевая роль Д. И.Менделеева в создании Периодической таблицы химических элементов. Не случайно его портрет помещен на эмблему Года таблицы, которую во многих странах так и зовут – Менделеевской. Главное, что роль Д.И.Менделеева, которая подчеркивалась и в отечественных публикациях на эту тему, и в зарубежных, стала более выпуклой, заметной для молодежи, прежде всего студентов, аспирантов, по всему миру. И в умах людей, интересующихся химией, Периодическая таблица, конечно, ассоциируется прежде всего с именем Д.Менделеева.
И.Менделеева в создании Периодической таблицы химических элементов. Не случайно его портрет помещен на эмблему Года таблицы, которую во многих странах так и зовут – Менделеевской. Главное, что роль Д.И.Менделеева, которая подчеркивалась и в отечественных публикациях на эту тему, и в зарубежных, стала более выпуклой, заметной для молодежи, прежде всего студентов, аспирантов, по всему миру. И в умах людей, интересующихся химией, Периодическая таблица, конечно, ассоциируется прежде всего с именем Д.Менделеева.
Как вы думаете, эту таблицу когда-нибудь заполнят или этот процесс бесконечен, как жизнь?
Есть предсказание о существовании «острова стабильности» при более высоких зарядах атомного ядра. Так что, по крайней мере, до тех пор, пока мы не дойдем до этих значений, таблица Менделеева, думаю, будет расширяться.
Определенно будет расширяться,
– продолжил тему академик Ю.Оганесян, научный руководитель Лаборатории ядерных реакций им. Г.Н.Флерова ОИЯИ.
Г.Н.Флерова ОИЯИ.
Ядра могут иметь массу более 300, а количество элементов – более 118. На примере 118-го видно, что у элементов, именуемых сегодня сверхтяжелыми, уже появляются признаки, отличающие их от легких гомологов. Экспериментальные данные здесь, к сожалению, весьма скудны, прежде всего из-за малого их количества и краткого времени жизни. Одно из направлений будущих исследований – изучение атомной структуры и химических свойств уже синтезированных сверхтяжелых элементов. Сложнее организовать изучение их химических свойств даже на новом оборудовании из-за короткого периода полураспада, исчисляемого долями миллисекунды. Пока не видно и принципиальных ограничений для синтеза 119-го и 120-го элементов – начала 8-го периода таблицы. Несмотря на то что некоторые попытки их получения на старых установках совершались, например, в разных лабораториях в реакциях с ионами титана, хрома и даже железа, усилия не увенчались успехом. Но это – дело техники. Сложнее с изучением химических свойств будущих сверхтяжелых элементов, ведь их период полураспада исчисляется долями миллисекунды. Но и здесь особых сюрпризов не ожидается. Надо работать.
Но и здесь особых сюрпризов не ожидается. Надо работать.
То есть выход за пределы 118-го элемента – дело будущего?
Возможно. Мы полагаем, что элемент 122 либо откроет новую, так называемую серию суперактиноидов, включающую еще 33 элемента вплоть до 155-го, либо 122-й элемент и все последующие продолжат 8-й период. Но в этом случае групповое различие элементов будет быстро исчезать или, как говорят ученые, размываться. Так что пока остается только гадать, как может выглядеть химия атомных гигантов за пределами Периодического закона.
Для новых открытий определенно требуется соответствующее оборудование.
Оно теперь есть. С 2012 года мы сильно сократили экспериментальную программу на действующих установках и начали строить новую лабораторию, получившую название ФСЭ – «Фабрика сверхтяжелых элементов». Пока она не имеет аналогов в мире и отражает технический уровень всех этапов работы по получению сверхтяжелых элементов: от создания мишеней из трансурановых элементов до доставки сверхтяжелых нуклидов к экспериментальным физическим и химическим установкам. По выходу на проектный уровень возможности ФСЭ превзойдут существующий уровень в 50-100 раз.
По выходу на проектный уровень возможности ФСЭ превзойдут существующий уровень в 50-100 раз.
Юрий Цолакович, за 80 лет после открытия нептуния и плутония – первых искусственных элементов – таблица пополнилась еще 24 названиями. Пять самых тяжелых элементов вписаны в нее за последние 7 лет. Запуск ФСЭ спровоцирует «ревизию» Периодического закона?
Вряд ли. В природе сверхтяжелых элементов пока не нашли, и, вероятнее всего, что самых тяжелых не было даже при зарождении Солнечной системы. Однако все 118 известных сегодня науке элементов располагаются в таблице строго соответственно Периодическому закону, сформулированному полтора века назад Д.И.Менделеевым. Лучше всего ответил на этот вопрос сам ученый. «Я думаю, что она (таблица) еще будет меняться, но совсем не уйдет, останется», – говорил он. Как в воду глядел.
Подготовил Андрей СУББОТИН
Ртуть – информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к Таллий >
| Группа | 12 | Температура плавления | −38,829° С, -37,892 ° F, 234,321 К |
| Период | 6 | Точка кипения | 356,619 ° С, 673,914 ° F, 629,769 К |
| Блок | д | Плотность (г см −3 ) | 13,5336 |
| Атомный номер | 80 | Относительная атомная масса | 200. 592 592 |
| Состояние при 20°C | Жидкость | Ключевые изотопы | 202 рт.ст. |
| Электронная конфигурация | [Хе] 4f 1 4 5d 1 0 6 с 2 | Номер КАС | 7439-97-6 |
| ХимПаук ID | 22373 | ChemSpider — бесплатная база данных химической структуры. | |
Изображение представляет собой традиционный алхимический символ ртути. Это также астрологический символ планеты Меркурий. Дракон или змей на заднем плане происходят из ранних алхимических рисунков и часто ассоциируются с элементом.
Жидкий серебристый металл.
Ртуть на протяжении тысячелетий очаровывала людей как тяжелый жидкий металл. Однако из-за ее токсичности многие виды использования ртути прекращаются или пересматриваются.
В настоящее время в основном используется в химической промышленности в качестве катализатора. Он также используется в некоторых электрических переключателях и выпрямителях.
Ранее его основным применением было производство гидроксида натрия и хлора путем электролиза рассола. Все эти растения будут выведены из эксплуатации к 2020 году. Он также широко использовался в батареях, люминесцентных лампах, производстве войлока, термометрах и барометрах. Опять же, эти виды использования были прекращены.
Опять же, эти виды использования были прекращены.
Ртуть легко образует сплавы, называемые амальгамами, с другими металлами, такими как золото, серебро и олово. Легкость, с которой он смешивается с золотом, сделала его полезным для извлечения золота из руд. Амальгамы ртути также использовались в зубных пломбах.
Сульфид ртути (киноварь) — это высококачественный ярко-красный пигмент для краски, но он очень токсичен, поэтому в настоящее время используется с большой осторожностью.
Ртуть не играет известной биологической роли, но присутствует во всех живых существах и широко распространена в окружающей среде. Каждый глоток пищи, которую мы едим, содержит немного ртути.
Наше ежедневное потребление составляет менее 0,01 миллиграмма (около 0,3 грамма за всю жизнь), и с этим мы легко справимся. Однако в гораздо более высоких дозах она токсична, а одна из форм ртути — метилртуть — особенно опасна. Он может накапливаться в мясе рыб и поедать людей, вызывая у них болезни.
Ртуть редко встречается в природе в чистом виде, но ее можно найти в виде капель в киноварных (сульфидных ртутных) рудах. Китай и Кыргызстан являются основными производителями ртути. Металл получают нагреванием киновари в токе воздуха и конденсацией паров.
Элементы и история периодической таблицы
Киноварь (также известная как киноварь, сульфид ртути, HgS) использовалась в качестве ярко-красного пигмента палеолитическими художниками 30 000 лет назад для украшения пещер в Испании и Франции. Киноварь выделяла свою ртуть просто при нагревании в тигле, и этот металл очаровывал людей, потому что это была жидкость, которая растворяла золото. Древние использовали в больших масштабах для добычи россыпного золота из наносов рек. Ртуть растворяла золото, которое можно было восстановить, отогнав ртуть.
Месторождение Альмаден в Испании снабжало Европу ртутью. В Америке именно испанские завоеватели использовали большие залежи киновари в Уанкавелике для добычи золота. В 1848 году горняки во время калифорнийской золотой лихорадки использовали ртуть из шахт Нью-Алмаден в Калифорнии.
В 1848 году горняки во время калифорнийской золотой лихорадки использовали ртуть из шахт Нью-Алмаден в Калифорнии.
Несмотря на высокую токсичность, ртуть нашла множество применений, например, в термометрах, но теперь они строго засекречены.
| Атомный радиус, несвязанный (Å) | 2,23 | Ковалентный радиус (Å) | 1,32 |
| Сродство к электрону (кДж моль −1 ) | Нестабильный | Электроотрицательность (шкала Полинга) | 1,9 |
| Энергии ионизации (кДж моль −1 ) | 1 ст 1007. 2 -й 1809.756 3 рд 3299,8 | ||
| Общие степени окисления | 2 , 1 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
196 рт. ст. ст. | 195.966 | 0,15 | > 2,5 x 10 18 г | α | |
| 198 рт.ст. | 197,967 | 9,97 | – | – | |
199 рт. ст. ст. | 198,968 | 16,87 | – | – | |
| 200 рт.ст. | 199.968 | 23.1 | – | – | |
201 рт. ст. ст. | 200.970 | 13.18 | – | – | |
| 202 рт.ст. | 201.971 | 29,86 | – | – | |
204 рт. ст. ст. | 203,973 | 6,87 | – | – | |
|
|
| Удельная теплоемкость (Дж кг -1 К -1 ) | 140 | Модуль Юнга (ГПа) | Неизвестный | |||||||||||
| Модуль сдвига (ГПа) | Неизвестный | Объемный модуль (ГПа) | 25 | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
| Слушайте подкаст Меркьюри |
Стенограмма: (Промо) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит Привет! На этой неделе мы исследуем связь между безумными шляпниками, тушью для ресниц, императорами Китая и рыбацкими поплавками; странная комбинация, вы могли бы сказать, но, вероятно, не настолько странная, как эта! Фред Кэмпбелл Может ли человек пройти через бассейн, наполненный ртутью? Не спрашивайте меня, как разговор дошел до этого места, но, находясь в окружении друзей, которые, честно говоря, назвали бы себя неграмотными в науке, я знал, что это зависит от меня, условного ученого, сидящего за столом. дайте окончательный ответ. “Нет.” Я уверенно сказал, добавив несколько самодовольно: «Он далеко не достаточно плотный». На следующее утро меня грубо разбудил звонок мобильного; Я был неправ! Элементарная ртуть, жидкая при комнатной температуре, в 13 раз плотнее воды. Достаточно получается, чтобы поддержать мужчину средней комплекции и да, если набрать человека, сидящего на ртути в Google, вы быстро найдете фотографию 1972 года, опубликованную в National Geographic, на которой мужчина в костюме и в ботинках сидит без посторонней помощи, хотя и немного нервно, на вершине резервуара с пульсирующей ртутью. С его греческим названием Hydrargyrum , буквально означающим жидкое серебро, возможно, неудивительно, что в течение последних трех тысячелетий цивилизации были поражены, веря, что ртуть обладает чудесными физическими и духовными свойствами, но часто те, кто баловался, достигали неприятного и ртутного конца. . Римляне были известны тем, что использовали его в косметике, часто при этом уродуя свои лица. Египтяне были похоронены с ним, чтобы продемонстрировать доблесть их цивилизаций в добыче полезных ископаемых, а древние китайцы пили смертоносные коктейли ртути в поисках вечной жизни и благополучия. Перенесемся в 18 й век, и впервые психологические заболевания были связаны с воздействием ртути. В безумии многих миллионеров обвиняли широкое использование нитрата ртути в шляпной промышленности и фразу м реклама в качестве шляпника был придуман. Эта ссылка почти наверняка вдохновила Льюиса Кэрролла на создание Безумного Шляпника, хотя многие споры ведутся по поводу того, действительно ли у него проявляются симптомы отравления ртутью. С этого момента опасности ртути были хорошо задокументированы; но, несмотря на его токсичность, он продолжал находить множество применений в повседневных приложениях на протяжении всего прошлого века. С одной стороны, мне грустно думать, что ртуть в конце концов станет стихийным артефактом, безнадежно застрявшим между золотом и таллием в таблице Менделеева, но с другой, она постоянно напоминает мне об опасностях, которые скрываются за фасадом ее прекрасного серебряный блеск. Крис Смит Фред Кэмпбелл из Chemistry World об использовании и злоупотреблениях элементом номер 80, быстрым серебром, также известным как ртуть. Вот вкус того, чего ожидать в следующий раз. Adina Payton Первое, о чем думает большинство людей при упоминании этого элемента, — это клизма с барием или глоток с барием, болезненные воспоминания часто всплывают после рентгенологической клиники, где милая медсестра спросила вас: «какой вкус вы предпочитаете». , клубника или банан’ 906:20 . Крис Смит Трудно проглотить, можно сказать, но, к счастью, очень удобоваримое описание бария. Это придумывается с Адиной Пэйтон на Химии на следующей неделе в своей стихии. (Промо) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists.com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. (конец акции) |
Нажмите здесь, чтобы просмотреть видеоролики о Mercury
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
W. M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г. Таблица 906 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd Издание 2011 г.
Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г.
Периодическая таблица видео, по состоянию на декабрь 2014 г.
Частично получены из материалов, предоставленных Британской геологической службой © NERC.
Исторический текст
Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
Podccasts
, созданные в здравых науках
. .
Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета.
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Исследуйте все элементы
Факты об элементе ртути (Hg или атомный номер 80)
Эта запись была опубликована от Anne Helmenstine (обновлено )
Ртуть — блестящий жидкий металл серебристого цвета. Это единственный металлический элемент в периодической таблице, который находится в жидком состоянии при комнатной температуре и давлении. Ртуть имеет атомный номер 80 с символом элемента Hg. Вот коллекция фактов об элементе ртути, включая ее свойства, историю и использование.
Ртуть — единственный металл, который является жидким элементом при комнатной температуре. (Таво Романн)Быстрые факты: Элемент Меркурий
- Название элемента: Mercury
- Символ элемента: Hg
- Атомный номер: 80
- Атомный вес: 200,592
- Классификация: переходный металл или постпереходный металл Hg происходит от названия Hydrargyrum , что означает «вода-серебро». Название Mercury происходит от римского бога Меркурия, известного своей стремительностью.
- Кем обнаружен: известен до 2000 г.
 до н.э. в Китае и Индии
до н.э. в Китае и Индии - Электронная конфигурация: [XE] 4F 14 5D 10 6S 2
- элемент ртуть. Он был известен древним китайцам и индусам, которые использовали его в лечебных целях. Ртуть была найдена в египетских гробницах, датируемых 1500 годом до нашей эры.
Как Меркурий получил свое название
Символ элемента Меркурия «Hg» означает его старое название, гидраргирум. Hydrargyrum означает «вода-серебро». Современное название относится к элементу и римскому богу Меркурию, в честь которого была названа планета Меркурий. Это название элемента восходит к эпохе алхимии, что делает ртуть единственным элементом, сохранившим свое алхимическое название как название IUPAC.
Применение ртути
Исторически ртуть широко использовалась в термометрах, манометрах, барометрах, сфимоманометрах, переключателях и реле, поплавковых клапанах и люминесцентных лампах. Однако токсичность ртути привела к замене ее другими материалами, когда это было возможно, поэтому сейчас редко можно найти ртутный термометр или сфимоманометр.
 Он по-прежнему широко используется в люминесцентных лампах и зубной амальгаме. Он используется для производства металлоорганического соединения тимерозола, который сохраняет некоторые вакцины, косметику и растворы для контактных линз. Местный антисептик мербромин или меркурохром по-прежнему используется в некоторых странах. Ртуть находит применение в батареях, добыче золота и серебра и изготовлении войлочных шляп. Хотя сегодня этот элемент мало используется для этих приложений, очистка окружающей среды от прошлого остается проблемой. В промышленных масштабах ртуть используется для получения хлора из хлорида натрия и гидроксида натрия из металлического натрия. Гремучая ртуть используется в качестве капсюля в стрелковом оружии и пиротехнике.
Он по-прежнему широко используется в люминесцентных лампах и зубной амальгаме. Он используется для производства металлоорганического соединения тимерозола, который сохраняет некоторые вакцины, косметику и растворы для контактных линз. Местный антисептик мербромин или меркурохром по-прежнему используется в некоторых странах. Ртуть находит применение в батареях, добыче золота и серебра и изготовлении войлочных шляп. Хотя сегодня этот элемент мало используется для этих приложений, очистка окружающей среды от прошлого остается проблемой. В промышленных масштабах ртуть используется для получения хлора из хлорида натрия и гидроксида натрия из металлического натрия. Гремучая ртуть используется в качестве капсюля в стрелковом оружии и пиротехнике.Изотопы ртути
Существует семь стабильных изотопов ртути. Наиболее распространена ртуть-202, на долю которой приходится 29,86% природного элемента. Существует множество радиоактивных изотопов. Самым долгоживущим радиоизотопом является ртуть-194, период полураспада которого составляет 444 года.

Источники ртути
Ртуть — очень редкий элемент в земной коре. На его долю приходится всего около 0,08 частей на миллион массы земной коры. Основным источником ртути является минеральная киноварь. Киноварь — это сульфид ртути. Извлечение ртути из руды требует нагревания минерала и сбора паров ртути. Также это редкость, иногда ртуть встречается в природе в свободном виде. Ртутные руды, как правило, встречаются вблизи горячих источников или вулканических регионов.
Влияние на здоровье
Исторически ртуть нашла применение в медицине. Это произошло во многих лекарствах и дезинфицирующих средствах. Его использование сократилось из-за токсичности ртути. Но этот элемент по-прежнему встречается в некоторых слабительных, глазных каплях, мочегонных средствах, назальных спреях, антисептиках и мазях.
Ртуть всасывается при вдыхании, через кожу и слизистые оболочки, а также при приеме внутрь. Органические соединения ртути наиболее токсичны, но даже чистый металл может вызывать острые и хронические отравления.
 Ртуть повреждает мозг, легкие и почки. К первым симптомам отравления относятся бессонница; раздражительность; отсутствие координации; нарушение зрения, речи и слуха; тремор; и нарушение когнитивных способностей. Острые отравления также сопровождаются кашлем, болью в груди и воспалением легочной ткани. Отравление ртутью лечат хелатирующими агентами.
Ртуть повреждает мозг, легкие и почки. К первым симптомам отравления относятся бессонница; раздражительность; отсутствие координации; нарушение зрения, речи и слуха; тремор; и нарушение когнитивных способностей. Острые отравления также сопровождаются кашлем, болью в груди и воспалением легочной ткани. Отравление ртутью лечат хелатирующими агентами.Интересные факты об элементе ртути
- Причина, по которой ртуть образует округлые жидкие шарики, заключается в ее чрезвычайно высоком поверхностном натяжении.
- Ртуть очень летучая, поэтому она рассеивается в воздухе из открытых контейнеров.
- Меркурий чрезвычайно плотный. Это один из тяжелых металлов.
- Ртуть обычно имеет степень окисления +1 или +2, но иногда она имеет степень окисления +4, что заставляет ее вести себя как благородный газ.
- Большинство металлов являются отличными теплопроводниками и электропроводниками, но ртуть плохо проводит тепло и является лишь слабым электропроводником.

- Большинство металлов легко реагируют с кислотами, но ртуть не реагирует с большинством из них.
- Ртуть образует амальгамы со всеми металлами, кроме железа. Таким образом, железо является хорошим выбором контейнера для жидкого металла.
- Электрический разряд может вызвать соединение ртути с инертными газами неоном, криптоном, аргоном и ксеноном.
- Меркурий и самолеты несовместимы! Ртуть вступает в реакцию с алюминием, используемым в самолетах, образуя амальгаму, которая мешает оксидному слою, обычно защищающему алюминий. По сути, алюминий, подвергающийся воздействию ртути, подвергается коррозии, как и железо.
- Ртутьсодержащий минерал киноварь является источником красного пигмента векильона.
- Фраза «сумасшедший как шляпник» происходит от отравления ртутью шляпников, которые использовали этот металл в процессе валяния.
- В 19 веке «синяя масса» представляла собой ртутную таблетку или сироп, назначаемые при зубной боли, деторождении, депрессии и запорах.

- На Всемирной выставке 1937 года в Париже был представлен ртутный фонтан, который сегодня экспонируется в Fundació Joan Miró в Барселоне, Испания.
Физические данные
Состояние при комнатной температуре (300 К) : Жидкость
Внешний вид: Тяжелый серебристый белый металл
Плотность: 13.546 G/CC (20 ° C)
. (-38,83 °C или -37,894 °F)
Температура кипения: 356,62 K (356,62 °C или 629,77 °F)
Критическая точка: 1750 K при 172 МПа
0 Теплота плавления18: 29 кДж/0 моль.
Теплота испарения: 59,11 кДж/моль
Молярная теплоемкость: 27,983 Дж/моль·К
Удельная теплоемкость: 0,138 Дж/г·К (при 20 °C)Атомные данные
Степени окисления: , 1 90 : 2.00
Атомный радиус: 1,32 Å
Атомный объем: 14,8 куб. /Мол
/Мол
Ионовый радиус: 1,10 Å (+2E) 1,27 Å (+1E)
COULD (+2E) 1,27 Å (+1E)
COULD (+2E) 1,27 Å (+1E)
COULD (+2E) 1,27 Å (+1E)
: : : : : : : : : : : : : . дер-Ваальсов радиус: 1,55 Å
Энергия первой ионизации: 1007,065 кДж/моль
Энергия второй ионизации: 1809,755 кДж/моль
Энергия третьей ионизации: 3299,796 кДж/мольСсылки
0 Eisler, R.441. Опасность ртути для живых организмов . КПР Пресс. ISBN 978-0-8493-9212-2. - Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 0-08-037941-9.
- Лиде, Д. Р., изд. (2005). CRC Справочник по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5.

- Норрби, Л. Дж. (1991). «Почему ртуть жидкая? Или почему релятивистские эффекты не попадают в учебники по химии?». Журнал химического образования . 68 (2): 110. doi:10.1021/ed068p110
- Вест, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4.
ртуть | Определение, использование, плотность и факты
Mercury
Посмотреть все СМИ
- Ключевые люди:
- Георг Брандт
- Похожие темы:
- переработка ртути эндокринный разрушитель нейротоксин отравление ртутью Болезнь Минамата
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
ртуть (Hg) , также называемая ртутью , химический элемент, жидкий металл группы 12 (IIb, или группа цинка) периодической таблицы.

Element Properties atomic number 80 atomic weight 200.592 melting point −38.83 °C (−37.89 °F) boiling point 356,62 °C (673,91 °F) удельный вес 13,5 при 20 °C (68 °F) валентность 1, 2 электронная конфигурация 2-8-18-2 (2-8-18-2) f 14 5 d 10 6 s 2 также был известен на Востоке как Меркурий 15 в Египте и вероятно до н.э. Название ртуть возникло в алхимии 6-го века, в которой символ планеты использовался для обозначения металла; химический символ Hg происходит от латинского Hydrargyrum , «жидкое серебро».
 Хотя его токсичность была признана на раннем этапе, его основное применение было в медицинских целях.
Хотя его токсичность была признана на раннем этапе, его основное применение было в медицинских целях.Ртуть — единственный элементарный металл, который находится в жидком состоянии при комнатной температуре. (Цезий плавится при температуре около 28,5 ° C [83 ° F], галлий примерно при 30 ° C [86 ° F] и рубидий примерно при 39 ° C [102 ° F].) Ртуть серебристо-белого цвета, медленно тускнеет во влажном воздухе. , и замерзает в мягкое твердое вещество, такое как олово или свинец, при температуре -38,83 ° C (-37,89 ° F). Он кипит при 356,62 ° C (673,91 ° F).
Сплавы с медью, оловом и цинком образуют амальгамы или жидкие сплавы. Амальгама с серебром используется в качестве пломбы в стоматологии. Ртуть не смачивает стекло и не прилипает к нему, и это свойство в сочетании с ее быстрым и равномерным объемным расширением во всем жидком диапазоне сделало ее полезной в термометрах. (Ртутные термометры были вытеснены более точными электронными цифровыми термометрами в начале 21 века.
 ) Барометры и манометры также использовали его высокую плотность и низкое давление пара. Однако токсичность ртути привела к ее замене в этих приборах. Золото и серебро легко растворяются в ртути, и в прошлом это свойство использовалось для извлечения этих металлов из их руд.
) Барометры и манометры также использовали его высокую плотность и низкое давление пара. Однако токсичность ртути привела к ее замене в этих приборах. Золото и серебро легко растворяются в ртути, и в прошлом это свойство использовалось для извлечения этих металлов из их руд.Britannica Викторина
118 Названий и символов периодической таблицы Викторина
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Хорошая электропроводность ртути делает ее исключительно полезной в герметичных электрических переключателях и реле. Электрический разряд через пары ртути, содержащиеся в трубке или колбе из плавленого кварца, создает голубоватое свечение, богатое ультрафиолетовым светом, явление, используемое в ультрафиолетовых, люминесцентных и ртутных лампах высокого давления.
 Некоторое количество ртути используется при приготовлении фармацевтических препаратов, а также сельскохозяйственных и промышленных фунгицидов.
Некоторое количество ртути используется при приготовлении фармацевтических препаратов, а также сельскохозяйственных и промышленных фунгицидов.В 20-м веке использование ртути в производстве хлора и гидроксида натрия путем электролиза рассола зависело от того факта, что ртуть, используемая в качестве отрицательного полюса или катода, растворяет выделяющийся натрий с образованием жидкой амальгамы. Однако в начале 21 века заводы с ртутными элементами для производства хлора и гидроксида натрия в основном были выведены из эксплуатации.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Ртуть встречается в земной коре в среднем в количестве около 0,08 грамма (0,003 унции) на тонну породы. Основная руда — красный сульфид, киноварь. Самородная ртуть встречается в виде отдельных капель, а иногда и в более крупных жидких массах, обычно с киноварью, вблизи вулканов или горячих источников. Найдены также крайне редкие природные сплавы ртути: мошелландсбергит (с серебром), потарит (с палладием), амальгама золота.
 Более 90 процентов мировых поставок ртути поступает из Китая; часто это побочный продукт добычи золота.
Более 90 процентов мировых поставок ртути поступает из Китая; часто это побочный продукт добычи золота.Киноварь добывают шахтным или открытым способом и очищают флотацией. Большинство методов извлечения ртути основаны на летучести металла и на том факте, что киноварь легко разлагается на воздухе или известью с образованием свободного металла. Ртуть извлекают из киновари путем ее обжига на воздухе с последующей конденсацией паров ртути. Из-за токсичности ртути и угрозы жесткого контроля за загрязнением внимание уделяется более безопасным методам извлечения ртути. Обычно они основаны на том факте, что киноварь легко растворяется в растворах гипохлорита или сульфида натрия, из которых ртуть может быть извлечена осаждением цинком или алюминием или электролизом. (Для обработки промышленного производства ртути см. обработка ртути; по минералогическим свойствам см. самородный элемент [таблица].)
Ртуть токсична. Отравление может произойти в результате вдыхания паров, проглатывания растворимых соединений или всасывания ртути через кожу.




 066
066 1
1
 Я однозначно оказался неправ, но за долю секунды это чувство трансформировалось в чистое изумление. Удивление не только тому факту, что ртуть была настолько плотной, что могла выдержать человека, но и тому, что этот человек, скорее всего, отравил себя смертельной дозой ртути в одной смертельной позе. Наверняка даже в 1972, такая деятельность рассматривалась как исключительно плохая идея. Конечно, это был не первый случай, когда человека опустили ртутью.
Я однозначно оказался неправ, но за долю секунды это чувство трансформировалось в чистое изумление. Удивление не только тому факту, что ртуть была настолько плотной, что могла выдержать человека, но и тому, что этот человек, скорее всего, отравил себя смертельной дозой ртути в одной смертельной позе. Наверняка даже в 1972, такая деятельность рассматривалась как исключительно плохая идея. Конечно, это был не первый случай, когда человека опустили ртутью. Говорят, что первый император Китая Цинь Ши Хуан так сильно верил в магические свойства Меркурия, что умер, стремясь к бессмертию, откашлявшись.0017 Ртуть и порошкообразный нефрит, тонизирующее средство. Считается, что его могила, которую еще предстоит полностью раскопать, окружена великими реками стихии и охраняется 8000 солдат терракотовой армии.
Говорят, что первый император Китая Цинь Ши Хуан так сильно верил в магические свойства Меркурия, что умер, стремясь к бессмертию, откашлявшись.0017 Ртуть и порошкообразный нефрит, тонизирующее средство. Считается, что его могила, которую еще предстоит полностью раскопать, окружена великими реками стихии и охраняется 8000 солдат терракотовой армии. Чтобы не перечислять огромный список странных и замечательных применений ртути, я хотел бы лишь вкратце упомянуть о моем личном фаворите, рыболовных поплавках, используемых для поддержания регулярного колебания на поверхности воды, ртутный поплавок оказывается настолько привлекательным для рыбы, что даже сейчас после того, как его использование было запрещено во всем мире, ведутся активные исследования, чтобы найти замену для выполнения той же работы. Его до сих пор можно найти в стоматологии, где он используется в пломбах из амальгамы, и он остается важным ингредиентом многих тушей для ресниц. Но оба этих источника ртути в настоящее время находятся под угрозой. Даже скромный термометр постепенно выводится из употребления и заменяется цифровыми приборами, заполненными спиртом, или приборами на основе термисторов.
Чтобы не перечислять огромный список странных и замечательных применений ртути, я хотел бы лишь вкратце упомянуть о моем личном фаворите, рыболовных поплавках, используемых для поддержания регулярного колебания на поверхности воды, ртутный поплавок оказывается настолько привлекательным для рыбы, что даже сейчас после того, как его использование было запрещено во всем мире, ведутся активные исследования, чтобы найти замену для выполнения той же работы. Его до сих пор можно найти в стоматологии, где он используется в пломбах из амальгамы, и он остается важным ингредиентом многих тушей для ресниц. Но оба этих источника ртути в настоящее время находятся под угрозой. Даже скромный термометр постепенно выводится из употребления и заменяется цифровыми приборами, заполненными спиртом, или приборами на основе термисторов. Что же касается человека, сидящего в чане с ртутью, то, к сожалению, я все еще жду ответа от National Geographic, хотя ради него мы можем только надеяться, что он живет долгой и здоровой жизнью и не присоединился к длинному списку многочисленные жертвы ртути.
Что же касается человека, сидящего в чане с ртутью, то, к сожалению, я все еще жду ответа от National Geographic, хотя ради него мы можем только надеяться, что он живет долгой и здоровой жизнью и не присоединился к длинному списку многочисленные жертвы ртути. Я Крис Смит, спасибо за внимание и до свидания!
Я Крис Смит, спасибо за внимание и до свидания! до н.э. в Китае и Индии
до н.э. в Китае и Индии Он по-прежнему широко используется в люминесцентных лампах и зубной амальгаме. Он используется для производства металлоорганического соединения тимерозола, который сохраняет некоторые вакцины, косметику и растворы для контактных линз. Местный антисептик мербромин или меркурохром по-прежнему используется в некоторых странах. Ртуть находит применение в батареях, добыче золота и серебра и изготовлении войлочных шляп. Хотя сегодня этот элемент мало используется для этих приложений, очистка окружающей среды от прошлого остается проблемой. В промышленных масштабах ртуть используется для получения хлора из хлорида натрия и гидроксида натрия из металлического натрия. Гремучая ртуть используется в качестве капсюля в стрелковом оружии и пиротехнике.
Он по-прежнему широко используется в люминесцентных лампах и зубной амальгаме. Он используется для производства металлоорганического соединения тимерозола, который сохраняет некоторые вакцины, косметику и растворы для контактных линз. Местный антисептик мербромин или меркурохром по-прежнему используется в некоторых странах. Ртуть находит применение в батареях, добыче золота и серебра и изготовлении войлочных шляп. Хотя сегодня этот элемент мало используется для этих приложений, очистка окружающей среды от прошлого остается проблемой. В промышленных масштабах ртуть используется для получения хлора из хлорида натрия и гидроксида натрия из металлического натрия. Гремучая ртуть используется в качестве капсюля в стрелковом оружии и пиротехнике.
 Ртуть повреждает мозг, легкие и почки. К первым симптомам отравления относятся бессонница; раздражительность; отсутствие координации; нарушение зрения, речи и слуха; тремор; и нарушение когнитивных способностей. Острые отравления также сопровождаются кашлем, болью в груди и воспалением легочной ткани. Отравление ртутью лечат хелатирующими агентами.
Ртуть повреждает мозг, легкие и почки. К первым симптомам отравления относятся бессонница; раздражительность; отсутствие координации; нарушение зрения, речи и слуха; тремор; и нарушение когнитивных способностей. Острые отравления также сопровождаются кашлем, болью в груди и воспалением легочной ткани. Отравление ртутью лечат хелатирующими агентами.
 /Мол
/Мол 

 Хотя его токсичность была признана на раннем этапе, его основное применение было в медицинских целях.
Хотя его токсичность была признана на раннем этапе, его основное применение было в медицинских целях. ) Барометры и манометры также использовали его высокую плотность и низкое давление пара. Однако токсичность ртути привела к ее замене в этих приборах. Золото и серебро легко растворяются в ртути, и в прошлом это свойство использовалось для извлечения этих металлов из их руд.
) Барометры и манометры также использовали его высокую плотность и низкое давление пара. Однако токсичность ртути привела к ее замене в этих приборах. Золото и серебро легко растворяются в ртути, и в прошлом это свойство использовалось для извлечения этих металлов из их руд.