Свинец – 82 элемент таблицы Менделеева
Свинец (лат. Plumbum) — химический элемент, ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается только в языках балтийской группы: svinas (литовский), svins (латышский).
Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber — водопроводчик (когда-то трубы зачеканивали мягким свинцом), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов.![]()
Содержание в земной коре 1,6·10-3 % по массе. Самородный свинец встречается редко. Входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4; из более сложных — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11. Всегда содержится в рудах урана и тория. В природных условия часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье).
| Относительная электроотрицательность (по Полингу): | 1,55 |
| Температура плавления: | 327,502°C |
| Температура кипения: | 1740°C |
| Теплопроводность: | 35 |
| Плотность: | 11,34 г/см3 |
| Открыт: | Известен с глубокой древности |
| Цвет в твёрдом состоянии: | |
| Тип: | Металл |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f145s25p65d105f06s26p2 |
| Электронная формула: |
Pb – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 4f14 5d10 6s2 6p2 Pb – [Xe] 4f14 5d10 6s2 6p2 |
| Валентность: | +2, +4 |
| Степени окисления: | 0, +II, IV |
| Сверхпроводящее состояние при температуре: | 7,23 К |
| Потенциалы ионизации: | 7,415 В 15,028 В 31,943 В |
Электропроводность в тв.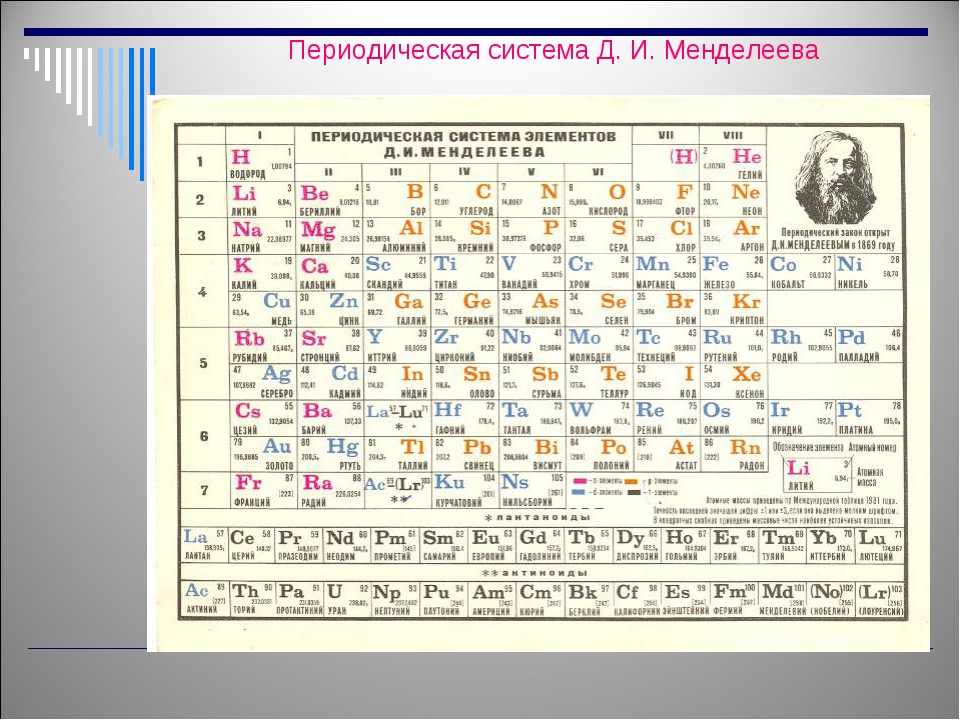 3/моль 3/моль |
|
| Атомный радиус: | 1,81 Å |
| Теплота распада: | 4,799 Кдж/моль |
| Теплота парообразования: | 177,7 Кдж/моль |
| Кристаллическая структура: | Гранецентрированный куб. Высота, ширина, длина равны. Все углы прямые. По атому имеется в каждой вершине, а также атом в центре каждой грани |
Остров Стабильности за пределами таблицы Менделеева
На исходе второго тысячелетия академик Виталий Лазаревич Гинзбург составил список из тридцати проблем физики и астрофизики, которые он считал наиболее важными и интересными (см. «Наука и жизнь» № 11, 1999 г.). В этом списке под № 13 указана задача отыскания сверхтяжёлых элементов. Тогда, 12 лет назад, академик с огорчением отметил, что «существование в космических лучах долгоживущих (речь идёт о миллионах лет) трансурановых ядер пока подтверждено не было». Сегодня следы таких ядер обнаружены. Это даёт надежду открыть наконец остров Стабильности сверхтяжёлых ядер, существование которого предсказал когда-то физик-ядерщик Георгий Николаевич Флёров.
Сегодня следы таких ядер обнаружены. Это даёт надежду открыть наконец остров Стабильности сверхтяжёлых ядер, существование которого предсказал когда-то физик-ядерщик Георгий Николаевич Флёров.‹
›
Вопрос, существуют ли элементы тяжелее урана-92 (238U — его стабильный изотоп), долгое время оставался открытым, так как в природе они не наблюдались. Считалось, что стабильных элементов с атомным номером больше 180 нет: мощный положительный заряд ядра разрушит внутренние уровни электронов тяжёлого атома. Однако довольно скоро выяснилось, что стабильность элемента определяется устойчивостью его ядра, а не оболочки. Стабильны ядра с чётным числом протонов Z и нейтронов N, среди которых особенно выделяются ядра с так называемым магическим числом протонов или нейтронов — 2, 8, 20, 28, 50, 82, 126 — это, например, олово, свинец.
Сегодня искусственно получено множество элементов вплоть до 118-го включительно — 254Uuo. Это самый тяжёлый неметалл, предположительно — инертный газ; его условные названия унуноктий (оно образовано из корней латинских числительных — 1, 1, 8), эка-радон и московий Mw. Все искусственные элементы когда-то существовали на Земле, но с течением времени распались.
Элементы, пропавшие за время существования Земли, получают двумя способами. Во-первых, в ядро тяжёлого элемента можно вогнать лишний нейтрон. Там он претерпевает бета-распад, образуя протон, электрон и электронное антинейтрино: n
Ещё более тяжёлые элементы создают в ускорителях, которые разгоняют и сталкивают ядра, например золота (см. «Наука и жизнь» № 6, 1997 г.). Именно так в лаборатории ядерных реакций Объединённого института ядерных исследований (ОИЯИ, г. Дубна) и получили 117-й и 118-й элементы. Причём теория предсказывает, что далеко за пределами известных ныне тяжёлых радиоактивных элементов должны существовать стабильные сверхтяжёлые ядра. Российский физик Г. Н. Флёров изобразил систему элементов в виде символического архипелага, где стабильные элементы окружены морем короткоживущих изотопов, которые, возможно, так никогда и не будут обнаружены. На главном острове архипелага высятся пики наиболее стабильных элементов — Кальция, Олова и Свинца, за проливом Радиоактивности лежит остров Тяжёлых ядер с пиками Урана, Нептуния и Плутония. А ещё дальше должен располагаться таинственный остров Стабильности сверхтяжёлых элементов, подобных уже упомянутому — Х-298.
Несмотря на все успехи экспериментальной и теоретической физики, остаётся открытым вопрос: существуют ли в природе сверхтяжёлые элементы, или же они — чисто искусственные, рукотворные вещества, подобные синтетическим материалам — капрону, нейлону, лавсану, — природой никогда не создававшимся?
Условия для образования таких элементов в природе есть. Они создаются в недрах пульсаров и при взрывах сверхновых звёзд. Потоки нейтронов в них достигают огромной плотности — 1038 n0/м2 и способны порождать сверхтяжёлые ядра. Они разлетаются в космосе в потоке межгалактических космических лучей, но их доля чрезвычайно мала — всего несколько частиц на квадратный метр в год. Поэтому возникла мысль использовать природный детектор—накопитель космического излучения, в котором сверхтяжёлые ядра должны оставить специфический, легко узнаваемый след. Такими детекторами с успехом послужили метеориты.
Они создаются в недрах пульсаров и при взрывах сверхновых звёзд. Потоки нейтронов в них достигают огромной плотности — 1038 n0/м2 и способны порождать сверхтяжёлые ядра. Они разлетаются в космосе в потоке межгалактических космических лучей, но их доля чрезвычайно мала — всего несколько частиц на квадратный метр в год. Поэтому возникла мысль использовать природный детектор—накопитель космического излучения, в котором сверхтяжёлые ядра должны оставить специфический, легко узнаваемый след. Такими детекторами с успехом послужили метеориты.
Метеорит — кусок породы, вырванный какой-то космической катастрофой из материнской планеты, — путешествует в космосе сотни миллионов лет. Его непрерывно «обстреливают» космические лучи, которые на 90% состоят из ядер водорода (протонов), на 7% — из ядер гелия (двух протонов) и на 1% — из электронов. На оставшиеся 2% приходятся другие частицы, среди которых могут быть и сверхтяжёлые ядра.
Исследователи из Физического института им. П. Н. Лебедева (ФИАН) и Института геохимии и аналитической химии им. В. И. Вернадского (ГЕОХИ РАН) изучают два палласита — железоникелиевые метеориты с вкраплениями оливина (группа полупрозрачных минералов, в которых к двуокиси кремния SiO4 присоединены в разных пропорциях Mg2, (Mg, Fe)2 и (Mn, Fe)2; прозрачный оливин называется хризолитом). Возраст этих метеоритов — 185 и 300 миллионов лет.
П. Н. Лебедева (ФИАН) и Института геохимии и аналитической химии им. В. И. Вернадского (ГЕОХИ РАН) изучают два палласита — железоникелиевые метеориты с вкраплениями оливина (группа полупрозрачных минералов, в которых к двуокиси кремния SiO4 присоединены в разных пропорциях Mg2, (Mg, Fe)2 и (Mn, Fe)2; прозрачный оливин называется хризолитом). Возраст этих метеоритов — 185 и 300 миллионов лет.
Тяжёлые ядра, пролетая сквозь кристалл оливина, повреждают его решётку, оставляя в ней свои следы — треки. Они становятся видны после химической обработки кристалла — травления. А поскольку оливин полупрозрачен, треки эти можно наблюдать и изучать в микроскоп. По толщине трека, его длине и форме можно судить о заряде и атомной массе ядра. Исследования сильно осложняет то, что кристаллы оливина имеют размеры порядка нескольких миллиметров, а трек тяжёлой частицы гораздо длиннее. Поэтому о величине её заряда приходится судить по косвенным данным — скорости травления, уменьшению толщины трека и пр.
Работы по отысканию следов сверхтяжёлых частиц с острова стабильности назвали «Проект Олимпия». В рамках этого проекта получены сведения примерно о шести тысячах ядер с зарядом более 55 и трёх ультратяжёлых ядрах, заряды которых лежат в интервале от 105 до 130. Все характеристики треков этих ядер измерены комплексом высокоточной аппаратуры, созданным в ФИАНе. Комплекс в автоматическом режиме распознаёт треки, определяет их геометрические параметры и, экстраполируя данные измерений, находит предположительную длину трека до его остановки в массиве оливина (напомним, что реальный размер его кристалла — несколько миллиметров).
Полученные экспериментальные результаты подтверждают реальность существования в природе стабильных сверхтяжёлых элементов.
| Круг, проволока Лист, Плита, Лента (полоса), Шина Шестигранник Квадрат Труба круглая, втулка Труба профильная Уголок Швеллер Тавр Двутавр | -Выберите-АлюминийМедьЛатуньБронзаОловоСвинецЦинкНикелевые сплавыМедно-никелевые сплавыНихромНержавеющие сталиСталь А5, А5Е, А6, А7, АД0, АД00 Д16 АМц, АМцС, ММ АД31 АД1 АМг6 АМг5 АМг3 АМг2 М1, М2, М3 Л90 Л85 Л80 Л70 ЛС59-1 Л68 Л63 БрОЦ4-3 БрОФ7-0,2 БрОФ6,5-0,15 БрАЖН10-4-4 БрХ1 БрБ2 БрКМц3-1 БрАМц9-2 БрАЖМц10-3-1,5 БрОЦС5-5-5 БрАЖ9-4 О1 С0, С1, С2 Ц0, Ц1 НМц2,5 НМц5 НК0,2 Алюмель НМцАК2-2-1 Монель НМЖМц28-2,5-1,5 Хромель Т НХ9,5 Куниаль Б МНА6-1,5 Нейзильбер МНЦ15-20 Куниаль А МНА6-1,5 Константан МНМц40-1,5 Копель МНМц43-0,5 Мельхиор МН19 Манганин МНМц3-12 МНЖ5-1 Х15Н60 Х20Н80 12Х18Н10Т, 12Х18Н12Т, 12Х18Н9 04Х18Н10Т, 08Х18Н12Б 08Х13, 08Х17Т, 08Х20Н14С2 08Х22Н6Т, 15Х25Т 08Х18Н10, 08Х18Н10Т 08Х18Н12Т 10Х17Н13М2Т 10Х23Н18 12Х13, 12Х17 Ст3, Ст5, Ст10, Ст20 | Длина (м) b – Диаметр (мм) Длина (м) b – Ширина (мм) c – Толщина (мм) Длина (м) b – Сечение (мм) Длина (м) b – Сечение (мм) Длина (м) b – Толщина стенки (мм) c – Диаметр (мм) Длина (м) b – Толщина стенки (мм) c – Ширина (мм) d – Высота (мм) Длина (м) b – Толщина стенки (мм) c – Высота полки1 (мм) d – Высота полки2 (мм) Длина (м) b – Толщина стенки (мм) c – Ширина (мм) d – Высота (мм) Длина (м) b – Толщина стенки (мм) c – Ширина (мм) d – Высота (мм) e – Толщина перемычки (мм) Длина (м) b – Толщина стенки (мм) c – Ширина (мм) d – Высота (мм) e – Толщина перемычки (мм) |
Свинец
Свинец – 82 элемент таблицы Менделеева
Свинец (лат. Plumbum) — химический элемент, ковкий, сравнительно легкоплавкий металл серого цвета.
Plumbum) — химический элемент, ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается только в языках балтийской группы: svinas (литовский), svins (латышский).
Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber — водопроводчик (когда-то трубы зачеканивали мягким свинцом), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Содержание в земной коре 1,6·10-3 % по массе. Самородный свинец встречается редко. Входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4; из более сложных — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11. Всегда содержится в рудах урана и тория. В природных условия часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы.
В кларковых концентрациях свинец входит практически во все породы.
Чтобы произвести расчеты, необходимо разрешить элементы ActiveX!Больше интересного в телеграм @calcsbox
Химические элементы в кино
Понятно, что Иван Вырыпаев, всерьез задумавшийся, чем дышат люди – не первый режиссер, обратившийся за вдохновением к периодической системе элементов , которую он изучал в школе. Однако, сопоставив знаменитую таблицу Менделеева со списком экранизированных веществ, мы поняли, что объем работ предстоит еще огромный: из ста с лишним элементов, существующих в природе, получили по фильму дай бог десяток, и остается только догадываться, какие замечательные истории можно получить на основе водорода, ртути или, скажем, гафния. Итак, вот те немногочисленные фильмы, в которых уже работает периодический закон.
«Кобальт-60», реж. Зак Снайдер
Радиоактивный изотоп кобальта будет увековечен на экране Заком Снайдером, лучшим на сегодняшний день экранизатором комиксов, за чьими творческими планами после «300 спартанцев» /300/ (2006) и «Хранителей» /Watchmen/ (2009) все, кто не равнодушен к жанру, следят теперь очень пристально. Если Снайдера перекупит какая-нибудь другая студия, то за адаптацию одноименного комикса Вона Боде, права на который купила Universal, он возьмется сразу после «Стражников Га’Хула», находящихся на стадии постпродакшна. Действие «Кобальта-60» происходит в постапокалиптическом мире, и кроме собственно Кобальта-60 (хорошего) в нем есть персонаж по имени Стронций-90 (плохой).
Если Снайдера перекупит какая-нибудь другая студия, то за адаптацию одноименного комикса Вона Боде, права на который купила Universal, он возьмется сразу после «Стражников Га’Хула», находящихся на стадии постпродакшна. Действие «Кобальта-60» происходит в постапокалиптическом мире, и кроме собственно Кобальта-60 (хорошего) в нем есть персонаж по имени Стронций-90 (плохой).
O
«Кислород», реж. Ричард Шепард
У фильмов Ричарда Шепарда («Матадор» /Matador, The/ (2005)) и Ивана Вырыпаева есть одно пугающее совпадение в сюжетах: в 1999 году герой Эдриэна Броуди, сыгравшего маньяка-вымогателя, как и вырыпаевский Санёк тоже закапывает женщину в землю, только в отличие от непрактичного душегуба русского – закапывает живьем и требует у богатого мужа миллион долларов, пока у нее не кончился кислород. Кислород один, а менталитеты разные.
Pb
«Плюмбум, или опасная игра» (1986), реж. Вадим Абдрашитов
Химический элемент под номером 82 загадочным образом вдохновил Вадима Абрашитова на эту странноватую остросоциальную сагу про перестроечного Павлика Морозова по кличке «Плюмбум». Интуиция автора не обманула: на смену коммунистам с их сталью и мартеновскими домнами пришло новое поколение металлов – мягкотелых и ядовитых.
As
«Мышьяк и старые кружева» /Arsenic And Old Lace/ (1944), реж. Фрэнк Капра
Про замечательный элемент мышьяк, вызывающий массу культурологических ассоциаций от алхимических порошков от сифилиса до заговора против Моцарта, сделали всего один фильм, но зато классический – с безупречным Кэри Грантом, сыгравшем в комичном макабре Фрэнка Капры убежденного противника брака, который сталкивается с бабушками-отравительницами, отправляющими на тот свет холостяков с помощью означенного вещества. Если сравнивать кислород и мышьяк с точки зрения пользы для здоровья зрителя, то капровский мышьяк перевешивает оба кислородных фильма однозначно.
Если сравнивать кислород и мышьяк с точки зрения пользы для здоровья зрителя, то капровский мышьяк перевешивает оба кислородных фильма однозначно.
Kr
Криптон
«Возвращение Супермена» /Superman Returns/ (2006), реж. Брайан Сингер
Назвав родную планету Супермена Криптон, создатели комикса вряд ли имели в виду 36-й элемент из периодической таблицы Менделеева. Но общие черты между криптоном и криптонитом – выдуманным минералом, подавляющим суперспособности героя – все же есть: и тот и другой излучают зеленый свет. Криптон, однако, не минерал, а благородный газ, отказывающийся вступать в случайные химические связи. В 2003 году, к 70-летнему юбилею Супермена, химики разрешили это противоречие, впервые синтезировав кристалл дифторида криптона (на фото). Это и есть то самые зеленое существо, из которого Лютор хочет выстроить новый континент в Атлантике.
Cl
«Хлорированные сны», реж. Софья Голлан
Именем галогена хлора хорошо бы назвать окопную драму времен Первой мировой войны, но сойдет и хлорка, от которой начинаются галлюцинации у героини фильма «Хлорированные сны»: в ее бассейне заводится призрак молодого скейтбордиста. Похоже, химически агрессивные газы, к которым принадлежит и кислород, играют в кино роль афродизиаков. В соответствии с этим периодическим свойством, не сложно догадаться, о чем будет фильм про фтор.
Похоже, химически агрессивные газы, к которым принадлежит и кислород, играют в кино роль афродизиаков. В соответствии с этим периодическим свойством, не сложно догадаться, о чем будет фильм про фтор.
Au
«Золото Маккенны» /Mackenna’s Gold/ (1969), реж. Дж. Ли Томпсон
После кислорода самым популярным элементом в кино оказалось, естественно, золото, без которого тоже жизни нет. Именем металла названы два фильма – собственно «Золото» с Роджером Муром, в том же году, кстати говоря, сыгравшим Джеймса Бонда в «Человеке с золотым пистолетом» /Man With The Golden Gun, The/ (1974), и недавний триллер «Aurum», который можно смело игнорировать. Но самым золотым фильмом в отечественном прокате остается вестерн «Золото Маккенны» /Mackenna’s Gold/ (1969) с Грегори Пеком и Омаром Шарифом, не сходивший 17 лет с наших экранов, и превратившийся, как и само индейское золото, в фильм-миф. Омар Шариф говорит в фильме голосом Анатолия Кузнецова, то есть товарища Сухова, охранявшего под белым солнцем пустыни черное золото от бандитов-террористов.
Но самым золотым фильмом в отечественном прокате остается вестерн «Золото Маккенны» /Mackenna’s Gold/ (1969) с Грегори Пеком и Омаром Шарифом, не сходивший 17 лет с наших экранов, и превратившийся, как и само индейское золото, в фильм-миф. Омар Шариф говорит в фильме голосом Анатолия Кузнецова, то есть товарища Сухова, охранявшего под белым солнцем пустыни черное золото от бандитов-террористов.
S
«Сульфур» («Искусство зеркал»), реж. Дерек Джармен
C горючим свойством серы экспериментировал в начале 70-х Дерек Джармен, снимавший в то время атмосферичные абстрактные этюды на восьмимиллиметровую камеру. Сульфур зарифмован с египетскими пирамидами, которые поджигают спичкой, навязчивым солнечным зайчиком и странным декадентским ритуалом, большим мастером которого уже тогда показал себе этот режиссер. После перемонтажа фильм стал называться «Искусство зеркал», но мефистофельская сера в нем осталась.
Сульфур зарифмован с египетскими пирамидами, которые поджигают спичкой, навязчивым солнечным зайчиком и странным декадентским ритуалом, большим мастером которого уже тогда показал себе этот режиссер. После перемонтажа фильм стал называться «Искусство зеркал», но мефистофельская сера в нем осталась.
Dt
Дилитий
«Звездные врата»
В знаменитом сериале мало того, что есть целая альтернативная периодическая система элементов, но и открыты целые залежи выдуманных полезных ископаемых: дюраниума, тританиума, нитриума, латинума и дилития, сделавшего возможными полеты к другим мирам. Помещенный в магнитное поле кристалл дилития не реагирует с антивеществом – топливом звездолетов, и по стратегической роли в экономике будущего он сопоставим с углеводородами, на которых работает вся нынешняя. Кончится дилитий – кончатся «Звездные врата». Без этого элемента вопрос поэта, для кого зажигают звезды, останется чисто риторическим.
C
«Углерод», реж. Джеймс МакТиг
Джеймс МакТиг
Начав с «Кобальта-60» завершим обзор экранизаций периодической системы еще одним проектом – «Углеродом». Протеже братьев Вачовски Джеймса МакТига, режиссера «V значит вендетта» /V for Vendetta/ (2005), позвали адаптировать «Altered Carbon» – «Модифицированный углерод», относительно свежий (2002) научно-фантастический опус Ричарда Моргана: удивительная оперативность для кино. Действие происходит в отдаленном будущем, когда из углерода научатся делать искусственные живые организмы. Кислород, которым они дышут, и золото, которому поклоняются, остаются в силе, но основа жизни будет все равно углеродной, как ни крути.
Алхимии отцовой пережитки
28 ноября 2016 года Международный союз теоретической и прикладной химии (ИЮПАК) присвоил названия четырем сверхтяжелым элементам: нихонию (113 элемент периодической системы), московию (115 элемент), теннесину (117 элемент) и оганесону (118 элемент).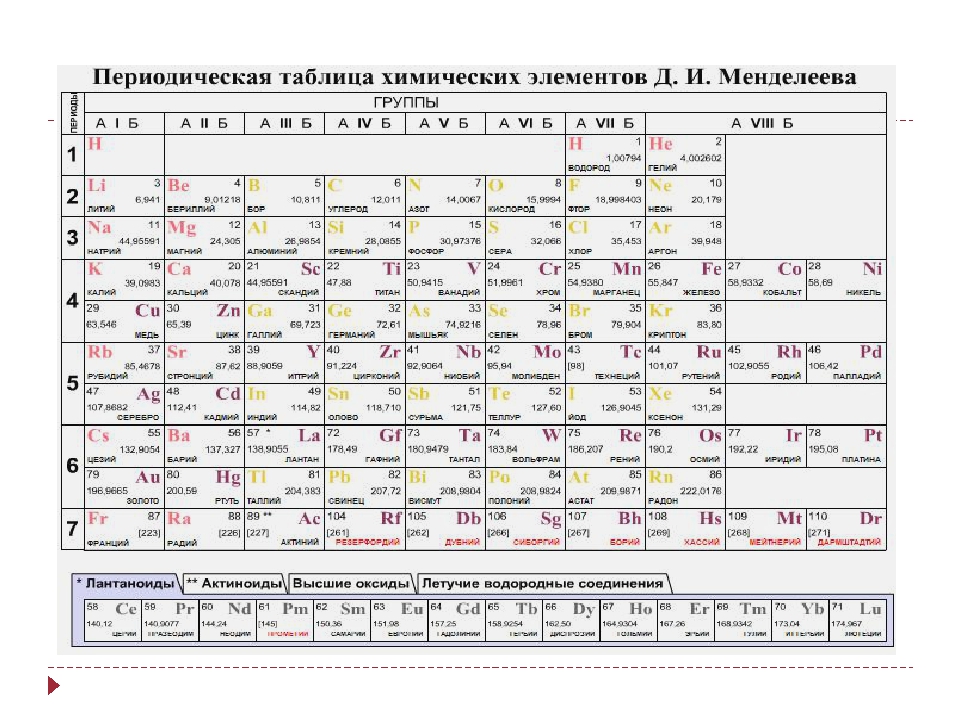 Московий, теннесин и оганесон впервые были получены в Российской Федерации в коллаборации с американскими физиками. В годовщину этой даты N + 1 совместно с Издательством Яндекса предлагает вам представить себя алхимиком и попробовать синтезировать один (или несколько, как повезет) сверхтяжелых элементов на ускорителе элементарных частиц.
Московий, теннесин и оганесон впервые были получены в Российской Федерации в коллаборации с американскими физиками. В годовщину этой даты N + 1 совместно с Издательством Яндекса предлагает вам представить себя алхимиком и попробовать синтезировать один (или несколько, как повезет) сверхтяжелых элементов на ускорителе элементарных частиц.
Сверхтяжелые химические элементы с атомным номером больше 100 удается получить только в реакциях слияния в ускорителях заряженных частиц. В них тяжелое ядро-мишень обстреливают более легкими ядрами-снарядами. Ядра новых элементов возникают в случае точного попадания и слияния ядер снаряда и мишени. У вас есть возможность почувствовать себя алхимиком-любителем и создать новый элемент. В вашем распоряжении есть ядра-снаряды и ядра-мишени. Выберите пару и нажмите кнопку «Включить ускоритель». Если выберете правильную пару, то получите сверхтяжелый элемент, увидите продукты его распада и узнаете, кем и когда он был синтезирован в реальности.
У вас есть возможность почувствовать себя алхимиком-любителем и создать новый элемент. В вашем распоряжении есть ядра-снаряды и ядра-мишени. Выберите пару и нажмите кнопку «Включить ускоритель». Если выберете правильную пару, то получите сверхтяжелый элемент, увидите продукты его распада и узнаете, кем и когда он был синтезирован в реальности.
А еще мы совместно с Издательством Яндекса приготовили ответы на распространенные в интернете вопросы про сверхтяжелые элементы. Кликните на вопрос, чтобы увидеть ответ.
Все подобные предсказания основаны на современных моделях устойчивости атомных ядер. Исходя из самых наивных соображений кажется, что устойчивым может быть любое ядро, в котором кулоновское отталкивание между положительно заряженными протонами компенсируется силой связи между ними за счет сильного взаимодействия. Для этого, в любом случае, в ядре должно быть определенное количество незаряженных нейтронов, однако соотношение между количеством нейтронов и протонов — недостаточное условие для устойчивости атомных ядер. Здесь вступает в игру квантовая природа нуклонов: они обладают полуцелым спином и, как и электроны, стремятся собираться парами и формировать заполненные энергетические уровни.
Здесь вступает в игру квантовая природа нуклонов: они обладают полуцелым спином и, как и электроны, стремятся собираться парами и формировать заполненные энергетические уровни.
Эти эффекты приводят к различию в устойчивости протонно-нейтронных систем относительно нескольких путей распада — спонтанного деления (которое происходит в результате квантово-механических эффектов и без внешнего возбуждения приводит к разделению на более легкие ядра и нейтроны), также α- и β-распада с испусканием α-частицы или электрона (или позитрона) соответственно. По отношению к каждому из каналов распада у каждого ядра есть свое время жизни. Так, при увеличении атомного номера элемента резко увеличивается вероятность спонтанного деления, что накладывает значительные ограничения на существование стабильных ядер сверхтяжелых элементов — все они должны быть неустойчивыми с довольно коротким периодом полураспада. Поэтому для всех элементов тяжелее свинца стабильных изотопов нет, все они радиоактивные.
Тем не менее, теория предсказывает, что даже среди сверхтяжелых элементов могут быть изотопы с относительно большим временем жизни. Они должны существовать для систем с подходящим соотношением протонов и нейтронов и полностью заполненными протонными и нейтронными уровнями. Тем не менее, синтезировать такие элементы пока не удалось, и если до ближайшего «острова стабильности» (который предсказывается для ядра флеровия со 184 нейтронами) добраться в ближайшем будущем кажется возможным, то отыскать среди абсолютно неустойчивых систем более тяжелые ядра со следующей заполненной оболочкой будет значительно тяжелее, если не невозможно.
Стоит, однако, отметить, что все эти предсказания основаны на моделях, которые хорошо работают для сравнительно небольших ядер, однако для сверхтяжелых элементов форма ядра, например, начинает довольно заметно отклоняться от сферической, что требует внесения поправок в эти модели.
На данный момент у сверхтяжелых элементов никакого практического применения нет. Это объясняется несколькими причинами. Во-первых, их синтез — крайне сложный технологический процесс, занимающий довольно долгое время, в результате которого происходит образование совсем небольшого количества ядер. Во-вторых, из всех элементов с порядковым номером больше ста только фермий (100-й элемент) и менделевий (101-й) имеют сравнительно стабильные изотопы с периодом полураспада 100 и 50 суток соответственно. У остальных же сверхтяжелых элементов даже самые устойчивые из синтезированных изотопов распадаются в лучшем случае за несколько десятков часов, а чаще — за секунды или даже миллисекунды.
Поэтому пока процесс синтеза сверхтяжелых ядер представляет лишь фундаментальный интерес, связанный с изучением нуклон-нуклонного взаимодействия и взаимодействия между кварками. Свойства синтезированных изотопов помогают строить более точные теоретические модели, которые можно использовать не только для исследования ядер атомов на Земле, но и, например, при изучении нейтронных звезд, в ядре которых плотность нуклонов значительно превышает плотность в ядрах атомов.
Ученые ожидают, что в будущем у сверхтяжелых элементов могут появиться и какие-то практические применения, связанные, в частности, с разработкой сенсоров или радиографических методов в медицине или промышленности. Возможно, это будут и какие-то новые способы использования, которые невозможно предсказать сейчас, однако в ближайшие годы их точно ожидать не стоит, потому что для этого должны кардинальным образом измениться технологии их получения.
Стабильные изотопы элементов, расположенных в таблице Менделеева после свинца, сейчас неизвестны. Порядковый номер свинца в таблице Менделеева — 82-й. Это значит, что все элементы начиная с висмута будут так или иначе радиоактивными. Период полураспада этих элементов, однако, может варьироваться в очень широких пределах. Так, у наиболее устойчивого изотопа висмута, который раньше считался устойчивым, период полураспада составляет 2 × 1019 лет, что на несколько порядков больше возраста Вселенной.
У синтезированных на данный момент изотопов сверхтяжелых элементов (с порядковым номером в таблице элементов больше ста) период полураспада значительно меньше, чем у висмута, и варьируется от ста дней до долей миллисекунды. Все они тоже радиоактивны.
Однако, согласно теоретическим предсказаниям, для некоторых элементов с определенным числом протонов и нейтронов в ядре возможно значительное увеличение периода полураспада. Нужное количество нейтронов и протонов в ядре соответствует полностью заполненным нейтронным и протонным оболочкам и предположительно должно равняться 114 для протонов и 184 для нейтронов. Теоретически такая конфигурация должна приводить к увеличению периода полураспада от сотен микросекунд до 105 лет. Относительная устойчивость ядер с числом протонов и нейтронов, близким к этим значениям, позволяет предположить существование «острова стабильности» среди сверхтяжелых элементов. Тем не менее, подтвердить его существование экспериментально пока не удалось. Но даже столь значительное увеличение времени жизни ядер не сделает эти изотопы устойчивыми — они так и останутся радиоактивными.
Ни один из сверхтяжелых элементов обнаружен в природе не был (что неудивительно, учитывая, что у всех из них очень короткие периоды полураспада). Элемент с самым большим порядковым номером, который удалось найти на сегодняшний день в природе, — это уран с его 92 протонами в ядре.
В начале 1970-х годов сообщалось о нахождения в природных минералах элемента с порядковым номером 108 (позднее был синтезирован под названием хассий), около десяти лет назад говорили об обнаружении в образцах тория следов 122-го элемента, однако подтверждены эти факты не были.
На Земле условий, необходимых для синтеза устойчивых сверхтяжелых ядер, нет и никогда не было, однако считается, что близкие к подобным условиям могут достигаться при взрывах сверхновых. Температура при этом поднимается до значений, достаточных для запуска быстрого поглощения ядрами нейтронов (так называемого r-процесса). Пока достоверных подтверждений естественного образования элементов с порядковым номером больше 100 в таких процессах зафиксировано не было, однако проводятся исследования состава космических лучей на предмет наличия в них следов сверхтяжелых элементов. В частности, об обнаружении в метеоритном веществе частиц с атомными числами более 100 говорили в 2011 году. Эти данные, однако, также не были подтверждены.
Это выражение обычно используют для обозначения споров между США и СССР о приоритете при открытии элементов с порядковыми номерами 104,105 и 106, которые были были открыты в 60-х и 70-х годах XX века. Сам термин «трансфермиевые войны» (все эти элементы располагаются в таблице Менделеева как раз вслед за фермием) был впервые предложен в 1994 году. В Советском Союзе синтез проводился в Объединенном институте ядерных исследований в Дубне, в США — в Национальными лабораториями имени Лоуренса в Беркли и Ливерморе. Первые удачные попытки синтеза 104-го элемента сейчас датируются 1964 годом, 105-го элемента — 1970 годом, а 106-го — 1974-м.
Советская сторона считала, что именно в Дубне впервые удалось синтезировать 104-й и 105-й элементы, и использовала для них названия «курчатовий» и «нильсборий» соответственно. Американские ученые критиковали результаты советских экспериментов и доказывали, что первыми получили эти элементы физики в их лабораториях и назвали их «резерфордием» и «ганием» (в честь Эрнеста Резерфорда и Отто Гана соответственно). Однако из-за того, что значительная часть данных о синтезе была в то время закрыта, однозначно определить первенство той или иной группы было достаточно сложно.
Из-за этого процесс выяснения первенства растянулся на 30 лет и стал одним из элементов холодной войны. Лишь в 1994 году была собрана международная комиссия, которая рассмотрела известные данные и предложила свои варианты названий для элементов. Изначально некоторые из принятых решений вызывали споры, в частности о присвоении элементам имен в честь еще живущего человека (Гленна Сиборга), перенесении названия от одного элемента другому относительно начальных предложений (что вовлекло в споры третью сторону — немецкое Общество исследования тяжелых элементов, ученые которого синтезировали 107-й, 108-й и 109-й элементы).
В результате было найдено компромиссное решение, и в 1997 году произошло окончательное утверждение приоритетов и названий элементов. В частности, было решено не увековечивать имена Игоря Курчатова и Отто Гана, имеющих отношение к советскому и нацистскому ядерным проектам. 104-й и 106-й элемент сейчас используют названия, предложенные американской стороной (резерфордий и сиборгий), 105-й элемент — в признание заслуг советских ученых назвали дубнием, для 107-го, 108-го и 109-го элементов используют названия, предложенные немецкими учеными — борий, хассий и мейтнерий (лишь первый из них отличается от предложенного варианта — изначально его предлагали называть нильсборием). Сейчас благодаря открытости данных и прописанной процедуре присвоения элементам имен вопросы о приоритете решаются значительно проще.
Миниатюра из алхимической рукописи XVI века «Блеск Солнца»
British museum
Известно, что при вспышках сверхновых может происходить образование ядер очень тяжелых элементов, например урана или тория. Эти ядра образуются по механизму быстрого захвата нейтронов (так называемый r-процесс). Считается, что при взрыве сверхновой образуется достаточная температура — около четырех миллиардов градусов — для запуска этого процесса. Тем не менее, частота образования самых тяжелых ядер даже в таких условиях не очень высока. Считается также, что, кроме урана и тория, при взрыве сверхновых звезд возможно, например, образование калифорния (это 98-й элемент).
Для образования более тяжелых ядер в результате r-процесса необходим запуск термоядерной реакции — таким образом, например, на Земле удалось впервые синтезировать эйнштейний (99-й элемент) и фермий (100-й). Предполагается, что несколько термоядерных взрывов могут привести и к достижению острова стабильности в результате r-процесса. Однако сегодня принято считать, что при взрывах сверхновых такие условия не выполняются и элементы с порядковыми номерами более 100 не образуются. Тем не менее, следы стабильных сверхтяжелых элементов, которые могли образоваться при взрывах сверхновых, продолжают искать, например, в космических лучах и облученных ими метеоритах. Подтверждение же синтеза более легких элементов (например, урана или калифорния) проводят по спектроскопическим исследованиям продуктов их спонтанного деления.
Сверхтяжелые ядра получают с помощью реакции слияния более легких ядер друг с другом. Для этого мишень из более тяжелых элементов бомбардируют ядрами более легких. Чтобы получить ядро с необходимым числом протонов и нейтронов, нужно правильно подобрать те ядра, которые используются в качестве мишеней и снарядов. Здесь может быть несколько проблем, снижающих вероятность образования нужного ядра и его обнаружения.
Во-первых, для образования нужного ядра необходимо преодолеть электростатический барьер — все-таки оба сталкиваемых ядра обладают довольно большим положительным зарядом (и до того, как на коротких расстояниях между протонами начнут действовать силы притяжения, нужно преодолеть дальнодействующее электростатическое отталкивание). Для этого тем ядрам, которыми бомбардируют мишень, необходимо изначально придать достаточно высокую энергию.
Для снижения этого барьера выгоднее использовать в качестве налетающих частиц ядра с довольно большим количеством протонов. Однако их выбор на сегодняшний день ограничен. Раньше для синтеза новых ядер мишени из тяжелых элементов, например свинца, плутония или урана, бомбардировали сравнительно легкими ядрами, например неоном-22 или кислородом-18. Позже для этих целей использовали различные изотопы более тяжелых элементов: железа-58, никеля-62, никеля-64 или цинка-70. Крайне важными стали продукты реакции различных мишеней с изотопом кальция-48.
Перспективными считаются реакции, в которых мишень из урана бомбардируют ионами из сверхтяжелых элементов — того же урана, калифорния, эйнштейния. Для повышения вероятности образования ядра нужно, чтобы налетающее ядро имело сравнительно небольшой момент импульса, а образующееся «компаунд-ядро» имело форму, близкую к сферической. Нарушение этих требований приводит к тому, что реакции не происходят. Однако даже при правильном подборе параметров процесс синтеза очень долог — облучение мишени в течение нескольких месяцев может привести к синтезу сотни нужных ядер.
Таким образом, ограниченный выбор изотопов, которые можно использовать в реакциях синтеза, сложная, с технической точки зрения, их реализация и длительное время протекание реакций значительно снижают вероятность синтеза нужных ядер — даже тех, которые, по теоретическим предсказаниям, должны оказаться устойчивыми.
Центр «острова стабильности», согласно оболочечной модели ядра, соответствует полностью заполненным протонной и нейтронной оболочкам — изотопу с порядковым номером 114 и массовым числом 298, то есть ядру, состоящему из 114 протонов и 184 нейтронов.
Некоторые ученые считают, что центр «острова стабильности» может соответствовать следующему протонному «магическому числу» и, таким образом, более устойчивым должен быть элемент с 120-м номером (а может быть, даже и со 126-м). Кроме того, из-за высокой вероятности α-распада центр стабильности может быть смещен относительно номера 114-го к 112-му и 110-му элементам.
Поскольку для образования относительно устойчивого ядра важно не только количество протонов в нем, но и количество нейтронов, пока синтезировать изотопы с нужным числом нуклонов из-за ограниченного выбора изотопов в эксперименте не удавалось. Потому необходимых данных для подтверждения существования «острова стабильности» нет. Однако те измерения, которые были проведены для менее устойчивых изотопов сверхтяжелых элементов, достаточно хорошо согласуются с данными теоретических моделей.
Тем не менее, стоит отметить, что положение «острова стабильности» определено в рамках концепции оболочечной модели ядра, которая при большом количестве нейтронов или протонов может работать не совсем точно. В частности, некоторые эффекты, связанные с взаимодействием кварков, для нейтрон-избыточных ядер с помощью нее объяснить не удается.
Согласно теоретическим предсказаниям, центру «острова стабильности» соответствует ядро, состоящее из 114 протонов и 184 нейтронов. Синтезировать такой тяжелый изотоп пока не удалось. Однако по данным теоретических моделей именно такое число нуклонов в ядре соответствует полностью заполненным энергетическим оболочкам.
Что касается периодов полураспада этих элементов, то при делении ядер стоит принимать во внимание три возможных процесса: спонтанное деление ядер, а также α- и β-распад. Так, период полураспада 298114, согласно предсказаниям моделей, должен составлять примерно 1016 лет относительно спонтанного деления, 10 лет — относительно α-распада и около 105 лет — относительно β-распада.
С учетом всех видов распада наиболее стабильным ядром оказывается ядро 298110. По данным теории, период его полураспада должен составлять около 109 лет. Тем не менее, область стабильных ядер относительно широкая, и почти для всех ядер с четным числом протонов от 110 до 114 и четным числом нейтронов от 180 до 184 период полураспада превышает 1 год.
Пока эти числа — лишь результат теоретических расчетов. Самый тяжелый и самый устойчивый изотоп 114-го элемента (флеровия Fl), который на данный момент был получен экспериментально, — это 289Fl. Период его полураспада составляет около 30 секунд. Период самого стабильного изотопа 110-го элемента (дармштадтий Ds) — около 10 секунд. Тем не менее, экспериментально полученные значения довольно хорошо согласуются с предсказаниями теоретических моделей, поэтому если удастся провести синтез нужных ядер с большим числом нейтронов, время их жизни может существенно увеличиться.
Вообще, согласно современным теоретическим моделям, в обозримой области элементов может существовать не два, а даже больше «островов стабильности», которые будут соответствовать ядрам с полностью заполненными нейтронными и протонными оболочками, когда число нуклонов равняется так называемому «магическому числу». Сейчас элемент, который может быть «островом стабильности», соответствует изотопу, состоящему из 114 протонов и 184 нейтронов. Согласно современным оболочечным моделям ядра, следующие для протонов «магические числа» — это 126 и 164, а для нейтронов — 196, 228 и 272.
Про возможное существование относительно устойчивых ядер с 120 или 126 протонами говорят довольно давно, а десять лет назад говорили о возможном существовании «острова стабильности» в районе 164-го элемента. Тем не менее, если возможного исследования 120-го элемента в относительно близкой перспективе еще можно ожидать, то говорить об экспериментальном изучении 126-го, а тем более 164-го элемента не приходится. Для этого нужны новые ускорители тяжелых ядер, которые позволили бы работать с низкими концентрациями короткоживущих изотопов. На данный момент таких устройств нет.
Сейчас самый тяжелый элемент, синтез которого удалось подтвердить, — это оганесон с порядковым номером 118. Кроме того, стоит отметить, что применимость использованных теоретических моделей для таких тяжелых ядер тоже не доказана.
Нет, нейтронная звезда, хоть и состоит преимущественно из протонов и нейтронов, на гигантское атомное ядро не очень похожа. На самом деле, звезда имеет довольно сложное строение — как минимум пять слоев с разными свойствами, и тяжелые атомные ядра входят в состав некоторых из них как один из важных компонентов. При этом во внешних слоях в нейтронной звезде присутствуют, например, и электроны. А во внутренних слоях — ближе к центру нейтронной звезды — очень много свободных нейтронов.
Несмотря на то, что атомное ядро — квантово-механическая система с максимальной плотностью нейтронов и протонов на Земле, в нейтронных звездах плотность нуклонов значительно выше. Размер нейтронных звезд — всего пара десятков километров, а их масса часто превышает массу Солнца, поэтому ближе к центру звезды у нее очень высокая плотность — в несколько раз больше, чем в любом атомном ядре. В ядре нейтронной звезды лишь несколько процентов электронов и протонов, основную массу составляют нейтроны, которые находятся в состоянии ферми-жидкости. В самом центре звезды — во внутреннем ядре — плотность нуклонов может в 10–15 раз превышать плотность в атомных ядрах, при этом точный состав, состояние и механизмы взаимодействия частиц в таких плотных системах достоверно неизвестны.
Исследования нейтрон-избыточных ядер может дать важную информацию, о том, каким образом нейтроны и кварки могут взаимодействовать в ядре нейтронной звезды, однако состояние нуклонов в центре нейтронной звезды в любом случае сильно отличается от того, которое можно наблюдать в атомных ядрах даже самых тяжелых элементов.
Александр Дубов
Расшифровка: Химия в ее стихии: свинец(Promo) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит Здравствуйте, на этой неделе мы погружаемся в новые глубины, поскольку мы встречаемся с металлом, который породил отвес, рок-группу, водопровод и даже отравление, а не упомянуть поколение алхимиков, тщетно пытавшихся превратить это вещество в золото.Это, конечно же, свинец, и нам предстоит размахивать им научным писателем Филом Боллом. Фил Болл Свинец – это ИА металлов – медленный, тупой и тяжелый. В латинской форме, plumbum , он вошел в наш словарь благодаря своему мягкому и тяжеловесному характеру: когда-то мы погружались в глубины с подвешенным серым шариком вещества, подчеркнуто управляемым силой тяжести, в то время как водопроводчики давно продали свои ковкие свинцовые трубы. для пластика. Все, что связано со свинцом, имеет тенденцию к чрезмерному мраку: в древней схеме металлического символизма свинец был связан с Сатурном, меланхоличной планетой, олицетворяемой старым богом, также называемым Кроносом, который кастрировал своего отца и проглатывал своих детей.Даже искра гламура, которую металл получает от ассоциации с величайшей рок-группой мира, проистекает из предсказания Иа-Иа, что они утонут, как свинцовый воздушный шар или дирижабль. Да, свинец – это оригинальный хэви-металл, самый известный преступник в этой токсичной группе. Свинец повреждает мозг и почки, он может вызвать анемию и форму подагры с печальным названием сатурнианской подагры. Даже римляне знали об отравлении свинцом – доктор Корнелий Цельс предупреждал о вреде свинцового белила, используемого в красках и косметике, а инженер Витрувий рекомендовал глиняные трубы вместо свинцовых.Но мы учились медленно. Свинцово-белила, разновидность карбоната свинца, оставались лучшим белым пигментом художника вплоть до девятнадцатого века, когда его заменили цинковыми белилами. По мере того как производство красок стало индустриализированным, свинец распространил болезни и смерть среди фабричных рабочих: в отчете «Труды Королевского общества» в семнадцатом веке среди причин, вызванных им, были указаны головокружение, головокружение, слепота, тупость и паралитические расстройства. И еще в 2007 году производитель игрушек Mattel был вынужден отозвать миллионы игрушек китайского производства, окрашенных свинцовой краской.Между тем, токсичная струйка свинца из припоя и электродов батарей медленно вымывается со свалок по всему миру. В 2006 году Европейский Союз фактически запретил использование свинца в большинстве бытовой электроники, но он по-прежнему используется в других странах. Для алхимиков свинец был самым низким из металлов – в некотором смысле, именно с него зародились все металлы. Говоря о неблагородных металлах, которые алхимия пыталась превратить в серебро и золото, не было ничего более низменного, чем свинец. Алхимики считали, что свинец медленно превращается в другие металлы в земле.Но алхимия также дала свинцу шанс избавиться от его серого и лишенного изящества образа. Чтобы из свинца нарисовать великолепные цвета, не нужно много времени. Древние технологи бланшировали тусклый металл, помещая полоски свинца в горшки с уксусом и запирая их в сарае, полном навоза. Пары уксуса и газ от ферментированного навоза разъедали свинец до свинцовой белила. Аккуратно нагрейте его, и он станет желтым: форма оксида свинца, известная как глет, или, в средние века, массикот. Нагрейте его еще немного, и он станет ярко-красным, так как вы образуете другой вид оксида.Оба эти вещества использовались художниками – красный свинец долгое время был их лучшим красным цветом, который в средние века использовали для росписи многих ярких одежд. Это был фирменный цвет Святого Иеронима. Для алхимиков эти изменения цвета были не просто способом создания пигментов. Они означали, что в металле происходят более глубокие изменения, приближающие его к цвету золота. Поэтому неудивительно, что их эксперименты часто начинались со свинца. Они не приблизились к созданию настоящего золота, но начали исследовать процессы химического превращения. Однако свинец, кажется, привык раскрывать свои истинные и грязные цвета. На воздухе он может продолжать поглощать кислород, пока не станет черным. Красный свинец стал шоколадно-коричневым на картинах по всему миру, от Японии до Индии и Швейцарии. В городских галереях есть еще одна опасность, так как сернистые пары загрязнений вступают в реакцию с красным свинцом или сернистым свинцом. Кажется, от этого никуда не деться: у свинца хмурое и меланхоличное сердце. Крис Смит Фил Болл исследует глубины научной истории свинца.Очередной выпуск химии в своей стихии обещает стать рекордсменом. Марк Пеплоу Вы можете много узнать о ком-то, встретившись с его семьей, и то же самое можно сказать о стихии. Вот почему мы так много узнали об астате. Считается, что верхний километр земной коры, который часто провозглашается самым редким природным элементом в мире, содержит менее 50 мг астата, что делает его самым редким элементом, установленным в Книге рекордов Гиннеса. Крис Смит И вы можете услышать, как Марк Пеплоу рассказывает историю самого редкого химического вещества в мире в химии в его элементе на следующей неделе. Я Крис Смит, спасибо за внимание, увидимся в следующий раз. (Промо) (Окончание промо) |
Свинец – элемент 82 или Pb
Свинец – это тяжелый металлический элемент, обычно встречающийся в радиационной защите и мягких сплавах.Это тускло-серый металл с символом элемента Pb и атомным номером 82. Вот коллекция интересных фактов о свинце, в том числе о его свойствах, использовании и источниках.
Интересные факты о свинце
- Свинец является относительно распространенным элементом, поскольку он является конечной точкой схем распада многих радиоактивных элементов с более высокими атомными номерами.
- Поскольку его довольно легко извлечь (для металла), свинец использовался с доисторических времен. Свинец был легко доступен простым людям в Римской империи, нашел применение в посуде, водопроводе, монетах и статуях.Люди использовали его для изготовления предметов повседневного обихода в течение тысяч лет, пока в конце 19 века он не оказался ядовитым.
- Тетраэтилсвинец был добавлен в бензин для уменьшения детонации двигателя в 1920-х годах. Даже когда его изобрели, было известно, что он ядовит. Несколько заводских рабочих умерли от воздействия свинца. Однако использование этилированного газа не прекращалось до 1970-х годов, а использование в дорожных транспортных средствах запрещалось до 1996 года. Этот металл до сих пор используется в автомобильных аккумуляторах, для изготовления этилированного стекла и для защиты от радиации.Производство и использование этого металла во всем мире продолжает расти.
- Свинец – металл после переходного периода. Он не такой реактивный, как многие другие металлы, за исключением порошкообразного состояния. Он проявляет слабый металлический характер, часто образуя ковалентные связи с другими элементами. Элемент легко соединяется с самим собой, образуя кольца, цепочки и многогранники. В отличие от большинства металлов, свинец мягкий, тусклый и не очень хорошо проводит электричество.
- Порошок свинца горит бело-голубым пламенем. Металлический порошок пирофорен.
- Грифель карандаша на самом деле представляет собой графитовую форму углерода, но металлический свинец достаточно мягкий, чтобы оставлять след. Свинец использовался как один из первых инструментов для письма.
- Соединения свинца на вкус сладкие. Ацетат свинца называли «сахаром свинца» и в прошлом использовали в качестве подсластителя.
- Раньше людям было трудно отличить олово от свинца. Считалось, что это две формы одного и того же вещества. Свинец назывался «plumbum nigrum» (черный свинец), а олово – «plumbum Candidum» (светлый свинец).
Свинцовые атомные данные
Название элемента: Lead
Символ: Pb
атомный номер: 82
Атомный вес: 207.2
Группа элементов: Основной металл
Открытие: Известно древним, история которого насчитывает не менее 7000 лет. Упоминается в книге Исход.
Происхождение имени: Англосаксонское: свинец; символ с латинского: отвес.
Плотность (г / куб. См): 11,35
Температура плавления (° K): 600,65
Температура кипения (° K): 2013
Свойства: Свинец – чрезвычайно мягкий, очень ковкий и пластичный, плохо проводящий электричество, устойчивый к коррозии, бело-голубой блестящий металл, который на воздухе тускнеет до тускло-серого цвета. Свинец – единственный металл, в котором отсутствует эффект Томсона. Свинец – это накопительный яд.
Атомный радиус (пм): 175
Атомный объем (куб.см / моль): 18.3
Ковалентный радиус (пм): 147
Ионный радиус: 84 (+ 4e) 120 (+ 2e)
Удельная теплоемкость (при 20 ° C Дж / г моль): 0,159
Теплота плавления (кДж / моль): 4,77
Теплота испарения (кДж / моль): 177,8
Температура Дебая (° K): 88.00
Полинг Номер отрицания: 1,8
Первая ионизирующая энергия (кДж / моль): 715.2
Степени окисления: 4, 2
Электронная конфигурация: [Xe] 4f 14 5d 10 6s 2 6p 2
Структура решетки: Гранецентрированная кубическая (FCC)
Константа решетки (Å): 4,950
Изотопы: Природный свинец представляет собой смесь четырех стабильных изотопов: 204 Pb (1,48%), 206 Pb (23,6%), 207 Pb (22,6%) и 208 Pb (52.3%). Известно 27 других изотопов, все радиоактивные.
Применение: Свинец используется в качестве звукопоглотителя, защиты от рентгеновского излучения и для поглощения вибраций. Он используется в рыболовных грузах, для покрытия фитилей некоторых свечей, в качестве охлаждающей жидкости (расплавленный свинец), в качестве балласта и для электродов. Свинцовые соединения используются в красках, инсектицидах и аккумуляторных батареях. Оксид используется для изготовления свинцового «хрусталя» и бесцветного стекла. Сплавы используются в качестве припоя, олова, металла, пуль, дроби, антифрикционных смазок и сантехники.
Источники: Свинец существует в своей естественной форме, хотя встречается редко. Свинец можно получить из галенита (PbS) в процессе обжарки. Другие распространенные свинцовые минералы включают англезит, церуссит и миним.
Другие факты: Алхимики считали свинец самым древним металлом. Он был связан с планетой Сатурн.
Источники
- Baird, C .; Канн, Н. (2012). Химия окружающей среды (5-е изд.). В. Х. Фриман и компания.ISBN 978-1-4292-7704-4.
- Эмсли, Джон (2011). Строительные блоки природы: Путеводитель по элементам от А до Я . Издательство Оксфордского университета. С. 492–98. ISBN 978-0-19-960563-7.
- Greenwood, Norman N .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- Хаммонд, К. Р. (2004). Элементы, в Справочнике по химии и физике (81-е изд.).CRC Press. ISBN 978-0-8493-0485-9.
- Вист, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4.
10 фактов об элементе свинца (Pb или атомный номер 82)
Свинец – это тяжелый металл, с которым вы сталкиваетесь в повседневной жизни в припое, витражах и, возможно, в вашей питьевой воде. Вот 10 фактов о ведущих элементах.
Быстрые факты: свинец
- Название элемента: Свинец
- Обозначение элемента: Pb
- Атомный номер: 82
- Атомный вес: 207.2
- Категория элемента: основной металл или металл после перехода
- Внешний вид: Свинец представляет собой твердое вещество серого металлического цвета при комнатной температуре.
- Электронная конфигурация: [Xe] 4f14 5d10 6s2 6p2
- Степень окисления: наиболее распространенная степень окисления – 2+, за которой следует 4+. Также встречаются состояния 3+, 1+, 1-, 2- и 4-.
Интересные факты о свинцовом элементе
- Свинец имеет атомный номер 82, что означает, что каждый атом свинца имеет 82 протона. Это наивысший атомный номер стабильных элементов.Природный свинец состоит из смеси 4 стабильных изотопов, хотя радиоизотопы также существуют. Название элемента «свинец» происходит от англосаксонского слова «металл». Его химический символ – Pb, который основан на слове «plumbum», старом латинском названии свинца.
- Свинец считается основным металлом или металлом после переходного периода. После резки это блестящий бело-голубой металл, но на воздухе он окисляется до тускло-серого цвета. При плавлении он становится блестящим, серебристо-хромовым. Хотя свинец плотный, пластичный и податливый, как и многие другие металлы, некоторые из его свойств не соответствуют тому, что можно было бы назвать «металлическим».Например, металл имеет низкую температуру плавления (327,46 o ° C) и плохо проводит электричество.
- Свинец – один из металлов, который был известен древнему человеку. Иногда его называют первым металлом (хотя древние знали также золото, серебро и другие металлы). Алхимики связали металл с планетой Сатурн и искали способ превратить свинец в золото.
- Более половины производимого сегодня свинца используется в свинцово-кислотных автомобильных аккумуляторах. Хотя свинец действительно встречается (редко) в природе в чистом виде, большая часть производимого сегодня свинца поступает из переработанных батарей.Свинец содержится в минерале галените (PbS) и рудах меди, цинка и серебра.
- Свинец очень токсичен. Элемент в первую очередь влияет на центральную нервную систему. Это особенно опасно для младенцев и детей, поскольку воздействие свинца может замедлить развитие. Свинец – это накопительный яд. В отличие от многих токсинов, на самом деле не существует безопасного уровня воздействия свинца, хотя он присутствует во многих распространенных материалах.
- Свинец – единственный металл, у которого отсутствует эффект Томсона. Другими словами, когда электрический ток пропускается через образец свинца, тепло не поглощается и не выделяется.
- В то время как современные ученые могут легко различить большинство элементов, раньше было трудно отличить свинец и олово, потому что эти два металла имеют очень много схожих свойств. Итак, долгое время эти два элемента считались разными формами одного и того же металла. Древние римляне называли свинец «plumbum nigrum», что означает «черный свинец». Они назвали олово «кандида свинца», что означает «светлый свинец».
- Деревянные карандаши никогда не содержали свинца, хотя свинец достаточно мягкий, его можно использовать для письма.Карандашный грифель – это разновидность графита, которую римляне называли plumbago, что означает «действие за свинец». Название прижилось, хотя два материала разные. Однако свинец связан с графитом. Графит – это форма или аллотроп углерода. Свинец принадлежит к семейству элементов углерода.
- Свинец находит бесчисленное множество применений. Из-за высокой коррозионной стойкости древние римляне использовали его для водопровода. Хотя это звучит как опасная практика, жесткая вода образует накипь внутри труб, уменьшая воздействие токсичных элементов.Даже в наше время свинцовый припой широко используется для сварки сантехники. Свинец добавляли в бензин для уменьшения детонации двигателя, в краски для лица и краски, используемые для изготовления игрушек и зданий, и даже в косметику и продукты питания (в прошлом) для придания сладкого вкуса. Из него делают витражи, свинцовый хрусталь, рыболовные грузила, радиационные щиты, пули, утяжелители для акваланга, кровлю, балласты и статуи. Когда-то соединения свинца были широко распространены в качестве добавки к краске и пестицидов, но сейчас они используются реже из-за их сохраняющейся токсичности.Сладкий вкус смесей делает их привлекательными для детей и домашних животных.
- Содержание свинца в земной коре составляет 14 частей на миллион по весу. Численность в Солнечной системе составляет 10 частей на миллиард по весу.
Периодическая таблица элементов
Периодическая таблица элементовЭЛЕМЕНТЫ В ОДНОЙ КОЛОНКЕ (ГРУППЕ) ИМЕЮТ ПОДОБНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА
Название каждого элемента (коричневым цветом) сопровождается его химическим символом (красным цветом),
, а также его атомным номером Z и его наиболее распространенным (или наиболее стабильный) массовое число А .
Z = атомный номер = количество протонов в ядре = количество электронов, вращающихся вокруг ядра;
A = массовое число = количество протонов и нейтронов в наиболее распространенном (или наиболее стабильном) ядре.
Группа I a | Группа II a | Группа III b | Группа IV b | Группа V b | Группа VI b | 9 Группа VI b 9 Группа VI b 9 Группа bГруппа VIII | Группа I b | Группа II b | Группа III a | Группа IV a | Группа V a | 9000 a3Группа VII a | Группа 0 | |||||
| Водород H Z = 1, A = 1 | -> -> -> – > -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> – -> -> -> – -> -> -> -> -> -> -> -> -> -> -> -> | Гелий He Z = 2, A = 4 | ||||||||||||||||
| Литий Li Z = 3, A = 6 | Берилий Be Z = 4, A = 10 | -> -> -> – -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> | Бор B Z = 5, A = 11 | Углерод C Z = 6, A = 12 | Азот N Z = 7, A = 14 | Кислород O Z = 8, A = 16 | Фтор F Z = 9, A = 19 | Neon Ne 9 0330 Z = 10, A = 20 | ||||||||||
| Натрий Na Z = 11, A = 23 | Магний Mg Z = 12, A = 24 | – > -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> – -> -> -> -> -> | Алюминий Al Z = 13, A = 27 | Кремний Si Z = 14, A = 28 | Фосфор P Z = 15, A = 31 | Сера S Z = 16, A = 32 | Хлор Cl Z = 17, A = 35.5 | Аргон Ar Z = 18, A = 40 | ||||||||||
| Калий K Z = 19, A = 39 | Кальций Ca Z = 20, A = 40 | Скандий Sc Z = 21, A = 45 | Титан Ti Z = 22, A = 48 | Ванадий Va Z = 23, A = 51 | Хром Cr Z = 24, A = 52 | Марганец Mn Z = 25, A = 55 | Железо Fe Z = 26, A = 56 | Кобальт Co Z = 27, A = 59 | Никель Ni Z = 28, A = 59 | Медь Cu Z = 29, A = 63.5 | Цинк Zn Z = 30, A = 65 | Галлий Ga Z = 31, A = 70 | Германий Ge Z = 32, A = 73 | Мышьяк As Z = 33, A = 75 | Селен Se Z = 34, A = 79 | Бром Br Z = 35, A = 80 | Криптон Kr Z = 36, A = 84 | |
| Рубидий Rb Z = 37, A = 85.5 | Стронций Sr Z = 38, A = 88 | Иттрий Y Z = 39, A = 89 | Цирконий Zr Z = 40, A = 91 | Ниобий Nb Z = 41, A = 93 | Молибден Mo Z = 42, A = 96 | Технеций Tc Z = 43, A = 97 | Рутений Ru Z = 44, A = 101 | Родий Rh Z = 45, A = 103 | Палладий Pd Z = 46, A = 106 | Серебро Ag Z = 47, A = 108 | Кадмий Cd Z = 48, A = 112 | Индий In Z = 49, A = 115 | Олово Sn Z = 50, A = 119 | Сурьма Sb Z = 51, A = 122 | Теллур Te Z = 52, A = 128 | Йод I Z = 53, A = 127 | Ксенон Xe Z = 54, A = 131 | |
| Цезий Cs Z = 55, A = 133 | Барий Ba Z = 56, A = 137 | Лантан La Z = 57, A = 139 | Лантанид Серия Z = 57-71 | Гафний Hf Z = 72, A = 178.5 | Тантал Ta Z = 73, A = 181 | Вольфрам W Z = 74, A = 184 | Рений Re Z = 75, A = 186 | Осмий Os Z = 76, A = 190 | Иридий Ir Z = 77, A = 192 | Платина Pt Z = 78, A = 195 | Золото Au Z = 79, A = 197 | Меркурий Hg Z = 80, A = 201 | Таллий Tl Z = 81, A = 204 | Свинец Pb Z = 82, A = 207 | Висмут Bi Z = 83, A = 209 | Полоний Po Z = 84, A = 209 | Астатин При Z = 85, A = 210 | Радон Rn Z = 86, A = 222 |
| Франций Fr Z = 87, A = 223 | Радий Ra Z = 88, A = 226 | Актиний Ac Z = 89, A = 227 | Актинид Серия Z = 89-103 | Резерфорд Rf Z = 104, A = 261 | Дубний Db Z = 105, A = 262 | Сиборгий Sg Z = 106, A = 263 | Бориум Bh Z = 107, A = 262 | Калий Hs Z = 108, A = 265 | Мейтнерий Mt Z = 109, A = 266 | Darmstadtium Ds Z = 110 | Рентген Rg Z = 111 | Copernicium Cn Z = 112 | Нихоний Nh Z = 113 | Флеровий Fl Z = 114 | Московий Mc Z = 115 | Ливерморий Ур. Z = 116 | Tennessine Ts Z = 117 | Оганессон Ог Z = 118 |
Группа I a | Группа II a | Группа III b | Группа IV b | Группа V b | Группа VI | Группа VI b Группа VII b | Группа VIII | Группа I b | Группа II b | Группа III a | Группа IV a | Группа V a | ГруппаГруппа 9 VI a | Группа VII a | Группа 0 | |||
| Серия лантанидов (редкоземельные элементы) | |||||||||||||||
| Лантан La Z = | Церий Ce Z = 58, A = 140 | Празеодим Pr Z = 59, A = 141 | Неодим Nd Z = 60, A = 144 | Прометий Pm Z = 61, A = 145 | Самарий Sm Z = 62, A = 150 | Европий Eu Z = 63, A = 152 | Гадолиний Gd Z = 64, A = 157 | Тербий Tb Z = 65, A = 159 | Диспрозий Dy Z = 66, A = 162.5 | Гольмий Ho Z = 67, A = 165 | Эрбий Er Z = 68, A = 167 | Тулий Tm Z = 69, A = 169 | Иттербий Yb Z = 70, A = 173 | Лютеций Lu Z = 71, A = 175 | Вернуться к Periodic Table |
| Серия актинидов (радиоактивные редкоземельные элементы) | |||||||||||||||
| Актиний Ac Z = 89, A | Торий Th Z = 90, A = 232 | Протактиний Па Z = 91, A = 231 | Уран U Z = 92, A = 238 | Нептуний Np Z = 93, A = 237 | Плутоний Pu Z = 94, A = 244 | Америций Am Z = 95, A = 243 | Кюрий Cm Z = 96, A = 247 | Berkelium Bk Z = 97, A = 247 | Калифорний Cf Z = 98, A = 251 | Эйнштейний Es Z = 99, A = 254 | Фермий Fm Z = 100, A = 257 | Менделевий Md Z = 101, A = 256 | Nobelium № Z = 102, A = 254 | Лоуренсий Lr Z = 103, A = 256 | Вернуться к Периодическая Таблица |
[Подкаталог урана] [Подкаталог плутония]
[ПОЛНЫЙ СПРАВОЧНИК]
по почте
ccnr @ web.нетто
С 27 марта 1996 г. было более
100 000 внешних посещений веб-сайта ЦКСР, плюс
(сброс счетчика 3 июня 1998 года в полночь)
Pb Информация об элементе свинца: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История потенциальных клиентов
Элемент Свинец был обнаружен на Ближнем Востоке в год. 4000 г. до н.э. в неизвестном месте .Вести получил свое название от английского слова (plumbum на латыни)
Присутствие свинца: изобилие в природе и вокруг нас
В таблице ниже показано содержание свинца во Вселенной, Солнце, метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура свинца
Свинец имеет твердую структуру Face Centered Cubic.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| a | б | c |
|---|---|---|
| 495.08 | 495,08 | 495.08 вечера |
и углы между ними Решетки Углы (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства свинца
Атомы свинца имеют 82 электрона и структура электронной оболочки [2, 8, 18, 32, 18, 4] с символом атомного члена (квантовые числа) 3 P 0 .
Оболочечная структура свинца – количество электронов на энергию уровень
| n | с | п. | д | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | кв.м | 2 | 6 | 10 | |
| 4 | N | 2 | 6 | 10 | 14 |
| 5 | O | 2 | 6 | 10 | |
| 6 | -P | 2 | 2 |
Основное состояние Электронная конфигурация свинца – нейтраль Атом свинца
Электронная конфигурация нейтрального атома свинца в основном состоянии [Xe] 4f14 5d10 6s2 6p2.Часть конфигурации свинца, эквивалентная благородному газу предыдущий период сокращенно обозначается как [Xe]. Для атомов с большим количеством электронов это нотация может стать длинной, поэтому используются сокращенные обозначения. электроны валентности 4f14 5d10 6s2 6p2, электроны в внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального провода
Полная электронная конфигурация основного состояния для атома свинца, несокращенная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d10 6s2 6p2
Атомная структура свинца
Атомный радиус свинца 154 пм, а его ковалентный радиус 147 пм.
Атомный спектр свинца
Свинец Химические свойства: Энергия ионизации свинца и сродство к электрону
Сродство к электрону свинца составляет 35,1 кДж / моль.
Энергия ионизации свинца
Энергии ионизации свинца
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 715.6 |
| 2 | 1450,5 |
| 3 | 3081,5 |
| 4 | 4083 |
| 5 | 6640 |
Физические свойства свинца
Физические свойства свинца см. В таблице ниже
| Плотность | 11.34 г / см3 |
| Молярный объем | 18,2716049383 см3 |
Упругие свойства
Твердость свинца – Испытания для измерения твердости элемента
Электрические свойства свинца
Свинец – проводник электричества. Ссылаться на стол ниже электрические свойства свинца
Свинец со свойствами теплопроводности и теплопроводности
Свинец Магнитные свойства
Оптические свойства свинца
Акустические свойства свинца
Тепловые свойства свинца – энтальпии и термодинамика
Термические свойства свинца
см. В таблице ниже.Энтальпия свинца
Изотопы свинца – ядерные свойства свинца
Изотопы родия.Свинец естественного происхождения имеет 4 стабильный изотоп – 204Пб, 206Пб, 207Пб, 208Пб.
| Изотоп | Масса изотопа | % изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 178Pb | ||||
| 179Pb | ||||
| 180Пб | ||||
| 181Pb | ||||
| 182Pb | ||||
| 183Pb | ||||
| 184Pb | ||||
| 185Pb | ||||
| 186Pb | ||||
| 187Pb | ||||
| 188Pb | ||||
| 189Pb | ||||
| 190Пб | ||||
| 191Pb | ||||
| 192Pb | ||||
| 193Pb | ||||
| 194Pb | ||||
| 195Pb | ||||
| 196Pb | ||||
| 197Pb | ||||
| 198Pb | ||||
| 199Pb | ||||
| 200Пб | ||||
| 201Пб | ||||
| 202Пб | ||||
| 203Пб | ||||
| 204Pb | 1.4% | Стабильный | N / A | |
| 205Pb | ||||
| 206Pb | 24.1% | Стабильный | N / A | |
| 207Pb | 22.1% | Стабильный | N / A | |
| 208Пб | 52.4% | Стабильный | N / A | |
| 209Pb | ||||
| 210Pb | ||||
| 211Pb | ||||
| 212Pb | ||||
| 213Pb | ||||
| 214Pb | ||||
| 215Pb |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
фактов о рубидии | Живая наука
Рубидий – серебристо-белый и очень мягкий металл – один из самых реактивных элементов в таблице Менделеева.По данным Chemicool, рубидий имеет плотность примерно в полтора раза больше воды и твердый при комнатной температуре, хотя металл плавится, если он немного теплее.
Как и другие щелочные металлы (литий, натрий, калий, цезий и франций), рубидий бурно реагирует с водой, окисляется при взаимодействии с кислородом и воспламеняется из-за влажности воздуха, поэтому при работе с ним необходимо соблюдать особую осторожность. элемент. Согласно Энциклопедии, ученые рассматривают рубидий как токсичный элемент, хотя о его влиянии на здоровье ничего не известно.
Только факты
- Атомный номер (число протонов в ядре): 37
- Символ атома (в периодической таблице элементов): Rb
- Атомный вес (средняя масса атома): 85,4678
- Плотность : 0,886 унции на кубический дюйм (1,532 грамма на куб см)
- Фаза при комнатной температуре: твердое вещество
- Точка плавления: 102,7 градуса по Фаренгейту (39,3 градуса Цельсия)
- Точка кипения: 1270,4 F (688 C)
- Количество натуральных изотопы (атомы одного элемента с разным числом нейтронов): 2.Также в лаборатории создано 29 искусственных изотопов.
- Наиболее распространенные изотопы: Rb-85 (72,2 процента естественного содержания), Rb-87 (27,8 процента естественного содержания)
История
Рубидий был открыт немецкими химиками Густавом Робертом Кирхгофом и Робертом Вильгельмом Бунзеном в 1861 году, когда они наблюдали спектр горящего минерала лепидолита, по словам Питера. ван дер Крогт, голландский историк.В спектре рубидия видны две темно-красные линии, и ученые назвали недавно обнаруженный щелочной металл рубидием в честь латинского слова «темно-красный».
Согласно Chemicool, рубидий был извлечен из окружающего минерала путем электролиза. Приблизительно 330 фунтов. (150 кг) лепидолитовой руды потребовалось для извлечения достаточного количества рубидия (около 1,5% минерала) для изучения его свойств. Ученые обнаружили, что рубидий был более электроположительным (это означает, что рубидий имел тенденцию образовывать положительные ионы с большей готовностью, согласно Энциклопедии), чем калий, другой щелочной металл, и бурно реагировал с водой, выделяя водород.
Согласно Энциклопедии Нового Света, рубидий был очень мало нужен или использовался до 1920-х годов, когда он все чаще использовался в исследованиях, химических реакциях и электронных приложениях.
Кто знал?
- Рубидий – 25-й по численности элемент, обнаруженный на Земле, согласно PeriodicTable. Согласно Chemicool, содержание рубидия в земной коре составляет 90 частей на миллион по весу и 30 частей на миллион по весу в Солнечной системе.
- Щелочные металлы обладают высокой реакционной способностью.По данным ChemicalElements, они имеют один электрон на внешней оболочке и не встречаются в природе свободно. Эти металлы также очень ковкие, пластичные и хорошо проводят тепло и электричество.
- Рубидий образует сплавы с другими щелочными металлами, а также с такими элементами, как ртуть (известная как амальгама) и золото, согласно Энциклопедии Нового Света. Он также присутствует во многих соединениях, которые используются в нескольких областях исследования, таких как хлорид рубидия в биологии и исследованиях клеток.
- По данным лаборатории Джефферсона, рубидий используется в качестве «геттера» в электронных лампах.Поскольку рубидий способен связываться с несколькими газами, он используется для удаления любых газовых примесей после изготовления вакуумных трубок.
- Согласно Британской энциклопедии, трудно извлечь чистый рубидий из-за того, что он всегда находится с цезием, а часто и с другими щелочными металлами. Разделить щелочные металлы сложно из-за схожей природы многих щелочных металлов.
- Рубидий самовоспламеняется при контакте с воздухом и бурно реагирует с водой, выделяя водород, который немедленно воспламеняется.Согласно Британской энциклопедии, рубидий должен храниться в минеральном масле или в атмосфере инертного газа.
- Согласно Энциклопедии Нового Света, рубидий не имеет большого коммерческого применения, но он используется в паровых турбинах, в электронных лампах, в фотоэлементах, в атомных часах, в некоторых типах стекла, в производстве супероксида путем сжигания кислорода, и с ионами калия в нескольких биологических применениях.
- Рубидий и стронций используются для радиоактивного датирования горных пород, минералов и метеоритов согласно Британской энциклопедии.Рубидий-87 – нестабильный изотоп с периодом полураспада около 50 миллиардов лет и распадается до стронция-87, стабильного изотопа стронция. Согласно Энциклопедии, радиоактивное датирование проводится путем наблюдения за соотношением стронция-87 к стронию-86.
- Согласно Chemicool, рубидий используется в фейерверках, чтобы придать взрывам пурпурно-красный цвет.
- Согласно Энциклопедии Нового Света, из-за легкой ионизации рубидия он был рассмотрен для использования в ионных двигателях космических кораблей.Однако цезий и ксенон оказались более эффективными.
- Согласно исследованию 2015 года, проведенному Рут Х. Задик и др., Группой физиков и химиков со всей Европы и Азии, опубликованному в Science Advances, рубидий был введен в «баки-шары» (молекулы углерода-60), перестраивая атомы в новую кристаллическую структуру. Новая структура показала комбинацию свойств, включая изолирующие, сверхпроводящие, металлические, магнитные и то, что известно как металл Яна-Теллера. Металл Ян-Теллера – это металл, который можно превратить из изолятора в проводник, приложив давление.
- Хотя секунда определяется колебаниями атома цезия, согласно Периодической таблице, часто рубидий используется в атомных часах из-за более низкой цены. В нескольких исследованиях, в том числе проведенных ЕКА и китайскими исследователями, обсуждается использование рубидиевых часов на спутниках, космических кораблях и в системах лазерного наведения, где требуется точное время.
Текущие исследования
В исследовании 2013 года, проведенном датскими учеными-медиками Адамом Готби, Андреасом Кьером и Филипом Хасбаком, опубликованном в Скандинавском обществе клинической физиологии и ядерной медицины, сравнивается использование радиоактивного изотопа рубидия-82 в качестве индикатор, используемый в технологии ПЭТ вместе с другими методами и индикаторами элементов.По мнению авторов, рубидий-82 становится одним из наиболее широко используемых элементов в индикаторах при исследованиях и процедурах миокарда. Рубидий-82 с периодом полураспада 75 секунд вводится в организм и используется системой визуализации для обнаружения поврежденных тканей и сердечных заболеваний и, по словам авторов, «дает отличное качество изображения».
Аналогичное исследование, опубликованное в 2016 году Дженнифер Рено и др., Группой канадских исследователей-медиков, в Journal of Nuclear Medicine. Исследование проводилось в течение одного года в трех центрах визуализации с участием более 3000 пациентов и проверяло качество визуализации с использованием рубидия-82.Авторы пришли к выводу, что использование рубидия-82 в ПЭТ-сканировании было «точным и точным, с постоянной производительностью между различными устройствами и центрами визуализации».
Использование рубидия-82 в медицинских целях началось в 1954 году, согласно исследованию 2015 года, проведенному группой французских исследователей-медиков Жаном-Франсуа Шаталем и др., Опубликованному в Frontiers in Medicine в подразделе Nuclear Medicine. Разрешение FDA на использование рубидия-82 в лечении миокарда было получено в 1989 году. Авторы суммируют плюсы и минусы рубидия-82, которые включают низкое радиационное воздействие и высокое качество изображений, а также плюсы и стоимость и ограниченное количество доступных ПЭТ-систем. являясь минусами.Даже с учетом минусов использование рубидия-82 идеально при исследованиях миокарда.
Дополнительные ресурсы
Кен Муди меняет периодическую таблицу
Кен Муди опирается на работу своих наставников, пытаясь создать новые элементы, гораздо более тяжелые, чем те, что существуют в природе (Фото: Жаклин МакБрайд / LLNL)1969, в разгар холодной войны, молодой Кен Муди сидел в класс химии в средней школе, запоминание 104 элементов периодической таблицы. В то время открытие элементов было конкурентным бизнесом, в котором советские и американские команды соревновались, кто первым сможет создать новые элементы, но обе команды думали, что достигли предела того, какие элементы они могут создать.
Сегодня, более 40 лет спустя, Moody добавляет новые элементы в периодическую таблицу Менделеева, которая, как считалось, заканчивается на 104. Он работает с крупными международными командами, хваля своих коллег в России и благодарит их за их помощь, а не соревнуется с ними. Вместе команда обнаружила шесть новых элементов, в результате чего периодическая таблица Менделеева теперь неофициально заканчивается на 118, но Moody считает, что это может пойти еще дальше.
Каждый новый элемент помогает нам понять повторяющиеся тенденции в периодической таблице.Большинство из этих новых элементов длится недолго; они исчезли до того, как Муди осознал, что они были созданы. Но Moody ищет Остров стабильности, теоретическое место в периодической таблице, где элементы будут стабильны и сохранятся достаточно долго для проведения химических тестов. Считалось, что элемент 114 находится в центре острова стабильности из-за его положения в таблице Менделеева. Он находится под свинцом (элемент 82), который является самым тяжелым стабильным элементом, поэтому элемент 114 был предсказан как очень стабильный.114-й элемент был элементом, которого люди пытались достичь на протяжении многих лет. Создав его, Муди наконец осуществил мечты своих прежних наставников.
Наука о тяжелых элементах стала неожиданным выбором для Moody. В 1977 году он отправился в Калифорнийский университет в Беркли, чтобы получить степень доктора философии. по химии, но ни один из профессоров физической химии его не вдохновил.
По прихоти он позвонил Гленну Сиборгу, известному физику и одному из лауреатов Нобелевской премии по физике 1951 года за совместное открытие плутония (элемент 94).Сиборг работал над трансурановыми элементами, группой элементов, которые, за исключением очень редких изотопов, не существуют в природе или среди атомов, которые присутствовали во время формирования Земли и теперь исчезли из-за ядерного распада. Это сверхтяжелые и высокорадиоактивные элементы, большие, чем уран (элемент 92), расположенные в особой области, которая теперь является стандартной для периодических таблиц, которые сегодня запоминаются учащимися. Элемент 106 назван в его честь, Себоргиум. В то время Сиборг стремился помочь следующему поколению ученых открыть новые элементы.
«Он все бросил, провел со мной два часа, провел меня по Национальной лаборатории Лоуренса в Беркли, показал мне ускорители. И в тот момент я был полностью увлечен. Как продавец Гленн был потрясающим человеком», – говорит Муди. о своем старом наставнике.
В 1985 году Муди был нанят Кеном Хьюлетом из Ливерморской национальной лаборатории Лоуренса, чтобы привнести инновации в открытие новых элементов.
Грюм и Хьюлет быстро приступили к поиску Острова Стабильности, но у них не было места для экспериментов.«Мы знали, что им требуется длительное время луча, много усилий, нас было всего шесть человек в группе. Я имею в виду, действительно, с точки зрения людских ресурсов, с точки зрения оборудования; на самом деле мы не могли соревноваться здесь в одиночку». Поэтому Хьюлет связался с русскими и предложил сотрудничать с ними, снабдив их такими вещами, как усовершенствованные детекторные технологии, которые они все еще используют, и радиоактивный материал для использования в качестве мишеней в экспериментах.
Сегодня Муди и его партнеры из лаборатории в Дубне в России все еще ищут Остров стабильности, который заинтриговал и Хьюлета, и Сиборга.Последний элемент, существующий в природе, – это уран. Но чем крупнее становятся элементы, тем короче их период полураспада. Соединение существующих атомов вместе создает новые элементы, процесс, требующий большой удачи, когда ядра сливаются и образуют новый элемент. Bu
т эти новые создания проходят альфа-распад и деление, прежде чем ученые осознали, что они были созданы. Все, что осталось, – это компьютерные записи.
Идея создания стабильных элементов заманчива. Мы уже используем синтетические элементы для ряда вещей, америций (элемент 95) находится в детекторах дыма, а другие синтетические элементы используются в медицине.Муди надеется, что создание еще более тяжелого и стабильного элемента может привести к «тефлону» в науке о тяжелых элементах.
В 1999 году Муди и команда Ливермора-Дубны наконец создали элемент 114, и один из его изотопов просуществовал несколько секунд, что намного дольше, чем его периодические соседи. Но этого недостаточно, чтобы доказать существование Острова стабильности. Некоторые теоретики теперь думают, что он может существовать и дальше, на элементе 120 или 122. Муди по-прежнему считает, что 114 находится на острове, по крайней мере, на его берегах, и считает, что у нас просто нет технологии для создания стабильного изотопа.
«На самом деле есть две вещи, которые обеспечивают дополнительную стабильность», – говорит он. “Есть число протона, чтобы определить элемент, поэтому элемент с 11
4 протона является сверхстабильным. Но есть еще нейтронное число, которого мы не достигли ». Но, признает Муди, это вызов для следующего поколения химиков, поскольку у нас пока нет технологии для этого.
Moody хочет увидеть, что происходит с периодической таблицей, когда элементы становятся больше. Он хочет проверить пределы периодичности и посмотреть, будут ли эти тяжелые элементы металлами, такими как свинец, или действовать как благородные газы, как предполагают некоторые.
«По мере того, как ядро становится все тяжелее и тяжелее, электроны, которые на самом деле находятся рядом с ядром, должны двигаться все быстрее и быстрее, и они становятся релятивистскими. Масса электрона, поскольку он движется так быстро, фактически начинает увеличиваться. Это делает орбиту сжаться, электрон проводит больше времени в непосредственной близости от ядра или внутри него, это распространяется через атом и изменяет конфигурацию внешних электронов. Таким образом, существует некоторый закон, согласно которому в какой-то момент периодическая таблица Менделеева перестает работать. .«
Изучение того, что происходит с этими крупными элементами, станет следующей задачей для молодых физиков и химиков, наставников Муди, точно так же, как он продолжает искать ответы на вопросы, которые ставили в тупик его собственных наставников несколько десятилетий назад.
.