Серебро Ag в таблице Менделеева, химический элемент
Серебро было известно человечеству еще 6 тысяч лет назад. Серебро — химический элемент 11 группы Таблицы Менделеева, обозначается Ag (от лат. Argrntum), благородный металл серебристо-белого цвета. Цвет серебра и дал ему название, латинское слово Argentum происходит от греческого argos — блестящий.
Серебро в природе
Серебро является достаточно редким элементом, в литосфере его содержится всего около 0,000001%. Это примерно в тысячу раз меньше, чем содержание меди в земной коре. Несмотря на редкость, серебро чаще встречается в виде самородков, поэтому то оно и было известно с незапамятных времен. Сейчас самородное серебро стало редкостью, основная часть серебра находится в разнообразных минералах, основным из которых является аргентит Ag2S. Также большая часть находится в так называемых полиметаллических рудах, в них серебро соседствует с такими металлами как свинец, цинк и медь.
Исторические факты о серебре
Существует легенда, что первые серебряные рудники были открыты в 968 г. никем иным как основателем Священной Римской империи восточно-франкским королём Оттоном I Великим. Легенда гласит, что однажды король послал своего егеря в лес на охоту. Во время охоты тот привязал коня к дереву, который в ожидании хозяина разрыл копытами землю, где оказались необычные светлые камни. Император понял, что это серебро и повелел основать на этом месте рудник. Существуют данные, что этот богатейший рудник разрабатывался еще спустя шесть веков. Об этом свидетельствуют записи немецкого врача и металлурга Георга Агриколы (1494–1555).
никем иным как основателем Священной Римской империи восточно-франкским королём Оттоном I Великим. Легенда гласит, что однажды король послал своего егеря в лес на охоту. Во время охоты тот привязал коня к дереву, который в ожидании хозяина разрыл копытами землю, где оказались необычные светлые камни. Император понял, что это серебро и повелел основать на этом месте рудник. Существуют данные, что этот богатейший рудник разрабатывался еще спустя шесть веков. Об этом свидетельствуют записи немецкого врача и металлурга Георга Агриколы (1494–1555).
Вообще Центральная Европа была очень богата залежами серебряных самородков. В Саксонии в 1477 году был найден один из самых больших самородков в истории массой до 20 тонн! Из серебра добытого в Чехии, близ города Иоахимсталя, были отчеканены миллионы европейских монет. Поэтому их так и называли — «иоахимсталер»; со временем слово укоротилось до «талера». В России это название переиначили на свой лад и у нас они назывались «ефи́мками». Серебряные талеры были самой распространенной европейской монетой в истории, от этого название пошло современное название «доллар».
Европейские серебряные рудники были настолько богаты, что расход серебра измерялся в тоннах! Но т.к. основная масса европейских серебряных рудников была открыта в XIV-XVI вв., то к настоящему времени они уже истощены.
После открытия Америки оказалось, что этот континент очень богат на серебро. Его залежи были обнаружены в Чили, Перу и Мексике. Аргентина даже получила название по латинскому имени серебра. Тут нужно указать на очень интересный факт. Географические названия химических элементов обычно давались элементу от названия какого-то места, например, гафний назван так от латинского наименования города Копенгаген, в котором он был открыт, географические названия имеют элементы полоний, рутений, галлий и другие. Тут же произошло все с точностью наоборот. Страна была названа по имени химического элемента! Это единственный подобный случай в истории. Самородки серебра находят в Америке и в настоящее время. Один из них был открыт уже в XX веке в Канаде.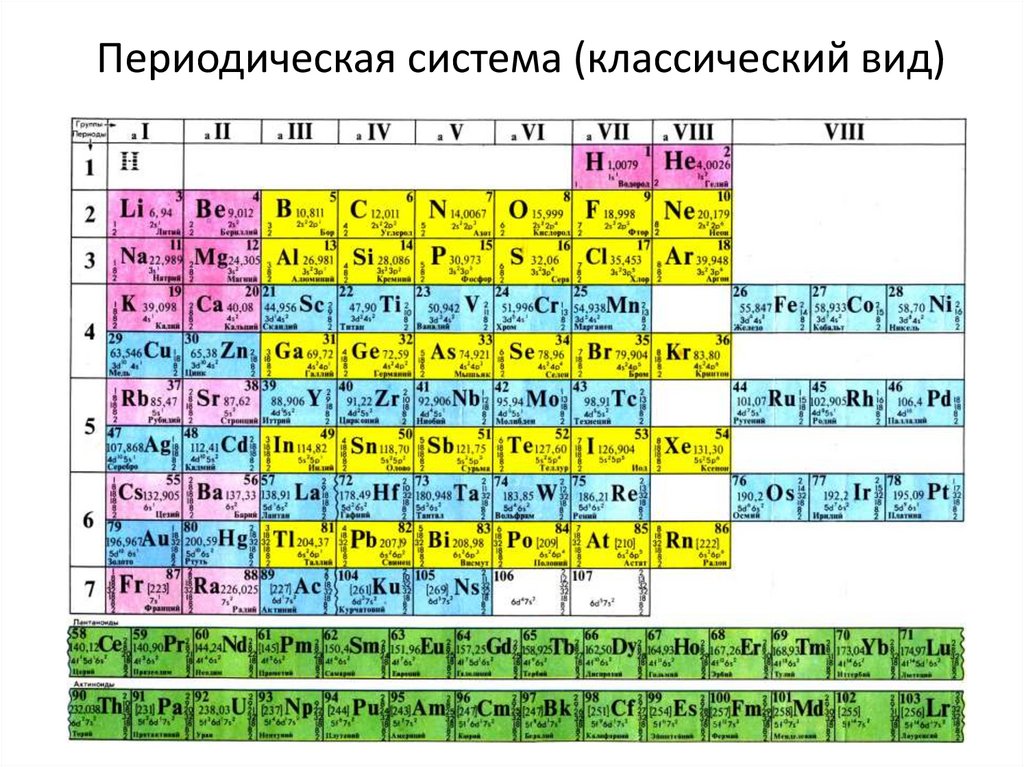 Этот самородок был длиной 30 метров и глубиной 18 метров! После освоения этого самородка оказалось, что он содержал 20 тонн чистого серебра!
Этот самородок был длиной 30 метров и глубиной 18 метров! После освоения этого самородка оказалось, что он содержал 20 тонн чистого серебра!
Химические свойства серебра
Серебро — сравнительно мягкий и пластичный металл, из 1 г его можно вытянуть металлическую нить длиной 2 км! Серебро тяжёлый металл, имеет низкую теплопроводность и электропроводность. Температура плавления относительно невысок, всего 962° С. Серебро охотно образует сплавы с другими металлами, которые придают ему новые свойства, например, при добавлении меди получается более твердый сплав — биллон.
При нормальных условиях серебро не подвержено окислению, однако имеет способность поглощать кислород. Твердое серебро при нагреве способно растворить в пять раз больший объем кислорода! В жидком серебре растворяются еще больший объем газа, примерно 20:1.
Иод способен воздействовать на серебро. Особенно благородный металл “боится” иодную настойку и сероводород. В этом и заключается причина потемнения серебра со временем. Источником сероводорода в быту служат испорченные яйца, резина, некоторые полимеры. При реакции сероводорода и серебра, особенно при повышенной влажности, на поверхности металла образуется очень прочная сульфидная плёнка, которая не разрушается при нагреве и воздействии кислот и щелочей. Удалить её можно только механическим способом, например щеткой с нанесенной на неё зубной пастой.
Источником сероводорода в быту служат испорченные яйца, резина, некоторые полимеры. При реакции сероводорода и серебра, особенно при повышенной влажности, на поверхности металла образуется очень прочная сульфидная плёнка, которая не разрушается при нагреве и воздействии кислот и щелочей. Удалить её можно только механическим способом, например щеткой с нанесенной на неё зубной пастой.
Интересны биохимические свойства серебра. Несмотря на то, что серебро не является биоэлементом оно способно оказывать влияние на жизнедеятельность микробов подавляя работу их ферментов. Это происходит при соединении серебра с аминокислотой, входящей в состав фермента. Поэтому вода в серебряных сосудах не портится, т.к. в ней подавляется жизнедеятельность бактерий.
Применение серебра
Уже с давних времен серебро использовали при изготовлении зеркал, в настоящее время его заменяют алюминием для удешевления производства. Низкое электрическое сопротивление серебра находит применение в электротехнике и электронике, тут из него изготавливают разнообразные контакты и разъемы. В настоящее время серебро практически не используют для производства монет, из него изготавливают только памятные монеты. Большая часть серебра используется в ювелирном деле, при изготовлении столовых приборов. Серебро также широко используется в химической и пищевой промышленности.
В настоящее время серебро практически не используют для производства монет, из него изготавливают только памятные монеты. Большая часть серебра используется в ювелирном деле, при изготовлении столовых приборов. Серебро также широко используется в химической и пищевой промышленности.
Интересно применение иодида серебра. С его помощью можно управлять погодой. Распыляя ничтожные количества иодида серебра с самолета, добиваются образования водяных капель, т.е. проще говоря вызывается дождь. При необходимости можно выполнить и противоположную задачу, когда дождь совершенно не нужен, например, при проведении какого-то очень важного мероприятия. Для этого иодид серебра распыляют за десятки километров до места события, тогда дождь прольется там, а в нужном месте будет сухая погода.
Серебро широко применяется в медицине. Его используют как зубные протезы, в производстве лекарств (колларгол, протаргол, ляпис и др.) и медицинских инструментов.
Влияние серебра на человека
Как мы видели выше, использование небольших доз серебра имеет обеззараживающее и бактерицидное действие. Однако, что полезно в малых дозах, очень часто бывает губительно в больших. Серебро здесь не исключение. Повышение концентрации серебра в организме может вызвать снижение иммунитета, повреждения почек и печени, щитовидной железы и головного мозга. В медицине описаны случаи нарушения психики при отравлении серебром.
Однако, что полезно в малых дозах, очень часто бывает губительно в больших. Серебро здесь не исключение. Повышение концентрации серебра в организме может вызвать снижение иммунитета, повреждения почек и печени, щитовидной железы и головного мозга. В медицине описаны случаи нарушения психики при отравлении серебром.
Многолетнее поступление серебра в организм малыми дозами приводит к развитию аргирии. Металл постепенно откладывается в тканях органов и придает им зеленоватый или голубоватый цвет, особенно виден этот эффект на коже. При тяжелых случаях аргирии кожа темнеет настолько, что становится похожа на кожу африканцев. Кроме косметического эффекта в остальном аргирия не оказывает какого то ухудшения самочувствия и расстройства работы организма. Но и тут имеется свой плюс, при том, что организм пропитан серебром, ему становятся нипочем любые инфекционные заболевания!
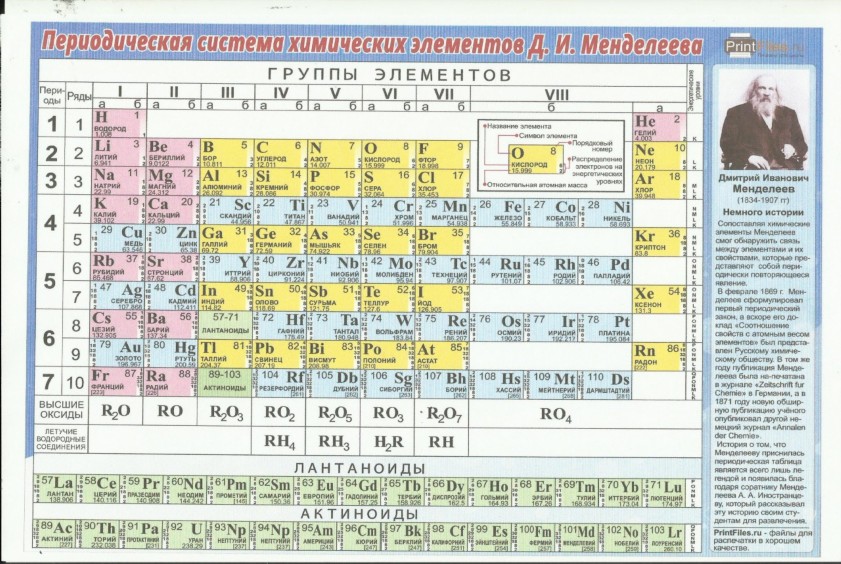
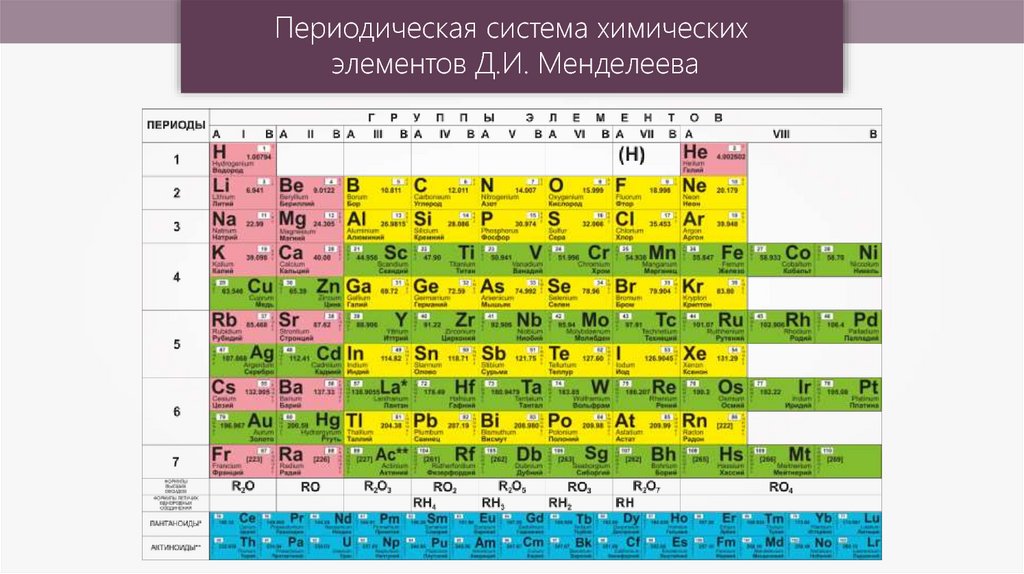
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65. 38
38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Серебро| Факты, свойства и использование
серебряный самородок
Просмотреть все материалы
- Похожие темы:
- химический элемент обработка серебра золото изделия из серебра серебрение
См. все связанные материалы →
серебро (Ag) , химический элемент, белый блестящий металл, ценимый за свою декоративную красоту и электропроводность. Серебро находится в группе 11 (Ib) и периоде 5 периодической таблицы, между медью (период 4) и золотом (период 6), а его физические и химические свойства занимают промежуточное положение между этими двумя металлами.
| атомный номер | 47 |
|---|---|
| атомный вес | 107,868 | 9 0028
| температура плавления | 960,8 °C (1861,4 °F) |
| температура кипения | 2,212 ° C (4014 °F) |
| удельный вес | 10,5 (20 °C [68 °F]) |
| степени окисления | +1, +2, +3 | 9002 8
| электронная конфигурация | [Kr]4 d 10 5 s 1 |
Свойства, использование и возникновение 9007 7
Наряду с золотом и металлами платиновой группы серебро является одним из так- называются драгоценными металлами. Из-за своей сравнительной редкости, ярко-белого цвета, ковкости, пластичности и стойкости к атмосферному окислению серебро уже давно используется в производстве монет, украшений и ювелирных изделий. Серебро обладает самой высокой из всех известных металлов электро- и теплопроводностью и используется при изготовлении печатных электрических схем и в качестве осажденного из паровой фазы покрытия для электронных проводников; он также легирован такими элементами, как никель или палладий, для использования в электрических контактах. Серебро также находит применение в качестве катализатора благодаря своей уникальной способности превращать этилен в оксид этилена, который является предшественником многих органических соединений. Серебро — один из самых благородных, то есть наименее химически активных переходных элементов.
Из-за своей сравнительной редкости, ярко-белого цвета, ковкости, пластичности и стойкости к атмосферному окислению серебро уже давно используется в производстве монет, украшений и ювелирных изделий. Серебро обладает самой высокой из всех известных металлов электро- и теплопроводностью и используется при изготовлении печатных электрических схем и в качестве осажденного из паровой фазы покрытия для электронных проводников; он также легирован такими элементами, как никель или палладий, для использования в электрических контактах. Серебро также находит применение в качестве катализатора благодаря своей уникальной способности превращать этилен в оксид этилена, который является предшественником многих органических соединений. Серебро — один из самых благородных, то есть наименее химически активных переходных элементов.
Викторина по Британике
Факты, которые вы должны знать: Викторина по периодической таблице
Серебряные украшения и украшения были найдены в царских гробницах, датируемых 4000 г.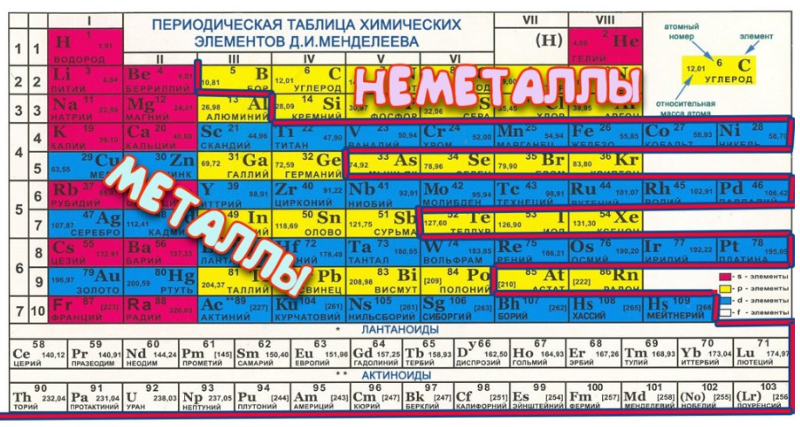
Серебро широко распространено в природе, но его общее количество довольно мало по сравнению с другими металлами; металл составляет 0,05 части на миллион земной коры. Практически все сульфиды свинца, меди и цинка содержат некоторое количество серебра. Серебросодержащие руды могут содержать количество серебра от следов до нескольких тысяч тройских унций на тонну эвердупуа, или около 10 процентов.
В отличие от золота, серебро присутствует во многих природных минералах. Для серебра более важными коммерческими месторождениями являются такие соединения, как минералы тетраэдрит и аргентит (сульфид серебра, Ag 2 S), которые обычно связаны с другими сульфидами, такими как сульфиды свинца и меди, а также с некоторыми другими сульфидами, некоторые из которых также содержат сурьму. Серебро обычно встречается в свинцовых рудах, медных рудах и рудах арсенида кобальта, а также часто связано с золотом в природе. Большая часть серебра получается как побочный продукт из руд, которые добываются и обрабатываются для получения этих других металлов. Месторождения самородного (химически свободного или несвязанного) серебра также имеют промышленное значение.
Большая часть серебра получается как побочный продукт из руд, которые добываются и обрабатываются для получения этих других металлов. Месторождения самородного (химически свободного или несвязанного) серебра также имеют промышленное значение.
Поскольку большинство руд, содержащих серебро, также содержат такие важные металлы, как свинец, медь или цинк или их комбинацию, серебросодержащая фракция этих руд часто извлекается как побочный продукт производства меди и свинца. . Затем из сырой фракции извлекают чистое серебро путем плавки в сочетании с огневым или электрорафинированием. (Для лечения восстановления и аффинажа серебра, см. обработка серебра.)
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться сейчас
| страна | добыча на руднике в 2016 г. (метрические тонны)* (метрические тонны)* | % мировой добычи полезных ископаемых | доказанные запасы 2016 г. (метрические тонны)* | % мировых доказанных запасов** |
|---|---|---|---|---|
| *Оценивать. | ||||
| ** Включая серебро, получаемое из руд цветных металлов. | ||||
| *** Детали не добавляются к общему количеству из-за округления. | ||||
| Источник: Министерство внутренних дел США, Сводные данные о минеральном сырье, 2017 г. | ||||
| Мексика | 5600 | 20,7 | 37000 | 6,5 |
| Перу | 4100 | 15. 2 2 | 120 000 | 21.1 |
| Китай | 3600 | 13.3 | 39000 | 6,8 |
| Чили | 1500 | 5.6 | 77000 | 13,5 |
| Австралия | 1400 | 5.2 | 89000 | 15,6 |
| Польша | 1400 | 5.2 | 85 000 | 14,9 |
| Россия | 1400 | 5.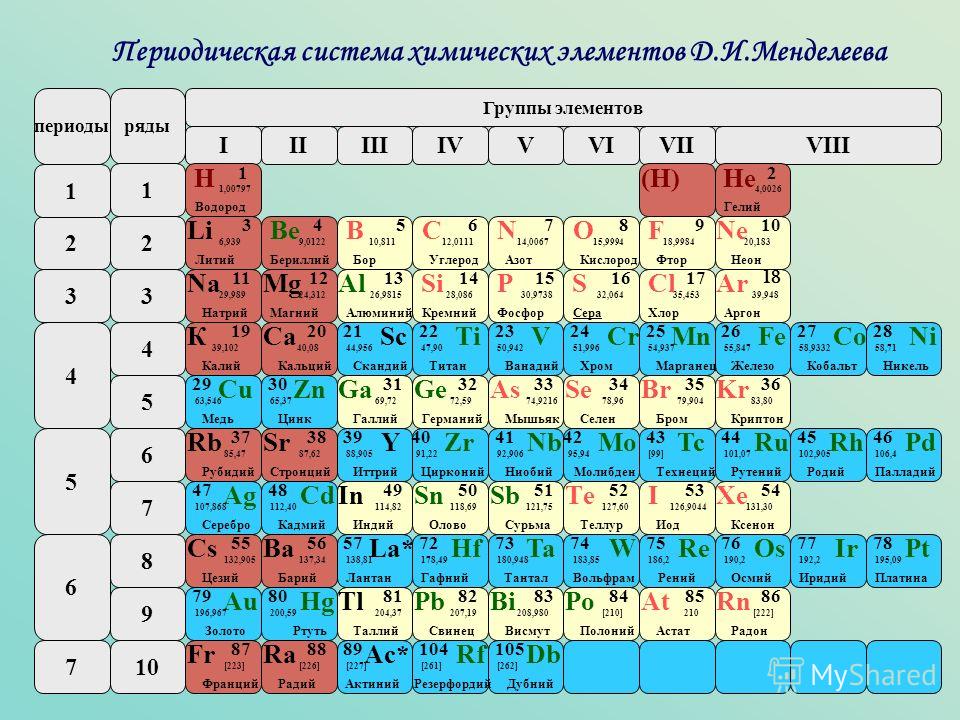 2 2 | 20 000 | 3,5 |
| Боливия | 1300 | 4,8 | 22000 | 3,9 |
| Соединенные Штаты | 1100 | 4.1 | 25000 | 4.4 |
| другие страны | 5400 | 20 | 57000 | 10 |
| мировой итог | 27000 | 100*** | 570 000 | 100*** |
Исторически сложилось так, что серебро в основном использовалось в денежной форме в виде резервов серебряных слитков и монет. Однако к 1960-м годам спрос на серебро для промышленных целей, в частности для фотоиндустрии, превысил общий годовой мировой объем производства. В начале 21 века цифровые камеры вытеснили те, в которых использовалась пленка, но спрос на серебро в других секторах, таких как столовое серебро и изделия из серебра с покрытием, украшения, ювелирные изделия, монеты, электронные компоненты и фотогальванические элементы, продолжал оставаться важным.
Однако к 1960-м годам спрос на серебро для промышленных целей, в частности для фотоиндустрии, превысил общий годовой мировой объем производства. В начале 21 века цифровые камеры вытеснили те, в которых использовалась пленка, но спрос на серебро в других секторах, таких как столовое серебро и изделия из серебра с покрытием, украшения, ювелирные изделия, монеты, электронные компоненты и фотогальванические элементы, продолжал оставаться важным.
Сплавы серебра с медью тверже, прочнее и легче плавятся, чем чистое серебро, и используются для ювелирных изделий и чеканки монет. Доля серебра в этих сплавах указывается в пробе, что означает количество частей серебра на тысячу сплава. Стерлинговое серебро содержит 92,5 процента серебра и 7,5 процента другого металла, обычно меди; т. е. оно имеет пробу 925. Ювелирное серебро представляет собой сплав, содержащий 80 процентов серебра и 20 процентов меди (чистота 800). Желтое золото, используемое в ювелирных изделиях, состоит из 53 процентов золота, 25 процентов серебра и 22 процентов меди.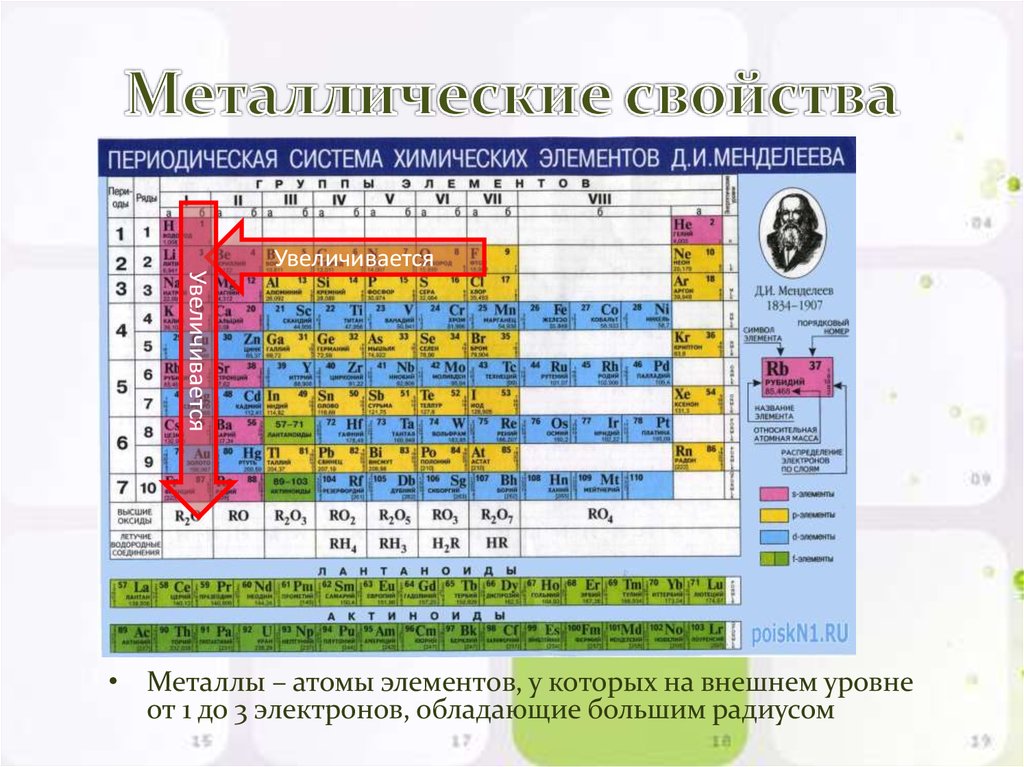 (Для рассмотрения использования серебра в декоративных и бытовых предметах, см. металлоконструкции.)
(Для рассмотрения использования серебра в декоративных и бытовых предметах, см. металлоконструкции.)
Натуральное серебро состоит из смеси двух стабильных изотопов: серебра-107 (51,839%) и серебра-109 (48,161%). Металл не реагирует с влажным воздухом или сухим кислородом, а поверхностно окисляется влажным озоном. Он быстро тускнеет при комнатной температуре из-за воздействия серы или сероводорода. В расплавленном состоянии серебро может растворять до 22-кратного объема кислорода; при затвердевании большая часть кислорода удаляется, явление, известное как выплескивание серебра. Это можно контролировать, добавляя в расплавленное серебро раскислитель, такой как древесный уголь. Серебро легко растворяется в азотной кислоте и в горячей концентрированной серной кислоте. Металл также растворяется в окисляющих кислотах и в растворах, содержащих ионы цианидов, в присутствии кислорода или перекисей. Растворение в растворах цианидов связано с образованием очень стабильного дицианоаргентата [Ag(CN) 2 ] − , ион.
Как и медь, серебро имеет единственный электрон s вне завершенной оболочки d , но, несмотря на сходство электронных структур и энергий ионизации, между серебром и медью мало сходства.
Соединения
Для серебра наиболее важной степенью окисления во всей его обычной химии является состояние +1, хотя известны состояния +2 и +3.
Соединения серебра включают хлорид серебра (AgCl), бромид серебра (AgBr) и йодид серебра (AgI). Каждая из этих солей используется в фотографии. Хлорид серебра служит светочувствительным материалом в бумаге для фотопечати и, вместе с бромидом серебра, в некоторых пленках и пластинах. Йодид также используется в производстве фотобумаги и пленки, а также при засеивании облаков для искусственного вызывания дождя и в некоторых антисептиках. Все три галогенида получены из нитрата серебра (AgNO 3 ), которая является наиболее важной из неорганических солей серебра. Помимо этих других солей, нитрат серебра также является исходным материалом для производства цианида серебра, используемого в серебрении.
Эта статья была недавно пересмотрена и обновлена Эриком Грегерсеном.
Ag Информация об элементе серебра: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура серебра
Твердотельная структура серебра Face Centered Cubic .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | b | c 90 025 |
|---|---|---|
| 408,53 пм | 408,53 пм | 408,53 пм |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π/2 | π/2 9002 7 | π/2 |
Положения атомов внутри элементарной ячейки описываются множеством атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.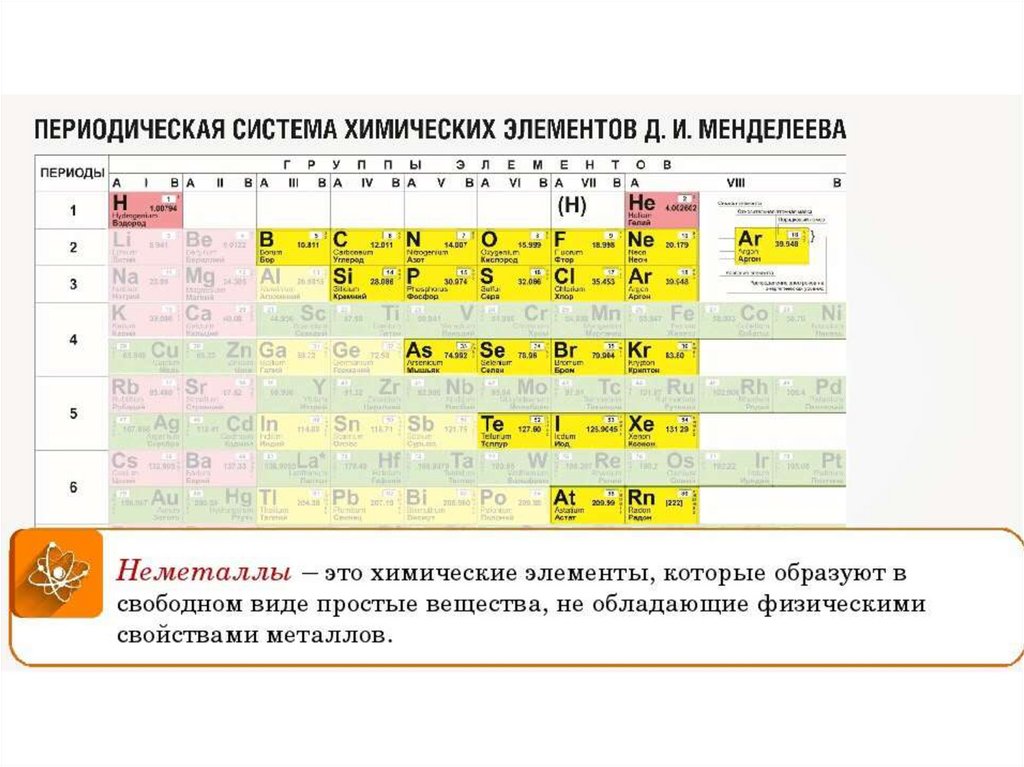
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными). 26 Пробел Номер группы
Число атомов в элементарной ячейке ячейка в простом кубе, гранецентрированном кубе и объемноцентрированном кубе 1,4,2 соответственно.
Атомные и орбитальные свойства серебра
Атомы серебра имеют 47 электронов и структуру электронной оболочки [2, 8, 18, 18, 1] с символом атомного термина (квантовые числа) 2 S 1/2 .
| Атомный номер | 47 |
| Число электронов (бесплатно) | 47 |
| Число протонов | 47 |
| Массовое число | 108 |
| Число нейтронов | 61 |
| Структура оболочки (электронов на энергетический уровень) | 2, 8, 18, 18, 1 |
| Электронная конфигурация | [Kr] 4d10 5s1 |
| Валентность Электроны | 4d10 5s1 |
| Валентность (Валентность) | 1 900 27 |
| Основные степени окисления | 1 |
| Степени окисления | -2, – 1, 0, 1, 2, 3 |
| Атомный термин (квантовые числа) | 2 S 1/2 |
Атомная модель серебра Бора – количество электронов на энергетическом уровне
Электронная конфигурация основного состояния серебра – нейтральный атом серебра
Сокращенная электронная конфигурация серебра
Сокращенная электронная конфигурация основного состояния нейтрального атома серебра [Kr] 4d10 5s1.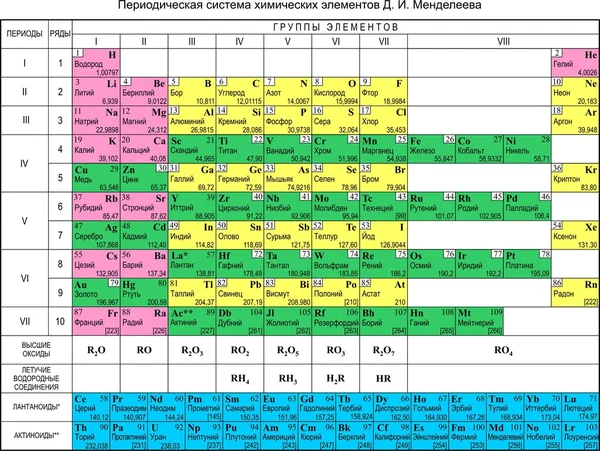 Часть конфигурации серебра, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Kr]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4d10 5s1, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации серебра, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Kr]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4d10 5s1, электроны в самой внешней оболочке, определяют химические свойства элемента.
Электронная конфигурация нейтрального серебра
Полная электронная конфигурация атома серебра в основном состоянии, электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s1
Электроны заполнены атомные орбитали в порядке, определяемом Принцип Ауфбау, принцип запрета Паули и правило Хунда.
 …
…Атомная структура серебра
Атомный радиус серебра составляет 165 пм, а ковалентный радиус — 153 пм.
| Вычисленный атомный радиус | 165 пм (1,65 Å) |
| Атомный радиус Эмпирический | 160 пм (1,6 Å) |
| Атомный объем | 10,28 3 см3/моль |
| Ковалентный радиус | 153 пм (1,53 Å) |
| Ван дер Ваальсов радиус | 172 пм |
| Сечение нейтронов | 63,6 |
| Массовое поглощение нейтронов | 0,02 | 90 028
Атомный спектр серебра
Химические свойства серебра: Энергии ионизации серебра и сродство к электрону
Сродство к электрону серебра составляет 125,6 кДж/моль.
| Валентность | 1 |
| Электроотрицательность | 1,93 |
| Электронное сродство | 125,6 кДж/моль |
Энергия ионизации серебра
Энергия ионизации серебра указана в таблице ниже
| Число энергии ионизации | Энтальпия – кДж/моль |
|---|---|
| 1-й | 731 |
| 2-й 900 27 | 2070 |
| 3-й | 3361 |
Физические свойства серебра
См. ниже таблица для физических свойств серебра
| Плотность | 10,49 г/см3 (когда жидкость при т.пл. плотностью $9,32 г/см3) |
| Молярный объем | 10,283 см3/моль |
Упругие свойства
| Модуль Юнга | 83 |
| Модуль сдвига | 30 ГПа |
| Модуль объемного сжатия | 100 ГПа |
| Коэффициент Пуассона | 0,37 |
Твердость серебра – испытания для измерения твердости элемента
| Твердость по шкале Мооса | 2,5 МПа |
| Твердость по Виккерсу | 251 МПа |
| Твердость по Бринеллю | 24,5 МПа |
Электрические свойства серебра
Серебро — проводник электричества.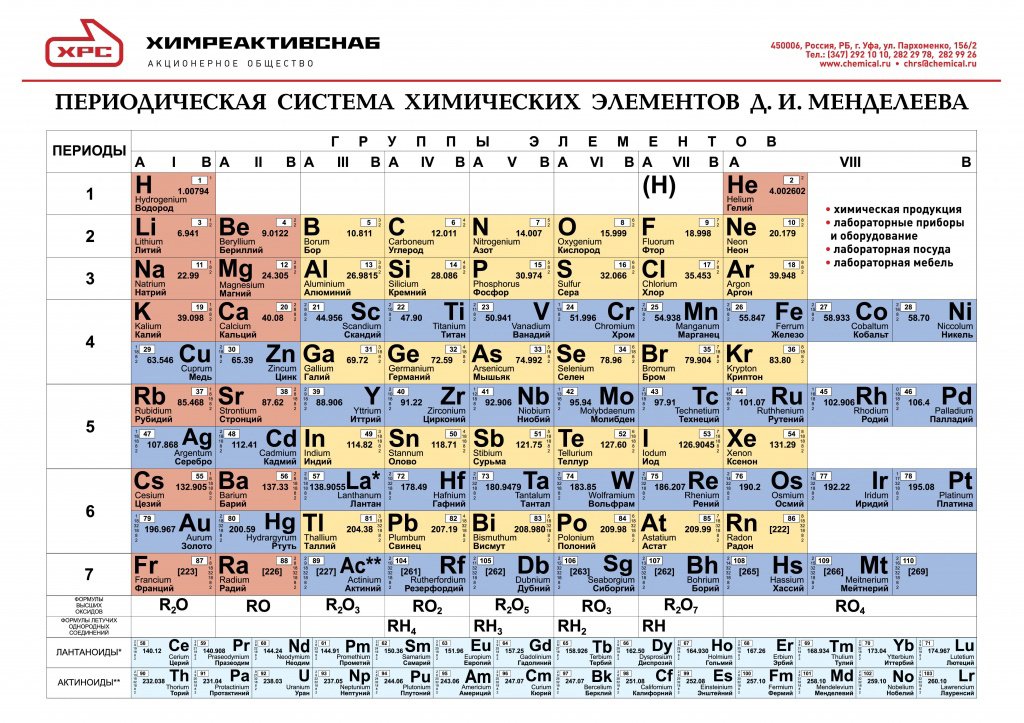 Электрические свойства серебра см. в таблице ниже. 027
Электрические свойства серебра см. в таблице ниже. 027
Серебро Теплопроводность
| Теплопроводность | 430 Вт/(м·К) |
| Тепловое расширение 900 27 | 0,0000189 /K |
Магнитные свойства серебра
| Магнитный тип | Диамагнитный |
| Точка Кюри | – |
| Масса Магнитная восприимчивость | -2,27e-9 м3/кг | 9
| Объемная магнитная восприимчивость | -0,0000238 |
| Показатель преломления | – |
Акустические свойства серебра
| Скорость звука | 2600 м/с |
Тепловые свойства серебра. Энтальпии и термодинамика
Термические свойства серебра см.
