Таблица Менделеева online – Al
Al
13
3
8
2
26.98154±1
3s23p1
Алюминий
| Относительная электроотрицательность (по Полингу): | 1,47 |
| Температура плавления: | 660,37°C |
| Температура кипения: | 2519°C |
| Теплопроводность: | 221 |
| Плотность: | 2,702 г/см3 |
| Открыт: | Ганс Кристиан Эрстед |
| Цвет в твёрдом состоянии: | Серебристый |
| Тип: | Металл |
| Орбитали: | 1s22s22p63s23p1 |
| Электронная формула: |
Al – 1s2 2s2 2p6 3s2 3p1 Al – [Ne] 3s |
| Валентность: | +3 |
| Степени окисления: | 0, +III |
| Сверхпроводящее состояние при температуре: | 1,175 К |
| Потенциалы ионизации: | 5,986 В 18,828 В 28,447 В |
Электропроводность в тв. фазе: фазе: |
38,2*106 при 273K |
| Ковалентный радиус: | 1,18 Å |
| Атомный объем: | 10 см3/моль |
| Атомный радиус: | 1,82 Å |
| Теплота распада: | 10,79 КДж/моль |
| Теплота парообразования: | 293,4 КДж/моль |
| Кристаллическая структура: | Гранецентрированный куб. Высота, ширина, длина равны. Все углы прямые. По атому имеется в каждой вершине, а также атом в центре каждой грани |
Реклама
Изотопы
| Символ нуклида |
Z(p) | N(n) | Масса изотопа (а. е. м.) |
Период полураспада (T |
Спин и чётность ядра |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 21Al | 13 | 8 | 21,02804 | 35 нс | 1/2+ |
| 22Al | 13 | 9 | 22,01952 | 59 мс | 3+ |
| 23Al | 13 | 10 | 23,007267 | 470 мс | 5/2+ |
| 23mAl | 350 мс | 79 | |||
| 24Al | 13 | 11 | 23,9999389 | 2,053 с | 4+ |
| 24mAl | 425,8 кэВ | 131,3 мс | 1+ | ||
| 25Al | 13 | 12 | 24,9904281 | 7,183 с | 5/2+ |
| 26Al | 13 | 13 | 25,98689169 | 717 тыс. лет лет |
5+ |
| 26mAl | 228,305 кэВ | 6,3452 с | |||
| 27Al | 13 | 14 | 26,98153863 | стабилен | 5/2+ |
| 28Al | 13 | 15 | 27,98191031 | 2,2414 мин | 3+ |
| 29Al | 13 | 16 | 28,9804450 | 6,56 мин | 5/2+ |
| 30Al | 13 | 17 | 29,982960 | 3,60 с | 3+ |
| 31Al | 13 | 18 | 30,983947 | 644 мс | 3/2+ |
| 32Al | 19 | 31,98812 | 31,7 мс | 1+ | |
| 32mAl | 955,7 кэВ | 200 нс | 4+ | ||
| 33Al | 13 | 20 | 32,99084 | 41,7 мс | 5/2+ |
| 34Al | 13 | 21 | 33,99685 | 56,3 мс | 4- |
| 35Al | 13 | 22 | 34,99986 | 38,6 мс | 5/2+ |
| 36Al | 13 | 23 | 36,00621 | 90 мс | |
| 37Al | 13 | 24 | 37,01068 | 10,7 мс | |
| 38Al | 13 | 25 | 38,01723 | 7,6 мс | |
| 39Al | 13 | 26 | 39,02297 | 7,6 мс | 3/2+ |
| 40Al | 13 | 27 | 40,03145 | 10 мс | |
| 41Al | 13 | 28 | 41,03833 | 2 мс | 3/2+ |
| 42Al | 13 | 42,04689 | 1 мс | ||
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д.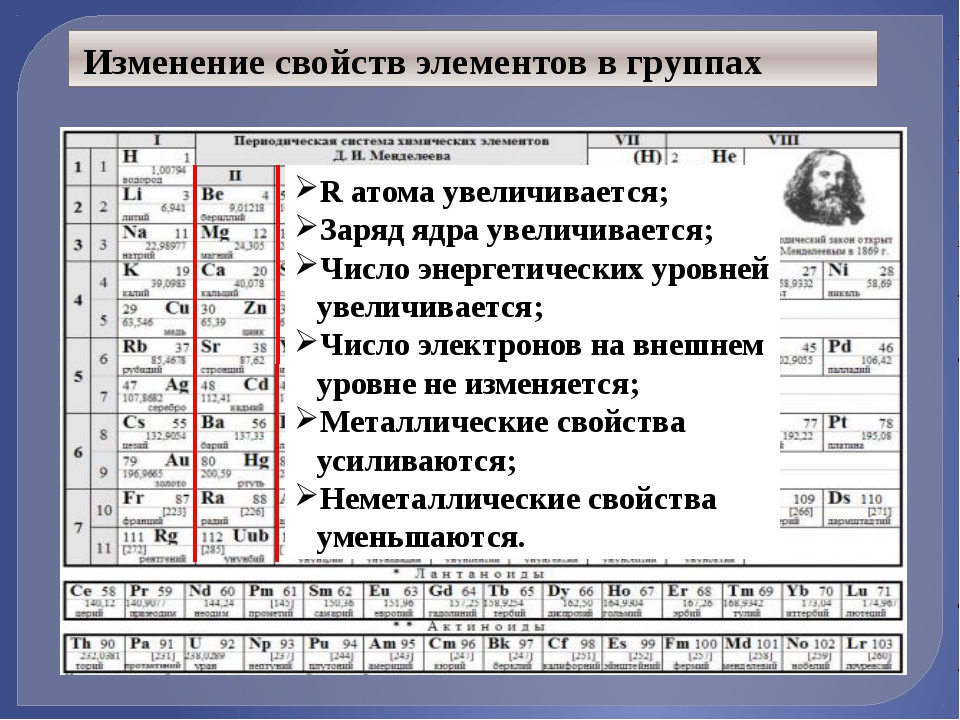 И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195. 084
084
79
Au
196.967
80
Hg
200.592
81
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree. ru • Электронный учебник
ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Алюминий | Использование, свойства и соединения
алюминий
Посмотреть все СМИ
- Ключевые люди:
- Ганс Кристиан Эрстед Эмиль Ратенау Фридрих Вёлер Чарльз Мартин Холл
- Похожие темы:
- химический элемент обработка алюминия элемент группы бора
Просмотреть весь связанный контент →
Сводка
Прочтите краткий обзор этой темы
алюминий (Al) , также пишется как алюминий , химический элемент, легкий серебристо-белый металл основной группы 13 (IIIa, или группа бора) периодической таблицы.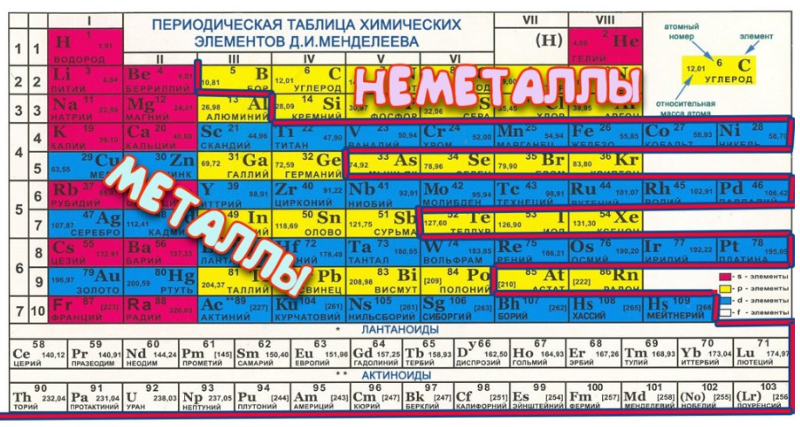 Алюминий является самым распространенным металлическим элементом в земной коре и наиболее широко используемым цветным металлом. В силу своей химической активности А. никогда не встречается в природе в металлическом виде, но его соединения в большей или меньшей степени присутствуют почти во всех горных породах, растительности и животных. Алюминий сосредоточен во внешних 16 км (10 милях) земной коры, из которых он составляет около 8 процентов по весу; его превосходят по количеству только кислород и кремний. Название алюминия происходит от латинского слова 9.0029 alumen , used to describe potash alum, or aluminum potassium sulfate, KAl(SO 4 ) 2 ∙12H 2 O.
Алюминий является самым распространенным металлическим элементом в земной коре и наиболее широко используемым цветным металлом. В силу своей химической активности А. никогда не встречается в природе в металлическом виде, но его соединения в большей или меньшей степени присутствуют почти во всех горных породах, растительности и животных. Алюминий сосредоточен во внешних 16 км (10 милях) земной коры, из которых он составляет около 8 процентов по весу; его превосходят по количеству только кислород и кремний. Название алюминия происходит от латинского слова 9.0029 alumen , used to describe potash alum, or aluminum potassium sulfate, KAl(SO 4 ) 2 ∙12H 2 O.
| atomic number | 13 |
|---|---|
| atomic weight | 26.9815384 |
| melting point | 660 °C (1,220 °F) |
| boiling point | 2,467 °C (4,473 °F) |
| specific gravity | 2. 70 (at 20 °C [68 °F]) 70 (at 20 °C [68 °F]) |
| valence | 3 |
| electron configuration | 1 s 2 2 s 2 2 p 6 3 S 2 3 P 1 |
ВОССТАНОВЛЕНИЕ И ИСТОРИЯ
Алюминий встречается в неганящих породах, главным образом, в том числе в алюминосиликации в Felds, Feldspath, и алюминосиликации в Felds, FELDSID; в полученной из них почве в виде глины; и при дальнейшем выветривании в виде бокситов и богатых железом латеритов. Бокситы, смесь гидратированных оксидов алюминия, являются основной алюминиевой рудой. Кристаллический оксид алюминия (наждак, корунд), встречающийся в некоторых магматических породах, добывается как природный абразив или в виде его более тонких разновидностей, таких как рубины и сапфиры. Алюминий присутствует в других драгоценных камнях, таких как топаз, гранат и хризоберилл. Из многих других алюминиевых минералов алунит и криолит имеют некоторое коммерческое значение.
Из многих других алюминиевых минералов алунит и криолит имеют некоторое коммерческое значение.
До 5000 г. до н. э. люди в Месопотамии изготавливали прекрасную керамику из глины, состоящей в основном из соединений алюминия, а почти 4000 лет назад египтяне и вавилоняне использовали соединения алюминия в различных химикатах и лекарствах. Плиний ссылается на квасцы, теперь известные как квасцы, соединение алюминия, широко используемое в древнем и средневековом мире для закрепления красителей в текстиле. Во второй половине 18 века такие химики, как Антуан Лавуазье, признали глинозем потенциальным источником металла.
Сырой алюминий был выделен (1825 г.) датским физиком Гансом Христианом Эрстедом путем восстановления хлорида алюминия амальгамой калия. Британский химик сэр Хамфри Дэви приготовил (1809 г.) железо-алюминиевый сплав путем электролиза плавленого оксида алюминия (оксида алюминия) и уже назвал этот элемент алюминием; слово позже было изменено на алюминий в Англии и некоторых других европейских странах. Немецкий химик Фридрих Велер, используя металлический калий в качестве восстановителя, получил алюминиевый порошок (1827 г.) и небольшие глобулы металла (1845 г.), по которым он смог определить некоторые его свойства.
Немецкий химик Фридрих Велер, используя металлический калий в качестве восстановителя, получил алюминиевый порошок (1827 г.) и небольшие глобулы металла (1845 г.), по которым он смог определить некоторые его свойства.
Новый металл был представлен публике (1855 г.) на Парижской выставке примерно в то же время, когда он стал доступен (в небольших количествах за большие деньги) путем восстановления натрием расплавленного хлорида алюминия в процессе Девиля. Когда электроэнергия стала относительно обильной и дешевой, почти одновременно Шарль Мартин Холл в Соединенных Штатах и Поль-Луи-Туссен Эру во Франции открыли (1886 г.) современный метод промышленного производства алюминия: электролиз очищенного оксида алюминия (Al 9).0031 2 O 3 ), растворенный в расплавленном криолите (Na 3 AlF 6 ). В 1960-е годы алюминий вышел на первое место, опередив медь, в мировом производстве цветных металлов. Для получения более подробной информации о добыче, переработке и производстве алюминия, см. обработка алюминия.
обработка алюминия.
Применение и свойства
Алюминий добавляют в небольших количествах к некоторым металлам для улучшения их свойств для конкретных целей, например, в алюминиевых бронзах и большинстве сплавов на основе магния; или, для сплавов на основе алюминия, к алюминию добавляются умеренные количества других металлов и кремния. Металл и его сплавы широко используются в авиастроении, строительных материалах, потребительских товарах длительного пользования (холодильники, кондиционеры, кухонная утварь), электрических проводниках, химическом и пищевом оборудовании.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Чистый алюминий (99,996%) довольно мягкий и непрочный; технический алюминий (чистота от 99 до 99,6%) с небольшими количествами кремния и железа отличается твердостью и прочностью. Ковкий и очень податливый алюминий можно вытягивать в проволоку или сворачивать в тонкую фольгу. Плотность металла составляет всего около одной трети плотности железа или меди. Несмотря на свою химическую активность, алюминий обладает высокой коррозионной стойкостью, так как на воздухе на его поверхности образуется прочная оксидная пленка.
Несмотря на свою химическую активность, алюминий обладает высокой коррозионной стойкостью, так как на воздухе на его поверхности образуется прочная оксидная пленка.
Алюминий является отличным проводником тепла и электричества. Его теплопроводность примерно вдвое меньше, чем у меди; его электропроводность, около двух третей. Он кристаллизуется в гранецентрированной кубической структуре. Весь природный алюминий представляет собой стабильный изотоп алюминия-27. Металлический алюминий, его оксид и гидроксид нетоксичны.
Алюминий медленно подвергается воздействию большинства разбавленных кислот и быстро растворяется в концентрированной соляной кислоте. Однако концентрированную азотную кислоту можно перевозить в алюминиевых цистернах, поскольку она делает металл пассивным. Даже очень чистый алюминий подвергается энергичному воздействию щелочей, таких как гидроксид натрия и калия, с образованием водорода и иона алюмината. Из-за большого сродства к кислороду мелкодисперсный алюминий при возгорании сгорает в монооксиде или диоксиде углерода с образованием оксида и карбида алюминия, но при температурах до красного каления алюминий инертен к сере.
Алюминий может быть обнаружен в концентрациях до одной части на миллион с помощью эмиссионной спектроскопии. Алюминий может быть количественно проанализирован как оксид (формула Al 2 O 3 ) или как производное азоторганического соединения 8-гидроксихинолина. Производное имеет молекулярную формулу Al(C 9 H 6 ON) 3 .
Соединения
Обычно алюминий является трехвалентным. Однако при повышенных температурах было получено несколько газообразных одновалентных и двухвалентных соединений (AlCl, Al 2 O, AlO). В алюминии конфигурация трех внешних электронов такова, что в некоторых соединениях (например, в кристаллическом фториде алюминия [AlF 3 ] и хлориде алюминия [AlCl 3 ]) голый ион Al 3+ образован потеря этих электронов, как известно, происходит. Однако энергия, необходимая для образования иона Al 3+ , очень велика, и в большинстве случаев атому алюминия энергетически выгоднее образовывать ковалентные соединения путем sp 2 гибридизация, как это делает бор. Ион Al 3+ может быть стабилизирован гидратацией, а октаэдрический ион [Al(H 2 O) 6 ] 3+ встречается как в водном растворе, так и в некоторых солях.
Ион Al 3+ может быть стабилизирован гидратацией, а октаэдрический ион [Al(H 2 O) 6 ] 3+ встречается как в водном растворе, так и в некоторых солях.
Ряд соединений алюминия имеет важное промышленное применение. Глинозем, встречающийся в природе в виде корунда, также производится в промышленных масштабах в больших количествах для использования в производстве металлического алюминия, а также в производстве изоляторов, свечей зажигания и различных других изделий. При нагревании оксид алюминия образует пористую структуру, которая позволяет ему поглощать водяной пар. Эта форма оксида алюминия, известная как активированный оксид алюминия, используется для сушки газов и некоторых жидкостей. Он также служит носителем для катализаторов различных химических реакций.
Анодный оксид алюминия (ААО), обычно получаемый путем электрохимического окисления алюминия, представляет собой наноструктурированный материал на основе алюминия с очень уникальной структурой. AAO содержит цилиндрические поры, которые можно использовать для различных целей. Это термически и механически стабильное соединение, а также оптически прозрачное и электрическое изолятор. Размер пор и толщину AAO можно легко адаптировать для определенных приложений, в том числе в качестве шаблона для синтеза материалов в нанотрубки и наностержни.
AAO содержит цилиндрические поры, которые можно использовать для различных целей. Это термически и механически стабильное соединение, а также оптически прозрачное и электрическое изолятор. Размер пор и толщину AAO можно легко адаптировать для определенных приложений, в том числе в качестве шаблона для синтеза материалов в нанотрубки и наностержни.
Другим важным соединением является сульфат алюминия, бесцветная соль, полученная действием серной кислоты на гидратированный оксид алюминия. Коммерческая форма представляет собой гидратированное кристаллическое твердое вещество с химической формулой Al 2 (SO 4 ) 3 . Он широко используется в производстве бумаги в качестве связующего для красителей и в качестве поверхностного наполнителя. Сульфат алюминия соединяется с сульфатами одновалентных металлов с образованием гидратированных двойных сульфатов, называемых квасцами. Квасцы, двойные соли формулы MAl(SO 4 ) 2 ·12H 2 O (где M представляет собой однозарядный катион, такой как K + ), также содержат ион Al 3+ ; М может быть катионом натрия, калия, рубидия, цезия, аммония или таллия, а алюминий может быть заменен множеством других ионов М 3+ , например, галлия, индия, титана, ванадия, хрома, марганца.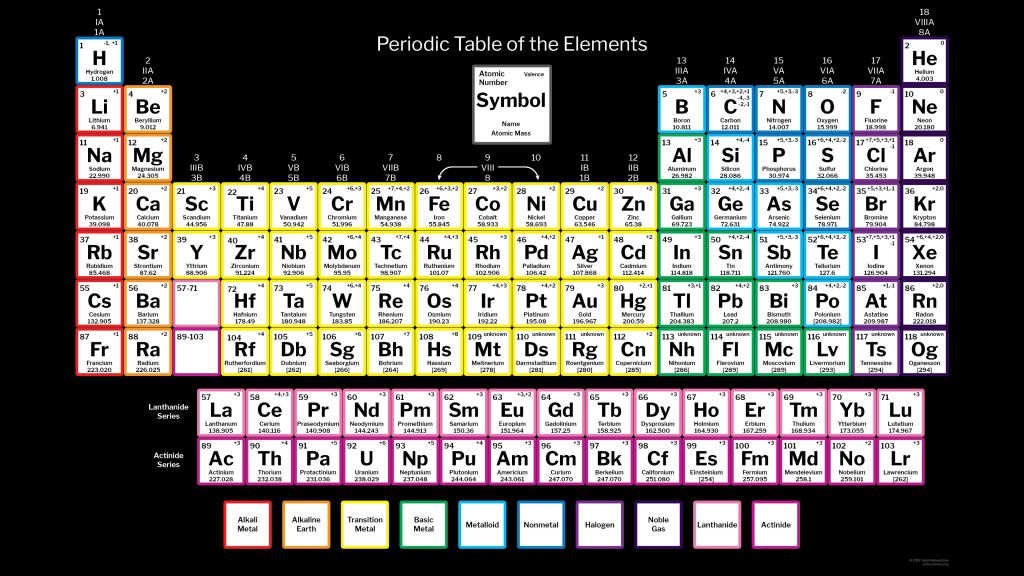 , железо или кобальт. Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы калия. Эти квасцы имеют множество применений, особенно в производстве лекарств, текстиля и красок.
, железо или кобальт. Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы калия. Эти квасцы имеют множество применений, особенно в производстве лекарств, текстиля и красок.
Реакция газообразного хлора с расплавленным металлическим алюминием дает хлорид алюминия; последний является наиболее часто используемым катализатором в реакциях Фриделя-Крафтса, т. Е. Синтетических органических реакциях, связанных с получением самых разных соединений, включая ароматические кетоны, антрохинон и его производные. Гидратированный хлорид алюминия, широко известный как хлоргидрат алюминия, AlCl 3 ∙H 2 O, используется в качестве местного антиперспиранта или дезодоранта для тела, который сужает поры. Это одна из нескольких солей алюминия, используемых в косметической промышленности.
Гидроксид алюминия, Al(OH) 3 , используется для водонепроницаемости тканей и для производства ряда других соединений алюминия, включая соли, называемые алюминатами, которые содержат группу AlO − 2 . С водородом алюминий образует гидрид алюминия, AlH 3 , полимерное твердое вещество, из которого получают тетрагидроалюминаты (важные восстановители). Алюмогидрид лития (LiAlH 4 ), образующийся при взаимодействии хлорида алюминия с гидридом лития, широко используется в органической химии, например, для восстановления альдегидов и кетонов до первичных и вторичных спиртов соответственно.
С водородом алюминий образует гидрид алюминия, AlH 3 , полимерное твердое вещество, из которого получают тетрагидроалюминаты (важные восстановители). Алюмогидрид лития (LiAlH 4 ), образующийся при взаимодействии хлорида алюминия с гидридом лития, широко используется в органической химии, например, для восстановления альдегидов и кетонов до первичных и вторичных спиртов соответственно.
Эта статья была недавно отредактирована и обновлена Эриком Грегерсеном.
Алюминий (Al) – Периодическая таблица
Алюминий представляет собой химический элемент периодической таблицы с химическим символом Al и атомным номером 13 с атомным весом 26,9815 u, классифицируется как постпереходный металл и входит в группу 13 (группа бора). Алюминий тверд при комнатной температуре.
Магний Периодическая таблица Кремний
| Symbol | Al |
| Atomic number | 13 |
| Group | 13 (Boron group) |
| Period | 3 |
| Block | p |
| Классификация | Металл после перехода |
| Внешний вид | Серебристо-серый металлик |
| Цвет | Серебристый |
| Количество протонов | 13 P + | |||||||||||||
| Номер нейтронов | 14 N 0 | |||||||||||||
| Номер Electrons | 13 | |||||||||||||
. Из Википедии, свободной энциклопедии Алюминий (или алюминий; см. разные окончания) — химический элемент группы бора с символом Al и атомным номером 13. Это серебристо-белый, мягкий, немагнитный, пластичный металл. Алюминий является третьим по распространенности элементом (после кислорода и кремния) и самым распространенным металлом в земной коре. Из Википедии, свободной энциклопедии Алюминий (или алюминий; см. разные окончания) — химический элемент группы бора с символом Al и атомным номером 13. Это серебристо-белый, мягкий, немагнитный, пластичный металл. Алюминий является третьим по распространенности элементом (после кислорода и кремния) и самым распространенным металлом в земной коре.
|

