Ион аммония, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
66575-17: HACH 5500 sc Анализаторы
Назначение
Анализаторы серии HACH 5500 sc предназначены для измерений массовых концентраций кремния в пересчете на SiO2, фосфат-ионов, монохлорамина и ионов аммония в воде.
Описание
Принцип действия анализаторов основан на образовании окрашенного комплекса измеряемого компонента при добавлении буферного раствора и индикаторного реагента, и последующего измерения интенсивности окрашивания с помощью фотометрического датчика. Определение монохлорамина и аммония проходит параллельно в двух колориметрических ячейках, в одну из которых (для измерения общего аммония) добавляется гипохлорит натрия, в результате реакции с ним весь аммоний превращается в монохлорамин. В результате в обеих ячейках измеряется содержания монохлорамина, а по разности между показаниями рассчитывается содержание свободного аммония.
Конструктивно анализатор состоит из двух отсеков. В нижнем отсеке размещены система подачи образцов и реагентов, емкости с реагентами. В верхнем расположены электронный модуль с дисплеем, предназначенный для управления всей системой. Результат измерения отображается на верхней части основного экрана, нижняя часть отображает вспомогательную информацию (данные о калибровке, количество реагентов и пр.). К нижнему отсеку с реагентами подключаются дренажные и пробоотборные системы.
В нижнем отсеке размещены система подачи образцов и реагентов, емкости с реагентами. В верхнем расположены электронный модуль с дисплеем, предназначенный для управления всей системой. Результат измерения отображается на верхней части основного экрана, нижняя часть отображает вспомогательную информацию (данные о калибровке, количество реагентов и пр.). К нижнему отсеку с реагентами подключаются дренажные и пробоотборные системы.
Анализаторы выпускаются в трех модификациях Hach 5500 sc AMC, Hach 5500 sc Silica, Hach 5500 sc Phosphate, которые различаются целевым компонентом (см. табл. 2) и набором реагентов.
Программное обеспечение
Анализаторы серии HACH 5500 sc имеют встроенное программное обеспечение «Hach», специально разработанное для выполнения измерений, передачи и просмотра результатов измерений в реальном времени на дисплее измерительного блока.
Структура встроенного программного обеспечения представляет древовидную форму. Встроенное ПО защищено на аппаратном уровне (опломбирование) от несанкционированной подмены программного модуля.
Программное обеспечение запускается в автоматическом режиме после включения анализатора. Просмотр версии ПО доступен в разделе Menu ->Setup System->Instrument Information.
Таблица 1 – Идентификационные данные (признаки) метрологически значимой части ПО.
|
Идентификационные данные (признаки) |
Значение | ||
|
Hach 5500 sc AMC |
Hach 5500 sc Silica |
Hach 5500 sc Phosphate | |
|
Идентификационное наименование ПО |
Hach 5500 |
Hach 5500 |
Hach 5500 |
|
Номер версии (идентификационный номер) ПО |
1.х |
1.х |
1.х |
|
Цифровой идентификатор ПО |
– |
– |
– |
|
Другие идентификационные данные (если имеются) |
– |
– |
– |
Защита ПО от преднамеренных и непреднамеренных изменений соответствует уровню «средний» по Р 50. 2.077-2014.
2.077-2014.
Влияние программного обеспечения на метрологические характеристики анализаторов учтено при нормировании метрологических характеристик.
Таблица 2 – Основные метрологические и технические характеристики
|
Наименование характеристик |
Значение характеристики для модификаций | ||
|
Hach 5500 sc AMC |
Hach 5500 sc Silica |
Hach 5500 sc Phosphate | |
|
Диапазон измерений массовой концентрацией кремния в пересчете на SiO2, мкг/дм3 |
– |
от 10 до 5000 |
– |
|
Пределы допускаемой абсолютной погрешности измерений массовой концентрацией кремния в пересчете на SiO2 в диапазоне от 10 до 100 мкг/дм включ., мкг/дм |
– |
±5 |
– |
|
Пределы допускаемой относительной погрешности измерений массовой концентрацией кремния в пересчете на SiO2 в диапазоне св. |
– |
±5 |
– |
|
Диапазон измерений массовой концентрации фосфат-ионов, мкг/дм3 |
– |
– |
от 4 до 50000 |
|
Пределы допускаемой относительной погрешности измерений массовой концентрации фосфат-ионов, % |
– |
– |
±5 |
|
Диапазон измерений массовой концентрации ионов аммония, мкг/дм3 |
от 10 до 2000 |
– |
– |
|
Пределы допускаемой погрешности измерений массовой концентрации ионов аммония при температуре от +5 до+ 40 °С – от 10 до 200 мкг/дм включ., (абсолютная) мкг/дм3: – св. 200 до 2000 мкг/дм , (относительная), %: |
±10 ±5 | ||
|
Пределы допускаемой погрешности измерений массовой концентрации ионов аммония при температуре св. – от 10 до 200 мкг/дм включ. (абсолютная) мкг/дм3: – св. 200 до 2000 мкг/дм , (относительная) %: |
±20 ±10 | ||
|
Наименование характеристик |
Значение характеристики для модификаций | ||
|
Hach 5500 sc AMC |
Hach 5500 sc Silica |
Hach 5500 sc Phosphate | |
|
Диапазон измерений массовой концентрации монохлораминов (по хлору), мкг/дм |
от 50 до 10000 |
– |
– |
|
Пределы допускаемой погрешности измерений массовой концентрации монохлорамина (по хлору) при температуре от +5 до +40 °C – от 50 до 1000 мкг/дм включ. (абсолютная) мкг/дм3: – св. 1000 до 10000 мкг/дм , (относительная) %: |
±50 ±5 | ||
|
Пределы допускаемой погрешности измерений массовой концентрации монохлорамина (по хлору) при температуре св. – от 50 до 1000 мкг/дм3 включ. (абсолютная) мкг/дм3: – св. 1000 до 10000 мкг/дм , (относительная) %: |
±100 ±10 | ||
|
Характеристики источника питания: напряжение, В частота, Гц |
от 100 до 240 50/60 | ||
|
Потребляемая мощность, В • А, не более |
1200 | ||
|
Выходной сигнал, мА |
от 0 до 20 или от 4 до 20 | ||
|
Г абаритные размеры: – длина, мм, не более – ширина, мм, не более – высота, мм, не более |
452 360 804 | ||
|
Масса, кг, (без реагентов) |
20,5 | ||
|
Средняя наработка на отказ, ч |
10000 | ||
|
Условия эксплуатации: »-» о/”ч – температура окружающей среды, С – относительная влажность воздуха, % – атмосферное давление, кПа |
от +5 до +45 до 95 без конденсации от 84 до 106,7 | ||
Знак утверждения типа
наносится на анализаторы в виде клеевой этикетки и на титульных листах Руководств по эксплуатации типографским способом.
Комплектность
1. Анализатор
1 шт. 1 шт. 1 шт. 1 шт.
2. Набор реагентов*
3. Руководство по эксплуатации
4. Методика поверки МП 209-21-2016 * – состав набора зависит от модели анализатора.
Поверка
осуществляется по документу МП 209-21-2016 «Анализаторы серии HACH 5500 sc Методика поверки», утвержденному ФГУП «ВНИИМ им. Д.И. Менделеева» 22 июля 2016 г.
Основные средства поверки:
– стандартные образцы массовой концентрации кремния в растворе силиката натрия ГСО 8934-2008
– стандартные образцы состава раствора фосфат-ионов ГСО 7260-96
– стандартные образцы состава водных растворов ионов аммония ГСО 7015-93+7017-93. Допускается применение аналогичных средств поверки, обеспечивающих определение
метрологических характеристик поверяемых СИ с требуемой точностью.
Знак поверки в виде голографической наклейки рекомендуется наносить на свидетельство о поверке, допускается нанесение на анализатор над дисплеем, как указано на рисунке 1.
Сведения о методах измерений
приведены в эксплуатационных документах.
Нормативные документы
Техническая документация фирмы «HACH Company», США
Аммоний хлорид, хлористый аммоний, хлорид аммония в Таразе (Аммоний хлористый)
- Казахстан
- Тараз
- Стандарт-титры: аммоний
- Аммоний хлористый Аммоний хлорид, хлористый аммоний, хлорид аммония в Таразе
Цена: Цену уточняйте
за 1 ед.
Описание товара
Хлорид аммония (хлористый аммоний, аммония хлорид, хлорид аммония) Nh5Cl — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Аммоний хлористый (нашатырь, аммония хлорид) – кристаллическая соль, белый малогигроскопичный порошок без запаха. Химическая формула – NH4Cl. Массовая доля вещества составляет – 99,8%.
Водный раствор аммония хлористого имеет слабокислую реакцию. Плохо растворим в воде, но хорошо растворяется в аммиаке, а при температуре свыше 3380 С распадается на хлороводород и аммиак. Расщепляет жирные вещества. При температуре ниже 184,30 С , аммоний хлористый образует устойчивую модификацию с кубической решеткой. Реагирует с щелочами, серной кислотой и различными окислителями.
Благодаря своей летучести аммоний хлористый используют в качестве компонента для дымообразующих составов.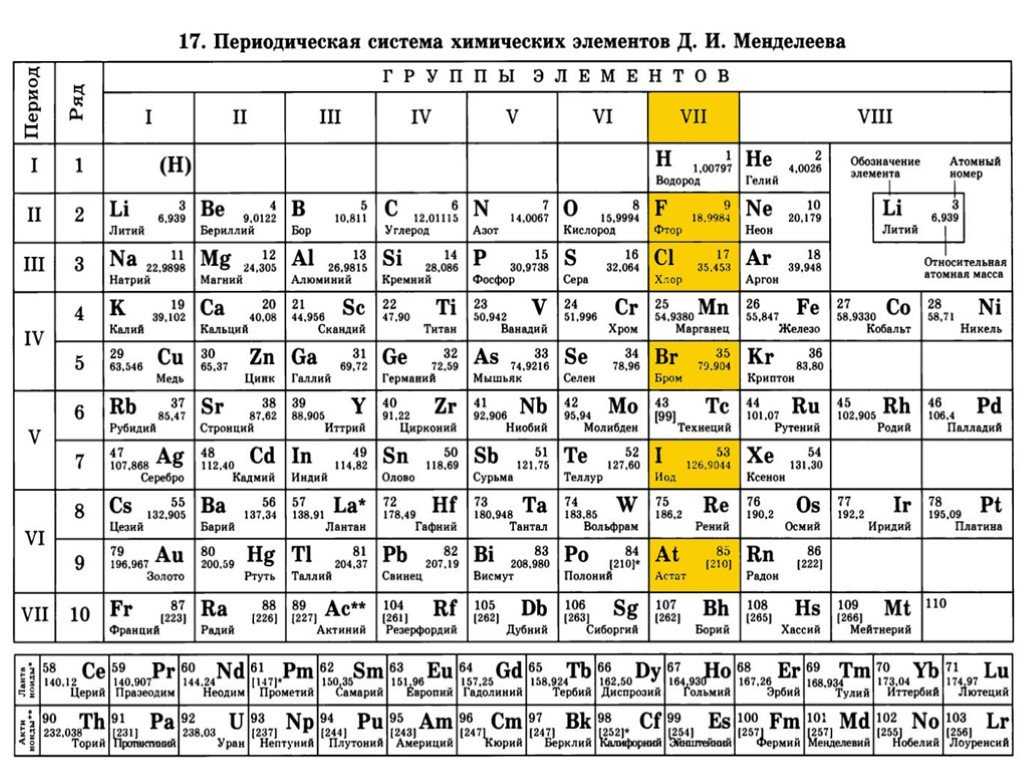 Применяется в медицине как средство, усиливающее действие диуретиков и уменьшающее отеки. Часто использовали как отхаркивающее средство при лечении пневмонии и бронхита. Азотное удобрение, в состав которого входит аммоний хлористый, эффективно при внесении его в почву, имеющую нейтральную или щелочную реакцию. Зарегистрирован как пищевая добавка Е 510: в некоторых странах считается вкусовой приправой и входит в состав лакричных конфет. Аммоний хлористый используется при пайке для удаления оксидной пленки с поверхности металла, как компонент электролита в гальванических элементах, в фотографии как компонент быстрого фиксажа. Кроме этого, аммоний хлористый широко применяется в различных отраслях промышленности: химической, цветной, машиностроительной и деревообрабатывающей.
Применяется в медицине как средство, усиливающее действие диуретиков и уменьшающее отеки. Часто использовали как отхаркивающее средство при лечении пневмонии и бронхита. Азотное удобрение, в состав которого входит аммоний хлористый, эффективно при внесении его в почву, имеющую нейтральную или щелочную реакцию. Зарегистрирован как пищевая добавка Е 510: в некоторых странах считается вкусовой приправой и входит в состав лакричных конфет. Аммоний хлористый используется при пайке для удаления оксидной пленки с поверхности металла, как компонент электролита в гальванических элементах, в фотографии как компонент быстрого фиксажа. Кроме этого, аммоний хлористый широко применяется в различных отраслях промышленности: химической, цветной, машиностроительной и деревообрабатывающей.
Хранят аммоний хлористый только в закрытых складах, предохраняя от попадания влаги и от соприкосновения с острыми или режущими предметами во избежании повреждения упаковки. Допускается хранить аммоний хлористый на открытых площадках.
Перевозят аммоний хлористый в твердом виде любым видом крытого транспорта, за исключением воздушного. Если продукт упакован в мягкую специализированную тару, его можно транспортировать и на открытых составах, избегая перевалок в пути следования.
Аммоний хлористый имеет третью степень токсичности. Негорюч, пожаро- и взрывобезопасен. Для здоровья человека не представляет угрозы, но при попадании в глаза и на слизистые оболочки может вызывать их умеренное раздражение.
Товары, похожие на Аммоний хлорид, хлористый аммоний, хлорид аммония
Вы можете оформить заявку на «Аммоний хлорид, хлористый аммоний, хлорид аммония» в организации «Технократ, ТОО» через нашу площадку BizOrg. На сегодня предложение находится в статусе «В наличии».
«Технократ, ТОО» предлагает Вам:
- специальное предложение по сервису и стоимости для пользователей портала BizOrg;
- гарантия качества от организации с рейтингом 4;
- разнообразные варианты оплаты.

Ответы на популярные вопросы
- Как оформить заказ?
Чтобы оставить заявку на «Аммоний хлорид, хлористый аммоний, хлорид аммония» свяжитесь с организацией «Технократ, ТОО» по контактным данным, которые указаны в правом верхнем углу страницы. Не забудьте указать, что нашли фирму на портале БизОрг.
- Где узнать более подробную информацию об организации «Технократ, ТОО»?
Для получения подробных данных об организации перейдите в правом верхнем углу страницы по ссылке с названием компании. Затем перейдите на интересную Вам вкладку с информацией.
- Предложение указано с ошибками, номер телефона не доступен и т.п.
Если у Вас обнаружились сложности при сотрудничестве с «Технократ, ТОО» – сообщите идентификаторы компании (747891) и товара/услуги (16790200) в нашу службу по работе с клиентами.
Служебная информация
- «Аммоний хлорид, хлористый аммоний, хлорид аммония» можно найти в следующих категориях: «Промышленная химия, нефтехимия», «Химические реактивы и особо чистые вещества», «Стандарт-титры: аммоний», «Аммоний хлористый»;
- Предложение было добавлено на сайт 08.
 03.2017, дата последнего обновления – 08.03.2017;
03.2017, дата последнего обновления – 08.03.2017; - За все время предложение было просмотрено 271 раз.
Обращаем ваше внимание на то, что торговая площадка BizOrg.su носит исключительно информационный характер и ни при каких условиях не является публичной офертой.
Заявленная компанией Технократ, ТОО цена товара «Аммоний хлорид, хлористый аммоний, хлорид аммония» может не быть окончательной ценой продажи. Для получения подробной информации о наличии и стоимости указанных товаров и услуг, пожалуйста, свяжитесь с представителями компании Технократ, ТОО по указанным телефону или адресу электронной почты.
Телефоны:
+7(7262)34-70-98,+7(7262)34-93-22
Купить аммоний хлорид, хлористый аммоний, хлорид аммония в Таразе:
ул.Исатая, 3 “Ж”
Аммоний хлорид, хлористый аммоний, хлорид аммонияФормула карбоната аммония – структура, свойства, применение, примеры вопросов
Карбонат аммония содержит ионы аммиака (NH 3 ) и карбоната (CO 3 ). Ион аммония содержит атомы азота (N) и водорода (H). Азот (N) — неметалл с атомным номером 7 в периодической таблице. Водород (H) — это химический элемент, который имеет атомный номер 1 в периодической таблице. Карбонат-ион содержал в себе как атомы углерода (С), так и кислорода (О). Углерод (C) — это химический элемент с атомным номером 6 в периодической таблице. Кислород (O) — это химический элемент с атомным номером 8 в периодической таблице.
Ион аммония содержит атомы азота (N) и водорода (H). Азот (N) — неметалл с атомным номером 7 в периодической таблице. Водород (H) — это химический элемент, который имеет атомный номер 1 в периодической таблице. Карбонат-ион содержал в себе как атомы углерода (С), так и кислорода (О). Углерод (C) — это химический элемент с атомным номером 6 в периодической таблице. Кислород (O) — это химический элемент с атомным номером 8 в периодической таблице.
Формула карбоната аммония
Карбонат аммония — это химическое соединение, содержащее ион аммония и ион карбоната. Химическая формула карбоната аммония: (NH 4 ) 2 CO 3 . Это бесцветный кристаллический или белый порошок. Имеет более сильный запах аммиака. Он растворим в воде. Он также известен как аммиак Бейкера или диаммониевая соль. Это негорючий состав.
Структура карбоната аммония
Получение карбоната аммония
Мы можем приготовить карбонат аммония, объединив водный раствор аммиака (NH 3 ) и двуокись углерода (CO 2 ).
NH 3 + CO 2 + H 2 O ⇢ (NH 4 ) 2 CO 4 90.
Физические свойства карбоната аммония
- Молекулярная масса карбоната аммония составляет 96,09 г/моль.
- Плотность карбоната аммония 1,50 г/см 3 .
- Температура плавления карбоната аммония составляет 58 °C.
- Растворим в воде.
- Имеет рН 8,6.
Chemical Properties of Ammonium Carbonate
- When ammonium Carbonate is reacted with water, we get
(NH 4 ) 2 CO 3 + H 2 O ⇢ 2NH + 4 + CO 3 2-
- Карбонат аммония может реагировать с кислотами и основаниями, а при взаимодействии с кислотой мы получаем соль аммония и углекислый газ.
CaCl 2 + (NH 4 ) 2 CO 3 → CaCO 3 + 2NH
3 4 Cl
3 4 Cl.

- Когда он реагирует с основанием, мы получаем газообразный аммиак.
(NH 4 ) 2 CO 3 + Ca(OH) 2 → 2 NH 3 + CaCO 3 + 2H 2 O.
Разложение карбоната аммония
Карбонат аммония обладает способностью разлагаться на бикарбонат аммония.
( NH 4 ) 2 CO 3 → NH 4 HCO 3 + NH 3 .
Далее разлагается на углекислый газ, воду и некоторые другие молекулы аммиака.
NH 4 HCO 3 → H 2 O + CO 2 + NH 3 .
Использование карбоната аммония
- Он используется в качестве разрыхлителя.
- При нагревании может выделять газообразный аммиак и углекислый газ.

- Используется в синтезе других химических соединений.
- Используется как нюхательная соль.
- Используется как огнетушитель.
- Используется в разрыхлителе.
- Используется в керамической и пластмассовой промышленности.
- Может также использоваться в резиновой промышленности, а также для закрепления красителей на тканях.
Примеры вопросов о карбонате аммония
Вопрос 1: Разлагается ли карбонат аммония?
Ответ:
Карбонат аммония имеет способность разлагаться на бикарбонат аммония и аммиак.
( НХ 4 ) 2 CO 3 → NH 4 HCO 3 + NH 3 .
Далее он разлагается на двуокись углерода, воду и некоторые другие молекулы аммиака .
NH 4 HCO 3 → H 2 O + CO 2 + NH 3 .

Вопрос 2: Чем опасен для здоровья карбонат аммония?
Ответ:
Опасность для здоровья карбоната аммония:
- При вдыхании вызывает раздражение носа и горла.
- Также может вызывать раздражение глаз и кожи.
- Может вызвать затруднение дыхания.
- Также может вызывать раздражение желудка.
Вопрос 3: Что происходит, когда карбонат аммония реагирует с хлоридом натрия?
Ответ:
Когда Карбонат аммония реагирует с Хлорид натрия , Мы получаем карбонат натрия (NA 2 CO 3 ) и хлорид аммония (NH 4 CL)
( NH 4 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 40004 4 0004 4 0004 4 0004 4 0004 4 0004 4 0004 4 0004 4 0004 4 0004 4 0004 4 00044 40004.
2 CO 3 + 2NaCl → Na 2 CO 3 + 2NH 4 Cl
Вопрос 4: Что происходит, когда карбонат аммония реагирует с хлоридом бария?
Ответ:
Когда карбонат аммония реагируют с хлоридом бария (BACL 2 ), Мы получаем карбонат бария (BACO 3 ) и хлорид аммония (NH 4 CL).
BaCl 2 + (NH 4 ) 2 CO 3 → BaCO 3 + 2NH 4 Cl.
Вопрос 5: Что происходит при взаимодействии карбоната аммония с гидроксидом натрия?
Ответ:
Когда карбонат аммония реагируют с гидроксидом натрия (NAOH), мы получаем карбонат натрия (NA 2 CO 3 ), аммиак (NH 3 ) и Water (Ammoniac Н 2 О).

(NH 4 ) 2 CO 3 + NAOH → NA 2 CO 3 + 2NH 3 + 2H 2 O.
. при взаимодействии карбоната аммония с хлоридом стронция?
Ответ:
Когда карбонат аммония реагируется с хлоридом стронция , мы получаем карбонат стронция (SRCO 3 ) и хлорид аммония (NH 4 CL).
SrCl 2 + (NH 4 ) 2 CO 3 → SrCO 3 + 2NH 4 Cl.
Бромид аммония | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Бромид аммония
Номер продукта: Все применимые коды продуктов American Elements, например. АМ-БР-02 , АМ-БР-03 , АМ-БР-04 , AM-BR-05
Номер CAS: 12124-97-9
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
Weburn. Анхелес, Калифорния
Анхелес, Калифорния
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ОПРЕДЕЛЕНИЕ ОПАСНОСТИ
Классификация
2012 OSHA Hazard Communication Standard (29 CFR 1910.1200)
Серьезное повреждение/раздражение глаз, категория 2
Элементы маркировки
Сигнальное слово: Предупреждение
Заявления об опасности
Вызывает серьезное раздражение глаз
Меры предосторожности
Профилактика
Тщательно вымойте лицо, руки и любые открытые участки кожи после работы
Наденьте средства защиты глаз/лица
Глаза
ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промыть глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжить промывание
Если раздражение глаз не проходит: обратиться к врачу
Опасности, не классифицированные иначе (HNOC)
Не выявлено
РАЗДЕЛ 3.
 СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ Компонент : Бромид аммония
CAS-No: 12124-97-9
% веса: >95
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Общие рекомендации Если симптомы сохраняются, обратитесь к врачу.
При попадании в глаза Немедленно промыть большим количеством воды, также под веками, в течение не менее 15 минут. Получите медицинскую помощь.
Контакт с кожей Немедленно смойте большим количеством воды в течение не менее 15 минут. Если раздражение кожи сохраняется, вызовите врача.
Вдыхание Выйти на свежий воздух. Если человек не дышит, сделайте ему искусственно дыхание. При появлении симптомов обратитесь за медицинской помощью.
Проглатывание Промойте рот водой и выпейте большое количество воды. Обратитесь за медицинской помощью при появлении симптомов
.
Наиболее важные симптомы и эффекты
Никакие разумно предсказуемые.
Примечания для врача Симптоматическое лечение
РАЗДЕЛ 5. ПРОТИВОПОЖАРНЫЕ МЕРЫ
Подходящие средства пожаротушения
Распыление воды. Углекислый газ (CO2). Сухой химический. Химическая пена.
Углекислый газ (CO2). Сухой химический. Химическая пена.
Неподходящие средства пожаротушения
Информация отсутствует
Температура вспышки
Информация отсутствует 9Не применимо Химикат
Храните продукт и пустую тару вдали от источников тепла и возгорания.
Опасные продукты горения
Галогениды водорода Аммиак
Защитное оборудование и меры предосторожности для пожарных
Как и при любом пожаре, надевайте автономный дыхательный аппарат, работающий под давлением, MSHA/NIOSH (утвержденный или эквивалентный) и полное защитное снаряжение
NFPA
Здоровье 2
Воспламеняемость 0
Нестабильность 1
Физические опасности N/ A
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры личной безопасности Обеспечьте достаточную вентиляцию. Используйте средства индивидуальной защиты. Избегайте образования пыли.
Меры предосторожности по охране окружающей среды Не следует выпускать в окружающую среду.
Методы локализации и очистки
Подмести или пропылесосить пролитое и собрать в подходящий контейнер для утилизации. Хранить в
Хранить в
подходящих закрытых контейнерах для утилизации.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение Пользоваться средствами индивидуальной защиты. Обеспечьте достаточную вентиляцию. Не допускать попадания в глаза, на кожу или одежду. Избегать проглатывания и вдыхания. Избегайте образования пыли.
Хранение Хранить в инертной атмосфере. Хранить контейнер плотно закрытым в сухом и хорошо проветриваемом
место. Беречь от влаги. Беречь от прямых солнечных лучей.
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Рекомендации по воздействию Этот продукт не содержит никаких опасных материалов с пределами воздействия на рабочем месте, установленными региональными регулирующими органами.
Технические меры Обеспечьте достаточную вентиляцию, особенно в закрытых помещениях. Убедитесь, что места для промывания глаз и аварийные душевые кабины находятся рядом с рабочим местом.
Средства индивидуальной защиты
Защита глаз/лица Носите соответствующие защитные очки или очки химической защиты, как описано в правилах OSHA по защите глаз и лица в 29 CFR 1910. 133 или европейском стандарте EN166.
133 или европейском стандарте EN166.
Защита кожи и тела Одежда с длинными рукавами.
Защита органов дыхания При нормальных условиях использования защитное оборудование не требуется.
Гигиенические меры
Обращайтесь в соответствии с правилами промышленной гигиены и техники безопасности.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Физическое состояние Порошок Твердое вещество
Внешний вид Белый
Запах Без запаха
Порог восприятия запаха Информация отсутствует
pH 4,5-5,5 Информация отсутствует
Скорость испарения Не применимо
Воспламеняемость (твердое вещество, газ) Информация отсутствует
Пределы воспламеняемости или взрываемости
Верхний Нет данных
Нижний Нет данных
Давление пара Информация отсутствует
Плотность пара Неприменимо
Удельный вес Информация отсутствует
Растворимость Растворим в воде
Коэффициент распределения; н-октанол/вода Данные отсутствуют
Температура самовоспламенения Неприменимо
Температура разложения Информация отсутствует
Вязкость Неприменимо
Молекулярная формула h5 Br N
Молекулярный вес 97,94
РАЗДЕЛ 10.
 СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ по имеющейся информации
СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ по имеющейся информации Стабильность Гигроскопичен. Чувствителен к свету.
Условия, которых следует избегать Воздействие воздуха. Несовместимые продукты. Воздействие влажного воздуха или воды. Воздействие света.
Несовместимые материалы Сильные окислители, Сильные кислоты, Сильные основания
Опасные продукты разложения Галогениды водорода, Аммиак
Опасная полимеризация Информация отсутствует.
Опасные реакции Отсутствуют при нормальной обработке.
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсикологически синергический
Продукты
Информация отсутствует
Отсроченные и немедленные эффекты, а также хронические эффекты при кратковременном и длительном воздействии
Раздражение Раздражает глаза
Сенсибилизация Информация отсутствует
Канцерогенность В приведенной ниже таблице указано, внесло ли каждое агентство какой-либо ингредиент в список канцерогенов.
Мутагенные эффекты Информация отсутствует
Репродуктивные эффекты Информация отсутствует.
Эффекты развития Информация отсутствует.
Тератогенность Информация отсутствует.
STOT – однократное воздействие Неизвестно
STOT – многократное воздействие Неизвестно
Опасность аспирации Информация отсутствует
Симптомы / эффекты, как острые, так и замедленные
Информация отсутствует
Нарушитель эндокринной системы Информация отсутствует
Другие неблагоприятные эффекты Токсикологические свойства не изучены полностью исследован.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Экотоксичность
Стойкость и способность к разложению Растворим в воде Стойкость маловероятна на основании имеющейся информации.
Биоаккумуляция/ Накопление Информация отсутствует.
Мобильность Вероятно, будет мобильным в окружающей среде из-за своей растворимости в воде.
РАЗДЕЛ 13. СООБРАЖЕНИЯ ПО УТИЛИЗАЦИИ
Методы утилизации отходов Производители химических отходов должны определить, классифицируется ли выбрасываемое химическое вещество как опасные отходы. Производители химических отходов также должны сверяться с местными, региональными и национальными нормами по опасным отходам, чтобы обеспечить полную и точную классификацию.
Производители химических отходов также должны сверяться с местными, региональными и национальными нормами по опасным отходам, чтобы обеспечить полную и точную классификацию.
SECTION 14. TRANSPORT INFORMATION
DOT Not regulated
TDG Not regulated
IATA Not regulated
IMDG/IMO Not regulated
SECTION 15. REGULATORY INFORMATION
U.S. Federal Regulations
TSCA 12(b) Not applicable
SARA 311 /312 Категории опасности См. раздел 2 для получения дополнительной информации
CWA (Закон о чистой воде) Неприменимо
Закон о чистом воздухе Неприменимо
Управление по охране труда и здоровья OSHA
Неприменимо
CERCLA Неприменимо
Предложение 65 штата Калифорния Этот продукт не содержит химикатов Предложения 65. не содержит химических веществ DHS.
Другие международные правила
Мексика – класс Информация отсутствует
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности согласно Регламенту (ЕС) № 1907/2006 (ДОСТИГАЕМОСТЬ). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Аммиак — Американское химическое общество
Аммиак — бесцветный ядовитый газ со знакомым ядовитым запахом. Это происходит в природе, в основном в результате анаэробного распада растительного и животного сырья; и он также был обнаружен в космосе. Некоторые растения, в основном бобовые, в сочетании с бактериями-ризобиями «фиксируют» атмосферный азот с образованием аммиака.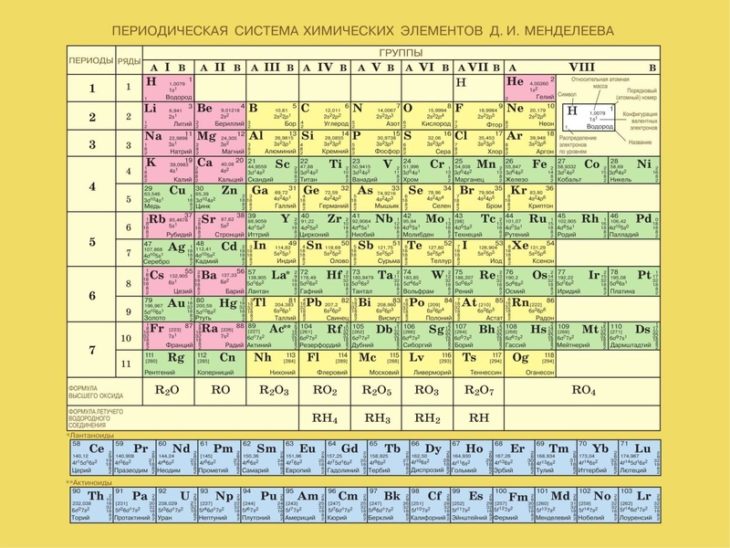
Аммиак известен своим запахом с древних времен. Он был выделен в 18 веке известными химиками Джозефом Блэком (Шотландия), Питером Вульфом (Ирландия), Карлом Вильгельмом Шееле (Швеция/Германия) и Джозефом Пристли (Англия). В 1785 году французский химик Клод Луи Бертолле определил его химический состав.
Аммиак производится в промышленных масштабах посредством каталитической реакции азота и водорода при высокой температуре и давлении. Процесс был разработан в 1909 году немецкими химиками Фрицем Габером и Карлом Бошем. Оба получили Нобелевскую премию по химии за свою работу, но в разные годы: Габер в 1918 году и Бош в 1931 году. Фундаментальный процесс Габера-Боша используется до сих пор.
В 2020 году мировые мощности по производству аммиака составили 224 миллиона тонн (Мт). Фактический объем производства составил 187 млн т. Он занимает девятое место среди химикатов, производимых в мире.
Большая часть производимого аммиака — ≈85% — прямо или косвенно используется в сельском хозяйстве. Химические удобрения, изготовленные из аммиака, включают мочевину, фосфат аммония, нитрат аммония и другие нитраты. Другие важные химические вещества, получаемые из аммиака, включают азотную кислоту, гидразин, цианиды и аминокислоты.
Химические удобрения, изготовленные из аммиака, включают мочевину, фосфат аммония, нитрат аммония и другие нитраты. Другие важные химические вещества, получаемые из аммиака, включают азотную кислоту, гидразин, цианиды и аминокислоты.
Аммиак когда-то широко использовался в качестве хладагента. Он был в значительной степени вытеснен хлорфторуглеродами и гидрохлорфторуглеродами, которые также находятся под пристальным вниманием со стороны окружающей среды. Вероятно, самое известное применение аммиака в быту – это средства для мытья стекол.
Аммиак хорошо растворим в воде; его точная растворимость зависит от температуры (см. быстрые факты). Водный аммиак также называют гидроксидом аммония, но эту молекулу нельзя выделить. Когда аммиак используется в качестве лиганда в координационных комплексах, его называют «аммином».
В настоящее время аммиак производится из водорода, полученного из ископаемого топлива, и поэтому не является «зеленым» продуктом, несмотря на его широкое использование в сельском хозяйстве. Но экологически чистый аммиак может появиться на горизонте, если водород будет производиться другими способами, такими как электролиз воды с помощью ветра или солнечной энергии.
Но экологически чистый аммиак может появиться на горизонте, если водород будет производиться другими способами, такими как электролиз воды с помощью ветра или солнечной энергии.
Аммиак можно сжигать в качестве топлива в стандартных двигателях. Исследование, проведенное компанией-производителем катализаторов Haldor Topsoe (Kongens Lyngby, Дания), показало, что замена обычного судового топлива зеленым аммиаком будет рентабельной и устранит значительный источник парниковых газов. Потенциально его также можно использовать в авиационном топливе. В переходный период аммиак можно будет смешивать с обычным топливом.
| Класс опасности* | Краткая характеристика опасности | |
|---|---|---|
| Газы под давлением, сжиженный газ | h380 — содержит газ под давлением; может взорваться при нагревании | |
| Разъедание/раздражение кожи, категория 1B | h414 — вызывает сильные ожоги кожи | .|
| Серьезное повреждение/раздражение глаз, категория 1 | h418 — вызывает серьезное повреждение глаз | |
| Острая токсичность при вдыхании, категория 3 | h431 — Токсично при вдыхании | |
| Опасность для водной среды, острая опасность, категория 1 | h500 — очень токсичен для водных организмов | |
| Опасность для водной среды, долговременная опасность, категория 2 | h511 — Токсично для водных организмов с долгосрочными последствиями | |
*Глобально согласованная система классификации и маркировки химических веществ. Пояснения к пиктограммам.
Обновление MOTW
L -Триптофан был Молекулой недели 20 ноября 2017 года. Это незаменимая аминокислота, которая должна быть частью рациона человека. Помимо других функций, он позволяет организму синтезировать серотонин и мелатонин. Недавно триптофан появился в двух биохимических исследованиях.
Недавно триптофан появился в двух биохимических исследованиях.
В одном исследовании исследователи из Университета штата Пенсильвания (Университетский парк) и Массачусетского технологического института (Кембридж) обнаружили, что фермент триптофан 2C метилтрансфераза, который катализирует добавление метильной группы к индольному кольцу триптофана в синтезе антибиотика тиострептона , не использует радикальный механизм, как большинство ферментов этого класса. Вместо этого карбоксилатная группа в ферменте действует как общее основание для депротонирования триптофанового субстрата.
Во втором исследовании А. Кит Дункер из Университета Индианы (Блумингтон) и Клара Хлухова из Карлова университета (Прага) вместе пытались выяснить, как зародилась жизнь на Земле. Они предположили, что изначально неупорядоченные белки (IDP), которые не придерживаются определенной конформации, а перемещаются, были вовлечены в этот процесс на ранней стадии. Они считают, что неструктурированные белки, образованные IDP, в конечном итоге были дополнены образующимися позже ароматическими аминокислотами триптофаном и тирозином, которые крупнее и придают белкам большую степень структуры.

 100 до 5000 мкг/дм3, %
100 до 5000 мкг/дм3, % +40 до +50 °С
+40 до +50 °С +40 до +50 °C
+40 до +50 °C
 03.2017, дата последнего обновления – 08.03.2017;
03.2017, дата последнего обновления – 08.03.2017;


 2 CO 3 + 2NaCl → Na 2 CO 3 + 2NH 4 Cl
2 CO 3 + 2NaCl → Na 2 CO 3 + 2NH 4 Cl 
