Тема №1 «Строение атома» | CHEM-MIND.com
- НОВОСТИ
- КУРС ХИМИИ
- Дополнительные уроки
- Курс химии
- Разбор заданий ЕГЭ
- ТЕСТЫ
- Вариаты ЕГЭ
- Тесты по заданиям
- Тесты по темам
- СТАТЬИ
- ОПЫТЫ
- ТАБЛИЦА МЕНДЕЛЕЕВА
Поиск
CHEM-MIND.com- НОВОСТИ
- Новости
Алгоритм обучения для подготовки к ЕГЭ по химии
НовостиОтветы в тестах вновь правильно отображаются!
НовостиТехнические проблемы
НовостиНовый раздел на сайте
НовостиС 8 марта
- Новости
- КУРС ХИМИИ
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
Разбор заданий ЕГЭ
Разбор задания №11 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №10 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №9 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №8 ЕГЭ по химии
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
Разбор заданий ЕГЭ
- ТЕСТЫ
- ВсеВариаты ЕГЭТесты по заданиямТесты по темам
Тесты по темам
Тест №40 «Высокомолекулярные соединения»
Тесты по темамТест №39 «Химия и проблемы охраны окружающей среды»
Тесты по темамТест №38 «Общие научные принципы химического производства»
Тесты по темамТест №37 «Химическая лаборатория»
- ВсеВариаты ЕГЭТесты по заданиямТесты по темам
Тесты по темам
- СТАТЬИ
- Статьи
Решение типовых задач по химии
- Статьи
www.chem-mind.com
Строение атома | himiyaklas.ru
Содержание статьи:
- Почему у атомов разных веществ разные свойства?
- Из чего “сделан” атом?
- Чем отличаются друг от друга атомы разных химических элементов?
- Масса атома.
- Строение электронной оболочки (электронные орбитали, основное и возбужденное состояние, электронные конфигурации атома и электрона).
У каждого вещества есть свои свойства, которые отличают его от других веществ. Чем обусловлены эти свойства?
Тем, какой состав имеет молекула. То есть какими атомами образована молекула, в каком количестве, какими связями соединены эти атомы. Все это определяет свойство молекулы, и соответственно свойство вещества, которое эти молекулы образуют.
Например, свойства воды: прозрачность, текучесть, способность вызывать ржавчину обусловлено именно наличием двух атомов водорода и одного атома кислорода.
Поэтому прежде, чем приступить к изучению свойств молекул (то есть свойств веществ), нужно рассмотреть «кирпичики», которыми эти молекулы образованы. Разобраться в строении атома.
Как устроен атом?
Атомы – это частицы, которые, соединяясь друг с другом, образуют молекулы.
Сам атом состоит из положительно заряженного ядра (+) и отрицательно заряженной электронной оболочки (-). В целом атом электронейтрален. То есть заряд ядра равен по модулю заряду электронной оболочки.
Ядро образовано следующими частицами:
- Протоны. Один протон несет заряд +1. Масса его равна 1 а.е.м (атомная единица массы). Эти частицы обязательно присутствуют в ядре.
- Нейтроны. Нейтрон не имеет заряда (заряд = 0). Масса его равна 1 а.е.м. Нейтронов может не быть в ядре. Это не обязательный компонент атомного ядра.
Таким образом за общий заряд ядра отвечают протоны. Поскольку один нейтрон имеет заряд +1, то заряд ядра равен числу протонов.
Электронная оболочка, как видно из названия образована частицами, которые называются электронами. Если сравнивать ядро атома с планетой, то электроны – это ее спутники. Вращаясь вокруг ядра (пока представим, что по орбитам, а на самом деле по орбиталям), они образуют электронную оболочку.
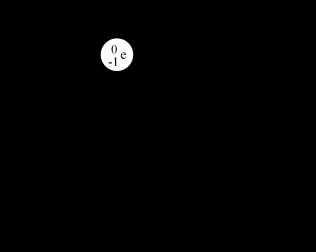
- Электрон – это очень маленькая частица. Ее масса на столько мала, что принимается за 0. А вот заряд у электрона -1. То есть по модулю равен заряду протона, отличается знаком. Поскольку один электрон несет заряд -1, то общий заряд электронной оболочки равен числу электронов в ней.
Одно важное следствие, раз атом – частица, не имеющая заряда (заряд ядра и заряд электронной оболочки равны по модулю, но противоположены по знаку), то есть электронейтральная, следовательно, число электронов в атоме равно числу протонов.

Чем отличаются атомы разных химических элементов друг от друга?
Атомы разных химических элементов отличаются друг от друга зарядом ядра (то есть числом протонов, и, следовательно, числом электронов).
Как узнать заряд ядра атома элемента? Гениальный отечественный химик Д. И. Менделеев, открыв периодический закон, и разработав таблицу, названную его именем, дал нам возможность сделать это. Его открытие забегало далеко вперед. Когда еще не было известно о строении атома, Менделеев расположил элементы в таблице в порядке возрастания заряда ядра.
То есть порядковый номер элемента в периодической системе – это заряд ядра атома данного элемента. Например, у кислорода порядковый номер 8, соответственно заряд ядра атома кислорода равен +8. Соответственно число протонов равно 8, и число электронов равно 8.
Именно электроны в электронной оболочке определяют химические свойства атома, но об этом чуть позже.
Теперь поговорим о массе.
Один протон – это одна единица массы, один нейтрон – это тоже одна единица массы. Поэтому сумма нейтронов и протонов в ядре называется массовым числом. (Электроны на массу никак не влияют, так как мы пренебрегаем его массой и считаем ее равной нулю).
Атомная единица массы (а. е. м.) – специальная физическая величина для обозначения малых масс частиц, образующих атомы.


Все эти три атома – атомы одного химического элемента – водорода. Поскольку у них одинаковый заряд ядра.
Чем они будут отличаться? У этих атомов разные массовые числа (из-за разного числа нейтронов). У первого атома массовое число равно 1, у второго 2, у третьего 3.
Атомы одного элемента, различающиеся количеством нейтронов (и, следовательно, массовыми числами) называются изотопами.
У представленных изотопов водорода даже есть свои названия:
- Первый изотоп (с массовым числом 1) называется протий.
- Второй изотоп (с массовым числом 2) называется дейтерий.
- Третий изотоп (с массовым числом 3) называется тритий.
Теперь следующий резонный вопрос: почему если число нейтронов и протонов в ядре число целое, масса их по 1 а.е.м., то в периодической системе масса атома – дробное число. У серы, например: 32,066.
Ответ: у элемента есть несколько изотопов, они отличаются друг от друга массовыми числами. Поэтому атомная масса в периодической таблице – это среднее значение атомных масс всех изотопов элемента с учетом их встречаемости в природе. Эта масса, указанная в периодической системе, называется относительной атомной массой.
Для химических расчетов используются показатели именно такого «усредненного атома». Атомная масса округляется до целого.

Строение электронной оболочки.
Химические свойства атома определяются строением его электронной оболочки. Электроны вокруг ядра располагаются не абы как. Электроны локализуются на электронных орбиталях.
Электронная орбиталь – пространство вокруг атомного ядра, где вероятность нахождения электрона наибольшая.
У электрона есть один квантовый параметр, который называется спин. Если брать классическое определение из квантовой механики, то спин – это собственный момент импульса частицы. В упрощенном виде это можно представить, как направление вращения частицы вокруг своей оси.
Электрон – это частица с полуцелым спином, у электрона спин может быть либо +½ либо -½. Условно это можно представить, как вращение по часовой и против часовой.
На одной электронной орбитали могут находиться не более двух электронов с противоположенными спинами.
Общепринятым обозначением электронной обитали является клетка либо черточка. Электрон обозначается стрелкой: стрелка вверх ↑ – электрон с положительным спином +½, стрелка вниз ↓ – электрон с отрицательным спином -½.
Электрон, одинокий на орбитали называется неспаренным. Два электрона, располагающиеся на одной орбитали, называются спаренными.
Электронные орбитали подразделяются в зависимости от формы на четыре вида: s, p, d, f. Орбитали одинаковой формы формируют подуровень. Число орбиталей на подуровне определяется числом возможных вариантов расположения в пространстве.
- s-орбиталь.
s-орбиталь имеет форму шара:
В пространстве s-орбиталь может располагаться только одним способом:
Поэтому s-подуровнь формируется только одной s-орбиталью.
- р-орбиталь.
p-орбиталь имеет форму гантели:
В пространстве p-орбиталь может располагаться только тремя способами:
Поэтому p-подуровнь формируется тремя p-орбиталями.
- d-орбиталь.
d-орбиталь имеет сложную форму:
В пространстве d-орбиталь может располагаться пятью разными способами. Поэтому d-подуровнь формируется пятью d-орбиталями.
- f-орбиталь
f-орбиталь имеет еще более сложную форму. В пространстве f-орбиталь может располагаться семью разными способами. Поэтому f-подуровнь формируется семью f-орбиталями.
Электронная оболочка атома похожа на слоеное кондитерское изделие. В нем тоже есть слои. Электроны, находящиеся на разных слоях, имеют разную энергию: на слоях ближе ядру – меньше, на удаленных от ядра – бо̀льшую. Слои эти называются энергетическими уровнями.
Заполнение электронных орбиталей.
Первый энергетический уровень имеет только s-подуровень:

На втором энергетическом уровне есть s-подуровень и появляется p-подуровень:
На третьем энергетическом уровне есть s-подуровень, p-подуровень и появляется d-подуровень:
На четвертом энергетическом уровне, в принципе, прибавляется f-подуровень. Но в школьном курсе f-орбитали не заполняются, поэтому мы можем не изображать f-подуровень:
Число энергетических уровней в атоме элемента равно номеру периода. При заполнении электронных орбиталей нужно следовать следующим принципам:
- Каждый электрон старается занять в атоме то положение, где его энергия будет минимальной. То есть сначала идет заполнение первого энергетического уровня, потом второго и так далее.
Для описания строения электронной оболочки так же используется электронная формула. Электронная формула – это краткая запись в одну строку распределения электронов по подуровням.
- На подуровне сначала каждый электрон заполняет свободную орбиталь. И каждый имеет спин +½ (стрелка вверх).
И только после того как на каждой орбитали подуровня будет по одному электрону, следующий электрон становится спаренным – то есть занимает орбиталь, на которой уже есть электрон:
- d-подуровень заполняется по-особому.
Дело в том, что энергия d-подуровня выше, чем энергия s-подуровня СЛЕДУЮЩЕГО энергетического слоя. А как мы знаем, электрон старается занять то положение в атоме, где его энергия будет минимальной.
Поэтому после заполнения 3p-подуровня, заполняется сначала 4s-подуровень, после чего заполняется 3d-подуровень.



И только после того как 3d-подуровень заполнен полностью, заполняется 4p-подуровень.

Так же и с 4 энергетическим уровнем. После заполнения 4p-подуровня, следующим заполняется 5s-подуровень, после него 4d-подуровень. И после него только 5p.



- И есть еще один момент, одно правило касаемо заполнения d-подуровня.
То происходит явление, называемое провалом. При провале один электрон с s-подуровня следующего энергетического уровня, в прямом смысле проваливается на d-электрон.


Основное и возбужденное состояния атома.
Атомы, электронные конфигурации которых мы сейчас строили, называются атомами в основнóм состоянии. То есть, это обычное, естественное, если угодно, состояние.
Когда атом получает энергию извне, может произойти возбуждение.
Возбуждение – это переход спаренного электрона на пустую орбиталь, в пределах внешнего энергетического уровня.
Например, у атома углерода:
Возбуждение характерно для многих атомов. Это необходимо помнить, потому как возбуждение определяет способность атомов связываться друг с другом. Главное помнить условие, при котором может произойти возбуждение: спаренный электрон и пустая орбиталь на внешнем энергетическом уровне.

Есть атомы, у которых несколько возбужденных состояний:

Электронная конфигурация иона.
Ионы – это частицы, в которые превращаются атомы и молекулы, приобретая или теряя электроны. Эти частицы имеют заряд, так как у них либо «не хватает» электронов, либо их избыток. Положительно заряженные ионы называются катионами, отрицательные – анионами.
Атом хлора (не имеет заряда) приобретает электрон. У электрона заряд 1- (один минус), соответственно образуется частица, имеющая избыточный отрицательный заряд. Анион хлора:
Cl0 + 1e → Cl–

Атом лития (тоже не имеющий заряда) теряет электрон. У электрона заряд 1+ (один плюс), образуется частица, с недостатком отрицательного заряда, то есть заряд у нее положительный. Катион лития:
Li0 – 1e → Li+

Превращаясь в ионы, атомы приобретают такую конфигурация, что внешний энергетический уровень становится «красивым», то есть полностью заполненным. Такая конфигурация наиболее термодинамически стабильная, поэтому атомам есть резон превращаться в ионы.
И поэтому атомы элементов VIII-A группы (восьмой группы главной подгруппы), как сказано в следующем параграфе это благородные газы, такие химически малоактивны. У них в основном состоянии такое строение: внешний энергетический уровень полностью заполнен. Другие атомы, как бы стремятся приобрести конфигурацию этих самых благородных газов, поэтому и превращаются в ионы и образуют химические связи.
himiyaklas.ru
Атом (химия) — Циклопедия
Строение атома и атомного ядра [1:15] Строение атома. Химия 11 класс. Часть 1 // UrokiXimii [28:23] Строение атома. Химия 11 класс. Часть 2 // UrokiXimii [19:58]Атом, изначально, это абстракция химически инертного твердого тела, взятого в неразличимой или неразделимой малости. Естественная наука предлагает одноименное понятие, близко соответствующее классическому при соблюдении некоторых пределов или рамок экспериментального наблюдения.
Помимо того, термин «атом» могут применять для некоего достаточно (или предельно) простого предмета какой-либо научной или вычислительной модели — например, в формальных науках или в технологии.
В физике атом — наименьшая, электронейтральная, химически неделимая частица-экземпляр химического элемента. Атом состоит из плотного ядра из положительно заряженных протонов и электрически нейтральных нейтронов, которое окружено облаком отрицательно заряженных электронов. Когда количество протонов равно количеству электронов, атом электрически нейтрален; в противном случае он превращается в ион, имеющий определенный электрический заряд. Атомы классифицируются в соответствии с количеством протонов и нейтронов: количество протонов определяет химический элемент, а количество нейтронов — его нуклид.
Образуя между собой связи, атомы объединяются в молекулы и большие по размеру твердые тела.
[править] Общая характеристика строения атома
Современные представления о строении атома базируются на квантовой механике. На популярном уровне строение атома можно изложить в рамках волновой модели, которая опирается на модель Бора, но учитывает также дополнительные сведения из квантовой механики.
- Атомы состоят из элементарных частиц (протонов, электронов, и нейтронов). Масса атома в основном сосредоточена в ядре, поэтому большая часть объема относительно пуста. Ядро окружено электронами. Количество электронов равно количеству протонов в ядре, количество протонов определяет порядковый номер элемента в периодической системе. В нейтральном атоме суммарный отрицательный заряд электронов равен положительному заряду протонов. Атомы одного элемента с разным количеством нейтронов называются изотопами.
- В центре атома находится крошечное, положительно заряженное ядро, состоящее из протонов и нейтронов.
Ядро атома примерно в 100 000 раз меньше, чем сам атом. Таким образом, если увеличить атом до размеров аэропорта Борисполь, размер ядра будет меньше размера шарика для настольного тенниса.
- Ядро окружено электронным облаком, которое занимает большую часть его объема. В электронном облаке можно выделить оболочки, для каждой из которых существует несколько возможных орбиталей. Заполненные орбитали составляют электронную конфигурацию, характерную для каждого химического элемента.
- Каждая орбиталь может содержать до двух электронов, характеризующихся тремя квантовыми числами: основным, орбитальным и магнитным.
- Каждый электрон на орбитали имеет уникальное значение четвертого квантового числа: спина.
Орбитали определяются специфическим распределением вероятности того, где именно можно найти электрон. Примеры орбиталей и их обозначения приведены на рисунке справа. «Границей» орбитали считается расстояние, на котором вероятность того, что электрон может находиться вне ее, меньше 90 %.
- Каждая оболочка может содержать не больше строго определенного числа электронов. Например, ближайшая к ядру оболочка может иметь максимум два электрона, следующая — 8, третья от ядра — 18.
- Когда электроны присоединяются к атому, они занимают орбиталь с низкой энергией. Только электроны внешней оболочки могут участвовать в образовании межатомных связей. Атомы могут отдавать и присоединять электроны, становясь положительно или отрицательно заряженными ионами.
- Химические свойства элемента определяются тем, с какой легкостью ядро может отдавать или получать электроны. Это зависит как от числа электронов, так и от степени заполненности внешней оболочки.
[править] Электронные оболочки и орбитали
Сложные атомы имеют десятки, а для очень тяжелых элементов, даже сотни электронов. Электронные состояния атомов формируются всеми электронами, и невозможно определить, где находится каждый из них. Однако, в так называемом одноэлектронном приближении, можно говорить об определенных энергетических состояниях отдельных электронов.
Согласно этим представлениям существует определенный набор орбиталей, которые заполняются электронами атома. Эти орбитали образуют определенную электронную конфигурацию. На каждой орбитали может находиться не более чем два электрона (принцип исключения Паули). Орбитали группируются в оболочки, каждая из которых может иметь лишь определенное фиксированное количество орбиталей (1, 4, 10 и т. д.). Орбитали разделяют на внутренние и внешние. В основном состоянии атома внутренние оболочки полностью заполнены электронами.
На внутренних орбиталях электроны сильно связаны с ядром. Чтобы вырвать электрон из внутренней орбитали, нужно предоставить ему большую энергию, до нескольких тысяч электрон-вольт. Такую энергию электрон на внутренней оболочке может получить только поглотив квант рентгеновского излучения. Энергии внутренних оболочек атомов индивидуальные для каждого химического элемента, а потому по спектру рентгеновского поглощения можно идентифицировать атом. Эту индивидуальность используют в некоторых методах рентгеновской спектроскопии, в частности в рентгенофлуоресцентном анализе, рентгеновской спектроскопии поглощения, рентгеновской фотоэлектронной спектроскопии.
На внешней оболочке электроны находятся на большем расстоянии от ядра и слабее связаны с ним. Именно эти электроны участвуют в формировании химических связей, поэтому внешнюю оболочку называют валентной, а электроны внешней оболочки — валентными электронами.
[править] Ядерные свойства
Основная масса атома сосредоточена в ядре, которое состоит из нуклонов: протонов и нейтронов, связанных между собой силами ядерного взаимодействия.
Количество протонов в ядре атома определяет его атомный номер и то, которому элементу принадлежит атом. Например, атомы углерода содержат 6 протонов. Все атомы с определенным атомным номером имеют одинаковые физические характеристики и проявляют одинаковые химические свойства. В периодической таблице элементы перечислены в порядке возрастания атомного номера.
Общее количество протонов и нейтронов в атоме элемента называется массовым числом и определяет его атомную массу, поскольку протон и нейтрон имеют массу примерно равную 1 а.е.м. Нейтроны в ядре не влияют на то, которому элементу принадлежит атом, но химический элемент может иметь атомы с одинаковым количеством протонов и разным количеством нейтронов. Такие атомы имеют одинаковый атомный номер, но разную массу, и называются изотопами элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, который иногда называют протием — самая распространенная форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий)[1]. Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов.[2]
Когда пишут название изотопа, после него пишут массовое число. Например, изотоп углерод-14 содержит 6 протонов и 8 нейтронов, что в сумме составляет массовое число 14. Другой популярный метод нотации заключается в том, что атомная масса обозначается верхним индексом перед символом элемента. Например, углерод-14 обозначается, как 14C.
Атомная масса элемента, приведенная в периодической таблице, является усредненным значением массы изотопов, встречающихся в природе. Усреднения проводится в соответствии с распространенности изотопа в природе.
С увеличением атомного номера растет положительный заряд ядра, а, следовательно, кулоновское отталкивание между протонами. Чтобы удержать протоны вместе необходимо все больше нейтронов. Однако большое количество нейтронов нестабильно, и это обстоятельство накладывает ограничения на возможный заряд ядра и количество химических элементов, существующих в природе. Все изотопы элементов периодической системы, начиная с номера 83 (висмут), радиоактивны.[3][4] Химические элементы с большими атомными номерами имеют очень малый время жизни, могут быть созданы только при бомбардировке ядер легких элементов ионами, и наблюдаются лишь во время экспериментов с использованием ускорителей. По состоянию на февраль 2008 года самым тяжелым синтезированным химическим элементом является унуноктий.[5]
Многие изотопы химических элементов нестабильны и распадаются со временем. Это явление используется радиоэлементным анализом для определения возраста объектов, имеет большое значение для археологии и палеонтологии.
[править] Масса
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, полное число этих частиц в нуклидов называют массовым числом. Значение массового числа близко к атомной массе нуклида. Массу покоя нуклида часто приводят в атомных единицах массы (а.е.м.) Эта единица определяется как 1/12 часть массы покоя нейтрального атома углерода-12, которая примерно равна 1,66×10−24 г.[6] Водород-1 или протий — легкий изотоп водорода, и атом с наименьшей массой, имеет массу около 1,007825 а.е.м.[7] Масса атома примерно равна произведению массового числа на атомную единицу массы.[8] Тяжелый стабильный изотоп — свинец-208[9] с массой 207,9766521 а.е.м.</ref> Так как массы даже самых тяжелых атомов в обычных единицах (например, в граммах) очень малы, в химии для измерения количества вещества используют моли. В одном моле любого вещества содержится одно и то же число атомов (примерно 6,022×1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а.е.м., то моль атомов этого элемента будет иметь массу 1 г. Например, атом углерода-12 имеет массу 12 а.е.м., значит, 1 моль углерода имеет массу 12 г.[10]
[править] Форма и размеры
Размер атома является величиной, трудно поддается измерению, ведь центральное ядро окружает размыта электронное облако. Для атомов, образующих твердые кристаллы, расстояние между смежными узлами кристаллической решетки может служить приближенным значением их размера. Для атомов, которые не образуют кристаллов, используют другие техники оценки, включая теоретические расчеты. Например, размер атома водорода оценивают 1,2×10−10 м. Это значение можно сравнить с размером протона (что является ядром атома водорода): 0,87×10−15 м и убедиться в том, что ядро атома водорода в 100 000 раз меньше, чем сам атом. Атомы других элементов сохраняют примерно то же соотношение. Причиной этого является то, что элементы с большим положительно-заряженным ядром притягивают электроны сильнее.
Еще одной характеристикой размеров атома является радиус Ван дер Ваальса — расстояние, на которое к данному атома может приблизиться другой атом. Межатомные расстояния в молекулах характеризуются длиной химических связей или ковалентным радиусом.
[править] Энергетические уровни
Значения энергии, которые может иметь атом, исчисляются и интерпретируются, исходя из положений квантовой механики. При этом учитываются такие факторы, как электростатическое взаимодействие электронов с ядром и электронов между собой, спины электронов, принцип неразличимости частиц. Существует определенный набор состояний, каждый из которых имеет определенное значение энергии. Состояние с наименьшей энергией называется основным состоянием. Другие состояния называются возбужденными. Атом находится в возбужденном состоянии конечное время, излучая рано или поздно квант электромагнитного поля (фотон) и переходя в основное состояние. В основном состоянии атом может находиться долго. Чтобы возбудиться, ему нужна внешняя энергия, которая может прийти к нему только из внешней среды. Атом излучает или поглощает свет только определенных частот, соответствующих разности энергий его состояний.
[править] Квантовые переходы в атоме
Между различными состояниями атомов возможны переходы, вызванные внешним возмущением, часто электромагнитным полем. Вследствие квантования состояний атома оптические спектры атомов состоят из отдельных линий, если энергия кванта света не превышает энергию ионизации. При более высоких частотах оптические спектры атомов становятся непрерывными. Вероятность возбуждения атома светом падает с дальнейшим ростом частоты, но резко возрастает при определенных характерных для каждого химического элемента частотах в рентгеновском диапазоне.
Возбужденные атомы излучают кванты света с теми же частотами, на которых происходит поглощение.
Переходы между различными состояниями атомов могут вызываться также взаимодействием с быстрыми заряженными частицами.
[править] Химические свойства
Химические свойства атома определяются в основном валентными электронами — электронами на внешней оболочке. Количество электронов на внешней оболочке определяет валентность атома.
Атомы последнего столбца периодической таблицы элементов имеют полностью заполненную внешнюю оболочку, а для перехода электрона на следующую оболочку нужно передать атому очень большую энергию. Поэтому эти атомы инертные, не склонные вступать в химические реакции, а соответствующие элементы называются инертными газами. Инертные газы сжижаются и кристаллизуются только при очень низких температурах.
Атомы первого столбца периодической таблицы элементов имеют на внешней оболочке один электрон, и являются химически активными. Их валентность равна 1. Характерным типом химической связи для этих атомов в кристаллизованном состоянии является металлическая связь.
Атомы элементов второго столбца периодической таблицы в основном состоянии имеют на внешней оболочке 2 s-электрона. Их внешняя оболочка заполнена, поэтому они должны быть инертными. Но для перехода из основного состояния с конфигурацией электронной оболочки s² в состояние с конфигурацией s¹p¹ нужно очень мало энергии, поэтому эти атомы имеют валентность 2, однако они проявляют меньшую активность.
Атомы элементов третьего столбца периодической таблицы элементов (в краткой форме) имеют в основном состоянии электронную конфигурацию s²p¹. Они могут проявлять различную валентность: 1, 3, 5. Последняя возможность возникает тогда, когда электронная оболочка атома дополняется до 8 электронов и становится замкнутой.
Атомы элементов четвертого столбца короткой формы периодической таблицы элементов основном имеют валентность 4 (например, углерод в составе углекислого газа), хотя возможна и валентность 2 (например, углерод в составе угарного газа). К этому столбцу принадлежит углерод — элемент, который образует самые разнообразные химические соединения. Соединениям углерода посвященный особый раздел химии — органическая химия. Другие элементы этого столбца — кремний, германий при обычных условиях является твердотельными полупроводниками.
Элементы пятого столбца имеют валентность 3 или 5.
Элементы шестого столбца короткой формы периодической таблицы в основном состоянии имеют конфигурацию s²p⁴ и общий спин 1. Поэтому они двухвалентные. Начиная с 3 периода, существует также возможность перехода атомов в возбужденные состояния s²p³d и sp³d², у которых валентность равна 4 и 6 соответственно.
Элементам седьмого столбца короткой формы периодической таблицы не хватает одного электрона на внешней оболочке для того, чтобы ее заполнить. Они в основном одновалентные. Однако они могут вступать в химические соединения в возбужденных состояниях, проявляя валентности 3, 5, 7.
Для переходных элементов характерно заполнение внешней s-оболочки, прежде чем полностью заполняется d-оболочка. Поэтому они в основном имеют валентность 1 или 2, но в некоторых случаях один из d-электронов участвует в образовании химических связей, и валентность становится равной трем. В образовании связей может принять участие и большее количество d-электронов. Именно элементам платиновой группы присущ широкий спектр валентностей[11] вплоть до максимального значения 8. А вот лантаноиды и актиноиды проявляют в основном валентность 3, реже 2, 4.
При образовании химических соединений атомные орбитали видоизменяются, деформируются и становятся молекулярными орбиталями. При этом происходит процесс гибридизации орбиталей — образование новых орбиталей, как специфической суммы базовых.
[править] Анализ и методы визуализации
Атомы слишком малы, чтобы их можно было наблюдать с помощью оптического микроскопа, разрешение которого не превышает десятых долей микрона. Разрешение электронного микроскопа целом сопоставимо с размерами атома, но все же получение изображений атомов в них — сложная техническая задача. Лучше отдельные атомы можно различить с помощью сканирующего туннельного микроскопа. При этом то изображение, которое видит исследователь, есть только результат компьютерной реконструкции на мониторе. Сканирующий туннельный микроскоп чувствует неровности на поверхности, в том числе неровности атомарных размеров, «на ощупь». В нем тонкий щуп сканирует поверхность в горизонтальном направлении, осуществляя такие движения в вертикальном направлении, чтобы поддерживать постоянным туннельный ток. Именно эти вертикальные смещения и записываются электроникой, которая в дальнейшем реконструирует изображение.
О существовании мельчайших частиц вещества человечество догадывалось еще с давних времен, однако подтверждение существования атомов было получено только в конце 19 века. Но почти сразу же стало понятно, что атомы, в свою очередь, имеют сложное строение, которым определяются их свойства.
Понятие атом, как и само слово, имеет древнегреческое происхождение, хотя истинность гипотезы о существовании атомов нашла свое подтверждение лишь в 20 веке.
Концепция атома как малейшей неделимой частицы материи впервые была предложена в начале I тысячелетия до н. э. и популяризована Демокритом — который, собственно, и ввел в научный оборот термин «атом». Основной идеей, которая стояла за данным понятием течение всех столетий, было представление о мире как о наборе огромного количества неделимых элементов, которые являются очень простыми по своей структуре и существуют от начала времен. В конце 19 — начале 20 веков, физики открыли первую из субатомных частиц — электрон, а несколько позже — атомное ядро, таким образом показав, что атом не является неделимым. Продвижение теории атома дал английский физик Дж. Томсон. Основным средством изучения Томсона были катодные лучи, используя их, он пришел к выводу, что атомы вещества содержат отрицательно заряженные частицы, которые получили название «электроны». В 1904 году Томсон представил первую модель строения атома — «пудинг с изюмом». В этой модели положительный заряд занимал весь объём атома и располагался там равномерно, электроны же находились внутри положительного заряда. Эрнест Резерфорд и Эрнест Марсден после опытов с бомбардировки золотой фольги альфа-частицами обнаружили, что небольшая часть альфа-частиц отражается, что идет вразрез с прогнозами модели Томсона. На основании этих результатов Резерфорд создал новую модель атома, получившую название планетарной. В этой модели положительный заряд и основная масса атома сосредоточены в небольшом ядре в центре, а отрицательно заряженные электроны вращаются вокруг ядра. Нильс Бор построил первую квантовую теорию атома водорода, которая получила название модели Бора. На смену теории Бора пришла квантовая теория, она учитывала волновые свойства электрона и других элементарных частиц.
[править] Натурфилософский атомизм
 Демокрит
ДемокритПервым начал проповедовать атомистическое учение в 5 веке до нашей эры философ Левкипп. Затем эстафету подхватил его ученик Демокрит. Сохранились лишь отдельные фрагменты их работ, из которых становится ясно, что они исходили из небольшого количества достаточно абстрактных физических гипотез:
«Сладость и горечь, жара и холод смысл определения, на самом деле [только] атомы и пустота».
По Демокриту, вся природа состоит из атомов, мельчайших частиц вещества, которые покоятся или движутся в совершенно пустом пространстве. Все атомы имеют простую форму, а атомы одного сорта тождественны; многообразие природы отражает многообразие форм атомов и многообразие способов, в которые атомы могут сцепляться между собой. И Демокрит, и Левкипп считали, что атомы, начав двигаться, продолжают двигаться по законам природы.
Наиболее тяжелым для древних греков был вопрос о физической реальности основных понятий атомизма. В каком смысле можно было говорить о реальности пустоты, если она, не имея материи, не может иметь никаких физических свойств? Идеи Левкиппа и Демокрита не могли служить удовлетворительной основой теории вещества в физическом плане, так как не объясняли, из чего состоят атомы, на также почему атомы неделимы.
Через поколение после Демокрита, Платон предложил свое решение этой проблемы: «мельчайшие частицы принадлежат не царству материи, а царству геометрии; они представляют собой различные телесные геометрические фигуры, ограниченные плоскими треугольниками».
Через тысячу лет абстрактные рассуждения древних греков проникли в Индию и были восприняты некоторыми школами индийской философии. Но если западная философия считала, что атомистическая теория должна стать конкретной и объективной основой теории материального мира, индийская философия всегда воспринимала материальный мир как иллюзию. Когда атомизм появился в Индии, то он принял форму теории, согласно которой реальность в мире есть процесс, а не субстанция, и мы присутствуем в мире как звенья процесса, а не как сгустки вещества.
То есть и Платон, и индийские философы считали примерно так: если природа состоит из мелких, но конечных по размерам, долей, то почему их нельзя разделить, хотя бы в воображении, на еще более мелкие частицы, которые стали бы предметом дальнейшего рассмотрения
Римский поэт Лукреций (96 — 55 год до н. э.) был одним из немногих римлян, которые проявляли интерес к чистой науке. В своей поэме «О природе вещей» (De rerum natura) он подробно выстроил факты, свидетельствующие в пользу атомистической теории. Например, ветер, который дует с большой силой, хотя никто не может его видеть, наверное состоит из частиц, слишком малых, чтобы их разглядеть. Мы можем чувствовать вещи на расстоянии по запаху, звуку и теплу, которые распространяются, оставаясь невидимыми. Лукреций связывает свойства вещей со свойствами их составляющих, то есть атомов: атомы жидкости малы и имеют округлую форму, поэтому жидкость течет так легко и просачивается через пористое вещество, тогда как атомы твердых веществ имеют крючки, которыми они сцеплены между собой. Так же и разнообразные вкусовые ощущения и звуки различной громкости состоят из атомов соответствующих форм — от простых и гармоничных в извилистых и нерегулярных. Учение Лукреция были осуждены церковью, поскольку он дал достаточно материалистическую их интерпретацию: например, представление о том, что Бог, запустив один раз атомный механизм, более не вмешивается в его работу, или то, что душа умирает вместе с телом.
[править] Начала научной теории атома
Одна из первых теорий о строении атома, которая имеет уже современные очертания, была описана Галилеем (1564—1642). По его теории вещество состоит из частиц, которые не находятся в состоянии покоя, а под воздействием тепла движутся во все стороны; тепло — не что иное, как движением частиц. Структура частиц является сложной, и если лишить любую часть ее материальной оболочки, то изнутри брызнет свет. Галилей был первым, кто, хотя и в фантастической форме, представил строение атома.
В 17 и 18 веках химики установили, что химические вещества вступают в реакции в определенных пропорциях, которые выражаются с помощью малых чисел. Кроме того, они выделили определенные простые вещества, которые назвали химическими элементами. Эти открытия привели к возрождению идеи о неделимых частицах. Развитие термодинамики и статистической физики показало, что тепловые свойства тел можно объяснить движением таких частиц. В конце концов были экспериментально определены размеры атомов.
Основоположником атомной теории стал Джон Дальтон. Он доказал реальность атомов, первый ввел понятие «атомный вес», рассчитав при это атомный массы некоторых элементов. В 19 веке Джон Дальтон открыл закон кратных отношений и исходя из него развил теорию, названную им «новой системой химической философии», по которой химические вещества состоят из атомов, но он предполагал, что они неразделимы.[12] Новый толчок в становлении современного понимания атома дала молекулярно-кинетическая теория.
Первая модель атома Дж. Томсона «Пудинг с изюмом» Атомная модель РезерфордаВ 1897 году Джозеф Джон Томсон, изучая катодные лучи, открыл электрон и пришел к выводу, что они есть в каждом атоме. Таким образом, было опровергнуто предположение, что атомы являются неделимыми компонентами вещества.[13] Он создал первую модель строения атома, которая получила название модели пудинга с изюмом, где отрицательно заряженные электроны плавают в однородной положительно заряженной сфере. Эта модель была изменена в 1909 году. Ганс Гейгер,
Резерфорд пришел к выводу, что в весь положительный заряд сконцентрирован в малом объёме, а большинство атомного пространства пустое. α-частица — это ионизированные атомы гелия, и электроны, входящие в состав атома не способны отклонить α-частицу. Во время опыта большинство α-частиц проходили без отклонения, но небольшая часть частиц отклонялась на значительный угол, превышающий 30 градусов, такой результат нельзя получить при расположении положительного заряда по всему объёму атома, так как электрическое поле будет недостаточно сильным. Так на смену модели Томсона пришла планетарная модель Резерфорда:
- Положительно заряженное ядро, занимающее ничтожную часть объёма, находится в центре.
- Почти вся масса и весь положительный заряд сконцентрированы в ядре
- Электроны вращаются вокруг атома. Количество электронов равно положительному заряду ядра.
На основе данной модели нельзя было объяснить существование, так как электроны двигаются с ускорением, они должны излучать электромагнитные волны и терять энергию, что приведет к тому, что электроны «упадут» на ядро, и атом прекратит существование. Но в действительности атом в невозбужденном состоянии устойчив и может существовать неограниченно долго, также он не излучается электромагнитные волны. Следует вывод, что законы классической механики неприменимы.
Нильс Бор построил первую квантовую теорию атома водорода, которая получила название модели Бора. Модель Бора сумела объяснить оптические спектры атомов. Дальнейшее ее совершенствование привело к развитию квантовой механики. Значительный вклад в становление научной атомистики сделал Жан Батист Перрен, экспериментально подтвердив теорию броуновского движения Альберта Эйнштейна. Эксперименты Генри Мозли и установленный им закон Мозли позволили связать атомный номер химического элемента с электрическим зарядом ядра. В 1913 году, исследуя ионы неона в канальных лучах, Джозеф Джон Томсон впервые открыл изотопы.
Развитие квантовой механики дало возможность объяснить не только строение атомов, но также их свойства: оптические спектры, способность вступать в химические реакции, образовывать молекулы.
В изучении этого вопроса отличился датский физик Нильс Бор. Он считал, что для микромира не работают законы, предназначенные для макроскопических тел. Законы микромира — квантовые законы, были сформулированы в его постулатах и дополнили атом Резерфорда. Первый постулат Бора гласит: атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определённая энергия E. В стационарном состоянии атом не излучает.
Согласно второму постулату Бора излучение фотонов происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний.
[править] Квантовая теория строения атома
На смену теории Бора пришла квантовая теория, она учитывала волновые свойства электрона и других элементарных частиц. В основе квантовой теории строения атома лежат следующие положения:
- Электрон имеет корпускулярно-волновую природу. Он может вести себя как волна либо частица. Движущийся электрон проявляет волновые свойства, но как частица он обладает массой и зарядом.
- Неопределенность в измерении. Для электрона невозможно одновременно точно измерить скорость и координату, чем точнее один из показателей, тем больше неопределенность в другом.
- Электрон не движется по определённым траекториям вокруг ядра, он может находиться в любой точке пространства, но вероятность нахождения его в определённой точке не равна, наиболее вероятное пространство называют орбиталью.
- Ядро состоит из нуклонов: протонов и нейтронов, количество протонов численно равно порядковому номеру элемента, а количеств нуклонов равно массовому значению.
Данные положения формулируют квантовую теорию строения атома.
См. также: Атомная орбиталь.
- Белый М. В. (1973). Атомная физика. Киев: Высшая школа.
- Ландау Л. Д., Лившиц Е. М. (1974). Теоретическая физика. т. ИИИ. Квантовая механика. Нерелятивистская теория. Москва: Наука.
- Бронштейн М. П. (1980). Атомы и электроны (Серия «Библиотечка „Квант“»). Москва: Наука.
- Шехтер В. М., Ансельм А. А. (1984). Атом и квантовая механика (Серия: «Физика»). Москва: Знание.
- Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st ed.). Springer.
cyclowiki.org
Строение атома
Развитие такой науки, как естествознание, на границе XIX-XX столетий продемонстрировало, что помимо уникальных физических превращений есть целый ряд процессов, в которых атомы выполняют роль многогранных объектов, состоящие из отрицательно заряженных электронов и положительно заряженной части – ядра. Общий заряд указанных элементов полностью компенсирует заряд всего ядра.
Определение 1
Атом – это самая мелкая часть химического вещества, которая может в течение длительного периода сохранять все его свойства.
Данное понятие многие физики связывают со словом «неделимый», так как именно так этот термин переводится с древнегреческого «atomos». В зависимости о того, какое количество частиц расположено в атоме, можно определить его главный химический элемент – ядро.
Сам центр атома состоит из мелких частиц – протонов и нейтронов. Протоны представляют собой только положительно заряженная энергия, а нейтроны вообще не несут в себе никакого заряда. Однако данные элементы объединяются в общую категорию под названием «нуклоны».
Первые сведения об атоме
Первые, кто начал подозревать, что материя состоит из неких мелких частиц, были еще древние греки. В те времена ученые считали, что все существующее на нашей планете состоит из атомов. Стоит отметить то такая теория была представлена более в философском виде и не была представлена научной точки зрения.
Первые ключевые сведения о строении атома представил английский физик Джон Дальтон. Именно этот ученый сумел определить, что два химических элемента постоянно взаимодействуют, и при этом данная комбинация представляет собой абсолютно новое вещество.
Пример 1
8 частиц в элементе кислорода могут порождать собой углекислый газ.
Почти столетие спустя эту гипотезу подтвердил еще один английский исследователь Эрнест Резерфорд, которые разработал и предложил новую модель электронной среды атомов. На тот момент уникальная структура мельчайших частиц считалась одной из важнейших шагов, которые могла сделать в то время физика.
Замечание 1
Данные о строении атома свидетельствовали о том, что он аналогичен по своим свойствам Солнечной системе: вокруг самого ядра по строго расположенным орбитам вращаются некие частицы-электроны, таким же образом, как это делают планеты вокруг солнца.
В 1913 году ученый Нильс Бора продолжил изучать строение атома и выдвинул свою концепцию, согласно которой электроны также вращаются вокруг самого ядра, расположенного в центре, однако делают это с определенной периодичностью. Физик доработал теорию Резерфорда и внес в нее стройность и факты.
Радиоактивность атома
Ученые всегда знали, что один элемент не может стать другим при помощи химической реакции. Однако в процессе радиоактивного излучения данный процесс происходит автоматически.
Определение 2
Радиоактивность – это способность ядер атомов незаметно превращаться в другие более устойчивые ядра.
Когда современные исследователи получили новые сведения о строении атомов, изотопы в какой-то мере стали для них воплощением мечтаний древних алхимиков. В процессе постоянного распада изотопов можно наблюдать сильное радиоактивное излучение. Впервые такое необычное явление было найдено Беккерелем.
Главным критерием радиоактивного излучения принято считать:
- альфа-распад – посредством которого происходит выброс частиц;
- бета-распад – обуславливает более слабое взаимодействие в заряде ядра;
- электронный распад – сохраняет лептонный заряд.
Все существующие изотопы можно увидеть в природе – в почве, горных породах и воздухе. Но помимо этих веществ, есть целый ряд искусственно выведенных изотопов, которые получаются в результате деятельности ядерных реакторов. Многие их таких элементов ученые начали использовать в медицине, особенно в диагностике тяжелых заболеваний.
На сегодняшний день известно о 40 естественных изотопов, большая часть которых находится в категориях:
- урана-радия;
- тория;
- актиния.
Пропорции внутри атома
Если мысленно представить себе атом размером спортивного стадиона, тогда можно визуально увидеть следующие пропорции. Электроны данного вещества будут располагаться на самом верху трибун, а каждый из них будет иметь размер не больше булавочной головки. Само ядро находится в центре поля, а его размер будет равен одной горошине.
Часто люди интересуются, как же на самом деле выглядит атом, но в действительности он в прямом смысле слова выглядит никак. Это связано не с тем, что в науке используют не совсем мощные микроскопы, а с тем, что размер этой элементарной частицы находятся в тех пределах, где понятия «видимости» просто не может быть.
Атомы представляют собой совсем маленькие размеры. Чтобы представить, насколько малы его пропорции нужно учитывать тот факт, что даже самая едва различимая человеческим глазом крупица соли включает в себя примерно один квинтиллион атомов.
Если же указанная часть химического вещества была бы с размером яблока, то тогда рядом с человечеством находились бы вирусы 400-метровой длины, а толщина волоса человека равнялась бы 150 км. Вот такой он интересный и непростой атом, исследованием которого физики продолжают заниматься и в настоящее время.
Одноэлектронный атом и квантовые числа
При правильном соизмерении квантовых чисел можно получить полноценный набор волновых функций электрона или же точно определить природу самого атома. Для более тщательного описания одноэлектронного элемента, в котором электрон участвует в единственной взаимосвязи – с ядром, которое оснащено симметрическим и электростатическим полем, удобно применять не декартовый метод координат с переменными $x, y, o, z$, а сферическую систему данных.
Итак, современные исследователи выделяют три главных квантовых числа:
- главное;
- орбитальное;
- магнитное.
Данные параметры дают возможность правильно задать атомную орбиталь и детализировать строение одноэлектронного атома: нам представлена теория создания электрона и охарактеризовано строение электронного облака, в результате чего можно поставить конкретный ориентир в присутствии внешнего поля, и указать количество внутренних узловых сфер.
Замечание 2
Решение химических уравнений для атома водорода помогает рассчитать его главные характеристики с любой точностью.
Самыми главными экспериментальными свойствами любых атомов признано считать энергии общего отрыва и присоединения электронов.
Идея эффективного заряда заключается в основе грамотной оценки специфики атомов, которыми пользуются физики. Среди них крайне важна электроотрицательность, предполагающая обобщенные сведения элемента, которую связывают с внешними электронами орбиты атома. В отличие от потенциала систематической ионизации и подобия с электроном, данная величина является не строго определенной частицей, а крайне полезной условной характеристикой.
spravochnick.ru
Строение атома
1. Ядро и электроны
Развитие естествознания на границе XIX-XX веков показало, что помимо химических превращений существует целый ряд процессов, в которых атомы выступают как сложные объекты, состоящие из положительно заряженной части – ядра и отрицательно заряженных электронов, суммарный заряд которых в точности компенсирует заряд ядра. В результате работ английского физика Дж. Дж. Томсона и американского физика Р.С. Малликена было установлено, что электрон имеет массу 9,1•1031 кг, или 1/1837 массы атома водорода, и заряд 1,6•10 19 Кл. Основная масса атома сосредоточена в ядре, которое занимает очень малую часть его объема: диаметр ядра порядка 1СГ14 м, он составляет лишь около 10 4 диаметра атома. Наглядно это соотношение размеров можно представить себе, если увеличить атом в 1011 раз: тогда ядро диаметром 1 мм разместится внутри атома диаметром 10 метров!
Позднее было показано, что атомные ядра состоят из положительно заряженных частиц – протонов и незаряженных частиц – нейтронов. Протон имеет заряд, равный заряду электрона, но со знаком плюс, его масса практически равна массе нейтрона. Отметим, что в химии принято выражать заряды ионов в единицах заряда электрона с соответствующим знаком, например Н+ , Mg2+ , СГ.
Таким образом, число протонов в ядре определяет его заряд и порядковый номер, а сумма чисел протонов и нейтронов – округленную общую массу ядра в атомных единицах, или массовое число атома. Очевидно, что в электронейтральном атоме число протонов в атомном ядре равно числу электронов в электронной оболочке атома.
2. Атомный номер элемента. изотопы
Порядковый номер элемента принято называть его атомным номером и обозначать буквой Z. Атомный номер лежит в основе систематизации химических элементов и определяет их положение в периодической системе.
При определенном атомном номере, т.е. при определенном числе протонов, в ядре могут находиться разные числа нейтронов, поэтому могут существовать отличающиеся по массе разновидности атомов одного и того же элемента – изотопы.
Например, природный водород представляет собой смесь изотопов с массовыми числами 1 и 2, а.
Клетка периодической таблицы
В ядре атома урана 92 протона, а в его электронной оболочке – 92 электрона
В периодической таблице, элементы расположены в порядке увеличения заряда ядра, а в отдельных клеточках таблицы принято приводить средневзвешенные атомные массы, поэтому они часто сильно отличаются от целочисленных.
Рис. 2.3, а. Масс-спектрометр.
Газ вводится в вакуумированный прибор через трубку (i) и подвергается ионизации потоком электронов из электронной пушки (2). Заряженные пластины (3) и (4) разгоняют поток полученных положительных ионов, который проходит через щель в пластине (4) и попадает в поле магнита (5), отклоняющее отдельные ионы в соответствии с отношением заряд: масса. За второй щелью (в) расположен детектор (7), который регистрирует число частиц, прошедших через щель. Меняя напряженность магнитного поля, можно последовательно регистрировать относительное количество ионов с различной массой, получая масс-спектр.
В масс-спектрометре молекулы газа превращаются в ионы. Показана часть масс-спектра, соответствующая нонам ТЮ+ и ТЮ2 . Отдельные полосы отвечают пяти изотопам титана с массой 46, 47, 48, 49, 50 значений масс атомов и разделение изотопов стало возможным в результате создания масс-спектрометрии – метода, основанного на воздействии магнитного поля на направленные пучки заряженных частиц.
3. Ядерная модель атома
Первая модель атома была предложена в начале XX века Э. Резерфордом, новозеландцем, работавшем в Англии. Она предполагала, что электроны движутся с большой скоростью по круговым орбитам вокруг ядра, подобно планетам по отношению к Солнцу. По представлениям классической электромагнитной теории в таком атоме электрон должен приближаться по спирали к ядру, непрерывно излучая энергию. Через короткое время электрон неизбежно должен упасть на ядро. Это очевидное несоответствие фактам было не единственным недостатком модели Резерфорда: плавное изменение энергии электронов в атоме не согласовывалось с появившимися наблюдениями над спектрами атомов. Одним из достижений второй половины XIX века была разработка атомного спектрального анализа – точного и чувствительного метода, сыгравшего важнейшую роль в открытии новых элементов и послужившего экспериментальной основой изучения строения атомов. Метод основан на испускании света свободными атомами, получающимися при сильном нагреваний вещества; при этом атомы переходят из основного состояния с минимальной энергией в возбужденные состояния с более высокими энергиями.

Возвращаясь в основное состояние, атомы излучают свет. Оказалось, что атомные спектры излучения состоят из отдельных линий, отвечающих только определенным длинам волн.
Чтобы объяснить линейчатый характер атомных спектров и устойчивость атомов, знаменитый датский физик Нильс Бор предложил два постулата, выходящие за рамки классической физики:
Из бесконечного числа орбит, возможных с точки зрения классической механики, допустимы лишь определенные орбиты, по которым электрон движется не излучая.
Частота поглощаемого или испускаемого атомом излучения при переходе из одного разрешенного состояния в другое определяется разностью энергий этих состояний.
При этом Бор опирался на идею Макса Планка о квантовании энергии. Планк установил, что, хотя свет, испускаемый раскаленным телом, кажется сплошным, световая энергия поглощается или излучается отдельными порциями – квантами Е = hv, пропорциональными частоте светового электромагнитного колебания. Коэффициент пропорциональности h = 6,6252 • 10 34 Дж • с был назван постоянной Планка. Таким образом в науку было введено понятие кванта света, или некоторого светового пакета – фотона, отражающее не только волновую, но и корпускулярную природу света.
Модель Бора позволила рассчитать точные значения энергии атома водорода и любых одноэлектронных ионов, но оказалась непригодной для объяснения наблюдаемых энергетических характеристик атомов с двумя и более электронами; главный же ее недостаток заключался в том, что она не давала логического обоснования природы квантования и устойчивости не меняющихся во времени состояний атома. Однако, несмотря на эти недостатки, сами идеи Бора о квантовании и стационарных состояниях легли в основу современного описания строения атома с позиций квантовой механики.
4. Волновые свойства электрона
Вскоре после 1920 г. был сделан следующий важный шаг в познании микромира: было установлено, что не только световые кванты, но и любые микрочастицы, в том числе электроны, обладают двойственной природой – частицы как таковой и волны.
Например, электрону при скорости 3 • 10е м/с отвечает длина волны
В частности, удалось обнаружить дифракцию электронов на периодической решетке кристаллов и на молекулах газов. Частице с массой покоя т, движущейся со скоростью v, соответствует длина волны X, которая может быть найдена из уравнения де Бройля: сопоставимая с размерами атома. В то же время можно говорить и об импульсе и даже о массе движущегося фотона, хотя, конечно, его масса покоя равна нулю. Это обстоятельство существенным образом влияет на характер информации, которую дает спектроскопия. При столкновении фотона с электроном меняются импульс фотона и частота света, тем самым давая экспериментатору информацию об импульсе электрона. Однако, поскольку импульсы фотона и электрона сопоставимы, при этом меняется и импульс электрона, который надо определить. Ситуация в какой-то степени подобна попытке измерить скорость бегуна с помощью наблюдателя, который прыгает ему на плечи с разбега. Математически эти соображения описываются принципом неопределенности Гейзенберга, согласно которому возможность одновременного определения положения микрочастицы в пространстве и ее импульса ограничена постоянной Планка. Это, в частности, означает, что если мы хотим определить с большой точностью энергию электрона в атоме, то мы не сможем столь же точно определить его положение по отношению к ядру.
5. Квантово-механическая модель атома
Представления о стационарных состояниях атома и дво
mirznanii.com
3. Строение атома
В результате открытия в 1911 г. Э. Резерфордом
атомного ядра образовалась новая концепция строения материи: атом состоит из
массивного положительно заряженного атомного ядра, окруженного электронными
оболочками. Положительный заряд атомного ядра определяет суммарное число
электронов в атомных оболочках. В целом атом является электрически нейтральной
системой. Н. Бор, 1913 г.: «Квантовая теория строения атомов. 1. Среди мыслимых состояний движения атомной системы имеется ряд так называемых стационарных состояний, относительно которых предполагается, что движение частиц в этих состояниях, подчиняясь в значительном объеме классическим механическим законам, отличается, однако, своеобразной механически необъяснимой устойчивостью, в результате которой следует, что всякое остаточное изменение движения системы должно состоять в полном переходе из одного состояния в другое. 2. В самих стационарных состояниях, в противоречие с классической электромагнитной теорией, излучения не происходит, однако процесс перехода между двумя стационарными состояниями может сопровождаться электромагнитным излучением, обладающим теми же свойствами, как излучение, посылаемое на основании классической теории электрической частицей, совершающей гармонические колебания с постоянной частотой. Эта частота ν не находится, однако, в простом отношении к движению частиц атома и определяется условием hν = E’ – E” где h – постоянная Планка, E’ и E” – значение атомной энергии в двух стационарных состояниях, образующих начальное и конечное состоянии процесса излучения. Обратно, освещение атома электромагнитными волнами этой частоты может привести к процессу поглощения, переводящее атом из конечного состояния в начальное». Электрон согласно модели Н. Бора в атоме водорода вращается вокруг ядра по классическим траекториям, не излучая энергию, если на его орбите укладывается целое число длин волн де Бройля nλ = 2πrn, n = 1, 2, 3… Разным разрешённым орбитам n соответствуют разные энергии электронов En n = 1, 2, 3… Радиус первой боровской орбиты атома водорода r1 ≈ 0.53·10-8см. Электромагнитное взаимодействие электронов и атомных ядер определяет энергию связи и размеры атомов, размеры молекулярных структур.
Э. Резерфорд, 1914 г.:
«Из рассмотрения атомов водорода и гелия, где водород имеет один
электрон, а гелий – два, очевидно, что число электронов не может быть всегда
точно равно половине атомного веса. Это приводит к интересному предположению,
которое высказал Размеры атома составляют несколько ангстрем (1 Å = 10–8 см). Химические свойства атомов, способность атомов образовывать различные химические соединения – молекулы определяются внешней электронной оболочкой атома и зависят от числа электронов в ней. Э. Резерфорд впервые использовал ядерные реакции под действием α‑частиц для изучения свойств атомного ядра. Следующим шагом в познании строения материи стало открытие в 1919 г. протона Э. Резерфордом и в 1932 г. нейтрона Дж. Чадвиком. Оказалось, что на уровне 10–12 см вещество состоит из протонов, нейтронов и электронов. Число протонов в атомном ядре Z определяет заряд атомного ядра. Суммарное число протонов Z и нейтронов N определяет массовое число A атомного ядра Z + N = A. Атомные ядра обладают магнитными моментами, которые измеряются в ядерных магнетонах
где mp – масса протона.
где me – масса электрона. Магнитные момента атомов в тысячи раз больше магнитных моментов ядер. Таблица 1 Характеристики протона, нейтрона и электрона
Протон, нейтрон и электрон являются фермионами, имеют спин J = 1/2 и подчиняются принципу Паули. Нейтрон имеет массу на 1.3 МэВ больше, чем протон, поэтому в свободном состоянии он распадается на протон p, электрон e− и электронное антинейтрино
|
|||
nuclphys.sinp.msu.ru
Строение атома
Существованием атомов удалось объяснить не только поведение металлов, но и вообще все наблюдаемые в окружающем нас мире физические и химические процессы.
Но что такое сам атом? Каково строение его? Какие силы действуют внутри атома?
Этих вопросов никто не ставил, пока не было открыто, что атом может распадаться. Тогда ученым поневоле пришлось задуматься над его строением.
Физики создали несколько «моделей» атома. Лучшей из них, позволившей истолковать множество явлений, была модель английского физика Резерфорда.
Резерфорд считал, что атом — подобие планетной системы; в центре его находится тяжелое положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг ядра обращаются отрицательно заряженные легкие частицы — электроны.
Заряд ядра по величине равен заряду всех электронов, удерживаемых его притяжением. Электроны очень быстро обращаются вокруг ядра, не падая, на него по той же причине, по которой удерживаются на своих орбитах планеты, обращающиеся вокруг Солнца.
На этом, однако, и кончалось сходство мёжду атомом и солнечной системой. Оказалось, что электроны, в отличие от планет, могут находиться только на определенных расстояниях от ядра. Они образуют так называемые электронные «оболочки». В каждой из оболочек может находиться не более определенного для нее количества электронов.
Эти законы, управляющие миром атомов, непонятны с точки зрения обычной, или классической, механики. Но все-таки ученым удалось воспроизвести явление, подобное образованию электронных оболочек.
На воду в широкой чашке было пущено несколько поплавков с магнитиками, обращенными вверх одним и тем же полюсом. Отталкиваясь друг от друга, магнитики рассеялись по поверхности воды. Они изображали в опыте электроны.
Затем невысоко над водой был помещен сильный магнит, обращенный вниз другим полюсом. Он играл роль атомного ядра. Под влиянием его притяжения магнитики-электроны выстроились под ним кольцом.
Когда был пущен еще один магнитик, он занял место в этом же кольце. То же произошло и с другими. Но затем новые поплавки с магнитиками, как бы не «поместившись» в кольце, начали строиться вне его, образуя новую кольцеобразную «оболочку».
Нечто подобное происходит и в мире атомов.
Электроны, притягиваемые положительно заряженным ядром, обращаются вокруг него. На ближайшей орбите «помещаются» только два электрона. Если ядро несет на себе более двух зарядов, то электроны размещаются и на второй орбите, где может «поместиться» не более 8 электронов. У атомов, ядро которых несет более 10 зарядов, электроны начинают заполнять третью орбиту, могущую «вместить» не более 18 электронов, и так далее (число электронов, заполняющее любую возможную орбиту, может быть найдено по формуле 2·n2, где n — номер орбиты).
Атом оказался сложной системой, но его ядро, как доказало дальнейшее изучение, — не просто сплошной шарик. В этом ученые убедились, сравнивая заряды и массы атомных ядер различных веществ.
Ядро атома водорода — протон — несет на себе один положительный заряд. Можно было бы думать, что атомные ядра остальных веществ также состоят только из этих частиц. Например, атомное ядро углерода, несущее на себе 6 положительных зарядов, должно состоять из 6 протонов, однако оно в 12 раз тяжелее атомного ядра водорода. У других же веществ несоответствие еще больше: атомное ядро хрома обладает 24 зарядами, но в 52 раза тяжелее протона.
Это несоответствие удалось объяснить, когда было открыто существование незаряженных частиц — нейтронов — с массой, почти равной массе протона. Стало очевидным, что атомное ядро углерода состоит из 6 протонов и такого же числа нейтронов. Поэтому оно, обладая 6 зарядами, в 12 раз тяжелее атомного ядра водорода. В атомном ядре хрома 24 протона и 28 нейтронов, и потому его масса в 52 раза больше массы протона. Самое же тяжелое атомное ядро (урана) состоит из 92 протонов и 146 нейтронов.
Позднее удалось установить, что существуют вещества, атомные ядра которых имеют одинаковый заряд, но разную массу. Их назвали изотопами. Например, кроме обычного урана с атомным весом 238, существует уран, атомное ядро которого только в 235 раз тяжелее протона. Так как заряд их атомных ядер одинаков, то разница только в числе нейтронов.
Протоны и нейтроны удерживаются в ядре силами связи, природа которых еще мало известна. Эти силы при очень близком расстоянии между частицами значительно превосходят силу отталкивания между одноименными зарядами протонов. С увеличением же расстояния между частицами начинает преобладать сила отталкивания одноименных зарядов.
Если в самой внешней электронной оболочке атома не более 2—3 электронов, то они слабо связаны с ним и могут сравнительно легко отделиться.
Заряд электронных оболочек по величине равен заряду ядра. Поэтому атом в целом — нейтральное тело. Но если он потеряет один или несколько электронов, то заряд ядра становится больше, чем у его электронных оболочек. Атом в целом приобретает положительный заряд, по величине равный заряду потерянных электронов. Он называется положительным ионом. Захватывая же в свою внешнюю оболочку лишний электрон, атом в целом приобретает отрицательный заряд. Положительный и отрицательный ионы притягиваются друг к другу и образуют молекулу сложного вещества.
Известно, однако, что водород, кислород и многие другие вещества также состоят из молекул. Как же их нейтральные атомы могут соединиться в молекулу?
Эта загадка уже разрешена физиками.
При сближении нейтральных атомов происходит то же, что наблюдается при приближении наэлектризованной трением стеклянной палочки к сухому шарику из сердцевины бузины: как известно, он притянется к стеклянной палочке.
Предположим, что два нейтральных атома сблизились настолько, что между ними возникает взаимодействие. При этом ядра атомов и электроны под влиянием взаимного притяжения несколько сблизятся между собой. Поэтому сила притяжения между ними, изменяющаяся обратно пропорционально квадрату расстояния, увеличится.
Части же атомов, заряженные одинаковым электричеством, под влиянием взаимного отталкивания немного удалятся друг от друга. Значит, сила отталкивания между ними немного уменьшится. В результате сила притяжения между нейтральными атомами получит перевес над отталкиванием и они притянутся друг к другу.
Предположим, что сблизились два атома водорода. У каждого из них по одному электрону. Каждое из ядер действует на оба электрона. Под влиянием их притяжения каждый из электронов начинает двигаться по очень сложной орбите вокруг то одного, то другого из них.
Ядра атомов не могут сблизиться до соприкосновения. Этому мешает взаимное отталкивание их одноименных зарядов. Но они и не могут удалиться друг от друга, так как их связывает притяжение электронов.
Так образуется молекула водорода.
Пока атомы принимались просто за шарообразные частицы, молекулы изображались двумя прижатыми друг к другу шариками, приплюснутыми в месте соприкосновения. В некоторых случаях можно удовлетвориться такой примитивной моделью.
В действительности же молекула водорода вовсе не два сблизившихся атома. Она представляет собой систему из двух ядер и двух коллективизированных, или «обобществленных», электронов. Очевидно, что в первой модели шарик — воображаемая частица с поперечником, равным радиусу орбиты электрона.
Теперь можно понять, что удерживает в «упаковке» атомы металлов.
У атома металла во внешней оболочке 1—3 электрона, слабо связанных с его ядром. Вещества, имеющие более заполненную внешнюю электронную оболочку, теряют металлические свойства.
Когда конденсируются металлические пары или кристаллизуется металлический расплав, происходит то же, что и при образовании молекулы: внешние электроны атомов металла, слабо связанные с ними, отрываются и «обобществляются». Атомы становятся положительными ионами, взаимно отталкивающими друг друга. Освободившиеся же электроны «блуждают» между ними, обращаясь по сложным орбитам вокруг лежащих по соседству ионов. Они-то и связывают взаимно отталкивающиеся ионы металлов.
Кристалл металла — система плотно упакованных положительных ионов, связанных обращающимися между ними свободными электронами. Притяжение к этим электронам уравновешивает взаимное отталкивание положительных ионов. Равновесие между этими силами притяжения и отталкивания определяет прочность металла.
Каковы же по величине силы, действующие внутри атомов и молекул?
Предположим, что удалось бы извлечь положительные заряды ядер и отрицательные заряды электронов всех атомов одного грамма водорода. Если бы сосредоточить положительные заряды в одной точке, а отрицательные заряды в другой на расстоянии 1 сантиметра, то они взаимно притягивались бы с силой порядка 1029 дин, или 1020 тонн. Эта сила в десятки раз превосходит силу притяжения Солнцем земного шара.
Проникнув в тайну строения вещества, ученые могли уже объяснить, что происходит со сталью и стеклом при закалке.
Схематическое изображение молекул, если принимать атомы за сплошные шарики: 1 — молекула кислорода; 2 — молекула воды; 3 — молекула углекислого газа.
www.stroitelstvo-new.ru
