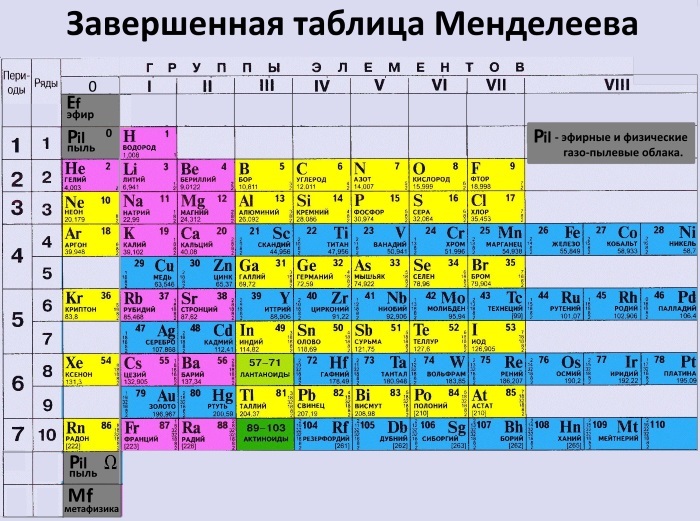
Таблица Менделеева online – Ba
Ba
56
2
8
18
18
8
2
137.33±1
6s2
Барий
| Относительная электроотрицательность (по Полингу): | 0,97 |
| Температура плавления: | 725°C |
| Температура кипения: | 1897°C |
| Теплопроводность: | 0 |
| Плотность: | 3,51 г/см3 |
| Открыт: | Гемфри Дэви |
| Цвет в твёрдом состоянии: | Серебристо-белый |
| Тип: | Щелочно-земельный металл |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f05s25p65d05f06s2 |
| Электронная формула: |
Ba – 1s2 2s2 2p6 3s Ba – [Xe] 6s2 |
| Валентность: | +2 |
| Степени окисления: | 0, +II |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 5,810 В 10,004 В |
Электропроводность в тв. фазе: фазе: |
1,67*106 при 273K |
| Ковалентный радиус: | 1,98 Å |
| 39,24 см3/моль | |
| Атомный радиус: | 2,78 Å |
| Теплота распада: | 7,75 Кдж/моль |
| Теплота парообразования: | 142 Кдж/моль |
| Кристаллическая структура: | Объемоцентрированный куб. Высота, ширина, длина равны. Все углы прямые. По атому имеется в каждой вершине, а также атом в центре куба |
Реклама
Изотопы
| Символ нуклида |
Z(p) | N(n) | Масса изотопа (а. е. м.) |
Период полураспада (T1/2) |
Спин и чётность ядра |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 114Ba | 56 | 58 | 113,95068 | 530 мс | 0+ |
| 115Ba | 56 | 59 | 114,94737 | 450 мс | 5/2+ |
| 116Ba | 56 | 60 | 115,94138 | 1,3 с | 0+ |
| 117 |
56 | 61 | 116,93850 | 1,75 с | 3/2+ |
| 118Ba | 56 | 62 | 117,93304 | 5,2 с | 0+ |
| 119Ba | 56 | 63 | 118,93066 | 5,4 с | 5/2+ |
| 120Ba | 56 | 64 | 119,92604 | 24 с | 0+ |
| 121Ba | 56 | 65 | 120,92405 | 29,7 с | 5/2+ |
| 122Ba | 56 | 121,91990 | 1,95 мин | 0+ | |
| 123Ba | 56 | 67 | 122,918781 | 2,7 мин | 5/2+ |
| 124Ba | 56 | 68 | 123,915094 | 11,0 мин | 0+ |
| 125Ba | 56 | 69 | 124,914473 | 3,5 мин | 1/2+ |
| 126Ba | 56 | 70 | 125,911250 | 100 мин | 0+ |
| 127Ba | 56 | 71 | 126,911094 | 1/2+ | |
| 127mBa | 80,33 кэВ | 1,9 с | 7/2- | ||
| 128Ba | 56 | 72 | 127,908318 | 2,43 сут | 0+ |
| 129Ba | 56 | 73 | 128,908679 | 2,23 ч | 1/2+ |
| 129mBa | 8,42 кэВ | 2,16 ч | 7/2+ | ||
| 130Ba | 56 | 74 | 129,9063208 | стабилен | 0+ |
| 130mBa | 9,54 мс | 8- | |||
| 131Ba | 56 | 75 | 130,906941 | 11,50 сут | 1/2+ |
| 131mBa | 187,14 кэВ | 14,6 мин | 9/2- | ||
| 132Ba | 56 | 76 | 131,9050613 | стабилен | 0+ |
| 133Ba | 56 | 77 | 132,9060075 | 10,51 лет | 1/2+ |
| 133mBa | 288,247 кэВ | 38,9 ч | |||
| 134Ba | 56 | 78 | 133,9045084 | стабилен | 0+ |
| 135Ba | 56 | 79 | 134,9056886 | стабилен | 3/2+ |
| 135mBa | 268,22 кэВ | 28,7 ч | 11/2- | ||
| 136Ba | 56 | 80 | 135,9045759 | стабилен | 0+ |
| 136mBa | 2,030466 МэВ | 308,4 мс | 7- | ||
| 56 | 81 | 136,9058274 | стабилен | 3/2+ | |
| 137m1Ba | 661,659 кэВ | 2,552 мин | 11/2- | ||
| 137m2Ba | 2,3491 МэВ | 590 нс | 17/2- | ||
| 138Ba | 56 | 82 | 137,9052472 | стабилен | 0+ |
| 138mBa | 2,09054 МэВ | 800 нс | 6+ | ||
| 139Ba | 56 | 83 | 83,06 мин | 7/2- | |
| 140Ba | 56 | 84 | 139,910605 | 12,752 сут | 0+ |
| 141Ba | 56 | 85 | 140,914411 | 18,27 мин | 3/2- |
| 142Ba | 56 | 86 | 141,916453 | 10,6 мин | 0+ |
| 143Ba | 56 | 87 | 142,920627 | 14,5 с | 5/2- |
| 144Ba | 56 | 88 | 143,922953 | 11,5 с | 0+ |
| 145Ba | 56 | 89 | 144,92763 | 4,31 с | 5/2- |
| 146Ba | 56 | 90 | 145,93022 | 2,22 с | 0+ |
| 147Ba | 56 | 91 | 146,93495 | 893 мс | 3/2+ |
| 148Ba | 56 | 92 | 147,93772 | 612 мс | 0+ |
| 149Ba | 56 | 93 | 148,94258 | 344 мс | 3/2- |
| 150Ba | 56 | 94 | 149,94568 | 300 мс | 0+ |
| 151Ba | 56 | 95 | 150,95081 | 200 мс | 3/2- |
| 152Ba | 56 | 96 | 151,95427 | 100 мс | 0+ |
| 153Ba | 56 | 97 | 152,95961 | 80 мс | 5/2- |
Барий
| Барий | |
|---|---|
| Атомный номер | 56 |
| Внешний вид простого вещества |
мягкий, слегка вязкий серебристо-белый металл |
| Свойства атома | |
|
Атомная масса (молярная масса) |
137,327 а. е. м. (г/моль) е. м. (г/моль) |
| Радиус атома | 222 пм |
|
Энергия ионизации (первый электрон) |
502,5 (5,21) кДж/моль (эВ) |
| Электронная конфигурация | [Xe] 6s2 |
| Химические свойства | |
| Ковалентный радиус | 198 пм |
| Радиус иона | (+2e) 134 пм |
|
Электроотрицательность (по Полингу) |
0,89 |
| Электродный потенциал | 0 |
| Степени окисления | 2 |
| Термодинамические свойства простого вещества | |
| Плотность | 3,5 г/см³ |
| Молярная теплоёмкость | 28,1 Дж/(K·моль) |
| Теплопроводность |
(18. 4) Вт/(м·K) 4) Вт/(м·K) |
| Температура плавления | 1 002 K |
| Теплота плавления | 7,66 кДж/моль |
| Температура кипения | 1 910 K |
| Теплота испарения | 142,0 кДж/моль |
| Молярный объём | 39,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая объёмноцентрированая |
| Параметры решётки | 5,020 Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| Ba | 56 |
| 137,327 | |
| [Xe]6s2 | |
| Барий | |
Барий — элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов, с атомным номером 56.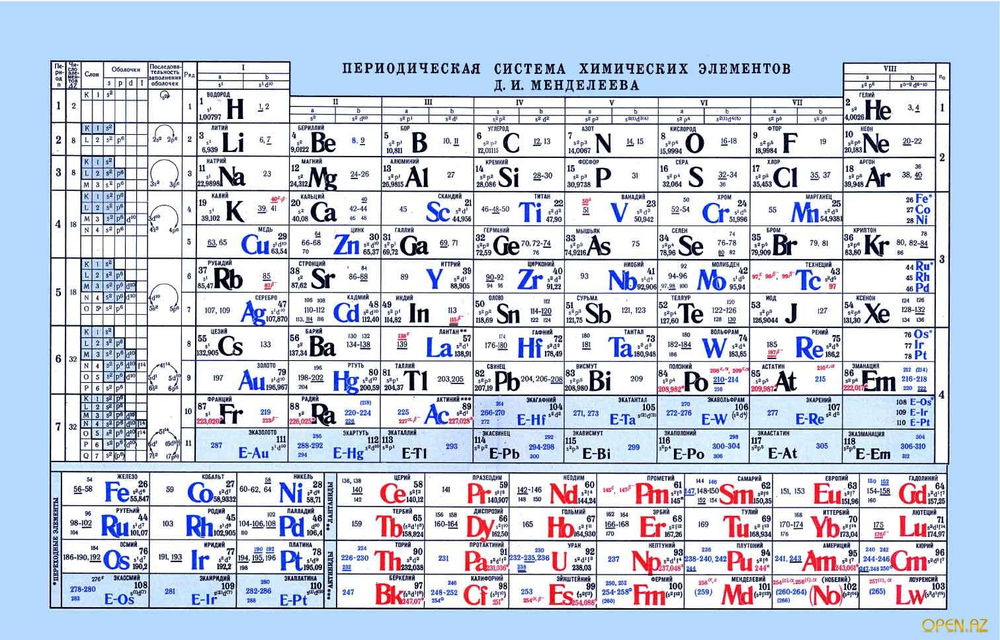 Обозначается символом Ba (лат. Barium). Простое вещество барий (CAS-номер: 7440-39-3) — мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
Обозначается символом Ba (лат. Barium). Простое вещество барий (CAS-номер: 7440-39-3) — мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
Барий был открыт в виде оксида BaO в 1774 г. Карлом Шееле. В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
Своё название получил от греческого barys — «тяжёлый», так как его оксид (BaO) был впервые охарактеризован, как имеющий большую массу.
Нахождение в природе
Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/литр. Основные минералы: барит (BaSO4) и витерит (BaCO3).
Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
Изотопы
Природный барий состоит из смеси семи стабильных изотопов: 130Ba, 132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba. Последний является самым распространенным (71,66 %). Известны и радиоактивные изотопы бария, наиболее важным из которых является 140Ba. Он образуется при распаде урана, тория и плутония.
Получение
Основное сырье для получения бария — баритовый концентрат (80-95 % BaSO4), который в свою очередь получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
BaSO4 + 4С = BaS + 4CO↑
BaSO4 + 2CH4 = BaS + 2С + 4H2O↑.
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
BaS + 2H2O = Ba(OH)2 + H2S↑
BaS + H2O + CO2 = BaCO3 + H2S↑
Ba(OH)2 = BaO + H2O↑
BaCO3 = BaO + CO2↑
Металлический барий получают из оксида восстановлением алюминием в вакууме при 1200-1250°С:
4BaO + 2Al = 3Ba + BaAl2O4.
Очищают барий перегонкой в вакууме или зонной плавкой.
Физические свойства
Барий — серебристо-белый ковкий металл. При резком ударе раскалывается. Существуют две аллотропные модификации бария: до 375 °C устойчив α-Ba с кубической объемно-центрированной решеткой (параметр а = 0,501 нм), выше устойчив β-Ba.
Твердость по минералогической шкале 1,25; по шкале Мооса 2.
Хранят металлический барий в керосине или под слоем парафина.
Химические свойства
Барий — щёлочноземельный металл. Интенсивно окисляется на воздухе, образуя оксид бария BaO и нитрид бария Ba3N2, а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН)2:
Ba + 2Н2О = Ba(ОН)2 + Н2↑
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария BaSO4, сульфит бария BaSO3, карбонат бария BaCO3, фосфат бария Ba3(PO4)2. Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде.
Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде.
Легко вступает в реакцию с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария BaH2, который в свою очередь с гидридом лития LiH дает комплекс Li[BaH3].
Реагирует при нагревании с аммиаком:
6Ba + 2NH3 = 3BaH2 + Ba3N2
Нитрид бария Ba3N2 при нагревании взаимодействует с CO, образуя цианид:
Ba3N2 + 2CO = Ba(CN)2 + 2BaO
С жидким аммиаком дает темно-синий раствор, из которого можно выделить аммиакат [Ba(NH3)6], имеющий золотистый блеск и легко разлагающийся с отщеплением NH3. В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
[Ba(NH3)6] = Ba(NH2)2 + 4NH3 + Н2
Карбид бария BaC2 может быть получен при нагревании в дуговой печи BaO с углем.
С фосфором образует фосфид Ba3P2.
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Качественный и количественный анализ
Качественно в растворах барий обнаруживается по выпадению осадка сульфата бария BaSO4, отличимого от соответствующих сульфатов кальция и сульфатов стронция крайне низкой растворимостью в неорганических кислотах.
Родизонат натрия выделяет из нейтральных солей бария характерный красно-бурый осадок родизоната бария. Реакция является очень чувствительной, специфичной, позволяя определить 1 часть ионов бария на 210000 массовых частей раствора[2].
Соединения бария окрашивают пламя в желто-зеленый цвет (длина волн 455 и 493 нм).
Количественно барий определяют гравиметрическим методом в виде BaSO4 или BaCrO4.
Применение
Применение в качестве геттерного материала
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах, а так же добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности к трубопроводам, и в металлургии.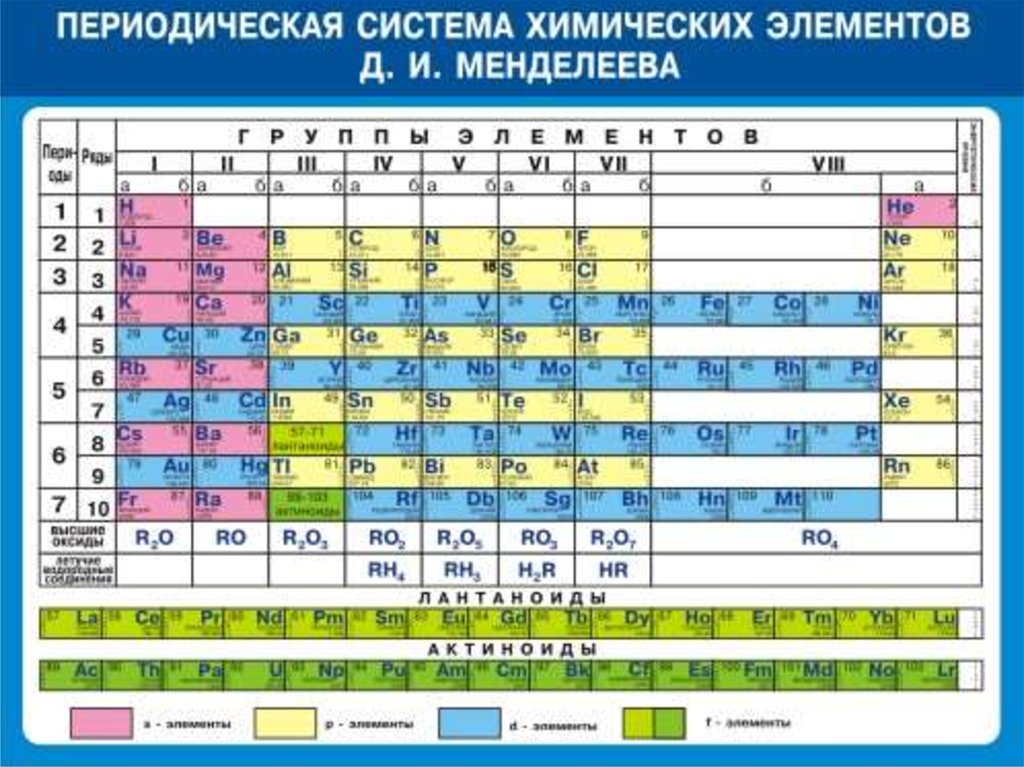
Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
Пиротехника
Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зеленый огонь).
Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
Высокотемпературная сверхпроводимость
Оксид бария совместно с оксидами меди и редкоземельных металлов применяется для синтеза сверхпроводящей керамики работающей при температуре жидкого азота и выше.
Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространенных типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, ВаО — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). В стекловарении для атомной промышленности применяется так же и фосфат бария.
В стекловарении для атомной промышленности применяется так же и фосфат бария.
Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
Цены
Цены на металлический барий в слитках чистотой 99,9 % колеблются около 30 долларов за 1 кг.
Биологическая роль
Биологическая роль бария изучена недостаточно. В число жизненно важных микроэлементов он не входит. Все растворимые соли бария сильно ядовиты.
Презентация по теме Барий Ba химический элемент периодической таблицы Д
Презентация по теме Барий(Ba)химический элемент периодической таблицы Д. И. Менделеева
И. Менделеева
• • Краткое содержание История • Физические свойства • Химические свойства • Применение • Биологическая роль • Происхождение названия
Барий(Ba) Ба рий — элемент главной подгруппы второй группы, шестого периода периодической системы химических элементовт. Д. И. Менделеева, с атомным номером 56. Обозначается символом Ba (лат. Barium). Простое вещество барий (CAS-номер: 7440 -39 -3) — мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
История Барий был открыт в виде оксида Ba. O в 1774 г. Карлом Шееле и Юханом Ганом. В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бар ия; после испарения ртути при нагревании он выделил металлический барий.
Происхождение названия Своё название получил от др. – греч. βαρύς — «тяжёлый» , так как его оксид (Ba. O) был охарактеризован, как имеющий необычно высокую для таких веществ плотность
Нахождение в природе Содержание бария в земной коре составляет 0, 05 % по массе; в морской воде среднее содержание бария составляет 0, 02 мг/литр. Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (Ba. SO 4) и витерит (Ba. CO 3). Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (Ba. SO 4) и витерит (Ba. CO 3). Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
Физические свойства Барий — серебристо-белый ковкий металл. При резком ударе раскалывается. Существуют две аллотропные модификации бария: до 375 °C устойчив αBa с кубической объемно-центрированной решеткой (параметр а = 0, 501 нм), выше устойчив β-Ba. Твердость по минералогической шкале 1, 25; по шкале Мооса 2. Хранят металлический барий в керосине или под слоем парафина.
Химические свойства Барий — щёлочноземельный металл. На воздухе барий быстро окисляется, образуя смесь оксид бария Ba. O и нитрид бария Ba 3 N 2, а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН)2: Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария Ba. SO 4, сульфит бария Ba. SO 3, карбонат бария Ba. CO 3, фосфат бария Ba 3(PO 4)2. Сульфид бария Ba. S, в отличие от сульфида кальция Ca. S, хорошо растворим в воде. Легко вступает в реакцию с галогенами, образуя галогениды. При нагревании с водородом образует гидрид бария Ba. H 2, который в свою очередь с гидридом лития Li. H дает комплекс Li[Ba. H 3].
Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария Ba. SO 4, сульфит бария Ba. SO 3, карбонат бария Ba. CO 3, фосфат бария Ba 3(PO 4)2. Сульфид бария Ba. S, в отличие от сульфида кальция Ca. S, хорошо растворим в воде. Легко вступает в реакцию с галогенами, образуя галогениды. При нагревании с водородом образует гидрид бария Ba. H 2, который в свою очередь с гидридом лития Li. H дает комплекс Li[Ba. H 3].
Применение Применение в качестве геттерного материала Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах. Антикоррозионный материал Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии. Сегнето- и пьезоэлектрик Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов, а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей. Оптика Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы). Пиротехника Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зеленый огонь).
Оптика Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы). Пиротехника Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зеленый огонь).
Атомно-водородная энергетика Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США). Высокотемпературная сверхпроводимость Пероксид бария совместно с оксидами меди и редкоземельных металлов применяется для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше. Ядерная энергетика Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространенных типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, Ва. О — 32 %, оксид алюминия — 1, 5 %, оксид натрия — 5, 5 %). В стекловарении для атомной промышленности применяется так же и фосфат бария. Химические источники тока Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита. Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди). Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцовокислотных аккумуляторов.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди). Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцовокислотных аккумуляторов.
Биологическая роль бария изучена недостаточно. В число жизненно важных микроэлементов он не входит. Все растворимые соли бария сильно ядовиты.
Барий – информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к Лантан >
| Группа | 2 | Температура плавления | 727°С, 1341°F, 1000 К |
| Период | 6 | Температура кипения | 1845°С, 3353°F, 2118 К |
| Блок | с | Плотность (г см −3 ) | 3,62 |
| Атомный номер | 56 | Относительная атомная масса | 137,327 |
| Состояние при 20°С | Твердый | Ключевые изотопы | 138 Ба |
| Электронная конфигурация | [Хе] 6s 2 | КАС номер | 7440-39-3 |
| ChemSpider ID | 4511436 | ChemSpider — бесплатная база данных химической структуры. | |
Изображение основано на рентгеновских снимках желудка и кишечника человека у пациентов, которым давали «бариевую муку».
Барий — мягкий металл серебристого цвета, который быстро тускнеет на воздухе и вступает в реакцию с водой.
Барий не является широко используемым элементом. Чаще всего используется в буровых растворах для нефтяных и газовых скважин. Он также используется в красках и в производстве стекла.
Все соединения бария токсичны; однако сульфат бария нерастворим, поэтому его можно безопасно проглатывать. Суспензию сульфата бария иногда назначают больным, страдающим расстройствами пищеварения. Это «бариевая мука» или «бариевая клизма». Барий является тяжелым элементом и рассеивает рентгеновские лучи, поэтому, проходя через тело, на рентгеновском снимке можно различить желудок и кишечник.
Карбонат бария в прошлом использовался как крысиный яд. Нитрат бария придает фейерверкам зеленый цвет.
Нитрат бария придает фейерверкам зеленый цвет.
Барий не играет известной биологической роли, хотя сульфат бария был обнаружен в одном конкретном типе водорослей. Барий токсичен, как и его водо- или кислоторастворимые соединения.
Барий встречается только в сочетании с другими элементами. Основными рудами являются барит (сульфат бария) и витерит (карбонат бария). Металлический барий можно получить электролизом расплавленного хлорида бария или нагреванием оксида бария с алюминиевым порошком.
Элементы и история периодической таблицы
В начале 1600-х годов Винченцо Кашароло из Болоньи, Италия, нашел несколько необычных камешков. Если днем они раскалялись докрасна, то ночью они светились. Это был минерал барит (сульфат бария, BaSO 4 ).
Когда в 1760-х годах Карл Шееле исследовал болонский камень, как он стал известен, он понял, что это сульфат неизвестного элемента. Тем временем минералог, доктор Уильям Уизеринг, обнаружил в свинцовой шахте в Камберленде еще один необычайно тяжелый минерал, который явно не был свинцовой рудой.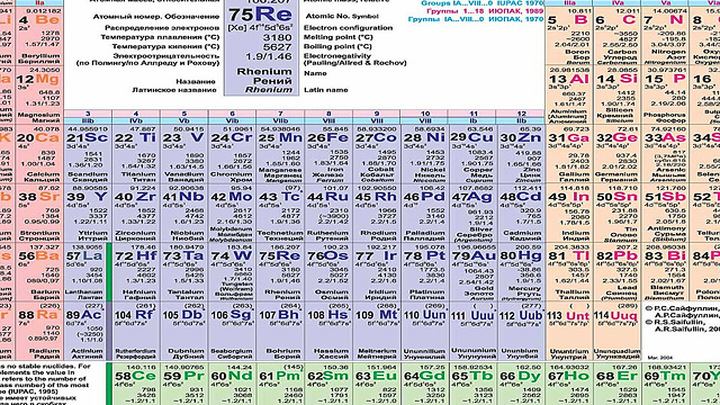 Он назвал его витеритом; позже было показано, что это карбонат бария, BaCO 3 .
Он назвал его витеритом; позже было показано, что это карбонат бария, BaCO 3 .
Ни сульфат, ни карбонат не дают самого металла при использовании обычного процесса плавки с углеродом. Однако Хамфри Дэви из Королевского института в Лондоне произвел его электролизом гидроксида бария в 1808 году.
| Атомный радиус, несвязанный (Å) | 2,68 | Ковалентный радиус (Å) | 2.06 |
| Сродство к электрону (кДж моль −1 ) | 13. 954 954 | Электроотрицательность (шкала Полинга) | 0,89 |
| Энергии ионизации (кДж моль −1 ) | 1 ст 502.849 2 -й 965,223 | ||
| Общие степени окисления | 2 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 130 Ба | 129. 906 906 | 0,106 | 2,2 х 10 21 г | β+β+ | |
| 132 Ба | 131,905 | 0,101 | 1,3 х 10 21 г | ЕС ЕС | |
| 134 Ба | 133. 905 905 | 2.417 | – | – | |
| 135 Ба | 134.906 | 6.592 | – | – | |
| 136 Ба | 135. 905 905 | 7.854 | – | – | |
| 137 Ба | 136.906 | 11.232 | – | – | |
| 138 Ба | 137. 905 905 | 71,698 | – | – | |
|
|
| Удельная теплоемкость (Дж кг -1 К -1 ) | 204 | Модуль Юнга (ГПа) | Неизвестный | |||||||||||
| Модуль сдвига (ГПа) | Неизвестный | Объемный модуль (ГПа) | Неизвестный | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
| Слушайте подкаст о барии |
Стенограмма: (Promo) Вы слушаете «Химию в ее стихии», представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит Привет, на этой неделе крысиный яд, фейерверки, тонкое стекло, разведка нефти и клизмы. Ссылку уже заметил, ну, ответ находится в яблочно-зеленом элементе внизу второй группы. Адина Пэйтон Барий вызывает у многих неприятные ассоциации. Первое, о чем думает большинство людей при упоминании этого элемента, — это «клизма с барием» или «глоток с барием». Болезненные воспоминания часто всплывают в рентгенологической клинике, где даже спрашивают, какой вкус вы предпочитаете, клубничный или банановый… Эти «коктейли» состоят из белой жидкости сульфата бария, которую либо «впрыскивают» в одно отверстие, либо проглатывают в другое. Он используется для диагностики заболеваний и других проблем, затрагивающих толстую кишку или пищевод. Тяжелый барий блокирует рентгеновские лучи, в результате чего заполненная часть пищеварительной системы отчетливо видна на рентгеновском снимке или компьютерной томографии. Барий — высокотоксичный металл. Он чрезвычайно ядовит — никто в здравом уме не стал бы его употреблять. В низких дозах он действует как мышечный стимулятор, в то время как более высокие дозы разрушают нервную систему, вызывая нерегулярное сердцебиение, тремор, слабость, тревогу, паралич и, возможно, смерть из-за отказа сердца и легких. Острые дозы менее 1 грамма могут быть смертельными для человека. Действительно, карбонат бария полезен в качестве крысиного яда. В отличие от сульфата бария, карбонат бария растворяется в желудочной кислоте, высвобождая ядовитый барий, который выполняет свою довольно неприятную, но эффективную работу. Барий, мягкий щелочноземельный металл серебристого цвета, никогда не встречается в природе в чистом виде из-за его реакционной способности с воздухом или водой. Соединения бария отличаются высоким удельным весом, что на практике означает, что соединения чрезвычайно тяжелые. Это относится к самому распространенному барийсодержащему минералу, его сульфату – бариту BaSO 4 – называется “тяжелый шпат” из-за высокой плотности (4,5 г/см³ – размер горошины). Действительно, название барий происходит от греческого барыс , что означает «тяжелый». Из-за своей плотности соединения бария, и особенно барит (BaSO 4 ), чрезвычайно важны для нефтяной промышленности. Барит используется в буровых растворах, в качестве утяжелителя при бурении новых нефтяных скважин. Карбонат бария также имеет более привлекательное применение, чем крысиный яд — он используется в производстве стекла для усиления блеска стекла. А барит используется в производстве красок, кирпича, плитки, стекла и резины; нитрат и хлорат бария придают зеленый цвет фейерверкам, а титанат бария был предложен в 2007 году для использования в технологии аккумуляторов следующего поколения для электромобилей. И почему меня так особенно интересует этот тяжелый ядовитый элемент? Что ж, как ученый я на самом деле изучаю барит — я отделяю барит от морских отложений — ила на дне моря — и анализирую его химический состав, который рассказывает нам невероятные истории о химическом составе морской воды и ее продуктивности в геологическом прошлом. Барит образует по мере продуктивности океана — деятельности морского фитопланктона плавающие «деревья» океана, являющиеся основой морской пищевой цепи, — и накапливается в морских отложениях. Накопление барита в океанских отложениях может рассказать нам, насколько продуктивным был океан в любой момент истории Земли. И поэтому это отличный архив истории океана. Крис Смит Химик Адина Пейтон рассказывает историю о барии. И говоря о том, что сидит на дне океанов . Стив Майлон “Как это пахло?” Это был единственный вопрос, который мне нужно было задать моей коллеге-геологу об отложениях, которые она пыталась понять. Запах осадка многое говорит о лежащей в его основе химии. Густые черные бескислородные отложения могут сопровождаться гнилостным запахом, характерным для восстановленной серы. Может быть, поэтому у серы такая плохая репутация. Мой сын не ел яйца 6 месяцев, когда впервые почувствовал запах тухлого. Крис Смит Это вонючая история серы со Стивом Майлоном на следующей неделе Химия в ее стихии, я надеюсь, что вы можете присоединиться к нам. (Промо) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists.com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. (окончание акции) |
Нажмите здесь, чтобы посмотреть видео о барии
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
W.M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г.
906 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd, New York, 2nd. Издание 2011 г.
Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г.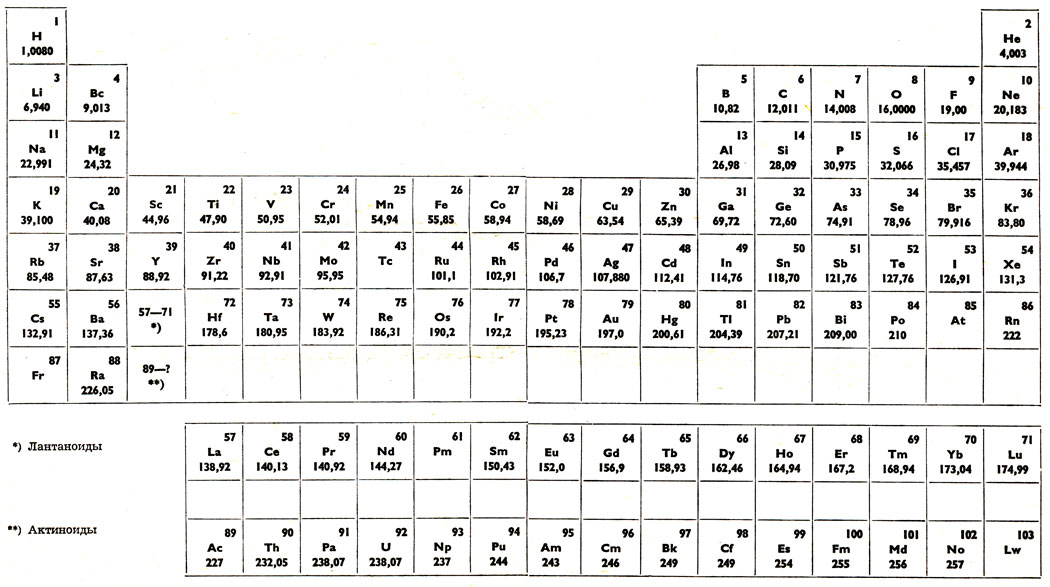
Периодическая таблица видео, по состоянию на декабрь 2014 г.
Частично получены из материалов, предоставленных Британской геологической службой © NERC.
Исторический текст
Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
Podccasts
, созданные The Nake Scients Scientists. .
Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета.
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Исследуйте все элементы
барий | Использование, соединения и факты
барий
Смотреть все СМИ
- Ключевые люди:
- Сэр Хамфри Дэви
- Похожие темы:
- химический элемент щелочноземельный металл псиломелан
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
барий (Ba) , химический элемент, один из щелочноземельных металлов группы 2 (IIa) периодической таблицы.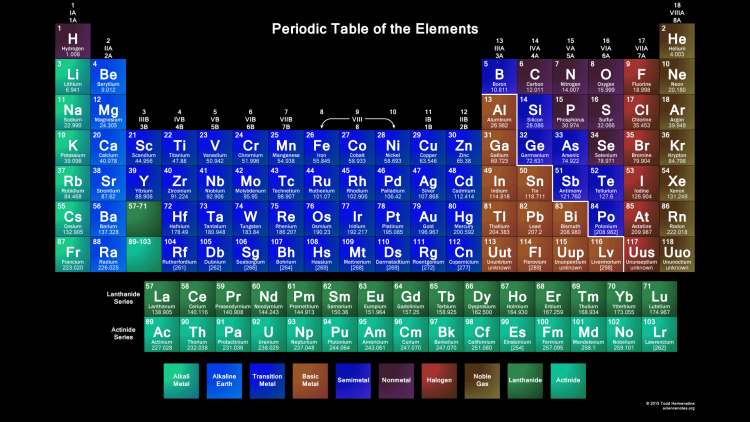 Элемент используется в металлургии, а его соединения — в пиротехнике, нефтедобыче и радиологии.
Элемент используется в металлургии, а его соединения — в пиротехнике, нефтедобыче и радиологии.
| atomic number | 56 |
|---|---|
| atomic weight | 137.327 |
| melting point | 727 °C (1,341 °F) |
| boiling point | 1,805 ° C (3281 °F) |
| удельный вес | 3,51 (при 20 °C или 68 °F) |
| степень окисления | +2 | [Xe]6 s 2 |
Происхождение, свойства и использование
Барий, немного более твердый, чем свинец, имеет серебристо-белый блеск в свежем виде. Он легко окисляется на воздухе и должен быть защищен от кислорода во время хранения. В природе он всегда встречается в сочетании с другими элементами. Шведский химик Карл Вильгельм Шееле открыл (1774 г.) новое основание (барит, или окись бария, BaO) в качестве второстепенной составляющей пиролюзита, и из этого основания он приготовил несколько кристаллов сульфата бария, которые отправил Йохану Готлибу Гану, первооткрыватель марганца. Месяц спустя Ган обнаружил, что минерал барит также состоит из сульфата бария, BaSO 9.0135 4 . Особая кристаллическая форма барита, найденная недалеко от Болоньи, Италия, в начале 17 века, после сильного нагревания с древесным углем некоторое время светилась после воздействия яркого света. Фосфоресценция «болонских камней» была настолько необычна, что привлекла внимание многих ученых того времени, в том числе Галилея. Только после того, как электрическая батарея стала доступной, сэр Хамфри Дэви смог, наконец, изолировать (1808 г.) сам элемент с помощью электролиза.
Шведский химик Карл Вильгельм Шееле открыл (1774 г.) новое основание (барит, или окись бария, BaO) в качестве второстепенной составляющей пиролюзита, и из этого основания он приготовил несколько кристаллов сульфата бария, которые отправил Йохану Готлибу Гану, первооткрыватель марганца. Месяц спустя Ган обнаружил, что минерал барит также состоит из сульфата бария, BaSO 9.0135 4 . Особая кристаллическая форма барита, найденная недалеко от Болоньи, Италия, в начале 17 века, после сильного нагревания с древесным углем некоторое время светилась после воздействия яркого света. Фосфоресценция «болонских камней» была настолько необычна, что привлекла внимание многих ученых того времени, в том числе Галилея. Только после того, как электрическая батарея стала доступной, сэр Хамфри Дэви смог, наконец, изолировать (1808 г.) сам элемент с помощью электролиза.
Британника Викторина
118 Названия и символы Периодической таблицы Викторина
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Минералы бария плотны (например, BaSO 4 , 4,5 грамма на кубический сантиметр; BaO, 5,7 грамма на кубический сантиметр), это свойство послужило источником многих их названий и названия самого элемента (от греческий барыс , «тяжелый»). По иронии судьбы, металлический барий сравнительно легкий, всего на 30 процентов плотнее алюминия. Его космическое содержание оценивается в 3,7 атома (по шкале, где содержание кремния = 10 6 атомов). Барий составляет около 0,03 процента земной коры, в основном в виде минералов барита (также называемого баритом или тяжелым шпатом) и витерита. Ежегодно добывается от шести до восьми миллионов тонн барита, более половины из которых приходится на Китай. Меньшие количества добываются в Индии, США и Марокко. Промышленное производство бария зависит от электролиза плавленого хлорида бария, но наиболее эффективным методом является восстановление оксида путем нагревания с алюминием или кремнием в высоком вакууме. Для восстановления также можно использовать смесь монооксида и пероксида бария. Ежегодно производится всего несколько тонн бария.
Для восстановления также можно использовать смесь монооксида и пероксида бария. Ежегодно производится всего несколько тонн бария.
Металл используется в качестве газопоглотителя в электронных лампах для улучшения вакуума путем соединения с конечными следами газов, в качестве раскислителя при рафинировании меди и в качестве компонента некоторых сплавов. Сплав с никелем легко испускает электроны при нагревании и поэтому используется в электронных лампах и электродах свечей зажигания. Обнаружение бария (атомный номер 56) после того, как уран (атомный номер 92) подвергся бомбардировке нейтронами, стало ключом к открытию ядерного деления в 1919 году.39.
Барий природного происхождения представляет собой смесь шести стабильных изотопов: бария-138 (71,7%), бария-137 (11,2%), бария-136 (7,8%), бария-135 (6,6%), бария-134. (2,4%) и барий-132 (0,10%). Барий-130 (0,11 процента) также встречается в природе, но подвергается распаду в результате двойного захвата электронов с чрезвычайно длительным периодом полураспада (более 4 × 10 21 лет). Известно более 30 радиоактивных изотопов бария с массовыми числами от 114 до 153. В качестве эталонного источника гамма-излучения используется изотоп с наибольшим периодом полураспада (барий-133, 10,5 лет).
Известно более 30 радиоактивных изотопов бария с массовыми числами от 114 до 153. В качестве эталонного источника гамма-излучения используется изотоп с наибольшим периодом полураспада (барий-133, 10,5 лет).
Соединения
В своих соединениях барий имеет степень окисления +2. Ион Ba 2 + можно осадить из раствора добавлением карбоната (CO 3 2– ), сульфата (SO 4 2– ), хромата (CrO 52 2 9005 6 ) − ), или фосфатные (PO 4 3− ) анионы. Все растворимые соединения бария токсичны для млекопитающих, вероятно, из-за нарушения функционирования калиевых ионных каналов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Сульфат бария (BaSO 4 ) представляет собой белый тяжелый нерастворимый порошок, встречающийся в природе в виде минерального барита. Почти 80 процентов мирового потребления сульфата бария приходится на буровые растворы для добычи нефти.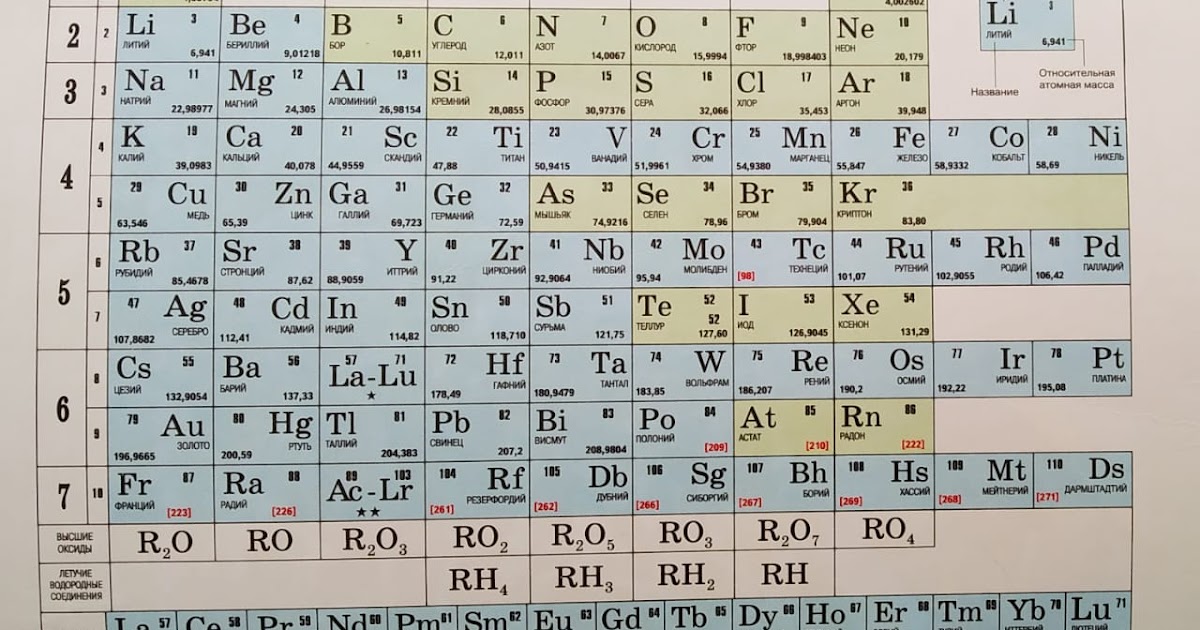 Он также используется в качестве пигмента в красках, где он известен как blanc fixe (т. е. «перманентный белый»), или как литопон при смешивании с сульфидом цинка. Сульфат широко используется в качестве наполнителя в бумаге и резине и находит важное применение в качестве непрозрачной среды при рентгенологическом исследовании желудочно-кишечного тракта.
Он также используется в качестве пигмента в красках, где он известен как blanc fixe (т. е. «перманентный белый»), или как литопон при смешивании с сульфидом цинка. Сульфат широко используется в качестве наполнителя в бумаге и резине и находит важное применение в качестве непрозрачной среды при рентгенологическом исследовании желудочно-кишечного тракта.
Большинство соединений бария получают из сульфата путем восстановления до сульфида, который затем используют для получения других производных бария. Около 75 процентов всего карбоната бария (BaCO 3 ) идет на производство специального стекла либо для увеличения его показателя преломления, либо для обеспечения радиационной защиты в электронно-лучевых и телевизионных трубках. Карбонат также используется для производства других химикатов бария, в качестве флюса в керамике, в производстве керамических постоянных магнитов для громкоговорителей и для удаления сульфата из соляных растворов перед их подачей в электролизеры (для производства хлора и щелочь). При нагревании карбонат образует оксид бария BaO, который используется при получении высокотемпературных сверхпроводников на основе купратов, таких как YBa 9.0135 2 Cu 3 O 7− x . Другой сложный оксид, титанат бария (BaTiO 3 ), используется в конденсаторах, в качестве пьезоэлектрического материала и в приложениях нелинейной оптики.
При нагревании карбонат образует оксид бария BaO, который используется при получении высокотемпературных сверхпроводников на основе купратов, таких как YBa 9.0135 2 Cu 3 O 7− x . Другой сложный оксид, титанат бария (BaTiO 3 ), используется в конденсаторах, в качестве пьезоэлектрического материала и в приложениях нелинейной оптики.
Хлорид бария (BaCl 2 ·2H 2 O), состоящий из бесцветных кристаллов, растворимых в воде, применяется в ваннах для термообработки и в лабораториях в качестве химического реактива для осаждения растворимых сульфатов. Несмотря на хрупкость, кристаллический фторид бария (BaF 2 ) прозрачен для широкой области электромагнитного спектра и используется для изготовления оптических линз и окон для инфракрасной спектроскопии. Соединение кислорода перекись бария (BaO 2 ) использовалась в 19 веке для производства кислорода (процесс Брина) и в качестве источника перекиси водорода. Летучие соединения бария придают пламени желтовато-зеленый цвет, при этом испускаемый свет имеет в основном две характерные длины волн. Нитрат бария, образованный азотно-кислородной группой NO 3 − и хлорат, образованный хлор-кислородной группой ClO 3 − , используются для этого эффекта в зеленых сигнальных ракетах и фейерверках.
Летучие соединения бария придают пламени желтовато-зеленый цвет, при этом испускаемый свет имеет в основном две характерные длины волн. Нитрат бария, образованный азотно-кислородной группой NO 3 − и хлорат, образованный хлор-кислородной группой ClO 3 − , используются для этого эффекта в зеленых сигнальных ракетах и фейерверках.
Barium (Ba) – Chemical properties
- Home
- Periodic table
- Elements
- Barium
|
Barium8848 ARSITIL ISIST ISIST ISIST ISIST ISIST ISIST ISIST ISIST ISIST ISIST ISIST ISISTIUL 848 ARITIUL ISISTIUL | 848 ARITIUL ISISTIUL | 848 ARITIUL | 8 ARSITIUL. . Это происходит в сочетании с другими химическими веществами, такими как сера, углерод или кислород. Ii очень легкий, и его плотность вдвое меньше, чем у железа. Барий окисляется на воздухе, энергично реагирует с водой с образованием гидроксида, выделяя водород. Барий реагирует почти со всеми неметаллами, образуя часто отравляющие соединения. Применение Барий часто используется в барий-никелевых сплавах для электродов свечей зажигания и в вакуумных трубках в качестве осушителя и агента для удаления кислорода. Барий в окружающей среде Барий удивительно распространен в земной коре, занимая 14-е место среди самых распространенных элементов. Большое количество бария можно найти только в почве и в продуктах питания, таких как орехи, морские водоросли, рыба и некоторые растения. Барий попадает в воздух во время процессов добычи полезных ископаемых, процессов переработки и производства соединений бария. Он также может попадать в воздух при сжигании угля и нефти. Основными добываемыми рудами являются барит, который также является наиболее распространенным, и витцерит. Основными районами добычи являются Великобритания, Италия, Чехия, США и Германия. Ежегодно добывается около 6 миллионов тонн, а запасы, как ожидается, превысят 400 миллионов тонн.
|

 1
1
 11
11
 Я Крис Смит, спасибо за внимание и до свидания.
Я Крис Смит, спасибо за внимание и до свидания. 9
9 MOL -1
MOL -1  Он также используется в люминесцентных лампах: нечистый сульфид бария фосфоресцирует после воздействия света.
Он также используется в люминесцентных лампах: нечистый сульфид бария фосфоресцирует после воздействия света. 
 Люди, которые живут рядом с ними, могут подвергаться воздействию вредных уровней. Воздействие будет вызвано вдыханием пыли, поеданием почвы или растений или питьевой водой, загрязненной барием. Также возможен контакт с кожей.
Люди, которые живут рядом с ними, могут подвергаться воздействию вредных уровней. Воздействие будет вызвано вдыханием пыли, поеданием почвы или растений или питьевой водой, загрязненной барием. Также возможен контакт с кожей.