Строение атома бария (Ba), схема и примеры
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Общие сведения о строении атома бария
Относится к семейству s-элементов. Металл. Обозначение – Ba. Порядковый номер – 56. Относительная атомная масса – 137,34 а.е.м.
Электронное строение атома бария
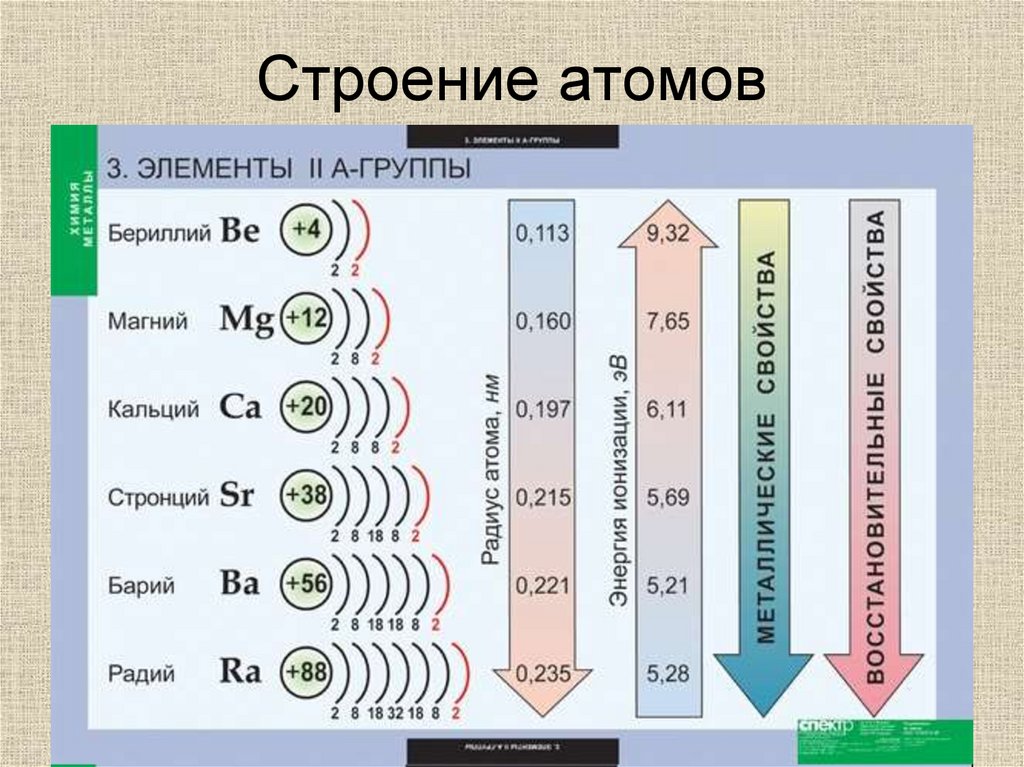
Атом бария состоит из положительно заряженного ядра (+56), внутри которого есть 56 протонов и 81 нейтрон, а вокруг, по шести орбитам движутся 56 электронов.
Рис.1. Схематическое строение атома бария.
Распределение электронов по орбиталям выглядит следующим образом:
+56Ba)2)8)18)18)8)2;
1s22s22p6

Внешний энергетический уровень атома бария содержит 2 электрона, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Для атома бария характерно наличие возбужденного состояния. Электроны 6s-подуровня распариваются и один из них занимает вакантную орбиталь 6p-подуровня:
Наличие двух неспаренных электронов свидетельствует о том, что для бария характерна степень окисления +2.
Валентные электроны атома бария можно охарактеризовать набором из четырех квантовых чисел:
|
Подуровень |
n |
l |
ml |
s |
|
s |
6 |
0 |
0 |
+1/2 |
|
s |
6 |
0 |
0 |
-1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65. 38
38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
76
Os
190.23
77
Ir
192.217
78
Pt
195. 084
084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Барий, атомарная структура – Stock Image – C018/3737
Похоже, вы используете старый веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Это изображение недоступно для покупки в вашей стране.
C018/3737
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см ⏐ 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Пожалуйста, свяжитесь с вашим менеджером по работе с клиентами, если у вас есть какие-либо вопросы.
Запрос
Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ ДелитьсяКупить Распечатать
Кредит
Обозначение
Барий (Ba). Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома бария-137 (атомный номер: 56), изотопа этого элемента. Ядро состоит из 56 протонов (красный) и 81 нейтрона (оранжевый). 56 электронов (белые) последовательно занимают доступные электронные оболочки (кольца). Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Барий — щелочноземельный металл группы 2, периода 6 и s-блока периодической таблицы. Он чрезвычайно реактивен и горит зеленым пламенем. Соединения бария используются в качестве рентгеноконтрастных веществ для пищеварительной системы.
Сведения о выпуске
Разрешение модели не требуется. Разрешение собственности не требуется.
Разрешение собственности не требуется.
Ключевые слова
- 6s
- 6с2
- щелочноземельный металл
- щелочноземельные металлы
- а.е.м.
- атом
- атомный
- атомный номер
- атомных орбиталей
- атомный радиус
- атомный вес
- ба
- барий
- барий-137
- черный фон
- химические данные
- химические свойства
- химическое свойство
- химия
- схема
- электронная конфигурация
- номер электрона
- электронная оболочка
- электронный
- электронов
- элемент
- элементаль
- элементов
- уровней энергии
- группа 2
- иллюстрация
- изотоп
- уровень
- уровней
- металл
- металлический
- металлы
- нейтрон
- нейтрон номер
- нейтронов
- ядерный
- ядерные данные
- нуклон
- нуклонов
- ядро
- орбитальный
- орбитальные типы
- орбиталей
- период 6
- физическая химия
- физические свойства
- физическое имущество
- вечера
- протон номер
- квантовая химия
- с блоком
- S-блок
- оболочка
- каркасная конструкция
- снаряды
- простая электронная конфигурация
- твердый
- твердые вещества
- структурный
- структура
- субатомный
- субатомный
- подоболочка
- подоболочек
- символ
- валентная орбиталь
- волновая функция
WebElements Periodic Table » Барий » свойства свободных атомов
56 Ba
Доступные свойства бария. ..
..
имеют 56 электронов, а структура оболочки равна 2.8.18.18.8.2.
Электронная конфигурация основного состояния газообразного нейтрального бария в основном состоянии равна [ Xe ]. 6s 2 , а символ термина — это 1 S 0 .
Схематическая электронная конфигурация бария. Структура оболочки Косселя бария.Атомный спектр
Представление атомного спектра бария.
Энергии ионизации и сродство к электрону
Электронное сродство бария составляет 13,95 кДж моль ‑1 . Энергии ионизации бария приведены ниже.
| Номер энергии ионизации | Энтальпия / кДж моль ‑1 |
|---|---|
| 1-й | 502.85 |
| 2nd | 965. 22 22 |
| 3rd | 3458.40 |
| 4th | 4530 |
| 5th | 5600 |
| 6th | 6850 |
| 7th | 8300 |
| 8th | 9750 |
| 12590 | |
| 10TH | 444441414141414141414141414141414141414141414141414141414141414141444444444094144444444444444444444441444444409444444444444414144444449н.0244 23250 |
| 12th | 25770 (calculated) |
| 13th | 28600 |
| 14th | 31400 |
| 15th | 34200 |
| 16th | 37600 |
| 17th | 40700 |
| 18th | 43900 |
| 19th | 47100 |
| 20th | 50200 |
| 21st | 62300 |

Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z эфф . Следуйте гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1 с | 54,89 | ||||||
|---|---|---|---|---|---|---|---|
| 2 с | 41,25 | 2п | 51,81 | ||||
| 3 с | 37,16 | 3 шт. | 37,32 | 3д | 42.02 | ||
| 4 с | 27,92 | 4 шт. | 26,80 | 4д | 23,78 | 4f | (нет данных) |
| 5 с | 16,62 | 5 шт. | 14,80 | 5д | (нет данных) | ||
| 6с | 7,58 | 6 шт. | (нет данных) | ||||
| 7 с | |||||||
Каталожные номера
Эти эффективные ядерные заряды, Z eff , адаптированы из следующих ссылок:
- E.
 Clementi and D.L.Raimondi, J. Chem. физ. 1963, 38 , 2686.
Clementi and D.L.Raimondi, J. Chem. физ. 1963, 38 , 2686. - Э. Клементи, Д.Л. Раймонди и В.П. Рейнхардт, J. Chem. физ. 1967, 47 , 1300.
Энергии связи электронов
| Этикетка | Орбитальный | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 37441 [1] |
| L I | 2s | 5989 [1] |
| L II | 2p 1/2 | 5624 [1] |
| L III | 2p 3/2 | 5247 [1] |
| 3s | 1293 [2, values derived from reference 1] | |
| M II | 3p 1/2 | 1137 [2, values derived from reference 1] |
| M III | 3p 3/2 | 1063 [2, values derived from reference 1] |
| M IV | 3d 3/2 | 795. 7 [3] 7 [3] |
| M В | 3d 5/2 | 780.5 [2] |
| N I | 4s | 253.5 [3] |
| N II | 4p 1/2 | 192 [ 1] |
| N III | 4p 3/2 | 178.6 [3] |
| N IV | 4d 3/2 | 92.6 [3] |
| Н В | 4d 5/2 | 89.9 [3] |
| N VI | 4f 5/2 | – |
| N VII | 4f 7/2 | – |
| O I | 5s | 30.3 [3] |
| O II | 5p 1/2 | 17 [3] |
| O III | 5p 3/2 | 14,8 [3] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США) за предоставление данных об энергии связи электрона.