Азот — степени окисления, свойства и реакции
Поможем понять и полюбить химию
Начать учиться
В этой статье мы рассмотрим характеристики азота в химии, узнаем, какие степени окисления может иметь азот и поговорим о важнейших соединениях, в состав которых входит этот химический элемент.
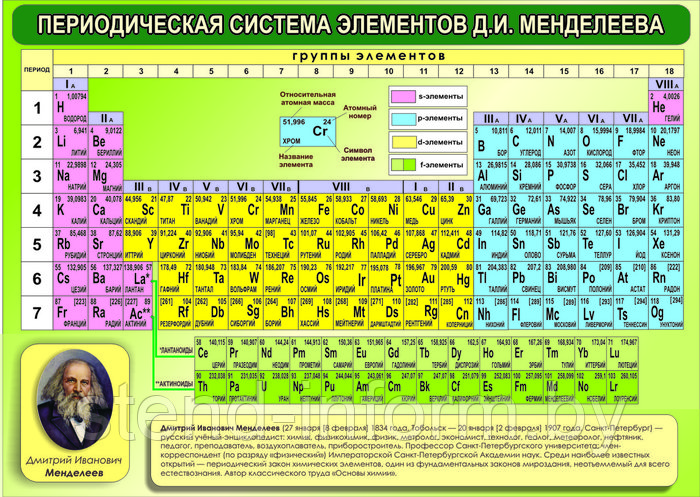
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
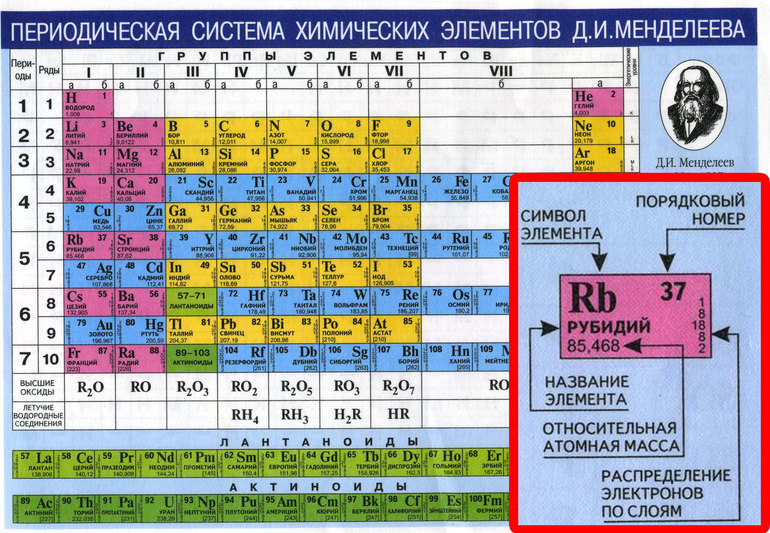
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Важно
Валентности азота V нет!
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
с фтором
N2 + F2 = 2NF3с кислородом
N2 + O2 = 2NO
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.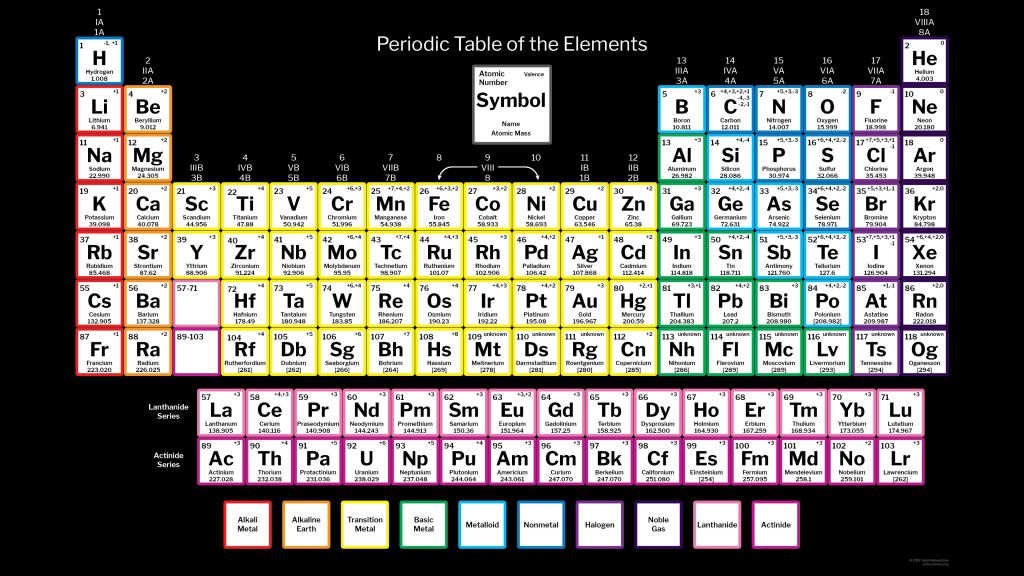
Как окислитель азот реагирует:
с металлами
N2 + 6Li = 2Li3Nазот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
с водородом
N2 +3H2 = 2NH3реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2O
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
6NH3 + 8KClO
10NH3 + 6KMnO4 + 9H2SO4 = 5N2 + 6MnSO4 + 3K2SO4 + 24H2O
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
Лабораторный способ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
Окисление оксида азота (II)
2NO + O2 = 2NO2Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота
Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Вопросы для самопроверки
Какую связь образуют между собой атомы азота?
Одинарную.
Двойную.

Тройную.
Выберите высшую и низшую степени окисления азота:
−3 и +5,
−5 и +3,
0 и +4,
−3 и +3.
Максимальная валентность азота равна:
V,
III,
IV,
II.
В каком качестве выступает аммиак в окислительно-восстановительных реакциях?
Только окислитель.
Только восстановитель.
И окислитель, и восстановитель.

Не участвует в реакциях с изменением степеней окисления.
Выберите формулу веселящего газа:
NO,
N2O3,
N2O,
N2O4.
Ответы
c
a
c
b
c
Ксения Боброва
К предыдущей статье
Теория электролитической диссоциации
К следующей статье
Электролиз расплавов и растворов
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Химический элемент таблицы Менделеева – Азот
Похожие презентации:
Элементы V А группы. Азот и его соединения
Азот и его соединения
Химическое равновесие. Азот (продолжение). 9 класс
Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы
Оксиды азота (II и IV). Азотная кислота. Строение молекулы
Оксиды азота
Соединения азота. Оксиды азота
Химия элементов VA группы (пниктогены или пникти́ды)
Кислородные соединения азота
Оксиды. Химические свойства и получение оксидов
Кислородсодержащие соединения азота
В атмосфере незаметен,
А в реакциях инертен.
Может пользу приносить,
В удобрениях служить…
В организме пребывает,
Роль не малую играет..
Нужен нам он на планете
Всем, и взрослым, и детям…
Азот «открывали» несколько раз и
разные люди. Его называли поразному, приписывая едва ли не
мистические свойства — и
«дефлогистированный воздух», и
«мефитический воздух», и
«атмосферный мофетт», да и
просто «удушливое вещество». До
сих пор у него несколько
названий: английский Nitrogen,
французский Azote, немецкий
Stickstoff, русский «азот»…
Химический элемент таблицы
Менделеева, неметалл.
Символ элемента: N.
Порядковый номер: 7.
Положение в
таблице: 2-й период,
группа – VA
Азот – нетоксичный газ, без цвета, без вкуса, без
запаха, слабый проводник тепла и электричества.
5. жидкость прозрачного цвета . Имеет точку кипения − 195,75 °С
Жидкий азот —не взрывоопасен и не ядовит.жидкость
прозрачного
цвета . Имеет
точку кипения −
195,75 °С
Испаряясь, азот охлаждает очаг возгорания и вытесняет
кислород, необходимый для горения, поэтому пожар
прекращается. Так как азот, в отличие от воды, пены или
порошка, просто испаряется и выветривается, азотное
пожаротушение, наряду с углекислотным, — наиболее
эффективный с точки зрения сохранности ценностей способ
тушения пожаров.
Жидкий азот способен при определенной
температуре и под воздействием соответствующего
давления преобразовываться в кристаллическое
твердое вещество.
В лаборатории азот легко
может быть получен при
нагревании концентрированного
нитрита аммония:
Nh5NO2= N2 + 2h3O.

Технический способ получения
азота основан на разделении
предварительно сжиженного воздуха,
который затем подвергается разгонке.
Азот существует в природе и является
невоспламеняющимся при нормальном
давлении и температуре газом. Поскольку
азот немного легче воздуха, с высотой
в атмосфере его концентрация увеличивается.
Нитраты являются необходимой частью
азотного питания растений, без которых
невозможны сложные биологические
процессы синтеза белка.
Нитраты в растениях восстанавливаются
до нитритов, которые, подвергаясь
дальнейшим превращениям, дают аммиак,
основу питания растений.
Оксид азота(II) – NO
Физические свойства.
Бесцветный газ, при низких температурах – голубая
жидкость. В твердом состоянии -димеризован (N2O2).
Не растворим в воде.
t0(плав) = -1640С, t0(кип) = – 151,70С.
Получение.
1. При реакции неактивных металлов с разбавленной
азотной кислотой:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O
2.
 При каталитическом окислении аммиака:
При каталитическом окислении аммиака:4Nh4 + 5O2 = 4NO + 6h3O
3. При взаимодействии с кислородом воздуха:
N2 + O2 = 2NO (t0 ≥ 20000C, кат. Pt/Rh)
4. При взаимодействии нитритов с серной кислотой:
2 NaNO2 + h3SO4 = Na2SO4 + NO + NO2 + h3O
Химические свойства.
Очень реакционноспособное вещество. Может проявлять и
окислительные и восстановительные свойства.
1.При обычной температуре окисляется кислородом
воздуха:
2NO + O2 = 2NO2
2. Восстановитель:
NO + NO2 = N2O3
2NO + Cl2 = 2NOCl (нитрозилхлорид)
3. Окислитель:
2NO + 2SO2 = 2SO3 + N2
2NO + 2Н2 = N2 + 2Н2О (2000С)
2NO + 2Cu = N2 + 2CuO (5000С)
2NO + 2h3S = N2 + 2S + 2Н2О (3000С)
4. Взаимодействует с органическими веществами.
Примененияется. В производстве азотной кислоты.
Оксид азота(IV) – NO2
и его димер N2O4
Физические свойства.
Это красно-бурый газ с резким запахом.
При низких температурах из-за наличия у
атомов азота неспаренных электронов
димеризуется в N2O4.
 Димер в жидком
Димер в жидкомсостоянии бесцветный, в твердом – белый.
t(пл) = -11,20С.
Хорошо растворяется в холодной воде.
Насыщенный раствор имеет ярко-зеленый
цвет.
Получение.
Бурый газ
Термическим разложением нитратов металлов, расположенных в ряду
активности в интервале Al-Сu:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Взаимодействием меди с концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
Окислением оксида азота(II):
2NO + O2 = 2NO2
Химические свойства.
Взаимодействие с водой:
2NO2 + h3O(хол) = HNO3 + HNO2
3NO2 + h3O(гор) = 2HNO3 + NO
Взаимодействие с растворами щелочей:
2NO2 + 2КОН = КNO3 + КNO2 + Н2О
При растворении в воде в присутствии кислорода:
4NO2 + 2h3O + О2 = 4HNO3
Используется в промышленном способе получения азотной
кислоты.
Хороший окислитель:
NO2 + SO2 = SO3 + NO 2NO2 + 4Cu = 4CuO + N2 (500-6000C)
Оксид азота(I) – N2O (“веселящий газ”)
Физические свойства.
Бесцветный газ с тошнотворным cладковатым запахом,
обладает анестезирующим действием.

Растворим в воде. t0(плав) = -910С, t0(кип) = -88,60С.
Получение.
Разложение нитрата аммония при нагревании:
Nh5NO3 = N2O + 2h3O
Нагрев должен быть не более 2450С.
Химические свойства.
1.Разлагается при 7000С с образованием кислорода: 2N2O
= 2N2 + O2
Поэтому поддерживает горение и является окислителем.
2.С водородом: N2O + h3 = N2 + h3O
Оксид азота(III) – азотистый ангидрид
Физические свойства.
Это синяя жидкость при обычных условиях. В твердом состоянии
– белое или голубоватое вещество. t(плав) = -1020С.
Получить можно при сильном охлаждении эквимолярной
смеси NO и NO2:
NO + NO2 = N2O3
Химические свойства.
N2O3 – кислотный оксид.
1.Взаимодействие со щелочами:
2NaOH + N2O3 = 2NaNO2 + h3O
2.Взаимодействие с водой:
N2O3 + h3O(хол) = 2HNO2
3N2O3 + h3O(гор) = 2HNO3 + 4NO
3.Окисляется кислородом воздуха при -100С:
2N2O3 + О2 = 4NO2
Оксид азота(V) – азотный ангидрид N2O5
Строение.
Физические свойства.

Белое кристаллическое вещество, летучее, неустойчивое. При
нагревании возгоняется и плавится. В воде легко
растворяется.
Получение.
Действие дегидратирующего агента Р4О10 на азотную кислоту:
4HNO3 + P4O10 = 2N2O5 + 4HPO3
Химические свойства. Оксид азота(V) – кислотный оксид.
1. При растворении в воде образует азотную кислоту:
N2O5 + h3O = 2HNO3
2. Со щелочами образует нитраты:
N2O5 + 2NaOH = 2NaNO3 + h3O
3. Малоустойчив и легко разлагается уже при комнатной
температуре: 2N2O5 = 4NO2 + O2
Прb нагревании разлагается со взрывом.
4. Сильный окислитель:
N2O5 + 5Сu = 5CuO + N2 (5000C)
На практике реакции не проводятся ввиду его
труднодоступности и малой устойчивости
Азотистая кислота HNO2
Строение.
Физические свойства.
Бесцветная жидкость, дымящая на воздухе.
Едкий запах.
Желтый цвет концентрированной кислоты (разложение с
образованием NO2)
4HNO3 = 4NO2↑ + 2h3O + O2↑
Плотность 1,52 г/см3.
Температура кипения – 860С.
Температура затвердевания – -41,60С.
Гигроскопична.
С водой смешивается в любых соотношениях.
Химические свойства.
Разбавленная азотная кислота проявляет свойства, общие
для всех кислот:
Диссоциациация в водном растворе:
HNO3 +
Реакция с основаниями:
NaOH + HNO3 = NaNO3 + h3O
Cu(OH)2↓ + 2HNO3 = Cu(NO3)2 + 2h3O
Реакция с основными оксидами:
CaO + 2HNO3 = Ca(NO3)2 + h3O
Реакция с солями:
Na2CO3 + 2HNO3 = 2NaNO3 + h3O + CO2↑
Специфические свойства –
взаимодействие с металлами
ЗАПОМНИ!
При взаимодействии азотной кислоты любой
концентрации с металлами водород никогда
не выделяется. Продукты зависят от металла
и концентрации кислоты.
Нитрит
С овощами и фруктами в организм человека поступают до
70 – 80% нитратов. Сами по себе они не представляют
опасности для здоровья, тем более, что большая часть этих
соединений выделяется с мочой (65 – 90% за сутки). Однако
часть нитратов (5-7%) при избыточном их содержании в
овощах, в желудочно-кишечном тракте может перейти в
нитриты (соли азотистой кислоты), которые оказывают
вредное воздействие на организм.

Пути попадания нитратов в организм
человека:
– Основная масса нитратов
попадает в организм человека с
консервированными и свежими
овощами;
– Часть нитратов может образоваться в
самом организме человека при обмене
веществ. – Нитраты поступают в
организм и с водой. Обычно жители
городов пьют воду, где содержится до
20 мг/л нитратов, жители же сельской
местности – мг/л нитратов;
– Нитраты содержатся и в животной
пище. Рыбная и мясная продукция в
натуральном виде содержит немного
нитратов (5- 25 мг/кг в мясе, и 2-15
мг/кг в рыбе). Но нитраты и нитриты
добавляют в готовую мясную и рыбную
продукцию с целью улучшения ее
потребительских свойств и для более
длительного хранения;
English Русский Правила
Бесцветный элемент Криптон | ChemTalk
Элементы
- Сообщение от Доннелл Грин
13
октябряЗнакомство с криптоном
Бесцветный элемент криптон относится к категории неметаллов периодической таблицы. Он относится к благородным газам и относится к группе 18. Этот элемент не только бесцветен, но и не имеет запаха.
Он относится к благородным газам и относится к группе 18. Этот элемент не только бесцветен, но и не имеет запаха.
Десять интересных фактов о криптоне
- Kr обычно используется в качестве наполняющего газа для энергосберегающих люминесцентных ламп.
- Этот благородный газ является одним из самых редких элементов на Земле. Он составляет только одну миллионную часть атмосферы по объему.
- Элемент криптон был обнаружен частично случайно, поэтому он назван в честь греческого слова «крипто», что означает «скрытый».
- Хотя Kr редко присутствует на Земле, его много на таких звездах, как Солнце.
- Криптон имеет период полураспада 10,76 года. В электрическом поле он выглядит как беловатое свечение.
- Вспышка камеры содержит криптон, из-за яркого источника света в медицине криптон используется для обнаружения аномальных отверстий сердца.
- Криптон будет излучать красновато-оранжевый свет, если его поместить в среду с высоким давлением и низкой температурой.
 Сэр Уильям Рэмси и Моррис Трэверс заметили это, когда впервые открыли этот элемент. С тех пор этот цвет стал важным в вывесках, которые светятся флуоресцентно, как вывески «выход» в зданиях.
Сэр Уильям Рэмси и Моррис Трэверс заметили это, когда впервые открыли этот элемент. С тех пор этот цвет стал важным в вывесках, которые светятся флуоресцентно, как вывески «выход» в зданиях. - Одним из распространенных способов использования криптона является получение искусственных рубинов.
- Kr излучает зеленовато-желтое свечение при смешивании с другими газами.
- Этот элемент и другие элементы группы 18 периодической таблицы были открыты одними из последних элементов.
Kr в периодической таблице
Криптон — химический элемент с символом Kr. Он находится в группе 18 и периоде 4, справа от брома и ниже аргона. Он относится к семейству благородных газов и имеет тенденцию не вступать в реакцию с другими элементами, потому что он уже имеет желаемые s- и p-электроны на своем валентном энергетическом уровне. Элемент имеет атомный номер 36, температуру плавления -157 градусов по Цельсию и температуру кипения -153 градуса по Цельсию.
Криптон очень похож на другие благородные газы, поскольку он бесцветен, не имеет запаха и не очень химически активен. Криптон имеет электроотрицательность 3.
Криптон имеет электроотрицательность 3.
Криптон-датирование
В 2014 году ученые успешно использовали метод криптон-датирования для определения возраста образца антарктического льда возрастом 120 000 лет. Как и очень распространенный метод датирования по углероду, датирование по криптону измеряет распад радиоактивного изотопа, который имеет постоянную и хорошо известную скорость распада, и сравнивает его со стабильным изотопом. Поскольку криптон является благородным газом, он химически не взаимодействует с другими элементами и имеет период полураспада около 230 000 лет. Углеродное датирование не работает на льду, потому что углерод-14 находится во льду под действием космических лучей. Он содержит радиоактивный изотоп (Кр-81), который медленно распадается, и стабильный изотоп (Криптон-83), который не распадается. При сравнении соотношения стабильных и радиоактивных изотопов определяется возраст льда. Исследователи считают, что с помощью этой новой техники они смогут датировать лед возрастом до 1,5 миллионов лет.
Глубокий мантийный криптон
Используя различные изотопы Kr, ученые смогли создать своего рода химический отпечаток пальца, отображающий ингредиенты, из которых была создана Земля. Kr из мантии Земли собирается из геологических горячих точек, вулканических мест, которые, как считается, питаются нижележащей мантией, которая очень горячая по сравнению с окружающей мантией. Такие места, как Галапагосские острова и Исландия, раскрывают более четкую картину того, как была создана наша планета. Полученные данные показывают, что летучие элементы прибыли на Землю, когда Земля росла и формировалась как планета. Эта информация важна, потому что она противоречит популярной теории о том, что летучие элементы Земли были в основном доставлены ближе к концу формирования Земли. Изотопы предполагают, что планетезимали, мельчайшие планеты, из внешней Солнечной системы бомбардировали Землю на раннем этапе.
Криптон в современном мире
Фотография
Криптон и ксенон часто используются в некоторых фотовспышках для высокоскоростной фотосъемки. Вспышки в камере состоят из электродов, заполненных газом с обоих концов, который при срабатывании ионизируется и производит импульс высокого напряжения для получения света. Ксеноновые лампы-вспышки излучают свет в различных спектральных линиях. Криптон — еще одно вещество, используемое в лампах-вспышках. Его эффективность может достигать 40%, но для достижения более эффективной вспышки требуется как минимум 70-процентное увеличение давления по сравнению с ксеноном.
Вспышки в камере состоят из электродов, заполненных газом с обоих концов, который при срабатывании ионизируется и производит импульс высокого напряжения для получения света. Ксеноновые лампы-вспышки излучают свет в различных спектральных линиях. Криптон — еще одно вещество, используемое в лампах-вспышках. Его эффективность может достигать 40%, но для достижения более эффективной вспышки требуется как минимум 70-процентное увеличение давления по сравнению с ксеноном.
Медицинская диагностика
Хотя Kr совершенно не имеет запаха, цвета и мало распространен в атмосфере Земли, его изотопы можно использовать в медицинских целях. Изотоп Кр-85 используется при изучении нарушений кровотока и функции легких в ядерной медицине. Аппараты магнитно-резонансной томографии (МРТ) используют еще один изотоп криптона, Kr-83. В этой новой форме визуализации будет использоваться обработанный газ Kr, который можно вдыхать и использовать в качестве контраста для выявления областей легких на МРТ-сканировании. В то время как традиционные МРТ используют протоны в организме в качестве мишени для получения изображения ткани, это не даст наилучшего изображения легких, поскольку они заполнены воздухом. При использовании вдыхаемых аппаратов МРТ с гиперполяризованным газом, которые используют лазеры для поляризации инертного благородного газа, выравниваются ядра газа, и это будет отображаться на МРТ-сканировании.
В то время как традиционные МРТ используют протоны в организме в качестве мишени для получения изображения ткани, это не даст наилучшего изображения легких, поскольку они заполнены воздухом. При использовании вдыхаемых аппаратов МРТ с гиперполяризованным газом, которые используют лазеры для поляризации инертного благородного газа, выравниваются ядра газа, и это будет отображаться на МРТ-сканировании.
Домашняя изоляция
Kr также используется в качестве изоляционного газа между оконными панелями. Он широко известен как лучший изолирующий агент по сравнению с его аналогом аргоном. Использование его в оконных панелях делает окна более энергоэффективными, особенно для больших окон. Хотя Kr стоит дороже, чем аргон, поскольку его труднее извлечь, со временем он компенсирует эту стоимость. Недавнее исследование показывает, что окна с изоляцией Kr сокращают счета за электроэнергию до 15% в год.
Открытие Криптона
30 мая 1898 года сэр Уильям Рамзи, химик из Шотландии, вместе с английским химиком Моррисом М.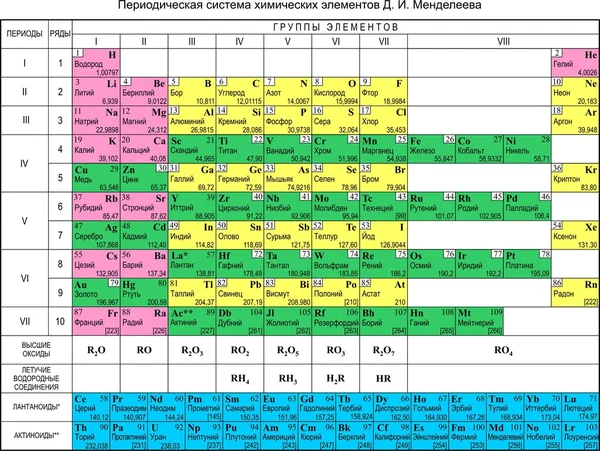 Трэверсом открыли криптон. Изучая жидкий воздух, они обнаружили, что небольшое количество жидкого криптона осталось после того, как более летучие компоненты жидкого воздуха испарились.
Трэверсом открыли криптон. Изучая жидкий воздух, они обнаружили, что небольшое количество жидкого криптона осталось после того, как более летучие компоненты жидкого воздуха испарились.
Криптон. Химия. Соединения, реакции, степени окисления.
Химические свойства. Этот газ почти в три раза тяжелее воздуха. Он бесцветный, без запаха, без вкуса и одноатомный. Этот газ также не очень реакционноспособен, так как это благородный газ. Обычно он реагирует только с газообразным фтором.
Соединения криптона
Дифторид криптона
После его открытия большинство ученых считали, что криптон не может образовывать соединения до 1960-х годов, когда был открыт дифторид криптона. Это было первое открытое соединение криптона, он используется как очень сильный окислитель KrF 2 .
Изоляция криптона
Его выделяют так же, как и любой другой благородный газ, путем сжижения воздуха. Это процесс, при котором воздух охлаждается до низких температур, чтобы он конденсировался в бледно-голубую подвижную жидкость.
Физические свойства Krypton
Символ Криптона: KR
Сумка плавления: -157 ° C
Точка кипячения: -153 ° C
Плотность: 3,73 10 -3 G.CM -3 . На 20 -3 G.CM -3 . C
Атомная масса: 83,80 г.моль -1
Атомный номер: 36
Электроотрицательность: 3
Классификация: Криптон — благородный газ. Это четвертый элемент в группе 18 периодической таблицы.
Конфигурация электронной оболочки: [ Ar ] 3d 10 4s 2 4p 6
Изотопы: Kr имеет 32 различных изотопа.
Токсичность: нетоксичен
Где я могу купить Kr?
Kr — очень редкий газ, содержащийся в атмосфере Земли. Он не имеет запаха, цвета, вкуса и нетоксичен. Концентрация элемента в атмосфере Земли составляет 1,1×10 90 103 -4 90 104 объемных процентов, что делает его чрезвычайно редким. Kr в основном поставляется в газообразном состоянии для эксимерных лазеров, лампочек, изоляции окон и лабораторных исследований. Такие компании, как Concorde Specialty Gases, являются основными продавцами элемента криптона.
Такие компании, как Concorde Specialty Gases, являются основными продавцами элемента криптона.
Доннелл Грин
Благородный газ | Определение, элементы, свойства, характеристики и факты
аргоновая изоляция
Посмотреть все носители
- Ключевые сотрудники:
- сэр Уильям Рамзи Фридрих Адольф Панет
- Похожие темы:
- ксенон гелий криптон радон аргон
Просмотреть весь связанный контент →
Сводка
Прочтите краткий обзор этой темы
благородный газ , любой из семи химических элементов, составляющих группу 18 (VIIIa) периодической таблицы. Элементами являются гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe), радон (Rn) и оганесон (Og). Благородные газы бесцветные, без запаха, без вкуса, негорючие газы. Их традиционно относят к группе 0 в периодической таблице, потому что в течение десятилетий после их открытия считалось, что они не могут связываться с другими атомами; то есть их атомы не могли соединяться с атомами других элементов с образованием химических соединений. Их электронная структура и обнаружение того, что некоторые из них действительно образуют соединения, привели к более подходящему обозначению — Группа 18.
Их электронная структура и обнаружение того, что некоторые из них действительно образуют соединения, привели к более подходящему обозначению — Группа 18.
Когда члены группы были обнаружены и идентифицированы, они считались чрезвычайно редкими, а также химически инертными, и поэтому их называли редкими или инертными газами. Однако теперь известно, что некоторые из этих элементов довольно распространены на Земле и в остальной части Вселенной, поэтому обозначение редкого вводит в заблуждение. Точно так же использование термина инертный имеет тот недостаток, что он подразумевает химическую пассивность, предполагая, что соединения группы 18 не могут быть образованы. В химии и алхимии слово благородный долгое время обозначал нежелание металлов, таких как золото и платина, вступать в химическую реакцию; это относится в том же смысле к рассматриваемой здесь группе газов.
Содержание инертных газов уменьшается по мере увеличения их атомных номеров. Гелий — самый распространенный элемент во Вселенной, кроме водорода. Все благородные газы присутствуют в атмосфере Земли, и, кроме гелия и радона, их основным коммерческим источником является воздух, из которого их получают сжижением и фракционной перегонкой. Большая часть гелия производится в коммерческих целях из определенных скважин природного газа. Радон обычно выделяют как продукт радиоактивного разложения соединений радия. Ядра атомов радия самопроизвольно распадаются, испуская энергию и частицы, ядра гелия (альфа-частицы) и атомы радона. Некоторые свойства благородных газов приведены в таблице.
Гелий — самый распространенный элемент во Вселенной, кроме водорода. Все благородные газы присутствуют в атмосфере Земли, и, кроме гелия и радона, их основным коммерческим источником является воздух, из которого их получают сжижением и фракционной перегонкой. Большая часть гелия производится в коммерческих целях из определенных скважин природного газа. Радон обычно выделяют как продукт радиоактивного разложения соединений радия. Ядра атомов радия самопроизвольно распадаются, испуская энергию и частицы, ядра гелия (альфа-частицы) и атомы радона. Некоторые свойства благородных газов приведены в таблице.
| гелий | неон | аргон | криптон | ксенон | радон | уноктий | |
|---|---|---|---|---|---|---|---|
*При 25,05 атм. | |||||||
| **ГПУ = гексагональная плотноупакованная, ГЦК = гранецентрированная кубическая (кубическая плотноупакованная). | |||||||
| ***Самый стабильный изотоп. | |||||||
| атомный номер | 2 | 10 | 18 | 36 | 54 | 86 | 118 |
| атомный вес | 4.003 | 20.18 | 39.948 | 83,8 | 131.293 | 222 | 294*** |
| температура плавления (°С) | −272,2* | −248,59 | −189,3 | −157,36 | −111,7 | −71 | — |
| температура кипения (°С) | −268,93 | −246,08 | −185,8 | −153,22 | −108 | −61,7 | — |
| плотность при 0 °C, 1 атмосфера (грамм на литр) | 0,17847 | 0,899 | 1,784 | 3,75 | 5. 881 881 | 9,73 | — |
| растворимость в воде при 20 °C (куб. сантиметры газа на 1000 граммов воды) | 8,61 | 10,5 | 33,6 | 59,4 | 108.1 | 230 | — |
| изотопное содержание (земное, в процентах) | 3 (0,000137), 4 (99,999863) | 20 (90,48), 21 (0,27), 22 (9,25) | 36 (0,3365), 40 (99,6003) | 78 (0,35), 80 (2,28), 82 (11,58), 83 (11,49), 84 (57), 86 (17,3) | 124 (0,09), 126 (0,09), 128 (1,92), 129 (26,44), 130 (4,08), 131 (21,18), 132 (26,89), 134 (10,44), 136 (8,87) | — | — |
| радиоактивные изотопы (массовые числа) | 5–10 | 16–19, 23–34 | 30–35, 37, 39, 41–53 | 69–77, 79, 81, 85, 87–100 | 110–125, 127, 133, 135–147 | 195–228 | 294 |
| цвет света, излучаемого газоразрядной трубкой | желтый | красный | красный или синий | желто-зеленый | от синего к зеленому | — | — |
| теплота плавления (килоджоулей на моль) | 0,02 | 0,34 | 1,18 | 1,64 | 2. 3 3 | 3 | — |
| теплота парообразования (калории на моль) | 0,083 | 1,75 | 6,5 | 9.02 | 12,64 | 17 | — |
| удельная теплоемкость (Джоули на грамм Кельвина) | 5.1931 | 1,03 | 0,52033 | 0,24805 | 0,15832 | 0,09365 | — |
| критическая температура (К) | 5.19 | 44,4 | 150,87 | 209,41 | 289,77 | 377 | — |
| критическое давление (атмосферы) | 2,24 | 27,2 | 48,34 | 54,3 | 57,65 | 62 | — |
| критическая плотность (грамм на кубический сантиметр) | 0,0696 | 0,4819 | 0,5356 | 0,9092 | 1. 103 103 | — | — |
| теплопроводность (ватт на метр Кельвина) | 0,1513 | 0,0491 | 0,0177 | 0,0094 | 0,0057 | 0,0036 | — |
| магнитная восприимчивость (единицы СГС на моль) | −0,0000019 | −0,0000072 | −0,0000194 | −0,000028 | −0,000043 | — | — |
| Кристальная структура** | hcp | ФКК | ФКК | ФКК | ФКК | ФКК | — |
| радиус: атомный (ангстрем) | 0,31 | 0,38 | 0,71 | 0,88 | 1,08 | 1,2 | — |
| радиус: ковалентный (кристаллический) оценочный (ангстрем) | 0,32 | 0,69 | 0,97 | 1. 1 1 | 1,3 | 1,45 | — |
| статическая поляризуемость (куб. ангстрем) | 0,204 | 0,392 | 1,63 | 2,465 | 4.01 | — | — |
| потенциал ионизации (первый, электрон-вольты) | 24.587 | 21,565 | 15.759 | 13.999 | 12.129 | 10.747 | — |
| электроотрицательность (Полинг) | 4,5 | 4. 0 0 | 2,9 | 2,6 | 2,25 | 2.0 | — |
В 1785 году Генри Кавендиш, английский химик и физик, обнаружил, что воздух содержит небольшую долю (чуть меньше 1 процента) вещества, химически менее активного, чем азот. Столетие спустя лорд Рэлей, английский физик, выделил из воздуха газ, который, по его мнению, был чистым азотом, но обнаружил, что он тяжелее азота, полученного путем высвобождения его из соединений. Он рассудил, что его воздушный азот должен содержать небольшое количество более плотного газа. В 1894, сэр Уильям Рэмзи, шотландский химик, сотрудничал с Рэлеем в выделении этого газа, который оказался новым элементом — аргоном.
Викторина “Британника”
Викторина “Наука”
После открытия аргона и по наущению других ученых в 1895 году Рамзи исследовал газ, выделяющийся при нагревании минерала клевита, который считался источником аргона.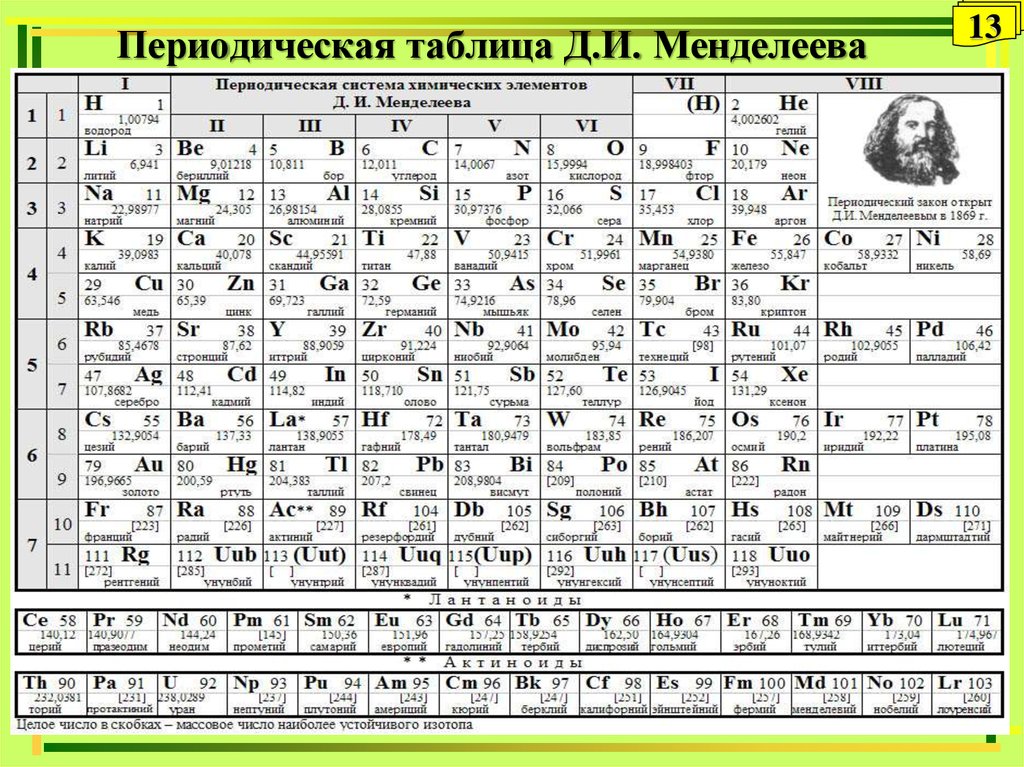 Вместо этого газом был гелий, который в 1868 году был обнаружен спектроскопически на Солнце, но не был обнаружен на Земле. Рамзи и его коллеги искали родственные газы и путем фракционной перегонки жидкого воздуха открыли криптон, неон и ксенон в 189 году.8. Впервые радон был обнаружен в 1900 г. немецким химиком Фридрихом Э. Дорном; он был основан как член группы по благородным газам в 1904 году. Рэлей и Рамзи получили Нобелевскую премию в 1904 году за свою работу.
Вместо этого газом был гелий, который в 1868 году был обнаружен спектроскопически на Солнце, но не был обнаружен на Земле. Рамзи и его коллеги искали родственные газы и путем фракционной перегонки жидкого воздуха открыли криптон, неон и ксенон в 189 году.8. Впервые радон был обнаружен в 1900 г. немецким химиком Фридрихом Э. Дорном; он был основан как член группы по благородным газам в 1904 году. Рэлей и Рамзи получили Нобелевскую премию в 1904 году за свою работу.
В 1895 году французский химик Анри Муассан, открывший элементарный фтор в 1886 году и получивший за это открытие Нобелевскую премию в 1906 году, потерпел неудачу в попытке вызвать реакцию между фтором и аргоном. Этот результат был значительным, потому что фтор является наиболее реакционноспособным элементом в периодической таблице. На самом деле все поздние 19Попытки получить химические соединения аргона в начале 20 века потерпели неудачу. Отсутствие химической реактивности, обусловленное этими неудачами, имело большое значение для развития теорий строения атома. В 1913 году датский физик Нильс Бор предположил, что электроны в атомах расположены в последовательных оболочках, имеющих характерные энергии и емкости, и что емкости оболочек для электронов определяют количество элементов в строках периодической таблицы. На основании экспериментальных данных, связывающих химические свойства с распределением электронов, было высказано предположение, что в атомах благородных газов тяжелее гелия электроны расположены в этих оболочках таким образом, что самая внешняя оболочка всегда содержит восемь электронов, независимо от сколько других (в случае с радоном 78 других) расположены внутри внутренних оболочек.
В 1913 году датский физик Нильс Бор предположил, что электроны в атомах расположены в последовательных оболочках, имеющих характерные энергии и емкости, и что емкости оболочек для электронов определяют количество элементов в строках периодической таблицы. На основании экспериментальных данных, связывающих химические свойства с распределением электронов, было высказано предположение, что в атомах благородных газов тяжелее гелия электроны расположены в этих оболочках таким образом, что самая внешняя оболочка всегда содержит восемь электронов, независимо от сколько других (в случае с радоном 78 других) расположены внутри внутренних оболочек.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
В теории химической связи, разработанной американским химиком Гилбертом Н. Льюисом и немецким химиком Вальтером Косселем в 1916 году, этот октет электронов считался наиболее стабильным расположением самой внешней оболочки любого атома. Хотя таким расположением обладали только атомы инертных газов, именно к этому состоянию стремились атомы всех других элементов в своих химических связях. Некоторые элементы удовлетворили эту тенденцию, либо сразу приобретя, либо потеряв электроны, становясь, таким образом, ионами; другие элементы делили электроны, образуя устойчивые комбинации, связанные между собой ковалентными связями. Таким образом, пропорции, в которых атомы элементов объединялись, образуя ионные или ковалентные соединения (их «валентности»), контролировались поведением их самых внешних электронов, которые — по этой причине — назывались валентными электронами. Эта теория объясняла химическую связь активных элементов, а также относительную неактивность инертных газов, которую стали рассматривать как их главную химическую характеристику. ( См. также химическая связь: связи между атомами.)
Хотя таким расположением обладали только атомы инертных газов, именно к этому состоянию стремились атомы всех других элементов в своих химических связях. Некоторые элементы удовлетворили эту тенденцию, либо сразу приобретя, либо потеряв электроны, становясь, таким образом, ионами; другие элементы делили электроны, образуя устойчивые комбинации, связанные между собой ковалентными связями. Таким образом, пропорции, в которых атомы элементов объединялись, образуя ионные или ковалентные соединения (их «валентности»), контролировались поведением их самых внешних электронов, которые — по этой причине — назывались валентными электронами. Эта теория объясняла химическую связь активных элементов, а также относительную неактивность инертных газов, которую стали рассматривать как их главную химическую характеристику. ( См. также химическая связь: связи между атомами.)
Экранированные от ядра промежуточными электронами внешние (валентные) электроны атомов более тяжелых благородных газов удерживаются менее прочно и легче удаляются (ионизируются) из атомы, чем электроны более легких благородных газов. Энергия, необходимая для удаления одного электрона, называется первой энергией ионизации. В 1962 году, работая в Университете Британской Колумбии, британский химик Нил Бартлетт обнаружил, что гексафторид платины удаляет электрон (окисляет) молекулярный кислород с образованием соли [O 2 + ][ПтФ 6 − ]. Первая энергия ионизации ксенона очень близка к энергии кислорода; таким образом, Бартлетт думал, что соль ксенона может быть образована аналогичным образом. В том же году Бартлетт установил, что химическим путем действительно можно удалять электроны из ксенона. Он показал, что взаимодействие паров PtF 6 в присутствии газообразного ксенона при комнатной температуре приводит к образованию желто-оранжевого твердого соединения, которое формулируется как [Xe + ][ПтФ 6 − ]. (Теперь известно, что это соединение представляет собой смесь [XeF + ][PtF 6 – ], [XeF + ] [Pt 2 F 11 – ] и 086 5 .
Энергия, необходимая для удаления одного электрона, называется первой энергией ионизации. В 1962 году, работая в Университете Британской Колумбии, британский химик Нил Бартлетт обнаружил, что гексафторид платины удаляет электрон (окисляет) молекулярный кислород с образованием соли [O 2 + ][ПтФ 6 − ]. Первая энергия ионизации ксенона очень близка к энергии кислорода; таким образом, Бартлетт думал, что соль ксенона может быть образована аналогичным образом. В том же году Бартлетт установил, что химическим путем действительно можно удалять электроны из ксенона. Он показал, что взаимодействие паров PtF 6 в присутствии газообразного ксенона при комнатной температуре приводит к образованию желто-оранжевого твердого соединения, которое формулируется как [Xe + ][ПтФ 6 − ]. (Теперь известно, что это соединение представляет собой смесь [XeF + ][PtF 6 – ], [XeF + ] [Pt 2 F 11 – ] и 086 5 .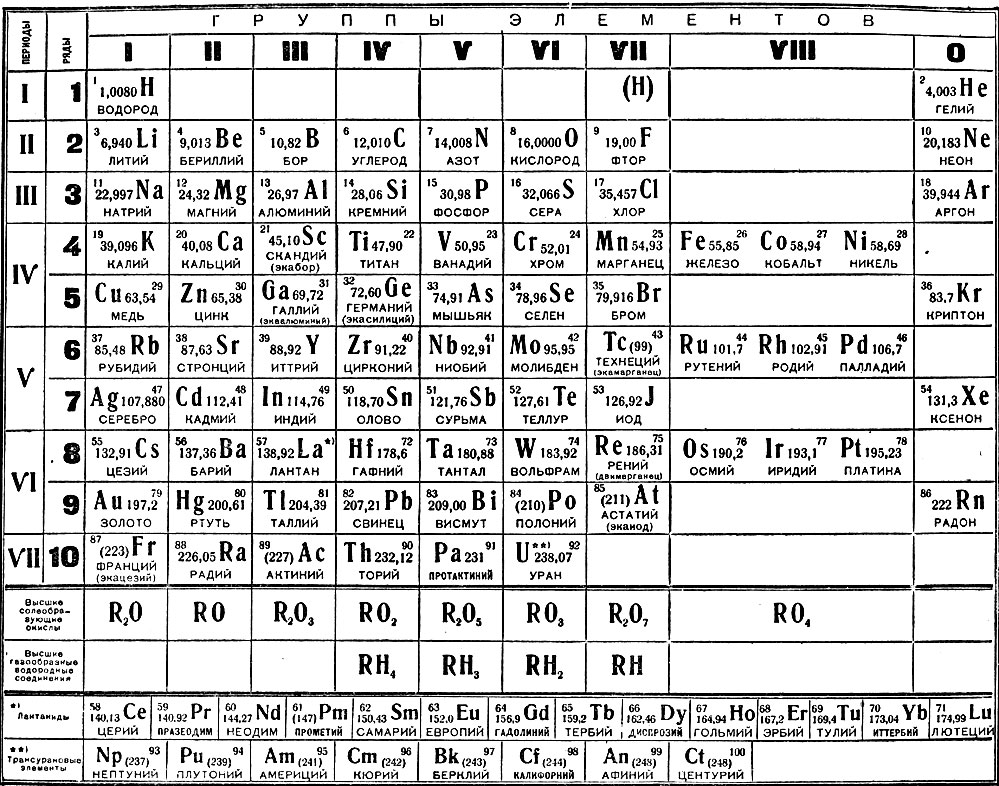


 Сэр Уильям Рэмси и Моррис Трэверс заметили это, когда впервые открыли этот элемент. С тех пор этот цвет стал важным в вывесках, которые светятся флуоресцентно, как вывески «выход» в зданиях.
Сэр Уильям Рэмси и Моррис Трэверс заметили это, когда впервые открыли этот элемент. С тех пор этот цвет стал важным в вывесках, которые светятся флуоресцентно, как вывески «выход» в зданиях.