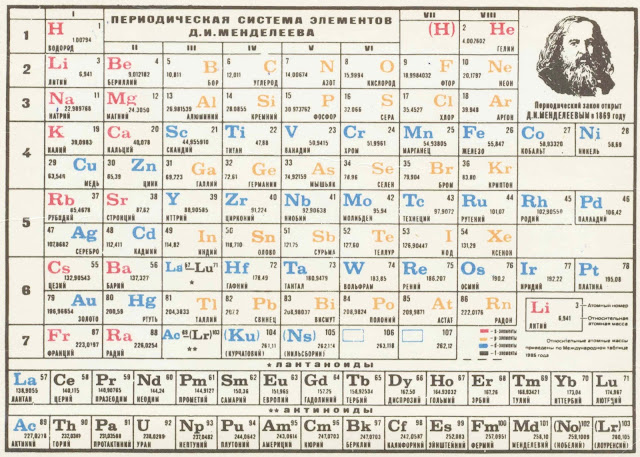
Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева
Похожие презентации:
Характеристика элемента по его положению в периодической системе химических элементов (1)
Периодический закон и Периодическая система химических элементов
Периодический закон и периодическая система химических элементов Д.И.Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Металлы в периодической системе химических элементов
Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева
Характеристика химического элемента Металла на основании его положения в периодической системе Д.И. Менделеева
Периодический закон и периодическая система химических элементов
Периодический закон химических элементов Д. И. Менделеева и периодическая система
И. Менделеева и периодическая система
2. Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева. ТБ
02.09.20173. Химический элемент
Химический элемент – это атомы одноговида (одинаковые атомы)
Атомыалюминия
углерода
Атомы
Строение Периодической системы
Малый период
Большой период
Строение Периодической системы
6. План характеристика химического элемента
1. Положение элемента в ПС и строение атомаНомер периода
Са
+20
20 р
2
8
8
2 18 е
Номер
ПорядковыйСтепень
номер окисления:
+2 группы
(если это элемент
главной
подгруппы)
20 р
18 е
«-»
«+»
Положение в ПС:
Са – порядковый номер 20
На 2 положителнозаряжанные
4 период, II группа, главная подгруппа
частицы больше, поэтому СО +2
План характеристика
химического элемента
2. Характеристика простого вещества (Ме/НеМе)
В
Бор
5
At
Астат
Только для элементов главных подгрупп!!!
В побочных подгруппах все элементы – металлы!!!
85
План характеристика
химического элемента
3.
 Сравнение свойств простого вещества со
Сравнение свойств простого вещества сосвойствами простых веществ – соседей по подгруппе
Цинк – элемент побочной подгруппы
Магний, кальций и стронций – элементы
главной подгруппы
Именно их и сравниваем:
Mg
Ca
Sr
3. Сравнение свойств простого вещества со
свойствами простых веществ – соседей по подгруппе
Z
Эн. Ур
e на вэу
R
ЭО
Вост. св
Заряд ядра
Число энергетических уровней
Число е на внешнем уровне
Радиус атома
Электроотрицательность
Восстановительные свойства
Ок. св
Окислительные свойства
Ме св
Металлические свойства
НеМе св
Неметаллические свойства
ВСО
Высшая степень окисления
Свойство усиливается
Значение увеличивается
Значение неизменно
Свойство ослабевает
Значение уменьшается
3. Сравнение свойств простого вещества со
свойствами простых веществ – соседей по подгруппе
Z
Эн. Ур
Mg
Mg
Ca
Ca
Sr
Sr
Mg
Ca
Sr
R
Mg
Ca
Sr
ЭО
Mg
Ca
Sr
Вост.
 св
свMg
Ca
Sr
Ок. св
Mg
Ca
Sr
Ме св
Mg
Ca
Sr
НеМе св
Mg
Ca
Sr
ВСО
Mg
Ca
Sr
e на вэу
Свойство усиливается
Значение увеличивается
Значение неизменно
Свойство ослабевает
Значение уменьшается
План характеристика
химического элемента
4. Сравнение свойств простого вещества со
свойствами простых веществ – соседей по периоду
Калий, кальций и скандий – элементы
одного периода
Именно их и сравниваем:
K
Ca
Sc
Вост. св
Ок. св
Ме св
НеМе св
Высшая степень окисления
Неметаллические свойства
Окислительные свойства
Металлические свойства
ЭО
Восстановительные свойства
R
Электроотрицательность
e на вэу
Радиус атома
Эн. Ур
Число е на внешнем уровне
Z
Число энергетических уровней
Заряд ядра
4. Сравнение свойств простого вещества со
свойствами простых веществ – соседей по периоду
ВСО
4.
 Сравнение свойств простого вещества со
Сравнение свойств простого вещества сосвойствами простых веществ – соседей по периоду
НеМе св
ВСО
Ca
Ca
Ca
Ca
Ca
Ca
K
K
K
K
K
Sc
Ме св
Sc
Ок. св
Sc
Вост. св
K
Sc
ЭО
Ca
Sc
R
K
Sc
e на вэу
Ca
Sc
Эн. Ур
K
Sc
Z
План характеристика
химического элемента
5. Состав высшего оксида, его характер (основный,
кислотный, амфотерный)
Доказательства основного характера высшего оксида
Доказательства кислотного характера высшего оксида
План характеристика
химического элемента
Например:
6. Состав высшего гидроксида, его характер
(кислородсодержащая кислота, основание, амфотерный
гидроксид)
Гидроксид Ме – основание
Гидроксид НеМе – кислородсодержащая кислота
Гидроксид Ме – амфотерный гидроксид
Са
степень окисления +2
Формула высшего гидроксида:
Са(ОН)2
S
ВСО +6
Формула высшего гидроксида:
h3SO4
Доказательства, что гидроксид – основание
Доказательства, что гидроксид – кислота
План характеристика
химического элемента
7.
 Состав летучего водородного соединения (НеМе)
Состав летучего водородного соединения (НеМе)24. Подготовка к с.р.
Работа на 15 минут1.
2.
3.
Дано распределение е в атоме. Определить элемент, записать формулы
высш.окс., гидроксида, ЛВС, указать характер и проиллюстрировать
Написать уравнения реакций простого вещества с тремя другими
простыми веществами. Составить электронный баланс. Указать
окислитель и восстановитель
Дан оксид. Дан перечень других веществ. Выяснить, с какими
веществами из перечня взаимодействует данный оксид. Записать
уравнения возможных реакций.
English Русский Правила
Характеристика химического элемента по положению его в ПСХЭ. Повторение и обобщение по теме «Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома»
Характеристика химического элемента по положению его в ПСХЭ. Повторение и обобщение по теме «Периодический закон и Периодическая система химических элементов Д.
 И. Менделеева. Строение атома»
И. Менделеева. Строение атома»
I. Периодический закон в свете теории строения атомов
| Понятие | Физ. смысл | Характеристика понятия |
| Заряд ядра | Равен порядковому номеру элемента | Основная характеристика элемента, определяет химические свойства, так как с ростом заряда ядра увеличивается количество электронов в атоме, в том числе и на внешнем уровне. Следовательно, изменяются свойства |
| Периодичность | С увеличением заряда ядра наблюдается периодическая повторяемость строения внешнего уровня, следовательно, периодически изменяются свойства (внешние электроны – валентные) |
II. Периодическая система в свете теории строения атома
| Понятие | Физ. смысл смысл |
Характеристика понятия |
| Порядковый номер |
Равен числу протоновв ядре. Равен числу электронов в атоме. |
|
| Период | Номер периода равен числу электронных оболочек |
Горизонтальный ряд элементов. 1,2,3 – малые; 4,5,6 – большие; 7 – незавершенный. В 1 периоде всего два элемента и больше быть не может. Это определяется формулой N = 2n2 Каждый период начинается щелочным металлом и заканчивается инертным газом. Первые два элемента любого периода s – элементы, последние шесть р – элементы, между ними d – и f – элементы. В периоде слева направо: 1.относит. атомная масса – увеличивается 2.заряд ядра – увеличивается 3.количество энерг. 4.кол-во электронов на внеш.уровне – увеличивается 5.радиус атомов – уменьшается 6.электроотрицательность – увеличивается Следовательно, внешние электроны удерживаются сильнее, и металлические свойства ослабевают, а неметаллические усиливаются В малых периодах этот переход происходит через 8 элементов, в больших – через 18 или 32. В малых периодах валентность увеличивается от 1 до 7 один раз, в больших – два раза. В том месте, где происходит скачок в изменении высшей валентности, период делится на два рядя. От периода к периоду происходит резкий скачок в изменении свойств элементов, так как появляется новый энергетический уровень. |
| Группа | Номер группы равен числу электронов на внешнем уровне (для элементов главных подгрупп) |
Вертикальный ряд элементов. Каждая группа делится на две подгруппы: главную и побочную. Главную подгруппу составляют s – ир – элементы, побочную -d – и f– элементы. Подгруппы объединяют наиболее сходные между собой элементы. В группе, в главной подгруппе сверху вниз: 1.относит. атомная масса – увеличивается 2.число электронов на внеш. уровне – постоянно 3.заряд ядра – увеличивается 4.кол – во энерг. уровней – увеличивается 5.радиус атомов – увеличивается 6.электроотрицательность – уменьшается. Следовательно, внешние электроны удерживаются слабее, и металлические свойства элементов усиливаются, неметаллические- ослабевают. Элементы некоторых подгрупп имеют названия: 1а группа – щелочные металлы 2а – щелочноземельные металлы 6а – халькогены 7а – галогены 8а – инертные газы (имеют завершённый внешний уровень) |
Выводы:
1. Чем меньше электронов на внешнем уровне и больше радиус атома, тем меньше электроотрицательность и легче отдавать внешние электроны, следовательно, тем сильнее выражены металлические свойства
Чем меньше электронов на внешнем уровне и больше радиус атома, тем меньше электроотрицательность и легче отдавать внешние электроны, следовательно, тем сильнее выражены металлические свойства
Чем больше электронов на внешнем уровне и меньше радиус атома, тем больше электроотрицательность и тем легче принимать электроны, следовательно, тем сильнее неметаллические свойства.
2. Для металлов характерна отдача электронов, для неметаллов – прием.
III. Особое положение водорода в периодической системе
Водород в периодической системе занимает две клетки (в одной из них заключен в скобки) – в 1 группе и в 7 – ой.
В первой группе водород стоит потому, что у него, как и у элементов первой группы, на внешнем уровне один электрон.
В седьмой группе водород стоит потому, что у него, как и у элементов седьмой группы, до завершения энергетического уровня.
IV. План – алгоритм характеристики элемента по его положению в ПСХЭ Д. И. Менделеева
1. Название
Название
2.Химический знак
3.Порядковый номер
4.Номер периода (большой 4-7 или малый 1-3)
5.Номер группы, подгруппа (главная «А» или побочная «Б»)
6.Состав атома: число электронов, число протонов, число нейтронов
Подсказка!
Число электронов = числу протонов = порядковому номеру;
Число нейтронов = атомная масса (Ar
7. Вид элемента (s, p, d, f)
Подсказка!
s-элементы: это первые два элемента в 1-7 периодах;
p-элементы: последние шесть элементов1-6 периодов;
d-элементы: это элементы больших периодов (по 10 штук) между s– и p-элементами;
f-элементы: это элементы 6 и 7 периодов – лантаноиды и актиноиды, они вынесены вниз таблицы.
8.Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня.
Подсказка! Внешний уровень завершён у элементов VIII группы главной подгруппы “А” – Ne, Ar, Kr, Xe, Rn.
Подсказка! Для написания схемы нужно знать следующее:
Заряд ядра атома = порядковому номеру атома;
Число энергетических уровней определяют по номеру периода, в котором находится элемент;
У s– и p-элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент.
Например, Na+11)2)8)1=номеру группы
У d– элементов на последнем уровне число электронов всегда равно 2 (исключения – хром, медь, серебро, золото и некоторые другие на последнем уровне содержат 1 электрон).
Например, Ti+22)2)8)10)2 ; Cr++24)2)8)13)1 – исключение
Максимальное возможное число электронов на уровнях определяют по формуле Nэлектронов = 2n2, где n – номер энергоуровня.
Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV – 32 электрона и т.д.
9.Электронная и электронно-графическая формулы строения атома
Подсказка!
Для написания электронной формулы используйте шкалу энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
Помните! На s – орбитали максимум может быть 2 электрона, на p – 6, на d – 10, на f – 14 электронов.
Например, +11Na 1s22s22p63s1; +22Ti 1s22s22p63s23p64s23d2
10.Металл или неметалл
Подсказка!
К неметаллам относятся: 2 s-элемента – водород и гелий и 20 p-элементов – бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат и радон.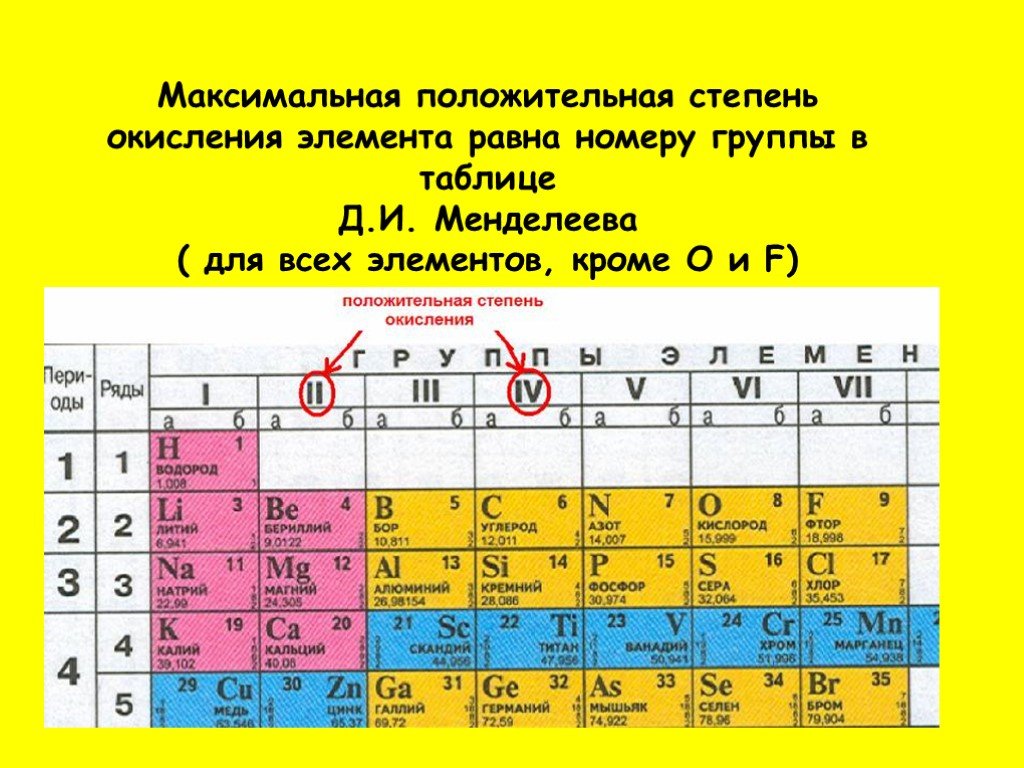
К металлам относятся: все d– и f-элементы, все s-элементы (исключения водород и гелий), некоторые p-элементы.
11.Высший оксид (только для s, p)
Подсказка!
Общая формула высшего оксида дана под группой химических элементов (R2O, RO и т.д.)
12.Летучее водородное соединение (только для s, p)
Подсказка!
Общая формула летучего водородного соединения дана под группой химических элементов (RH4, RH3 и т.д.) – только для элементов 4 -8 групп.
V. Задание для самостоятельной работы
Дайте характеристику следующим элементам по плану: кальций, фосфор, медь.
План характеристики химического элемента по его положению в Периодической системе элементов Д. И. Менделеева
И. Менделеева
VI. Тренажеры
Тренажёр №1 “Характеристика элемента металла по его положению в Периодической системе элементов Д. И. Менделеева”
Тренажёр №2 “Характеристика элемента неметалла по его положению в Периодической системе элементов Д. И. Менделеева”
Тренажёр №3. Интерактивное упражнение для контроля и самопроверки на строение атомов элементов
«Лабиринт по периодической системе химических элементов Д.И.Менделеева»
Необходимо найти верный путь к финишу, отмечая его последовательно цифрами, начиная с 1. (Подсказка: количество ходов – 9.)
Игра-лабиринт №2
Домашнее задание
Количество коротких периодов в таблице Менделеева: (A) 2(B) 3(C) 4(D) 1
Ответ
Проверено
198.3k+ просмотров
Подсказка: Во-первых, мы должны понять, что именно Период – это расположение в периодической таблице элементов с одинаковым количеством оболочек в их естественном или нейтральном состоянии. Сейчас в периодической таблице Менделеева в качестве критерия считается атомный вес, и соответственно используются и элементы. В окончательной форме таблицы в таблице 7 строк и 8 столбцов.
Сейчас в периодической таблице Менделеева в качестве критерия считается атомный вес, и соответственно используются и элементы. В окончательной форме таблицы в таблице 7 строк и 8 столбцов.
Полный шаг за шагом Ответ:
Во-первых, нам нужно знать, что такое период:
Любой период в современной периодической таблице относится к ряду химических элементов с одной и той же конечной оболочкой. Это означает, что все элементы в ряду должны иметь одинаковое количество электронных оболочек.
Период номер 1, 2 и 3 содержит 2, 8 и 8 элементов соответственно. Другие периоды содержат более 8 элементов в своем периоде. Это потому, что первые три периода называются короткими периодами. Следовательно, в периодической таблице Менделеева всего 3 коротких периода.
Он использует атомный вес в качестве критерия для организации элементов. Определяемая информация считается справедливой точностью в то время, поскольку она была основным критерием. Теперь этот атомный вес также работал достаточно хорошо, чтобы Менделеев мог точно предсказать свойства отсутствующих элементов.
Теперь, согласно менделеевской форме периодической таблицы, видно, что в длинной форме таблицы всего 7 периодов, из которых в периодической таблице Менделеева всего 3 коротких периода.
Следовательно, правильным вариантом является вариант B.
Примечание:
Русский профессор химии Дмитрий Менделеев и немецкий химик Юлиус Лотар Мейер независимо друг от друга опубликовали свои периодические таблицы в 1869 и 1870 годах соответственно. Таблица Менделеева от 1 марта 1869 года была его первой опубликованной версией. Таблица Мейера была расширенной версией его (Мейера) таблицы 1864 года.0003
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Тенденции сомнений
Понимание тенденций атомного радиуса: 2 ключевых принципа
Нужна информация о тенденциях атомного радиуса? Какова тенденция атомного радиуса? В этом руководстве мы подробно объясним тренды атомного радиуса и то, как они работают.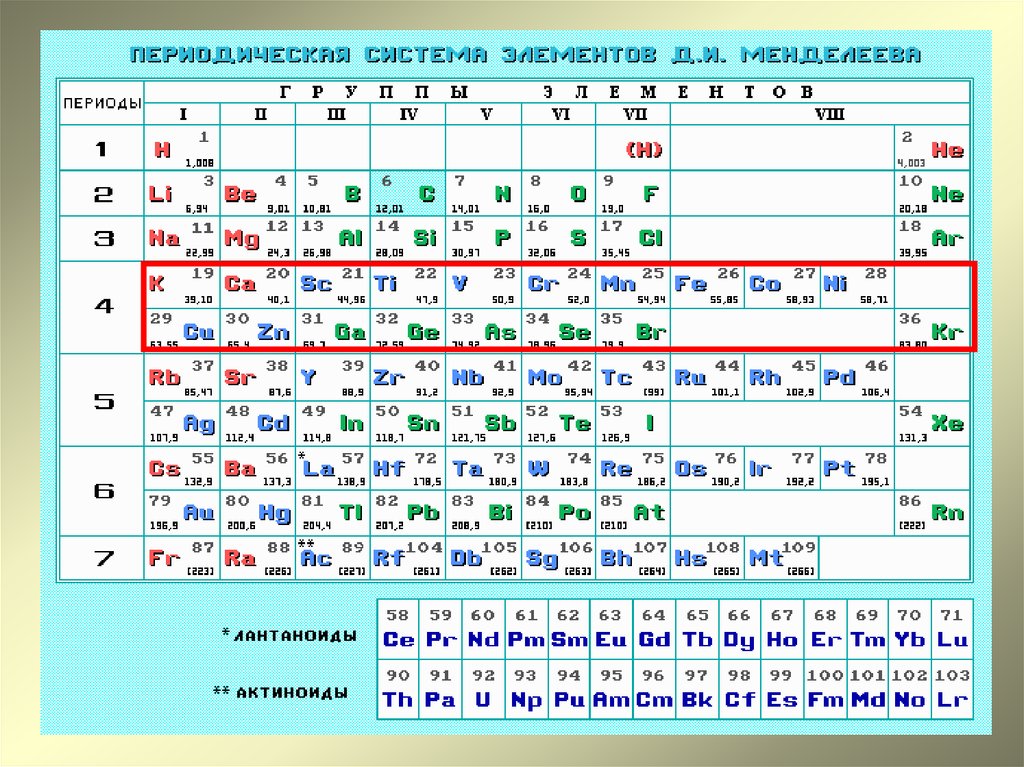 Мы также обсудим исключения из тенденций и то, как вы можете использовать эту информацию как часть более широкого понимания химии.
Мы также обсудим исключения из тенденций и то, как вы можете использовать эту информацию как часть более широкого понимания химии.
Прежде чем мы углубимся в тенденции атомного радиуса, давайте рассмотрим некоторые основные термины. Атом — это основная единица химического элемента, такого как водород, гелий, калий и т. д. Радиус — это расстояние между центром объекта и его внешним краем.
Атомный радиус равен половине расстояния между ядрами двух атомов. Атомные радиусы измеряются в пикометрах (один пикометр равен одной триллионной части метра). Водород (H) имеет наименьший средний атомный радиус около 25 часов, в то время как цезий (Cs) имеет самый большой средний радиус около 260 часов.
Каковы тренды атомного радиуса? Что их вызывает?
Существуют две основные тенденции атомного радиуса. Одна тенденция атомного радиуса возникает при перемещении слева направо по периодической таблице (движение в пределах периода), а другая тенденция возникает при движении сверху вниз по периодической таблице (движение внутри группы).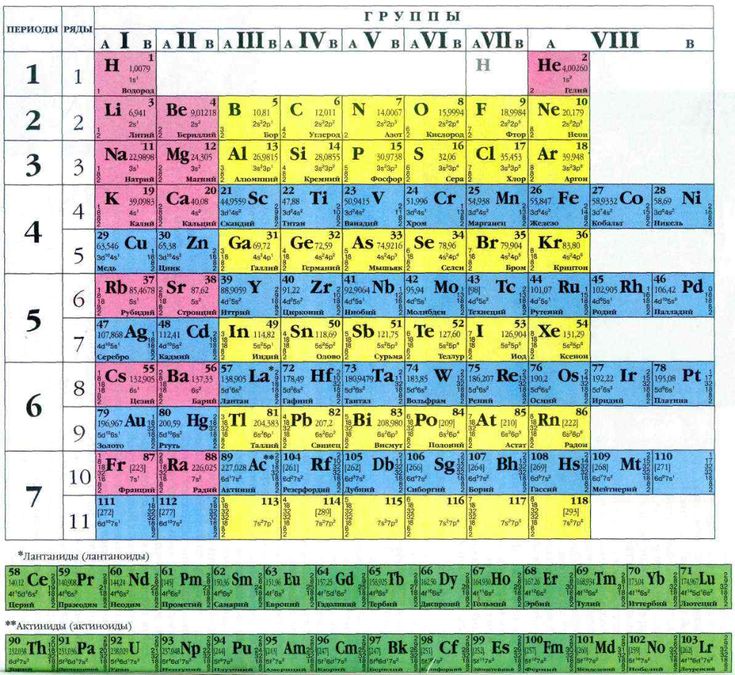 Ниже приведена периодическая таблица со стрелками, показывающая, как изменяются атомные радиусы , чтобы помочь вам понять и визуализировать каждую тенденцию атомного радиуса. В конце этого раздела находится диаграмма с расчетным эмпирическим атомным радиусом для каждого элемента.
Ниже приведена периодическая таблица со стрелками, показывающая, как изменяются атомные радиусы , чтобы помочь вам понять и визуализировать каждую тенденцию атомного радиуса. В конце этого раздела находится диаграмма с расчетным эмпирическим атомным радиусом для каждого элемента.
Тенденция атомного радиуса 1: Уменьшение атомного радиуса слева направо в течение периода
Первая периодическая тенденция атомного радиуса заключается в том, что размер атома уменьшается по мере движения слева направо в течение периода. В периоде элементов каждый новый электрон добавляется к одной и той же оболочке. Когда добавляется электрон, к ядру также добавляется новый протон, что придает ядру более сильный положительный заряд и большее ядерное притяжение.
Это означает, что по мере добавления протонов ядро получает более сильный положительный заряд, который сильнее притягивает электроны и притягивает их ближе к ядру атома. Электроны притягиваются ближе к ядру, уменьшая радиус атома.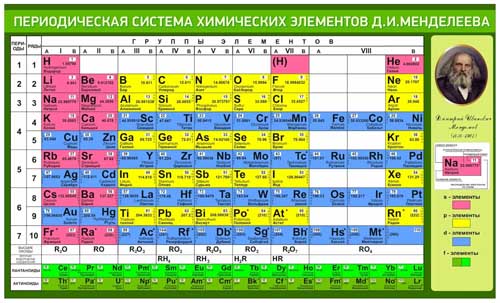
Сравнивая углерод (C) с атомным номером 6 и фтор (F) с атомным номером 9, мы можем сказать, что, основываясь на трендах атомного радиуса, атом углерода будет иметь больший радиус, чем атом фтора. , так как три дополнительных протона, которые есть у фтора, притягивают его электроны ближе к ядру и уменьшают радиус фтора. И это правда; углерод имеет средний атомный радиус около 70 пм, а фтор — около 50 пм.
Тенденция 2 атомного радиуса: атомные радиусы увеличиваются по мере продвижения вниз по группе
Вторая периодическая тенденция атомного радиуса заключается в том, что атомных радиусов увеличиваются по мере того, как вы перемещаетесь вниз по группе в периодической таблице. Для каждой группы, которую вы перемещаете вниз, атом получает дополнительную электронную оболочку. Каждая новая оболочка находится дальше от ядра атома, что увеличивает радиус атома.
Хотя вы можете подумать, что валентные электроны (находящиеся во внешней оболочке) будут притягиваться к ядру, экранирование электронов предотвращает это. Экранирование электронов относится к уменьшению притяжения между внешними электронами и ядром атома всякий раз, когда атом имеет более одной электронной оболочки. Итак, из-за электронного экранирования валентные электроны не подходят особенно близко к центру атома, и поскольку они не могут подобраться так близко, атом имеет больший радиус.
Экранирование электронов относится к уменьшению притяжения между внешними электронами и ядром атома всякий раз, когда атом имеет более одной электронной оболочки. Итак, из-за электронного экранирования валентные электроны не подходят особенно близко к центру атома, и поскольку они не могут подобраться так близко, атом имеет больший радиус.
Например, калий (K) имеет больший средний атомный радиус (220 пм), чем натрий (Na) (180 пм). Атом калия имеет дополнительную электронную оболочку по сравнению с атомом натрия, что означает, что его валентные электроны находятся дальше от ядра, что дает калию больший атомный радиус.
Эмпирические атомные радиусы
| Атомный номер | Символ | Имя элемента | Эмпирический атомный радиус (пм) |
| 1 | Х | Водород | 25 |
| 2 | Он | Гелий | Нет данных |
| 3 | Ли | Литий | 145 |
| 4 | Быть | Бериллий | 105 |
| 5 | Б | Бор | 85 |
| 6 | С | Углерод | 70 |
| 7 | Н | Азот | 65 |
| 8 | О | Кислород | 60 |
| 9 | Ф | Фтор | 50 |
| 10 | Не | Неон | Нет данных |
| 11 | Нет | Натрий | 180 |
| 12 | мг | Магний | 150 |
| 13 | Ал | Алюминий | 125 |
| 14 | Си | Кремний | 110 |
| 15 | Р | Фосфор | 100 |
| 16 | С | Сера | 100 |
| 17 | Кл | Хлор | 100 |
| 18 | Ар | Аргон | Нет данных |
| 19 | К | Калий | 220 |
| 20 | Са | Кальций | 180 |
| 21 | Sc | Скандий | 160 |
| 22 | Ти | Титан | 140 |
| 23 | В | Ванадий | 135 |
| 24 | Кр | Хром | 140 |
| 25 | Мн | Марганец | 140 |
| 26 | Фе | Железо | 140 |
| 27 | Ко | Кобальт | 135 |
| 28 | Ni | Никель | 135 |
| 29 | Медь | Медь | 135 |
| 30 | Цинк | Цинк | 135 |
| 31 | Га | Галлий | 130 |
| 32 | Гэ | Германий | 125 |
| 33 | Как | Мышьяк | 115 |
| 34 | Se | Селен | 115 |
| 35 | Бр | Бром | 115 |
| 36 | Кр | Криптон | Нет данных |
| 37 | руб | Рубидий | 235 |
| 38 | Старший | Стронций | 200 |
| 39 | Д | Иттрий | 180 |
| 40 | Цр | Цирконий | 155 |
| 41 | № | Ниобий | 145 |
| 42 | Пн | Молибден | 145 |
| 43 | ТК | Технеций | 135 |
| 44 | Ру | Рутений | 130 |
| 45 | Рх | Родий | 135 |
| 46 | Пд | Палладий | 140 |
| 47 | Аг | Серебро | 160 |
| 48 | CD | Кадмий | 155 |
| 49 | В | Индий | 155 |
| 50 | Сн | Олово | 145 |
| 51 | Сб | Сурьма | 145 |
| 52 | Те | Теллур | 140 |
| 53 | я | Йод | 140 |
| 54 | Хе | Ксенон | Нет данных |
| 55 | цезий | Цезий | 260 |
| 56 | Ба | Барий | 215 |
| 57 | Ла | Лантан | 195 |
| 58 | Се | Церий | 185 |
| 59 | Пр | Празеодим | 185 |
| 60 | Нд | Неодим | 185 |
| 61 | вечера | Прометий | 185 |
| 62 | См | Самарий | 185 |
| 63 | ЕС | Европий | 185 |
| 64 | Гд | Гадолиний | 180 |
| 65 | Тб | Тербий | 175 |
| 66 | Дай | Диспрозий | 175 |
| 67 | Хо | Гольмий | 175 |
| 68 | Er | Эрбий | 175 |
| 69 | Тм | Тулий | 175 |
| 70 | Ыб | Иттербий | 175 |
| 71 | Лу | Лютеций | 175 |
| 72 | Хф | Гафний | 155 |
| 73 | Та | Тантал | 145 |
| 74 | Вт | Вольфрам | 135 |
| 75 | Ре | Рений | 135 |
| 76 | Ос | Осмий | 130 |
| 77 | Ир | Иридий | 135 |
| 78 | Пт | Платина | 135 |
| 79 | Золото | Золото | 135 |
| 80 | рт. ст. ст. | Меркурий | 150 |
| 81 | Тл | Таллий | 190 |
| 82 | Пб | Свинец | 180 |
| 83 | Би | Висмут | 160 |
| 84 | По | Полоний | 190 |
| 85 | В | Астатин | Нет данных |
| 86 | Р-н | Радон | Нет данных |
| 87 | Пт | Франций | Нет данных |
| 88 | Ра | Радий | 215 |
| 89 | Ас | Актиний | 195 |
| 90 | Т | Торий | 180 |
| 91 | Па | Протактиний | 180 |
| 92 | У | Уран | 175 |
| 93 | Нп | Нептуний | 175 |
| 94 | Пу | Плутоний | 175 |
| 95 | Ам | Америций | 175 |
| 96 | См | Кюриум | Нет данных |
| 97 | Бк | Берклиум | Нет данных |
| 98 | См. | Калифорния | Нет данных |
| 99 | Эс | Эйнштейний | Нет данных |
| 100 | ФМ | Фермиум | Нет данных |
| 101 | Мд | Менделевий | Нет данных |
| 102 | № | Нобелий | Нет данных |
| 103 | Лр | Лоуренсиум | Нет данных |
| 104 | Рф | Резерфордий | Нет данных |
| 105 | Дб | Дубниум | Нет данных |
| 106 | Сг | Сиборгиум | Нет данных |
| 107 | Бх | Борий | Нет данных |
| 108 | Гс | Хассиум | Нет данных |
| 109 | Мт | Мейтнерий | Нет данных |
| 110 | Дс | Дармштадтиум | Нет данных |
| 111 | Рг | рентгений | Нет данных |
| 112 | Сп | Коперниций | Нет данных |
| 113 | Нх | Нихоний | Нет данных |
| 114 | Фл | Флеровиум | Нет данных |
| 115 | Мк | Московиум | Нет данных |
| 116 | ур.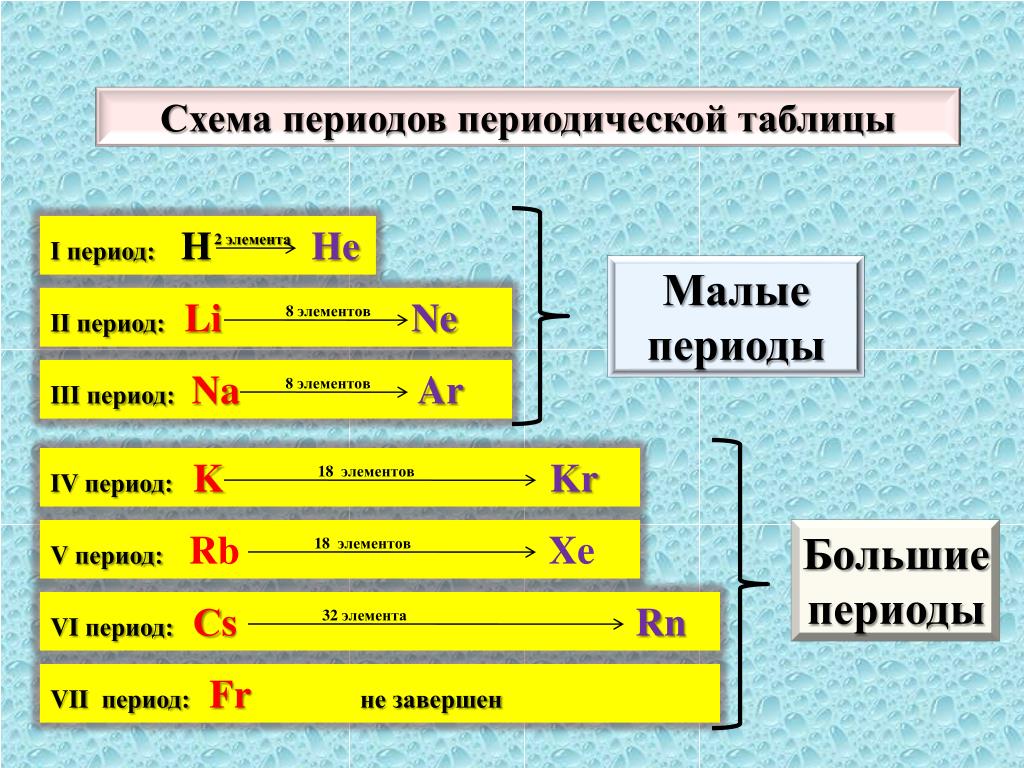 | Ливермориум | Нет данных |
| 117 | Ц | Теннесси | Нет данных |
| 118 | Ог | Оганесон | Нет данных |
Источник: Webelements
3 Исключения из трендов атомного радиуса
Два тренда атомного радиуса, которые мы обсуждали выше, верны для большинства элементов Периодической таблицы элементов. Однако есть несколько исключений из этих тенденций.
Единственным исключением являются инертные газы. Шесть благородных газов в группе 18 периодической таблицы: гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). Благородные газы являются исключением, потому что они связываются иначе, чем другие атомы, и атомы благородных газов не становятся так близко друг к другу, когда они связываются. Поскольку атомный радиус составляет половину расстояния между ядрами и двух атомов , то, насколько близко эти атомы друг к другу, влияет на атомный радиус.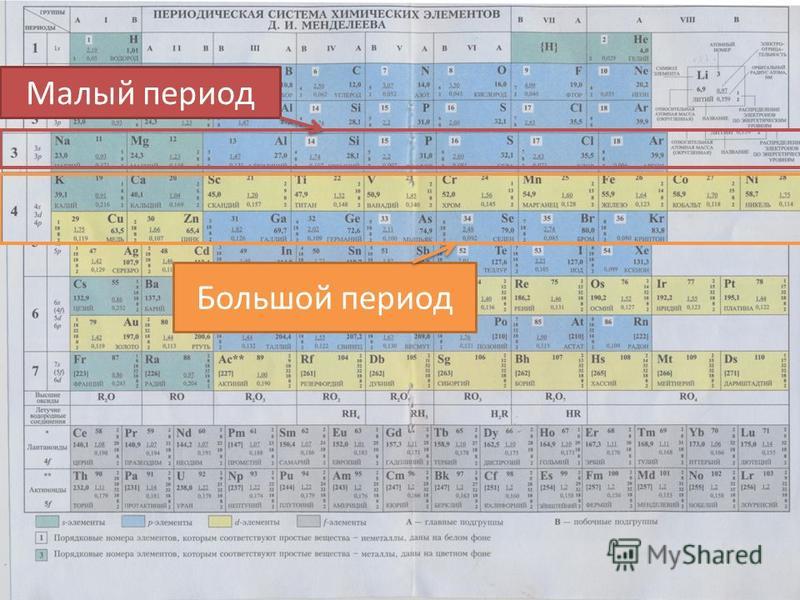
У каждого из благородных газов внешняя электронная оболочка полностью заполнена, что означает, что атомов благородных газов удерживаются вместе силами Ван-дер-Ваальса, а не посредством связей. Силы Ван-дер-Ваальса не так прочны, как ковалентные связи, поэтому два атома, соединенные силами Ван-дер-Ваальса, не подходят друг к другу так близко, как два атома, соединенных ковалентной связью. Это означает, что радиусы благородных газов будут завышены, если мы попытаемся найти их эмпирические радиусы, поэтому ни один из благородных газов не имеет эмпирического радиуса и, таким образом, не следует тенденциям атомного радиуса.
Ниже приведена очень упрощенная схема четырех атомов примерно одинакового размера. Два верхних атома связаны ковалентной связью, что приводит к некоторому перекрытию между атомами. Два нижних атома — это атомы благородных газов, и они связаны силами Ван-дер-Ваальса, которые не позволяют атомам сблизиться друг с другом. Красные стрелки обозначают расстояние между ядрами. Половина этого расстояния равна радиусу атома. Как видите, хотя все четыре атома имеют примерно одинаковый размер, радиус инертного газа намного больше, чем радиус других атомов. При сравнении двух радиусов атомы инертных газов кажутся больше, хотя это не так. Включение радиусов благородных газов дало бы людям неточное представление о том, насколько велики атомы благородных газов. Поскольку атомы благородных газов связываются по-разному, их радиусы нельзя сравнивать с радиусами других атомов, поэтому они не следуют тенденциям атомного радиуса.
Красные стрелки обозначают расстояние между ядрами. Половина этого расстояния равна радиусу атома. Как видите, хотя все четыре атома имеют примерно одинаковый размер, радиус инертного газа намного больше, чем радиус других атомов. При сравнении двух радиусов атомы инертных газов кажутся больше, хотя это не так. Включение радиусов благородных газов дало бы людям неточное представление о том, насколько велики атомы благородных газов. Поскольку атомы благородных газов связываются по-разному, их радиусы нельзя сравнивать с радиусами других атомов, поэтому они не следуют тенденциям атомного радиуса.
Другие исключения включают ряды лантанидов и актиноидов в нижней части периодической таблицы. Эти группы элементов отличаются от большей части остальной части таблицы Менделеева и не следуют многим тенденциям, как другие элементы. Ни один из рядов не имеет четкой тенденции атомного радиуса.
Как вы можете использовать эту информацию?
Хотя вам, вероятно, не понадобится знать атомный радиус различных элементов в повседневной жизни, эта информация все же может быть полезна, если вы изучаете химию или другую смежную область. Как только вы поймете каждую ключевую тенденцию периода атомного радиуса, вам будет легче понять другую информацию об элементах.
Как только вы поймете каждую ключевую тенденцию периода атомного радиуса, вам будет легче понять другую информацию об элементах.
Например, вы можете помнить, что благородные газы являются исключением из тенденций атомного радиуса, поскольку они имеют полную внешнюю электронную оболочку. Эти внешние электронные оболочки также делают благородные газы инертными и стабильными. Эта стабильность может быть удобной. Например, воздушные шары обычно наполняют гелием, а не водородом, потому что гелий гораздо более стабилен и, следовательно, менее воспламеняем и безопаснее в использовании.
Вы также можете использовать атомные радиусы, чтобы оценить, насколько реактивными будут различные элементы. Атомы с меньшим радиусом более реакционноспособны, чем атомы с большим радиусом. Галогены (в группе 17) имеют наименьшие средние радиусы в периодической таблице. Фтор имеет наименьший атомный радиус галогенов (что имеет смысл, исходя из тенденций), и это делает его очень реакционноспособным. Простое добавление фтора в воду вызовет пламя, поскольку фтор превращается в газ.
Простое добавление фтора в воду вызовет пламя, поскольку фтор превращается в газ.
Резюме: периодические тренды атомного радиуса
Существуют два основных тренда атомного радиуса. Первая периодическая тенденция атомного радиуса состоит в том, что атомные радиусы увеличиваются по мере того, как вы двигаетесь вниз в группе. Это происходит из-за электронного экранирования. Когда добавляется дополнительная оболочка, эти новые электроны оказываются дальше от ядра атома, что увеличивает радиус атома. Вторая периодическая тенденция атомного радиуса заключается в том, что размер атома уменьшается слева направо по периоду , потому что более сильный положительный заряд атома из-за большего количества протонов сильнее притягивает электроны и притягивает их ближе к ядру, уменьшая размер атома. .
Есть несколько исключений из этих тенденций, в частности благородные газы, которые не образуют связей, как это делают большинство других атомов, а также ряды лантанидов и актинидов. Вы можете использовать эту информацию, чтобы лучше понять периодическую таблицу, как связаны атомы и почему одни элементы более реакционноспособны, чем другие.
Вы можете использовать эту информацию, чтобы лучше понять периодическую таблицу, как связаны атомы и почему одни элементы более реакционноспособны, чем другие.
Что дальше?
Хотите освежить знания по молекулярной химии? Рассмотрите различные виды гидратов, как работает электроотрицательность, а также использование (и ограничения) атомной модели Бора.
Изучаю химию и нуждаюсь в помощи? У нас есть учебные пособия для AP Chem и IB Chemistry, а также общий обзор Regents Chemistry для учащихся средних школ Нью-Йорка.
Погружаетесь в удивительный мир биохимии? Узнайте о шести типах ферментов и химическом составе нуклеотидов.
Нужна дополнительная помощь по этой теме? Проверьте Tutorbase!
Наша проверенная база данных репетиторов включает ряд опытных преподавателей, которые могут помочь вам отшлифовать эссе по английскому языку или объяснить, как производные работают для исчисления. Вы можете использовать десятки фильтров и критериев поиска, чтобы найти идеального человека для ваших нужд.

 уровней – постоянно
уровней – постоянно