Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.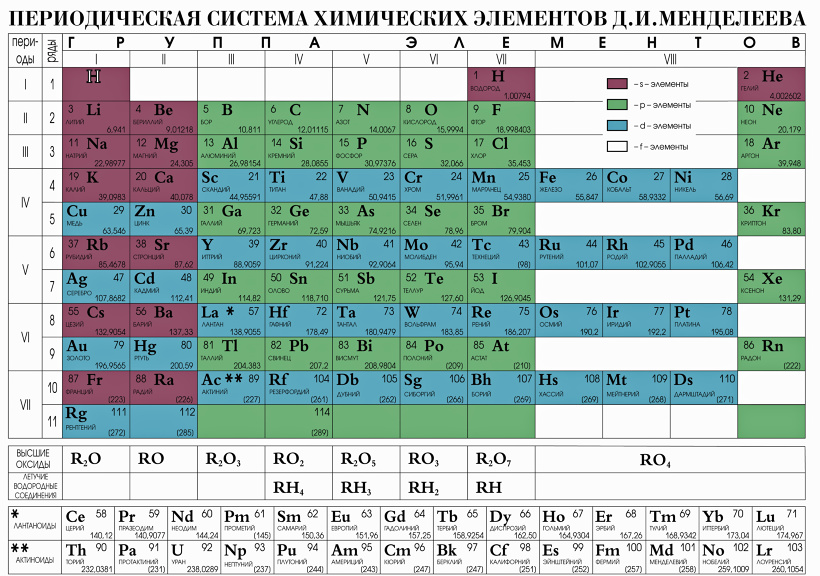
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Таблица Д. И. Менделеева
Бром- при нормальных условиях является тяжёлой едкой жидкостью красно-бурого цвета с сильным неприятным запахом. Ядовит.
Бром был независимо открыт двумя химиками: Карлом Якобом Лёвихом (нем. Carl Jacob Löwig) в 1825 году, и Антуаном Жеромом Баларом в 1826 году. Открытие Балара, молодого преподавателя колледжа города Монпелье, сделало его имя известным всему миру. Название элемента происходит от др.-греч. βρῶμος — «дурной запах, зловоние».
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Существует широко распространенная городская легенда о том, что в армии, местах лишения свободы и психиатрических больницах будто бы добавляют соединения брома в еду для снижения полового влечения. Происхождение этого мифа неизвестно.
Название элемента происходит от др.-греч. βρῶμος — «дурной запах, зловоние».
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Существует широко распространенная городская легенда о том, что в армии, местах лишения свободы и психиатрических больницах будто бы добавляют соединения брома в еду для снижения полового влечения. Происхождение этого мифа неизвестно.
AgBr — бромид серебра(I)
AgBrO3 — бромат серебра
Ag3Br2 — дибромид серебра
Ag3Br3 — трибромид серебра(III)
AlBr — монобромид алюминия
AlBr3 — трибромид алюминия
Al2Br6 — гексабромид диалюминия
AsBrO — оксобромид мышьяка(III)
AsBr3 — трибромид мышьяка
AuBr — бромид золота(I)
AuBr3 — бромид золота(III)
BBr3 — бромид бора
Ba(BrO3)2·H2O — моногидрат бромата бария
Ba(BrO3)2·2H2O — дигидрат бромата бария
BaBr2 — бромид бария
BeBr2 — бромид бериллия
BiBr3 — бромид висмута(III)
BrCl — хлорид брома
BrO3− — бромат
Br2 — бром
CH3CH2Br — бромэтан
C2H5Br — бромэтан
C4
C4H7BrO2 — 4-броммасляная кислота
C4H7BrO2 — α-бромизомасляная кислота
C4H7BrO2 — этилбромацетат
CaBr2 — бромид кальция
CdBr2 — бромид кадмия
CeBr3 — бромид церия(III)
CoBr2 — бромид кобальта(II)
CrBr2 — бромид хрома(II)
CrBr3 — бромид хрома(III)
CsBr — бромид цезия
CsBrO3 — бромат цезия
CsBr3
CuBr — бромид меди(I)
Cu(BrO3)2 · 6H2O — гексагидрат бромата меди(II)
CuBr2 — бромид меди(II)
GaBr3 — бромид галлия
GeBr4 — бромид германия
HBr — бромоводород
HfBr4 — бромид гафния(IV)
Hg(BrO3)2 · 2H2O — дигидрат бромата ртути(II)
HgBr2 — бромид ртути(II)
Hg2Br2 — бромид ртути(I)
IBr — бромид иода(I)
IBr3 — бромид иода(III)
InBr — бромид индия(I)
InBrI2 — бромдииодид индия(III)
InBr2I — дибромиодид индия(III)
InBr3 — бромид индия(III)
LiBr — Бромид лития
LiBrO3 — Бромат лития
LiBr — Бромид лития
LiBrO3 — Бромат лития
MnBr2 — Бромид марганца(II)
MoBr2 — Бромид молибдена(II)
MoBr3 — Бромид молибдена(III)
HgBr — Бромид ртути(I)
NH4Br — бромид аммония
NaBr — бромид натрия
NbBr5 — бромид ниобия(V)
NiBr2 — бромид никеля(II)
NiBr2 · 3H2O
NiBr2 · 6H2O — nickel(II) bromide – hexahydrate
PtBr2 — platinum(II) bromide
PtBr4 — platinum(IV) bromide
[Pt(NH2CH2CH2NH2)3]Br4 — tris(ethylenediamine)platinum(IV) bromide
[Pt(NH3)2(H2O)2Cl2]Br2 — diamminediaquadichloroplatinum(VI) bromide
RbBr — rubidium bromide
S2Br2 — sulfur(II) bromide
SbBr3 — antimony(III) bromide
SeBr4 — selenium(IV) bromide
SiBr
SnBrCl3 — tin(IV) bromotrichloride
SnBr2 — tin(II) bromide
SnBr2Cl2 — tin(IV) dibromodichloride
SnBr3Cl — tin(IV) tribromochloride
SnBr4 — tin(IV) bromide
SrBr2 — strontium bromide
SrBr2·6H2O — strontium bromide – hexahydrate
TaBr3 — бромид тантала (III)
TaBr5 — бромид тантала (V)
TeBr2 — tellurium(II) bromide
TeBr4 — tellurium(IV) bromide
TiBr4 — titanium(IV) bromide
TlBr — thallium(I) bromide
TlBr3 — thallium(III) bromide
VBr2 — Бромид ванадия(II)
VBr3 — Бромид ванадия(III)
WBr2 — бромид вольфрама(II)
WBr3 — бромид вольфрама(III)
WBr4 — бромид вольфрама(IV)
WBr5 — бромид вольфрама(V)
WBr6 — бромид вольфрама(VI)
WOBr3 — трибромооксид вольфрама(V)
WOBr4 — тетрабромооксид вольфрама(VI)
WO2Br2 — диоксид-дибромид вольфрама(VI)
YBr3 — Бромид иттрия
YbBr2 — Бромид иттербия(II)
YbBr3 — Бромид иттербия(III)
ZnBr2 — бромид цинка
ZrBr4 — бромид циркония
Бром | Свойства, использование и факты
бром
Смотреть все СМИ
- Ключевые люди:
- Антуан-Жером Балар Виктор Мейер
- Похожие темы:
- химический элемент галоген
См.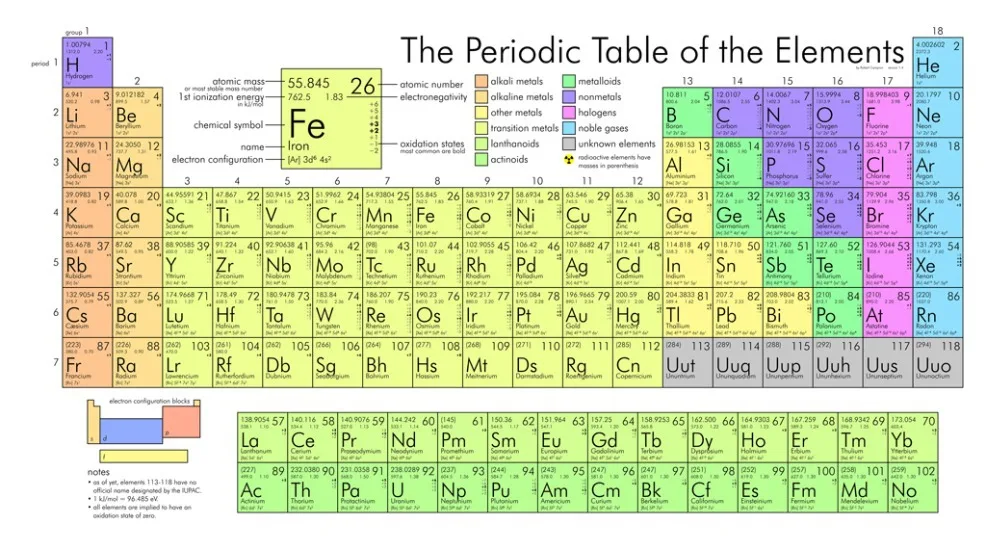 все связанные материалы →
все связанные материалы →
бром (Br) , химический элемент, темно-красная ядовитая жидкость, член группы галогенов или группы 17 (группа VIIa) периодической таблицы.
| atomic number | 35 |
|---|---|
| atomic weight | [79.901, 79.907] |
| melting point | −7.2 °C (19 °F) |
| boiling точка | 59 °C (138 °F) |
| удельный вес | 3,12 при 20 °C (68 °F) |
| степени окисления | −1, +51, +3, +3 7 |
| электронная конфигурация | (AR) 3 D 10 4 S 2 4 P 5 |
ИСТОРИЯ
. остатки (горечь) от производства морской соли в Монпелье. Он освободил элемент, пропуская хлор через водный раствор остатков, который содержал бромид магния. Перегонка материала с диоксидом марганца и серной кислотой дала красные пары, которые конденсировались в темную жидкость. Сходство этой процедуры с процедурой получения хлора навело Балара на мысль, что он получил новый элемент, подобный хлору. (Немецкий химик Юстус фон Либих, по-видимому, получил этот элемент раньше Балара, но он ошибочно принял его за хлорид йода.) Из-за неприятного запаха этого элемента Французская академия наук предложила название бром от греческого слова bromos , что означает «неприятный запах» или «вонь».
Перегонка материала с диоксидом марганца и серной кислотой дала красные пары, которые конденсировались в темную жидкость. Сходство этой процедуры с процедурой получения хлора навело Балара на мысль, что он получил новый элемент, подобный хлору. (Немецкий химик Юстус фон Либих, по-видимому, получил этот элемент раньше Балара, но он ошибочно принял его за хлорид йода.) Из-за неприятного запаха этого элемента Французская академия наук предложила название бром от греческого слова bromos , что означает «неприятный запах» или «вонь».
Наличие и распространение
Бром, редкий элемент, встречается в природе в рассеянном виде по всей земной коре только в виде растворимых и нерастворимых бромидов. Некоторое обогащение происходит в океанской воде (65 частей на миллион по весу), в Мертвом море (приблизительно 5 граммов на литр [0,7 унции на галлон]), в некоторых термальных источниках и в редких нерастворимых минералах бромида серебра (таких как бромирит, встречается в Мексике и Чили). Природные месторождения солей и рассолы являются основными источниками брома и его соединений. Иордания, Израиль, Китай и Соединенные Штаты лидировали в мире по производству брома в начале 21 века; другие важные страны-производители брома в этот период включают Японию, Украину и Индию.
Природные месторождения солей и рассолы являются основными источниками брома и его соединений. Иордания, Израиль, Китай и Соединенные Штаты лидировали в мире по производству брома в начале 21 века; другие важные страны-производители брома в этот период включают Японию, Украину и Индию.
Бром природный представляет собой смесь двух стабильных изотопов: брома-79 (50,54%) и брома-81 (49,46%). Из 17 известных радиоактивных изотопов элемента бром-77 имеет самый длительный период полураспада (57 часов).
Викторина «Британника»
Викторина «118 названий и символов периодической таблицы»
Физические и химические свойства
Свободный бром представляет собой красновато-коричневую жидкость с заметным давлением паров при комнатной температуре. Пары брома имеют янтарный цвет. Бром имеет резкий запах и раздражает кожу, глаза и дыхательную систему. Воздействие паров концентрированного брома даже на короткое время может привести к летальному исходу. Как и другие галогены, бром существует в виде двухатомных молекул во всех агрегатных состояниях.
Как и другие галогены, бром существует в виде двухатомных молекул во всех агрегатных состояниях.
Около 3,41 грамма (0,12 унции) брома растворяется в 100 мл (0,1 кварты) воды при комнатной температуре. Раствор известен как бромная вода. Подобно хлорной воде, это хороший окислитель, и он более полезен, потому что не так легко разлагается. Он высвобождает свободный йод из йодидсодержащих растворов и серу из сероводорода. Сернистая кислота окисляется бромной водой до серной кислоты. На солнечном свету бромная вода разлагается с выделением кислорода, как в следующем уравнении:
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться
Из бромной воды можно выделить гидрат (клатрат), который содержит 172 молекулы воды и 20 полостей, способных вместить молекулы брома. Бром растворяется в водных растворах гидроксидов щелочных металлов, давая бромиды, гипобромиты или броматы, в зависимости от температуры. Бром легко извлекается из воды органическими растворителями, такими как четыреххлористый углерод, хлороформ или сероуглерод, в которых он хорошо растворим. В органических растворителях дает оранжевый раствор.
В органических растворителях дает оранжевый раствор.
Сродство к электрону брома высокое и такое же, как у хлора. Однако он является менее сильным окислителем, главным образом из-за более слабой гидратации бромид-иона по сравнению с хлорид-ионом. Точно так же связь металл-бром слабее, чем соответствующая связь металл-хлор, и это различие отражается в химической активности брома, которая находится между реакционной способностью хлора и йода. Органическое соединение брома похоже на соответствующее производное хлора, но обычно более плотное, менее летучее, менее горючее и менее стабильное.
Бром бурно соединяется с щелочными металлами, а также с фосфором, мышьяком, алюминием и сурьмой, но менее бурно с некоторыми другими металлами. Бром вытесняет водород из насыщенных углеводородов и присоединяется к ненасыщенным углеводородам, хотя и не так быстро, как это делает хлор.
Наиболее стабильной степенью окисления элемента является -1, при которой бром встречается в природе. Но степени окисления 0 (элементарный бром, Br 2 ), +1 (гипобромит, BrO – ), +3 (бромит, BrO – 2 ), +5 (бромат, BrO – 3 ) и +7 (пербромат, BrO – 4 ) также известны. Первая энергия ионизации брома высока, и соединения, содержащие бром в положительных степенях окисления, стабилизируются соответствующими лигандами, главным образом кислородом и фтором. Соединения со степенью окисления +1, +3, +4, +5 и +7 содержат ковалентные связи.
Но степени окисления 0 (элементарный бром, Br 2 ), +1 (гипобромит, BrO – ), +3 (бромит, BrO – 2 ), +5 (бромат, BrO – 3 ) и +7 (пербромат, BrO – 4 ) также известны. Первая энергия ионизации брома высока, и соединения, содержащие бром в положительных степенях окисления, стабилизируются соответствующими лигандами, главным образом кислородом и фтором. Соединения со степенью окисления +1, +3, +4, +5 и +7 содержат ковалентные связи.
Производство и использование
Основным коммерческим источником брома является морская вода, из которой элемент извлекают путем химического замещения (окисления) хлором в присутствии серной кислоты по реакции
Продукт реакции – разбавленный раствор брома, из которого элемент удаляют продуванием воздуха. Затем свободный бром смешивают с двуокисью серы, и смешанные газы пропускают вверх по башне, по которой стекает вода. В градирне происходит следующая реакция:
, в результате чего получается смесь кислот, которая намного богаче ионами брома, чем морская вода.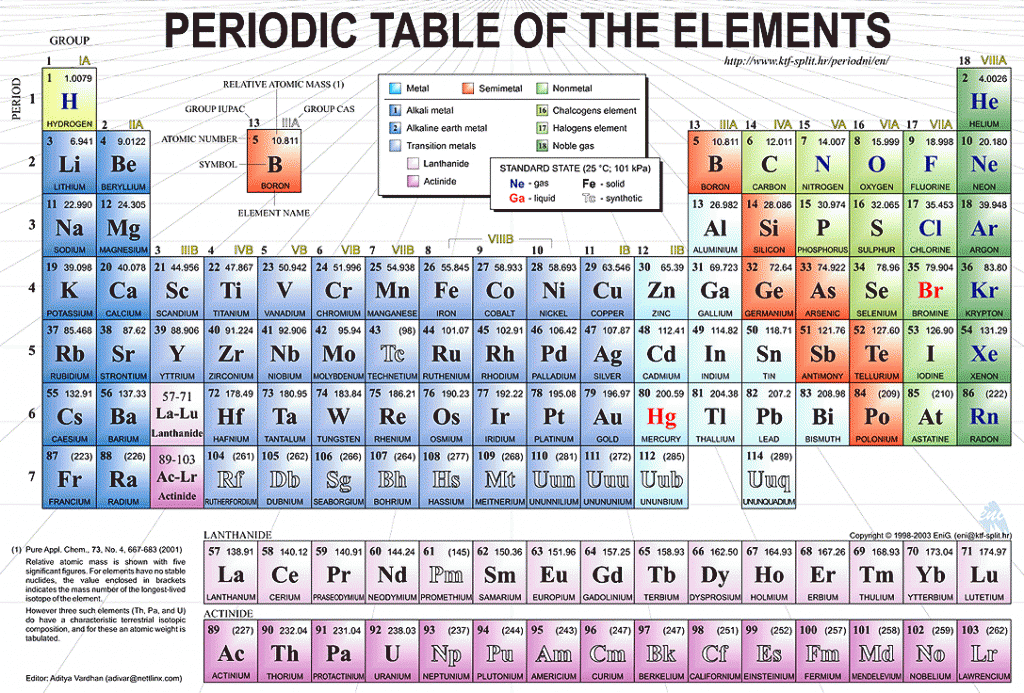 Вторая обработка хлором высвобождает бром, который освобождается от хлора и очищается путем пропускания через влажные железные опилки.
Вторая обработка хлором высвобождает бром, который освобождается от хлора и очищается путем пропускания через влажные железные опилки.
Товарный бром обычно содержит до 0,3 процента хлора. Обычно его хранят в стеклянных бутылках или в бочках, покрытых свинцовым или монель-металлическим покрытием.
В промышленном использовании брома преобладало соединение бромистого этилена (C 2 H 4 Br 2 ), которое когда-то добавляли к бензину с тетраэтилсвинцом для предотвращения отложения свинца в двигателе. После отказа от этилированного бензина соединения брома в основном использовались в антипиренах, но бромистый этилен по-прежнему остается важным соединением, поскольку он используется для уничтожения нематод и других вредителей в почве. Бром также используется в производстве катализаторов, таких как бромид алюминия.
Бром имеет и другие применения, например, в производстве различных красителей и соединений тетрабромэтана (C 2 H 2 Br 4 ) и бромоформа (CHBr 3 ), которые используются в качестве жидкостей в манометрах из-за их высокой удельный вес.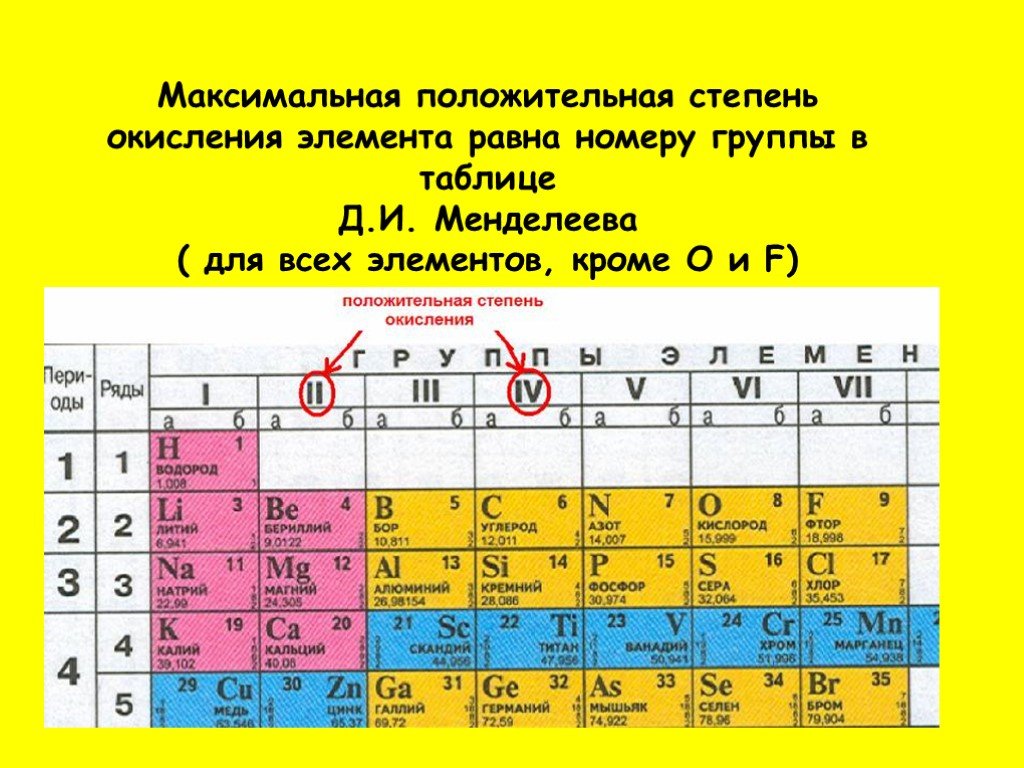 До разработки барбитуратов в начале 20 века бромиды калия, натрия, кальция, стронция, лития и аммония широко использовались в медицине из-за их седативного действия. Бромид серебра (AgBr), важный компонент фотопленки, так же, как хлорид и йод серебра, чувствителен к свету. Следы бромата калия (KBrO 3 ) добавляют в пшеничную муку для улучшения выпечки. Другие важные соединения брома включают бромистый водород (HBr), бесцветный газ, используемый в качестве восстановителя и катализатора в органических реакциях. Раствор газа в воде называется бромистоводородной кислотой, сильной кислотой, которая напоминает соляную кислоту по своей активности по отношению к металлам, их оксидам и гидроксидам.
До разработки барбитуратов в начале 20 века бромиды калия, натрия, кальция, стронция, лития и аммония широко использовались в медицине из-за их седативного действия. Бромид серебра (AgBr), важный компонент фотопленки, так же, как хлорид и йод серебра, чувствителен к свету. Следы бромата калия (KBrO 3 ) добавляют в пшеничную муку для улучшения выпечки. Другие важные соединения брома включают бромистый водород (HBr), бесцветный газ, используемый в качестве восстановителя и катализатора в органических реакциях. Раствор газа в воде называется бромистоводородной кислотой, сильной кислотой, которая напоминает соляную кислоту по своей активности по отношению к металлам, их оксидам и гидроксидам.
Выпь | химия | Британика
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- В этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории.
- Студенческий портал
Britannica — это лучший ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и многое другое. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.


