Строение атома брома (Br), схема и примеры
Общие сведения о строении атома брома
Относится к элементам p-семейства. Неметалл. Обозначение – Br. Порядковый номер – 35. Относительная атомная масса – 79,904 а.е.м.
Электронное строение атома брома
Атом брома состоит из положительно заряженного ядра (+35), внутри которого есть 35 протонов и 45 нейтронов, а вокруг, по четырем орбитам движутся 35 электронов.
Рис.1. Схематическое строение атома брома.
Распределение электронов по орбиталям выглядит следующим образом:
+35Br)2)8)18)7;
1s22s22p63s23p63d104s24p5.
Внешний энергетический уровень атома брома содержит 7 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Каждый валентный электрон атома брома можно охарактеризовать набором из четырех квантовых чисел:
|
Подуровень |
n |
l |
ml |
s |
|
s |
4 |
0 |
0 |
+1/2 |
|
s |
4 |
0 |
0 |
-1/2 |
|
p |
4 |
1 |
-1 |
+1/2 |
|
p |
4 |
1 |
-1 |
-1/2 |
|
p |
4 |
1 |
0 |
+1/2 |
|
p |
4 |
1 |
0 |
-1/2 |
|
p |
4 |
1 |
1 |
+1/2 |
Наличие одного неспаренного электрона свидетельствует о том, что степень окисления брома может быть равна -1 или +1. Так как на четвертом уровне есть вакантные орбитали 4d-подуровня, то для атома брома характерно наличие возбужденного состояния:
Так как на четвертом уровне есть вакантные орбитали 4d-подуровня, то для атома брома характерно наличие возбужденного состояния:
Именно поэтому для брома также характерна степень окисления +3. Известно, что в своих соединениях бром также способен проявлять степени окисления +5 и +7.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Периодическая система и электронное строение атома
Элементы фтор F, хлор С1, бром Вг, иод I и астат At составляют V1IA группу Периодической системы Д. И. Менделеева. Групповое название этих элементов — галогены.
Атом кислорода, располагаясь в главной подгруппе шестой группы периодической системы, имеет электронное строение ls 2s 2p, структура его внешнего электронного слоя выражается схемой [c.134]
С позиций строения атома объяснимо положение водорода в периодической системе. Атом водорода имеет один электрон, который может быть отдан атомам других элементов. Поскольку это свойство проявляют атомы всех элементов, начинающих периоды,— Ыа, К, НЬ, s, Рг, то и водород должен стоять в главной подгруппе I группы. С другой стороны, поскольку атом водорода обладает способностью, подобно атомам галогенов, присоединять один электрон (Н+е =Н ), т. е. проявляет неметаллические свойства, он должен находиться в главной подгруппе VII группы.
На рис. 2 схематически изображено строение атомов водорода, гелия и лития. Атом самого легкого элемента — водорода состоит из двух частиц. Вокруг ядра вращается один электрон. Вокруг ядра гелия вращаются уже два электрона, вокруг ядра лития — три. Чем тяжелее атом, тем сложнее его строение. Например, кислород, занимающий восьмое место в периодической системе элементов, имеет восемь электронов два из них вращаются на /С-оболочке, остальные шесть— на -оболочке. Конечно, приведенные модели атомов отражают их строение весьма схематично. На самом деле прост- [c.18]
Побочную группу VI группы периодической системы д. И. Менделеева образуют переходные металлы хром Сг, молибден Мо, вольфрам W. Электронное строение атомов этих элементов характеризуется наличием незаполненной -оболочки, причем атомы хрома и молибдена имеют неспарепные s-электроны, а атом вольфрама содержит пару (6s ) электронов  210]
210]
Строение комплекса меди [Си(ЫНз)4] + совершенно иное, чем у аналогичного комплекса цинка (хотя медь и цинк — элементы одного, четвертого периода Периодической системы). Результаты магнитных измерений указывают на наличие в этом ионе одного неспаренного электрона. Это можно объяснить следующим образом. Невозбужденный атом меди имеет один 45-электрон (рис. 3.27,а). При образовании иона Си + отрываются этот электрон и один электрон с З -подуровня таким образом, ион Си + имеет один неспаренный электрон на 3 -подуровне (рис. 3.27,6). Известно, что комплекс [Си(ЫНз)4] + квадратный. В квадратных комплексах других -элементов с координационным числом 4 электронные орбитали центрального атома находятся в состоянии бр -гибридизации. Поэтому можно предположить, что неспаренный электрон с З -подуровня
С позиций строения атома объяснимо положение водорода в периодической системе. Атом водорода имеет один внешний электрон, который может быть отдан атомам других элементов.
С развитием электронной теории строения атомов стало ясно, что химические свойства элементов являются функцией электронной стрз ктуры атомов. Отсюда следует, что в качестве объективного критерия, однозначно определяющего положение элемента в Периодической системе, целесообразно выбрать именно электронное строение атома. Поэтому в развитии Периодического закона выделяют три этапа. На первом этапе в качестве аргумента, определяющего свойства элементов, была выбрана атомная масса и закон был сформулирован Д.И.Менделеевым следующим образом “Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от их атомного веса”. На втором этапе было выяснено значение атомного номера, который, как оказалось, определяет заряд ядра атома. Открытие изотопов и изобаров показало, что истинным аргументом, определяющим природу элемента, является именно заряд ядра, а не атомная масса.
Используемое ныне в научной литературе выражение “превращение химических элементов” некорректно. Оно подменяет конкретный объект превращения (атом), неопределенным понятием (химический эле.мент). Недостатком формулировки закона радиоактивных смещений (правильнее превращений ) является то, что она не выделяет подвиды атомов как объект превращения. Она, по-прежнему, “вяжет” их к смещениям в Периодической системе. Возникает принципиальное несоответствие между законом и наглядной его иллюстрацией. Периодическая система химических элементов имеет в основе своей структуры устройство электронной оболочки атомов. Строение ядра имеет здесь лишь опосредованное значение через равенство Ерц. = 1 . Закон же радиоактивных превращений касается исключительно ядерных преобразований и индифферентен (в рамках данных рассмотрений ) к структуре электронной оболочки.
Атом элемента VII группы Периодической системы состоит из 28 элементарных частиц, а атом элемента V группы — из 21. Каков заряд ядер этих атомов Приведите схему строения их электронных оболочек. [c.67]
Атом первого элемента в Периодической системе — водорода — обладает наипростейшим строением. Он состоит всего из двух частиц протона и электрона, — между которыми существуют лишь силы притяжения. Не случайно именно для атома водорода оказалась успешно применимой первая квантовая теория — теория Бора, и только для этого атома волновое уравнение Шредингера имеет точное решение. [c.292]
Заряд атомного ядра по величине совпадает с порядковым номером элемента в периодической системе число электронов равно заряду ядра. Атом в целом нейтрален, т.
 е. сумма отрицательных зарядов компенсирована положительным зарядом ядра. Размеры атомного ядра (диаметр 10 — 10 м) весьма малы по сравнению с размерами атома (диаметр 10 м), но почти вся его масса сосредоточена в ядре ( 99,97 %). А так как масса является мерой энергии, то в ядре сосредоточена почти вся энергия атома. Плотность ядерного вещества огромна ( 10 кг/м ). Заряд ядра определяет не только общее число электронов, но и электронное строение атомов, а следовательно, их физико-химические свойства. [c.90]
е. сумма отрицательных зарядов компенсирована положительным зарядом ядра. Размеры атомного ядра (диаметр 10 — 10 м) весьма малы по сравнению с размерами атома (диаметр 10 м), но почти вся его масса сосредоточена в ядре ( 99,97 %). А так как масса является мерой энергии, то в ядре сосредоточена почти вся энергия атома. Плотность ядерного вещества огромна ( 10 кг/м ). Заряд ядра определяет не только общее число электронов, но и электронное строение атомов, а следовательно, их физико-химические свойства. [c.90] Рассмотрим строение атома какого-нибудь элемента, например натрия, с позиций протонно-нейтронной теории. Порядковый номер натрия в периодической системе 11, массовое число 23. В соответствии с порядковым номером заряд ядра натрия равен 11+. Следовательно, в атоме натрия имеется И электронов, сумма зарядов которых равна положительному заряду ядра. Если атом натрия потеряет один электрон, то положительный заряд ядра будет на единицу больше суммы отрицательных зарядов электронов (10), и атом натрия станет ионом с зарядом 1+. Заряд ядра атома равен сумме зарядов 11 протонов, находящихся в ядре, масса [c.41]
Заряд ядра атома равен сумме зарядов 11 протонов, находящихся в ядре, масса [c.41]
Строение атома. Атом состоит из положительно заряженного ядра, в котором сосредоточена практически вся его масса, и вращающихся вокруг ядра электронов. Атом в целом нейтрален, поэтому заряд ядра и общий заряд всех электронов равны между собой. Число электронов меняется у атомов разных элементов. Порядковый номер элемента в периодической системе Д. И. Менделеева показывает, каков заряд ядра и сколько электронов содержится в нейтральном атоме этс- [c.32]
Следует подчеркнуть, что периодическая система элементов Д. И. Менделеева явилась исходным пунктом для решения вопроса о строении атома и для создания его модели. Так, согласно ядерной модели наиболее просто устроен атом водорода ядро несет один элементарный положительный заряд, а в поле ядра по орбите движется один электрон. Порядковый номер железа 26. Значит, положительный заряд ядра равен 26, а в поле ядра нейтрального атома движется 26 электронов. У элемента курчатовия (2 = 104) положительный заряд ядра равен 104, а в поле ядра движется 104 электрона. Аналогично можно представить и строение атомов других элементов. [c.30]
У элемента курчатовия (2 = 104) положительный заряд ядра равен 104, а в поле ядра движется 104 электрона. Аналогично можно представить и строение атомов других элементов. [c.30]
При заполнении электронных слоев и оболочек атомы подчиняются 1) принципу наименьшей энергии, согласно которому электроны сначала заполняют вакантные орбитали с минимальной энергией 2) принципу Паули 3) правилу Гунда — на вырожденных орбиталях суммарное спиновое число электронов должно быть максимальным. В квантовых ячейках с одинаковой энергией заселение электронами происходит так, чтобы атом имел наибольшее число неспаренных электронов. Это отвечает нормальному состоянию атома (минимум энергии). Рассмотрим связь между электронным строением атомов и положением элементов в короткой 8-клеточной Периодической сис ме (см. форзац). У каждого следующего элемента Периодической системы по сравнению с предыдущим на один электрон больше. Наиболее прост первый период системы, состоящий лишь из двух элементов. У водорода единственный электрон заселяет наинизшую по энергии орбиталь 1 , а у гелия на этой орбитали два электрона с антипарал-лельными спинами. Гелием заканчивается первый период системы и исчерпаны все вариации квантовых чисел при п = I. Таким образом, у атома гелия полностью формируется наиболее близкий к ядру А -слой. [c.40]
У водорода единственный электрон заселяет наинизшую по энергии орбиталь 1 , а у гелия на этой орбитали два электрона с антипарал-лельными спинами. Гелием заканчивается первый период системы и исчерпаны все вариации квантовых чисел при п = I. Таким образом, у атома гелия полностью формируется наиболее близкий к ядру А -слой. [c.40]
Общими физическими свойствами, характеризующими металлы, обладают в свободном состоянии 82 элемента из 105. Естественно предположить, что атомы этих элементов должны быть сходными и по строению. Атомы элементов главных подгрупп I—III групп периодической системы на внешнем энергетическом уровне имеют мало электронов (от одного до трех) и, стремясь принять более устойчивое состояние (структуру атомов благородных газов), сравнительно легко отдают эти электроны, превращаясь в положительно заряженные ионы. Эта особенность обусловливает своеобразное строение кристаллической решетки металлов, которая состоит из положительных ионов и атомов, находящихся в узлах решетки. Между узлами находятся электроны, не принадлежащие каким-либо определенным атомам. Малые размеры электронов позволяют им более или менее свободно перемещаться по всему кристаллу металла, переходя от одного атома или иона к другому атому или иону. При достаточном сближении электронов с ионами образуются нейтральные атомы, которые снова распадаются на ионы и электроны. Следовательно, в кристалле металла существует своеобразное равновесие [c.390]
Между узлами находятся электроны, не принадлежащие каким-либо определенным атомам. Малые размеры электронов позволяют им более или менее свободно перемещаться по всему кристаллу металла, переходя от одного атома или иона к другому атому или иону. При достаточном сближении электронов с ионами образуются нейтральные атомы, которые снова распадаются на ионы и электроны. Следовательно, в кристалле металла существует своеобразное равновесие [c.390]
В настоящее время особенности атома углерода объясняются его строением и положением в периодической системе элементов Д. И. Менделеева. Атом углерода имеет четыре валентных электрона и обладает одинаковой способностью как к отдаче, так и к присоединению их. В органических соединениях химическая связь ковалентная. Атомы углерода образуют с другими атомами, а также друг с другом общие электронные пары. В этом случае каждый атом углерода на внешнем уровне будет иметь восемь электронов (октет), четыре из которых одновременно принадлежат другим атомам. [c.307]
[c.307]
Схематически влияние р-металла III группы периодической системы на проводимость полупроводника (Ое) показано на рис. 204. Захватывая электроны из о-связи Ое—Ое, атом Оа обращается в отрицательный ион, создавая этим самым электронную вакансию, или дырку . Таким образом, создается примесная проводимость полупроводников, очень сильно изменяющая их электрические свойства. Подбор донорных и акцепторных примесей показан в табл. 127, где приведена часть периодической системы Д. И. Менделеева, из которой исключены – и /-металлы, электронное строение которых является особым (гл. XII). [c.448]
Бор — первый р-элемент в периодической системе элементов. Строение внешних электронных оболочек его атома в невозбужденном состоянии 25 Ввзбуждение переводит атом в состояние [c.327]
Магний расположен в главной подгруппе второй группы периодической системы элементов Д. И. Менделеева. Порядковый номер его 12, атомный вес 24,312. Электронная конфигурация атома-магния в невозбужденном состоянии 1х 25 /) 35 валентными являются электроны наружного слоя, в соответствии с этим магний проявляет валентность 2- -. В тесной связи со строением электронных оболочек атома магния находится его реакционная способность. Из-за наличия на внешней оболочке только двух электронов атом магния склонен легко отдавать их для получения устойчивой восьмиэлектронной конфигурации поэтому магний в химич ском отношении очень активен. На воздухе магний окисляется, но образующаяся при этом окисная пленка предохраняет металл от дальнейшего окисления. При нагревании до 600—650° С магний сгорает с образованием окиси магния МдО и частично нитрида [c.8]
Электронная конфигурация атома-магния в невозбужденном состоянии 1х 25 /) 35 валентными являются электроны наружного слоя, в соответствии с этим магний проявляет валентность 2- -. В тесной связи со строением электронных оболочек атома магния находится его реакционная способность. Из-за наличия на внешней оболочке только двух электронов атом магния склонен легко отдавать их для получения устойчивой восьмиэлектронной конфигурации поэтому магний в химич ском отношении очень активен. На воздухе магний окисляется, но образующаяся при этом окисная пленка предохраняет металл от дальнейшего окисления. При нагревании до 600—650° С магний сгорает с образованием окиси магния МдО и частично нитрида [c.8]
Многие химические и физические процессы могут быть объяснены с помощью простых моделей строения атома, предложенных Резерфордом, Бором и другими учеными. Каждая из таких моделей, чем-то отличаясь, тем не менее предполагает, что каждый атом состоит из трех видов субатомных частиц протонов, нейтронов и электронов. Это далеко не полная картина, но для наших целей этого пока достаточно. Протоны и нейтроны образуют ядро атомов. Ядро намного тяжелее электронов. В ядре сосредоточена почти вся масса атома, но ядро занимает лишь ничтожную часть объема. Электроны движутся (часто говорят вращаются ) вблизи ядра по определенным законам. Ядро может быть описано всего лишь двумя числами — порядковым номером атома в периодической системе элементов (его называют атомным номером и обозначают символом ) и массовым числом символ А). [c.15]
Это далеко не полная картина, но для наших целей этого пока достаточно. Протоны и нейтроны образуют ядро атомов. Ядро намного тяжелее электронов. В ядре сосредоточена почти вся масса атома, но ядро занимает лишь ничтожную часть объема. Электроны движутся (часто говорят вращаются ) вблизи ядра по определенным законам. Ядро может быть описано всего лишь двумя числами — порядковым номером атома в периодической системе элементов (его называют атомным номером и обозначают символом ) и массовым числом символ А). [c.15]
Двойственность свойств водорода определяется оригинальностью строения его атома — один протон и один электрон. Потеряй водород электрон, и останется голый протон — частица, а не атом. Никакой другой элемент не имеет подобной структуры ато ма. Но где бы он ни находился — в I группе или в VII, нижняя граница периодической системы проходит по этому элементу. [c.183]
Строение атома углерода, находящегося в первом ряду IV группы периодической системы Менделеева, можно выразить схемой, изображенной на рис.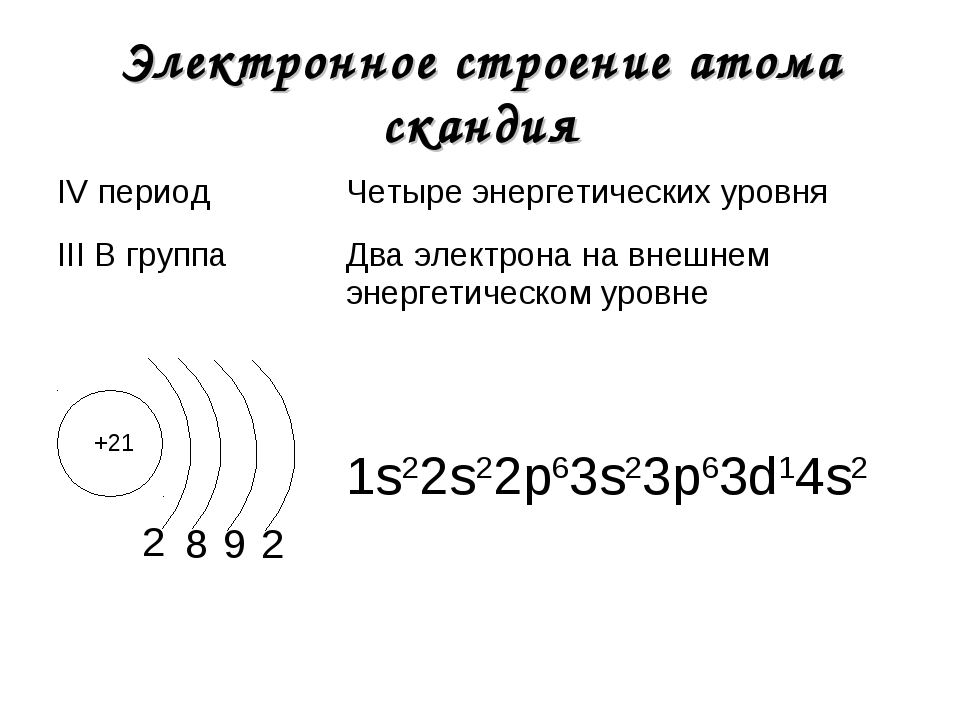 6, а. Атом углерода во внутреннем электронном слое, соответствующем атому инертного газа гелия, имеет 2 электрона, в следующем, внешнем электронном слое атом углерода имеет 4 электрона, являющихся валентными. Из курса неорганической химии известно, что наличие во внешнем электронном слое малого числа электронов (у элементов I, II и III групп) приводит к легкой потере этих электронов и превращению атомов в катионы (например, Na+, Са +, [c.27]
6, а. Атом углерода во внутреннем электронном слое, соответствующем атому инертного газа гелия, имеет 2 электрона, в следующем, внешнем электронном слое атом углерода имеет 4 электрона, являющихся валентными. Из курса неорганической химии известно, что наличие во внешнем электронном слое малого числа электронов (у элементов I, II и III групп) приводит к легкой потере этих электронов и превращению атомов в катионы (например, Na+, Са +, [c.27]
Схема, представленная на рис. 3, изображает строение атома углерода, который находится, как известно, в первом ряду IV группы периодической системы Менделеева. Схема показывает, что атом углерода имеет во внутреннем электронном слое 2 электрона, а в следующем — наружном слое — 4 электрона, которые являются валентными электронами. [c.31]
Строение ядер. Нейтральный атом состоит из плотного ядра диаметром около см, окруженного диффузным облаком электронов. Внешний диаметр этого облака равен примерно 10 см. Почти вся масса атома сосредоточена в положительно заряженном ядре. Величина заряда ядра равна целому числу зарядов электрона или 4,80223-Z эл. ст. ед. Это целое число 2 называется атомным номером. Оно совпадает с порядковым номером элемента в периодической системе элементов. Ядро состоит из 2 протонов и N нейтронов. [c.24]
Почти вся масса атома сосредоточена в положительно заряженном ядре. Величина заряда ядра равна целому числу зарядов электрона или 4,80223-Z эл. ст. ед. Это целое число 2 называется атомным номером. Оно совпадает с порядковым номером элемента в периодической системе элементов. Ядро состоит из 2 протонов и N нейтронов. [c.24]
Этими правилами определяется порядок заполнения орбиталей электронами и образование характерных электронных конфигураций атомов, что и отражено в приведенной периодической системе Д. И. Менделеева. Однако необходимо иметь в виду, что правила Клечковского не полностью охватывают все частные особенности электронной структуры атомов. Например, при переходе от атома никеля к атому меди число Зй-электронов увеличивается не на один, а сразу на два электрона за счет проскока одного 45-электрона на подуровень Зй. Таким образом, электронное строение атома меди выражается формулой 15 28 2р 35 3/7 3 г 45 . Аналогичный провал электрона с внешнего 5- на р-подуровень происходит и в атомах [c. 18]
18]
Сопоставляя полученные результаты с величинами потенцна-.лов иоиизатгии и констант основности, видим, что сравнительная протоноакцепторная способность вторичных и третичных ароматических аминов согласуется с характером изменения их основности и ионизационного потенциала третичные амины являются более сильными акцепторами протона и донорами электрона, чем вторичные. Энергии же водородной связи, образуемой атомом азота алифатических аминов с фиксированным донором протона, у третичных аминов ниже, чем у вторичных, хотя электронодо-норная способность RsN, мерой которой может служить ионизационный потенциал или прочность комплексов донориоакцептор-ного типа с переносом заряда, выше, чем у R9NH. Подобная закономерность ранее наблюдалась только для рядов соединений, функциональный атом которых меняется по столбцу Периодической системы. Результат данной работы показывает, что при большом сходстве в электронном строении атома азота вторичных и третичных аминов их способность выступать в качестве доноров электрона и акцепторов протона меняется в противоположном направлении. Это означает, что перенос заряда не вносит заметного вклада в энергетику рассматриваемых комплексов с водородной связью. [c.36]
Это означает, что перенос заряда не вносит заметного вклада в энергетику рассматриваемых комплексов с водородной связью. [c.36]
Бор – первый р-элемент в периодической системе элементов. Строение внешней электронной оболочки его атома в невозбужлениом состоянии 2х 2р . Возбуждение переводит атом в состояние 2f 2p p и далее в ip -тбридное валентное состояние, в котором орбитали расположены под углом 120. Этому состоянию отвечает структура соединений бора, в которых атом В связан с тремя другими атомами (три Образование донорно-акцепторной ж-связи (акцептор – атом бора) стабилизирует ip -гибридное состояние. Это приводит к уменьшению межатомных расстояний В-Г, В-О и др. Благодаря наличию в небольшом по размеру атоме бора свободной орбитали бор – один из сильнейших акцепторов неподеленных электронных пар. Многие соединения бора являются кислотами Льюиса, они энергично взаимодействуют с основаниями Льюиса, например [c.343]
Попять физический смысл валентности помогло учение о строении атомов и химической связл. Как уже отмечалось, электроны, которые участвуют в образовании химических связей между атомами, называются валентными. Зто электроны, наиболее слабо связанные с ядром. У химических элементов общее число валентных электронов в атоме, как правило, равно номеру группы периодической системы элементов Д. И. Менделеева. Так, атом серы (элемент VI группы) содержит всего 16 электронов, нз них валентных 6. К валентным относятся прежде всего электроны внешних незавершенных уровней. Однако валентными могут быть и электроны второго снаружи уровня (например, у -элементов), а также электроны третьего снаружи уровня (например, у /-элементов). [c.58]
Как уже отмечалось, электроны, которые участвуют в образовании химических связей между атомами, называются валентными. Зто электроны, наиболее слабо связанные с ядром. У химических элементов общее число валентных электронов в атоме, как правило, равно номеру группы периодической системы элементов Д. И. Менделеева. Так, атом серы (элемент VI группы) содержит всего 16 электронов, нз них валентных 6. К валентным относятся прежде всего электроны внешних незавершенных уровней. Однако валентными могут быть и электроны второго снаружи уровня (например, у -элементов), а также электроны третьего снаружи уровня (например, у /-элементов). [c.58]
В настоящее время наблюдается мощный интеллектуальный подъем в неорганической химии, который сильнее всего затронул те ее области, которые лежат на стыке с соседними дисциплинами химию металлоорганических и бионеорганических соединений, химию твердого тела, биогеохимию и др. Возрастает, в частности, уверенность ученых в том, что неорганические элементы играют важную роль в живых системах. Живые существа вовсе не являются чисто органическими. Они весьма чувствительны к ионам металлов почти всей Периодической системы Д.И. Менделеева. Некоторые ионы играют важнейшую роль в таких жизненно важных процессах, как связывание и транспорт кислорода (железо в гемоглобине), поглощение и конверсия солнечной энергии (магний в хлорофилле, марганец в фотосистеме II, железо в ферродоксине, медь во фта-лоцианине), передача электрических импульсов между клетками (кальций, калий в нервных клетках), мышечное сокращение (кальций), ферментативный катализ (кобальт в витамине В12). Это привело к взрыву творческой активности ученых в области неорганической химии биосистем. Мы начинаем изучать строение ближайшего и дальнего окружения атомов металлов в биосистемах и учимся понимать, как это окружение позволяет атому металла с такой высокой чувствительностью реагировать на изменение pH, давление кислорода, присутствие доноров или акцепторов электронов. [c.158]
Живые существа вовсе не являются чисто органическими. Они весьма чувствительны к ионам металлов почти всей Периодической системы Д.И. Менделеева. Некоторые ионы играют важнейшую роль в таких жизненно важных процессах, как связывание и транспорт кислорода (железо в гемоглобине), поглощение и конверсия солнечной энергии (магний в хлорофилле, марганец в фотосистеме II, железо в ферродоксине, медь во фта-лоцианине), передача электрических импульсов между клетками (кальций, калий в нервных клетках), мышечное сокращение (кальций), ферментативный катализ (кобальт в витамине В12). Это привело к взрыву творческой активности ученых в области неорганической химии биосистем. Мы начинаем изучать строение ближайшего и дальнего окружения атомов металлов в биосистемах и учимся понимать, как это окружение позволяет атому металла с такой высокой чувствительностью реагировать на изменение pH, давление кислорода, присутствие доноров или акцепторов электронов. [c.158]
Электронное строение и типы связей элементов периодической системы – ключ к пониманию Сфуктуры и свойств простых и сложных веществ, образованных эти. ми элементами Два или более атомов располагаются друг около друга так, как это энергетически выгодно. Это справедливо независимо от того, сильно или слабо связана фуппа атомов, содержит эта фуппа лишь несколько или 10 атомов, является расположение атомов упорядоченным (как в кристалле) или неупорядоченным (как в жидкости). Группа ато.мов устойчива тогда и только тогда, когда энергия атомов, расположенных вместе, ниже, чем у отдельных атомов. Единственной физической причиной конкретной кристаллической сфуктуры любого элемента и его модификаций является перекрытие валентных и подвалентных оболочек его атомов, приводящее к образованшо определенных межатомных связей. Число протяженность и симмефия орбиталей атомов данного конкретного элемента полностью определяют число, длину, ориентиров и энергию межатомных связей, образующихся в результате перекрытия этих орбита-лей, а следовательно, размещение атомов в пространстве, т е. кристаллическую структуру, основные физико-химические свойства элемента.
ми элементами Два или более атомов располагаются друг около друга так, как это энергетически выгодно. Это справедливо независимо от того, сильно или слабо связана фуппа атомов, содержит эта фуппа лишь несколько или 10 атомов, является расположение атомов упорядоченным (как в кристалле) или неупорядоченным (как в жидкости). Группа ато.мов устойчива тогда и только тогда, когда энергия атомов, расположенных вместе, ниже, чем у отдельных атомов. Единственной физической причиной конкретной кристаллической сфуктуры любого элемента и его модификаций является перекрытие валентных и подвалентных оболочек его атомов, приводящее к образованшо определенных межатомных связей. Число протяженность и симмефия орбиталей атомов данного конкретного элемента полностью определяют число, длину, ориентиров и энергию межатомных связей, образующихся в результате перекрытия этих орбита-лей, а следовательно, размещение атомов в пространстве, т е. кристаллическую структуру, основные физико-химические свойства элемента. [c.30]
[c.30]
Схемы образования веществ с различным типом связи
Ответ на вопрос 5.
Элемент с порядковым номером 35 – это бром (Br). Заряд ядра его атома равен 35. Атом брома содержит 35 протонов, 35 электронов и 45 нейтронов.
§ 7 . Изменения в составе ядер атомов химических элементов. Изотопы
Ответ на вопрос 1.
Изотопы 40 19 K и40 18 Ar проявляют разные свойства, потому что имеют разный заряд ядра и разное количество электронов.
Ответ на вопрос 2.
Относительная атомная масса аргона близка к 40, т.к. в ядре его атома 18 протонов и 22 нейтрона, а в ядре атома калия 19 протонов и 20 нейтронов, поэтому его относительная атомная масса близка к 39. Так как число протонов в ядре атома калия больше, он стоит в таблице после аргона.
Ответ на вопрос 3.
Изотопы – это разновидности атомов одного элемента, имеющие одинаковое количество протонов и электронов и различное число нейтронов.
Ответ на вопрос 4.
Изотопы хлора схожи по свойствам, т.к. свойства определяются зарядом ядра, а не его относительной массой, даже при изменении относительной атомной массы изотопов хлора на 1 или 2 единицы масса изменяется незначительно, в отличие от изотопов водорода, где при добавлении одного или двух нейтронов масса ядра изменяется в 2 или 3 раза.
Ответ на вопрос 5.
Дейтериевая (тяжелая вода) – соединение, где 1 атом кислорода связан с двумя атомами изотопа водорода 2 1 D , формула D2 O. Сравнение свойств D2 O и Н2 О
Ответ на вопрос 6.
Вначале расположен элемент с большим значением относительной
атомной массы в парах:
Te-I (теллур-иод) 128 Te и127 I.
Th-Pa (торий-протактиний) 232 90 Th и231 91 Pa . U-Np (уран-нептуний) 238 92 U и237 93 Np .
§ 8 . Строение электронных оболочек атомов
Ответ на вопрос 1.
а) Al +13 | б) Р | в) О | |||||||
13 Al 2e– , 8e– , 3e– | 15 Р 2e– , 8e– , 5e– | 8 О 2e– , 6e– | |||||||
а) – схема строения атома алюминия; б) – схема строения атома фосфора; в) – схема строения атома кислорода.
Ответ на вопрос 2.
а) сравним строение атомов азота и фосфора.
7 N 2e– , 5e– | 15 Р 2e– , 8e– , 5e– | |||||
Cтроение электронной оболочки этих атомов схоже, оба на последнем энергетическом уровне содержат 5 электронов. Однако у азота всего 2 энергетических уровня, а у фосфора их 3.
б) Сравним строение атомов фосфора и серы.
15 Р 2e– , 8e– , 5e– | 16 S 2e– , 8e– , 6e– | ||||||
Атомы фосфора и серы имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у фосфора на последнем энергетическом уровне 5 электронов, а у серы 6.
Ответ на вопрос 3.
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3. Число внешних электронов определяется номером группы и равно 4.
Ответ на вопрос 4.
Количество содержащихся в периоде элементов равно максимально возможному числу электронов на внешнем энергетическом уровне и это число определяется по формуле 2n2 , где n – номер периода.
Поэтому в первом периоде содержится только 2 элемента (2 12 ), а во втором периоде 8 элементов (2 22 ).
Ответ на вопрос 5.
В астрономии – Период вращения Земли вокруг своей оси 24 часа.
В географии – Смена сезонов с периодом 1 год.
В физике – Периодические колебания маятника.
В биологии – Каждая клетка дрожжей в оптимальных условиях раз в 20 мин. делится.
Ответ на вопрос 6.
Электроны и строение атома были открыты в начале XX века, чуть позже было написано это стихотворение, которое отражает во многом нуклеарную, или планетарную, теорию строения атома, а также автор допускает возможность, что и электроны тоже сложные частицы, строение которых мы еще просто не изучили.
Ответ на вопрос 7.
Приведенные в учебнике 2 четверостишия говорят об огромном поэтическом таланте В. Брюсова и гибком уме его, раз он мог так легко понять и принять все достижения современной ему науки, а также, по всей видимости, просвещенности и образованности в данной области.
§ 9 . Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов
Ответ на вопрос 1.
а) Сравним строение и свойства атомов углерода и кремния
6 С 2e– , 4e– | 14 Si 2e– , 8e– , 4e– | ||||
По строению электронной оболочки эти элементы схожи: оба на последнем энергетическом уровне имеют по 4 электрона, но у углерода 2 энергетических уровня, а у кремния 3. Т.к. число электронов на внешнем уровне одинаково, то и свойства этих элементов будут похожи, но радиус атома кремния больше, поэтому по сравнению с углеродом он будет проявлять больше металлических свойств.
б) Сравним строение и свойства атомов кремния и фосфора:
14 Si 2e– , 8e– , 4e– | 15 Р 2e– , 8e– , 5e– | |||||
Атомы кремния и фосфора имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у кремния на последнем энергетическом уровне 4 электрона, а у фосфора 5, поэтому радиус атома фосфора меньше и он в большей степени проявляет неметаллические свойства, чем кремний.
Ответ на вопрос 2.
а) Рассмотрим схему образования ионной связи между алюминием и кислородом.
1. Алюминий – элемент главной подгруппы III группы, металл. Его атому легче отдать 3 внешних электрона, чем принять недостающие
Al0 – 3e– → Al+ 3
2. Кислород – элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, которых не хватает до завершения внешнего уровня, чем отдать 6 электронов с внешнего уровня.
Его атому легче принять 2 электрона, которых не хватает до завершения внешнего уровня, чем отдать 6 электронов с внешнего уровня.
O0 + 2e– → О− 2
3. Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 6(3 2). Чтобы атомы Al отдали 6
электронов, их нужно взять 2(6:3), чтобы атомы кислорода смогли принять 6 электронов, их нужно взять 3(6:2).
4. Схематично образование ионной связи между атомами алюминия и кислорода можно записать так:
2Al0 + 3O0 → Al2 +3 O3 –2 → Al2 O3
6e–
б) Рассмотрим схему образования ионной связи между атомами лития и фосфора.
1. Литий – элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7:
Li0 – 1e– → Li+ 1
2. Фосфор – элемент главной подгруппы V группы, неметалл. Его атому легче принять 3 электрона, которых не хватает до завершения вешнего уровня, чем отдать 5 электронов:
Р0 + 3e– → Р− 3
3.
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 3(3 1). Чтобы атомы лития отдали
Чтобы атомы лития отдали
3 электронов, их нужно взять 3(3:1), чтобы атомы фосфора смогли принять 5 электронов, нужно взять только 1 атом (3:3).
4. Схематично образование ионной связи между атомами лития и фосфора можно записать так:
3Li0 – + P0 → Li3 +1 P–3 → Li3 P
в) Рассмотрим схему образования ионной связи между атомами магния и фтора.
1. Магний – элемент II группы главной подгруппы, металл. Его атому легче отдать 2 внешних электрона, чем принять недостающие
Mg0 – 2e– → Mg+ 2
2. Фтор – элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, которого не хватает до завершения вешнего уровня, чем отдать 7 электронов:
F0 + 1e– → F− 1
3. Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2 1). Чтобы атомы магния отдали 2 электрона, нужен только один атом, чтобы атомы фтора смогли принять 2 электрона, их нужно взять 2(2:1).
4. Схематично образование ионной связи между атомами лития и фосфора можно записать так:
Mg0 +– 2F0 → Mg+2 F2 –1 → MgF2
Ответ на вопрос 3.
Самые типичные металлы расположены в периодической системе
в начале периодов и в конце групп, таким образом, самым типичным металлом является франций (Fr). Типичные неметаллы расположены
в конце периодов и в начале групп. Таким образом, самый типичный неметалл фтор (F). (Гелий не проявляет каких-либо химических свойств).
Ответ на вопрос 4.
Инертные газы стали называть благородными, так же как и металлы, потому что в природе они встречаются исключительно в свободном виде и с большим трудом образуют химические соединения.
Ответ на вопрос 5.
Выражение «Улицы ночного города были залиты неоном» химически неверно, т.к. неон – инертный, малораспространенный газ, в воздухе его содержится очень мало. Однако неоном заполняют неоновые лампы и лампы дневного света, которые часто используются для подсветки вывесок, афиш, реклам ночью.
§ 10 . Взаимодействие атомов элементов-неметаллов между собой
Ответ на вопрос 1.
Электронная схема образования двухатомной молекулы галогена будет выглядеть так:
а + а→ аа
А структурная формула
Ответ на вопрос 2.
а) Схема образования химической связи для AlCl3 :
Алюминий – элемент III группы. Его атому легче отдать 3 внешних электрона, чем принять недостающие 5.
Al° – 3 e→ Al+3
Хлор – элемент VII группы. Его атому легче принять 1 электрон, которого не хватает до завершения внешнего уровня, чем отдать 7 электронов.
Сl° + 1 e → Сl–1
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 3(3:1). Чтобы атомы алюминия отдали 3 электрона надо взять только 1 атом (3:3), чтобы атомы хлора смогли принять 3 электрона, их нужно взять 3(3:1)
Al° + 3Сl° → Al+3 Cl–1 → AlСl3
3 e –
Связь между атомами металла и неметалла носит ионный характер. б) Схема образования химической связи для Cl2 :
Хлор – элемент главной подгруппы VII группы. Его атомы имеют 7 электронов на внешнем уровне. Число непарных электронов равно
Связь между атомами одного и того же элемента ковалентна.
Ответ на вопрос 3.
Сера – элемент главной подгруппы VI группы. Ее атомы имеют 6 электронов на внешнем уровне. Число непарных электронов равно (8–6)2. В молекулах S2
атомы связаны двумя общими электронными парами, поэтому связь двойная.
Ее атомы имеют 6 электронов на внешнем уровне. Число непарных электронов равно (8–6)2. В молекулах S2
атомы связаны двумя общими электронными парами, поэтому связь двойная.
Схема образования молекулы S2 будет выглядеть следующим образом:
Ответ на вопрос 4.
В молекуле S2 связь двойная, в молекуле Cl связь одинарная, в молекуле N2 – тройная. Поэтому самой прочной молекулой будет N2 , менее прочной S2 , а еще слабее Cl2 .
Длина связи самая маленькая в молекуле N2 , больше в молекуле S2 , еще больше в молекуле Cl2 .
§ 11 . Ковалентная полярная химическая связь
Ответ на вопрос 1.
Так как значения ЭО водорода и фосфора одинаковы, то химическая связь в молекуле Ph4 будет ковалентной неполярной.
Ответ на вопрос 2.
1. а) в молекуле S2 связь ковалентная неполярная, т.к. она образована атомами одного и того же элемента. Схема образования связи будет следующей:
Сера – элемент главной подгруппы VI группы. Ее атомы имеют по 6 электронов на внешней оболочке. Непарных электронов будет: 8 – 6 = 2.
Непарных электронов будет: 8 – 6 = 2.
Обозначим внешние электроны S
б) в молекуле K2 O связь ионная, т.к. она образована атомами элементов металла и неметалла.
Калий – элемент I группы главной подгруппы, металл. Его атому легче отдать 1 электрон, чем принять недостающие 7:
K0 – 1e– → K+ 1
Кислород – элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, которых не хватает до завершения уровня, чем отдать 6 электронов:
O0 + 2e– → O− 2
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2 1). Чтобы атомы калия отдали 2 электрона, их нужно взять 2, чтобы атомы кислорода смогли принять 2 электрона, необходим только 1 атом:
2K2e 0 – + O0 → K2 +1 O–2 → K2 O
в) в молекуле h3 S связь ковалентная полярная, т.к. она образована атомами элементов с различной ЭО. Схема образования связи будет следующей:
Сера – элемент главной подгруппы VI группы. Ее атомы имеют по 6 электронов на внешней оболочке. Непарных электронов будет: 8– 6=2.
Непарных электронов будет: 8– 6=2.
Водород – элемент главной подгруппы I группы. Его атомы содержат по 1 электрону на внешней оболочке. Непарным является 1 электрон (для атома водорода завершенным является двухэлектронный уровень). Обозначим внешние электроны:
Общие электронные пары смещены к атому серы, как более электроотрицательному
H δ+→ S 2 δ−← H δ+
1. а) в молекуле N2 связь ковалентная неполярная, т.к. она образована атомами одного и того же элемента. Схема образования связи следующая:
Азот – элемент главной подгруппы V группы. Его атомы имеют 5 электронов на внешней оболочке. Непарных электронов: 8 – 5 = 3.
Обозначим внешние электроны: N
N ≡ N
б) в молекуле Li3 N связь ионная, т.к. она образована атомами элементов металла и неметалла.
Литий – элемент главной подгруппы I группы, металл. Его атому легче отдать 1 электрон, чем принять недостающие 7:
Li0 – 1e– → Li+ 1
Азот – элемент главной подгруппы V группы, неметалл. Его атому легче принять 3 электрона, которых не хватает до завершения внешнего уровня, чем отдать пять электронов с внешнего уровня:
Его атому легче принять 3 электрона, которых не хватает до завершения внешнего уровня, чем отдать пять электронов с внешнего уровня:
N0 + 3e– → N− 3
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 3(3 1). Чтобы атомы лития отдали 3 электрона, необходимо 3 атома, чтобы атомы азота смогли принять 3 электрона, необходим только один атом:
3Li0 + N0 → Li3 +1 N–3 → Li3 N
3e–
в) в молекуле NCl3 связь ковалентная полярная, т.к. она образована атомами элементов-неметаллов с различными значениями ЭО. Схема образования связи следующая:
Азот – элемент главной подгруппы V группы. Его атомы имеют по 5 электронов на внешней оболочке. Непарных электронов будет: 8– 5=3.
Хлор – элемент главной подгруппы VII группы. Его атомы содержат по 7 электронов на внешней оболочке. Непарным остается
Данный урок посвящен обобщению и систематизации знаний о видах химической связи. В процессе урока будут рассмотрены схемы образования химической связи в различных веществах. Урок поможет закрепить умение определять вид химической связи в веществе по его химической формуле.
Урок поможет закрепить умение определять вид химической связи в веществе по его химической формуле.
Тема: Химическая связь. Электролитическая диссоциация
Урок: Схемы образования веществ с различным типом связи
Рис. 1. Схема образования связи в молекуле фтора
Молекула фтора состоит из двух атомов одного химического элемента-неметалла с одинаковой электроотрицательностью, следовательно, в этом веществе реализуется ковалентная неполярная связь. Изобразим схему образования связи в молекуле фтора. Рис. 1.
Вокруг каждого атома фтора с помощью точек нарисуем семь валентных, то есть внешних, электронов. До устойчивого состояния каждому атому необходим еще один электрон. Таким образом, образуется одна общая электронная пара. Заменив ее черточкой, изобразим графическую формулу молекула фтора F-F.
Вывод: ковалентная неполярная связь образуется между молекулами одного химического элемента-неметалла. При таком типе химической связи образуются общие электронные пары, которые в равной степени принадлежат обоим атомам, то есть не происходит смещения электронной плотности ни к одному из атомов химического элемента
Рис. 2. Схема образования связи в молекуле воды
2. Схема образования связи в молекуле воды
Молекула воды состоит из атомов водорода и кислорода – двух элементов-неметаллов с разными значениями относительной электроотрицательности, следовательно, в этом веществе – ковалентная полярная связь.
Так как кислород – более электроотрицательный элемент, чем водород, общие электронные пары смещаются в сторону кислорода. На атомах водорода возникает частичный заряд, а на атоме кислорода – частичный отрицательный. Заменив обе общие электронные пары черточками, а точнее стрелками, показывающими смещение электронной плотности, запишем графическую формулу воды Рис. 2.
Вывод: ковалентная полярная связь возникает между атомами разных элементов-неметаллов, то есть с разными значениями относительной электроотрицательности. При этом типе связи образуются общие электронные пары, которые смещаются в сторону более электроотрицательного элемента .
1. №№ 5,6,7 (с.145) Рудзитис Г.Е. Неорганическая и органическая химия.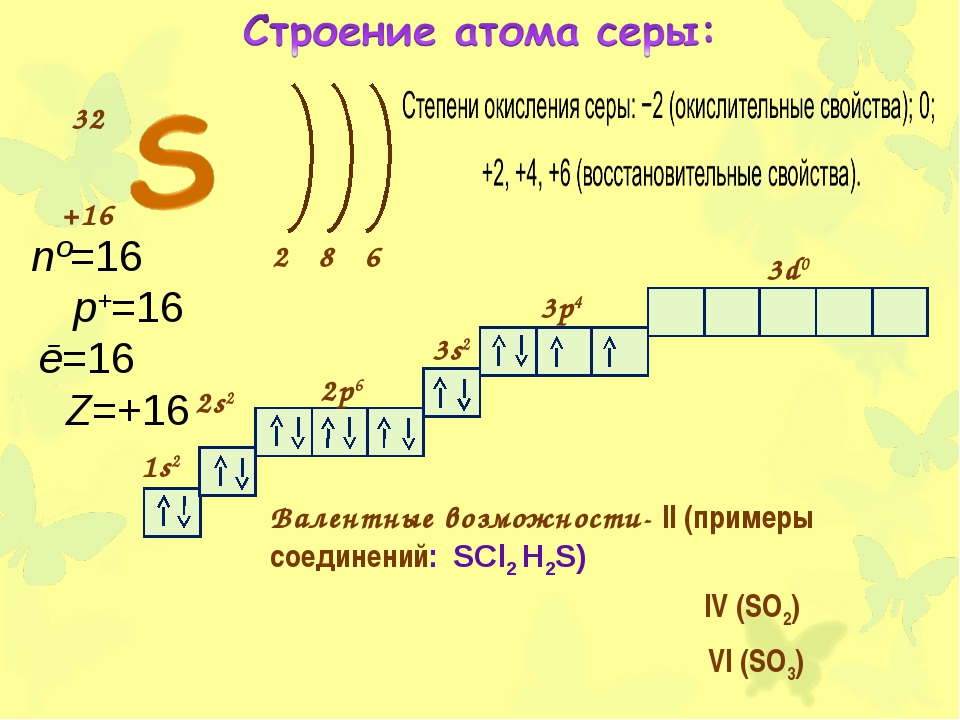 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Укажите частицу с наибольшим и наименьшим радиусом: атом Ar, ионы: K + , Ca 2+ , Cl – .Ответ обоснуйте.
3. Назовите три катиона два аниона, которые имеют такую же электронную оболочку, что и ион F – .
Часть I
1. Атомы металлов, отдавая внешние электроны, превращаются в положительные ионы:
где n – число электронов внешнего слоя атома, соответствующее номеру группы химического элемента.
2. Атомы неметаллов, принимая электроны, недостающие до завершения внешнего электронного слоя , превращаются в отрицательные ионы:
3. Между разноимённо заряженными ионами возникает связь, которая называется ионной.
4. Дополните таблицу «Ионная связь».
Часть II
1. Дополните схемы образования положительно заряженных ионов. Из букв, соответствующих правильным ответам, вы составите название одного из древнейших природных красителей:
индиго.
2. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы веществ с ионной химической связью.
3. Верны ли следующие утверждения?
3) верно только Б
4. Подчеркните пары химических элементов, между которыми образуется ионная химическая связь.
1) калий и кислород
3) алюминий и фтор
Составьте схемы образования химической связи между выбранными элементами.
5. Придумайте рисунок в стиле комиксов, отражающий процесс образования ионной химической связи.
6. Составьте схему образования двух химических соединений с ионной связью по условной записи:
Выберите химические элементы «А» и «Б» из следующего списка:
кальций, хлор, калий, кислород, азот, алюминий, магний, углерод, бром.
Подходят для данной схемы кальций и хлор, магний и хлор, кальций и бром, магний и бром.
7. Напишите небольшое литературное произведение (эссе, новеллу или стихотворение) об одном из веществ с ионной связью, которое человек применяет в быту или на производстве. Для выполнения задания используйте возможности Интернета.
Для выполнения задания используйте возможности Интернета.
Хлорид натрия – вещество с ионной связью, без него нет жизни, хотя, когда его много – это тоже нехорошо. Даже есть такая народная сказка, где рассказывается о том, что принцесса любила своего отца короля так сильно, как соль, за что была изгнана из королевства. Но, когда король однажды попробовал еду без соли и понял, что есть невозможно, он тогда понял, что дочь его очень сильно любила. Значит, соль – есть жизнь, но её потребление должно быть в
меру. Потому что чрезмерное потребление соли сильно вредит здоровью. Избыток соли в организме приводит к заболеванию почек, меняет цвет кожи, задерживает излишнюю жидкость в организме, что приводит к отёкам и нагрузке на сердце. Поэтому, надо контролировать потребление соли. 0,9% раствор хлорида натрия – это физиологический раствор, используется для вливания лекарств в организм. Поэтому, очень трудно ответить на вопрос: полезна или вредна соль? Она нам нужна в меру.
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока :
- Сформировать понятие об химических связях на примере ионной связи. Добиться понимания образования ионной связи как крайнего случая полярной.
- Обеспечить в ходе урока усвоение следующих основных понятий: ионы (катион, анион), ионная связь.
- Развивать умственную деятельность учащихся через создание проблемной ситуации при изучении нового материала.
Задачи:
- научить распознавать виды химической связи;
- повторить строение атома;
- исследовать механизм образования ионной химической связи;
- научить составлять схемы образования и электронные формулы ионных соединений, уравнения реакций с обозначением перехода электронов.
Оборудование : компьютер, проектор, мультимедийный ресурс, периодическая система химических элементов Д.И. Менделеева, таблица «Ионная связь».
Тип урока: Формирование новых знаний.
Вид урока: Мультимедиа урок.
Х од урока I. Организационный момент . II. Проверка домашнего задания .Учитель: Как атомы могут принимать устойчивые электронные конфигурации? Каковы cпособы образования ковалентной связи?
Ученик: Полярная и неполярная ковалентные связи образованы по обменному механизму. К обменному механизму относят случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. Например, водород: (слайд 2)
Связь возникает благодаря образованию общей электронной пары за счет объединения неспаренных электронов. У каждого атома есть по одному s-электрону. Атомы Н равноценны и пары одинаково принадлежат обоим атомам. Поэтому же принципу происходит образование общих электронных пар (перекрывание р-электронных облаков) при образовании молекулы F 2 . (слайд 3)
Запись H· означает, что у атома водорода на внешнем электронном слое находится 1 электрон. Запись показывает, что на внешнем электронном слое атома фтора находится 7 электронов.
Запись показывает, что на внешнем электронном слое атома фтора находится 7 электронов.
При образовании молекулы N 2 . Образуются 3 общие электронные пары. Перекрываются р-орбитали. (слайд 4)
Связь называется неполярная.
Учитель: Мы сейчас рассмотрели случаи, когда образуются молекулы простого вещества. Но вокруг нас множество веществ, сложного строения. Возьмем молекулу фтороводорода. Как в этом случае происходит образование связи?
Ученик: При образовании молекулы фтороводорода перекрывается орбиталь s-электрона водорода и орбиталь р-электрона фтора Н-F. (слайд 5)
Связывающая электронная пара смещена к атому фтора, в результате чего образуется диполь . Связь называется полярная .
III. Актуализация знаний .Учитель: Химическая связь возникает вследствие изменений, которые происходят с наружными электронными оболочками соединяющихся атомов. Это возможно потому, что наружные электронные слои не завершены у элементов, кроме инертных газов. Химическая связь объясняется стремлением атомов приобрести устойчивую электронную конфигурацию, подобную конфигурации «ближайшего» к ним инертного газа.
Химическая связь объясняется стремлением атомов приобрести устойчивую электронную конфигурацию, подобную конфигурации «ближайшего» к ним инертного газа.
Учитель: Записать схему электронного строения атома натрия (у доски). (слайд 6)
Ученик: Атому натрия для достижения устойчивости электронной оболочки необходимо либо отдать один электрон, либо принять семь. Натрий легко отдаст свой далекий от ядра и слабо связанный с ним электрон.
Учитель: Составить схему отдачи электрона.
Nа° – 1ē → Nа+ = Ne
Учитель: Записать схему электронного строения атома фтора (у доски).
Учитель: Как добиться завершения заполнения электронного слоя?
Ученик: Атому фтора для достижения устойчивости электронной оболочки необходимо либо отдать семь электронов, либо принять один. Энергетически выгоднее фтору принять электрон.
Учитель: Составить схему приема электрона.
F° + 1ē → F- = Ne
IV. Изучение нового материал.Учитель обращается с вопросом к классу, в котором ставится задача урока:
Возможны ли другие варианты, при которых атомы могут принимать устойчивые электронные конфигурации? Каковы пути образования таких связей?
Сегодня мы рассмотрим один из видов связей – ионную связь. Сопоставим строение электронных оболочек уже названных атомов и инертных газов.
Сопоставим строение электронных оболочек уже названных атомов и инертных газов.
Беседа с классом.
Учитель: Какой заряд имели атомы натрия и фтора до реакции?
Ученик: Атомы натрия и фтора электронейтральны, т.к. заряды их ядер уравновешиваются электронами, вращающимися вокруг ядра.
Учитель: Что происходит между атомами при отдаче и принятии электронов?
Ученик: Атомы приобретают заряды.
Учитель дает пояснения: В формуле иона дополнительно записывают его заряд. Для этого используют верхний индекс. В нем цифрой указывают величину заряда (единицу не пишут), а потом – знак (плюс или минус). Например, ион Натрия с зарядом +1 имеет формулу Na + (читается «натрий-плюс»), ион Фтора с зарядом -1 – F – («фтор-минус»), гидроксид-ион с зарядом -1 – ОН – («о-аш-минус»), карбонат-ион с зарядом -2 – CO 3 2- («цэ-о-три-два-минус»).
В формулах ионных соединений сначала записывают, не указывая зарядов, положительно заряженные ионы, а потом – отрицательно заряженные.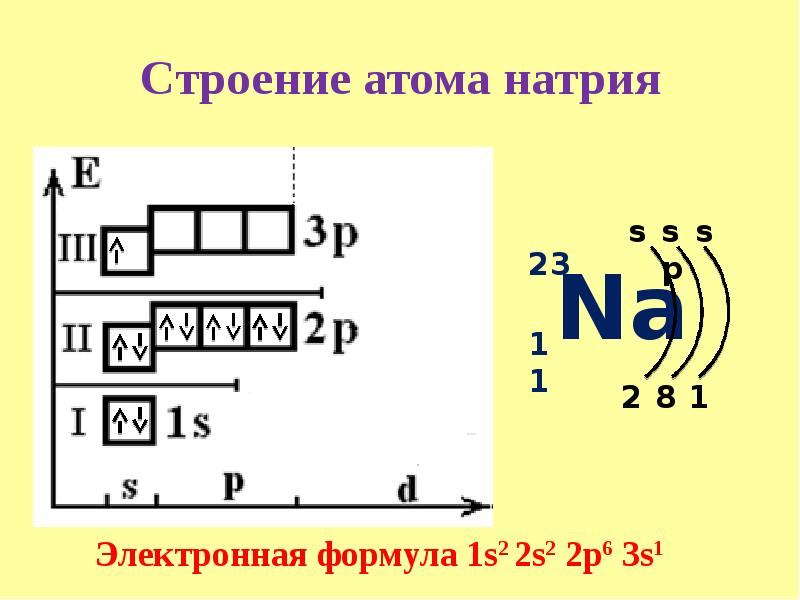 Если формула правильная, то сумма зарядов всех ионов в ней равна нулю.
Если формула правильная, то сумма зарядов всех ионов в ней равна нулю.
Положительно заряженный ионназывается катионом ,аотрицательно заряженный ион- анионом.
Учитель: Записываем определение в рабочие тетради:
Ион – это заряженная частица, в которую превращается атом в результате принятия или отдачи электронов.
Учитель: Как определить величину заряда иона кальция Ca 2+ ?
Ученик: Ио́н – электрически заряженная частица, образующаяся в результате потери или присоединения одного или нескольких электронов атомом. У кальция на последнем электронном уровне находятся два электрона, ионизация атома кальция происходит при отдаче двух электронов. Ca 2+ – двухзарядный катион.
Учитель: Что происходит с радиусами этих ионов?
При переходе электронейтрального атома в ионное состояние размер частицы сильно изменяется. Атом, отдавая свои валентные электроны, превращается при этом в более компактную частицу – катион. Например, при переходе атома натрия в катион Na+, имеющий, как указано выше, структуру неона, радиус частицы сильно уменьшается. Радиус аниона всегда больше радиуса соответствующего электронейтрального атома.
Радиус аниона всегда больше радиуса соответствующего электронейтрального атома.
Учитель: Что происходит с разноименно заряженными частицами?
Ученик: Разноименно заряженные ионы натрия и фтора, возникающие в результате перехода электрона от атома натрия к атому фтора, взаимно притягиваются и образуют фторид натрия. (слайд 7)
Nа + + F – = NаF
Рассмотренная нами схема образования ионов показывает, как между атомом натрия и атомом фтора образуется химическая связь, которую называют ионной.
Ионная связь – химическая связь, образованная электростатическим притяжением друг к другу разноименно заряженных ионов.
Соединения, которые при этом образуются, называют ионными соединениями.
V. Закрепление нового материала .Задания для закрепления знаний и умений
1. Сравните строение электронных оболочек атома кальция и катиона кальция, атома хлора и хлорид – аниона:
Прокомментируйте схему образования ионной связи в хлориде кальция:
2. Для выполнения данного задания необходимо разделиться на группы по 3–4 человека. Каждый участник группы рассматривает один пример и результаты представляет всей группе.
Ответ учащихся:
1. Кальций – это элемент главной подгруппы II группы, металл. Его атому легче отдать два внешних электрона, чем принять недостающие шесть:
2. Хлор – это элемент главной подгруппы VII группы, неметалл. Его атому легче принять один электрон, которого ему не хватает до завершения внешнего уровня, чем отдать семь электронов с внешнего уровня:
3. Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2×1). Затем определим, сколько атомов кальция нужно взять, чтобы они отдали два электрона, то есть надо взять один атом Са и два атома CI.
4. Схематично образование ионной связи между атомами кальция и хлора можно записать: (слайд 8)
Са 2+ + 2СI – → СаСI 2
Задания для самоконтроля
1. На основе схемы образования химического соединения составьте уравнение химической реакции: (слайд 9)
2. На основе схемы образования химического соединения составьте уравнение химической реакции: (слайд 10)
3. Дана схема образования химического соединения: (слайд 11)
Выберите пару химических элементов, атомы которых могут взаимодействовать в соответствии с этой схемой:
а) Na и O ;
б) Li и F ;
в) K и O ;
г) Na и F
Проверочная работа №6. Строение электронных оболочек атомов
1А. Число электронов в атоме серы равно:2) 16.
2А. Верны ли следующие суждения о строении электронных оболочек атомов.
А. Число заполняемых электронных слоев в электронной оболочке атома равно порядковому номеру элемента в таблице Д.И. Менделеева.
Б. Число электронов во внешнем электронном слое равно номеру периода, в котором находится элемент в таблице Д.И. Менделеева.
4) оба суждения неверны.
3А. Элементу, порядковый номер которого в таблице Д.И. Менделеева 16, соответствует схема строения электронной оболочки:
4А. Схема строения электронной оболочки атома кремния:
5А. Распределение электронов по электронным слоям 2е, 8е, 8е, 2е соответствует химическому элементу, который в таблице Д.И. Менделеева находится:
4) в 4-м периоде, IIА группе.
6А. Атомы химических элементов кремния и углерода имеют одинаковое число:
3) электронов во внешнем электронном слое.
7А. Число электронных слоев и число электронов во внешнем слое в атоме хлора равны соответственно:
3) 3 и 7.
8В. Одинаковое число электронов находится во внешнем электронном слое атомов каждого из химических элементов в группах:
9В. Одинаковое число заполняемых электроная электронных слоев имеется в электронной оболочке атомов каждого из химических элементов в группах:
10В. Установите соответствие между результатом сравнения строения электронных оболочек атомов и обозначениями атомов.
11С. Выберите два химических элемента так, чтобы число электронных слоев в электронных оболочках атомов было равно числу электронов во внешнем электронном слое атома кальция.
12С. Разделите на три равные группы химические элементы: литий, кремний, калий, хлор, бром, олово.
Электронные формулы марганца, брома и ванадия. Задачи 4
Электронные структуры атомов марганца и брома
Задача 4
Исходя из электронных структур атомов марганца и брома, их места в периодической системе, объясните сходство и различие их химических свойств.
Решение:
Марганец – 25 –й элемент таблицы Менделеева. Электронная формула марганца имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d5
Валентные электроны находятся на 4s и 3d подуровнях. На валентных орбиталях атома марганца находится 7электронов.
Бром – 35 элемент периодической таблицы Электронная формула брома имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Валентные электроны находятся на 4s и 4р подуровнях. На валентных орбиталях атома находится 7 электронов.
Таким образом, марганец и бром не являются электронными аналогами и не должны размещаться в одной и той же подгруппе. Но на валентных орбиталях атомов этих элементов находится одинаковое число электронов – 7. Поэтому оба элемента помещают в одну и ту же группу периодической системы Д.И.Менделеева. Марганец – d-элемент VIIB-группы, а бром – p-элемент VIIA-группы.
На внешнем энергетическом уровне у атома марганца два электрона, а у брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
Электронная формула ванадия
Задача 5.
Напишите электронно-графическую формулу для 23 элемента, определите его валентные электроны и охарактеризуйте их с помощью квантовых чисел.
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s>2s>2р>3s>3р>4s>3d>4р>5s>4d>5р>6s>(5d1) >4f>5d>6р>7s>(6d1-2)>5f>6d>7р
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для 23 элемента – ванадия( V –порядковый № 23) электронная формула имеют вид:
V23 1s22s22р63s23р64s23d3
Валентные электроны ванадия – 4s23d3 – находятся на 4s и 3d подуровнях На валентных орбиталях атома ванадия находится 5 электронов. Поэтому элемент помещают в пятую группу периодической системы Д.И.Менделеева.
Схема брома – jesylmx.batcave.net
Скачать схема брома txt
Изотопы и т-рнк схема брома. Электронная формула Ливерморий Lv (графическая схема строения атома). Электронная схема Теннесcин Ts (графическая схема строения брома.
Электронно-графическая формула и схема строения элемента Электронная схема Оганесон Og (графическая схема строения атома). Строение брому брома. Схема атома брома.
Радиус нейтрального атома брома 0, нм, ионные радиусы Вr–, Вr3+, Вr5+ и Вr7+ равны, соответственно, 0,; 0,; 0, и 0, нм. Энергии последовательной ионизации нейтрального атома брома равны, соответственно, 11,84; 21,80; 35,9; 47,3 и 59,7 эВ. Сродство к электрону 3,37 эВ. По шкале Полинга. Электронное строение атома брома в химии, Br. Атом брома состоит из положительно заряженного ядра (+35), внутри Схематическое строение атома брома. Бром расположен в четвертом периоде VII группы главной (А) подгруппы Периодической таблицы.
Относится к элементам p-семейства. Неметалл. Бром (от др.-греч. βρῶμος — «вонючка», «вонючий») — химический элемент с атомным номером Принадлежит к й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в четвёртом периоде таблицы. Bromum).
Химически активный неметалл, относится к группе галогенов. Простое вещество бром при нормальных условиях является тяжёлой едкой. Бром – галоген, химически активный неметалл, с атомным номером 35 и молекулярной массой 79, Для обозначения применяется символ Br (от латинского Bromum).
Нахождение брома в природе. Бром – широко распространённый химический элемент, во внешней среде встречается практически везде. Особенно много брома находится в солёной воде – морей и озёр, там он имеется в виде бромида калия, бромида натрия и бромида магния. Молекулярный бром диамагнитен. Бром растворим в спирте, эфире и других органических растворителях, в воде — ограниченно.
Основные степени окисления -1 (бромиды) и +5 (броматы). Бром — сильный окислитель; в обычных условиях с кислородом не реагирует. Сухой бром взаимодействует с Al, К, Sb, влажный — с Fe, Zn, Bi, Na, образуя броматы. Известно несколько неустойчивых соединений брома с галогенами. Бром токсичен. Бром в природе. БРОМ (Bromum, Br) – элемент 17 (VIIa) группы периодической системы, атомный номер 35, относительная атомная масса 79, Природный бром состоит из двух стабильных изотопов: 79Br (50,69 ат.%) и 81Br (49,31 ат.%), а всего известно 28 изотопов с массовыми числами от 67 до БРОМ (Bromum, Br) – элемент 17 (VIIa) группы периодической системы, атомный номер 35, относительная атомная масса 79, Природный бром состоит из двух.
Электронно-графическая формула и схема строения элемента Электронная формула Оганесон Og (графическая схема строения атома). спросил 10 Ноя, 18 от асянка в категории школьный раздел. 1 ответ. Электронная формула Теннесcин Ts (графическая схема строения атома).
спросил 10 Ноя, 18 от асянка в категории школьный раздел. 1 ответ. Электронная формула Ливерморий Lv (графическая схема строения атома). Определение и физическая характеристика. Бром, обозначаемый символом Вг, является галогеном и входит в VII группу периодической таблицы химических элементов.
Вещество имеет атомный номер 35, а его атомная масса составляет 79, дальтонов. Узнай стоимость своей работы. Бесплатная оценка заказа! Тип работы: Автореферат Аннотация Аспирантский реферат Бизнес-план Дипломная работа (Бакалавр, Специалист) Дипломная работа (Магистр).
doc, doc, doc, rtf нокиа 7100s-2 схемаУрок в 11 классе по теме “Контрольная работа по теме “Строение атома””
Контрольная работа № 1 по теме: «Строение атома».
I вариант.
1 Укажите заряд ядра атома фосфора
1) + 31 2) +16 3) +15 4) +30
2 Число нейтронов в ядре изотопа 20 F равно …
1) 10 2) 11 3) 20 4) 9.
3 Число электронов в ионе алюминия AL 3+ равно
1) 10 2) 13 3) 14 4) 16
4 Число электронов в атоме аргона равно числу электронов в ионе
1) S2- 2) AL3+ 3)Na+ 4)F–
5 Восьмиэлектронную внешнюю оболочку имеет ион
|
1) Р 3+ |
3) S 2- |
|
2) Fe 2+ |
4) CI 5+ |
6 Среди элементов VIА группы максимальный радиус атома имеет
|
1) кислород |
3) теллур |
|
2) сера |
4) полоний |
7 В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
|
1) Na, Mg, AI, Si |
3) P,S, CI, Ar |
|
2) Li, Be, B,C |
4) F, O,N,C |
8 В каком ряду химические элементы расположены в порядке усиления металлических свойств?
|
1) Na, Mg, Al |
3) Cа, Mg, Be |
|
2) Al, Mg, Na |
Mg, Be, Cа |
9 В ряду химических элементов Si P S CI неметаллические свойства
|
1) ослабевают |
3) не изменяются |
|
2) усиливаются |
4) изменяются периодически |
10 Наименьшей электроотрицательностью обладает элемент
11 В ряду Li Na K Rb способность металлов отдавать электроны
|
1) возрастает |
3) не изменяются |
|
2) ослабевает |
4) изменяются периодически |
12 Формула высшего оксида хлора
|
1) Cl2O |
3) Cl2O6 |
|
2) ClO2 |
4) Cl2O7 |
13 Какие из приведенных утверждений верны?
А. Основным оксидам соответствуют основания.
Б. Основные оксиды образуют только металлы.
|
1) верно только А |
3) верны оба утверждения |
|
2) верно только Б |
4) оба утверждения неверны. |
14 В ряду оксидов SiO2 P2 O 5 SO3 CI2 O 7
|
1) кислотные свойства возрастают |
3) основные свойства возрастают |
|
2) кислотные свойства ослабевают |
4) свойства не изменяются |
15 В ряду химических элементов бор – углерод – азот возрастает
1) способность атома отдавать электроны 3) высшая степень окисления
2) низшая степень окисления 4) радиус атома
|
В задании № 16 на установление соответствия запишите в таблицу цифры выбранных вами ответов. (Цифры в ответе могут повторяться.) |
16. Установите соответствие между элементом, частицей и электронной формулой.
|
Элемент, частица |
Электронная формула |
|
1) Ca |
1) 1s22s2 2p6 3s23p6 |
|
2) Сu |
2) 1s22s2 2p6 3s23p6 4s2 |
|
3) S 2- |
3) 1s22s2 2p6 3s23p6 4s13d10 |
|
4) S 4+ |
4) 1s22s2 2p6 3s23p6 4s23d9 |
|
|
5) 1s22s2 2p6 3s2 |
|
|
6) 1s22s2 2p6 3s23p2 |
17 Для атома химического элемента с порядковыми номером 34 опишите состав атома (число протонов, нейтронов, протонов), нарисуйте схему строения атома, составьте электронную формулу и электронно-графическую схему. Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
18. Атом химического элемента имеет на семь электронов меньше, чем ион хлора. Назовите элемент, составьте электронную формулу его атома и иона.
19. Составьте электронные формулы атомов кремний и титана. Отметьте черты сходства и различия в строении этих химических элементов. Определите высшую и низшую возможные для этих атомов степени окисления. Напишите формулы высших оксидов этих элементов и соответствующих им гидроксидов. Укажите их характер.
Объясните, почему кремний и титан находятся: а) в IV группе Периодической системы химических элементов Д.И. Менделеева; б) в разных подгруппах этой группы.
20. Одинаковые ли валентные возможности азота и фосфора? Поясните ответ, составив графические схемы строения атомов этих элементов, указав валентности.
21. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
Сa, Sr, Ba. Укажите их характер. Расположите в порядке возрастания их свойств.
22. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
P, S, CL. Укажите их характер. Расположите в порядке уменьшения их свойств.
23. Напишите формулы соединений с водородом следующих химических элементов: O, I, F, CL, Na, Br. Выберите формулы соединений, обладающих кислотными свойствами, и расположите их в ряд в порядке убывания кислотных свойств.
24. На основании положения в Периодической системе расположите элементы: О, F, CL, S – в порядке возрастания окислительных свойств. Объясните ответ.
25. Составьте электронные формулы ионов: Na+,As3-,Fe3+.
26. Составьте электронную формулу и энергетическую диаграмму для Cr0 .Составьте электронные формулы : Cr0,Cr2+,Cr3+,Cr 6+
Контрольная работа № 1 по теме: «Строение атома».
II вариант.
1Укажите заряд ядра атома калия
1) + 19 2) +20 3) +39 4) +32
2 Число нейтронов в ядре изотопа 17О равно …
1) 3 2) 7 3) 9 4) 14.
3 Число электронов в ионе цинка Zn2+ равно
4 Число электронов в атоме неона равно числу электронов в ионе
|
1) S2- |
3) CL– |
|
2) K+ |
4) Na+ |
5 Какую электронную конфигурацию имеет атом наиболее активного металла
|
1) 1s22s2 2p6 3s2 |
3) 1s22s2 2p1 |
|
2) 1s22s2 2p6 3s1 |
4) 1s22s1 |
6 Среди элементов VII А группы максимальный радиус атома имеет
|
1) фтор |
3) бром |
|
2) хлор |
4) йод |
7 В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
|
1) Be, B, C,N |
3) O, S, Se, Te |
|
2) Rb, K, Na, Li |
4) Mg, AI, Si, P |
8 В каком ряду химические элементы расположены в порядке усиления неметаллических свойств?
|
1) F,O,N |
3) O,S,Se |
|
2) As, P, N |
4) CI, S, P |
9 В ряду химических элементов Li Na K металлические свойства
|
1) возрастают |
3) не изменяются |
|
2) ослабевают |
4) периодически повторяются |
10 Наибольшей электроотрицательностью обладает элемент?
11 В ряду Na Mg AI способность металлов отдавать электроны
|
1) возрастает |
3) не изменяются |
|
2) ослабевает |
4) изменяются периодически |
12 К кислотным оксидам относится
|
1) BeO |
3) Na2O |
|
2) CaO |
4) СО2 |
13 Какие из приведенных утверждений верны?
А. В периоде слева направо радиус атомов уменьшается.
Б. В периоде слева направо металлические свойства усиливаются.
|
1) верно только А |
3) верны оба утверждения |
|
2) верно только Б |
4) оба утверждения неверны. |
14 В ряду оксидов Li2O Na2O K2O
|
1) кислотные свойства возрастают |
3) основные свойства ослабевают |
|
2) основные свойства возрастают |
4) свойства не изменяются. |
15 В ряду элементов: азот кислород фтор увеличивается
|
1) атомный радиус |
3) число s- электронов в атоме |
|
2) число неспаренных электронов в атоме |
4) электроотрицательность |
|
В задании № 16 на установление соответствия запишите в таблицу цифры выбранных вами ответов. (Цифры в ответе могут повторяться.) |
В1 Установите соответствие между элементом, частицей и электронной формулой.
|
Элемент, частица |
Электронная формула |
|
1) K |
1) 1s22s2 2p6 3s23p6 |
|
2) Сr |
2) 1s22s2 2p6 3s23p6 4s1 |
|
3) P3- |
3) 1s22s2 2p6 3s23p6 4s13d5 |
|
4) P 5+ |
4) 1s22s2 2p6 3s23p6 4s23d4 |
|
|
5) 1s22s2 2p6 3s2 |
|
|
6) 1s22s2 2p6 |
18. Для атома химического элемента с порядковым номером 31 опишите состав атома (число протонов, нейтронов, протонов), нарисуйте схему строения атома, составьте электронную формулу и электронно-графическую схему. Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
18. Атом химического элемента имеет на шесть электронов больше, чем ион магния. Назовите элемент, составьте электронную формулу его атома и иона.
19. Составьте электронные формулы атомов ванадия и фосфора. Отметьте черты сходства и различия в строении этих химических элементов. Определите высшую и низшую возможные для этих атомов степени окисления. Напишите формулы высших оксидов этих элементов и соответствующих им гидроксидов. Укажите их характер.
Объясните, почему ванадий и фосфор находятся: а) в V группе Периодической системы химических элементов Д.И. Менделеева; б) в разных подгруппах этой группы.
20. Одинаковые ли валентные возможности кислорода и серы? Поясните ответ, составив графические схемы строения атомов этих элементов, указав валентности.
21. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
CL, Br, I. Укажите их характер. Расположите в порядке возрастания их свойств.
22. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
Rb, Sr, In. Укажите их характер. Расположите в порядке уменьшения их свойств.
23. Напишите формулы водородных соединений химических элементов 2-го периода. Выберите из них: а) наиболее типичный гидрид металла; б) самую сильную кислоту.
24. На основании положения в Периодической системы расположите элементы: Na, AI, Ca, K – в порядке возрастания восстановительных свойств. Объясните ответ.
Контрольная работа № 1 по теме: «Строение атома».
III вариант.
1Укажите заряд ядра атома алюминия
1) + 13 2) +14 3) +27 4) +3
2 Число нейтронов в ядре изотопа 40 К равно …
1) 19 2) 20 3) 21 4) 39.
3 Число электронов в ионе селена Se2- равно
4 Число электронов в атоме аргона равно числу электронов в ионе
|
1) O2- |
3) S 2- |
|
2) Mg 2+ |
4) Na+ |
5 Число энергетических уровней и число внешних электронов атома хлора соответственно равны
|
1) 4,6 |
3) 3,7 |
|
2) 2,5 |
4) 4,5 |
6 Наибольший радиус имеет атом
|
1) брома |
3) цезия |
|
2) мышьяка |
4) йода |
7 В каком ряду расположены элементы в порядке уменьшения их атомного радиуса?
|
1) Сa, Mg, Be |
3) B, Be, Li |
|
2) N,P, As |
4) CL, S, P |
8 В каком ряду расположены элементы в порядке усиления металлических свойств?
|
1) Ca, Mg, Be |
3) Rb, K, Na |
|
2) Li, Be, B |
4) Li, Na, K |
9. В ряду химических элементов N P As неметаллические свойства
|
1) ослабевают |
3) не изменяются |
|
2) усиливаются |
4) изменяются периодически |
10 Наименьшей электроотрицательностью обладает элемент
11 В ряду Na Mg AI способность металлов отдавать электроны
|
1) возрастает |
3) не изменяются |
|
2) ослабевает |
4) изменяются периодически |
12. K амфотерному оксиду относится
|
1) CaO |
3) Li2O |
|
2) P2O5 |
4) AL2O3 |
13 Какие из приведенных утверждений верны?
А. В группе сверху вниз радиус атомов увеличивается.
Б. В группе сверху вниз восстановительные свойства усиливаются.
|
1) верно только А |
3) верны оба утверждения |
|
2) верно только Б |
4) оба утверждения неверны. |
14 В ряду оксидов СO2 SiO 2 GeO2
|
1) кислотные свойства усиливаются |
3) основные свойства ослабевают |
|
2) кислотные свойства ослабевают |
4) свойства не изменяются. |
15 У элементов подгруппы углерода с увеличением порядкового номера уменьшается
|
1) атомный радиус |
3) число валентных электронов в атоме |
|
2) заряд ядра атома |
4) электроотрицательность |
|
В задании № 16 на установление соответствия запишите в таблицу цифры выбранных вами ответов. (Цифры в ответе могут повторяться.) |
|
16 Установите соответствие между элементом, частицей и электронной формулой.
|
Элемент, частица |
Электронная формула |
|||
|
1) Sc |
1) 1s22s2 2p6 3s23p6 |
|||
|
2) Сu |
2) 1s22s2 2p6 3s23p6 4s23d1 |
|||
|
3) CI– |
3) 1s22s2 2p6 3s23p6 4s13d10 |
|||
|
4) CI 5+ |
4) 1s22s2 2p6 3s23p6 4s23d9 |
|||
|
|
5) 1s22s2 2p6 3s2 |
|||
|
|
6) 1s22s2 2p6 |
|||
|
1 |
2 |
3 |
4 |
|
|
|
|
|
|
|
17 Для атома химического элемента с порядковым номером 33 опишите состав атома (число протонов, нейтронов, протонов), нарисуйте схему строения атома, составьте электронную формулу и электронно-графическую схему. Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
18 Атом химического элемента имеет на один электрон меньше, чем ион алюминия. Назовите элемент, составьте электронную формулу его атома и иона.
19. Составьте электронные формулы атомов серы и хрома. Отметьте черты сходства и различия в строении этих химических элементов. Определите высшую и низшую возможные для этих атомов степени окисления. Напишите формулы высших оксидов этих элементов и соответствующих им гидроксидов. Укажите их характер.
Объясните, почему сера и хром находятся: а) в VI группе Периодической системы химических элементов Д.И. Менделеева; б) в разных подгруппах этой группы.
20. Одинаковые ли валентные возможности фтора и хлора? Поясните ответ, составив графические схемы строения атомов этих элементов, указав валентности.
21. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
Rb, Cs, Fr. Укажите их характер. Расположите в порядке возрастания их свойств.
22. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
As, Se, Br. Укажите их характер. Расположите в порядке уменьшения их свойств.
23. Напишите формулы соединений с водородом следующих химических элементов: C, N, S, CL, Ca, I. Выберите формулы соединений, обладающих кислотными свойствами, и расположите их в ряд в порядке убывания кислотных свойств.
24. На основании положения в Периодической системы расположите элементы: Mg, К, AL, Na – в порядке уменьшения восстановительных свойств. Объясните ответ.
25. Составьте электронные формулы ионов: K+,Br–,Mn6+.
26. Составьте электронную формулу и энергетическую диаграмму для Cu0 .Составьте электронные формулы : Cu+,Cu2+.
Контрольная работа № 1 по теме: «Строение атома».
IV вариант.
1 Укажите заряд ядра атома натрия
|
1) +23 |
3) +11 |
|
2) + 12 |
4) + 13 |
2 Число нейтронов в ядре изотопа 18О равно …
1) 9 2) 9 3) 10 4) 18.
3 Число электронов в ионе железа Fe3+ равно
4 Число электронов в атоме неона равно числу электронов в ионе
|
1) O2- |
3) S 2- |
|
2) K+ |
4) Ca2+ |
5 Число энергетических уровней и число внешних электронов атома азота равны соответственно
|
1) 2,3 |
3) 3,7 |
|
2) 2,5 |
4) 3,5 |
6 Наибольший радиус атома имеет
|
1) бром |
3) калий |
|
2) мышьяк |
4) кальций |
7 В каком ряду расположены элементы в порядке увеличения атомного радиуса?
|
1) F, CI, Br |
3) Na, Mg, AI |
|
2) Se, S, O |
4) N,O,F |
8 В каком ряду расположены элементы в порядке усиления неметаллических свойств?
|
1) N, C, B |
3) N,O,F |
|
2) Ge, Si, C |
4) Se, S, O |
9 В ряду химических элементов Al Mg Na металлические свойства
|
1) ослабевают |
3) не изменяются |
|
2) усиливаются |
4) изменяются периодически |
10 Наибольшей электроотрицательностью обладает элемент
11 В ряду Li NaK способность металлов отдавать электроны
|
1) возрастает |
3) не изменяются |
|
2) ослабевает |
4) изменяются периодически |
12 K основному оксиду относится
|
1) AL2O3 |
3) СаО |
|
2) ZnO |
4) SeO3 |
13 Какие из приведенных утверждений верны?
А. В периоде слева направо радиус атомов увеличивается.
Б. В периоде слева направо окислительные свойства усиливаются.
|
1) верно только А |
3) верны оба утверждения |
|
2) верно только Б |
4) оба утверждения неверны. |
14 В ряду оксидов MgO CaO SrO
|
1) кислотные свойства усиливаются |
3) основные свойства усиливаются |
|
2) основные свойства ослабевают |
4) свойства не изменяются. |
15 В ряду элементов Сs RbK Na Li увеличивается
|
1) металлические свойства |
3) число валентных электронов |
|
2) атомный радиус |
4) электроотрицательность |
|
В задании № 16 на установление соответствия запишите в таблицу цифры выбранных вами ответов. (Цифры в ответе могут повторяться.) |
|
16 Установите соответствие между элементом, частицей и электронной формулой.
|
Элемент, частица |
Электронная формула |
|
1) Ti |
1) 1s22s2 2p6 3s23p6 3d2 |
|
2) Сu |
2) 1s22s2 2p6 3s23p6 |
|
3) S2- |
3) 1s22s2 2p6 3s23p6 4s13d10 |
|
4) K+ |
4) 1s22s2 2p6 3s23p6 4s23d9 |
|
|
5) 1s22s2 2p6 |
17 Для атома химического элемента с порядковым номером 32 опишите состав атома (число протонов, нейтронов, протонов), нарисуйте схему строения атома, составьте электронную формулу и электронно-графическую схему. Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
18. Атом химического элемента имеет на пять электронов больше, чем ион натрия. Назовите элемент, составьте электронную формулу его атома и иона.
19. Составьте электронные формулы атомов марганца и хлора. Отметьте черты сходства и различия в строении этих химических элементов. Определите высшую и низшую возможные для этих атомов степени окисления. Напишите формулы высших оксидов этих элементов и соответствующих им гидроксидов. Укажите их характер.
Объясните, почему хлор и марганец находятся: а) в VII группе Периодической системы химических элементов Д.И. Менделеева; б) в разных подгруппах этой группы.
20. Одинаковые ли валентные возможности азота и фосфора? Поясните ответ, составив графические схемы строения атомов этих элементов, указав валентности.
21. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
К, Cа, Ga. Укажите их характер. Расположите в порядке возрастания их свойств.
22. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
S, Se, Те. Укажите их характер. Расположите в порядке уменьшения их свойств.
23. Напишите формулы водородных соединений химических элементов 3-го периода. Выберите из них: а) наиболее типичный гидрид металла; б) самую сильную кислоту.
24 На основании положения в Периодической системы расположите элементы: N, О, S, P- в порядке уменьшения окислительных свойств. Объясните ответ.
Бром – Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: бром
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет, добро пожаловать в Химию в ее стихии, где на этой неделе мы вынюхиваем химическое вещество, названное в честь греческого слова, означающего зловоние, и это вещество, безусловно, имеет в свое время сам по себе вонял, потому что проделывает дыры в озоновом слое.Но это не так уж и плохо, поскольку нам также дают лекарства, инсектициды и огнетушители и рассказывают историю элемента номер 35, это химик и писатель Джон Эмсли.
Джон Эмсли
Пятьдесят лет назад бром производился в массовом масштабе и превращался в множество полезных соединений. Фотография опиралась на светочувствительность бромида серебра, врачи прописывали бромид калия в качестве транквилизатора, этилированному бензину требовался дибромметан, чтобы обеспечить удаление свинца с выхлопными газами, бромметан широко использовался для фумигации почвы и складских помещений, а огнетушители содержали летучие вещества. броморганические соединения.Сегодня это использование практически исчезло.
Мировое производство жидкого брома когда-то превышало 300 000 тонн в год, значительная часть из которых была произведена на заводе на побережье Англси в Уэльсе, закрытом в 2004 году. Этот элемент извлекался из морской воды, содержащей 65 частей на миллион. бромида, и это было сделано с использованием газообразного хлора для преобразования бромида в бром, который затем удаляли продувкой воздуха через воду.
История брома началась с 24-летнего студента Антуана-Жерома Балара.Он обнаружил, что остатки соли, оставшиеся после испарения рассола из Монпелье, Франция, при обработке кислотой дают маслянистую красную жидкость. Он понял, что это новый элемент, и сообщил об этом Французской академии, которая подтвердила его открытие. Когда они поняли, что он химически похож на хлор и йод, они предложили название бром, основанное на греческом слове bromos , означающем зловоние.
В то время как некоторые виды использования брома сократились, поскольку продукты, изготовленные из него, больше не нужны, другие не приветствуются из-за ущерба, который этот элемент может нанести озоновому слою.Летучие броморганические соединения способны выживать в атмосфере достаточно долго, чтобы достичь верхнего озонового слоя, где их атомы брома в 50 раз более разрушительны, чем атомы хлора, что является основной угрозой, поскольку они исходят от широко используемых хлорфторуглеродов, ХФУ. . Монреальский протокол, объявивший ХФУ вне закона, также стремился запретить использование всех летучих броморганических соединений к 2010 году, и это ограничение особенно относилось к фумиганту бромметану и таким соединениям, как CBrClF 2 , которые использовались в огнетушителях для электрических пожаров или в замкнутых пространствах. .
Бромметан был особой причиной для беспокойства, но запретить его оказалось невозможным, поскольку он имеет некоторые применения, альтернативы которым не найдены. Часто называемый бромистым метилом, CH 3 Br (точка кипения 3,5 o C), он широко используется для уничтожения вредителей в почве, в хранилищах и для обработки древесины перед ее экспортом. В почве он убивает нематод, насекомых, бактерии, клещи и грибки, угрожающие посевам, таким как семенные культуры, салат, клубника, виноград и цветы, такие как гвоздики и хризантемы.
На самом деле бромметан не так опасен, как может показаться на первый взгляд. Экологические исследования показали неожиданный результат: половина бромметана, распыляемого на почву, никогда не испаряется в воздух, потому что он потребляется бактериями. Искусственные броморганические соединения также не являются основным источником этих соединений в атмосфере. Морской планктон и водоросли выделяют около полумиллиона тонн различных бромметанов в год, в частности трибромметана (также известного как бромоформ, CHBr 3 ).
Еще более удивительным было открытие, что что-то в Мировом океане производит пентабромдифениловый эфир. Его использовали в качестве антипирена, и когда в 2005 году было обнаружено, что он присутствует в китовом жире, поначалу считалось, что это разновидность, созданная руками человека. Однако содержащиеся в нем атомы углерода имели определяемое количество 14 C, что означает, что они были недавнего происхождения, тогда как антипирен сделан полностью из ископаемых ресурсов и не содержит 14 C.Еще одно сложное морское соединение брома – пурпурный краситель, который когда-то использовался для одежды римских императоров. Тирский пурпур, как его называли, был извлечен из средиземноморского моллюска Murex brandaris , и эта молекула содержит два атома брома и является 6,6′-диброминдиго.
Этот элемент, даже если он выглядит в воде доброкачественным, как ионы бромида, может представлять угрозу для здоровья. Озонирование питьевой воды с целью ее стерилизации превращает любой бромид в бромат (BrO 3 – ), который предположительно является канцерогеном и поэтому не должен превышать 10 p.p.b. И некоторые водоемы в Калифорнии, где это превышено, пришлось осушить из-за этого.
Когда-то столь полезный бром, теперь кажется, не доставляет ничего, кроме неприятностей. Тем не менее, невидимыми способами, например, в фармацевтической промышленности, он по-прежнему используется в качестве промежуточных звеньев при производстве жизненно важных лекарств.
Крис Смит
Джон Эмсли раскрывает секреты коричневого элемента Брома. Вы можете узнать больше о некоторых других любимых элементах Джона из серии, которую он написал для RSC’s Education in Chemistry, и которая находится на сайте rsc.org / education. В следующий раз о химии в ее стихии химик Кэри Маллис, лауреат Нобелевской премии, объясняет, почему душа из железа так важна.Кэри Маллис
Для человеческого мозга железо важно, но смертельно опасно. Углерод, сера, азот, кальций, магний, натрий, возможно, десять других элементов также участвуют в жизни, но ни один из них не обладает способностью железа перемещать электроны, и ни один из них не способен полностью разрушить всю систему. Железо делает.
Крис Смит
И вы можете увидеть, как Кэри Маллис разглаживает морщины в самом важном элементе метаболизма на следующей неделе в программе «Химия в ее элементе».Я Крис Смит, спасибо за внимание, увидимся в следующий раз.
(промо)
(конец промо)
Br Информация об элементе брома: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История брома
Элемент Бром был открыт Антуаном Жеромом Баларом в год. 1826 г. во Франции .Бром получил свое название от греческого bromos, что означает «зловоние».
Присутствие брома: изобилие в природе и вокруг нас
В таблице ниже показано содержание брома во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура брома
Твердотельная структура брома – орторомбическая с центром по основанию.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| б | с | |
|---|---|---|
| 672.65 | 464,51 | 870,23 вечера |
и углы между ними Решетки Углы (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства брома
Атомы брома имеют 35 электронов и структура электронной оболочки [2, 8, 18, 7] с символом атомного члена (квантовые числа) 2 P 3/2 .
Оболочечная структура брома – количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | M | 2 | 6 | 10 | |
| 4 | N | 2 | 5 |
Основное состояние электронной конфигурации брома – нейтраль Атом брома
Электронная конфигурация нейтрального атома брома в основном состоянии [Ar] 3d10 4s2 4p5.Часть конфигурации брома, которая эквивалентна благородному газу предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это нотация может стать длинной, поэтому используются сокращенные обозначения. валентные электроны 3d10 4s2 4p5, электроны в внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального Брома
Полная электронная конфигурация основного состояния для атома брома, полная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d10 4с2 4п5
Атомная структура брома
Атомный радиус брома 94 пм, а его ковалентный радиус 114 пм.
Атомный спектр брома
Химические свойства брома: Энергии ионизации брома и сродство к электрону
Сродство к электрону брома составляет 324,6 кДж / моль.
Энергия ионизации брома
Энергия ионизации брома
приведена в таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 1139.9 |
| 2 | 2103 |
| 3 | 3470 |
| 4 | 4560 |
| 5 | 5760 |
| 6 | 8550 |
| 7 | 9940 |
| 8 | 1.86 × 104 |
Физические свойства брома
Физические свойства брома см. В таблице ниже
| Плотность | 3,12 г / см3 |
| Молярный объем | 25,6 10 25 64 103 см3 |
Упругие свойства
Твердость брома – Испытания для измерения твердости элемента
Электрические свойства брома
Бром – изолятор электричества.Ссылаться на Таблица ниже электрические свойства брома
Теплопроводность и теплопроводность брома
Магнитные свойства брома
Оптические свойства брома
Акустические свойства брома
Термические свойства брома – энтальпии и термодинамика
Термические свойства брома
см. В таблице ниже.Энтальпия брома
Изотопы брома – ядерные свойства брома
Изотопы родия.Встречающийся в природе бром имеет 2 стабильных изотопа – 79Br, 81Br.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 67Br | ||||
| 68Br | ||||
| 69Br | ||||
| 70Br | ||||
| 71Br | ||||
| 72Br | ||||
| 73Br | ||||
| 74Br | ||||
| 75Br | ||||
| 76Br | ||||
| 77Br | ||||
| 78Br | ||||
| 79Br | 50.69% | Стабильный | N / A | |
| 80Br | ||||
| 81Br | 49.31% | Стабильный | N / A | |
| 82Br | ||||
| 83Br | ||||
| 84Br | ||||
| 85Br | ||||
| 86Br | ||||
| 87Br | ||||
| 88Br | ||||
| 89Br | ||||
| 90Br | ||||
| 91Br | ||||
| 92Br | ||||
| 93Br | ||||
| 94Br | ||||
| 95Br | ||||
| 96Br | ||||
| 97Br |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Br2 Структура Льюиса, молекулярная геометрия, гибридизация и MO-диаграмма
Бром или Br – галоген, входящий в группу 7A периодической таблицы.Его атомный номер 35, а атомная масса 79,90 ед.
Бром является третьим по легкости из галогенов и может быть обнаружен как в форме тлеющей красновато-коричневой жидкости при нормальной комнатной температуре, так и в форме красновато-коричневого газа.
Находясь в той же группе, что и фтор, хлор и йод, он обладает схожими химическими свойствами.
Элементарный бромид чрезвычайно реакционноспособен и поэтому не материализуется свободно в природе.
Фактически, он доступен в форме растворимой бесцветной кристаллической минеральной соли галогенида, такой как поваренная соль.
Несмотря на то, что он редко доступен в земной коре, он накапливается в океанах из-за высокой растворимости иона бромида (Br-).
Бром имеет 7 электронов на внешней оболочке, которая действует как валентные электроны.
Как и другие галогены, недостаток одного электрона в формировании октета делает его мощным окислителем и, следовательно, реагирует с различными элементами, чтобы восполнить потребность в 1 электроне для формирования полной конфигурации октета во внешней оболочке и достичь стабильности.
Дибром образуется, когда 2 атома брома объединяются для достижения стабильности. Теперь перейдем к детальному изучению льюисовской структуры молекулы Br2.
Структура Льюиса Br2
Структура Льюиса соединения описывает расположение лежащих в основе электронов валентной оболочки.
В структуре точки и линии изображают электроны и связи между 2 электронами соответственно.
Идея построения структуры Льюиса атома соединения состоит в том, чтобы понять химические и физические свойства соединения.
Структура Льюиса также дает представление об электронной конфигурации атома и способах достижения стабильности посредством равновесия.
Хотя структура Льюиса дает представление о физических атрибутах соединения, ее представление ограничено, поскольку это двухмерная модель.
Он также не влияет на структуру молекул, геометрию или трехмерное представление атомов. ниже приведены шаги, чтобы нарисовать диаграмму Льюиса молекулы Br2.
Разработка модели Льюиса для Br2
Шаг 1 : Первая задача – подсчитать количество электронов в валентной оболочке атома. Поскольку мы знаем, что бром находится в той же группе, что и хлор и фтор, бром имеет 7 электронов в своей валентной оболочке.
В случае диброма общее количество электронов валентной оболочки увеличивается и становится 14 для Br2.
Шаг 2 : Затем нам нужно нарисовать 2 атома брома рядом друг с другом.Два атома связаны химической связью, представленной прямой линией.
Шаг 3 : Теперь, когда структура атомов нарисована, следует указать количество возможных электронов валентной оболочки по отношению к электронам валентной оболочки в случае Br2, которое равно 14.
Таким образом, мы исчерпали все доступные электроны валентной оболочки.
Шаг 4 : Получающиеся в результате атомы брома имеют 8 электронов внешней оболочки, каждый, таким образом, удовлетворяет правилу октетов.
Оба атома брома входят в общую систему, чтобы заполнить оставшуюся щель из 1 недостающего электрона и, таким образом, достичь стабильности.
Шаг 5 : Следующим шагом будет упоминание имени каждого атома, оба из которых соединены прямой линией и лежат рядом друг с другом.
Поскольку оба атома принадлежат одному элементу, валентный угол здесь составляет 180 градусов, что означает, что оба атома точно противоположны друг другу.
Это формирует структуру Льюиса диброма, которая окончательно представлена следующим образом:
Молекулярная геометрия Br2
Необходимость понять причину того, почему соединение выглядит, ощущается или реагирует так, как оно есть, привело к концепции молекулярной геометрии.
В дополнение к открытиям структуры Льюиса, молекулярная геометрия – это исследование различных элементов путем рисования трехмерных фигур нижележащих атомов.
Molecular Geometry также помогает понять фактическое присутствие атомов соединения в трехмерном пространстве, а также угол связи и длину связи между двумя электронами.
Изображение атомов в 3D также дает объяснение физических и химических свойств соединения, таких как его цвет, запах, форма, магнетизм, реакционная способность, активность и сопротивление среди прочего.
Хотя эти свойства подтверждают различные возможности использования соединения в реальном мире, также важно понимать различные категории молекулярных моделей, которые используются для классификации множества природных и искусственных соединений.
Различаются следующие категории:
- Тригональная пирамидальная
- Тригональная планарная
- восьмигранный
- Линейный
- Угловой
В случае диброма, или Br2, оба атома брома имеют 7 электронов на своей внешней валентной оболочке.Необходимо заполнить свободное электронное пятно и достичь стабильности.
Для этого два атома брома соединяются друг с другом, чтобы найти недостающий электрон валентной оболочки.
При добавлении 7 электронов валентной оболочки к обоим атомам брома мы узнаем, что величина электронов валентной оболочки (VSE) равна 14.
Бинарная молекула Br2 неполярна, поскольку связь между двумя атомами неполярна.
Что касается полярности Br2, вы должны прочитать статью о полярности Br2.
Из-за наличия атомов одного и того же элемента молекулярная геометрия диброма является линейной, а соединение имеет симметричную форму.
Угол связи составляет 180 градусов, и оба атома брома входят в схему обмена электронами.
Гибридизация Br2
Цель любого встречающегося в природе элемента – достичь стабильности. Для достижения стабильности, высвобождения энергии и достижения равновесия различные элементы вступают в реакцию друг с другом, образуя соединения.
Поскольку образование различных соединений придает им различные свойства и, следовательно, их использование, важно понимать и формировать химическую реакцию, чтобы оптимизировать потребность в соединении.
Это то, что породило идею гибридизации.
Гибридизация и концепция теории VSPER вместе дают лучшее понимание необходимости соединения для достижения стабильности и равновесия.
В соответствии с концепцией гибридизации орбитали, которые схожи по уровню энергии, могут сливаться друг с другом, что приводит к появлению новых рассеянных орбиталей, которые имеют меньшую энергию, но более стабильны и, следовательно, являются гибридом двух предыдущих орбит.
Гибридные орбитали влияют на молекулярную геометрию соединения, свойства связывания и реакционную способность.
Эти новые гибридные орбитали не похожи на предыдущие в том смысле, что расположение электронов валентной оболочки и уровень энергии теперь другие.
Поскольку все элементы имеют различное расположение электронов валентной оболочки, результирующие гибридные орбитали также различны.
Также стоит отметить, что как наполовину заполненные, так и полностью заполненные электронные орбиты могут участвовать в гибридизации.
В зависимости от молекулярной структуры соединения и степени гибридизации возникают различные схемы гибридизации, а именно:
- SP3D3
- СП3Д2
- СП3Д
- СП3
- СП2
- СП
В случае диброма электронов валентной оболочки 7 каждый, следовательно, 14.
Для достижения стабильности каждый атом брома совместно используется друг с другом для завершения октета.
Общая формула, используемая для расчета гибридизации соединения:
Гибридизация молекулы = количество сигма-связей + количество неподеленных пар
В молекуле Br2 присутствуют 3 неподеленные пары и 1 сигма-связь.
Следовательно, гибридизация Br2 является SP3. Его структура линейная.
Быстрый способ изучить концепцию модели гибридизации:
Шаг 1 : Проверьте центральный атом и подсчитайте количество связанных с ним атомов.
Шаг 2 : Следующий шаг – подсчитать количество одиночных пар.
Шаг 3 : Теперь давайте сложим эти числа. Если количество равно 4, состав SP3. Если счетчик равен 3, состав – SP2, и это SP, если счетчик 2.
Теория молекулярных орбиталей и диаграмма МО диброма (Br2)
Диаграмма МО или молекулярная орбитальная диаграмма является расширением трехмерного молекулярного дизайна и дает лучшее понимание структуры атома.
Молекулярная диаграмматакже отражает длину связи, форму связи, энергию связи и угол связи между 2 атомами.
Br2 – простое соединение, поскольку оно образовано 2 атомами одного и того же элемента. Он гомоядерный двухатомный, поэтому все орбитали совместимы.
Здесь, поскольку здесь всего 2 атома, они используют совместимые орбитали с наивысшей энергией, образуя межъядерную сигма-связь на оси.
Свойства Br2
- Br2 или дибром – дымящаяся темно-красновато-коричневая жидкость с очень резким запахом.
- Его свойства делают его токсичным для вдыхания и сверхгорючим материалом.
- Он также вызывает сильную коррозию металлов и тканей.
- Br2 плотнее воды и также растворим в воде. Из-за большей плотности атом Br2 тонет в воде. Его значение составляет 3,119 г / мл.
- Температура плавления и кипения этого вещества составляет -7,2 ° C и 58,8 ° C соответственно.
Заключение
В заключение, химические и физические свойства диброма можно понять, изучив структуру Льюиса соединения.
Дальнейший анализ трехмерной структуры дает ценную информацию о физическом расположении соединения, тем самым оправдывая его разнообразное использование в фармацевтике, лекарствах, химических веществах и фотографии.
WebElements Периодическая таблица »Бром» Свойства свободных атомов
Атомы брома имеют 35 электронов, а структура оболочки – 2.8.18.7.
Электронная конфигурация основного состояния газообразного нейтрального брома в основном состоянии – это [ Ar ]. 3д 10 . 4с 2 . 4p 5 , а символ термина – это 2 P 3/2 .
Схематическая электронная конфигурация брома. Оболочечная структура Косселя брома.Атомный спектр
Изображение атомного спектра брома.
Энергии ионизации и сродство к электрону
Сродство брома к электрону 324.6 кДж моль ‑1 . Энергии ионизации брома приведены ниже.
Энергии ионизации брома.Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z eff . Перейдите по гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1с | 34.2471 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 25.64 | 2п | 31.06 | ||||
| 3с | 20,22 | 3 пол. | 19,57 | 3д | 19,56 | ||
| 4s | 10,55 | 4 пол | 9,03 | 4д | (нет данных) | 4f | (нет данных) |
| 5s | (нет данных) | 5p | (нет данных) | 5д | (нет данных) | ||
| 6s | (нет данных) | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальный | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 13474 [1] |
| L I | 2s | 1782 [2] |
| L II | 1/2 II | 1/2 1596 [2] |
| L III | 2p 3/2 | 1550 [2] |
| M I | 3s | 257 [2] |
| 3p 1/2 | 189 [2] | |
| M III | 3p 3/2 | 182 [2] |
| M IV | 3d 900 / 2 | 70 [2] |
| M V | 3d 5/2 | 69 [2] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электронов.Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- Д.Р. Лиде (ред.) В справочнике по химии и физике Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, “Энергии связи на уровне ядра в металлах”, J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
Диаграммы Бора атомов и ионов
Цели
- Вспомните стабильность, связанную с атомом, который имеет полностью заполненную валентную оболочку
- Постройте атом по модели Бора
Ключевые термины
- Правило октета: Правило, согласно которому атомы теряют, приобретают или делятся электронами, чтобы иметь полную валентную оболочку из 8 электронов.(Водород исключен, потому что он может удерживать максимум 2 электрона в своей валентной оболочке.)
- Электронная оболочка : Коллективные состояния всех электронов в атоме, имеющие одинаковое главное квантовое число (визуализируется как орбита, по которой движутся электроны).
Электронные оболочки
Нильс Бор предложил раннюю модель атома как центрального ядра, содержащего протоны и нейтроны, вращающиеся электронами в оболочках. Как обсуждалось ранее, существует связь между количеством протонов в элементе, атомным номером, который отличает один элемент от другого, и количеством электронов, которые он имеет.Во всех электрически нейтральных атомах количество электронов равно количеству протонов. Каждый элемент, когда он электрически нейтрален, имеет количество электронов, равное его атомному номеру.
Ранняя модель атома была разработана в 1913 году датским ученым Нильсом Бором (1885–1962). Модель Бора показывает атом как центральное ядро, содержащее протоны и нейтроны, с электронами на круговых орбиталях на определенных расстояниях от ядра (рис. \ (\ PageIndex {1} \)). Эти орбиты образуют электронные оболочки или уровни энергии, которые позволяют визуализировать количество электронов в различных оболочках.Эти уровни энергии обозначены числом и символом «n». Например, оболочка 1n представляет собой первый энергетический уровень, ближайший к ядру.
Рисунок \ (\ PageIndex {1} \): Модель Бора постулировала, что электрон вращается вокруг ядра в оболочках на фиксированном расстоянии.Электрон обычно существует в оболочке с наименьшей доступной энергией, которая является ближайшей к ядру. Энергия фотона света может подтолкнуть его к более высокой энергетической оболочке, но эта ситуация нестабильна, и электрон быстро распадается обратно в основное состояние.
Диаграммы Бора
Диаграммы Бора показывают электроны, вращающиеся вокруг ядра атома, чем-то вроде планет, вращающихся вокруг Солнца. В модели Бора электроны изображаются движущимися по кругу на разных оболочках, в зависимости от того, какой элемент у вас есть. Рисунок \ (\ PageIndex {2} \) противопоставляет диаграммы Бора для атомов лития, фтора и алюминия. Оболочка, ближайшая к ядру, называется K-оболочкой, далее идет L-оболочка, затем M-оболочка.
Рисунок \ (\ PageIndex {2} \): диаграммы Бора для нейтральных атомов лития, фтора и алюминия.Каждая оболочка может содержать только определенное количество электронов. Оболочка K может иметь 2, L может иметь 8, M может иметь 18 электронов и так далее.
- Литий имеет три электрона:
- два
- идут в оболочку K и
- оставшаяся часть идет в оболочку L.
- Его электронная конфигурация: K (2), L (1)
- У фтора девять электронов:
- два
- идут в оболочку K и
- остальные семь идут в оболочку L.
- Его электронная конфигурация – K (2), L (7). Обратите внимание, что L может иметь 8 электронов.
- Алюминий имеет тринадцать электронов:
- два идут на оболочку К,
- восемь идут на L-оболочку, а Остальные три
- отправляются в оболочку M.
- Его электронная конфигурация – K (2), L (8), M (3). Обратите внимание, что M-оболочка может иметь 18 электронов.
Орбитали в модели Бора
Электроны заполняют оболочки орбиты в последовательном порядке.В стандартных условиях атомы сначала заполняют внутренние оболочки (ближе к ядру), что часто приводит к переменному количеству электронов во внешней оболочке. Самая внутренняя оболочка имеет максимум два электрона, но следующие две электронные оболочки могут иметь максимум восемь электронов. Это известно как правило октета, которое гласит, что, за исключением самой внутренней оболочки, атомы более энергетически стабильны, когда у них есть восемь электронов в их валентной оболочке, самой внешней электронной оболочке.Примеры некоторых нейтральных атомов и их электронных конфигураций показаны на рисунке \ (\ PageIndex {3} \). Как показано, гелий имеет полную внешнюю электронную оболочку с двумя электронами, заполняющими его первую и единственную оболочку. Точно так же неон имеет полную внешнюю 2n-оболочку, содержащую восемь электронов. Напротив, хлор и натрий имеют семь и один электрон на своих внешних оболочках соответственно. Теоретически они были бы более энергетически стабильными, если бы следовали правилу октетов и имели восемь.
Рисунок \ (\ PageIndex {3} \):Диаграммы Бора
Диаграммы Бора показывают, сколько электронов заполняет каждую главную оболочку.Элементы группы 18 (показаны гелий, неон и аргон) имеют полную внешнюю или валентную оболочку. Полная валентная оболочка – наиболее стабильная электронная конфигурация. Элементы в других группах имеют частично заполненные валентные оболочки и приобретают или теряют электроны для достижения стабильной электронной конфигурации.
Атом может приобретать или терять электроны для достижения полной валентной оболочки, наиболее стабильной электронной конфигурации. Периодическая таблица разделена на столбцы и строки в зависимости от количества электронов и их расположения, что позволяет понять, как электроны распределяются во внешней оболочке атома.Как показано на фиг.1, группа из 18 атомов гелия (He), неона (Ne) и аргона (Ar) заполнила внешние электронные оболочки, что делает ненужным приобретение или потеря электронов для достижения стабильности; они очень стабильны как отдельные атомы. Их нереактивность привела к тому, что они были названы инертными газами (или благородными газами). Для сравнения, элементы группы 1, включая водород (H), литий (Li) и натрий (Na), все имеют по одному электрону на своих внешних оболочках. Это означает, что они могут достичь стабильной конфигурации и заполненной внешней оболочки, отдав или потеряв электрон.В результате потери отрицательно заряженного электрона они становятся положительно заряженными ионами. Когда атом теряет электрон, чтобы стать положительно заряженным ионом, это обозначается знаком плюс после символа элемента; например Na + . Элементы группы 17, включая фтор и хлор, имеют семь электронов на своих внешних оболочках; они стремятся заполнить эту оболочку, получая электрон от других атомов, делая их отрицательно заряженными ионами. – \).Таким образом, столбцы периодической таблицы представляют потенциальное общее состояние внешних электронных оболочек этих элементов, которое отвечает за их схожие химические характеристики.
Символы Льюиса
Символы Льюиса – это упрощенные диаграммы Бора, которые отображают электроны только на внешнем энергетическом уровне.
Сводка
- В модели атома Бора ядро содержит большую часть массы атома в его протонах и нейтронах.
- По орбите положительно заряженного ядра вращаются отрицательно заряженные электроны, которые имеют небольшой вклад в массе, но электрически эквивалентны протонам в ядре.
- В большинстве случаев электроны сначала заполняют орбитали с более низкой энергией, затем следуют орбитали с более высокой энергией, пока она не заполнится, и так далее, пока не будут размещены все электроны.
- Атомы имеют тенденцию быть наиболее стабильными с полной внешней оболочкой (которая после первой содержит 8 электронов), что приводит к тому, что обычно называют «правилом октетов».
- Свойства элемента определяются его внешними электронами или электронами на орбитали с наибольшей энергией.
- Атомы, у которых нет полных внешних оболочек, будут иметь тенденцию приобретать или терять электроны, в результате чего получается полная внешняя оболочка и, следовательно, стабильность.
Авторы и авторство
Без границ (www.boundless.com)
Brf3 Структура Льюиса: изобразите точечную структуру трифторида брома
BrF3, или то, что широко известно как трифторид брома, представляет собой фторирующий агент и межгалогенное соединение. Существуя в жидкой форме, это соединение используется в синтезе других соединений и химических веществ. Трифторид брома представляет собой Т-образную молекулу, в которой центральным атомом является бром.Чтобы узнать больше о его геометрии и других характеристиках, необходимо понять структуру Льюиса для BrF3.
Точечная структура Льюиса или электронно-точечная структура – это диаграмма, которая показывает связи атомов в молекуле вместе с их неподеленными парами. Связи на диаграмме показаны линиями, а неподеленные пары представлены точками. Эта структура помогает понять структуру распределения электронов в соединении и его молекулярную геометрию .
Каждая молекула имеет тенденцию следовать правилу октетов, согласно которому внешняя оболочка атома должна иметь восемь электронов, чтобы быть стабильной и нереактивной. Атомы имеют тенденцию образовывать связи, чтобы завершить свой октет и стать стабильными. Структура Льюиса также опирается на это правило, поскольку атомы в молекуле разделяют свои валентные электроны и образуют связи, чтобы завершить свой октет. Итак, чтобы понять структуру точки Льюиса BrF3, давайте сначала узнаем некоторые основные детали, необходимые для создания этой структуры.
BrF3 Валентные электроныБром имеет семь электронов на валентной оболочке, а фтор также имеет семь электронов на внешней оболочке.Чтобы получить общее количество валентных электронов, мы должны сложить все эти электроны:
Br = 7 электронов
F = 7 * 3 = 14 электронов (так как атома фтора три, то мы умножим также число валентных электронов на )
Следовательно, общее количество валентных электронов для BrF3 равно 28. Теперь, когда мы знаем валентные электроны в молекуле, мы можем начать с построения диаграммы Льюиса для соединения.
Точечная структура Льюиса для BrF3Как упоминалось выше, центральным атомом в этом соединении является бром, окруженный тремя атомами флурина.Каждый атом в этой молекуле имеет семь валентных электронов, поэтому вы можете оставить семь точек вокруг каждого атома в соединении.
Теперь, когда есть три атома фтора, электроны его внешней оболочки образуют связь с электронами внешней оболочки брома.
Следовательно, правило октета для всех трех атомов фтора будет выполняться, поскольку ему нужен только один электрон, чтобы завершить свой октет и стать стабильным. Все атомы фтора теперь имеют связь с бромом, что показано линиями между Br-F.После образования связи три из семи валентных электронов на внешней оболочке брома образовали связи. Четыре из этих валентных электронов все еще остаются во внешней оболочке атома брома.
Следовательно, в структуре Льюиса BrF3 есть три связанных пары электронов и две неподеленные пары. Структура Льюиса BrF3 будет иметь три связи между Br-F, представленные линиями, и четыре несвязывающих электрона, представленные четырьмя точками на атоме брома.
Сколько неподеленных пар находится на центральном атоме BrF3?Поскольку три электрона из семи образуют связь с валентными электронами в атоме фтора, на центральном атоме BrF3 имеется четыре несвязывающих электрона.Следовательно, есть две неподеленные пары электронов или четыре несвязывающих электрона на центральном атоме (, бром, ) BrF3.
Заключительные замечания
Фторид брома имеет 28 валентных электронов, что приводит к образованию трех связей в молекуле и двух неподеленных пар электронов на атоме брома. Гибридизация центрального атома является sp3d, но для минимизации отталкивания между неподеленными парами форма молекулы изогнута, а не тригонально-пирамидальная.
Электронно-точечные диаграммы Льюиса
9.1 Электронно-точечные диаграммы Льюиса
Цель обучения
- Нарисуйте точечную диаграмму электронов Льюиса для атома или одноатомного иона.
Почти во всех случаях химические связи образуются за счет взаимодействия валентных электронов в атомах. Чтобы облегчить наше понимание того, как взаимодействуют валентные электроны, будет полезен простой способ представления этих валентных электронов.
Электронная точечная диаграмма Льюиса – представление валентных электронов атома с использованием точек вокруг символа элемента. (или электронная точечная диаграмма, или диаграмма Льюиса, или структура Льюиса) представляет собой представление валентных электронов атома, в котором используются точки вокруг символа элемента. Количество точек равно количеству валентных электронов в атоме. Эти точки расположены справа и слева, а также над и под символом, не более двух точек по бокам.(Не имеет значения, в каком порядке используются позиции.) Например, электронно-точечная диаграмма Льюиса для водорода просто равна
.Поскольку сторона не важна, электронная точечная диаграмма Льюиса также может быть нарисована следующим образом:
Электронная точечная диаграмма для гелия с двумя валентными электронами выглядит следующим образом:
Соединяя два электрона на одной стороне, мы подчеркиваем тот факт, что оба эти электрона находятся в подоболочке 1 s ; это обычная конвенция, которую мы примем, хотя позже будут исключения.Следующий атом, литий, имеет электронную конфигурацию 1 с 2 2 с 1 , поэтому он имеет только один электрон на валентной оболочке. Его электронно-точечная диаграмма напоминает диаграмму водорода, за исключением того, что используется символ лития:
Бериллий имеет два валентных электрона в своей оболочке 2 s , поэтому его электронная точечная диаграмма похожа на диаграмму гелия:
Следующий атом – бор. Его валентная электронная оболочка составляет 2 с 2 2 p 1 , поэтому он имеет три валентных электрона.Третий электрон уйдет по другую сторону символа:
.Опять же, не имеет значения, с какой стороны символа расположены электронные точки.
Для углерода имеется четыре валентных электрона: два в подоболочке 2 s и два в подоболочке 2 p . Как обычно, мы нарисуем две точки вместе на одной стороне, чтобы представить 2 s электронов. Однако условно мы рисуем точки для двух электронов p с разных сторон.Таким образом, электронно-точечная диаграмма углерода выглядит следующим образом:
С N, который имеет три p электронов, мы помещаем по одной точке на каждой из трех оставшихся сторон:
Для кислорода, который имеет четыре p электронов, теперь мы должны начать удваивать точки на одной другой стороне символа. При удвоении электронов убедитесь, что на одной стороне не более двух электронов.
Фтор и неон имеют семь и восемь точек соответственно:
Со следующим элементом, натрием, процесс начинается с одного электрона, потому что у натрия есть единственный электрон в его оболочке с самым большим номером, оболочке n = 3.Просматривая периодическую таблицу, мы видим, что на электронных точечных диаграммах атомов Льюиса никогда не будет более восьми точек вокруг атомного символа.
Пример 1
Что такое электронная точечная диаграмма Льюиса для каждого элемента?
- алюминий
- селен
Решение
Конфигурация валентных электронов для алюминия 3 с 2 3 p 1 .Таким образом, он будет иметь три точки вокруг символа алюминия, две из которых спарены, чтобы представить 3 s электронов:
Конфигурация валентных электронов селена 4 с 2 4 p 4 . В оболочке с самым большим номером, оболочке n = 4, находится шесть электронов. Его электронная точечная диаграмма выглядит следующим образом:
Проверьте себя
Что такое электронная точечная диаграмма Льюиса для каждого элемента?
- фосфор
- аргон
Ответ
Для атомов с частично заполненными подоболочками d или f эти электроны обычно опускаются на электронных точечных диаграммах Льюиса.Например, электронная точечная диаграмма для железа (конфигурация валентной оболочки 4 с 2 3 d 6 ) выглядит следующим образом:
Элементы в одном столбце периодической таблицы имеют схожие электронные точечные диаграммы Льюиса, потому что у них одинаковая электронная конфигурация валентной оболочки. Таким образом, электронные точечные диаграммы для первого столбца элементов выглядят следующим образом:
Одноатомные ионы – это атомы, которые потеряли (для катионов) или приобрели (для анионов) электроны.Электронно-точечные диаграммы для ионов такие же, как и для атомов, за исключением того, что часть электронов удалена для катионов, а часть электронов добавлена для анионов. Таким образом, сравнивая электронные конфигурации и электронные точечные диаграммы для атома Na и иона Na + , мы отмечаем, что атом Na имеет один валентный электрон на своей диаграмме Льюиса, тогда как ион Na + потерял эту одну валентность. электрон:
Технически валентная оболочка иона Na + теперь представляет собой оболочку n = 2, в которой находится восемь электронов.Так почему бы нам не поставить восемь точек вокруг Na + ? Обычно, когда мы показываем электронные точечные диаграммы для ионов, мы показываем исходную валентную оболочку атома, которая в данном случае является оболочкой n = 3 и пуста в ионе Na + .
При создании катионов электроны сначала теряются из оболочки с наивысшим номером , не обязательно из последней заполненной подоболочки. Например, при переходе от нейтрального атома Fe к иону Fe 2+ атом Fe сначала теряет свои 4 s электронов, а не свои 3 d электронов, несмотря на то, что подоболочка 3 d заполняется последняя подоболочка.Таким образом, мы имеем
Анионы имеют лишние электроны по сравнению с исходным атомом. Вот сравнение атома Cl с ионом Cl – :
Пример 2
Что такое электронная точечная диаграмма Льюиса для каждого иона?
- Ca 2+
- O 2−
Решение
Потеряв два исходных валентных электрона, электронная точечная диаграмма Льюиса представляет собой просто Ca 2+ .
Ca 2+Ион O 2- получил два электрона на своей валентной оболочке, поэтому его электронная точечная диаграмма Льюиса выглядит следующим образом:
Проверьте себя
Валентная электронная конфигурация таллия, обозначенная как Tl, равна 6 с 2 5 d 10 6 p 1 .Что такое электронная точечная диаграмма Льюиса для иона Tl + ?
Ответ
Основные выводы
- На электронных точечных диаграммах Льюиса точки используются для обозначения валентных электронов вокруг атомного символа.
- Электронно-точечные диаграммы Льюиса для ионов имеют меньше (для катионов) или больше (для анионов) точек, чем соответствующий атом.
Упражнения
Объясните, почему первые две точки на электронной точечной диаграмме Льюиса нарисованы с одной стороны от символа атома.
Обязательно ли, чтобы первая точка вокруг атомного символа располагалась на определенной стороне атомного символа?
В каком столбце периодической таблицы есть электронные точечные диаграммы Льюиса с двумя электронами?
В каком столбце периодической таблицы есть электронные точечные диаграммы Льюиса с шестью электронами?
Нарисуйте электронную точечную диаграмму Льюиса для каждого элемента.
- стронций
- кремний
Нарисуйте электронную точечную диаграмму Льюиса для каждого элемента.
- криптон
- сера
Нарисуйте электронную точечную диаграмму Льюиса для каждого элемента.
- титан
- фосфор
Нарисуйте электронную точечную диаграмму Льюиса для каждого элемента.
- бром
- галлий
Нарисуйте точечную диаграмму электронов Льюиса для каждого иона.
- мг 2+
- S 2−
Нарисуйте точечную диаграмму электронов Льюиса для каждого иона.
- В +
- Br –
Нарисуйте точечную диаграмму электронов Льюиса для каждого иона.
- Fe 2+
- N 3−
Нарисуйте точечную диаграмму электронов Льюиса для каждого иона.
- H +
- H –
ответов
Первые два электрона в валентной оболочке – это s электронов, которые спарены.
второй столбец периодической таблицы
- мг 2+
- Fe 2+
