Строение атома кальция и схема электронной оболочки
4.4
Средняя оценка: 4.4
Всего получено оценок: 196.
4.4
Средняя оценка: 4.4
Всего получено оценок: 196.
Кальций (Ca) – щелочноземельный металл, входящий в состав минералов. Из-за строения атома кальций проявляет активные восстановительные свойства. Играет важную роль в метаболизме и постройке организма.
Строение
Кальций – 20 элемент периодической таблицы. Находится во второй группе, четвёртом периоде. Относится к элементам s-семейства. Электронное строение атома кальция – 1s22s22p63s23p64s2 или +20 Ca)2)8)8)2.
Рис. 1. Кальций в таблице Менделеева.Ядро атома содержит 20 протонов и 20 нейронов, имеет положительный заряд +20. Вокруг ядра по четырём орбитам движется 20 электронов. Последний энергетический s-уровень содержит два спаренных электрона, поэтому постоянная валентность кальция – II.
В соединениях атом кальция отдаёт два электрона, выполняя функцию восстановителя. Степень окисления кальция – +2.
Рис. 2. Строение атома.Кальций не может переходить в возбуждённое состояние.
Общее описание
Основным источником кальция является карбонат кальция – CaCO3, который является главным соединением известняка, мела, мрамора. Также кальций входит в состав доломита, гипса, апатита, шпата и других минералов.
Кальций – металл серебристого цвета с температурой плавления 854°С. При высоком давлении проявляет свойства полупроводника. Легко окисляется на воздухе.
Рис. 3. Кальций.Кальций получают электролизом расплавленного хлорида кальция – CaCl2.
Химические свойства
 Основные реакции кальция с элементами и соединения приведены в таблице.
Основные реакции кальция с элементами и соединения приведены в таблице.Взаимодействие | Продукты | Уравнение |
С кислородом при нагревании (реакция горения) | Оксид кальция (негашёная известь) | 2Ca + O2 → 2CaO |
С большинством неметаллов при нагревании | Соли | – Ca + S → CaS; – Ca + Br2 → CaBr2; – 3Ca + N2 → Ca3N2; – Ca + 2C → CaC2; – 2Ca + Si → Ca2Si; – Ca + Cl2 → CaCl2 |
С фтором даже на холоде | Фторид кальция | Ca + F2 → CaF2 |
С водой | Гидроксид кальция (гашёная или едкая известь) выпадает в осадок, выделяется водород | Ca + 2H2O → Ca(OH)2↓ + H2↑ |
С кислотами | Соли | Ca + 2HCl → CaCl2 + H2↑ |
Большинство солей кальция (фторид, сульфат, карбонад кальция) не растворяются в воде. Хорошо растворимы бромид (CaBr2), хлорид (CaCl2), йодид (CaI2), нитрат (Ca(NO3)2) кальция.
Хорошо растворимы бромид (CaBr2), хлорид (CaCl2), йодид (CaI2), нитрат (Ca(NO3)2) кальция.
Элемент в составе соединений используется в строительстве, пищевой и химической промышленности, медицине.
Что мы узнали?
Кальций – активный щелочноземельный металл, являющийся восстановителем. На внешнем энергетическом уровне атома находится два электрона, определяющие валентность. Кальций входит в состав минералов, быстро окисляется на воздухе, реагирует с неметаллами при нагревании, водой и кислотами. Оксид кальция называется негашёной известью, гидроксид – гашёной известью. Большинство солей кальция плохо растворяются в воде. Кальций входит в состав костей, крови, участвует в метаболизме, применяется в промышленности, строительстве и медицине.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Александр Котков
5/5
Алексей Беляев
4/5
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4. 4
4
Средняя оценка: 4.4
Всего получено оценок: 196.
А какая ваша оценка?
Строение атома кальция – Ektpol
Кальций (Ca) представляет собой щелочноземельный металл, содержащийся в минералах. Благодаря строению атома кальций проявляет активные восстановительные свойства. Он играет важную роль в метаболизме и построении тела.
Содержание
- 1 Строение
- 2 Общее описание
- 3 Химические свойства
Строение
Кальций — двадцатый элемент периодической таблицы. Он во второй группе, четвертый период. Относится к элементам s-семейства. Электронная структура атома кальция 1s22s22p63s23p64s2 или +20 Ca)2)8)8)2.
Рис. 1. Кальций в периодической таблице.
Ядро атома содержит 20 протонов и 20 нейронов и имеет положительный заряд +20. Вокруг ядра по четырем орбитам движется 20 электронов. На последнем s энергетическом уровне находятся два спаренных электрона, поэтому валентная константа кальция равна II.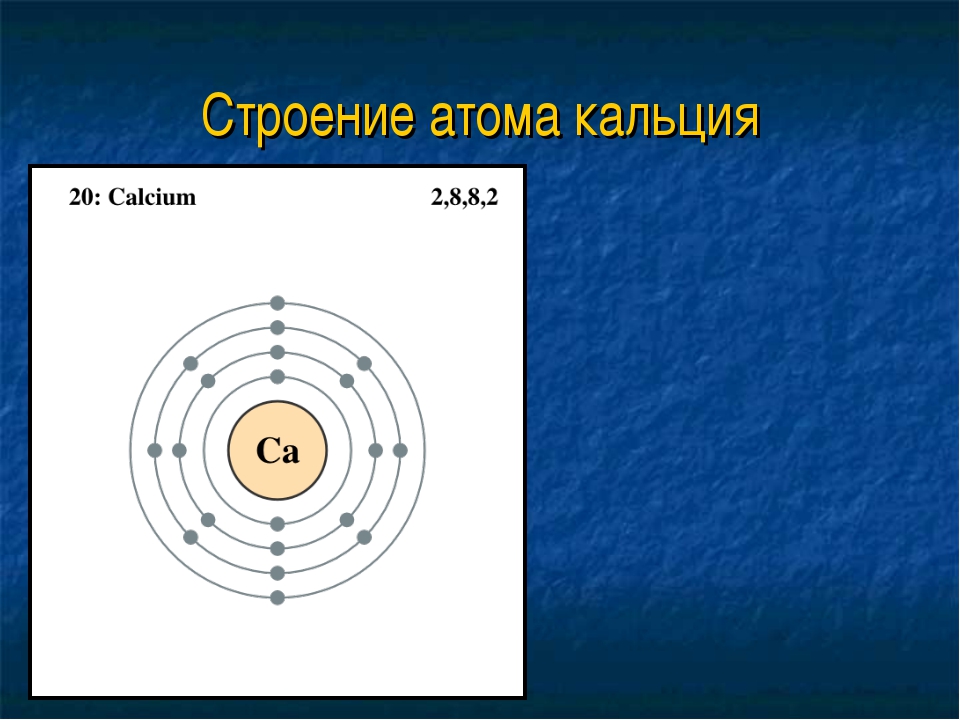
В соединениях атом кальция отдает два электрона, действуя как восстановитель. Степень окисления кальция +2.
Рис. 2. Строение атома.
Кальций не может перейти в возбужденное состояние.
Общее описание
Основным источником кальция является карбонат кальция — CaCO3, который является основным соединением в известняке, меле и мраморе. Кальций также входит в состав доломита, гипса, апатита, шпата и других полезных ископаемых.
Кальций — серебристый металл с температурой плавления 854°C. При высоком давлении проявляет свойства полупроводника. Легко окисляется на воздухе.
Рис. 3. Кальций.
Кальций получают электролизом расплавленного хлорида кальция — CaCl2.
Химические свойства
Строение атома определяет химические свойства элемента. Кальций активно реагирует с простыми и сложными веществами. Благодаря способности быстро связывать кислород, образуя на поверхности оксидную пленку, кальций хранят под слоем парафина или керосина в герметично закрытой таре.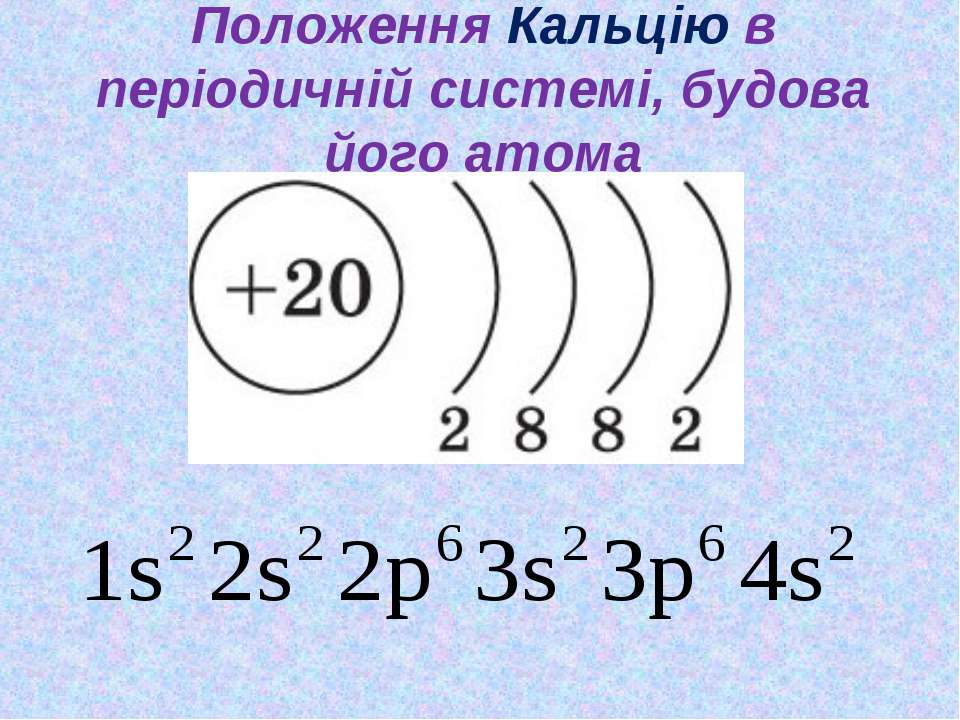 Основные реакции кальция с элементами и соединениями приведены в таблице.
Основные реакции кальция с элементами и соединениями приведены в таблице.
Взаимодействие | Продукты | Уравнение |
С кислородом при нагревании (реакция горения) | оксид кальция (негашеная известь) | 2Са + О2 → 2СаО |
С большинством неметаллов при нагревании | Соль | – Ca+S → CaS; – Са + Br2 → CaBr2; – 3Ca + N2 → Ca3N2; – Са+2С → СаС2; – 2Ca + Si → Ca2Si; – Са + Cl2 → CaCl2 |
С фтором даже на морозе | Фторид кальция | Са + F2 → CaF2 |
С водой | Гидроксид кальция (гашеная или каустическая известь) выпадает в осадок, выделяется водород | Ca + 2h3O → Ca(OH)2↓ + h3↑ |
С кислотами | Соль | Ca + 2HCl → CaCl2 + h3↑ |
Большинство солей кальция (фторид, сульфат, карбонат кальция) не растворяются в воде.
Элемент в составе соединений используется в строительстве, пищевой и химической промышленности, медицине.
Кальций, атомная структура – Стоковая фотография – C018/3701
Похоже, вы используете устаревший веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Это изображение недоступно для покупки в вашей стране.
C018/3701
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см · 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Пожалуйста, свяжитесь с вашим менеджером по работе с клиентами, если у вас есть какие-либо вопросы.
Запрос Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ Делиться Купить РаспечататьКредит
КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Заголовок
Кальций (Ca). Схема состава ядра, электронной конфигурации, химических данных и валентных орбиталей атома кальция-40 (атомный номер: 20), наиболее распространенного изотопа этого элемента. Ядро состоит из 20 протонов (красный) и 20 нейтронов (оранжевый). 20 электронов (белые) занимают доступные электронные оболочки (кольца). Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Кальций, жизненно важный для клеточной функции, представляет собой щелочноземельный металл группы 2, периода 4 и s-блока периодической таблицы. В элементарной форме это реактивный металл, горящий ярким оранжево-красным пламенем при нагревании на воздухе.
Схема состава ядра, электронной конфигурации, химических данных и валентных орбиталей атома кальция-40 (атомный номер: 20), наиболее распространенного изотопа этого элемента. Ядро состоит из 20 протонов (красный) и 20 нейтронов (оранжевый). 20 электронов (белые) занимают доступные электронные оболочки (кольца). Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Кальций, жизненно важный для клеточной функции, представляет собой щелочноземельный металл группы 2, периода 4 и s-блока периодической таблицы. В элементарной форме это реактивный металл, горящий ярким оранжево-красным пламенем при нагревании на воздухе.
Сведения о выпуске
Разрешение модели не требуется. Разрешение собственности не требуется.
Ключевые слова
- 4s
- 4с2
- щелочноземельный металл
- щелочноземельные металлы
- а.е.м.
- атом
- атомный
- атомный номер
- атомных орбиталей
- атомный радиус
- атомный вес
- черный фон
- примерно
- кальций
- кальций-40
- химические данные
- химические свойства
- химическое свойство
- химия
- схема
- электронная конфигурация
- номер электрона
- электронная оболочка
- электронный
- электронов
- элемент
- элементаль
- элементов
- уровней энергии
- группа 2
- иллюстрация
- изотоп
- уровень
- уровней
- металл
- металлический
- металлы
- нейтрон
- нейтрон номер
- нейтронов
- ядерный
- ядерные данные
- нуклон
- нуклонов
- ядро
- орбитальный
- орбитальные типы
- орбиталей
- период 4
- физическая химия
- физические свойства
- физическое имущество
- вечера
- протон номер
- квантовая химия
- с блоком
- S-блок
- оболочка
- каркасная конструкция
- снаряды
- простая электронная конфигурация
- твердый
- твердые вещества
- структурный
- структура
- субатомный
- субатомный
- подоболочка
- подоболочек
- символ
- валентная орбиталь
- волновая функция
Ca: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура кальция
Твердотельная структура кальция Гранецентрированная кубическая .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | б | с |
|---|---|---|
| 558,84 пм | 558,84 пм | 558,84 пм | 902 07
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π/2 | π/2 9021 2 | π/2 |
Положения атомов внутри элементарной ячейки описываются множеством атомных позиций ( x i , y i , z i ), измеренные от контрольной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными). 11 Пробел Номер группы
Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными). 11 Пробел Номер группы
Число атомов на элементарную ячейку в простой кубической, гранецентрированной кубической и объемной -центрированная куба равна 1,4,2 соответственно.
Атомные и орбитальные свойства кальция
Атомы кальция имеют 20 электронов и структуру электронной оболочки [2, 8, 8, 2] с символом атомного термина (квантовые числа) 1 С 0 .
| Атомный номер | 20 |
| Число электронов (бесплатно) | 20 |
| Число протонов | 20 |
| Массовое число | 40 |
| Число нейтронов | 20 |
| Структура оболочки (электронов на энергетический уровень) | 2, 8, 8, 2 |
| Электронная конфигурация | [Ar] 4s2 |
| Валентность Электроны | 4s2 |
| Валентность (Валентность) | 2 | Основные степени окисления | 2 |
| Степени окисления | 1, 2 |
| Символ атомного термина (квантовые числа) | 1 S 0 |
Атомная модель кальция по Бору – электроны на энергетический уровень 9019 0
Электронная конфигурация основного состояния кальция – нейтральный атом кальция
Сокращенная электронная конфигурация кальция
Сокращенная электронная конфигурация основного состояния нейтрального атома кальция [Ar] 4s2. Часть конфигурации кальция, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации кальция, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального кальция
Полная электронная конфигурация основного состояния атома кальция, Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 4s2
Электроны заполняют атомные орбитали в порядке, определяемом Aufba ты принцип, Паули Принцип исключения и правило Хунда.

Атомная структура кальция
Атомный радиус кальция составляет 194 пм, а его ковалентный радиус равен 174 пм.
| Расчетный атомный радиус | 194 пм (1,94 Å) |
| Атомный радиус Эмпирический | 180 пм (1,8 Å) |
| Атомный объем | 9021 1 25,857 см3/моль|
| Ковалентный радиус | 174 пм (1,74 Å) |
| Радиус Ван-дер-Ваальса | 231 пм |
| Сечение нейтронов | 0,43 |
| Поглощение массы нейтронов | 0,00 037 |
Атомный спектр кальция
Химические свойства кальция: Энергия ионизации кальция и сродство к электрону
Сродство к электрону кальция составляет 2,37 кДж/моль.
| Валентность | 2 |
| Электроотрицательность | 1 |
| ElectronAffinity 90 212 | 2,37 кДж/моль |
Энергия ионизации кальция
Энергии ионизации кальция см. в таблице ниже
в таблице ниже
| Число энергии ионизации | Энтальпия – кДж/моль |
|---|---|
| 1-й | 589,8 |
| 2-й 9 0212 | 1145.4 |
| 3-й | 4912.4 |
| 4-й | 6491 | 5-й | 8153 |
| 6-й | 10496 |
| 7-й | 12270 |
| 8-й | 14206 |
| 9-й | 18191 |
| 10-й | 20385 |
| 11-й | 57110 902 12 |
| 12-й | 63410 |
| 13-й | 70110 |
| 14-й | 78890 |
| 15-й | 86310 |
| 16-й | 94000 |
| 17-й | 104900 | 9020 7
| 18-й | 111711 |
| 19-й | 494850 |
| 20-й | 527762 |
Физические свойства кальция
Физические свойства кальция см.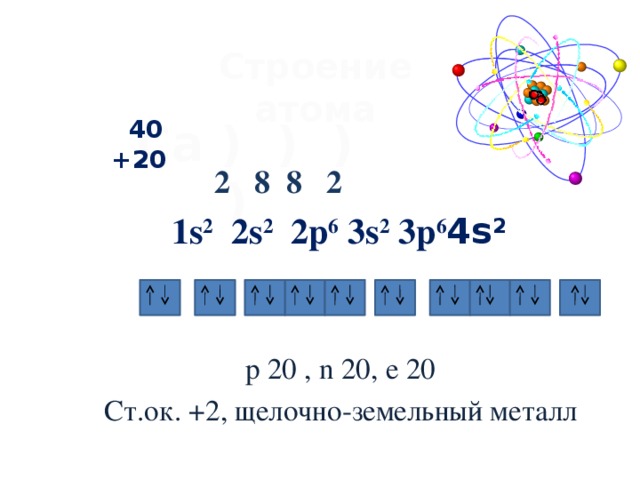 в таблице ниже
в таблице ниже
| Плотность | 1,55 г/см3 (в жидком состоянии при составляет $1,378 г/см3) |
| Молярный объем | 25,857 см3/моль |
Упругие свойства
| 20 | |
| Модуль сдвига | 7,4 ГПа |
| Объемный модуль упругости | 17 ГПа |
| 0,31 |
Кальциевая твердость – испытания для измерения твердости элемента
| Твердость по Моосу | 1,75 МПа |
| Твердость по Виккерсу | – |
| Твердость по Бринеллю | 16 7 МПа |
Электрические свойства кальция
Кальций является проводником электричества. Электрические свойства кальция
| Электропроводность | 200 См/м |
| Удельное сопротивление | 3,4e-8 мОм 902 12 |
| Сверхпроводящая точка | – |
Кальций Теплопроводность
| Теплопроводность | 200 Вт/(м·К) |
| Тепловое расширение | 0,0000223 /K |
Магнитные свойства кальция
| Магнитный тип | Парамагнитный |
| Точка Кюри | – |
| Массовая магнитная восприимчивость | 1. 38e-8 м3/кг 38e-8 м3/кг |
| Молярная магнитная восприимчивость | 5.531e-10 м3/моль |
| Объемная магнитная восприимчивость способность | 0,00002139 |
Оптические свойства кальция
| Показатель преломления | – |
Акустические свойства кальция
| Скорость звука | 3810 м/с |
Тепловые свойства кальция – энтальпии и термодинамика
См. таблицу ниже для тепловых свойств кальция
| Точка плавления | 1115 K (841,85 °C, 1547,3300000000002 °F) |
| Температура кипения | 1757 K (1483,85 °C, 2702,93 °F) 9021 2 |
| Критическая температура | – |
| Сверхпроводящая точка | – |
Энтальпии кальция
| Теплота плавления | 8,54 кДж/моль |
| Теплота парообразования | 155 кДж/моль |
| Теплота сгорания | -990 Дж/(кг·К) |
Изотопы кальция.

