Атомный номер | 48 |
Внешний вид простого вещества | мягкий ковкий металл, серебристо-белого цвета |
Свойства атома | |
Атомная масса | 112,411 а. е. м. (г/моль) |
Радиус атома | 154 пм |
Энергия ионизации | 867,2 (8,99) кДж/моль (эВ) |
Электронная конфигурация | [Kr] 4d10 5s2 |
Химические свойства | |
Ковалентный радиус | 148 пм |
Радиус иона | (+2e) 97 пм |
Электроотрицательность | 1,69 |
Электродный потенциал | −0,403 |
Степени окисления | 2 |
Термодинамические свойства простого вещества | |
Плотность | 8,65 г/см³ |
Молярная теплоёмкость | 26,0[1] Дж/(K·моль) |
Теплопроводность | 96,9 Вт/(м·K) |
Температура плавления | 594,1 K |
Теплота плавления | 6,11 кДж/моль |
Температура кипения | 1 038 K |
Теплота испарения | 59,1 кДж/моль |
Молярный объём | 13,1 см³/моль |
Кристаллическая решётка простого вещества | |
гексагональная | |
Параметры решётки | a=2,979 c=5,618 Å |
Отношение c/a | 1,886 |
Температура Дебая | 209 K |
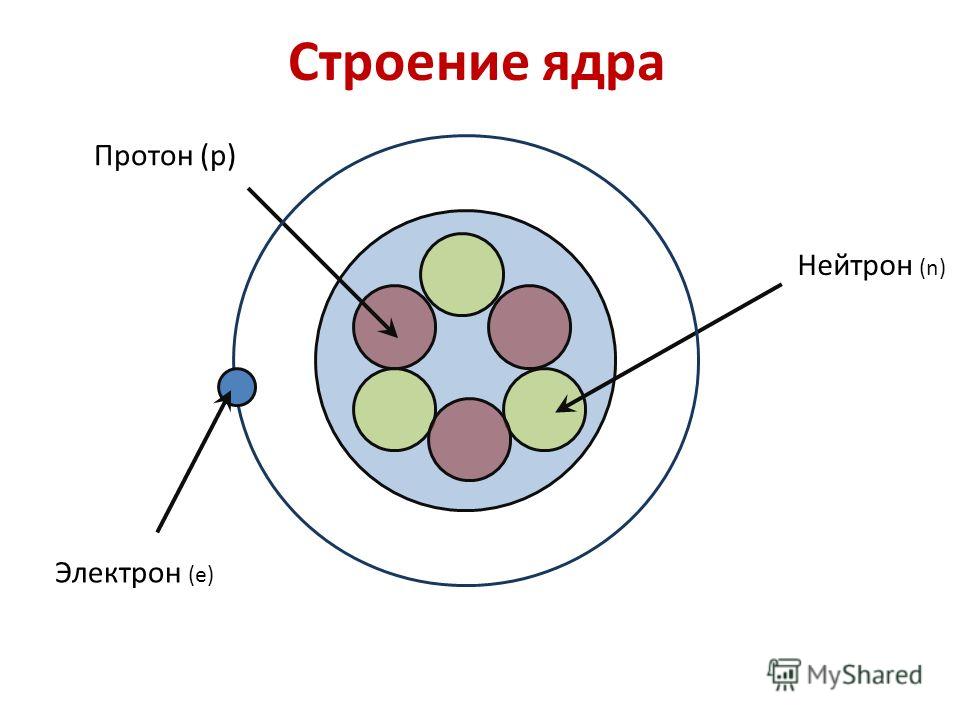
Строение атома.
 Закономерности изменения химических свойств элементов в ПСХЭ | Материал для подготовки к ЕГЭ (ГИА) по химии (11 класс):
Закономерности изменения химических свойств элементов в ПСХЭ | Материал для подготовки к ЕГЭ (ГИА) по химии (11 класс):Занятие 1. Строение атома. Закономерности изменения химических свойств элементов в ПСХЭ
1. Строение атома
Основные элементы содержания: |
атом, атомное ядро, протон, нейтрон, электрон, атомная орбиталь, энергетический уровень, энергетический подуровень, электронная конфигурация атома, внешние и валентные электроны, основное и возбужденное состояние атома. |
1.1. Современное представление об атоме
Химический элемент – это вид атомов с одинаковым _____________________________ .
Электронейтральная частица, состоящая из положительно ядра и отрицательно заряженной электронной оболочки ___________________________________________________ .
Ядро атома состоит из _______________________________________________________.
Основные характеристики протонов, нейтронов и электронов
Частица | Обозначение | Заряд, условный | Массовое число | Масса, а.е.м. |
Электрон | -1 | 0 | 5,5·10-4 | |
Протон | p | +1 | 1 | 1,0073 |
Нейтрон | n | 0 | 1 | 1,0087 |
Как установлено Г Мозли, заряд ядра численно равен порядковому номеру элемента ПСХЭ Д.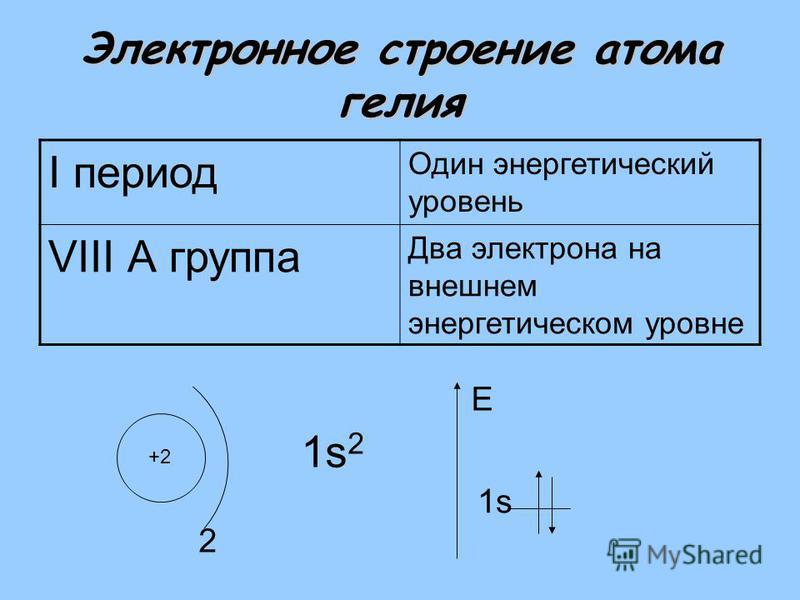 И. Менделеева (физический смысл порядкового номера):
И. Менделеева (физический смысл порядкового номера):
Порядковый Заряд Число Число
номер ядра протонов электронов
элемента атома в ядре в атоме
Атомы химического элемента обозначают, используя запись – , в которой:
Э – _________________ химического элемента; А – это массовое число равное ______________________________________________ , Z – это ___________________________ .
Разные атомы, у которых | число протонов Z одинаково, число нейтронов N различно | называется | |
число нейтронов N одинаково, число протонов Z различно | называется | ||
массовое число А одинаково, число протонов Z различно, | называется |
1.2. Строение электронной оболочки атома
Область пространства в атоме, в которой наиболее вероятно находится электрон называют _________________________________________________________________________.
Каждая атомная орбиталь имеет определенную форму (рисунок).
Атомные орбитали образуют энергетические уровни и подуровни.
Энергетические уровни обозначаются ____________, номер энергетического уровня равен номеру ____________.
Каждый энергетический уровень состоит из подуровней.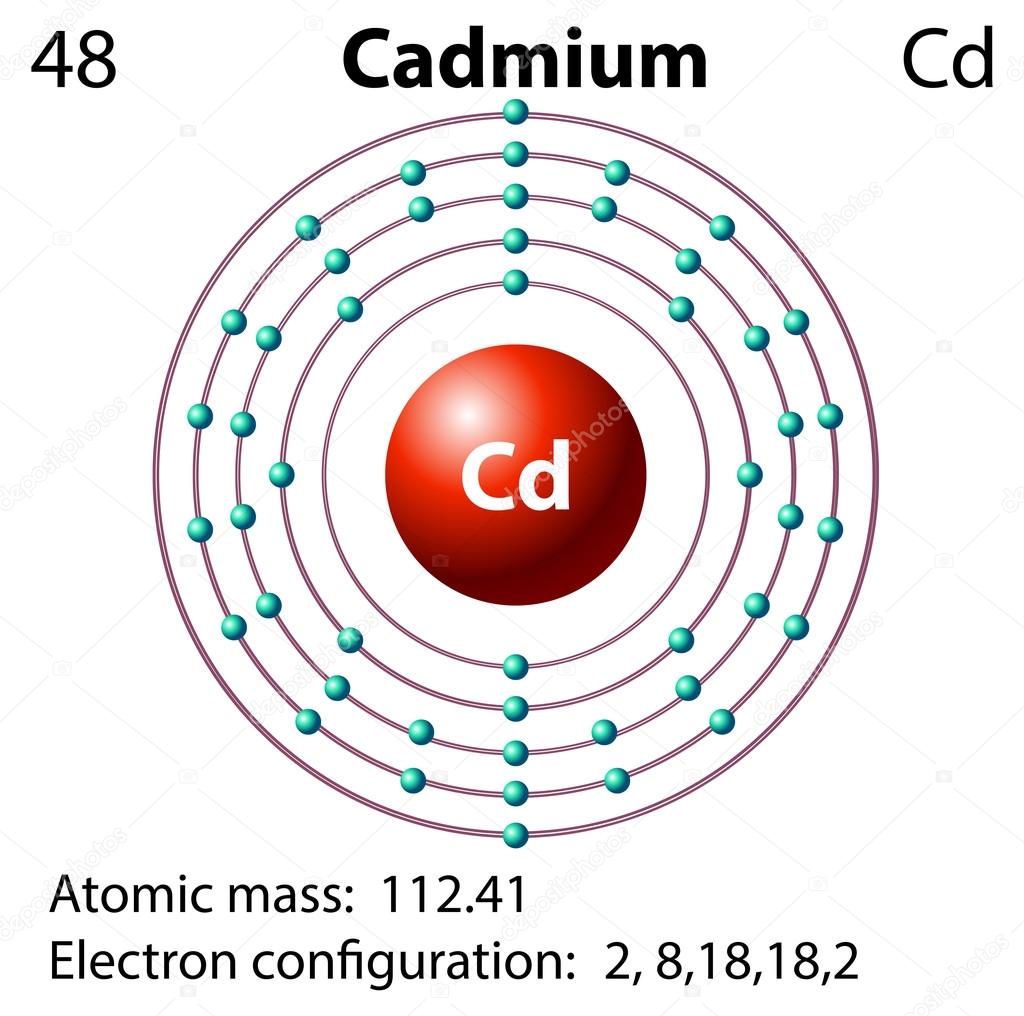 Число подуровней равно номеру ___________.
Число подуровней равно номеру ___________.
Подуровни объединяют орбитали одного вида.
Первый подуровень состоит из __________________.
Второй подуровень состоит из __________________.
Третий подуровень состоит из __________________.
ЗАПОМНИТЬ!!!!
Любой s-подуровень состоит из одной _______________________, p-подуровень состоит из трех _____________________, d-подуровень состоит из пяти ____________________.
Рис. Энергетические уровни и подуровни в атоме
Принцип Паули______________________________________________________________.
Максимальное число электронов на энергетических уровнях
Уровень | Подуровни | Максимальное число электронов на подуровне | Максимальное число электронов на уровне |
К (первый) | 1s | 2 | 2 |
L (второй) | 2s 2р | 2 6 | 8 |
М (третий) | 3s 3р 3d | 2 6 10 | 18 |
N (четвертый) | 4s 4р 4d 4f | 2 6 10 14 | 32 |
Принцип минимума энергии ___________________________________________________
___________________________________________
Электроны, находящиеся на последнем энергетическом уровне, называются ___________.
Электроны, которые могут принимать участие в образовании химических связей, называются ________________________________.
Для элементов главных подгрупп валентными являются внешние ________________.
17Cl 1s22s22p6 3s23p6 – валентные электроны.
Для элементов побочных подгрупп валентными являются внешние ___________ и предвнешние _________________.
24 Cr 1s22s22p6 3s23p6 4s13d5 – валентные электроны
В зависимости от характера заполнения электронами, орбитали делятся на ____________ (без электронов), _______________ (один электрон) и ___________________________ (два электрона).
Два электрона, которые находятся на одной орбитали и имеют противоположные спины, называются ______________________________________________________________________.
Правило Хунда _______________________________________________________________
___________________________________________________________________________________________________________________________________________________________________
Приобретая энергию, атом может из своего основного, самого устойчивого состояния перейти в возбужденное состояние.
Основное и возбужденное состояние
С С*
Правило Хунда справедливо ТОЛЬКО ДЛЯ ОСНОВНОГО СОСТОЯНИЯ!!!
1.3. Способы изображения электронной конфигурации
Схемы электронного строения показывают ______________________________________
Электронные формулы показывают _____________________________________________
Электронно-графические формулы показывают __________________________________
____________________________________________________________________________
1.4. Провал электрона
«Провал» электрона приводит к повышению устойчивости подуровней
2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Основные элементы содержания: |
Периодический закон, Периодическая система химических элементов, периодические изменения в системе химических элементов, атомный радиус, электроотрицательность, |
2. 1. Структура Периодической системы химических элементов
1. Структура Периодической системы химических элементов
Периодическая система Д.И. Менделеева
I | II | III | IV | V | VI | VII | VIII | |||
1 | H | He | ||||||||
2 | Li | Be | B | C | N | O | F | Ne | ||
3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||
4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni |
Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||
5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Rd |
Ag | Cd | In | Sn | Sb | Te | I | Xe | |||
6 | Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt |
Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||
7 | Fr | Ra | Ac | Db | Jl | Rf | Bh | Hn | Mt | |
Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
Элементы располагаются в порядке возрастания __________________________________
Порядковый номер элемента равен ______________________________________________
Горизонтальные строки – ______________________________________________________
Вертикальные колонки – _______________________________________________________
Периода – последовательность химических элементов, выстроенных в порядке ________________ заряда ядра, атомы которых имеют в электронной оболочке одинаковое число _________________________________. В ПСХЭ _____________ периодов, из них 1, – 3 – ___________________ периоды; 4 – 6 ___________________ периоды; 7 – незавершенный.
В ПСХЭ _____________ периодов, из них 1, – 3 – ___________________ периоды; 4 – 6 ___________________ периоды; 7 – незавершенный.
Номер периода равен _________________________________________________________.
Каждая строка большого периода называется – ___________________________________.
Группа – последовательность химических элементов, выстроенных в порядке ___________________ заряда ядра, атомы которых имеют в электронной оболочке одинаковое число ____________________________________________________________________________.
Номер группы равен _________________________________________________________.
2.2. Периодическое изменение свойств элементов:
2.2.1. Радиус атома
В группе сверху вниз число электронных уровней _____________________________________,
следовательно, радиус атом _________________________________________________________.
В периоде слева направо число электронных уровней ___________________________________,
при этом заряд ядра ___________________, следовательно, радиус атома _________________.
2.2.2. Прочность связи внешних электронов с ядром
В группе сверху вниз радиус атома __________________________________________________,
следовательно, прочность связи внешних электронов с ядром ____________________________.
В периоде слева направо радиус ____________________, при этом заряд ядра ______________,
следовательно, прочность связи внешних электронов с ядром __________________________
2.2.3. Металлические свойства – способность отдавать электроны
В группе сверху вниз прочность связи внешних электронов с ядром _______________________, следовательно, металлические свойства______________________________________________.
В периоде слева направо прочность связи внешних электронов с ядром ____________________, следовательно, металлические свойства _____________________________________________.
2.2.4. Неметаллические свойства – способность принимать электроны
В группе сверху вниз радиус атома___________________________________________________,
следовательно, неметаллические свойства ____________________________________________.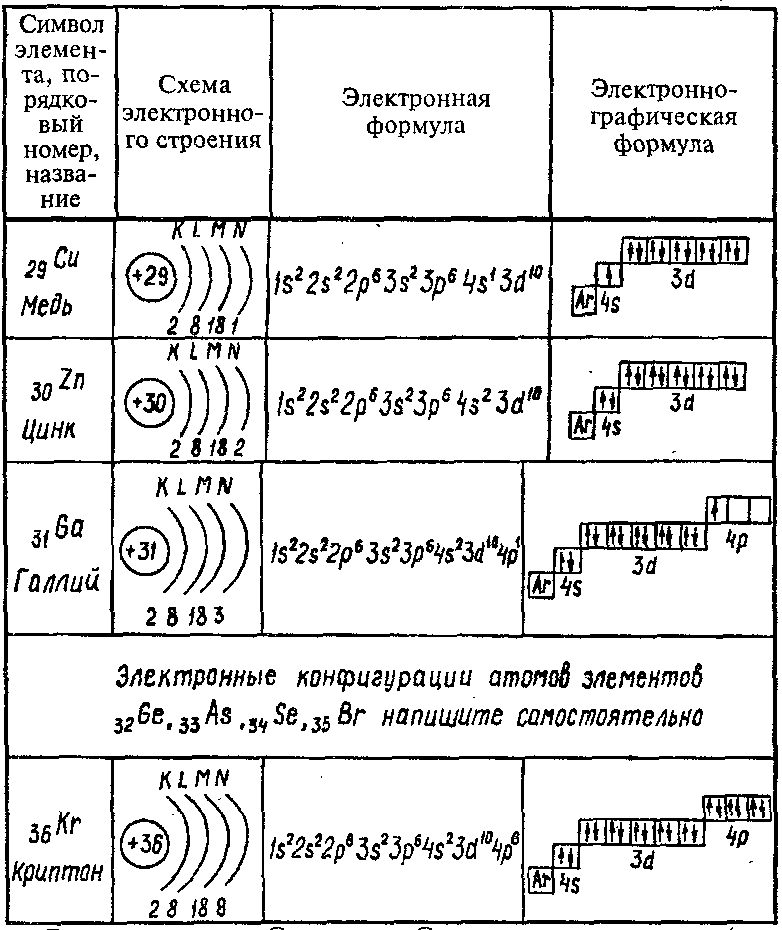
В периоде слева направо радиус атома _____________, при этом заряд ядра _____________, следовательно, неметаллические свойства ___________________________________________.
2.2.5. Энергия ионизации. Сродство к электрону
Наименьшая энергия, необходимая для отрыва электрона от атома, называется __________________________________________________________________________________.
Так как энергия ионизации характеризует способность атомов отдавать электроны, она является количественной характеристикой металлических свойств элементов. Энергия ионизации зависит в основном от заряда ядра и радиуса атома.
В группе сверху вниз радиус атома __________________________________________________,
прочность связи внешних электронов с ядром ________________________________________,
следовательно, энергия ионизации ____________________________________________________.
В периоде слева направо радиус атома _______________________________________________,
при этом заряд ядра ______________________________________________________________,
прочность связи внешних электронов с ядром _________________________________________,
следовательно, энергия ионизации __________________________________________________
Зависимость свойств атомов элементов от их положения в ПС
Название свойства | Характер изменения: | |
в периоде слева направо → | в подгруппе сверху вниз ↓ | |
Число внешних электронов | ||
Заряд ядра (число электронов в атоме) | ||
Число электронных уровней | ||
Число валентных электронов | ||
Радиус атома | ||
Прочность связи внешних электронов с ядром | ||
Металлические свойства | ||
Неметаллические свойства | ||
Электроотрицательность | ||
Энергия ионизации | ||
Окислительный свойства | ||
Восстановительные свойства | ||
3. Задания для закрепления
Задания для закрепления
1. Химический элемент, имеющий электронную конфигурацию 1s22s22p63s23p64s2, в периодической системе находится в
1) 3-м периоде, VIIIВ группе 2) 4-м периоде, IIА группе
3) 4-м периоде, IIВ группе 3) 3-м периоде, VIIIA группе
2. Атом хрома имеет электронную конфигурацию
1) 1s22s22p4 3) 1s22s22p63s23p63d54s1
2) 1s22s22p63s23p6 4) 1s22s22p63s23p4
3. Сходную конфигурацию внешнего энергетического уровня имеют элементы хлор и
1) марганец 2) сера 3) аргон 4) бром
4. Число электронов на 3р-орбиталях атома фосфора в основном состоянии равно:
1) пяти 2) двум 3) трем 4) четырем
5. У атома кремния в основном состоянии число неспаренных электронов равно
1) 1 2) 2 3) 3 4) 0
6. Атом серы в максимально возбужденном состоянии имеет электронную конфигурацию валентных электронов
1) 3s23p43d0 3) 3s13p23d3
2) 3s23p33d1 4) 3s13p33d2
7. Не может находиться в возбужденном состоянии атом
1) углерода 2) азота 3) фосфора 4) серы
8.Электронная конфигурация иона хлора Cl-:
1) 1s22s22p63s23p3 3) 1s22s22p63s23p5
2) 1s22s22p63s23p4 4) 1s22s22p63s23p6
9. Одинаковую электронную конфигурацию имеют атомы неона и частица:
1) Mg2+ 2) S2- 3) Cl+ 4) К+
10. Частицей, имеющей такое же строение электронной оболочки, как у атома аргона, является
1) С1+3 2) Cl+ 3) Cl0 4) Сl-
11. Число электронов в ионе Al3+ равно:
Число электронов в ионе Al3+ равно:
1) 13 2) 18 3) 5 4) 10
12. Легче всего присоединяют электроны атомы:
1) хлора 2) серы 3) селена 4) брома
13. Одинаковую электронную конфигурацию имеют ионы
1) Al3+ и K+ 2) Na+ и O2– 3) Mg2+ и Ca2+ 4) Na+ и Cl–
14. На 3s-энергетическом подуровне в основном состоянии расположены все валентные электроны атома
1) магния 2) алюминия 3) азота 4) бора
15. На 2s-энергетическом подуровне расположены все валентные электроны атома
1) магния 2) бериллия 3) кремния 4) натрия
16. Электронная конфигурация 1s22s22p6 соответствует
1) атому С 2) иону O2– 3) иону Cl- 4) иону Ca2+
17. Атому аргона в основном состоянии соответствует электронная конфигурация частицы
1) S2- 2) Zn2+ 3) Si4+ 4) Se0
18. Атом химического элемента, водородное соединение которого имеет формулу Rh4, имеет конфигурацию внешнего уровня:
1) ns2np2 2) ns2np4 3) ns2 4) ns2np3
19. Атому аргона в основном состоянии соответствует электронная конфигурация частицы
1) Ca0 2) K+ 3) Cl+ 4) Zn2+
20. Электронную конфигурацию, отличную от инертного газа, имеет ион
1) K+ 2) O2- 3) Cu2+ 4) Ca2+
21. Какие два атома имеют одинаковое число s-электронов в основном состоянии?
1) Na и K 2) Cl и Na 3) Cl и Fe 4) P и Cl
22. Среди элементов 2-го периода наибольшее число неспаренных электронов имеет в основном состоянии атом
1) лития 2) углерода 3) азота 4) фтора
23. Два неспаренных электрона на внешнем уровне в основном состоянии имеет атом
Два неспаренных электрона на внешнем уровне в основном состоянии имеет атом
1) магния 2) углерода 3) хлора 4) бериллия
24. Электронную конфигурацию ls22s22p6 имеет ион
1) Mg2+ 2) К+ 3) Fe2+ 4) С −
25. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
1) кальция 2) хрома 3) кремния 4) алюминия
26. Электронная конфигурация 1s22s22p63s23p6 соответствует частице
1) N3- 2) Ca2+ 3) F- 4) Al3+
27. Элемент, электронная конфигурация атома которого 1s22s22p63s23p2, образует водородное соединение
1) Ch5 2) Sih5 3) h3O 4) h3S
28. Одинаковую электронную конфигурацию имеют ионы
1) Cl- и Br- 2) Al3+ и F- 3) O2- и Ca2+ 4) Mg2+ и S2-
29. Одинаковую электронную конфигурацию имеют
1) Mg2+ и O2- 2) Na+ и K+ 3) F- и Ar 4) O и S
30. Среди элементов 3-го периода наибольшее число неспаренных электронов имеет в основном состоянии атом
1) натрия 2) кремния 3) фосфора 4) хлора
31. Ион элемента имеет заряд -2 и электронную конфигурацию 1s22s22p63s23p6. Порядковый номер элемента равен
1) 8 2) 16 3) 18 4) 20
32. Какое соединение содержит оба элемента с электронной конфигурацией 1s22s22p6
1) Na2S 2) KF 3) Na2O 4) KBr
33. Восьмиэлектронную внешнюю оболочку имеет каждая из двух частиц:
1) P3+ и Cl5+ 2) S2- и Cl7+ 3) H+ и Ca2+ 4) Cl5+ и Li+
34. Электронная конфигурация внешнего уровня элемента – 4s23d3. В периодической системе элемент находится в
Электронная конфигурация внешнего уровня элемента – 4s23d3. В периодической системе элемент находится в
1) 3 периоде, V группе 2) 3 периоде, VII группе
3) 4 периоде, V группе 4) 4 периоде, VII группе
35. Элемент, электронная конфигурация атома которого 1s22s22p63s23p3, образует водородное соединение
1) Nh4 2) Ph4 3) HCl 4) h3S
36. Какая электронная конфигурация соответствует распределению валентных электронов в атоме хрома?
1) 3d44s2 2) 3s23p4 3) 3d54s1 4) 4s24p6
37. Высший оксид элемента с электронной конфигурацией 1s22s22p63s23p5:
1) Э2О5 2) ЭО3 3) Э2О7 4) ЭО4
38. Электронная конфигурация внешнего уровня элемента – 4s23d3. В периодической системе элемент находится в
1) 3 периоде, III группе 2) 3 периоде, V группе
3) 4 периоде, III группе 4) 4 периоде, V группе
39. Электронная конфигурация 1s22s22p63s23p6 соответствует частице
1) S4+ 2) P3- 3) Al3+ 4) O2-
40. Элемент имеет на внешнем энергетическом уровне 5 электронов. Каков может быть порядковый номер этого элемента?
1) 5 2) 7 3) 11 4) 25
41. Элемент находится в 3-м периоде, IVA группе. Конфигурация его валентных электронов –
1) 3s23p2 2) 3s23d2 3) 3p4 4) 4s23d1
42. Электронная конфигурация атома ванадия:
1) 1s22s22p63s23p63d5 2) 1s22s22p63s23p63d34s2
3) 1s22s22p63s23p63d44s1 4) 1s22s22p63s23p64s24p3
43. Электронная конфигурация внешнего электронного слоя . ..4s24p3 соответствует атому:
..4s24p3 соответствует атому:
1) мышьяка; 2) ванадия; 3) фосфора; 4) сурьмы
44. Электронная конфигурация ns2np6 соответствует каждому из двух атомов:
1) аргон и криптон; 3) фтор и хлор;
2) неон и гелий; 4) сера и кислород
45. Электронная конфигурация ls22s22p63s23p63d104s24p6 не соответствует частице:
1) Kr0; 2) Rb0; 3) Вr-; 4) Se2-
46. Электронная конфигурация ls22s22p63s23p63d10 не соответствует иону:
1) Сu+; 2) Zn2+; 3) Cu2+; 4)Ga3+
47. Электронную конфигурацию инертного газа не имеет ион:
1) Ca2+; 2) С1-; 3) К+; 4)Сr3+
48. Элементу, электронная формула атома которого ls22s22p5, соответствует водородное соединение, формула которого:
1) HF; 2) НС1; 3) СН4; 4) Nh4
49. Элементу, электронная формула внешнего электронного слоя атома которого …3s23p2, соответствует водородное соединение, формула которого:
1) РН3; 2) СН4; 3) Sih5; 4) HI
50. Элементу, электронная формула атома которого 1s22s22p63s23p63d54s2, соответствует высший оксид, формула которого:
1) Br2O7; 2) МnO2; 3) МnO; 4) Мn2O7
51. Атомы элементов 4-го периода имеют одинаковое число:
1) электронов на внешнем энергетическом уровне
2) нейтронов
3) энергетических уровней
4)протонов
52. Атомы элементов IIА группы сходны по:
1) числу электронов в атоме
2) числу электронов на внешнем электронном слое
3) числу энергетических уровней в электронной оболочке
4) радиусу атомов
53. Какая из характеристик атомов одинакова для всех элементов 3-го периода периодической системы?
1) число энергетических уровней
2) радиусы атомов
3) число электронов на внешнем энергетическом уровне
4) число протонов в ядре атома
54. В группах с ростом порядкового номера атомов элементов увеличивается:
В группах с ростом порядкового номера атомов элементов увеличивается:
1) число валентных электронов
2) атомный радиус
3) электроотрицательность
4) кислотные свойства высших гидроксидов
55. Наименьший радиус имеет атом
1) фтора 2) бериллия 3)бария 4) кремния
56. Атому с наибольшим радиусом соответствует электронная конфигурация
1) 1 s22s22p63s23p1 3) 1s22s22p63s23p5
2) 1s22s22p4 4) 1s22s22p2
57. Наибольший радиус имеет ион
1) Rb+ 2) Sr2+ 3) Те2- 4) I-
58. Наименьший радиус имеет ион
1) Сl- 2) Mg2+ 3) S2- 4) Са2+
59. Наибольшее значение электроотрицательности имеет атом, электронная конфигурация которого
1) 1s22s22p1 3) 1s22s22p5
2) 1s22s22p4 4) 1s22s22p63s23p5
60. Химическому элементу, электронная формула которого 1s22s22p63s23p2, соответствует водородное соединение
1) хлороводород 2) сероводород 3) фосфин 4) силан
61. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
1) Se → S → O 2) Cl → Br → I 3) S → P → Si 4) Al → Mg → Na
62. В порядке ослабления основных свойств оксиды расположены в ряду:
1) B2O3 → BeO → Li2O 2) Al2O3 → MgO → Na2O
3) CaO → MgO → BeO 4) Li2O → K2O → Rb2O
63. В каком ряду химические элементы расположены в порядке возрастания их электроотрицательности?
1) B → C → N 2) S → Se → Te
3) Be → Mg → Ca 4) B → Al → Ga
64. Во втором периоде периодической системы с ростом порядкового номера уменьшается
1) электроотрицательность атома 2) радиус атома
3) энергия ионизации 4) высшая степень окисления
65. В ряду элементов O → S → Se → Te увеличивается
В ряду элементов O → S → Se → Te увеличивается
1) электроотрицательность
2) низшая степень окисления
3) кислотный характер водородного соединения
4) валентность элемента в водородном соединении
67. В каком ряду химические элементы расположены в порядке возрастания их электроотрицательности?
1) B, C, N 2) Be, Mg, Ca 3) Cl, Br, I 4) S, P, Si
68. Сила кислот увеличивается в ряду
1) HF ─ HCl ─ HBr 2) h3SO4 ─ h3SO3 ─ h3S
3) h3SO4 ─ h4PO4 ─ h3SiO3 3) h3Se ─ h3S ─ h3O
69. Наиболее ярко выраженные неметаллические свойства проявляет
1) хлор 2) бор 3) фосфор 4) бром
70. Кислотные свойства высших оксидов усиливаются в ряду:
1) GeO2 ─ SiO2 ─ CO2 2) Cl2O7 ─ SO3 ─ P2O5
3) N2O5 ─ CO2 ─ B2O3 4) Cl2O7 ─ Br2O7 ─ I2O7
71. Среди элементов VIA группы максимальный радиус атома имеет
1) кислород 2) сера 3) теллур 4) полоний
72. Верны ли следующие суждения о магнии и его соединениях?
А. Высшая степень окисления магния в соединениях равна +3.
Б. Гидроксид магния проявляет основные свойства.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
73. Верны ли следующие суждения об элементах IIA группы?
А. Барий более активный металл, чем стронций.
Б. Основный характер оксидов в ряду BaO → CaO → MgO ослабевает.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
74. Верны ли следующие суждения о металлах и их соединениях?
А. Магний проявляет более выраженные металлические свойства, чем алюминий.
Б. Основный характер оксидов в ряду Li2O → BeO → B2O3 усиливается.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
75. В ряду элементов Na → Mg → Al → Si
1) уменьшаются радиусы атомов
2) уменьшается число протонов в ядрах атомов
3) увеличивается число электронных слоёв в атомах
4) уменьшается высшая степень окисления атомов
76. Соединения состава NaHЭО3 и NaHЭО4 характерны для
1) азота 2) фосфора 3) хлора 4) серы
77. В ряду элементов Cl → S → P → Si
1) уменьшается число электронных слоев в атомах
2) уменьшаются радиусы атомов
3) ослабевают неметаллические свойства
4) увеличивается число внешних электронов в атомах
78. В ряду химических элементов хлор → сера → фосфор:
1) ослабевают неметаллические свойства;
2) уменьшается радиус атома;
3) увеличивается радиус атома;
4) усиливаются неметаллические свойства;
5) уменьшается электроотрицательность.
79. В ряду химических элементов углерод → кремний → германий:
1) ослабевают неметаллические свойства;
2) уменьшается радиус атома;
3) увеличивается радиус атома;
4) усиливаются неметаллические свойства;
5) уменьшается электроотрицательность.
80. Ряды химических элементов, в которых радиус атома увеличивается:
1) натрий → магний → алюминий;
2) фтор → кислород → азот;
3) селен → сера → кислород;
4) углерод → кремний → германий;
5) фтор → хлор → бром.
81. Ряды химических элементов, в которых радиус атома уменьшается:
1) алюминий → магний → натрий;
2) селен → сера → кислород;
3) кремний → фосфор → хлор;
4) барий → кальций → магний;
5) бор → бериллий → литий.
82. Ряды химических элементов, в которых неметаллические свойства усиливаются:
1) йод → бром → хлор;
2) фтор → бром → йод;
3) кремний → фосфор → хлор;
4) кислород → сера → селен;
5) бор → углерод → азот.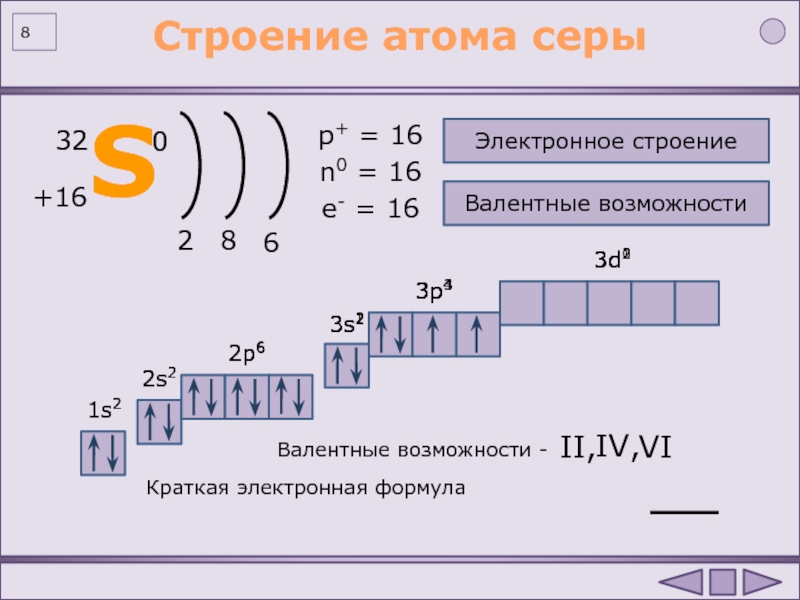
83. Ряды химических элементов, в которых металлические свойства ослабевают:
1) литий → бериллий → бор;
2) барий → кальций → магний;
3) углерод → кремний → германий;
4) натрий → магний → алюминий;
5) алюминий → магний → натрий.
84. Ряды формул высших оксидов, в которых кислотные свойства ослабевают:
1) Р2О5 → SiО2 → А12О3;
2) СО2 → В2О3 → ВеО;
3) Р2О5 → SО3 → С12О7;
4) As2О5 → P2О5 → N2О5;
5) СО2 → SiО2 → GeО2.
85. В ряду элементов Si → P → S уменьшается
1) число электронов в атоме 2) радиус атома
3) электроотрицательность 4) высшая степень окисления
86. Верны ли следующие суждения о строении атомов и свойствах щелочных металлов?
А. Атомы щелочных металлов в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns1.
Б. Все щелочные металлы способны взаимодействовать с водой при обычной температуре.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
87. В подгруппе кислорода с ростом порядкового номера элемента уменьшается
1) низшая степень окисления 2) радиус атома
3) энергия ионизации атома 4) относительная атомная масса
88. В ряду элементов C → Si → Ge увеличивается
1) электроотрицательность атома
2) радиус атома
3) высшая степень окисления
4) валентность элемента в летучем водородном соединении
89. Верны ли следующие суждения о металлах и их соединениях?
А. Восстановительные свойства у калия выражены сильнее, чем у магния.
Б. Высшие оксиды металлов IA группы имеют состав R2O.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
90. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
1) хлор 2) германий 3) мышьяк 4) селен
91. Электроотрицательность увеличивается в ряду элементов
Электроотрицательность увеличивается в ряду элементов
1) F − Сl – Вr 2) Р − S − Сl
3) Na − К – Rb 4) C − Si − Ge
92. В каком ряду химические элементы расположены в порядке возрастания их электроотрицательности?
1) Cl → Br → I 2) S → Se → Te 3) N → P → As 4) Li → Be → B
93. Верны ли следующие суждения о металлах и их соединениях?
А. Высшая степень окисления атома хрома равна номеру группы периодической
системы химических элементов.
Б. Высший гидроксид алюминия проявляет амфотерные свойства.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
94. Наиболее ярко выраженные неметаллические свойства проявляет
1) фтор 2) иод 3) сера 4) кремний
95. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) B, C, O, F 2) C, Si, Ge, Sn 3) Cl, S, P, Si 4) O, N, C, B
96. Неметаллические свойства элементов усиливаются в ряду:
1) Cl ─ S ─ P ─ Si 2) N ─ P ─ As ─ Se
3) B ─ C ─ N ─ O 4) C ─ Si ─ P ─ N
97. В ряду элементов Na → Mg → Al → Si
1) уменьшаются радиусы атомов
2) уменьшается число протонов в ядрах атомов
3) увеличивается число электронных слоёв в атомах
4) уменьшается высшая степень окисления атомов
98. Верны ли следующие утверждения о цинке и его соединениях?
А. Оксид и гидроксид цинка проявляют амфотерные свойства.
Б. Соединения цинка в высшей степени окисления являются сильными окислителями.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
99. В подгруппе галогенов с ростом порядкового номера увеличивается
1) электроотрицательность
2) высшая степень окисления
3) окислительная способность простых веществ
4) число заполненных энергетических уровней в атоме
100. В порядке усиления неметаллических свойств простых веществ образующие их элементы расположены в ряду
В порядке усиления неметаллических свойств простых веществ образующие их элементы расположены в ряду
l) C, Si, Ge 2) Se, S, О 3) F, О, N 4) Se, As, Ge
4. Задания для самостоятельной работы
1. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) P 2) Bi 3) Be 4) At 5) Ba
Запишите в поле ответа номера выбранных элементов.
2. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов.
1) Cl 2) S 3) Li 4) At 5) Al
Запишите в поле ответа номера выбранных элементов.
3. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) Cs 2) H 3) Sr 4) Sb 5) Te
Запишите в поле ответа номера выбранных элементов.
4. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) Ge 2) Al 3) Ca 4) Br 5) Ba
Запишите в поле ответа номера выбранных элементов.
5. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов.
1) Cl 2) Rb 3) Te 4) F 5) Sn
Запишите в поле ответа номера выбранных элементов.
6. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) Ba 2) At 3) Bi 4) Mg 5) Cs
Запишите в поле ответа номера выбранных элементов.
7. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов.
1) I 2) S 3) Al 4) Na 5) At
Запишите в поле ответа номера выбранных элементов.
8. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) C 2) Ca 3) As 4) Be 5) Ga
Запишите в поле ответа номера выбранных элементов.
9. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
1) Ba 2) In 3) Pb 4) Si 5) Cs
Запишите в поле ответа номера выбранных элементов.
10. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
1) Pb 2) Ge 3) Cs 4) Po 5) At
Запишите в поле ответа номера выбранных элементов.
11. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) H 2) I 3) Se 4) Rb 5) Sb
Запишите в поле ответа номера выбранных элементов.
12. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне шесть электронов.
1) K 2) Se 3) Ge 4) O 5) P
Запишите в поле ответа номера выбранных элементов.
13. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
1) Cl 2) Pb 3) Ca 4) Si 5) Mg
Запишите в поле ответа номера выбранных элементов.
14. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) Na 2) F 3) H 4) Mg 5) Si
Запишите в поле ответа номера выбранных элементов.
15. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
1) Sr 2) N 3) Li 4) Bi 5) F
Запишите в поле ответа номера выбранных элементов.
16. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) Ca 2) C 3) Ba 4) F 5) O
Запишите в поле ответа номера выбранных элементов.
17. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне три электрона.
1) Be 2) O 3) B 4) Al 5) H
Запишите в поле ответа номера выбранных элементов.
18. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов.
1) Br 2) Ca 3) F 4) Al 5) K
Запишите в поле ответа номера выбранных элементов.
19. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) Cs 2) Cl 3) Tl 4) Li 5) Ba
Запишите в поле ответа номера выбранных элементов.
20. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) C 2) Ca 3) Br 4) As 5) Mg
Запишите в поле ответа номера выбранных элементов.
21. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) P 2) Bi 3) Be 4) At 5) Ba
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
22. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) Cl 2) S 3) Li 4) At 5) Al
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
23. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Cs 2) H 3) Sr 4) Sb 5) Te
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
24. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Ge 2) Al 3) Ca 4) Br 5) Ba
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
25. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) Cl 2) Rb 3) Te 4) F 5) Sn
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
26. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Br 2) At 3) Bi 4) Mg 5) Cs
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
27. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) I 2) S 3) Al 4) Na 5) At
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
28. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) C 2) Ca 3) As 4) Be 5) Ga
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
29. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Ba 2) In 3) Pb 4) Si 5) Cs
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
30. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Rb 2) Ge 3) Cs 4) Po 5) At
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
31. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) H 2) I 3) Se 4) Rb 5) Sb
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
32. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) K 2) Se 3) Ge 4) O 5) P
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
33. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Cl 2) Pb 3) Ca 4) Si 5) Mg
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
34. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Na 2) F 3) H 4) Mg 5) Si
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
35. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Sr 2) N 3) Li 4) Bi 5) F
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
36. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Ca 2) C 3) Ba 4) F 5) O
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
37. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Be 2) O 3) B 4) Al 5) H
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
38. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1)Br 2) Ca 3) F 4) Al 5) K
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
39. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Cs 2) Cl 3) Tl 4) Li 5) Ba
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
40. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) C 2) Ca 3) Br 4) As 5) Mg
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
5. Задания для проверки
1. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне шесть электронов.
1) Po 2) Cl 3) Na 4) O 5) P
Запишите в поле ответа номера выбранных элементов.
2. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) Li 2) C 3) B 4) H 5) Al
Запишите в поле ответа номера выбранных элементов.
3. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) Ba 2) Po 3) Bi 4) Sr 5) I
Запишите в поле ответа номера выбранных элементов.
4. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
1) Na 2) C 3) F 4) Sn 5) O
Запишите в поле ответа номера выбранных элементов.
5. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) Cs 2) P 3) Al 4) Li 5) S
Запишите в поле ответа номера выбранных элементов.
6. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
1) As 2) Sr 3) P 4) Al 5) Mg
Запишите в поле ответа номера выбранных элементов.
7. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне три электрона.
1) Tl 2) At 3) Li 4) Al 5) Ba
Запишите в поле ответа номера выбранных элементов.
8. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне три электрона.
1) Ga 2) Ca 3) Kr 4) In 5) H
Запишите в поле ответа номера выбранных элементов.
9. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов.
1) Cl 2) Sn 3) Sb 4) I 5) Ba
Запишите в поле ответа номера выбранных элементов.
10. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) H 2) O 3) B 4) Li 5) Se
Запишите в поле ответа номера выбранных элементов.
11. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) Po 2) Cl 3) Na 4) O 5) P
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
12. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Li 2) C 3) B 4) H 5) Al
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
13. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Ba 2) Po 3) Bi 4) Sr 5) I
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
14. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Na 2) C 3) F 4) Sn 5) O
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
15. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Cs 2) P 3) Al 4) Li 5) S
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
16. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) As 2) Sr 3) P 4) Al 5) Mg
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
17. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Tl 2) At 3) Li 4) Al 5) Ba
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
18. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Ga 2) Ca 3) Kr 4) In 5) H
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
19. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) Cl 2) Sn 3) Sb 4) I 5) Ba
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
20. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) H 2) O 3) B 4) Li 5) Se
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Стронций схема строения атома – eecauxaigo.styleguides.io
Стронций схема строения атома – eecauxaigo.styleguides.ioСтронций схема строения атома
Учебник Химия 8 класс Габриелян – данный книгу (пособие) можно бесплатно скачать в формате pdf, а также читать онлайн с компьютера и телефона. Электронное строение атома стронция в химии, Sr. Атом стронция состоит из положительно заряженного ядра (+38), внутри которого есть Схема. На сайте Учебник-скачать-бесплатно.ком ученик найдет электронные учебники ФГОС и рабочие тетради в формате pdf (пдф). Написать схему электронного строения, электронную формулу, графическую электронную формулу атома СТРОНЦИЯ. 2. Как изменяются свойтва. 18 ноя 2016 Строение атома стронция схема. Дальнейшее развитие теории строения атома связано с развитием кванто- h3O)4(h3O-κO)8·2h3O}n. Стро́нций — химический элемент с атомным номером 38. Принадлежит к 2- й группе Проценты указаны по числу атомов. Известны также радиоактивные изотопы стронция с массовым числом от 73 до 105. Лёгкие изотопы (до. Строение атома стронция схема. Барий схема строения атома. Атомные спектры, энергетические уровни. Состояние электронов в атоме online. Строение атома стронция схема Cd строение атома – строение атома. Строение электронных оболочек. Строение атома молибдена (mo), схема. Электронная формула атома: Sr – 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 Электронно-графическая формула и схема строения элемента. Электронная схема стронция Порядок заполнения оболочек атома стронция (Sr) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d Валентность следует из строения электронной оболочки атома, электроны, участвующие. 19 сен 2015 Изобразите электронно-графические схемы атома брома в Напишите электронные формулы атома стронция и иона Sr2+. Укажите. Учебник Химия 8 класс Габриелян – данный книгу (пособие) можно бесплатно скачать в формате.
Links to Important Stuff
Links
- Учебник Химия 8 класс Габриелян.
© Untitled. All rights reserved.
3 Строение атома » СтудИзба
Строение атома
Установлено, что существует тесная связь между положением химических элементов в таблице Менделеева и строением атомов этих элементов.
Количество протонов в ядре (р) атома данного элемента числено совпадает с порядковым номером элемента (z).
Количество нейтронов (n) в ядре атома элемента равно разности между атомным весом (А) элемента (округленным до целого значения) и его порядковым номером в таблице Менделеева
n= A-z
Количество электронов в атоме данного элемента числено равно порядковому номеру элемента.
Так, например, золото имеет порядковый номер 79. Значит, в ядре его атома находится 79 протонов, а вокруг ядра движутся 79 электронов, что обеспечивает электронейтральность атома. Атомный вес золота равен 196.9655, или округленно 197. Следовательно, в ядре атома золота содержится 197-79=118 нейтронов.
Электроны в атомах располагаются на определенных энергетических уровнях.
Количество энергетических уровней электронов в атоме данного элемента числено равно периоду таблицы Менделеева этого элемента.
Так, золото находится в 6 периоде, следовательно, 79 электронов атома золота располагаются на 6 уровнях.
Максимальное число электронов, которое может располагаться в атоме на любом уровне, определяется его номером n и равно 2n2.
Так, в атоме золота на первом (n=1, ближайшем к ядру) уровне может находиться не более 2 электронов, на втором (n=2) – не более 8 электронов, на третьем (n=3)- не более 18 электронов, на четвертом (n=4) -не более 32 электронов и т.д. Электронное строение атома золота выглядит таким образом (79 электронов располагаются на 6 уровнях)
79Au 2,8,18,32,18,1
Для элементов, находящихся в главной подгруппе таблицы Менделеева, число электронов, вращающихся на внешнем (самом удаленном от ядра) уровне, числено равно номеру группы. Номер группы данного элемента в таблице Менделеева характеризует максимально возможную валентность данного элемента в его соединениях с другими элементами. Следовательно, максимально возможная валентность элемента главной подгруппы определяется числом электронов на внешнем энергетическом уровне. Поэтому такие электроны называют валентными электронами. Для элементов побочной подгруппы это правило не всегда соблюдается (например, для цинка 30Zn 2,8,18,2 оно соблюдается, а для титана 22Ti 2,8,10,2 -нет).
Опыт показал, что движение электронов в атоме нельзя описать в рамках классической ньютоновской механики, и к 1925-1926 году австрийским ученым Шредингером была разработана квантовая механика. Согласно принципу неопределенности Гейзенберга, невозможно одновременно точно определить местонахождение частицы и ее скорость, поэтому в квантовой механике говорят лишь о вероятности обнаружения электрона в той или иной области пространства. Поэтому под орбитой электрона в атоме (например, в атоме водорода) не следует понимать какую-то траекторию его движения вокруг ядра, как в планетарной модели строения атома
Электрон в атоме как бы размазан в пространстве вокруг ядра с определенной электронной плотностью. Поэтому говорят, что при своем движении в атоме электрон образует электронное облако. С учетом этого простейший атом водорода можно изобразить схемой
Согласно квантовой механике, состояние электронов в атоме (плотность электронного облака) полностью характеризуется волновой функцией Y, которая определяется набором из четырех квантовых чисел:
1. Главным квантовым числом -n, которое определяет дискретный (квантовый) набор разрешенных энергетических уровней энергии электронов. Главное квантовое число может принимать целочисленные положительные значения 1.2.3, и т.д. до бесконечности, т.е. n=1,2,3,….,¥, если количество химических элементов бесконечно. Для любого известного элемента таблицы Менделеева n совпадает с номером периода этого элемента.
Так, для всех элементов первого периода в атоме может быть только один энергетический уровень (n=1), а для всех элементов 7 периода электроны располагаются на 7 энергетических уровнях (n=7).
2. Орбитальным (или побочным) квантовым числом -l (эль), которое определяет величину орбитального момента количества движения электрона. Для каждого значения n побочное квантовое число l может принимать целый набор значений от нуля до n-1: l=0, 1, 2,…, n-1
Так, например,
для n=1 может быть только одно значение l=0;
для n=2 побочное квантовое число может иметь уже два значения: l=0 и 1;
для одного только значения главного квантового числа n побочное квантовое число l может принимать целый набор значений от 0 до n-1 включительно.
3. Магнитное квантовое число m определяет состояние электрона при наложении на атом внешнего магнитного поля. Оно может принимать значения от -l до +l, включая нуль, т.е. m=0,±1,±2,….,±l.
4. Спиновое квантовое число-s. Оно характеризует собственный момент количества движения электрона. Спиновое квантовое число может принимать всего два значения: s=+1/2, -1/2.
Таким образом, состояние электрона в атоме (волновая функция -Y) характеризуется набором четырех квантовых чисел Y(n,l,m,s). Согласно принципу запрета Паули, в любом атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Другими словами электроны в атоме неповторимы.
Состояние электрона, характеризующееся определенным значением главного квантового числа n, принято называть энергетическим уровнем электрона в атоме. Если n=1, то говорят, что электрон находится на первом (ближайшем к ядру атома) энергетическом уровне. При n=2 электроны образуют второй (более удаленный от ядра) энергетический уровень и т.д.. Максимальное количество электронов N, которые могут находиться на энергетическом уровне n равно
N=2n2
Отсюда следует, что на первом энергетическом уровне могут располагаться не более 2 электронов, на втором уровне – не более 8 электронов, на третьем энергетическом уровне не более 18 электронов, на четвертом уровне – не более 32 электронов и т.д.
Волновая функция со значением орбитального квантового числа l=0 называется S-орбиталью, т.е. S-орбиталь – это волновая функция видаY(n,0,m,s). Для каждого значения n существует своя единственная S-орбиталь. Чем выше значение n, тем выше значение энергии для соответствующей S-орбитали. Геометрически S-орбиталь представляет собой сферу
Волновая функция со значением орбитального квантового числа, равным единице (l=1) принято называть р-орбиталью, т.е. р-орбиталь – это волновая функция вида Y(n,1,m,s).
Для каждого значения n существует свои три р-орбитали:
Y(n,1,-1,s), Y(n,1,0,s), Y(n,1,1,s),
поскольку при l=1 магнитное квантовое число может принимать три значения m=
-1,0,1.
Чем выше значение n, тем выше значение энергии для соответствующей p-орбитали. Геометрически p-орбиталь напоминает восьмерку, или гантель, ориентированную вокруг соответствующей оси
Аналогичным образом выглядят рY и pZ– орбитали.
Волновая функция со значением орбитального квантового числа, равным двум (l=2) принято называть d-орбиталью, т.е. d-орбиталь – это волновая функция вида Y(n,2,m,s).
Для каждого значения n существует свои пять d-орбиталей:
Y(n,2,-2,s),Y(n,2,-1,s), Y(n,2,0,s), Y(n,2,1,s), Y(n,2,2,s),
поскольку при l=2 магнитное квантовое число может принимать пять значений m=-2,-1,0,1,2. Чем выше значение n, тем выше значение энергии для соответствующей d-орбитали. Геометрически d-орбиталь напоминает 4-x лепестковый цветок.
Волновая функция со значением орбитального квантового числа, равным трем (l=3) принято называть f-орбиталью, т.е. f-орбиталь – это волновая функция вида Y(n,3,m,s).
Для каждого значения n существует свои семь f-орбиталей:
Y(n,3,-3,s),Y(n,3,-2,s), Y(n,3,-1,s), Y(n,3,0,s), Y(n,3,1,s), Y(n,3,2,s), Y(n,3,3,s),
поскольку при l=3 магнитное квантовое число может принимать семь значений m=-3,-2,-1,0,1,2,3. Чем выше значение n, тем выше значение энергии для соответствующей f-орбитали. Геометрически f-орбиталь имеет еще более сложную конфигурацию. Аналогично вводятся понятия g и h- орбиталей.
Связь между значением l и типом орбитали суммирована в таблице:
значение l 0 1 2 3 4 5
тип орбитали s p d f g h
Энергия электрона в атоме неоднозначно определяется значением главного квантового числа n. Каждому значению n (т.е. каждому значению энергетического уровня) соответствует несколько значений орбитального квантового числа (l), которые называют энергетическими подуровнями. Эти подуровни различаются по энергии. В соответствии с этим говорят об s-подуровне, p-подуровне, d-подуровне и т.д. А электроны, находящиеся на этих подуровнях называют соответственно s-электронами, р-электронами, d-электронами и т.д. По энергии подуровни в атоме возрастают в следующем порядке:
1s<2s<2p<3s<3p<4s»3d<4p<5s»4d<5p<6s»5d»4f<6p
В такой последовательности происходит заполнение электронами энергетических уровней в атоме. Эта последовательность обусловлена действием двух правил Клечковского:
1. Заполнение энергетических подуровней электронами происходит таким образом, чтобы сумма n+l была минимальна, т.е. min(n+l)
2. Если возможны два различных пути заполнения, при которых выполняется 1 правило, то реализуется тот путь, при котором минимально n, min(n).
Так, например, после подуровня 3p в указанной выше последовательности происходит заполнение не подуровня 3d, а подуровня 4s. Действительно, для подуровня 3d n+l=3+2=5, а для 4s n+l=4+0=4, что отвечает 1 правилу Клечковского. Для подуровней 6s, 5d, 4f сумма n+l соответственно равна 6+0, 5+2, 4+3. Для этой последовательности соблюдаются оба правила Клечковского.
Таким образом, в атоме каждому энергетическому уровню соответствует несколько подуровней. Для n>1 число подуровней числено совпадает с n (на втором уровне могут быть только два подуровня, на третьем уровне только три подуровня и т.д.).
Максимальное количество электронов N’, которые могут находиться на подуровне со значением орбитального квантового числа, равного l, определяется уравнением
N’=2(2l + 1)
C учетом этой формулы получается, что каждый тип орбитали характеризуется следующими максимальными числами электронов, которые могут на них располагаться
тип орбитали s p d f g h
максимум электронов 2 6 10 14 18 22
На каждой орбитали располагается не более двух электронов, причем согласно принципу Паули каждая пара электронов в пределах одной и той же орбитали должна иметь антипараллельные спины (т.е. s=1/2 и s=-1/2).
Схему энергетических уровней и подуровней атома для n=3 можно изобразить таким образом
На этом рисунке все подуровни в пределах данных n и l обозначены одним цветом и имеют одинаковую энергию.
Согласно правилу Хунда, устойчивому состоянию электронов в атоме соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина электронов максимально.
До введения понятия энергетического подуровня мы записывали электронную конфигурацию (электронное строение) атомов по энергетическим уровням. Так для атома цинка она имела вид 30Zn 2,8,18,2. Теперь, с учетом представлений о существовании на каждом энергетическом уровне соответствующих подуровней, электронное строение атома цинка можно представить более детально.
Для первого энергетического уровня n=1, l=0, следовательно, возможно существование только s-подуровня, на котором может разместиться не более 2 электронов, что отразим записью 1s2.
На втором энергетическом уровне может быть только два подуровня: s и p, на которых максимальное число электронов равно, соответственно, 2 и 6. Поэтому 8 электронов второго энергетического уровня распределены таким образом: 2s22p6.
Следующие 18 электронов находятся на третьем уровне, на котором должно быть уже три подуровня: s, p и d, на которых максимальное число электронов составляет 2, 6 и 10. Следовательно, электронную конфигурацию третьего 18-электронного уровня можно представить в виде: 3s23p63d10.
Для последнего 4-го уровня могут существовать 4 подуровня: s,p,d,f, на которых может находиться 2, 6, 10 и 14 электронов. Но в атоме цинка на 4 уровне находится всего 2 электрона. Эти два электрона займут самый низший подуровень 4s. Поэтому электронное строение 4 уровня можно записать в виде: 4s2.
Соединив все полученные фрагменты электронного строения по всем уровням, получаем детализированную картину распределения электронов в атоме цинка: 30Zn 1s22s22p63s23p63d104s2.
Таким образом, основные особенности заполнения электронных оболочек атомов в периодической системе следующие:
1. Начало периода совпадает с началом образования нового энергетического уровня электронного слоя.
Период представляет собой последовательный ряд элементов, атомы которых различаются числом электронов в наружных слоях. Каждый период завершается благородным газом. У благородных газов наружная оболочка состоит из 8 электронов, за исключение гелия, у которого на внешней оболочке только 2 электрона.
2. Элементы главных и побочных подгрупп отличаются порядком заполнения электронных оболочек.
У всех элементов главных подгрупп заполняются только внешние оболочки. При этом у элементов I и II групп заполняются s-оболочки, поэтому эти элементы называются s-элементами. А у элементов III-VII групп заполняются p-оболочки, поэтому эти элементы называются р-элементами.
У элементов первых подгрупп (за исключением Mn, Zn, Tc, Ag, Cd, Hg) заполняются внутренние d-оболочки. Такие элементы называются d-элементами.
Элементы, у которых заполняются внутренние f-оболочки, называются f-элементами (лантаноиды и актиноиды).
Заполнение электронных оболочек электронами в таблице Менделеева происходит в согласии с двумя правилами Клечковского.
Ниже представлено электронное строение всех элементов таблицы Менделеева. Элементы, для которых наблюдается эффект проскока электрона с одного подуровня на другой выделены жирным шрифтом.
1 Н 1s1 1 период
2 He 1s2
3 Li 1s22s1 2 период
4 Be 1s22s2
5 B 1s22s22p1
6 C 1s22s22p2
7 N 1s22s22p3
8 O 1s22s22p4
9 F 1s22s22p5
10 Ne 1s22s22p6
11 Na 1s22s22p63s1 3 период
12 Mg 1s22s22p63s2
13 Al 1s22s22p63s23p1
14 Si 1s22s22p63s23p2
15 P 1s22s22p63s23p3
16 S 1s22s22p63s23p4
17 Cl 1s22s22p63s23p5
18 Ar 1s22s22p63s23p6
19 K 1s22s22p63s23p6 3d04s1 4 период
20 Ca 1s22s22p63s23p6 3d0 4s2
21 Sc 1s22s22p63s23p63d1 4s2
22 Ti 1s22s22p63s23p63d2 4s2
23 V 1s22s22p63s23p63d3 4s2
24 Cr 1s22s22p63s23p63d5 4s1 проскок 1 электрона с 4s на 3d
25 Mn 1s22s22p63s23p63d5 4s2
26 Fe 1s22s22p63s23p63d6 4s2
27 Co 1s22s22p63s23p63d7 4s2
28 Ni 1s22s22p63s23p63d8 4s2
29 Cu 1s22s22p63s23p63d10 4s1
30 Zn 1s22s22p63s23p63d10 4s2
31 Ga 1s22s22p63s23p63d10 4s2 4p1
32 Ge 1s22s22p63s23p63d10 4s2 4p2
33 As 1s22s22p63s23p63d10 4s2 4p3
34 Se 1s22s22p63s23p63d10 4s2 4p4
35 Br 1s22s22p63s23p63d10 4s2 4p5
36 Kr 1s22s22p63s23p63d10 4s2 4p6
37 Rb 1s22s22p63s23p63d10 4s2 4p6 4do4f05s1 5 период
38 Sr 1s22s22p63s23p63d10 4s2 4p6 4do4f05s2
39 Y 1s22s22p63s23p63d10 4s2 4p6 4d14f05s2
40 Zr 1s22s22p63s23p63d10 4s2 4p6 4d24f05s2
41 Nb 1s22s22p63s23p63d10 4s2 4p6 4d44f05s1
42 Mo 1s22s22p63s23p63d10 4s2 4p6 4d54f05s1
43 Te 1s22s22p63s23p63d10 4s2 4p6 4d54f05s2
44 Ru 1s22s22p63s23p63d10 4s2 4p6 4d74f05s1
45 Rh 1s22s22p63s23p63d10 4s2 4p6 4d84f05s1
46 Pd 1s22s22p63s23p63d10 4s2 4p6 4d104f05s0
47 Ag 1s22s22p63s23p63d10 4s2 4p6 4d104f05s1
48 Cd 1s22s22p63s23p63d10 4s2 4p6 4d104f05s2
49 In 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p1
50 Sn 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p2
51 Sb 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p3
52 Te 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p4
53 I 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p5
54 Xe 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p6
55 Cs 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p6 5d05f05g06s1 6 период
56 Ba 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p6 5d05f05g06s2
57 La 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p6 5d15f05g06s2
58 Ce 1s22s22p63s23p63d10 4s2 4p6 4d104f25s25p6 5d05f05g06s2
59 Pr 1s22s22p63s23p63d10 4s2 4p6 4d104f35s25p6 5d05f05g06s2
60 Nd 1s22s22p63s23p63d10 4s2 4p6 4d104f45s25p6 5d05f05g06s2
61 Pm 1s22s22p63s23p63d10 4s2 4p6 4d104f55s25p6 5d05f05g06s2
62 Sm 1s22s22p63s23p63d10 4s2 4p6 4d104f65s25p6 5d05f05g06s2
63 Eu 1s22s22p63s23p63d10 4s2 4p6 4d104f75s25p6 5d05f05g06s2
64 Gd 1s22s22p63s23p63d10 4s2 4p6 4d104f75s25p6 5d15f05g06s2
65 Tb 1s22s22p63s23p63d10 4s2 4p6 4d104f95s25p6 5d05f05g06s2
66 Dy 1s22s22p63s23p63d10 4s2 4p6 4d104f105s25p6 5d05f05g06s2
67 Ho 1s22s22p63s23p63d10 4s2 4p6 4d104f115s25p6 5d05f05g06s2
68 Er 1s22s22p63s23p63d10 4s2 4p6 4d104f125s25p6 5d05f05g06s2
69 Tm 1s22s22p63s23p63d10 4s2 4p6 4d104f135s25p6 5d05f05g06s2
70 Yb 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d05f05g06s2
71 Lu 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d15f05g06s2
72 Hf 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d25f05g06s2
73 Ta 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d35f05g06s2
74 W 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d45f05g06s2
75 Re 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d55f05g06s2
76 Os 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d65f05g06s2
77 Ir 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d75f05g06s2
78 Pt 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d95f05g06s1
79 Au 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s1
80 Hg 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s2
81 Tl 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p1
82 Pb 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p2
83 Bi 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p3
84 Po 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p4
85 At 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p5
86 Rn 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p6
87 Fr 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p6 6d07s1 7 период
88 Ra 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p6 6d07s2
89 Ac 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p6 6d17s2
90 Th 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p6 6d27s2
91Pa 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f25g06s16p6 6d17s2
92 U 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f35g06s26p6 6d17s2
93 Np 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f45g06s26p6 6d17s2
94 Pu 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f65g06s26p6 6d07s2
95 Am 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f75g06s26p6 6d07s2
96 Cm 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f75g06s26p6 6d17s2
97 Bk 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f85g06s26p6 6d17s2
98 Cf 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f105g06s26p6 6d07s2
99 Es 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f115g06s26p6 6d07s2
100 Fm 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f125g06s26p6 6d07s2
101 Md 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f135g06s26p6 6d07s2
102 No 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f145g06s26p6 6d07s2
103 Lr 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f145g06s26p6 6d17s2
Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации»,
сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г. №1029-КМ “О введение в действие новой редакции Устава и изменении наименования Университета” с 13.07.2016 г. в связи с переименованием Университета считать:
– полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
– сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
– полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
– сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13.07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
Конспект урока по химии на тему “СТРОЕНИЕ АТОМА”
Строение атома
Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом атом – система электронейтральная. Заряд ядра равен порядковому номеру элемента в таблице Д.И.Менделеева. Состояние электрона в атоме описывается при помощи набора четырех квантовых чисел: главного
Главное квантовое число n определяет энергию АО и номер энергетического уровня, на котором находится электрон, и может принимать целочисленные значения от единицы до бесконечности.
Орбитальное квантовое число l определяет форму АО и энергетический подуровень, оно может принимать значения от нуля до
Магнитное квантовое число ml определяет пространственную ориентацию АО и отчасти ее форму, оно может принимать значения от –l до +l.
Спиновое квантовое число ms характеризует собственный момент импульса и связанный с ним магнитный момент и может принимать значения ±1/2.
Последовательность распределения электронов в атоме по мере увеличения значений
При заполнении АО действует принцип Паули, из которого следует, что в атоме не может быть двух электронов, характеризующихся одинаковым набором значений четырех квантовых чисел. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа.
Заполнение энергетических подуровней подчиняется правилу Хунда, согласно которому электроны в основном состоянии в атоме располагаются так, чтобы модуль суммарного спина всех электронов подуровня был максимальным. Например, четыре валентных p-электрона атома кислорода размещаются в квантовых ячейках следующим образом:
Последовательность заполнения энергетических уровней и подуровней в атомах выражается правилом Клечковкого: порядок заполнения определяется возрастанием суммы n+l, а при одинаковом ее значении первым заполняется подуровень с меньшим значением n в этой сумме. Например,
1s2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f
(лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней: s-элементы – заполнение внешнего s-подуровня (например, литий 1s22s1), р-элементы – заполнение внешнего p-подуровня (например, фтор – 1s22s22p5), d-элементы – заполнение предвнешнего d-подуровня (например, ванадий – 1s2 2s2 2p6 3s2 3p6 4s2 3d3), f-элементы – заполнение f-подуровня второго снаружи уровня (например, неодим – 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4).
Для d– и f-элементов возможны отклонения от описанного способа заполнения АО – так называемый провал электрона. Это явление связано с тем, что для атома устойчивым состоянием является полностью или наполовину заполненная АО, т.е. d10, d5, f14, f7. В ситуации, когда до достижения такого состояния не хватает одного электрона, он переходит («проваливается») с предыдущего уровня. Например, электронный паспорт серебра 1s22s22p63s23p64s23d104p65s24d9 с учетом провала электрона примет вид 1s22s22p63s23p64s23d104p65s14d10.
Если на валентных энергетических уровнях имеются вакантные АО, то при получении электронами порции энергии (возбуждении атома) становится возможным «разъединение» валентных электронов, т.е. их переходы с тех подуровней, где все АО заняты полностью () или частично (), на другие валентные подуровни того же уровня, имеющие незаполненные АО. При этом с тех АО, которые в основном (соответствующем минимальной энергии атома) состоянии были заняты полностью, «уходит» по одному электрону последовательно, т.е. возможно несколько возбужденных состояний. Возбуждение меняет валентное состояние атома (число его неспаренных электронов).
Пример 1. Составить электронную формулу атома брома и графическую схему заполнения электронами валентных орбиталей в нормальном и возбужденном состояниях.
Решение. 1. Порядковый номер брома – 35, следовательно атом брома имеет 35 электронов. Бром находится в IV периоде периодической системы, следовательно, АО с n, равным 1; 2 и 3 заполнены полностью. Бром относится к p-элементам, следовательно, заполнен 4s-подуровень. В ряду 4p-элементов бром – пятый элемент, следовательно, на 4p-подуровне – пять электронов. Таким образом, электронная формула брома имеет вид 1s22s22p63s23p64s23d104p5.
2. Валентными орбиталями в этом атоме являются орбитали внешнего (четвертого) электронного слоя, т.е. 4s-, 4p– и незаполненные 4d-орбитали. Графически схема заполнения электронами этих орбиталей имеет вид
в таком состоянии бром имеет валентность 1, которой соответствуют степени окисления 1 и +1.
3. При затрате некоторой энергии спаренный p-электрон перейдет на свободную d-орбиталь. В этом первом возбужденном состоянии
бром имеет валентность 3, которой соответствует степень окисления +3.
4. При передаче атому брома еще некоторого количества энергии следующий p-электрон также перейдет на свободную d-орбиталь. Во втором возбужденном состоянии
бром имеет валентность 5, которой соответствует степень окисления +5.
5. При передаче атому брома еще некоторого количества энергии s-электрон также перейдет на свободную d-орбиталь. В третьем возбужденном состоянии
бром имеет валентность 7, которой соответствует степень окисления +7.
Пример 2. Составить электронные формулы атома селена в состояниях Se2 и Se+4 и графические схемы заполнения электронами валентных орбиталей.
Решение. 1. Cоставим электронную формулу атома селена (см. пример 1): 1s22s22p63s23p64s23d104p4. Графическая схема заполнения электронами валентных орбиталей имеет вид
2. Для получения Se2 необходимо к атому селена добавить два электрона на 4p-орбиталь (согласно правилу Клечковского). Тогда графическая схема примет вид
Электронная формула Se2 – 1s22s22p63s23p64s23d104p6.
3. Для получения Se+4 необходимо убрать четыре электрона с 4p-орбитали, атома селена:
Электронная формула Se+4 – 1s22s22p63s23p64s23d104p0.
Пример 3. Составить полную электронную формулу элемента, валентные электроны которого имеют конфигурацию 3d6, определить, к какому периоду таблицы Д.И.Менделеева принадлежит данный элемент.
Решение. Согласно правилу Клечковского 3d-элементы находятся в четвертом периоде таблицы Д.И.Менделеева. На данной орбитали находится шесть электронов, значит, это шестой по счету среди 3d-элементов, т.е. железо, полная электронная формула которого 1s22s22p63s23p64s23d6.
Задание I. Составить электронные формулы элементов, графические схемы заполнения электронами валентных орбиталей в спокойном и возбужденном состояниях, указать, к какому типу эти элементы относятся.
1. B, Al, Th.2. Po, Ba, Lu.
3. Mg, Pm, Be.
4. Br, Co, Hf.
5. C, Tm, As.
6. Nd, Ca, V.
7. Ta, O, Ce.
8. Y, Rb, S.
9. At, Xe, Lr.
10. Cs, U, H.
11. Cl, Cu, Bi.
12. Na, Ac, Fe.
13. Pb, Ra, Dy.
14. Ag, Re, In.
15. Cd, K, Pa.
16. P, Se, Li.
17. Yb, Mn, Sn.
18. Mo, La, N.
19. Pu, Ni, Sb.
20. Au, Np, Rn.
21. Cr, Tl, Cm.
22. Si, I, Zr.
23. Tb, Sr, Bk.
24. Fr, Ti, W.
25. He, Hg, Gd.
26. Pt, Ne, Sm.
27. Ga, Ru, Ho.
28. Sc, Pr, Os.
29. Ar, Ir, Eu.
30. Zn, Rh, Er.
31. Kr, Pd, Am.
32. Ge, Cf, F.
Задание II. Составить электронные формулы атомов в указанных состояниях и графические схемы заполнения электронами валентных орбиталей.
33. Li+, C+2.34. O2, F.
35. Na+, N3.
36. Ca+2, C+4.
37. Al+3, B3.
38. C4, Ba+2.
39. S+6, P3.
40. P+5, Cl1.
41. I+5, Fe+3.
42. Be+2, Co+3.
43. Cr+6, Cu+2.
44. I, P+3.
45. Cr+3, Br+3.
46. Ag+, Sn+4.
47. Zn+2, S2.
48. K+, Fe+2.
49. Zr+4, Pb+2.
50. N+5, Br.
51. Ni+2, Cl+5.
52. Se2, Cs+.
53. Te2, Sr+2.
54. Bi+3, Si4.
55. B+3, Sc+2.
56. Mg+2, Mn+7.
57. Cd+2, Sn+2.
58. Nb+3, Hg+.
59. Tl+, V+3.
60. Ti+4, Mn+2.
61. Os+3, Au+3.
62. Rb+, Ce+3.
63. Fr+1, Y+3.
64. H+, Re+7.
Задание III. Исходя из состояния валентных электронов, составить электронную формулу элемента в нулевой степени окисления. Определить, к какому периоду таблицы Д.И.Менделеева принадлежит данный элемент.
65. 4d1.66. 3d10.
67. 4s13d10.
68. 5d2.
69. 6p2.
70. 6s14f145d10.
71. 4s23d5.
72. 4s13d5.
73. 7s26d1.
74. 5d3.
75. 6s24f2.
76. 6p1.
77. 5s14d5.
78. 4f3.
79. 6d15f3.
80. 5s24d5.
81. 5d8.
82. 5s14d10.
83. 5s24d10.
84. 5s2.
85. 5p3.
86. 6p4.
87. 4d6.
88. 5d6.
89. 5f7.
90. 5d6.
91. 5f2.
92. 4d7.
93. 5d14f7.
94. 4f10.
95. 4d8.
96. 5p6.
Электронные формулы атомов химических элементов
Электронные формулы атомов химических элементов, слои расположены в порядке заполнения подуровней. Электронные слои атомов заполняются электронами в порядке, согласно правилу Клечковского.
Порядок заполнения атомных орбиталей по мере увеличения энергии следующий: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈ 6d < 7p < 8s. При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа n и побочного (орбитального) квантового числа l , т.е. n + l , имеет меньшее значение.
| s-элементы | d-элементы | f-элементы | p-элементы |
| № | Знак | Элемент | Электронная формула |
| I период | |||
| 1 | H | водород | 1s1 |
| 2 | He | гелий | 1s2 |
| № | Знак | Элемент | Электронная формула |
| II период | |||
| 3 | Li | литий | 1s2 2s1 |
| 4 | Be | бериллий | 1s2 2s2 |
| 5 | B | бор | 1s2 2s2 2p1 |
| 6 | C | углерод | 1s2 2s2 2p2 |
| 7 | N | азот | 1s2 2s2 2p3 |
| 8 | O | кислород | 1s2 2s2 2p4 |
| 9 | F | фтор | 1s2 2s2 2p5 |
| 10 | Ne | неон | 1s2 2s2 2p6 |
| № | Знак | Элемент | Электронная формула |
| III период | |||
| 11 | Na | натрий | 1s2 2s2 2p6 3s1 |
| 12 | Mg | магний | 1s2 2s2 2p6 3s2 |
| 13 | Al | алюминий | 1s2 2s2 2p6 3s2 3p1 |
| 14 | Si | кремний | 1s2 2s2 2p6 3s2 3p2 |
| 15 | P | фосфор | 1s2 2s2 2p6 3s2 3p3 |
| 16 | S | сера | 1s2 2s2 2p6 3s2 3p4 |
| 17 | Cl | хлор | 1s2 2s2 2p6 3s2 3p5 |
| 18 | Ar | аргон | 1s2 2s2 2p6 3s2 3p6 |
| № | Знак | Элемент | Электронная формула |
| IV период | |||
| 19 | K | калий | 1s2 2s2 2p6 3s2 3p6 4s1 |
| 20 | Ca | кальций | 1s2 2s2 2p6 3s2 3p6 4s2 |
| 21 | Sc | скандий | 1s2 2s2 2p6 3s2 3p6 4s2 3d1 |
| 22 | Ti | титан | 1s2 2s2 2p6 3s2 3p6 4s2 3d2 |
| 23 | V | ванадий | 1s2 2s2 2p6 3s2 3p6 4s2 3d3 |
| 24 | Cr | хром | 1s2 2s2 2p6 3s2 3p6 4s1 3d5 |
| 25 | Mn | марганец | 1s2 2s2 2p6 3s2 3p6 4s2 3d5 |
| 26 | Fe | железо | 1s2 2s2 2p6 3s2 3p6 4s2 3d6 |
| 27 | Co | кобальт | 1s2 2s2 2p6 3s2 3p6 4s2 3d7 |
| 28 | Ni | никель | 1s2 2s2 2p6 3s2 3p6 4s2 3d8 |
| 29 | Cu | медь | 1s2 2s2 2p6 3s2 3p6 4s1 3d10 |
| 30 | Zn | цинк | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 |
| 31 | Ga | галлий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1 |
| 32 | Ge | германий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 |
| 33 | As | мышьяк | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3 |
| 34 | Se | селен | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4 |
| 35 | Br | бром | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 |
| 36 | Kr | криптон | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 |
| № | Знак | Элемент | Электронная формула |
| V период | |||
| 37 | Rb | рубидий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 |
| 38 | Sr | стронций | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 |
| 39 | Y | иттрий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d1 |
| 40 | Zr | цирконий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2 |
| 41 | Nb | ниобий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d4 |
| 42 | Mo | молибден | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d5 |
| 43 | Tc | технеций | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d5 |
| 44 | Ru | рутений | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d7 |
| 45 | Rh | родий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d8 |
| 46 | Pd | палладий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s0 4d10 |
| 47 | Ag | серебро | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10 |
| 48 | Cd | кадмий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 |
| 49 | In | индий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1 |
| 50 | Sn | олово | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p2 |
| 51 | Sb | сурьма | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s22 4d10 5p3 |
| 52 | Te | теллур | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p4 |
| 53 | I | йод | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5 |
| 54 | Xe | ксенон | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 |
| № | Знак | Элемент | Электронная формула |
| VI период | |||
| 55 | Cs | цезий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 |
| 56 | Ba | барий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 |
| 57 | La | лантан | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 |
| 58 | Ce | церий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f2 |
| 59 | Pr | празеодим | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f3 |
| 60 | Nd | неодим | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4 |
| 61 | Pm | прометий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f5 |
| 62 | Sm | самарий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f6 |
| 63 | Eu | европий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f7 |
| 64 | Gd | гадолиний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f7 5d1 |
| 65 | Tb | тербий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f9 |
| 66 | Dy | диспрозий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f10 |
| 67 | Ho | гольмий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f11 |
| 68 | Er | эрбий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12 |
| 68 | Tm | тулий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f13 |
| 70 | Yb | иттербий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 |
| 71 | Lu | лютеций | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d1 |
| 72 | Hf | гафний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 |
| 73 | Ta | тантал | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d3 |
| 74 | W | вольфрам | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4 |
| 75 | Re | рений | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d5 |
| 76 | Os | осмий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d6 |
| 77 | Ir | иридий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d7 |
| 78 | Pt | платина | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 5d9 |
| 79 | Au | золото | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 5d10 |
| 80 | Hg | ртуть | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 |
| 81 | Tl | таллий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p1 |
| 82 | Pb | свинец | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p2 |
| 83 | Bi | висмут | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p3 |
| 84 | Po | полоний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p4 |
| 85 | At | астат | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p5 |
| 86 | Rn | радон | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10 5p6 6s2 4f14 5d10 6p6 |
| № | Знак | Элемент | Электронная формула |
| VII период | |||
| 87 | Fr | франций | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s1 |
| 88 | Ra | радий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 |
| 89 | Ac | актиний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 6d1 |
| 90 | Th | торий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 6d2 5f0 |
| 91 | Pa | протактиний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f2 6d1 |
| 92 | U | уран | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f3 6d1 |
| 93 | Np | нептуний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f4 6d1 |
| 94 | Pu | плутоний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f5 6d1 |
| 95 | Am | америций | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f7 |
| 96 | Cm | кюрий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f7 6d1 |
| 97 | Bk | берклий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f8 6d1 |
| 98 | Cf | калифорний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f10 |
| 99 | Es | эйнштейний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f11 |
| 100 | Fm | фермий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f12 |
| 101 | Md | менделеевий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f13 |
| 102 | No | нобелий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 |
| 103 | Lr | лоуренсий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d1 |
| 104 | Rf | резерфордий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d2 |
| 105 | Db | дубний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d3 |
| 106 | Sg | сиборгий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d4 |
| 107 | Bh | борий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d5 |
| 108 | Hs | хассий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d6 |
| 109 | Mt | мейтнерий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d7 |
| 110 | Ds | дармштадтий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d8 |
| 111 | Rg | рентгений | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d9 |
| 112 | Cn | коперниций | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 |
| 113 | Nh | нихоний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p1 |
| 114 | Fl | флеровий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2 |
| 115 | Mс | московий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p3 |
| 116 | Lv | ливерморий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p4 |
| 117 | Ts | теннесcин | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p5 |
| 118 | Og | оганесон | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6 |
Электронные конфигурации элементов со 105 по 118
Электронные конфигурации элементов со 105 по 118 приведены согласно данных сайта WebElements
- 105 Db : [Rn].5f14.6d3.7s2 (догадка, основанная на электронной конфигурации тантала) ; 2.8.18.32.32.11.2
- 106 Sg : [Rn].5f14.6d4.7s2 (догадка, основанная на электронной конфигурации вольфрама) ; 2.8.18.32.32.12.2
- 107 Bh : [Rn].5f14.6d5.7s2 (догадка, основанная на электронной конфигурации рения) ; 2.8.18.32.32.13.2
- 108 Hs : [Rn].5f14.6d6.7s2 (догадка, основанная на электронной конфигурации осмия) ; 2.8.18.32.32.14.2
- 109 Mt : [Rn].5f14.6d7.7s2 (догадка, основанная на электронной конфигурации иридия) ; 2.8.18.32.32.15.2
- 110 Ds : [Rn].5f14.6d9.7s1 (догадка, основанная на электронной конфигурации платины) ; 2.8.18.32.32.17.1
- 111 Rg : [Rn].5f14.6d10.7s1 (догадка, основанная на электронной конфигурации золота) ; 2.8.18.32.32.18.1
- 112 Cn : [Rn].5f14.6d10.7s2 (догадка, основанная на электронной конфигурации ртути) ; 2.8.18.32.32.18.2
- 113 Uut : [Rn].5f14.6d10.7s2.7p1 (догадка, основанная на электронной конфигурации таллия) ; 2.8.18.32.32.18.3
- 114 Fl : [Rn].5f14.6d10.7s2.7p2 (догадка, основанная на электронной конфигурации свинца) ; 2.8.18.32.32.18.4
- 115 Uup : [Rn].5f14.6d10.7s2.7p3 (догадка, основанная на электронной конфигурации висмута) ; 2.8.18.32.32.18.5
- 116 Lv : [Rn].5f14.6d10.7s2.7p4 (догадка, основанная на электронной конфигурации полония) ; 2.8.18.32.32.18.6
- 117 Uus : [Rn].5f14.6d10.7s2.7p5 (догадка, основанная на электронной конфигурации астата) ; 2.8.18.32.32.18.7
- 118 Uuo : [Rn].5f14.6d10.7s2.7p6 (догадка, основанная на электронной конфигурации радона) ; 2.8.18.32.32.18.8
Эмпирическое правило Клечковского
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d, а не 4f, и только затем происходит заселение четырнадцатью электронами орбиталей 4f, затем продолжается и завершается заселение десятиэлектронного состояния 5d. Аналогичная ситуация характерна и для орбиталей 7s, 6d и 5f.
Источники:
- Atomic, Molecular, & Optical Physics Handbook, Ed. Gordon W. F. Drake, American Institute of Physics, Woodbury, New York, USA, 1996.
- R.L. DeKock and H.B. Gray in Chemical Structure and bonding, Benjamin/Cummings, Menlo Park, California, USA, 1980.
- A.M. James and M.P. Lord in Macmillan’s Chemical and Physical Data, Macmillan, London, UK, 1992.
- J.E. Huheey, E.A. Keiter, and R.L. Keiter in Inorganic Chemistry : Principles of Structure and Reactivity, 4th edition, HarperCollins, New York, USA, 1993.
Chemistry of Cadmium – Chemistry LibreTexts
Этот модуль создан для предоставления информации о кадмии, которую может быть очень полезно знать, поскольку этот переходный металл ядовит и может нанести вред тем, кто не обращается с ним осторожно.
Введение
Кадмий, переходный металл, имеет химический символ Cd. Кадмий находится в d-блоке и группе 12 периодической таблицы Менделеева, имея атомный номер 48 и атомную массу 112,411 г. Кадмий был открыт в Германии в 1817 году немецким ученым Фридрихом Штромейером.Этот элемент очень часто использовался в качестве расходуемого анода для защиты железа и стали от коррозии, а также используется в никель-кадмиевых батареях. Кадмий очень токсичен, поэтому с ним следует обращаться с большой осторожностью.
Общие свойства кадмия
- Химический символ: Cd
- Атомный номер: 48
- Атомная масса: 112,411
- Номер группы: 12
- Номер периода: 5
- Электроотрицательность: 1,69
- Стандартное состояние: твердое вещество
- Стандартный цвет: серебристо-серый металлик
- Плотность: 8.65 г / см 3
- Точка плавления: 320,9 o C
- Точка кипения: 767 o C
- Наиболее частое состояние окисления: +2
- Теплота плавления: 6,192 кДж моль -1
- Теплота испарения: 99,87 кДж моль -1
Атомная структура
Электронная конфигурация кадмия
Cd: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s2 4d 10 или [Kr] 4d 10 5s 2
Общие изотопы
Кадмий содержит восемь изотопов естественного происхождения.Это 106 Cd, 108 Cd, 110 Cd, 111 Cd, 112 Cd, 113 Cd, 114 Cd, 116 Cd. Из этих восьми истопов наиболее распространены 114 Cd и 112 Cd с содержанием 29% и 24% соответственно.
Металлические характеристики
Кадмий в чистом виде мягкий и ковкий. Он используется в основном для гальваники стали (коррозионная стойкость) и в производстве подшипников.Соединения кадмия также присутствуют в масляных красках, где они дают яркие цвета (например, «желтый кадмий»). В твердом состоянии этот металл серебристо-серого цвета. Кадмий является очень хорошим проводником электричества, а также очень устойчивым к коррозии, что делает его отличным расходным анодом для металлов, таких как железо и сталь.
Подобно цинку и олову, металлический кадмий «плачет» или издает высокий звук при быстром сгибании. Сегодня большая часть кадмия извлекается как побочный продукт процесса рафинирования цинка.
Естественные явления
Кадмий никогда не встречается в природе в своей элементарной форме. Он всегда находится в сочетании с другим элементом. Наиболее распространенными природными соединениями кадмия являются сульфид кадмия, карбонат кадмия и оксид углерода. Сульфид углерода, также известный как минерал гринокит, является наиболее известным источником кадмия. Кадмий также содержится в земной коре в количествах от 0,1 до 0,2 частей на миллион, что очень мало. Большая часть кадмия получается в результате процесса, известного как очистка цинка, при котором используются разные точки плавления.
Общие реакции с кадмием
Кадмий образует несколько важных соединений в природе:
- Гидроксид кадмия (Cd (OH) 2 ): это соединение присутствует в никель-кадмиевой батарее и образует осадок в присутствии азота. Кислотный раствор.
- Оксид кадмия (CdO): это соединение используется в различных реакциях, включая действие в качестве катализатора в окислительно-восстановительных реакциях, реакциях гидрирования, полимеризации и расщеплении. Оксид кадмия термостойкий, поэтому он может быть очень полезен в термостойких пластмассах, а также в других покрытиях для пластмасс.Это соединение присутствует в некоторых эмалях и батареях.
- Сульфат кадмия (CdSO 4 ): это соединение, как и многие другие соединения кадмия, используется в гальванических покрытиях, пигментах, флуоресцентных лампах и батареях, в частности, в элементе Вестона.
Эти три соединения наиболее широко используются в обществе; однако есть несколько других соединений, которые существуют в природе: цианид кадмия, хлорид кадмия, карбонат кадмия и нитрат кадмия.
Общие области применения
Наиболее известные кадмиевые аккумуляторы, которые используются в никель-кадмиевых или никель-кадмиевых аккумуляторных батареях, которые являются второй наиболее широко используемой батареей, встречающейся в самолетах, телефонах, электроинструментах, проигрывателях компакт-дисков, компьютерах и даже радиолокационных станциях. .В этой батарее кадмий принимает форму гидроксида кадмия. Кадмий также используется в покрытиях, пигментах, пластмассах и сплавах. Чаще всего образуются сплавы с серебром, медью и цинком, главным образом потому, что кадмий снижает температуру плавления, что делает их пригодными для твердой пайки металлов. В прошлые годы кадмий использовался при гальванике стали для защиты от коррозии; однако это не так часто.
Опасности и токсичность
Кадмий – очень токсичный металл, поэтому с ним нужно обращаться с большой осторожностью.Кадмий может попадать в организм человека через курение сигарет, загрязненную воду из-за свалок, определенные продукты, такие как моллюски, и в основном при обращении с самим металлом. Этот металл при вдыхании или переваривании может вызвать множество заболеваний, включая рвоту, тошноту, диарею, сухость в горле и головные боли. Более серьезные последствия все еще исследуются, но считается, что они вызывают высокое кровяное давление, рак, болезни сердца и печени.
Список литературы
- Schulte-Schrepping, K.-ЧАС. and Piscator, M. 2000. Кадмий и соединения кадмия. Энциклопедия промышленной химии Ульмана. Печать.
- Ньютон, Дэвид Э. «Кадмий». Химические элементы: от углерода до криптона . Vol. 1. Детройт: U.X.L., 1999. 81–86. Распечатать.
- Янг, Джей А. «Кадмий». Журнал химического образования 2005 82 (4), 521. Print.
Проблемы
- Какая электронная конфигурация у Cd 2 + ??????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????? Нарисуйте заполненную орбитальную диаграмму для этого иона.
- Какой пример сбалансированной химической реакции образования гидроксида кадмия? Не забудьте указать фазы.
- Гальваника была обычным применением кадмия. Объясните, что такое гальваника и чем она полезна?
- Объясните термин «изотоп» применительно к кадмию.
- Каковы характеристики металла? Обладает ли кадмий этими характеристиками?
Решения проблем
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 10
Cd (NO 3 ) 2 + 2 NaOH → Cd (OH) 2 + 2 NaNO 3
Гальваника – это использование одного металла для полного покрытия или покрытия другого металла для защиты от коррозии .Например, использование кадмия для гальваники стали для защиты от коррозии.
Изотоп – это встречающаяся в природе форма кадмия, в которой имеется разное количество нейтронов, но такое же количество протонов.
Характеристики металла включают хорошие проводники тепла и электричества, склонность к потере электронов, высокие температуры плавления, пластичность и пластичность. Кадмий действительно обладает этими характеристиками и является хорошим примером металла.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
кадмия (Cd) | АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ ®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Металлический кадмий
Номер продукта: Все применимые коды продуктов American Elements, например CD-M-02, CD-M-03, CD-M-04, CD-M-05, CD-M-06, CD-M-07
Номер CAS: 7440-43-9
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
1093 Broxton Ave.Suite 2000
Лос-Анджелес, CA
Тел .: +1 310-208-0551
Факс: +1 310-208-0351
Телефон экстренной помощи:
Внутренний, Северная Америка +1 800-424-9300
Международный +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси
Классификация в соответствии с Регламентом (ЕС) № 1272/2008
GHS06 Череп и скрещенные кости
Acute Tox. 2 h430 Смертельно при вдыхании.
GHS08 Опасность для здоровья
Muta.2 h441 Предположительно вызывает генетические дефекты.
Carc. 1B h450 Может вызывать рак.
Репр. 2 h461 Предположительно может нанести ущерб фертильности или нерожденному ребенку.
STOT RE 1 h472 Вызывает повреждение легких, почек, репродуктивной системы и крови в результате длительного или многократного воздействия. Путь воздействия: Устный.
Классификация в соответствии с Директивой 67/548 / EEC или Директивой 1999/45 / EC
T +; Очень токсично
R26: Очень токсично при вдыхании.
Т; Токсичный
Carc. Кот. 2
R45-48 / 23/25: Может вызывать рак. Токсичен: опасность серьезного повреждения здоровья при длительном воздействии путем вдыхания и проглатывания.
Xn; Вредно для здоровья
R62-68-63: Возможный риск нарушения фертильности. Возможный риск необратимых эффектов. Возможный риск причинения вреда будущему ребенку.
N; Опасно для окружающей среды
R50 / 53: Очень токсичен для водных организмов, может оказывать долгосрочное вредное воздействие на водную среду.
Muta. Кот. 3, Repr. Кот. 3
Информация об особых опасностях для человека и окружающей среды:
Неприменимо
Опасности, не классифицированные иным образом
Информация отсутствует.
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Вещество классифицируется и маркируется в соответствии с Регламентом CLP.
Пиктограммы, обозначающие опасности
GHS06 GHS08
Сигнальное слово: Опасно
Краткая характеристика опасности
h430 Смертельно при вдыхании.
h441 Предположительно вызывает генетические дефекты.
h450 Может вызывать рак.
h461 Предположительно может нанести вред фертильности или нерожденному ребенку.
h472 Вызывает повреждение легких, почек, репродуктивной системы и крови в результате длительного или многократного воздействия. Путь воздействия: Устный.
Меры предосторожности
P260 Избегать вдыхания пыли / дыма / газа / тумана / паров / аэрозолей.
P284 [В случае недостаточной вентиляции] использовать средства защиты органов дыхания.
P281 При необходимости используйте средства индивидуальной защиты.
P320 Срочно требуется специальное лечение (см. На этой этикетке).
P405 Хранить под замком.
P501 Утилизировать содержимое / контейнер в соответствии с местными / региональными / национальными / международными правилами.
Классификация WHMIS
D1A – Очень токсичный материал, вызывающий немедленные и серьезные токсические эффекты
D2A – Очень токсичный материал, вызывающий другие токсические эффекты
Система классификации
Рейтинги HMIS (шкала 0-4)
(Система идентификации опасных материалов)
ЗДОРОВЬЕ
ПОЖАР
РЕАКТИВНОСТЬ
1
0
0
Здоровье (острые эффекты) = 1
Воспламеняемость = 0
Физическая опасность = 0
Другие опасности
Результаты оценки PBT и vPvB
PBT: Неприменимо.
vPvB: Не применимо.
Химические характеристики: Вещества
Номер CAS Описание:
7440-43-9 Кадмий
Идентификационный номер (а):
Номер ЕС: 231-152-8
Номер индекса: 048-002-00-0
РАЗДЕЛ 4. ПЕРВАЯ ПОМОЩЬ
Описание мер первой помощи
Общая информация
Немедленно снимите всю одежду, загрязненную продуктом.
Снимайте дыхательный аппарат только после полного снятия загрязненной одежды.
При нерегулярном дыхании или остановке дыхания произвести искусственное дыхание.
При вдыхании
Обеспечьте свежий воздух. При необходимости сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь за медицинской помощью.
При попадании на кожу
Немедленно промыть водой с мылом и тщательно сполоснуть.
Немедленно обратитесь за медицинской помощью.
При попадании в глаза
Промыть открытый глаз под проточной водой в течение нескольких минут. Тогда обратитесь к врачу.
После проглатывания
Обратитесь за медицинской помощью.
Информация для врача
Наиболее важные симптомы и воздействия, как острые, так и замедленные
Отсутствует какая-либо соответствующая информация.
Указание на необходимость немедленной медицинской помощи и специального лечения
Отсутствует какая-либо соответствующая информация
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Надлежащие средства тушения
Специальный порошок для пожаров металла. Не используйте воду.
Средства пожаротушения, непригодные из соображений безопасности
Вода
Особые опасности, исходящие от вещества или смеси
При пожаре могут образоваться следующие вещества:
Оксид кадмия
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономную одежду респиратор.
Надеть полностью защитный непромокаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры по обеспечению личной безопасности, защитное снаряжение и порядок действий в чрезвычайной ситуации
Надевайте защитное снаряжение. Не подпускайте незащищенных людей.
Обеспечьте соответствующую вентиляцию.
Меры по защите окружающей среды:
Не допускайте попадания материала в окружающую среду без соответствующих правительственных разрешений.
Не допускать попадания продукта в канализацию или водоемы.
Не допускать проникновения в землю / почву.
Методы и материалы для локализации и очистки:
Утилизируйте зараженный материал как отходы в соответствии с разделом 13.
Обеспечьте соответствующую вентиляцию.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для получения информации о безопасном обращении.
См. Раздел 8 для получения информации о средствах индивидуальной защиты.
Информацию об утилизации см. В Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держать контейнер плотно закрытым.
Хранить в сухом прохладном месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Откройте контейнер и обращайтесь с ним осторожно.
Сведения о защите от взрывов и пожаров:
Информация отсутствует.
Условия безопасного хранения с учетом несовместимости
Хранение
Требования, предъявляемые к складским помещениям и таре:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Информация отсутствует.
Дополнительная информация об условиях хранения:
Держать емкость плотно закрытой.
Хранить в прохладных, сухих условиях в хорошо закрытых емкостях.
Особые конечные области применения
Отсутствует какая-либо соответствующая информация.
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ / ЛИЧНАЯ ЗАЩИТА
Дополнительная информация о конструкции технических систем:
Правильно работающий вытяжной шкаф для химических веществ, предназначенный для опасных химикатов и имеющий среднюю скорость движения не менее 100 футов в минуту.
Контрольные параметры
Компоненты с предельными значениями, требующие контроля на рабочем месте: 7440-43-9 Кадмий (100,0%)
PEL (США) Долгосрочное значение: 0,005 мг / м³ в виде Cd; см. 29 CFR 1910.1027
REL (США) См. приложение «Карманное руководство». A
TLV (США). Долгосрочное значение: 0,01 0,002 * мг / м³ в пересчете на Cd; * респирабельная фракция; BEI
EL (Канада) Долгосрочное значение: 0,01 мг / м³ в пересчете на кадмий; ACIGH A1, IARC 1
EV (Канада) Долгосрочное значение: 0,01 0,002 * мг / м³ * при вдыхании
Ингредиенты с биологическими предельными значениями: 7440-43-9 Кадмий (100.0%)
BEI (США) 5 мкг / г креатинина
Среда: моча
Время: некритично
Параметр: Кадмий (фон)
5 мкг / л
Среда: кровь
Время: не критично
Параметр: Кадмий (фон)
Дополнительная информация: Нет данных
Контроль воздействия
Средства индивидуальной защиты
Общие защитные и гигиенические меры
Следует соблюдать обычные меры предосторожности при обращении с химическими веществами.
Хранить вдали от продуктов питания, напитков и кормов.
Немедленно снимите всю грязную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Храните защитную одежду отдельно.
Поддерживайте эргономичную рабочую среду.
Дыхательное оборудование:
В чрезвычайных ситуациях использовать автономное устройство защиты органов дыхания.
Защита рук:
Непроницаемые перчатки
Проверяйте защитные перчатки перед каждым использованием на предмет их надлежащего состояния.
Выбор подходящих перчаток зависит не только от материала, но и от качества. Качество будет варьироваться от производителя к производителю.
Материал перчаток
Нитрилкаучук, NBR
Время проницаемости материала перчаток (в минутах)
Не определено
Защита глаз: Защитные очки
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физических и химических свойствах
Общая информация
Внешний вид:
Форма: Твердое вещество в различных формах
Цвет: Серебристо-белый
Запах: Не определено
Порог запаха: Не определено.
Значение pH: Не применимо.
Изменение состояния
Точка плавления / интервал плавления: 321 ° C (610 ° F)
Точка кипения / интервал кипения: 765 ° C (1409 ° F)
Температура сублимации / начало: Не определено
Воспламеняемость (твердое, газообразное): Не определено.
Температура возгорания: Не определено.
Температура разложения: Не определено.
Самовоспламенение: Не определено.
Взрывоопасность: Не определено.
Пределы взрываемости:
Нижний: Не определено
Верхнее: Не определено
Давление пара при 180 ° C (356 ° F): 0.00013 гПа
Плотность при 20 ° C (68 ° F): 8,65 г / см³ (72,184 фунта / галлон)
Насыпная плотность при 20 ° C (68 ° F): 2700 кг / м³
Относительная плотность: Не определено.
Плотность пара: Не применимо.
Скорость испарения: Не применимо.
Растворимость в / Смешиваемость с водой: Не определено.
Коэффициент распределения (н-октанол / вода): Не определено.
Вязкость:
динамическая: Не применимо.
кинематика: Не применимо.
Другая информация
Отсутствует какая-либо соответствующая информация.
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Информация отсутствует.
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит при использовании и хранении в соответствии со спецификациями.
Возможность опасных реакций
Об опасных реакциях не известно
Условия, которых следует избегать
Отсутствует какая-либо соответствующая информация.
Несовместимые материалы:
Информация отсутствует.
Опасные продукты разложения:
Оксид кадмия
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Смертельно при вдыхании.
Реестр токсических эффектов химических веществ (RTECS) содержит данные об острой токсичности этого вещества.
Значения LD / LC50, имеющие отношение к классификации: Нет данных
Раздражение или разъедание кожи:
Порошок: раздражающее действие
Раздражение или разъедание глаз:
Порошок: раздражающее действие
Сенсибилизация: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевой клетки:
Предположительно вызывает генетические дефекты.
Реестр токсических эффектов химических веществ (RTECS) содержит данные о мутациях этого вещества.
Канцерогенность:
Может вызывать рак.
IARC-1: Канцерогенный для человека: достаточные доказательства канцерогенности.
EPA-B1: Вероятный канцероген для человека, эпидемиологические исследования ограничены доказательствами канцерогенности.
Канцероген согласно определению OSHA.
ACGIH A2: Предполагаемый канцероген для человека: Агент канцерогенен для экспериментальных животных при уровнях доз, путях введения, в месте (ах), гистологическом типе (ах) или механизмах, которые считаются относящимися к воздействию на рабочих .Доступные эпидемиологические исследования противоречивы или недостаточны для подтверждения повышенного риска рака у людей, подвергшихся воздействию.
NTP-K: Известно, что он канцерогенный: достаточно данных исследований на людях.
Реестр токсических эффектов химических веществ (RTECS) содержит данные о онкогенных, канцерогенных и / или опухолевых заболеваниях для этого вещества.
Репродуктивная токсичность:
Предположительно может нанести ущерб фертильности или нерожденному ребенку.
Реестр токсических эффектов химических веществ (RTECS) содержит репродуктивные данные для этого вещества.
Специфическая системная токсичность на органы-мишени – многократное воздействие:
Вызывает повреждение легких, почек, репродуктивной системы и крови в результате длительного или многократного воздействия. Путь воздействия: Устный.
Специфическая системная токсичность, поражающая отдельные органы-мишени – однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о токсичности при множественных дозах этого вещества.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не изучена.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Токсичность для водной среды: Отсутствует какая-либо соответствующая информация.
Стойкость и разлагаемость
Отсутствует какая-либо соответствующая информация.
Способность к биоаккумуляции
Отсутствует какая-либо соответствующая информация.
Подвижность в почве
Отсутствует какая-либо соответствующая информация.
Экотоксические эффекты:
Примечание:
Очень токсично для водных организмов
Дополнительная экологическая информация:
Общие примечания:
Не допускайте попадания материала в окружающую среду без соответствующих правительственных разрешений.
Не допускать попадания продукта в грунтовые воды, водоемы или канализацию, даже в небольших количествах.
Опасность для питьевой воды при попадании в землю даже очень небольшого количества.
Также ядовит для рыб и планктона в водоемах.
Может вызывать длительные вредные последствия для водных организмов.
Избегать попадания в окружающую среду.
Очень токсично для водных организмов
Результаты оценки PBT и vPvB
PBT: Неприменимо.
vPvB: Не применимо.
Другие побочные эффекты
Отсутствует какая-либо соответствующая информация
РАЗДЕЛ 13.СООБРАЖЕНИЯ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
Проконсультируйтесь с государственными, местными или национальными правилами, чтобы обеспечить надлежащую утилизацию.
Неочищенная тара:
Рекомендация:
Утилизация должна производиться в соответствии с официальными предписаниями.
РАЗДЕЛ 14. ТРАНСПОРТНАЯ ИНФОРМАЦИЯ
Номер ООН
DOT, ADN, IMDG, IATA
Неприменимо
Собственное транспортное наименование ООН
DOT, ADN, IMDG, IATA
Неприменимо
Класс (ы) опасности при транспортировке
DOT, ADR, ADN, IMDG, IATA
Класс
Неприменимо
Группа упаковки
DOT, IMDG, IATA
Неприменимо
Опасность для окружающей среды:
Экологически опасное вещество, твердое вещество
Особые меры предосторожности для пользователя
Неприменимо.
Транспортировка наливом в соответствии с Приложением II MARPOL73 / 78 и Кодексом IBC
Не применимо.
Транспорт / Дополнительная информация:
DOT
Морской загрязнитель (DOT):
№
Типовой регламент ООН:
–
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Нормы / законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к веществу или смеси
Национальные предписания
Все компоненты этого продукта перечислены в Реестре химических веществ в соответствии с Законом о контроле над токсичными веществами Агентства по охране окружающей среды США.
Все компоненты этого продукта занесены в Канадский список веществ, предназначенных для домашнего использования (DSL).
SARA Раздел 313 (списки конкретных токсичных химических веществ)
7440-43-9 Кадмий
Предложение 65 Калифорнии
Предложение 65 – Химические вещества, вызывающие рак
7440-43-9 Кадмий
Предложение 65 – Токсичность для развития
Вещество не указано.
Предложение 65 – Токсичность для развития, женщины
Вещество не указано.
Правило 65 – Токсичность для развития, мужчины
7440-43-9 Кадмий
Информация об ограничении использования:
Рабочие не могут подвергаться воздействию этого опасного материала.В определенных случаях власти могут делать исключения.
Для использования только технически квалифицированными специалистами.
Другие постановления, ограничения и запретительные постановления
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (EC) № 1907/2006.
Это вещество включено в Список потенциально опасных веществ (SVHC) в соответствии с Регламентом (ЕС) № 1907/2006 (REACH).
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещества нет в списке.
Приложение XIV Правил REACH (требуется разрешение на использование)
Вещество не указано.
REACH – Предварительно зарегистрированные вещества
Вещество внесено в список.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Вышеприведенная информация считается правильной, но не претендует на исчерпывающий характер и должна использоваться только в качестве руководства.Информация в этом документе основана на текущем уровне наших знаний и применима к продукту с учетом соответствующих мер безопасности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. На обратной стороне счета или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2016 AMERICAN ELEMENTS. ЛИЦЕНЗИОННЫМ ДАННЫМ РАЗРЕШЕНО ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННЫХ КОПИИ БУМАГИ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ
Что такое кадмий – Свойства элемента кадмия – Символ Cd
Что такое кадмий
Кадмий – это химический элемент с атомным номером 48 , что означает, что в атомной структуре 48 протонов и 48 электронов. Химический символ для кадмия – Cd .
Кадмий – мягкий голубовато-белый металл, химически похожий на два других стабильных металла группы 12, цинк и ртуть. В атомной промышленности кадмий обычно используется в качестве поглотителя тепловых нейтронов из-за очень высокого сечения поглощения нейтронов 113Cd.113Cd имеет удельное сечение поглощения.
Кадмий – Свойства
| Элемент | Кадмий |
|---|---|
| Атомный номер | 48 |
| Символ | Cd |
| Категория элемента | Переходный металл |
| Фаза в STP | цельный |
| Атомная масса [а.е.м.] | 112.411 |
| Плотность при стандартной температуре [г / см3] | 8.65 |
| Электронная конфигурация | [Kr] 4d10 5s2 |
| Возможные состояния окисления | +2 |
| Сродство к электрону [кДж / моль] | – |
| Электроотрицательность [шкала Полинга] | 1,69 |
| Энергия первой ионизации [эВ] | 8,9937 |
| Год открытия | 1817 |
| Первооткрыватель | Стромейер, проф.Фридрих |
| Тепловые свойства | |
| Точка плавления [шкала Цельсия] | 321,07 |
| Точка кипения [шкала Цельсия] | 767 |
| Теплопроводность [Вт / м · К] | 97 |
| Удельная теплоемкость [Дж / г К] | 0,23 |
| Теплота плавления [кДж / моль] | 6,192 |
| Теплота испарения [кДж / моль] | 99.57 |
См. Также: Свойства кадмия
Атомная масса кадмия
Атомная масса кадмия 112,411 ед.
Обратите внимание, что каждый элемент может содержать больше изотопов, поэтому эта результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их содержания.
Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 x 10 -24 граммов. Одна унифицированная атомная единица массы равна примерно массе одного нуклона (одного протона или нейтрона) и численно эквивалентна 1 г / моль.
Для 12 C атомная масса равна точно 12u, поскольку от нее определяется атомная единица массы. Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0,1 u от массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в его основном ядерном состоянии равна 62, ед.
Существует две причины разницы между массовым числом и изотопной массой, известной как дефект массы:
- Нейтрон на немного тяжелее , чем протон .Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы атомных единиц массы, основанной на 12 C с равным количеством протонов и нейтронов.
- Энергия связи ядра варьируется от ядра к ядру. Ядро с большей энергией связи имеет более низкую полную энергию и, следовательно, на более низкую массу в соответствии с соотношением эквивалентности массы и энергии Эйнштейна E = mc 2 . Для 63 Cu атомная масса меньше 63, поэтому это должен быть доминирующий фактор.
См. Также: Массовое число
Плотность кадмия
Плотность кадмия 8,65 г / см 3 .
Типичные плотности различных веществ при атмосферном давлении.
Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, разделенная на объем:
ρ = м / В
Проще говоря, плотность (ρ) вещества – это общая масса (m) этого вещества, деленная на общий объем (V), занимаемый этим веществом.Стандартная единица СИ составляет килограмма на кубический метр ( кг / м 3 ). Стандартная английская единица – фунта массы на кубический фут ( фунта / фут 3 ).
См. Также: Что такое плотность
См. Также: Самые плотные материалы Земли
Сродство к электрону и электроотрицательность кадмия
Электронное сродство кадмия составляет – кДж / моль .
Электроотрицательность кадмия 1.69 .
Сродство к электрону
В химии и атомной физике сродство к электрону атома или молекулы определяется как:
изменение энергии (в кДж / моль) нейтрального атома или молекулы (в газовой фазе), когда электрон присоединяется к атому с образованием отрицательного иона .
X + e – → X – + сродство энергии = – ∆H
Другими словами, это может быть выражено как вероятность нейтрального атома получить электрон .Обратите внимание, что энергии ионизации измеряют склонность нейтрального атома сопротивляться потере электронов. Сродство к электрону измерить труднее, чем энергии ионизации.
Атом кадмия в газовой фазе, например, выделяет энергию, когда он получает электрон с образованием иона кадмия.
Cd + e – → Cd – – ∆H = Сродство = – кДж / моль
Чтобы правильно использовать сродство к электрону, важно отслеживать знак. Когда электрон присоединяется к нейтральному атому, выделяется энергия.Это сродство известно как сродство к первому электрону, и эти энергии отрицательны. По условию отрицательный знак означает выделение энергии. Однако для добавления электрона к отрицательному иону требуется больше энергии, что подавляет любое выделение энергии в процессе присоединения электрона. Это сродство известно как сродство ко второму электрону, и эти энергии положительны.
Сродство неметаллов и сродство металлов
- Металлы: Металлы любят терять валентные электроны с образованием катионов, чтобы иметь полностью стабильную оболочку.Электронное сродство металлов ниже, чем у неметаллов. Меркурий наиболее слабо притягивает лишний электрон.
- Неметаллы: Обычно неметаллы имеют более положительное сродство к электрону, чем металлы. Неметаллы любят получать электроны, чтобы образовывать анионы, чтобы иметь полностью стабильную электронную оболочку. Хлор сильнее всего притягивает лишние электроны. Сродство к электрону благородных газов не было окончательно измерено, поэтому они могут иметь или не иметь слегка отрицательные значения.
Электроотрицательность
Электроотрицательность , символ χ, представляет собой химическое свойство, которое описывает тенденцию атома притягивать электроны к этому атому.Для этих целей чаще всего используется безразмерная величина , шкала Полинга , символ χ.
Электроотрицательность кадмия:
χ = 1,69
В общем, на электроотрицательность атома влияет как его атомный номер, так и расстояние, на котором его валентные электроны находятся от заряженного ядра. Чем выше соответствующее число электроотрицательности, тем больше элемент или соединение притягивает к себе электронов.
Самому электроотрицательному атому, фтору, присваивается значение 4.0, а значения варьируются до цезия и франция, которые являются наименее электроотрицательными при 0,7.
Первая энергия ионизации кадмия
Первая энергия ионизации кадмия 8,9937 эВ .
Энергия ионизации , также называемая потенциалом ионизации , – это энергия, необходимая для удаления электрона из нейтрального атома.
X + энергия → X + + e –
, где X – это любой атом или молекула, способная к ионизации, X + – это атом или молекула с удаленным электроном (положительный ион), а e – – удаленный электрон.
Атому кадмия, например, требуется следующая энергия ионизации для удаления самого удаленного электрона.
Cd + IE → Cd + + e – IE = 8,9937 эВ
Чаще всего используется энергия ионизации, связанная с удалением первого электрона. Энергия ионизации n -я относится к количеству энергии, необходимому для удаления электрона из частиц с зарядом ( n -1).
1-я энергия ионизации
X → X + + е –
2-я энергия ионизации
X + → X 2+ + e –
3-я энергия ионизации
X 2+ → X 3+ + e –
Энергия ионизации различных элементов
Есть энергия ионизации для каждого следующего удаляемого электрона.Электроны, вращающиеся вокруг ядра, движутся по довольно четко определенным орбитам. Некоторые из этих электронов более прочно связаны в атоме, чем другие. Например, всего 7,38 эВ требуется для удаления самого внешнего электрона из атома свинца, в то время как 88000 эВ требуется для удаления самого внутреннего электрона. Помогает понять реакционную способность элементов (особенно металлов, которые теряют электроны).
В общем, энергия ионизации увеличивается при движении вверх по группе и перемещении слева направо через период.Более того:
- Энергия ионизации самая низкая для щелочных металлов, которые имеют единственный электрон вне замкнутой оболочки.
- Энергия ионизации увеличивается в ряд на периодическом максимуме для благородных газов, имеющих закрытые оболочки.
Например, для ионизации натрия требуется всего 496 кДж / моль или 5,14 эВ / атом. С другой стороны, неон, благородный газ, непосредственно предшествующий ему в периодической таблице, требует 2081 кДж / моль или 21,56 эВ / атом.
Кадмий – точка плавления и точка кипения
Температура плавления кадмия 321,07 ° C .
Температура кипения кадмия 767 ° C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Точка кипения – насыщение
В термодинамике термин насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданных температуре и давлении.Температура, при которой начинает происходить испарение (кипение) для данного давления, называется температурой насыщения или точкой кипения . Давление, при котором начинается испарение (кипение) для данной температуры, называется давлением насыщения. Если рассматривать температуру обратного перехода от пара к жидкости, ее называют точкой конденсации.
Точка плавления – насыщение
В термодинамике точка плавления определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии.Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда рассматривается как температура обратного перехода от жидкости к твердому телу, она упоминается как точка замерзания или точка кристаллизации.
Кадмий – удельная теплоемкость, скрытая теплота плавления, скрытая теплота испарения
Удельная теплоемкость кадмия 0,23 Дж / г K .
Скрытая теплота плавления кадмия составляет 6,192 кДж / моль .
Скрытая теплота испарения кадмия составляет 99,57 кДж / моль .
Удельная теплоемкость
Удельная теплоемкость, или удельная теплоемкость, – это свойство, связанное с внутренней энергией , которое очень важно в термодинамике. Интенсивные свойства c v и c p определены для чистых простых сжимаемых веществ как частные производные внутренней энергии u (T, v) и энтальпии ч. (Т, п) , соответственно:
, где индексы v и p обозначают переменные, фиксированные во время дифференцирования.Свойства c v и c p упоминаются как удельная теплоемкость (или теплоемкости ), потому что при определенных особых условиях они связывают изменение температуры системы с количеством энергии, добавляемой за счет теплопередача. Их единицы СИ: Дж / кг K или Дж / моль K .
На различные вещества влияет разной величины за счет добавленного тепла .Когда к разным веществам добавляется определенное количество тепла, их температура увеличивается на разную величину.
Теплоемкость – это обширное свойство материи, что означает, что она пропорциональна размеру системы. Теплоемкость C выражается в единицах энергии на градус или энергии на кельвин. При выражении того же явления, что и интенсивное свойство, теплоемкость делится на количество вещества, массы или объема, таким образом, количество не зависит от размера или протяженности образца.
Скрытая теплота испарения
Обычно, когда материал меняет фазу с твердой на жидкую или с жидкости на газ, в это изменение фазы вовлекается определенное количество энергии. В случае перехода жидкости в газовую фазу это количество энергии известно как энтальпия испарения (обозначение ∆H vap ; единица: Дж), также известная как (скрытая) теплота испарения или теплота испарение.В качестве примера посмотрите рисунок, на котором изображены фазовые переходы воды.
Скрытая теплота – это количество тепла, добавляемого к веществу или отводимого от него для изменения фазы. Эта энергия разрушает межмолекулярные силы притяжения, а также должна обеспечивать энергию, необходимую для расширения газа ( pΔV работа ). При добавлении скрытого тепла изменение температуры не происходит. Энтальпия парообразования является функцией давления, при котором происходит это преобразование.
Скрытая теплота плавления
В случае перехода твердой фазы в жидкую, изменение энтальпии, необходимое для изменения ее состояния, известно как энтальпия плавления (обозначение ∆H fus ; единица: Дж), также известная как (скрытая) теплота плавления. .Скрытая теплота – это количество тепла, добавляемого к веществу или отводимого от него для изменения фазы. Эта энергия разрушает межмолекулярные силы притяжения, а также должна обеспечивать энергию, необходимую для расширения системы ( pΔV работа ).
