Таблица менделеева – Электронный учебник K-tree
Электронный учебник
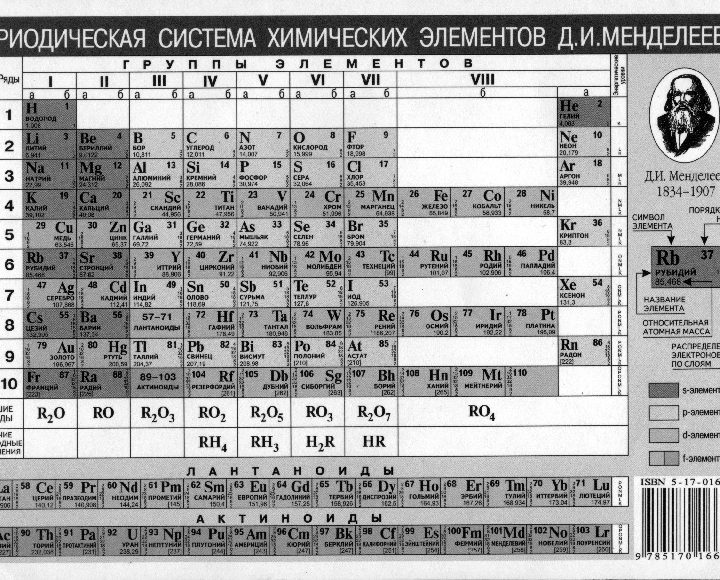
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Церий
|
Церий |
|
|---|---|
| Атомный номер |
58 |
| Внешний вид простого вещества |
ковкий, вязкий металл |
| Свойства атома | |
|
Атомная масса (молярная масса) |
140,115 а. |
| Радиус атома | 181 пм |
|
Энергия ионизации (первый электрон) |
540,1 (5,60) кДж/моль (эВ) |
| Электронная конфигурация | [Xe]4f15d16s2 |
| Химические свойства | |
| Ковалентный радиус | 165 пм |
| Радиус иона | (+4e) 92 103.(+3e) 4 пм |
|
Электроотрицательность (по Полингу) |
1,12 |
| Электродный потенциал | Ce←Ce3+ −2,34 В |
| Степени окисления | 4, 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 6,757 г/см³ |
| Молярная теплоёмкость | 26,94 Дж/(K·моль) |
| Теплопроводность | 11,3 Вт/(м·K) |
| Температура плавления | 1072 K |
| Теплота плавления | 5,2 кДж/моль |
| Температура кипения | 3699 K |
| Теплота испарения | 398 кДж/моль |
| Молярный объём | 21,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированая |
| Параметры решётки | 5,160 Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| Ce | 58 |
| 140,115 | |
|
[Xe]4f15d16s |
|
| Церий | |
Церий — химический элемент из группы лантаноидов, серебристый металл.
История
Назван в честь самой большой из малых планет, Цереры (Ceres), открытой 1 января 1801 года итальянским астрономом Джузеппе Пьяцци. Длительное время Церера рассматривалась как планета Солнечной системы, впоследствии была классифицирована как астероид, а 24 августа 2006 года XXVI Генеральной Ассамблеей Международного астрономического союза была отнесена к карликовым планетам.
Немецкий химик М. Г. Клапрот, открывший цериевую землю почти одновременно со своими шведскими коллегами — В. Хизингером и Й. Я. Берцелиусом, возражал против названия «церий», предлагая «церерий». Берцелиус, однако, отстоял свое название, ссылаясь на трудности произношения того имени, которое предлагал новому элементу Клапрот.
Получение
Получают электролизом расплава фторида церия CeF3.
Цены
Цены на церий чистотой 99-99,9 составляют около 1-2 долл за 1 кг, в связи с тем, что себестоимость добычи данного элемента низка и он весьма распространен в ряду редкоземельных металлов.
Физические свойства
Серебристо-белый металл. Плотность 6,77 г/дм3. Температура плавления 804 С. Температура кипения 3260 С.
Химические свойства
Редкоземельный металл, неустойчив на воздухе, постепенно окисляется, превращаясь в белый оксид.
Применение
Металлургия
В современной технике широко используют способность церия (как и других лантаноидов) модифицировать сплавы на основе железа, магния, добавления 1 % церия к магнию резко увеличивает прочность последнего на разрыв и сопротивление ползучести.
Церий повышает электропроводность алюминия, меди, ниобия, титана.
Легирование конструкционных сталей церием значительно повышает их прочность. Здесь действие церия в целом аналогично действию лантана. Но, поскольку церий и его соединения дешевле и доступнее, чем лантан, значение церия как легирующей добавки больше, нежели лантана.
Легирование церием алюминия резко увеличивает его прочность и электропроводность (на несколько процентов).
Стоит отметить то обстоятельство что церий с рядом металлов при сплавлении реагирует весьма бурно с образованием интерметаллидов. Так, весьма характерна для церия бурная реакция с цинком при сплавлении или при локальном нагревании смеси порошка церия с порошком цинка. Эта реакция протекает в форме мощного взрыва, поэтому весьма опасно прибавление кусочка церия к расплавленному цинку — происходит яркая вспышка и сильный взрыв.
Катализаторы
В химической и нефтяной промышленности диоксид церия СеО2 (т. пл. 2600 °C) используют как катализатор. В частности, CeO2 хорошо ускоряет практически важную реакцию между водородом и окисью углерода. Так же хорошо и надёжно работает двуокись церия в аппаратах, где происходит дегидрогенизация спиртов. Другое соединение церия — его сульфат Ce(SO4)SUB>2 — считают перспективным катализатором для сернокислого производства. Он намного ускоряет реакцию окисления сернистого ангидрида в серный.
Термоэлектрические материалы
Сульфид церия применяется в качестве высокотемпературного термоэлектрического материала с высокой эффективностью, для увеличения эффективности обычно легируется сульфидом стронция.
Производство стекла
В атомной технике широко применяют церий-содержащие стекла — они не тускнеют под действием радиации, позволяя изготавливать толстые стёкла для защиты персонала.
Двуокись церия церит входит в состав специальных стёкол как осветлитель и иногда как светло-жёлтый краситель.
Абразивные материалы
То же вещество — основной компонент полирита, самого эффективного порошка для полировки оптического и зеркального стекла. Полирит — коричневый порошок, состоящий из окислов редкоземельных элементов. Окиси церия в нем не меньше 45 %. Известно, что с переходом на полирит качество полировки значительно улучшилось. На харьковском заводе имени Ф. Э. Дзержинского, например, выход первосортного зеркального стекла после перехода на полирит увеличился в 10 раз. Выросла и производительность конвейера — за то же время полирит снимает примерно вдвое больше материала, чем другие полирующие порошки.
Выросла и производительность конвейера — за то же время полирит снимает примерно вдвое больше материала, чем другие полирующие порошки.
Пирофорные сплавы
Сплав церия с 50 % железа (ферроцерий), а иногда и мишметалл используется как искусственный «кремень» в зажигалках.
Источники света
Трифторид церия используется в качестве добавки при изготовлении углей для дуговых источников света, его добавление к материалу углей резко повышает яркость свечения.
Оксид церия совместно с двуокисью титана используется для варки цветных стекол, окрашенных от светло-жёлтого до оранжевого оттенка.
Огнеупорные материалы
В качестве чрезвычайно стойких огнеупорных материалов используют двуокись церия(до 2300 °C в окислительной и инертной атмосфере), сульфид церия (до 1800 °C в восстановительной атмосфере).
Церий в медицине
Соли церия применяются для лечения и предотвращения симптомов «морской болезни». В стоматологии используется цериевая сталь и керамика с содержанием двуокиси церия.
В стоматологии используется цериевая сталь и керамика с содержанием двуокиси церия.
Топливные элементы
Диоксид церия применяется в качестве компонента для производства твёрдого электролита высокотемпературных топливных элементов.
Химические источники тока
Трёхфтористый церий в сплаве с фторидом стронция используется для производства очень мощных твердотельных аккумуляторных батарей. Анодом в таких батареях является чистый металлический церий.
Изотопы
Природный церий состоит из смеси четырёх стабильных изотопов: 136Ce (0,185%), 138Ce (0,251%), 140Ce (88,450%) и 142Ce (11,114%). Два из них (136Ce и 142Ce) в принципе могут испытывать двойной бета-распад, однако их радиоактивность не наблюдалась, установлены лишь нижние ограничения на периоды полураспада (3,8×1016 лет и 5,0×1016 лет, соответственно). Известны также 26 радионуклидов церия. Из них наиболее стабильны 144Ce (период полураспада 284,893 д), 139Ce (137,640 д) и 141Ce (32,501 д). Остальные известные радионуклиды церия имеют периоды полураспада менее 4 дней, а большинство из них — менее 10 минут. Известны также 2 изомерных состояния изотопов церия.
Из них наиболее стабильны 144Ce (период полураспада 284,893 д), 139Ce (137,640 д) и 141Ce (32,501 д). Остальные известные радионуклиды церия имеют периоды полураспада менее 4 дней, а большинство из них — менее 10 минут. Известны также 2 изомерных состояния изотопов церия.
Церий-144 (период полураспада 285 суток) является одним из продуктов деления урана-235, в связи с чем нарабатывается в больших количествах в ядерных реакторах. Применяется в виде двуокиси (плотность около 6,4 г/см³) в производстве радиоизотопных источников тока в качестве источника тепла, его энерговыделение составляет около 12,5 Вт/см³.
Биологическая роль
Токсичность
Оказывает токсическое действие на рыб и низшие водные организмы. Обладает способностью к биоаккумуляции. Рекомендованные ВОЗ ПДК церия для питевой воды составляют 0-0,05 мг/л.
Cerium (Ce) – Chemical properties, Health and Environmental effects
- Home
- Periodic table
- Elements
- Cerium
| |||||||||||||||||||||||||||||||||
ЦерийЦерий — ковкий, мягкий, пластичный металл серого цвета, немного тверже свинца. Он очень реакционноспособен: легко тускнеет на воздухе, медленно окисляется в холодной воде и быстро в горячей воде. Он растворяется в кислотах. Он может обжечься при нагревании или поцарапании ножом. Области применения Металл используется в качестве сердцевины для угольных электродов дуговых ламп, для ламп накаливания для газового освещения. Церий в окружающей среде Церий является наиболее распространенным из редкоземельных элементов. Он составляет около 0,0046 % земной коры по массе. Церий поступает в основном из основных лантаноидных руд, но часть его получают из перовскита, минерала титана и алланита, оба из которых могут содержать достаточно церия, чтобы сделать их жизнеспособными источниками. Производство составляет 23 000 тонн в год, но этот объем, вероятно, будет увеличиваться, поскольку в настоящее время используется все больше и больше церия.
Назад к периодическим элементам диаграммы . | |||||||||||||||||||||||||||||||||
More from ‘Elements’
Actinium
Silver
Aluminum
Americium
Argon
Arsenic
Astatine
Gold
Boron
Barium
Beryllium
Bohrium
Висмут
Берклий
Бром
Carbon
Calcium
Cadmium
Californium
Chlorine
Curium
Cobalt
Chromium
Cesium
Copper
Dubnium
Darmstadtium
Dysprosium
Erbium
Einsteinium
Europium
Fluorine
Железо
Фермий
Франций
Галлий
Гадолиний
Германий
Hydrogen
Helium
Hafnium
Mercury
Holmium
Hassium
Iodine
Indium
Iridium
Potassium
Krypton
Lanthanum
Lithium
Lawrencium
Lutetium
Mendelevium
Магний
Марганец
Молибден
Мейтнерий
Азот
Натрий
Niobium
Neodymium
Neon
Nickel
Nobelium
Neptunium
Oxygen
Osmium
Phosphorus
Protactinium
Lead
Palladium
Promethium
Polonium
Praseodymium
Platinum
Plutonium
Радий
Рубидий
Рений
Резерфордий
Рентгений
Rhodium
Radon
Ruthenium
Sulfur
Antimony
Scandium
Selenium
Seaborgium
Silicon
Samarium
Tin
Strontium
Tantalum
Terbium
Technetium
Tellurium
Thorium
Ce Информация об элементе церия: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура церия
Твердотельная структура церия Простая гексагональная .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | B | C |
|---|---|---|
| 362 PM | 362 PM | 599 PM |
и Angles между ними Lattice (Alpha).
| alpha | beta | gamma |
|---|---|---|
| π/2 | π/2 | 2 π/3 |
The positions of the atoms inside the unit cell are described by the набор атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если киральные копии считаются различными).
Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если киральные копии считаются различными).
Атомные атомные и орбитальные свойства. 9, 2] с символом атомного термина (квантовые числа)
1 G 4 .| Атомный номер | 58 |
| Количество электронов (без заряда) | 58 |
| Number of Protons | 58 |
| Mass Number | 140 |
| Number of Neutrons | 82 |
| Shell structure (Electrons per energy level) | 2, 8, 18, 19, 9, 2 |
| Электронная конфигурация | [xe] 4F1 5D1 6S2 |
| Валентные электроны | 4F1 5D1 6S2 |
| (Валентность) | 2 |
| (валентность) | 2 |
| (валентность) | |
| (валентность) | |
| (валентность) | |
| (валентность) | |
. 0014 4 0014 4 | |
| Main Oxidation States | 3, 4 |
| Oxidation States | 2, 3, 4 |
| Atomic Term Symbol (Quantum Numbers) | 1 G 4 |
Модель атома церия по Бору – количество электронов на энергетический уровень
Электронная конфигурация церия в основном состоянии – нейтральный атом церия
Сокращенная электронная конфигурация церия
Сокращенная электронная конфигурация основного состояния нейтрального атома церия: [Xe] 4f1 5d1 6s2. Часть конфигурации церия, эквивалентная благородному газу предшествующего периода, обозначается аббревиатурой [Xe]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4f1 5d1 6s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального церия
Полная электронная конфигурация атома церия в основном состоянии. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f1 5d1 6s2 Принцип исключения и правило Хунда.
Атомная структура церия
Атомный радиус церия составляет 185 пм, а его ковалентный радиус – .
| Расчетный атомный радиус | 185 пм (1,85 Å) |
| Atomic Radius Empirical | 185 pm (1. |
| Atomic Volume | 20.947 cm3/mol |
| Covalent Radius | – |
| Van der Waals Radius | – |
| Нейтронное сечение | 0,6 |
| Массовое поглощение нейтронов | 0,00021 |
Атомный спектр цетра0018
Химические свойства церия: Энергия ионизации церия и сродство к электрону
Сродство к электрону церия составляет 50 кДж/моль.
| Valence | 4 |
| Electronegativity | 1.12 |
| ElectronAffinity | 50 kJ/mol |
Ionization Energy of Cerium
Refer to table below for Ionization energies of Cerium
| Ionization energy number | Enthalpy – kJ/mol |
|---|---|
| 1st | 534.4 |
| 2nd | 1050 |
| 3rd | 1949 |
| 4th | 3547 |
| 5th | 6325 |
| 6th | 7490 |
Физические свойства церия
Физические свойства церия см. в таблице ниже
в таблице ниже
| Density | 6.689 g/cm3(when liquid at m.p density is $6.55 g/cm3) |
| Molar Volume | 20.947 cm3/mol |
Elastic Properties
| Young Modulus | 34 | ||||||||||||||||||||||||||||||
| Модуль сдвига | 14 GPA | ||||||||||||||||||||||||||||||
| Модуль объема | 22 GPA | ||||||||||||||||||||||||||||||
.0794 Hardness of Cerium – Tests to Measure of Hardness of Element
Cerium Electrical СвойстваЦерий является проводником электричества. Электрические свойства церия
Cerium Heat and Conduction Properties
Церий Магнитные свойства
Оптические свойства церия
Акустические свойства церия5
Термические свойства – энтузиазм и термодинамика. | |||||||||||||||||||||||||||||||
| Boiling Point | 3633 K (3359.85°C, 6079.73 °F) | ||||||||||||||||||||||||||||||
| Critical Temperature | – | ||||||||||||||||||||||||||||||
| Superconducting Point | 0.022 |
Enthalpies of Cerium
| Heat of Fusion | 5.5 kJ/mol |
| Heat of Vaporization | 350 kJ/mol |
| Heat of Combustion | – |
Изотопы церия. Ядерные свойства церия
Церий состоит из 39 изотопов, содержащих от 119 до 157 нуклонов. Церий имеет 4 стабильных природных изотопа.
Изотопы церия – Встречающиеся в природе стабильные изотопы: 136Ce, 138Ce, 140Ce, 142Ce.
| Isotope | Z | N | Isotope Mass | % Abundance | T half | Decay Mode | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 119Ce | 58 | 61 | 119 | Synthetic | ||||||||
| 120Ce | 58 | 62 | 120 | Синтетика | ||||||||
| 121Ce | 58 | 63 | 121 | Synthetic | ||||||||
| 122Ce | 58 | 64 | 122 | Synthetic | ||||||||
| 123Ce | 58 | 65 | 123 | Синтетический | ||||||||
| 124CE | 58 | 66 | 124 | Синтетик | ||||||||
| 125514 125CE | ||||||||||||
| 125514 125CE | ||||||||||||
| 125514 1255 | ||||||||||||
| 12514 1255 | ||||||||||||
| 12514 1255 | 58 | 67 | 125 | Synthetic | ||||||||
| 126Ce | 58 | 68 | 126 | Synthetic | ||||||||
| 127Ce | 58 | 69 | 127 | Synthetic | ||||||||
| 128ce | 58 | 70 | 128 | Синтетик | ||||||||
| 129CE | 58 | |||||||||||
| 129CE | 58 | |||||||||||
| 129CE | 58 | 129CE | 58 | .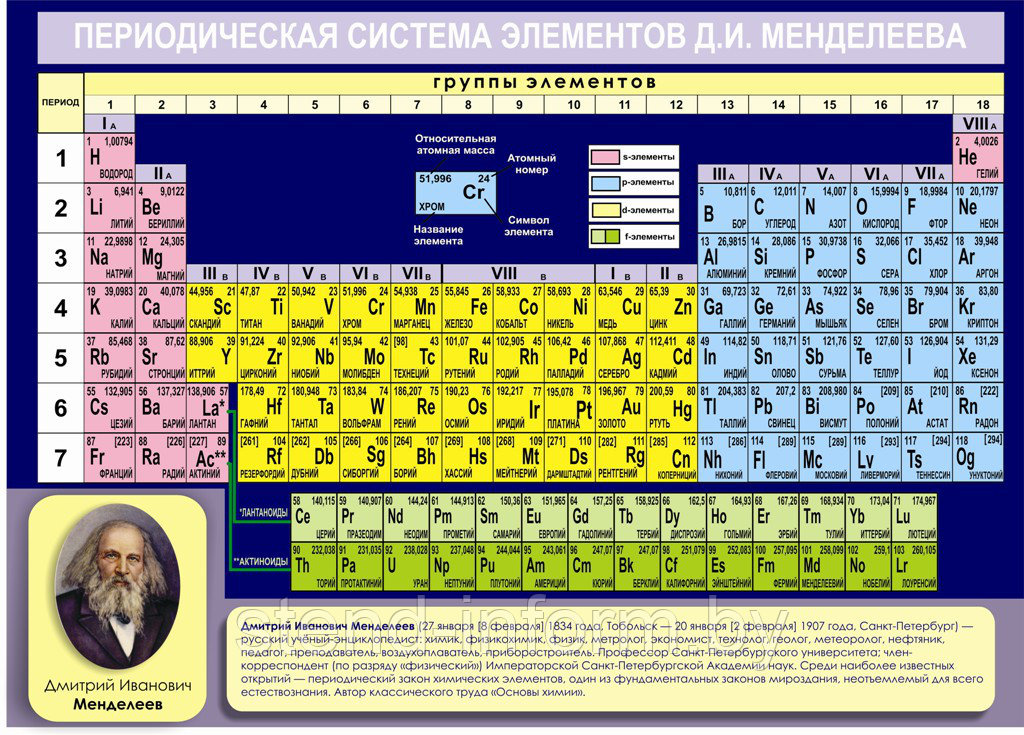 0022 0022 | 129 | Synthetic | ||||||
| 130Ce | 58 | 72 | 130 | Synthetic | ||||||||
| 131Ce | 58 | 73 | 131 | Synthetic | ||||||||
| 132Ce | 58 | 74 | 132 | Synthetic | ||||||||
| 133Ce | 58 | 75 | 133 | Synthetic | ||||||||
| 134Ce | 58 | 76 | 134 | Synthetic | ||||||||
| 135Ce | 58 | 77 | 135 | Synthetic | ||||||||
| 136Ce | 58 | 78 | 136 | 0,185% | Стабильная | N/A | ||||||
| 137CE | 58 | 137 | 22 | 137 | 14 2922 | 1120 | ||||||
| 138Ce | 58 | 80 | 138 | 0.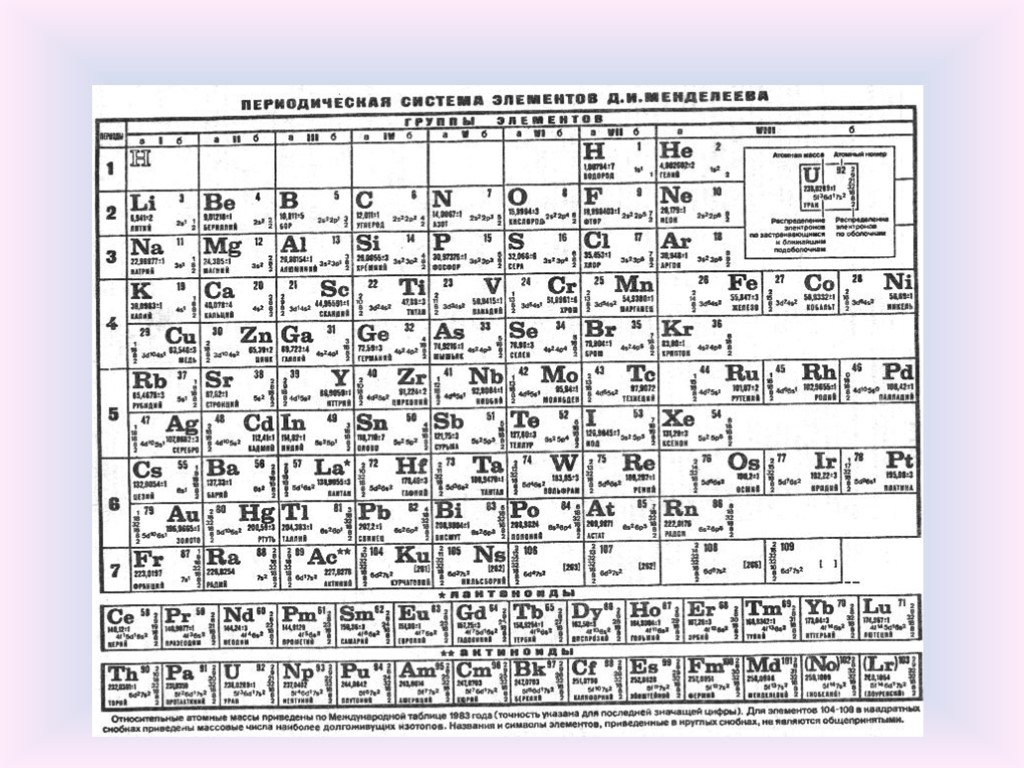 251% 251% | Stable | N/A | ||||||
| 139Ce | 58 | 81 | 139 | Synthetic | ||||||||
| 140Ce | 58 | 82 | 140 | 88.45% | Stable | |||||||
| 141Ce | 58 | 83 | 141 | Synthetic | ||||||||
| 142Ce | 58 | 84 | 142 | 11.114% | Stable | N/A | ||||||
| 143Ce | 58 | 85 | 143 | Synthetic | ||||||||
| 144Ce | 58 | 86 | 144 | Synthetic | ||||||||
| 145Ce | 58 | 87 | 145 | Synthetic | ||||||||
| 146Ce | 58 | 88 | 146 | Synthetic | ||||||||
| 147Ce | 58 | 89 | 147 | Synthetic | ||||||||
| 148Ce | 58 | 90 | 148 | Synthetic | ||||||||
| 149Ce | 58 | 91 | 149 | Synthetic | ||||||||
| 150Ce | 58 | 92 | 150 | Synthetic | ||||||||
| 151Ce | 58 | 93 | 151 | Synthetic | ||||||||
| 152Ce | 58 | 94 | 152 | Synthetic | ||||||||
| 153CE | 58 | 95 | 153 | Синтетик | ||||||||
| 154CE | 58 | |||||||||||
| 154CE | 58 | 154CE | 58 | . |

 е. м. (г/моль)
е. м. (г/моль) моль -1
моль -1  mol -1
mol -1  Церий используется в алюминиевых и железных сплавах, в нержавеющей стали в качестве дисперсионного твердения, для изготовления постоянных магнитов. Оксид церия входит в состав катализатора каталитических нейтрализаторов, используемых для очистки выхлопных газов автомобилей, а также катализирует восстановление оксидов азота (NO x ) до газообразного азота. Все новые автомобили теперь оснащены каталитическим преобразователем, состоящим из керамической или металлической подложки, покрытия из оксидов алюминия и церия и слоя мелкодисперсного металла, такого как платина или родий, который является активной поверхностью.
Церий используется в алюминиевых и железных сплавах, в нержавеющей стали в качестве дисперсионного твердения, для изготовления постоянных магнитов. Оксид церия входит в состав катализатора каталитических нейтрализаторов, используемых для очистки выхлопных газов автомобилей, а также катализирует восстановление оксидов азота (NO x ) до газообразного азота. Все новые автомобили теперь оснащены каталитическим преобразователем, состоящим из керамической или металлической подложки, покрытия из оксидов алюминия и церия и слоя мелкодисперсного металла, такого как платина или родий, который является активной поверхностью.  Использование церия все еще растет из-за того, что он подходит для производства катализаторов и полировки стекла.
Использование церия все еще растет из-за того, что он подходит для производства катализаторов и полировки стекла. Это может вызвать легочную эмболию, особенно при длительном воздействии. Церий может представлять угрозу для печени, когда он накапливается в организме человека.
Это может вызвать легочную эмболию, особенно при длительном воздействии. Церий может представлять угрозу для печени, когда он накапливается в организме человека.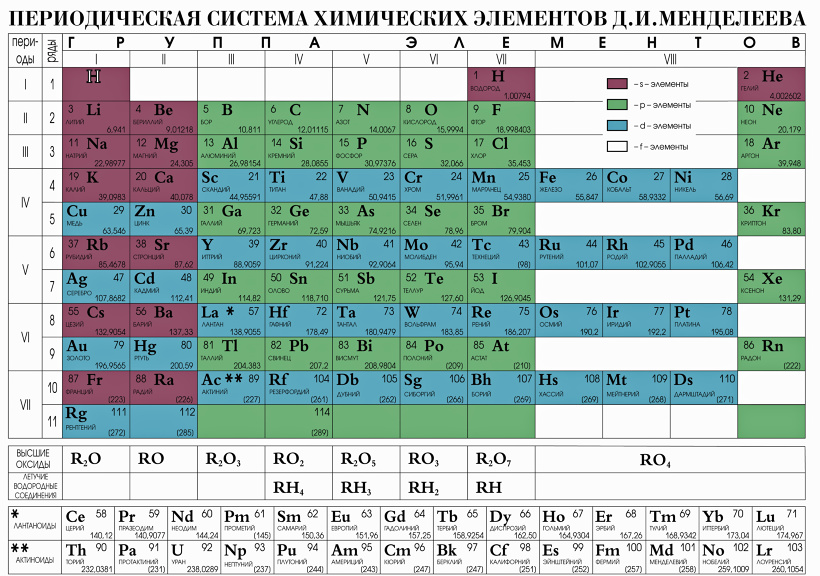 Дизельные двигатели выбрасывают твердые частицы, частицы углерода диаметром всего несколько микрометров. Один из способов уменьшить выбросы твердых частиц — улавливать их в керамическом фильтре, а затем сжигать. Если к самому топливу добавить немного оксида церия, он будет катализировать горение частиц и устранять их.
Дизельные двигатели выбрасывают твердые частицы, частицы углерода диаметром всего несколько микрометров. Один из способов уменьшить выбросы твердых частиц — улавливать их в керамическом фильтре, а затем сжигать. Если к самому топливу добавить немного оксида церия, он будет катализировать горение частиц и устранять их.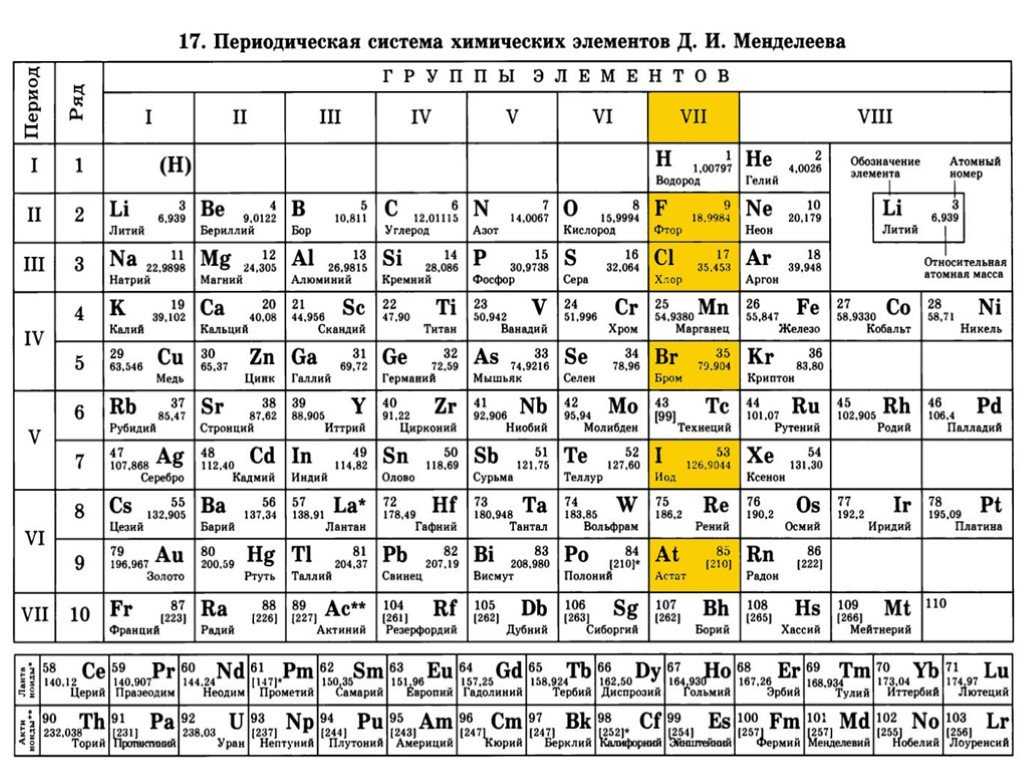 85 Å)
85 Å) 4e-7 m Ω
4e-7 m Ω См. Таблицу ниже для термои. °C, 1468.13 °F)
См. Таблицу ниже для термои. °C, 1468.13 °F)