Углеводороды (таблица) реферат по химии
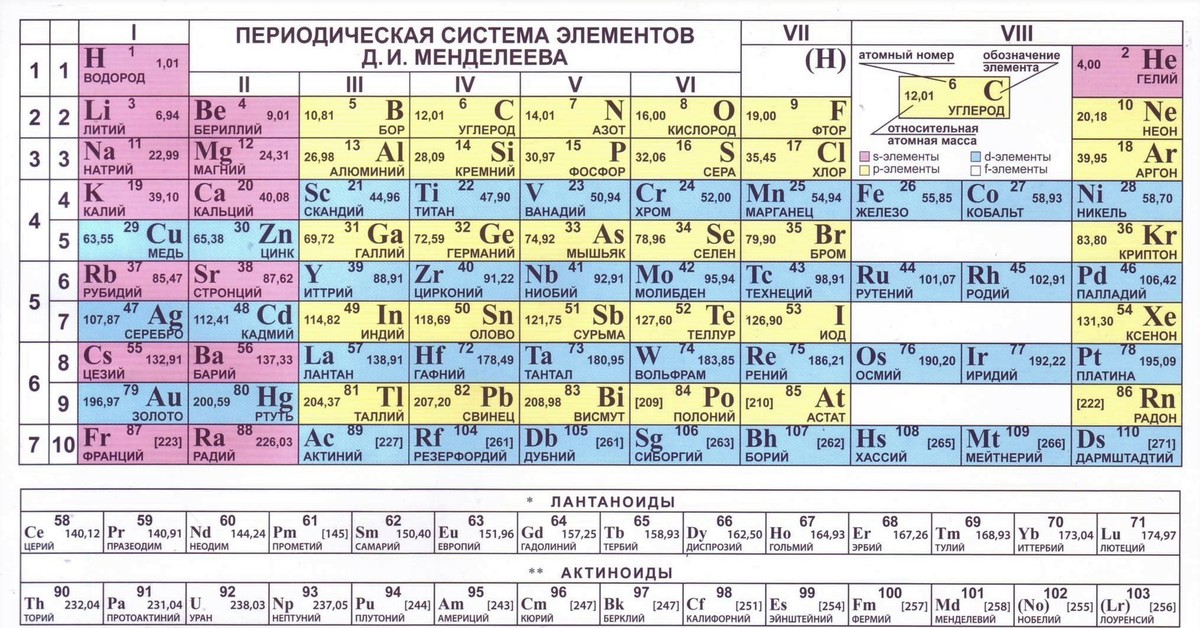
Предельные углеводороды . Непредельные углеводороды . Ароматические или Арены Алканы Циклоалканы Алкены Диеновые Алкины 1.Общая формула Cnh3n Ch5-МЕТАН С6Н12-ГКСАН С10Н22-ДЕКАН Cnh3n С6Н12-ЦИКЛОГЕКСАН С3Н6-ЦИКЛОПРОПАН С4Н8-ЦИКЛОБУТАН Cnh3n С2Н4-ЭТЕН С6Н12-ГЕКСЕН С4Н8-БУТЕН Cnh3N-2 С3Н8-ПЕНТАДИЕН С3Н4-ПРОПАДИЕН С6Н10-ГЕКСАДИЕН Cnh3N-2 С3Н4-ПРОПИН С4Н6-БУТИН С7Н12-ГЕПТИН Cnh3n-6 С6Н6-БЕНЗОЛ С7Н8-ТУЛУОЛ С8Н10-КСИЛОЛ 2.Строение А) тип гибридизации sp 3 -гибридизация sp3 -гибридизация sp2-гибридизация sp-гибридизация sp-гибридизация sp2-гибридизация Б) угол связи ∟ 109*28′ ∟ 60*, 90*, 100*, 120* ∟120* ∟ 120* ∟ 180* ∟ 120* В) длина связи (нм) 0,154 0,154 0,134 0,134 0,12 0,142 Г) форма молекулы тетраэдр стремится к тетраэдру плоская плоская линейная плоская Д) структурная формула H H C H (МЕТАН) H CH 2 Ch3———Ch3 (ЦИКЛОПРОПАН) Н H C=C H H (ЭТЕН) Ch3=C=Ch3 (ПРОПАДИЕН 1,2) HC≡CH (ЭТИН) CH CH (БЕНЗОЛ) HC HC CH CH 3.Изомерия 1.Структурная По положению заместителя в ядре ! А) строение углеродного скелета 1) h4C-Ch3-Ch3-CH 3 (Бутан) 2)h4C-CH-Ch4 Ch4 (2метил пропан) 1) Ch3-CH-Ch4 Ch3-Ch3 (метил бутан) 1) Ch3=CH-Ch3-Ch4 (бутен 1) 2) CH 2=C-Ch4 Ch4 (метилпрорен 1) 1)Ch3=C=CH-Ch3-Ch4 (пентадиен 1,2) 2)Ch3=C=C-Ch4 Ch4 (2метилБутадиен1,2) 1)CH≡C-Ch3-Ch3-CH 3 (пентин 1) 2)CH≡C-CH-Ch4 Ch4 (2метилбутин1) 1) Ch4 Ch4 -ортоксилол 2) Ch4 Ch4 -Мметаксилол 3) CH 3 -ПАРАКСИЛОЛ Ch4 Б) по положению двойной (тройной) связи Ch3=CH-Ch3-CH 3 (бутен 1) Ch4-CH=CH-Ch4 (бутен2) 1)Ch3=C=CH-Ch3-Ch4 (пентадиен 1,2) 2)Ch4=CH-CH=CH-Ch4 (пентадиен 1,3) 1)CH≡C-Ch3-Ch4 (бутин 1) 2)Ch4-C≡C-Ch4 (бутин 2) В) с углеводородом Другого класса 1)с алкенами 2) CH Ch3=CH-CH 3 CH——–CH (пропен) (циклопропан) С циклоалканами (см циклоалканы) С алкинами (см Алкины) С диеновыми : 1) CH 2=C=CH 2 (пропадиен) 2) CH≡C-Ch4 (пропин) Г) по положению радикала 1) Ch3-CH-Ch4 2)CH 2-CH-Ch4 Ch3-CH-Ch4 Ch4-CH-Ch3 (1,2диметилбутан) (1,3диметилбутан) 2. Пространственная Д)Пространственная изомерия (цис-транс изомерия) Ch4 Ch4 Ch4 H C=C C=C H (цис) H H (транс) Ch4 Ch4 CH=Ch3 Ch4 H C=C C=C H H H CH=Ch3 3.Химические свойства . А)Горение Ch5+O 2→CO2+h3O+Q МЕТАН CH 2 Ch3—–Ch3+O2→CO 2+h3O+Q С2h5+O2→CO2+h3O+Q ЭТЕН Те же свойства что и у алкенов но реакции происходят в 2 этапа ! 1.полное сгорание 2C2h3+5O 2→4CO2+2h3O+Q 2 неполное сгорание С2h3+O 2→C+H 2O 1.полное сгорание C6H6 +O2→CO 2+h3O 2. Неполное сгорание C6H6+O 2→C+H 2O+Q Б)Термическое разложение C4h20→4C+5H 2+Q БУТАН С2h5→C+H 2-Q ЭТЕН C2h3→C+h3 C6H6→C+h3-Q В)р замещения *Ch5+CL2→Ch4CL+HCL хлорметан *Ch4CL+CL2→Ch3CL2+HCL дихлорметан *Ch3CL2+CL=CHCL3+HCL C7h24+Br2→C7h23Br+HBr (бромциклогептан) 1. C6H6+CL2→C6H5-CL хлорбензол 2.C6H 6+HNO3→C6H5-NO3 нитробензол
Пространственная Д)Пространственная изомерия (цис-транс изомерия) Ch4 Ch4 Ch4 H C=C C=C H (цис) H H (транс) Ch4 Ch4 CH=Ch3 Ch4 H C=C C=C H H H CH=Ch3 3.Химические свойства . А)Горение Ch5+O 2→CO2+h3O+Q МЕТАН CH 2 Ch3—–Ch3+O2→CO 2+h3O+Q С2h5+O2→CO2+h3O+Q ЭТЕН Те же свойства что и у алкенов но реакции происходят в 2 этапа ! 1.полное сгорание 2C2h3+5O 2→4CO2+2h3O+Q 2 неполное сгорание С2h3+O 2→C+H 2O 1.полное сгорание C6H6 +O2→CO 2+h3O 2. Неполное сгорание C6H6+O 2→C+H 2O+Q Б)Термическое разложение C4h20→4C+5H 2+Q БУТАН С2h5→C+H 2-Q ЭТЕН C2h3→C+h3 C6H6→C+h3-Q В)р замещения *Ch5+CL2→Ch4CL+HCL хлорметан *Ch4CL+CL2→Ch3CL2+HCL дихлорметан *Ch3CL2+CL=CHCL3+HCL C7h24+Br2→C7h23Br+HBr (бромциклогептан) 1. C6H6+CL2→C6H5-CL хлорбензол 2.C6H 6+HNO3→C6H5-NO3 нитробензол
|
|||||||||||||||||||||||||||||||
Органические растворители
| |||
Атомы химических элементов.
 8-й класс
8-й классТип урока: Обобщение и систематизация знаний.
Технология: традиционная
Задачи урока:
- а) образовательные: закрепить, повторить и обобщить знания обучающихся о строении атомов химических элементов на основании их положения в Периодической системе Д.И. Менделеева, о природе химической связи;
- б) развивающие: развивать умение применять теоретические знания при выполнении заданий различного уровня сложности, развивать внимание, воображение, мышление, память;
- в) воспитательные: формировать мировоззрение, коллективизм, содействовать повышению интереса к предмету.
Оборудование: Периодическая таблица Д.И. Менделеева, ИК-средства обучения, карты-лабиринты, карточки с заданиями.
Методы: репродуктивные, частично-поисковые, словесные, наглядные.
Формы работы на уроке: фронтальная, групповая, индивидуальная.
I. Организационный момент. Вводное слово учителя.
Весь класс заранее поделен на 4 группы. Учитель сообщает тему и задачи урока.
II. Обобщение и систематизация знаний.
1. Положение химических элементов в периодической системе химических элементов Д.И. Менделеева.
Задание 1 всему классу: найдите в каждом ряду один химический элемент, который отличается от остальных по положению в периодической системе химических элементов Д.И. Менделеева и объяснить причину своего выбора. На слайде:
а) H He Ne Ar
б) H Li Be B
в) Fe Co Ni Ar
г) F Cl Mn Br
Запишите правильный ответ.
2. Взаимосвязь строения атома и положения химического элемента в таблице периодической системы Д.И. Менделеева.
а) Задание 2 один человек выполняет у доски, учитель и весь класс контролируют правильность выполнения задания.
Задание: определите, какие величины, характеризующие строение атома и положение химического элемента в периодической таблице Д.И. Менделеева, численно равны между собой. Буквы, соответствующие правильным ответам, образуют название химического элемента, обнаруженного в 1868 г. в солнечном спектре. На доске:
| Строение атома | Положение химического элемента в таблице периодической системы Д.И. Менделеева | ||
| порядковый номер | номер периода | номер группы | |
| 1. Заряд ядра | Г | Д | Ж |
2. Число электронов в атоме Число электронов в атоме |
Е | З | К |
| 3. Число протонов в ядре | Л | М | Н |
| 4. Число нейтронов в ядре атома | Ю | У | С |
| 5. Число электронов в наружном слое атома | О | П | И |
| 6. Число электронных слоев (энергетических уровней) в атоме | Ч | Й | Я |
Ответ: Гелий
б) Задание 3 обучающиеся выполняют в карточках в своих группах. Карточки у всех групп одинаковые. После выполнения задания учитель собирает карточки на проверку и показывает правильный результат. Задание на карточках: заполните графы в таблице в соответствии с приведенными данными. Сумма цифр третьего, четвертого и пятого столбцов равна относительной молекулярной массе азотной кислоты (HNO3).
Карточки у всех групп одинаковые. После выполнения задания учитель собирает карточки на проверку и показывает правильный результат. Задание на карточках: заполните графы в таблице в соответствии с приведенными данными. Сумма цифр третьего, четвертого и пятого столбцов равна относительной молекулярной массе азотной кислоты (HNO3).
| Название химического элемента | Электронные формулы | Порядковый номер | Номер периода | Номер группы |
| 4 | ||||
| 1s2 2s2 2p3 | ||||
| 2 | 4 | |||
| 1s2 2s2 2p6 3s23p6 |
3. Изменение свойств атомов химических элементов. Химическая связь.
Изменение свойств атомов химических элементов. Химическая связь.
Задание 4 выполняется по разным карточкам в группах самостоятельно.
Задания в карточках:
Карточка №1
Какие суждения о строении и свойствах атомов, приведенные в левом столбце, соответствуют понятиям из правого столбца:
| 1) Атомные радиусы уменьшаются с увеличением зарядов ядер атомов. 2) Атомные радиусы увеличиваются с увеличением зарядов ядер атомов. 3) Одинаковое число электронов на внешних энергетических уровнях атомов. 4) Металлические свойства ослабевают с увеличением заряда ядер. 5) Металлические свойства усиливаются с увеличением заряда ядер. |
а) главная подгруппа б) группа в) период |
Карточка №2
Какие из попарно приведенных свойств не взаимосвязаны между собой:
а) большие значения атомного радиуса и электроотрицательности;
б) небольшое значение атомного радиуса и сильно выраженные неметаллические свойства;
в) большое значение атомного радиуса и сильно выраженные металлические свойства;
г) небольшое значение электроотрицательности и большое значение атомного радиуса;
д) небольшое значение электроотрицательности и слабо выраженные металлические свойства?
Карточка №3
Определите в каком ряду пары атомов расположены в порядке последовательного увеличения смещения общей электронной пары:
а) F – F, H – F , Na – F
б) F – F, Na – F, H – F
в) Na – F, F – F, H – F
г) H – F, F – F, Na – F
д) Na – F, H – F, F – F.
Карточка №4
В каком из рядов соединения расположены в порядке увеличения полярности связи:
а) CH4, HF, HCl, H2O, NH3
б) HCl, CH4, NH3, HF, H2O
в) CH4, HCl, NH3, H2O, HF
г) HCl, CH4, H2O, NH3, HF
д) HF, CH4, HCl, NH3, H2O.
После самостоятельной работы в группах представителями от каждой группы оглашаются результаты и оцениваются другими группами и учителем.
4. Задание 5 игра в «Крестики- нолики» на определение вида химической связи выполняют на доске представители из каждой группы по очереди, после выполнения проверяются всем классом и оцениваются учителем.
Задание на доске: исходя из вида химической связи, определите для каждого случая выигрышный путь, если его составляют вещества с а) с неполярной ковалентной связью, б) полярной ковалентной связью, в) ионной связью, г) ионной связью.
| а) |
|
в) |
|
|||||||||||||||||||
| б) |
|
г) |
|
5. Игра-лабиринт проводится самостоятельно в группах по картам-лабиринтам. Та группа, которая быстрее выполнит задание, озвучивает результат. Учитель проверяет правильность выполнения задания и показывает правильный ответ.
Игра-лабиринт проводится самостоятельно в группах по картам-лабиринтам. Та группа, которая быстрее выполнит задание, озвучивает результат. Учитель проверяет правильность выполнения задания и показывает правильный ответ.
Задание: найдите путь в лабиринте, который приведет вас к финишу, принимая за исходные разные клетки. Если суждение, вписанное в эту клетку, правильное, то продолжайте путь по стрелке с обозначением «да». Если данное суждение ошибочно, то вам следует продолжить путь по стрелке с обозначением «нет».
III. Подведение итогов.
Выставление оценок за урок. Завершающее слово учителя.
Список литературы:
- Тыльдсепп А.А.Мы изучаем химию [Текст]: учебное пособие / А.А. Тыльдсепп, В.А. Корк. – М.: Просвещение, 1988. – 96 с.
- Габриелян О.С. Химия 8 кл: рабочая тетрадь к учебнику О.С. Габриеляна «Химия. 8» [ Текст] / О.С. Габриелян, А.В. Яшукова. – М: Дрофа, 2007.
 – 176 с.:ил.
– 176 с.:ил.
ГАЗОВАЯ ПОСТОЯННАЯ R = 0,0821 л.атм/моль.K. (см. КЛАПЕЙРОНА-МЕНДЕЛЕЕВА УРАВНЕНИЕ).
ГИБРИДИЗАЦИЯ.
Теоретическое
представление,
с помощью
которого
удается
связать
между собой
физическую
картину
строения
атома и
определяемую
опытным
путем
геометрию
молекул (см. РЕНТГЕНОСТРУКТУРНЫЙ
АНАЛИЗ).
Например,
атом
углерода
имеет s- и p-орбитали,
но в
молекуле CH4
не удалось
опытным
путем
обнаружить
отдельных
связей,
образованных
s-электронами
и отдельных
связей -
образованных
p-электронами
(все связи в CH4
одинаковы). Поэтому
принято, что
одна s- и три p-орбитали
смешиваются
(гибридизуются),
образуя 4
новые,
совершенно
одинаковые
орбитали (четыре
sp3-гибридные
орбитали).
Эти 4
гибридные
орбитали
перекрываются
с
электронными
оболочками
4-х атомов Н.
Геометрическую
формулу
образовавшейся
молекулы
предсказывают
исходя из
правила, что
гибридные
орбитали в
молекуле
стремятся
расположиться
на
максимальном
расстоянии
друг от
друга.
Например,
для 4-х
гибридных
орбиталей
это
тетраэдр.
Поэтому
принято, что
одна s- и три p-орбитали
смешиваются
(гибридизуются),
образуя 4
новые,
совершенно
одинаковые
орбитали (четыре
sp3-гибридные
орбитали).
Эти 4
гибридные
орбитали
перекрываются
с
электронными
оболочками
4-х атомов Н.
Геометрическую
формулу
образовавшейся
молекулы
предсказывают
исходя из
правила, что
гибридные
орбитали в
молекуле
стремятся
расположиться
на
максимальном
расстоянии
друг от
друга.
Например,
для 4-х
гибридных
орбиталей
это
тетраэдр. В
тех случаях,
когда одна
или две p-орбитали
не
участвуют
в
гибридизации,
они
остаются в
негибридизованном
виде и либо
не несут
электронов,
либо
участвуют в
связывании
другого
типа (двойные
и тройные
связи). Это
соответственно
sp2– и sp-гибридизации.
НЕПОДЕЛЕННЫЕ
электронные
ПАРЫ тоже
участвуют в
гибридизации.
Например,
аммиак :NH3 – sp3-гибридизация
атома N,
молекула
имеет форму
тетраэдра,
одна из
вершин
которого -
неподеленная
пара
электронов,
оставшиеся
три – атомы Н.
В
тех случаях,
когда одна
или две p-орбитали
не
участвуют
в
гибридизации,
они
остаются в
негибридизованном
виде и либо
не несут
электронов,
либо
участвуют в
связывании
другого
типа (двойные
и тройные
связи). Это
соответственно
sp2– и sp-гибридизации.
НЕПОДЕЛЕННЫЕ
электронные
ПАРЫ тоже
участвуют в
гибридизации.
Например,
аммиак :NH3 – sp3-гибридизация
атома N,
молекула
имеет форму
тетраэдра,
одна из
вершин
которого -
неподеленная
пара
электронов,
оставшиеся
три – атомы Н. В различных
гибридизациях
вместе с s- и p-орбиталями
могут
участвовать
также и d-орбитали
(sp3d- и sp3d2-гибридизации).
Тип
гибридизации
атома часто
определяют
с помощью
его ОРБИТАЛЬНОЙ
ДИАГРАММЫ.
В различных
гибридизациях
вместе с s- и p-орбиталями
могут
участвовать
также и d-орбитали
(sp3d- и sp3d2-гибридизации).
Тип
гибридизации
атома часто
определяют
с помощью
его ОРБИТАЛЬНОЙ
ДИАГРАММЫ.
ГИДРАТАЦИЯ – связывание молекул (атомов, ионов вещества) с водой, не сопровождающееся разрушением молекул воды.
ГИДРАТЫ
– соединения
вещества с
водой,
имеющие
постоянный
или
переменный
состав и
образующиеся
в
результате
гидратации.
ГИДРОКСИ-ГРУППА – группа ОН.
ГРАММ-МОЛЬ. См. МОЛЯРНАЯ МАССА.
ГОРЕНИЕ – быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и, как правило, света.
Виктор Мироненко о послевыборных раскладах на Украине, ч. 2 — Реальное время
Виктор Мироненко — о послевыборных раскладах на Украине. Часть 2-я
О том, реален ли твердый мир на Донбассе и вероятно ли смягчение отношений России и Украины при новом президенте, читайте во второй части интервью «Реальному времени» руководителя Центра украинских исследований Института Европы РАН Виктора Мироненко. Первую часть см. здесь.
Первую часть см. здесь.
«ДНР и ЛНР — это колоссальная ошибка»
— Виктор Иванович, хотя многие эксперты говорят, что главные вопросы, интересующие украинского избирателя, это экономика и коррупция, вопрос установления мира на Донбассе ушел от них не слишком далеко. Зеленский заявляет, что, избравшись президентом, он не снимет экономическую блокаду ЛНР и ДНР, то есть перевозку того же угля. Нормально ли это по отношению к территориям, которые Украина считает своими?
— А о какой блокаде идет речь? Перед нами сепаратистский мятеж! Вспомните дудаевскую Чечню в составе России — разве Россия ввозила туда какое-то имущество? Нет. Пенсионеры Донбасса получают от Украины пенсию, если могут выезжать за ней — но иначе никак. Можно ли вести Украине экономическую деятельность, если со стороны ДНР и ЛНР стоят «Грады», артиллерийские орудия и пулеметы? Можно ли ее вести, если каждый день хоронят людей во всех городах Украины? Я приезжаю в Чернигов и там полкладбища убитых в этом конфликте.
Шахтеры — очень наивные, и в этом смысле они как дети, и не они, конечно, виноваты в этом — сепаратистский мятеж ряда лиц, увы, был поддержан Россией. Представьте, если бы во время войны в Чечне боевиков Дудаева стал снабжать пулеметами и снарядами президент Украины Кучма — как бы это поняли в Москве? В общем, ДНР и ЛНР — это колоссальная ошибка.
— Все чаще слышны разговоры, что неконтролируемый Украиной Донбасс может превратиться во второе Приднестровье — конфликт будет заморожен на долгие годы.
— Это будет хуже — это будет раковая опухоль Европы. Донбасс — это шахты, а стало быть, в шахтах постоянно идет подтопление. И даже если они закрылись, из них все равно нужно откачивать воду, за ними нужно следить. И если, не дай бог, грунтовые воды, в которых вся таблица Менделеева, поднимутся до водоносного слоя, экологическая катастрофа на Донбассе будет такой, что Чернобыль покажется детской неприятностью. Катастрофа будет ожидать уже весь регион. Поэтому конфликт нужно не замораживать, а размораживать. Новому президенту нужно немедленно вводить контроль миротворцев и срочно искать деньги на предотвращение экологической катастрофы такого масштаба. Но почему-то о вероятности такой катастрофы никто не говорит!
Новому президенту нужно немедленно вводить контроль миротворцев и срочно искать деньги на предотвращение экологической катастрофы такого масштаба. Но почему-то о вероятности такой катастрофы никто не говорит!
«Донбасс — это шахты, а стало быть, в шахтах постоянно идет подтопление, и даже если они закрылись, из них все равно нужно откачивать воду, за ними нужно следить. И если, не дай бог, грунтовые воды, в которых вся таблица Менделеева, поднимутся до водоносного слоя, экологическая катастрофа на Донбассе будет такой, что Чернобыль покажется детской неприятностью». Фото pr.kharkov.ua
— Но Зеленский сказал, что минские договоренности 2015 года надо заставить работать через введение миротворцев и подключение к этому процессу США и Великобритании. Это многое дает?
— Сейчас работа этих договоренностей зависит не только от украинского президента, но и от российского, а также от Макрона, Меркель и многих других политиков. Но желания погасить этот конфликт с российской стороны я не вижу. У России есть только твердая позиция поддержки тех людей, которые там воюют. Кстати, там надо разбираться, кого мы, Россия, там поддерживаем, и, думаю, со временем мы это поймем.
У России есть только твердая позиция поддержки тех людей, которые там воюют. Кстати, там надо разбираться, кого мы, Россия, там поддерживаем, и, думаю, со временем мы это поймем.
Но дело даже не в сепаратистах! Зеленский высказал одну очень правильную вещь, хотя для этого ему понадобилось политическое мужество. Он сказал, что решить проблему Донбасса без участия тех людей, которые контролируют территорию ДНР и ЛНР, невозможно. А значит, нужны другие форматы. Есть нормандский, минский, но нужен более узкий формат, то есть обязательно нужно разговаривать с людьми из ДНР и ЛНР и понять, чего они хотят. В 2014 году было понятно — эти люди хотели в Россию, а если говорить конкретно — в некий «новый СССР», как и Крым: в старом СССР у шахтера зарплата была больше, чем у министра, отпуск составлял 2 месяца, а для их жен построили кондитерские и ткацкие фабрики, где эти женщины стали уважаемыми и были в орденах и медалях.
Но людей обманули. «Новый СССР», то есть Донбасс в России, оказался ложью, а теперь им уже некуда деваться. Работать им негде, зарабатывать негде. Я понимаю, что Россия помочь Донбассу уже не может, у нас своих забот полон рот. Но пусть жители этих районов идут своим путем, пусть сами думают и решают. И не надо им мешать. И такой подход может помочь и России. Сейчас же, когда мы мешаем Украине в больных вопросах, мы ей тем самым помогаем и добавляем ей решительности, добавляем способности терпеть.
Работать им негде, зарабатывать негде. Я понимаю, что Россия помочь Донбассу уже не может, у нас своих забот полон рот. Но пусть жители этих районов идут своим путем, пусть сами думают и решают. И не надо им мешать. И такой подход может помочь и России. Сейчас же, когда мы мешаем Украине в больных вопросах, мы ей тем самым помогаем и добавляем ей решительности, добавляем способности терпеть.
«На кого рассчитана наша пропаганда, на которую тратятся такие деньги, если на Украине ее никто не видит?»
— Если Зеленский начнет переговоры с лидерами ДНР и ЛНР, изменится ли позиция России по отношению к Украине? Вот вчера мы узнали, что запрещен экспорт нефти из нашей страны в соседнюю.
— Я не вижу возможности смены этой политики до смены политических лидеров в России, до смены политических сил, которые отвечают в нашей стране за политику. Сейчас окончательно восторжествовала точка зрения, что нам надо мешать Украине. Это очень странно, потому что Украина и Россия — две страны, которые обречены на сотрудничество, иначе они не выйдут из того кризиса, в котором находятся.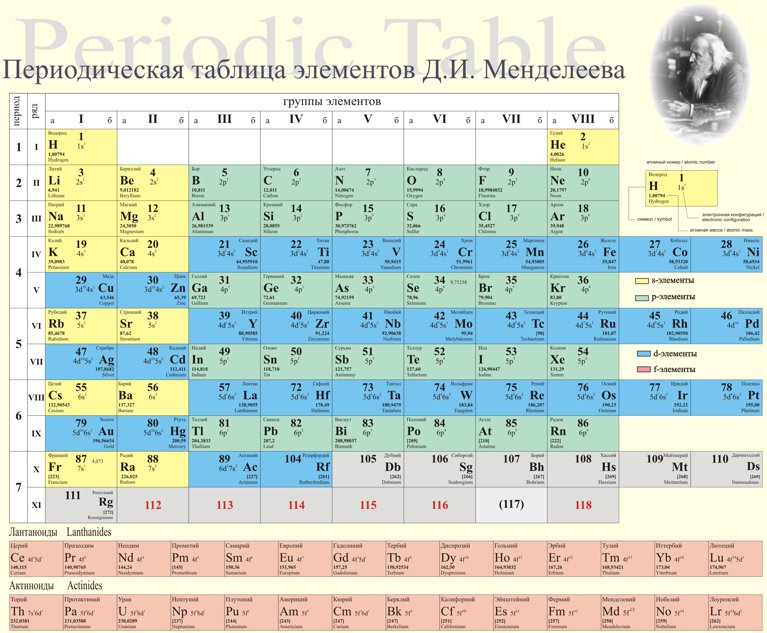 Но справедливости ради скажу, что и Украина, и Россия сейчас начинают вставлять друг другу палки в колеса. Если бы я был политиком, я бы ввел следующий принцип — если то или иное политическое решение может нанести ущерб одной из стран, лучше этого не совершать, но и украинская, и российская сторона эти гадости друг другу делают. Недоброжелателей у России хватает, и вы представьте, как они сейчас радуются!
Но справедливости ради скажу, что и Украина, и Россия сейчас начинают вставлять друг другу палки в колеса. Если бы я был политиком, я бы ввел следующий принцип — если то или иное политическое решение может нанести ущерб одной из стран, лучше этого не совершать, но и украинская, и российская сторона эти гадости друг другу делают. Недоброжелателей у России хватает, и вы представьте, как они сейчас радуются!
«Зачем мы, к примеру, поддерживали Януковича? Мне никто не дал вразумительного ответа! Я даже спрашивал у многих своих коллег, занимавших противоположную позицию: «В чем ваша любовь к Януковичу?». Не объясняли». Фото kremlin.ru
— Пару недель назад шли разговоры о возможном непризнании Россией этих выборов, правда, потом они утихли. Это реально?
— Я не знаю. Но если у российского руководства есть в голове какие-то реальные заботы о своей стране и если есть понимание истинных интересов России, то оно признает выборы. А если нет понимания, то значит, будут делать то, что делали в отношении Украины с 2004 года.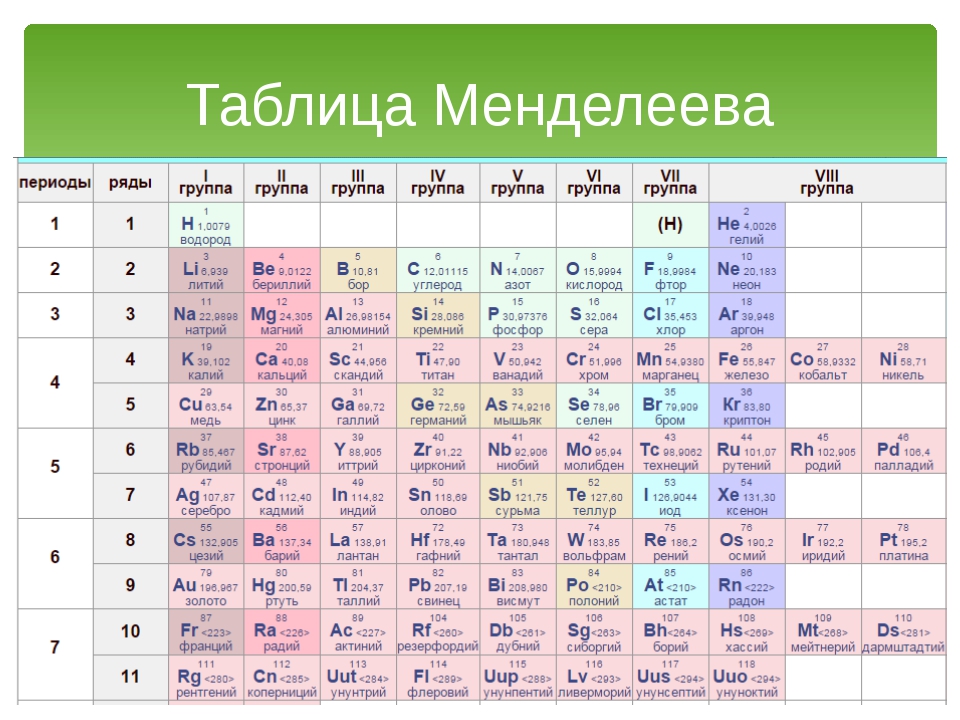 Зачем мы, к примеру, поддерживали Януковича? Мне никто не дал вразумительного ответа! Я даже спрашивал у многих своих коллег, занимавших противоположную позицию: «В чем ваша любовь к Януковичу?». Не объясняли.
Зачем мы, к примеру, поддерживали Януковича? Мне никто не дал вразумительного ответа! Я даже спрашивал у многих своих коллег, занимавших противоположную позицию: «В чем ваша любовь к Януковичу?». Не объясняли.
— Может, дело в бизнесе, в выгодах, которые Россия могла гарантированно получить от Януковича, а от Ющенко нет?
— Дело намного серьезнее и глубже. Я не включаю телевизор и не смотрю передачи на украинскую тему, потому что я знаю, что происходит на Украине, потому что там бываю, и второе — то, что несут Скабеева и остальные, у меня вызывает оторопь. Но у украинских экспертов, которые участвуют в этих программах и которые заезжают ко мне по старой памяти, я спрашиваю: «Зачем вы туда ездите?», а они говорят: «Деньги кончились, Виктор Иванович — надо съездить! А платят по 100—200 тысяч в месяц на этом часовом стоянии». Так вот — если тратятся такие деньги только на пропаганду, которую на Украине никто не видит, то на кого рассчитана эта пропаганда? Явно не на украинцев, а на российских граждан — но зачем?
Затем, чтобы наши граждане не вздумали быть свободными и не вздумали следовать примеру украинских соседей. В этом цель и пропаганды, и властей России — страх, боязнь отпустить руль власти, неверие в своих людей, неверие в свою страну, неверие в способность граждан жить свободными. И Украина, соответственно, должна быть заранее дискредитирована в глазах российских граждан! А вдруг у нее что-то получится и в экономическом, и в социальном росте. И тогда российские граждане зададут вопрос: а почему украинцы могут сделать что-то, а мы нет?
В этом цель и пропаганды, и властей России — страх, боязнь отпустить руль власти, неверие в своих людей, неверие в свою страну, неверие в способность граждан жить свободными. И Украина, соответственно, должна быть заранее дискредитирована в глазах российских граждан! А вдруг у нее что-то получится и в экономическом, и в социальном росте. И тогда российские граждане зададут вопрос: а почему украинцы могут сделать что-то, а мы нет?
— Я заметил, что чаще объектом критики на российских ток-шоу становилась не столько экономическая и политическая жизнь на Украине во всех ее проявлениях, сколько президент Порошенко. В Зеленском многие видят разумного человека, и это затрудняет для российского телевидения поиск выгодного и постоянного объекта критики. Закончится ли украинская тематика на нашем ТВ?
— Я думаю, что в скором времени закончится. Судьба России — это судьба Украины, это ключевой вопрос. Вспомните, когда Россия стала влиятельной империей. При Петре I, но до него уже произошло воссоединение Украины с Россией. Когда СССР стал мировой державой? После Союзного договора 1922 года! Я не ратую за восстановление империи — я ратую за позитивное понимание национальных интересов страны и за способность служить этим интересам, а не своему карману.
Когда СССР стал мировой державой? После Союзного договора 1922 года! Я не ратую за восстановление империи — я ратую за позитивное понимание национальных интересов страны и за способность служить этим интересам, а не своему карману.
— Но ведь и Украина должна что-то сделать?
— Украинскому руководству нужно открыть границу как можно шире — пусть граждане России едут и смотрят, что там на самом деле происходит! Да, там действительно жизнь тяжелая, но жизнь продолжается, а во многих отношениях даже лучше — продукты лучше, цены ниже.
«Возьмите Украину. В 1991 году она получила полную государственную самостоятельность и суверенитет, а самым массовым движением в стране в то время был «Рух». Но когда Украина уже была суверенной, «Рух» и его лидеры проиграли выборы с треском!». Фото commons.wikimedia.org
Если команда Порошенко использует административный ресурс, будет взрыв посильнее, чем в 2004-м или 2014-м»
— А нет ли на Украине роста национализма? Ведь многие считают Россию врагом и при таком подходе ехать захочется немногим.
— У меня есть свое понятие — реактивный национализм. Давайте разберемся, что такое национализм. Если этнический, то скажу так: дураки есть везде — и на Украине, и в России. Но, наверное, вы имеете в виду еще и политический национализм.
Политический национализм — это легальное политическое течение, которое, правда, было наиболее распространено в XIX веке. Оно имеет своей целью образование национального государства с преобладанием людей, принадлежащих к определенной культуре, которые сами могут решать свою судьбу. Как только эта задача решена, политический национализм теряет всякий смысл — у него уже нет цели. Возьмите Украину. В 1991 году она получила полную государственную самостоятельность и суверенитет, а самым массовым движением в стране в то время был «Рух». Но когда Украина уже была суверенной, «Рух» и его лидеры проиграли выборы с треском! Или возьмите уже 2014 год, когда избирали президента – в России было море разговоров о «Правом секторе», Яроше, партии «Свобода», но сколько их кандидаты получили голосов? Два процента! На Украине нет почвы для этнического национализма!
На Украине, как и в любой стране, национализм возникает лишь в том случае, когда суверенной стране что-то угрожает извне. И если этот национализм где-то и есть, то он порожден российской политикой. Но даже в 2019 году людей, позитивно относящихся к России, на Украине в два раза больше, чем в России к Украине! Мы родили реактивный национализм. Дайте людям спокойно жить! Если речь идет о людях с русской культурой и их проблемах, надо использовать все международные арены, чтобы об этом говорить, но не танки же, не гаубицы. Наверное, кому-то нужен был и такой украинский национализм.
И если этот национализм где-то и есть, то он порожден российской политикой. Но даже в 2019 году людей, позитивно относящихся к России, на Украине в два раза больше, чем в России к Украине! Мы родили реактивный национализм. Дайте людям спокойно жить! Если речь идет о людях с русской культурой и их проблемах, надо использовать все международные арены, чтобы об этом говорить, но не танки же, не гаубицы. Наверное, кому-то нужен был и такой украинский национализм.
Да, на Украине есть люди, кто и на сверхпатриотизме делает себе сверхкарьеру — профессиональные украинцы, как я их называю, но таких мало.
— Возможны ли какие-то сложности для Зеленского-президента до выборов в Раду, которые состоятся в октябре? Ведь правительство в эти полгода будет состоять не из его людей.
— Мой друг, журналист Дмитрий Гордон сказал, что нужно было бы сразу произвести полную перезагрузку власти — внеочередные выборы в парламент и местные органы власти. Но нынешний премьер Гройсман держит нормальную позицию — лояльную к действующему президенту, но, с другой стороны, он никогда с ним не солидаризировался.
«Вот посмотрите, как мудро поступила после выборов Юлия Тимошенко. Была информация, что она проиграла при наличии выборных нарушений, но она сказала — страна важнее, и не стала опротестовывать результаты. А это означает, что многие украинцы уже повзрослели и этим они отличаются от нас». Фото facebook.com/YuliaTymoshenko
— Можно ли быть спокойным за Украину в ближайшие 5 лет? Судя по вашим наблюдениям и выводам, можно?
— Я за Украину спокоен, хотя у нее впереди очень трудный путь. И вслед за Меркель скажу, что украинцы очень много сделали в стране, но перед ними еще длительный путь к созданию развитого государства. И главное, не надо украинцам мешать на этом пути, потому что для России никакой опасности от Украины нет, а даже наоборот: на примере соседа мы можем научиться, что делать в политике надо, а что не надо. Риск опасностей, конечно, большой — не дай бог, команда Порошенко захочет использовать административный ресурс, тогда будет взрыв, а это очень опасно. Это будет уже не 2004-й и не 2014-й — 100—200 тысяч украинцев уже прошли войну и многие пришли с нее не с пустыми руками, поэтому не приведи бог… А если на Украине начнутся серьезный конфликт и разделение страны, то первыми пострадаем именно мы.
Это будет уже не 2004-й и не 2014-й — 100—200 тысяч украинцев уже прошли войну и многие пришли с нее не с пустыми руками, поэтому не приведи бог… А если на Украине начнутся серьезный конфликт и разделение страны, то первыми пострадаем именно мы.
— Хочется надеяться, что это понимает и Петр Порошенко.
— Надеюсь. Вот посмотрите, как мудро поступила после выборов Юлия Тимошенко. Была информация, что она проиграла при наличии выборных нарушений, но она сказала — страна важнее, и не стала опротестовывать результаты. А это означает, что многие украинцы уже повзрослели. И этим они отличаются от нас.
Сергей Кочнев
ОбществоВластьМасса атомов и молекул
Масса атомов и молекул
Для измерения масс атомов и молекул в физике и химии принята единая система измерения. Эти величины измеряются в относительных единицах – атомных единицах массы. Атомная единица массы (а.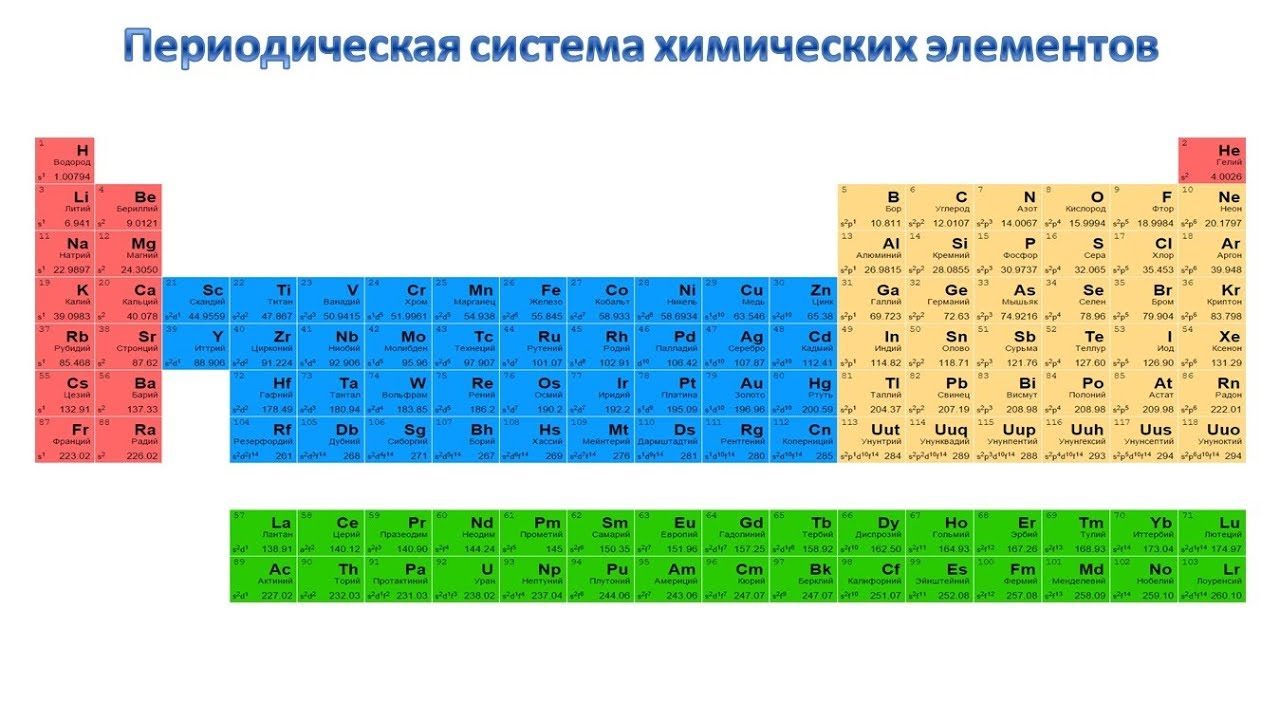 е.м.) равна 1/12 массы m атома углерода 12С (m одного атома 12С равна 1,993 • 10-26 кг). Относительная атомная масса элемента (Ar) – это безразмерная величина,
равная отношению средней массы атома элемента к 1/12 массы атома 12С. При расчете относительной атомной массы учитывается изотопный состав элемента. Величины Ar определяют по таблице Д.И. Менделеева.
е.м.) равна 1/12 массы m атома углерода 12С (m одного атома 12С равна 1,993 • 10-26 кг). Относительная атомная масса элемента (Ar) – это безразмерная величина,
равная отношению средней массы атома элемента к 1/12 массы атома 12С. При расчете относительной атомной массы учитывается изотопный состав элемента. Величины Ar определяют по таблице Д.И. Менделеева.Абсолютная масса атома (m) равна относительной атомной массе, умноженной на 1 а.е.м. Например, для атома водорода абсолютная масса определяется следующим образом:
m(H) = 1,008 • 1,661 • 10-27 кг = 1,674 • 10-27 кгОтносительная молекулярная масса соединения (Mr) – это безразмерная величина, равная отношению массы m молекулы вещества к 1/12 массы атома 12С:
Относительная молекулярная масса равна сумме относительных масс атомов, входящих в состав молекулы. Например:
Например:
Например, при полимеризации пропилена CH2=CHCH3 получен полипропилен [–CH2–CH(CH3)–]n, который содержит 20% макромолекул с молекулярной массой 84000, и 80% макромолекул с молекулярной массой 126000. Чтобы охарактеризовать молекулярную массу этого полимера, находят ее среднее (числовое) значение: Mr(ср)(полипропилена) = 84000 • 0,2 + 126000 • 0,8 = 117600.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на 1 а.е.м.
m(C2H6) = Mr(C2H6) • 1,661 • 10-27 кг = 49,82 • 10-27 кг.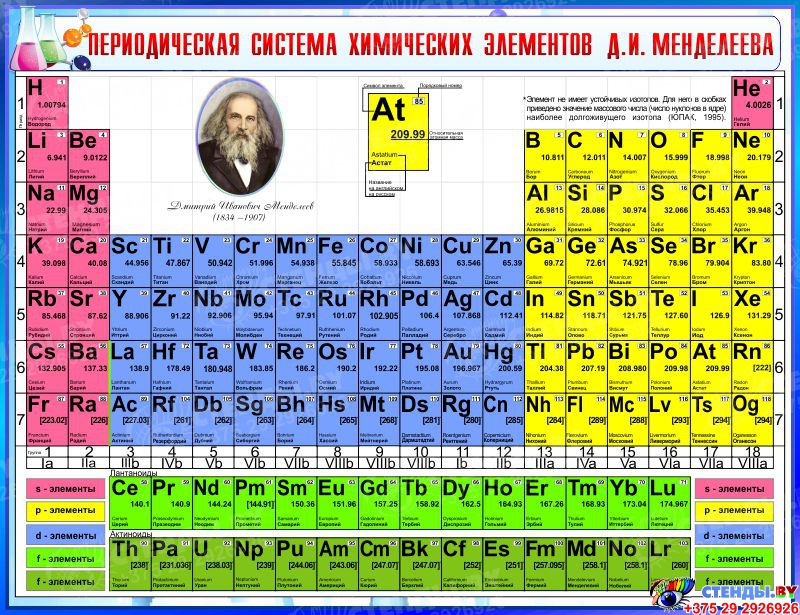
Когда швейцарские химики были в своей стихии
Дмитрий Менделеев, отец таблицы Менделеева Королевского химического обществаГадолиний, гольмий и иттербий. Что они собой представляют и что у них общего? К 150 -й -й годовщине публикации периодической таблицы Менделеева мы рассмотрим свойства и использование трех элементов таблицы, которые были открыты швейцарскими учеными.
Этот контент был опубликован 6 марта 2019 г. – 13:38 Томас СтивенсТомас родился в Лондоне, работал журналистом в The Independent до переезда в Берн в 2005 году.Он говорит на трех официальных швейцарских языках, любит путешествовать по стране и практиковать их, прежде всего в пабах, ресторанах и джелатериях.
Больше от этого автора | Кафедра английского языка
Кай Реуссерswissinfo.ch
Другие языки: 7 (в оригинале) 6 марта 1869 года Дмитрий Менделеев представил Русскому химическому обществу свою систему классификации 63 известных химических элементов. Как вы помните из школьных лет, сегодня 118 элементов. Внешние связи упорядочены по атомному номеру, электронной конфигурации и повторяющимся химическим свойствам.
Как вы помните из школьных лет, сегодня 118 элементов. Внешние связи упорядочены по атомному номеру, электронной конфигурации и повторяющимся химическим свойствам.
Однако около 50 лет некоторые элементы не рассматривались, потому что они либо были недостаточно чистыми, либо их нельзя было идентифицировать. Многие из них были редкоземельными элементами (лантаноидами), включая три «швейцарских» элемента.
Жан-Шарль Галиссар де Мариньяк, преподававший химию в Женевской академии (с 1873 г. – Женевский университет), запомнится за открытие иттербия (Yb) в 1878 г. и гадолиния (Gd) в 1880 г. Он также точно рассчитал атомный вес многих элементов.За свои усилия в 1886 году он был награжден престижной медалью Дэви за внешнюю ссылку, которую Менделеев получил четыре года назад.
В 1878 году двое учеников де Мариньяка, Жак-Луи Соре и Марк Делафонтен, обнаружили гольмий (Ho). Независимо и в то же время шведский ученый Пер Теодор Клев открыл, выделил и описал его.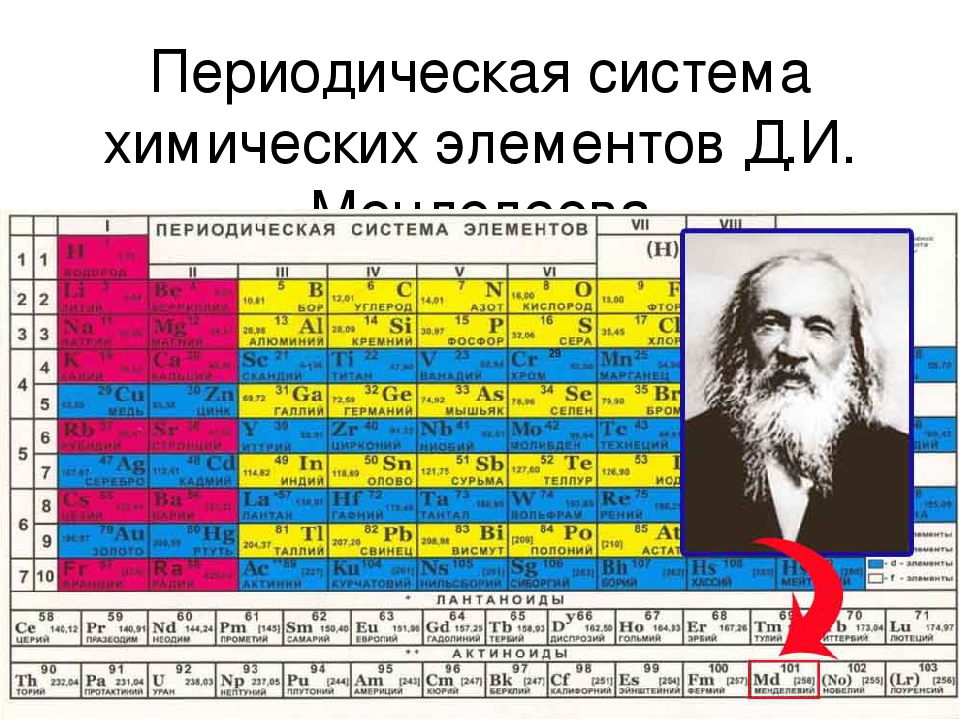
Давайте посмотрим на гадолиний Внешнее звено, гольмий Внешнее звено и иттербий Внешний звено ближе:
Кай Реуссер / swissinfo.chПо всем трем элементам в тройку крупнейших производителей входят Китай, Россия и Малайзия, а в тройку крупнейших держателей резервов входят Китай, страны СНГ, внешние связи (включая Россию) и США.
Эта статья была автоматически импортирована из нашей старой системы управления контентом. Если вы видите какие-либо ошибки на дисплее, сообщите нам об этом: [email protected]
Многоядерный ЯМР
Воспользуйтесь нашей услугой ЯМР за наш обширный опыт многоядерного ЯМР.
Выбрать ядро
Спектроскопия ЯМР возможна практически с любым элементом таблицы Менделеева.
Те, которые у нас есть, выделены в таблице ниже и могут быть
выбрано для получения дополнительной информации. Если интересующее вас ядро находится в
курсивом это означает, что у нас нет такого опыта. Все элементы (кроме аргона
который не имеет стабильного ядра ЯМР) подходят для ЯМР, и наша служба ЯМР будет
принимать ядра, о которых у нас нет опыта.См. Ниже, чтобы получить доступ к нашей базе данных многоядерного ЯМР.
Все элементы (кроме аргона
который не имеет стабильного ядра ЯМР) подходят для ЯМР, и наша служба ЯМР будет
принимать ядра, о которых у нас нет опыта.См. Ниже, чтобы получить доступ к нашей базе данных многоядерного ЯМР.
Выбрать из таблицы Менделеева
Выберите интересующее ядро из периодической таблицы или см. Ниже:
Выбрать из списка
из алфавитного списка ядер.
(Ядра в скобках менее желательны, чем другие изотопы того же элемента.) У нас нет опыта с ядрами, выделенными курсивом.
Сравнение ядерных свойств
Ядра различаются простотой наблюдения.Есть три основных фактора, которые
влияют на удобство наблюдения ядер: восприимчивость (чувствительность), ширину линии
и дисперсия химического сдвига. Желательно принять это во внимание.
прежде чем заняться незнакомым ядром. Часто бывает больше
чем одно ядро ЯМР для элемента. Иногда каждый изомер имеет свой
преимущества ( например, , азот, где 14 Н более чувствителен при естественном
изобилие, но 15 N дает много
более узкие сигналы, потому что он не квадруполярный), а иногда и один изотоп
лучше по всем статьям (как и в случае стабильных ядер водорода
где 1 H более чувствителен и дает более узкие сигналы
чем 2 H.Следовательно 1 H – предпочтительный изотоп
если не изучается конкретное изотопное замещение).
Часто бывает больше
чем одно ядро ЯМР для элемента. Иногда каждый изомер имеет свой
преимущества ( например, , азот, где 14 Н более чувствителен при естественном
изобилие, но 15 N дает много
более узкие сигналы, потому что он не квадруполярный), а иногда и один изотоп
лучше по всем статьям (как и в случае стабильных ядер водорода
где 1 H более чувствителен и дает более узкие сигналы
чем 2 H.Следовательно 1 H – предпочтительный изотоп
если не изучается конкретное изотопное замещение).
Разные ядра имеют разную восприимчивость, 1 H –
самое чувствительное стабильное ядро с 19 F.
Эффективная восприимчивость – это продукт внутренней восприимчивости ядра.
и его естественное изобилие. Например 3 Ему присущ
восприимчивость 0.В 44 раза больше, чем у протона, но имеет такой низкий естественный
изобилие, которое почти ненаблюдаемо; однако при обогащении его можно
наблюдается легко.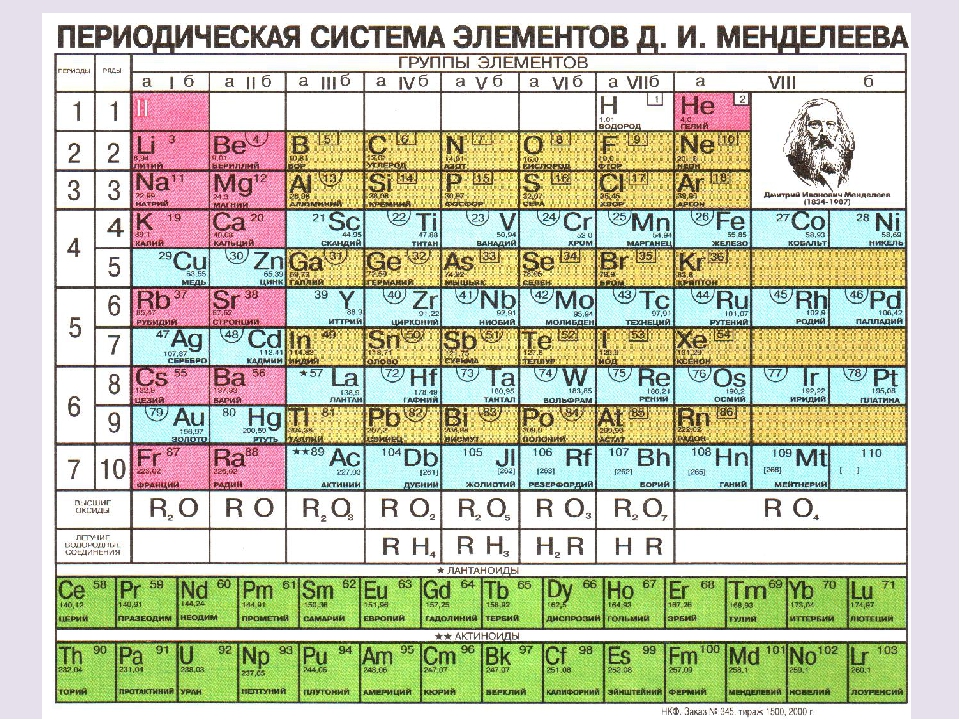
Ширины линий ядер со спином 1/2 обычно невелики, если только на них не влияют
парамагнетизм или анизотропия. Более тяжелые ядра, такие как 199 Hg более склонны к
анизотропное вращение, чем более легкие ядра, и проблема усугубляется
для более крупных молекул в более сильных магнитных полях.Широкие сигналы обычно
проблема для квадрупольных ядер (спин> ½) и шире для больших
параметр ширины линии, размер молекулы,
асимметрия в ядре и магнитном поле спектрометра. Во многих
случаях ширина линии слишком велика, чтобы ее можно было обнаружить с высоким разрешением
спектрометр, например, 127 I
ширина линии водного KI в спектрометре 400 МГц порядка 2
кГц, но для более крупного и менее симметричного иодбензола она порядка
10 МГц, слишком широкая, чтобы ее можно было наблюдать с помощью спектрометра высокого разрешения
и более чем на порядок шире, чем диапазон его химического сдвига.
Дисперсия химического сдвига широко варьируется между ядрами в зависимости от как электронные, так и химические свойства с некоторой тенденцией к увеличению дисперсии для более тяжелых ядер. Диапазон химического сдвига варьируется от от 10 ppm для водорода до 20000 ppm для кобальта. Когда химический сдвиг диапазон очень большой, химический сдвиг чрезвычайно чувствителен к параметры окружающей среды и сигналы могут быть расширены в зависимости от температуры градиенты по образцу.Диапазоны химического сдвига для разных изотопы одного и того же элемента практически идентичны.
Химия: Таблица Менделеева, гл. 2 | The Adventure Classroom
** ПОСМОТРЕТЬ ПРЕДВАРИТЕЛЬНЫЙ ВИДЕО **
ВКЛЮЧАЕТ:
1) Приключенческое мероприятие (онлайн)
2) Раздаточный материал
3) План урока по предмету
4) Power Point Presentation
5) Рекламное видео
6) Интерактивные видео с нашими суперзлодеями
7) Версия с QR-кодом и версия без QR-кода
** Интерактивный характер наших видео отличает нас от всех других учебных программ. Студенты ЛЮБЯТ наших суперзлодеев и будут умолять вас о большем. Когда в последний раз ваши ученики умоляли вас дать еще один урок? Они будут после этого! **
Студенты ЛЮБЯТ наших суперзлодеев и будут умолять вас о большем. Когда в последний раз ваши ученики умоляли вас дать еще один урок? Они будут после этого! **
ФОКУС:
Учащиеся опишут роль Менделеева в развитии современной периодической таблицы Менделеева, определят / найдут части периодической таблицы (периоды против групп, металлы против неметаллов против металлоидов, назовут семейства элементов) , а также описать и объяснить периодические тенденции изменения атомной массы, размера атома, электроотрицательности, энергии первой ионизации и металлического / неметаллического характера.
ВАЖНО:
Рекомендуется сначала начать с Главы 1. Почему? Большинство наших приключений будет в сериях (например, в главе 1 и главе 2). Истории опираются друг на друга. Это позволит продолжить увлечение уроком, продолжая творчески и весело закреплять материал по предмету.
Получить главу 1
⭐ Химия: Таблица Менделеева, гл. 1 | Выберите свой собственный класс приключений
1 | Выберите свой собственный класс приключений
Сопутствующие товары
⭐ Химия: Квест с периодической таблицей | Класс побега
⭐ Химия: Тайна таблицы Менделеева | Таинственный класс
******************************************* *******************************************
ПОЧЕМУ ПОЛУЧИТЬ 1 ПРОДУКТ, КОГДА У ВАС ЕСТЬ ВСЕ
** Полноценное членство в The Escape Classroom для всех продуктов (описание каждого продукта приведено ниже).Кроме того, любой новый продукт, созданный в рамках вашего 12-месячного членства.
The Escape Classroom
Учащиеся соревнуются с другими командами, чтобы покинуть класс до того, как часы обратятся к нулю. Один из наших суперзлодеев запер их в классе, но разместил в классе подсказки, чтобы они могли сбежать. Наши побеги разработаны в соответствии с конкретной учебной программой.
Тайный класс
Аноним выбрал ваших учеников, чтобы они помогли ему выяснить, какой из суперзлодеев «сделал это».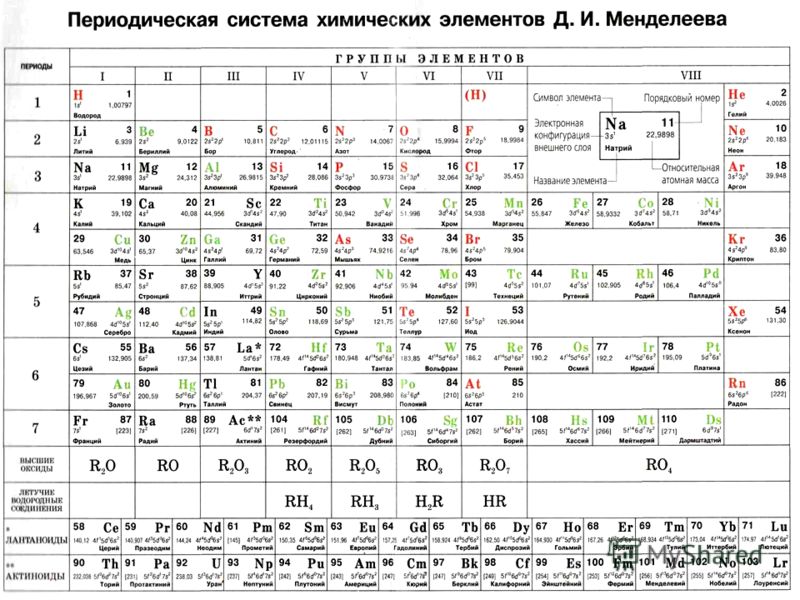 Они должны ответить на ряд вопросов, основанных на конкретной учебной программе, чтобы получить подсказки и свидетельства. После того, как они откроют все улики и свидетельства, они должны разгадать тайну и выяснить, «кто это сделал».
Они должны ответить на ряд вопросов, основанных на конкретной учебной программе, чтобы получить подсказки и свидетельства. После того, как они откроют все улики и свидетельства, они должны разгадать тайну и выяснить, «кто это сделал».
Класс «Приключения»
Учащиеся оказались внутри рассказа. Им придется выбрать собственное приключение. Чтобы завершить рассказ, учащиеся должны ответить на ряд вопросов, основанных на конкретной учебной программе. Каждое приключение рассказывается одним из наших суперзлодеев с высоким уровнем видеовзаимодействия.
The Hero Classroom
Студенты пополнили ряды Anonymous. Они будут участвовать в театральной истории, рассказанной с помощью текстов, видео, изображений, видеозвонков и телефонных звонков. Им придется придумать, как помочь нуждающемуся сбежать от одного из наших суперзлодеев. Студенты должны будут ответить на вопросы, основанные на конкретной учебной программе, чтобы успешно спасти положение и победить Суперзлодея…. или не.
Побеги по сбору средств от PTO
Наши побеги по сбору средств от PTO разработаны, чтобы увеличить посещаемость PTO и / или собрать деньги для вашей школы с помощью нашего формата театральной комнаты Escape Room.Родителям / детям придется покинуть школу. Этот Escape предназначен для одновременного размещения сотен человек.
*********************************************** ****************
ПОЧЕМУ ВЫБИРАЙТЕ ПРОДУКТЫ ESCAPE CLASSROOM
Мы могли бы вам сказать, но слушать рэп от наших суперзлодеев – это намного веселее.
Супер злодей Рэп
[PDF] Гл. 14 Периодическая таблица с
1 Название Период PRE-AP 14-1 Развитие Периодической таблицы Гл.14 Периодическая таблица с Дмитрием Менделеевым опубликован …
Наименование ____________________ Период ________PRE-AP
Ch. 14 – Периодическая таблица с. 390-406 14-1 Разработка Периодической таблицы
Дмитрий Менделеев опубликовал первую таблицу Менделеева в 1869 году.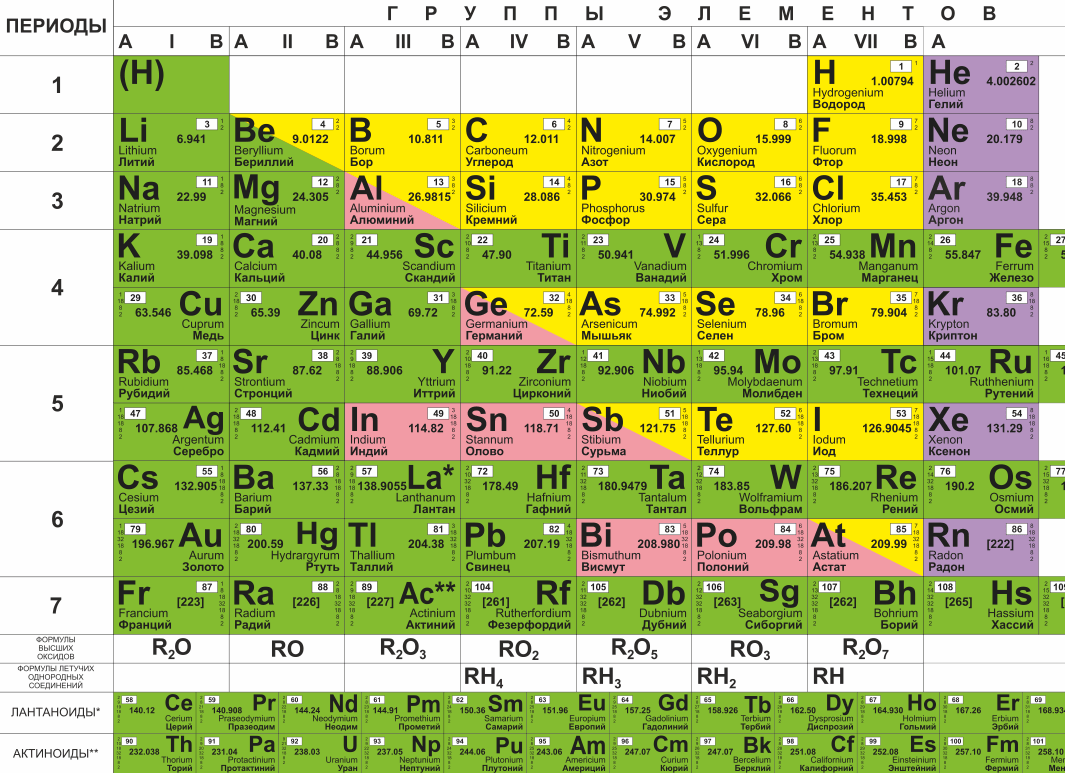 Он организовал элементы по атомной массе.
Он организовал элементы по атомной массе.
Он даже оставил отверстия для элементов, которые, по его словам, еще не были обнаружены. Одно из этих отверстий находилось ниже кремния. Он назвал этот элемент Экасиликон и предсказал его свойства.Позже был открыт германий, который был определен как экасиликон Менделеева. Сравните свойства, предсказанные Менделеевым, с фактическими свойствами германия с рис. 5-5 на стр. 162 вашего текста. В 1913 г. Мосли, работая в лаборатории Резерфорда, открыл способ определения атомного номера каждого элемента. Затем он улучшил периодическую таблицу Менделеева, реорганизовав ее по атомному номеру вместо атомной массы. 1 Глава 14 Примечания к Периодической таблице
Периодический закон гласит, что, когда элементы расположены в порядке возрастания атомного номера, их химические и физические свойства показывают периодическую структуру.Мы уже видели один пример этого закона в электронной конфигурации. 14-1. Чтение периодической таблицы. Группы или семейства – это вертикальные столбцы в периодической таблице. Периоды представляют собой горизонтальные ряды в периодической таблице. Рисунок 14-5 на стр. 395 показывает длинную форму таблицы Менделеева. Элементы всех групп «А» называются репрезентативными элементами. (Блок S&P) Элементы всех групп «B» называются переходными элементами. Элементы в двух нижних рядах (f-блок) являются внутренними переходными элементами.Рисунок 14.2 на стр. 392-393 идентифицирует некоторые имена групп и разделов. 2 Глава 14 Примечания к таблице Менделеева
Периоды представляют собой горизонтальные ряды в периодической таблице. Рисунок 14-5 на стр. 395 показывает длинную форму таблицы Менделеева. Элементы всех групп «А» называются репрезентативными элементами. (Блок S&P) Элементы всех групп «B» называются переходными элементами. Элементы в двух нижних рядах (f-блок) являются внутренними переходными элементами.Рисунок 14.2 на стр. 392-393 идентифицирует некоторые имена групп и разделов. 2 Глава 14 Примечания к таблице Менделеева
ВАМ НУЖНЫ ЦВЕТНЫЕ КАРАНДАШИ И НОВАЯ ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ДЛЯ ЭТОГО РАЗДЕЛА !!!!
Группы 1А называются щелочными металлами. (Примечание: водород – это отдельная группа.)
Группа 2А называется щелочноземельными металлами.
3 Глава 14 Примечания к таблице Менделеева
Группа 3A называется группой бора. Группа 4А называется углеродной группой. Группа 5А называется группой азота.Группа 6А называется кислородной группой. Группа 7А называется галогенами. (Галоген означает солеобразование. ) Группа 8А называется благородными газами.
) Группа 8А называется благородными газами.
Количество элементов группы A – это количество валентных электронов в атоме. Элементы в группе обладают схожими свойствами, потому что они имеют одинаковое количество и расположение валентных электронов. . Рисунок 14.2 на стр. 392-393 – периодическая таблица с фазами при комнатной температуре (20 oC) и металлическими свойствами. 4 Глава 14 Примечания к таблице Менделеева
Металлы – это элементы, которые имеют высокий блеск (выглядят блестящими), являются пластичными (можно расколоть листы), пластичными (можно протянуть в проволоку) и являются хорошими проводниками электричества и тепла.Почти все металлы находятся в твердом состоянии при комнатной температуре. Металлы находятся слева от зигзагообразной линии. Неметаллы – это элементы, которые имеют низкий блеск (выглядят тусклыми), НЕ являются пластичными или пластичными и плохо проводят тепло и электричество. Большинство неметаллов представляют собой газы при комнатной температуре, но некоторые из них являются твердыми телами, а один – жидкостью. Неметаллы находятся справа от зигзагообразной линии плюс водород. Полиметаллы (также известные как металлоиды) – это элементы, которые имеют некоторые характеристики как металлов, так и неметаллов. Полиметаллы находятся на зигзагообразной линии, за исключением алюминия и полония, которые оба являются металлами.
Неметаллы находятся справа от зигзагообразной линии плюс водород. Полиметаллы (также известные как металлоиды) – это элементы, которые имеют некоторые характеристики как металлов, так и неметаллов. Полиметаллы находятся на зигзагообразной линии, за исключением алюминия и полония, которые оба являются металлами.
5 Глава 14 Примечания к таблице Менделеева
14-2 Периодические тенденции ВАМ НУЖНЫ ЦВЕТНЫЕ КАРАНДАШИ И НОВАЯ ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ДЛЯ ЭТОГО РАЗДЕЛА !!!!
Периодические тренды – это свойства элементов, которые циклически изменяются предсказуемым образом по мере того, как вы перемещаетесь по таблице Менделеева.
Атомный радиус (он же размер атома) – это расстояние от центра ядра атома до самого дальнего электрона. Атомный радиус уменьшается по мере того, как вы перемещаетесь слева направо в любой период. Атомный радиус увеличивается по мере того, как вы опускаетесь в любой группе.Рис. 14-10 на стр. 401. Нисходящая тенденция возникает из-за того, что по мере движения вниз по группе вы увеличиваете главное квантовое число n. Чем больше n, тем больше размер орбиты. Горизонтальная тенденция возникает потому, что по мере того, как вы перемещаетесь слева направо в течение периода, вы увеличиваете количество протонов в ядре, что увеличивает положительный заряд ядра, который притягивает отрицательно заряженные электроны ближе к ядру, что уменьшает размер атом. 6 Глава 14 Примечания к таблице Менделеева
Чем больше n, тем больше размер орбиты. Горизонтальная тенденция возникает потому, что по мере того, как вы перемещаетесь слева направо в течение периода, вы увеличиваете количество протонов в ядре, что увеличивает положительный заряд ядра, который притягивает отрицательно заряженные электроны ближе к ядру, что уменьшает размер атом. 6 Глава 14 Примечания к таблице Менделеева
Ионные радиусы: часто каждый элемент может образовывать несколько различных ионов.Однако, как правило, чаще всего встречается ион с определенным зарядом. Список обычных зарядов ионов приведен ниже. Ионы группы 1A ____
Ионы группы 5A ____
Ионы группы 2A ____
Ионы группы 6A ____
Ионы группы 3A ____
Ионы группы 7A ____
Ионы группы 4A ____
Группа 8A – ____
Обратите внимание, что каждый атом приобретает или теряет электроны, так что он имеет электронную конфигурацию ближайшего благородного газа.. Это связано с тем, что конфигурация благородного газа очень стабильна, поскольку она имеет полный внешний подуровень s и p, также известный как стабильный октет. Размер этих общих ионов также периодичен. Посмотрите на рис. _______. Ионный размер увеличивается при движении вниз по группе и уменьшается при перемещении слева направо с прыжком вверх на 5А. Причины как нисходящей, так и горизонтальной тенденции те же, что и для атомного размера. Однако размер иона резко увеличивается из-за увеличения количества уровней энергии, которые он имеет.Сколько электронов у C4 +? ______ Какая у него конфигурация? _________________________ Сколько электронов у N3-? ______ Какая у него конфигурация? _________________________
Размер этих общих ионов также периодичен. Посмотрите на рис. _______. Ионный размер увеличивается при движении вниз по группе и уменьшается при перемещении слева направо с прыжком вверх на 5А. Причины как нисходящей, так и горизонтальной тенденции те же, что и для атомного размера. Однако размер иона резко увеличивается из-за увеличения количества уровней энергии, которые он имеет.Сколько электронов у C4 +? ______ Какая у него конфигурация? _________________________ Сколько электронов у N3-? ______ Какая у него конфигурация? _________________________
Плотность, точка плавления и точка кипения увеличиваются по мере того, как вы спускаетесь по группе. У них нет значительных тенденций слева направо. Металлы увеличивают реактивность по мере того, как вы спускаетесь по группе. Реактивность неметаллов увеличивается по мере того, как вы поднимаетесь по группе. Опять же, здесь нет существенных тенденций слева направо. Энергия ионизации: энергия ионизации – это энергия, необходимая для удаления электрона из атома. Помните, что единицей измерения энергии в системе СИ является джоуль (Дж). Единицей измерения большого числа атомов является моль, сокращенно моль. Таким образом, энергия ионизации измеряется в кДж / моль. 7 Глава 14 Примечания к таблице Менделеева
Помните, что единицей измерения энергии в системе СИ является джоуль (Дж). Единицей измерения большого числа атомов является моль, сокращенно моль. Таким образом, энергия ионизации измеряется в кДж / моль. 7 Глава 14 Примечания к таблице Менделеева
Энергия Li + -> Li + + e Вы можете думать об энергии ионизации как о том, насколько сильно атом удерживает свой крайний электрон. Энергия ионизации увеличивается при движении слева направо в любой период. Энергия ионизации уменьшается по мере того, как вы опускаетесь в любой группе. См. Рис. 14-13 стр. 403. Обратите внимание, что эти тенденции противоположны тенденциям размеров атомов.Чем больше притяжение между ядром и самым удаленным электроном, тем меньше будет атом и тем больше будет энергия ионизации.
Энергия, необходимая для удаления первого электрона, иногда называется энергией первой ионизации. Энергия удаления второго электрона является второй энергией ионизации. Li —> Li + + e-
Энергия первой ионизации = 521 кДж / моль
Li + —> Li2 + + e-
Энергия второй ионизации = 7,304 кДж / моль
Li2 + —> Li3 + + e –
Третья энергия ионизации = 11,752 кДж / моль
Посмотрите на рис. 14.12 на стр. 403. Обратите внимание на значительное увеличение энергии ионизации натрия от первой ко второй. Для магния большое увеличение составляет от второго до третьего. Как вы думаете, почему это так? Это снова идея стабильного октета или стабильной конфигурации благородного газа. Сродство к электрону – это изменение энергии, которое происходит, когда электрон присоединяется к атому. Ne + e- —> Ne-
14.12 на стр. 403. Обратите внимание на значительное увеличение энергии ионизации натрия от первой ко второй. Для магния большое увеличение составляет от второго до третьего. Как вы думаете, почему это так? Это снова идея стабильного октета или стабильной конфигурации благородного газа. Сродство к электрону – это изменение энергии, которое происходит, когда электрон присоединяется к атому. Ne + e- —> Ne-
Сродство к электрону = 29 кДж / моль
Положительное сродство к электрону означает, что атому нужно было добавить количество энергии, чтобы он забрал электрон.Отрицательное сродство к электрону означает, что количество энергии было отдано атомом при добавлении электрона. F + e- -> F-
Сродство к электрону = -328 кДж / моль
Сродство к электрону можно представить как степень притяжения атома к дополнительному электрону. Помните, что отрицательное сродство к электрону означает, что атом имеет большее притяжение, чем положительное. 8 Глава 14 Примечания к таблице Менделеева
В общем, металлы имеют положительное (низкое) сродство к электрону, а неметаллы – отрицательное (высокое) сродство к электрону. Опять же, эта тенденция относится к правилу стабильных октетов.
Опять же, эта тенденция относится к правилу стабильных октетов.
Электроотрицательность – это притяжение атома к электронам в связи. Электроотрицательность возрастает при движении слева направо в любой период. Электроотрицательность уменьшается по мере того, как вы опускаетесь в любой группе. См. Рисунок 14.2 на стр. 405.
9 Глава 14 Примечания к периодической таблице
Периодическая таблица kahoot | Научная обучающая игра
Верно, таблица Менделеева мания . Метко названная JenKrug «Мания по атомной структуре и периодической таблице» делает изучение химии увлекательным – вот как…
1.Формулировка вопроса критическая!
В этой удивительной Периодической таблице приведены вопросы, которые звучат почти одинаково, но на самом деле это не так. Насколько хорошо ваши студенты-химики обращали внимание? Могут ли они вспомнить, какая таблица Менделеева была основана на атомном n umber , а какая на атомном m ass ?
ОСНОВНОЙ СОВЕТ: подобные вопросы – это небольшая изящная подсказка, позволяющая остановить и освежить знания учащихся об атомной массе и атомном числе, а также о значении самой структуры Периодической таблицы.
2. Разумное использование специальных символов и форматирования
Хорошо, поэтому мы должны признать, что мы не создавали нашу «сборщицу символов» с электронным расположением в голове… так что видеть, как этот учитель химии использует стрелки в ответах, было приятным маленьким сюрпризом!
ПОЛЕЗНЫЙ СОВЕТ. Для любителей математики и естествознания вам понравятся средства выбора символов и форматирования! Щелкните любую текстовую область, и вы сможете добавлять надстрочные и подстрочные индексы, специальные символы и иностранные символы.
3. Примеры повседневной химии
Из-за сложных обозначений и всех этих разговоров о субатомных частицах некоторым студентам может быть очень трудно разобраться в химии – это просто нереально. Один из лучших приемов – по возможности возвращать это к примерам из реальной жизни.
Например, вы можете сделать термодинамику более доступной, просто поговорив с классом (на простом английском!) О том, что на самом деле происходит на субатомном уровне, когда ваша чашка кофе остывает.Этот Kahoot! ‘Er использовал простой вопрос о повседневных химических смесях, чтобы сделать основы химии немного более осязаемыми.
Главный совет по адаптации этого кахута: разбейте его!
Нам очень нравится этот кахут, и наш химик-резидент утверждает, что за одну игру она узнала о Периодической таблице больше, чем за весь первый год обучения в университете. Но … он очень длинный, а (в зависимости от того, как он используется) может быть подвержен риску давления или отстранения, а не радости и активного обучения.Нам бы очень хотелось, чтобы такие кахуты были разбиты на три-четыре небольших игры.
Создавая кахуты, думайте о каждый вопрос как о возможности чему-то научиться. Каждый вопрос дает учащимся возможность освежить свое понимание, преподаватель выявить пробелы в знаниях, класс обсудить, почему они ответили определенным образом, и даже снова пройтись по основам определенного предмета. .
Когда кахуты длиннее 10–15 вопросов, и вы действительно используете каждый вопрос как возможность для обучения, каждый начинает чувствовать небольшое давление, заставляющее спешить. Вместо этого создавайте короткие и целенаправленные кахуты с некоторой передышкой, и кахуты будут веселее и эффективнее.
Ваш вызов!
Во-первых, вернитесь к созданным вами кахутам и найдите тот, который, по вашему мнению, слишком длинный. Или, если у вас нет своего собственного, вы можете найти действительно длинный, но в остальном красиво оформленный кахут по своей любимой теме – вы можете использовать наши списки тенденций в качестве ярлыка или использовать необычные ключевые слова в поиске найти что-нибудь крутое.
А теперь создайте идеальный маленький кахут series на основе этого длинного кахута. Используя в качестве примера кахут из таблицы Менделеева, вот как можно разбить кахут из 32 вопросов на 4 кахута размером с укус:
1. Дублируйте один и тот же кахут 4 раза.
2. Измените название каждого дубликата, чтобы вы и другие сотрудники Kahoot! Позже узнали их как часть серии, например Периодическая таблица, часть 1.
3. Отредактируйте первый кахут, удалив все, кроме первых 8 вопросов, и сохраните.
4. Отредактируйте второй кахут, удалив первые 8 вопросов и последние 16 вопросов и сохраните.
5. И повторяйте, пока у вас не получится 4 кахута без пересекающихся вопросов. Теперь у вас есть серия Периодической таблицы.
Было ли это полезно?
Напишите нам в Твиттере @GetKahoot или загляните в Kahoot! Сообщество Facebook, чтобы сообщить нам, какие еще кахуты вы хотите, чтобы мы рассмотрели или представили!
Периодическая классификация элементов Класс 10 Примечания Наука Глава 5
Примечания CBSE Примечания CBSE Наука Решения NCERT Наука
CBSE Научные заметки 10-го класса, глава 5, Периодическая классификация элементов. Бесплатная загрузка в формате PDF является частью Научных заметок 10-го класса для быстрой проверки.Здесь мы привели NCERT Class 10 Science Notes Глава 5 Периодическая классификация элементов.
В соответствии с новым шаблоном экзамена CBSE, вопросы MCQ для класса 10 по естествознанию pdf оцениваются в 20 баллов.
CBSE Class 10 Science Notes Глава 5 Периодическая классификация элементов
«Периодическая таблица – это табличный метод отображения элементов таким образом, чтобы элементы, имеющие аналогичные свойства, располагались в одном вертикальном столбце или группе».
Ранние попытки классификации элементов: Триады Доберейнера, закон октав Ньюленда.
Триады Доберейнера: Эта классификация основана на атомной массе. В соответствии с этим, когда элементы расположены в порядке возрастания атомных масс, получаются группы из трех элементов, обладающих схожими свойствами. Атомная масса среднего элемента триады почти равна средней атомной массе двух других элементов.
Например, Li (6,9), Na (23), K (39).
Ограничение: не удается расположить все известные элементы в виде триад, даже имеющих схожие свойства.
Закон октав Ньюленда: Согласно этому «когда элементы размещаются в порядке возрастания атомных масс, физические и химические свойства каждого восьмого элемента повторяют свойства первого элемента».
Форма октав Ньюленда дана в следующей таблице:
Ограничения
- Закон октав применим только к кальцию (только к более легким элементам).
- Newland установила два элемента в одном слоте (например,грамм. Co и Ni), обладающие разными свойствами. Например; Co и Ni с фтором, хлором, бромом и йодом.
- Согласно Ньюленду, в природе существует только 56 элементов, и в будущем никаких элементов не будет обнаружено.
Современные попытки классификации элементов: Периодическая таблица Менделеева, Современная Периодическая таблица.
Периодическая таблица Менделеева: Периодическая таблица Менделеева основана на физических и химических свойствах элементов и их атомных масс.
Периодический закон Менделеева: Согласно этому закону «Физические и химические свойства элементов являются периодической функцией их атомных масс».
Периодичность свойств : Повторение свойств элементов через определенные регулярные интервалы известно как периодичность свойств.
Достоинства Периодической таблицы Менделеева
- Менделеев оставил вакантные места в своей таблице, что дало идею для открытия новых элементов.Пример: Эка-бор, Эка-алюминий и Эка-кремний.
- В периодической таблице Менделеева были предсказаны свойства нескольких неоткрытых элементов на основе их положения в периодической таблице Менделеева.
- Это полезно для корректировки сомнительных атомных масс некоторых элементов.
- Благородные газы могли поместиться в периодической таблице Менделеева, не нарушая ее после открытия.
Ограничения Периодической таблицы Менделеева
(a) Нет фиксированного положения для водорода: Не было правильного положения атома водорода в периодической таблице Менделеева.
Пример: положение водорода с щелочными металлами и галогенами (17-я группа).
(b) Нет места для изотопов: положение изотопов не определено.
Пример: Cl-35 и Cl-37.
(c) Нет регулярной тенденции в изменении атомной массы: положение некоторых элементов с более низкой атомной массой раньше с более высокой атомной массой.
Пример: Ni-58,7 перед Co-58,9.
Исходная таблица Менделеева воспроизведена в таблице ниже
Современная периодическая таблица: В 1913 году Генри Мозли показал, что атомный номер элемента является более фундаментальным свойством, чем его атомная масса.
Современный период закона: Физические и химические свойства элементов являются периодической функцией их атомного номера.
Современная таблица Менделеева основана на атомном числе элементов.
Атомный номер (Z) равен количеству протонов, присутствующих в ядре атома элемента.
Современная таблица Менделеева содержит 18 вертикальных столбцов, известных как группы, и семь горизонтальных рядов, известных как периоды.
При перемещении слева направо по периоду количество валентных электронов в присутствующих элементах увеличивается с 1 до 8.
При движении слева направо в периоде номер снаряда остается прежним.
Все элементы группы периодической таблицы имеют одинаковое количество валентных электронов.
Тенденции в современной периодической таблице: валентность , размер атома, металлические и неметаллические символы и электроотрицательность.
(i) Валентность: Валентность элемента определяется количеством валентных электронов, присутствующих во внешней оболочке его атома (т.е. объединяющая способность элемента известна как его валентность).
In Period: При движении слева направо в периоде валентность сначала увеличивается с 1 до 4, а затем уменьшается до нуля (0).
В группах: При движении сверху вниз в группе валентность остается той же, потому что количество валентных электронов остается неизменным.
Пример: Валентность элементов первой группы = 1 Валентность элементов второй группы = 2.
(ii) Размер атома: Размер атома относится к радиусу атома. Это расстояние между центром ядра и внешней оболочкой изолированного атома. (iii) Металлический характер: это тенденция атома терять электроны. В периоде: вдоль периода слева направо металлические символы уменьшаются, потому что тенденция к потере электронов уменьшается из-за увеличения заряда ядра. Пример: Металлический характер элементов второго периода: Li> Be> B> C >> N> O> F (iv) Неметаллический характер: Это тенденция атома накапливать электроны. (v) Химическая реакционная способность (vi) Электроотрицательность: Это тенденция элемента притягивать к себе общую пару электронов в ковалентно связанной молекуле.Он увеличивается с увеличением заряда ядра или уменьшением размера атома. (vii) Природа оксидов: Оксиды металлов имеют основную природу. Бывший. Na2O, MgO и т. Д. В случае реакционной способности металла она увеличивается вниз по группе из-за увеличения тенденции к потере электронов. В случае неметаллической реакционной способности снижается по группе из-за уменьшения тенденции к получению электронов. Группа: Вертикальные столбцы в таблице Менделеева, а также в современной периодической таблице называются группами. Период: Горизонтальные ряды в современной периодической таблице и в таблице Менделеева называются периодами. В современной периодической таблице 18 групп и 7 (семь) периодов. Размер атома: Размер атома можно представить как расстояние между центром ядра и внешней оболочкой изолированного атома. Тенденция изменения размера (радиуса) атома в группе вниз: Продолжая движение вниз в группе Периодической таблицы, размер атома увеличивается, потому что на каждом шаге к атомам добавляется новая оболочка электронов. Увеличивается расстояние между электронами внешней оболочки и ядром атома. Тенденция изменения размера (радиуса) атома слева направо за период: При перемещении слева направо по периоду размер атомов уменьшается, поскольку при перемещении слева направо атомное число элементов увеличивается это означает, что количество протонов и электронов в атомах увеличивается.Из-за большого положительного заряда ядра электроны притягиваются ближе к ядру, и размер атома уменьшается. Характеристики триад J.W. Доберейнер. Пример: атомная масса Na равна 23 в триаде Li, Na и K. Эта атомная масса представляет собой среднее значение атомных масс Li и K, которые имеют атомные массы 7 и 39 соответственно. Триады, созданные Доберейнером. 2-я триада 3-я триада Периодический закон Менделеева: Он гласит, что «свойства элементов являются периодическими функциями их атомных масс.Это означает, что свойства элементов зависят от их атомных масс, и элементам присваивается положение в периодической таблице на основе их возрастающих атомных масс. Достоинства Периодической таблицы Менделеева (ii) Он дал правильное положение благородным газам, которые были обнаружены позже, не нарушая существующий порядок элементов. Он поместил их в новую группу. Ограничения классификации Менделеева: Современный периодический закон: Этот закон был предложен Генри Мозли, ученым в 1913 году.Согласно этому Закону «Свойства элементов являются периодической функцией их атомного номера». Это означает, что свойства элементов зависят от их атомных номеров, и элементам даны позиции в периодической таблице на основе их возрастающих атомных номеров. Поскольку атомный номер определяет распределение электронов по орбитам, а электроны самой внешней орбиты определяют свойства элемента. Группы и периоды в современной (длинной форме) Периодической таблице: Есть 18 групп (вертикальные столбцы) и 7 периодов (горизонтальные линии) в современной (или длинной форме) Периодической таблице.Номер периода равен количеству оболочек в атомах элементов, принадлежащих этому периоду. Тенденции в Периодической таблице Менделеева Тенденции в современной периодической таблице (ii) Размер атома или радиус атома увеличивается: при движении вниз в группе и уменьшается при перемещении слева направо за период. Размер атома увеличивается вниз по группе из-за увеличения количества оболочек. Размер атома уменьшается с течением времени из-за увеличения заряда ядра, который притягивает электроны ближе к ядру и уменьшает размер атома. (iii) Металлические и неметаллические свойства: В современной периодической таблице металлы находятся на левой стороне, а неметаллы – на правой стороне таблицы. Зигзагообразная линия металлоидов отделяет металлы от неметаллов. 1. Необходимость классификации элементов: 2. Триады Доберейнера: (ii) Примеры триад: 3.Закон октав Ньюлендса: (ii) Таблица, показывающая октавы Ньюлендса: 4. Периодическая таблица Менделеева: Дмитрий Иванович – 5 ‘Менделеев, русский демист, внес самый важный вклад в раннюю разработку периодической таблицы элементов, в которой элементы были расположены на основе их атомной массы и химического состава. характеристики. 5. Периодическая таблица модема: Генри Мозли, дал новую! свойство элементов, «атомный номер», и я принял его за основу современной периодической таблицы. (iii) Таблица, показывающая электронную конфигурацию первых 20 элементов: Металлические и неметаллические свойства: Мы надеемся, что данная бесплатная загрузка CBSE Class 10 Science Notes Chapter 5 Periodic Classification of Elements Pdf поможет вам. Если у вас есть какие-либо вопросы относительно NCERT Class 10 Science Notes Глава 5 Периодическая классификация элементов, оставьте комментарий ниже, и мы свяжемся с вами в ближайшее время. Таблица элементов в 2369 Периодическая таблица в 1953 году Периодическая таблица , также известная как Таблица элементов или элементная таблица , была средством группировки химических элементов. Федерации были известны несколько периодических таблиц, хотя элементы, неизвестные ни одной из них, все еще существовали. (TAS: «Одна из наших планет отсутствует»). Используя таблицу, многие элементы имеют общий атомный вес или символ, а некоторые даже имеют несколько атомных весов или символов и перечислены дважды. У Бенни Рассела в 1953 году на стене кухни висела таблица Менделеева. (DS9: «Вдали от звезд») 23 октября 2032 года лейтенант Джон Келли записал, что после анализа содержимого гравитонного эллипса необходимо освободить место в таблице Менделеева. (VOY: “Один маленький шаг”) В 2269 году Спок заявил, что облако материи-энергии содержит « элементов, не известных в наших периодических таблицах ». (ТАС: «Одна из наших планет отсутствует») Таблицу элементов видели в классе на борту USS Enterprise -D (TNG: «Мошенники»), а также в классе на Променаде Deep Space 9.(DS9: “Кардассианцы”) В 3189 году прапорщик Сильвия Тилли обнаружила в поселении на планете минералы, которых не было в таблице элементов. (DIS: “Вдали от дома”) Таблица элементов на станции Deep Space 9 Эта таблица появилась в TNG: «Мошенники». В нем много шуток и ошибок, а также отсутствуют некоторые ключевые элементы. Элементы также сортируются по «атомному весу», а атомный вес известных элементов отличается от их фактического атомного веса.Также интересно отметить, что размер самого атома (как видно на окудаграмме Таблицы элементов) не влияет на атомный вес. Это можно увидеть с помощью элемента poi, самого тяжелого элемента, и что его физический атомный размер намного меньше, чем у элемента «ястребиный глаз», который намного легче с точки зрения атомного веса. Стол из «Мошенников» позже использовался для сцен в классе на Star Trek: Deep Space Nine . Однако по крайней мере в одном случае в эпизоде «Кардассианцы» (см. Изображение справа) таблица имела другой цветовой код.Неизвестно, была ли эта таблица также помечена другими элементами, чем те, что видели в «Мошенниках». Другая версия таблицы Менделеева может быть найдена в Медицинском справочном руководстве Звездного Флота , которое лишено «шуток», которые можно найти в версии Next Generation . Это периодическая таблица, используемая сегодня, со ссылками на реальные элементы, упомянутые в Star Trek :
Период: При движении слева направо в периоде размер атома уменьшается, потому что увеличивается заряд ядра.
Пример: размер элементов второго периода: Li> Be> B> C> N> O> F
Полезная информация: атомный размер благородных газов в соответствующий период является самым большим
из-за наличия полностью заполненной электронной конфигурации (т.е. октет).
В группе: Размер атома увеличивается вниз по группе, потому что добавляются новые оболочки
, несмотря на увеличение ядерного заряда.
Пример; Атомный размер элемента первой группы: Li
In Group: Металлический характер, при движении сверху вниз увеличивается, потому что размер атома и тенденция к потере электронов увеличивается.
Пример: элемент первой группы: Li
Элементы 17-й группы: F
In Period: В период слева направо неметаллический характер увеличивается, потому что тенденция к получению электронов увеличивается из-за увеличения заряда ядра. Пример ; Неметаллический характер элементов 2-го периода: Li
В металлах: Химическая реакционная способность металлов увеличивается вниз по группе, потому что возрастает тенденция к потере электронов. Пример ; Li
По мере увеличения периода электроотрицательность. Пример: Li
F> Cl> Br> I
Оксиды неметаллов имеют кислотную природу. Бывший. Cl2O7, SO3, P2O5,
1-я триада
Li – Литий
Na – Натрий
K – Калий
Ca – Кальций
Sr – Стронций
Ba – Барий
Cl – Хлор
Br – Бром
I – Йод
(i) Менделеев оставил в своей таблице ряд пробелов для размещения новых элементов, которые будут обнаружены позже. Так что Менделеев смело предсказал существование еще каких-то элементов. Он даже предсказал свойства некоторых из этих элементов и назвал их Эка-бор, Эка-алюминий и Эка-кремний соответственно.Позже были обнаружены элементы, например, галлий заменил эка-алюминий и показал свойства, аналогичные свойствам алюминия.
(i) Валентность: Элементы, принадлежащие к одной группе, имеют одинаковое количество валентных электронов и, следовательно, одинаковую валентность. Валентность в определенный период слева направо сначала увеличивается как положительная валентность, а затем уменьшается как отрицательная валентность.
Пример: В элементах 2-го периода:
Li имеет валентность 1 + , затем Be 2+ , B 3+ , C 4+ ковалентность, N 3- валентность, затем O 2- и F (-) валентность.
Увеличение количества открытий различных элементов затруднило систематизацию всего, что было известно об элементах. Чтобы с легкостью изучить большое количество элементов, были предприняты разные попытки. Попытки привели к классификации элементов на металлы и неметаллы.
Иоганн Вольфганг Доберейнер, немецкий химик, классифицировал известные элементы на группы по три элемента на основе сходства в их свойствах.Эти группы были названы триадами.
(i) Характеристики триад:
(iii) Ограничения: Доберейнер смог выделить только три триады. Он не смог подготовить триады из всех известных элементов.
Английский ученый Джон Ньюлендс расположил известные элементы в порядке возрастания атомных масс и назвал его «Законом октав». Он известен как «закон октав Ньюлендса».
(i) Характеристики закона октав Ньюлендса:
(iii) Ограничения закона октав Ньюлендса:
Он предсказал существование некоторых элементов, которые в то время не были обнаружены. Его предсказания полностью оправдались, поскольку позже были открыты такие элементы, как скандий, галлий и германий.
(i) Периодический закон модема: Свойства элементов являются периодической функцией i их атомного номера.
(ii) Положение элементов в периодической таблице модема:
Тенденции в современной периодической таблице: Примечания NCERT для науки 10 класса
Таблица Менделеева | Память Alpha
Таблица элементов
По атомной массе
Справочная информация
Группа →
Период ↓ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 1
H 2
He 2 3
Ли 4
Be 5
B 6
С 7
N 8
O 9
Ф 10
Ne 3 11
Na 12
мг 13
Al 14
Si 15
п 16
S 17
Класс 18
Ар 4 19
К 20
Ca 21
SC 22
Ti 23
В 24
Cr 25
Mn 26
Fe 27
Co 28
Ni 29
Cu 30
Zn 31
Ga 32
Ge 33
Как 34
SE 35
Br 36
Kr 5 37
руб. 38
Sr 39
Y 40
Zr 41
Nb 42
Пн 43
Tc 44
Ру 45
Rh 46
Pd 47
Ag 48
КД 49
В 50
Sn 51
Сб 52
Te 53
I 54
Xe 6 55
CS 56
Ba * 72
Hf 73
Ta 74
Вт 75
Re 76
Ос 77
Ir 78
Pt 79
Au 80
Hg 81
Тл 82
Pb 83
Bi 84
Po 85
при 86
Rn 7 87
Fr 88
Ra **
104
Rf 105
Db 106
Sg 107
Bh 108
HS 109
Mt 110
DS 111
Rg 112
Cn 113
Nh 114
Fl 115
Mc 116
Ур. 117
Ц 118
Og * Лантаноиды 57
La 58
CE 59
Pr 60
Nd 61
PM 62
см 63
Eu 64
Gd 65
ТБ 66
Dy 67
Ho 68
Er 69
ТМ 70
Yb 71
Лю ** Актиниды 89
Ас 90
Чт 91
Па 92
U 93
НП 94
Pu 95
Am 96
см 97
Bk 98
Cf 99
Es 100
FM 101
Md 102
№ 103
Lr Щелочные металлы Щелочноземельные металлы лантаноидов Актиниды Переходные металлы Бедные металлы Металлоиды Неметаллы галогены Благородные газы Внешняя ссылка
.

 )
)

 – 176 с.:ил.
– 176 с.:ил.