Чему соответствует номер группы в Периодической системе химических элементов Д. И.
Дайте визначення класам речовин, що є електролітами
ca3(po4)2+…=caso4↓+…
ПОМОГИТЕ СРОЧНО ЗАПОЛНИТЬ ТАБЛИЦУ, ССЫЛКИ ВИДЕО С ПОМОЩЬЮ КОТОРЫХ НУЖНО ЕЁ ЗАПОЛНИТЬ НА СКРИНЛОТЕ НАХОДЯТСЯ СНИЗУ
алюміній бромід це сіль?
Обчисліть відносні молекулярні маси таких речовин: СаСl2, С3Н7ОН, (Nh5)3PO4Срочно
17. В эксперименте по изучению фотосинтеза в лаборатории образовалось 2,7 л кислорода (н.у.).
В ответе должны быть указаны:
17.1. Сумма коэффициентов
… в уравнении реакции.
17.2. Масса образовавшейся глюкозы в граммах (округлить до десятых).
17.3. Относительная плотность другого (не кислорода) газа-участника реакции по кислороду при н.у.
17.4. Общераспространенное название вещества, выполняющего функцию катализатора в данном процессе.
18. Соединение, содержащее по массе 24,7% кальция; 14,8% углерода; 59,3% кислорода и 1,2% водорода, обработали 500 г соляной кислоты (ω HCl = 43,8%).

В заданиях 13-16 установите правильную последовательность. Запишите в таблицу номера выбранных ответов (без пробелов и других символов).
13. Расположи
… те вещества в порядке уменьшения степени окисления выделенного элемента:
1) ZnS
2) CaCO3
3) K2FeO4
4) Cl2O
5)Nh5NO3
6) KMnO4
14. Расположите элементы в порядке увеличения радиусов их атомов:
1) рубидий
2) литий
3) калий
4) водород
5) цезий
6) натрий
15. Расположите газы в порядке уменьшения их относительной плотности по гелию (н.у.):
1) кислород
2) озон
3) криптон
4) угарный газ
5) сернистый газ
6) метан
16. Расположите по порядку следования коэффициенты в уравнении окислительно-восстановительной реакции (цифры могут повторяться):
K2SO3 + K2CrO4 + h3O → Cr(OH)3 + K2SO4 + KOH
Ответ запишите в виде перечисления коэффициентов-цифр.
В предложенном списке отметьте правильное утверждение: при диссоциации оснований образуются анионы металлов при диссоциации кислот образуются катионы … гидрогена при диссоциации оснований образуются анионы металла и катионы кислотного остатка при диссоциации кислот образуются катионы кислотного остатка
в атомі хімічного елемента електрони розподілені по енергетичних рівнях так : 2, 8, 6. Визначте місце цього елемента в періодичній системі: склад і ха … рактер його вищого оксиду та гідроксиду; склад летткої сполуки з Гідрогеном, якщо цей елемент утворює
помогите пожалуйста!!!
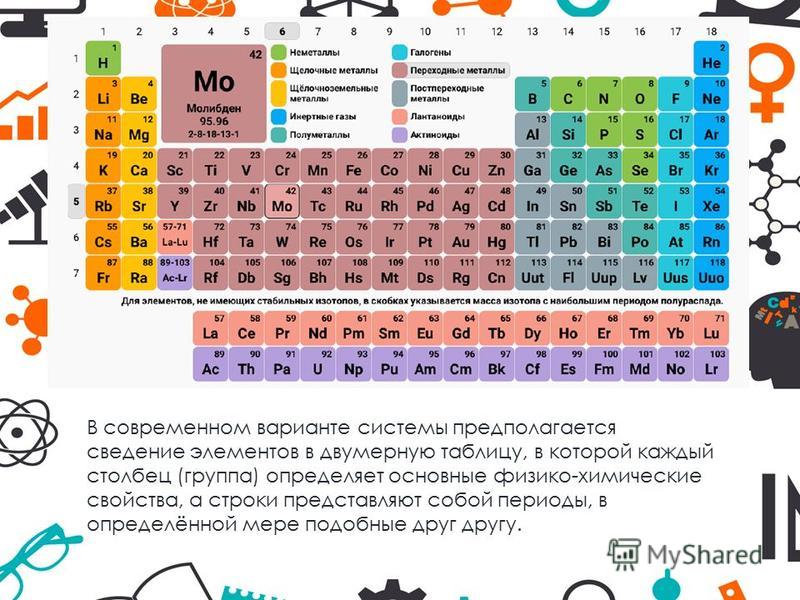
Периодический закон и периодическая система элементов Д.И. Менделеева
«Периодический закони Периодическая система
элементов Д.И. Менделеева»
После открытия строения атома
Периодический закон имеет следующий вид:
Свойства элементов, простых веществ и их
соединений находятся в периодической
зависимости от величины заряда ядер их атомов.

Периодическая зависимость – результат периодического
повторения электронных конфигураций внешнего
энергетического уровня.
В таблице все элементы расположены в порядке возрастания их
порядкового номера.
Порядковый номер элемента в таблице Менделеева
соответствует числу протонов, заряду ядра
и общему количеству электронов в атоме.
ПЕРИОДЫ
В таблице Менделеева находится 7 периодов, которые
расположены по горизонтали. Периоды делятся на малые и
большие. Малые периоды имеют один ряд (1-3 периоды).
Большие периоды имеют два ряда (4-6 периоды). 7-ой период
называется незавершённым, он содержит один ряд.
Номер периода и ряда обозначают арабскими цифрами.
энергетических уровней в атоме, которые
заполняются электронами.
ГРУППЫ
В таблице Менделеева по вертикали элементы
расположены в группах. Таких групп восемь.
Группы обозначают римскими цифрами (I – VIII).

Группы делятся на подгруппы:
главные (а) и побочные (б).
На внешнем энергетическом уровне атомов не
может находиться более восьми электронов.
Номер группы соответствует числу
электронов на внешнем уровне
(для элементов главных подгрупп).
НАПРИМЕР:
Кислород (О) находится в VI (шестой) группе
(главная подгруппа) и, следовательно, имеет 6
Это подтверждает электронная формула кислорода:
1s22s22р4 – на втором (внешнем) энергетическом
уровне находятся 6 электронов.
Все d- и f- элементы – металлы!
Металлы – это элементы, которые обладают
высокими металлическими свойствами, т.е. их атомы
способны отдавать свои электроны.
Металлы имеют низкие значения энергии ионизации.
Энергия ионизации – это энергия, необходимая
для отрыва наиболее слабо связанного электрона от
атома.
Неметаллические свойства – это способность
атома принимать электроны от других атомов
(высокая электроотрицательность).

Уменьшение радиуса атомов в периоде объясняется тем,
что увеличивается заряд ядра и количество электронов на
внешнем уровне, и, следовательно, возрастает притяжение
электронной оболочки к ядру.
Энергетические уровни
Энергетические уровни (слои) электронов в атоме:
У орбиталей, кстати, тоже есть и своя энергия. И если несколько орбиталей имеют равную или близкую энергию, то они образуют свой энергетический слой (уровень). Подобно облакам вокруг планеты, которые могут быть на разной высоте и образовывать разные слои.
Каждый энергетический уровень обозначен за n, от единицы и выше (n = 1, n = 2, n = 3,…). Либо в буквах, тогда первый уровень 1 = K, второй 2 = L, третий 3 = M и далее по латинскому алфавиту.
Например, натрий можно изобразить так:
На одном энергетическом уровне (слое) n может находиться n2 орбиталей, больше просто не влезет в слой. Т.е. на 1-м уровне 1 орбиталь, на втором 4 орбитали, на третьем, 9 и т.д. А в каждой орбитали, как вы помните, может быть по 2 электрона, значит максимальное количество электронов на электронном уровне атома: N = 2n2
на 1-м уровне 1 орбиталь, на втором 4 орбитали, на третьем, 9 и т.д. А в каждой орбитали, как вы помните, может быть по 2 электрона, значит максимальное количество электронов на электронном уровне атома: N = 2n2
Значит, уровень 1 имеет 2 электрона, уровень 2 – 8 электронов, уровень 3 – 18 и т.д.
Логично, что первые электроны занимают сначала первый уровень, потом, весь второй, третий и т.д. И снова нам помогает таблица Менделеева, ведь номер периода (строки) соответствует количеству энергетических уровней в элементе.
Например, только у гелия и водорода всего 1 энергетический уровень, причем в гелии он максимально заполнен электронами (на первом уровне их же всего 2).
Во втором ряду как раз 8 элементов, что логично, ведь на втором уровне может быть всего 8 электронов 2n2 = 2*22 = 8
На третьем уровне элементов тоже почему-то 8? Здесь фишка в том, что на внешнем уровне не может быть более 8 электронов. И хотя на третьем уровне может быть максимум 18 электронов 2*3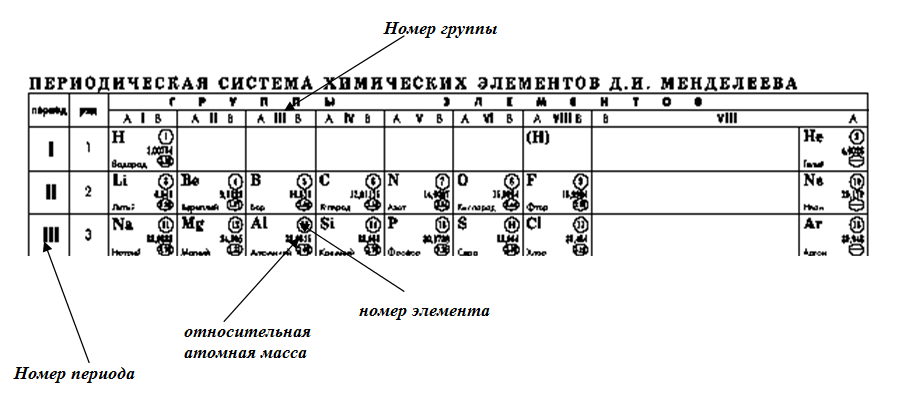
Ничего страшного, все компенсируется на 4-м уровне, где целых 18 элементов.
В периодической таблице также подписаны все электроны на каждом уровне. Посмотрите, там очень мелко в каждой клетке элементов.
Редактировать этот урок и/или добавить задание Добавить свой урок и/или заданиеДобавить интересную новость
Периодический Стол
В предыдущем разделе периодический
Таблица была представлена как список элементов. Мы также отметили, что
конструкция периодической таблицы отделяет металлы от неметаллов. В этом
В разделе мы покажем, как различные характеристики таблицы связаны с электронным
конфигурацию различных элементов и их положение в таблице.
Сначала позвольте нам указать на эти особенности, используя полную таблицу Менделеева.
на рисунке 5.10. В таблице элементы расположены в строках и столбцах
разной длины. Семь строк используются для отображения всех известных в настоящее время элементов.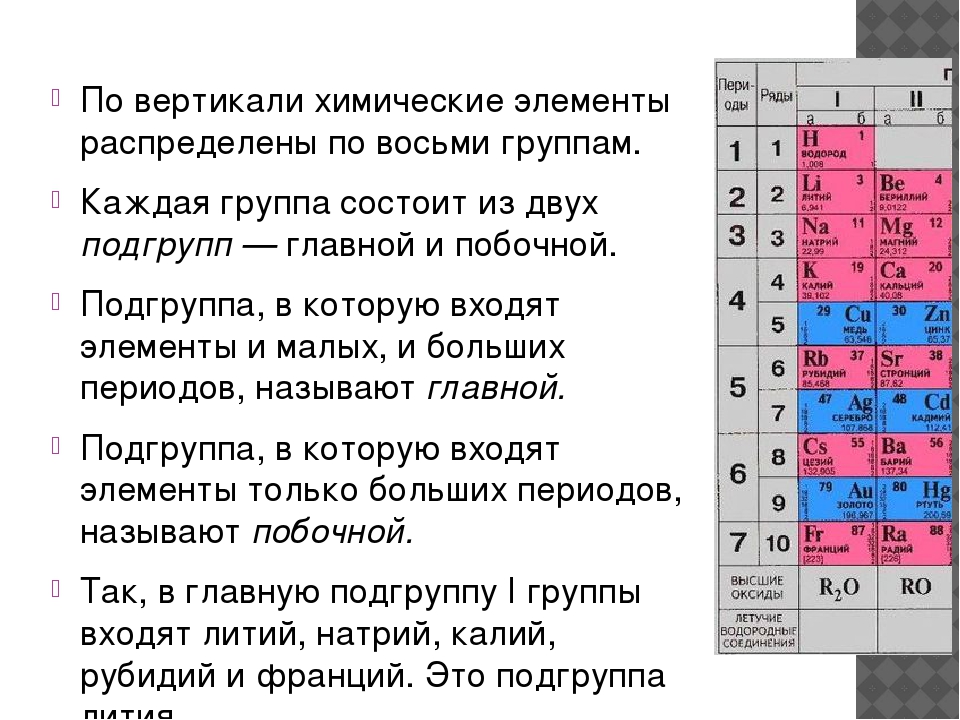
| РИСУНОК 5.10 Периодическая таблица элементов. |
Элементы в столбце составляют семейство элементов. Семья также известна как группа.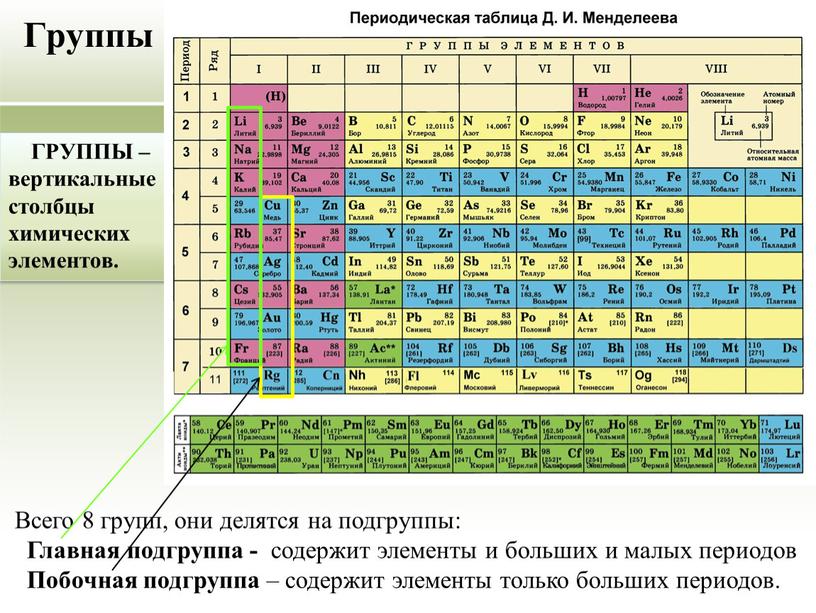 Таким образом, элементы в столбце 8 известны как семейство или группа благородных газов.
Таким образом, элементы в столбце 8 известны как семейство или группа благородных газов.
A. Электронная конфигурация и периодичность
Стол
На рис. 5.11 снова показана таблица Менделеева, но без символов элементов.
Вместо этого он показывает последние заполненные подуровни, описывающие электронные конфигурации.
элементов в каждом разделе.Мы будем использовать рисунок 5.11 и рисунок.
5.8, чтобы связать электронную конфигурацию элемента с его положением в
периодическая таблица.
| РИСУНОК 5.11 Периодическая таблица и подоболочки уровней энергии. |
| РИСУНОК 5.8 Основные энергетические уровни атома и подуровни и орбитали каждый содержит. Стрелки показывают порядок, в котором подуровни заполняются. |
В периоде 1 есть две коробки. В обычной таблице эти квадраты будут содержать символы для водорода и гелия, элементов этого периода. На рисунке 5.11 вместо этого мы показываем букву s, указывающую, что последний добавленный электрон для элементов в этих ячейках находится на подуровне 1s. Во втором периоде есть восемь ящиков. Вместо символов для восьми элементов на рис. 5.11 показаны s в первых двух прямоугольниках и p в последних шести прямоугольниках, показывая, что подуровни 2s и 2p заполняются по мере завершения электронных конфигураций элементов в этих прямоугольниках.В периоде 3 также есть восемь ящиков, которые соответствуют электронам, необходимым для заполнения подуровней 3s и 3p.
На рисунке 5.11 вместо этого мы показываем букву s, указывающую, что последний добавленный электрон для элементов в этих ячейках находится на подуровне 1s. Во втором периоде есть восемь ящиков. Вместо символов для восьми элементов на рис. 5.11 показаны s в первых двух прямоугольниках и p в последних шести прямоугольниках, показывая, что подуровни 2s и 2p заполняются по мере завершения электронных конфигураций элементов в этих прямоугольниках.В периоде 3 также есть восемь ящиков, которые соответствуют электронам, необходимым для заполнения подуровней 3s и 3p.
Теперь вернемся к рис. 5.8, на котором показан порядок заполнения подуровней. Обратите внимание, что подуровень 4s заполняется сразу после подуровня 3p. На рисунке 5.11 показано, что элементы, последний добавленный электрон которых попадает на подуровень s, находятся в столбцах 1 и 2. Таким образом, мы должны начать здесь новый период, период 4, и поместить ячейки для элементов, образованных путем заполнения подуровня 4s в этих столбцах. На рис. 5.8 показано, что следующим заполняемым подуровнем является подуровень 3d. Это первые добавленные d-электроны, поэтому мы начинаем новые столбцы для элементов, образованных их добавлением. Десять электронов необходимы для заполнения пяти d-орбиталей, поэтому мы начинаем десять столбцов в этом четвертом периоде, помещая столбцы рядом со столбцом 2 и между ним и столбцом 3. Подуровень 4p заполняется следующим, после подуровня 3d. Ящики для элементов, образованные заполнением p-орбиталей, находятся под ячейками для элементов, образованных добавлением 3p-электронов.
На рис. 5.8 показано, что следующим заполняемым подуровнем является подуровень 3d. Это первые добавленные d-электроны, поэтому мы начинаем новые столбцы для элементов, образованных их добавлением. Десять электронов необходимы для заполнения пяти d-орбиталей, поэтому мы начинаем десять столбцов в этом четвертом периоде, помещая столбцы рядом со столбцом 2 и между ним и столбцом 3. Подуровень 4p заполняется следующим, после подуровня 3d. Ящики для элементов, образованные заполнением p-орбиталей, находятся под ячейками для элементов, образованных добавлением 3p-электронов.
Посмотрев на рисунок 5.8, мы видим, что следующие заполненные подуровни расположены в следующем порядке: 5s, 4d и 5p. Ящики для элементов, образованных заполнением орбиталей этих подуровней, расположены так же, как и в периоде 4. Так же, как период 4 содержит больше элементов, чем период 3, период 6 содержит больше элементов, чем период 5. Период 6 начинается с элементов, у которых последний добавленный электрон находится на подуровне 6s. На следующем этапе период 6 отличается от периода 5. Посмотрите еще раз на рисунок 5.8 и обратите внимание, что подуровень 4f заполняется после подуровня 6s и перед подуровнем 5d. Нам понадобится 14 ящиков, в которых будут находиться электроны, необходимые для заполнения семи f-орбиталей. Это коробки из ряда лантаноидов, показанные под таблицей. Есть некоторые свидетельства того, что эти орбитали не заполняются до того, как один электрон окажется на 5d-орбитали, поэтому на рисунке 5.11 мы показали серию лантанидов, идущую после первого d-столбца. После того, как орбитали 4f заполнены, отображаются прямоугольники для остальных элементов, образованных добавлением электронов 5d и 6p.Седьмой период содержит прямоугольники для элементов, образованных заполнением подуровней 7, 5f (серия актинидов, показанная под таблицей) и, наконец, подуровней 6d.
На следующем этапе период 6 отличается от периода 5. Посмотрите еще раз на рисунок 5.8 и обратите внимание, что подуровень 4f заполняется после подуровня 6s и перед подуровнем 5d. Нам понадобится 14 ящиков, в которых будут находиться электроны, необходимые для заполнения семи f-орбиталей. Это коробки из ряда лантаноидов, показанные под таблицей. Есть некоторые свидетельства того, что эти орбитали не заполняются до того, как один электрон окажется на 5d-орбитали, поэтому на рисунке 5.11 мы показали серию лантанидов, идущую после первого d-столбца. После того, как орбитали 4f заполнены, отображаются прямоугольники для остальных элементов, образованных добавлением электронов 5d и 6p.Седьмой период содержит прямоугольники для элементов, образованных заполнением подуровней 7, 5f (серия актинидов, показанная под таблицей) и, наконец, подуровней 6d.
Таким образом, рисунок 5.11 показывает тесную взаимосвязь между электронной конфигурацией элемента и его положением в периодической таблице. Эта взаимосвязь далее выражается следующими именами, которые иногда дают частям таблицы:
Эта взаимосвязь далее выражается следующими именами, которые иногда дают частям таблицы:
| столбцы 1 и 2 | с блок |
| столбцы 3-8 | р блок |
| короткие колонны | д блок |
| лантаноиды и актиниды | ф блок |
Группы элементов в этих блоках известны также под другими названиями.
B. Категории элементов в периодическом Стол
1. Репрезентативные элементы
Элементы в блоках s и p известны как
репрезентативные элементы или элементы основной группы. Термин « представитель » восходит к давним временам, когда химики считали, что химический состав этих элементов является репрезентативным для всех элементов. Группа 8 не всегда включается в репрезентативные элементы, потому что химический состав благородных газов уникален для них.В периоде 7 элементов в блоке p нет.
Блок p периода 7 будет содержать элементы с атомными номерами больше 112; такие элементы еще не были обнаружены в земной коре и не были получены ядерной реакцией.
В блоках s и p период, в котором находится элемент, имеет тот же номер, что и самый высокий энергетический уровень, который содержит электроны в атоме в основном состоянии. Номер столбца, в котором находится элемент, совпадает с количеством s- и p-электронов на этом уровне.Натрий – представительный элемент с 11 электронами. Его электронная конфигурация:
1s 2 2s 2 2p 6 3s 1
Натрий находится в столбце 1 третьего периода. В атоме натрия основной энергетический уровень с самой высокой энергией, содержащий электроны, является третьим энергетическим уровнем, и этот энергетический уровень содержит один электрон.
2. Переходные элементы
Элементы перехода (или переход
металлы, поскольку все они металлы) – это те элементы, которые находятся в коротких столбцах
блока d.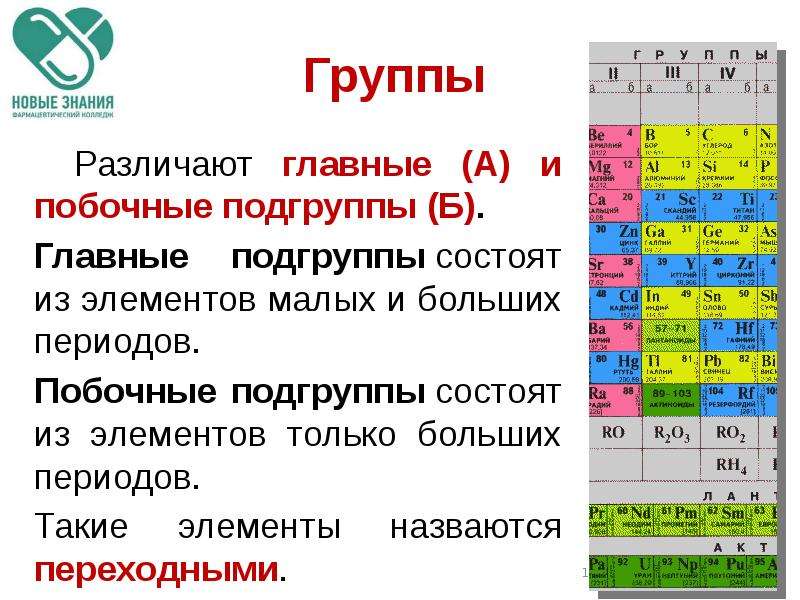 Многие из этих элементов, вероятно, вам знакомы. Чеканка
металлы – золото, серебро и медь – здесь. Железо – главный ингредиент
стали, а также те элементы, которые добавляются в железо, чтобы сделать особые
виды стали: хром, никель, марганец. В периоде 7 блок d равен
не заполнено. Причина та же, что и причина, по которой раздел p периода
7 пусто: эти элементы не встречаются в природе и еще не найдены.
как продукт ядерной реакции.Многие свойства перехода
элементы связаны с тем, что в их электронной структуре занятые
s и d подуровни наивысшей энергии очень близки по энергии.
Многие из этих элементов, вероятно, вам знакомы. Чеканка
металлы – золото, серебро и медь – здесь. Железо – главный ингредиент
стали, а также те элементы, которые добавляются в железо, чтобы сделать особые
виды стали: хром, никель, марганец. В периоде 7 блок d равен
не заполнено. Причина та же, что и причина, по которой раздел p периода
7 пусто: эти элементы не встречаются в природе и еще не найдены.
как продукт ядерной реакции.Многие свойства перехода
элементы связаны с тем, что в их электронной структуре занятые
s и d подуровни наивысшей энергии очень близки по энергии.
3. Внутренние переходные элементы
Внутренние переходные элементы находятся в блоке f периодической таблицы (в двух строках под основной частью таблицы). Элементы в этом блоке очень похожи химически, что будет казаться разумным, если учесть, что они имеют одинаковые электронные конфигурации на двух крайних энергетических уровнях.Различия возникают на следующем более низком уровне энергии. Например, электронная конфигурация церия (Ce, # 58) такова:
Например, электронная конфигурация церия (Ce, # 58) такова:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 6102 5p 2
а празеодим (Pr, # 59):
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 6102 5p 3
Единственная разница между этими двумя конфигурациями заключается в количестве 4f-электронов.И пятый, и шестой уровни энергии содержат электроны.
Элементы в лантаноидный ряд также известны как редкие земли. Они широко используются при производстве мониторов для цветного телевидения.
Элементы в
актинидный ряд все радиоактивны, и только три из них обнаружены в заметной концентрации в земной коре. Из других только некоторые были обнаружены в следовых количествах на Земле или в звездах.Все они были произведены в лабораториях как продукты ядерных реакций.
Из других только некоторые были обнаружены в следовых количествах на Земле или в звездах.Все они были произведены в лабораториях как продукты ядерных реакций.
В. Электронная конфигурация благородных
Газы; Обозначение ядра
Мы установили связь между электронной конфигурацией элемента и его положением в периодической таблице. Давайте теперь ближе познакомимся с электронными конфигурациями
благородные газы, те элементы в группе 8 периодической таблицы. Электронная конфигурация этих элементов показана в таблице 5.3.
| Элемент | Атомный номер | Электронная конфигурация |
|---|---|---|
| He | 2 | 1с 2 |
| Ne | 10 | 1s 2 2s 2 2p 6 |
| Ар | 18 | 1s 2 2s 2 2p 6 3s 2 3p 6 |
| Kr | 36 | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 |
| Xe | 54 | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 510p |
| Rn | 86 | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5103 610p 2 10 6s 2 6p 6 |
Тщательное изучение этих конфигураций показывает, что ни в одной из них нет частично заполненных подуровней. Символ благородного газа в скобках используется для обозначения заполненных подуровней. В качестве примера рассмотрим электронную конфигурацию брома:
Символ благородного газа в скобках используется для обозначения заполненных подуровней. В качестве примера рассмотрим электронную конфигурацию брома:
Br: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5
Первые 18 электронов находятся на тех же орбиталях, что и у атома аргона (см. Таблицу 5.3). Если мы используем символ [Ar] для обозначения этих 18 электронов, мы можем записать электронную конфигурацию брома как
Br: [Ar] 3d 10 4s 2 4p 5
Это устройство полезно, потому что мы можем писать электронные конфигурации быстрее.Что еще более важно, это обозначение подчеркивает электронные конфигурации на более высоких энергетических уровнях, где различия важны для определения химического состава элемента. Такое использование благородных газов для представления определенных конфигураций известно как обозначение ядра. Символ благородного газа, заключенный в скобки, представляет внутренние заполненные орбитали элемента. За скобками стандартно показаны дополнительные электроны. Обратите внимание, что только благородных газов могут использоваться в обозначении ядра.При использовании этого метода помните, что, хотя внутренняя конфигурация элемента может быть записана так же, как и у благородного газа, энергии этих внутренних электронов немного отличаются.
Символ благородного газа, заключенный в скобки, представляет внутренние заполненные орбитали элемента. За скобками стандартно показаны дополнительные электроны. Обратите внимание, что только благородных газов могут использоваться в обозначении ядра.При использовании этого метода помните, что, хотя внутренняя конфигурация элемента может быть записана так же, как и у благородного газа, энергии этих внутренних электронов немного отличаются.
В таблице 5.4 в обозначениях ядра показаны электронные конфигурации элементов. в группах 1 и 6 периодической таблицы. Обратите внимание, как этот метод подчеркивает аналогичная структура элементов в одном столбце.
| Группа 1 | Группа 6 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Д. Валентные электроны Таблица
Валентные электроны Таблица
Обсуждая химические свойства элемента, мы часто сосредотачиваемся на электронах на крайнем занятом уровне энергии. Эти электроны внешней оболочки называются валентными электронами, а уровень энергии, который они занимают, называется валентной оболочкой. Валентные электроны участвуют в химической связи и химических реакциях. Валентные электроны элемента показаны с использованием представления элемента, называемого электронно-точечной структурой или структурой Льюиса.
Вы, возможно, заметили при написании электронных конфигураций, что подуровень основного уровня энергии n всегда занят до того, как d электронов добавляются к основному уровню энергии с номером n – 1.Сразу после заполнения d подуровня главного уровня n – 1 заполняется подуровень p главного уровня n, и следующий заполненный подуровень будет s подуровнем n + 1 главного энергетического уровня. Этот порядок заполнения проиллюстрирован конфигурациями криптона, ксенона и радона в таблице 5. 3 и селена, теллура и полония в таблице 5.4. Значение этих наблюдений состоит в том, что в электронной конфигурации любого атома главный энергетический уровень с наибольшим числом, который содержит какие-либо электроны, не может содержать более восьми электронов.Это также означает, что валентные электроны атома являются s- и p-электронами на занятом основном уровне энергии с наибольшим числом. Следовательно, ни один атом не может иметь более восьми валентных электронов.
3 и селена, теллура и полония в таблице 5.4. Значение этих наблюдений состоит в том, что в электронной конфигурации любого атома главный энергетический уровень с наибольшим числом, который содержит какие-либо электроны, не может содержать более восьми электронов.Это также означает, что валентные электроны атома являются s- и p-электронами на занятом основном уровне энергии с наибольшим числом. Следовательно, ни один атом не может иметь более восьми валентных электронов.
Рисуя структуру атома Льюиса, мы представляем четырехстороннюю рамку вокруг символа атома и считаем, что каждая сторона этой коробки соответствует орбитали. Мы представляем каждый валентный электрон точкой. Первые два валентных электрона будут s-электронами; они будут представлены двумя точками на одной стороне (неважно, с какой стороны) символа.Валентные электроны, находящиеся в подоболочке p, размещаются первыми, по одному на каждой из оставшихся сторон символа, а затем добавляются по второму к каждой стороне. Этот метод заполнения аналогичен тому, который используется при рисовании диаграмм электронных конфигураций. В качестве примера рассмотрим структуру натрия Льюиса.
Этот метод заполнения аналогичен тому, который используется при рисовании диаграмм электронных конфигураций. В качестве примера рассмотрим структуру натрия Льюиса.
Возвращаясь к Таблице 5.4, мы видим, что основное обозначение натрия – [Ne] 3s 1 . Это говорит нам о том, что атом натрия имеет один электрон во внешней оболочке, поэтому его структура Льюиса имеет вид .Основное обозначение селена – [Ar] 3d 10 4s 2 4p 4 . Его структура Льюиса . Десять 3d-электронов селена не показаны, потому что они не находятся во внешней оболочке, которая является основным энергетическим уровнем 4. Структуры Льюиса для элементов в первых трех периодах и группе 2 периодической таблицы показаны в таблице 5.5.
Чему соответствует каждый период в периодической таблице? – Реабилитационная робототехника.нетто
Чему соответствует каждый период в периодической таблице?
Каждый период соответствует основному уровню энергии. он расположен в порядке увеличения атомной массы. Все элементы периода имеют одинаковое количество атомных орбиталей. Например, каждый элемент в верхнем ряду (первый период) имеет одну орбиталь для своих электронов.
он расположен в порядке увеличения атомной массы. Все элементы периода имеют одинаковое количество атомных орбиталей. Например, каждый элемент в верхнем ряду (первый период) имеет одну орбиталь для своих электронов.
Чему соответствуют уровни энергии в периодической таблице?
Когда вы смотрите на Периодическую таблицу элементов, уровни энергии атомов соответствуют строкам таблицы.Два элемента в верхнем ряду, водород и гелий, заполняют свой первый энергетический уровень своими конечными электронами. Уровни энергии строятся от уровня, ближайшего к ядру, наружу.
Каковы основные энергетические уровни и подуровни?
Первый главный энергетический уровень содержит только подуровень s; следовательно, он может содержать максимум два электрона. Каждый главный энергетический уровень выше первого содержит одну s-орбиталь и три p-орбитали. Набор из трех p-орбиталей, называемый p-подуровнем, может содержать максимум шесть электронов.
Как связаны числа периодов и основные уровни энергии?
Число n периода в периодической таблице совпадает с номером наивысшего основного энергетического уровня для атомов в этом ряду, то есть основного энергетического уровня, занятого его валентными электронами.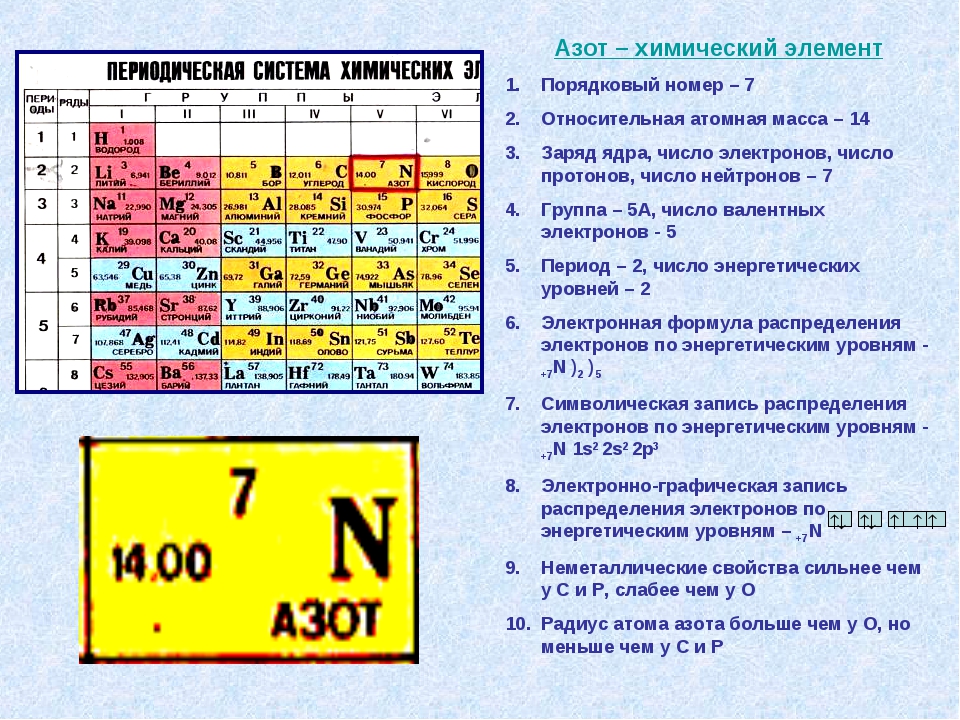 Таким образом, элементы в периоде 1 имеют наивысший основной уровень энергии, равный 1, и так далее.
Таким образом, элементы в периоде 1 имеют наивысший основной уровень энергии, равный 1, и так далее.
Какие два элемента находятся в одном периоде?
Элементы, относящиеся к одному и тому же периоду, обладают не такими похожими химическими свойствами.Рассмотрим первых двух членов периода 3: натрий (Na) и магний (Mg). В реакциях они оба имеют тенденцию терять электроны (в конце концов, это металлы), но натрий теряет один электрон, а магний – два.
Какой элемент входит в группу 5, период 4?
Группа 5 (по стилю ИЮПАК) – это группа элементов периодической таблицы. Группа 5 содержит ванадий (V), ниобий (Nb), тантал (Ta) и дубний (Db). Эта группа находится в d-блоке периодической таблицы. Сама группа не получила банального названия; он принадлежит к более широкой группе переходных металлов.
[PDF] Организация Периодической таблицы – Ответьте на ключевые направления
Скачать Организация Периодической таблицы – Ответить на ключевые направления . ..
..
Организация Периодической таблицы Менделеева – ответ на ключевые направления. Используя компьютер, планшет или мобильное устройство, перейдите на веб-сайт: www.ptable.com. Вы будете взаимодействовать с этой периодической таблицей, чтобы найти ответы на приведенные ниже вопросы. * Убедитесь, что вкладка «Википедия» выбрана, чтобы ответить на следующие вопросы: 1.Вертикальные столбцы в периодической таблице называются группами, сколько групп в периодической таблице? 18 2. Горизонтальные ряды периодической таблицы называются периодами, сколько периодов в периодической таблице? 7 3. Используя номера группы и периода, определите элементы, которые находятся в каждом из следующих мест. а. Элемент в группе 10 и периоде 5 = Pd b. Элемент в группе 15 и периоде 4 = As c. Элемент в группе 2 и периоде 3 = Mg d. Элемент в группе 18 и периоде 6 = Rn e.Элемент в группе 1 и периоде 7 = Fr 4. Классифицируются ли большинство элементов периодической таблицы как металл или неметалл? Металл 5. Неметаллические элементы расположены слева или справа от таблицы Менделеева? Справа (кроме водорода) * Элементы также можно классифицировать по семействам, используйте цветовую кодировку вверху страницы, чтобы помочь идентифицировать имена семейств и их членов. 6. Сколько элементов относится к семейству щелочных металлов? Перечислите элементы-члены по их символу. 6 элементов = Li, Na, K, Rb, Cs, Fr 7.Щелкните номер группы для семейства щелочных металлов вверху таблицы. Ответьте на следующие вопросы о щелочных металлах: a. Каковы 3 схожих свойства этих элементов? Блестящий, мягкий, высокореактивный б. Где они встречаются в природе? Только в солях, а не как свободный элемент c. С каким обычным веществом щелочные металлы активно реагируют? Вода
Неметаллические элементы расположены слева или справа от таблицы Менделеева? Справа (кроме водорода) * Элементы также можно классифицировать по семействам, используйте цветовую кодировку вверху страницы, чтобы помочь идентифицировать имена семейств и их членов. 6. Сколько элементов относится к семейству щелочных металлов? Перечислите элементы-члены по их символу. 6 элементов = Li, Na, K, Rb, Cs, Fr 7.Щелкните номер группы для семейства щелочных металлов вверху таблицы. Ответьте на следующие вопросы о щелочных металлах: a. Каковы 3 схожих свойства этих элементов? Блестящий, мягкий, высокореактивный б. Где они встречаются в природе? Только в солях, а не как свободный элемент c. С каким обычным веществом щелочные металлы активно реагируют? Вода
Американская ассоциация учителей химии
1
8. Какой тип элемента обозначает неоново-зеленый цвет? Перечислите символы элементов, обозначенных ниже неоново-зеленым цветом.H, C, N, O, P, S, Se 9. Сколько элементов принадлежит семейству галогенов? Перечислите элементы-члены по их символу. 5 или 6 элементов – F, Cl, Br, I, At, Uus (возможно) 10. Щелкните номер группы для семейства галогенов в верхней части таблицы. Ответьте на следующие вопросы о галогенных элементах: a. Что означает название «галоген»? Производство соли b. Какой тип молекулы образуется при соединении галогена с водородом? Кислота 11. Какому семейству элементов соответствует 2 группа в периодической таблице? Щелочноземельные металлы 12.К какому семейству элементов принадлежит мышьяк (As)? Металлоиды 13. Какие элементы относятся к семейству мышьяка? Щелкните имя этой группы, расположенное в кнопке с цветовой кодировкой вверху страницы. Каково общее свойство элементов в этом семействе? B, Si, Ge, As, Sb, Te, Po – эти элементы обладают свойствами, которые представляют собой смесь металлов и неметаллов. 14. Вольфрам (W), медь (Cu) и железо (Fe) принадлежат к одному семейству, члены которого обычно используются в качестве проводников электричества.Что это за семья? Переходные металлы 15. В правом верхнем углу экрана установите (√) флажок рядом с «Широкий».
5 или 6 элементов – F, Cl, Br, I, At, Uus (возможно) 10. Щелкните номер группы для семейства галогенов в верхней части таблицы. Ответьте на следующие вопросы о галогенных элементах: a. Что означает название «галоген»? Производство соли b. Какой тип молекулы образуется при соединении галогена с водородом? Кислота 11. Какому семейству элементов соответствует 2 группа в периодической таблице? Щелочноземельные металлы 12.К какому семейству элементов принадлежит мышьяк (As)? Металлоиды 13. Какие элементы относятся к семейству мышьяка? Щелкните имя этой группы, расположенное в кнопке с цветовой кодировкой вверху страницы. Каково общее свойство элементов в этом семействе? B, Si, Ge, As, Sb, Te, Po – эти элементы обладают свойствами, которые представляют собой смесь металлов и неметаллов. 14. Вольфрам (W), медь (Cu) и железо (Fe) принадлежат к одному семейству, члены которого обычно используются в качестве проводников электричества.Что это за семья? Переходные металлы 15. В правом верхнем углу экрана установите (√) флажок рядом с «Широкий». Это отобразит периодическую таблицу, включая семейства лантаноидов и актиноидов. Есть ли у семейств лантаноидов и актиноидов определенные номера групп? № 16. Щелкните на слове Lanthanoid, какое еще общее название для этой группы элементов? Редкоземельные элементы. 17. Щелкните на слове «Актиноид», это семейство элементов, как известно, радиоактивно. Какой важный пример, показанный на рисунке, приводится относительно реальной связи с этими элементами? Атомная бомба сброшена на Нагасаки.18. Заполните следующую таблицу, найдя атомные номера и атомные массы для каждого элемента: Символ
Это отобразит периодическую таблицу, включая семейства лантаноидов и актиноидов. Есть ли у семейств лантаноидов и актиноидов определенные номера групп? № 16. Щелкните на слове Lanthanoid, какое еще общее название для этой группы элементов? Редкоземельные элементы. 17. Щелкните на слове «Актиноид», это семейство элементов, как известно, радиоактивно. Какой важный пример, показанный на рисунке, приводится относительно реальной связи с этими элементами? Атомная бомба сброшена на Нагасаки.18. Заполните следующую таблицу, найдя атомные номера и атомные массы для каждого элемента: Символ
Be
O 8
Al 13
Ar 18
K
20
Te 52
I 53
Xe
Атомный номер
4
Атомная масса
9.0121 15.999 26.981 39.948 39.0983 40.078 127.60 126.90 131.293
Американская ассоциация учителей химии
19
Ca
Используя данные из вышеприведенной таблицы, можно ли организовать периодическую таблицу за счет увеличения атомной массы? Объяснять. Нет. В периодической таблице есть несколько мест, где масса не увеличивается с атомным номером, в таблице данных выше это может быть показано между аргоном (Ar) и калием (K) и снова между теллуром (Te) и йодом ( Я). б. По какому свойству организована таблица Менделеева? Увеличение атомного номера (протоны). * В правом верхнем углу экрана установите (√) флажок «Электроны.В результате счетчик электронов для каждого элемента появится справа от его символа в периодической таблице. 19. Какую электронную структуру вы замечаете для всех элементов, принадлежащих к семейству щелочных металлов? Последний электрон в списке (валентный электрон) равен 1. 20. Учитывая ваш ответ выше, хотя мы знаем, что водород – неметалл, почему вы думаете, что его помещают поверх щелочных металлов? Его количество валентных электронов такое же, как у членов семейства щелочных металлов. 21. Какую электронную картину можно наблюдать с благородными газами? Галогены? Все благородные газы имеют 8 валентных электронов, кроме He, у которого 2.
Нет. В периодической таблице есть несколько мест, где масса не увеличивается с атомным номером, в таблице данных выше это может быть показано между аргоном (Ar) и калием (K) и снова между теллуром (Te) и йодом ( Я). б. По какому свойству организована таблица Менделеева? Увеличение атомного номера (протоны). * В правом верхнем углу экрана установите (√) флажок «Электроны.В результате счетчик электронов для каждого элемента появится справа от его символа в периодической таблице. 19. Какую электронную структуру вы замечаете для всех элементов, принадлежащих к семейству щелочных металлов? Последний электрон в списке (валентный электрон) равен 1. 20. Учитывая ваш ответ выше, хотя мы знаем, что водород – неметалл, почему вы думаете, что его помещают поверх щелочных металлов? Его количество валентных электронов такое же, как у членов семейства щелочных металлов. 21. Какую электронную картину можно наблюдать с благородными газами? Галогены? Все благородные газы имеют 8 валентных электронов, кроме He, у которого 2. Каждый член семейства галогенов имеет по 7 валентных электронов. * Модели Бора можно использовать, чтобы примерно показать, как электроны расположены в атоме. Напомним, что количество электронов равно количеству протонов в нейтральном атоме, которое также совпадает с атомным номером элемента. Модели Бора: Первое кольцо может содержать до 2 электронов Второе кольцо может содержать до 8 электронов Третье кольцо может содержать до 8 электронов Четвертое кольцо может содержать до 2 электронов Модель Бора завершена для данного атома, заполняя самое внутреннее кольцо до своей емкости и двигаясь наружу к каждому последующему кольцу, заполняя каждое до своей емкости, прежде чем двигаться дальше. Электроны на самом внешнем кольце известны как ЭЛЕКТРОНЫ ВАЛЕНЦИИ. Это электроны, которые участвуют в химической связи. Каждая точка представляет один электрон.
Каждый член семейства галогенов имеет по 7 валентных электронов. * Модели Бора можно использовать, чтобы примерно показать, как электроны расположены в атоме. Напомним, что количество электронов равно количеству протонов в нейтральном атоме, которое также совпадает с атомным номером элемента. Модели Бора: Первое кольцо может содержать до 2 электронов Второе кольцо может содержать до 8 электронов Третье кольцо может содержать до 8 электронов Четвертое кольцо может содержать до 2 электронов Модель Бора завершена для данного атома, заполняя самое внутреннее кольцо до своей емкости и двигаясь наружу к каждому последующему кольцу, заполняя каждое до своей емкости, прежде чем двигаться дальше. Электроны на самом внешнем кольце известны как ЭЛЕКТРОНЫ ВАЛЕНЦИИ. Это электроны, которые участвуют в химической связи. Каждая точка представляет один электрон.Американская ассоциация учителей химии
3
22. Определите элементы, показанные в моделях Бора ниже, и укажите количество валентных электронов в каждом атоме: a.
г.
г.
Элемент = C
Элемент = F
Элемент = Mg
Валентные электроны = 4
Валентные электроны = 7
Валентные электроны = 2
23.Нарисуйте модели Бора для элементов, перечисленных ниже, и укажите количество валентных электронов в каждом из них. а. Азот (N) Внутреннее кольцо = 2 точки Наружное кольцо = 5 точек
b. Хлор (Cl) Внутреннее кольцо = 2 точки Среднее кольцо = 8 точек Внешнее кольцо = 7 точек
c. Кальций Внутреннее кольцо = 2 точки Среднее кольцо = 8 точек Среднее кольцо = 8 точек Внешнее кольцо = 2 точки
24. Семейство переходных металлов очень велико. Какие номера групп включены в это семейство? Вы видите закономерность их электронных чисел? Группы 3-12 – переходные металлы.Нет шаблона для валентных / внешних электронных чисел.
Американская ассоциация учителей химии
4
Группы периодической таблицы соответствуют элементам с a. того же цвета б. тот же атомный номер c.
 аналогичное химическое свойство
аналогичное химическое свойствоПо определению, отложение – это геологический процесс, при котором осадки, почва и горные породы добавляются к рельефу или массиву суши. Следовательно, то, что происходит с земными материалами во время осаждения, заключается в том, что эродированные земные материалы оседают в другом месте.Надеюсь, это ответит на вопрос. Хорошего дня!
Ответ:
(B) Лечение ципрофлоксацином убивает или останавливает рост чувствительных штаммов, но устойчивые штаммы выживают.
Пояснение:
Campylobacter jejuni является возбудителем пищевой инфекции с самой высокой заболеваемостью в Европе. И домашняя птица, и дикие птицы являются основным резервуаром бактерий, бактерии живут в кишечнике теплокровных животных, но они весьма вредны только для человека.Было установлено, что разнообразие генов fo отвечает за его устойчивость к антибиотикам.
Ответ:
1: Осевой скелет, 2: кроветворная клетка,
Пояснение:
Надеюсь, это поможет, я знаю только два
Ответ: Клетка дрожжей, растущая в анаэробных условиях
Пояснение:
Клетки дрожжей способны расти в среде в отсутствие кислорода.
Это процесс ферментации. Дрожжи могут сбраживать моносахариды и дисахариды.
Растения также могут осуществлять анаэробное дыхание, например, семена во время прорастания.
При дрожжевом брожении конечный продукт гликолиза, пировиноградная кислота, образует этанол. Выделяется углекислый газ.
Baker’s использует преимущество анаэробного дыхания дрожжей, потому что при добавлении в тесто выделяемый углекислый газ заставляет тесто подниматься.
Периодические свойства элементов
Периодическая таблица в форме, первоначально опубликованной Дмитрием Менделеевым в 1869 году, была попыткой перечислить химические элементы в порядке их атомного веса, разбивая список на строки таким образом, чтобы элементы, имеющие аналогичные физические и химические свойства, были помещены в каждый столбец. В то время об атомах ничего не было известно; разработка таблицы была полностью эмпирической.
В то время об атомах ничего не было известно; разработка таблицы была полностью эмпирической.
Наша цель в этом уроке – помочь вам понять, как форма и организация современной таблицы Менделеева являются прямым следствием атомной электронной структуры элементов.
Мы начинаем с изображения, которое вы видели в предыдущем уроке, показывая длинную форму таблицы с выделенной «блочной» структурой.Вы помните, что два блока f написаны внизу просто для того, чтобы таблица не стала неудобно широкой; эти два блока фактически находятся между La-Hf и Ac-Db, соответственно, в блоке d .
1 Как устроена таблица Менделеева
Рекомендуемое видео:
Введение в таблицу Менделеева
(Сократика, 9 мин.)
Очень простой способ организовать химические элементы – составить длинный длинный горизонтальный список элементов в порядке возрастания их атомных номеров. Началось бы так:
Началось бы так:
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca …
Теперь, если мы посмотрим на различные физические и химические свойства этих элементов, мы обнаружим, что их значения имеют тенденцию увеличиваться или уменьшаться с Z таким образом, чтобы обнаруживать повторяющийся узор, то есть периодичность . Для элементов, перечисленных выше, эти разрывы могут быть обозначены вертикальными полосами, показанными здесь цветом:
H He | Li Be B C N O F Ne | Na Mg Al Si P S Cl Ar | ок…
Периоды, группы и блоки
Чтобы построить таблицу, мы помещаем каждую последовательность (обозначенную вертикальной красной полосой выше) в отдельную строку, которую мы называем периодом . Строки выровнены таким образом, чтобы элементы в каждом вертикальном столбце имели определенное сходство.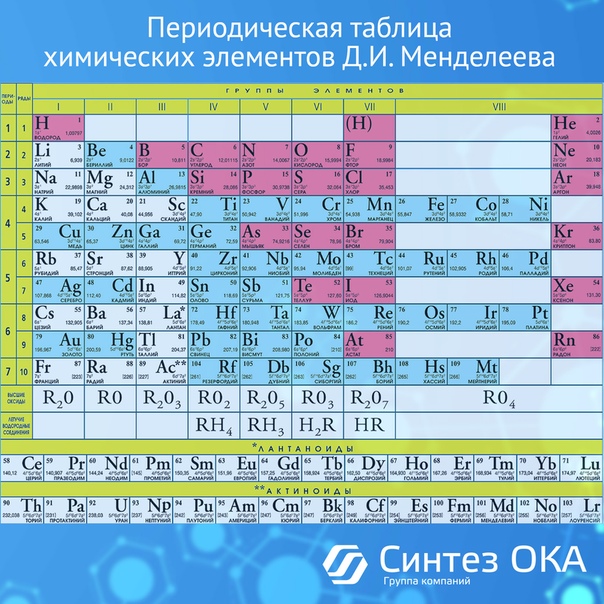 Таким образом, первые короткопериодические элементы H и He химически подобны элементам Li и Ne в начале и в конце второго периода.Обратите внимание, что первый период разделен, чтобы отразить эти химические сходства .
Таким образом, первые короткопериодические элементы H и He химически подобны элементам Li и Ne в начале и в конце второго периода.Обратите внимание, что первый период разделен, чтобы отразить эти химические сходства .
Найдите минутку, чтобы увидеть, как изображение выше соотносится с полной таблицей Менделеева, которую мы воспроизводим ниже. Каждая строка, начинающаяся с H до Fr, соответствует точке; в этой таблице семь периодов.
Каждый столбец, помеченный маленькими синими цифрами 1-18 в верхней части таблицы, соответствует группе .
В прошлом для обозначения различных групп использовались две разные системы римских цифр и букв.Североамериканцы добавили букву B для обозначения групп блоков d и A для остальных; это система, показанная в таблице выше. Но остальной мир использовал A для элементов блока d и B для остальных.
В 1985 году была принята новая международная система, в которой столбцы обозначались просто цифрами 1-18. Хотя изначально этой системе сопротивлялись североамериканские химики, предсказавшие, что она оставит студентов безнадежно запутанными, система «от одного до восемнадцати» постепенно стала приниматься, поскольку старые химики умирали, а американцы с опозданием догоняли остальной мир.
Хотя изначально этой системе сопротивлялись североамериканские химики, предсказавшие, что она оставит студентов безнадежно запутанными, система «от одного до восемнадцати» постепенно стала приниматься, поскольку старые химики умирали, а американцы с опозданием догоняли остальной мир.
Теперь посмотрите на раздел таблицы, содержащий группы с 3 по 12, помеченный как
d-block . Внизу группы 3 в этом блоке обратите внимание на элементы лантан и актиний, которые заштрихованы светло-зеленым цветом. Вы увидите направленную вниз стрелку, которая указывает еще на две строки, также заштрихованные зеленым.
Эти два f-блока , как они называются, не считаются отдельными периодами в этой «краткой форме» таблицы, а втиснуты, начиная с третьего периода, где скандий Sc является первым элементом, в котором оболочка 3 d начинает заполняться.
«Блочная» номенклатура периодической таблицы относится к суборбитальному типу (квантовое число & ell; , или s-p-d-f классификации) орбиталей с наивысшей энергией, которые заняты в данном элементе. Обратите внимание:
Обратите внимание:
- Для n = 1 нет блока p , а блок s разделен таким образом, что гелий помещается в ту же группу, что и другие инертные газы, на что он похож по химическому составу.
- Для второго периода ( n = 2) есть блок p , но нет блока d ; в обычной «длинной форме» периодической таблицы обычно оставляют промежуток между этими двумя блоками, чтобы разместить блоки d , которые встречаются на n = 3 и выше.
- При n = 6 мы вводим блок f , но для того, чтобы удерживать таблицу до разумных размеров, блоки f размещаются под основной частью таблицы.
Семейства периодических таблиц
Химики давно сочли удобным называть определенные категории элементов специальными именами, обычно известными как семейства. Ярлыки, нанесенные на таблицу Менделеева ниже, широко используются, и их стоит знать.
Из семейств, показанных на изображении, особенно важно, чтобы вы могли распознать щелочных металлов , которые начинают каждый ряд, переходных металлов (все элементы в группах d-блока 3-12) и газы благородные группы 18; эти семейства напрямую связаны с электронными конфигурациями элементов.
Другие семейства элементов могут быть совершенно произвольными, например, элементы, присутствующие в живых организмах, драгоценных металлов или чеканки металлов, конструкционные металлы , такие как железо, алюминий и титан, элементы, которые коммерчески добываются в данная страна и т. д.
2 Как электронные структуры формируют таблицу Менделеева
Свойства атома зависят в конечном итоге от числа электронов на различных орбиталях и от заряда ядра, который определяет компактность орбиталей.
Оболочечная модель атома
Чтобы связать свойства элементов с их расположением в периодической таблице, часто удобно использовать упрощенный вид атома, в котором ядро окружено одной или несколькими концентрическими сферическими «оболочками», каждая из которых который состоит из орбиталей с наивысшим главным квантовым числом (всегда s – и p -орбиталей), которые содержат по крайней мере один электрон.
Как и любая научная модель, модель оболочки предлагает упрощенное представление, которое помогает нам понимать и соотносить различные явления. Принципиальное упрощение здесь состоит в том, что он имеет дело только с элементами основной группы из s – и p -блоков, исключая d – и f -элементы блока, свойства которых имеют тенденцию быть менее тесно связанными. к их групповым номерам.
На этой диаграмме показаны первые три ряда так называемых репрезентативных элементов , то есть только элементов блока s и p .По мере продвижения вниз (в четвертый ряд и ниже) присутствие
d -электронов оказывает усложняющее влияние, которое позволяет элементам проявлять несколько балансов. Этот эффект особенно заметен в элементах из переходного металла и является причиной того, что d-блок не включен в репрезентативные элементы.
Электроны (обозначенные красными точками) в самой внешней оболочке атома – это те, которые наиболее легко взаимодействуют с другими атомами и, таким образом, играют важную роль в управлении химией элемента. Обратите внимание на использование символов благородных газов для упрощения записи электронной конфигурации.
Обратите внимание на использование символов благородных газов для упрощения записи электронной конфигурации.
Рекомендуемое видео по модели оболочки атома:
Валентные электроны и таблица Менделеева
(ТайлерДьюит, 17 мин.)
В частности, количество электронов внешней оболочки (которое задается крайней правой цифрой в номере группы ) является основным определяющим фактором «объединяющей способности» элемента или валентности .Общая тенденция заключается в том, что атом приобретает или теряет электроны либо напрямую (что приводит к образованию ионов ), либо разделяя электроны с другими атомами, чтобы достичь конфигурации внешней оболочки s 2 p 6 . Эта конфигурация, известная как октет , соответствует конфигурации одного из элементов благородных газов Группы 18.
- элементы в группах 1, 2 и 13 имеют тенденцию отдавать свои валентные электроны с образованием положительных ионов, таких как Na + , Mg 2+ и Al 3+ , а также соединения NaH, MgH 2 и AlH 3 .
 Конфигурация внешней оболочки атомов металлов в этих разновидностях соответствует таковой у неона.
Конфигурация внешней оболочки атомов металлов в этих разновидностях соответствует таковой у неона. - элементов в группах 15-17 имеют тенденцию приобретать электроны, образуя ионы, такие как P 3–, S 2– и Cl – или соединения, такие как PH 3 , H 2 S и HCl. Конфигурация внешней оболочки этих элементов соответствует конфигурации аргона.
- Элементы группы 14 обычно вообще не образуют ионы, но делят электроны с другими элементами в четырехвалентных соединениях, таких как CH 4 .
Эффективный ядерный заряд
Эти электроны в внешней или валентной оболочке особенно важны, потому что они могут участвовать в совместном использовании и обмене, который отвечает за химические реакции; то, насколько прочно они связаны с атомом, во многом определяет химический состав элемента. Степень связывания является результатом двух противоположных сил: притяжения между электроном и ядром и отталкивания между рассматриваемым электроном и всеми другими электронами в атоме. Все, что имеет значение, – это суммарная сила, разница между ядерным притяжением и совокупностью электрон-электронного отталкивания.
Все, что имеет значение, – это суммарная сила, разница между ядерным притяжением и совокупностью электрон-электронного отталкивания.
Мы можем еще больше упростить оболочечную модель, представив, что электроны валентной оболочки – это только электронов в атоме, и что заряд ядра имеет любое значение, необходимое для связывания этих электронов так сильно, как это наблюдается экспериментально. Поскольку количество электронов в этой модели меньше атомного номера Z , требуемый ядерный заряд также будет меньше и известен как эффективный ядерный заряд .Эффективный заряд ядра – это, по сути, положительный заряд, который «видит» валентный электрон.
Частично разница между Z и Z , эффективная , связана с другими электронами в валентной оболочке, но обычно это лишь незначительный вклад, потому что эти электроны имеют тенденцию действовать так, как если бы они были распределены в диффузной сферической оболочка большего радиуса. Основными действующими лицами здесь являются электроны в гораздо более компактных внутренних оболочках, которые окружают ядро и оказывают то, что часто называют экранирующим или « экранирующим » эффектом на валентные электроны.
Основными действующими лицами здесь являются электроны в гораздо более компактных внутренних оболочках, которые окружают ядро и оказывают то, что часто называют экранирующим или « экранирующим » эффектом на валентные электроны.
Формула для расчета эффективного заряда ядра не очень сложна, но мы пропустим ее здесь обсуждение. Еще более простая, хотя и довольно грубая процедура – просто вычесть количество электронов внутренней оболочки из заряда ядра; результатом является форма эффективного ядерного заряда, который называется ядерным зарядом атома.
4 Периодические тренды атомных и ионных радиусов
Первоначальная цель периодической таблицы состояла в том, чтобы организовать химические элементы таким образом, чтобы понять, каким образом наблюдаемые физические и химические свойства элементов меняются в зависимости от атомного номера.
В этом разделе мы рассмотрим некоторые из этих тенденций и попытаемся понять их причины на основе электронных структур элементов.
Периодические тренды размеров атомов
Что мы подразумеваем под «размером» атома?
Понятие «размер» несколько двусмысленно в применении к масштабу атомов и молекул. Причина этого становится очевидной, если вспомнить, что атом не имеет определенной границы; существует конечная (но очень малая) вероятность найти электрон атома водорода, например, в 1 см или даже 1 км от ядра.Невозможно указать конкретное значение радиуса изолированного атома; Лучшее, что мы можем сделать, – это определить сферическую оболочку, в радиусе которой можно найти произвольный процент электронной плотности.
Когда атом объединен с другими атомами в твердом элементе или соединении, эффективный радиус может быть определен путем наблюдения расстояний между соседними рядами атомов в этих твердых телах. Чаще всего это выполняется с помощью экспериментов по рассеянию рентгеновских лучей. Из-за различных способов, которыми атомы могут агрегироваться вместе, можно определить несколько различных типов атомных радиусов.
Расстояния в атомной шкале традиционно выражались в единицах Ангстрема (1Å = 10 –8 см = 10 –10 м), но в настоящее время предпочтение отдается пикометру;
1 пм = 10 –12 м = 10 – 10 см = 10 –2 Å, или 1Å = 100 пм. Радиусы атомов и ионов обычно находятся в диапазоне 70-400 пм.
Несколько видеороликов об атомных и ионных радиусах:
Периодические тренды 1 – радиусы
(Аманда Холтон, 11 мин)
Атомный и ионный радиусы
(ХанОрг, 11½ мин.)
Атомный радиус
(Калифорнийский университет в Беркли, 1,5 мин.)
Приблизительное представление о размере металлического атома можно получить, просто измерив плотность образца металла.Это говорит нам о количестве атомов в единице объема твердого тела. Предполагается, что атомы представляют собой сферы радиуса r , контактирующие друг с другом, каждая из которых находится в кубической коробке с длиной ребра 2 r . Объем каждой коробки – это просто общий объем твердого тела, деленный на количество атомов в этой массе твердого тела; атомный радиус – это кубический корень из r .
Объем каждой коробки – это просто общий объем твердого тела, деленный на количество атомов в этой массе твердого тела; атомный радиус – это кубический корень из r .
Хотя радиус атома или иона нельзя измерить напрямую, в большинстве случаев он может быть определен из измерений расстояния между соседними ядрами в кристаллическом твердом теле.
Поскольку твердые тела делятся на несколько разных классов, определено несколько видов атомных радиусов. Многие атомы имеют несколько разных радиусов; Например, натрий образует металлическое твердое тело и, таким образом, имеет металлический радиус, он образует газообразную молекулу Na 2 в паровой фазе (ковалентный радиус) и, конечно, он образует ионные твердые вещества, такие как NaCl.
- Металлический радиус – половина расстояния между ядрами в металлическом кристалле.
- Ковалентный радиус – это половина расстояния между одинаковыми атомами, которые связаны вместе в молекуле.

- Ван-дер-Ваальсовый радиус – это эффективный радиус соседних атомов, которые не связаны химически в твердом теле, но предположительно находятся в «контакте». Примером может служить расстояние между атомами йода соседних молекул I 2 в кристаллическом йоде.
Многие атомы имеют несколько разных радиусов; например, натрий образует металлическое твердое тело и, таким образом, имеет металлический радиус, он образует газообразную молекулу Na 2 в паровой фазе (ковалентный радиус) и, конечно, он образует ионные твердые частицы, как упомянуто выше.
Периодические тренды атомного радиуса
Можно ожидать, что размер атома будет зависеть главным образом от главного квантового числа самой высокой занятой орбитали; иными словами, от «количества занятых электронных оболочек». Поскольку каждая строка в периодической таблице соответствует приращению n, атомный радиус увеличивается по мере того, как мы движемся вниз по столбцу. Другой важный фактор – это ядерный заряд; чем выше атомный номер, тем сильнее притягиваются электроны к ядру и тем меньше размер атома.Этот эффект отвечает за сокращение, которое мы наблюдаем при перемещении по таблице Менделеева слева направо.
Другой важный фактор – это ядерный заряд; чем выше атомный номер, тем сильнее притягиваются электроны к ядру и тем меньше размер атома.Этот эффект отвечает за сокращение, которое мы наблюдаем при перемещении по таблице Менделеева слева направо.
На рисунке показана периодическая таблица, в которой размеры атомов представлены графически. Очевидные разрывы на этой диаграмме отражают сложность сравнения радиусов атомов с металлическими и неметаллическими типами связи. Радиусы элементов из благородных газов являются оценками радиусов близлежащих элементов.
Как оцениваются ионные радиусы
Размер иона может быть определен только для тех, которые присутствуют в ионных твердых телах .Когда ион растворяется в воде, он приобретает гидратную оболочку из слабо связанных молекул H 2 O, которые увеличивают его эффективный радиус способами, которые трудно определить систематическим образом.
Наблюдая дифракцию рентгеновских лучей на ионном кристалле, легко измерить расстояние между соседними рядами ионов Na + и Cl –, но нет однозначного способа решить, какие части этого расстояния относятся к каждому иону. Лучшее, что можно сделать, – это сделать оценки на основе исследований нескольких различных ионных твердых веществ (например, LiI, KI, NaI), которые содержат один общий ион. Было сделано много таких оценок, и они оказались удивительно последовательными.
Лучшее, что можно сделать, – это сделать оценки на основе исследований нескольких различных ионных твердых веществ (например, LiI, KI, NaI), которые содержат один общий ион. Было сделано много таких оценок, и они оказались удивительно последовательными.
Например, ион лития настолько мал, что в LI ионы йодида находятся в контакте, поэтому расстояния I-I в два раза превышают ионный радиус I – . Это неверно для KI, но в этом твердом теле соседние ионы калия и иодида находятся в контакте, что позволяет оценить ионный радиус K + .
Сравнение радиусов атомов и их ионов
Положительный ион всегда меньше нейтрального атома из-за меньшего отталкивания электронов. Если второй электрон теряется, ион становится еще меньше; например, ионный радиус Fe 2+ составляет 76 мкм, а ионный радиус Fe 3+ составляет 65 мкм. Если при образовании иона происходит полное опустошение внешней оболочки, то уменьшение радиуса особенно велико.
Ион водорода H + находится в отдельном классе; при отсутствии электронного облака его радиус равен радиусу голого протона или около 0,1 пм – сокращение на 99,999%! Поскольку единичный положительный заряд сконцентрирован в таком небольшом объеме пространства, плотность заряда иона водорода чрезвычайно высока; он очень сильно взаимодействует с другими веществами, включая молекулы воды, и в водном растворе существует только как ион гидроксония H 3 O + .
Отрицательные ионы всегда больше, чем родительский ион; добавление одного или нескольких электронов к существующей оболочке увеличивает электрон-электронное отталкивание , что приводит к общему расширению атома.
Периодические тренды ионных радиусов
Лучший способ визуализировать эти тенденции – сравнить радиусы изоэлектронной серии – последовательности видов, все из которых имеют одинаковое количество электронов (и, следовательно, одинаковое количество электрон-электронного отталкивания), но различаются по заряду ядра. .Конечно, только один член такой последовательности может быть нейтральным атомом (неон в серии, показанной ниже). Ясно видно влияние увеличения заряда ядра на радиус.
.Конечно, только один член такой последовательности может быть нейтральным атомом (неон в серии, показанной ниже). Ясно видно влияние увеличения заряда ядра на радиус.
4 Периодические тенденции в энергетике образования ионов
Химические реакции основаны в основном на взаимодействиях между наиболее слабосвязанными электронами в атомах, поэтому неудивительно, что тенденция атома приобретать, терять или делиться электронами должна играть важную роль в определении его химических свойств.
Периодические тенденции энергии ионизации
Термин «энергия ионизации» всегда относится к удалению электронов атома, что приводит к образованию положительных ионов. Чтобы удалить электрон из атома, необходимо выполнить работу по преодолению электростатического притяжения между электроном и ядром; эта работа называется энергией ионизации атома и соответствует экзотермическому процессу
M (г) → M + (г) + e –
, в котором M ( г ) обозначает любой изолированный (газообразный) атом.
Энергия ионизации, сродство к электрону (6 мин)
>Периодические тренды энергии ионизации (4 мин)
Экранирование внутренними электронами, эффективный заряд ядра и его влияние на энергию ионизации
(4½ мин)
Тест по энергии ионизации (2 мин)
У атома столько же энергий ионизации, сколько у него электронов.Электроны всегда удаляются с орбитали, занятой наивысшей энергией. Исследование последовательных энергий ионизации первых десяти элементов (ниже) дает экспериментальное подтверждение того, что связывание двух самых внутренних электронов (1 s орбиталь) значительно отличается от связывания n = 2 электронов. атома быстро увеличиваются, поскольку уменьшенное электрон-электронное отталкивание заставляет электронные оболочки сжиматься, таким образом связывая электроны еще более прочно с ядром.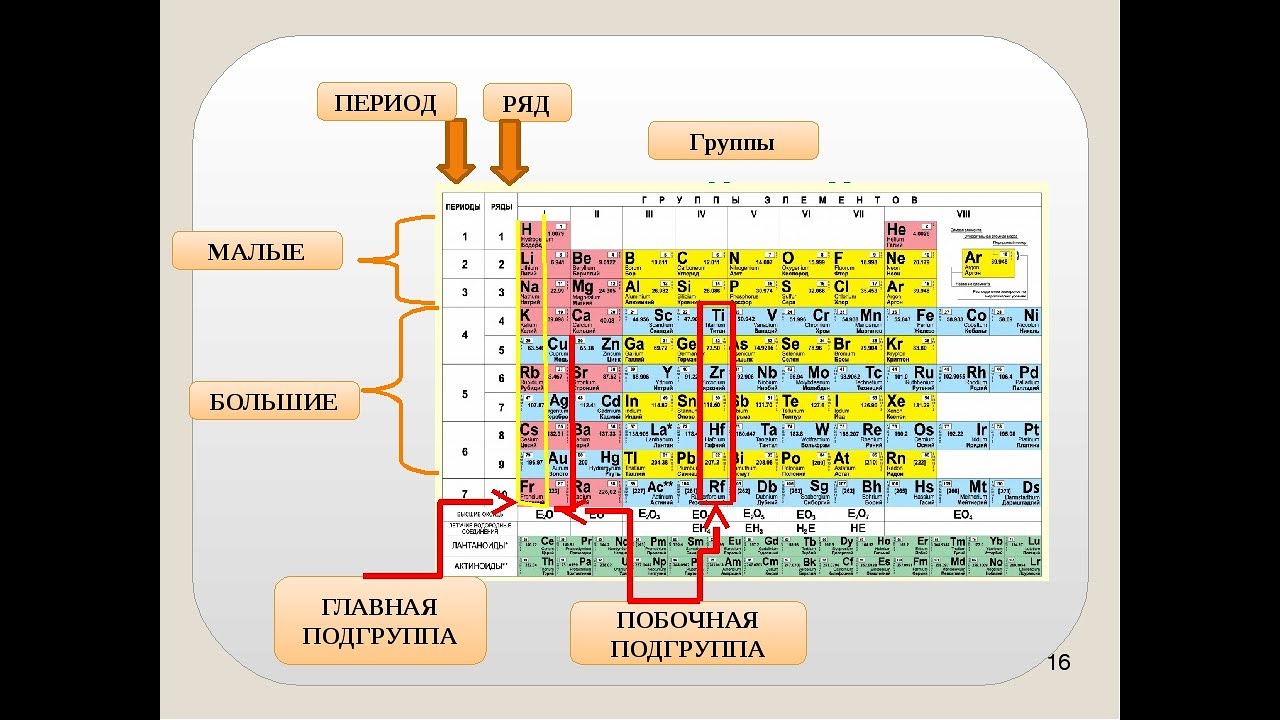
В таблице перечислены энергии в электрон-вольтах, необходимые для удаления каждого последующего электрона из первых десяти элементов.
Стоит потратить некоторое время на изучение довольно резких скачков в последовательности с E1 по E10 при увеличении атомного номера. Обратите внимание на очень большие скачки энергии, необходимые для удаления электронов с 1s-орбиталей атомов элементов второго ряда Li-Ne.
Энергия ионизации увеличивается с зарядом ядра Z , когда мы перемещаем по периодической таблице.Они уменьшаются по мере того, как мы перемещаемся на вниз на по таблице, потому что в каждый период электрон удаляется из оболочки на один шаг дальше от ядра, чем в атоме непосредственно над ним. Это приводит к знакомым зигзагообразным линиям, когда первая энергия ионизации отображается как функция Z.
Этот более подробный график энергий ионизации атомов первых десяти элементов показывает некоторые интересные неоднородности, которые могут быть связаны с немного более низкими энергиями (большей стабильностью) электронов в наполовину заполненных (неспаренных по спину) подоболочках по сравнению с полностью заполненными подоболочками. .
.Изображение энергий ионизации основных элементов группы в контексте периодической таблицы предлагает более полное представление об этих тенденциях.
Некоторые моменты, на которые следует обратить внимание:
- Благородные газы имеют самые высокие IE из всех элементов за этот период. Это не имеет ничего общего с какой-либо загадочной «особой стабильностью» электронной конфигурации s 2 p 6 ; дело просто в том, что высокий ядерный заряд действует на более сжатые орбитали. IE
- (как и многие другие свойства) обычно не сильно различаются среди элементов d -block. Это отражает тот факт, что по мере заполнения более компактных орбиталей d они оказывают экранирующий эффект, который частично компенсирует этот увеличивающийся ядерный заряд на наиболее удаленных орбиталях s с более высоким главным квантовым числом.
- Каждый из элементов Группы 13 имеет более низкий первый IE, чем у предшествующего ему элемента.
 Изменение тенденции IE в этой группе часто объясняется более легким удалением единственного p-электрона внешней оболочки по сравнению с электронами, содержащимися в заполненных (и, таким образом, спаренных) s – и d -орбиталях. в предыдущих элементах.
Изменение тенденции IE в этой группе часто объясняется более легким удалением единственного p-электрона внешней оболочки по сравнению с электронами, содержащимися в заполненных (и, таким образом, спаренных) s – и d -орбиталях. в предыдущих элементах.
Периодические тенденции сродства к электрону
Образование отрицательного иона происходит, когда электрон из некоторого внешнего источника входит в атом и оказывается на орбитали с наименьшей энергией, на которой есть вакансия. Поскольку входящий электрон притягивается к положительному ядру, образование отрицательных ионов обычно экзотермично. Выделяемая энергия – это сродство к электрону атома. Для некоторых атомов сродство к электрону оказывается слегка отрицательным, что позволяет предположить, что электрон-электронное отталкивание является доминирующим фактором в этих случаях.
В общем, сродство к электрону, как правило, намного меньше энергии ионизации, что позволяет предположить, что они контролируются противоположными факторами, имеющими схожие величины. Этими двумя факторами, как и прежде, являются заряд ядра и электрон-электронное отталкивание. Но последний, лишь второстепенный участник образования положительных ионов, теперь имеет гораздо большее значение. Одна из причин этого заключается в том, что электроны, содержащиеся во внутренних оболочках атома, создают коллективный отрицательный заряд, который частично нейтрализует заряд ядра, таким образом оказывая так называемый экранирующий эффект, который уменьшает тенденцию к образованию отрицательных ионов.
Этими двумя факторами, как и прежде, являются заряд ядра и электрон-электронное отталкивание. Но последний, лишь второстепенный участник образования положительных ионов, теперь имеет гораздо большее значение. Одна из причин этого заключается в том, что электроны, содержащиеся во внутренних оболочках атома, создают коллективный отрицательный заряд, который частично нейтрализует заряд ядра, таким образом оказывая так называемый экранирующий эффект, который уменьшает тенденцию к образованию отрицательных ионов.
Из-за этих противоположных эффектов периодические тенденции сродства к электрону не так ясны, как тенденции энергий ионизации. Это особенно очевидно в первых нескольких строках периодической таблицы, в которой небольшие эффекты имеют тенденцию к усилению в любом случае, потому что добавленный электрон вызывает большое процентное увеличение количества электронов в атоме.
В целом, мы можем сказать, что сродство к электрону становится более экзотермическим, когда мы движемся слева направо через период (из-за увеличения заряда ядра и меньшего размера атома). Однако есть некоторые интересные отклонения:
Однако есть некоторые интересные отклонения:
- В элементах Группы 2 заполненная орбиталь 2 s очевидно защищает ядро настолько эффективно, что сродство к электрону является слегка эндотермическим.
- Элементы Группы 15 имеют довольно низкие значения, возможно, из-за необходимости разместить добавленный электрон на наполовину заполненной орбитали p ; почему электронное сродство азота должно быть эндотермическим, не ясно. Вертикальная тенденция заключается в том, что сродство к электрону становится менее экзотермическим в последовательные периоды из-за лучшего экранирования ядра большим количеством внутренних оболочек и большего размера атома, но здесь также есть некоторые очевидные аномалии.
Электроотрицательность
Когда два элемента соединены в химическую связь, элемент, который сильнее притягивает общие электроны, является более электроотрицательным . Элементы с низкой электроотрицательностью (металлические элементы) называются электроположительными .
Важно понимать, что электроотрицательность – это свойства атомов, которые химически связаны друг с другом; нет способа измерить электроотрицательность изолированного атома.
Периодические тренды сродства к электрону
(TheChemSolution, 5½ мин.)
Как сродство к электрону, энергия ионизации и электроотрицательность связаны друг с другом
(ChristinaStein, 5½ мин.)
Более того, один и тот же атом может проявлять разную электроотрицательность в разных химических средах, поэтому «электроотрицательность элемента» является лишь общим руководством по его химическому поведению, а не точной спецификацией его поведения в конкретном соединении.Тем не менее, электроотрицательность в высшей степени полезна для обобщения химического поведения элемента. Вы будете широко использовать электроотрицательность, когда будете изучать химические связи и химию отдельных элементов.
Поскольку не существует единого определения электроотрицательности, любая числовая шкала для ее измерения обязательно должна быть в некоторой степени произвольной. Большинство таких шкал сами по себе основаны на атомных свойствах, которые можно измерить напрямую и которые так или иначе связаны со склонностью к притяжению электронов.
Большинство таких шкал сами по себе основаны на атомных свойствах, которые можно измерить напрямую и которые так или иначе связаны со склонностью к притяжению электронов.
Самая широко используемая из этих шкал была разработана Линусом Полингом и связана с энергией ионизации и сродством к электрону.
Шкала Полинга от 0 до 4; самое высокое сродство к электрону, 4,0, приписывается фтору, в то время как цезий имеет самое низкое значение 0,7. Значения менее 2,2 обычно связаны с электроположительным или металлическим характером. В представлении шкалы, показанном на рисунке, элементы расположены в ряды, соответствующие их положению в периодической таблице.Корреляция очевидна; электроотрицательность связана с верхними строками и крайними правыми столбцами.
Расположение водорода на этой шкале отражает некоторые важные химические свойства этого элемента. Хотя он во многих отношениях действует как металлический элемент (например, образует положительный ион), он также может образовывать твердые гидрид-ионные (H –) твердые тела с более электроположительными элементами и, конечно же, своей способностью делить электроны с углеродом. и другие p -блочные элементы дают начало очень богатой химии, включая, конечно, миллионы органических соединений.
и другие p -блочные элементы дают начало очень богатой химии, включая, конечно, миллионы органических соединений.
Что вы должны уметь
Убедитесь, что вы полностью понимаете следующие основные концепции, представленные выше.
- Вы должны быть в состоянии набросать общую форму периодической таблицы и идентифицировать различные блоков и определить групп , соответствующих щелочным металлам , переходным элементам , галогенам и галогенам благородные газы .
- Для первых восемнадцати элементов вы должны уметь предсказать формулы типичных бинарных соединений, которые, как можно ожидать, они образуют с водородом и кислородом.
- Прокомментируйте концепцию «размера» атома и приведите примеры того, как определяются радиусы, по крайней мере, в двух классах веществ.
- Определите энергию ионизации и сродство к электрону и объясните периодические общие тенденции.

- Укажите значение и значение электроотрицательность .
Концептуальная карта
Периодическая таблица
В 19 веке были обнаружены многие ранее неизвестные элементы, и ученые отметили, что определенные наборы элементов имеют схожие химические свойства. Например, хлор, бром и йод реагируют с другими элементами (такими как натрий) с образованием подобных соединений. Точно так же литий, натрий и калий реагируют с другими элементами (такими как кислород) с образованием подобных соединений.Почему это так?
В 1864 году немецкий химик Юлиус Лотар Мейер организовал элементы по атомной массе и сгруппировал их по химическим свойствам. Позже в том же десятилетии русский химик Дмитрий Менделеев организовал все известные элементы по схожим свойствам. Он оставил пробелы в своей таблице для того, что считал неоткрытыми элементами, и сделал несколько смелых прогнозов относительно свойств этих неоткрытых элементов. Когда позже были обнаружены элементы, свойства которых полностью соответствовали предсказаниям Менделеева, его версия таблицы завоевала признание научного сообщества.Поскольку определенные свойства элементов регулярно повторяются по всей таблице (то есть они периодические), она стала известна как периодическая таблица – таблица элементов, в которой элементы группируются по некоторым из их свойств. один из краеугольных камней химии, потому что он организует все известные элементы на основе их химических свойств. Современная версия показана на рисунке 2.7 «Современная периодическая таблица». Большинство периодических таблиц предоставляют дополнительные данные (например, атомную массу) в поле, содержащем символ каждого элемента.Элементы перечислены в порядке их атомного номера.
Когда позже были обнаружены элементы, свойства которых полностью соответствовали предсказаниям Менделеева, его версия таблицы завоевала признание научного сообщества.Поскольку определенные свойства элементов регулярно повторяются по всей таблице (то есть они периодические), она стала известна как периодическая таблица – таблица элементов, в которой элементы группируются по некоторым из их свойств. один из краеугольных камней химии, потому что он организует все известные элементы на основе их химических свойств. Современная версия показана на рисунке 2.7 «Современная периодическая таблица». Большинство периодических таблиц предоставляют дополнительные данные (например, атомную массу) в поле, содержащем символ каждого элемента.Элементы перечислены в порядке их атомного номера.
Характеристики Периодической таблицы
Элементы, которые имеют аналогичные химические свойства, сгруппированы в столбцы, называемые группами (или семействами). Столбец элементов в периодической таблице. Некоторые из этих групп не только пронумерованы, но и имеют имена, например, щелочные металлы (первый столбец элементов), щелочноземельных металлов (второй столбец элементов), галогенов (предпоследний столбец элементов) и благородных газов (последний столбец элементов).
Некоторые из этих групп не только пронумерованы, но и имеют имена, например, щелочные металлы (первый столбец элементов), щелочноземельных металлов (второй столбец элементов), галогенов (предпоследний столбец элементов) и благородных газов (последний столбец элементов).
Примечание
Слово галоген происходит от греческого слова «солеобразователь», потому что эти элементы объединяются с другими элементами, образуя группу соединений, называемых солями.
На ваше здоровье: радон
Радон – это невидимый благородный газ без запаха, который медленно выделяется из земли, особенно из горных пород и почв с высоким содержанием урана. Поскольку это благородный газ, радон химически неактивен.К сожалению, он радиоактивен, и повышенное его воздействие коррелирует с повышенным риском рака легких.
Поскольку радон исходит из земли, мы не можем полностью его избежать. Более того, поскольку он плотнее воздуха, радон имеет тенденцию накапливаться в подвалах, которые при неправильной вентиляции могут быть опасны для жителей здания. К счастью, специализированная вентиляция сводит к минимуму количество собираемого радона. Доступны специальные вентиляционные системы, которые забирают воздух из-под цокольного этажа, прежде чем он попадет в жилое пространство, и вентилируют его над крышей дома.
Более того, поскольку он плотнее воздуха, радон имеет тенденцию накапливаться в подвалах, которые при неправильной вентиляции могут быть опасны для жителей здания. К счастью, специализированная вентиляция сводит к минимуму количество собираемого радона. Доступны специальные вентиляционные системы, которые забирают воздух из-под цокольного этажа, прежде чем он попадет в жилое пространство, и вентилируют его над крышей дома.
Считается, что радон является второй по значимости предотвратимой причиной рака легких в Соединенных Штатах после курения. По оценкам Американского онкологического общества, 10% всех случаев рака легких связаны с облучением радоном. Существует неуверенность в том, какие уровни воздействия вызывают рак, а также то, каким может быть точный возбудитель (радон или один из продуктов его распада, многие из которых также радиоактивны и, в отличие от радона, не являются газами). Агентство по охране окружающей среды США рекомендует проверять каждый этаж ниже третьего этажа на уровень радона, чтобы предотвратить долгосрочные последствия для здоровья.
Каждая строка элементов в периодической таблице называется периодом. Строка элементов в периодической таблице. Периоды имеют разную длину; в первом периоде всего 2 элемента (водород и гелий), а во втором и третьем периодах по 8 элементов. Четвертый и пятый периоды имеют по 18 элементов каждый, а более поздние периоды настолько длинные, что сегмент из каждого удаляется и помещается под основной частью таблицы.
Определенные свойства элементов становятся очевидными при обзоре таблицы Менделеева в целом.Каждый элемент можно классифицировать как металл, неметалл или полуметалл, как показано на Рисунке 2.8 «Типы элементов». Металл – это блестящий элемент, обычно серебристого цвета, отличный проводник тепла и электричества, податливый и пластичный. представляет собой блестящее вещество, обычно (но не всегда) серебристого цвета, которое отлично проводит электричество и тепло. Металлы бывают также пластичными (их можно раскалывать на тонкие листы) и пластичными (их можно вытягивать в тонкую проволоку). Неметалл – это элемент, который обычно тусклый, плохо проводит тепло и электричество и является хрупким.обычно унылый и плохо проводит электричество и тепло. Твердые неметаллы также очень хрупкие. Как показано на рисунке 2.8 «Типы элементов», металлы занимают три левых четверти таблицы Менделеева, в то время как неметаллы (за исключением водорода) сгруппированы в верхнем правом углу таблицы Менделеева. Элементы со свойствами, промежуточными между свойствами металлов и неметаллов, называются полуметаллами (или металлоидами). Элемент, свойства которого являются промежуточными между металлами и неметаллами.. Элементы, примыкающие к жирной линии в правой части таблицы Менделеева, обладают полуметаллическими свойствами.
Неметалл – это элемент, который обычно тусклый, плохо проводит тепло и электричество и является хрупким.обычно унылый и плохо проводит электричество и тепло. Твердые неметаллы также очень хрупкие. Как показано на рисунке 2.8 «Типы элементов», металлы занимают три левых четверти таблицы Менделеева, в то время как неметаллы (за исключением водорода) сгруппированы в верхнем правом углу таблицы Менделеева. Элементы со свойствами, промежуточными между свойствами металлов и неметаллов, называются полуметаллами (или металлоидами). Элемент, свойства которого являются промежуточными между металлами и неметаллами.. Элементы, примыкающие к жирной линии в правой части таблицы Менделеева, обладают полуметаллическими свойствами.
Рисунок 2.8 Типы элементов
Элементы бывают металлы, неметаллы или полуметаллы. Каждая группа расположена в разных частях периодической таблицы.
Другой способ категоризации элементов периодической таблицы показан на рисунке 2. 9 «Специальные имена для частей периодической таблицы». Первые два столбца слева и последние шесть столбцов справа называются элементами основной группы – элементом первых двух или последних шести столбцов периодической таблицы.. Блок из десяти столбцов между этими столбцами содержит переходные металлы. Элемент между элементами основной группы периодической таблицы. Две строки под основной частью таблицы Менделеева содержат внутренние переходные металлы. периодическая таблица. Такие металлы также называются лантанидами и актинидами. Элементы в этих двух рядах также называются, соответственно, металлами-лантаноидами и металлами-актинидами .
9 «Специальные имена для частей периодической таблицы». Первые два столбца слева и последние шесть столбцов справа называются элементами основной группы – элементом первых двух или последних шести столбцов периодической таблицы.. Блок из десяти столбцов между этими столбцами содержит переходные металлы. Элемент между элементами основной группы периодической таблицы. Две строки под основной частью таблицы Менделеева содержат внутренние переходные металлы. периодическая таблица. Такие металлы также называются лантанидами и актинидами. Элементы в этих двух рядах также называются, соответственно, металлами-лантаноидами и металлами-актинидами .
Рисунок 2.9 Специальные имена для разделов периодической таблицы
Некоторые разделы периодической таблицы имеют особые названия. Элементы литий, натрий, калий, рубидий, цезий и франций вместе известны как щелочные металлы.
Для вашего здоровья: переходные металлы в организме
Согласно Таблице 2. 2 «Элементный состав человеческого тела», большая часть элементного состава человеческого тела состоит из основных групповых элементов.Первым элементом в списке, который не является элементом основной группы, является железо с массовой долей 0,006%. Поскольку железо имеет относительно массивные атомы, оно могло бы оказаться еще ниже в списке, организованном с точки зрения процента по атомам , а не процента по массе.
2 «Элементный состав человеческого тела», большая часть элементного состава человеческого тела состоит из основных групповых элементов.Первым элементом в списке, который не является элементом основной группы, является железо с массовой долей 0,006%. Поскольку железо имеет относительно массивные атомы, оно могло бы оказаться еще ниже в списке, организованном с точки зрения процента по атомам , а не процента по массе.
Железо – переходный металл. Переходные металлы обладают интересными химическими свойствами, отчасти потому, что некоторые из их электронов находятся в подоболочках d . (Дополнительную информацию об электронных оболочках см. В разделе 2.6 «Устройство электронов».) Химический состав железа делает его ключевым компонентом правильного функционирования красных кровяных телец.
Красные кровяные тельца – это клетки, которые переносят кислород от легких к клеткам тела, а затем переносят углекислый газ от клеток к легким.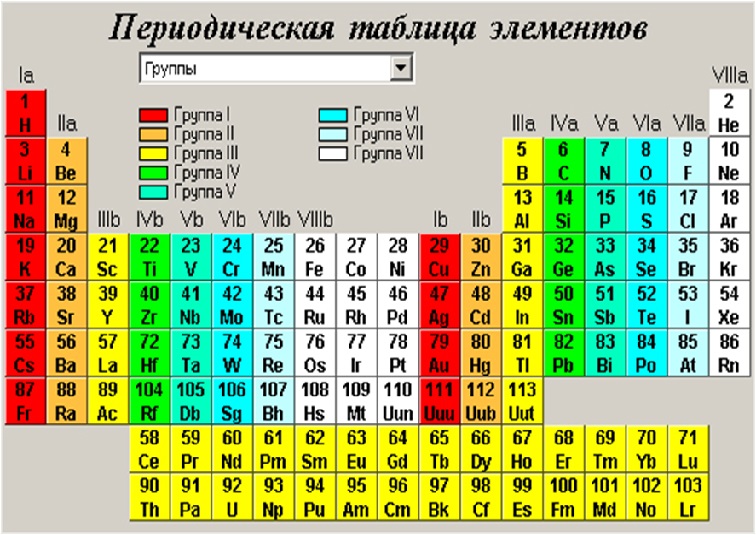 Без эритроцитов дыхание животных, каким мы его знаем, не существовало бы. Важнейшей частью красных кровяных телец является белок под названием гемоглобин . Гемоглобин соединяется с кислородом и углекислым газом, транспортируя эти газы из одного места в другое в организме.Гемоглобин – это относительно большая молекула с массой около 65000 единиц.
Без эритроцитов дыхание животных, каким мы его знаем, не существовало бы. Важнейшей частью красных кровяных телец является белок под названием гемоглобин . Гемоглобин соединяется с кислородом и углекислым газом, транспортируя эти газы из одного места в другое в организме.Гемоглобин – это относительно большая молекула с массой около 65000 единиц.
Решающим атомом в белке гемоглобина является железо. Каждая молекула гемоглобина имеет четыре атома железа, которые действуют как центры связывания кислорода. Именно присутствие этого переходного металла в красных кровяных тельцах позволяет вам использовать вдыхаемый кислород.
Другие переходные металлы выполняют важные функции в организме, несмотря на то, что они присутствуют в небольших количествах. Цинк необходим для правильного функционирования иммунной системы организма, а также для синтеза белка и роста тканей и клеток.Медь также необходима для правильного функционирования некоторых белков в организме. Марганец необходим организму для правильного метаболизма кислорода. Кобальт – необходимый компонент витамина B-12, жизненно важного питательного вещества. (Для получения дополнительной информации о белках и витаминах см. Главу 18 «Аминокислоты, белки и ферменты».) Эти последние три металла не указаны явно в Таблице 2.2 «Элементный состав человеческого тела», поэтому они присутствуют в организме. в очень небольших количествах. Однако даже эти небольшие количества необходимы для правильного функционирования организма.
Марганец необходим организму для правильного метаболизма кислорода. Кобальт – необходимый компонент витамина B-12, жизненно важного питательного вещества. (Для получения дополнительной информации о белках и витаминах см. Главу 18 «Аминокислоты, белки и ферменты».) Эти последние три металла не указаны явно в Таблице 2.2 «Элементный состав человеческого тела», поэтому они присутствуют в организме. в очень небольших количествах. Однако даже эти небольшие количества необходимы для правильного функционирования организма.
Периодическая таблица Менделеева построена на основе сходства свойств элементов, но чем объясняется это сходство? Оказывается, форма таблицы Менделеева отражает заполнение подоболочек электронами, как показано на рисунке 2.10 «Форма таблицы Менделеева». Начиная с первого периода слева направо в таблице воспроизводится порядок заполнения электронных подоболочек в атомах. Кроме того, элементы в одном столбце имеют одинаковую электронную конфигурацию валентной оболочки. Например, все элементы в первом столбце имеют один электрон s в их валентных оболочках, поэтому их электронные конфигурации можно описать как ns 1 (где n представляет собой номер оболочки). Это последнее наблюдение очень важно. Химия в значительной степени является результатом взаимодействий между валентными электронами разных атомов. Таким образом, атомы с одинаковой электронной конфигурацией валентной оболочки будут иметь схожий химический состав.
Например, все элементы в первом столбце имеют один электрон s в их валентных оболочках, поэтому их электронные конфигурации можно описать как ns 1 (где n представляет собой номер оболочки). Это последнее наблюдение очень важно. Химия в значительной степени является результатом взаимодействий между валентными электронами разных атомов. Таким образом, атомы с одинаковой электронной конфигурацией валентной оболочки будут иметь схожий химический состав.
Рисунок 2.10 Форма периодической таблицы
Форма таблицы Менделеева отражает порядок, в котором электронные оболочки и подоболочки заполняются электронами.
Пример 9
Используя переменную n для обозначения номера валентной электронной оболочки, запишите электронную конфигурацию валентной оболочки для каждой группы.
- щелочноземельные металлы
- колонна элементов, возглавляемая углеродом
Решение
- Щелочноземельные металлы находятся во втором столбце периодической таблицы Менделеева.
 Этот столбец соответствует подоболочке s , заполненной 2 электронами. Следовательно, электронная конфигурация валентной оболочки равна нс 2 .
Этот столбец соответствует подоболочке s , заполненной 2 электронами. Следовательно, электронная конфигурация валентной оболочки равна нс 2 . - Электронная конфигурация углерода: 1 s 2 2 s 2 2 p 2 . Электронная конфигурация его валентной оболочки: 2 s 2 2 p 2 . Каждый элемент в одном столбце должен иметь аналогичную конфигурацию электронов валентной оболочки, которую мы можем представить как нс 2 нп 2 .
Упражнение по развитию навыков
столбик элементов во главе с кислородом
Используя переменную n для обозначения номера валентной электронной оболочки, запишите электронную конфигурацию валентной оболочки для каждой группы.
Атомный радиус
Периодическая таблица Менделеева полезна для понимания свойств атомов, которые показывают периодические тенденции. Одним из таких свойств является атомный радиус – приблизительный размер атома. (Рисунок 2.11 «Тенденции периодической таблицы»). Как упоминалось ранее, чем выше номер оболочки, тем дальше от ядра, вероятно, будут находиться электроны в этой оболочке. Другими словами, размер атома обычно определяется номером валентной электронной оболочки. Следовательно, по мере того, как мы спускаемся по столбцу в периодической таблице, атомный радиус увеличивается. Однако, когда мы проходим через период в периодической таблице, электроны добавляются к той же валентной оболочке ; тем временем к ядру добавляется больше протонов, поэтому положительный заряд ядра увеличивается.Увеличивающийся положительный заряд сильнее притягивает электроны, притягивая их ближе к ядру. Следовательно, по мере прохождения периода атомный радиус уменьшается. Эти тенденции четко видны на Рисунке 2.11 «Тенденции Периодической таблицы».
Одним из таких свойств является атомный радиус – приблизительный размер атома. (Рисунок 2.11 «Тенденции периодической таблицы»). Как упоминалось ранее, чем выше номер оболочки, тем дальше от ядра, вероятно, будут находиться электроны в этой оболочке. Другими словами, размер атома обычно определяется номером валентной электронной оболочки. Следовательно, по мере того, как мы спускаемся по столбцу в периодической таблице, атомный радиус увеличивается. Однако, когда мы проходим через период в периодической таблице, электроны добавляются к той же валентной оболочке ; тем временем к ядру добавляется больше протонов, поэтому положительный заряд ядра увеличивается.Увеличивающийся положительный заряд сильнее притягивает электроны, притягивая их ближе к ядру. Следовательно, по мере прохождения периода атомный радиус уменьшается. Эти тенденции четко видны на Рисунке 2.11 «Тенденции Периодической таблицы».
Рисунок 2.11 Тенденции в Периодической таблице
Относительные размеры атомов показывают несколько тенденций в отношении структуры периодической таблицы. Атомы становятся больше по столбцу и меньше по периоду.
Атомы становятся больше по столбцу и меньше по периоду.
Пример 10
Используя периодическую таблицу (а не рисунок 2.11 «Тенденции периодической таблицы»), какой атом больше?
- N или Bi
- мг или Cl
Решение
- Поскольку Bi находится ниже N в периодической таблице и имеет электроны в оболочках с более высокими номерами, мы ожидаем, что атомы Bi больше N атомов.
- И Mg, и Cl относятся к периоду 3 периодической таблицы, но Cl находится правее.Поэтому мы ожидаем, что атомы Mg будут больше, чем атомы Cl.
Карьера: клинический химик
Клиническая химия – это область химии, связанная с анализом биологических жидкостей для определения состояния здоровья человеческого тела. Клинические химики измеряют множество веществ, от простых элементов, таких как натрий и калий, до сложных молекул, таких как белки и ферменты, в крови, моче и других жидкостях организма. Отсутствие или присутствие, либо аномально низкие или высокие количества вещества могут быть признаком какого-либо заболевания или признаком здоровья. Многие химики-клиницисты используют в своей работе сложное оборудование и сложные химические реакции, поэтому им необходимо не только понимать основы химии, но также знать специальные приборы и способы интерпретации результатов испытаний.
Отсутствие или присутствие, либо аномально низкие или высокие количества вещества могут быть признаком какого-либо заболевания или признаком здоровья. Многие химики-клиницисты используют в своей работе сложное оборудование и сложные химические реакции, поэтому им необходимо не только понимать основы химии, но также знать специальные приборы и способы интерпретации результатов испытаний.
Упражнения по обзору концепции
Как элементы организованы в периодическую таблицу?
Если посмотреть на таблицу Менделеева, где появляются следующие элементы?
- металлы
- неметаллы
- галогены
- переходные металлы
Опишите тенденции изменения атомных радиусов в зависимости от положения элемента в периодической таблице.
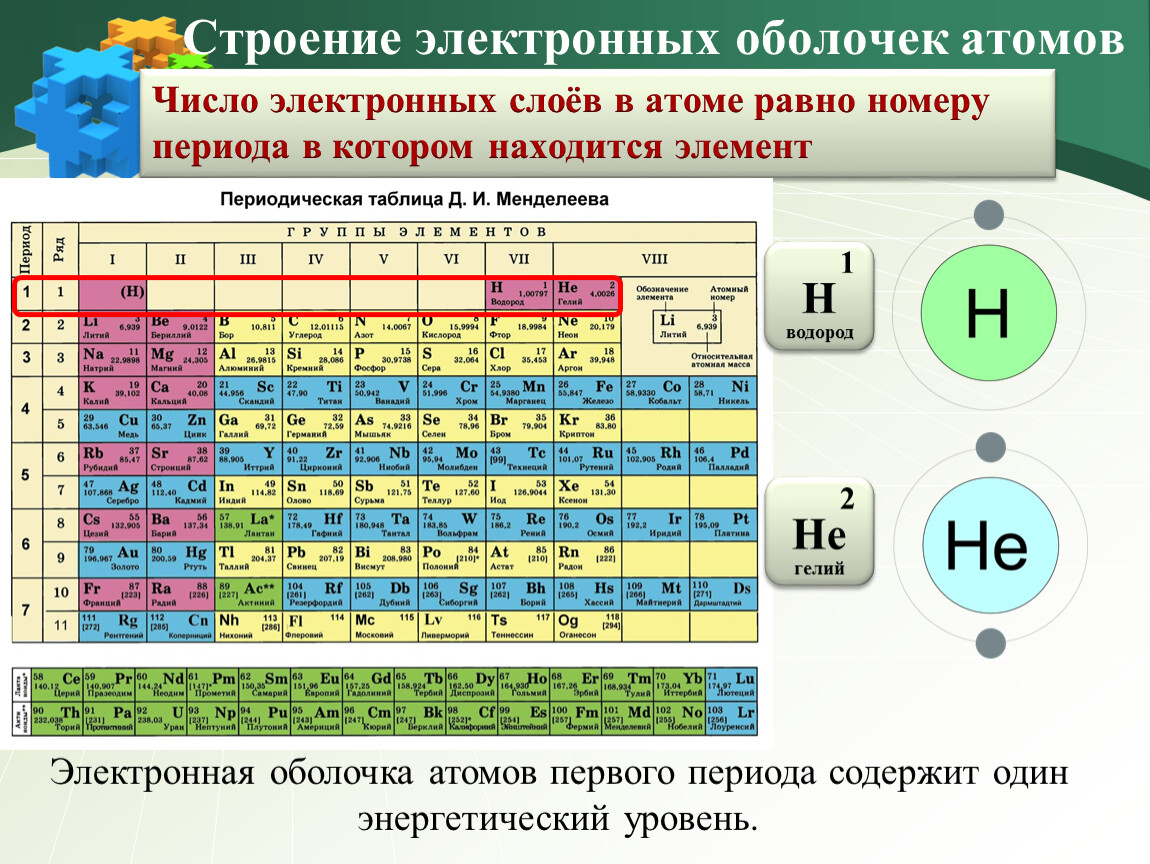
Ответы
Элементы организованы по атомным номерам.
- левые три четверти таблицы Менделеева
- правая четверть таблицы Менделеева
- предпоследний столбец таблицы Менделеева
- средняя часть таблицы Менделеева
По мере того, как вы пересекаете периодическую таблицу, атомные радиусы уменьшаются; по мере того, как вы спускаетесь по таблице Менделеева, атомные радиусы увеличиваются.
Основные выводы
- Химические элементы расположены в таблице, называемой периодической таблицей.

- Некоторые характеристики элементов связаны с их положением в таблице Менделеева.
Упражнения
Какие элементы имеют химические свойства, аналогичные свойствам магния?
- натрий
- фтор
- кальций
- барий
- селен
Какие элементы имеют химические свойства, аналогичные свойствам лития?
- натрий
- кальций
- бериллий
- барий
- калий
Какие элементы имеют химические свойства, аналогичные свойствам хлора?
- натрий
- фтор
- кальций
- йод
- сера
Какие элементы имеют химические свойства, аналогичные свойствам углерода?
- кремний
- кислород
- германий
- барий
- аргон
Какие элементы относятся к щелочным металлам?
- натрий
- магний
- алюминий
- калий
- кальций
Какие элементы относятся к щелочноземельным металлам?
- натрий
- магний
- алюминий
- калий
- кальций
Какие элементы являются галогенами?
- кислород
- фтор
- хлор
- сера
- углерод
Какие элементы являются благородными газами?
- гелий
- водород
- кислород
- неон
- хлор
Какие пары элементов находятся в одном периоде?
- H и Li
- H и He
- Na и S
- Na и Rb
Какие пары элементов находятся в одном периоде?
- V и Nb
- К и Br
- Na и P
- Li и Mg
Какой атом имеет больший атомный радиус в каждой паре атомов?
- H и Li
- N и P
- Cl и Ar
- Al и Cl
Какой атом имеет больший атомный радиус в каждой паре атомов?
- H и He
- N и F
- Cl и Br
- А1 и В
Скандий является (металл, неметалл, полуметалл) и входит в (элементы основной группы, переходные металлы).

Кремний является (металл, неметалл, полуметалл) и входит в (элементы основной группы, переходные металлы).
Лантаноиды, редкоземельные элементы – колодцы – – Основные справочные работы
Лантаноиды (или лантаноны) представляют собой группу из 15 элементов с атомными номерами от 57 до 71, в которые иногда включаются скандий (атомный номер 21) и иттрий (атомный номер 39).Собственно ряд лантанидов – это группа химических элементов, которые следуют за лантаном в его позиции столбца группы IIIB периодической таблицы. Их отличительной атомной особенностью является то, что они заполняют электронную подоболочку 4 f . Фактически, только элементы с атомными номерами 58–71 являются лантаноидами. Большинство химиков также включают лантан в эту серию, потому что, хотя он не заполняет подоболочку 4 f , его свойства очень похожи на свойства лантаноидов.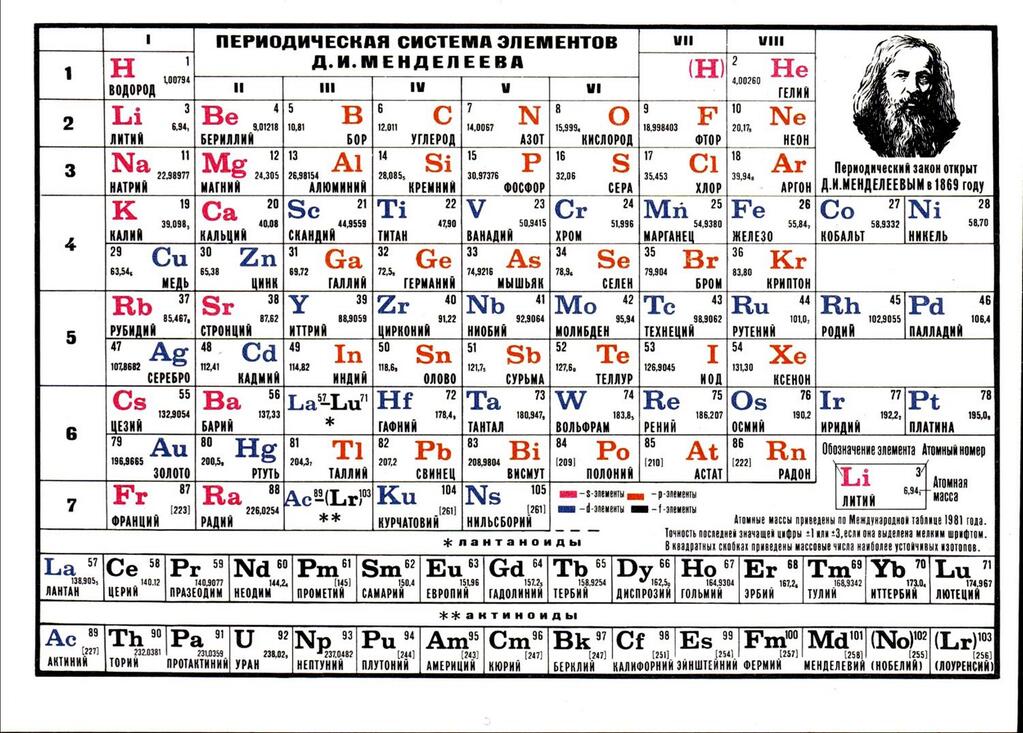 Элементы скандий и иттрий также известны как «редкоземельные элементы», потому что они были первоначально обнаружены вместе с лантаноидами в редких минералах и изолированы в виде оксидов или «земель».В совокупности эти металлы также называют редкоземельными элементами (РЗЭ). Однако по сравнению со многими другими элементами редкоземельные элементы не являются редкими, за исключением прометия, который имеет только радиоактивные изотопы. Иттрия, лантана, церия и неодима в земной коре больше, чем свинца. Все, кроме прометия, который, вероятно, не встречается в природе, более распространены, чем кадмий. Приведены относительная численность и атомные номера. Наиболее распространенные соединения лантаноидов перечислены в разделе 1.
Элементы скандий и иттрий также известны как «редкоземельные элементы», потому что они были первоначально обнаружены вместе с лантаноидами в редких минералах и изолированы в виде оксидов или «земель».В совокупности эти металлы также называют редкоземельными элементами (РЗЭ). Однако по сравнению со многими другими элементами редкоземельные элементы не являются редкими, за исключением прометия, который имеет только радиоактивные изотопы. Иттрия, лантана, церия и неодима в земной коре больше, чем свинца. Все, кроме прометия, который, вероятно, не встречается в природе, более распространены, чем кадмий. Приведены относительная численность и атомные номера. Наиболее распространенные соединения лантаноидов перечислены в разделе 1.
Скандий – серебристо-белый металлический химический элемент, первый член первой серии переходных металлов в периодической таблице. Название происходит из Скандинавии, где этот элемент был обнаружен в минералах эвксените и гадолините. В 1876 г. Л. Ф. Нильсон получил около 2 г оксида скандия высокой чистоты. Впоследствии было установлено, что скандий соответствует элементу «экаборон», предсказанному Менделеевым на основании разрыва в периодической таблице. Скандий в небольших количествах содержится в более чем 800 минералах и вызывает синий цвет аквамаринового берилла.
Нильсон получил около 2 г оксида скандия высокой чистоты. Впоследствии было установлено, что скандий соответствует элементу «экаборон», предсказанному Менделеевым на основании разрыва в периодической таблице. Скандий в небольших количествах содержится в более чем 800 минералах и вызывает синий цвет аквамаринового берилла.
Иттрий – один из четырех химических элементов (другие – эрбий, тербий и иттербий), названных в честь Иттерби, деревни в Швеции, богатой необычными минералами и редкоземельными элементами. Иттрий – это металл с серебристым блеском и свойствами, близкими к свойствам редкоземельных металлов. Это первый член второй серии переходных металлов. Иттрий содержится в нескольких минералах и производится в основном из рудного материала ксенотим.
Лантан – белый ковкий металл; это первый член третьей серии переходных металлов и первый из редкоземельных элементов.Лантан встречается с другими лантаноидами в рудных минералах монаците, бастнезите и ксенотиме, а также в других минералах.