(PDF) Стабильность химических элементов в условиях жизни
Эволюция элементарного состава живых организмов
Некоторые сформулированные ранее правила и корреляции [2, 4, 7-10], как уже
отмечалось, является приближенным. Однако во многих случаях они полезны для
выявления термодинамической направленности процессов эволюции и старения живых
существ. Например, хорошо известно, что химические вещества в обычных условиях,
содержащие C-N, O-N, H-N связи, являются весьма нестабильными. Это объясняется
тем, что указанные соединения легко перегруппировываются с образованием
стабильных молекул азота – N2, двуокиси углерода – CO2, воды – h3O и других
подобных продуктов. Примерами таких нестабильных энергоемких веществ являются
нитроглицерин, гексоген и тринитротолуол. Эти и другие аналогичные
азотсодержащие соединения образуют сравнительно стабильные супрамолекулярные
структуры и применяются в качестве реактивных топлив и взрывчатых веществ.
В ряде случаев «многоэлементных» по составу молекул (молекул содержащих H, C, N,
O и другие элементы) они (эти молекулы) содержат не только указанные выше связи.
Так, мочевина, CO(NH₂)₂, глицин, N h3 —C h3 —C O O H, другие аминокислоты являются
весьма стабильными, хотя содержат не только кислород, но и азот (N h3 – группы).
Таким образом, представленные правила можно (целесообразно) использовать,
рассматривая органические молекулы, содержащие структуры, образованные из трех
элементов: «H, C, N» и «H, C, O» или принимать во внимание наличие в молекулах
упомянутых связей . Однако, еще раз отметим, что иногда удобно руководствоваться
качественным утверждением: атомы кислорода (особенно кислород, участвующие в
образовании связей C=O, C-OH ) в молекулах способствует их стабильности, тогда как
присутствие атомов азота удаляет эти молекулы от стабильности”. Более точные
оценки стабильности химических веществ (устойчивости по отношению к элементам
их образующих) можно делать с помощью методов учитывающих вклады валентных
связей и (или) групповые вклады. Групповые вклады удельной функции Гиббса
Групповые вклады удельной функции Гиббса
образовании соответствуют стабильности этих групп относительно элементов их
образующих.
Доказательством направленного действия «принципа стабильности вещества» является
сравнительное повышенное накопление атомов азота, фосфора, а также серы
организмами при развитии биологической эволюции. Рассмотрим данные Таблицы 1, в
которой проведено сопоставление содержания химических элементов – органогенов
(% масс.) в растениях и животных (по А.П.Виноградову).
. Общая химия: учебник / А. В. Жолнин; под ред. В. А. Попкова, А. В. Жолнина. – 2012, 400с.
Химические элементы в окружающей среде. Таблица 10.10. http://vmede.org/sait/?
page=13&id=Obwaja_himija_jolina_2012&menu=Obwaja_himija_jolina_2012
Таблица 1.
Содержание органогенов (% масс.) в растениях и животных (по А.П.Виноградову)
[11].
Новые поступления :: Набор химических элементов демонстрационный
Данное учебное пособие представляет собой Периодическую таблицу Д.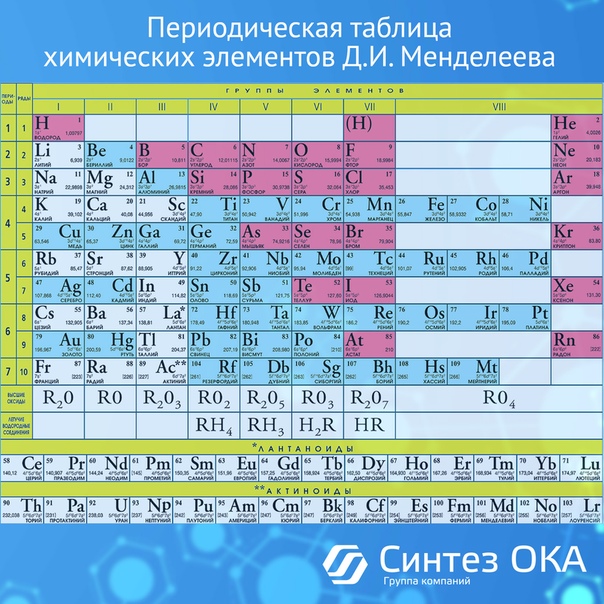 И. Менделеева с набором образцов химических элементов в ампулах и служит для наглядного представление периодического закона Д.И.Менделеева, демонстрации химических элементов, определения физико-химических свойств элементов в нормальных условиях.
И. Менделеева с набором образцов химических элементов в ампулах и служит для наглядного представление периодического закона Д.И.Менделеева, демонстрации химических элементов, определения физико-химических свойств элементов в нормальных условиях.
Набор образцов химических элементов в ампулах помещен в буковый короб, на дне и крышке которого изображены длиннопериодические варианты Периодической таблицы Д.И. Менделева по двум классификациям – по семействам химических элементов и по электронной конфигурации.
Всего в таблице 118 химических элементов, в соответствии с рекомендациями IUPAC.
Для каждого химического элемента представлена следующая информация:
– Обозначение;
– Наименование;
– Порядковый номер;
– Относительная атомная масса;
– Распределение электронов по энергетическим уровням.
Образцы химических элементов герметично упакованы в прозрачные ампулы, на этикетках которых имеется цветовая индикация и краткая информация об содержащемся в ней химическом элементе.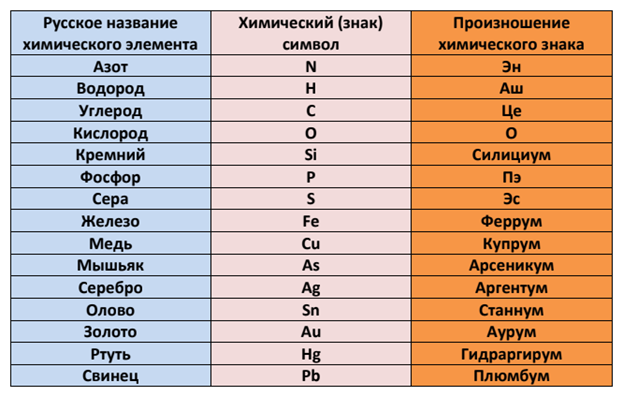
Цветовая индикация блоков элементов:
S – элементы (красного цвета) 14 штук
P – элементы (желтого цвета) 36 штук
D – элементы (синего цвета) 38 штук
F – элементы (зеленого цвета) 30 штук
Ампул с реальными образцами химических элементов 75 штук. Опасные и радиоактивные элементы представлены пустыми ампулами с соответствующими информационными знаками.
В коробе: ампулы с крышками (43х16мм.) с обозначением химических элементов 118 штук, короб из бука (542х357х72мм.), с печатной периодической таблицей на дне, ложемент на 118 отверстий, диаметром 17мм. из органического стекла (525х325х3мм.), крышка короба (324х515х3мм.), с печатной периодической таблицей на внутренней стороне, материал органическоестекло, размер короба 550х360х80мм.
Производитель оставляет за собой право вносить изменения в комплектацию учебного пособия
Набор химических элементов демонстрационный купить со скидкой и с нашей доставкой вы можете, обратившись в нашу компанию
Чтение химических формул – Справочник химика 21
ПРАВИЛА ЧТЕНИЯ ХИМИЧЕСКИХ ФОРМУЛ И УРАВНЕНИЙ [c. 88]
88]Запишите химическую формулу гипса и переходите к чтению рубрики 38. [c.219]
Чтение химических формул [c.226]
Для закрепления навыков пользования химической номенклатурой при чтении уравнений реакций и вообще при устном ответе следует произносить названия веществ по международной номенклатуре, а не читать символы элементов и индексы в фор.муле (напри.мер, купрум-эс-о-четыре ). Для выработки этого навыка в пособии широко используются названия веществ по. международной но.менклатуре в.место их формул, если последние очевидны.
Запишите химические формулы этих соединений. Не в их число натриевые и кальциевые соли угольной кислот рядом с каждой формулой название соответствующего сое Переходите к чтению рубрики 9. [c.289]
Запишите название и химическую формулу этого соединения, а затем переходите к чтению рубрики 13. “ [c.395]
“ [c.395]
Изучение отдельных глав книги рекомендуется проводить в два этапа. При первом чтении создается общее представление о содержании главы и выясняются ее трудные места. При повторном изучении темы усваиваются сущность вопроса, теоретические положения, их приложения, математические зависимости, уравнения химических реакций. Подавляющее большинство людей легче усваивает прочитанное, если параллельно с чтением книги ведут конспект. Работа над конспектом способствует сосредоточенности внимания, помогает пониманию прочитанного и является средством самоконтроля. Лучшая форма конспектирования учебника — тезисная. Тезис, сформулированный студентами на основе изучения учебника, передает не только содержание книги, но и отношение читающего к изучаемому материалу. Прежде чем записать мысль, необходимо обдумать ее формулировку и выразить ее своими словами. Однако наиболее важные положения и определения целесообразно приводить в виде выписок и цитат. Необходимо заносить в конспекты основные законы и понятия химии, формулы и уравнения реакций, математические зависимости, незнакомые термины и названия.
Изучение отдельных глав книги рекомендуется проводить в два этапа. При первом чтении создается общее представление о содержании и выясняются ее трудные места. При повторном изучении темы легче понять сущность вопроса, теоретические положения, их применение, математические зависимости, уравнения химических реакций. Подавляющее большинство людей легче усваивают прочитанное, если параллельно с чтением книги ведут конспект. Работа над конспектом помогает пониманию прочитанного и является средством самоконтроля. Лучшая форма конспектирования учебника — тезисная. Тезис, сформулированный самостоятельно при чтении учебника, передает не только содержание книги,- но и отношение к изучаемому материалу. Наиболее важные положения и определения целесообразно выписывать дословно. Рекомендуется заносить в конспекты основные законы и понятия, формулы и уравнения реакций, математические расчеты, незнакомые термины и названия.
В учебнике крупными оранжевыми буквами выделены определения. Широкие белые поля на каждой странице гигиеничны, позволяют отдыхать глазам при чтении. Разнообразие шрифтов, а также наличие на многих страницах оранжевого и темносерого цветов снимают монотонность при чтении и устраняют скуку. В оранжевых рамках выделены алгоритмы (например, составления формул), образцы химических расчетов (например, расчет молекулярной массы вещества), а в темно-серых рамках приведены исторические факты, высказывания ученых и даже выдержки из детских сочинений о химии. Все это возбуждает интерес и желание вникнуть в содержание. Довольно крупный шрифт позволяет не перегружать страницу учебника. Все это имеет большую методическую ценность.
Ознакомимся с важнейшими физико-химическими свойствами некоторых газов, исследование которых имеет большое значение для различных отраслей промышленности.
 Предварительно, для удобства и облегчения чтения, напомним вкратце содержание понятий, определений и формул, с которыми мы будем встречаться при дальнейшем изложении материала.
Предварительно, для удобства и облегчения чтения, напомним вкратце содержание понятий, определений и формул, с которыми мы будем встречаться при дальнейшем изложении материала. Н. Н. Зинин начал свои работы, когда в органической химии господствовала теория радикалов, затем, в 50-е годы, он стал горячим приверженцем теории типов после становления теории химического строения в 60-х годах он долгое время избегал пользоваться структурными формулами, ограничиваясь выражением в своих формулах лишь эмпирического состава изучавшихся им соединений. В какой-то мере это было оправдано тем, что он занимался сложными соединениями бензойного ряда, тогда как структурная формула бензола была установлена в 1865 г., а нафталина лишь в 1869 г., причем далеко не все их признавали. Перевод формул Зинина на язык структурной теории читатель найдет в примечаниях. Основное назначение примечаний — облегчить современному читателю чтение работ Н. Н. Зинина, изобилующих уже вышедшей из употребления терминологией.
Хотя в этом случае уравнение, по-видимому, более точно отражает реально происходящие события, но по сравнению с уравнением (4.7) оно несет в себе ряд неудобств протон представлен формулой НзО , которую при беглом чтении трудно отличить от НгО, причем с химической точки зрения, быть может, правильнее было бы писать не Н3О+, а НэО или что-нибудь еще в этом роде. Вода в уравнении (4.11) выступает в роли одного из реагентов, однако из выражения для константы равновесия (и в частности для константы Ка) она неизбежно выпадает, так как концентрация воды остается постоянной. Если мы будем записывать диссоциацию НА в форме уравнения (4.
Учебник включает 29 уроков раздел дополнительных текстов для чтения, тематика которых связана с тематикой текстов уроков раздел обзорных упражнений по основным грамматическим темам список слов, часто встречающийся в научно-технической литературе, и список сокращений, принятых в химической литературе правила чтения химических формул, а также список химических элементов с указанием их произношения. В учебнике имеется также краткий грамматический справочник, в котором представлен материал, изучаемый в уроках учебника. Справочник предназначается для самостоятельной работы над выделенными грамматическими темами. В конце учебнг ка даи англо-русский словарь, содержащий лексику учебника. [c.3]
Гипс имeet химическую формулу. … При обжиге гипс теряет. … Переходите к чтению рубрики 63. [c.221]
Как бы ни идеальна была формула, подсчет по ней может дать лишь приближенные результаты. Сложность и разнообразие химических соединений, составляющих органическую массу топлива, да еще разных его видов, не могут быть выражены или у,чтены никакой формулой. [c.213]
Сложность и разнообразие химических соединений, составляющих органическую массу топлива, да еще разных его видов, не могут быть выражены или у,чтены никакой формулой. [c.213]
С течением времени такая система записи валового химического состава вещества, будучи формально вполпе корректной, привела к определенной терминологической путанице. Действительно, при чтении валовой формулы вещества содержание всех элементов читается как сумма окислов окись кальция, окись углерода, окись кремния и никогда СаО, Oj или SiO не читаются [c.8]
При вводе химических формул возникают такие же сложности, как и для математических формул, но, к счастью, необходимые символы имеются на клавиатуре. Из-за ограниченных возможностей первых компьютеров авторы программ представляли химические формулы в линейном формате. При этом студенты должны были усвоить определенный формализм для чтения таких химических формул. Большинство микрокомпьютеров достаточно гибки для вывода на дисплей подстрочных и надстрочных индексов, но проблема восприятия вводных команд от студента сохраняется. Если вводные команды включают подстрочные и надстрочные индексы, то для обозначения места индикации этих чисел на экране следует ввести некоторый формальный параметр. В одном из подходов к этой проблеме для индикации того, что данная цифра должна быть надстрочным индексом, с успехом применяли клавишу SHIFT. В противном случае эти числа воспринимаются как подстрочные индексы или коэффициенты, причем программа идентифицирует два последних варианта в соответствии с контекстом [16]. [c.99]
Если вводные команды включают подстрочные и надстрочные индексы, то для обозначения места индикации этих чисел на экране следует ввести некоторый формальный параметр. В одном из подходов к этой проблеме для индикации того, что данная цифра должна быть надстрочным индексом, с успехом применяли клавишу SHIFT. В противном случае эти числа воспринимаются как подстрочные индексы или коэффициенты, причем программа идентифицирует два последних варианта в соответствии с контекстом [16]. [c.99]
В конце своей книги М. Дьюар заметил, что те дни, когда химик-органик при теоретическом обсуждении интересующих его вопросов мог ограничиваться примитивной теорией резонанса или даже результатами расчетов по простому мётоду Хюккеля (МОХ), сочтены. Именно справедливость этого утверждения и является причиной, по которой мы рекомендуем самому широкому кругу химиков эту не очень легкую для них книгу. Правда, применение метода МОХ дало органической химии много интересных и важных выводов, а полная доступность такого подхода сделала его исключительно привлекательным. Не случайно книга Стрейтвизера Теория молекулярных орбит для химиков-органиков ), в которой изложен этот метод и его приложения, — одна из наиболее часто цитируемых книг в мировой химической литературе. Однако со времени выхода этой монографии прошло более 10 лет, причем это были годы чрезвычайно интенсивной работы химиков-теоретиков, в результате которой в круг их рассмотрения включались не только новые объекты, но и развивался йовый подход, основанный на более глубоком анализе самого метода молекулярных орбита-лей. Выводы, к которым привело это направление, оказались не особенно утешительными для сторонников примитивной теории. На основании детального анализа было продемонстрировано, что применение метода Хюккеля надежно обосновано только для ограниченного круга систем (альтернантных углеводородов), распространение же его на другие молекулы (не-альтернантные углеводороды, системы с гетероатомами и т. п.) является недопустимым произволом и может приводить (и уже приводило) к ошибочным заключениям.
Не случайно книга Стрейтвизера Теория молекулярных орбит для химиков-органиков ), в которой изложен этот метод и его приложения, — одна из наиболее часто цитируемых книг в мировой химической литературе. Однако со времени выхода этой монографии прошло более 10 лет, причем это были годы чрезвычайно интенсивной работы химиков-теоретиков, в результате которой в круг их рассмотрения включались не только новые объекты, но и развивался йовый подход, основанный на более глубоком анализе самого метода молекулярных орбита-лей. Выводы, к которым привело это направление, оказались не особенно утешительными для сторонников примитивной теории. На основании детального анализа было продемонстрировано, что применение метода Хюккеля надежно обосновано только для ограниченного круга систем (альтернантных углеводородов), распространение же его на другие молекулы (не-альтернантные углеводороды, системы с гетероатомами и т. п.) является недопустимым произволом и может приводить (и уже приводило) к ошибочным заключениям.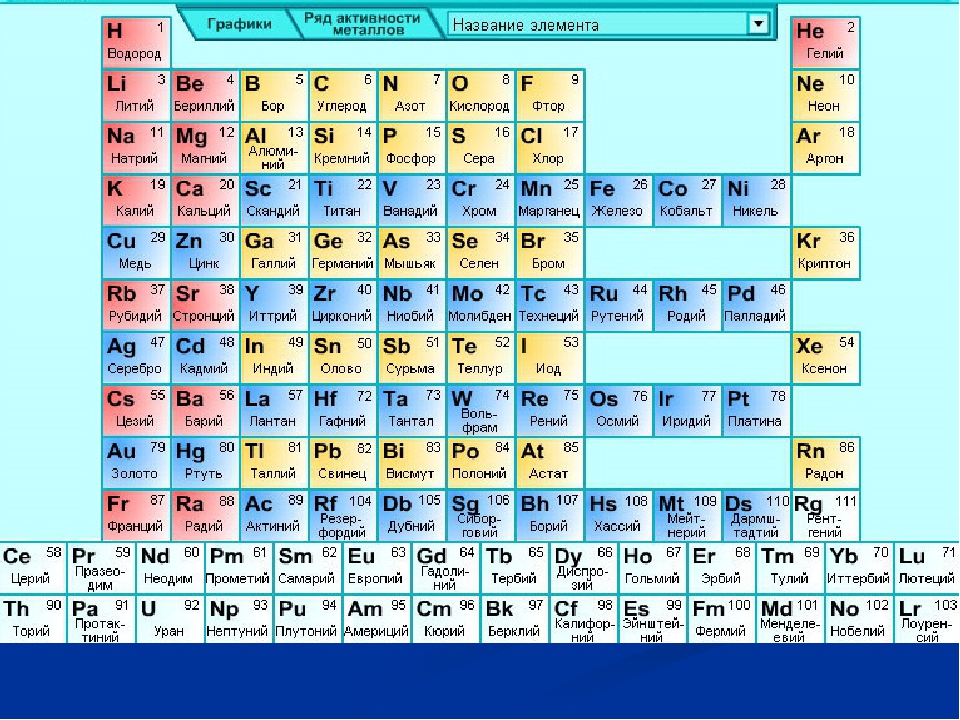 Поэтому оставаться на старых позициях оказалось невозможным. Настоящая книга и предназначена для того, чтобы служить трамплином для овладения более современным подходом, его идеями, методами и результатами. Правда, для этого необходимо преодоление некоторых трудностей. Химика могут насторожить первые главы книги, в которых нет ни одной химической формулы и на первый взгляд слишком много математических формул. Но это не должно служить препятствием для чтения этих глав. Дело [c.5]
Поэтому оставаться на старых позициях оказалось невозможным. Настоящая книга и предназначена для того, чтобы служить трамплином для овладения более современным подходом, его идеями, методами и результатами. Правда, для этого необходимо преодоление некоторых трудностей. Химика могут насторожить первые главы книги, в которых нет ни одной химической формулы и на первый взгляд слишком много математических формул. Но это не должно служить препятствием для чтения этих глав. Дело [c.5]
При чтении работ А. М. Бутлерова необходимо иметь в виду, что в работах № 1—8 и диссертациях он пользуется эквивалентными весами для углерода и кислорода, т. е. в этих работах С = 6 и О = 8 во всех остальных работах он употребляет а гомные веса, однако, для отличия между собою знаков, соответствующих эквивалентным и атомным весам элементов, перечеркивает, как это было принято в конце 1850-х — начале 60-х годов, атомные знаки углерода, кислорода, серы, цинка и т.
 д., т. е. пишет = 12, -0- = 16, 2п = 65 и т. д. (работы № 9—24 и 28). Обычное для французских журналов написание в химических формулах индексов вверху в настоящем издании везде заменено на написание их внизу как из соображений единообразия, так и потому, что сам А. М. Бутлеров в своих статьях па французском языке в изданиях Петербургской Академии Наук всегда писал индексы внизу. [c.10]
д., т. е. пишет = 12, -0- = 16, 2п = 65 и т. д. (работы № 9—24 и 28). Обычное для французских журналов написание в химических формулах индексов вверху в настоящем издании везде заменено на написание их внизу как из соображений единообразия, так и потому, что сам А. М. Бутлеров в своих статьях па французском языке в изданиях Петербургской Академии Наук всегда писал индексы внизу. [c.10] Химическая номенклатура состоит из формул и названий при этом название должно адекватно описывать формулу (т. е. состав). В части, посвященной номенклатуре неорганических веществ (глава 2), авторы книги уделяют основное внимание изложению и иллюстрированию правил построения названий соединений, но почти не рассматривают правил построения формул. По нашему глубокому убеждению написание формул должно подчиняться таким же строгим правилам, как и построение их систематических названий. Тогда переход от формулы к названию неорганического соединения окажется весьма простым и будет заключаться в чтении формулы справа налево с заменой химических символов элементов (или групп симво-“ [c. 10]
10]
Сз ществующая номенклатура складывалась стихийно, и ее состояние нельзя считать отвечающим современным требованиям. Если способы написания ф о р -м у л, в основном, общеприняты и особых изменений не требуют, то значительно хуже обстоит дело с названиями соединений. Как известно, в настоящее время параллельно применяются две основные номенклатуры таких названий — старая русская (хлористый натрий и т. п.) и приближенная к международной латинизированная (хлорид натрия и т. п.). Обе они используют заимствованную в начале прошлого века из Франции неудобную систему обратного чтения формул (тогда еще писали С1Ыа, 80 Ыа и т. д.). Очевидно, что при совершенствовании номенклатуры разумно стремиться к минимализацин логических операций, необходимых для перехода от формул к названиям и обратно, т. е. строить названия по ходу формул . Это становится особенно актуальным в связи с уже намечающимися возможностями автоматизированной обработки химических данных при помощи электронных счетно-логических машин. [c.532]
[c.532]
А. Петренко, Т. И. Шушаиская, М. Я. Голобородько и др. Ими установлено, что сведения о фактах большинство учаидих-ся усваивают лучше в процессе чтения книги, чем при слушании речи учителя. Однако не имеет смысла заменять устное изложение работой с учебником, если делаются важные теоретические обобщения, научные прогнозы. Учащиеся могут самостоятельно по учебнику изучить инструкции к выполнению опытов, систематизировать в форме таблицы или схемы фактический материал, изучить несложные вопросы, например применение веществ, распространение и круговорот их в природе, общую характеристику естественных групп химических элементов. Учебник используют и как справочник для нахождения формул, цифровых данных. Учебники используют на уроке и тогда, когда надо изучить имеющиеся в нем рисунки, схемы, таблицы. [c.41]
В английском варианте Правил ШРАС названия веществ строятся по ходу формул (например, K l — калия хлорид, h3S — водорода сульфид), что не согласуется с правилами русского литературного языка.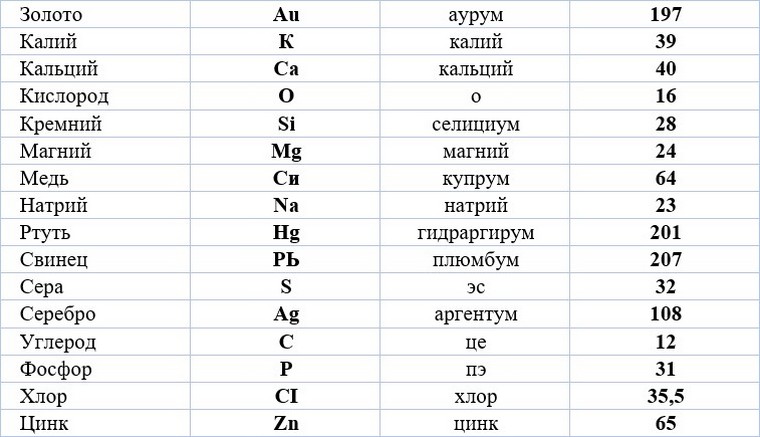 В соответствии с традицией, существующей в русском химическом языке, используется вариант номенклатуры с обратным чтением формул (например, Na l — хлорид натрия, aS — сульфид кальция). Порядок расположения элементов в формуле основывается на их положении в Периодической системе и электроотрицательности неметаллов (см. п. 1. ]. 4). [c.5]
В соответствии с традицией, существующей в русском химическом языке, используется вариант номенклатуры с обратным чтением формул (например, Na l — хлорид натрия, aS — сульфид кальция). Порядок расположения элементов в формуле основывается на их положении в Периодической системе и электроотрицательности неметаллов (см. п. 1. ]. 4). [c.5]
За исключением отдельных, специальных случаев, вычисление изотермически-изохорной работы реакции мало интересует химиков. Это своеобразно отразилось в том, что не все авторы руководств по химической термодинамике считают нужным говорить о различии величин А и Л . Так, например, даже в таком фундаментальном курсе, как Химическая термодинамика Улиха [Е—И], величины Л и обозначены просто одним символом (К), и только при весьма внимательном чтении можно понять (из сводки формул п ед 10), что для реакций при р = onst и u = onst один и тот же символ К означает все же разные величины. [c.305]
При воспроизведении формул в нашей монографии допущено дна отступления от оригинала. Оба эти отступления, не меняя ничего ио существу, позволяют устранить излишний разнобой в написании формул. Во-первых, во всех случаях мы пишем, как обычно, цифровые индексы при знаках элементов справа внизу, хотя в прошлом, главным образом во французских изданиях, было принято писать индексы справа вверху. Во-вторых, мы не воспроизводим перечеркивапие знаков углерода, кислорода II серы, которое в 50-х и 60-х годах XIX в., во время перехода от знаков, отвечающих эквивалентам, к знакам, отвечающим атомным весам, применялось, хотя и не систематично, для отличия вторых от первых. Такое отступление от оригинала тем более оправданно, что иначе пришлось бы пользоваться перечеркнутыми и неперечеркнутыми знаками в одном и том же смысле, а неперечеркнутыми знаками в двух разных значениях, что затрудняло бы чтение книги. Таким образом, химические знаки в приводимых далее формулах имеют обычное, современное значение, если не сделано оговорки, что они отвечают эквивалентным весам. [c.5]
Оба эти отступления, не меняя ничего ио существу, позволяют устранить излишний разнобой в написании формул. Во-первых, во всех случаях мы пишем, как обычно, цифровые индексы при знаках элементов справа внизу, хотя в прошлом, главным образом во французских изданиях, было принято писать индексы справа вверху. Во-вторых, мы не воспроизводим перечеркивапие знаков углерода, кислорода II серы, которое в 50-х и 60-х годах XIX в., во время перехода от знаков, отвечающих эквивалентам, к знакам, отвечающим атомным весам, применялось, хотя и не систематично, для отличия вторых от первых. Такое отступление от оригинала тем более оправданно, что иначе пришлось бы пользоваться перечеркнутыми и неперечеркнутыми знаками в одном и том же смысле, а неперечеркнутыми знаками в двух разных значениях, что затрудняло бы чтение книги. Таким образом, химические знаки в приводимых далее формулах имеют обычное, современное значение, если не сделано оговорки, что они отвечают эквивалентным весам. [c.5]
Отмеченная Гейнцем своеобразная манера, с которой Кекуле говорит о химическом строении, повидимому, применяется последним таь же в его учебнике п по отношению к современным теоретическим взглядам других химиков. По крайней мере, при чтении рассуждений Кеку. ю о рациональных формулах (Lehrb., ILS. 246) создается впечатление, что все возникшие за последние годы идеи о способе соединения атомов в молекулах высказаны впервые самим Кекуле. В статье такой прием, пожалуй, был бы безвреден. На основапип же учебника учащийся должен будет считать одного Кекуле создателем современных взглядов, относящихся к способу соединения атомов. Между тем этп взг,ляды не являются, подобно унитарной системе, созданием одного человека они стали нам ясны благодаря усилиям многих химиков и постепенно завоевали себе в науке почетное положе-пне, причем среди этих химиков Кекуле, несомненно, занимает одно из самых выдающихся мест. [c.133]
По крайней мере, при чтении рассуждений Кеку. ю о рациональных формулах (Lehrb., ILS. 246) создается впечатление, что все возникшие за последние годы идеи о способе соединения атомов в молекулах высказаны впервые самим Кекуле. В статье такой прием, пожалуй, был бы безвреден. На основапип же учебника учащийся должен будет считать одного Кекуле создателем современных взглядов, относящихся к способу соединения атомов. Между тем этп взг,ляды не являются, подобно унитарной системе, созданием одного человека они стали нам ясны благодаря усилиям многих химиков и постепенно завоевали себе в науке почетное положе-пне, причем среди этих химиков Кекуле, несомненно, занимает одно из самых выдающихся мест. [c.133]
Урок по теме “Знаки химических элементов”
Урок по теме: Что в имени тебе моем..
1. Деятельностная: формирование универсальных учебных действий при изучении знаков химических элементов
2. Предметно-дидактическая: формирование знаний учащихся о знаках химических элементов, через изучение происхождения названия химических элементов.
Планируемые образовательные результаты урока:
1. По ведущей дидактической цели: изучение нового материала.
2. По способу организации: комбинированный.
3. По ведущему методу обучения: репродуктивный.
1. Основной: объяснительно-иллюстративный.
2. Дополнительные: объяснение, рассказ, беседа, самостоятельная работа,
1. Химический язык, его основа- химическая символика
2. Совершенствование знаковой системы обозначения химических элементов
3. Этимология названия химического элемента.
Ход урока:
2. Изучение нового материала:1. Привлекает обучающихся к определении темы урока с помощью объяснения и просмотра презентации:
При изучении школьных предметов используются разные языки: русский язык, иностранный язык… При изучении многих наук используются искусственные языки, так в химии – химический язык. Это особая система условных обозначений и понятий для передачи химической информации.
Предлагает обучающимся сравнить составные части русского языка и химического языка. (слайд 2).
Русский язык – химический язык
Слова – химические формулы
Буквы- знаки химических элементов.
Предлагает обучающимся сформулировать тему урока.
В древности было распространено изречение: «Как слова состоят из букв, так и тела — из элементов».
В античности слово элемент (лат. elementum) использовалось как часть чего-то.
Более 2000 лет назад было введено понятие «атом». Совокупность атомов одного вида – химический элемент.
2. Обсуждение вопроса: возникновение и совершенствование системы химической символики.
Учитель рассказывает:
-Существовали разные представления обозначения химических элементов, веществ и явлений.
– «Элементами» у древних греков считались земля, вода, воздух и огонь (4 стихии)
-Так в древнем Египте многие процессы, например, получение золота изображали с помощью рисунка.
-В средние века ученые знали уже десять химических элементов – семь металлов (золото, серебро, медь, железо, олово, свинец, и ртуть) и три неметалла (серу, углерод, и сурьму). –Обращает внимание на обозначение химических элементов алхимиками (слайд 3).
О каких элементах говорится в стихотворении?
Семь металлов создал свет
По числу семи планет:
Дал нам Космос на добро
Медь, железо, серебро,
Злато, олово, свинец…
Сын мой! Сера – их отец!
И спеши, мой сын, узнать,
Всем им ртуть – родная мать!
С какими планетами отождествляли эти металлы?
– В 17 веке алхимики использовали различные символы (знаки) для обозначения различных веществ. (Слайд 4
-В 18 веке первую систему химических знаков изобрел учитель математики и физики в школе и колледже Джон Дальтон.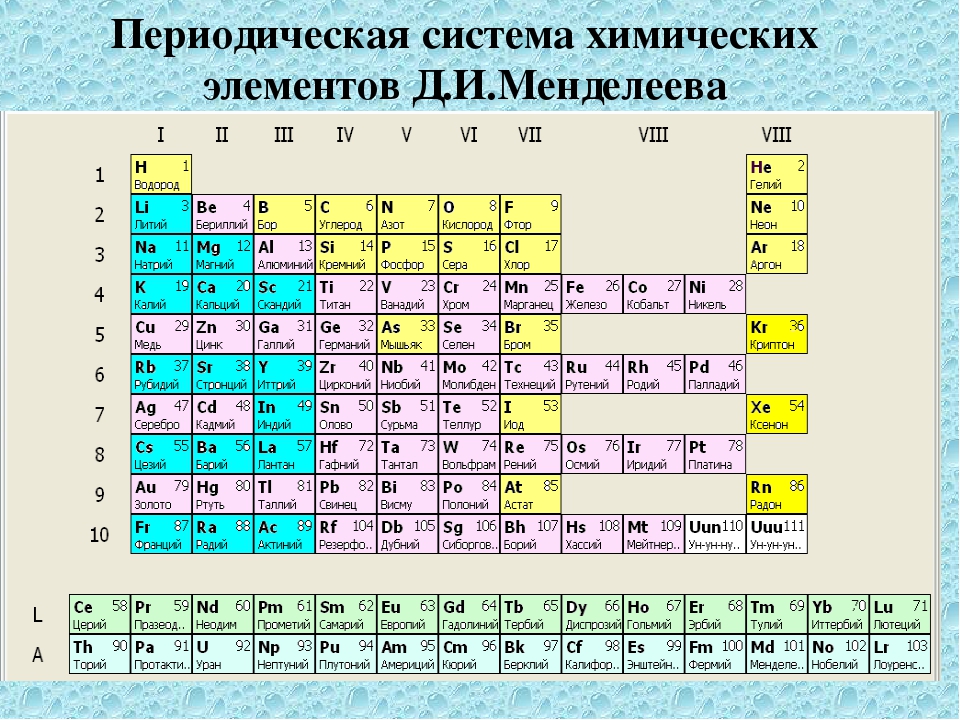 (слайд5).
(слайд5).
– Современную символику обозначения химических элементов предложил Я. Берцелиус. с помощью знаков. (слайд 6)
Знак химического элемента – буквенное обозначение химических элементов (символ).
– Д.И. Менделеев разработал научную классификацию химических элементов – Периодическую систему в форме таблицы. (слайд7)
3. Строение Периодической системы химических элементов Д.И. Менделеева
– учитель знакомит со строением таблицы: периодической системы химических элементов Д.И. Менделеева (ПСХЭ). (Слайд 7)
-Предлагает назвать химические элементы по порядковым номерам: 87, 101,92, 44, 63, 47, 96, 1, 53, 94
– Учитель предлагает распределить химические элементы по общему признаку названия и составить схему: Этимология названия химических элементов. (слайд8)
4. Учитель знакомит, как обозначаются химические элементы, что обозначают их названия, как произносятся химические элементов (слайд 9)
Предлагает выполнить задание.
Задание 1.
А) Определите название химического элемента:
Газ, легчайший и бесцветный,
неядовитый и безвредный.
Соединяясь с кислородом,
для питья дает он воду. (водород)
Б Он без запаха, без цвета,
С углеродом даст он дым,
Им окутана планета –
Без него не быть живым. (кислород)
В) Какие элементы имеют похожие названия. (углерод)
Учитель объясняет происхождение названия элементов,
Приводит примеры некоторых элементов;. (серы, фтора, железа, брома, йода, хлора, азота…)
Сера – S – от индийского «сира» – светло-желтый цвет;
Хлор – Cl – от греческого «хлорос» – зеленый;
Йод – I – от греческого « иодес» – фиолетовый.
Задание2. Какой элемент «вращается» вокруг Солнца? (Уран). Назовите какие элементы имеют подобные названия.
Учитель обращает внимание на элемент под № 52 (Теллур), названный в честь планеты Земля. (Слай10)
(Слай10)
Задание 3.
По какому признаку можно объединить названия химических элементов с пор. Номерами: 87. 44, 105.29, 21 ( слайд11)
Учитель обращает внимание на элемент под №44 Рутений. (слайд 12)
Задание 4.
Кто из героев древнегреческого мифа принес огонь людям? Название какого элемента совпадает с именем этого героя. (Прометий) Приведите примеры названий химических элементов, названных в честь героев древних мифов.(Слайд13)
Учитель обращает внимание учащихся на химические элементы, названные в честь выдающихся ученых. (слайд14,15)
Задание 5.
Определите элемент с порядковым номером 101.
Назовите сходные по названию элементы.
Учитель обращает внимание к слайдам презентации,
Задание 6.
В 2016 году таблица Менделеева пополнилась названиями сразу четырех химических элементов. Это 113-й элемент нихоний (Nihonium, Nh), 115-й — московий (Moscovium, Mc), 117-й теннесин (Tennessine, Ts) и 118-й — оганессон (Oganesson, Og). Подтверждающая информация находится на сайте Международного союза теоретической и прикладной химии (ИЮПАК). Новые элементы были верифицированы и добавлены в Периодическую таблицу Менделеева в январе 2016 года.
Подтверждающая информация находится на сайте Международного союза теоретической и прикладной химии (ИЮПАК). Новые элементы были верифицированы и добавлены в Периодическую таблицу Менделеева в январе 2016 года.
Как вы думаете, почему они так называются?
( слайд16)
5.Учитель обобщает сведения о символике химических элементов.
6. Предлагает выполнить физкультминутку.
7. В качестве закрепления учитель предлагает выполнить задание по определению химических элементов (в Приложении). Объясняет выполнение и оформление заданий.
Ведет контроль за выполнением работы.
После выполнения работы предлагает оценить правильность ответов и посчитать количество баллов.
Слушают объяснение учителя,
смотрят презентацию, участвуют в обсуждении
Отвечают на вопросы.
Сравнивают символику русского языка и химического языка.
Предлагают название темы урока.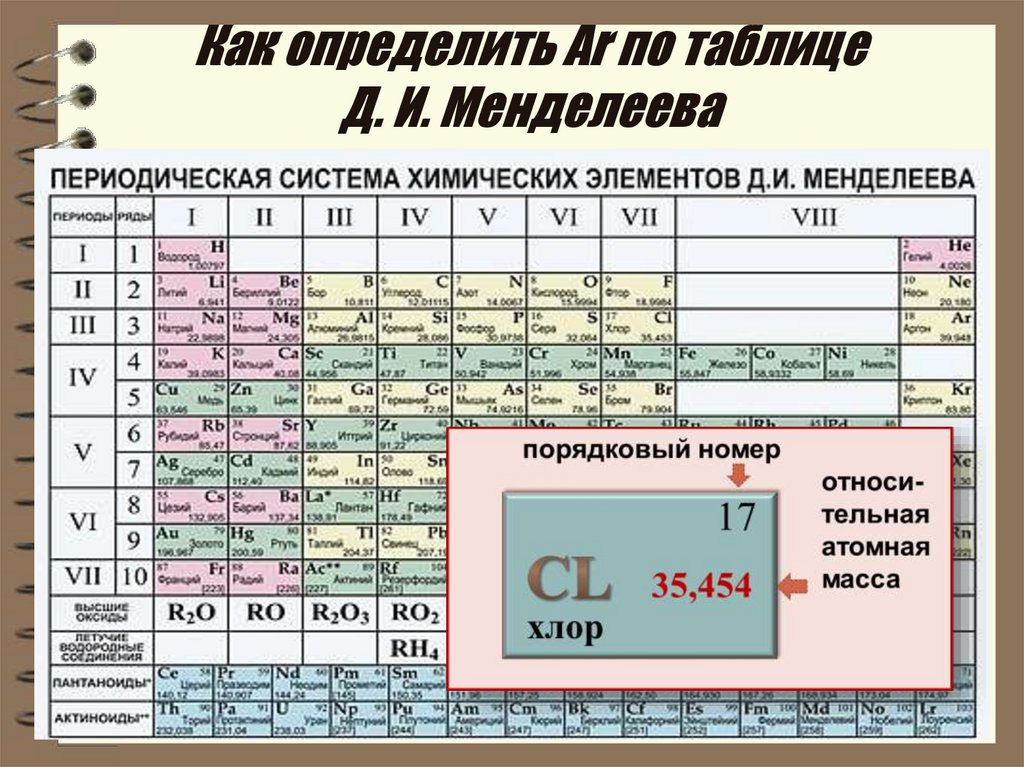
Записывают тему урока в тетрадь.
Называют химические элементы, проводят соответствие названия элемента и космических тел.
Сравнивают разные виды предлагаемых обозначений элементов и веществ. Обсуждают и выделяют недостатки и преимущества предлагаемых обозначений
Записывают в тетрадь:
Символ химического элемента – это условное обозначение химического элемента.
Изучают строение таблицы: Периодическая система химических элементов Д.И. Менделеева.
Составляют схему в тетради:
№ группы
пор. № 8Знак : О
Ат. Масса 15,99..
№
периода
Ученики выполняют задания по нахождению химических элементов по ПСХЭ им. Д.И. Менделеева (называют химические элементы)
Распределяют символы элементов по общим признакам названия и составляют схему:
Этимология названия химических элементов.
1
2
3 4 5
Работают по таблицам: ПСХЭ и Знаки химических элементов (в приложении), выполняя задания. Участвуют в обсуждении.
Учащиеся находят элементы в ПСХЭ, определяют их порядковые номера, знаки химических элементов, названия.
По приложению дают их название, знак и произношение.
Делают запись в тетради:
Элементы, названные по характерным свойствам: Н, О, С, S, Cl, I,F, Fe…
Учащиеся определяют названия химических элементов по ПСХЭ, делают запись в тетради:
Астрономические названия химических элементов: (примеры)
Географические названия химических элементов: (примеры)
Элементы, названные в честь мифологических героев: (примеры)
Элементы, названные в честь ученых: ( примеры)
Рассуждают о названии химических элементов, отвечают на поставленный вопрос.
Определяют элемент и рисуют в воздухе знак этого элемента.
Учащиеся выполняют работу.
Самопроверка и самооценка.
Учащиеся сдают работу.
Дом. Задание:
Придумайте знак и название химического элемента, если бы он был открыт в Выборге ( рисунок)
Этимология названия химического элемента с порядковым номером твоего дня рождения.
.
Рефлексия:
названия каких элементов вы запомнили
каково происхождение их названия
что понравилось на уроке
ФАМИЛИЯ ___________________ КЛАСС______ ПРИЛОЖЕНИЕ
1.ОПРЕДЕИТЕ ХИМИЧЕСКИЙ ЭЛЕМЕНТ, ЗАПИШИТЕ ЗНАК и НАЗВАНИЕ.
Какие химические элементы утверждают, что могут другие вещества «рождать»?
В состав названия какого элемента входит напиток морских пиратов?
От какого металла нужно убрать две буквы, чтобы получилась известная кость скелета животного или человека?
Название какого металла несет в себе волшебника?
2. ЗАПИШИТЕ СИМВОЛЫ ЭЛЕМЕНТОВ, УКАЗАННЫЕ В СТИХОТОВОРЕНИИ:
ЗАПИШИТЕ СИМВОЛЫ ЭЛЕМЕНТОВ, УКАЗАННЫЕ В СТИХОТОВОРЕНИИ:
3. ОПРЕДЕЛИТЕ ЛИШНИЙ ЭЛЕМЕНТ,
4. УСТАНОВИ СООТВЕТСТВИЕ С ПОМОЩЬЮ СТРЕЛОК
5.ОПРЕДЕЛИТЕ НАЗВАНИЕ ЭЛЕМЕНТОВ, классифицируйте по происхождению названия .
6.
Задание 1.
7 элементов -3 балла.
Найдены названия 9 элементов, выполнено правильно 5 баллов, 1 ошибка 4 балла, 2-3 ошибки 3 балла.
«3» – 15-20 баллов.
Трансмутация химических элементов.: viictor — LiveJournal
❝ Виктор, Здравствуйте!У меня есть несколько вопросов:
1. Технология по преобразованию химических элементов
Т.е. допустим у меня есть исходный продукт – крахмал, при помощи данной технологии можно будет
получить вещество с определенными качествами?2. Некоторые из сопутствующих технологий
Назовите еще несколько, кроме опубликованных❞
Здравствуйте, Дмитрий.
Принцип следующий:
1.В рабочую зону (бункер ) загружается руда ( любая. хим состав не принципиален. Например песок, гравий итд).
хим состав не принципиален. Например песок, гравий итд).
2.Под действием силовых полей, руда:
А) структурно расщепляется ( доатомный уровень).
В) Разносится на фракции.
С) разделяется, замыкается в отдельных отсеках.
Д) «гасится», до сворачивания в химические элементы.
В результате: в каждом отсеке сворачивается своя часть таблицы Менделеева с выходом ( вплоть до 90-100%) требуемого химического элемента. (которого в исходной руде конечно не было).
❝ Прогноз создания технологии по преобразованию химических элементов:
Период 3-5 лет ( с момента создания работоспособного коллектива) – создание полноценной схемы по преобразованию химических элементов.
Период 5-10 лет – создание промышленной отрасли осуществляющей преобразование химических элементов.
(высокорентабельные устройства перерабатывающие объемы исходной руды в требуемые редкоземельные химические элементы).❞
.
❝ Иные технологии:
Программа подразумевает практическое воплощение ряда принципиально новых технологий, доступ к которым получен в качестве сопутствующего продукта, в ходе работ по основному проекту.
Доступность смежных технологий обусловлена тем, что базовое гравитационное поле по отношению ко всем остальным физическим полям является первичным и определяющим. Получая практический доступ к базовому гравитационному полю, мы автоматически получаем доступ ко всем вторичным физическим процессам.
Некоторые из сопутствующих технологий:
– Скоростные гравитационные технологии. Создание транспортных средств использующих новый принцип перемещения (схема позволяет придавать объекту, обладающему реальной физической массой скоростные режимы до ½ скорости света без разрушения структуры самого объекта). Доставка грузов на орбиту, перемещение в ближнем и дальнем космосе без применения реактивной тяги.
– Технологии по преобразованию химических элементов (преобразование непрофильного сырья в заданный химический элемент).
– Технологии по отражению ракетных атак противника.
– Технологии активного воздействия на «время» (изменение скорости протекания физических процессов в замкнутом контуре).
Практическая перспективность данного технологического направления в возможности создания системы надвременного реагирования – устройство в рамках которого пилоту предоставляется опережение по времени для реагировании (дополнительный, многократный запас времени для практического решения задач в боевых условиях). В сочетании с возможностью перемещения ½ с это направление позволяет эффективно решать задачи по отражению атак (осуществляемых с реактивной доставкой боезарядов).
– прочие технологии оборонительного и наступательного применения.
❞
Как читаются элементы в таблице менделеева. Произношение символа как звучит название элемента по-латыни
Откуда происходят названия и символы химических эле-ментов ? Уже в Древнем Египте для обозначения некоторых веществ использовали символические изображения, которые выражали целые слова или понятия (рис. 5.7).
В средние века количество алхимических символов до-стигло нескольких тысяч. А для одного и того же вещества существовали десятки разных знаков.
А для одного и того же вещества существовали десятки разных знаков.
Символ химического элемента — его условное обозна-чение.
Во второй половине XVIII в. ученые делали напрасные по-пытки упорядочить химические знаки. Обозначить каждое вещество отдельным символом не удавалось из-за открытия многих новых веществ. Поэтому со временем старинную алхи-мическую символику заменили химическими знаками, пред-ложенными английским химиком Дж. Дальтоном. В символи-ке Дальтона атом каждого элемента изображен кружком. На поле изображения обозначены либо черточки и точки, либо на-чальные буквы английских названий элементов. Буквенная система химических знаков является удоб-ным способом записи, хранения и передачи химической информации.
Знаки Дальтона, хотя и имели определенное распростра-нение, но были неудобны для печатания. Поэтому в 1814 г. шведский ученый Й.Я. Берцелиус предложил только буквенную систему знаков. Знаки элементов составлялись или из первой буквы их латинских названий, или из первой и од-ной из последующих букв. Так Берцелиус добился максимально возможного сближения символа химического элемента с его названием.
Так Берцелиус добился максимально возможного сближения символа химического элемента с его названием.
Латинское на-звание химического элемента | Символ | ||
алхимичес-кий | по Дж. Дальтону | по Й. Я. Берцелиусу | |
H ydrarg yrum | |||
P lumb um | |||
Таблица. Названия и символы некоторых химических элементов
Символ | Произноше-ние | Латинское название | Современное название | |
русское | украинское | |||
H ydrogenium | Гідроген | |||
C arboneum | ||||
N itrogenium | Нітроген | |||
O xygenium | кислород | |||
M ag nesium | ||||
Алюминий | Al uminium | алюминий | Алюміній | |
Si licium | ||||
P hoshorus | ||||
Z in kum | ||||
Аргентум | A rg entum | Аргентум Материал с сайта | ||
S tan num | ||||
P lumb um | ||||
Гидраргирум | H ydrarg yrum | Меркурій | ||
Проанализируй данные, приведенные в таблице.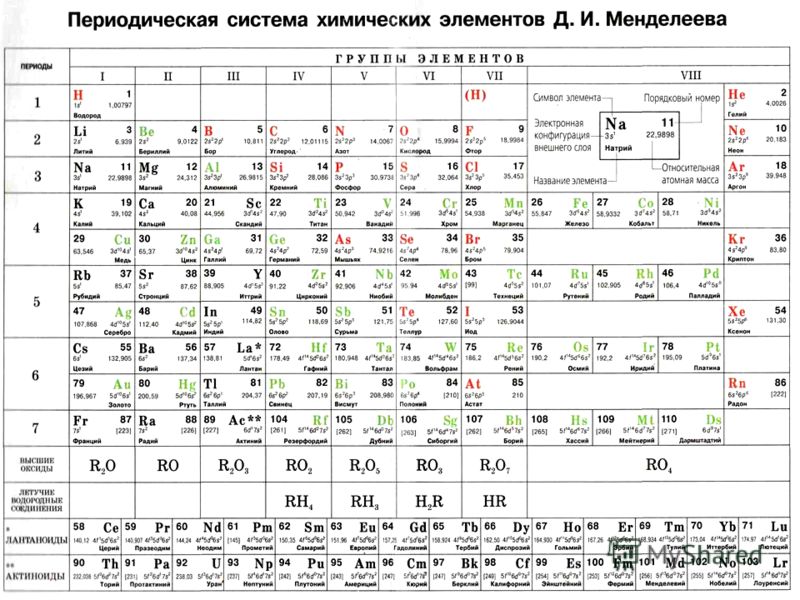 Сравни современные русские и украинские назва-ния химических элементов. Определи, какие из них непо-средственно происходят от латинских названий.
Сравни современные русские и украинские назва-ния химических элементов. Определи, какие из них непо-средственно происходят от латинских названий.
Запомни, что русские названия химических элементов — нарицательные, их пишут со строчной буквы. Современные украинские названия химических элементов являются собственными, поэтому их пишут с прописной буквы. И в том и в другом случае нельзя в устной речи заменять назва-ние химического элемента произношением его символа. Не следует также заменять название элемента его символом в рукописях или печатных текстах.
На этой странице материал по темам:
Знаки хим элементов. символ рус название произношение
Обозначения элементов химии в древности
Таблица химических элементов знаки символы как читается на русском
Все химические элементы список с произношением и с символами
Русское название химический знак произношение латинское нказв
Вопросы по этому материалу:
«Химический элемент – сера» – Природный сросток кристаллов самородной серы.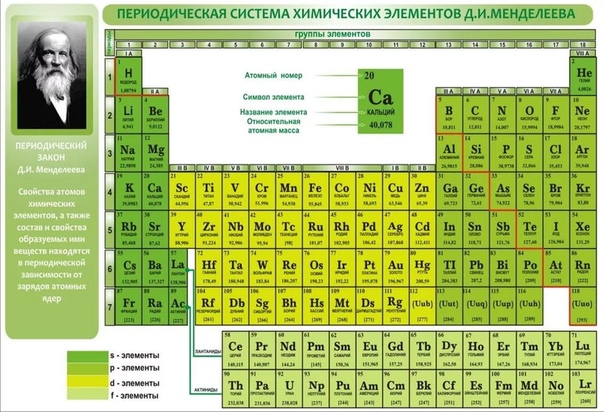 Возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Серные руды добывают разными способами – в зависимости от условий залегания. Природные минералы серы. Нельзя забывать о возможности ее самовозгорания. Добыча руды открытым способом. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда.
Возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Серные руды добывают разными способами – в зависимости от условий залегания. Природные минералы серы. Нельзя забывать о возможности ее самовозгорания. Добыча руды открытым способом. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда.
«Вопросы по химическим элементам» – Могут быть стабильными и радиактивными, естественными и искуственными. Связана с изменением числа энергетических уровней в главных подгруппах. 8. Какой элемент не имеет постоянной «прописки» в Периодической системе? Находятся в постоянном движении. Теллур, 2) селен, 3) осмий, 4) германий. Где накапливается мышьяк?
«h3O и h3S» – Cульфат-ион. Y = ? K K2 =1,23 · 10?13 моль/л. Получение: Na2SO3 + S = Na2SO3S (+t, водн.р-р). В водном растворе: +Hcl (эфир). Купоросы MSO4·5(7)h3O (M – Cu, Fe, Ni, Mg …). Серная кислота h3SO4. Строение анионов SO32– и HSO3–. = y. Молекула SO3 – неполярная и диамагнитная. ? . Гидросульфит-ион: таутомерия.
«Периодическая система химических элементов» – 8. Сколько электронов максимально может находиться на третьем энергетическом уровне? Расположить элементы в порядке возрастания металлических свойств. Название страны: «Химический элементарий». Стихи Степана Щипачева. А. 17 Б. 35 В. 35,5 Г. 52 6. Сколько электронов вращается вокруг ядра в атоме фтора?
«Кальций Сa» – Соединения Ca. Химические свойства Ca. Физические свойства Ca. Кальций относится к распространенным элементам. Применение. Получение кальция в промышленности. Кальций Ca. Опишите физические свойства Ca. Нахождение в природе. Задание для повторения. Кальций Ca серебристо белый и довольно твердый металл, легкий.
«Элемент фосфор» – Фосфор занимает 12-е место по распространенности элементов в природе. Взаимодействие с простыми веществами – неметаллами. Взаимодействие с металлами. Для связывания соединений кальция добавляют кварцевый песок. При нагревании белого фосфора в растворе щелочи он диспропорционирует. Фосфор. Черный фосфор.
Черный фосфор.
Всего в теме 46 презентаций
Периодическая система химических элементов – это уникальный справочный материал, который нужно правильно «читать», а затем воспользоваться полученной информацией. Помимо этого таблица Д.И. Менделеева считается разрешенным материалом на всех видах контроля, включая даже ЕГЭ по химии.
Вам понадобится
Периодическая система химических элементов Д.И. Менделеева
Спонсор размещения P&G Статьи по теме “Как научиться читать таблицу химических элементов Д.И. Менделеева” Как читать таблицу Менделеева Почему в периодической системе изменяются металлические свойства Как составить формулу вещества
Инструкция
Периодическая система представляет собой многоэтажный «дом», в котором располагается большое количество квартир. Каждый «жилец» или химический элемент живет в своей собственной квартире под определенным номером, который является постоянным. Помимо этого элемент имеет «фамилию» или название, например кислород, бор или азот.
 Кроме этих данных в каждой «квартире» или клетке указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Как в любом доме, здесь имеются «подъезды», а именно группы. Причем в группах элементы располагаются слева и справа, образуя подгруппы. В зависимости от того, с какой стороны их больше, та подгруппа называется главной. Другая подгруппа, соответственно, будет побочной. Также в таблице имеются «этажи» или периоды. Причем периоды могут быть как большими (состоят из двух рядов) так и малыми (имеют только один ряд).
По таблице можно показать строение атома элемента, каждый из которых имеет положительно заряженное ядро, состоящее из протонов и нейтронов, а также вращающихся вокруг него отрицательно заряженных электронов. Число протонов и электронов численно совпадает и определяется в таблице по порядковому номеру элемента. Например, химический элемент сера имеет №16, следовательно, будет иметь 16 протонов и 16 электронов.
Чтобы определить количество нейтронов (нейтральных частиц, также расположенных в ядре) вычтите из относительной атомной массы элемента его порядковый номер.
Кроме этих данных в каждой «квартире» или клетке указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Как в любом доме, здесь имеются «подъезды», а именно группы. Причем в группах элементы располагаются слева и справа, образуя подгруппы. В зависимости от того, с какой стороны их больше, та подгруппа называется главной. Другая подгруппа, соответственно, будет побочной. Также в таблице имеются «этажи» или периоды. Причем периоды могут быть как большими (состоят из двух рядов) так и малыми (имеют только один ряд).
По таблице можно показать строение атома элемента, каждый из которых имеет положительно заряженное ядро, состоящее из протонов и нейтронов, а также вращающихся вокруг него отрицательно заряженных электронов. Число протонов и электронов численно совпадает и определяется в таблице по порядковому номеру элемента. Например, химический элемент сера имеет №16, следовательно, будет иметь 16 протонов и 16 электронов.
Чтобы определить количество нейтронов (нейтральных частиц, также расположенных в ядре) вычтите из относительной атомной массы элемента его порядковый номер. Например, железо имеет относительную атомную массу равную 56 и порядковый номер 26. Следовательно, 56 – 26 = 30 протонов у железа.
Электроны находятся на разном расстоянии от ядра, образуя электронные уровни. Чтобы определить число электронных (или энергетических) уровней, нужно посмотреть на номер периода, в котором располагается элемент. Например, алюминий находится в 3 периоде, следовательно, у него будет 3 уровня.
По номеру группы (но только для главной подгруппы) можно определить высшую валентность. Например, элементы первой группы главной подгруппы (литий, натрий, калий и т.д.) имеют валентность 1. Соответственно, элементы второй группы (бериллий, магний, кальций и т.д.) будут иметь валентность равную 2.
Также по таблице можно проанализировать свойства элементов. Слева направо металлические свойства ослабевают, а неметаллические усиливаются. Это хорошо видно на примере 2 периода: начинается щелочным металлом натрием, затем щелочноземельный металл магний, после него амфотерный элемент алюминий, затем неметаллы кремний, фосфор, сера и заканчивается период газообразными веществами – хлором и аргоном.
Например, железо имеет относительную атомную массу равную 56 и порядковый номер 26. Следовательно, 56 – 26 = 30 протонов у железа.
Электроны находятся на разном расстоянии от ядра, образуя электронные уровни. Чтобы определить число электронных (или энергетических) уровней, нужно посмотреть на номер периода, в котором располагается элемент. Например, алюминий находится в 3 периоде, следовательно, у него будет 3 уровня.
По номеру группы (но только для главной подгруппы) можно определить высшую валентность. Например, элементы первой группы главной подгруппы (литий, натрий, калий и т.д.) имеют валентность 1. Соответственно, элементы второй группы (бериллий, магний, кальций и т.д.) будут иметь валентность равную 2.
Также по таблице можно проанализировать свойства элементов. Слева направо металлические свойства ослабевают, а неметаллические усиливаются. Это хорошо видно на примере 2 периода: начинается щелочным металлом натрием, затем щелочноземельный металл магний, после него амфотерный элемент алюминий, затем неметаллы кремний, фосфор, сера и заканчивается период газообразными веществами – хлором и аргоном. В следующем периоде наблюдается аналогичная зависимость.
Сверху вниз также наблюдается закономерность – металлические свойства усиливаются, а неметаллические ослабевают. То есть, например, цезий гораздо активнее по сравнению с натрием.
Как просто
В следующем периоде наблюдается аналогичная зависимость.
Сверху вниз также наблюдается закономерность – металлические свойства усиливаются, а неметаллические ослабевают. То есть, например, цезий гораздо активнее по сравнению с натрием.
Как простоДругие новости по теме:
Атом любого химического элемента состоит из атомного ядра и, обращающихся вокруг него, электронов. А из чего состоит атомное ядро? В 1932 году было установлено, что атомное ядро состоит из протонов и нейтронов. Вам понадобится – периодическая таблица химических элементов Д.И. Менделеева.
Строение атома – это одна из базовых тем курса химии, которая основана на умении пользоваться таблицей «Периодическая система химических элементов Д.И.Менделеева». Это не только систематизированные и расположенные по определенным законам химические элементы, но и кладезь информации, в том числе и о
Для определения количества протонов в атоме найдите элемент таблицы Менделеева, отображающий свойства данного атома. Его порядковый номер в таблице и будет отображать число протонов в ядре атома. Количество протонов можно найти, зная заряд ядра атома, а также количество электронов в нем. Вам
Его порядковый номер в таблице и будет отображать число протонов в ядре атома. Количество протонов можно найти, зная заряд ядра атома, а также количество электронов в нем. Вам
Таблица Дмитрия Ивановича Менделеева – это универсальный справочный материал, по которому можно узнать самые необходимые сведения о химических элементах. Самое главное – знать основные принципы ее «чтения», то есть нужно уметь правильно пользоваться этим информационным материалом, что послужит
Валентность химического элемента – это способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи. Нужно помнить, что некоторые атомы одного и того же химического элемента могут иметь разную валентность в разных соединениях. Вам
Протоны и нейтроны, содержащиеся в атомном ядре, называют нуклонами. Поскольку практически вся масса атома сосредоточена в его ядре, то массовое число атома означает количество нуклонов в ядре.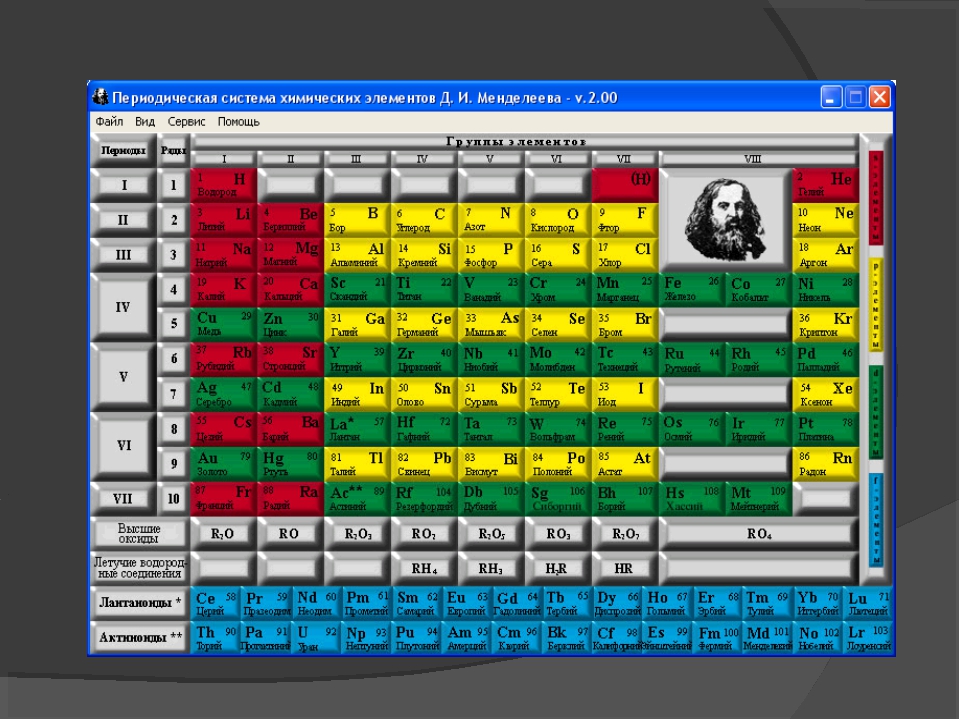 С помощью периодической таблицы химических элементов Менделеева можно найти количество протонов и
С помощью периодической таблицы химических элементов Менделеева можно найти количество протонов и
Исследование химических элементов 13-ой группы
В учебной исследовательской работе по химии на тему «Исследование химических элементов 13-ой группы» автором была поставлена цель, провести общее знакомство с элементами 13-ой группы хим. элементов, углубить знания о самых редких элементах на Земле и их применении в жизни.
Подробнее о проекте:
В рамках исследовательского проекта по химии на тему «Исследование химических элементов 13-ой группы» ученик 10 класса приводит общую характеристику 13-м элементам группы, а именно: В (бор), Al (алюминий), Ga (галлий), In (индий), Tl (таллий), рассказывает об их практическом применении.
В индивидуальном исследовательском проекте по химии “Исследование химических элементов 13-ой группы” учащийся проводит анализ химических элементов 13-ой группы Периодической таблицы Д.И. Менделеева, детально разбирает каждый элемент группы, а также узнает, как вышеперечисленные элементы помогают людям в повседневной жизни.
Оглавление
Введение
1. Общее знакомство с элементами 13-й группы.
2. Детальный разбор каждого элемента.
2.1. Бор
2.2. Алюминий
2.3. Галлий
2.4. Индий
2.5. Таллий
Заключение
Литература
Введение
В мире известно очень много химических элементов, новые открываются учеными каждый год. Ученые объясняют возникновение химических элементов теорией Большого Взрыва. Согласно ей, Вселенная образовалась после Большого Взрыва огромного огненного шара, который разбросал во всех направлениях частицы материи и потоки энергии. Хотя, если во Вселенной самые распространенные химические элементы это Водород и Гелий, то на планете Земля – это Кислород и Кремний.
Из всего числа известных химических элементов, на Земле найдено 88 таких элементов, среди которых самыми распространенными в земной коре являются Кислород (49,4%), Кремний (25,8%), также Алюминий (7,5%), Железо, Калий и другие химические элементы, встречаемые в природе.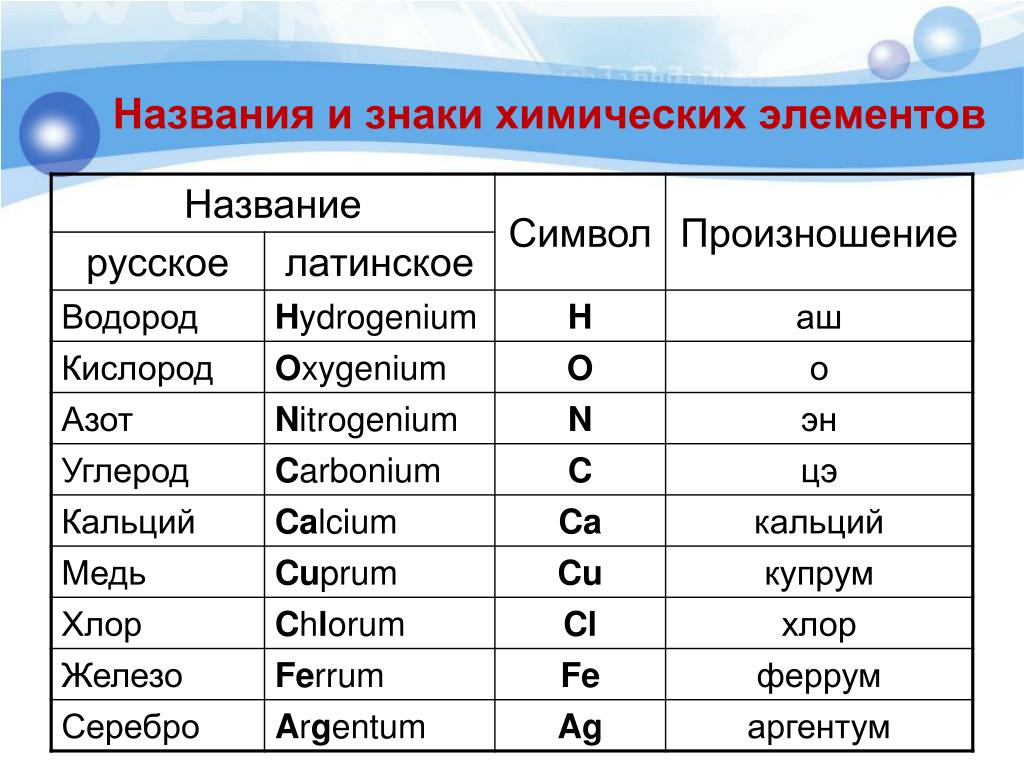 На эти элементы приходится 99% массы всей Земной оболочки.
На эти элементы приходится 99% массы всей Земной оболочки.
Состав элементов в Земной коре отличается от элементов, находящихся в мантии и ядре. Так ядро Земли состоит в основном из железа и никеля, а поверхность Земли насыщена кислородом.
Цель работы: провести анализ химических элементов 13-ой группы.
Задачи:
- Проанализировать элементы, находящиеся в 13-ой группе.
- Детально разобрать каждый элемент группы.
- Узнать, как вышеперечисленные элементы помогают людям в жизни.
Предмет исследования: химические элементы 13-ой группы.
Объект исследование: свойства химических элементов 13-ой группы.
Самые распространенные химические элементы на Земле
O2
(49,4% в Земной коре)
Кислород используют для дыхания почти все живые организмы на Земле. Десятки миллиардов тонн Кислорода расходуются каждый год, но в воздухе его все равно не становится меньше.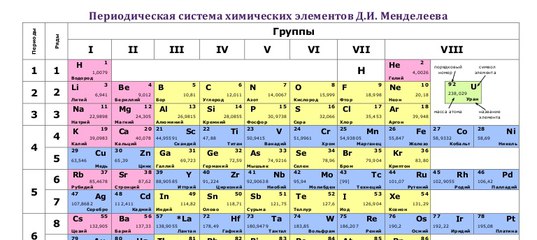 Ученые считают, что зеленые растения на планете выделяют Кислорода почти в шесть раз больше, чем он расходуется…
Ученые считают, что зеленые растения на планете выделяют Кислорода почти в шесть раз больше, чем он расходуется…
Si
(25,8% в Земной коре)
Роль Кремния в геохимии Земли огромна, примерно 12% литосферы составляет кремнезем SiO2 (все твердые и прочные породы состоят на треть из кремния), а число минералов, в которых содержится кремнезем больше 400. На Земле Кремний в свободном виде не встречается, только в соединениях…
Al
(7,5% в Земной коре)
В чистом виде в природе Алюминий не встречается. Алюминий входит в состав гранитов, глины, базальтов, полевого шпата и др. и содержится во многих минералах…
Fe
(4,7% в Земной коре)
Этот химический элемент очень важен для живых организмов, так как является катализатором дыхательного процесса, участвует в доставке кислорода к тканям и присутствует в гемоглобине крови. В природе Железо встречается в руде (магнетит, гематит, лимонит и пирит) и в более 300 минералах (сульфиды, силикаты, карбонаты и др. )…
)…
Ca
(3,4% в Земной коре)
В чистом виде в природе не встречается, в соединениях содержится в почве, во всех неорганических связующих веществах, животных, растениях и природной воде. Ионы Кальция в крови играют важную роль в регулировании работы сердца, и позволяют ей свертываться на воздухе. При недостатке Кальция у растений, страдает корневая система…
Na
(2,6% в Земной коре)
Натрий распространен в верхней части земной коры, в природе встречается в виде минералов: галита, мирабилита, криолита и буры. Входит в состав человеческого организма, в крови человека содержится около 0.6% КаС1, за счет которого поддерживается нормальное осмотическое давление крови. В животных Натрия содержится больше чем в растениях…
K
(2,4% в Земной коре)
В природе не встречается в чистом виде, только в соединениях, содержится во многих минералах: сильвине, сильвините, карналлите, алюмосиликатах и др. В морской воде содержится примерно 0,04% калия. Калий быстро окисляется на воздухе и легко вступает в химические реакции. Является важным элементом развития растений, при его недостатке они желтеют, а семена теряют всхожесть…
В морской воде содержится примерно 0,04% калия. Калий быстро окисляется на воздухе и легко вступает в химические реакции. Является важным элементом развития растений, при его недостатке они желтеют, а семена теряют всхожесть…
Mg
(1,9% в Земной коре)
В природе Магний не встречается в чистом виде, но входит в состав многих минералов: силикатов, карбонатов, сульфатов, алюмосиликатов и др. Кроме этого Магния много в морской воде, подземных водах, растениях и природных рассолах…
H2
(0,9% в Земной коре)
Водород входит в состав атмосферы, всех органических веществ и живых клеток. Его доля в живых клетках по числу атомов составляет 63%. Водород входит в состав нефти, вулканических и природных горючих газов, немного Водорода выделяют зеленые растения. Образуется при разложении органических веществ и при коксовании угля…
Ti
(0,6% в Земной коре)
В природе не встречается в свободном виде, часто в виде двуокиси TiO2 или её соединений (титанитов). Содержится в почве, в животных и растительных организмах и входит в состав больше 60 минералов. В биосфере Титан рассеян, в морской воде его 10-7%.Титан содержится и в зернах, плодах, стеблях растений, в тканях животных, молоке, куриных яйцах и в человеческом организме…
Содержится в почве, в животных и растительных организмах и входит в состав больше 60 минералов. В биосфере Титан рассеян, в морской воде его 10-7%.Титан содержится и в зернах, плодах, стеблях растений, в тканях животных, молоке, куриных яйцах и в человеческом организме…
Самые редкие химические элементы на Земле
- Лютеций (0,00008 % в Земной коре по массе). Для получения его выделяют из минералов вместе с другими тяжёлыми редкими элементами.
- Иттербий (3,310-5% в Земной коре по массе). Содержится в бастензите, монаците, гадолините, талените и др. минералах.
- Тулий (2,7 •10−5 масс. % в Земной коре по массе). Так же как и другие редкоземельные элементы содержится в минералах: ксенотим, монацит, эвксенит, лопарит и др.
- Эрбий (3,3 г/т в Земной коре по массе). Добывается из монацита и бастенизита, так же как и некоторые редкие химические элементы.

- Гольмий (1,3•10−4 % в Земной коре по массе). Вместе с другими редкоземельными элементами содержится в минералах монаците, эвксените, бастенизите, апатите и гадолините.
- Очень редкие химические элементы применяют в радиоэлектронике, атомной технике, машиностроении, металлургии и химической промышленности и др. Очень важно изучать химию элементов т.к это напрямую ведет к прогрессу и изобретениям.
Общее знакомство с элементами 13-ой группы
Своё внимание я хотел бы акцентировать именно на элементах 13-й группы.
Это В( бор), Al(алюминий), Ga(галлий), In(индий), Tl(таллий).
Общая характеристика
Типические элементы — бор В и алюминий А1, а также галлий Ga, индий In и таллий Т1 составляют 13-ю группу. Внешние электронные оболочки (конфигурация …ns2np{) содержат по три электрона, из которых два спаренных (ил*2-электроны) и один р-электрон. Предвнешняя оболочка бора содержит два электрона, алюминия — восемь, а галлия, индия и таллия — по 18, поэтому последние три элемента выделяют в отдельную группу — группу галлия.
В нормальном, невозбужденном состоянии все рассматриваемые элементы должны проявлять ковалентность 1 (например, ВН, А1Н и др.), однако соединения, где эти элементы проявляют степень окисления +1, неустойчивы. Алюминий образует такие соединения только в газовой фазе при высокой температуре (например, А1С1). Известны некоторые соединения, где галлий и индий проявляют степень окисления +1. Так, соединение GaCl2, называемое дихлоридом галлия, на самом деле представляет собой Ga[GaCl J. Наиболее устойчивыми соединениями являются те, в которых элементы проявляют степень окисления +3.
- Металлические радиусы атомов и ионизационные потенциалы изменяются не монотонно, так как у галлия, индия и таллия предвнешние уровни содержат по 18 электронов. Условные радиусы положительных ионов Э3+ увеличиваются от бора к таллию. Атомный объем как функция плотности также увеличивается от В к Tl. С увеличением заряда ядра от В к Т1 металлические свойства увеличиваются.
- Бор — неметалл, тогда как Al, Ga, In и Tl — металлы.
 Если бор проявляет как окислительные, так и восстановительные свойства, то остальные элементы этой группы проявляют только восстановительные свойства. Бор не образует катионов, потому что энтальпии ионизации бора так велики, что энтальпии образования решетки или энтальпии гидратации не могут компенсировать такие затраты энергии. Обычно бор образует три ковалентные связи с использованием трех $/?2-гибридных орбиталей, лежащих в плоскости под углом 120°. Соединения бора типа ВХ3 координационно ненасыщенны и ведут себя как сильные кислоты Льюиса.
Если бор проявляет как окислительные, так и восстановительные свойства, то остальные элементы этой группы проявляют только восстановительные свойства. Бор не образует катионов, потому что энтальпии ионизации бора так велики, что энтальпии образования решетки или энтальпии гидратации не могут компенсировать такие затраты энергии. Обычно бор образует три ковалентные связи с использованием трех $/?2-гибридных орбиталей, лежащих в плоскости под углом 120°. Соединения бора типа ВХ3 координационно ненасыщенны и ведут себя как сильные кислоты Льюиса.
Бор (В)
Бор (B, лат. borum) — хим.элемент 13-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе III группы, или к группе IIIA) с атомным номером 5. Бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.
Основной вид залеж, при котором Бор был в первые получен – Na2B4O7 ( тетраборат натрия.)
Хим. свойства:
– Бор довольно интернет и реагирует со F при комнатной температуре
2В + 3F2 = 2BF3
– Бор имеет свой ряд бороводоротов(Бораты)
B2H6 – B10h24.
– При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
3SiO2 + 4B = 3Si + 2B2O3
Практическое применение:
- Изотоп бора B10 широко используется в ядерной энергетики из-за своего свойства принимать нейтроны и регулировать ядерные реакции. Для этого в основном используют соли Бора.
- Бороводороды являются эффективным источником топлива.
- Карбид бора является материалом для изготовления композитной брони.
- У бора важная биол. роль у растений: при его недостатке не развивается нормальный рост. Следовательно соли бора являются хорошим удобрением.

Алюминий (Al)
Алюминий (Al, лат. aluminium) — элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы III группы), третьего периода, с атомным номером 13. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий — лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Основное содержание примеси Al2O3 в руде – Боксит.
Способ получения – электролизом Na3[AlF6]
Химические свойства:
При растворении оксидной пленки, активно реагирует с h3O
2Al(чист) + 6h3O = 2Al(OH)3 + h3
Реакция с Йодом с выделенением большого кол-ва тепла и ярко-фиолетового дыма.
2Al + 3I2 = 2AlI3
Может образовывать комплексы.
2Al + 2NaOH + 4h3O = 2Na[Al(OH)3] + 2h3
Практическое применение:
- Алюминий используется в радиаторах и на высоковольтных линиях электропередач, т.к хорошо проводить тепло.
- Алюминий широко используется в промышленности из-за доступности и низкой стоимости.
- Алюминий выступает в роли восстановителя многих металлов
- Сплав алюминия и циркония – циркалой широко применяется в ядерной энергетике.
Галлий (Ga)
Галлий — элемент 13-й группы (по устаревшей классификации — главной подгруппы третьей группы) четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 31. Обозначается символом Ga (лат. Gallium). Относится к группе лёгких металлов. Простое вещество галлий — мягкий хрупкий металл серебристо-белого (по другим данным светло-серого) цвета с синеватым оттенком.
Для получения металлического галлия чаще используют редкий минерал галлит CuGaS2
Из уникальных химических свойств – температура плавления всего 30′ C, т.е этот металл можно расплавить в руке!
Химические свойства:
Галлий реагирует с горячей водой.
2Ga + 4h3O = 2GaOOH + 3h3
Образует гидрогаллаты
4LiH + GaCl3 = Li[Gah5] + 3LiCl
Так же может образовать комплексы
2Ga + 6h3O + 2 NaOH = 2Na[Ga(OH)4] + 3h3
Практическое применение:
В медицине галлий используется для торможения потери костной массы у онкологических больных и для быстрой остановки кровотечения из глубоких ран, не вызывая образование тромбов. Также галлий является мощным антибактериальным средством и ускоряет заживление ран. Металлическим галлием также заполняют кварцевые термометры (вместо ртути) для измерения высоких температур. Это связано с тем, что галлий имеет значительно более высокую температуру кипения по сравнению со ртутью. Галлий и его эвтектический сплав с индием используется как теплоноситель в контурах реакторов.
Индий (In)
Индий — элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы III группы), атомный номер 49. Обозначается символом In (лат. Indium). Относится к группе лёгких металлов. Простое вещество индий — ковкий, легкоплавкий, очень мягкий металл серебристо-белого цвета. Сходен по химическим свойствам с алюминием и галлием, по внешнему виду с цинком.
В настоящее время известно менее 10 индиевых минералов: самородный индий, рокезит CuInS2, индит FeIn2S4, кадмоиндит CdInS4 и т.д.
Индий очень мягкий металл, который можно поцарапать ногтем.
Химические свойства:
Индий реагирует с хлором.
In + Cl2 = InCl3
Так же хорошо идет реакция с теллуром
2In + 3Te = In2Te3
Индий реагирует с кислотами. Н-р с азотной.(Разб.)
8In + 30HNO3 = 8In(NO3)3 + 3Nh5NO3 + 9h3O
Практическое применение:
Широко применяется в производстве жидкокристаллических экранов для нанесения прозрачных плёночных электродов из оксида индия-олова. Используется в микроэлектронике как акцепторная примесь к германию и кремнию. Ранее, когда широко применялась сплавная технология производства первых полупроводниковых приборов, характерным решением было сплавление индия с германием для получения pn-перехода, например, в диодах серий ДГ-Ц1, Д7 и так далее до сотни мг индия.
Используется в микроэлектронике как акцепторная примесь к германию и кремнию. Ранее, когда широко применялась сплавная технология производства первых полупроводниковых приборов, характерным решением было сплавление индия с германием для получения pn-перехода, например, в диодах серий ДГ-Ц1, Д7 и так далее до сотни мг индия.
Компонент ряда легкоплавких припоев и сплавов (так, жидкий при комнатной температуре галинстан содержит 21,5 % индия). Обладает высокой адгезией ко многим материалам, позволяя спаивать, например, металл со стеклом. В сплаве с оловом применяется как легкоплавкий припой с высокой теплопроводностью для термоинтерфейсов принудительно охлаждаемых электронных компонентов. Иногда применяется (чистый или в сплаве с серебром) для покрытия зеркал, в частности, автомобильных фар, при этом отражающая способность зеркал не хуже, чем у серебряных, а стойкость к воздействию атмосферы больше.
Таллий (Tl)
Таллий — элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы III группы), шестого периода, атомный номер 81.
 Обозначается символом Tl (лат. Thallium). Относится к группе тяжёлых металлов. Простое вещество таллий — мягкий, чрезвычайно токсичный металл серебристо-белого цвета с серовато-голубоватым оттенком.
Обозначается символом Tl (лат. Thallium). Относится к группе тяжёлых металлов. Простое вещество таллий — мягкий, чрезвычайно токсичный металл серебристо-белого цвета с серовато-голубоватым оттенком.Известно лишь семь минералов таллия (круксит (Cu, Tl, Ag)2Se, лорандит TlAsS2, врбаит Tl4Hg3Sb2As8S20, гутчинсонит(Pb, Tl)S • Ag2S • 5As2S5, авиценнит Tl2O3)
Из интересных свойств Таллия. Таллий -самый токсичный металл на Земле. Соединения Таллия не имеют ни цвета, ни запаха, поэтому раньше его использовали как смертельный яд.
хим.свойства:
Оксид таллия темного цвета (Ta2O3 + 6HNO3 = 2Ta(NO3)3 + 3h3O) растворяется мгновенно образуя Нитрат Таллия(3) – чрезвычайно токсичное соединение.
Нитрат талия(1) реагирует с йодидом калия( TlNO3 +KI = TlI + KNO3)
С соляной кислотой Таллий почти не реагирует из-за пассивации.
2NaCl + Tl2SO4 = 2TlCl + Na2SO4
Tl2S + ZnSO4 = Tl2SO4 + ZnS
4Tl + 4C2H5OH + O2 = 4TlOC2H5 + 2h3O
Tl + 5P = TlP5
Практическое применение:
Таллий вводится в качестве активатора в кристаллы иодида натрия, использующегося в качестве сцинтиллятора для регистрации ионизирующих излучений. В инфракрасной оптике в качестве материалов линз применяются бромид и иодид таллия(I). Кроме того, в годы Великой Отечественной войны оксисульфид таллия (таллофид) применялся в качестве чувствительного элемента приборов ночного видения[9].
В инфракрасной оптике в качестве материалов линз применяются бромид и иодид таллия(I). Кроме того, в годы Великой Отечественной войны оксисульфид таллия (таллофид) применялся в качестве чувствительного элемента приборов ночного видения[9].
Иодид таллия(I) добавляют в осветительные металлогалогеновые лампы.
Сульфат таллия(I) и карбонат таллия(I) ранее применялись в качестве средства для борьбы с грызунами в труднодоступных местах.
Заключение
Рассмотрев элементы 13 группы, я сделал вывод, что элементы 13 группы оказались очень необычны и неоднозначны по свойствам. Безобидный галлий находиться чуть вышел в группе самого токсичного металла – таллия. Применения элементов в целом очень широкое. Они находят применение от ядерной энергетике(Бор) до медицины (Tl,Ga) и даже в зеркалах машин! (In). Благодаря всему разнообразию данные элементы находят широкое применение в нашей жизни.
Список литературы:
- Коттон Ф. Уилкинсон Дж. Основы неорганической химии.

- Лидин Р.А Химические свойства неорганических веществ.
- Ремми Г. Курс неорганической химии Том 2
- Третьяков Ю.Д Неорганическая химия Том 2.
Если страница Вам понравилась, поделитесь в социальных сетях:
химический элемент – Студенты | Britannica Kids
Введение
Британская энциклопедия, Inc.Любое вещество, которое не может быть разложено на более простые вещества с помощью обычных химических процессов, определяется как химический элемент. Известно, что в природе существует всего 94 таких вещества (и два из них встречаются лишь в следовых количествах). Они встречаются либо химически свободными, как кислород в воздухе, либо в сочетании с другими элементами, такими как водород и кислород в воде.Два десятка дополнительных элементов были получены в лаборатории с помощью методов ядерной физики. ( См. также атом; химия.)
Encyclopædia Britannica, Inc. Некоторые вещества, ныне признанные элементами, — медь, железо, серебро, олово, золото, ртуть и свинец — были известны в древности, потому что они присутствуют на Земле в относительно чистом виде. Но они не были тогда признаны элементами. Ранние греческие философы действительно верили, что существуют фундаментальные субстанции, из которых состоит вся материя, но их понимание этих субстанций отличалось от современного определения элемента.Философ Фалес считал, что основным веществом является вода, а Гераклит считал, что это огонь. Более поздние греческие мыслители, в том числе Эмпедокл и Аристотель, считали, что существует четыре элемента: земля, воздух, огонь и вода.
Но они не были тогда признаны элементами. Ранние греческие философы действительно верили, что существуют фундаментальные субстанции, из которых состоит вся материя, но их понимание этих субстанций отличалось от современного определения элемента.Философ Фалес считал, что основным веществом является вода, а Гераклит считал, что это огонь. Более поздние греческие мыслители, в том числе Эмпедокл и Аристотель, считали, что существует четыре элемента: земля, воздух, огонь и вода.
Одним из первых, кто определил элементы в современном понимании, был английский химик Роберт Бойль в 1661 году. Он указал, что землю, воздух, огонь и воду нельзя извлечь из других веществ или соединить для их образования. В 1789 году французский химик Антуан-Лоран Лавуазье сделал первую попытку составить список элементов на основе современного определения.
Названия и символы элементов
Именование элементов
У каждого элемента есть символ, который используется химиками во всем мире в качестве условного обозначения. Символы элементов могут состоять из одной или двух букв. Там, где это возможно, символ представляет собой первую букву общего названия или латинского названия элемента. Например, символ водорода — H; для углерода C; для урана — U. Символ калия — K, после kalium — латинского названия этого элемента.
Символы элементов могут состоять из одной или двух букв. Там, где это возможно, символ представляет собой первую букву общего названия или латинского названия элемента. Например, символ водорода — H; для углерода C; для урана — U. Символ калия — K, после kalium — латинского названия этого элемента.
Простые символы для химических элементов: общепринятые названия
Простые символы для химических элементов: латинские названия
Поскольку отдельных букв недостаточно, и несколько элементов могут начинаться с одной и той же буквы, иногда необходимо добавлять другие буквы. В таких случаях символом является первая буква имени элемента, за которой следует еще одна буква имени. Например, гелий — это He, а хлор — это Cl. Латинское название свинца — plumbum , а его символ — Pb.В символе элемента заглавной является только первая буква. Co, который является символом кобальта, отличается от CO, химической формулы монооксида углерода, соединения, образованного из углерода и кислорода.
Атомные свойства
Химические элементы классифицируются или идентифицируются в соответствии со свойствами их атомов. Каждый элемент имеет свой тип атомов — водород состоит только из атомов водорода, а гелий состоит только из атомов гелия. Все атомы состоят из трех основных частиц: протона, нейтрона и электрона.Каждый из них играет роль в определении элемента.
Атомный номер
Сердце каждого атома, его ядро, содержит один или несколько протонов, каждый из которых имеет положительный электрический заряд. Количество протонов и, следовательно, количество положительных зарядов варьируется от одного в водороде, самом легком элементе, до 92 в уране, самом тяжелом элементе, который встречается в природе в значительных количествах. Это число известно как атомный номер. Атомный номер был введен английским ученым Генри Мозли в 1913 году.Он расположил элементы в соответствии с узорами, которые они образовывали при воздействии рентгеновских лучей. Позже было показано, что его расположение совпадает с числом положительных зарядов — протонов — в ядре.
Изотопы
Все ядра, кроме ядер обычного водорода, содержат не только положительно заряженные протоны, но и нейтроны, которые электрически нейтральны. Количество нейтронов может различаться в атомах одного и того же элемента, но такие изменения не влияют на количество электронов, атомный номер или общий заряд атома.Они незначительно влияют на химические свойства, а также влияют на массу ядра и, следовательно, атома. Атомы одного и того же элемента, масса которых различается из-за разного числа нейтронов, называются изотопами. Общее число протонов плюс нейтроны называется массовым числом атома или изотопа. Это целое число очень близко к атомной массе.
Атомная масса (или атомный вес)
Атом имеет очень небольшую массу. Один атом кислорода имеет массу всего 0,0000000000000000000000027 грамм.(В науке повсеместно используется метрическая система измерения.) Поскольку такое число неудобно использовать, химики вместо этого используют единицу измерения, основанную на атомном эталоне, изотопе углерода с массой 12, который записывается как углерод-12..jpg) . Это изотоп углерода, в ядре которого есть 6 нейтронов в дополнение к 6 протонам, которыми обладают все атомы углерода. Одна двенадцатая часть массы углерода-12 определяется как атомная единица массы (а.е.м.). В круглых числах атомная масса (также называемая атомным весом) водорода равна 1; углерода, 12; и кислорода, 16.Точные атомные массы элементов, встречающихся в природе, немного отличаются от этих цифр. Атомная масса углерода, например, равна 12,011, потому что в дополнение к углероду-12 присутствуют небольшие количества углерода-13 и углерода-14 (которые представляют собой изотопы с дополнительными нейтронами).
. Это изотоп углерода, в ядре которого есть 6 нейтронов в дополнение к 6 протонам, которыми обладают все атомы углерода. Одна двенадцатая часть массы углерода-12 определяется как атомная единица массы (а.е.м.). В круглых числах атомная масса (также называемая атомным весом) водорода равна 1; углерода, 12; и кислорода, 16.Точные атомные массы элементов, встречающихся в природе, немного отличаются от этих цифр. Атомная масса углерода, например, равна 12,011, потому что в дополнение к углероду-12 присутствуют небольшие количества углерода-13 и углерода-14 (которые представляют собой изотопы с дополнительными нейтронами).
Атомные массы также могут быть выражены в граммах. Полученное число известно как грамм-атомная масса (или грамм-атомный вес). Он представляет собой массу в граммах 6,02 × 10 23 атомов элемента. Например, 1 грамм водорода содержит 6.02 × 10 23 атомов водорода и 12 граммов углерода содержат 6,02 × 10 23 атомов углерода. Число 6,02 × 10 23 известно как число Авогадро.
Электронные оболочки и химическая активность
Ядро атома окружено отрицательно заряженными электронами. Электроны расположены слоями, называемыми оболочками. Атом может иметь до семи оболочек, каждая из которых содержит только определенное количество электронов. Оболочки в порядке от ближайшей к самой удаленной от ядра содержат максимум 2, 8, 18, 32, 50, 72 и 98 электронов каждая.Самый легкий элемент, водород, имеет один электрон на первой оболочке. У самых тяжелых элементов в их нормальном состоянии только первые четыре оболочки полностью заняты электронами, а следующие три оболочки заняты частично.
Если это электрически нейтральный атом, количество электронов равно числу протонов. Однако часто атом имеет либо больше, либо меньше электронов, чем протоны, и, таким образом, либо отрицательно, либо положительно заряжен соответственно.
Электроны можно показать точками, расположенными вокруг химического символа элемента.Например:
Обычно показана только самая внешняя оболочка, так как именно она участвует в химической активности.
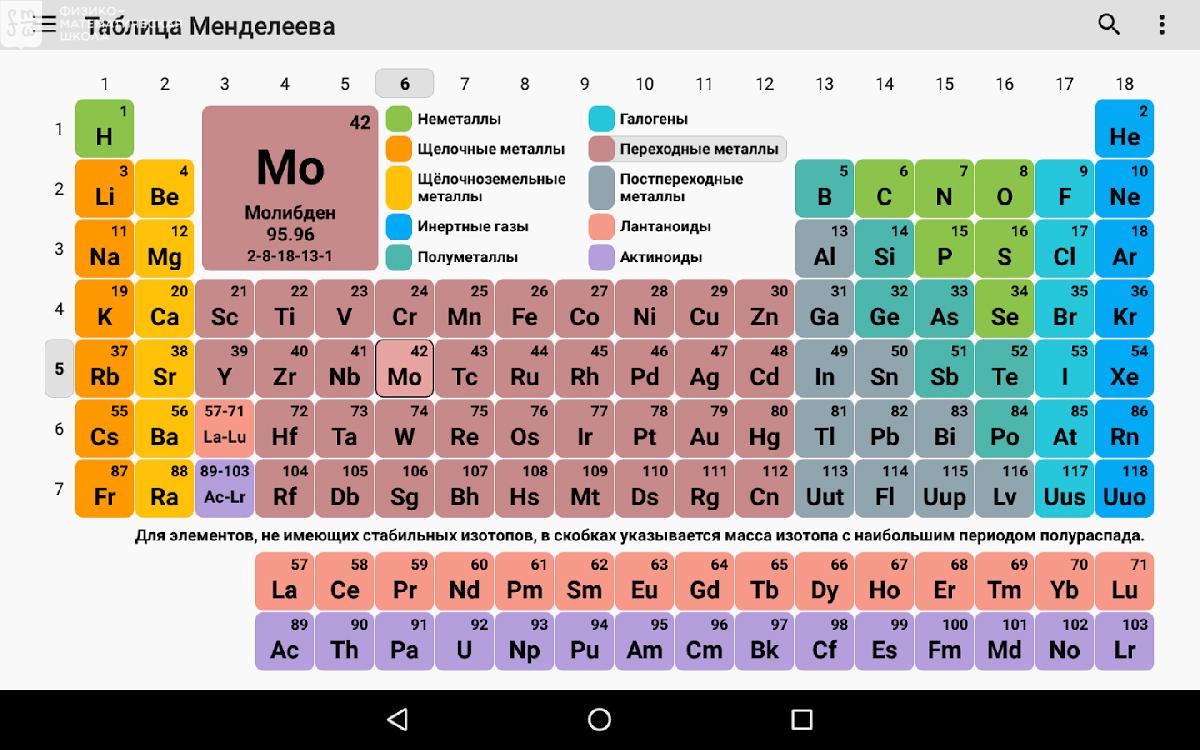 Если самая внешняя оболочка заполнена или заполнена максимальным числом электронов для этой оболочки, атом электрически стабилен и инертен, с небольшой тенденцией к взаимодействию с другими атомами или вообще без нее. Гелий с двумя электронами, заполняющими его единственную оболочку, и неон с двумя электронами в его первой оболочке и восемью во второй, оба инертны.
Если самая внешняя оболочка заполнена или заполнена максимальным числом электронов для этой оболочки, атом электрически стабилен и инертен, с небольшой тенденцией к взаимодействию с другими атомами или вообще без нее. Гелий с двумя электронами, заполняющими его единственную оболочку, и неон с двумя электронами в его первой оболочке и восемью во второй, оба инертны.Атомы с незавершенными внешними оболочками стремятся заполнить или опустошить такие оболочки, приобретая или теряя электроны или делясь электронами с другими атомами.Это основа химической активности атома. Атомы с одинаковым числом электронов во внешней оболочке обладают схожими химическими свойствами, поскольку их методы достижения полных внешних оболочек или устранения неполных у них схожи.
Элементы образуют группы и периоды
Изучая атомные массы (тогда называемые атомными весами) элементов и их химические свойства, химики обнаружили, что элементы следуют схеме, которая позволяет им быть организованными очень полезным образом. Первым, кто успешно описал эту закономерность, был русский химик Дмитрий Менделеев в 1869 году.
Первым, кто успешно описал эту закономерность, был русский химик Дмитрий Менделеев в 1869 году.
Менделеев заметил, что элементы не изменяют свойства постепенно, в соответствии с постепенным увеличением атомного веса. Скорее, свойства изменяются постепенно через определенное количество элементов, называемое «периодом». Свойства и характер их изменений повторяются или повторяются в течение следующего периода. Чтобы выразить эту повторяемость, Менделеев сформулировал периодический закон: свойства элементов являются периодическими функциями атомных весов.К аналогичному выводу независимо пришел немецкий химик Юлиус Лотар Мейер.
Когда элементы расположены по закону, получается периодическая таблица элементов. Химики теперь знают, что периодический закон лучше выражается в терминах атомного номера, чем в терминах атомного веса, и исходная таблица Менделеева была перестроена, чтобы отразить эту идею. Сегодня более легкие элементы можно расположить в таблице в соответствии с их свойствами следующим образом:
Все элементы в каждой вертикальной колонке таблицы имеют схожие химические свойства.
 Столбец этих связанных элементов образует группу (например, группу IIA). Каждая горизонтальная строка образует период элементов.
Столбец этих связанных элементов образует группу (например, группу IIA). Каждая горизонтальная строка образует период элементов.Классификация элементов периодической таблицы
Периодическая таблица позволяет легко идентифицировать связанные группы элементов. Элементы в левой части таблицы Менделеева образуют основания, а в правой — кислотообразующие ( см. кислота и основание). Те, что между ними, могут быть любыми. Они образуют так называемые амфотерные оксиды и гидроксиды, которые могут действовать как кислоты или основания.Периодическое расположение также делит элементы на металлические и неметаллические виды. Обычно различают чистые металлы и неметаллы по физическим и химическим свойствам. Из элементов, показанных в таблице выше, литий (Li), бериллий (Be), натрий (Na), магний (Mg), алюминий (Al), калий (K) и кальций (Ca) являются металлическими. Остальные неметаллические.
Периодическая таблица группирует элементы в химические семейства. Например, в приведенной выше таблице группа 0 содержит гелий (He), неон (Ne) и аргон (Ar)..jpeg) Они входят в семейство элементов, называемых благородными газами. (В некоторых таблицах эта группа обозначена как VIII вместо 0.) В группу IA входят водород (H), литий, натрий и калий. За исключением водорода, это мягкие активные вещества, химические свойства которых во многих отношениях аналогичны металлам. Они реагируют с водой, образуя основные или щелочные растворы. Из-за этих свойств они известны как щелочные металлы. В группу IIA входит семейство элементов, известных как щелочноземельные металлы. В группу VIIA входят галогены.Их соединения с водородом, например фтористый водород (HF) и хлористый водород (HCl), растворяются в воде с образованием кислот. Водород иногда включают в состав галогенов из-за некоторых общих с ними характеристик.
Они входят в семейство элементов, называемых благородными газами. (В некоторых таблицах эта группа обозначена как VIII вместо 0.) В группу IA входят водород (H), литий, натрий и калий. За исключением водорода, это мягкие активные вещества, химические свойства которых во многих отношениях аналогичны металлам. Они реагируют с водой, образуя основные или щелочные растворы. Из-за этих свойств они известны как щелочные металлы. В группу IIA входит семейство элементов, известных как щелочноземельные металлы. В группу VIIA входят галогены.Их соединения с водородом, например фтористый водород (HF) и хлористый водород (HCl), растворяются в воде с образованием кислот. Водород иногда включают в состав галогенов из-за некоторых общих с ними характеристик.
Свойства металлов и неметаллов
Многие элементы с атомными номерами более 20 имеют сложную структуру, поскольку они имеют внутренние электронные оболочки, которые принимают от 18 до 32 электронов. Элементы, имеющие атомы этого типа, появляются в периодической таблице как переходная или вставленная группа между группами IIA и IIIA. Электронная структура некоторых из этих элементов, таких как хром, железо и никель, придает их соединениям яркие цвета. К переходным элементам относятся редкоземельные элементы и ряд актиноидов.
Электронная структура некоторых из этих элементов, таких как хром, железо и никель, придает их соединениям яркие цвета. К переходным элементам относятся редкоземельные элементы и ряд актиноидов.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.

- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
3.2: Элементы и соединения — LibreTexts по биологии
Структура атома
Атом — это наименьшая частица элемента, которая все еще обладает свойствами этого элемента. Любое вещество состоит из атомов.Атомы чрезвычайно малы, обычно около одной десятимиллиардной метра в диаметре. Однако атомы не имеют четко определенных границ, как предполагает атомная модель, показанная на рисунке \(\PageIndex{2}\). Атом состоит из многих субатомных частиц. Мы будем обсуждать только протонов , нейтронов и электронов .
Атом состоит из многих субатомных частиц. Мы будем обсуждать только протонов , нейтронов и электронов .
| Частица | Протон | Нейтрон | Электрон |
|---|---|---|---|
| Электрический заряд | +1 | 0 | -1 |
| Местоположение | Ядро | Ядро | Вне ядра |
| Масса | 1 а.е.м. | 1 а. е.м. е.м. | ~0 а.е.м. |
Если количество протонов и электронов в атоме одинаково, то атом электрически нейтрален, потому что положительные и отрицательные заряды уравновешиваются. Если атом имеет больше или меньше электронов, чем протонов, то он имеет общий отрицательный или положительный заряд соответственно и называется ионом .
Отрицательно заряженные электроны атома притягиваются к положительно заряженным протонам в ядре под действием силы, называемой электромагнитной силой, для которой противоположные заряды притягиваются.Электромагнитная сила между протонами в ядре заставляет эти субатомные частицы отталкивать друг друга, потому что они имеют одинаковый заряд. Однако протоны и нейтроны в ядре притягиваются друг к другу другой силой, называемой ядерной силой, которая обычно сильнее, чем электромагнитная сила, отталкивающая положительно заряженные протоны друг от друга.
Соединения и молекулы
Соединение — это уникальное вещество, состоящее из двух или более элементов, объединенных в фиксированных пропорциях.Это означает, что состав соединения всегда одинаков. Наименьшая частица большинства соединений в живых существах называется молекулой . В качестве примера рассмотрим воду. Молекула воды всегда содержит один атом кислорода и два атома водорода. Состав воды выражается химической формулой H 2 O. Модель молекулы воды показана на рисунке \(\PageIndex{4}\). Обратите внимание, что молекулы могут быть изображены по-разному, но представлять одну и ту же молекулу.В данном случае молекула состоит из одного кислорода и двух атомов водорода.
Что заставляет атомы молекулы воды «слипаться» друг с другом? Ответ — химические связи. Химическая связь – это сила, удерживающая вместе атомы молекул. Связи в молекулах включают атомы, разделяющие электроны. Новые химические связи образуются, когда вещества реагируют друг с другом.
Обзор
- Что такое элемент? Приведите три примера.
- Определение соединения. Объясните, как образуются соединения.
- Сравните и сопоставьте атомы и молекулы.
- Соединение, называемое водой, можно разложить на составные элементы, подав на него электрический ток. Какое соотношение элементов образуется в этом процессе?
- Свяжите ионы с элементами и атомами.
- Что является самым важным элементом жизни?
- Оксид железа часто называют ржавчиной — это красноватое вещество, которое вы можете найти на корродированном металле.Химическая формула этого типа оксида железа – Fe2O3. Ответьте на следующие вопросы об оксиде железа и кратко объясните каждый ответ.
- Является ли оксид железа элементом или соединением?
- Можно ли считать одну частицу оксида железа молекулой или атомом?
- Опишите относительную долю атомов в оксиде железа.

- Что заставляет Fe и O слипаться в оксиде железа?
- Оксид железа состоит из атомов металлов, атомов металлоидов, атомов неметаллов или их комбинации?
- Объясните, почему ионы имеют положительный или отрицательный заряд.
- Назовите три субатомные частицы, описанные в этом разделе.
Химические элементы и их символы
Был ли Эйнштейниум Германиумом, работавшим в Америциуме?
Произведите впечатление на своих друзей, зная химический символ иттербия!
Зачем нужно знать символы химических элементов? Помимо прочего, знание символов значительно облегчает чтение Периодической таблицы. (Эта ссылка на периодические таблицы в режиме онлайн — еще один способ увидеть информацию, представленную ниже.Многие из этих таблиц содержат горячие ссылки на дополнительную информацию о каждом из элементов. Мы призываем вас исследовать!)
- Ас – Актиний
- Серебряный – Серебряный
- Алюминий – Алюминий
- Ам – Америций
- Аргон – Аргон
- Как – Мышьяк
- Ат – Астатин
- Золото – Золото
- В – Бор
- Ва – Барий
- Be – Бериллий
- Bh – Борий
- Би – Висмут
- Бк – Берклиум
- Br – Бром
- C – Углерод
- Са – Кальций
- Cd – Кадмий
- Се – Церий
- Cf – Калифорния
- Cl – Хлор
- См – Кюриум
- Co – Кобальт
- Cn – Копернициум
- Cr – Хром
- Cs – Цезий
- Cu – Медь
- Дб – Дубний
- Ds – Дармштадтий
- Dy – Диспрозий
- Er – Эрбий
- Es – Эйнштейний
- Европий – Европий
- F – Фтор
- Fe – Железо
- Fm – Фермиум
- Fr – Франций
- Ga – Галлий
- Gd – Гадолиний
- Ge – Германий
- H – Водород
- Не – Гелий
- Hf – Гафний
- Hg – Меркурий
- Ho – Гольмий
- Hs – Хассиум
- I – Йод
- Ин – Индий
- Ir – Иридий
- К – Калий
- Кр – Криптон
- Ла – Лантан
- Литий – Литий
- Lr – Лоренсиум
- Лу – Лютеций
- Md – Менделевий
- Мг – Магний
- Mn – Марганец
- Мо – Молибден
- Гора – Мейтнериум
- N – Азот
- Na – Натрий
- Nb – ниобий
- Nd – Неодим
- Неон – Неон
- Никель – Никель
- № – Нобелий
- Np – Нептуний
- О – Кислород
- Ос – Осмий
- P – Фосфор
- Па – Протактиний
- Pb – Свинец
- Pd – Палладий
- Пм — Прометий
- Ро – Полоний
- Pr – Празеодим
- Pt – Платина
- Pu – Плутоний
- Ра – Радий
- Рубидий – Рубидий
- Re – Рений
- Rf – Резерфордий
- Rg – рентгений
- Родий – Родий
- Рн – Радон
- Ру – Рутений
- S – Сера
- Сб – Сурьма
- Sc – Скандий
- Се – Селен
- Sg – Сиборгиум
- Si – Кремний
- См – Самарий
- Sn – олово
- Sr – Стронций
- Та – Тантал
- Тб – Тербий
- ТК – Технеций
- Те – Теллур
- Th – Торий
- Ти – Титан
- Тл – Таллий
- Тм – Тулий
- U – Уран
- Уух – Унунгексий
- Уу -н Унуннилиум
- Uu -o Ununoctium
- Uu -p Унунпентиум
- Uu -q Ununquadium
- Uu -s Унунсептиум
- Уу -т Унунтриум
- Уу -у Унунумиум
- В – Ванадий
- Вт – Вольфрам
- Хе – Ксенон
- Y – Иттрий
- Yb – Иттербий
- Цинк – Цинк
- Zr – Цирконий
Химические символы и формулы.
 Знакомство с химическими реакциями. OCR Gateway. GCSE Chemistry (Single Science) Revision. OCR Gateway.
Знакомство с химическими реакциями. OCR Gateway. GCSE Chemistry (Single Science) Revision. OCR Gateway.Химические символы.Периодическая таблица показывает названия и символы элементов. Химический символ:
- состоит из одной или двух букв
- всегда начинается с заглавной буквы, с любой другой буквы в нижнем регистре
Например, элемент ртуть обозначается как Hg. Вы не должны показывать его как HG, hg или hG.
Формулы элементов
Химическая формула представляет элемент или соединение в сбалансированных уравнениях. Формулы для большинства элементов — это всего лишь их условное обозначение.
Некоторые неметаллические элементы существуют в виде простых молекул с двумя соединенными вместе атомами. Мы говорим, что эти элементы являются двухатомными. Чтобы показать это, их формулы содержат индивидуальный номер 2. Например:
- водород, H 2
- азот, N 2
- Oxygen, O 2
- фтор, F 2
- бром, Br 260nt0gjqhg.0.0.0.1:0.1.0.$0.$1.$7.$4.$1″> 2
- хлор, Cl 2
- йод, I 2
).
Формулы простых ковалентных соединений
Соединение содержит два или более элементов, соединенных химическими связями. Простые ковалентные соединения содержат атомы неметаллов, соединенные ковалентными связями. Их молекулярные формулы показывают:
- символы для каждого элемента в молекуле
- количество атомов каждого элемента в молекуле
| Название соединения | атомов в каждой молекуле | |
|---|---|---|
| NH | NH 3 | 0.0.0.1:0.1.0.$0.$1.$13.$2.$0.$1.$1″> 3 31 азот, 3 водорода |
| углекислый диоксид | CO 2 | 1 углерода, 2 Oxygen |
| Methane | 0.$0.$1.$13.$2.$2.$1″> CH 4 | 1 углерода, 4 водорода |
| 1 сера, 2 кислорода | ||
| Вода | 0.0.0.1:0.1.0.$0.$1.$13.$2.$4.$1″> H 2 O | 2 Водород, 1 кислород |
Эйнштейний загадочен.Ученые раскрыли некоторые его секреты.
Эйнштейний — элемент со знаменитым названием, о котором почти никто не слышал.
С 99 протонами и 99 электронами, он находится в безвестности в нижней части периодической таблицы химических элементов, между калифорнием и фермием. Впервые он был обнаружен во взрывоопасных обломках первой водородной бомбы в 1952 году, и группа ученых, обнаруживших его, дала ему имя в честь Альберта Эйнштейна.
Даже сегодня ученые мало знают об этом.
Эйнштейний очень радиоактивный. Потому что нет стабильных версий, которые не разваливаются в течение нескольких лет, в природе не встречается. Его можно производить в нескольких специализированных ядерных реакторах, но только в незначительных количествах.
В статье для журнала Nature исследователи во главе с Ребеккой Дж. Абергель, возглавляющей группу по химии тяжелых элементов в Национальной лаборатории Лоуренса Беркли в Калифорнии, сообщили в среду, что им удалось выяснить некоторые основные химические свойства эйнштейния.
Это было непросто. Действительно, доктор Абергель описала свою статью как кульминацию «длинной череды несчастных случаев».
Дэвид Л. Кларк, ученый из Лос-Аламосской национальной лаборатории, не участвовавший в исследованиях, сказал, что конечный результат стал «подвигом» и частью возрождения в изучении этих тяжелых элементов, которые очень другие свойства, чем более легкие, более распространенные элементы, и могут быть использованы в новых ядерных реакторах или в терапии рака.
«Такой работы еще никто не делал», — сказал доктор.— сказал Кларк. «Это современное искусство».
Потребовалось время, чтобы начать.
Несколько лет назад доктор Абергель упустил шанс получить некоторое количество эйнштейния, которое производилось в Ок-Риджской национальной лаборатории в Теннесси — федеральном исследовательском центре, занимавшем центральное место в производстве урана, использовавшегося в первых атомных бомбах — потому что вовремя не собрала деньги на исследования. Она была готова к следующей кампании по производству эйнштейния в 2019 году.
Она была готова к следующей кампании по производству эйнштейния в 2019 году.
После того, как она и ее коллеги разработали эксперименты и процедуры безопасности при обращении с радиоактивным элементом, Ок-Ридж сказал им, что никакого эйнштейния в конце концов не будет.Но примерно через неделю Ок-Ридж заявил, что может предоставить некоторое количество эйнштейния. «Внезапно это как «О, оно приближается», — вспоминает доктор Абергель. «Но вы получаете только одну треть того, что вы думали».
Это меньшее количество составляло менее 250 нанограммов, или 250 миллиардных долей грамма — менее одной стомиллионной унции.
Хуже того, образец, который получили исследователи из Беркли, был сильно загрязнен соседом эйнштейния по таблице Менделеева, калифорнием. Это помешало их первоначальным планам собрать атомы эйнштейния в кристалл, а затем пролить свет на химические свойства элемента, бомбардируя его рентгеновскими лучами, прежде чем исследовать структуру отраженных лучей.
Вместо этого они обратились к большой молекулярной структуре, которая, по сути, работала как клешня, удерживая атом эйнштейния, связывая его в восьми местах. Но для изучения этой структуры им нужно было использовать другой исследовательский центр в Национальной ускорительной лаборатории SLAC на другой стороне залива Сан-Франциско. Во время одного из первых приготовлений образец был слишком кислым, что привело к выходу из строя контейнера.
Несмотря на отсутствие утечки радиации, доктор Абергель сказал: «Поскольку у нас так много протоколов безопасности — и это правильно — нам сказали, что мы должны пересмотреть все, переоценить наши методы.
Лос-Аламосская национальная лаборатория, родина атомных бомб, спроектировала новый контейнер для команды из Беркли. Это заняло несколько месяцев, и, наконец, доктор Абергель и ее коллеги смогли провести свои эксперименты.
Они исследовали изотоп эйнштейния, который имеет 155 нейтронов в дополнение к 99 протонам в ядре. Это вторая по продолжительности жизни версия эйнштейния с периодом полураспада 276 дней. С каждой задержкой у них оставалось все меньше эйнштейния для изучения.Каждый месяц исчезало около 7 процентов атомов эйнштейния.
Это вторая по продолжительности жизни версия эйнштейния с периодом полураспада 276 дней. С каждой задержкой у них оставалось все меньше эйнштейния для изучения.Каждый месяц исчезало около 7 процентов атомов эйнштейния.
Затем, из-за пандемии коронавируса, все лаборатории, в том числе необходимые для изучения других аспектов эйнштейния, закрылись. Когда они возобновили работу, большая часть образца исчезла. Но этого еще хватило, чтобы закончить большую часть исследований.
В ходе экспериментов в SLAC они измерили длину молекулярных связей между эйнштейнием и восемью атомами в удерживающей его молекулярной клешне.Длина оказалась 2,38 ангстрема. Один ангстрем — это одна стомиллионная часть сантиметра.
Они ожидали 2,42 или 2,43 ангстрема, сказал Кори П. Картер, профессор химии в Университете Айовы и еще один автор статьи в Nature. «Статистически значимая разница», — сказал он.
Излучение света эйнштейнием также неожиданно сместилось в сторону более короткой длины волны, когда он был связан в молекулярном клешне. Исследователи ожидали, что длина волны станет больше.
Исследователи ожидали, что длина волны станет больше.
Доктор Абергель сказал, что различия указывают на то, что электроны двигались иначе, чем предполагалось.
Неудивительно. С 99 электронами, вращающимися вокруг ядра эйнштейния, трудно придумать модель, точно описывающую происходящее. В отличие от более легких элементов, большой положительный заряд эйнштейния и других тяжелых элементов заставляет электроны двигаться со скоростями, которые составляют значительную часть скорости света. Это означает, что эффекты специальной теории относительности Эйнштейна также должны быть приняты во внимание.
«Электроны движутся так быстро, что химия меняется, потому что вся химия связана с поведением электронов», — сказал Томас Альбрехт-Шёнцарт, профессор химии из Университета штата Флорида, не участвовавший в исследовании. «Почти по определению вы получите странные свойства».
Этот вопрос еще долго будет изучаться.
«Проблема в том, что эти вычисления очень сложны», — сказал доктор Альбрехт-Шёнцарт.
Сам по себе эйнштейний вряд ли найдет практическое применение в ближайшее время.Но другие тяжелые элементы могут, например, актиний, который немного легче с 89 протонами и 89 электронами. И то, что ученые узнают об эйнштейнии, также может дать еще больше информации об этих элементах. «Сходство в этой части периодической таблицы учит нас принципам структуры и связи», — сказал доктор Кларк, ученый из Лос-Аламосской национальной лаборатории.
Актиний уже проходит испытания в качестве средства для лечения рака. Поскольку химия тяжелых элементов изучена недостаточно, сложнее разработать содержащие их молекулы.
«Но если мы сможем понять и освоить эту химию на этом уровне образования химических связей, тогда мы сможем заняться такими вещами, как лечение рака», — сказал доктор Кларк.
Чтение периодической таблицы | Институт научного образования Дэвидсона
Многие люди не понимают важности периодической таблицы элементов. Они могут думать, что это не более чем способ организации природных элементов. Чтобы оценить его гениальность и почерпнуть огромное количество информации, которую он содержит, вам нужно уметь его читать.
Чтобы оценить его гениальность и почерпнуть огромное количество информации, которую он содержит, вам нужно уметь его читать.
Дмитрий Менделеев, разработавший его, организовал элементы таким образом, чтобы отразить их свойства. Он опирался на все имевшиеся в 1869 г. сведения об известных элементах и искал способ вместить все знания об этих элементах и изложить их перед читателями самой формой таблицы.
Многие из известных сегодня элементов не были открыты во времена Менделеева, а доступная информация об известных была ограничена. При составлении таблицы Менделеев опирался на работы Джона Дальтона, одного из первых ученых, определивших атомную массу элементов, и Иоганна Вольфганга Доберейнера о закономерностях некоторых свойств отдельных групп элементов.
Как лучше всего смотреть периодическую таблицу?
Начнем с самого очевидного расположения — атомного номера. Элементы расположены в порядке возрастания атомного номера. Каждый элемент имеет уникальный атомный номер, который указывает, сколько у него протонов. Например, атомный номер кислорода равен 8, что говорит нам о том, что его ядро содержит восемь протонов.
Каждый элемент имеет уникальный атомный номер, который указывает, сколько у него протонов. Например, атомный номер кислорода равен 8, что говорит нам о том, что его ядро содержит восемь протонов.
Ядро атома (почти всегда) содержит протоны и нейтроны. Масса протона очень похожа на массу нейтрона, а масса электрона, окружающего ядро, намного меньше.Следовательно, совокупная масса протонов и нейтронов составляет массу атома. Масса одного протона или одного нейтрона принята за одну атомную единицу массы.
Например, атом фтора имеет 9 протонов и 10 нейтронов. Его атомный номер равен 9, а его атомная масса составляет 19 атомных единиц массы. Таким образом, мы можем сказать, что его атомный вес равен 19, или его массовое число равно 19.
Другим уровнем упорядочения являются столбцы таблицы. Каждый столбец представляет собой химическое семейство — химические элементы в нем имеют схожие химические свойства.Почему? Потому что каждый элемент столбца имеет одинаковое количество электронов на внешней оболочке. Эти электроны оказывают наиболее существенное влияние на то, как элемент реагирует с другими элементами или веществами. Все элементы в первом столбце, например, имеют один электрон в своей валентной оболочке, и поэтому будут иметь очень сильную реакцию на воду.
Эти электроны оказывают наиболее существенное влияние на то, как элемент реагирует с другими элементами или веществами. Все элементы в первом столбце, например, имеют один электрон в своей валентной оболочке, и поэтому будут иметь очень сильную реакцию на воду.
Что происходит, когда натрий встречается с водой? ScienceFix:
Четыре столбца – два первых и два последних – имеют наибольшее семейное сходство:
В первой колонке таблицы перечислены водород и щелочные металлы, все из которых имеют один электрон на валентной оболочке.Этот электрон делает их очень реакционноспособными, поэтому их необходимо хранить в масле, чтобы они не реагировали с воздухом или водяным паром. Эти металлы очень мягкие, обладают высокой тепло- и электропроводностью, имеют низкую температуру плавления и пластичны. По мере спуска по колонне металлы становятся еще мягче, а их температуры плавления – ниже.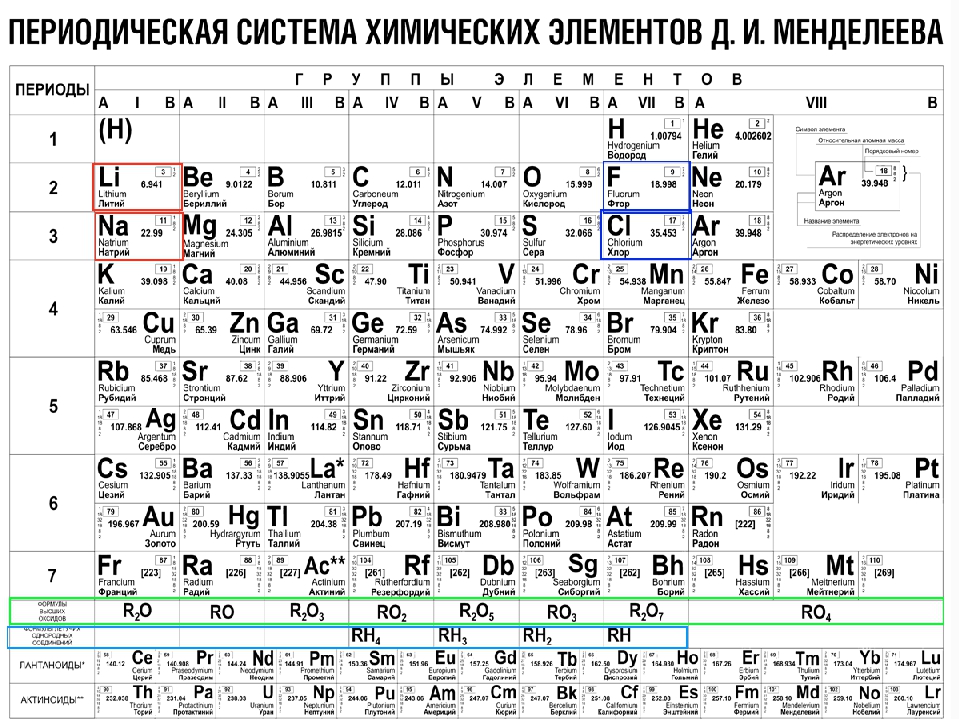
Во второй столбец входят щелочноземельные металлы, которые имеют два электрона на своих внешних оболочках. По своим свойствам они аналогичны щелочным металлам, но химически менее активны.Поскольку у них есть два электрона в их оболочках, они имеют тенденцию производить различные соединения из щелочных металлов.
В седьмой колонке находятся галогены. Это неметаллы с семью электронами на внешней оболочке, поэтому до полной оболочки им не хватает одного электрона. Галогены очень химически активны, потому что они «хотят» привлечь этот дополнительный электрон от другого элемента, чтобы завершить свою оболочку. Все галогены имеют очень сильный запах и встречаются в природе в двухатомном состоянии — например, хлор Cl2.
Восьмая и последняя колонка содержит благородные газы — все они бесцветны, не имеют запаха и вкуса. Эти элементы имеют полную внешнюю оболочку с восемью электронами (за исключением гелия, у которого полная оболочка с двумя электронами). Им «не нужно» получать электроны от какого-либо другого элемента или делиться своими электронами в химической реакции, и поэтому обычно они не образуют соединений. Отсюда и произошло название «благородные газы» — потому что они не любят ни с кем смешиваться.
Им «не нужно» получать электроны от какого-либо другого элемента или делиться своими электронами в химической реакции, и поэтому обычно они не образуют соединений. Отсюда и произошло название «благородные газы» — потому что они не любят ни с кем смешиваться.
Ряды
Строки таблицы называются периодами, поскольку каждая из них начинается с элемента в первом столбце, который ведет себя как щелочной металл, переходит к щелочноземельному металлу и заканчивается галогеном и благородным газом.Каждая строка представляет целый ряд элементов с их типичными химическими свойствами.
Номер периода означает количество уровней энергии электрона или самый высокий уровень энергии, который занимает электрон. Возьмем, к примеру, столбец щелочного металла: литий (Li) находится на периоде 2 и содержит два электронных энергетических уровня; натрий (Na), период 3, имеет три уровня; калий (К), период 4, имеет четыре; и так далее.
Другое имущество
Теперь, когда мы рассмотрели расположение атомных номеров, столбцов и строк, мы можем рассмотреть другие общие тенденции, которые предсказывают химическое поведение элементов в соответствии с их положением в таблице. .
.
Двигаясь вниз по определенному столбцу, атомный номер увеличивается, т. е. ядро элемента становится больше и имеет больше электронов на разных энергетических уровнях, что приводит к большему расстоянию между ядром и внешней электронной оболочкой (другими словами, большему атомному радиусу). .
Такое расположение позволяет также предложить некоторые общие правила, например, об ионизации. Ионизация — это уровень энергии, необходимый для удаления электрона из атома в газообразном состоянии. Он может указывать на уровень реакционной способности атома, а также на его химические и физические свойства.
Если мы посмотрим, например, на конкретный столбец, то увидим, что чем дальше вниз мы движемся, тем дальше находится электронная оболочка от ядра – и тем легче удалить из нее электрон. Таким образом, энергия ионизации становится меньше при движении вниз по столбу. Теперь, глядя на конкретную строку, мы видим, что атомный номер увеличивается по мере продвижения (слева направо) по периоду, и, таким образом, ядро становится больше и более положительным, что затрудняет удаление электрона из атома. Таким образом, по мере движения по ряду его энергия ионизации уменьшается.
Таким образом, по мере движения по ряду его энергия ионизации уменьшается.
Периодическая таблица предлагает огромное количество информации, которую используют как начинающие, так и опытные химики, чтобы понять свойства металлов, расположение электронов, квантовые числа, электроотрицательность, ионное поведение, ожидаемые соединения, образующиеся в результате реакции между различными элементами, и более.
Периодическая таблица считается плодом гениальности. Это гораздо больше, чем просто расположение элементов — таблица сортирует элементы в соответствии с их химическими семействами и химическим поведением, так что ее принципы организации позволяют предсказать поведение незнакомого элемента в соответствии с нашими знаниями о соседних элементах.Знание того, как читать периодическую таблицу, позволяет расширить наши химические знания и, таким образом, лучше понять материальный мир внутри и вокруг нас.
.
.




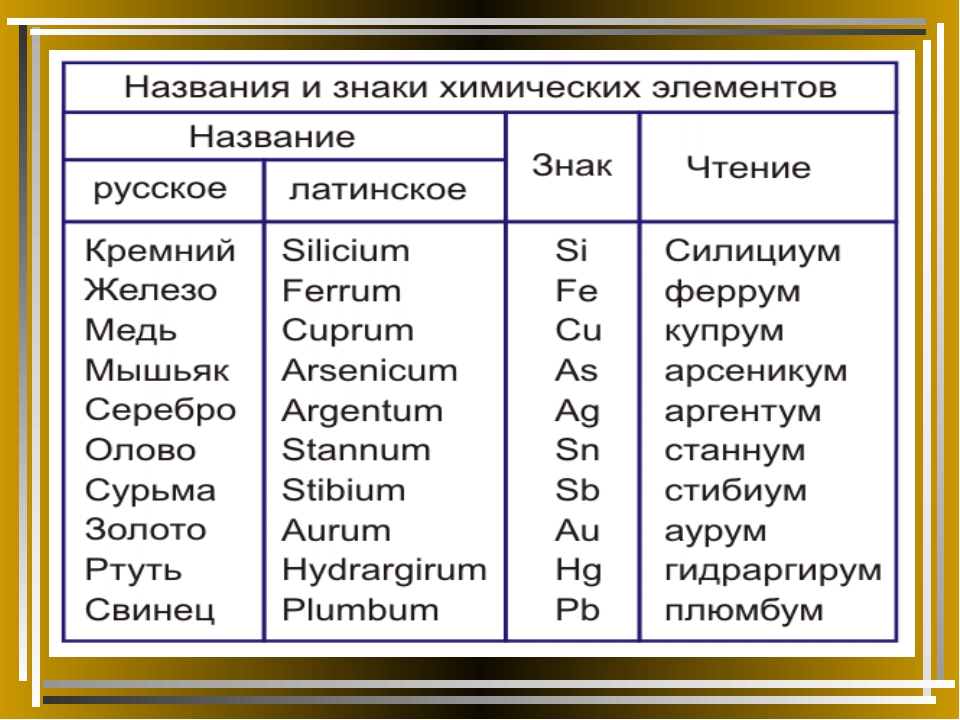 Если бор проявляет как окислительные, так и восстановительные свойства, то остальные элементы этой группы проявляют только восстановительные свойства. Бор не образует катионов, потому что энтальпии ионизации бора так велики, что энтальпии образования решетки или энтальпии гидратации не могут компенсировать такие затраты энергии. Обычно бор образует три ковалентные связи с использованием трех $/?2-гибридных орбиталей, лежащих в плоскости под углом 120°. Соединения бора типа ВХ3 координационно ненасыщенны и ведут себя как сильные кислоты Льюиса.
Если бор проявляет как окислительные, так и восстановительные свойства, то остальные элементы этой группы проявляют только восстановительные свойства. Бор не образует катионов, потому что энтальпии ионизации бора так велики, что энтальпии образования решетки или энтальпии гидратации не могут компенсировать такие затраты энергии. Обычно бор образует три ковалентные связи с использованием трех $/?2-гибридных орбиталей, лежащих в плоскости под углом 120°. Соединения бора типа ВХ3 координационно ненасыщенны и ведут себя как сильные кислоты Льюиса.


