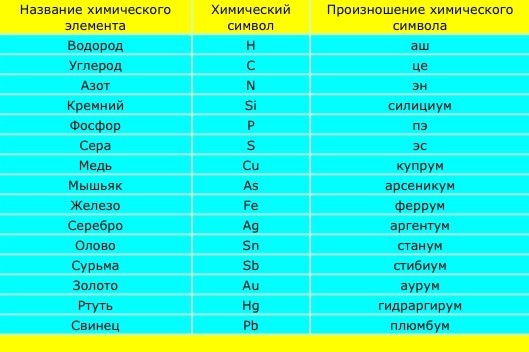
обозначающие знаки, таблица, правильное чтение
Химия
12.11.21
16 мин.
Строение веществ и их переходы из одного состояния в другое изучает химия. В первую очередь для успешного понимания науки нужно выучить названия и произношение химических элементов. Существует общепринятая система классификации. Её первоначальный вариант разработал русский учёный Дмитрий Иванович Менделеев, назвав свой свод периодической таблицей. Всего же на начало 2019-го года известно 118 элементов.
Оглавление:
- Классификация химических веществ
- Правильное произношение
- Названия популярных элементов
- Чтение формул и символов
Классификация химических веществ
Вещество состоит из различных частиц. В его состав входят электроны, нейтроны и протоны. Взаимосвязи элементарных зарядов образуют атомы. В свою очередь, из них формируются молекулы и кристаллы. Из-за особенностей строения кристаллической решётки — основы вещества — тела могут находиться в твёрдом, жидком или газообразном состоянии. При этом они могут переходить из одной фазы в другую.
Из-за особенностей строения кристаллической решётки — основы вещества — тела могут находиться в твёрдом, жидком или газообразном состоянии. При этом они могут переходить из одной фазы в другую.
Каждому состоянию тела присущ набор свойств. Это характеристики, определяющие индивидуальность вещества, позволяя их отличать друг от друга.
Из наиболее интересных можно отметить: температуру плавления и кипения, строение кристаллической решётки, плотность, термодинамические и фазовые характеристики.
Вещества могут не только изменять свои агрегатные состояния, но и взаимодействовать между собой, образовывая новые соединения. Впервые классифицировать тела попробовал Д. И. Менделеев.
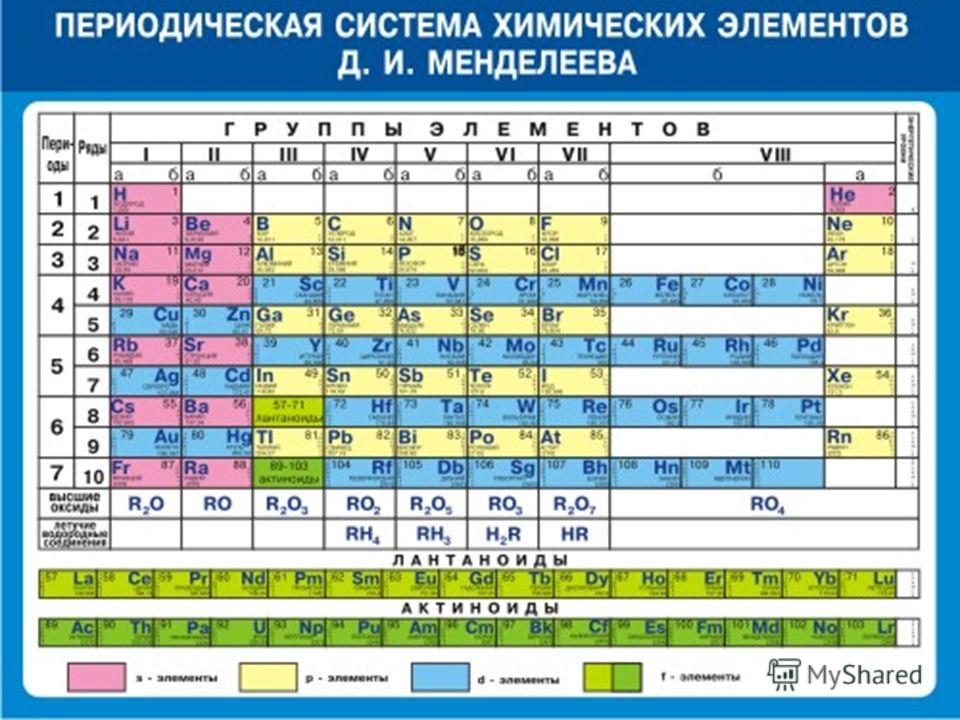
Его периодическая таблица, составленная им с 1869 года по 1871 год, строилась на отличии атомного веса (массы). В современном варианте его система видоизменилась. Так было выполнено сведение веществ в двумерную таблицу, в которой столбцы определяют главные физико-химические свойства, а строки являются периодами, в определённой мере подобными друг другу.
Каждый элемент, внесённый в таблицу, имеет свою историю открытия. Учёные, исследуя то или иное вещество, выделяли в нём индивидуальные особенности, что позволяло им давать названия, ассоциирующиеся с какими-то либо личными убеждениями и сравнениями.
Но перед этим в учёном мире были приняты важные термины:
- Элемент — слово произошло от латинского elementum, обозначающего какую-либо часть. Ученые античного времени говорили: «Как слова состоят из букв, так и тела — из элементов». Слово образовано из отрицательной приставки «а» и «томе» — рассечение.
- Атом — в переводе с греческого языка слово обозначает целое (неделимое).
- Молекула — термин происходит от латинского moles. На русский язык это слово можно перевести как «массив», «глыба».
Как видно из названия, химические совокупности ассоциируются с их свойствами.
При этом у подавляющего числа элементов, звучащих на русском, они фонетически близки к латинским.
Правильное произношение
В таблице Менделеева все вещества написаны на латыни. Часто вместе с сокращённым названием указывается полное. Например, Ar — argon, Ba — barium, Au — aurum. Но для русскоязычного населения полное наименование пишут на русском. Так, Ar — аргон, Ba — барий, Au — аурум.
Произношение их что на латыни, что на русском языке одинаково. Единственное — присутствует акцент. Но существуют элементы, которые имеют двойное название. То есть, их можно произносить так же, как они и пишутся, или совсем по-другому. К таким веществам относятся:
- Золото — обозначается знаком Au и читается аурум.
 Слово в переводе с иностранного обозначает «жёлтое».
Слово в переводе с иностранного обозначает «жёлтое». - Серебро — символизируется символом Ar, может произноситься как «аргентум». Слово имеет индоевропейское происхождение. Arg — обозначает светлый.
- Железо — подписывают знаком Fe, а читают как феррум. С латинского ferrum происходит от fars, что обозначает «крепкий».
- Сера — правильное название sulfur (сульфур). Обозначают её символом S. Интересно, что в древнерусском и старославянском под серой понимали любое горючее вещество, например, жир.
- Свинец — произносится как плюмбум (plumbum). Причина названия элемента доподлинно неизвестна. Сокращённое обозначение элемента — Pb.
- Олово — химический символ Sn. Элемент четырнадцатой группы пишется на латыни как stannum. Произносится также — «станниум». Происхождение записи связывают с санскритским словом, обозначающим прочность.
- Углерод — элемент, обозначающийся знаком C. Латинское название carboneum произносится как «карбон». Слово имеет в названии корень carbō обозначающий «уголь».

- Ртуть — с латинского звучит как «гидраргиум». Hydrargirum произошло от слияния слов «хюдор» — вода и «аргирос» — серебро.
- Медь — международное обозначение Сu. Пишется как cuprum, а произносится «купрум». Считается, что элемент получил название в честь острова Кипр, где находилось много рудников.
- Азот — пишется в зарубежной литературе как nitrogenium. За обозначение принят символ N. На русском языке произносится как «нитрогениум». Слово происходит от древнегреческого ἄζωτоς — «безжизненный».
Названия популярных элементов
В классической периодической таблице указано 118 элементов.
Расположены они по атомным номерам. Но вместе с этим существует и расширенный свод. Он является логическим продолжением труда русского химика и включает возможные, ещё не выявленные вещества. С учётом расширенной таблицы всего предполагается существование 218 веществ. Вот самые распространённые химические элементы таблицы Менделеева с произношением:
Вот самые распространённые химические элементы таблицы Менделеева с произношением:
| Азо́т | эн | N | Nitrogenium |
| Алюми́ний | алюми́ний | Al | Aluminium |
| Ба́рий | Barium | Ba | ба́рий |
| Бери́ллий | Beryllium | Be | бери́ллий |
| Бор | Borum | B | бор |
| Бром | Bromium | Br | бром |
| Вана́дий | Vanadium | V | вана́дий |
| Ви́смут | Bismuthum | Bi | ви́смут |
| Водород | Hydrogenium | H | аш |
| Вольфра́м | Wolframium | W | вольфра́м |
| Ге́лий | Helium | He | ге́лий |
| Герма́ний | Germanium | Ge | герма́ний |
| Желе́зо | Ferrum | Fe | фе́ррум |
| Зо́лото | Aurum | Au | а́урум |
| Индий | Indium | In | и́ндий |
| Йод | Iodium | I | йод |
| Ири́дий | Iridium | Ir | ири́дий |
| Ка́дмий | Cadmium | Cd | ка́дмий |
| Ка́лий | Kalium | K | ка́лий |
| Ка́льций | Calcium | Ca | ка́льций |
| Кислоро́д | Oxygenium | O | о |
| Ко́бальт | Cobaltum | Co | ко́бальт |
| Кре́мний | Silicium | Si | сили́циум |
| Крипто́н | Krypton | Kr | крипто́н |
| Ксено́н | Xenon | Xe | ксено́н |
| Литий | Lithium | Li | ли́тий |
| Ма́гний | Magnesium | Mg | ма́гний |
| Ма́рганец | Manganum | Mn | ма́рганец |
| Медь | Cuprum | Cu | ку́прум |
| Молибде́н | Molybdaenum | Mo | молибде́н |
| Мышьяк | As | арсе́никум | |
| На́трий | Natrium | Na | на́трий |
| Неоди́м | Neodymium | Nd | неоди́м |
| Нео́н | Neon | Ne | нео́н |
| Ни́кель | Niccolum | Ni | ни́кель |
| Олово | Stannum | Sn | ста́ннум |
| Осмий | Osmium | Os | о́смий |
| Палла́дий | Palladium | Pd | палла́дий |
| Платина | Platinum | Pt | пла́тина |
| Плуто́ний | Plutonium | Pu | плуто́ний |
| Radium | Ra | ра́дий | |
| Радо́н | Radon | Rn | радо́н |
| Резерфо́рдий | Rutherfordium | Rf | резерфо́рдий |
| Ре́ний | Rhenium | Re | ре́ний |
| Ртуть | Hydrargyrum | Hg | гидра́ргирум |
| Руби́дий | Rubidium | Rb | руби́дий |
| Свине́ц | Plumbum | Pb | плю́мбум |
| Селе́н | Selenium | Se | селе́н |
| Се́ра | Sulfur | S | эс |
| Серебро́ | Argentum | Ag | арге́нтум |
| Стро́нций | Strontium | Sr | стро́нций |
| Сурьма́ | Stibium | Sb | сти́биум |
| Танта́л | Tantalum | Ta | танта́л |
| Тита́н | Titanium | Ti | тита́н |
| То́рий | Thorium | Th | то́рий |
| Углеро́д | Carboneum | C | цэ |
| Ура́н | Uranium | U | ура́н |
| Фо́сфор | Phosphorus | P | пэ |
| Фтор | Fluorum | F | фтор |
| Хлор | Chlorum | Cl | хлор |
| Хром | Chromium | Cr | хром |
| Це́зий | Caesium | Cs | це́зий |
| Цинк | Zincum | Zn | цинк |
| Цирко́ний | Zirconium | Zr | цирко́ний |
Следует отметить, что знаковое обозначение элементов принято Международным союзом теоретической и прикладной химии. Его членами являются академии наук, химические общества, и научные организации 57 стран мира.
Его членами являются академии наук, химические общества, и научные организации 57 стран мира.
В качестве аббревиатуры комитета используется ИЮПАК. Именно его члены занимаются стандартизацией в области химии.
Чтение формул и символов
Цифра, стоящая перед веществом, обозначает количество молекул. Элемент же записывают буквенными символами. В устной речи придерживаются правила, при котором называют последовательно, начиная справа, все знаки.
Например, h3O — формула воды, её читают как «аш два о», NaCl (хлорид натрия) — «натрий хлор». Чтобы правильно произносить химические соединения, необходимо знать, как звучат символы элементов. Не стоит забывать и то, что индекс, относящийся к скобкам (группе атомов), произносят с суффиксом -жды. Например: дважды, трижды, четырежды.
Таким образом, несмотря на то, что существуют русские и латинские обозначения каждого химического элемента, в химических формулах используется только стандартное правило. При произношении соединения употребляют латинские названия. При этом часто они соответствуют русским, особенно если в имени элемента используется более одной буквы. Если же в названии стоит один символ, то латинскому имении соответствует название этой буквы.
При произношении соединения употребляют латинские названия. При этом часто они соответствуют русским, особенно если в имени элемента используется более одной буквы. Если же в названии стоит один символ, то латинскому имении соответствует название этой буквы.
То есть, например, гелий, так и произносится в формулах. Но если встречаются сокращённые буквы латиницы, то нужно произносить элемент полностью, как он и называется, например, Si — сицилициум и так далее. Вот некоторые названия редких элементов:
- Сm — кюрий.
- Сf — калифорний.
- Fm — фермий.
- No — нобелий.
- Lr — лоуренций.
- Hs — хассий.
- Po — полоний.
- Pa — проктаний.
- Gd — гадолиний.
- Er — эрбий.
Интересно и то, что последние элементы, которые добавляют в таблицу Менделеева являются синтезированными. Так, 115 был получен в Дубне. Назвали его moscovium (Mc), произносится на русском — «московий». Элемент 117 назвали tennessine (TS). Имя ему было дано в честь штата Теннесси.
Имя ему было дано в честь штата Теннесси.
В честь Юрия Цолаковича Оганесяна было решено назвать 118 элемент. Пишется он как oganesson (Og), читается — «оганесон». Это пока последний элемент, добавленный в таблицу.
Латинские названия химических элементов – произношение на русском языке
1936
3
В этом уроке вы научитесь читать периодическую таблицу. Мы внимательно рассмотрим группы периодической таблицы. Кроме того, вы узнаете о различных свойствах групп периодической таблицы, периодов и семейств.
Различные элементы организованы и отображаются в периодической таблице. В этой таблице, разработанной русским химиком Дмитрием Менделеевым (1834–1907) в 1869 году, сгруппированы элементы, которые, хотя и уникальны, обладают некоторыми общими химическими свойствами с другими элементами. Свойства элементов определяют их физическое состояние при комнатной температуре: они могут быть газами, твердыми телами или жидкостями. Элементы также обладают специфической химической активностью, способностью соединяться и химически связываться друг с другом.
В этой таблице, разработанной русским химиком Дмитрием Менделеевым (1834–1907) в 1869 году, сгруппированы элементы, которые, хотя и уникальны, обладают некоторыми общими химическими свойствами с другими элементами. Свойства элементов определяют их физическое состояние при комнатной температуре: они могут быть газами, твердыми телами или жидкостями. Элементы также обладают специфической химической активностью, способностью соединяться и химически связываться друг с другом.
В периодических таблицах есть много типов физических и химических элементов, которые устанавливаются в соответствии с их свойствами и позиционируются из-за их атомной структуры. Периодические таблицы содержат строки и столбцы. В периодической таблице строки расположены слева направо, а столбцы — сверху вниз.
Периодические таблицы — один из важнейших инструментов в истории химии. Он сообщает нам атомные свойства каждого типа химического вещества, также сообщает об атомном номере, атомной массе, а также показывает сравнение между элементами. Итак, здесь мы показываем некоторые моменты о том, как читать периодическую таблицу.
Итак, здесь мы показываем некоторые моменты о том, как читать периодическую таблицу.
Таблица исключений с правильным произношением химических элементов на русском языке
| АТОМНЫЙ НОМЕР | РУССКОЕ НАЗВАНИЕ ХИМИЧЕСКОГО ЭЛЕМЕНТА | ХИМИЧЕСКИЙ ЗНАК | ПРОИЗНОШЕНИЕ НА РУССКОМ ЯЗЫКЕ |
| 1 | Водород | H | Аш |
| 6 | Углерод | C | Це |
| 7 | Азот | N | Эн |
| 8 | Кислород | O | О |
| 14 | Кремний | Si | Силициум |
| 15 | Фосфор | P | Пэ |
| 16 | Сера | S | Эс |
| 26 | Железо | Fe | Феррум |
| 29 | Медь | Cu | Купрум |
| 33 | Мышьяк | As | Арсеникум |
| 47 | Серебро | Ag | Аргентум |
| 50 | Олово | Sn | Станум |
| 51 | Сурьма | Sb | Стибиум |
| 79 | Золото | Au | Аурум |
| 80 | Ртуть | Hg | Гидраргирум |
| 82 | Свинец | Pb | Плюмбум |
Примечание: произношение остальных химических элементов соответствует названию элементов на русском языке (пример: аргон произносится как аргон, хром произносится как хром и т. д.) д.) | |||
В таблице ниже описаны произношения всех известных на данный момент химических элементов.
Полная таблица латинских названий химических элементов с произношением на русском языке
(расположение слоев в порядке заполнения подуровней)
| Атомный номер | Русское название химического элемента | Латинское название химического элемента | Химический знак | Произношение на русском языке |
| 1 | водород | hydrogenium | H | аш |
| 2 | гелий | helium | He | гелий |
| 2 период химических элементов | ||||
| 3 | литий | lithium | Li | литий |
| 4 | бериллий | beryllium | Be | бериллий |
| 5 | бор | borium | B | бор |
| 6 | углерод | carboneum | C | це |
| 7 | азот | nitrogenium | N | эн |
| 8 | кислород | oxygenium | O | о |
| 9 | фтор | fluorum | F | фтор |
| 10 | неон | neon | Ne | неон |
| 3 период химических элементов | ||||
| 11 | натрий | natrium | Na | натрий |
| 12 | магний | magnesium | Mg | магний |
| 13 | алюминий | aluminium | Al | алюминий |
| 14 | кремний | silicium | Si | силициум |
| 15 | фосфор | phosphorus | P | пэ |
| 16 | сера | sulfur | S | эс |
| 17 | хлор | clorum | Cl | хлор |
| 18 | аргон | argon | Ar | аргон |
| 4 период химических элементов | ||||
| 19 | калий | kalium | K | калий |
| 20 | кальций | calcium | Ca | кальций |
| 21 | скандий | scandium | Sc | скандий |
| 22 | титан | titanium | Ti | титан |
| 23 | ванадий | vanadium | V | ванадий |
| 24 | хром | chromium | Cr | хром |
| 25 | марганец | manganum | Mn | марганец |
| 26 | железо | ferrum | Fe | феррум |
| 27 | кобальт | cobaltum | Co | кобальт |
| 28 | никель | niccolum | Ni | никель |
| 29 | медь | cuprum | Cu | купрум |
| 30 | цинк | zincum | Zn | цинк |
| 31 | галий | gallium | Ga | галий |
| 32 | германий | germanium | Ge | германий |
| 33 | мышьяк | arsenicum | As | арсеникум |
| 34 | селен | selenium | Se | селен |
| 35 | бром | bromum | Br | бром |
| 36 | криптон | krypton | Kr | криптон |
| 5 период химических элементов | ||||
| 37 | рубидий | rubidium | Rb | рубидий |
| 38 | стронций | strontium | Sr | стронций |
| 39 | иттрий | yttrium | Y | иттрий |
| 40 | цирконий | zirconium | Zr | цирконий |
| 41 | ниобий | niobium | Nb | ниобий |
| 42 | молибден | molybdaenum | Mo | молибден |
| 43 | технеций | technetium | Tc | технеций |
| 44 | рутений | ruthenium | Ru | рутений |
| 45 | родий | rhodium | Rh | родий |
| 46 | палладий | palladium | Pd | палладий |
| 47 | серебро | argentum | Ag | аргентум |
| 48 | кадмий | cadmium | Cd | кадмий |
| 49 | индий | indium | In | индий |
| 50 | олово | stannum | Sn | станум |
| 51 | сурьма | stibium | Sb | стибиум |
| 52 | теллур | tellurium | Te | теллур |
| 53 | йод | iodum | I | йод |
| 54 | ксенон | xenon | Xe | ксенон |
| 6 период химических элементов | ||||
| 55 | цезий | ceslum | Cs | цезий |
| 56 | барий | barlum | Ba | барий |
| 57 | лантан | lanthanum | La | лантан |
| 58 | церий | cerium | Ce | церий |
| 59 | празеодим | praseodymium | Pr | празеодим |
| 60 | неодим | neodymium | Nd | неодим |
| 61 | прометий | promethium | Pm | прометий |
| 62 | самарий | samarium | Sm | самарий |
| 63 | европий | europium | Eu | эвропий |
| 64 | гадолиний | gadolinium | Gd | гадолиний |
| 65 | тербий | terbium | Tb | тербий |
| 66 | диспрозий | dysprosium | Dy | диспрозий |
| 67 | гольмий | holmium | Ho | гольмий |
| 68 | эрбий | erbium | Er | эрбий |
| 69 | тулий | thulium | Tm | тулий |
| 70 | иттербий | ytterbium | Yb | иттербий |
| 71 | лютеций | lutetium | Lu | лютеций |
| 72 | гафний | hafnium | Hf | гафний |
| 73 | тантал | tantalum | Ta | тантал |
| 74 | вольфрам | wolframium | W | вольфрам |
| 75 | рений | rhenium | Re | рений |
| 76 | осмий | osmium | Os | осмий |
| 77 | иридий | iridium | Ir | иридий |
| 78 | платина | platinum | Pt | платины |
| 79 | золото | aurum | Au | аурум |
| 80 | ртуть | hydrargyrum | Hg | гидраргирум |
| 81 | таллий | thallium | Tl | таллий |
| 82 | свинец | plumbum | Pb | плюмбум |
| 83 | висмут | bismuthum | Bi | висмут |
| 84 | полоний | polonium | Po | полоний |
| 85 | астат | astatium | At | астата |
| 86 | радон | radon | Rn | радон |
| 7 период химических элементов | ||||
| 87 | франций | francium | Fr | франций |
| 88 | радий | radium | Ra | радий |
| 89 | актиний | actinium | Ac | актиний |
| 90 | торий | thorium | Th | торий |
| 91 | протактиний | protactinium | Pa | протактиний |
| 92 | урана | uranium | U | уран |
| 93 | нептуний | neptunium | Np | нептуний |
| 94 | плутоний | plutonium | Pu | плутоний |
| 95 | америций | americium | Am | америций |
| 96 | кюрий | curium | Cm | кюрий |
| 97 | берклий | berkelium | Bk | берклий |
| 98 | калифорний | californium | Cf | калифорний |
| 99 | эйнштейний | einsteinium | Es | эйнштейний |
| 100 | фермий | fermium | Fm | фермий |
| 101 | менделеевий | mendelevium | Md | менделеевий |
| 102 | нобелий | nobelium | No | нобелий |
| 103 | лоуренсий | lawrencium | Lr | лоуренсий |
| 104 | резерфордий | rutherfordium | Rf | резерфордий |
| 105 | дубний | dubnium | Db | дубний |
| 106 | сиборгий | seaborgium | Sg | сиборгий |
| 107 | борий | bohrium | Bh | борий |
| 108 | хассий | hassium | Hs | хассий |
| 109 | мейтнерий | meitnerium | Mt | мейтнерий |
| 110 | Дармштадтий (Унуннилий) | Darmstadtium (Ununnilium) | Ds (Uun) | дармштадий |
| 111 | Рентгений (Унунуний) | Roentgenium (Unununium) | Rg (Uuu) | рентгений |
| 112 | Коперниций (Унунбий) | Copernicium (Ununbium) | Cn (Uub) | коперниций |
| 113 | Нихоний (Унунтрий) | Nihonium (Ununtrium) | Nt (Unt) | нихоний |
| 114 | Флеровий (Унунквадий) | Flerovium (Ununquadium) | Fl (Uuq) | флеровий |
| 115 | Московий (Унунпентий) | Moscovium (Ununpentium) | Mc (Uup) | московий |
| 116 | Ливерморий (Унунгексий) | Livermorium (Ununhexium) | Lv (Uuh) | ливерморий |
| 117 | Теннессин (Унунсептий) | Tennessine (Ununseptium) | Тc (Uus) | теннессин |
| 118 | Оганесон (Унуноктий) | Oganesson (Ununoctium) | Og (Uuo) | оганесон |
| 8 период химических элементов | ||||
| 119 | унуненний | ununnenium | Uue | |
| 120 | унбинилий | unbinilium | Ubn | |
| 121 | унбиуний | unbiunium | Ubu | |
| 122 | унбибий | unbibium | Ubb | |
| 123 | унбитрий | unbitrium | Ubt | |
| 124 | унбиквадий | unbiquadium | Ubq | |
| 125 | унбипентий | unbipentium | Ubp | |
| 126 | унбигексий | unbihexium | Ubh | |
Таблицы
Читать книгу «Химические элементы» онлайн полностью📖 — Александр Иванов — MyBook.

Что выбрать
Библиотека
Подписка
📖Книги
🎧Аудиокниги
👌Бесплатные книги
🔥Новинки
❤️Топ книг
🎙Топ аудиокниг
🎙Загрузи свой подкаст
📖Книги
🎧Аудиокниги
👌Бесплатные книги
🔥Новинки
❤️Топ книг
🎙Топ аудиокниг
🎙Загрузи свой подкаст
- Главная
- Библиотека
- Александр Иванов
- «Химические элементы»
- Читать
Александр Иванов, Игорь Гордий
Химические элементы
© Иванов А. Б., Гордий И.В., текст, 2018
Б., Гордий И.В., текст, 2018
© Чукавин А.А., ил., 2018
© ООО «Издательство АСТ», 2018
* * *
От авторов
Приветствуем тебя, дорогой читатель! В руках ты держишь книгу, в которой рассказывается о том, из каких химических элементов состоит окружающий нас мир, об их свойствах, о том, по какому принципу они расположены в таблице Менделеева, удивительные истории их открытия и многое другое. Вместе мы погрузимся в прекрасный мир химии и сделаем акценты на самых интересных, самых важных и самых необычных явлениях, с которыми мы можем встретиться при изучении химии.
Нет, это не занудный школьный учебник – гораздо лучше! Эта книга станет для тебя первым серьезным, но при этом легким шагом в мир самой удивительной и прекрасной науки – химии. Ведь она присутствует во всех сферах нашей жизни, а мы об этом даже не задумываемся.
Да, у многих возникают проблемы с химией, но мы постараемся сделать так, чтобы твое путешествие через эту книгу было максимально комфортным и полезным. Для этого мы объясним тебе все термины, с которыми ты можешь встретиться впервые.
Для этого мы объясним тебе все термины, с которыми ты можешь встретиться впервые.
Данная книга написана Александром Ивановым, создателем и автором проекта «Химия – просто» и Игорем Гордием – ответственным за научный контент в социальных сетях проекта «Химия – просто». Мы очень рады, что у нас есть возможность вместе с тобой окунуться в эту восхитительную науку. И не забудь подписаться на наш YouTube-канал, группу вконтакте, а также в других социальных сетях. В конце книги ты найдёшь QR-коды, с помощью которых ты легко найдешь наши аккаунты:
youtube.com/c/ChemistryEasy
vk.com/chemistryeasyru
Ну все, скорее перелистывай страницу и читай дальше! Книга сама себя не прочтет!
P.S.: а школьный учебник сдай в макулатуру. Береги природу!
Введение
«Вся гордость учителя в учениках, в росте посеянных им семян».
Д. И. Менделеев
Когда мы говорим о химии, то в первую очередь на ум нам приходит таблица химических элементов Дмитрия Ивановича Менделеева. В 1869 году, в первом ее варианте, она отличалась от ныне существующей. В ней было меньше элементов, так как их было открыто всего 63, а сейчас в таблице содержится 118 элементов. Причем последний из них получил свое название совсем недавно в 2016 году в честь Юрия Цолаковича Оганесяна.
В 1869 году, в первом ее варианте, она отличалась от ныне существующей. В ней было меньше элементов, так как их было открыто всего 63, а сейчас в таблице содержится 118 элементов. Причем последний из них получил свое название совсем недавно в 2016 году в честь Юрия Цолаковича Оганесяна.
Постепенно наука развивалась, и сам Менделеев модернизировал свое творение. Были открыты инертные газы, и таблица пополнилась новыми элементами. Также Дмитрий Иванович поменял расположение элементов в таблице из столбцов в строчки. Да-да, в самом первом варианте химические элементы располагались по столбцам, а не по строчкам, как мы привыкли.
Элементы в таблице располагались в порядке увеличения их массы. Водород – самый легкий, значит, он стоит в начале, за ним идут все остальные более тяжелые элементы. Если взглянуть в старую таблицу и в новую, то можно заметить принципиальное отличие, которым пользуются современные лжеученые. В старой таблице инертные газы стоят в первой колонке (химики называют колонки – группами), а в новой – в последней. Логика была проста: это же газы, значит, они должны быть легче остальных. Вроде бы логично, но нет. По этой логике все элементы в самом начале таблицы должны быть газами, так как они самые легкие. Например, газообразными должны быть как минимум литий, бериллий, бор, углерод. Но это неверно: они твердые при обычных условиях, а вот следующие за ними азот, кислород, фтор и неон – газообразные. Чувствуете, что что-то здесь не так?!
Логика была проста: это же газы, значит, они должны быть легче остальных. Вроде бы логично, но нет. По этой логике все элементы в самом начале таблицы должны быть газами, так как они самые легкие. Например, газообразными должны быть как минимум литий, бериллий, бор, углерод. Но это неверно: они твердые при обычных условиях, а вот следующие за ними азот, кислород, фтор и неон – газообразные. Чувствуете, что что-то здесь не так?!
На самом деле, логика расположения элементов в таблице была не совсем правильной. Но при этом, волею случая, она совпала с современным принципом расположения элементов в таблице. Тем, кто хочет подробно разобраться в данном вопросе, советую открыть YouTube-канал «Химия – Просто» и посмотреть видео «Урок 1» и «Как пользоваться таблицей Менделеева». В них мы досконально разобрали принцип построения таблицы.
Однако вкратце все равно ответим на возникшие вопросы. Раньше элементы в таблице располагались в порядке увеличения их массы. Но тогда не знали, как устроен атом.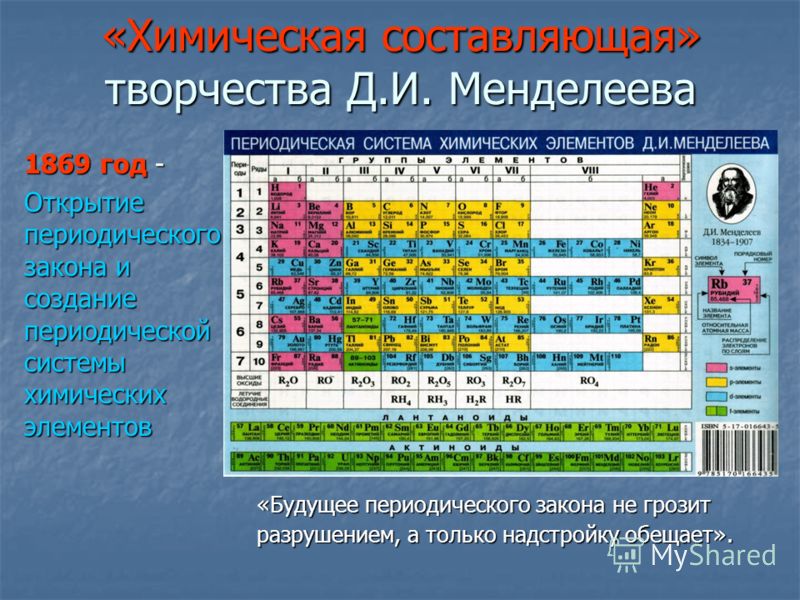 Обратите внимание, что он состоит из ядра и электронов. Ядро в свою очередь состоит из протонов и нейтронов.
Обратите внимание, что он состоит из ядра и электронов. Ядро в свою очередь состоит из протонов и нейтронов.
В современной таблице элементы расположены в порядке увеличения количества протонов в ядре атома. Поясним: в ядре любого атома водорода всегда один протон. В ядре атома гелия всегда два протона. Возьмем любой другой элемент, например полоний, в его ядре 84 протона. Порядковый номер элемента равен количеству протонов в ядре этого элемента. Все просто! Поэтому все инертные газы отправились в последнюю колонку, то есть группу. Так как оказалось, что, например, у аргона в ядре восемнадцать протонов, а у хлора семнадцать протонов, значит, аргон должен находиться в таблице после хлора.
Поздравляю, вы только что прошли полгода школьного курса за 8 класс. Можете собой гордиться!
В следующие полгода школьной химии нам обычно рассказывают, что какие-то там элементы имеют похожие свойства, что еще сам Дмитрий Иванович, зная свойства одних элементов, предсказывал свойства других. Обычно в такие моменты у всех возникает вопрос: «Как он это делал? Он что, экстрасенс?»
Обычно в такие моменты у всех возникает вопрос: «Как он это делал? Он что, экстрасенс?»
На самом деле все просто! Иначе бы не было такого проекта, как «Химия – Просто». Как мы уже сказали выше, в атоме, кроме ядра, еще есть электроны. Их количество равно количеству протонов в ядре и порядковому номеру элемента в таблице. Где же они находятся? На самом деле эти самые электроны до сих пор никто не видел и это плод буйной фантазии ученых. Так существуют ли они на самом деле?! Давайте посмотрим вокруг себя. У нас есть мобильные телефоны, компьютеры, мы ездим на машинах, чистим воду фильтрами, летаем на самолетах, а особо удачливые вообще в космос летают. Для всего это необходимы различные материалы, которые создали химики. Не могли же они так ошибаться и создать столько всего, чем мы каждый день пользуемся и все это работает?! Конечно не могли. Поэтому считается, что электроны вращаются где-то вокруг ядра атома. Конечно, ты сам можешь стать ученым и все перепроверить или посвятить свою жизнь тому, чтобы сделать фотографию электрона. Или наоборот доказать, что все ошибались. Это точно будет величайшим достижением человечества, а ты будешь его автором.
Или наоборот доказать, что все ошибались. Это точно будет величайшим достижением человечества, а ты будешь его автором.
На этом моменте, конечно, нужно упомянуть про теорию вероятности, но мы же не изверги, чтобы напрягать ваш мозг таким материалом. Мы здесь собрались получать удовольствие от изучения науки в легкой форме. Это потом в ВУЗах преподаватели вам будут читать сложные лекции, а мы – не они. Однако отметим, что электрон может находиться где угодно. Он может находиться бесконечно далеко от ядра атома или, наоборот, бесконечно близко к ядру, но вероятность такого нахождения электрона бесконечно мала. То есть электроны находятся на какой-то стационарной «орбите» над ядром, как космические спутники. Можно даже привести в пример Луну. Она же тоже находится на определенном расстоянии от Земли. Не улетает и не падает на Землю. Так и электроны.
Правда говоря, природа сил, которые удерживают Луну и Землю вместе, отличаются от тех, что удерживают электрон рядом с ядром.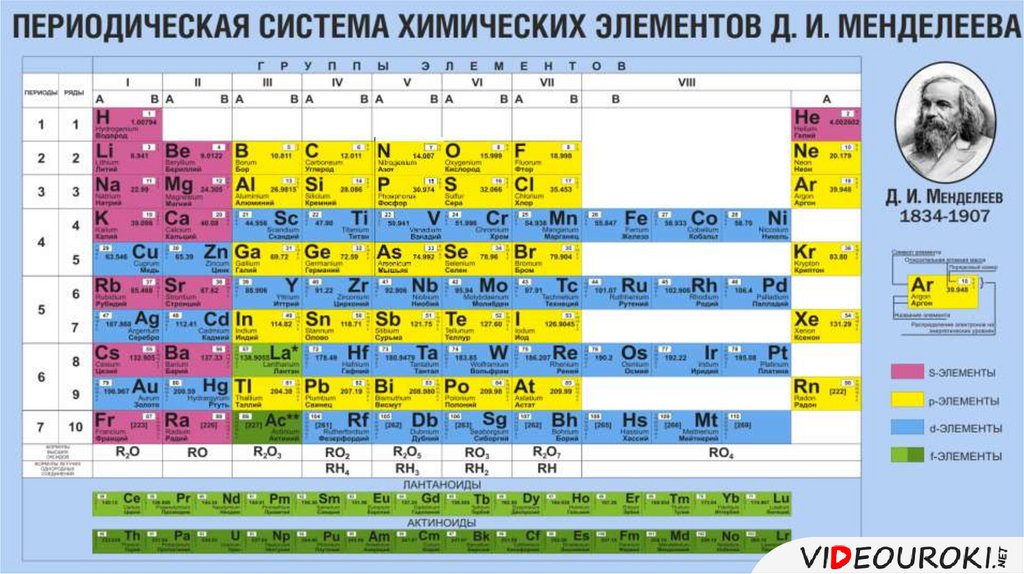 В первом случае мы имеем дело с гравитацией (она создается за счет масс), во втором случае – с притяжением противоположных зарядов (электрон заряжен отрицательно, а протон положительно).
В первом случае мы имеем дело с гравитацией (она создается за счет масс), во втором случае – с притяжением противоположных зарядов (электрон заряжен отрицательно, а протон положительно).
А теперь давайте возьмем какой-нибудь элемент с большим количеством электронов. В таком атоме электронам сложно «летать» на одной и той же «орбите». Поэтому они находятся на разных «орбитах». Только в химии их называют орбитали. И как показывают математические расчеты, формы этих орбиталей разные. Существуют s, p, d, f – орбитали. Только не спрашивайте почему не а, б, в, г, д. Все они имеют разные формы. Опять же, это рассчитали математики. Боюсь, что в школе или в ВУЗе вы часто говорили что-то типа: «эти синусы/косинусы/интегралы/роторы/дивергенции/… мне в жизни не пригодятся», поэтому вы не сможете проверить вычисления этих самых ученых-математиков и придется поверить им на слово.
Электроны располагаются на разных орбиталях. И чем больше электронов, тем больше орбиталей они занимают. Отметим, что через какое-то время, эти орбитали начинают повторяться. Например, первая орбиталь – s. Затем идет вторая орбиталь и она тоже s. Третья орбиталь уже p. Четвертая снова s и так далее. Далее появляются d и f орбитали. Их порядок можно посмотреть в таблице Менделеева. На заметку: на s-орбтитали помещается только 2 электрона, на p-орбитали помещается 6 электронов, на d-орбитали помещается 10 электронов, а на f-орбитали 14 электронов.
Например, первая орбиталь – s. Затем идет вторая орбиталь и она тоже s. Третья орбиталь уже p. Четвертая снова s и так далее. Далее появляются d и f орбитали. Их порядок можно посмотреть в таблице Менделеева. На заметку: на s-орбтитали помещается только 2 электрона, на p-орбитали помещается 6 электронов, на d-орбитали помещается 10 электронов, а на f-орбитали 14 электронов.
Как мы уже отметили, электроны занимают разные орбитали на столько, на сколько их хватает. При этом через какое-то время орбитали повторяются. И если у двух атомов разных элементов их последние орбитали похожи, то есть они одинаковы и имеют одинаковое количество электронов, то и их свойства похожи. Например, возьмем литий, натрий, калий, рубидий, цезий, франций. Как вы видите, все они располагаются друг под другом. При этом их самый последний электрон находится на s-уровне. Причем на этом самом s-уровне находится всего лишь 1 электрон. Свойства этих элементов очень схожи. Их еще называют щелочными металлами.
А теперь самая хорошая новость для лентяев, изучающих химию: все элементы таблицы Менделеева можно разбить на такие группы со схожими свойствами. Поэтому учить или зубрить свойства каждого элемента в отдельности не надо!
В данной книге мы не будем разбирать каждый элемент в отдельности. Мы расскажем про группы элементов со схожими свойствами и про самые интересные элементы в этих группах.
А теперь, когда мы стали гораздо умнее, давайте пользоваться нашими мозгами и получать от этого неимоверное удовольствие! Перелистывай страницу, и начнем погружение в этот дивный мир элементов!
Щелочные металлы
Со школы мы не раз сталкивались с термином «щелочные металлы». Многим понятно только второе слово «металлы». Но что значит «щелочные»? Это какие-то особые металлы? Они обладают какими-то уникальными свойствами? Давайте вместе разбираться.
Обратимся к нашему вечному спутнику и соратнику в изучении химии – Периодической системе химических элементов Д.И. Менделеева. Найдите в ней первую колонку (химики именуют ее группой), в ней располагаются H, Li, Na, K, Rb, Cs, Fr. И здесь незадачливого ученика подстерегает опасность: водород не является металлом, в то время как все остальные элементы составляют группу щелочных металлов.
Менделеева. Найдите в ней первую колонку (химики именуют ее группой), в ней располагаются H, Li, Na, K, Rb, Cs, Fr. И здесь незадачливого ученика подстерегает опасность: водород не является металлом, в то время как все остальные элементы составляют группу щелочных металлов.
Почему же водород не относится к щелочным металлам? Для всех элементов этой группы характерно то, что они с легкостью отдают свой последний (валентный) электрон. А водород не такой. Он отдает его гораздо хуже, то есть с большими затратами энергии. Еще надо постараться, чтобы отобрать у него единственный электрон.
Если мы сравним физические свойства всех элементов из первой группы, то увидим, что водород – газ при нормальных условиях, а все остальные – твердые тела. Кстати, среди химиков до сих пор существует спор о том, к какой группе отнести водород: к I группе или же VII, где расположены фтор, хлор, бром, йод и астат. Но как вы заметили, элемент под номером 1 все-таки гораздо чаще относят к первой группе.
И все же почему эту группу называют щелочными металлами? Дело в том, что при соприкосновении с водой эти металлы образуют щелочи, попутно выделяется водород. Стоит отметить, что эта реакция происходит очень бурно, с образованием большого количества тепла. Небольшие количества лития, натрия и калия горят на поверхности воды, большие же просто взрываются. Любое количество рубидия и цезия ждет такая же участь. Поэтому, если вы вдруг увидите горящий щелочной металл, не тушите его ни в коем случае водой, иначе пламя будет еще ярче. Во времена СССР дети в школах взрывали туалеты, бросая в них металлический калий, правда, для многих это оборачивалось не только срывом контрольной работы, но и тяжелыми химическими ожогами.
Любознательным на заметку:
Энергия, требуемая на отрыв электрона от атома, называется «энергией ионизации».
Я помню, как все начиналось…
Люди знакомы с соединениями этих металлов еще с давних времен, историки находят упоминания соды в трудах Аристотеля и даже в Ветхом завете! Выделить в свободном виде их удалось лишь полторы тысячи лет спустя, когда Гемфри Деви в 1807 году проводил электролиз гидроксидов калия (KOH) и натрия (NaOH) в платиновой чашке. Уже через десять лет, после блестящих опытов Деви, талантливый ученик Берцелиуса – Арфведсон открыл самый легкий металл – литий. Однако чистый литий был выделен Бунзеном и Матиссеном значительно позднее, в 1855 году, во время проведения электролиза расплавленного хлорида лития (LiCl). Спустя еще восемь лет Бунзен выделил свободный рубидий.
Уже через десять лет, после блестящих опытов Деви, талантливый ученик Берцелиуса – Арфведсон открыл самый легкий металл – литий. Однако чистый литий был выделен Бунзеном и Матиссеном значительно позднее, в 1855 году, во время проведения электролиза расплавленного хлорида лития (LiCl). Спустя еще восемь лет Бунзен выделил свободный рубидий.
На этом поиск новых щелочных металлов не закончился, и в 1882 году Саттерберг получил чистый цезий при помощи электролиза его цианида (CsCN). Сам опыт был крайне опасен, так как при его проведении летит очень токсичный газ – дициан (СN)2. Кроме того, от ученого требовалась крайняя аккуратность, ведь цезий является самым активным металлом из известных человечеству, и он моментально реагирует с кислородом воздуха, самовоспламеняясь.
И только лишь в 1939 году удалось открыть элемент, который был предсказан еще Д.И. Менделеевым и назван им эка-цезий. Радиоактивный щелочной металл франций открыла французская ученая Перей, исследуя распад актиния. Так в 1946 году элемент был назван в честь Родины его первооткрывательницы.
Так в 1946 году элемент был назван в честь Родины его первооткрывательницы.
История показывает, что много ученых-химиков на протяжении почти 150 лет работали над получением элементов, входящих в I группу ПСХЭ и названных «щелочными металлами».
ПСХЭ – под этой страшной аббревиатурой прячется название таблицы Менделеева и расшифровывается как Периодическая Система Химических Элементов.
По одному электрону, или Чем они похожи?
Выделив элементы, ученые начинали исследовать их химические свойства. В науке существует два основных метода познания: наблюдение и эксперимент. Проводя эксперименты с щелочными металлами, ученые наблюдали похожие свойства. Например, все они бурно реагируют с водой, при этом выделяется водород.
Химические свойства зависят от большого количества факторов, одним из которых является строение атома. Все щелочные металлы имеют на внешнем энергетическом уровне 1 электрон, занимающий s-орбиталь. Это приводит к тому, что они имеют одинаковую валентность.
Литий. Самый легкий
Литий – это самый легкий металл во Вселенной. При этом литий составляет всего лишь 3,2×10-3 % массы земной коры. Кстати, в металлическом виде в природе он не встречается из-за высокой химической активности, впрочем, как и все щелочные металлы. Важнейшими минералами, в состав которых входит литий, являются сподумен (Li2O×Al2O3×4SiO2) и амблигонит (LiAlPO4F).
Стандарт
(19 оценок)
Александр Иванов
На этой странице вы можете прочитать онлайн книгу «Химические элементы», автора Александр Иванов. Данная книга относится к жанру «Детская познавательная и развивающая литература». Произведение затрагивает такие темы, как «занимательная химия», «развитие кругозора». Книга «Химические элементы» была написана в 2018 и издана в 2018 году. Приятного чтения!
О проекте
Что такое MyBook
Правовая информация
Правообладателям
Документация
Помощь
О подписке
Купить подписку
Бесплатные книги
Подарить подписку
Как оплатить
Ввести подарочный код
Библиотека для компаний
Настройки
Другие проекты
Издать свою книгу
MyBook: Истории
Sn химический элемент как читается.
 Названия химических элементов
Названия химических элементов2.1. Химический язык и его части
Человечество использует много разных языков.
Кроме естественных языков (японского,
английского, русского – всего более 2,5 тысяч),
существуют еще и искусственные языки ,
например, эсперанто. Среди искусственных языков
выделяются языки различных наук . Так, в
химии используется свой, химический язык .
Химический язык – система условных
обозначений и понятий, предназначенная для
краткой, ёмкой и наглядной записи и передачи
химической информации.
Сообщение, написанное на большинстве
естественных языков, делится на предложения,
предложения – на слова, а слова – на буквы. Если
предложения, слова и буквы мы назовем частями
языка, то тогда мы сможем выделить аналогичные
части и в химическом языке (таблица 2).
Таблица 2. Части химического языка
Любым языком овладеть сразу невозможно, это
относится и к химическому языку. Поэтому пока вы
познакомитесь только с основами этого языка:
выучите некоторые ” буквы” , научитесь
понимать смысл ” слов” и” предложений” .
В конце этой главы вы познакомитесь с названиями химических веществ – неотъемлемой частью
химического языка. По мере изучения химии ваше
знание химического языка будет расширяться и
углубляться.
Поэтому пока вы
познакомитесь только с основами этого языка:
выучите некоторые ” буквы” , научитесь
понимать смысл ” слов” и” предложений” .
В конце этой главы вы познакомитесь с названиями химических веществ – неотъемлемой частью
химического языка. По мере изучения химии ваше
знание химического языка будет расширяться и
углубляться.
ХИМИЧЕСКИЙ ЯЗЫК.
1.Какие искусственные языки вы знаете (кроме
названных в тексте учебника)?
2.Чем естественные языки отличаются от
искусственных?
3.Как вы думаете, можно ли при описании химических
явлений обходиться без использования
химического языка? Если нет, то почему? Если да, то
в чем будут заключаться преимущества, а в чем
недостатки такого описания?
2.2. Символы химических элементов
Символ химического элемента обозначает сам
элемент или один атом этого элемента.
Каждый такой символ представляет собой
сокращенное латинское название химического
элемента, состоящее из одной или двух букв
латинского алфавита (латинский алфавит см. в
приложении 1). Символ пишется с прописной буквы.
Символы, а также русские и латинские названия
некоторых элементов, приведены в таблице 3. Там же
даны сведения о происхождении латинских
названий. Общего правила произношения символов
не существует, поэтому в таблице 3 приводится и
” чтение” символа, то есть, как этот символ
читается в химической формуле.
в
приложении 1). Символ пишется с прописной буквы.
Символы, а также русские и латинские названия
некоторых элементов, приведены в таблице 3. Там же
даны сведения о происхождении латинских
названий. Общего правила произношения символов
не существует, поэтому в таблице 3 приводится и
” чтение” символа, то есть, как этот символ
читается в химической формуле.
Заменять символом название элемента в устной
речи нельзя, а в рукописных или печатных текстах
это допускается, но не рекомендуется.В настоящее
время известно 110 химических элементов, у 109 из
них есть названия и символы, утвержденные
Международным союзом теоретической и прикладной
химии (ИЮПАК).
В таблице 3 приведена информация только о 33
элементах. Это те элементы, которые при изучении
химии вам встретятся в первую очередь. Русские
названия (в алфавитном порядке) и символы всех
элементов приведены в приложении 2.
Таблица 3. Названия и символы некоторых химических элементов
Название | ||||
Латинское | Написание | |||
| – | Написание | Происхождение | – | – |
| Азот | N itrogenium | От греч. ” рождающий селитру” ” рождающий селитру” | ” эн” | |
| Алюминий | Al uminium | От лат. ” квасцы” | ” алюминий” | |
| Аргон | Ar gon | От греч. ” недеятельный” | ” аргон” | |
| Барий | Ba rium | От греч. ” тяжелый” | ” барий” | |
| Бор | B orum | От арабск. ” белый минерал” | ” бор” | |
| Бром | Br omum | От греч. ” зловонный” | ” бром” | |
| Водород | H ydrogenium | От греч. ” рождающий воду” ” рождающий воду” | ” аш” | |
| Гелий | He lium | От греч. ” Солнце” | ” гелий” | |
| Железо | Fe rrum | От лат. ” меч” | ” феррум” | |
| Золото | Au rum | От лат. ” горящий” | ” аурум” | |
| Йод | I odum | От греч. ” фиолетовый” | ” йод” | |
| Калий | K alium | От арабск. ” щёлочь” | ” калий” | |
| Кальций | Ca lcium | От лат. ” известняк” ” известняк” | ” кальций” | |
| Кислород | O xygenium | От греч. ” рождающий кислоты” | ” о” | |
| Кремний | Si licium | От лат. ” кремень” | ” силициум” | |
| Криптон | Kr ypton | От греч. ” скрытый” | ” криптон” | |
| Магний | M ag nesium | От назв. полуострова Магнезия | ” магний” | |
| Марганец | M an ganum | От греч.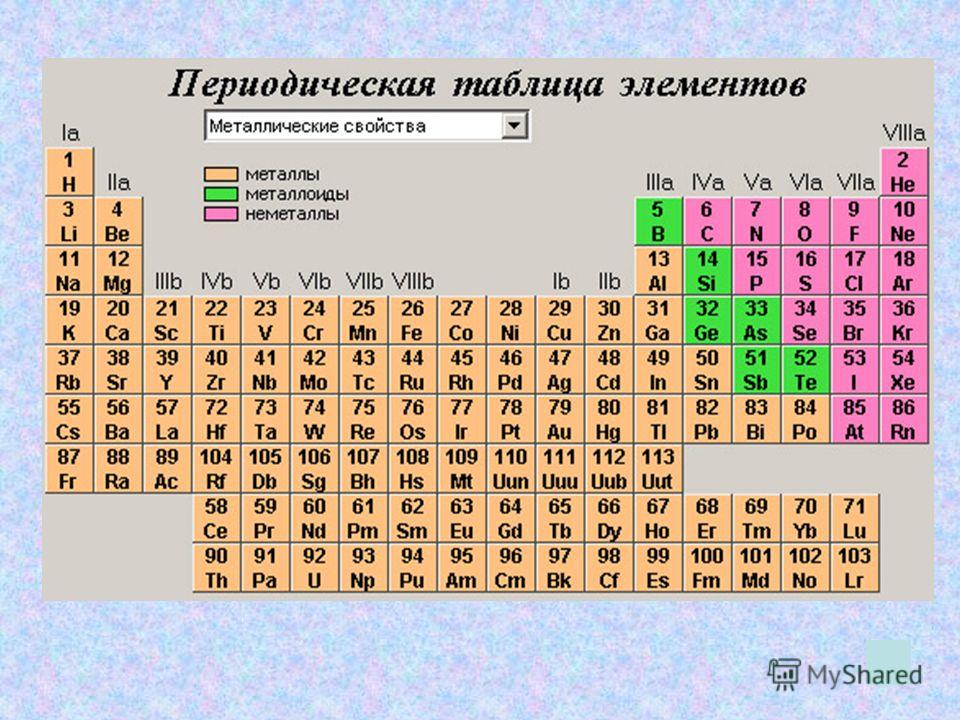 ” очищающий” ” очищающий” | ” марганец” | |
| Медь | Cu prum | От греч. назв. о. Кипр | ” купрум” | |
| Натрий | Na trium | От арабск, ” моющее средство” | ” натрий” | |
| Неон | Ne on | От греч. ” новый” | ” неон” | |
| Никель | Ni ccolum | От нем. ” медь святого Николая” | ” никель” | |
| Ртуть | H ydrarg yrum | Лат. ” жидкое серебро” | ” гидраргирум” | |
| Свинец | P lumb um | От лат. названия сплава свинца с
оловом. названия сплава свинца с
оловом. | ” плюмбум” | |
| Сера | S ulfur | От санскриттского ” горючий порошок” | ” эс” | |
| Серебро | A rg entum | От греч. ” светлый” | ” аргентум” | |
| Углерод | C arboneum | От лат. ” уголь” | ” цэ” | |
| Фосфор | P hosphorus | От греч. ” несущий свет” | ” пэ” | |
| Фтор | F luorum | От лат. глагола ” течь” | ” фтор” | |
| Хлор | Cl orum | От греч. ” зеленоватый” ” зеленоватый” | ” хлор” | |
| Хром | C hr omium | От греч. ” краска” | ” хром” | |
| Цезий | C aes ium | От лат. ” небесно-голубой” | ” цезий” | |
| Цинк | Z in cum | От нем. ” олово” | ” цинк” | |
2.3. Химические формулы
Для обозначения химических веществ используют химические формулы .
Для молекулярных веществ химическая формула
может обозначать и одну молекулу этого вещества.
Информация о веществе может быть разной, поэтому
существуют разные типы химических формул .
В зависимости от полноты информации химические
формулы делятся на четыре основных типа: простейшие , молекулярные , структурные и пространственные .
Подстрочные индексы в простейшейформуле не
имеют общего делителя.
Индекс ” 1″ в формулах не ставится.
Примеры простейших формул: вода – Н 2 О,
кислород – О, сера – S, оксид фосфора – P 2 O 5 ,
бутан – C 2 H 5 , фосфорная кислота – H 3 PO 4 ,
хлорид натрия (поваренная соль) – NaCl.
Простейшая формула воды (Н 2 О) показывает,
что в состав воды входит элемент водород (Н) и
элемент кислород (О), причем в любой порции
(порция – часть чего-либо, что может быть
разделено без утраты своих свойств.) воды число
атомов водорода в два раза больше числа атомов
кислорода.
Число частиц , в том числе и число атомов ,
обозначается латинской буквой N . Обозначив
число атомов водорода – N H , а число
атомов кислорода – N O , мы можем
записать, что
Или N H: N O = 2:
1.
Простейшая формула фосфорной кислоты (Н 3 РО 4) показывает, что в состав фосфорной кислоты входят атомы водорода , атомы фосфора и атомы кислорода , причем отношение чисел атомов этих элементов в любой порции фосфорной кислоты равно 3:1:4, то есть
N H: N P: N O = 3: 1: 4.
Простейшая формула может быть составлена для любого индивидуального химического вещества, а для молекулярного вещества, кроме того, может быть составлена молекулярная формула .
Примеры молекулярных формул: вода – H 2 O, кислород – O 2 , сера – S 8 , оксид фосфора – P 4 O 10 , бутан – C 4 H 10 , фосфорная кислота – H 3 PO 4 .
У немолекулярных веществ молекулярных формул нет.
Последовательность записи символов элементов
в простейших и молекулярных формулах
определяется правилами химического языка, с
которыми вы познакомитесь по мере изучения
химии. На информацию, передаваемую этими
формулами, последовательность символов влияния
не оказывает.
Из знаков, отражающих строение веществ, мы будем использовать пока только валентный штрих (” черточку”). Этот знак показывает наличие между атомами так называемой ковалентной связи (что это за тип связи и каковы его особенности, вы скоро узнаете).
В молекуле воды атом кислорода связан простыми (одинарными) связями с двумя атомами водорода, а атомы водорода между собой не связаны. Именно это наглядно показывает структурная формула воды.
Другой пример: молекула серы S 8 . В этой молекуле 8 атомов серы образуют восьмичленный цикл, в котором каждый атом серы связан с двумя другими атомами простыми связями. Сравните структурную формулу серы с объемной моделью ее молекулы, показанной на рис. 3. Обратите внимание на то, что структурная формула серы не передает форму ее молекулы, а показывает только последовательность соединения атомов ковалентными связями.
Структурная формула фосфорной кислоты
показывает, что в молекуле этого вещества один из
четырех атомов кислорода связан только с атомом
фосфора двойной связью, а атом фосфора, в свою
очередь, связан еще с тремя атомами кислорода
простыми связями. Каждый из этих трех атомов
кислорода, кроме того, связан простой связью с
одним из трех имеющихся в молекуле атомов
водорода./p>
Каждый из этих трех атомов
кислорода, кроме того, связан простой связью с
одним из трех имеющихся в молекуле атомов
водорода./p>
Сравните приведенную ниже объемную модель молекулы метана с его пространственной, структурной и молекулярной формулой:
В пространственной формуле метана клиновидныевалентные штрихи как бы в перспективе показывают, какой из атомов водорода находится ” ближе к нам” , а какой ” дальше от нас” .
Иногда в пространственной формуле указывают длины связей и значения углов между связями в молекуле, как это показано на примере молекулы воды.
Немолекулярные вещества не содержат молекул. Для удобства проведения химических расчетов в немолекулярном веществе выделяют так называемую формульную единицу .
Примеры состава формульных единиц некоторых
веществ: 1) диоксид кремния (кварцевый песок,
кварц) SiO 2 – формульная единица состоит из
одного атома кремния и двух атомов кислорода;
2) хлорид натрия (поваренная соль) NaCl –
формульная единица состоит из одного атома
натрия и одного атома хлора; 3) железо Fe –
формульная единица состоит из одного атома
железа. Как и молекула, формульная единица –
наименьшая порция вещества, сохраняющая его
химические свойства.
Как и молекула, формульная единица –
наименьшая порция вещества, сохраняющая его
химические свойства.
Таблица 4
Информация, передаваемая формулами разных типов
Тип формулы | Информация, передаваемая формулой. | |
| Простейшая Молекулярная Структурная Пространственная |
| |
Рассмотрим теперь на примерах, какую
информацию дают нам формулы разных типов.
1. Вещество: уксусная кислота . Простейшая формула – СН 2 О, молекулярная формула – C 2 H 4 O 2 , структурная формула
Простейшая формула говорит нам, что
1) в состав уксусной кислоты входит углерод,
водород и кислород;
2) в этом веществе число атомов углерода
относится к числу атомов водорода и к числу
атомов кислорода, как 1:2:1, то есть N H: N C:N O = 1:2:1.
Молекулярная формула добавляет, что
3) в молекуле уксусной кислоты – 2 атома углерода,
4 атома водорода и 2 атома кислорода.
Структурная формула добавляет, что
4, 5) в молекуле два атома углерода связаны между
собой простой связью; один из них, кроме этого,
связан с тремя атомами водорода, с каждым простой
связью, а другой – с двумя атомами кислорода, с
одним – двойной связью, а с другим – простой;
последний атом кислорода связан еще простой
связью с четвертым атомом водорода.
2. Вещество: хлорид натрия . Простейшая формула – NaCl.
1) В состав хлорида натрия входит натрий и хлор.
2) В этом веществе число атомов натрия равно числу
атомов хлора.
3. Вещество: железо . Простейшая
формула – Fe.
1) В состав этого вещества входит только железо,
то есть это простое вещество.
4. Вещество: триметафосфорная кислота . Простейшая формула – HPO 3 , молекулярная формула – H 3 P 3 O 9 , структурная формула
1) В состав триметафосфорной кислоты входит
водород, фосфор и кислород.
2) N H: N P:N O = 1:1:3.
3) Молекула состоит из трех атомов водорода, трех
атомов фосфора и девяти атомов кислорода.
4, 5) Три атома фосфора и три атома кислорода,
чередуясь, образуют шестичленный цикл. Все связи
в цикле простые. Каждый атом фосфора, кроме того,
связан еще с двумя атомами кислорода, причем с
одним – двойной связью, а с другим – простой.
Каждый из трех атомов кислорода, связанных
простыми связямис атомами фосфора, связан еще
простой связью с атомом водорода.
| Фосфорная кислота – H 3 PO 4 (другое название – ортофосфорная кислота) – прозрачное бесцветное кристаллическое вещество молекулярного строения, плавящееся при 42 o С. Это вещество очень хорошо растворяется в воде и даже поглощает пары воды из воздуха (гигроскопично). Фосфорную кислоту производят в больших количествах и используют прежде всего в производстве фосфорных удобрений, а также в химической промышленности, при производстве спичек и даже в строительстве. Кроме того, фосфорная кислота применяется при изготовлении цемента в зубоврачебной технике, входит в состав многих лекарственных средств. Эта кислота достаточно дешева, поэтому в некоторых странах, например в США, очень чистая сильно разбавленная водой фосфорная кислота добавляется в освежающие напитки для замены дорогой лимонной кислоты. |
Метан – CH 4 . Если у вас
дома есть газовая плита, то с этим веществом вы
сталкиваетесь ежедневно: природный газ, который
горит в конфорках вашей плиты, на 95 % состоит из
метана. Метан – газ без цвета и запаха с
температурой кипения –161 o С. В смеси с
воздухом он взрывоопасен, этим и объясняются
происходящие иногда в угольных шахтах взрывы и
пожары (другое название метана – рудничный газ).
Третье название метана – болотный газ – связано
с тем, что пузырьки именно этого газа поднимаются
со дна болот, где он образуется в результате
деятельности некоторых бактерий. В
промышленности метан используется как топливо и
сырье для производства других веществ.Метан
является простейшим углеводородом . К этому
классу веществ относятся также этан (C 2 H 6),
пропан (C 3 H 8), этилен (C 2 H 4),
ацетилен (C 2 H 2) и многие другие
вещества. Метан – газ без цвета и запаха с
температурой кипения –161 o С. В смеси с
воздухом он взрывоопасен, этим и объясняются
происходящие иногда в угольных шахтах взрывы и
пожары (другое название метана – рудничный газ).
Третье название метана – болотный газ – связано
с тем, что пузырьки именно этого газа поднимаются
со дна болот, где он образуется в результате
деятельности некоторых бактерий. В
промышленности метан используется как топливо и
сырье для производства других веществ.Метан
является простейшим углеводородом . К этому
классу веществ относятся также этан (C 2 H 6),
пропан (C 3 H 8), этилен (C 2 H 4),
ацетилен (C 2 H 2) и многие другие
вещества. |
Таблица 5 . Примеры формул разных типов для некоторых веществ –
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
Ниже приведем саму таблицу
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс “Таблица Менделеева для чайников”. В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе , который с радостью поделится с вами своими знаниями и опытом.
Инструкция
Периодическая система представляет собой многоэтажный «дом», в котором располагается большое количество квартир. Каждый «жилец» или в своей собственной квартире под определенным номером, который является постоянным. Помимо этого элемент имеет «фамилию» или название, например кислород, бор или азот. Кроме этих данных в каждой «квартире» или указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Кроме этих данных в каждой «квартире» или указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Как в любом доме, здесь имеются «подъезды», а именно группы. Причем в группах элементы располагаются слева и справа, образуя . В зависимости от того, с какой стороны их больше, та называется главной. Другая подгруппа, соответственно, будет побочной. Также в таблице имеются «этажи» или периоды. Причем периоды могут быть как большими (состоят из двух рядов) так и малыми (имеют только один ряд).
По таблице можно показать строение атома элемента, каждый из которых имеет положительно заряженное ядро, состоящее из протонов и нейтронов, а также вращающихся вокруг него отрицательно заряженных электронов. Число протонов и электронов численно совпадает и определяется в таблице по порядковому номеру элемента. Например, химический элемент сера имеет №16, следовательно, будет иметь 16 протонов и 16 электронов.
Чтобы определить количество нейтронов (нейтральных частиц, также расположенных в ядре) вычтите из относительной атомной массы элемента его порядковый номер. Например, железо имеет относительную атомную массу равную 56 и порядковый номер 26. Следовательно, 56 – 26 = 30 протонов у железа.
Например, железо имеет относительную атомную массу равную 56 и порядковый номер 26. Следовательно, 56 – 26 = 30 протонов у железа.
Электроны находятся на разном расстоянии от ядра, образуя электронные уровни. Чтобы определить число электронных (или энергетических) уровней, нужно посмотреть на номер периода, в котором располагается элемент. Например, алюминий находится в 3 периоде, следовательно, у него будет 3 уровня.
По номеру группы (но только для главной подгруппы) можно определить высшую валентность. Например, элементы первой группы главной подгруппы (литий, натрий, калий и т.д.) имеют валентность 1. Соответственно, элементы второй группы (бериллий, магний, кальций и т.д.) будут иметь валентность равную 2.
Также по таблице можно проанализировать свойства элементов. Слева направо металлические свойства ослабевают, а неметаллические усиливаются. Это хорошо видно на примере 2 периода: начинается щелочным металлом натрием, затем щелочноземельный металл магний, после него амфотерный элемент алюминий, затем неметаллы кремний, фосфор, сера и заканчивается период газообразными веществами – хлором и аргоном. В следующем периоде наблюдается аналогичная зависимость.
В следующем периоде наблюдается аналогичная зависимость.
Сверху вниз также наблюдается закономерность – металлические свойства усиливаются, а неметаллические ослабевают. То есть, например, цезий гораздо активнее по сравнению с натрием.
Все названия химических элементов происходят из латинского языка. Это необходимо в первую очередь для того, чтобы ученые разных стран могли понимать друг друга.
Химические знаки элементов
Элементы принято обозначать химическими знаками (символами). По предложению шведского химика Берцелиуса (1813 г.) химические элементы обозначают начальной или начальной и одной из последующих букв латинского названия данного элемента; первая буква всегда прописная, вторая строчная. Например, водород (Hydrogenium) обозначается буквой H, кислород (Oxygenium) – буквой O, сера (Sulfur) – буквой S; ртуть (Hydrargyrum) – буквами Hg, алюминий (Aluminium) – Al, железо (Ferrum) – Fe и т. д.
Рис. 1. Таблица химических элементов с названиями на латинском и русском языке.
Русские названия химических элементов зачастую представляют собой латинские названия с видоизмененными окончаниями. Но также существует множество элементов, произношение которых отличается от латинского первоисточника. Это либо коренные русские слова (например, железо), либо слова, которые являются переводом (пример – кислород).
Химическая номенклатура
Химическая номенклатура – правильное наименование химических веществ. Латинское слово nomenclatura переводится как «перечень имен, названий»
На ранней стадии развития химии веществам давались произвольные, случайные наименования (тривиальные названия). Легколетучие жидкости назывались спиртами, к ним относились «соляной спирт» – водный раствор соляной кислоты, «силитряный спирт» – азотная кислота, «нашатырный спирт» – водный раствор аммиака. Маслообразные жидкости и твердые вещества назывались маслами, например, концентрированная серная кислота носила название «купоросное масло», хлорид мышьяка – «мышьяковое масло».
Иногда вещества получали название по имени его первооткрывателя, например, «глауберова соль» Na 2 SO 4 *10H 2 O, открытая немецким химиком И. Р. Глаубером в XVII веке.
Рис. 2. Портрет И. Р. Глаубер.
В старинных названиях могли указываться вкус веществ, цвет, запах, внешний вид, медицинское действие. Одно вещество иногда имело несколько наименований.
К концу XVIII века химикам было известно не более 150-200 соединений.
Первую систему научных названий в химии выработала в 1787 г. комиссия химиков во главе с А. Лавуазье. Химическая номенклатура Лавуазье послужила основой для создания национальных химических номенклатур. Для того, чтобы химики разных стран понимали друг друга, номенклатура должна быть единой. В настоящее время построение химических формул и названий неорганических веществ подчиняется системе номенклатурных правил, созданной комиссией Международного союза теоретической и прикладной химии (ИЮПАК). Каждое вещество изображается формулой, в соответствии с ней строится систематическое название соединения.
Рис. 3. А. Лавуазье.
Что мы узнали?
Все химические элементы имеют латинские корни. Латинские названия химических элементов являются общепринятыми. В русский язык они переносятся с помощью калькирования или перевода. однако некоторые слова имеют изначально русское значение, например, медь или железо. Химической номенклатуре подчиняются все химические вещества, состоящие из атомов и молекул. впервые система научных названий была разработана А. Лавуазье.
Тест по теме
Оценка доклада
Средняя оценка: 4.2 . Всего получено оценок: 768.
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. И наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Шаги
Часть 1
Структура таблицы
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2.
 Однако они расположены на противоположных краях, так как принадлежат к разным группам.
Однако они расположены на противоположных краях, так как принадлежат к разным группам.
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2.
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
Узнайте, почему в таблице присутствуют пустые ячейки.
 Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 102 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода – 7 орбиталей.

- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода – 7 орбиталей.
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.
Часть 2
Обозначения элементовКаждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.

- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.
- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента.
 Элементы имеют атомные номера от 1 до 118.
Элементы имеют атомные номера от 1 до 118.- Атомный номер всегда является целым числом.
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны – отрицательный заряд. Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс».
 Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус». - Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс».
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Читать книгу Химия. Периодическая система химических элементов Д.И. Менделеева и строение атомов Антонины Гуровой : онлайн чтение
2.4. Электронные орбитали
В зависимости от запаса энергии электрона каждый энергетический уровень делится на подуровни – место наиболее вероятного нахождения электрона.
Часть околоядерного пространства, в которой вероятность нахождения электрона достаточно велика, называется электронной орбиталью.
Различают 4 вида электронных орбиталей: s, p, d, f. Они отличаются формой и энергией: s-орбиталь имеет форму сферы и не имеет направления в пространстве, максимально на этой орбитали может находится два электрона;
p-орбитали имеют форму симметричной восьмерки и три направления в пространстве во взаимно перпендикулярных плоскостях (х, у, z). Различают рх-, ру-, рz-орбитали. Максимально на них может располагаться 6 электронов – по два на каждой;
Различают рх-, ру-, рz-орбитали. Максимально на них может располагаться 6 электронов – по два на каждой;
d-орбитали имеют 5 направлений в пространстве, и максимально на них может располагаться 10 электронов;
f-орбитали имеют 7 направлений в пространстве, и максимально на них может располагаться 14 электронов.
Графически положение орбиталей в пространстве с учетом их количества можно изобразить следующим образом:
s-подуровень содержит одну электронную орбиталь
p-подуровень содержит три электронные орбитали
d-подуровень содержит пять электронных орбиталей
f-подуровень содержит семь электронных орбиталей
С увеличением энергии электрона и номера энергетического уровня размер электронного облака увеличивается.
Электроны заполняют орбитали энергетического уровня строго последовательно. Каждая следующая орбиталь заполняется электронами после полного завершения предыдущей орбитали.
Число орбиталей на каждом уровне совпадает с номером энергетического уровня.
1-й энергетический уровень – s-орбиталь,
2-й энергетический уровень – s-,р-орбитали,
3-й энергетический уровень – s-,р-,d-орбитали,
4-й энергетический уровень – s-,р-,d-, f-орбитали.
2.5. Электронные и электронно-графические формулы строения атома
Чтобы правильно изображать электронные конфигурации различных атомов, нужно знать:
1) число электронов в атоме (равно порядковому (атомному)) номеру элемента;
2) максимальное число электронов на энергетических уровнях, подуровнях;
3) порядок заполнения энергетических уровней и подуровней (орбиталей).
Задания
2.5.1 II. Запишите строение атома и составьте электронную формулу, электронно-графическую формулу элемента № 17.
Ответ. Элемент № 17 – хлор, заряд ядра атома +17, электронов в атоме 17. Элемент находится в 3-м большом периоде, следовательно, в атоме три энергетических уровня, в УПА группе, следовательно, семь электронов на внешнем энергетическом уровне.
2.5.2. Установите соответствие между элементом и его электронной формулой.
Определите принадлежность каждого элемента к группе металлов, неметаллов, благородных газов.
См. образец ответа к заданию 2.3.4.
2.5.3. По порядковому номеру следующих элементов определите количество электронов на внешнем энергетическом уровне их атомов: а) № 14; б) № 8; в) № 4; г) № 9; д) № 13.
2.5.4. По электронной формуле определите элемент 4-го периода, IА группы:
а) 1s22s22р63s1;
б) 1s22s22р63s23р64s2;
в) 1s22s22р63s23р2;
г) 1s22s22р63s23р64s1.
2.5.5. В химии используют запись в виде сокращенных электронных формул, в которых указываются только незавершенные энергетические уровни. Укажите элементы по сокращенным электронным формулам:
См.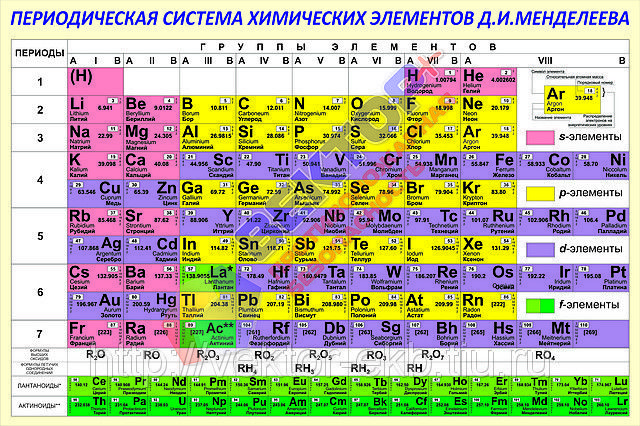 образец ответа к заданию 2.3.4 (II способ).
образец ответа к заданию 2.3.4 (II способ).
2.6. Квантовые числа
Состояние электрона в атоме определяется четырьмя квантовыми числами. Квантовые числа – это энергетическая характеристика электрона.
Главное квантовое число n численно совпадает с номером энергетического уровня. Это основная, но не единственная характеристика электрона.
Чем дальше расположен электрон от ядра, тем больше его главное квантовое число и больше запас энергии.
Максимальное число электронов, находящихся на энергетически устойчивом, заполненном уровне, равно 2n2.
Побочное квантовое число l – принимает значения от 0 до n – 1 и характеризует форму электронной орбитали (s, p, d, f).
Число значений l для каждого энергетического уровня численно равно главному квантовому числу этого энергетического уровня.
Энергия состояния электрона в атоме определяется суммой главного и побочного квантовых чисел (n + l). По этой формуле можно точно определить порядок распределения электронов в атоме. Первыми заполняются те энергетические уровни, которые имеют наименьшее значение главного квантового числа.
Первыми заполняются те энергетические уровни, которые имеют наименьшее значение главного квантового числа.
При равных суммах n + l первыми заполняются те орбитали, у которых значение главного квантового числа меньше.
Так как n = 3 меньше, чем n = 4, то электроны заполняют сначала 3р-орбиталь.
Магнитное квантовое число m – принимает целые значения от – l через 0 до +1 и определяет направление электронных орбита-лей в пространстве.
Графически орбиталь изображается в виде клетки (квантовой ячейки):
Спиновое квантовое число ms– характеризует два возможных направления вращения (спин) электронов вокруг собственной оси.
Оно имеет два значения: +½ и – ½. Электрон со спином +½ изображают ↑, а со спином – ½ ↓.
На одной орбитали может быть не более двух электронов с противоположными спинами ↑↓.
Принципы заполнения электронных орбиталей
1. Принцип наименьшей энергии (правило Клечковского) n + l.
Подуровни заполняются в порядке последовательного увеличения суммы n + l, а при одинаковых значениях этой суммы – в порядке увеличения значения n (рис. 6).
2. Принцип Паули.
В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковые.
При одинаковом наборе трех квантовых чисел спиновое квантовое число обязательно будет различным (+½, -½).
3. Правило Хунда.
Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально.
При заполнении подуровня, имеющего свободные орбитали, на каждой орбитали располагается по одному электрону с положительным спином. Затем происходит последовательное дозаполнение этих же орбиталей электронами с отрицательным спином.
Рис. 6. Порядок заполнения электронных орбиталей на энергетических уровнях и подуровнях
Все элементы разделяются на 4 электронных семейства: в-элементы, р-элементы, d-элементы, f-элементы, в зависимости от того, какой подуровень заполняется последним.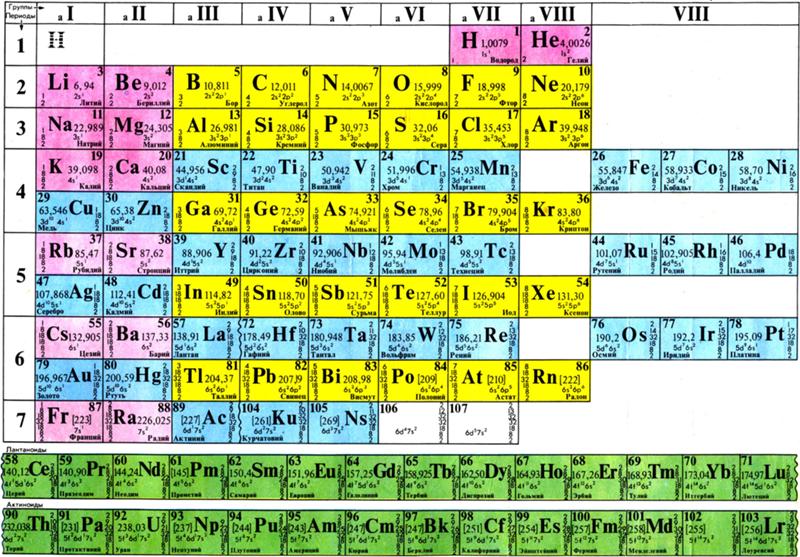
Рассмотрим заполнение энергетических орбиталей в атомах элементов главных и побочных подгрупп.
В атоме кальция последним заполняется s-подуровень внешнего энергетического уровня, поэтому кальций относится к s-элемен-там.
Элементы, в атомах которых заполняется последним в-подуровень внешнего энергетического уровня, называются в-эле-ментами.
В атоме кремния последним заполняется р-подуровень внешнего энергетического уровня, поэтому кремний относится к р-элементам.
Элементы, в атомах которых заполняется последним р-подуровень внешнего энергетического уровня называются р-эле-ментами.
В главных (А) подгруппах Периодической системы химических элементов Д.И. Менделеева находятся s– и р-элементы.
У скандия заполняется последним пред-внешний d-подуровень, поэтому скандий является d-элементом.
У d-элементов последним заполняется d-подуровень предвнешнего энергетического уровня.
У церия заполняется последним предпредвнешний f-подуровень, поэтому церий является f-элементом.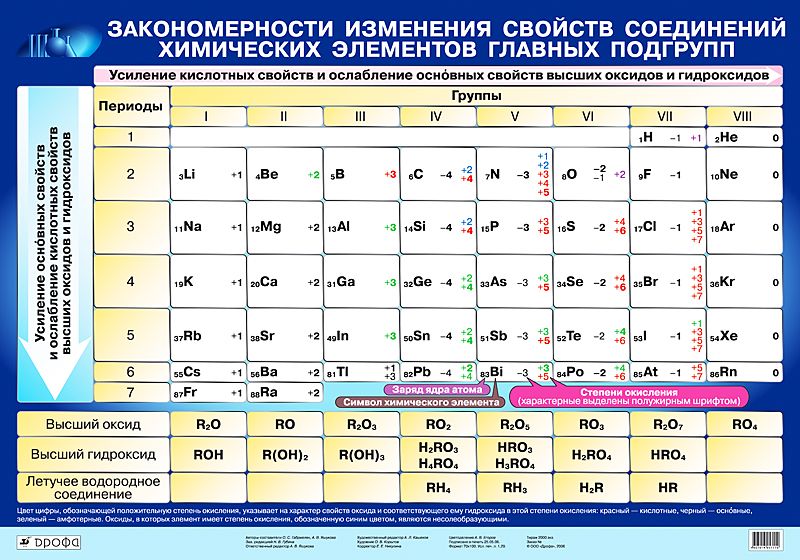
У f-элементов последним заполняется третий снаружи энергетический уровень – f-подуровень.
В побочных (В) подгруппах Периодической системы химических элементов Д.И. Менделеева находятся d– и f-элементы.
Чтобы избежать записи длинных электронных формул, используют их сокращенный вариант. В сокращенной электронной формуле в квадратных скобках записывают знак ближайшего химического элемента – благородного газа, у которого энергетические уровни полностью завершены.
20Са 1s2 2s22р6 3s23р64s2 [Ar] 4s2
14Si 1s2 2s22р6 3s23р2 [Ne] 3s23р2
21Sc 1s2 2s22р63s23р64s23d1 [Ar] 3s23р2
58Се 1s2 2s22р63s23р64s23d104р65s24d105р6 6s24f2 [Xe] 6s24f2
На внешнем энергетическом уровне для элементов А-подгрупп и предвнешнем и предпред-внешнем энергетических уровнях для элементов В-подгрупп находятся электроны, которые называются валентными. Сумма этих электронов равна номеру группы. В побочных (В) подгруппах у некоторых d-элементов наблюдается «провал» электрона. Для более устойчивого состояния атома электрон с внешнего в-подуровня переходит на d-орбиталь предвнешнего энергетического уровня, что объясняется наиболее устойчивым состоянием электронных форм d5и d10. «Провал» электрона наблюдается, например, в атомах хрома, меди.
Сумма этих электронов равна номеру группы. В побочных (В) подгруппах у некоторых d-элементов наблюдается «провал» электрона. Для более устойчивого состояния атома электрон с внешнего в-подуровня переходит на d-орбиталь предвнешнего энергетического уровня, что объясняется наиболее устойчивым состоянием электронных форм d5и d10. «Провал» электрона наблюдается, например, в атомах хрома, меди.
Таблица. Масимальное оличество элетронов на энергетичесих уровнях и подуровнях
Задания
2.6.1 II. Записать электронные орбитали в порядке возрастания энергии: 4d 5s 5р.
Ответ. Запас энергии электронов на орбиталях рассчитывается по принципу наименьшей энергии (правило Клечковского) n + l.
2.6.2. Какой из подуровней заполняется электронами раньше:
Зd или 4s; 4р, 4f или 5s. Запишите их в порядке возрастания энергии?
2.6.3 II. Какой завершенный энергетический уровень характеризуют электронные формулы:
а) ns2;
б) ns2np6nd10nf14;
в) ns2np6.
Ответ. Максимальное количество электронов на энергетическом уровне рассчитывают по формуле 2n2. В примере а) максимальное количество электронов на энергетическом уровне 2, следовательно, 2n2 = 2, откуда n = 1.
2.6.4 II. Напишите электронные формулы элементов, атомы которых содержат:
а) на 3d-подуровне три электрона;
б) на 4р-подуровне один электрон;
в) на 2р-подуровне три электрона;
г) на 3d-подуровне пять электронов.
Так как последним завершается d-подуровень, это d-элемент. Он находится в побочной (В) подгруппе. У элементов побочных подгрупп валентные электроны располагаются на в-орбитали внешнего энергетического уровня и на d-орбитали предвнешнего энергетического уровня. Следовательно, валентные электроны 4s23d3, их сумма равна 5. Это элемент VB группы, побочной подгруппы, 4-го периода, т. к. 4 энергетических уровня. Это – ванадий V,элемент № 23.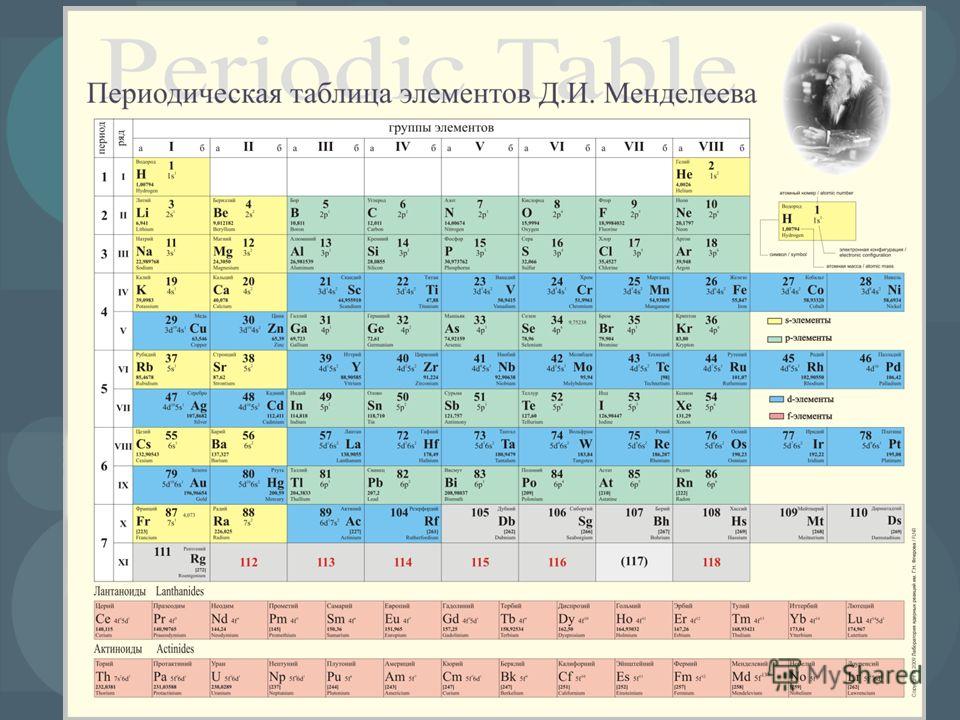
2.6.5. Напишите электронные формулы атомов серы, магний, цинка, меди. Укажите, к каким семействам относятся данные элементы.
2.7. Ионы
Атомы химических элементов являются электронейтральными частицами. В атомах металлов и неметаллов внешний энергетический уровень не завершен. Электроны внешнего энергетического уровня, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав внешнего энергетического уровня последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженными положительно, т. к. количество протонов в ядре атома превышает количество оставшихся отрицательно заряженных электронов. Атомы, присоединившие к себе лишние электроны, заряжаются отрицательно. Образующиеся заряженные частицы называются ионами. Заряд иона численно совпадает с количеством отданных или принятых электронов.
Электронные формулы
Электронно-графические формулы
Следует знать, что одинаковую электронную формулу могут иметь и атомы, и ионы.
Например: электронная формула [Ne]3s23р6 соответствует строению атома аргона Аr0, отрицательным ионам С1–, s2-, положительным ионам К+, Са2+.
Потеря атомом электронов приводит к уменьшению его размеров, а присоединение избыточных электронов – к увеличению. Радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома.
Задания
2.7.1 II. В ядре 7 протонов и 7 нейтронов. Вокруг ядра движутся 6 электронов. Как называется эта частица?
Ответ. Протонов р+ = 7, электронов е– = 6, эначит положительно заряженный ион (катион). Число протонов соответствует порядковому (атомному) номеру элемента в Периодической системе химических элементов Д.И. Менделеева. Следовательно, это ион N+.
2.7.2. В ядре частицы 8 протонов.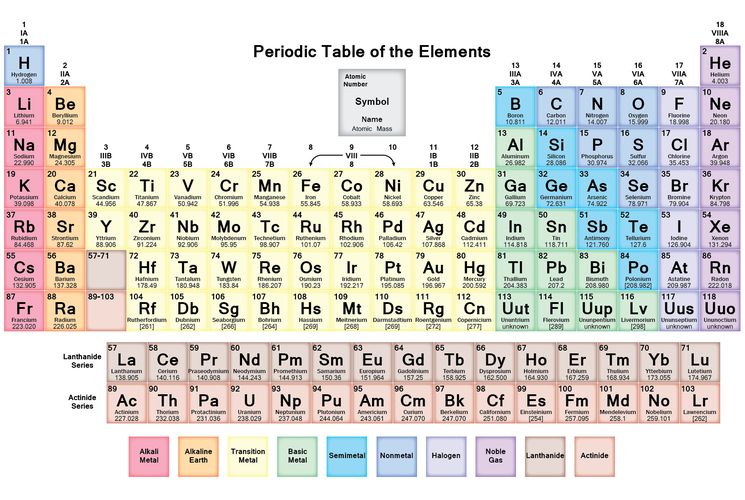 Вокруг ядра вращаются 10 электронов. Как называется такая частица?
Вокруг ядра вращаются 10 электронов. Как называется такая частица?
2.7.3 II. Чем отличается строение атома аллюминия Al3+?
Ответ.
Ион А13+ не имеет электронов на третьем энергетическом уровне.
2.7.4. Чем отличается строение атома серы от строения иона серы S2-?
2.7.5. Напишите электронные формулы для ионов N3-, Zn2+. Атомам каких химических элементов соответствуют эти формулы?
3. Периодический закон. Периодическая система химических элементов Д.И. Менделеева в свете строения атома
После отрытия строения атома стало возможным дать более точную современную формулирову Периодического закона: свойства химических элементов и образованных им и соединений находятся в периодической зависимости от заряда ядра их атомов.
В Периодической системе химических элементов Д. И. Менделеева, графическом изображении Периодического закона, каждое обозначение: порядковый (атомный) номер элемента, номер периода, номер группы связано со строением атома.
Для элементов неметаллов по номеру группы можно определить низшую степень окисления и количество непарных электронов на внешнем энергетическом уровне атома. Для этого из номера группы, в которой находится элемент, надо вычесть максимальный номер группы 8.
Причина изменения свойств также объясняется строением атомов химических элементов.
Каждый период начинается элементом щелочным металлом (исключение – первый период), в атомах которых на внешнем энергетическом уровне имеются один я-электрон. Общая электронная формула строения внешнего энергетического уровня щелочных металлов ns10,где n – номер периода.
Каждый период заканчивается элементом благородным газом. В атомах элементов благородных газов на внешнем энергетическом уровне имеются два я– и шесть р-электронов. Общая электронная формула строения внешнего энергетического уровня благородных газов ms2np6, где n – номер периода (исключение: гелий Не – ns2).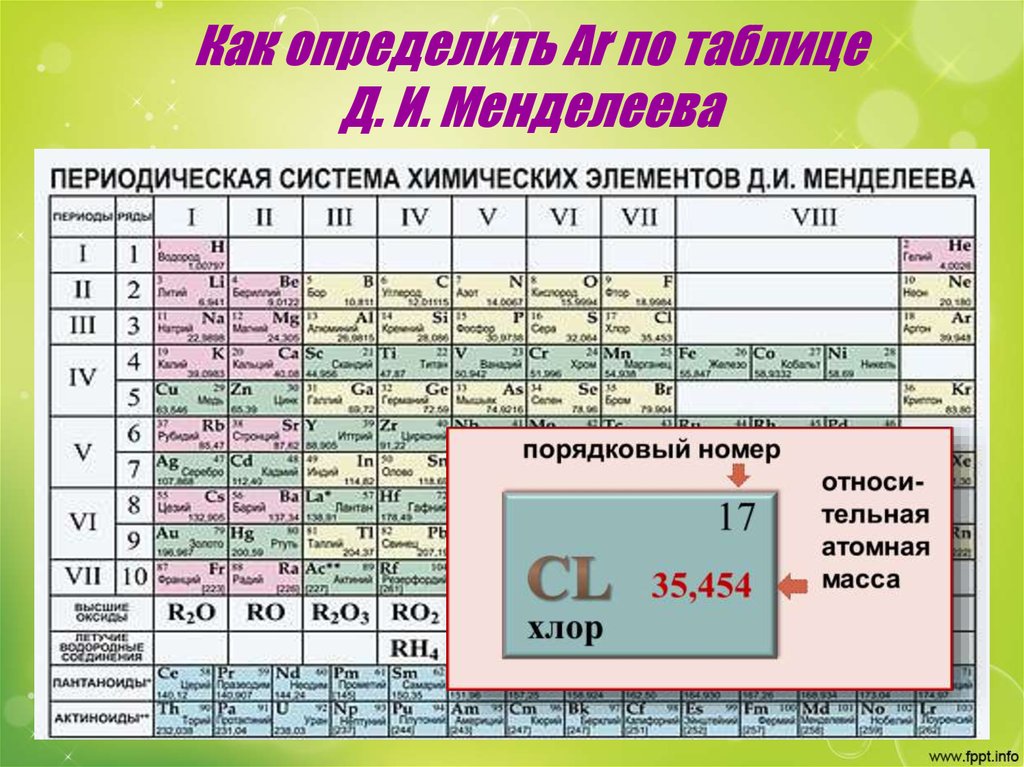
Период – это горизонтальная последовательность элементов по возрастанию порядкового (атомного) номера элемента, атомы которых имеют одинаковое число энергетических уровней, численно равное номеру периода.
В периодах металлические свойства уменьшаются, а неметаллические свойства увеличиваются. В больших периодах изменения свойств происходят медленнее, что объясняется появлением десяти d-элементов (4-й, 5-й периоды) и четырнадцати f-элементов (6-й, 7-й периоды).
По группам (в главных подгруппах) металлические свойства увеличиваются, а неметаллические уменьшаются.
Группа – это вертикальная последовательность элементов по возрастанию порядкового (атомного) номера, обладающая схожими свойствами.
Главная подгруппа – это вертикальная последовательность в– и р-элементов с одинаковым числом электронов на внешнем энергетическом уровне, равным номеру группы.
Побочная подгруппа – это вертикальная последовательность d– и f-элементов, которые имеют одинаковое суммарное количество валентных электронов.
Следовательно, возможна третья формулировка Периодического закона, которая отражает причину периодического изменения свойств.
Свойства химических элементов и образованных ими соединений находятся в периодической зависимости от строения внешних энергетических уровней атомов.
Изменение свойств элементов по диагонали
Под диагональной периодичностью понимают повторяемость сходства химических свойств простых веществ и соединений элементов, расположенных по диагонали друг от друга. Диагональ из левого верхнего угла к нижнему правому объединяет отчасти сходные элементы. Это объясняется приблизительно одинаковым увеличением неметаллических свойств в периодах и металлических свойств в группах.
Литий Li и его соединения больше похожи на магний Mg и его соединения. Бор В больше напоминает кремний Si, чем алюминий Аl.
Если провести диагональ от бериллия 4Ве до астата 85Аt, то она условно разделит элементы на металлы и неметаллы. Вдоль этой диагонали будут расположены переходные элементы, соединения которых обладают ам-фотерными (двойственными) свойствами.
Вдоль этой диагонали будут расположены переходные элементы, соединения которых обладают ам-фотерными (двойственными) свойствами.
«Звездная периодичность» химических элементов
Под «звездной периодичностью» подразумевают изменение свойств элементов с учетом горизонтальной, вертикальной и диагональной периодичности.
«Звездная периодичность» наблюдается как у элементов главных, так и побочных подгрупп.
Рис. 8. «Звездность» Периодической системы
Свойства центрального элемента являются средними из свойств элементов, окружающих его.
Обобщение всех видов периодичности изменений свойств элементов позволяет предсказывать и открывать новые химические элементы.
Задания
3.1 II. Укажите, к какому электронному семейству относятся следующие элементы:
а) 56Ва б) 41Nb, в) 53I, г) 26Ре.
Ответ.
3.2 II. По электронной формуле внешнего энергетического уровня:
а) 4s24р6, б) 5s25р3, в) 6s26р2, г) 3s2,д) 3d64s2 – определите, какой это элемент. Укажите, к какому электронному семейству они относятся.
Укажите, к какому электронному семейству они относятся.
Ответ: а) 4s24р6 – это элемент 4-го большого периода, т. к. в атоме четыре энергетических уровня; VIII группы, т. к. сумма валентных электронов равна 8; главной (А) подгруппы, т. к. это р-элемент (последней электронами заполняется р-орбиталь). Следовательно, это криптон Кr.
3.3 II. По положению элемента в Периодической системе определите, какой элемент имеет больший радиус атома и большую электроотрицательность: а) 32Gе и 35Вr; б) 17Сl и 35Вr; в) 12Mg и 56Ва; г) 80Hg и 85At. Ответ поясните.
Ответ. Радиус атома по периоду уменьшается, а по группе возрастает.
(Ассоциация: «Снежная баба, смотрящая вдаль»)
Электроотрицательность (Э.О.), наоборот, по периоду возрастает, по группе уменьшается.
а) 32Gе и 35Вг – это элементы одного периода, следовательно, радиус атома германия Gе больше радиуса атома брома Вг, а электроотрицательность Gе меньше электроотрицательности брома Вг.
Rа(Gе) > Rа(Вr), Э.О.(Gе) < Э.О.(Bг).
3.4 II. 33Аs и 35Вг являются неметаллами. Какие свойства проявляет селен 34Sе?
Ответ. 33Аs, 34Sе, 35Вг.
Элемент селен находится между элементами мышьяком и бромом в одном периоде. Следовательно, он будет проявлять свойства средние между свойствами своих соседей (горизонтальное сходство). 33Аs – неметалл, 35Вг – очень активный неметалл, 34Sе – неметалл со средней химической активностью.
3.5 II. Сколько валентных электронов в атомах следующих элементов: а) 4Ве; б) 25Мn; в) 50Sn?
Ответ. а) 4Ве – элемент № 4, находится во 2-м малом периоде, во II группе, главной (А) подгруппе. Следовательно, он имеет на внешнем энергетическом уровне атома два валентных электрона (…2в2).
4. Изменения свойств простых веществ и соединений элементов в периодах и подгруппах
Малые периоды (второй, третий) Периодической системы химических элементов Д. И. Менделеева являются типичными, так как в них элементы расположены в один ряд и четко прослеживается изменение свойств элементов и их соединений от неметаллических к металлическим; хорошо видна причинно-следственная связь между строением атома и свойствами.
И. Менделеева являются типичными, так как в них элементы расположены в один ряд и четко прослеживается изменение свойств элементов и их соединений от неметаллических к металлическим; хорошо видна причинно-следственная связь между строением атома и свойствами.
Первый период тоже считается малым, но в нем только два элемента, поэтому к типичным его не относят.
Характеристики и свойства атомов химических элементов, простых веществ и соединений элементов определяются: зарядом ядра, радиусом, числом электронов на внешнем энергетическом уровне атома.
Рассмотрим элементы третьего периода.
Большие периоды
В четных рядах больших периодов ослабление металлических свойств происходит медленнее, что объясняется присутствием d-элементов (в 4-м, 5-м периоде) и f-элементов (в 6-м, 7-м периодах), имеющих схожее строение. Сжатие их электронного облака происходит в меньшей степени, т. к. структура внешнего энергетического уровня остается неизменной. Это незначительно влияет на уменьшение радиуса атомов и всех других свойств этих элементов и их соединений.
В нечетных рядах больших периодов свойства элементов и их соединений изменяются аналогично изменению свойств элементов малых периодов.
Главные (А) подгруппы
В IА, IIА, IIIА (кроме бора 5В) группах Периодической системы химических элементов Д.И. Менделеева находятся элементы металлы, активность которых усиливается с увеличением порядкового (атомного) номера элемента.
Таблица. Элементы IА группы
Элементы VIIА группы
Особое двойственное положение в Периодической системе химических элементов Д.И. Менделеева занимает элемент 1Н. Это объясняется электронным строением его атома – 1s1.До завершения энергетического уровня атому водорода не хватает одного электрона, который он может принимать, проявляя окислительные свойства. В этом его сходство с элементами VII(А) группы.
Атом водорода может и отдать один электрон, проявляя при этом восстановительные свойства. В этом его сходство с элементами
I(А) группы – щелочными металлами.
Побочные (В) подгруппы
Атомы элементов побочных подгрупп в большинстве имеют на внешнем энергетическом уровне два s-электрона. Они отличаются по занятости внутренних d– и (или) f-орбиталей. Сходство между элементами главных и побочных подгрупп одной группы сильно увеличивается от первой группы к четвертой, потом быстро уменьшается от четвертой группы к седьмой. Химические свойства элементов побочных подгрупп меняются значительно меньше, чем в главных подгруппах. В различных соединениях элементы побочных подгрупп часто имеют разные степени окисления. В отличие от соединений элементов главных подгрупп внутри побочной подгруппы стабильность соединений элементов в высшей степени окисления увеличивается. Оксиды элементов побочных подгрупп в низшей положительной степени окисления проявляют основные свойства, в промежуточной – амфотерные, в высшей положительной степени окисления – кислотные свойства.
Например: элемент VIВ группы хром 24Сг образует следующие оксиды:
Периодическая повторяемость свойств элементов связана с повторяемостью числа электронов на внешнем энергетическом уровне, где располагаются электроны, участвующие в химических превращениях, поэтому многие элементы со сходными свойствами имеют исторически сложившиеся групповые названия.
Рассмотрев изменения свойств простых веществ и их соединений по периодам и группам, можно сделать вывод: свойства простого вещества и соединений химического элемента являются промежуточными между двумя соседними с ним элементами по периоду и подгруппе.
Физический смысл Периодического закона стал понятен после создания теории строения атома. Но сама эта теория развивалась на основе Периодического закона и Периодической системы Д. И. Менделеева. Периодический закон – один из основных законов природы и важнейший закон химии.
Задания
4.1 II. Какой из двух элементов обладает более выраженными неметаллическими свойствами: а) Р или Si, б) Сl или I, в) Аs или Sе?
Ответ. В Периодической системе химических элементов Д.И. Менделеева неметаллические свойства по периоду усиливаются, по группе ослабевают. С точки зрения строения атома на внешнем энергетическом уровне атомов неметаллов находятся от четырех до семи электронов, следовательно, чем больше электронов на внешнем энергетическом уровне, тем активнее неметалл.
а) P или Si – фосфор № 15 и кремний № 14 элементы одного периода. В Периодической системе химических элементов Д.И. Менделеева по периоду сначала стоит кремний, а затем фосфор. Кремний – элемент IVA группы, следовательно, в его атоме 4 электрона на внешнем энергетическом уровне. У фосфора 5 электронов на внешнем энергетическом уровне, т. к. это элемент VA группы. Вывод: фосфор обладает более ярко выраженными неметаллическими свойствами.
4.2. Какой из элементов 4-го периода обладает наиболее ярко выраженными металлическими свойствами: цинк, медь, хром, калий? Ответ объясните.
4.3 II. Как изменяется характер оксидов в ряду Li2O, ВеО, В2О3, CO2, N2O5?
Ответ. Данные оксиды образованы элементами 2-го малого периода. Свойства элементов по периоду с увеличением порядкового (атомного) номера изменяются от металлических через переходные элементы к неметаллическим. Переходным элементом в данном периоде является бериллий Ве, следовательно…
4. 4. Выберите элемент: селен, барий, алюминий, оксид которого проявляет: а) основные свойства; б) кислотные свойства.
4. Выберите элемент: селен, барий, алюминий, оксид которого проявляет: а) основные свойства; б) кислотные свойства.
4.5. Выберите формулу амфотерного оксида: Сl207, Р205, Аl203, SОд, MgО.
4.6. Как изменяется радиус атома у элементов 2-го периода с возрастанием порядкового (атомного) номера элемента?
а) Уменьшается;
б) увеличивается;
в) не изменяется.
4.7. Сравните кислотные свойства растворов сероводорода Н2S и селеноводорода Н2Sе.
4.8. Укажите формулу оксида, образованного элементом IV группы: RО3, RО2, R2О7, R2О5 (R – обозначение элемента).
4.9. Используя Периодическую систему химических элементов Д. И. Менделеева, определите низшую степень окисления серы.
4.10. Выберите общую формулу водородного соединения, образованного элементом V группы: НR, Н2R, RН3, RН4.
Как произносится серебро в таблице менделеева. Алфавитный список химических элементов. Карьерный фокус: клинический химик
Все названия химических элементов происходят из латинского языка. Это необходимо в первую очередь для того, чтобы ученые разных стран могли понимать друг друга.
Химические знаки элементов
Элементы принято обозначать химическими знаками (символами). По предложению шведского химика Берцелиуса (1813 г.) химические элементы обозначают начальной или начальной и одной из последующих букв латинского названия данного элемента; первая буква всегда прописная, вторая строчная. Например, водород (Hydrogenium) обозначается буквой H, кислород (Oxygenium) – буквой O, сера (Sulfur) – буквой S; ртуть (Hydrargyrum) – буквами Hg, алюминий (Aluminium) – Al, железо (Ferrum) – Fe и т. д.
Рис. 1. Таблица химических элементов с названиями на латинском и русском языке.
Русские названия химических элементов зачастую представляют собой латинские названия с видоизмененными окончаниями. Но также существует множество элементов, произношение которых отличается от латинского первоисточника. Это либо коренные русские слова (например, железо), либо слова, которые являются переводом (пример – кислород).
Но также существует множество элементов, произношение которых отличается от латинского первоисточника. Это либо коренные русские слова (например, железо), либо слова, которые являются переводом (пример – кислород).
Химическая номенклатура
Химическая номенклатура – правильное наименование химических веществ. Латинское слово nomenclatura переводится как «перечень имен, названий»
На ранней стадии развития химии веществам давались произвольные, случайные наименования (тривиальные названия). Легколетучие жидкости назывались спиртами, к ним относились «соляной спирт» – водный раствор соляной кислоты, «силитряный спирт» – азотная кислота, «нашатырный спирт» – водный раствор аммиака. Маслообразные жидкости и твердые вещества назывались маслами, например, концентрированная серная кислота носила название «купоросное масло», хлорид мышьяка – «мышьяковое масло».
Иногда вещества получали название по имени его первооткрывателя, например, «глауберова соль» Na 2 SO 4 *10H 2 O, открытая немецким химиком И. Р. Глаубером в XVII веке.
Р. Глаубером в XVII веке.
Рис. 2. Портрет И. Р. Глаубер.
В старинных названиях могли указываться вкус веществ, цвет, запах, внешний вид, медицинское действие. Одно вещество иногда имело несколько наименований.
К концу XVIII века химикам было известно не более 150-200 соединений.
Первую систему научных названий в химии выработала в 1787 г. комиссия химиков во главе с А. Лавуазье. Химическая номенклатура Лавуазье послужила основой для создания национальных химических номенклатур. Для того, чтобы химики разных стран понимали друг друга, номенклатура должна быть единой. В настоящее время построение химических формул и названий неорганических веществ подчиняется системе номенклатурных правил, созданной комиссией Международного союза теоретической и прикладной химии (ИЮПАК). Каждое вещество изображается формулой, в соответствии с ней строится систематическое название соединения.
Рис. 3. А. Лавуазье.
Что мы узнали?
Все химические элементы имеют латинские корни. Латинские названия химических элементов являются общепринятыми. В русский язык они переносятся с помощью калькирования или перевода. однако некоторые слова имеют изначально русское значение, например, медь или железо. Химической номенклатуре подчиняются все химические вещества, состоящие из атомов и молекул. впервые система научных названий была разработана А. Лавуазье.
Латинские названия химических элементов являются общепринятыми. В русский язык они переносятся с помощью калькирования или перевода. однако некоторые слова имеют изначально русское значение, например, медь или железо. Химической номенклатуре подчиняются все химические вещества, состоящие из атомов и молекул. впервые система научных названий была разработана А. Лавуазье.
Тест по теме
Оценка доклада
Средняя оценка: 4.2 . Всего получено оценок: 768.
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто. . Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
Ниже приведем саму таблицу
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.

- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс “Таблица Менделеева для чайников”. В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе , который с радостью поделится с вами своими знаниями и опытом.
2.1. Химический язык и его части
Человечество использует много разных языков.
Кроме естественных языков (японского,
английского, русского – всего более 2,5 тысяч),
существуют еще и искусственные языки ,
например, эсперанто. Среди искусственных языков
выделяются языки различных наук . Так, в
химии используется свой, химический язык .
Химический язык – система условных
обозначений и понятий, предназначенная для
краткой, ёмкой и наглядной записи и передачи
химической информации.
Сообщение, написанное на большинстве
естественных языков, делится на предложения,
предложения – на слова, а слова – на буквы. Если
предложения, слова и буквы мы назовем частями
языка, то тогда мы сможем выделить аналогичные
части и в химическом языке (таблица 2).
Таблица 2. Части химического языка
Любым языком овладеть сразу невозможно, это относится и к химическому языку. Поэтому пока вы познакомитесь только с основами этого языка: выучите некоторые ” буквы” , научитесь понимать смысл ” слов” и” предложений” . В конце этой главы вы познакомитесь с названиями химических веществ – неотъемлемой частью химического языка. По мере изучения химии ваше знание химического языка будет расширяться и углубляться.
ХИМИЧЕСКИЙ ЯЗЫК.
1.Какие искусственные языки вы знаете (кроме
названных в тексте учебника)?
2.Чем естественные языки отличаются от
искусственных?
3.Как вы думаете, можно ли при описании химических
явлений обходиться без использования
химического языка? Если нет, то почему? Если да, то
в чем будут заключаться преимущества, а в чем
недостатки такого описания?
2. 2. Символы химических элементов
2. Символы химических элементов
Символ химического элемента обозначает сам
элемент или один атом этого элемента.
Каждый такой символ представляет собой
сокращенное латинское название химического
элемента, состоящее из одной или двух букв
латинского алфавита (латинский алфавит см. в
приложении 1). Символ пишется с прописной буквы.
Символы, а также русские и латинские названия
некоторых элементов, приведены в таблице 3. Там же
даны сведения о происхождении латинских
названий. Общего правила произношения символов
не существует, поэтому в таблице 3 приводится и
” чтение” символа, то есть, как этот символ
читается в химической формуле.
Заменять символом название элемента в устной
речи нельзя, а в рукописных или печатных текстах
это допускается, но не рекомендуется.В настоящее
время известно 110 химических элементов, у 109 из
них есть названия и символы, утвержденные
Международным союзом теоретической и прикладной
химии (ИЮПАК).
В таблице 3 приведена информация только о 33
элементах. Это те элементы, которые при изучении
химии вам встретятся в первую очередь. Русские
названия (в алфавитном порядке) и символы всех
элементов приведены в приложении 2.
Это те элементы, которые при изучении
химии вам встретятся в первую очередь. Русские
названия (в алфавитном порядке) и символы всех
элементов приведены в приложении 2.
Таблица 3. Названия и символы некоторых химических элементов
Название | ||||
Латинское | Написание | |||
| – | Написание | Происхождение | – | – |
| Азот | N itrogenium | От греч. ” рождающий селитру” | ” эн” | |
| Алюминий | Al uminium | От лат. ” квасцы” ” квасцы” | ” алюминий” | |
| Аргон | Ar gon | От греч. ” недеятельный” | ” аргон” | |
| Барий | Ba rium | От греч. ” тяжелый” | ” барий” | |
| Бор | B orum | От арабск. ” белый минерал” | ” бор” | |
| Бром | Br omum | От греч. ” зловонный” | ” бром” | |
| Водород | H ydrogenium | От греч. ” рождающий воду” | ” аш” | |
| Гелий | He lium | От греч.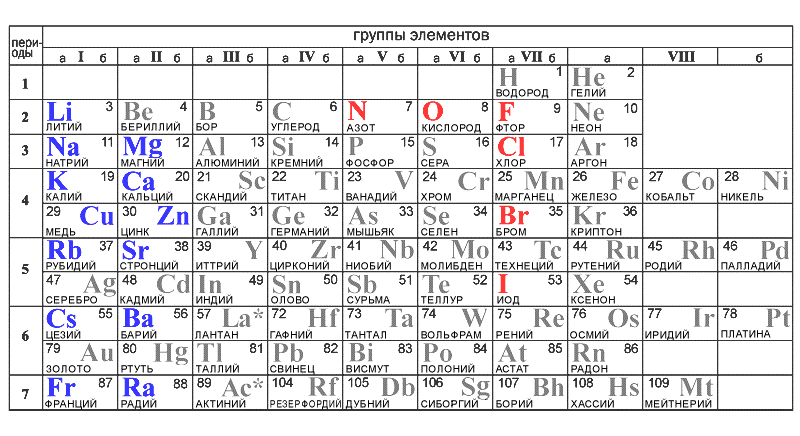 ” Солнце” ” Солнце” | ” гелий” | |
| Железо | Fe rrum | От лат. ” меч” | ” феррум” | |
| Золото | Au rum | От лат. ” горящий” | ” аурум” | |
| Йод | I odum | От греч. ” фиолетовый” | ” йод” | |
| Калий | K alium | От арабск. ” щёлочь” | ” калий” | |
| Кальций | Ca lcium | От лат. ” известняк” | ” кальций” | |
| Кислород | O xygenium | От греч. ” рождающий кислоты” ” рождающий кислоты” | ” о” | |
| Кремний | Si licium | От лат. ” кремень” | ” силициум” | |
| Криптон | Kr ypton | От греч. ” скрытый” | ” криптон” | |
| Магний | M ag nesium | От назв. полуострова Магнезия | ” магний” | |
| Марганец | M an ganum | От греч. ” очищающий” | ” марганец” | |
| Медь | Cu prum | От греч. назв. о. Кипр о. Кипр | ” купрум” | |
| Натрий | Na trium | От арабск, ” моющее средство” | ” натрий” | |
| Неон | Ne on | От греч. ” новый” | ” неон” | |
| Никель | Ni ccolum | От нем. ” медь святого Николая” | ” никель” | |
| Ртуть | H ydrarg yrum | Лат. ” жидкое серебро” | ” гидраргирум” | |
| Свинец | P lumb um | От лат. названия сплава свинца с
оловом. | ” плюмбум” | |
| Сера | S ulfur | От санскриттского ” горючий порошок” | ” эс” | |
| Серебро | A rg entum | От греч. ” светлый” | ” аргентум” | |
| Углерод | C arboneum | От лат. ” уголь” | ” цэ” | |
| Фосфор | P hosphorus | От греч. ” несущий свет” | ” пэ” | |
| Фтор | F luorum | От лат. глагола ” течь” | ” фтор” | |
| Хлор | Cl orum | От греч.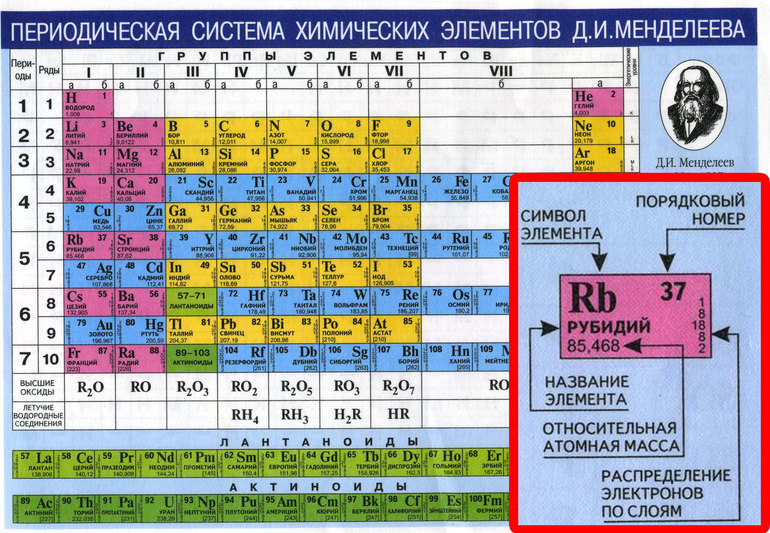 ” зеленоватый” ” зеленоватый” | ” хлор” | |
| Хром | C hr omium | От греч. ” краска” | ” хром” | |
| Цезий | C aes ium | От лат. ” небесно-голубой” | ” цезий” | |
| Цинк | Z in cum | От нем. ” олово” | ” цинк” | |
2.3. Химические формулы
Для обозначения химических веществ используют химические формулы .
Для молекулярных веществ химическая формула
может обозначать и одну молекулу этого вещества.
Информация о веществе может быть разной, поэтому
существуют разные типы химических формул .
В зависимости от полноты информации химические
формулы делятся на четыре основных типа: простейшие , молекулярные , структурные и пространственные .
Подстрочные индексы в простейшейформуле не
имеют общего делителя.
Индекс ” 1″ в формулах не ставится.
Примеры простейших формул: вода – Н 2 О,
кислород – О, сера – S, оксид фосфора – P 2 O 5 ,
бутан – C 2 H 5 , фосфорная кислота – H 3 PO 4 ,
хлорид натрия (поваренная соль) – NaCl.
Простейшая формула воды (Н 2 О) показывает,
что в состав воды входит элемент водород (Н) и
элемент кислород (О), причем в любой порции
(порция – часть чего-либо, что может быть
разделено без утраты своих свойств.) воды число
атомов водорода в два раза больше числа атомов
кислорода.
Число частиц , в том числе и число атомов ,
обозначается латинской буквой N . Обозначив
число атомов водорода – N H , а число
атомов кислорода – N O , мы можем
записать, что
Или N H: N O = 2:
1.
Простейшая формула фосфорной кислоты (Н 3 РО 4) показывает, что в состав фосфорной кислоты входят атомы водорода , атомы фосфора и атомы кислорода , причем отношение чисел атомов этих элементов в любой порции фосфорной кислоты равно 3:1:4, то есть
N H: N P: N O = 3: 1: 4.
Простейшая формула может быть составлена для любого индивидуального химического вещества, а для молекулярного вещества, кроме того, может быть составлена молекулярная формула .
Примеры молекулярных формул: вода – H 2 O, кислород – O 2 , сера – S 8 , оксид фосфора – P 4 O 10 , бутан – C 4 H 10 , фосфорная кислота – H 3 PO 4 .
У немолекулярных веществ молекулярных формул нет.
Последовательность записи символов элементов
в простейших и молекулярных формулах
определяется правилами химического языка, с
которыми вы познакомитесь по мере изучения
химии. На информацию, передаваемую этими
формулами, последовательность символов влияния
не оказывает.
Из знаков, отражающих строение веществ, мы будем использовать пока только валентный штрих (” черточку”). Этот знак показывает наличие между атомами так называемой ковалентной связи (что это за тип связи и каковы его особенности, вы скоро узнаете).
В молекуле воды атом кислорода связан простыми (одинарными) связями с двумя атомами водорода, а атомы водорода между собой не связаны. Именно это наглядно показывает структурная формула воды.
Другой пример: молекула серы S 8 . В этой молекуле 8 атомов серы образуют восьмичленный цикл, в котором каждый атом серы связан с двумя другими атомами простыми связями. Сравните структурную формулу серы с объемной моделью ее молекулы, показанной на рис. 3. Обратите внимание на то, что структурная формула серы не передает форму ее молекулы, а показывает только последовательность соединения атомов ковалентными связями.
Структурная формула фосфорной кислоты
показывает, что в молекуле этого вещества один из
четырех атомов кислорода связан только с атомом
фосфора двойной связью, а атом фосфора, в свою
очередь, связан еще с тремя атомами кислорода
простыми связями. Каждый из этих трех атомов
кислорода, кроме того, связан простой связью с
одним из трех имеющихся в молекуле атомов
водорода./p>
Каждый из этих трех атомов
кислорода, кроме того, связан простой связью с
одним из трех имеющихся в молекуле атомов
водорода./p>
Сравните приведенную ниже объемную модель молекулы метана с его пространственной, структурной и молекулярной формулой:
В пространственной формуле метана клиновидныевалентные штрихи как бы в перспективе показывают, какой из атомов водорода находится ” ближе к нам” , а какой ” дальше от нас” .
Иногда в пространственной формуле указывают длины связей и значения углов между связями в молекуле, как это показано на примере молекулы воды.
Немолекулярные вещества не содержат молекул. Для удобства проведения химических расчетов в немолекулярном веществе выделяют так называемую формульную единицу .
Примеры состава формульных единиц некоторых
веществ: 1) диоксид кремния (кварцевый песок,
кварц) SiO 2 – формульная единица состоит из
одного атома кремния и двух атомов кислорода;
2) хлорид натрия (поваренная соль) NaCl –
формульная единица состоит из одного атома
натрия и одного атома хлора; 3) железо Fe –
формульная единица состоит из одного атома
железа.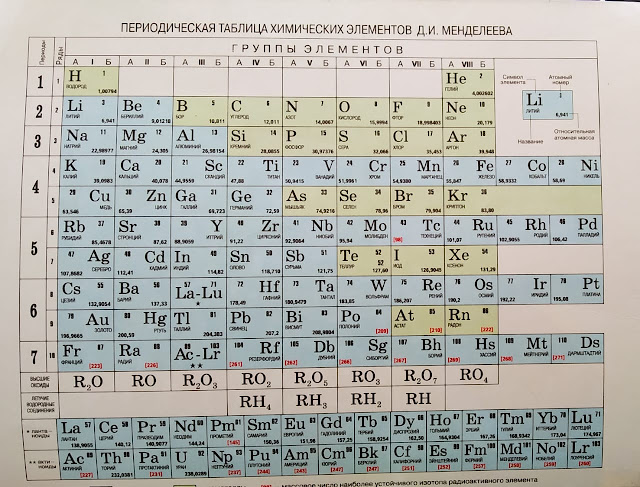 Как и молекула, формульная единица –
наименьшая порция вещества, сохраняющая его
химические свойства.
Как и молекула, формульная единица –
наименьшая порция вещества, сохраняющая его
химические свойства.
Таблица 4
Информация, передаваемая формулами разных типов
Тип формулы | Информация, передаваемая формулой. | |
| Простейшая Молекулярная Структурная Пространственная |
| |
Рассмотрим теперь на примерах, какую
информацию дают нам формулы разных типов.
1. Вещество: уксусная кислота . Простейшая формула – СН 2 О, молекулярная формула – C 2 H 4 O 2 , структурная формула
Простейшая формула говорит нам, что
1) в состав уксусной кислоты входит углерод,
водород и кислород;
2) в этом веществе число атомов углерода
относится к числу атомов водорода и к числу
атомов кислорода, как 1:2:1, то есть N H: N C:N O = 1:2:1.
Молекулярная формула добавляет, что
3) в молекуле уксусной кислоты – 2 атома углерода,
4 атома водорода и 2 атома кислорода.
Структурная формула добавляет, что
4, 5) в молекуле два атома углерода связаны между
собой простой связью; один из них, кроме этого,
связан с тремя атомами водорода, с каждым простой
связью, а другой – с двумя атомами кислорода, с
одним – двойной связью, а с другим – простой;
последний атом кислорода связан еще простой
связью с четвертым атомом водорода.
2. Вещество: хлорид натрия . Простейшая формула – NaCl.
1) В состав хлорида натрия входит натрий и хлор.
2) В этом веществе число атомов натрия равно числу
атомов хлора.
3. Вещество: железо . Простейшая
формула – Fe.
1) В состав этого вещества входит только железо,
то есть это простое вещество.
4. Вещество: триметафосфорная кислота . Простейшая формула – HPO 3 , молекулярная формула – H 3 P 3 O 9 , структурная формула
1) В состав триметафосфорной кислоты входит
водород, фосфор и кислород.
2) N H: N P:N O = 1:1:3.
3) Молекула состоит из трех атомов водорода, трех
атомов фосфора и девяти атомов кислорода.
4, 5) Три атома фосфора и три атома кислорода,
чередуясь, образуют шестичленный цикл. Все связи
в цикле простые. Каждый атом фосфора, кроме того,
связан еще с двумя атомами кислорода, причем с
одним – двойной связью, а с другим – простой.
Каждый из трех атомов кислорода, связанных
простыми связямис атомами фосфора, связан еще
простой связью с атомом водорода.
| Фосфорная кислота – H 3 PO 4 (другое название – ортофосфорная кислота) – прозрачное бесцветное кристаллическое вещество молекулярного строения, плавящееся при 42 o С. Это вещество очень хорошо растворяется в воде и даже поглощает пары воды из воздуха (гигроскопично). Фосфорную кислоту производят в больших количествах и используют прежде всего в производстве фосфорных удобрений, а также в химической промышленности, при производстве спичек и даже в строительстве. Кроме того, фосфорная кислота применяется при изготовлении цемента в зубоврачебной технике, входит в состав многих лекарственных средств. Эта кислота достаточно дешева, поэтому в некоторых странах, например в США, очень чистая сильно разбавленная водой фосфорная кислота добавляется в освежающие напитки для замены дорогой лимонной кислоты. |
Метан – CH 4 . Если у вас
дома есть газовая плита, то с этим веществом вы
сталкиваетесь ежедневно: природный газ, который
горит в конфорках вашей плиты, на 95 % состоит из
метана.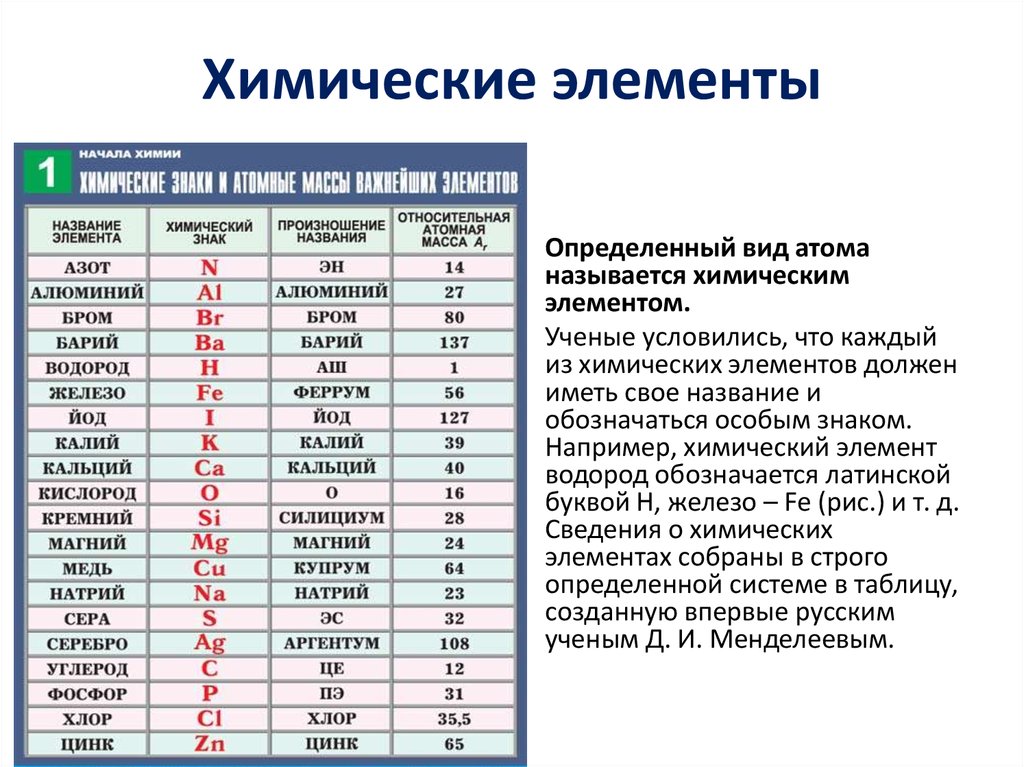 Метан – газ без цвета и запаха с
температурой кипения –161 o С. В смеси с
воздухом он взрывоопасен, этим и объясняются
происходящие иногда в угольных шахтах взрывы и
пожары (другое название метана – рудничный газ).
Третье название метана – болотный газ – связано
с тем, что пузырьки именно этого газа поднимаются
со дна болот, где он образуется в результате
деятельности некоторых бактерий. В
промышленности метан используется как топливо и
сырье для производства других веществ.Метан
является простейшим углеводородом . К этому
классу веществ относятся также этан (C 2 H 6),
пропан (C 3 H 8), этилен (C 2 H 4),
ацетилен (C 2 H 2) и многие другие
вещества. Метан – газ без цвета и запаха с
температурой кипения –161 o С. В смеси с
воздухом он взрывоопасен, этим и объясняются
происходящие иногда в угольных шахтах взрывы и
пожары (другое название метана – рудничный газ).
Третье название метана – болотный газ – связано
с тем, что пузырьки именно этого газа поднимаются
со дна болот, где он образуется в результате
деятельности некоторых бактерий. В
промышленности метан используется как топливо и
сырье для производства других веществ.Метан
является простейшим углеводородом . К этому
классу веществ относятся также этан (C 2 H 6),
пропан (C 3 H 8), этилен (C 2 H 4),
ацетилен (C 2 H 2) и многие другие
вещества. |
Таблица 5 . Примеры формул разных типов для некоторых веществ –
Инструкция
Периодическая система представляет собой многоэтажный «дом», в котором располагается большое количество квартир. Каждый «жилец» или в своей собственной квартире под определенным номером, который является постоянным.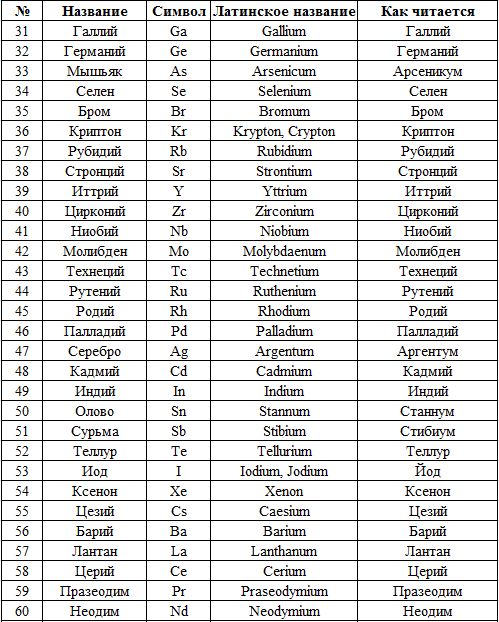 Помимо этого элемент имеет «фамилию» или название, например кислород, бор или азот. Кроме этих данных в каждой «квартире» или указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Помимо этого элемент имеет «фамилию» или название, например кислород, бор или азот. Кроме этих данных в каждой «квартире» или указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Как в любом доме, здесь имеются «подъезды», а именно группы. Причем в группах элементы располагаются слева и справа, образуя . В зависимости от того, с какой стороны их больше, та называется главной. Другая подгруппа, соответственно, будет побочной. Также в таблице имеются «этажи» или периоды. Причем периоды могут быть как большими (состоят из двух рядов) так и малыми (имеют только один ряд).
По таблице можно показать строение атома элемента, каждый из которых имеет положительно заряженное ядро, состоящее из протонов и нейтронов, а также вращающихся вокруг него отрицательно заряженных электронов. Число протонов и электронов численно совпадает и определяется в таблице по порядковому номеру элемента. Например, химический элемент сера имеет №16, следовательно, будет иметь 16 протонов и 16 электронов.
Чтобы определить количество нейтронов (нейтральных частиц, также расположенных в ядре) вычтите из относительной атомной массы элемента его порядковый номер. Например, железо имеет относительную атомную массу равную 56 и порядковый номер 26. Следовательно, 56 – 26 = 30 протонов у железа.
Электроны находятся на разном расстоянии от ядра, образуя электронные уровни. Чтобы определить число электронных (или энергетических) уровней, нужно посмотреть на номер периода, в котором располагается элемент. Например, алюминий находится в 3 периоде, следовательно, у него будет 3 уровня.
По номеру группы (но только для главной подгруппы) можно определить высшую валентность. Например, элементы первой группы главной подгруппы (литий, натрий, калий и т.д.) имеют валентность 1. Соответственно, элементы второй группы (бериллий, магний, кальций и т.д.) будут иметь валентность равную 2.
Также по таблице можно проанализировать свойства элементов. Слева направо металлические свойства ослабевают, а неметаллические усиливаются. Это хорошо видно на примере 2 периода: начинается щелочным металлом натрием, затем щелочноземельный металл магний, после него амфотерный элемент алюминий, затем неметаллы кремний, фосфор, сера и заканчивается период газообразными веществами – хлором и аргоном. В следующем периоде наблюдается аналогичная зависимость.
Это хорошо видно на примере 2 периода: начинается щелочным металлом натрием, затем щелочноземельный металл магний, после него амфотерный элемент алюминий, затем неметаллы кремний, фосфор, сера и заканчивается период газообразными веществами – хлором и аргоном. В следующем периоде наблюдается аналогичная зависимость.
Сверху вниз также наблюдается закономерность – металлические свойства усиливаются, а неметаллические ослабевают. То есть, например, цезий гораздо активнее по сравнению с натрием.
Объяснение Периодической таблицы элементов
Обновлено 26 января 2022 г.
Периодическая таблица элементов 1 представляет собой упорядоченную систему всех идентифицированных элементов. Эти элементы составляют все в нашей вселенной.
Химические элементы таблицы Менделеева являются строительными блоками всего в природе. Эти элементы также создают продукты и технологии, которые бесчисленным образом сформировали современное общество — чистая питьевая вода, эффективные лекарства и технологии, начиная от солнечных батарей и заканчивая компонентами электроники.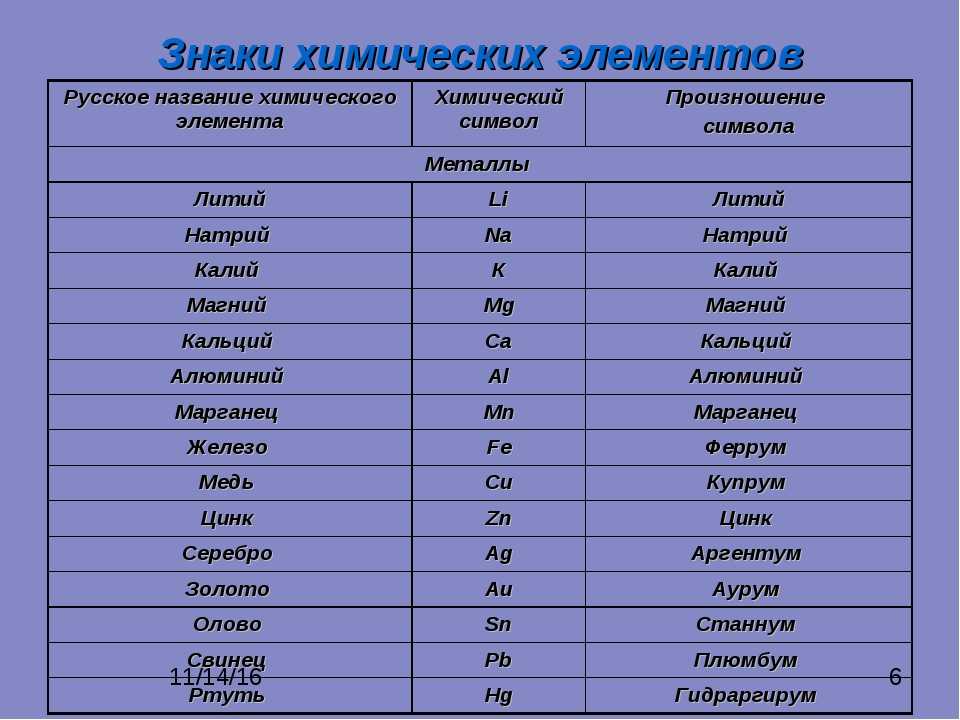
Вам не нужно быть химиком, чтобы понимать периодическую таблицу. Читайте дальше, чтобы узнать больше об этом.
Почему была разработана таблица Менделеева:
В 1869 году русский химик Дмитрий Менделеев хотел выяснить, существует ли закономерность в химических свойствах известных ему элементов. Он нашел закономерность, упорядочив элементы по возрастанию атомного номера и расположив их на диаграмме, создав первую периодическую таблицу. Эта структура помогла Менделееву и другим ученым определить сходства и различия между элементами, чтобы предсказать будущие химические реакции.
Периодическая таблица Менделеева включала 63 элемента. Он ожидал, что в один прекрасный день будут обнаружены и другие, поэтому он оставил свободное место в своей таблице для дополнений. Сегодня 118 химических элементов, идентифицированных в периодической таблице, включают материалы, из которых состоят все известные объекты во Вселенной.
Знаете ли вы? Наиболее распространенным элементом (по массе), составляющим Землю4, является железо (Fe).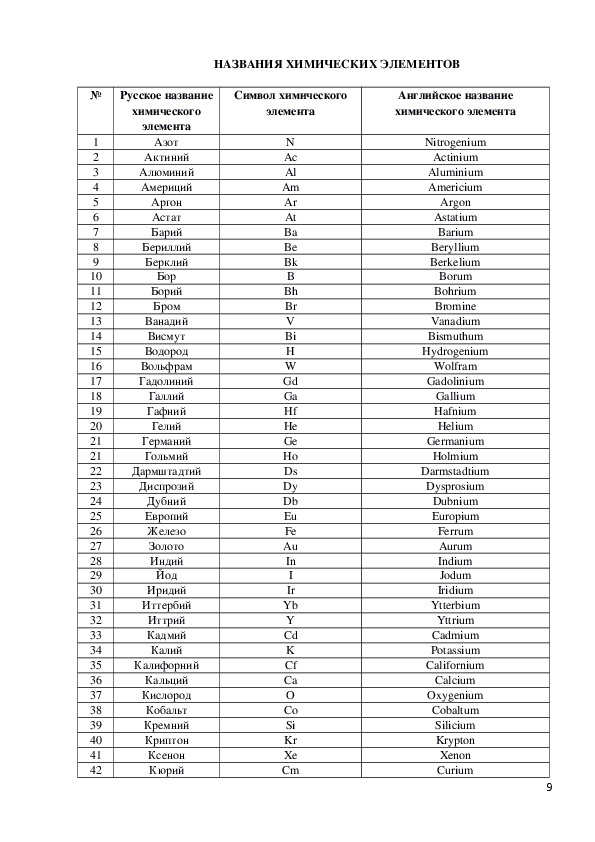 2 Кислород (O) является наиболее распространенным элементом в земной коре. 3
2 Кислород (O) является наиболее распространенным элементом в земной коре. 3
Как элементы организованы в периодической таблице:
Элементы организованы в горизонтальные ряды по возрастанию атомного номера. 4 Атомный номер, расположенный в верхнем левом углу символа элемента, означает количество протонов в ядре атома.
Под символом элемента стоит атомный вес, представляющий собой средний вес протонов и нейтронов в атоме. Поскольку в природе атомы имеют разное количество нейтронов (известных как изотопы), атомная масса представляет собой среднее значение всех весов всех изотопов для данного атома.
Что такое периоды?
Горизонтальные ряды периодической таблицы называются периодами. Периодическая таблица содержит семь периодов 5 (девять, если считать ряды лантаноидов и актиноидов). В каждом периоде атомные номера элементов увеличиваются слева направо. Все элементы одного и того же периода имеют одинаковое количество электронных оболочек, но разное количество электронов и протонов.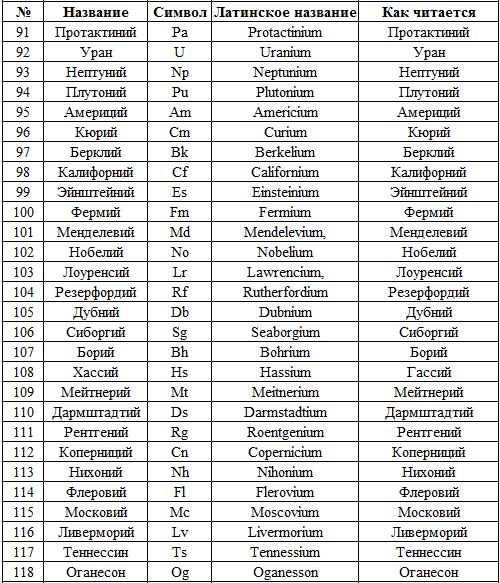
Зная количество электронов химического элемента, вы можете вычислить его валентность. 6 Способность атома или группы атомов образовывать химические связи с другими атомами. Валентность является важным аспектом расчета химических формул для студентов и химиков.
Что такое семьи?
«Семейства» — это группы элементов, представленные в девяти из 18 вертикальных столбцов периодической таблицы. 7 Семейства химических элементов имеют сходные свойства, например, их электронные конфигурации. 8 Например, элементы со свойствами, сходными с натрием (Na), такие как литий (Li) и калий (K), входят в одно и то же семейство.
Как элементы добавляются в таблицу?
Международный союз теоретической и прикладной химии (IUPAC) ведет периодическую таблицу и устанавливает критерии для новых дополнений. 9 Последний раз ИЮПАК обновлял периодическую таблицу в 2016 году, добавляя четыре новых элемента: нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). 10
10
Как читать и интерпретировать периодическую таблицу:
Периодическая таблица помогает химикам классифицировать элементы по свойствам и сходству. Один из способов сортировки элементов состоит в том, чтобы разделить их на три категории: металлы, неметаллы и металлоиды:
- Большинство элементов в периодической таблице считаются металлами . У них схожие характеристики — большинство из них твердые, блестящие, хорошо проводят электричество и податливы.
- Неметаллы обладают свойствами, противоположными металлам – они хрупкие, не гибкие и плохо проводят тепло или электричество. Некоторые неметаллы являются жидкостями, некоторые газообразными.
- Металлоиды или полуметаллы считаются чем-то средним между металлами и неметаллами. Металлоиды обладают уникальными свойствами проводимости, что делает их полезными в производстве полупроводников и компьютерных микросхем. 11
Периодическая таблица элементов помогает нам лучше понять химические элементы и их связь друг с другом. Продукты, материалы и технологии, формирующие нашу жизнь, создаются элементами и тем, как они взаимодействуют друг с другом.
Продукты, материалы и технологии, формирующие нашу жизнь, создаются элементами и тем, как они взаимодействуют друг с другом.
1 Периодическая таблица элементов – PubChem (nih.gov)
2 Ион железа | Fe+3 – PubChem (nih.gov)
3 Самый распространенный элемент во Вселенной, Земле и теле (thightco.com)
4 Как устроена Периодическая таблица сегодня? (thinkco.com)
5 Разница между группой элементов и периодом (thoughtco.com)
6 Что такое валентность или валентность в химии? (thinkco.com)
7 Семейства элементов периодической таблицы (thightco.com)
8 Периодическая таблица: семейства и периоды – макеты
9 Международный союз теоретической и прикладной химии (iupac.org)
10 ИЮПАК называет четыре новых элемента нихониум, московий, теннессин и оганесон – ИЮПАК
11 Периодическая таблица: металлы, неметаллы и металлоиды – макеты
2.
 15: Химические символы и формулы
15: Химические символы и формулы- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 52544
Как шахматисты следят за своими ходами в игре ?
Предположим, вы шли и заметили на земле лист бумаги с отметками на нем. Вы поднимаете его и видите бумагу на картинке выше.
Для большинства людей эти заметки ничего не значат (возможно, это секретный шпионский код). Но для шахматиста эти символы рассказывают историю шахматной партии. Каждая аббревиатура описывает шахматную фигуру или ход во время игры.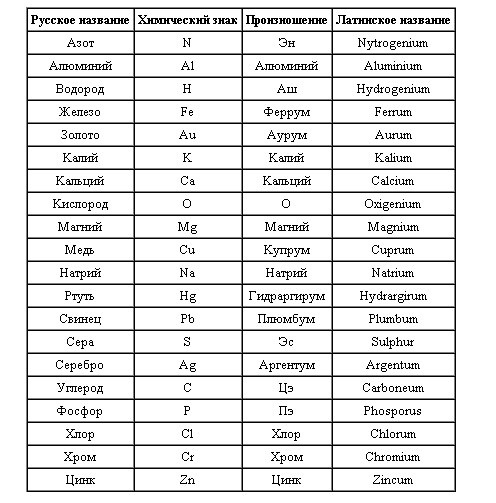 Использование специальных символов позволяет шахматистам «видеть» игру без необходимости читать многословное и, возможно, неполное описание того, что произошло.
Использование специальных символов позволяет шахматистам «видеть» игру без необходимости читать многословное и, возможно, неполное описание того, что произошло.
Химические символы и формулы
Химическая формула
Для иллюстрации химических реакций и элементов и соединения , входящие в их состав, химики используют символы и формулы. Химический символ представляет собой одно- или двухбуквенное обозначение элемента. Некоторые примеры химических символов: \(\ce{O}\) для кислорода, \(\ce{Zn}\) для цинка и \(\ce{Fe}\) для железа. Первая буква символа всегда заглавная. Если символ состоит из двух букв, вторая буква является строчной. Большинство элементов имеют символы, основанные на их английских названиях. Однако некоторые элементы, известные с древних времен, сохранили символы, основанные на их латинских названиях, как показано ниже.
| Химический символ | Имя | Латинское название |
|---|---|---|
| \(\ce{Na}\) | Натрий | Натрий |
| \(\се{К}\) | Калий | Калиум |
| \(\ce{Fe}\) | Железо | Феррум |
| \(\ce{Cu}\) | Медь | Купрум |
| \(\ce{Ag}\) | Серебро | Аргентум |
| \(\ce{Sn}\) | Олово | Станнум |
| \(\ce{Sb}\) | Сурьма | Стибиум |
| \(\ce{Au}\) | Золото | Аурум |
| \(\ce{Pb}\) | Свинец | Свинец |
Посмотрите следующее видео, чтобы узнать больше о происхождении символов различных элементов.
Химические формулы
Соединения представляют собой комбинации двух или более элементов. А 9Химическая формула 0021 — это выражение, которое показывает элементы в соединении и относительные пропорции этих элементов. Вода состоит из водорода и кислорода в соотношении два к одному. Химическая формула воды \(\ce{H_2O}\). Серная кислота является одним из наиболее широко производимых химических веществ в Соединенных Штатах и состоит из элементов водорода, серы и кислорода. Химическая формула серной кислоты: \(\ce{H_2SO_4}\).
Резюме
- Химический символ представляет собой одно- или двухбуквенное обозначение элемента.
- Соединения представляют собой комбинации двух или более элементов.
- Химическая формула — это выражение, которое показывает элементы в соединении и относительные пропорции этих элементов.

- Некоторые элементы имеют символы, происходящие от латинского названия элемента.
Обзор
- Что такое химический символ?
- Что такое химическая формула?
- Сколько атомов водорода в одной молекуле соединения С 12 Н 22 О 11 ?
- Какое латинское название элемента калия?
Эта страница под названием 2.15: Химические символы и формулы распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 через исходный контент, отредактированный в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Вернуться к началу
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Фундамент СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Метки
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
Список для чтения | Химические соединения
Это список (в основном популярных) научных книг (с уклоном в сторону химии), которые я прочитал, собираюсь прочитать или которые мне рекомендовали. Если у вас есть другие предложения, дайте мне знать, и я добавлю их в список с благодарностью (используйте #chembooks в Твиттере или оставьте комментарий здесь, в блоге).
[Вот еще один список научно-популярных книг, составленный @kashfarooq — спасибо @alex_brovvn за указание на него]
ОБНОВЛЕНИЕ: когда (если) я доберусь до 100 в списке, я расставлю по алфавиту имя автора, чтобы сделать это легче ориентироваться…
1. Алхимия воздуха: еврейский гений, обреченный магнат и научное открытие, которое накормило мир, но подстегнуло восстание Гитлера – Томас Хагер
История Габера и Босха. Отличное чтение; настоятельно рекомендуется. Я узнал об этой книге из комментария, оставленного под этой записью в блоге @biochembelle.
Отличное чтение; настоятельно рекомендуется. Я узнал об этой книге из комментария, оставленного под этой записью в блоге @biochembelle.
2. Демон под микроскопом: от полевых госпиталей до нацистских лабораторий, героические поиски первого в мире чудодейственного лекарства одним врачом – Томас Хагер
История первых синтетических антибиотиков и Герхарда Домагка. Еще одна блестящая книга Хагера.
3. В погоне за молекулой – Джон Бэкингем
Я читал это несколько лет назад, но помню, что это было отличное чтение. По сути, это история о том, как возникла современная химия.
4. Исчезающая ложка: и другие правдивые рассказы о безумии, любви и истории мира из Периодической таблицы элементов – Сэм Кин
5. Elements – Hugh Aldersey-Williams
6. Прекрасная жизнь с элементами: периодическая таблица в персонифицированном виде: приключение в периодической таблице – Bunpei Yorifuji
ты когда-нибудь увидишь…
7. 13-й элемент: грязная история об убийстве, огне и фосфоре – Джон Эмсли
13-й элемент: грязная история об убийстве, огне и фосфоре – Джон Эмсли
8. Элементы убийства: история яда – Джон Эмсли 9002 Джон Эмсли Молекулы на выставке: портреты интригующих материалов в повседневной жизни – Джон Эмсли
10. То же самое и не то же самое – Роальд Хоффманн
11. Другое 9 Слоны на кислоте0024 – Алекс Бозе
Эту книгу я взял в аэропорту перед трансатлантическим перелетом; в основном из-за названия. Это весело читать.
12. Пятнистое чудовище: историческая история борьбы с оспой – Дженнифер Ли Кэррелл
Не химия, а увлекательное чтение о том, как оспа боролась по обе стороны Атлантики в 18 веке.
13. Краткая история почти всего – Билл Брайсон
14. Вы, конечно, шутите, мистер Фейнман! (Приключения любопытного персонажа) – Ричард Фейнман и Ральф Лейтон
Я мог целыми днями читать книги о Фейнмане; а это я читал много лет назад. Предложено в Твиттере @SeeArrOh
Предложено в Твиттере @SeeArrOh
15. Большой палец скрипача: и другие утерянные рассказы о любви, войне и гении, написанные нашим генетическим кодом Пуговицы Наполеона: как 17 молекул изменили историю – Пенни Ле Кутер и Джей Бурресон
Предложено в Твиттере @sciencegeist
17. Справочник отравителя: Убийство и рождение судебной медицины в эпоху джаза Нью-Йорк – Дебора Блюм sciencegeist
18. О еде и кулинарии: наука и знания о кухне – Гарольд МакГи
Рекомендовано в Твиттере @sciencegeist, @L_Howes и @Chemjobber
19. Так рассыпается печенье: 62 совершенно новых комментария об увлекательной химии повседневной жизни от @Cationally
21. Создание атомной бомбы – Ричард Роудс
Еще одно предложение от @Chemjobber, который отмечает, что «да, это много физики, но все дело в химии».
22. Гений: жизнь и наука Ричарда Фейнмана – Джеймс Глейк
Больше корма Фейнмана. Один у меня есть (и я читал), и он спрятан где-то в коробке на чердаке… также был предложен в Твиттере @NeilWithers
Один у меня есть (и я читал), и он спрятан где-то в коробке на чердаке… также был предложен в Твиттере @NeilWithers
23. Молекулы и медицина – E. J. Corey, Barbara Czakó & László Kürti
Предложено в Твиттере @stephengdavey
24. Молекулы, которые изменили мир – К. К. Николау и Тэмсин Монтаньон
Еще одно предложение от @stephengdavey (этого у меня нет, но я уже пролистывал копию. Вот забавная игра: посмотрите, сколько фотографий самого KC вы найдете в книге, думаю, >70…)
25. Периодическая таблица – Примо Леви
Я действительно должен получить копию этого. Предложено в Твиттере @alex_brovvn и @SimonHiggins_60
26. Дядя Вольфрам: Воспоминания о химическом детстве – Оливер Сакс
Еще один, который я прочитал (хороший) и, вероятно, спрятан где-то в коробке… также был предложен в Твиттере @Chemjobber
27. Убийство, магия и медицина – Джон Манн
Предложено в Твиттер @CyclinScience
28. Золотая книга химических экспериментов – Роберт Брент
Золотая книга химических экспериментов – Роберт Брент
Вероятно, лучше не пробовать это дома, дети! Вот ссылка на pdf-версию книги. Предположительно, в какой-то момент она была запрещена, и, согласно Википедии, в библиотеках всего мира насчитывается всего 126 экземпляров этой книги. У меня есть pdf где-то на моем ноутбуке, но @Dr_GHill 9 напомнил о книге в Твиттере.0003
29. Радиоактивный бойскаут: пугающая правдивая история о вундеркинде и его самодельном ядерном реакторе – Кен Сильверстайн
Прочитал это несколько лет назад – стоит посмотреть.
30. Розалинда Франклин: темная леди ДНК – Бренда Мэддокс
Еще одна книга лежит дома на полке и ждет, чтобы ее прочитали… также предложено в Твиттере @Marcel_Swart
31. Мистер Томпкинс в мягкой обложке – Георгий Гамов
Еще одно предложение от @Dr_GHill
32. Молекула на миллиард долларов: поиск идеального лекарства одной компанией Великий спор, положивший начало революции в физике – Дэвид Линдли
Еще одно предложение от @ChemProfCramer
34. Лиз Мейтнер: жизнь в физике – Рут Левин Сайм
Лиз Мейтнер: жизнь в физике – Рут Левин Сайм
И еще один выбор @ChemProfCramer.
35. E=mc 2 : Биография самого известного уравнения в мире – Дэвид Боданис – Джордж Гамов
Еще одно предложение от @CoulombicExp
37. Великие научные эксперименты: Двадцать экспериментов, которые изменили наше представление о мире – Ром Харре
И еще один выбор @CoulombicExp.
38. Абсолютный ноль и победа над холодом – Том Шахтман
Еще один, который я читал некоторое время назад; Кажется, я помню, как наслаждался этим!
39. ASIMOV по химии – ISAAC ASIMOV
Предлагается в Твиттере @peonor
40. Странный человек: скрытая жизнь Пола Дирака, Мистик Атома – Грахам. от @Marcel_Swart
41. Сотворения огня: живая история химии от алхимии до атомной эры – Кэти Кобб и Гарольд Голдуайт Obsession – Чендлер Берр
Предложено в Твиттере @onesleepynerd
43. Сэр Кристофер Ингольд: главный пророк органической химии книга, написанная Джеком Робертсом (pdf).
Сэр Кристофер Ингольд: главный пророк органической химии книга, написанная Джеком Робертсом (pdf).
44. Лайнус Полинг своими словами: отрывки из его сочинений, речей и интервью – Барбара Мариначчи
Еще одно предложение от @conway_group
45. Борьба Альберта Вудса 90 90 90 90 2 Уильяма Вудса и 9 3 3 Купера 900 еще один выбор @conway_group.
46. Лиловый: как один человек изобрел цвет, изменивший мир – Саймон Гарфилд
Все о сэре Уильяме Генри Перкине и его синтезе лилового красителя – стоит прочитать.
47. Секреты алхимии – Лоуренс Принсипи
Указано в Твиттере @_byronmiller после сообщения в блоге @sciencegeist Теодор Грей
У меня есть версия для iPad. Это красиво.
49. Рыба, пойманная вовремя: В поисках латимерии – Саманта Вайнберг
Не химия, но мне понравилось.
50. Serendipity: Случайные открытия в науке – Ройстон Робертс
Здесь много удачи, связанной с химией.
51. Музыка простых чисел: В поисках решения величайшей тайны математики – Маркус дю Сотуа
Я обожаю подобные математические книги… и эта хорошая (и следующие несколько тоже в списке).
52. Человек, который любил только числа: История Пола Эрдоса и поиски математической истины – Пол Хоффман
Эрдос был немного странным… и это отличное чтение.
53. Человек, познавший бесконечность: жизнь гения Рамануджана – Роберт Канигель
Увлекательно.
54. Загадка Ферма: Эпический поиск решения величайшей математической задачи в мире – Саймон Сингх
Кто не любит немного Ферма? Я думаю, что это помогло мне начать читать учебники по математике…
55. Возраст молекулы – Нина Холл (редактор)
Прекрасная настольная книга из Королевского химического общества.
56. Периодическая таблица: очень краткое введение – Эрик Шерри (@ericscerri)
@hacp81 напомнил мне в Твиттере о книгах Эрика по периодической таблице.
57. Периодическая таблица: история и значение – Эрик Шерри (@ericscerri)
58. История семи элементов – Эрик Шерри (@ericscerri)
Вышел в июне 2013 г.; последние семь элементов должны быть выделены из первых 92 в периодической таблице.
59. Сотворение: Происхождение жизни / Будущее жизни – Адам Резерфорд (@AdamRutherford)
Первое место в моем списке «к прочтению».
60. Соборы науки: Личности и соперничество, создавшие современную химию – Патрик Коффи
61. ЛСД: мой трудный ребенок — взгляды/перспективы – Альберт Хофманн (перевод Джонатана Отта)
62. Химик-мистик: жизнь Альберта Хофмана и его открытие ЛСД – Дитер Хагенбах и Люциус Вертмюллер
02 63. 63. Палитра – Виктория Финли
Предложено в Твиттере @DocTHop
64. Эврика и Эйфория: Оксфордская книга научных анекдотов – Уолтер Гратцер
Эврика и Эйфория: Оксфордская книга научных анекдотов – Уолтер Гратцер
Предложено в Твиттере @Chemtips
65. Девушки из Атомного города: Нерассказанная история женщин, которые помогли выиграть Вторую мировую войну – Дениз Кирнан
Предложено в Твиттере @echristophy
66. Что такое жизнь?: с разумом и материей и Autobiographical Sketches – Erwin Schrödinger
Одна из серии книг о происхождении жизни, упомянутых в Твиттере @V_Saggiomo, которые собраны в этом сообщении в блоге @yigitaltay
67. Биогенез: теории происхождения жизни – Ноам Лахав
Одна из серии книг о происхождении жизни, упомянутых в Твиттере @V_Saggiomo, которые собраны в этом сообщении в блоге @yigitaltay
68. Вселенная из ничего: почему существует нечто, Ничего – Лоуренс М. Краусс
Одна из серии книг о происхождении жизни, упомянутых в Твиттере @V_Saggiomo, которые собраны в этом сообщении в блоге @yigitaltay
69. Большой взрыв: Происхождение Вселенной – Саймон Сингх
Большой взрыв: Происхождение Вселенной – Саймон Сингх
Одна из серии книг о происхождении жизни, упомянутых в Твиттере @V_Saggiomo, которые собраны в этом сообщении в блоге @yigitaltay
70. Удивительная история квантовой механики: исследование без математики Наука, которая создала наш мир – Джеймс Какалиос
Предложено в Twitter @hacp81
71. Что такое жизнь?: Как химия становится биологией – Эдди Просс
сделал…
Нравится:
Нравится Загрузка…
Соединения и элементы – разница и сравнение
Элементы и Соединения представляют собой чистые химические вещества, встречающиеся в природе. Отличие между элементом и соединением состоит в том, что элемент представляет собой вещество, состоящее из атомов одного типа, тогда как соединение состоит из разных элементов в определенных пропорциях. Примеры элементов включают железо, медь, водород и кислород. Примеры соединений включают воду (H 2 O) и соль (хлорид натрия – NaCl).
Примеры соединений включают воду (H 2 O) и соль (хлорид натрия – NaCl).
Элементы перечислены в соответствии с их атомным номером в периодической таблице. Среди 117 известных элементов 94 встречаются в природе, такие как углерод, кислород, водород и т. д. 22 созданы искусственно, претерпев радиоактивные изменения. Причиной этого является их нестабильность, из-за которой они подвергаются радиоактивному распаду в течение определенного периода времени с образованием новых элементов в процессе, таких как уран, торий, висмут и т. д. Элементы объединяются в фиксированных соотношениях и образуют стабильные соединения благодаря химическим связям. которые облегчают образование соединений.
Сравнительная таблица
| Соединение | Элемент | |
|---|---|---|
| Определение | Соединение содержит атомы различных элементов, химически объединенных вместе в фиксированном соотношении. | Элемент — это чистое химическое вещество, состоящее из атомов того же типа. |
| Состав | Соединения содержат различные элементы в фиксированном соотношении, расположенные определенным образом посредством химических связей. Они содержат только один тип молекулы. Элементы, входящие в состав соединения, химически связаны. | Элементы содержат только один тип атома. Каждый атом имеет одинаковый атомный номер, то есть одинаковое количество протонов в ядре. |
| Способность к разрушению | Соединение можно разделить на более простые вещества с помощью химических методов/реакций. | Элементы не могут быть разделены на более простые вещества с помощью химических реакций. |
| Представление | Соединение представляется с использованием его химической формулы, которая представляет собой символы составляющих его элементов и количество атомов каждого элемента в одной молекуле соединения. | Элемент представлен с помощью символов. |
| Типы | Можно создать огромное, практически безграничное количество химических соединений. Соединения подразделяются на молекулярные соединения, ионные соединения, интерметаллические соединения и комплексы. | Наблюдено около 117 элементов. Могут быть классифицированы как металлические, неметаллические или металлоидные. |
| Примеры | Вода (h3O), хлорид натрия (NaCl), бикарбонат натрия (NaHCO3) и соляная кислота (HCl) являются примерами соединений. | Водород (H), кислород (O), натрий (Na), хлор (Cl), углерод (C), железо (Fe), медь (Cu), серебро (Ag) и золото (Au) являются примерами элементов. . |
Различия в свойствах
Элементы различаются по названию, символу, атомному номеру, температуре плавления, температуре кипения, плотности и энергии ионизации. В Периодической таблице элементы располагаются в соответствии с их атомным номером, и они сгруппированы в соответствии с аналогичными химическими свойствами и изображаются их символами.
В Периодической таблице элементы располагаются в соответствии с их атомным номером, и они сгруппированы в соответствии с аналогичными химическими свойствами и изображаются их символами.
- Атомный номер – атомный номер обозначается буквой Z и представляет собой количество протонов, присутствующих в ядре атома элемента. Например, углерод имеет 6 протонов в своем ядре, а для углерода Z = 6. Количество протонов также указывает на электрический заряд или количество электронов, присутствующих в ядре, которое определяет химические свойства элемента.
- Атомная масса – буква А обозначает атомную массу элемента, которая представляет собой общее количество протонов и нейтронов в ядре атома элемента. Изотопы одних и тех же элементов различаются атомными массами.
- Изотопы – изотопы элемента имеют одинаковое количество протонов в ядре, но отличаются количеством нейтронов. Встречающиеся в природе элементы имеют более одного стабильного изотопа.
 Таким образом, изотопы имеют сходные химические свойства (из-за одинакового количества протонов), но разные ядерные свойства (из-за разного количества нейтронов). Например, углерод имеет три изотопа: углерод-12, углерод-13 и углерод-14.
Таким образом, изотопы имеют сходные химические свойства (из-за одинакового количества протонов), но разные ядерные свойства (из-за разного количества нейтронов). Например, углерод имеет три изотопа: углерод-12, углерод-13 и углерод-14. - Аллотропы – атомы элемента могут образовывать связи друг с другом более чем одним способом, что приводит к различиям в их химических свойствах. Например, углерод связывается в тетраэдр, образуя алмаз, а слои шестиугольников углерода образуют графит.
Соединения состоят из различных элементов в фиксированной пропорции. Например, 1 атом натрия (Na) соединяется с 1 атомом хлора (Cl) с образованием одной молекулы соединения хлорида натрия (NaCl).
Элементы в соединении не всегда сохраняют свои первоначальные свойства и не могут быть разделены физическими средствами. Объединению элементов способствует их валентность. Валентность определяется как количество необходимых атомов водорода, которые могут соединиться с атомом элемента, образующего соединение. Большинство соединений могут существовать в твердом состоянии (достаточно низкие температуры) и могут разлагаться при нагревании. Иногда посторонние элементы задерживаются внутри кристаллической структуры соединений, придавая им неоднородную структуру. Соединения изображаются по их химической формуле, которая соответствует системе Хилла, в которой атомы углерода перечислены первыми, за которыми следуют атомы водорода, после чего элементы перечислены в алфавитном порядке.
Валентность определяется как количество необходимых атомов водорода, которые могут соединиться с атомом элемента, образующего соединение. Большинство соединений могут существовать в твердом состоянии (достаточно низкие температуры) и могут разлагаться при нагревании. Иногда посторонние элементы задерживаются внутри кристаллической структуры соединений, придавая им неоднородную структуру. Соединения изображаются по их химической формуле, которая соответствует системе Хилла, в которой атомы углерода перечислены первыми, за которыми следуют атомы водорода, после чего элементы перечислены в алфавитном порядке.
Визуализация различий
На этом рисунке показаны различия между элементами и соединениями на атомарном уровне. Элементы имеют только 1 тип атомов; соединения имеют более 1. Элементы и соединения являются веществами; они отличаются от смесей, в которых разные вещества смешиваются друг с другом, но не посредством атомных связей.
Визуализация различий между элементами, соединениями и смесями, как гомогенными, так и гетерогенными.
История элементов и соединений
Элементы изначально использовались для обозначения любого состояния материи, такого как жидкость, газ, воздух, твердое тело и т. д. Индийские, японские и греческие традиции относятся к пяти элементам, а именно: воздуху, воде, земле, огню и эфиру. Аристотель концептуализировал новый пятый элемент, названный «квинтэссенцией», который, по-видимому, сформировал небеса. По мере продолжения исследований многие выдающиеся ученые проложили путь к современному пониманию и описанию элементов. Среди них особенно выделяются работы Роберта Бойля, Антуана Лавуазье, Дмитрия Менделеева. Лавуазье первым составил список химических элементов, а Менделеев первым расположил элементы в соответствии с их атомными номерами в периодической таблице. Самое современное определение элемента дано в исследованиях, проведенных Генри Мозли, в которых говорится, что атомный номер атома физически выражается зарядом его ядра.
До 1800-х годов использование термина соединение также могло означать смесь. Именно в 19 веке значение соединения можно было отличить от смеси. Такие алхимики, как Джозеф Луи Пруст, Дальтон и Бертолле, и их исследования различных соединений дали современной химии нынешнее определение соединения. Работа Пруста продемонстрировала миру химии, что соединения состоят из постоянного состава соответствующих элементов.
Именно в 19 веке значение соединения можно было отличить от смеси. Такие алхимики, как Джозеф Луи Пруст, Дальтон и Бертолле, и их исследования различных соединений дали современной химии нынешнее определение соединения. Работа Пруста продемонстрировала миру химии, что соединения состоят из постоянного состава соответствующих элементов.
Номер CAS
Каждое химическое вещество идентифицируется своим уникальным числовым идентификатором – номером CAS (служба химических рефератов). Следовательно, каждое химическое соединение и элемент имеют номер CAS. Это делает поиск элементов и соединений в базе данных более удобным.
Ссылки
- Химический элемент – Википедия
- Химическое соединение – Википедия
- Подписаться
- Поделиться
- Укажите
- Авторы
Поделитесь этим сравнением:
Если вы дочитали до этого места, подписывайтесь на нас:
«Соединение против элемента». Diffen.com. Diffen LLC, nd Веб. 7 сентября 2022 г. < >
Diffen.com. Diffen LLC, nd Веб. 7 сентября 2022 г. < >
Какие химические элементы содержатся в организме человека?
Реджинальд Дейви Рецензию написала София Ковени
Химические элементы являются строительным материалом жизни. Они составляют ошеломляющее разнообразие молекул, которые объединяются в ДНК, клеточные органеллы, клетки, ткани и органы. В этой статье мы обсудим те элементы, которые присутствуют в человеческом теле, их пропорции и различные основные функции, которые они выполняют.
Изображение предоставлено: bestber/Shutterstock.com
Элементы, из которых состоит человеческое тело
Во всех смыслах и целях тело представляет собой чрезвычайно сложный механизм. Для этого требуется множество частей, работающих вместе в сложных отношениях от микро- до макромолекулярного уровня. Строение строительных блоков, составляющих сумму таких частей, как белки и нуклеиновые кислоты, определяется соотношением и взаимодействием химических элементов.
Некоторые элементы встречаются гораздо чаще, чем другие. Человеческое тело примерно на 99% состоит всего из шести элементов: кислорода, водорода, азота, углерода, кальция и фосфора. Еще пять элементов составляют около 0,85% оставшейся массы: сера, калий, натрий, хлор и магний. Все эти 11 элементов являются важными элементами.
Оставшиеся 0,15% человеческого тела состоят из микроэлементов. Суммарная масса микроэлементов не соответствует массе магния, который является наименее распространенным из неследовых элементов. Некоторые из микроэлементов (около дюжины или около того) могут быть необходимы для жизни, если верить лабораторным данным.
Функция химических элементов в организме
Большинство химических элементов, присутствующих в организме человека, играют жизненно важную роль. Некоторые микроэлементы, такие как титан и цезий, могут быть загрязнителями. Некоторые, такие как свинец, ртуть, мышьяк и кадмий, являются активными токсинами в зависимости от присутствующего количества.
Основные элементы в организме человека выполняют следующие функции в процентах от массы:
КислородКислород является наиболее распространенным элементом в организме человека, составляющим приблизительно 65,0% массы тела. Большая часть присутствующего кислорода находится в форме воды. Кислород играет решающую роль в обмене веществ и дыхании, и этот элемент содержится в каждой основной органической молекуле в организме, включая белки, углеводы, жиры и нуклеиновые кислоты.
УглеродУглерод — следующий по распространенности элемент в организме человека, составляющий 18% массы тела. Его роль в основном структурная, образуя «костяк» многих органических молекул.
Водород Водород является самым распространенным элементом во Вселенной (около 75% общей массы) и составляет около 10% массы человеческого тела. Он присутствует в форме воды (наряду с кислородом), а также является важным элементом в органических молекулах.
Азот составляет 3% массы тела человека. Он содержится во всех организмах в таких молекулах, как аминокислоты (из которых состоят белки), нуклеиновые кислоты (ДНК и РНК) и аденозинтрифосфат (АТФ), важная молекула переноса энергии.
КальцийПохожие статьи
- Курение и риск заражения SARS-CoV-2 и COVID-19
- Испанское исследование обнаружило следы загрязнения окружающей среды в грудном молоке
- Воздействие нетрадиционных месторождений нефти и газа увеличивает риск острого лимфобластного лейкоза у детей
Кальций является наиболее распространенным металлом в организме человека, его содержание составляет около 1,4% по массе. Возможно, его наиболее известная функция заключается в формировании костей и зубов, а недостаток кальция в рационе может привести к различным дегенеративным состояниям. Другие важные роли в организме человека включают синтез белка, поддержание разности потенциалов на клеточных мембранах и действие в качестве вторичных мессенджеров в путях передачи сигнала.
Фосфор обладает высокой реакционной способностью, и из-за этого свойства он никогда не встречается на Земле в виде свободного элемента. Фосфаты необходимы для жизни, и эта связанная форма фосфора является основным компонентом основных органических молекул, таких как фосфолипиды, АТФ и нуклеиновые кислоты. Он составляет 1,1% от общей массы тела человека.
КалийКалий составляет менее 1% массы тела. Он играет жизненно важную роль в передаче нервных импульсов посредством переноса ионов калия через мембраны нервных клеток.
СераДесятый по распространенности элемент во Вселенной и пятый по распространенности на Земле, сера играет важную роль в организме человека. В организме почти всегда находится в виде сульфидов металлов и сероорганических соединений. Сера также является основным структурным элементом белкового кератина, который содержится в коже и волосах.
Натрий Натрий, щелочной металл, обычно содержится в соли. Ионы натрия способствуют осмотическому давлению, поскольку они являются основным катионом внеклеточной жидкости (ECF). Натрий также играет ключевую роль в передаче нервных импульсов.
Ионы натрия способствуют осмотическому давлению, поскольку они являются основным катионом внеклеточной жидкости (ECF). Натрий также играет ключевую роль в передаче нервных импульсов.
Хлор играет важную роль в поддержании кислотно-щелочного баланса крови, а также в формировании сухожилий, зубов и костей. Он обычно содержится в солях и в сочетании с калием и натрием в организме. Он также способствует функции печени и помогает устранять органические отходы.
МагнийМагний является наименее распространенным из основных элементов в организме человека. Около 300 или около того ферментов требуют ионов магния для правильного функционирования, а ионы магния взаимодействуют с такими соединениями, как ДНК, РНК и АТФ.
Микроэлементы Микроэлементы играют множество ролей, некоторые из них более важны, чем другие, в то время как другие не выполняют никакой заметной функции. Некоторые активно токсичны для человека.
Тремя наиболее распространенными незаменимыми микроэлементами являются железо, фтор и цинк. Железо играет важную роль в здоровье человека как часть гемоглобина, который транспортирует кислород по телу в крови. Фтор важен для зубов. Цинк необходим для более чем 300 ферментов и 1000 факторов транскрипции и жизненно важен для здоровья глаз и роста репродуктивных органов.
Изображение предоставлено: Aldona Griskeviciene/Shutterstock.com
В заключение
Основным источником всех этих элементов является диета. Некоторые элементы более важны, чем другие, и они находятся в ошеломляющем множестве соединений и молекул в организме человека.
Некоторые из них могут даже причинять активный вред организму, а уровни, в которых они присутствуют в организме, могут определять, насколько опасны последствия. Соотношения химических элементов варьируются от человека к человеку в зависимости от самых разных факторов, но, как правило, они в основном одинаковы у разных видов.
Из каких элементов состоят люди?
Источники
- Основные элементы человеческого тела. Общественный колледж Остина. Доступно по адресу: www.austincc.edu/…/Basic%20Elements.pdf
- Роль кислорода в организме человека. Инициатива сторонников защиты окружающей среды. Доступно по адресу: https://enviroppi.org/role-of-oxygen-in-a-human-body/ .
Периодическая таблица химических элементов
Периодическая таблица химических элементов похожа на химический алфавит. Подобно буквам в алфавите, элементы могут комбинироваться и реагировать разными способами.
Фактически, перестановок всех возможных химических комбинаций элементов больше, чем предполагаемое количество атомов в видимой Вселенной!
Если мы включим инертные газы в перестановки, то будет 6,62×10184 возможностей. Из этих возможностей возникла сложная химия жизни. Для сравнения, расчетное общее верхнее число атомов во Вселенной составляет всего около 1×1082, или сто тысяч квадриллионов вигинтиллион атомов.
Вы можете предсказать некоторые реакции и сочетания элементов, если знаете их свойства на основе таблицы Менделеева. И если вы знакомы с тем, как организована таблица, вы можете описать по крайней мере некоторые свойства элемента, просто взглянув на его положение в таблице.
В этом сообщении:
Что такое периодическая таблица?
В периодической таблице все известные элементы распределены по периодам и группам, которые соответствуют определенным химическим свойствам.
Тенденции сразу бросаются в глаза, если вы понимаете, как устроена таблица Менделеева.
Вот некоторые свойства и тенденции химических элементов, перечисленных в периодической таблице:
- Атомный радиус — Вы можете определить радиус атома, измерив расстояние между двумя ядрами ионной связи. Радиус атома имеет тенденцию к уменьшению при перемещении слева направо по таблице. Она увеличивается по мере продвижения сверху вниз.
- Энергия ионизации — это энергия, необходимая для удаления электрона с внешней орбиты газообразного атома или иона.
 Энергия ионизации увеличивается при движении слева направо и уменьшается сверху вниз по таблице Менделеева.
Энергия ионизации увеличивается при движении слева направо и уменьшается сверху вниз по таблице Менделеева. - Сродство к электрону . В отличие от энергии ионизации, сродство к электрону представляет собой количество энергии, высвобождаемой при присоединении электрона к атому. Сродство к электрону увеличивается слева направо по периодической таблице.
- Электроотрицательность – Электроотрицательность показывает, насколько хорошо атом может притягивать пару связывающих электронов в молекулах. Сила электроотрицательности атома увеличивается среди элементов по мере движения слева направо по периоду.
- Металлические характеристики – Металлы являются хорошими проводниками тепла и электричества. Они пластичны, податливы и, за исключением ртути, тверды. Металлические характеристики элементов увеличиваются по диагонали справа налево.
Для чего используется периодическая таблица?
Периодическая таблица используется химиками и другими учеными в качестве всеобъемлющего справочного источника.
Очень полезно знать относительные свойства элементов и уметь предсказывать их реакционную способность на основе их положения в периодической таблице.
Например, периодическую таблицу можно использовать для предсказания и сравнения энергии ионизации различных элементов. Конкретные детали, такие как атомный вес и значения электроотрицательности, также можно найти довольно легко.
Печатные периодические таблицы могут содержать лишь очень ограниченный объем информации, не становясь при этом чрезвычайно большими и непрактичными. Однако цифровые периодические таблицы не ограничены физическим пространством. Это означает, что они могут предоставить больше информации, включая видеоконтент. Некоторые цифровые периодические таблицы также являются интерактивными и позволяют вам щелкнуть символ элемента, чтобы просмотреть дополнительные сведения.
Как расположены элементы в периодической таблице?
Как следует из названия, элементы периодической таблицы расположены в виде периодов или рядов с возрастающим атомным номером. Есть семь периодов.
Есть семь периодов.
Также имеется 18 «групп», представленных разными столбцами. Для каждого периода характерны определенные тенденции, например увеличение сродства к электрону. Группы классифицируют элементы на основе их общих свойств. Например, группа 15 (5А) — это колонка для инертных газов, которые являются наименее реакционноспособными элементами.
Периоды в основном представляют количество орбиталей. Элементы, принадлежащие к одному периоду, имеют одинаковое количество орбиталей. Это означает, что вы также можете записать электронную конфигурацию этих элементов. Электронная конфигурация описывает, как электроны распределяются по орбиталям.
- Период 1: одна орбиталь, два элемента
- Период 2: две орбитали, восемь элементов
- Период 3: три орбитали, восемь элементов
- Период 4: четыре орбитали, 18 элементов
- Период 5: пять орбиталей, 18 элементов
- Период 6: шесть орбиталей, 32 элемента
- Период 7: семь орбиталей, 32 элемента
Сколько групп в периодической таблице?
Периодическая таблица элементов имеет 18 групп, каждая из которых представляет определенный набор свойств. Все элементы в определенной группе или столбце имеют одинаковое количество валентных электронов.
Все элементы в определенной группе или столбце имеют одинаковое количество валентных электронов.
- Группа 1 : Эта группа известна как щелочные металлы, за исключением водорода. Эти металлы очень реакционноспособны и очень чувствительны к воде, поэтому они встречаются во многих соединениях. Каждый элемент имеет только один валентный электрон.
- Группа 2 : Щелочноземельные металлы являются вторыми наиболее реакционноспособными металлами. Они также являются очень хорошими восстановителями. Щелочноземельные металлы отдают электроны в ходе химических реакций. Каждый элемент этой группы имеет два валентных электрона.
- Группы 3-12 : Также известные как переходные металлы, элементы этих групп образуют две или более степеней окисления. Эти металлы относительно стабильны и не так активны, как щелочные и щелочноземельные металлы. Большинство переходных металлов прочны и тверды, но податливы. Они также блестящие и имеют высокую температуру плавления.
 Переходные металлы являются хорошими проводниками электричества и тепла. У каждого из них по два валентных электрона.
Переходные металлы являются хорошими проводниками электричества и тепла. У каждого из них по два валентных электрона. - Группа 13 : Это группа бора. Элементы этой категории имеют три валентных электрона. Они также обладают металлоидными или металлическими свойствами. Элементами этой группы являются бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Tl) и нихоний (Nh).
- Группа 14 : Эта группа называется углеродной и включает углерод (C), кремний (Si), германий (Ge), олово (Sn), свинец (Pb) и флеровий (Fl). Каждый из этих элементов имеет пять валентных электронов. Большинство этих элементов довольно распространены в земной коре. Углерод является наиболее важным элементом, потому что он служит основой органических соединений и самой жизни.
- Группа 15 : Это азотная группа элементов. К элементам этой группы относятся азот (N), фосфор (P), мышьяк (As), сурьма (Sb), висмут (Bi) и московий (Mc).
 Каждый из этих элементов имеет шесть валентных электронов. Они имеют общее химическое поведение, но их физические свойства различаются.
Каждый из этих элементов имеет шесть валентных электронов. Они имеют общее химическое поведение, но их физические свойства различаются. - Группа 16 : Эта группа известна как кислородное семейство или халькогены. К этой группе относятся кислород (O), сера (S), селен (Se), теллур (Te), полоний (Po) и ливерморий (Lv). Каждый из этих элементов имеет шесть валентных электронов.
- Группа 17 : Это группа галогенов, названная в честь их способности образовывать соли. Этимология имени греческая: hal или соль и -gen, что означает формировать. К элементам этой группы относятся фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Они очень реактивны с щелочными металлами и щелочноземельными металлами. Каждый элемент имеет семь валентных электронов.
- Группа 18 : Известные также как благородные газы, элементы этой группы очень стабильны, поскольку все они имеют восемь валентных электронов.
 К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe), радон (Rn) и оганесон (Og). Они наименее реакционноспособны из всех элементов и в основном находятся в элементарном состоянии. Из этих элементов в природе образуется очень мало соединений.
К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe), радон (Rn) и оганесон (Og). Они наименее реакционноспособны из всех элементов и в основном находятся в элементарном состоянии. Из этих элементов в природе образуется очень мало соединений.
История периодической таблицы
С древних времен философы задавались вопросом об окончательном или фундаментальном составе материи. Например, греческий философ Аристотель считал, что в природе всего четыре элемента: земля, воздух, вода и огонь.
Древние греки считали, что четыре элемента: земля, воздух, вода и огонь составляют всю материю.
Эта вера стала основой алхимии и даже медицины на тысячи лет. Однако эта идея была опровергнута открытием многих других элементов. Эти прорывы также показали, что так называемые четыре элемента были не элементами, а скорее смесями и соединениями.
Первая научная попытка классифицировать элементы восходит к Антуану Лавуазье в 1789 году. . Он попытался классифицировать элементы, сгруппировав их в газы, неметаллы и земли. Эти группы все еще существуют в современной периодической таблице элементов.
. Он попытался классифицировать элементы, сгруппировав их в газы, неметаллы и земли. Эти группы все еще существуют в современной периодической таблице элементов.
Прошло более четырех десятилетий, прежде чем триада элементов была признана другим ученым, Иоганном Доберейнером. В 1829 году он понял, что элементы можно разделить на три группы в зависимости от их свойств. Это означало, что свойства среднего элемента можно было предсказать на основе двух известных элементов триады. Похоже, Доберейнер имел представление о периодичности.
Прошло три десятилетия, прежде чем был достигнут настоящий прогресс в открытии периодичности элементов. Именно во время конференции в Германии в 1860 году научному сообществу стал доступен точный список атомных масс элементов.
Кто изобрел периодическую таблицу?
Периодическую таблицу химических элементов не придумал никто. Скорее, нынешнее расположение элементов в периодической таблице было обнаружено и разработано несколькими учеными в течение нескольких десятилетий.
Разработка современной периодической таблицы элементов в основном принадлежит следующим ученым: винт), опубликованный в 1862 году. Он был основан на известных атомных весах элементов. В результате на диаграмме выстроились элементы со схожими свойствами.
Джон Ньюлендс. Примерно за четыре года до того, как Менделеев опубликовал свою периодическую таблицу химических элементов (см. ниже), Ньюлендс предложил Закон Октав, основанный на сходстве элементов, вес которых различается на семь единиц. Однако его система была неуклюжей и не предусматривала пробелов для неоткрытых элементов. Его также критиковали за излишнюю произвольность.
Юлий Лотар Мейер. Технически Мейеру можно было приписать идею современной периодической таблицы химических элементов. Однако его работа была опубликована намного позже открытий Менделеева. Мейер сгруппировал элементы по их валентности и в порядке атомного веса. Его таблица была очень похожа на таблицу Менделеева.
Дмитрий Менделеев – Менделеев считается отцом современной периодической таблицы элементов. Подобно ученым до него, он расположил элементы по их атомному весу, но заметил некоторые несоответствия. Вместо этого он сгруппировал их в соответствии с их химическими свойствами. Однако истинная гениальность его открытия заключалась в том, что он включал пробелы, представляющие неоткрытые элементы.
Подобно ученым до него, он расположил элементы по их атомному весу, но заметил некоторые несоответствия. Вместо этого он сгруппировал их в соответствии с их химическими свойствами. Однако истинная гениальность его открытия заключалась в том, что он включал пробелы, представляющие неоткрытые элементы.
Генри Мозли. Главный вклад Мозли заключался в упорядочении элементов по их атомному номеру, а не по атомному весу. Хотя веса хорошо соответствуют атомному номеру с точки зрения периодичности свойств, были некоторые исключения. Мозли разрешил это противоречие.
Периодическая таблица в 2022 году
Современная таблица Менделеева включает 92 природных элемента и 26 синтетических элементов. По мере увеличения атомного номера атом становится менее стабильным. Синтетические элементы существуют мгновенно во время атомных столкновений. Они слишком нестабильны, чтобы существовать в большом количестве, а некоторые из них могут быть получены только из нескольких атомов.
Текущая таблица Менделеева не меняется уже несколько лет. Самые новые элементы в периодической таблице:
Самые новые элементы в периодической таблице:
- Нигоний (Nh) – атомный номер 113
- Московий (Mc) – атомный номер 115
- Теннессин (Ts) – атомный номер 117
- Оганесон (Ог) – атомный номер 118.
Заявление об отказе от ответственности
Весь контент, опубликованный в блоге ReAgent.co.uk, предназначен только для информации. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования предоставленной информации. Кроме того, мы не рекомендуем использовать какие-либо химические вещества, не ознакомившись с Паспортом безопасности материала (MSDS), который можно получить у производителя. Вы также должны следовать всем советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть вопросы, связанные со здоровьем и безопасностью, посетите HSE.

 Слово в переводе с иностранного обозначает «жёлтое».
Слово в переводе с иностранного обозначает «жёлтое».
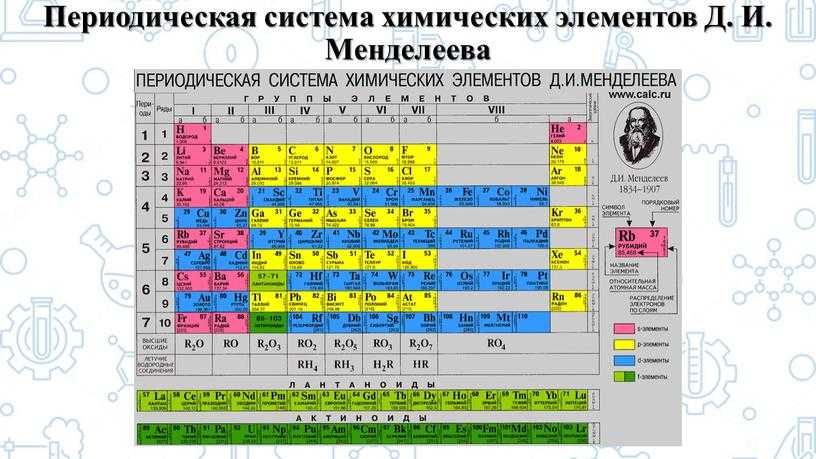 Однако они расположены на противоположных краях, так как принадлежат к разным группам.
Однако они расположены на противоположных краях, так как принадлежат к разным группам. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.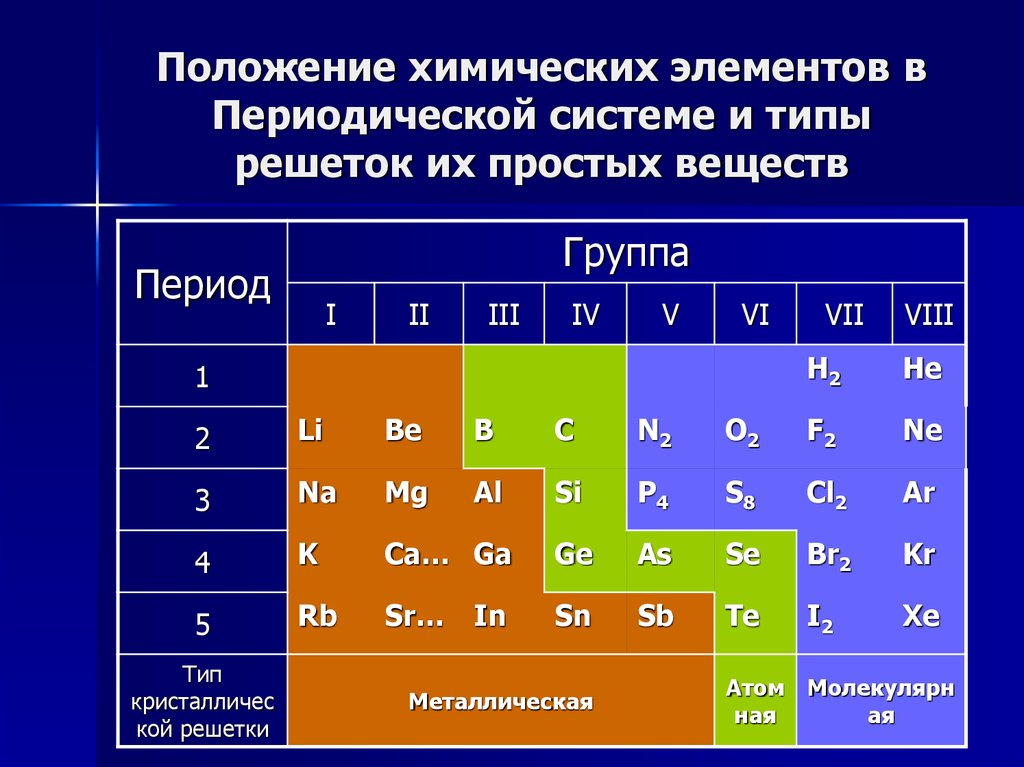

 Элементы имеют атомные номера от 1 до 118.
Элементы имеют атомные номера от 1 до 118..jpeg) Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».