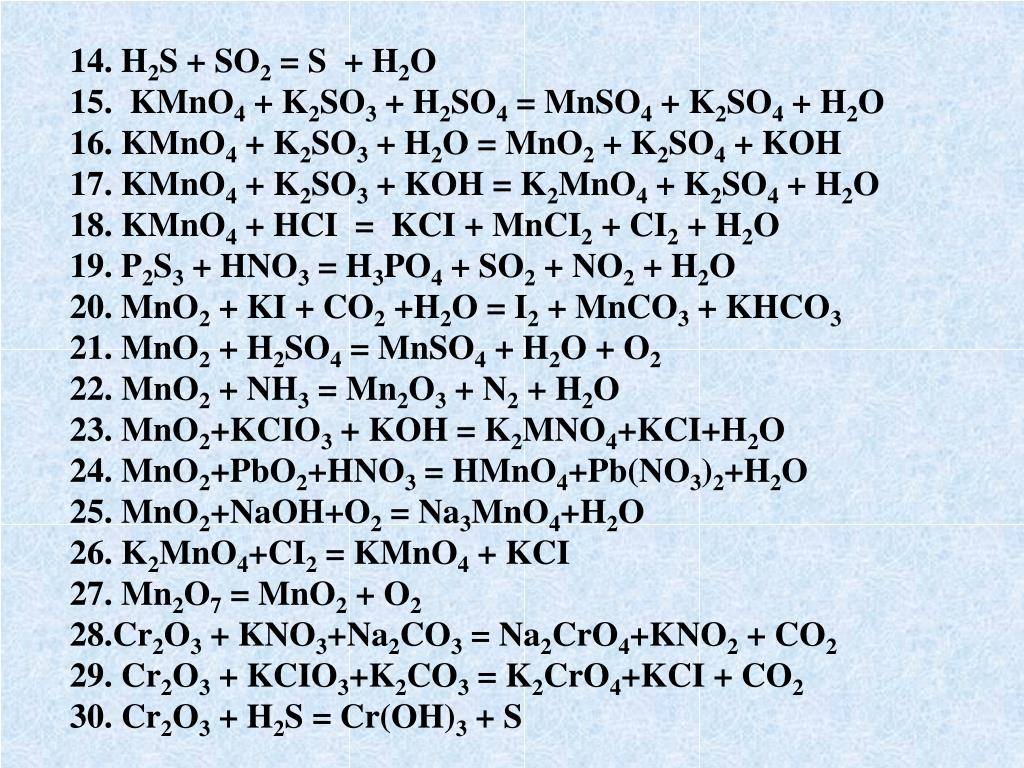Как сдать ЕГЭ по химии
<<Лид>>
Екатерина Корсакова,
преподаватель химии в «Фоксфорде»
Как ставят баллыВ ЕГЭ по химии 34 задания. Из них 28 заданий с кратким ответом и 6 с развёрнутым ответом.
1 балл: задания 1–5 , 9–13, 16–21 и 25–28. Задание считается выполненным, если дан правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
2 балла: задания 6–8, 14, 15, 22–24 считаются выполненными верно, если правильно указана последовательность цифр. За полный правильный ответ на каждое из заданий 6–8, 14, 15, 22–24 ставится 2 балла; если допущена одна ошибка — 1 балл; за неверный ответ (более одной ошибки) или его отсутствие — 0 баллов.
2-5 баллов: решение задач с развёрнутым ответом — при условии, что задание выполнено полностью и верно в соответствии с критериями оценивания. Здесь необходимо правильно оформить решение задачи и прописать всю последовательность действий, чтобы экзаменатору было ясно, как и почему вы пришли к решению.
Здесь необходимо правильно оформить решение задачи и прописать всю последовательность действий, чтобы экзаменатору было ясно, как и почему вы пришли к решению.
Подготовка к экзаменуНа что стоит обратить внимание:
— Обязательно изучите кодификатор и спецификацию ЕГЭ по химии на сайте ФИПИ. Там указаны все темы, которые вы должны знать, количество баллов за решение каждого задания и критерии оценивания.
— В 2023-м некоторые старые задания усложнились. Например, появились скелетные формулы соединений и нелинейные цепочки реакций. Поэтому подготовка лишь по материалам прошлых лет будет неудачной стратегией. Используйте классическую школьную литературу, учебники углублённого курса химии, пособия для абитуриентов и материалы с сайта ФИПИ.
Задание 32 из демонстрационной версии ЕГЭ-2023
— Демонстрационная версия ЕГЭ всегда легче той, что будет на экзамене. Она отражает лишь темы и формат заданий.
— Чтобы уверенно чувствовать себя на ЕГЭ, необходимо решать сложные задачи и не только формата экзамена.
— Во время подготовки к ЕГЭ не зацикливайтесь на одном авторе. У всех авторов учебников есть любимые темы и форматы задач. Чем больше заданий из разных учебников вы решите, тем проще вам будет на экзамене. Активно решать тесты стоит начать с марта, а до этого большую часть времени посвящать теоретическому материалу и практике.
— Чтобы написать ЕГЭ на хорошем уровне, нужно знать не только основные принципы и законы, которые мы используем при написании химической реакции или когда говорим о свойстве соединений. Нужно хорошо ориентироваться в исключениях. В химии очень много исключений, которые надо просто выучить и не пропустить от невнимательности, решая задачу.
<<Лидген для статьи>>
Организационные моментыНа выполнение заданий даётся три с половиной часа. При хорошей подготовке трёх часов вполне достаточно. У вас останется ещё 30 минут, чтобы всё проверить.
На ЕГЭ разрешается пользоваться калькулятором, в том числе инженерным. Главное, чтобы он не был программируемым. На всякий случай возьмите с собой два калькулятора: инженерный и обычный. Если инженерный всё-таки заберут, вам всё равно не придётся терять время, считая в столбик. Начните пользоваться калькулятором ещё при подготовке к экзамену, чтобы привыкнуть к нему и не ошибаться, нажимая на клавиши.
Главное, чтобы он не был программируемым. На всякий случай возьмите с собой два калькулятора: инженерный и обычный. Если инженерный всё-таки заберут, вам всё равно не придётся терять время, считая в столбик. Начните пользоваться калькулятором ещё при подготовке к экзамену, чтобы привыкнуть к нему и не ошибаться, нажимая на клавиши.
На экзамене можно пользоваться периодической системой Менделеева, таблицей растворимостей солей, кислот и оснований в воде, а также электрохимическим рядом напряжений металлов. Скачайте эти материалы заранее и потренируйтесь ими пользоваться. Таблица Менделеева на экзамене отличается от школьных таблиц, раскрашенных разными цветами. Особое внимание обратите на главную и побочную подгруппы: в таблицах ЕГЭ они не подписаны, а определять их по принципу «справа и слева» — неверно.
Периодическая система химических элементов Д.И. МенделееваРастворимость кислот, солей и оснований в воде и электрохимический ряд напряжений металлов
Заложите не меньше часа для переноса выполненной работы на чистовик. При проверке и оценивании ЕГЭ черновики не учитываются.
При проверке и оценивании ЕГЭ черновики не учитываются.
Результаты первой части ЕГЭ по химии не пересматриваются. А вот результаты второй части могут быть пересмотрены, если вы подадите апелляцию. По итогам апелляции вам могут добавить баллы. Случаи, когда после апелляции баллы снимают, очень редки, поэтому если вы уверены, что решили верно, смело подавайте заявление. Если сомневаетесь — посоветуйтесь с преподавателем или старшими товарищами, хорошо знающими химию.
Советы по решению задач✔️ Внимательно читайте условие задачи и записывайте номера выбранных вариантов именно в той последовательности, которая от вас требуется. Иначе балл за задание не засчитают, даже если номера вариантов будут выбраны правильно. Лучше всего подчёркивать в тексте формулировки «в порядке возрастания» и «в порядке убывания» — так вы точно их не пропустите.
✔️ Выполняя задания по неорганической химии, нужно знать не только то, как взаимодействует каждый класс элементов, но и то, в какие реакции вступает каждый элемент. У каждого элемента есть свои особенности, которые надо выучить.
У каждого элемента есть свои особенности, которые надо выучить.
✔️ Всегда проверяйте все варианты, которые вам предложены. Если в задании написано «найдите все правильные ответы» — значит их точно больше одного. Даже если вам кажется, что вы нашли верный, вы можете ошибаться. Если вы исключили все варианты, не выбирайте последний «по умолчанию», решите и его тоже. Убедитесь, что он верный.
✔️ Записывая реакции, не забывайте уравнивать все элементы. С помощью кислорода вы можете проверить, верно ли вы всё уравняли. Если кислород сошёлся, значит, всё правильно, если нет — ищите ошибку.
✔️ В задачах с развёрнутым ответом может быть только один правильный вариант ответа, а может быть и несколько. Если вы видите два способа решения задачи, выбирайте тот, в котором меньше всего сомневаетесь.
✔️ Если требуется один вариант ответа, а вы видите несколько, пишите один вариант, в котором вы уверены.
✔️ В задачах с развёрнутым ответом всегда записывайте «дано». Это не добавит вам баллов, но поможет успокоиться, упорядочить условие задачи и разобраться, что от вас требуется.
Это не добавит вам баллов, но поможет успокоиться, упорядочить условие задачи и разобраться, что от вас требуется.
✔️ Если вы не знаете ответ на задание с кратким ответом, пропустите его и вернитесь к нему после того, как выполните все задания, включая задачи с развёрнутым ответом. Подумайте ещё раз, что там должно быть, и дайте ответ.
✔️ Помните, что задания с кратким ответом проверяет компьютер. Округляйте ответ с точностью, указанной в условии задания, иначе вам его не засчитают.
✔️ В задачах с развёрнутым ответом всегда записывайте «дано». Это не добавит вам баллов, но поможет успокоиться, упорядочить условие задачи и разобраться, что от вас требуется.
✔️ При их решении задач 24 и 25 ведите таблицы с наблюдениями за экспериментом. Кроме того, что так процесс решения станет более наглядным, этот навык точно пригодится вам в будущем.
✔️ Используйте не только знание химии, но и логику.
✔️ Хорошо подготовиться к ЕГЭ при одном уроке химии в неделю практически невозможно — это отмечают сами авторы экзамена. Чтобы чувствовать себя уверенно, присоединяйтесь к нашим экспресс-курсам по подготовке к ЕГЭ.
Чтобы чувствовать себя уверенно, присоединяйтесь к нашим экспресс-курсам по подготовке к ЕГЭ.
Свойства углеводородов | ЕГЭ по химии
Алканы
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле $С_{n}Н_{2n+2}$.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп $СН_2$.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан:
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК:
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи.
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—$СН_3$), затем пропил ($—СН_2—СН_2—СН_3$), этил ($—СН_2—СН_3$) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую ($2. 2-$). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
2-$). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
Названия веществ, структурные формулы которых приведены выше, следующие:
— структура А: $2$-метилпропан;
— структура Б: $3$-этилгексан;
— структура В: $2,2,4$-триметилпентан;
— структура Г: $2$-метил $4$-этилгексан.
Физические и химические свойства алканов
Физические свойства. Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах газа, почувствовав который, надо звонить $104$, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от $С_5Н_{12}$ до $С_{15}Н_{32}$ — жидкости; более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства.
1. Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
$CH_4+Cl_2→CH_3Cl+HCl$.
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
$CH_3Cl+Cl_2→HCl+{CH_2Cl_2}↙{\text”дихлорметан(хлористый метилен)”}$,
$CH_2Cl_2+Cl_2→HCl+{CHСl_3}↙{\text”трихлорметан(хлороформ)”}$,
$CHCl_3+Cl_2→HCl+{CCl_4}↙{\text”тетрахлорметан(четыреххлористый углерод)”}$.
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). В ходе пропускания алканов над катализатором ($Pt, Ni, Al_2O_3, Cr_2O_3$) при высокой температуре ($400–600°С$) происходит отщепление молекулы водорода и образование алкена:
$CH_3—CН_3→СH_2=CH_2+Н_2↑$
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
$СН_4+2О_2→СО_2+2Н_2O+880 кДж.$
В общем виде реакцию горения алканов можно записать следующим образом:
$C_{n}H_{2n+2}+({3n+1}/{2})O_2→nCO_2+(n+1)H_2O$
Термическое расщепление углеводородов:
$C_{n}H_{2n+2}{→}↖{400-500°C}C_{n-k}H_{2(n-k)+2}+C_{k}H_{2k}$
Процесс протекает по свободнорадикальному механизму.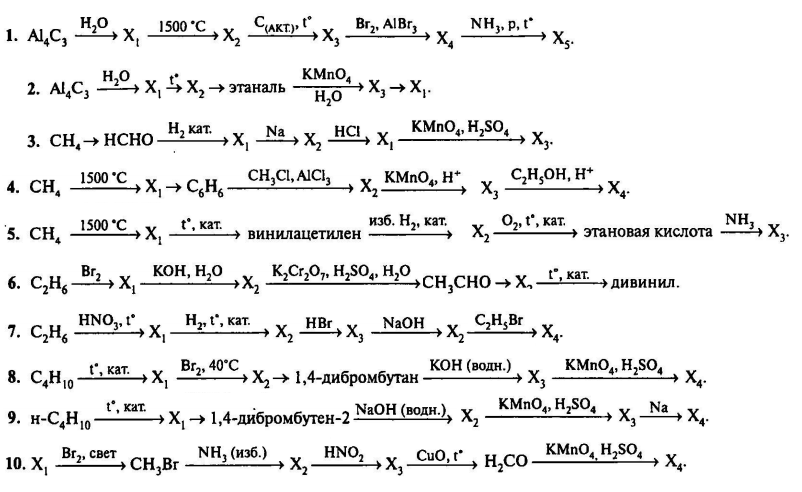 Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
$R—CH_2CH_2:CH_2—R→R—CH_2CH_2·+·CH_2—R$.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры $1000°С$ начинается пиролиз метана — разложение на простые вещества:
$CH_4{→}↖{1000°C}C+2H_2↑$
При нагревании до температуры $1500°С$ возможно образование ацетилена:
$2CH_4{→}↖{1500°C}CH=CH+3H_2↑$
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
5. Ароматизация. Алканы с шестью и более углеродными атомами в цепи в присутствии катализатора циклизируются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии $sp^3$-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных $С—С$ (углерод — углерод) связей и слабополярных $С—Н$ (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Молекулы этих веществ построены при помощи ковалентных неполярных $С—С$ (углерод — углерод) связей и слабополярных $С—Н$ (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алкены
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкадиены (полиены), алкины. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство непредельности связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n}$.
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от лат. oleum — масло).
Гомологический ряд этена
Неразветвленные алкены составляют гомологический ряд этена (этилена):
$С_2Н_4$ — этен, $С_3Н_6$ — пропен, $С_4Н_8$ — бутен, $С_5Н_{10}$ — пентен, $С_6Н_{12}$ — гексен и т. д.
Изомерия и номенклатура
Для алкенов, так же, как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
$СН_3—{СН_2}↙{бутен-1}—СН=СН_2$ $СН_3—{СН=СН}↙{бутен-2}—СН_3$
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс изомерии.
Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости $π$-связи, а следовательно, и свойствами.
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения:
$5$-метилгексен-$2$, а не $2$-метилгексен-$4$, как можно было бы предположить.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей, так же, как для предельных углеводородов.
3. Формирование названия.
Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, — -ен.
Например:
Физические и химические свойства алкенов
Физические свойства. Первые три представителя гомологического ряда алкенов — газы; вещества состава $С_5Н_{10}$ – $С_{16}Н_{32}$ — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства.
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
$CH_3—CH_2—CH=CH_2+H_2{→}↖{Pt}CH_3—CH_2—CH_2—CH_3$.
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т.к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе ($CCl_4$) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалоген алканов:
$СН_2=СН_2+Br_2→CH_2Br—CH_2Br$.
3. Гидрогалогенирование (присоединение галогеноводорода).
$CH_3-{CH}↙{пропен}=CH_2+HBr→CH_3-{CHBr}↙{2-бромпропен}-CH_3$
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т.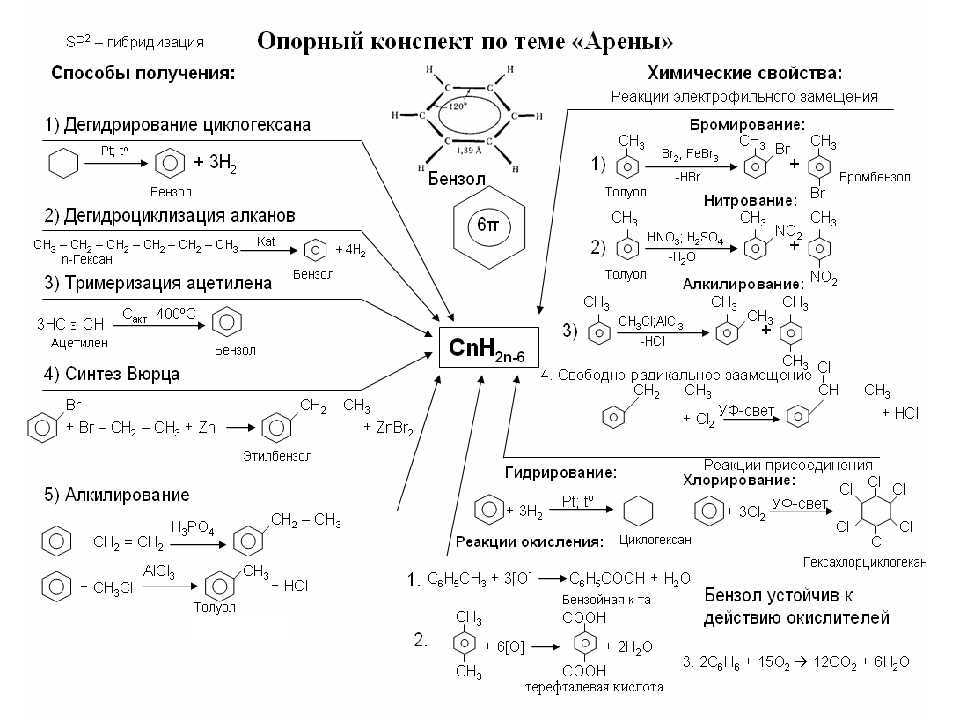 е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
${CH_2}↙{этен}=CH_2+H_2O{→}↖{t,H_3PO_4}CH_3-{CH_2OH}↙{этанол}$
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
$nCH_2{=}↙{этен}CH_2{→}↖{УФ-свет,R}(…{-CH_2-CH_2-}↙{полиэтилен}…)_n$
Эта реакция присоединения протекает по свободнорадикальному механизму.
6. Реакция окисления.
Как и любые органические соединения, алкены горят в кислороде с образованием $СО_2$ и $Н_2О$:
$СН_2=СН_2+3О_2→2СО_2↑+2Н_2О$.
В общем виде:
$C_{n}H_{2n}+{3n}/{2}O_2→nCO_2↑+nH_2O$
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Алкадиены (диеновые углеводороды)
Алкадиены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
В зависимости от взаимного расположения двойных связей различают три вида диенов:
— алкадиены с кумулированным расположением двойных связей:
$CH_2=C=CH_2$;
— алкадиены с сопряженными двойными связями;
$CH_2=CH—CH=CH_2$;
— алкадиены с изолированными двойными связями
$CH_2=CH—CH_2—CH=CH_2$.
Эти все три вида алкадиенов существенно отличаются друг от друга по строению и свойствам. Центральный атом углерода (атом, образующий две двойные связи) в алкадиенах с кумулированными связями находится в состоянии $sp$-гибридизации. Он образует две $σ$-связи, лежащие на одной прямой и направленные в противоположные стороны, и две $π$-связи, лежащие в перпендикулярных плоскостях. $π$-Связи образуются за счет негибридизированных р-орбиталей каждого атома углерода. Свойства алкадиенов с изолированными двойными связями весьма специфичны, т.к. сопряженные $π$-связи существенно влияют друг на друга.
р-Орбитали, образующие сопряженные $π$-связи, составляют практически единую систему (ее называют $π$-системой), т.к. р-орбитали соседних $π$-связей частично перекрываются.
Изомерия и номенклатура
Для алкадиенов характерна как структурная изомерия, так и цис-, транс-изомерия.
Структурная изомерия.
— изомерия углеродного скелета:
— изомерия положения кратных связей:
${CH_2=CH—CH=CH_2}↙{бутадиен-1,3}$ ${CH_2=C=CH—CH_3}↙{бутадиен-1,2}$
Цис-, транс-изомерия (пространственная и геометрическая)
Например:
Алкадиены изомерны соединениям классов алкинов и циклоалкенов.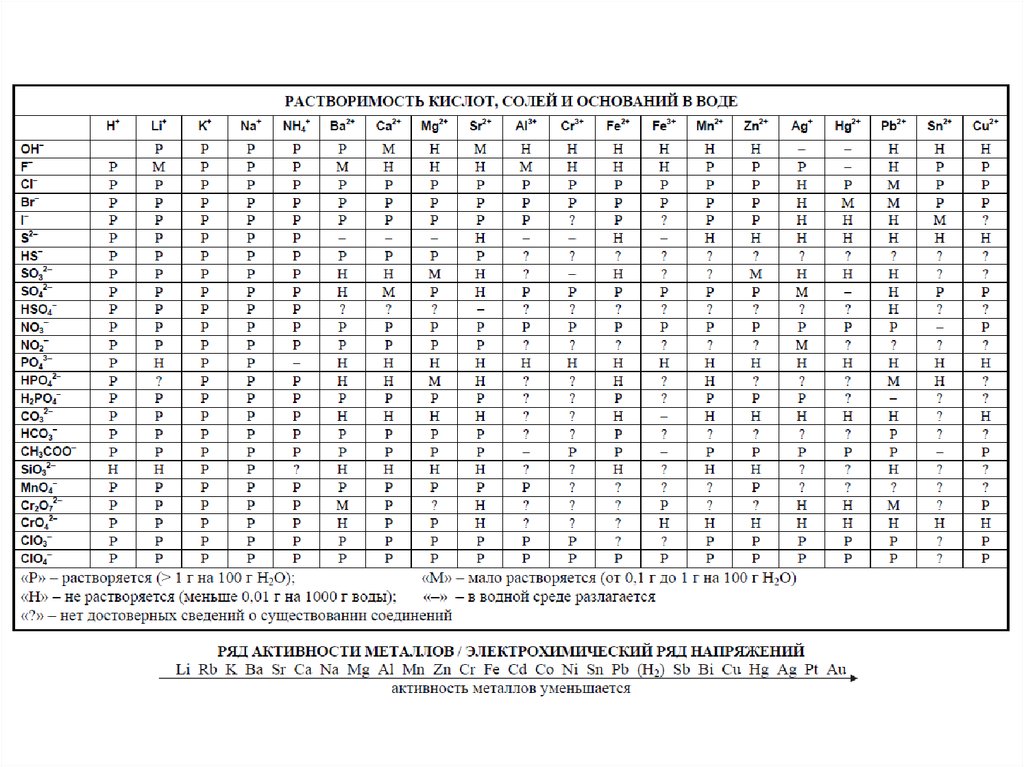
При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать две кратные связи.
Например:
Физические и химические свойства алкадиенов
Физические свойства.
В обычных условиях пропандиен-1,2, бутадиен-1,3 — газы, 2-метилбутадиен-1,3 — летучая жидкость. Алкадиены с изолированными двойными связями (простейший из них — пентадиен-1,4) — жидкости. Высшие диены — твердые вещества.
Химические свойства.
Химические свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к алкадиенам с сопряженными связями является способность присоединять молекулы как в положениях 1 и 2, так и в положениях 1 и 4.
Соотношение продуктов зависит от условий и способа проведения соответствующих реакций.
2. Реакция полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой синтетических каучуков:
$nCH_2={CH—CH=CH_2}↙{бутадиен-1,3}→{(… —CH_2—CH=CH—CH_2— …)_n}↙{\text”синтетический бутадиеновый каучук”}$.
Полимеризация сопряженных диенов протекает как 1,4-присоединение.
В этом случае двойная связь оказывается центральной в звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс-конфигурацию.
Алкины
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена):
$С_2Н_2$ — этин, $С_3Н_4$ — пропин, $С_4Н_6$ — бутин, $С_5Н_8$ — пентин, $С_6Н_{10}$ — гексин и т. д.
д.
Изомерия и номенклатура
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
$СН_3—{СН_2}↙{бутин-1}—С≡СН$ $СН_3—{С≡С}↙{бутин-2}—СН_3$
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.
Например:
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу $С_6Н_{10}$ имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические и химические свойства алкинов
Физические свойства. Температуры кипения и плавления алкинов, так же, как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Температуры кипения и плавления алкинов, так же, как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства.
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома):
$CH≡CH+Br_2→{CHBr=CHBr}↙{1,2-дибромэтан},$
$CHBr=CHBr+Br_2→{CHBr_2-CHBr_2}↙{1,1,2,2-тетрабромэтан}$
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях выполняется правило Марковникова:
$CH_3-C≡CH+Br→{CH_3-CBr=CH_2}↙{2-бромпропен},$
$CH_3-CBr=CH_2+HBr→{CH_3-CHBr_2-CH_3}↙{2,2-дибромпропан}$
3. Гидратация (присоединение воды). Боль шое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
Гидратация (присоединение воды). Боль шое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов ($Pt, Pd, Ni$):
$R-C≡C-R+H_2{→}↖{Pt}R-CH=CH-R,$
$R-CH=CH-R+H_2{→}↖{Pt}R-CH_2-CH_2-R$
Так как тройная связь содержит две реакционноспособные $π$-связи, алканы присоединяют водород ступенчато:
1) тримеризация.
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:
2) димеризация.
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей одновалентной меди образуется винилацетилен:
$2HC≡CH→{HC≡C-CH=CH_2}↙{\text”бутен-1-ин-3(винилацетилен)”}$
Это вещество используется для получения хлоропрена:
$HC≡C-CH=CH_2+HCl{→}↖{CaCl}H_2C={CCl-CH}↙{хлоропрен}=CH_2$
полимеризацией которого получают хлоропреновый каучук:
$nH_2C=CCl-CH=CH_2→(. ..-H_2C-CCl=CH-CH_2-…)_n$
..-H_2C-CCl=CH-CH_2-…)_n$
Окисление алкинов.
Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
$2C_2H_2+5O_2→4CO_2↑+2H_2O+2600кДж$ На этой реакции основано действие кислородно-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более $3000°С$), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т.к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
учебных пособий по общей химии | 10 лучших советов по учебе
«Химия слишком сложна. Я этого не понимаю».
Как часто вы думали, что химия слишком сложна? Я не могу сказать вам, сколько студентов колледжей рассказывали мне разные версии одной и той же вещи. Многие студенты думают, что они не могут этого понять или что их мозг просто не работает таким образом. Это НЕ правда. Некоторые люди могут понимать это более естественно или иметь больший математический опыт. Тем не менее, вы (да… вы читаете это) можете понимать химию так же хорошо, как и все остальные… если вы поработаете и используете эти советы по учебе .
Это НЕ правда. Некоторые люди могут понимать это более естественно или иметь больший математический опыт. Тем не менее, вы (да… вы читаете это) можете понимать химию так же хорошо, как и все остальные… если вы поработаете и используете эти советы по учебе .
Найдите время , чтобы использовать эти 10 учебных советов по общей химии
Используйте следующие 10 учебных советов по общей химии . Помните, что общая химия требует больше времени и усилий, чем обычный курс в колледже.
1. Понимание электронов Химия считается наукой о материи. Это изучение атомов, молекул и того, как они взаимодействуют друг с другом. Когда мы говорим о том, как ВЗАИМОДЕЙСТВУЮТ атомы и молекулы, мы конкретно говорим об электронах. Помните об электронах при изучении химии. Подумайте, сколько электронов, что они делают и почему. Несмотря на то, что в общей химии требуется некоторое запоминание, понимание электронов и того, как они взаимодействуют, значительно сократит объем работы и запоминания, необходимых во время учебы.
Практические экзамены ACS – Мгновенный онлайн-доступ – Видеорешения для каждого вопроса
2. Прочтите перед лекциейЕсли бы кто-нибудь сказал мне, что только 10% учащихся по общей химии получили пятерку, я бы сказал им, что 90% класса не читали материал перед лекцией. На самом деле, большинство студентов колледжей НИКОГДА этого не делают. Если вы хотите иметь преимущество перед другими учениками, это отличный совет для любого класса. Не только общая химия.
3. Идите в класс. Каждый… Один… Класс Каждый раз ходите на лекции и лабораторные! Многие преподаватели колледжей ожидают, что вы станете взрослым, и никогда не посещают занятия. Это может показаться очевидным советом по изучению , но все равно идите на занятия! Посещаемость имеет значение, потому что, если вы не пойдете на лекцию и лабораторию, вы отстанете, и ваши оценки упадут. Никогда не пропускайте, если в этом нет крайней необходимости. Если вы пропустите, напишите своему профессору и сообщите ему или ей! Получайте заметки от других студентов. Возможно, вы даже сможете посетить лекцию или лабораторию другого профессора.
Если вы пропустите, напишите своему профессору и сообщите ему или ей! Получайте заметки от других студентов. Возможно, вы даже сможете посетить лекцию или лабораторию другого профессора.
После урока и перед следующим уроком организуйте свои заметки по химии. Просмотрите учебник и добавьте дополнительную информацию, которая может отсутствовать. Прочитайте примечания, поскольку они относятся к учебнику. Вы также можете добавить примеры задач из текста или переписать примечания своими словами, чтобы их было легче понять.
5. Сдать практические экзаменыСдача практических экзаменов может значительно повысить ваши оценки на экзаменах по общей химии. Если ваш преподаватель химии не предоставляет практические экзамены, поищите их в Интернете или сделайте свои собственные. Иногда создание собственного пробного экзамена может помочь еще больше.
Если вы сдаете итоговый экзамен по общей химии Американского химического общества, вы можете найти практические экзамены по общей химии 1 и общей химии 2 онлайн здесь:
Общая химия 1 — Практический экзамен ACS
Общая химия 2 — ACS Практический экзамен
Здесь есть видео решения для каждого вопроса!
6. Учиться каждый день
Учиться каждый день Я знаю, что трудно найти время. Иногда даже трудно найти время, чтобы поесть или поспать. Но если вы не уделяете время учебе, вам будет очень тяжело с общей химией. Да… будут времена, когда вам придется учиться по несколько часов за раз. Но даже 10-15 минут в день могут быть полезными. Флэш-карты, заметки, рабочие задачи или любой другой быстрый метод, который работает для вас, должен быть доступен ежедневно.
7. Присоединяйтесь к исследовательской группеУчастие в учебной группе дает так много преимуществ, что я даже не могу перечислить их все здесь. Важно присоединиться к учебной группе для вашего класса общей химии. Это отличный способ узнать больше советов по обучению и методов, используемых вашими сверстниками. Поскольку учебные группы встречаются регулярно, это помогает избежать проволочек в вашем учебном графике.
Исследования показали, что обучение со сверстниками помогает вам учиться быстрее, заполнять любые пробелы в вашей информации и смотреть на вещи с точки зрения других учеников. Если вы поможете другим учащимся в своей учебной группе, это поднимет ваше обучение на совершенно другой уровень. Когда вы начинаете учить других, вы начинаете осваивать материал сами.
Если вы поможете другим учащимся в своей учебной группе, это поднимет ваше обучение на совершенно другой уровень. Когда вы начинаете учить других, вы начинаете осваивать материал сами.
Домашние задания по общей химии существуют для того, чтобы помочь вам попрактиковаться в решении задач. Это хорошая причина никогда не пропускать домашнее задание. Однако иногда выполнения домашних заданий недостаточно.
В дополнение к выполнению всех, да, я сказал всех, ваших домашних заданий, вы должны работать над дополнительными задачами в своих учебных группах! Сделайте учебную группу активной. Рабочие задачи на доске. В течение недели, когда вы сталкиваетесь с проблемами, с которыми боретесь, спасайте их! Запишите их. Сфотографируйте его своим телефоном. Сохраните его как-нибудь, чтобы вы могли принести его в свою учебную группу и попрактиковаться с другими.
9. Определите непонятные области Если вы столкнулись с темами, концепциями или задачами по химии, которые кажутся вам непонятными, примите меры! Не стесняйтесь. Во-первых, поищите в Интернете. На YouTube есть много отличных видео, которые могут помочь вам разобраться во всем. Затем принесите его в свою учебную группу. Обсудите это с группой и посмотрите, смогут ли ваши сверстники прояснить ситуацию и помочь вам понять. Наконец, поговорите об этом со своим профессором. Большинство профессоров рады помочь, когда студенты приходят в их рабочее время.
Во-первых, поищите в Интернете. На YouTube есть много отличных видео, которые могут помочь вам разобраться во всем. Затем принесите его в свою учебную группу. Обсудите это с группой и посмотрите, смогут ли ваши сверстники прояснить ситуацию и помочь вам понять. Наконец, поговорите об этом со своим профессором. Большинство профессоров рады помочь, когда студенты приходят в их рабочее время.
Это невероятно важный момент. Я вижу это все время со студентами-химиками. Важно, чтобы студенты-химики знали разницу между важными понятиями и сложными. Да, многие важные понятия и химические методы сложны, но не все сложные из них так же важны.
Пожалуйста, не поймите неправильно этот момент и не начинайте игнорировать все, что сложно! Просто помните о том, какие темы важны, когда вы начинаете копаться в книге или работать над дополнительными задачами. Если вы не уверены, что что-то важно, спросите своего профессора. Я видел, как учебные группы тратили час, пытаясь понять, как решить невероятно сложную проблему, которая не имела отношения к изучаемой ими информации. Время было потрачено впустую. Ваше учебное время бесценно. Сосредоточьтесь на важном материале.
Время было потрачено впустую. Ваше учебное время бесценно. Сосредоточьтесь на важном материале.
Химия требует времени. Вы должны найти время, чтобы добиться успеха в этом классе. Если вы потратите время и усердно поработаете над изучением материала, вы добьетесь успеха. Спасибо, что нашли время прочитать. Есть ли у вас какие-либо советы по обучению, которые вы не видели выше? Какими советами по учебе вы пользуетесь? Поделитесь с нами в комментариях ниже! Кроме того, пожалуйста, не стесняйтесь обращаться к нам с любыми вопросами.
Ознакомьтесь с советами по экзамену ACS для студентов-химиков: как сдать экзамен ACS
Химия – это сложно? Полное руководство на 2022 год
Вы рассматриваете AP Chemistry? Мы рассмотрим все тонкости AP Chemistry, чтобы помочь вам понять, подходит ли вам этот курс.
к
Джеймс Мильке
Прочитать полную биографиюПисатель
Джеймс Мильке пишет руководства по образованию и карьере для BestColleges. Помимо тем высшего образования, его работы были представлены в журналах Golfweek и Eaten Magazine. У Джеймса степень по истории Белмонтского университета, и он беззастенчивый благодарный…
Помимо тем высшего образования, его работы были представлены в журналах Golfweek и Eaten Magazine. У Джеймса степень по истории Белмонтского университета, и он беззастенчивый благодарный…
Отредактировано
Тайлер Эппс
Прочитать полную биографиюРедактор и писатель
Тайлер Эппс — редактор BestColleges. Он пишет и редактирует материалы о высшем образовании, специализируясь на планировании получения степени и рейтинге колледжей. Он увлечен тем, что помогает студентам подготовиться к поступлению в колледж и ориентироваться в их образовательном путешествии. Он…
Обновлено 7 апреля 2022 г.
Узнайте больше о нашем процессе редактирования
8 минут чтения
Поделиться этой статьей
- AP Химия неизменно входит в число самых сложных курсов AP.
- Курс охватывает множество тем, уделяя особое внимание основным научным практикам.

- Данные тестов по химии AP не учитывают такие факторы, как качество учителей и школы.
- Экзамен AP Chemistry состоит как из множественного выбора, так и из письменных разделов.
AP Химия неизменно считается одним из самых сложных предметов AP. В мае 2020 года менее 60% студентов сдали экзамен AP по химии.
Но даже несмотря на серьезную академическую строгость, более 145 000 студентов ежегодно записываются на AP Chemistry. Почему? Классы AP могут повысить успеваемость, подготовить студентов к поступлению в колледж и помочь компенсировать расходы на обучение в колледже за счет заработанных кредитов.
BestColleges.com — это сайт, поддерживаемый рекламой. Рекомендуемые или доверенные партнерские программы, а также все результаты поиска, поиска или подбора школ предназначены для школ, которые выплачивают нам компенсацию. Эта компенсация не влияет на рейтинги наших школ, справочники ресурсов или другую независимую от редакции информацию, опубликованную на этом сайте.
Готов начать свое путешествие?
На этой странице мы изучаем содержание курса AP Chemistry и то, что делает его сложным. Мы также выделяем плюсы и минусы теста AP. Продолжайте читать, чтобы узнать, подходит ли вам AP Chemistry.
Что покрывает AP Chemistry?
Этот курс знакомит учащихся с темами и навыками, которые являются основой занятий химией в колледже. Учащиеся классов AP Chemistry изучают учебную программу, проверенную и одобренную профессором колледжа. Продолжайте читать, чтобы ознакомиться с дополнительными примерами содержания курса AP Chemistry.
- Атомная структура и свойства
- Молекулярная и ионная структура и свойства соединений
- Межмолекулярные силы и свойства
- Химические реакции
- Кинетика
- Термодинамика
- Равновесие
- Кислоты и основания
- Приложения термодинамики
Что определяет сложность AP химии? 3 ключевых фактора
Потенциальные учащиеся должны учитывать различные факторы и вопросы, прежде чем записываться на курс AP, включая уровень сложности предмета.
Проходной балл
Один полезный фактор при определении сложности курса AP включает в себя холодные, достоверные данные: процент сдачи. В 2020 году у студентов, завершивших курсы AP Chemistry, общий процент сдачи составил около 56%, что на 15% ниже, чем 71% всех классов AP в этом году.
Кроме того, на экзаменах AP по химии меньше студентов получают отличные оценки, чем на других тестах AP.
Меньшие значения как проходного балла, так и идеальных результатов указывают на то, что AP Chemistry значительно сложнее, чем другие классы AP. В приведенной ниже таблице приведены данные о проходных баллах AP Chemistry.
| Класс AP/экзамен | Проходной балл (3 или выше) | Идеальный результат (5) |
|---|---|---|
| Химия АП | 56,1% | 10,6% |
| Все классы точек доступа | 71,13% | 19,57% |
Источник: College Board
Хотя данные могут дать представление о сложности определенного курса, необработанные цифры без контекста не дают полной картины.
Доступ к службам поддержки учащихся, таким как репетиторство и онлайн-программы подготовки к экзаменам, также может повлиять на результаты тестирования.
Материал курса
Сложность класса AP часто зависит от объема содержания курса, охватываемого учебной программой. Студенты AP Chemistry не только разбираются в теоретических концепциях, но и тратят значительное количество учебного времени на применение теории в лабораторных условиях.
Учащиеся обычно решают девять разделов на уроке химии AP, развивая научные практики, включая анализ моделей, модели и представление, а также представление данных и явлений. Кроме того, учащиеся AP используют математические знания для решения задач по химии.
Ваши предметные навыки
Другим ключевым фактором при определении сложности является набор предметных навыков учащегося — рекомендуемые предпосылки включают в себя курсовые работы средней школы как по химии, так и по алгебре II.
Учащиеся, которые обычно преуспевают в математике и естественных науках, должны чувствовать себя относительно комфортно в AP Chemistry.
На протяжении этого курса студенты планируют эксперименты, проверяют теории и учатся создавать эффективные графики и модели для представления идей, основанных на химии. Студенты AP Chemistry также учатся составлять химические уравнения и разрабатывать научные утверждения, подкрепленные фактами.
Когда следует сдавать экзамен по химии?
AP Химия — один из самых сложных классов AP. Учащиеся часто заканчивают курс в младших или старших классах, чтобы будущие колледжи проверяли оценки и результаты экзаменов в процессе оценки заявлений.
Твердая оценка в классе и проходной балл на экзамене могут продемонстрировать способность учащегося справляться со сложной и тщательной курсовой работой на уровне колледжа.
Несмотря на то, что учащиеся первого и второго курсов старшей школы не имеют права зачисляться на курс химии AP, они могут не пройти обязательные предварительные курсы по химии и алгебре II.
Поскольку AP Chemistry является сложной задачей, учащиеся должны развить компетентность и удобство в различных математических и естественных темах. Из-за его сложного характера учащимся не рекомендуется проходить другие курсы AP наряду с AP Chemistry.
Экзамен по химии AP: что нужно знать
Тысячи студентов сдают экзамен AP по химии, и значительный процент успешно сдает тест и получает кредит колледжа. Просмотрите таблицу ниже, чтобы увидеть, как учащиеся справляются с экзаменом AP Chemistry.
| Оценка за экзамен | Количество студентов | Процент студентов |
|---|---|---|
| 5 | 15 464 | 10,6% |
| 4 | 27 012 | 18,6% |
| 3 | 39 135 | 26,9% |
| 2 | 34 913 | 24,0% |
| 1 | 19,9% |
Источник: College Board
Как устроен экзамен AP по химии?
Во время более чем трехчасового экзамена AP по химии учащиеся отвечают на вопросы в двух разных форматах. Тест содержит 60 вопросов с несколькими вариантами ответов и семь вопросов со свободным ответом.
Тест содержит 60 вопросов с несколькими вариантами ответов и семь вопросов со свободным ответом.
У тестируемых есть 90 минут, чтобы заполнить раздел с несколькими вариантами ответов, и 105 минут, чтобы заполнить письменный раздел. Наблюдатели за тестами рекомендуют учащимся принести с собой графический калькулятор и предоставляют учащимся список применимых формул и копию таблицы Менделеева.
- Раздел I : 60 вопросов с несколькими вариантами ответов (90 минут)
- Раздел II : Семь бесплатных вопросов (105 минут)
Как оценивается экзамен по химии AP?
Лица, оценивающие тесты AP по шкале от 1 до 5. Оценка 3 и выше считается проходным баллом. Два раздела экзамена AP Chemistry — множественный выбор и свободный ответ — каждый составляет 50% баллов учащегося.
При подготовке к экзамену AP по химии учащиеся должны подумать, какой раздел теста кажется им более удобным. Студенты, у которых могут возникнуть проблемы с письменной частью экзамена, могут захотеть посвятить этой области больше учебного времени.
| Раздел 1 | 50% |
|---|---|
| Вопросы с несколькими вариантами ответов | 50% |
| Раздел 2 | 50% |
| 3 вопроса с длинным ответом (по 10 баллов каждый) | 32,6% |
| 4 вопроса с короткими ответами (по 4 балла за каждый) | 17,4% |
Источник: College Board
AP Химия: какой балл мне нужен для кредита колледжа?
Возможность перевода результатов теста AP по химии в зачет колледжа зависит от колледжа или университета. Некоторые школы не принимают результаты тестов для зачета колледжа, в то время как другие действуют более щедро.
Как правило, оценка 4 или 5 является ключом к получению кредита в колледже по предмету AP. Тем не менее, некоторые школы принимают оценки 3 и выше, поэтому обязательно свяжитесь с будущими школами, чтобы подтвердить их политику тестирования AP.
Тем не менее, некоторые школы принимают оценки 3 и выше, поэтому обязательно свяжитесь с будущими школами, чтобы подтвердить их политику тестирования AP.
Из-за присущих ему трудностей большинство школ требуют 3 или 4 балла при выдаче кредита колледжа. Если вы сомневаетесь, вы можете обратиться к этому инструменту поиска кредитной политики AP.
Должен ли я сдавать экзамен по химии?
Решая, какие курсы AP выбрать, учащиеся должны понимать, что рабочая нагрузка и академические способности могут помочь определить, какой тест им подходит. Не каждый учащийся может справиться со всеми дисциплинами, но те, у кого есть навыки STEM и предварительные требования к естественным наукам и математике, могут попробовать этот сложный курс AP.
В дополнение к оценке определенных факторов потенциальные учащиеся AP могут захотеть связаться с учителями и бывшими учащимися, чтобы понять, чего ожидать от урока химии AP. Учителя естественных наук и математики также могут иметь представление о том, подходит ли AP Chemistry.
Часто задаваемые вопросы о AP Chemistry
Учащимся с сильными математическими и естественными способностями стоит записаться на курс химии AP. Курс знакомит учащихся с химией на уровне колледжа, предлагая им возможность заработать кредит колледжа. Учащиеся получают необходимые знания по химии, которые они регулярно применяют в лабораторных условиях во время этого занятия.
AP-тесты сложнее, чем стандартные школьные курсы. Тем не менее, зачисленные студенты могут получить непосредственный опыт работы с курсовой работой на уровне колледжа с возможностью сэкономить деньги на обучении в виде кредита колледжа. AP Chemistry может стать ценным вложением для многих студентов, поступающих в колледж.
Хотя AP Chemistry имеет репутацию одного из наиболее требовательных курсов и экзаменов AP, более пристальный взгляд на данные немного сложнее.
В мае 2020 года около 84 % учащихся программы AP Biology набрали от 2 до 4 баллов, в то время как менее 70 % участников теста AP Chemistry попали в тот же диапазон.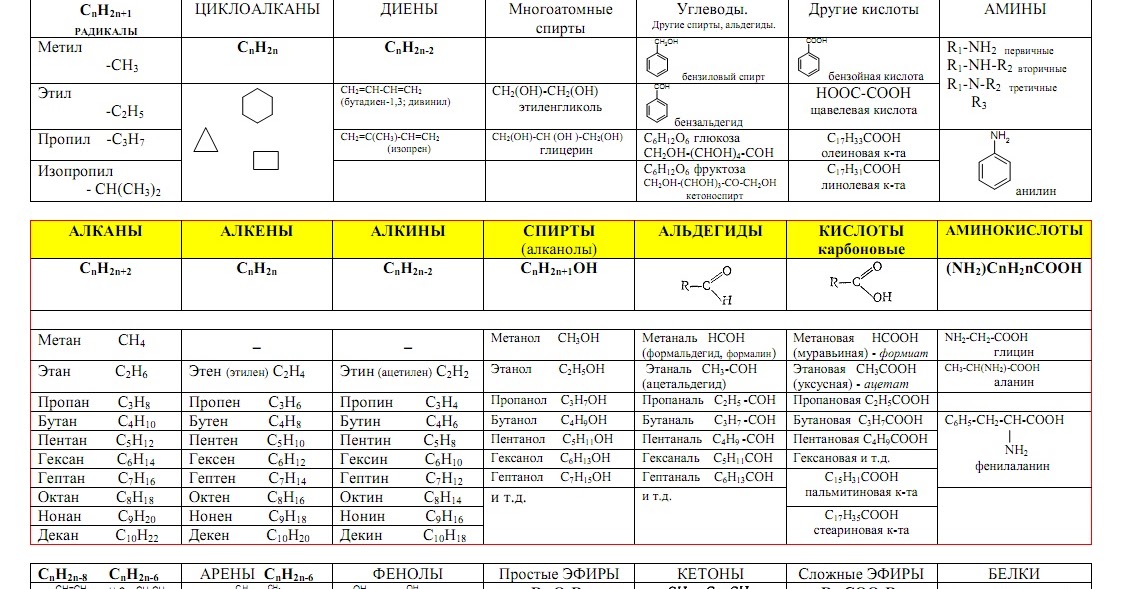 Кроме того, почти 20% участников теста AP Chemistry получили 1 балл, в то время как только 7% студентов AP Biology получили самый низкий балл.
Кроме того, почти 20% участников теста AP Chemistry получили 1 балл, в то время как только 7% студентов AP Biology получили самый низкий балл.
Кроме того, процент учащихся AP Chemistry, набравших 5 баллов, выше, чем тех, кто сдает тест AP Biology. Эти данные подчеркивают ценность посещения курсов AP, которые отражают академические навыки и опыт.
Колледжи осведомлены о различных уровнях сложности курсов и тестов AP. В результате учащиеся, получившие высшие оценки в своих классах и сдавшие экзамен AP по химии, могут помочь улучшить свои академические справки.
AP Химия неизменно считается одним из самых сложных экзаменов AP, и учащиеся, которые сдают его невредимыми, обнаруживают как талант STEM, так и готовность к поступлению в колледж. Тем не менее, AP Chemistry не является обязательным требованием для колледжа. Студенты, обладающие другими сильными сторонами, могут найти способы улучшить свое резюме в колледже как за счет академической, так и за неакадемической деятельности.