Описание элемента по положению в Периодической системе 8 класс онлайн-подготовка на Ростелеком Лицей
Строение атома элемента
Для того чтобы определить состав ядра и распределение электронов по слоям в атоме химического элемента, нужно знать порядковый номер элемента, номер периода, номер группы и подгруппу в Периодической системе.
Рассмотрим конкретный пример. Определим строение атома калия. Порядковый номер калия равен 19. Порядковый номер определяет число протонов в ядре и общее число электронов в атоме. Число нейтронов в конкретном атоме можно определить по разнице между массовым числом и числом протонов. Для изотопа калия с массовым числом 39 число протонов равно 19, число нейтронов равно 39-19=20, число электронов – 19.
По номеру периода можно определить число электронных слоев в атоме. Калий – элемент 4 периода, значит, все его 19 электронов расположены на 4-х электронных слоях. При этом нужно помнить, что на 1-м слое может максимально находиться не более 2-х электронов, на втором – не более 8. Число электронов на последнем слое равно номеру группы (для элементов главных подгрупп). У калия всего 1 внешний электрон, он находится на 4-м слое. Оставшиеся электроны – на третьем слое. Таким образом, в атоме калия электроны распределяются по слоям в следующем количестве: 2, 8, 8, 1 (рис. 1).
Число электронов на последнем слое равно номеру группы (для элементов главных подгрупп). У калия всего 1 внешний электрон, он находится на 4-м слое. Оставшиеся электроны – на третьем слое. Таким образом, в атоме калия электроны распределяются по слоям в следующем количестве: 2, 8, 8, 1 (рис. 1).
Рис. 1. Схема строения атома калия
Номер группы определяет не только число внешних электронов, но высшую валентность элемента. Численное значение низшей валентности для элементов V-VII групп равно 8 – номер группы. Итак, высшая и единственная валентность калия равна I.
Свойства простого вещества, образованного элементом
По положению элемента в периодической системе можно определить его принадлежность к металлам или неметаллам, а также свойства образованных им высших оксида и гидроксида. Элементы главных подгрупп, лежащие выше диагонали Be-At, относятся к неметаллам. Остальные элементы – металлы. При этом металлические свойства слева направо по периоду ослабевают, а сверху вниз по группе усиливаются.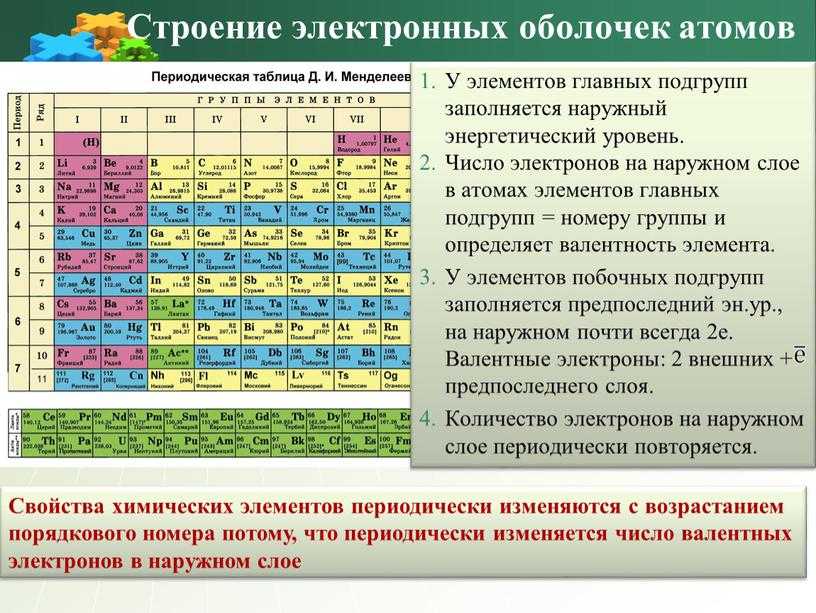
Таким образом, калий – металл. Его металлические свойства выражены сильнее, чем у натрия и кальция.
Формула и свойства высшего оксида и гидроксида элемента
Если элемент образует простое вещество-металл, то его высший оксид и гидроксид будут основными. Если неметалл – то кислотными. Если переходный металл – то амфотерными (рис. 2).
Рис. 2. Связь свойств элементов и образованных ими соединений
Так как калий – металл, его высший оксид и гидроксид будут проявлять основные свойства.
Составим формулы высшего оксида и гидроксида калия. Высшая валентность калия равна I, значит, формула высшего оксида – К2О, его характер – основный.
Основному оксиду соответствует основание – КОН.
Можно подтвердить основный характер оксида и гидроксида калия, записав уравнения реакций этих веществ с кислотой:
K2O + 2HCl = 2KCl + H2O
KOH + HCl = KCl + H2O
Элементы-неметаллы могут образовать летучие водородные соединения.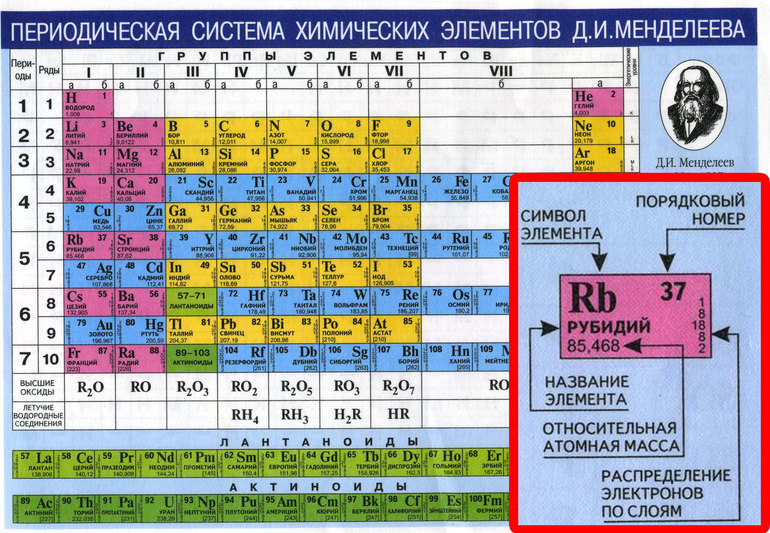 Чтобы составить формулу летучего водородного соединения неметалла, нужно знать низшую валентность последнего. Например, летучее водородное соединение азота – NH3 (низшая валентность азота равна III). Металлы летучих водородных соединений не образуют.
Чтобы составить формулу летучего водородного соединения неметалла, нужно знать низшую валентность последнего. Например, летучее водородное соединение азота – NH3 (низшая валентность азота равна III). Металлы летучих водородных соединений не образуют.
Если сравнивать калий с соседними по подгруппе и периоду элементами, то можно сказать, что основные свойства его оксида и гидроксида будут ярче выражены, чем у оксидов и гидроксидов натрия и кальция. Рубидий – более активный металл, чем калий. Значит, основные свойства его оксида и гидроксида будут выражены сильнее, чем у оксида и гидроксида калия.
Характеристика серы
Охарактеризуем по плану химический элемент серу, учитывая ее положение в Периодической системе элементов Д. И. Менделеева:
1. Химический знак – S («Эс»)
2. Порядковый номер – 16, VI группа, А подгруппа, 3 период
3. Строение атома:
4. Свойства простого вещества: S – неметалл
5. Высшая и низшая валентность: VI и II
6. Высший оксид: SO3 (кислотный)
Высший оксид: SO3 (кислотный)
Высший гидроксид: H2SO4 (кислота)
7. Формула летучего водородного соединения: H2S
Список литературы
- Оржековский П. А. Химия: 8-й класс: учеб для общеобр. учрежд. / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. (§§45)
- Рудзитис Г. Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§36)
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 35–36)
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «InternetUrok.ru» (Источник)
- Дальневосточный Государственный Университет Путей Сообщения (Источник)
Домашнее задание
- с.
 255 №№ 1–3
255 №№ 1–3 - Охарактеризуйте по вышеприведенному плану химический элемент № 20.
Таблица Менделеева online – О сайте
Таблица Менделеева, (или периодическая система химических элементов) – это таблица, которая квалифицирует химические элементы по различным свойствам, зависящим от заряда атомного ядра. Эта система выражает, в виде таблицы, периодический закон химических элементов, который в 1869 году открыл Русский ученый химик Д.И. Менделеев. Самый первый вариант таблицы, был разработан Менделеевым в 1869-1871 годах, он определял зависимость свойств химических элементов, от атомной массы (в то время это называлось атомным весом). Было предложено несколько сотен различных вариантов изображения свойств химических элементов, от аналитических кривых графиков, и до различных геометрических фигур. Но ученые, в конце концов, сошлись во мнении, что самым удобным вариантом будет изображение в виде двухмерной таблицы, в которой каждый столбик будет указывать на физико-химические свойства того или иного элемента, а периоды элементов приближенных друг к другу, будут определять строки таблицы.
Открытие, сделанное Русским химиком Менделеевым, сыграло (безусловно) наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке (физика атома и ядра атома). В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, (он же атомный), есть и мера электрического заряда атомного ядра этого элемента. А номер периода (т.е. горизонтального ряда), определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, (этим самым, элементы одного ряда, обязаны сходством химических свойств).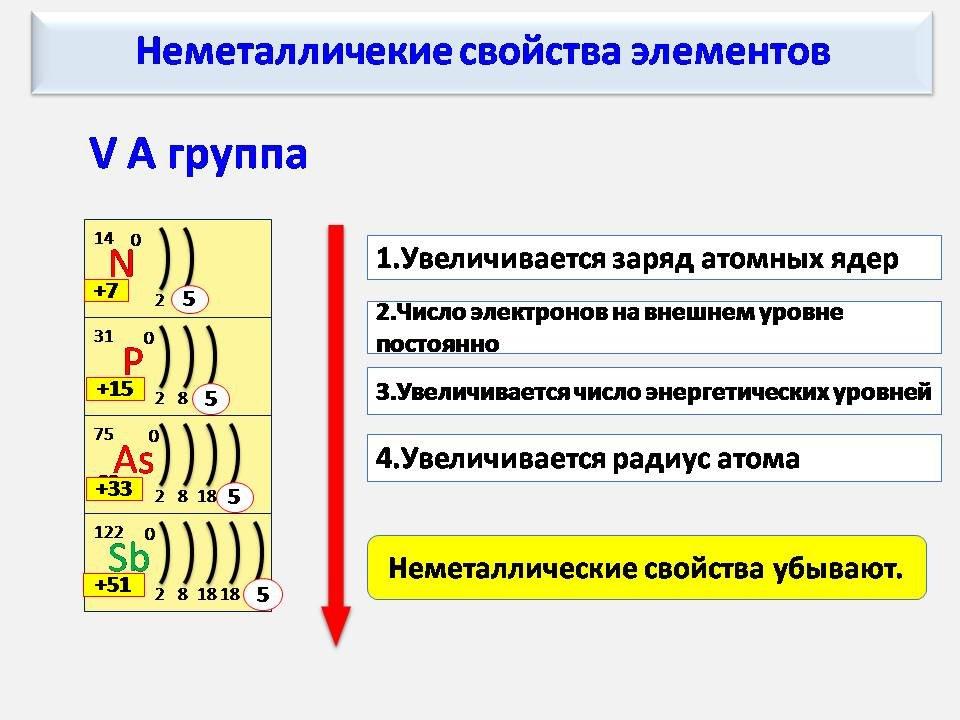
Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки. Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия.
Одна из особенностей периодической таблицы Менделеева, состоит в том, что группа (колонка в таблице), имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, (одинаковыми), особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы.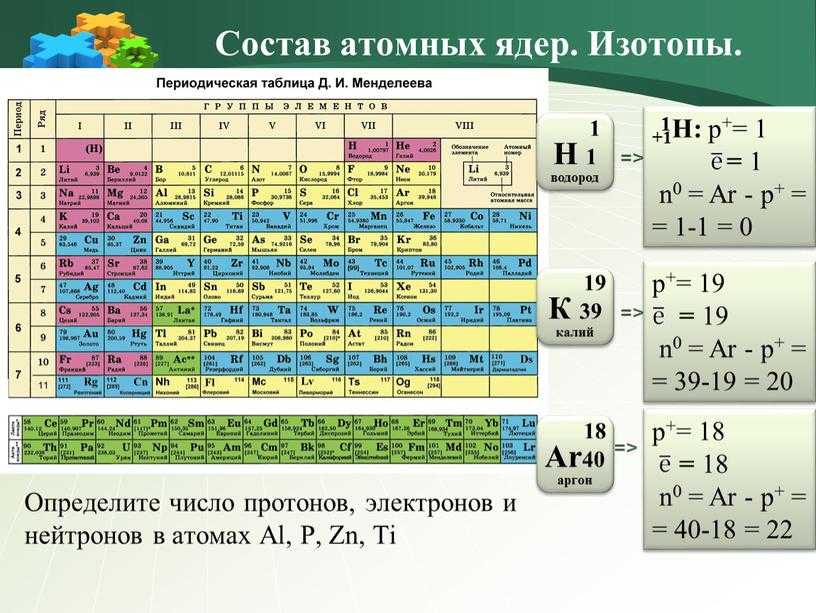 Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 (с лева, на право), согласно международной системе именования групп. В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» – для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA – это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» – после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
Многие группы получили несистематические названия травиального характера, (к примеру – «щелочноземельные металлы», или «галогены», и другие подобные названия). Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы (титановая, кобальтовая и тому подобно).
Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность , это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Среди групп, есть и такие у которых более значимыми являются горизонтальные направления (в отличии от других, у которых большее значение имеют вертикальные направления), к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности.
Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме – возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, (не считая благородных газов).
Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки.
В S-блок, входит две первые группы элементов, (щелочные и щелочноземельные металлы, водород и гелий).
В P-блок, входят шест последних групп, с 13 по 18 (согласно ИЮПАК, или по системе принятой в Америке – с IIIA до VIIIA), этот блок так же включает в себя все металлоиды.
Блок – D, группы с 3 по 12 (ИЮПАК, или с IIIB до IIB по-американски), в этот блок включены все переходные металлы.
Блок – F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды.
Разбор и решение задания №1 ОГЭ по химии
Первое задание в ОГЭ по химии проверяет знания в области строения атома и строения электронных оболочек атомов первых 20 элементов Периодической системы Менделеева. Поэтому для успешного решения первого задания нам потребуются знания в этой области.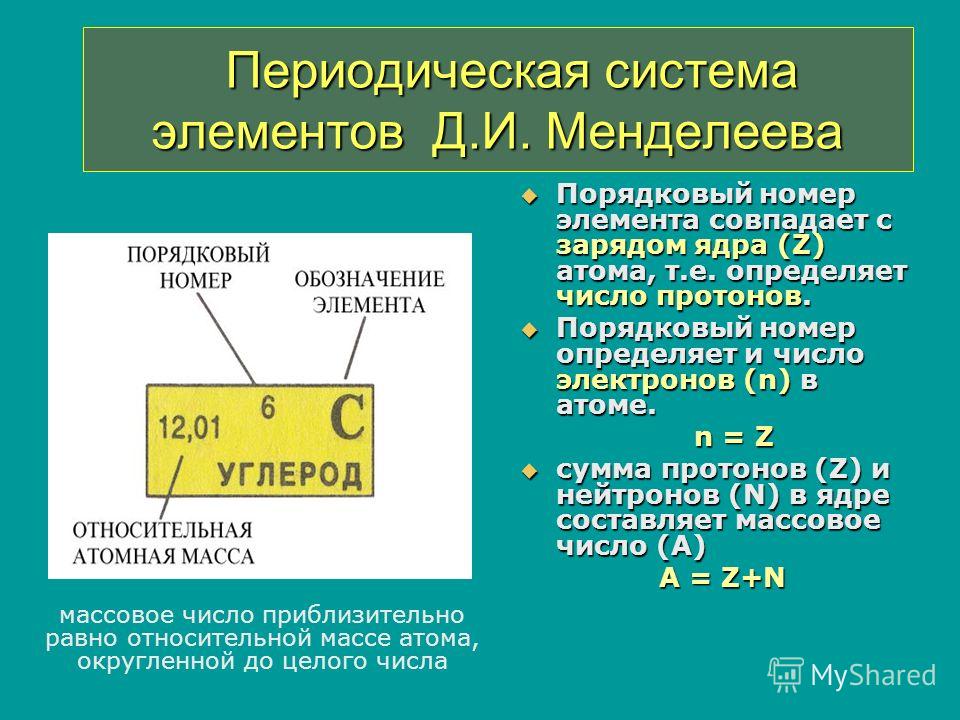 Что же нам необходимо знать?
Что же нам необходимо знать?
Теория к заданию №1 ОГЭ по химии
Все атомы состоят из ядра и электронной оболочки. Ядро поэтому так и называется, так как оно расположено в самом центре и очень-очень маленькое. Ядро заряжено положительно. Положительный заряд ядру придают протоны – положительно заряженные элементарные частицы. Один протон несет в себе заряд +1. Таким образом, сколько в ядре протонов, таков и заряд ядра. Заряд ядра, а следовательно и количество протонов показывает нам порядковый номер элемента в таблице Менделеева. Если порядковый номер 2, то заряд ядра равен двум – это ядро гелия – второго элемента в периодической таблице.
Порядковый номер элемента показывает также и количество электронов в электронной оболочке. Электронная оболочка окружает ядро и компенсирует положительный заряд ядра отрицательными зарядами электронов. Более того, электронная оболочка обуславливает протекания всех химических реакций – именно изменение состава электронной оболочки и её конфигураций объясняет природу химических реакций. Как и ядро, оболочка состоит из элементарных частиц – электронов. Электроны, в отличии от протонов, несут заряд -1 – электронная оболочка заряжена отрицательно. Но кроме этого, есть еще одно важное отличие электрона от протона – протон имеет вес 1, а электрон не имеет веса (на самом деле это не так, но для решения задач нам не понадобятся знания о массах элементарных частиц).
Как и ядро, оболочка состоит из элементарных частиц – электронов. Электроны, в отличии от протонов, несут заряд -1 – электронная оболочка заряжена отрицательно. Но кроме этого, есть еще одно важное отличие электрона от протона – протон имеет вес 1, а электрон не имеет веса (на самом деле это не так, но для решения задач нам не понадобятся знания о массах элементарных частиц).
Кроме протонов, в ядре содержатся нейтроны – незаряженные элементарные частицы с массой 1. Они придают только вес атому и ядру, но не заряд. Количество нейтронов можно найти, зная массу элемента и его порядковый номер, так как порядковый номер показывает количество протонов и их суммарную массу, а молекулярная масса – общую массу. Таким образом, вычитая из общей массы массу протонов, мы получаем количество нейтронов.
Суммарный заряд атома нейтрален, отсюда следует, что количество протонов равно количеству электронов.
Электроны в оболочке расположены упорядочено – слоями. Количество слое определяет номер периода в периодической таблице.
Число слоев определяется номер периода, в котором стоит элемент.
В первом периоде может быть максимально два электрона, во втором – восемь, в третьем – восемь. Заполнение электронных оболочек первых трех периодов идет постепенно – сначала полностью заполняется первый, потом полностью второй и третий.
Число свободных неспаренных электронов определяется по формуле 8-n, где n – номер группы, в которой стоит химический элемент.
На этом теоретический экскурс окончен и мы можем приступить к разбору типовых заданий.
Разбор типовых вариантов заданий №1 ОГЭ по химии
Первый вариант задания
В атоме калия распределение электронов по электронным слоям соответствует ряду чисел:
- 2; 8; 6; 3
- 8; 8; 2; 2
- 2; 8; 1
- 2; 8; 8; 1
Так как элемент калий стоит в 4-м периоде, в главной подгруппе 1-ой группе, его порядковый номер 19. Следовательно, 19 электронов распределены по 4-м слоям. На первом слое 2 электрона, на втором 8, на третьем восемь, и на четвертый остается один, значит схема строения:
Следовательно, 19 электронов распределены по 4-м слоям. На первом слое 2 электрона, на втором 8, на третьем восемь, и на четвертый остается один, значит схема строения:
2; 8; 8; 1
Ответ: 4
Второй вариант задания
Сколько электронов содержит атом алюминия?
- 27
- 13
- 14
- 3
У алюминия порядковый номер 13, а значит и электронов у него 13.
Ответ: 2
Третий вариант задания
Число протонов в атоме равно
- числу электронов
- относительной атомной массе
- числу нейтронов
- заполненных электронных слоев
Из вышеизложенного мною материала количество протонов равно количеству электронов.
Ответ: 1
Четвертый вариант задания
Число заполняющихся электронных слоёв в атоме равно
- порядковому номеру элемента
- номеру группы
- заряду ядра атома
- номеру периода
Число заполняющихся электронных слоев равно номеру периода.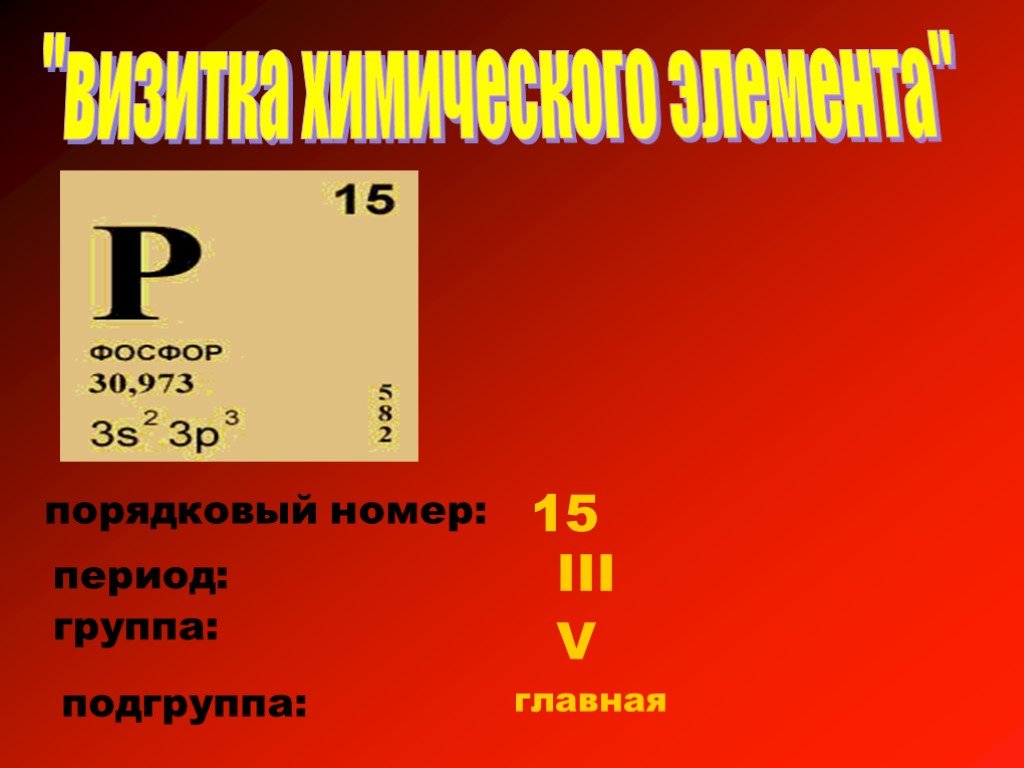
Ответ: 4
Пятый вариант задания
Для элементов главных подгрупп число электронов во внешнем электронном слое атома равно
- числу нейтронов
- номеру периода
- заряду ядра атома
- номеру группы
В главных подгруппах (знаки элементов стоят слева в ячейке таблицы) число электронов во внешнем слое равно номеру группы.
Ответ: 4
Шестой вариант задания
- значение радиусов атомов
- значение зарядов ядер атомов
- число электронов во внешнем электронном слое
- число заполненных электронных слоёв
Так как азот и фтор стоят в одном периоде, значит у них одинаковое число электронных слоев. К слову, не бывает разных элементов с одинаковыми радиусами атомов, значениями зарядов ядер.
Ответ: 4
Седьмой вариант задания
Атомы углерода и кремния имеют одинаковое
- число нейтронов в ядре атома
- значение относительной атомной массы
- число протонов в ядре атома
- число валентных электронов
Так как углерод и кремний находятся в одной группе (четвертой), то у них одинаковое число валентных электронов.
Ответ: 4
Восьмой вариант задания
Схема распределения электронов по электронным слоям 2, 8, 7 соответствует атому
- хлора
- фтора
- кислорода
- серы
Суммарное число электронов:
2 + 8 + 7 = 17
Находим 17 элемент – это хлор.
Ответ: 1
6.8: Блоки периодической таблицы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53700
Что делает эти ноты уникальными?
Все мы любим музыку в той или иной степени. Кому-то нравится классическая музыка, кому-то джаз или кантри. Музыкальные стили меняются от одного периода времени к другому и от одного региона к другому. Каждый тип музыки имеет свой язык, который его описывает. Классическая музыка имеет определенную структуру, стиль и содержание. Есть разные выражения классической музыки – симфония, концерт, соната. У нас есть балет и опера, а также хоровая музыка. Джаз отличается набором характеристик от классики и разными стилями исполнения. Каждый тип музыки можно описать и сравнить с другими типами на основе определенных общих качеств, таких как ноты, аккорды и мелодические стили.
Кому-то нравится классическая музыка, кому-то джаз или кантри. Музыкальные стили меняются от одного периода времени к другому и от одного региона к другому. Каждый тип музыки имеет свой язык, который его описывает. Классическая музыка имеет определенную структуру, стиль и содержание. Есть разные выражения классической музыки – симфония, концерт, соната. У нас есть балет и опера, а также хоровая музыка. Джаз отличается набором характеристик от классики и разными стилями исполнения. Каждый тип музыки можно описать и сравнить с другими типами на основе определенных общих качеств, таких как ноты, аккорды и мелодические стили.
Элементы периодической таблицы можно считать похожими на типы музыки. Каждый набор элементов имеет свой уникальный набор свойств, при этом разные наборы элементов имеют некоторые общие характеристики с точки зрения расположения электронов. Мы можем видеть закономерности электронной структуры и реактивности в периодической таблице, что позволяет нам лучше понять поведение отдельных элементов.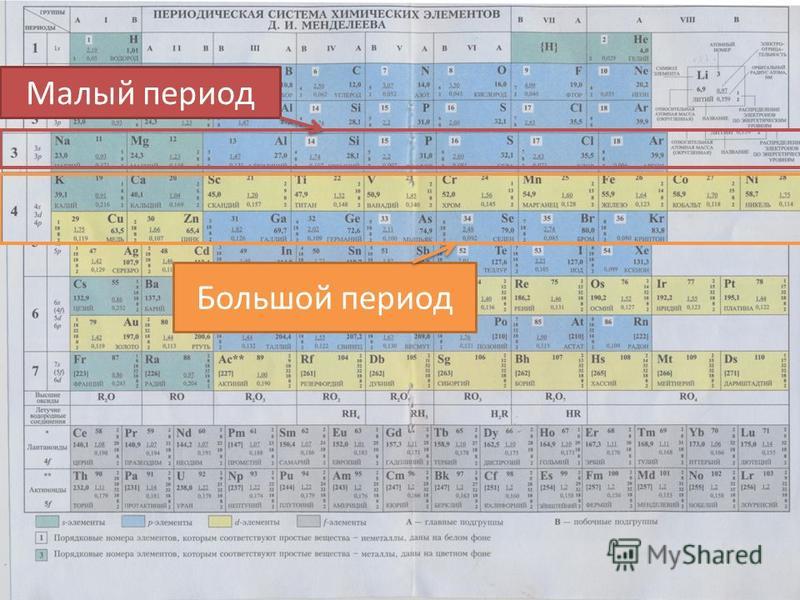
Периоды и блоки
В периодической таблице есть семь горизонтальных строк, называемых периода . Продолжительность каждого периода определяется количеством электронов, способных занять подуровня , которые заполняются в течение этого периода, как показано в таблице ниже.
| Период | Количество элементов в периоде | Подуровни в порядке заполнения |
|---|---|---|
| 1 | 2 | \(1с\) |
| 2 | 8 | \(2п\) \(2п\) |
| 3 | 8 | \(3с\) \(3п\) |
| 4 | 18 | \(4с\) \(3п\) \(4п\) |
| 5 | 18 | \(5s\) \(4d\) \(5p\) |
| 6 | 32 | |
| 7 | 32 | \(7s\) \(5f\) \(6d\) \(7s\) |
Напомним, что каждый из четырех различных подуровней состоит из разного количества орбиталей.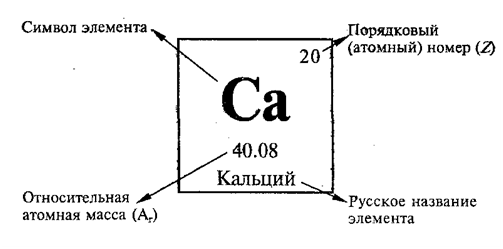 Подуровень \(s\) имеет одну орбиталь, подуровень \(p\) – три орбитали, подуровень \(d\) – пять орбиталей, подуровень \(f\) – семь орбиталей. В первом периоде заполняется только подуровень \(1s\). Поскольку все орбитали могут содержать два электрона, весь первый период состоит всего из двух элементов. Во втором периоде заполняются подуровень \(2s\) с двумя электронами и подуровень \(2p\) с шестью электронами. Следовательно, второй период содержит восемь элементов. Третий период аналогичен второму, заполняя подуровни \(3s\) и \(3p\). Обратите внимание, что подуровень \(3d\) на самом деле не заполняется до тех пор, пока не заполнится подуровень \(4s\). Это приводит к четвертому периоду, содержащему 18 элементов из-за дополнительных 10 электронов, внесенных подуровнем \(d\). Пятый период аналогичен четвертому. После заполнения подуровня \(6s\) заполняется подуровень \(4f\) с его 14 электронами. Далее следуют \(5d\) и \(6p\). Общее количество элементов в шестом периоде равно 32. Более поздние элементы в седьмом периоде все еще создаются.
Подуровень \(s\) имеет одну орбиталь, подуровень \(p\) – три орбитали, подуровень \(d\) – пять орбиталей, подуровень \(f\) – семь орбиталей. В первом периоде заполняется только подуровень \(1s\). Поскольку все орбитали могут содержать два электрона, весь первый период состоит всего из двух элементов. Во втором периоде заполняются подуровень \(2s\) с двумя электронами и подуровень \(2p\) с шестью электронами. Следовательно, второй период содержит восемь элементов. Третий период аналогичен второму, заполняя подуровни \(3s\) и \(3p\). Обратите внимание, что подуровень \(3d\) на самом деле не заполняется до тех пор, пока не заполнится подуровень \(4s\). Это приводит к четвертому периоду, содержащему 18 элементов из-за дополнительных 10 электронов, внесенных подуровнем \(d\). Пятый период аналогичен четвертому. После заполнения подуровня \(6s\) заполняется подуровень \(4f\) с его 14 электронами. Далее следуют \(5d\) и \(6p\). Общее количество элементов в шестом периоде равно 32. Более поздние элементы в седьмом периоде все еще создаются.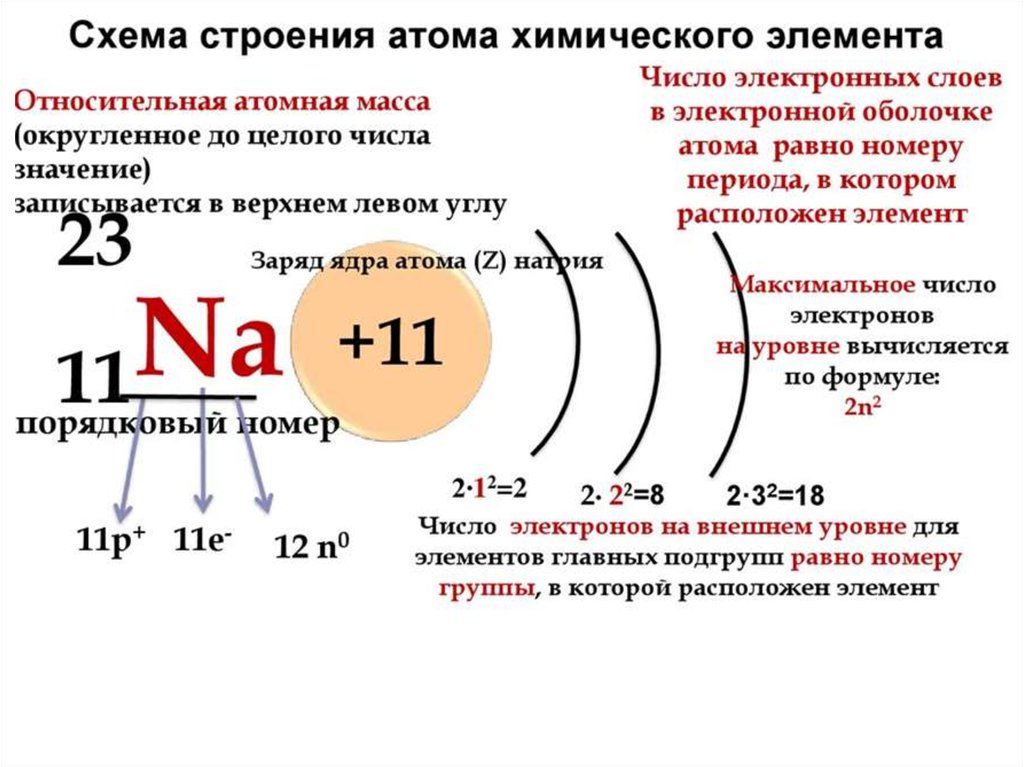
На основе электронных конфигураций периодическую таблицу можно разделить на блоков, обозначающих, какой подуровень находится в процессе заполнения. Блоки \(s\), \(p\), \(d\) и \(f\) показаны ниже.
На рисунке также показано, как \( г\) подуровень всегда на один главный уровень отстает от периода, в котором этот подуровень встречается. Другими словами, подуровень \(3d\) заполняется в течение четвертого периода. Подуровень \(f\) всегда отстает на два уровня. Подуровень \(4f\) принадлежит шестому периоду.
youtube.com/embed/hJ0WwAGSjlc?vq=hd1080″ frameborder=”0″ allowfullscreen=”true”>Резюме
- Горизонтальные ряды периодической таблицы называются периодами.
- Длина периода зависит от того, сколько электронов необходимо, чтобы занять подуровни, заполняющие период.
- Блоки указывают, какой подуровень заполняется.
Обзор
- Как называются горизонтальные ряды периодической таблицы?
- Какой подуровень заполняется в периоде 1?
- Какой подуровень заполняется в периоде 7?
- Как электронная конфигурация элемента дает информацию о периоде, в котором он находится?
- В каком блоке элементов заполнены \(d\) подуровни?
Эта страница под названием 6.8: Блоки периодической таблицы распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts.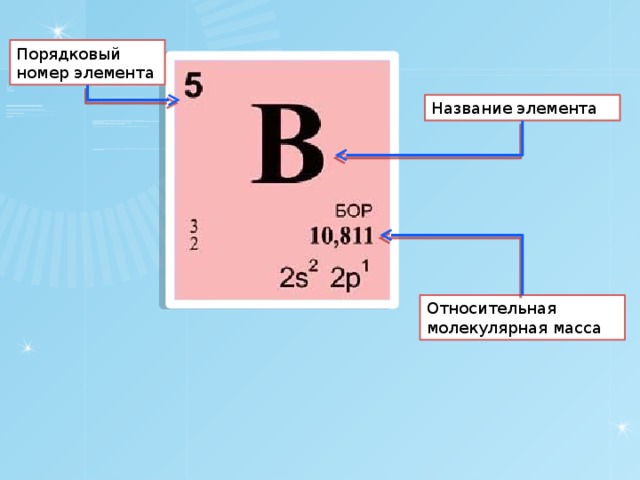 ; подробная история редактирования доступна по запросу.
; подробная история редактирования доступна по запросу.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.
- Теги
- источник@https://flexbooks.
 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
- источник@https://flexbooks.
Периодическая таблица | Безграничная химия |
Периодическая таблица
Периодическая таблица показывает все элементы и их физические свойства; он организован на основе атомных номеров и электронных конфигураций.
Цели обучения
Определите общие периодические тенденции, которые можно вывести из периодической таблицы элементов
Ключевые выводы
Ключевые моменты
- В периодической таблице перечислены все элементы с информацией об их атомном весе, химических символах и атомных номерах.
- Расположение периодической таблицы позволяет нам визуализировать определенные тенденции среди атомов.
- Вертикальные столбцы (группы) таблицы Менделеева расположены так, что все ее элементы имеют одинаковое количество валентных электронов. Таким образом, все элементы в пределах определенной группы имеют схожие свойства.

Ключевые термины
- атомный номер : число, равное количеству протонов в атоме, которое определяет его химические свойства. Символ: Z
- группа : Вертикальный столбец в периодической таблице, обозначающий количество электронов валентной оболочки в атоме элемента.
- период : Горизонтальная строка в периодической таблице, обозначающая общее количество электронных оболочек в атоме элемента.
Символы элементов
Периодическая таблица имеет структуру сетки 18 X 7, расположенную над меньшим двойным рядом элементов. Периодическая таблица содержит только химические элементы и включает каждый изотоп каждого элемента в пределах одной ячейки. В типичной периодической таблице каждый элемент указан по символу элемента и атомному номеру. Например, «H» обозначает водород, «Li» обозначает литий и так далее. Большинство элементов представлены первой буквой или первыми двумя буквами их английского имени, но есть некоторые исключения. Два заметных исключения включают серебро и ртуть. Символ серебра – «Ag» от латинского 9.0260 argentum, , что означает «серый» или «блестящий». Символ ртути — «Hg» от латинизированного греческого Hydrargyrum, , что означает «вода-серебро». Многие периодические таблицы также включают полное название элемента и цветовую кодировку элементов в зависимости от их фазы при комнатной температуре (твердое, жидкое или газообразное).
Два заметных исключения включают серебро и ртуть. Символ серебра – «Ag» от латинского 9.0260 argentum, , что означает «серый» или «блестящий». Символ ртути — «Hg» от латинизированного греческого Hydrargyrum, , что означает «вода-серебро». Многие периодические таблицы также включают полное название элемента и цветовую кодировку элементов в зависимости от их фазы при комнатной температуре (твердое, жидкое или газообразное).
Периодическая таблица : Периодическая таблица представляет собой табличное отображение всех химических элементов. Атомы сгруппированы в порядке возрастания атомного номера.
Строки и периоды
Символ элемента почти всегда сопровождается другой информацией, такой как атомный номер и атомный вес. Атомный номер описывает количество протонов в одном атоме этого элемента. Например, атом кислорода содержит 8 протонов. Элементы перечислены в порядке возрастания атомного номера слева направо.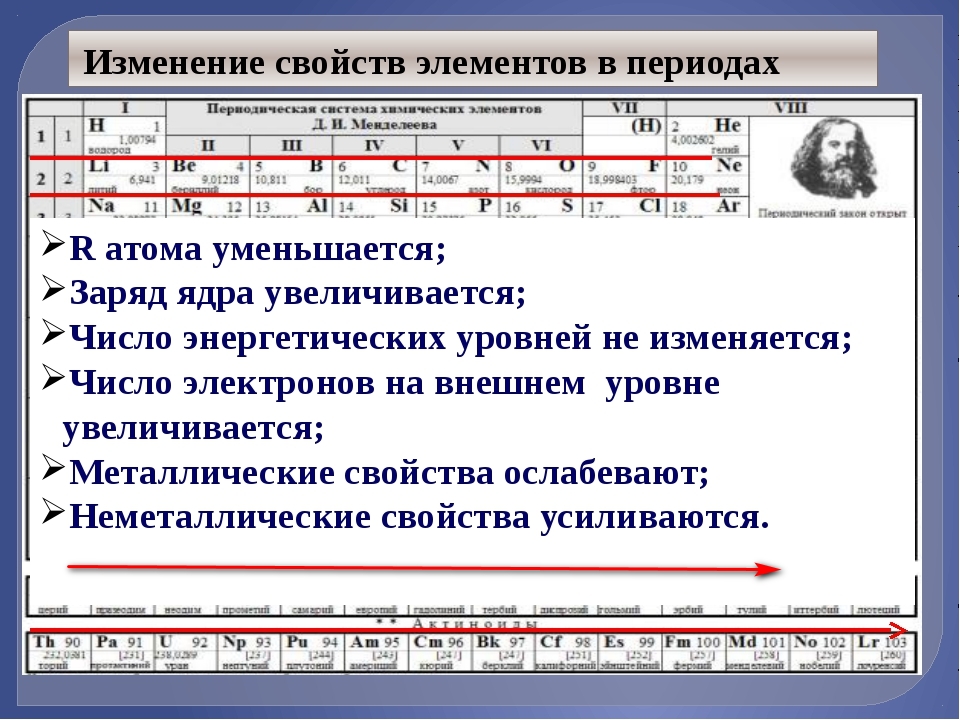 Каждая строка периодической таблицы называется периодом, а каждый столбец периодической таблицы называется группой (или семейством). Некоторые группы имеют определенные названия, такие как галогены или благородные газы. Элементы одного периода или группы имеют схожие свойства.
Каждая строка периодической таблицы называется периодом, а каждый столбец периодической таблицы называется группой (или семейством). Некоторые группы имеют определенные названия, такие как галогены или благородные газы. Элементы одного периода или группы имеют схожие свойства.
Определение химических свойств с помощью Периодической таблицы
Химические свойства каждого элемента определяются электронной конфигурацией элемента и, в частности, его внешними валентными электронами. Положение элемента в периодической таблице во многом зависит от его электронов; количество электронов валентной оболочки определяет его группу, а тип орбитали, на которой лежат валентные электроны, определяет блок элемента. Кроме того, общее количество электронных оболочек атома определяет, к какому периоду он принадлежит. Из-за своей структуры таблица Менделеева стала чрезвычайно полезным инструментом для оценки и предсказания трендов в элементах и химическом составе.
Химия 3.1 Введение в периодическую таблицу — YouTube : введение в периодическую таблицу, в которой металлы, неметаллы и металлоиды идентифицируются по местоположению, а также сравниваются и противопоставляются физические свойства металлов и неметаллов.
Молекулы
Молекулы представляют собой электрически нейтральные соединения, состоящие из нескольких атомов, связанных друг с другом химическими связями.
Цели обучения
Знать общие свойства молекул
Ключевые выводы
Ключевые моменты
- Молекулы нейтральны и не несут никакого заряда.
- Молекула может состоять из неметаллических атомов одного химического элемента, как в случае кислорода (O 2 ), или из разных элементов, как в случае воды (H 2 O).

- Геометрия и состав молекулы определяют ее химические и физические свойства.
- Изомеры — это молекулы с одинаковыми атомами в разном геометрическом расположении.
Ключевые термины
- ковалентный : когда 2 или более неметаллических атома связаны друг с другом за счет общих электронов.
- изомер : Молекулы с одинаковым числом атомов в различном геометрическом расположении.
- соединение : когда два или более различных атома связаны вместе ковалентной связью. Все соединения являются молекулами, но не все молекулы являются соединениями.
- молекула : два или более атома, которые удерживаются вместе химической ковалентной связью.
Атомы и молекулы
Атом определяется как основная единица материи, которая содержит централизованное плотное ядро, окруженное электронным облаком. Когда два или более атома удерживаются вместе химической ковалентной связью, эта новая сущность известна как молекула. Слово «молекула» является расплывчатым термином, и в разговорной речи оно имеет разные значения в разных областях исследования. Например, термин «молекулы» используется в кинетической теории газов по отношению к любым частицам газа независимо от их состава.
Слово «молекула» является расплывчатым термином, и в разговорной речи оно имеет разные значения в разных областях исследования. Например, термин «молекулы» используется в кинетической теории газов по отношению к любым частицам газа независимо от их состава.
Чаще всего термин «молекулы» относится к нескольким атомам; молекула может состоять из одного химического элемента, например кислорода (O 2 ), или из нескольких элементов, таких как вода (H 2 O). Молекулы нейтральны и не несут заряда; это свойство отличает их от многоатомных ионов, таких как нитрат (NO 3 – ).
молекула кофеина : Кофеин представляет собой сложную молекулу, состоящую из множества атомов, связанных друг с другом в определенном порядке.
Размер молекулы варьируется в зависимости от количества атомов, составляющих молекулу. Большинство молекул слишком малы, чтобы их можно было увидеть невооруженным глазом.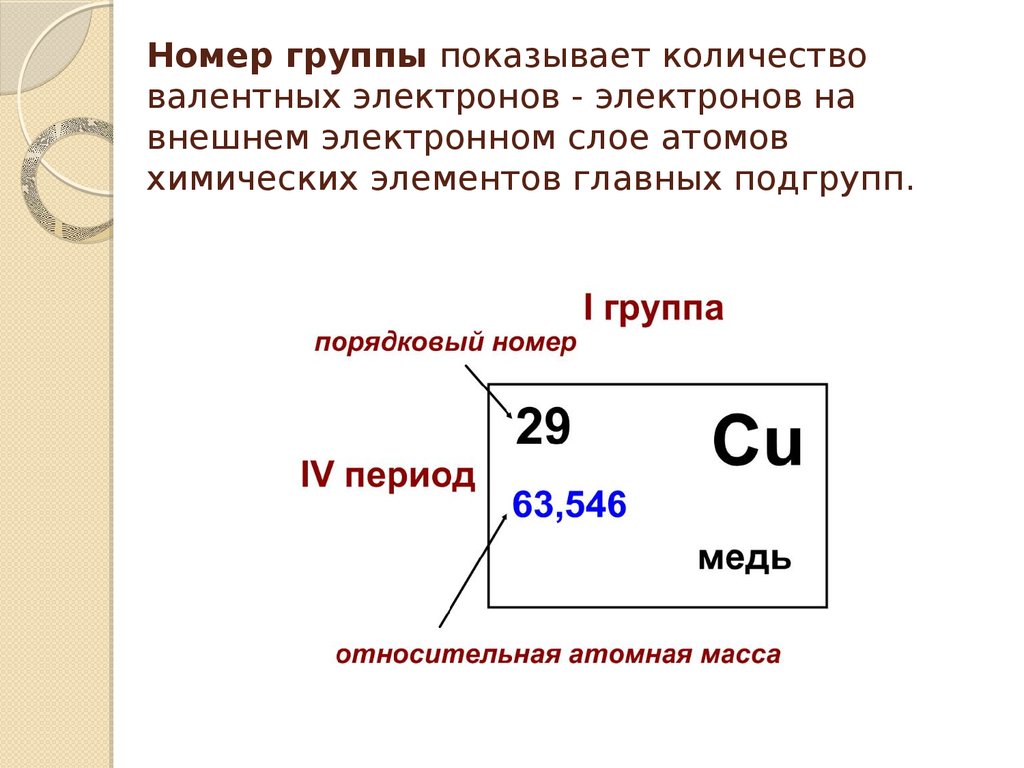 Наименьшей молекулой является двухатомный водород (H 2 ) с длиной связи 0,74 ангстрема. Макромолекулы — это большие молекулы, состоящие из более мелких субъединиц; этот термин из биохимии относится к нуклеиновым кислотам, белкам, углеводам и липидам. Некоторые макромолекулы можно наблюдать в специализированные микроскопы.
Наименьшей молекулой является двухатомный водород (H 2 ) с длиной связи 0,74 ангстрема. Макромолекулы — это большие молекулы, состоящие из более мелких субъединиц; этот термин из биохимии относится к нуклеиновым кислотам, белкам, углеводам и липидам. Некоторые макромолекулы можно наблюдать в специализированные микроскопы.
Часто состав соединения можно также обозначить эмпирической формулой, которая представляет собой простейшее целочисленное соотношение составляющих его химических элементов. Однако эта эмпирическая формула не всегда описывает конкретную рассматриваемую молекулу, поскольку она дает только соотношение его элементов. Полный элементный состав молекулы может быть точно представлен ее молекулярной формулой, которая указывает точное количество атомов, находящихся в молекуле.
Пример
- C 6 H 12 O 6 = молекулярная формула глюкозы
- CH 2 O = эмпирическая формула (упрощенное соотношение) для глюкозы
Изомеры
Изомеры — это молекулы с одними и теми же атомами в разном геометрическом расположении.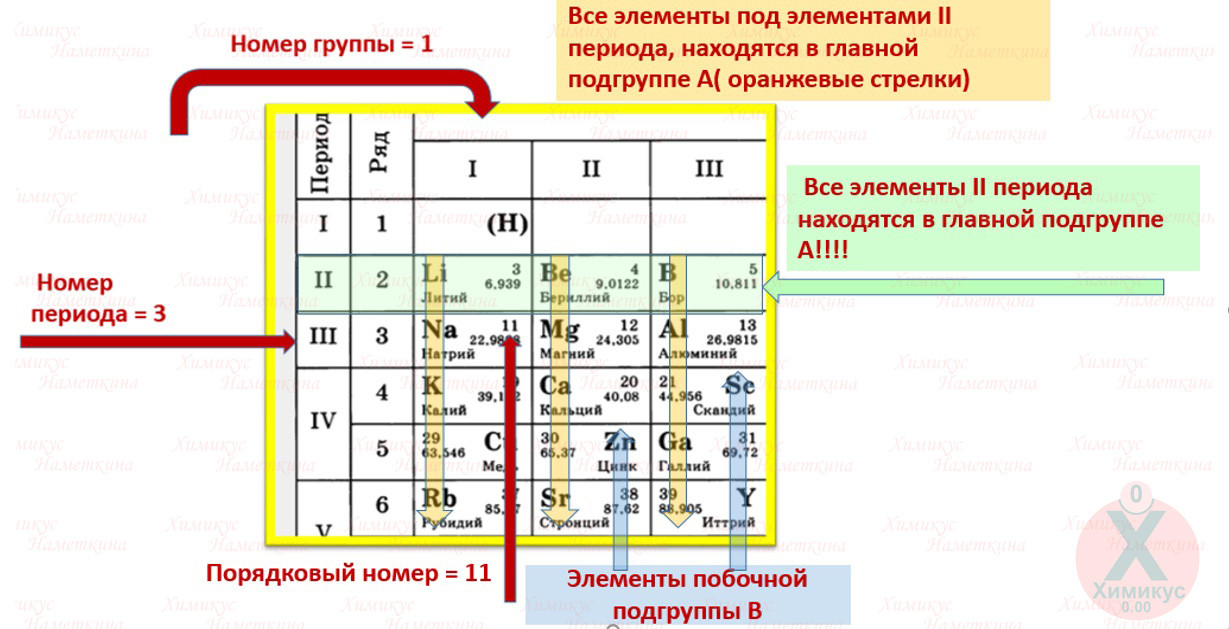 Из-за такого различного расположения изомеры часто имеют очень разные химические и физические свойства. На картинке ниже 1-пропанол в основном используется в синтезе других соединений и имеет менее неприятный запах, тогда как 2-пропанол — обычный бытовой спирт.
Из-за такого различного расположения изомеры часто имеют очень разные химические и физические свойства. На картинке ниже 1-пропанол в основном используется в синтезе других соединений и имеет менее неприятный запах, тогда как 2-пропанол — обычный бытовой спирт.
структурные изомеры пропанола : Химическая формула пропанола (C 3 H 7 OH) описывает несколько различных молекул, которые различаются положением спирта (ОН). Каждая молекула является структурным изомером другой.
Ионы
Ион — это атом или молекула, обладающая суммарным электрическим зарядом, поскольку общее количество электронов не равно количеству протонов.
Цели обучения
Сравните разные классы ионов
Основные выводы
Ключевые моменты
- Ионы образуются, когда количество протонов в атоме не равно количеству электронов. Если присутствует больше протонов, ион положительный и известен как катион; если присутствует больше электронов, ион отрицателен и называется анионом.

- Ионы являются высокореактивными частицами. Обычно они находятся в газообразном состоянии и не встречаются в изобилии на Земле. Они отталкиваются от одинаковых электрических зарядов и притягиваются к противоположным зарядам.
- Электронное облако атома определяет размер атома; добавленные электроны (анионы) увеличивают отталкивание электронов, увеличивая размер иона, в то время как катионы (с меньшим количеством электронов) меньше атома, потому что в облаке меньше электронов, которые отталкивают друг друга.
Ключевые термины
- ион : Атом или группа атомов, несущих электрический заряд, например атомы натрия и хлора в солевом растворе.
- анион : Ионы, которые заряжены отрицательно, потому что у них больше электронов, чем протонов.
- катион : Ионы, которые заряжены положительно, потому что у них больше протонов, чем электронов.
Атом — это основная единица материи, состоящая из плотного ядра, состоящего из положительно заряженных протонов и нейтральных нейтронов, которое окружено облаком отрицательно заряженных электронов. Если атом имеет одинаковое количество протонов и электронов, он электронно нейтрален. Однако, если общее количество электронов не равно количеству протонов, атом имеет суммарный электрический заряд.
Если атом имеет одинаковое количество протонов и электронов, он электронно нейтрален. Однако, если общее количество электронов не равно количеству протонов, атом имеет суммарный электрический заряд.
Любой атом или молекула с суммарным зарядом, положительным или отрицательным, называется ионом. Ион, состоящий из одного атома, является одноатомным ионом; ион, состоящий из двух или более атомов, называется многоатомным ионом. Положительный электрический заряд протона равен по величине отрицательному заряду электрона; следовательно, чистый электрический заряд иона равен количеству его протонов минус количество электронов.
Ионы являются высокореактивными веществами. Обычно они находятся в газообразном состоянии и не встречаются в изобилии на Земле. Ионы в жидком или твердом состоянии образуются при взаимодействии солей с их растворителями. Они отталкиваются от одинаковых электрических зарядов и притягиваются к противоположным зарядам.
Типы ионов
Существуют специальные типы ионов.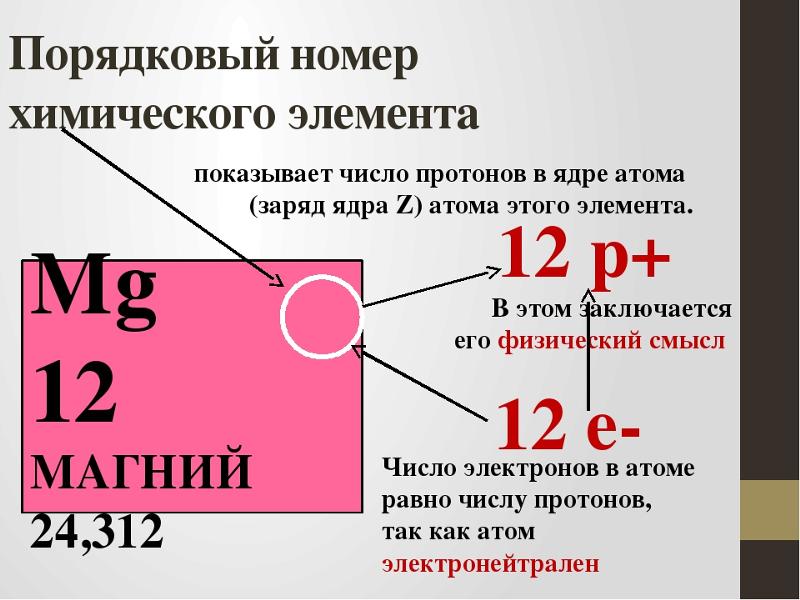 Анионы имеют больше электронов, чем протонов, и поэтому имеют общий отрицательный заряд. Катионы имеют больше протонов, чем электронов, и поэтому имеют положительный заряд. Цвиттерионы нейтральны и имеют как положительные, так и отрицательные заряды в разных местах молекулы. Анионы обычно крупнее исходной молекулы или атома, потому что избыточные электроны отталкивают друг друга и увеличивают физический размер электронного облака. Катионы обычно меньше, чем их родительский атом или молекула, из-за меньшего размера их электронных облаков.
Анионы имеют больше электронов, чем протонов, и поэтому имеют общий отрицательный заряд. Катионы имеют больше протонов, чем электронов, и поэтому имеют положительный заряд. Цвиттерионы нейтральны и имеют как положительные, так и отрицательные заряды в разных местах молекулы. Анионы обычно крупнее исходной молекулы или атома, потому что избыточные электроны отталкивают друг друга и увеличивают физический размер электронного облака. Катионы обычно меньше, чем их родительский атом или молекула, из-за меньшего размера их электронных облаков.
Ионы водорода : Показана взаимосвязь между молекулой, ее катионом и анионом.
Ион обозначается записью его суммарного отрицательного заряда в верхнем индексе сразу после химической структуры атома/молекулы. Обычно чистый заряд записывается с величиной перед знаком; величина однозарядных молекул/атомов обычно не указывается. Одноатомные ионы иногда также обозначаются римскими цифрами, которые обозначают формальную степень окисления элемента, тогда как цифры в верхнем индексе обозначают суммарный заряд.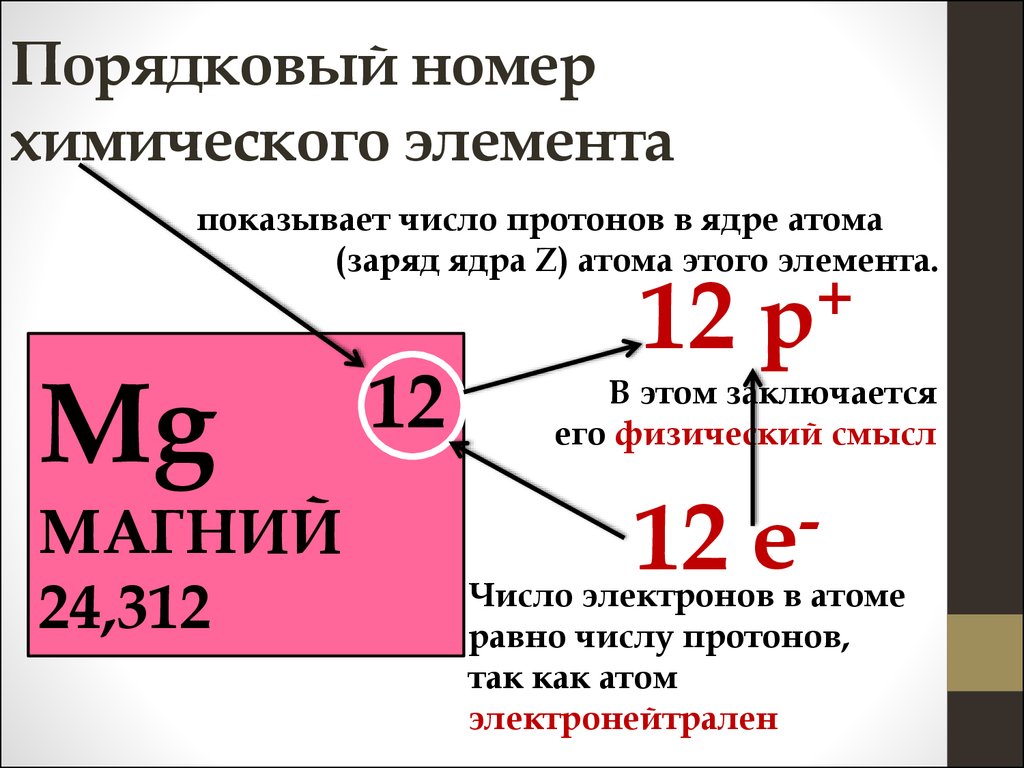 Например, Fe 2+ можно обозначить как Fe(II). Эти представления можно считать эквивалентными для одноатомных ионов, но римские цифры нельзя применять к многоатомным ионам.
Например, Fe 2+ можно обозначить как Fe(II). Эти представления можно считать эквивалентными для одноатомных ионов, но римские цифры нельзя применять к многоатомным ионам.
Формирующие ионы
Ионы могут образовываться в результате ионизации, которая представляет собой процесс потери или приобретения электронов нейтральным атомом. Как правило, электроны либо добавляются к валентной оболочке атома, либо теряются; электроны внутренней оболочки более прочно связаны с положительно заряженным ядром и поэтому не участвуют в этом типе химического взаимодействия.
Ионизация обычно включает перенос электронов между атомами или молекулами. Этот процесс мотивирован достижением более стабильных электронных конфигураций, таких как правило октетов, которое гласит, что самые стабильные атомы и ионы имеют восемь электронов в их самой внешней (валентной) оболочке. Многоатомные и молекулярные ионы также могут образовываться, как правило, за счет приобретения или потери элементарных ионов, таких как H + , в нейтральных молекулах.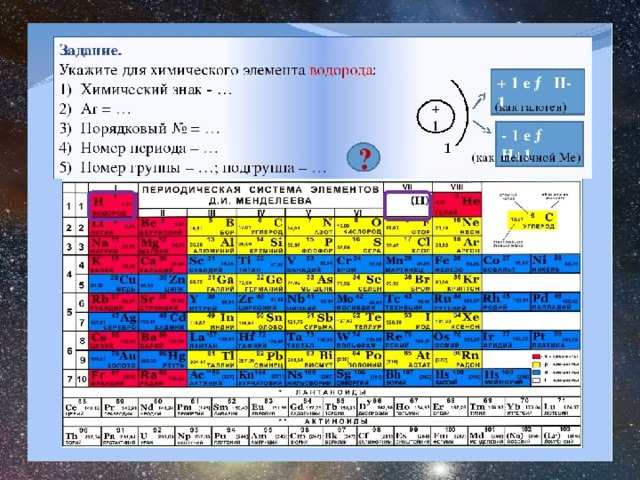 Многоатомные ионы обычно очень нестабильны и реакционноспособны.
Многоатомные ионы обычно очень нестабильны и реакционноспособны.
Типичным примером иона является Na + . Натрий имеет заряд +1, потому что натрий имеет одиннадцать электронов. Однако, согласно правилу октета, натрий был бы более стабильным с 10 электронами (2 в самой внутренней его оболочке, 8 в самой внешней оболочке). Следовательно, натрий имеет тенденцию терять электрон, чтобы стать более стабильным. С другой стороны, хлор имеет тенденцию приобретать электрон, чтобы стать Cl –. У хлора, естественно, 17 электронов, но он был бы более стабильным с 18 электронами (2 в его самой внутренней оболочке, 8 во второй оболочке и 8 в его валентной оболочке). Следовательно, хлор заберет электрон у другого атома, чтобы стать отрицательно заряженным.
Периодические свойства: Часть 3, Ионный радиус, Прогнозирование ионных зарядов — YouTube : Продолжение обсуждения периодических свойств, включая ионный радиус и способы предсказания ионных зарядов.
Лицензии и ссылки
Контент под лицензией CC, совместно используемый ранее
- Курирование и пересмотр. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
Лицензионный контент CC, конкретное указание авторства
- Периодические тренды. Предоставлено : Википедия. Лицензия : CC BY-SA: Attribution-ShareAlike
- Периодическая таблица. Предоставлено : Википедия. Лицензия : CC BY-SA: Группа Attribution-ShareAlike
- . Предоставлено : Викисловарь. Лицензия : CC BY-SA: Attribution-ShareAlike
- период. Предоставлено : Википедия. Лицензия : CC BY-SA: Attribution-ShareAlike
- атомный номер. Предоставлено : Викисловарь. Лицензия : CC BY-SA: Attribution-ShareAlike
- Периодическая%20таблица%20%20%20элементов.
 Предоставлено : Wikimedia. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Wikimedia. Лицензия : CC BY-SA: Attribution-ShareAlike - Химия 3.1 Введение в периодическую таблицу — YouTube. Лицензия : Общественное достояние: Нет данных Copyright . Условия лицензии : Стандартная лицензия YouTube
- Молекула. Предоставлено : Википедия. Лицензия : CC BY-SA: Attribution-ShareAlike
- молекулярная геометрия. Предоставлено : Википедия. Лицензия : CC BY-SA: Attribution-ShareAlike
- Периодическая%20таблица%20%20%20элементов. Предоставлено : Wikimedia. Лицензия : CC BY-SA: Attribution-ShareAlike
- Химия 3.1 Введение в периодическую таблицу — YouTube. Лицензия : Общественное достояние: нет данных Copyright . Условия лицензии : Стандартная лицензия YouTube
- молекула кофеина.
 png. Предоставлено : wikipedia. Лицензия : CC BY-SA: Attribution-ShareAlike
png. Предоставлено : wikipedia. Лицензия : CC BY-SA: Attribution-ShareAlike - propanol.gif. Предоставлено : зеленая планета, солнечная энергия. Расположен по адресу : http://www.green-planet-solar-energy.com/этанол.html. Лицензия : Общественное достояние: Нет данных Copyright
- Ион. Предоставлено : Википедия. Лицензия : CC BY-SA: Attribution-ShareAlike
- ion. Предоставлено : Викисловарь. Лицензия : CC BY-SA: Attribution-ShareAlike
- zwitterion. Предоставлено : Викисловарь. Лицензия : CC BY-SA: Attribution-ShareAlike
- электронное облако. Предоставлено : Викисловарь. Лицензия : CC BY-SA: Attribution-ShareAlike
- Периодическая%20таблица%20%20%20элементов.
 Предоставлено : Wikimedia. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Wikimedia. Лицензия : CC BY-SA: Attribution-ShareAlike - Химия 3.1 Введение в периодическую таблицу — YouTube. Лицензия : Общественное достояние: Нет данных Copyright . Условия лицензии : Стандартная лицензия YouTube
- молекула кофеина.png. Предоставлено : wikipedia. Лицензия : CC BY-SA: Attribution-ShareAlike
- пропанол.gif. Предоставлено : зеленая планета, солнечная энергия. Расположен по адресу : http://www.green-planet-solar-energy.com/этанол.html. Лицензия : Общественное достояние: неизвестно Авторские права
- Ионы. Предоставлено : Википедия. Лицензия : CC BY-SA: Attribution-ShareAlike
- Периодические свойства: Часть 3, Ионный радиус, Прогнозирование ионных зарядов — YouTube.
 Лицензия : Общественное достояние: Авторские права неизвестны . Условия лицензии : Стандартная лицензия YouTube
Лицензия : Общественное достояние: Авторские права неизвестны . Условия лицензии : Стандартная лицензия YouTube
О чем говорят номер группы и номер периода?
от Admin
Номер группы говорит вам об общем числе электронов, присутствующих на самой внешней орбите атома.
Другими словами, номер группы сообщает вам число валентных электронов атома.
Например,
Рассмотрим группу 1 Периодической таблицы.
Группа 1 указывает, что элементы, лежащие в этой группе, имеют только 1 электрона на внешней орбите.
Другими словами, группа 1 элементов имеет 1 валентных электрона.
Аналогичным образом рассмотрим группу 2 периодической таблицы.
Группа 2 означает, что элементы, лежащие в этой группе, имеют 2 электрона на самой внешней орбите.
Или мы можем сказать, что эти элементы группы 2 имеют 2 валентных электрона.
Аналогично, запомните это;
Элементы 13 группы имеют 3 валентных электрона, а не 13.
Элементы 14 группы имеют 4 валентных электрона, а не 14.
Элементы 15 группы имеют 5 валентных электронов, а не 15. 16.
Элементы 17 группы имеют 7 валентных электронов, а не 17.
Элементы 18 группы имеют 8 валентных электронов, а не 18.
( Боковое примечание: элементы d-блока и элементы f-блока не показывают то же количество валентных электронов, что и их номер группы.
Например, элементы группы 3 d-блока должны иметь 3 электрона на самой внешней орбите. . Но у них есть 2 электрона на самой внешней орбите.
Аналогично, элементы группы 4 d-блока должны иметь 4 электрона на самой внешней орбите, но у них также есть 2 электрона на самой внешней орбите.
Это потому, что элементы d-блока имеют самые внешние электроны. на s-орбиталях, а также на d-орбиталях.
на s-орбиталях, а также на d-орбиталях.
Кроме того, эти элементы d-блока имеют неполные d-орбитали.
Таким образом, в химической реакции участвуют электроны как s-орбиталей, так и d-орбиталей.
Точно так же элементы f-блока имеют неполные f-орбитали.
И здесь также в химической реакции участвуют электроны как s-орбиталей, так и f-орбиталей.
Следовательно, элементы d-блока и f-блока имеют переменную валентность или разные валентные электроны, отличные от номера группы.)
Запутались?? Касса Интерактивная периодическая таблица (где вы найдете расположение электронов для каждого элемента.)
Посмотрите, как эта интерактивная таблица Менделеева поможет вам
- Вы можете легко найти каждую деталь об элементах из этой единственной интерактивной таблицы Менделеева.
- Вы получите подробную информацию о таблице Менделеева, которая превратит новичка в профессионала.

- Вы также получите HD изображения Периодической таблицы (БЕСПЛАТНО).
Посещение ➢ Таблица Менделеева
О чем говорит номер периода?Номер периода в Периодической таблице говорит вам об общем числе орбит, которые будет иметь атом.
Другими словами, номер периода указывает количество энергетических уровней (или энергетических орбит) атома.
Например,
1 st период указывает на то, что эти элементы обладают 1 энергетической оболочкой (или энергетической орбитой).
2 й период указывает на то, что эти элементы обладают 2 энергетическими оболочками.
3 -й период указывает на то, что эти элементы обладают 3 энергетическими оболочками.
4 -й период указывает на то, что эти элементы обладают 4 энергетическими оболочками.
5 -й период указывает на то, что эти элементы обладают 5 энергетическими оболочками.
6 -й период указывает на то, что эти элементы обладают 6 энергетические снаряды.
И, наконец,
7 -й период указывает на то, что эти элементы обладают 7 энергетическими оболочками.
Заключительные словаГруппы и периоды очень важны в периодической таблице.
Элементы расположены в соответствии с их атомным номером в современной периодической таблице.
Элементы, находящиеся в одних и тех же группах, имеют одинаковое количество электронов на самой внешней орбите (т.е. 1-я группа имеет 1 электрон на самой внешней орбите, 2-я группа имеет 2 электрона на самой внешней орбите, 13-я группа имеет 3, 14-я группа имеет 4 и так далее …)
Также периоды таблицы Менделеева указывают количество энергетических орбит или энергетических оболочек атома.
Элементы периода 1 имеют 1 энергетическую оболочку, элементы периода 2 имеют 2 энергетические оболочки и так далее…
На этом тема завершена.
Надеюсь, теперь вы знаете, что номер группы и номер периода говорят вам об атоме в периодической таблице.
Если у вас есть какие-либо сомнения, не стесняйтесь спрашивать меня в комментариях ниже.
Также дайте знать, помогла вам эта статья или нет?
Бесплатный подарок для вас: Интерактивная таблица МенделееваПозвольте мне рассказать вам, как эта Интерактивная таблица Менделеева поможет вам в учебе.
1). Вы можете легко найти каждую деталь об элементах из этой единственной интерактивной периодической таблицы.
(Интерактивную периодическую таблицу можно просматривать на ноутбуке/настольном компьютере для лучшего восприятия. Если вы пользуетесь мобильным устройством, используйте «режим сайта рабочего стола», чтобы просмотреть интерактивную периодическую таблицу)
2).

 255 №№ 1–3
255 №№ 1–3 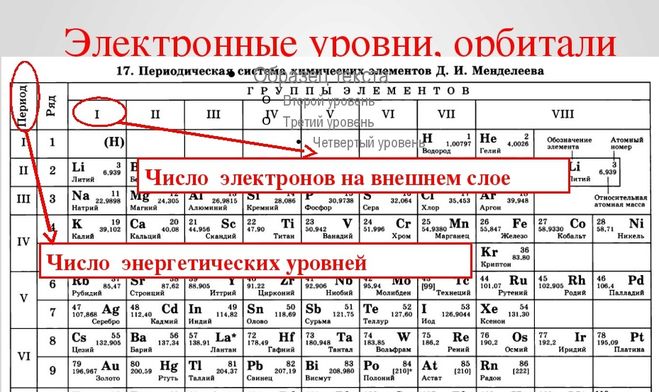 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/


 Предоставлено : Wikimedia. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Wikimedia. Лицензия : CC BY-SA: Attribution-ShareAlike  png. Предоставлено : wikipedia. Лицензия : CC BY-SA: Attribution-ShareAlike
png. Предоставлено : wikipedia. Лицензия : CC BY-SA: Attribution-ShareAlike 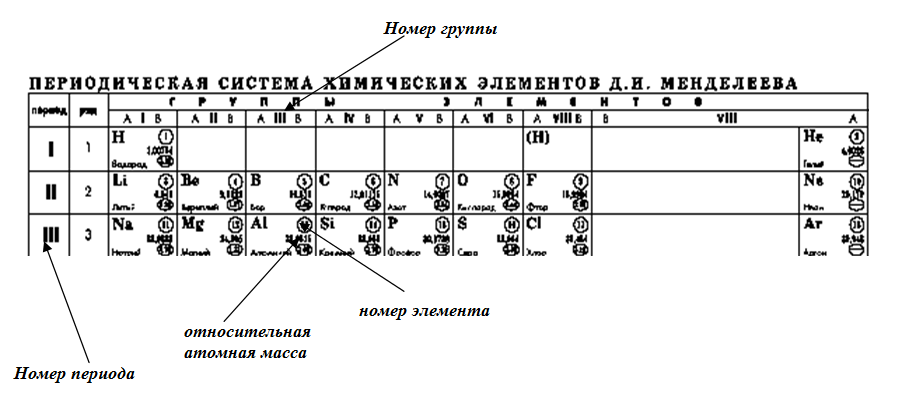 Предоставлено : Wikimedia. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Wikimedia. Лицензия : CC BY-SA: Attribution-ShareAlike  Лицензия : Общественное достояние: Авторские права неизвестны . Условия лицензии : Стандартная лицензия YouTube
Лицензия : Общественное достояние: Авторские права неизвестны . Условия лицензии : Стандартная лицензия YouTube