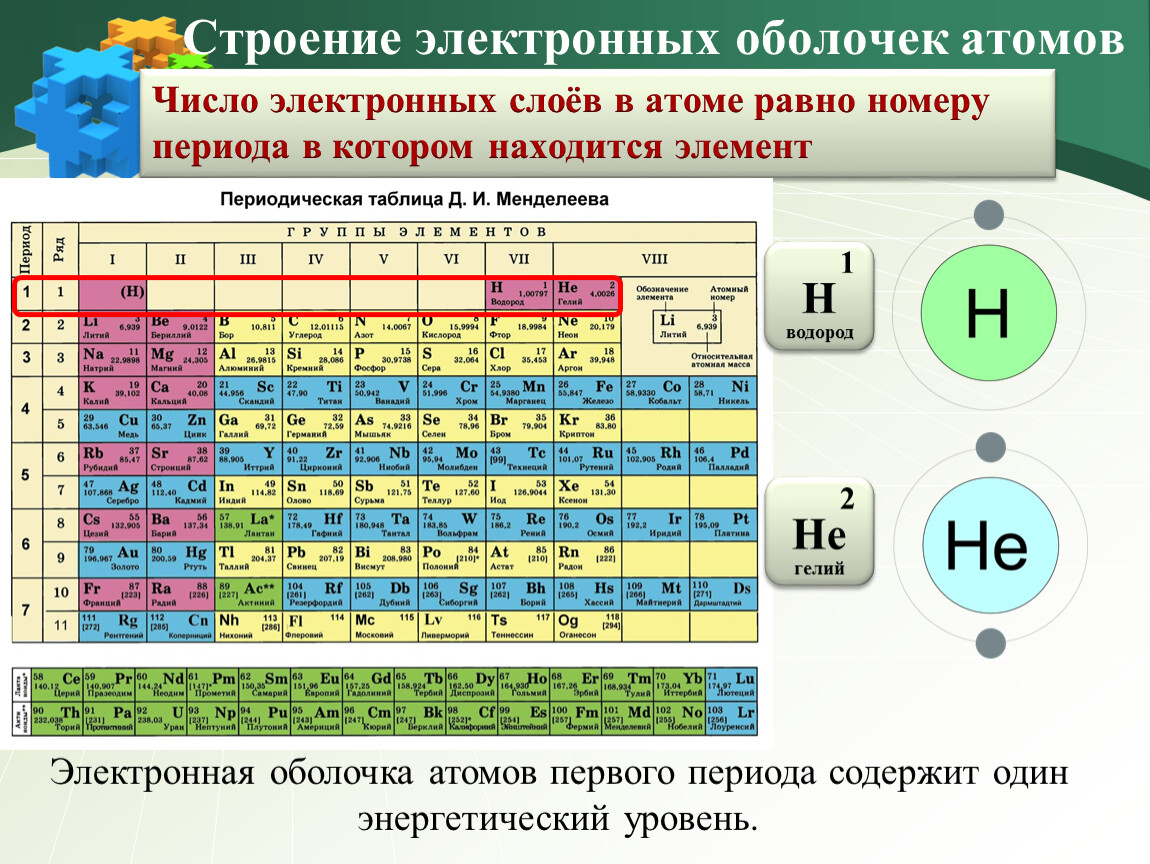
1.3. Таблица Менделеева – Азбука химии
[МУЗЫКА] [МУЗЫКА] [МУЗЫКА] Я думаю, что если у десяти случайных прохожих спросить, с чем у них ассоциируется химия, то девять однозначно ответят: с периодической системой Дмитрия Ивановича Менделеева. Давайте познакомимся с этой таблицей подробнее. Итак, сейчас известно 118 элементов, и все они имеют свои названия. Последние элементы получили названия в конце 2016 года. Все элементы расположены в периодической системе в порядке возрастания заряда ядра. Однако Менделеев изначально располагал элементы в порядке возрастания атомных масс элементов. Однако уже при жизни Менделеева были открыты инертные газы, которые не имели в первоначальном варианте таблицы своего положения. Эту проблему очень легко разрешил Дмитрий Иванович: он сказал, что необходимо добавить еще одну группу и пошел на нарушение своего собственного принципа — он расположил аргон, имеющего атомную массу 40, перед калием, у которого атомная масса 39. Дело в том, что Менделеев ориентировался не только на атомный вес, но также еще и на сходство химических свойств.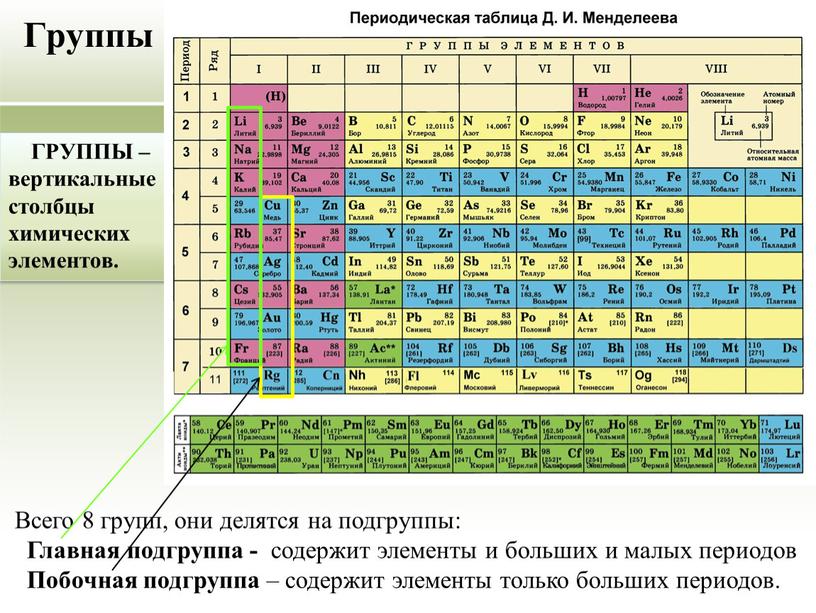 Как же устроена периодическая система? Мы ее называем периодической, поскольку в ней есть периоды. Период — это последовательность химических элементов по возрастанию заряда ядра их атома, в которых происходит заполнение внешних электронных оболочек. Существуют два варианта периодической системы в зависимости от того, как изображены периоды. Длинный периодный вариант, рекомендованный IUPAC, в нем все элементы одного периода располагаются в одну строчку. Или короткопериодный вариант — этот вариант особенно популярен на территории России. В этом варианте один период может записываться в две строки. Такая табличка получается более компактной и в чем-то даже более удобной для использования. Кроме того, в периодической системе есть еще и группы. Группы — это тоже последовательность атомов по возрастанию заряда ядра, однако эти атомы обладают однотипным электронным строением. То есть в них происходит заполнение однотипных атомных орбиталей. В короткопериодном варианте периодической системы группы дополнительно разделяются на главную и побочную подгруппу.
Как же устроена периодическая система? Мы ее называем периодической, поскольку в ней есть периоды. Период — это последовательность химических элементов по возрастанию заряда ядра их атома, в которых происходит заполнение внешних электронных оболочек. Существуют два варианта периодической системы в зависимости от того, как изображены периоды. Длинный периодный вариант, рекомендованный IUPAC, в нем все элементы одного периода располагаются в одну строчку. Или короткопериодный вариант — этот вариант особенно популярен на территории России. В этом варианте один период может записываться в две строки. Такая табличка получается более компактной и в чем-то даже более удобной для использования. Кроме того, в периодической системе есть еще и группы. Группы — это тоже последовательность атомов по возрастанию заряда ядра, однако эти атомы обладают однотипным электронным строением. То есть в них происходит заполнение однотипных атомных орбиталей. В короткопериодном варианте периодической системы группы дополнительно разделяются на главную и побочную подгруппу. Дело в том, что в главной подгруппе заполняются только s- или p-электроны, а в побочных подгруппах также d-электроны. Некоторые группы элементов имеют собственные групповые названия. Так, первая A группа, то есть главная подгруппа первой группы периодической системы, или просто первая в длиннопериодном варианте периодической таблицы, имеет название «Щелочные металлы». Там расположены элементы металлы, которые могут образовывать сильные основания — щелочи. Вторая A группа, то есть главная подгруппа второй группы, — это щелочно-земельные элементы. Пятая A группа, или 15-я группа в длиннопериодном варианте, — это элементы пниктогены. Однако такое название редко используется. Шестая A группа, или 16-я группа в длиннопериодном варианте — это элементы халькогены, то есть рождающие руду. Седьмая A группа — галогены, то есть рождающие соли. И наконец восьмая A группа — это инертные, или благородные, газы. Помимо разделения элементов на группы и периоды, можно выделять еще и отдельные семейства элементов.
Дело в том, что в главной подгруппе заполняются только s- или p-электроны, а в побочных подгруппах также d-электроны. Некоторые группы элементов имеют собственные групповые названия. Так, первая A группа, то есть главная подгруппа первой группы периодической системы, или просто первая в длиннопериодном варианте периодической таблицы, имеет название «Щелочные металлы». Там расположены элементы металлы, которые могут образовывать сильные основания — щелочи. Вторая A группа, то есть главная подгруппа второй группы, — это щелочно-земельные элементы. Пятая A группа, или 15-я группа в длиннопериодном варианте, — это элементы пниктогены. Однако такое название редко используется. Шестая A группа, или 16-я группа в длиннопериодном варианте — это элементы халькогены, то есть рождающие руду. Седьмая A группа — галогены, то есть рождающие соли. И наконец восьмая A группа — это инертные, или благородные, газы. Помимо разделения элементов на группы и периоды, можно выделять еще и отдельные семейства элементов. Самым естественным разделением элементов на семейства является разделение их по электронному строению. Так, можно выделить электронное семейство s-элементов, p-элементов, d-элементов и f-элементов. Особенно ярко они появляются в длиннопериодном варианте таблицы, потому что здесь эти элементы занимают отдельные прямоугольные блоки. В короткопериодном варианте эти элементы начинают пересекаться, однако при определенной сноровке и тренировке вы сможете легко отличить s- и p-элементы от d-элементов в периодической системе в короткопериодной ее форме. По общности химических свойств часто объединяют некоторые и другие элементы. Например, выделяют триаду железа, которая содержит железо, кобальт и никель. И платиновые металлы: рутений, родий, палладий, осмий, иридий и платина. Если к ним добавить серебро и золото, то такое семейство можно назвать благородные металлы. Переходными металлами называют d-элементы за исключением последних d-элементов. Всего можно выделить несколько переходных рядов.
Самым естественным разделением элементов на семейства является разделение их по электронному строению. Так, можно выделить электронное семейство s-элементов, p-элементов, d-элементов и f-элементов. Особенно ярко они появляются в длиннопериодном варианте таблицы, потому что здесь эти элементы занимают отдельные прямоугольные блоки. В короткопериодном варианте эти элементы начинают пересекаться, однако при определенной сноровке и тренировке вы сможете легко отличить s- и p-элементы от d-элементов в периодической системе в короткопериодной ее форме. По общности химических свойств часто объединяют некоторые и другие элементы. Например, выделяют триаду железа, которая содержит железо, кобальт и никель. И платиновые металлы: рутений, родий, палладий, осмий, иридий и платина. Если к ним добавить серебро и золото, то такое семейство можно назвать благородные металлы. Переходными металлами называют d-элементы за исключением последних d-элементов. Всего можно выделить несколько переходных рядов. Первый переходный ряд — это элементы от скандия до меди, а второй — от иттрия до серебра, третий — от лантана до золота. Это обусловлено тем, что у них некоторые особые свойства, которые отличают их от свойств непереходных элементов. С этими свойствами мы будем знакомиться в нашем курсе. Наконец можно выделить трансурановые элементы. Общим для них является то, что это искусственные элементы. Они все сильно радиоактивны и крайне неустойчивы. Как же связано строение атома в его положением в периодической системе? Химические элементы расположены в таблице не хаотично, а в строгом соответствии со строением их атомов. Так, количество электронных уровней определяет номер периода, а количество электронов на валентных подуровнях определяет номер группы. Последний по правилам заполнения электрон определяет принадлежность элемента к определенному электронному семейству. Давайте проиллюстрируем эти правила на нескольких примерах. Возьмем, например, натрий: это 11-й по счету элемент.
Первый переходный ряд — это элементы от скандия до меди, а второй — от иттрия до серебра, третий — от лантана до золота. Это обусловлено тем, что у них некоторые особые свойства, которые отличают их от свойств непереходных элементов. С этими свойствами мы будем знакомиться в нашем курсе. Наконец можно выделить трансурановые элементы. Общим для них является то, что это искусственные элементы. Они все сильно радиоактивны и крайне неустойчивы. Как же связано строение атома в его положением в периодической системе? Химические элементы расположены в таблице не хаотично, а в строгом соответствии со строением их атомов. Так, количество электронных уровней определяет номер периода, а количество электронов на валентных подуровнях определяет номер группы. Последний по правилам заполнения электрон определяет принадлежность элемента к определенному электронному семейству. Давайте проиллюстрируем эти правила на нескольких примерах. Возьмем, например, натрий: это 11-й по счету элемент. Всего в электронной оболочке атомов натрия три электронных уровня, поэтому натрий расположен в третьем периоде. Его электронная конфигурация 1s2 2s2 2p6 3s1. На внешнем электронном слое один электрон, 3s1 — внешний электронный слой. Поэтому натрий расположен в первой группе. Этот электрон относится к s-электронам, поэтому натрий относится к s-электронному семейству элементов. Это щелочной металл. Кислород — это восьмой по счету элемент. Его электронная конфигурация — 1s2 2s2 2p4. Всего два электронных уровня, поэтому кислород располагается во втором периоде. На внешнем слое у кислорода шесть электронов 2s2 2p4, поэтому кислород принадлежит к шестой группе элементов. И последний по правилам заполнения электрон — это p-электрон, поэтому кислород относится к p-электронному семейству элементов. Железо. Железо расположено в четвертом периоде. Его электронная конфигурация (я назову ее в краткой форме): это [Ar] 4s2 3d6. Всего у железа четыре электронных уровня, на которых есть электроны, поэтому железо находится в четвертом периоде.
Всего в электронной оболочке атомов натрия три электронных уровня, поэтому натрий расположен в третьем периоде. Его электронная конфигурация 1s2 2s2 2p6 3s1. На внешнем электронном слое один электрон, 3s1 — внешний электронный слой. Поэтому натрий расположен в первой группе. Этот электрон относится к s-электронам, поэтому натрий относится к s-электронному семейству элементов. Это щелочной металл. Кислород — это восьмой по счету элемент. Его электронная конфигурация — 1s2 2s2 2p4. Всего два электронных уровня, поэтому кислород располагается во втором периоде. На внешнем слое у кислорода шесть электронов 2s2 2p4, поэтому кислород принадлежит к шестой группе элементов. И последний по правилам заполнения электрон — это p-электрон, поэтому кислород относится к p-электронному семейству элементов. Железо. Железо расположено в четвертом периоде. Его электронная конфигурация (я назову ее в краткой форме): это [Ar] 4s2 3d6. Всего у железа четыре электронных уровня, на которых есть электроны, поэтому железо находится в четвертом периоде. На внешнем электронном слое восемь электронов 4s2 3d6, поэтому железо находится в восьмой группе. Ну и последний по правилам заполнения электрон — это d-электрон, поэтому и железо тоже — d-элемент. Дмитрий Иванович Менделеев сформулировал свой закон следующим образом: «Свойства простых тел, а также формы и свойства соединения элементов, а потому и свойства образуемых или простых и сложных тел стоят в периодической зависимости от их атомного веса». Пользуясь этим законом, Дмитрий Иванович Менделеев предсказал свойства неизвестных на тот момент элементов. Эти элементы — некоторые из них — были открыты уже при жизни самого Дмитрия Ивановича Менделеева, которые подтвердили верность его закона. Именно это отличает открытие Дмитрия Ивановича Менделеева от попыток других многочисленных ученых систематизировать химические элементы. Однако, конечно, в XX веке ученым удалось раскрыть строение атома, и в этот периодический закон пришлось внести одну, но очень важную, существенную корректировку.
На внешнем электронном слое восемь электронов 4s2 3d6, поэтому железо находится в восьмой группе. Ну и последний по правилам заполнения электрон — это d-электрон, поэтому и железо тоже — d-элемент. Дмитрий Иванович Менделеев сформулировал свой закон следующим образом: «Свойства простых тел, а также формы и свойства соединения элементов, а потому и свойства образуемых или простых и сложных тел стоят в периодической зависимости от их атомного веса». Пользуясь этим законом, Дмитрий Иванович Менделеев предсказал свойства неизвестных на тот момент элементов. Эти элементы — некоторые из них — были открыты уже при жизни самого Дмитрия Ивановича Менделеева, которые подтвердили верность его закона. Именно это отличает открытие Дмитрия Ивановича Менделеева от попыток других многочисленных ученых систематизировать химические элементы. Однако, конечно, в XX веке ученым удалось раскрыть строение атома, и в этот периодический закон пришлось внести одну, но очень важную, существенную корректировку. Все-таки свойства простых тел, а также формы и свойства соединения элементов находятся в периодической зависимости не от атомного веса, а от заряда ядер атомов химических элементов. Какие же свойства находятся в такой периодической зависимости? Давайте разберем некоторые из них. Одно из главнейших свойств — это радиус атомов элементов. Радиус атомов увеличивается в группах и уменьшается в периодах. Уменьшение радиуса атомов в периодах связано с тем, что количество энергетических уровней не изменяется, тогда как заряд ядра возрастает. Это означает, что внешние электроны начинают с большей силой притягиваться к ядру, и поэтому радиус атома уменьшается, а в группах происходит нарастание количества энергетических уровней. Мы помним, что номер энергетического уровня, то есть главное квантовое число, связано с размером атомной орбитали: чем больше номер, тем больше размер. Поэтому в группах радиус атомов увеличивается. Очень важное свойство химических элементов — это электроотрицательность, то есть способность атомов химических элементов притягивать к себе свои собственные электроны, а также электроны химических связей.
Все-таки свойства простых тел, а также формы и свойства соединения элементов находятся в периодической зависимости не от атомного веса, а от заряда ядер атомов химических элементов. Какие же свойства находятся в такой периодической зависимости? Давайте разберем некоторые из них. Одно из главнейших свойств — это радиус атомов элементов. Радиус атомов увеличивается в группах и уменьшается в периодах. Уменьшение радиуса атомов в периодах связано с тем, что количество энергетических уровней не изменяется, тогда как заряд ядра возрастает. Это означает, что внешние электроны начинают с большей силой притягиваться к ядру, и поэтому радиус атома уменьшается, а в группах происходит нарастание количества энергетических уровней. Мы помним, что номер энергетического уровня, то есть главное квантовое число, связано с размером атомной орбитали: чем больше номер, тем больше размер. Поэтому в группах радиус атомов увеличивается. Очень важное свойство химических элементов — это электроотрицательность, то есть способность атомов химических элементов притягивать к себе свои собственные электроны, а также электроны химических связей. Наибольшей электроотрицательностью обладает атом фтора, а наименьшей — цезий и рубидий. Электроотрицательность увеличивается в периодах и уменьшается в группах. Способность атомов притягивать к себе электроны обуславливает их многие химические свойства. Так, элементы-галогенам, которым недостает до заполнения своей электронной конфигурации всего лишь одного электрона, то есть до получения ими электронной конфигурации инертного газа, обладают высокой электроотрицательностью, высокой способностью притянуть к себе еще один хотя бы электрончик. А вот щелочным металлам гораздо проще избавиться от своего единственного электрона, чтобы принять очень устойчивую электронную конфигурацию инертного газа. Поэтому у щелочных газов наименьшая электроотрицательность. Другие важные свойства — это металлические и неметаллические свойства. Металлические, или восстановительные, свойства возрастают в группах и уменьшаются в периодах. Это означает, что наиболее выраженными металлическими свойствами обладают элементы, расположенные в левом нижнем углу периодической системы.
Наибольшей электроотрицательностью обладает атом фтора, а наименьшей — цезий и рубидий. Электроотрицательность увеличивается в периодах и уменьшается в группах. Способность атомов притягивать к себе электроны обуславливает их многие химические свойства. Так, элементы-галогенам, которым недостает до заполнения своей электронной конфигурации всего лишь одного электрона, то есть до получения ими электронной конфигурации инертного газа, обладают высокой электроотрицательностью, высокой способностью притянуть к себе еще один хотя бы электрончик. А вот щелочным металлам гораздо проще избавиться от своего единственного электрона, чтобы принять очень устойчивую электронную конфигурацию инертного газа. Поэтому у щелочных газов наименьшая электроотрицательность. Другие важные свойства — это металлические и неметаллические свойства. Металлические, или восстановительные, свойства возрастают в группах и уменьшаются в периодах. Это означает, что наиболее выраженными металлическими свойствами обладают элементы, расположенные в левом нижнем углу периодической системы. А вот, напротив, неметаллические, или окислительные, свойства возрастают в периодах и уменьшаются в группах. Это означает, что наиболее характерные элементы-неметаллы расположены в правой верхней части периодической системы. Можно провести условную диагональ металличности/неметалличности в периодической системе. Тогда выше этой диагонали будут расположены элементы-неметаллы, а ниже — элементы-металлы. Вдоль такой диагонали будут расположены амфотерные элементы. Поэтому такую диагональ часто называют диагональ амфотерности. Итак, как же реагируют элементы друг с другом? Они вступают во взаимодействие, которое непременно приводит к тому, что электроны, принадлежащие атомам, становятся общими электронами. В этом заключается основной принцип образования химических связей. Давайте рассмотрим это в следующей лекции.
А вот, напротив, неметаллические, или окислительные, свойства возрастают в периодах и уменьшаются в группах. Это означает, что наиболее характерные элементы-неметаллы расположены в правой верхней части периодической системы. Можно провести условную диагональ металличности/неметалличности в периодической системе. Тогда выше этой диагонали будут расположены элементы-неметаллы, а ниже — элементы-металлы. Вдоль такой диагонали будут расположены амфотерные элементы. Поэтому такую диагональ часто называют диагональ амфотерности. Итак, как же реагируют элементы друг с другом? Они вступают во взаимодействие, которое непременно приводит к тому, что электроны, принадлежащие атомам, становятся общими электронами. В этом заключается основной принцип образования химических связей. Давайте рассмотрим это в следующей лекции.
Что означают цифры в таблице менделеева. Периодическая система химических элементов
Периодическая система – упорядоченное множество химических элементов, их естественная классификация, которая является графическим (табличным) выражением периодического закона химических элементов. Структура её, во многом сходная с современной, разработана Д. И. Менделеевым на основе периодического закона в 1869–1871 гг.
Структура её, во многом сходная с современной, разработана Д. И. Менделеевым на основе периодического закона в 1869–1871 гг.
Прообразом периодической системы был «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленный Д. И. Менделеевым 1 марта 1869 г. На протяжении двух с половиной лет ученый непрерывно совершенствовал «Опыт системы», ввел представление о группах, рядах и периодах элементов. В результате структура периодической системы приобрела во многом современные очертания.
Важным для её эволюции стало понятие о месте элемента в системе, определяемом номерами группы и периода. Опираясь на это понятие, Менделеев пришел к выводу, что необходимо изменить атомные массы некоторых элементов: урана, индия, церия и его спутников. Это было первое практическое применение периодической системы. Менделеев также впервые предсказал существование и свойства нескольких неизвестных элементов. Ученый подробно описал важнейшие свойства экаалюминия (будущего галлия), экабора (скандия) и экасилиция (германия).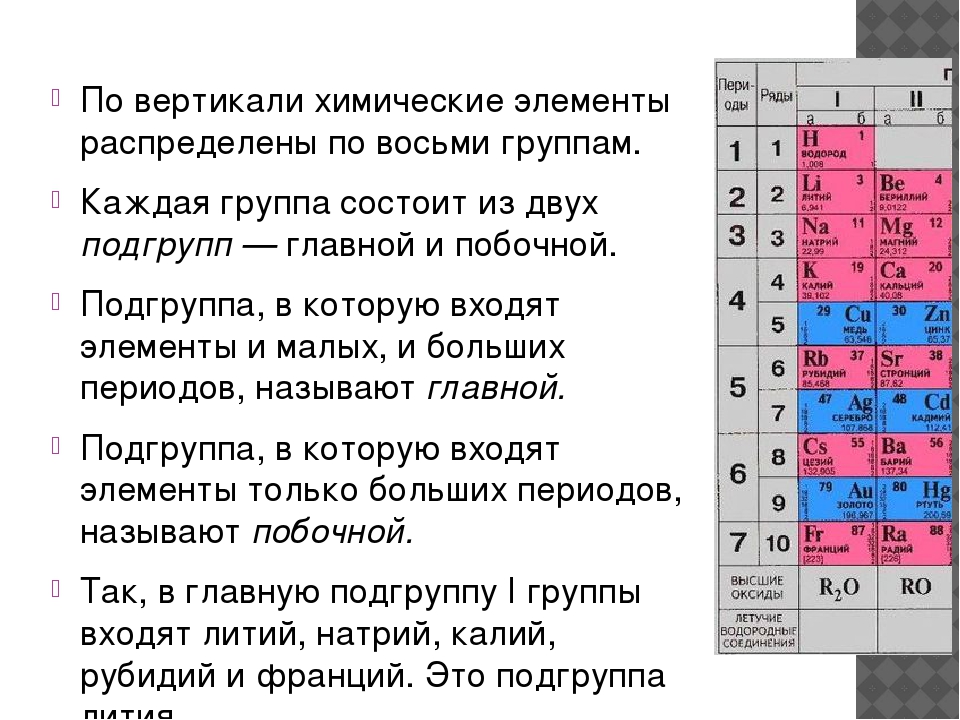
Первые варианты периодической системы во многом представляли лишь эмпирическое обобщение. Ведь был неясен физический смысл периодического закона, отсутствовало объяснение причин периодического изменения свойств элементов в зависимости от возрастания атомных масс. В связи с этим оставались нерешенными многие проблемы. Есть ли границы периодической системы? Можно ли определить точное количество существующих элементов? Оставалась неясной структура шестого периода – каково точное количество редкоземельных элементов? Было неизвестно, существуют ли еще элементы между водородом и литием, какова структура первого периода. Поэтому вплоть до физического обоснования периодического закона и разработки теории периодической системы перед ней не раз возникали серьезные трудности.
Одна из главных причин невозможности объяснить физический смысл периодического закона и структуру периодической системы состояла в том, что было неизвестно, как устроен атом (см. Атом). Важнейшей вехой на пути развития периодической системы явилось создание атомной модели Э. Резерфордом (1911). На её основе голландский ученый А. Ван ден Брук (1913) высказал предположение, что порядковый номер элемента в периодической системе численно равен заряду ядра его атома (Z).
В результате структура периодической системы значительно упрочилась. Была определена нижняя граница системы. Это водород – элемент с минимальным Z = 1. Стало возможным точно оценить количество элементов между водородом и ураном. Были определены «пробелы» в периодической системе, соответствующие неизвестным элементам с Z = 43, 61, 72, 75, 85, 87. Однако оставались неясными вопросы о точном количестве редкоземельных элементов и, что особенно важно, не были вскрыты причины периодичности изменения свойств элементов в зависимости от Z.
Опираясь на сложившуюся структуру периодической системы и результаты изучения атомных спектров, датский ученый Н. Бор в 1918–1921 гг. развил представления о последовательности построения электронных оболочек и подоболочек в атомах. Ученый пришел к выводу, что сходные типы электронных конфигураций внешних оболочек атомов периодически повторяются. Таким образом, было показано, что периодичность изменения свойств химических элементов объясняется существованием периодичности в построении электронных оболочек и подоболочек атомов.
Ученый пришел к выводу, что сходные типы электронных конфигураций внешних оболочек атомов периодически повторяются. Таким образом, было показано, что периодичность изменения свойств химических элементов объясняется существованием периодичности в построении электронных оболочек и подоболочек атомов.
Периодическая система охватывает более 100 элементов. Из них все трансурановые элементы (Z = 93–110), а также элементы с Z = 43 (технеций), 61 (прометий), 85 (астат), 87 (франций) получены искусственно. За всю историю существования периодической системы было предложено очень большое количество (>500) вариантов её графического изображения, преимущественно в виде таблиц, а также в виде различных геометрических фигур (пространственных и плоскостных), аналитических кривых (спиралей и пр.) и т. д. Наибольшее распространение получили короткая, полудлинная, длинная и лестничная формы таблиц. В настоящее время предпочтение отдается короткой форме.
Фундаментальным принципом построения периодической системы является её подразделение на группы и периоды.
Особенность первого периода заключается в том, что он содержит всего 2 газообразных в свободном виде элемента: водород и гелий. Место водорода в системе неоднозначно. Поскольку он проявляет свойства, общие со щелочными металлами и с галогенами, то его помещают либо в 1a‑, либо в Vlla‑подгруппу, либо в обе одновременно, заключая в одной из подгрупп символ в скобки. Гелий – первый представитель VIIIa‑подгруппы. Долгое время гелий и все инертные газы выделяли в самостоятельную нулевую группу. Это положение потребовало пересмотра после синтеза химических соединений криптона, ксенона и радона. В результате инертные газы и элементы бывшей VIII группы (железо, кобальт, никель и платиновые металлы) были объединены в рамках одной группы.
Гелий – первый представитель VIIIa‑подгруппы. Долгое время гелий и все инертные газы выделяли в самостоятельную нулевую группу. Это положение потребовало пересмотра после синтеза химических соединений криптона, ксенона и радона. В результате инертные газы и элементы бывшей VIII группы (железо, кобальт, никель и платиновые металлы) были объединены в рамках одной группы.
Второй период содержит 8 элементов. Он начинается щелочным металлом литием, единственная степень окисления которого +1. Далее следует бериллий (металл, степень окисления +2). Бор проявляет уже слабо выраженный металлический характер и является неметаллом (степень окисления +3). Следующий за бором углерод – типичный неметалл, который проявляет степени окисления как +4, так и −4. Азот, кислород, фтор и неон – все неметаллы, причем у азота высшая степень окисления +5 соответствует номеру группы. Кислород и фтор относятся к самым активным неметаллам. Инертный газ неон завершает период.
Третий период (натрий – аргон) также содержит 8 элементов. Характер изменения их свойств во многом аналогичен тому, который наблюдался для элементов второго периода. Но здесь есть и своя специфика. Так, магний в отличие от бериллия более металличен, так же как и алюминий по сравнению с бором. Кремний, фосфор, сера, хлор, аргон – все это типичные неметаллы. И все они, кроме аргона, проявляют высшие степени окисления, равные номеру группы.
Характер изменения их свойств во многом аналогичен тому, который наблюдался для элементов второго периода. Но здесь есть и своя специфика. Так, магний в отличие от бериллия более металличен, так же как и алюминий по сравнению с бором. Кремний, фосфор, сера, хлор, аргон – все это типичные неметаллы. И все они, кроме аргона, проявляют высшие степени окисления, равные номеру группы.
Как видим, в обоих периодах по мере увеличения Z наблюдается отчетливое ослабление металлических и усиление неметаллических свойств элементов. Д. И. Менделеев называл элементы второго и третьего периодов (по его словам, малых) типическими. Элементы малых периодов принадлежат к числу самых распространенных в природе. Углерод, азот и кислород (наряду с водородом) – органогены, т. е. основные элементы органической материи.
Все элементы первого – третьего периодов размещаются в a‑подгруппах.
Четвертый период (калий – криптон) содержит 18 элементов. По Менделееву, это первый большой период. После щелочного металла калия и щелочноземельного металла кальция следует ряд элементов, состоящий из 10 так называемых переходных металлов (скандий – цинк). Все они входят в b‑подгруппы. Большинство переходных металлов проявляют высшие степени окисления, равные номеру группы, кроме железа, кобальта и никеля. Элементы, начиная с галлия и кончая криптоном, принадлежат к а-подгруппам. Для криптона известен ряд химических соединений.
После щелочного металла калия и щелочноземельного металла кальция следует ряд элементов, состоящий из 10 так называемых переходных металлов (скандий – цинк). Все они входят в b‑подгруппы. Большинство переходных металлов проявляют высшие степени окисления, равные номеру группы, кроме железа, кобальта и никеля. Элементы, начиная с галлия и кончая криптоном, принадлежат к а-подгруппам. Для криптона известен ряд химических соединений.
Пятый период (рубидий – ксенон) по своему построению аналогичен четвертому. В нем также содержится вставка из 10 переходных металлов (иттрий – кадмий). У элементов этого периода есть свои особенности. В триаде рутений – родий – палладий для рутения известны соединения, где он проявляет степень окисления +8. Все элементы a‑подгрупп проявляют высшие степени окисления, равные номеру группы. Особенности изменения свойств у элементов четвертого и пятого периодов по мере роста Z имеют по сравнению со вторым и третьим периодами более сложный характер.
Шестой период (цезий – радон) включает 32 элемента. В этом периоде кроме 10 переходных металлов (лантан, гафний – ртуть) содержится еще и совокупность из 14 лантаноидов – от церия до лютеция. Элементы от церия до лютеция химически очень похожи, и на этом основании их давно включают в семейство редкоземельных элементов. В короткой форме периодической системы ряд лантаноидов включают в клетку лантана и расшифровку этого ряда дают внизу таблицы (см. Лантаноиды).
В этом периоде кроме 10 переходных металлов (лантан, гафний – ртуть) содержится еще и совокупность из 14 лантаноидов – от церия до лютеция. Элементы от церия до лютеция химически очень похожи, и на этом основании их давно включают в семейство редкоземельных элементов. В короткой форме периодической системы ряд лантаноидов включают в клетку лантана и расшифровку этого ряда дают внизу таблицы (см. Лантаноиды).
В чем состоит специфика элементов шестого периода? В триаде осмий – иридий – платина для осмия известна степень окисления +8. Астат имеет достаточно выраженный металлический характер. Радон обладает наибольшей реакционной способностью из всех инертных газов. К сожалению, из‑за того, что он сильно радиоактивен, его химия мало изучена (см. Радиоактивные элементы).
Седьмой период начинается с франция. Подобно шестому, он также должен содержать 32 элемента, но из них пока известны 24. Франций и радий соответственно являются элементами Ia‑ и IIa‑подгрупп, актиний принадлежит к IIIb‑подгруппе. Далее следует семейство актиноидов, которое включает элементы от тория до лоуренсия и размещается аналогично лантаноидам. Расшифровка этого ряда элементов также дается внизу таблицы.
Далее следует семейство актиноидов, которое включает элементы от тория до лоуренсия и размещается аналогично лантаноидам. Расшифровка этого ряда элементов также дается внизу таблицы.
Теперь посмотрим, как изменяются свойства химических элементов в подгруппах периодической системы. Основная закономерность этого изменения заключается в усилении металлического характера элементов по мере роста Z. Особенно отчетливо эта закономерность проявляется в IIIa–VIIa‑подгруппах. Для металлов Ia–IIIa‑подгрупп наблюдается рост химической активности. У элементов IVa–VIIa‑подгрупп по мере увеличения Z наблюдается ослабление химической активности элементов. У элементов b‑подгрупп характер изменения химической активности более сложен.
Теория периодической системы была разработана Н. Бором и другими учеными в 20‑х гг. XX в. и основана на реальной схеме формирования электронных конфигураций атомов (см. Атом). Согласно этой теории, по мере роста Z заполнение электронных оболочек и подоболочек в атомах элементов, входящих в периоды периодической системы, происходит в следующей последовательности:
| Номера периодов | ||||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1s | 2s2p | 3s3p | 4s3d4p | 5s4d5p | 6s4f5d6p | 7s5f6d7p |
На основании теории периодической системы можно дать следующее определение периода: период есть совокупность элементов, начинающаяся элементом со значением n, равным номеру периода, и l = 0 (s‑элементы) и заканчивающаяся элементом с тем же значением n и l = 1 (p‑элементы) (см.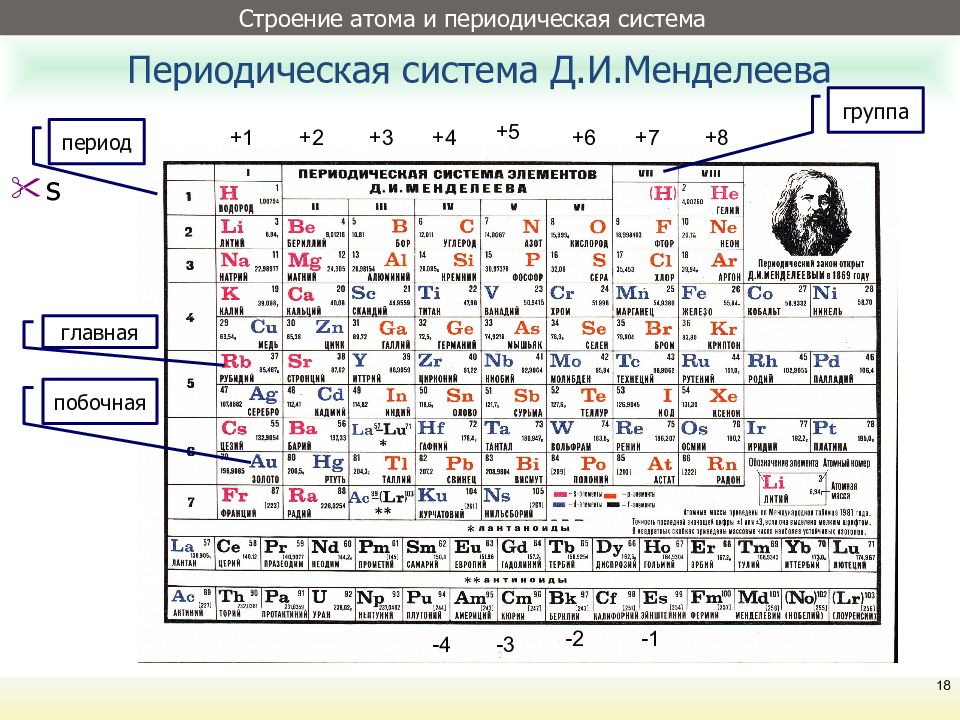 Атом). Исключение составляет первый период, содержащий только 1s‑элементы. Из теории периодической системы следуют числа элементов в периодах: 2, 8, 8, 18, 18, 32…
Атом). Исключение составляет первый период, содержащий только 1s‑элементы. Из теории периодической системы следуют числа элементов в периодах: 2, 8, 8, 18, 18, 32…
В таблице символы элементов каждого типа (s‑, p‑, d‑ и f‑элементы) изображены на определенном цветовом фоне: s‑элементы – на красном, p‑элементы – на оранжевом, d‑элементы – на синем, f‑элементы – на зеленом. В каждой клетке приведены порядковые номера и атомные массы элементов, а также электронные конфигурации внешних электронных оболочек.
Из теории периодической системы следует, что к a‑подгруппам принадлежат элементы с n, равным номеру периода, и l = 0 и 1. К b‑подгруппам относятся те элементы, в атомах которых происходит достройка оболочек, ранее остававшихся незавершенными. Именно поэтому первый, второй и третий периоды не содержат элементов b‑подгрупп.
Структура периодической системы элементов тесно связана со строением атомов химических элементов. По мере роста Z периодически повторяются сходные типы конфигурации внешних электронных оболочек. А именно они определяют основные особенности химического поведения элементов. Эти особенности по‑разному проявляются для элементов a‑подгрупп (s‑ и р‑элементы), для элементов b‑подгрупп (переходные d‑элементы) и элементов f‑семейств – лантаноидов и актиноидов. Особый случай представляют элементы первого периода – водород и гелий. Для водорода характерна высокая химическая активность, потому что его единственный 1s‑электрон легко отщепляется. В то же время конфигурация гелия (1s 2) весьма устойчива, что обусловливает его химическую бездеятельность.
А именно они определяют основные особенности химического поведения элементов. Эти особенности по‑разному проявляются для элементов a‑подгрупп (s‑ и р‑элементы), для элементов b‑подгрупп (переходные d‑элементы) и элементов f‑семейств – лантаноидов и актиноидов. Особый случай представляют элементы первого периода – водород и гелий. Для водорода характерна высокая химическая активность, потому что его единственный 1s‑электрон легко отщепляется. В то же время конфигурация гелия (1s 2) весьма устойчива, что обусловливает его химическую бездеятельность.
У элементов а-подгрупп происходит заполнение внешних электронных оболочек атомов (с n, равным номеру периода), поэтому свойства этих элементов заметно изменяются по мере роста Z. Так, во втором периоде литий (конфигурация 2s) – активный металл, легко теряющий единственный валентный электрон; бериллий (2s 2) – также металл, но менее активный вследствие того, что его внешние электроны более прочно связаны с ядром. Далее, бор (2s 2 p) имеет слабо выраженный металлический характер, а все последующие элементы второго периода, у которых происходит построение 2p‑подоболочки, являются уже неметаллами. Восьмиэлектронная конфигурация внешней электронной оболочки неона (2s 2 p 6) – инертного газа – очень прочна.
Восьмиэлектронная конфигурация внешней электронной оболочки неона (2s 2 p 6) – инертного газа – очень прочна.
Химические свойства элементов второго периода объясняются стремлением их атомов приобрести электронную конфигурацию ближайшего инертного газа (конфигурацию гелия – для элементов от лития до углерода или конфигурацию неона – для элементов от углерода до фтора). Вот почему, например, кислород не может проявлять высшей степени окисления, равной номеру группы: ведь ему легче достичь конфигурации неона путем приобретения дополнительных электронов. Такой же характер изменения свойств проявляется у элементов третьего периода и у s‑ и p‑элементов всех последующих периодов. В то же время ослабление прочности связи внешних электронов с ядром в a‑подгруппах по мере роста Z проявляется в свойствах соответствующих элементов. Так, для s‑элементов отмечается заметный рост химической активности по мере роста Z, а для p‑элементов – нарастание металлических свойств.
В атомах переходных d‑элементов достраиваются не завершенные ранее оболочки со значением главного квантового числа n, на единицу меньшим номера периода. За отдельными исключениями, конфигурация внешних электронных оболочек атомов переходных элементов – ns 2 . Поэтому все d‑элементы являются металлами, и именно поэтому изменения свойств d‑элементов по мере роста Z не так резки, как это наблюдается у s‑ и p‑элементов. В высших степенях окисления d‑элементы проявляют определенное сходство с p‑элементами соответствующих групп периодической системы.
За отдельными исключениями, конфигурация внешних электронных оболочек атомов переходных элементов – ns 2 . Поэтому все d‑элементы являются металлами, и именно поэтому изменения свойств d‑элементов по мере роста Z не так резки, как это наблюдается у s‑ и p‑элементов. В высших степенях окисления d‑элементы проявляют определенное сходство с p‑элементами соответствующих групп периодической системы.
Особенности свойств элементов триад (VIIIb‑подгруппа) объясняются тем, что b‑подоболочки близки к завершению. Вот почему железо, кобальт, никель и платиновые металлы, как правило, не склонны давать соединения высших степеней окисления. Исключение составляют лишь рутений и осмий, дающие оксиды RuO 4 и OsO 4 . У элементов Ib‑ и IIb‑подгрупп d‑подоболочка фактически оказывается завершенной. Поэтому они проявляют степени окисления, равные номеру группы.
В атомах лантаноидов и актиноидов (все они металлы) происходит достройка ранее не завершенных электронных оболочек со значением главного квантового числа n на две единицы меньше номера периода. В атомах этих элементов конфигурация внешней электронной оболочки (ns 2) сохраняется неизменной, а заполняется третья снаружи N‑оболочка 4f‑электронами. Вот почему лантаноиды так сходны.
В атомах этих элементов конфигурация внешней электронной оболочки (ns 2) сохраняется неизменной, а заполняется третья снаружи N‑оболочка 4f‑электронами. Вот почему лантаноиды так сходны.
У актиноидов дело обстоит сложнее. В атомах элементов с Z = 90–95 электроны 6d и 5f могут принимать участие в химических взаимодействиях. Поэтому актиноиды имеют гораздо больше степеней окисления. Например, для нептуния, плутония и америция известны соединения, где эти элементы выступают в семивалентном состоянии. Только у элементов, начиная с кюрия (Z = 96), становится устойчивым трехвалентное состояние, но и здесь есть свои особенности. Таким образом, свойства актиноидов значительно отличаются от свойств лантаноидов, и оба семейства поэтому нельзя считать подобными.
Семейство актиноидов заканчивается элементом с Z = 103 (лоуренсий). Оценка химических свойств курчатовия (Z = 104) и нильсбория (Z = 105) показывает, что эти элементы должны быть аналогами соответственно гафния и тантала. Поэтому ученые полагают, что после семейства актиноидов в атомах начинается систематическое заполнение 6d‑подоболочки. Оценка химической природы элементов с Z = 106–110 экспериментально не проводилась.
Оценка химической природы элементов с Z = 106–110 экспериментально не проводилась.
Конечное число элементов, которое охватывает периодическая система, неизвестно. Проблема её верхней границы – это, пожалуй, основная загадка периодической системы. Наиболее тяжелый элемент, который удалось обнаружить в природе,- это плутоний (Z = 94). Достигнутый предел искусственного ядерного синтеза – элемент с порядковым номером 110. Остается открытым вопрос: удастся ли получить элементы с большими порядковыми номерами, какие и сколько? На него нельзя пока ответить сколь‑либо определенно.
С помощью сложнейших расчетов, выполненных на электронных вычислительных машинах, ученые попытались определить строение атомов и оценить важнейшие свойства «сверхэлементов», вплоть до огромных порядковых номеров (Z = 172 и даже Z = 184). Полученные результаты оказались весьма неожиданными. Например, в атоме элемента с Z = 121 предполагается появление 8p‑электрона; это после того, как в атомах с Z = 119 и 120 завершилось формирование 8s‑подоболочки. А ведь появление p‑электронов вслед за s‑электронами наблюдается только в атомах элементов второго и третьего периодов. Расчеты показывают также, что у элементов гипотетического восьмого периода заполнение электронных оболочек и под-оболочек атомов происходит в очень сложной и своеобразной последовательности. Поэтому оценить свойства соответствующих элементов – проблема весьма сложная. Казалось бы, восьмой период должен содержать 50 элементов (Z = 119–168), но, согласно расчетам, он должен завершаться у элемента с Z = 164, т. е. на 4 порядковых номера раньше. А «экзотический» девятый период, оказывается, должен состоять из 8 элементов. Вот его «электронная» запись: 9s 2 8p 4 9p 2 . Иными словами, он содержал бы всего 8 элементов, как второй и третий периоды.
А ведь появление p‑электронов вслед за s‑электронами наблюдается только в атомах элементов второго и третьего периодов. Расчеты показывают также, что у элементов гипотетического восьмого периода заполнение электронных оболочек и под-оболочек атомов происходит в очень сложной и своеобразной последовательности. Поэтому оценить свойства соответствующих элементов – проблема весьма сложная. Казалось бы, восьмой период должен содержать 50 элементов (Z = 119–168), но, согласно расчетам, он должен завершаться у элемента с Z = 164, т. е. на 4 порядковых номера раньше. А «экзотический» девятый период, оказывается, должен состоять из 8 элементов. Вот его «электронная» запись: 9s 2 8p 4 9p 2 . Иными словами, он содержал бы всего 8 элементов, как второй и третий периоды.
Трудно сказать, насколько соответствовали бы истине расчеты, проделанные с помощью компьютера. Однако если бы они были подтверждены, то пришлось бы серьезно пересмотреть закономерности, лежащие в основе периодической системы элементов и её структуры.
Периодическая система сыграла и продолжает играть огромную роль в развитии различных областей естествознания. Она явилась важнейшим достижением атомно-молекулярного учения, способствовала появлению современного понятия «химический элемент» и уточнению понятий о простых веществах и соединениях.
Закономерности, вскрытые периодической системой, оказали существенное влияние на разработку теории строения атомов, открытие изотопов, появление представлений о ядерной периодичности. С периодической системой связана строго научная постановка проблемы прогнозирования в химии. Это проявилось в предсказании существования и свойств неизвестных элементов и новых особенностей химического поведения элементов уже открытых. Ныне периодическая система представляет фундамент химии, в первую очередь неорганической, существенно помогая решению задачи химического синтеза веществ с заранее заданными свойствами, разработке новых полупроводниковых материалов, подбору специфических катализаторов для различных химических процессов и т.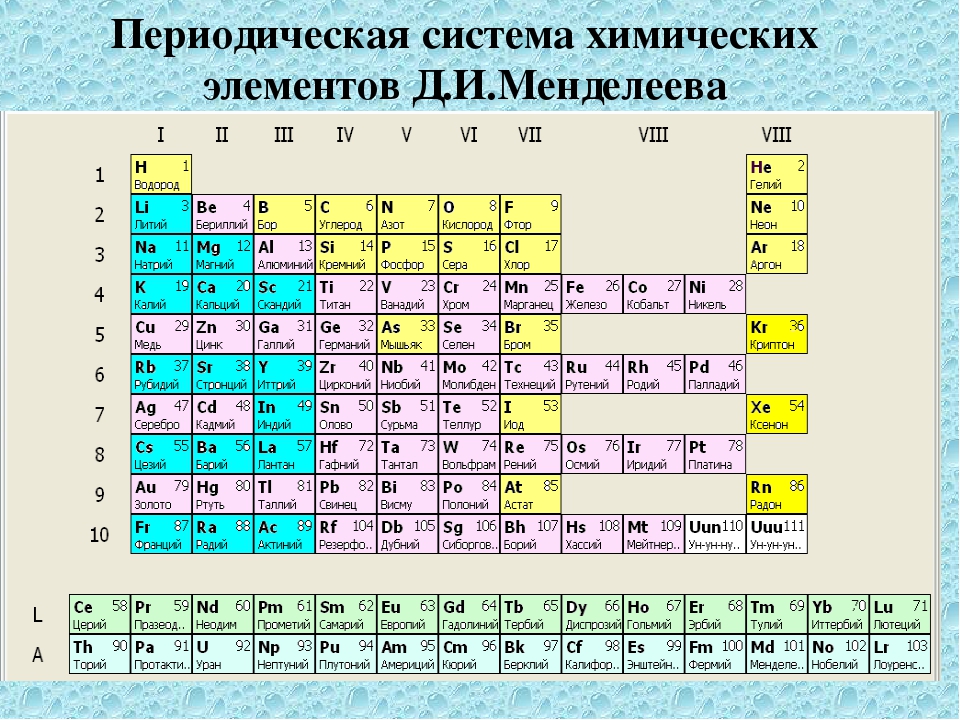 д. И наконец, периодическая система лежит в основе преподавания химии.
д. И наконец, периодическая система лежит в основе преподавания химии.
Инструкция
Периодическая система представляет собой многоэтажный «дом», в котором располагается большое количество квартир. Каждый «жилец» или в своей собственной квартире под определенным номером, который является постоянным. Помимо этого элемент имеет «фамилию» или название, например кислород, бор или азот. Кроме этих данных в каждой «квартире» или указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Как в любом доме, здесь имеются «подъезды», а именно группы. Причем в группах элементы располагаются слева и справа, образуя . В зависимости от того, с какой стороны их больше, та называется главной. Другая подгруппа, соответственно, будет побочной. Также в таблице имеются «этажи» или периоды. Причем периоды могут быть как большими (состоят из двух рядов) так и малыми (имеют только один ряд).
По таблице можно показать строение атома элемента, каждый из которых имеет положительно заряженное ядро, состоящее из протонов и нейтронов, а также вращающихся вокруг него отрицательно заряженных электронов. Число протонов и электронов численно совпадает и определяется в таблице по порядковому номеру элемента. Например, химический элемент сера имеет №16, следовательно, будет иметь 16 протонов и 16 электронов.
Число протонов и электронов численно совпадает и определяется в таблице по порядковому номеру элемента. Например, химический элемент сера имеет №16, следовательно, будет иметь 16 протонов и 16 электронов.
Чтобы определить количество нейтронов (нейтральных частиц, также расположенных в ядре) вычтите из относительной атомной массы элемента его порядковый номер. Например, железо имеет относительную атомную массу равную 56 и порядковый номер 26. Следовательно, 56 – 26 = 30 протонов у железа.
Электроны находятся на разном расстоянии от ядра, образуя электронные уровни. Чтобы определить число электронных (или энергетических) уровней, нужно посмотреть на номер периода, в котором располагается элемент. Например, находится в 3 периоде, следовательно, у него будет 3 уровня.
По номеру группы (но только для главной подгруппы) можно определить высшую валентность. Например, элементы первой группы главной подгруппы (литий, натрий, калий и т.д.) имеют валентность 1. Соответственно, элементы второй группы (бериллий, кальций и т. д.) будут иметь валентность равную 2.
д.) будут иметь валентность равную 2.
Также по таблице можно проанализировать свойства элементов. Слева направо металлические , а неметаллические усиливаются. Это хорошо видно на примере 2 периода: начинается щелочным металлом , затем щелочноземельный металл магний, после него элемент алюминий, затем неметаллы кремний, фосфор, сера и заканчивается период газообразными веществами – хлором и аргоном. В следующем периоде наблюдается аналогичная зависимость.
Сверху вниз также наблюдается закономерность – металлические свойства усиливаются, а неметаллические ослабевают. То есть, например, цезий гораздо активнее по сравнению с натрием.
Полезный совет
Для удобства лучше использовать цветной вариант таблицы.
Открытие периодического закона и создание упорядоченной системы химических элементов Д.И. Менделеевым стали апогеем развития химии в XIX веке. Ученым был обобщен и систематизирован обширный материал знаний о свойствах элементов.
Инструкция
В XIX веке не было никаких представлений о строении атома.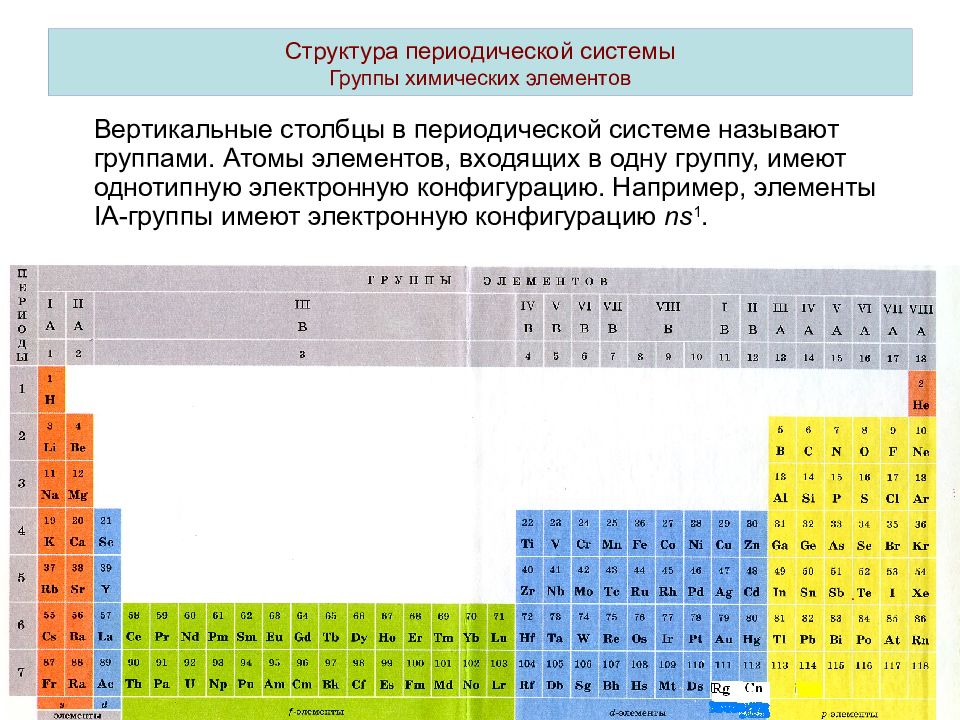 Открытие Д.И. Менделеева являлось лишь обобщением опытных фактов, но их физический смысл долгое время оставался непонятным. Когда появились первые данные о строении ядра и распределении электронов в атомах, это взглянуть на закон и систему элементов по-новому. Таблица Д.И. Менделеева дает возможность наглядно проследить свойств элементов, встречающихся в .
Открытие Д.И. Менделеева являлось лишь обобщением опытных фактов, но их физический смысл долгое время оставался непонятным. Когда появились первые данные о строении ядра и распределении электронов в атомах, это взглянуть на закон и систему элементов по-новому. Таблица Д.И. Менделеева дает возможность наглядно проследить свойств элементов, встречающихся в .
Каждому элементу в таблице присвоен определенный порядковый номер (H – 1, Li – 2, Be – 3 и т.д.). Этот номер соответствует ядра (количеству протонов в ядре) и числу электронов, вращающихся вокруг ядра. Число протонов, таким образом, равно числу электронов, и это говорит о том, что в обычных условиях атом электрически .
Деление на семь периодов происходит по числу энергетических уровней атома. Атомы первого периода имеют одноуровневую электронную оболочку, второго – двухуровневую, третьего – трехуровневую и т.д. При заполнении нового энергетического уровня начинается новый период.
Первые элементы всякого периода характеризуются атомами, имеющими по одному электрону на внешнем уровне, – это атомы щелочных металлов. Заканчиваются периоды атомами благородных газов, имеющими полностью заполненный электронами внешний энергетический уровень: в первом периоде инертные газы имеют 2 электрона, в последующих – 8. Именно по причине похожего строения электронных оболочек группы элементов имеют сходные физико- .
Заканчиваются периоды атомами благородных газов, имеющими полностью заполненный электронами внешний энергетический уровень: в первом периоде инертные газы имеют 2 электрона, в последующих – 8. Именно по причине похожего строения электронных оболочек группы элементов имеют сходные физико- .
В таблице Д.И. Менделеева присутствует 8 главных подгрупп. Такое их количество обусловлено максимально возможным числом электронов на энергетическом уровне.
Внизу периодической системы выделены лантаноиды и актиноиды в качестве самостоятельных рядов.
С помощью таблицы Д.И. Менделеева можно пронаблюдать периодичность следующих свойств элементов: радиуса атома, объема атома; потенциала ионизации; силы сродства с электроном; электроотрицательности атома; ; физических свойств потенциальных соединений.
Четко прослеживаемая периодичность расположения элементов в таблице Д.И. Менделеева рационально объясняется последовательным характером заполнения электронами энергетических уровней.
Источники:
- Таблица Менделеева
Периодический закон, являющийся основой современной химии и объясняющий закономерности изменения свойств химических элементов, был открыт Д.И. Менделеевым в 1869 году. Физический смысл этого закона вскрывается при изучении сложного строения атома.
В XIX веке считалось, что атомная масса является главной характеристикой элемента, поэтому для классификации веществ использовали именно ее. Сейчас атомы определяют и идентифицируют по величине заряда их ядра (числу и порядковому номеру в таблице Менделеева). Впрочем, атомная масса элементов за некоторыми исключениями (например, атомная масса меньше атомной массы аргона) увеличивается соразмерно их заряду ядра.
При увеличении атомной массы наблюдается периодическое изменение свойств элементов и их соединений. Это металличность и неметалличность атомов, атомный радиус , потенциал ионизации, сродство к электрону, электроотрицательность, степени окисления, соединений (температуры кипения, плавления, плотность), их основность, амфотерность или кислотность.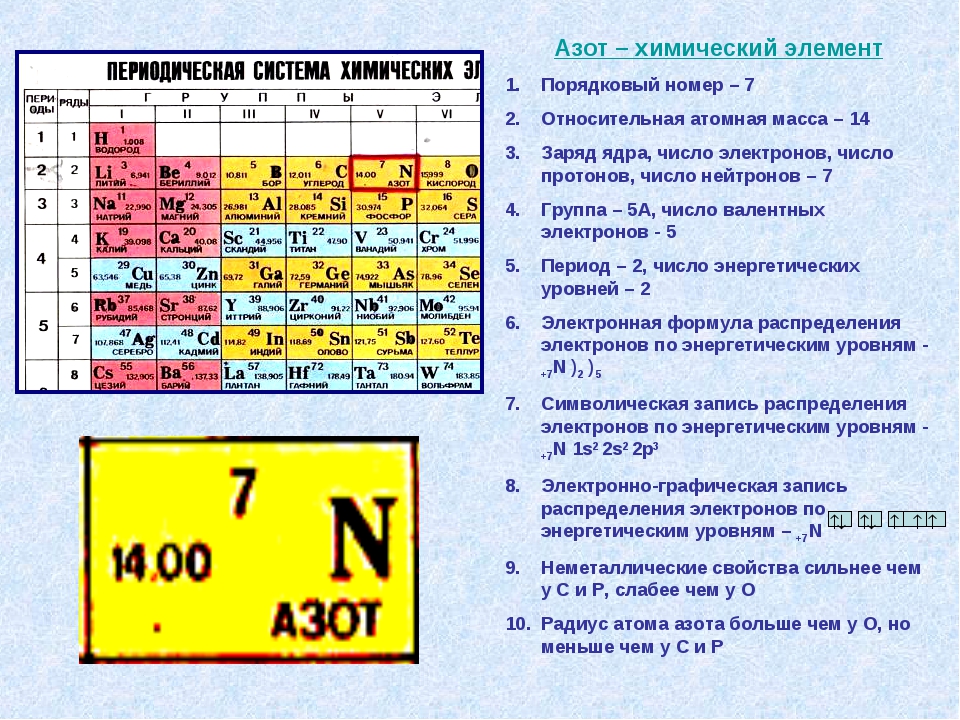
Сколько элементов в современной таблице Менделеева
Таблица Менделеева графически выражает открытый им закон. В современной периодической системе содержится 112 химических элементов (последние – Мейтнерий, Дармштадтий, Рентгений и Коперниций). По последним данным, открыты и следующие 8 элементов (до 120 включительно), но не все из них получили свои названия, и эти элементы пока еще мало в каких печатных изданиях присутствуют.
Каждый элемент занимает определенную клетку в периодической системе и имеет свой порядковый номер, соответствующий заряду ядра его атома.
Как построена периодическая система
Структура периодической системы представлена семью периодами, десятью рядами и восемью группами. Каждый период начинается щелочным металлом и заканчивается благородным газом. Исключения составляют первый период, начинающийся водородом, и седьмой незавершенный период.
Периоды делятся на малые и большие. Малые периоды (первый, второй, третий) состоят из одного горизонтального ряда, большие (четвертый, пятый, шестой) – из двух горизонтальных рядов. Верхние ряды в больших периодах называются четными, нижние – нечетными.
Верхние ряды в больших периодах называются четными, нижние – нечетными.
В шестом периоде таблицы после (порядковый номер 57) находятся 14 элементов, похожих по свойствам на лантан, – лантаноидов. Они вынесены в нижнюю часть таблицы отдельной строкой. То же самое относится и к актиноидам, расположенным после актиния (с номером 89) и во многом повторяющим его свойства.
Четные ряды больших периодов (4, 6, 8, 10) заполнены только металлами.
Элементы в группах проявляют одинаковую высшую в оксидах и других соединениях, и эта валентность соответствует номеру группы. Главные вмещают в себя элементы малых и больших периодов, – только больших. Сверху вниз усиливаются, неметаллические – ослабевают. Все атомы побочных подгрупп – металлы.
Химический элемент селен относится к VI группе периодической системы Менделеева, он является халькогеном. Природный селен состоит из шести стабильных изотопов. Известно также 16 радиоактивных изотопов селена.
Инструкция
Селен считается очень редким и рассеянным элементом, в биосфере он энергично мигрирует, образуя более 50 минералов.![]() Самые известные из них: берцелианит, науманнит, самородный селен и халькоменит.
Самые известные из них: берцелианит, науманнит, самородный селен и халькоменит.
Селен содержится в вулканической сере, галените, пирите, висмутине и других сульфидах. Его добывают из свинцовых, медных, никелевых и других руд, в которых он находится в рассеянном состоянии.
В тканях большинства живых существ содержится от 0,001 до 1 мг/кг , некоторые растения, морские организмы и грибы его концентрируют. Для ряда растений селен является необходимым элементом. Потребность человека и животных в составляет 50-100 мкг/кг пищи, этот элемент обладает антиоксидантными свойствами, влияет на множество ферментативных реакций и повышает восприимчивость сетчатки глаза к свету.
Селен может существовать в различных аллотропических модификациях: аморфной (стекловидный, порошкообразный и коллоидный селен), а также кристаллической. При восстановлении селена из раствора селенистой кислоты или быстрым охлаждением его паров получают красный порошкообразный и коллоидный селен.
При нагревании любой модификации этого химического элемента выше 220°С и последующем охлаждении образуется стекловидный селен, он хрупок и обладает стеклянным блеском.
Наиболее устойчив термически гексагональный серый селен, решетка которого построена из расположенных параллельно друг другу спиральных цепочек атомов. Его получают при помощи нагревания других форм селена до плавления и медленным охлаждением до 180-210°С. Внутри цепей гексагонального селена атомы связаны ковалентно.
Селен устойчив на воздухе, на него не действуют: кислород, вода, разбавленная серная и соляная кислоты, однако он хорошо растворяется в азотной кислоте. Взаимодействуя с металлами, селен образует селениды. Известно множество комплексных соединений селена, все они ядовиты.
Получают селен из отходов бумажного или производства, методом электролитического рафинирования меди. В шламах этот элемент присутствует вместе с тяжелыми и металлами, серой и теллуром. Для его извлечения шламы фильтруют, затем нагревают с концентрированной серной кислотой или подвергают окислительному обжигу при температуре 700°С.
Селен используется при производстве выпрямительных полупроводниковых диодов и другой преобразовательной техники.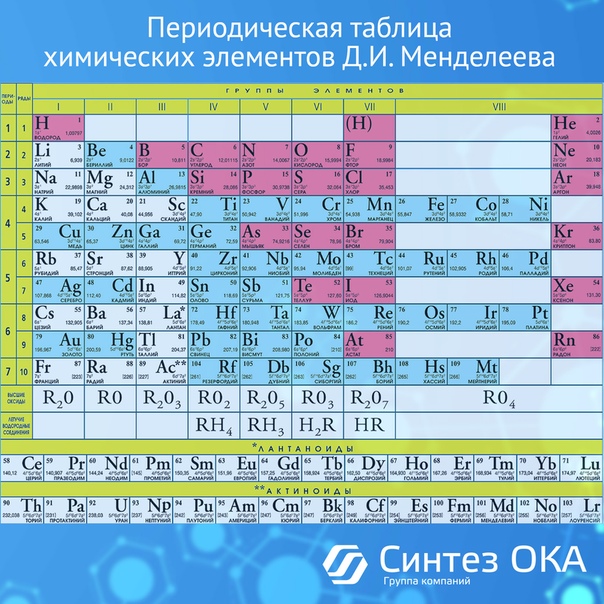 В металлургии с его помощью придают стали мелкозернистую структуру, а также улучшают ее механические свойства. В химической промышленности селен применяется в качестве катализатора.
В металлургии с его помощью придают стали мелкозернистую структуру, а также улучшают ее механические свойства. В химической промышленности селен применяется в качестве катализатора.
Источники:
- ХиМиК.ру, Селен
Кальций представляет собой химический элемент, относящийся ко второй подгруппе периодической таблицы с символическим обозначением Ca и атомной массой в 40,078 г/моль. Он представляет собой довольно мягкий и химически активный щелочноземельный металл с серебристым цветом.
Инструкция
С латинского языка « » переводится как «известь» или «мягкий камень», а своим открытием он обязан англичанину Хэмфри Дэви, который в 1808 году смог выделить кальций электролитическим методом. Ученый тогда взял смесь влажной гашеной извести, «приправленную» оксидом ртути, и подверг ее процессу электролиза на платиновой пластине, фигурирующей в эксперименте в качестве анода. Катодом же выступала проволока, которую химик погрузил в жидкую ртуть. Интересно и то, что такие соединения кальция, как известняк, мрамор и гипс, а также известь, были известны человечеству за много столетий до эксперимента Дэви, в течение которых ученые полагали некоторые из них простыми и самостоятельными телами. Только в 1789 году француз Лавуазье опубликовал труд, в котором он предположил, что известь, кремнезий, барит и глинозем являются сложными веществами.
Интересно и то, что такие соединения кальция, как известняк, мрамор и гипс, а также известь, были известны человечеству за много столетий до эксперимента Дэви, в течение которых ученые полагали некоторые из них простыми и самостоятельными телами. Только в 1789 году француз Лавуазье опубликовал труд, в котором он предположил, что известь, кремнезий, барит и глинозем являются сложными веществами.
Кальций обладает высокой степенью химической активности, в силу чего в чистом виде в природе практически не встречается. Но ученые подсчитали, что на долю этого элемента приходятся около 3,38% от общей массы всей земной коры, что делает кальций пятым по распространенности после кислорода, кремний, алюминия и железа. Есть этот элемент в морской воде – около 400 мг на один литр. Входит кальций и в состав силикатов различных горных пород (к примеру, гранит и гнейсы). Много его в полевом шпате, меле и известняках, состоящих из минерала кальцита с формулой СаСО3. Кристаллическая форма кальция – это мрамор. В общей же сложности путем миграции этого элемента в земной коре он образует 385 минералов.
В общей же сложности путем миграции этого элемента в земной коре он образует 385 минералов.
К физическим свойствам кальция относится его способность проявлять ценные полупроводниковые способности, хотя он и не становится полупроводником и металлом в традиционном смысле этого слова. Меняется данная ситуация при постепенном повышении давления, когда кальцию сообщается металлическое состояние и способности проявления сверхпроводящих свойств. Легко взаимодействует кальций с кислородом, влагой воздуха и углекислым газом, в силу чего в лабораториях для работы этот химический элемент хранят в плотно закрытых и химик Джон Александр Ньюленд – однако научное сообщество проигнорировало его достижение. Предложение Ньюленда не приняли всерьез из-за его поисков гармонии и связи между музыкой и химией.
Дмитрий Менделеев впервые опубликовал свою периодическую таблицу в 1869 году на страницах журнала Русского химического общества. Также ученый разослал извещения о своем открытии всем ведущим мировым химикам, после чего он неоднократно улучшал и дорабатывал таблицу, пока она не стала такой, какой ее знают сегодня. Суть открытия Дмитрия Менделеева заключалась в периодическом, а не монотонном изменении химических свойств элементов с ростом атомной массы. Окончательное объединение теории в периодический закон произошло в 1871 году.
Суть открытия Дмитрия Менделеева заключалась в периодическом, а не монотонном изменении химических свойств элементов с ростом атомной массы. Окончательное объединение теории в периодический закон произошло в 1871 году.
Легенды о Менделееве
Наиболее распространенной легендой является открытие таблицы Менделеевым во сне. Сам ученый неоднократно осмеивал данный миф, утверждая, что он придумывал таблицу на протяжении многих лет. По другой легенде Дмитрий Менделеев водку – она появилась после защиты ученым диссертации «Рассуждение о соединении спирта с водою».
Менделеева до сих пор многие считают первооткрывателем , который сам любил творить под водно-спиртовым раствором. Современники ученого часто посмеивались над лабораторией Менделеева, которую тот оборудовал в дупле гигантского дуба.
Отдельным поводом для шуток по слухам являлась страсть Дмитрия Менделеева к плетению чемоданов, которым ученый занимался, проживая в Симферополе. В дальнейшем он мастерил из картона для нужд своей лаборатории, за что его язвительно называли мастером чемоданных дел.
Таблица Менделеева, кроме упорядочивания химических элементов в единую систему, дала возможность предсказать открытие многих новых элементов. Однако в то же время некоторые из них ученые признали несуществующими, поскольку они были несовместимы с концепцией . Наиболее известной историей на тот момент являлось открытие таких новых элементов, как короний и небулий.
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. И наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Шаги
Часть 1
Структура таблицыТаблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 102 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода – 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится.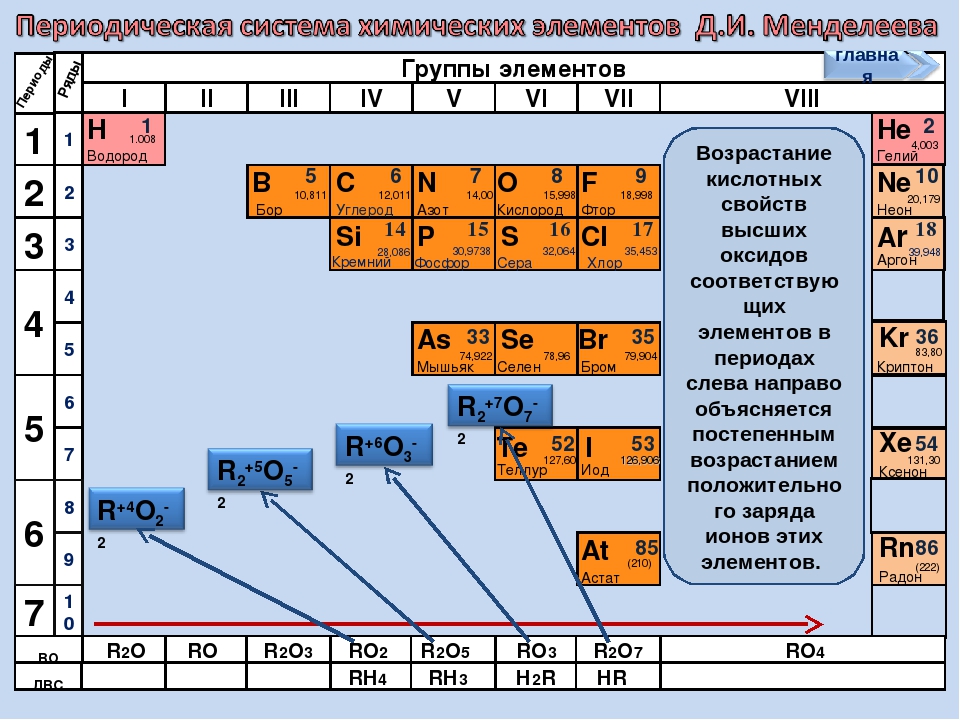 Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.
Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.
Часть 2
Обозначения элементовКаждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.

- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.
- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.
- Атомный номер всегда является целым числом.
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
Открытие Дмитрием Менделеевым периодической таблицы химических элементов в марте 1869 года стало настоящим прорывом в химии. Российскому ученому удалось систематизировать знания о химических элементах и представить их в виде таблицы, которую и сейчас обязательно изучают школьники на уроках химии. Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история ее открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
Российскому ученому удалось систематизировать знания о химических элементах и представить их в виде таблицы, которую и сейчас обязательно изучают школьники на уроках химии. Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история ее открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
История таблицы Менделеева: как все начиналось
Попытки классифицировать и систематизировать известные химические элементы предпринимались задолго до Дмитрия Менделеева. Свои системы элементов предлагали такие известные ученые, как Деберейнер, Ньюлендс, Мейер и другие. Однако из-за нехватки данных о химических элементах и их правильных атомных массах предложенные системы были не совсем достоверными.
История открытия таблицы Менделеева начинается в 1869 году, когда российский ученый на заседании Русского химического общества рассказал своим коллегам о сделанном им открытии.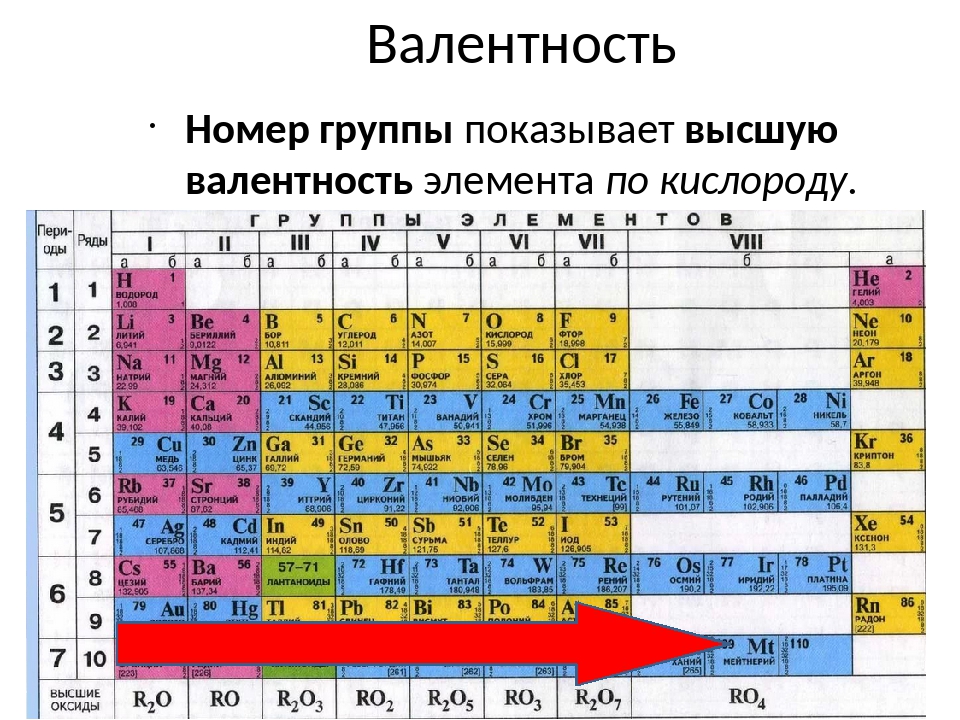 В предложенной ученым таблице химические элементы располагались в зависимости от их свойств, обеспечивающихся величиной их молекулярной массы.
В предложенной ученым таблице химические элементы располагались в зависимости от их свойств, обеспечивающихся величиной их молекулярной массы.
Интересной особенностью таблицы Менделеева было также наличие пустых клеток, которые в будущем были заполнены открытыми химическими элементами, предсказанными ученым (германий, галлий, скандий). После открытия периодической таблицы в нее много раз вносились добавления и поправки. Совместно с шотландским химиком Уильямом Рамзаем Менделеев добавил в таблицу группу инертных газов (нулевую группу).
В дальнейшем история периодической таблицы Менделеева была напрямую связана с открытиями в другой науке – физике. Работа над таблицей периодических элементов продолжается до сих пор, и современные ученые добавляют новые химические элементы по мере их открытия. Значение периодической системы Дмитрия Менделеева сложно переоценить, так как благодаря ей:
- Систематизировались знания о свойствах уже открытых химических элементов;
- Появилась возможность прогнозирования открытия новых химических элементов;
- Начали развиваться такие разделы физики, как физика атома и физика ядра;
Существует множество вариантов изображения химических элементов согласно периодическому закону, однако наиболее известный и распространенный вариант – это привычная для каждого таблица Менделеева.
Мифы и факты о создании периодической таблицы
Самым распространенным заблуждением в истории открытия таблицы Менделеева является то, что ученый увидел ее во сне. На самом деле сам Дмитрий Менделеев опроверг этот миф и заявил, что размышлял над периодическим законом на протяжении многих лет. Чтобы систематизировать химические элементы он выписывал каждый из них на отдельную карточку и многократно комбинировал их между собой, расставляя в ряды в зависимости от их схожих свойств.
Миф о «вещем» сне ученого можно объяснить тем, что Менделеев работал над систематизацией химических элементов сутками напролет, прерываясь на непродолжительный сон. Однако только упорный труд и природный талант ученого дал долгожданный результат и обеспечил Дмитрию Менделееву всемирную известность.
Многих учащихся в школе, а иногда и в университете, заставляютзаучивать или хотя бы примерно ориентироваться в таблице Менделеева. Для этого человек должен не только иметь хорошую память, но и логически мыслить, связывая элементы в отдельные группы и классы. Изучение таблицы легче всего дается тем людям, которые постоянно поддерживают мозг в тонусе, проходя тренинги на BrainApps.
Изучение таблицы легче всего дается тем людям, которые постоянно поддерживают мозг в тонусе, проходя тренинги на BrainApps.
Девятнадцатый век в истории человечества – век, в который многие науки реформировались, в том числе и химия. Именно в это время появилась периодическая система Менделеева, а вместе с ней – и периодический закон. Именно он стал основой современной химии. Периодическая система Д. И. Менделеева представляет собой систематизацию элементов, которая устанавливает зависимость химических и физических свойств от строения и заряда атома вещества.
История
Начало периодической положила книга «Соотношение свойств с атомным весом элементов», написанная в третьей четверти XVII века. В ней были отображены основные понятия относительно известных химических элементов (на тот момент их насчитывалось всего 63). К тому же у многих из них атомные массы были определены неправильно. Это сильно мешало открытию Д. И. Менделеева.
Дмитрий Иванович начал свою работу со сравнения свойств элементов. В первую очередь он занялся хлором и калием, а уж потом перешёл к работе со щелочными металлами. Вооружась специальными карточками, на которых были изображены химические элементы, он многократно пытался собрать эту «мозаику»: раскладывал на своем столе в поисках нужных комбинаций и совпадений.
В первую очередь он занялся хлором и калием, а уж потом перешёл к работе со щелочными металлами. Вооружась специальными карточками, на которых были изображены химические элементы, он многократно пытался собрать эту «мозаику»: раскладывал на своем столе в поисках нужных комбинаций и совпадений.
После долгих стараний Дмитрий Иванович все же нашёл ту закономерность, которую искал, и выстроил элементы в периодические ряды. Получив в результате пустые ячейки между элементами, учёный понял, что русским исследователям известны не все химические элементы, и что именно он должен дать этому миру те знания в области химии, которые ещё не были даны его предшественниками.
Всем известен миф о том, что Менделееву периодическая таблица явилась во сне, и он по памяти собрал элементы в единую систему. Это, грубо говоря, ложь. Дело в том, что Дмитрий Иванович довольно долго и сосредоточенно работал над своим трудом, и его это сильно выматывало. Во время работы над системой элементов Менделеев однажды заснул. Проснувшись, он понял, что не закончил таблицу, и скорее продолжил заполнение пустых ячеек. Его знакомый, некий Иностранцев, университетский педагог, решил, что таблица Менделееву приснилась во сне и распространил данный слух среди своих студентов. Так и появилась данная гипотеза.
Проснувшись, он понял, что не закончил таблицу, и скорее продолжил заполнение пустых ячеек. Его знакомый, некий Иностранцев, университетский педагог, решил, что таблица Менделееву приснилась во сне и распространил данный слух среди своих студентов. Так и появилась данная гипотеза.
Известность
Химических элементов Менделеева является отображением созданного Дмитрием Ивановичем ещё в третьей четверти XIX века (1869 год) периодического закона. Именно в 1869 году на заседании русского химического сообщества было зачитано уведомление Менделеева о создании им определённой структуры. И в этом же году была выпущена книга «Основы химии», в которой впервые была опубликована периодическая система химических элементов Менделеева. А в книге «Естественная система элементов и использование её к указанию качеств неоткрытых элементов» Д. И. Менделеев впервые упомянул понятие «периодический закон».
Структура и правила размещения элементов
Первые шаги в создании периодического закона были сделаны Дмитрием Ивановичем еще в 1869-1871 годах, в то время он усиленно работал над установлением зависимости свойств данных элементов от массы их атома. Современный вариант представляет собой сведённые в двумерную таблицу элементы.
Современный вариант представляет собой сведённые в двумерную таблицу элементы.
Положение элемента в таблице несёт определённый химический и физический смысл. По местонахождению элемента в таблице можно узнать, какая у него валентность, определить и другие химические особенности. Дмитрий Иванович пытался установить связь между элементами, как сходными между собой по свойствам, так и отличающимися.
В основу классификации известных на тот момент химических элементов он положил валентность и атомную массу. Сопоставляя относительные свойства элементов, Менделеев пытался найти закономерность, которая объединила бы все известные химические элементы в одну систему. Расположив их, основываясь на возрастании атомных масс, он всё-таки добился периодичности в каждом из рядов.
Дальнейшее развитие системы
Появившаяся в 1969 году таблица Менделеева ещё не раз дорабатывалась. С появлением благородных газов в 1930 годах получилось выявить новейшую зависимость элементов – не от массы, а от порядкового номера.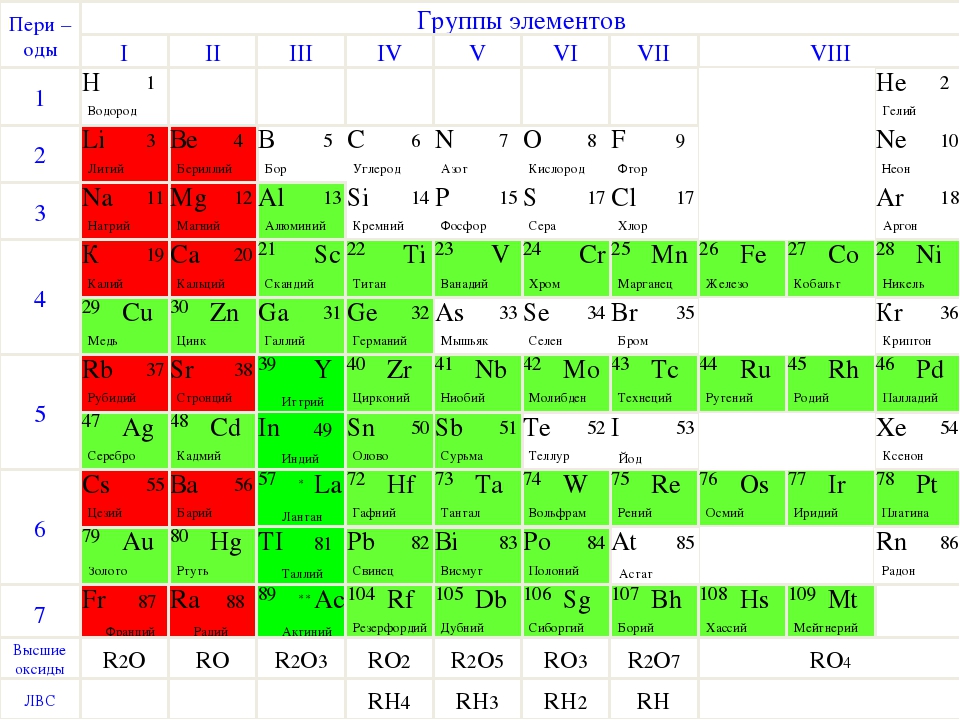 Позднее удалось установить число протонов в атомных ядрах, и оказалось, что оно совпадает с порядковым номером элемента. Учёными XX века было изучено электронное Оказалось, что и оно влияет на периодичность. Это сильно меняло представления о свойствах элементов. Данный пункт был отражён в более поздних редакциях периодической системы Менделеева. Каждое новое открытие свойств и особенностей элементов органично вписывалось в таблицу.
Позднее удалось установить число протонов в атомных ядрах, и оказалось, что оно совпадает с порядковым номером элемента. Учёными XX века было изучено электронное Оказалось, что и оно влияет на периодичность. Это сильно меняло представления о свойствах элементов. Данный пункт был отражён в более поздних редакциях периодической системы Менделеева. Каждое новое открытие свойств и особенностей элементов органично вписывалось в таблицу.
Характеристики периодической системы Менделеева
Таблица Менделеева поделена на периоды (7 строк, расположенных горизонтально), которые, в свою очередь, подразделяются на большие и малые. Начинается период со щелочного металла, а заканчивается элементом с неметаллическими свойствами.
Вертикально таблица Дмитрия Ивановича поделена на группы (8 столбцов). Каждая из них в периодической системе состоит из двух подгрупп, а именно – главной и побочной. После долгих споров по предложению Д. И. Менделеева и его коллеги У. Рамзая было решено ввести так называемую нулевую группу. В неё входят инертные газы (неон, гелий, аргон, радон, ксенон, криптон). В 1911 году учёным Ф. Содди было предложено поместить в периодической системе и неразличимые элементы, так называемые изотопы, – для них были выделены отдельные ячейки.
В неё входят инертные газы (неон, гелий, аргон, радон, ксенон, криптон). В 1911 году учёным Ф. Содди было предложено поместить в периодической системе и неразличимые элементы, так называемые изотопы, – для них были выделены отдельные ячейки.
Несмотря на верность и точность периодической системы, научное общество долго не хотело признавать данное открытие. Многие великие учёные высмеивали деятельность Д. И. Менделеева и считали, что невозможно предсказать свойства элемента, который ещё не был открыт. Но после того как предполагаемые химические элементы были открыты (а это были, например, скандий, галлий и германий), система Менделеева и его периодический закон стали науки химии.
Таблица в современности
Периодическая система элементов Менделеева – основа большинства химических и физических открытий, связанных с атомно-молекулярным учением. Современное понятие элемента сложилось как раз благодаря великому учёному. Появление периодической системы Менделеева внесло кардинальные изменения в представления о различных соединениях и простых веществах. Создание ученым периодической системы оказало огромное влияние на развитие химии и всех наук, смежных с ней.
Создание ученым периодической системы оказало огромное влияние на развитие химии и всех наук, смежных с ней.
“Периодический закон и Периодическая система химических элементов Д.И. Менделеева”
Цель урока:
- Создать условия для обобщения знаний учащихся по темам из курса химии.
- Закрепить знания о взаимосвязях между положением элемента в периодической системе и строении атома.
- Развивать интерес к учебе и познавательной деятельности, умение быстро и четко формулировать и высказывать свои мысли, логически рассуждать.
- Использовать информационные технологии для оформления результатов исследований.
- Воспитывать у учащихся навыки коллективного сотрудничества.
Средство обучения: Средства обучения ТСО: таблица “Периодическая система химических элементов Д.И. Менделеева” компьютерная презентация.
Подготовка учащихся к уроку: Класс заранее разбивается на 4
группы (за месяц до урока), каждая из которых получает свою тему, над которой
работает, собирая теоретический и практический материал.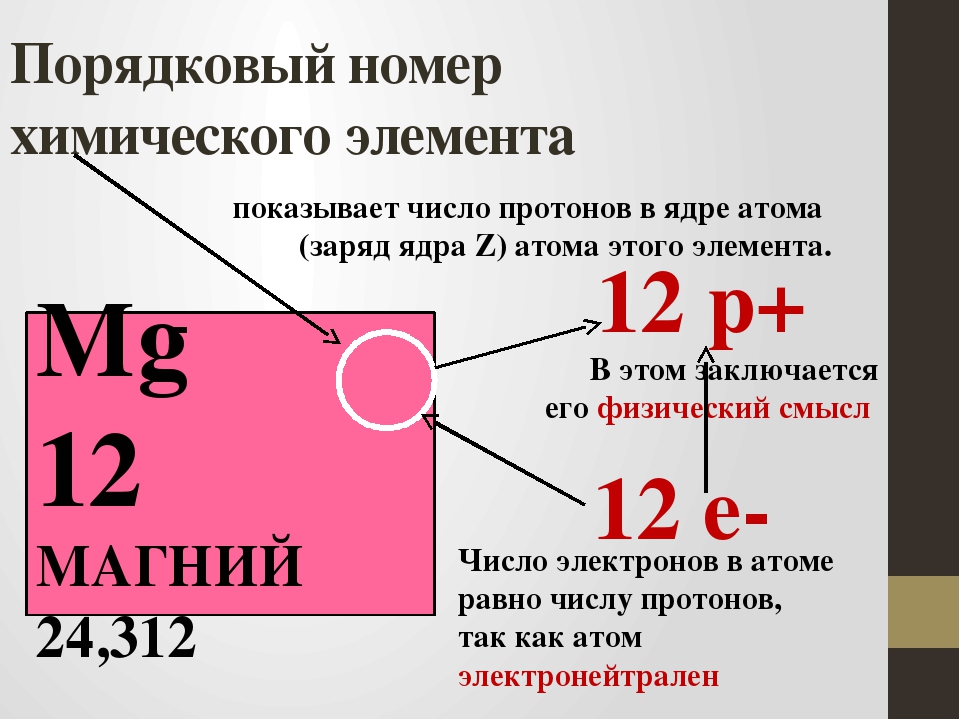
Периодическая система химических элементов и строение атома.
Периодический закон Д.И. Менделеева — фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д.И. Менделеевым при сопоставлении всех известных в то время элементов и величин их атомных масс (весов).
- 1 Группа
- История открытия периодического закона
Триады, октавы, спираль, таблица….?!
- Цель: Раскрыть сущность первых попыток классификации химических элементов. Выяснить как Д.И. Менделеев систематизировал химические элементы.
- Гипотеза: Мы предполагаем, что трудности классификации
химических элементов у предшественников Д.И. Менделеева вызваны
недостаточностью эксперементальных данных и что Д.И. Менделеев нашел
закономерность, которая объеденила все элементы в единую систему.

- Ход исследования: Триады Деберейнера, Спираль де Шанкуртуа, Октавы Ньюледнса, Таблицы Олдинга, Работа Л. Мейера, Таблица Д.И.Менделеева
История открытия Периодического закона
Поиски основы естественной классификации химических элементов и их систематизации начались задолго до открытия Периодического закона. Трудности, с которыми сталкивались естествоиспытатели, которые первыми работали в этой области, были вызваны недостаточностью экспериментальных данных: в начале XIX в. число известных химических элементов было ещё слишком мало, к середине 19 века было известно 63 химических элемента, а принятые значения атомных масс многих элементов неточны.
Триады Деберейнера и первые системы элементов
В 1829 г. немецкий химик И.Дёберейнер предпринял первую значимую попытку систематизации элементов. Он заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы, которые он назвал триадами:
Li —
Na —
K ;
Ca —
Sr —
Ba ;
S —
Se —
Te ;
P —
As —
Sb ;
Cl —
Br —
I .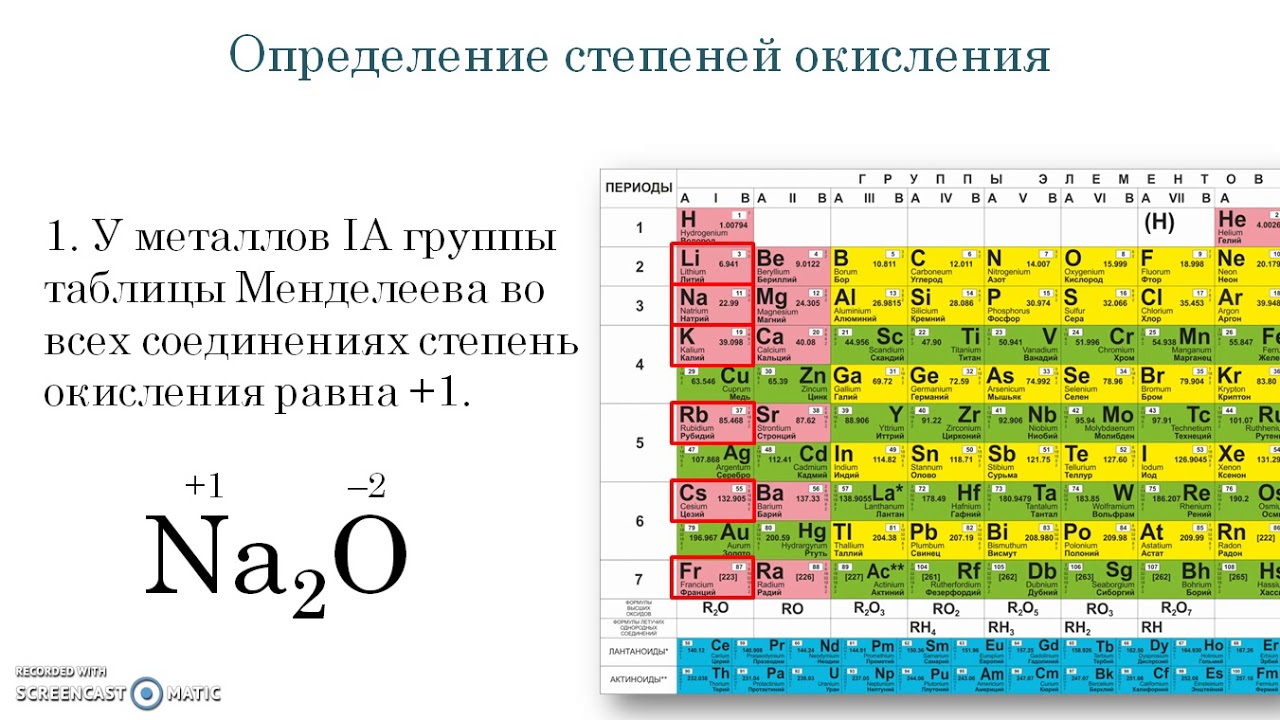
Сущность предложенного закона триад Дёберейнера состояла в том, что атомная масса среднего элемента триады была близка к полусумме (среднему арифметическому) атомных масс двух крайних элементов триады. Хотя разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в соответствии с их атомными массами.
Спираль де Шанкуртуа
А.де Шанкуртуа (Франция) располагал все известные в то время химические элементы в единой последовательности возрастания их атомных масс и полученный ряд наносил на поверхность цилиндра по линии, исходящей из его основания под углом 45° к плоскости основания (т.н. земная спираль).
При развертывании поверхности цилиндра оказывалось, что на вертикальных
линиях, параллельных оси цилиндра, находились химические элементы со сходными
свойствами.
Так, на одну вертикаль попадали литий, натрий, калий; бериллий, магний, кальций; кислород, сера, селен, теллур и т. д. Недостатком спирали де Шанкуртуа было то обстоятельство, что на одной линии с близкими по своей химической природе элементами оказывались при этом и элементы совсем иного химического поведения. В группу щелочных металлов попадал марганец, в группу кислорода и серы — ничего общего с ними не имеющий титан.
Октавы Ньюлендса
Английский учёный Дж. Ньюлендс в 1864 г. опубликовал таблицу элементов, отражающую предложенный им закон октав. Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого.
Ньюлендс пытался придать этой зависимости, действительно имеющей место для
лёгких элементов, всеобщий характер. В его таблице в горизонтальных рядах
располагались сходные элементы, однако в том же ряду часто оказывались и
элементы совершенно отличные по свойствам.
Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица не содержала свободных мест; в итоге закон октав был принят чрезвычайно скептически. Однако в его основе лежала правильная мысль о периодическом изменении свойств элементов с увеличением их атомного веса
| H | Li | Be | B | C | N | O |
| F | Na | Mg | Al | Si | P | S |
| Cl | K | Ca | Cr | Ti | Mn | Fe |
Таблицы Олдинга и Мейра
В 1864 г. У.Олдинг опубликовал таблицу, в которой элементы были размещены
согласно их атомным весам и сходству химических свойств, не сопроводив её,
однако, какими-либо комментариями.
У.Олдинг опубликовал таблицу, в которой элементы были размещены
согласно их атомным весам и сходству химических свойств, не сопроводив её,
однако, какими-либо комментариями.
В том же 1864 г. появилась первая таблица немецкого химика Л. Мейера; в неё были включены 28 элементов, размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах сходных элементов.
В 1870 г. вышла работа Мейера, содержащая новую таблицу под названием
“Природа элементов как функция их атомного веса”, состоявшая из девяти
вертикальных столбцов. Сходные элементы располагались в горизонтальных рядах
таблицы; некоторые ячейки Мейер оставил незаполненными. Таблица сопровождалась
графиком зависимости атомного объёма элемента от атомного веса, имеющий
характерный пилообразный вид, прекрасно иллюстрирующий термин “периодичность”,
уже предложенный к тому времени Менделеевым.
Д.И. Менделеев
В марте 1869 г. русский химик Д.И. Менделеев представил Русскому химическому обществу сообщение об открытии им Периодического закона химических элементов. В том же году вышло первое издание менделеевского учебника “Основы химии”, в котором была приведена его периодическая таблица.
В конце 1870 г. он доложил РХО статью “Естественная система элементов и применение её к указанию свойств неоткрытых элементов”, в которой предсказал свойства нескольких не открытых ещё элементов. Для предсказания свойств простых веществ и соединений Менделеев исходил из того, что свойства каждого элемента являются промежуточными между соответствующими свойствами двух соседних элементов в группе периодической таблицы (то есть сверху и снизу) и одновременно двух соседних элементов в периоде (слева и справа).
В 1871 г. в итоговой статье “Периодическая законность химических элементов”
Менделеев дал следующую формулировку Периодического закона: “Свойства элементов,
а потому и свойства образуемых ими простых и сложных тел стоят в периодической
зависимости от атомного веса”.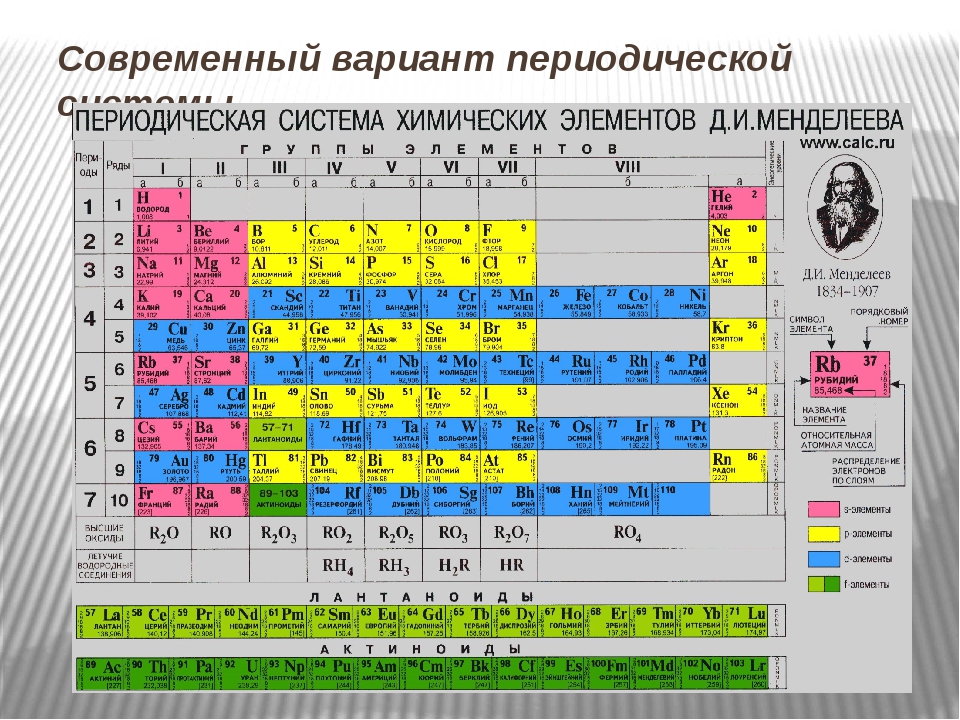 Тогда же Менделеев придал своей периодической
таблице вид, ставший классическим (т.н. короткий вариант).
Тогда же Менделеев придал своей периодической
таблице вид, ставший классическим (т.н. короткий вариант).
В отличие от своих предшественников, Менделеев не только составил таблицу и указал на наличие несомненных закономерностей в численных величинах атомных весов, но и решился назвать эти закономерности общим законом природы. Он взял на себя смелость на основании предположения, что атомная масса предопределяет свойства элемента, изменить принятые атомные веса некоторых элементов и подробно описать свойства неоткрытых ещё элементов.
В начале XX века Периодическая система элементов неоднократно видоизменялась
для приведения в соответствие с новейшими научными данными. Д.И. Менделеев и У.
Рамзай пришли к выводу о необходимости образования в таблице нулевой группы
элементов, в которую вошли инертные газы. Инертные газы явились, таким образом,
элементами, переходными между галогенами и щелочными металлами. Б. Браунер нашёл
решение проблемы размещения в таблице редкоземельных элементов, предложив в 1902
г. помещать все РЗЭ в одну ячейку; в предложенном им длинном варианте таблицы
шестой период таблицы был длиннее, чем четвёртый и пятый, которые в свою очередь
длиннее, чем второй и третий периоды.
помещать все РЗЭ в одну ячейку; в предложенном им длинном варианте таблицы
шестой период таблицы был длиннее, чем четвёртый и пятый, которые в свою очередь
длиннее, чем второй и третий периоды.
Дальнейшее развитие Периодического закона в было связано с успехами физики: установление делимости атома на основании открытия электрона и радиоактивности в конце концов позволило понять причины периодичности свойств химических элементов и создать теорию Периодической системы.
Как отразилась теория строения атом на объяснении Периодического закона
- 2 Группа
- Цель: Раскрыть смысл периодического закона с точки зрения строения атома.
- Гипотеза: Мы утверждаем, что сведения о строении атома уточняют суть Переодического закона и что новые научные открытия в области строения атома позволили уточнить формулировку периодического закона
Ход исследования: Гениальность Д. И. Менделеева:
И. Менделеева:
- Предвидел причины открытых им закономерностей,
- угадал порядок расположения элементов,
- создал таблицу так что, она характеризует строение атома.
Открытие сложного строения атома. Открытие изотопов. Закон Мозли.
Д. И. Менделеев писал: “Легко предположить, но ныне пока нет еще возможности доказать, что атомы простых тел суть сложные существа, образованные сложением некоторых ещё меньших частей, что называемое нами неделим (атом) – неделим только обычными химическими силами, как частицы неделимы в обычных условиях физическими силами… выставленная мною. Периодическая зависимость между свойствами и весом по-видимому, подтверждает такое предчувствие…”
Периодический закон и высказанные на его основе гипотезы явились стимулом к
выяснению строения атома. В 1911г. Английский ученый Э.Резерфорд своим опытом Рассеивание альфа частиц
доказал, что в центре атома есть положительно заряженное ядро и заряд ядра
численно совпадает с порядковым номером элемента.
Вокруг ядра атома движутся электроны имеющие отрицательный заряд, а так как атом электронейтрален следовательно число электронов тоже равно порядковому номеру элемента.
Благодаря открытию радиоактивности учёные убедились, что в состав ядер атомов входят частицы с зарядом +1 и массой 1 их назвали Протонами – Р, а так как массы атомов кроме водорода больше той массы которая приходится на долю протонов, то предположили что в состав ядер входят нейтральные частицы с массой 1. Такие частицы были эксперементально получены в 1913г. и их назвали Нейтроны – п.
В результате эксперементальных исследований. Т.Сведберг в 1909г. Доказал что свинец и неон, полученный в результате радиоактивного распада отличаются по величине атомных масс от “обычных” элементов, но химически им полностью тождественны, это означало что, в природе встречаются атомы одного и того же элемента с одинаковым зарядом ядра но с разными массами. Так были открыты изотопы
В 1911 г. Ф. Содди предложил размещать химически неразличимые элементы,
имеющие различные атомные массы (изотопы) в одной ячейке таблицы.
Ф. Содди предложил размещать химически неразличимые элементы,
имеющие различные атомные массы (изотопы) в одной ячейке таблицы.
В 1913 г. английский физик Г.Мозли установил, что корень из характеристической частоты рентгеновского излучения элемента (ν) линейно зависит от целочисленной величины — атомного номера (Z), который совпадает с номером элемента в Периодической таблице: ν=R(Z-σ)²(1/m²-1/n²), где R – постоянная Ридберга, σ – постоянная экранирования.
Закон Мозли дал возможность экспериментально определить положение элементов в
Периодической таблице. Атомный номер, совпадающий, как предположил в 1911 г.
голландский физик А. ван ден Брук, с величиной положительного заряда ядра атома,
стал основой классификации химических элементов. В 1920 г. английский физик Дж.
Чедвик экспериментально подтвердил гипотезу Ван ден Брука; тем самым был раскрыт
физический смысл порядкового номера элемента в Периодической системе. Периодический закон получил современную формулировку: “Свойства простых веществ,
а также формы и свойства соединений элементов находятся в периодической
зависимости от зарядов ядер атомов элементов”.
Периодический закон получил современную формулировку: “Свойства простых веществ,
а также формы и свойства соединений элементов находятся в периодической
зависимости от зарядов ядер атомов элементов”.
В 1921 — 1923 гг., основываясь на модели атома Бора-Зоммерфельда, представляющей собой компромисс между классическими и квантовыми представлениями, Н. Бор заложил основы формальной теории Периодической системы. Причина периодичности свойств элементов, как показал Бор, заключалась в периодическом повторении строения внешнего электронного уровня атома.
Что означает № элемента, периода, группы?
- Группа 3
- Цель: выяснить, какую особенность или закономерность в строении атомов элементов отражает каждое обозначение в Периодической системе химических элементов Д.И. Менделеева.
- Гипотеза: Периодическая система является графическим изображением Периодического закона?
Ход исследования: Физический смысл элемента, периода, группы. Причины
изменения свойств элементов и образованных ими веществ в периодах. Причины
изменения свойств элементов и образованных ими веществ в группах (главных подгруппах). Причины
более медленного изменения этих свойств в больших периодах. Валентность. Степень
окисления.
Причины
изменения свойств элементов и образованных ими веществ в периодах. Причины
изменения свойств элементов и образованных ими веществ в группах (главных подгруппах). Причины
более медленного изменения этих свойств в больших периодах. Валентность. Степень
окисления.
На основе приобретенных знаний о строении атома каждое обозначение периодической таблицы имеет свой физический смысл. Заряд ядра является основной характеристикой атома он соответствует порядковому номеру элемента и определяет число электронов в атоме, строение энергетических уровней, свойства элемента и его положение в периодической системе. Периодическая система естественная классификация химических элементов основанная на периодическом законе. Графически её изображают в виде таблицы. Таблица состоит из 7 периодов, 10 рядов и 8 групп.
Период – это горизонтальный ряд элементов расположенных в порядке возрастания
зарядов ядер атомов. Номер периода – арабская цифра слева – показывает число
энергетических уровней в атомах элементов относящихся к данному периоду на
которых находятся электроны атома. В этом заключается физический смыл номера
периода. Первые три периода малые остальные большие (4,5,6 и 7 не завершенный)
состоят из двух горизонтальных рядов.
Номер периода – арабская цифра слева – показывает число
энергетических уровней в атомах элементов относящихся к данному периоду на
которых находятся электроны атома. В этом заключается физический смыл номера
периода. Первые три периода малые остальные большие (4,5,6 и 7 не завершенный)
состоят из двух горизонтальных рядов.
Во всех периодах с возрастанием заряда ядер атомов наблюдается ослабление металлических и восстановительных свойств атомов элементов и усиление неметаллических и окислительных свойств атомов элементов. Легче отдают электроны атомы щелочных металлов имеющие по одному валентному электрону труднее всего атомы благородных газов, обладающих замкнутой электронной оболочкой.
В малых периодах переход от щелочного металла к инертному элементу происходит
через 8 элементов – быстрое уменьшение атомных радиусов, а в больших периодах
через 18 и 32 элементов – медленное уменьшение атомных радиусов, по этому в
больших периодах металлические свойства элементов ослабляются медленнее чем в
малых периодах.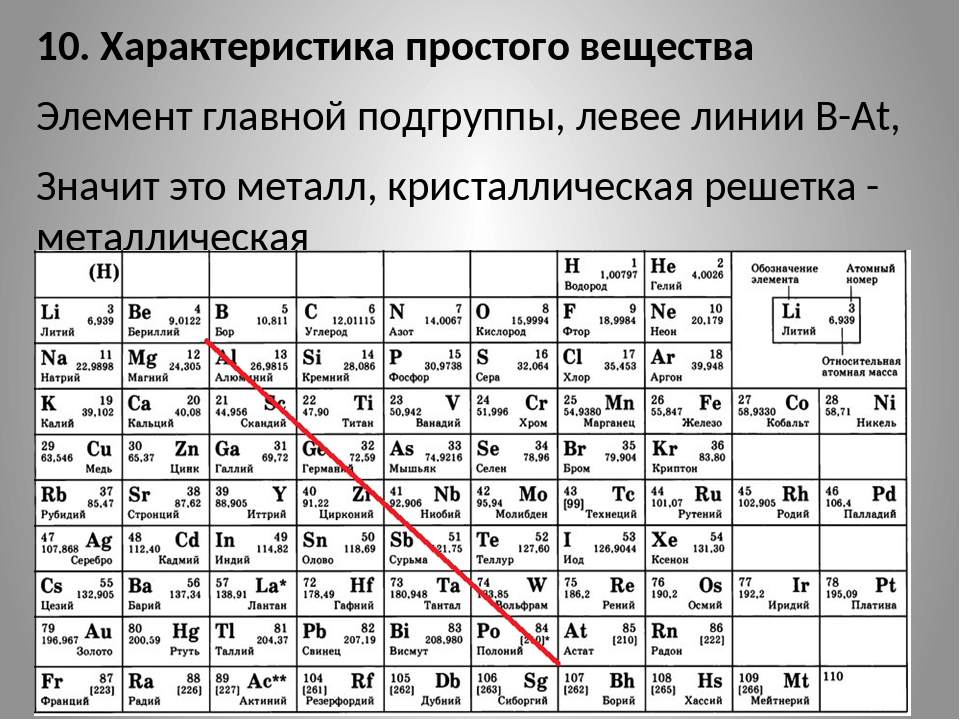
Группа – это вертикальный ряд элементов атомы которых имеют одинаковое число валентных электронов. Валентные это электроны, за счет которых атомы соединяются между собой, образуя молекулы. Номер группы – римская цифра вверху –показывает число валентных электронов в атоме. В этом заключается физический смысл номера группы. В периодической системе элементов 8 групп состоящих из подгрупп. Главные подгруппы содержат элементы малых и больших периодов Подгруппа А. Побочные подгруппы содержат элементы только больших периодов Подгруппа Б. С увеличением заряда ядра металлические и восстановительные свойства возрастают.
Валентность. Наиболее общее определение валентности элемента – это
способность его атомов соединяться с другими атомами в определенных
соотношениях. Иногда валентность элемента заменяют близким ему понятием степени
окисления (с.о.). Степень окисления соответствует заряду, который приобрел бы
атом, если бы все электронные пары его химических связей сместились в сторону
более электроотрицательных атомов. В любом периоде слева направо происходит
увеличение положительной степени окисления элементов. Элементы первой группы
имеют с.о., равную +1 и формулу оксида R2O, элементы второй группы –
соответственно +2 и RO и т.д. Элементы с отрицательной с.о. находятся в пятой,
шестой, и седьмой группах; считается, что углерод и кремний, находящиеся в
четвертой группе, не имеют отрицательной степени окисления. Галогены, имеющие
степень окисления -1, образуют соединения с водородом состава RH. В целом
положительная степень окисления элементов соответствует номеру группы, а
отрицательная равна разности восемь минус номер группы. Из таблицы нельзя
определить наличие или отсутствие других степеней окисления.
В любом периоде слева направо происходит
увеличение положительной степени окисления элементов. Элементы первой группы
имеют с.о., равную +1 и формулу оксида R2O, элементы второй группы –
соответственно +2 и RO и т.д. Элементы с отрицательной с.о. находятся в пятой,
шестой, и седьмой группах; считается, что углерод и кремний, находящиеся в
четвертой группе, не имеют отрицательной степени окисления. Галогены, имеющие
степень окисления -1, образуют соединения с водородом состава RH. В целом
положительная степень окисления элементов соответствует номеру группы, а
отрицательная равна разности восемь минус номер группы. Из таблицы нельзя
определить наличие или отсутствие других степеней окисления.
Физический смысл атомного номера. Истинное понимание периодической таблицы
возможно на основе современных представлений о строении атома. Порядковый номер
элемента в периодической таблице – его атомный номер – значительно важнее.
Знаете ли вы, что с открытием Периодического закона химия перестала быть описательной наукой?
- Группа 4
- Цель: раскрыть значение периодического закона и Периодической системы химических элементов для современной науки.
- Гипотеза: мы предполагаем, что с открытием Периодического закона химия стала экспериментальной наукой. Периодический закон стал инструментом познания и объективным законом природы.
Ход исследования: Установление связи между элементами и объединение их в группы. Расположение элементов в естественной последовательности. Объяснение периодичности. Исправление и уточнение относительных атомных масс элементов. Предсказание и описание свойств, указание пути открытия еще неоткрытых элементов. Значение закона.
В большинстве случаев с возрастанием заряда ядра атомов элементов закономерно
увеличиваются их относительные атомные массы. Это обстоятельство и позволило
Д.И. Менделееву открыть периодический закон, располагая элементы в порядке
возрастания относительно атомных масс.
Это обстоятельство и позволило
Д.И. Менделееву открыть периодический закон, располагая элементы в порядке
возрастания относительно атомных масс.
С открытия периодического закона начинается новый этап развития химической науки. Химия стала целостной наукой, разнообразность содержания которой объединено в стройную систему. Как любой закон природы он объясняет многие факты и явления, объясняет взаимосвязь строения и свойств химических элементов, закономерности изменения их свойств, причины периодичности изменения свойств элементов и их соединений.
Сущность явления периодичности объясняется тем, что с возрастанием зарядов ядра атомов элементов наблюдается периодическая повторяемость элементов с одинаковым числом валентных электронов, чем объясняется периодическая повторяемость свойств химических элементов и их соединений
Например, периодическая повторяемость свойств у атомов лития Li, натрия Na и
калия K объясняется тем, что на наружном энергетическом уровне их атомов имеется
по одному валентному электрону.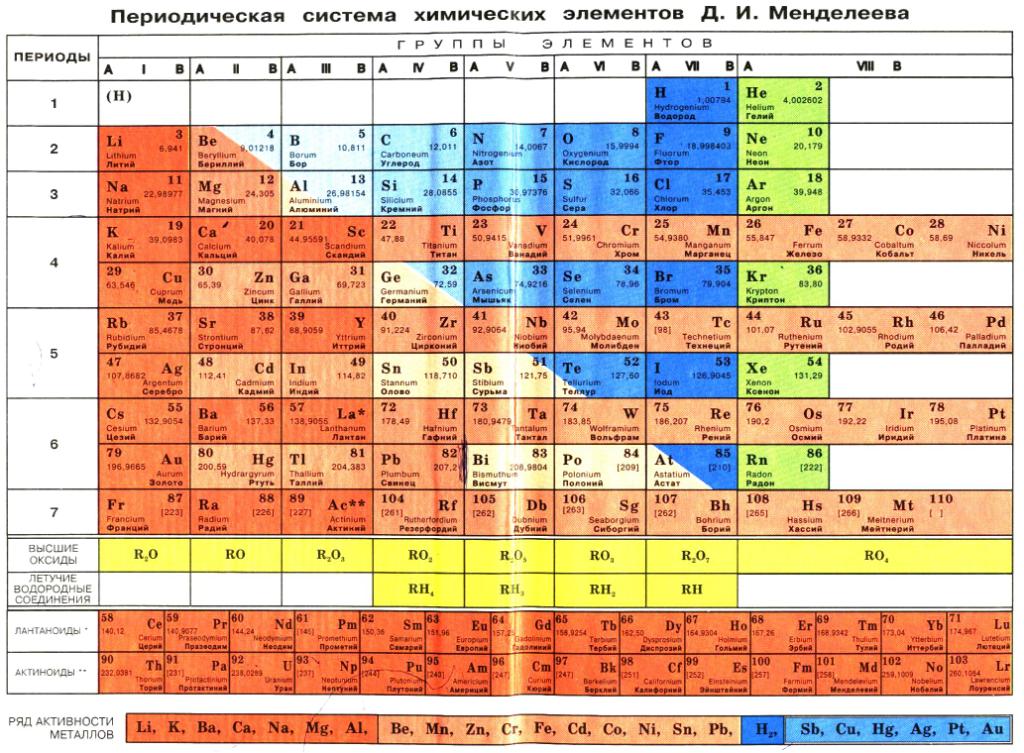
Благодаря периодическому закону стало возможно не только исправлять относительные атомные массы элементов но и предсказывать свойства элементов, которые ещё не открыты. Д.И. Менделеев исправил атомные массы 9 химических элементов (Be,La,U и другие) Так, относительная атомная масса Be была 13,5. Он делает заключение, что масса должна быть равна 9. Последующие исследования подтвердили правильность вычисления.
Д.И. Менделеев предсказал существование более 10 неизвестных в то время элементов; свойства 3 из них (№ 21 – скандий, № 31- галлий, № 32 – германий) он описал наиболее подробно. Все предсказанные элементы были в последствии открыты. Существование этих элементов и описание их свойств он основывал на положении: Свойства любого химического элемента (например Mg) являются промежуточными между свойствами соседних элементов расположенных слева и справа (Na, Al), снизу и сверху (Be, Ca)
Он назвал предсказанные элементы соответственно экабором, экаалюминием, экасилицием (эка значит “под”), так как считал, что эти элементы должны быть сходны по свойствам с бором, алюминием и кремнием
- В 1875 г.
 Французский химик П.Лекок де Буабодран открыл элемент № 31, который
обладал всеми свойствами экаалюминия, он был назван Галлием.
Французский химик П.Лекок де Буабодран открыл элемент № 31, который
обладал всеми свойствами экаалюминия, он был назван Галлием. - В 1879 г. Шведский ученый Л.Нильсон открыл элемент № 21 – скандий имевший свойства экабора.
- В 1886 г. Немецкий химик К.Винклер открыл элемент № 32 – германий имевший свойства экасилиция.
Периодический закон – объективный закон природы он отражает материальность мира его единство и развитие, показывает что мир познаваем и нет предела процессу познания тайн природы.
Периодический закон и периодическая система являются в настоящее время важнейшим инструментом познания – это компас и путеводная звезда для научного предвидения во многих областях естественных наук.
Урок заканчивается рефлексией учащимся предлагается периодическая таблица с заданием. Учащийся каждой группы по данному заданию заполняет.
- 1гр. – Элементы 1 и 2 группы.
- 2.
 гр – Элементы 3 и 4 группы.
гр – Элементы 3 и 4 группы. - 3.гр. – Элементы 5 и 6 группы.
- 4.гр. – Элементы 7 и 8 группы.
Возможны варианты заполнения на усмотрение учителя.
Приложение 2
Презентация
Группа содействия и координации клинических испытаний
19/07/2021
Завершение процедуры VHP
Крайний срок подачи заявок в VHP в контексте рождественских каникул 2021/2022 и перехода на CTIS/CTR, начиная с заявки CTR
CTFG информирует Спонсоров о том, что полное внедрение CTR 536/2014 запланировано на 31 января 2022 г. В целях организации плавного перехода VHP-процессов в CTIS и CTR, особенно в свете VHP-Рождественского перерыва были определены следующие сроки.
Рождественские каникулы VHP 2021/2022 состоятся с 22 декабря 2021 года по 7 января 2022 года (включительно). Все процедуры ПДС должны быть завершены в январе 2022 года. Для достижения этой цели и предоставления четких указаний последним днем подачи любой заявки ПДС (первоначальная, существенная поправка, 2-й раунд) будет 15 октября 2021 года.
Для достижения этой цели и предоставления четких указаний последним днем подачи любой заявки ПДС (первоначальная, существенная поправка, 2-й раунд) будет 15 октября 2021 года.
Дополнительные сведения доступны здесь. .
21/01/2021
Заключение процедуры добровольной гармонизации
CTFG информирует спонсоров, что проект процедуры добровольной гармонизации (VHP) будет закрыт контекстуально с реализацией Регламент ЕС 536/2014 о клинических испытаниях.Таким образом, спонсоры уведомляются о том, что за 60 дней до даты вступления в силу нового регламента заявки на первоначальные клинические испытания и заявки на существенные изменения через VHP больше не будут приниматься и обрабатываться администратором VHP.
9/10/20209
9/10/2020
пресс-релиз, относящиеся к организации заседания CTFG с заинтересованными сторонами
, CTFG хотелось бы информировать заинтересованные стороны, что из-за чрезвычайной ситуации в области чрезвычайных ситуаций, связанных с COVID- 19 и последующих мерах, принятых странами, встреча, первоначально запланированная на четвертый квартал 2020 года, вместо этого будет проведена во второй половине 2021 года. CTFG считает, что реальная ценность встреч с заинтересованными сторонами — это возможность обмена мнениями между людьми, и поэтому CTFG решили отложить встречу, а не организовывать ее виртуальную, чтобы поощрять взаимодействие между заинтересованными сторонами, принадлежащими к мир клинических испытаний. Тем не менее, обмен с заинтересованными сторонами имеет важное значение для CTFG , поэтому мы планируем провести виртуальную встречу в 2021 году, если встреча лицом к лицу будет невозможна.
CTFG считает, что реальная ценность встреч с заинтересованными сторонами — это возможность обмена мнениями между людьми, и поэтому CTFG решили отложить встречу, а не организовывать ее виртуальную, чтобы поощрять взаимодействие между заинтересованными сторонами, принадлежащими к мир клинических испытаний. Тем не менее, обмен с заинтересованными сторонами имеет важное значение для CTFG , поэтому мы планируем провести виртуальную встречу в 2021 году, если встреча лицом к лицу будет невозможна.
21.09.2020
Принято и внедрено обновление CTFG , документ «Рекомендации, касающиеся контрацепции и тестирования на беременность в клинических испытаниях» .
Изменения заключаются в следующем:
- после прекращения соответствующего системного воздействия лекарственного средства для воздействия других видов генотоксикантов, кроме анеугенных соединений, продлевается продолжительность применения высокоэффективных мер контрацепции для женщин детородного возраста от 1 месяца до 6 месяцев (один цикл фолликулогенеза).

- В раздел о необходимости сексуального консультирования субъектов исследования добавлена необходимость информирования участников о необходимости получения консультации по поводу донорства и криоконсервации зародышевых клеток в соответствии с данным руководством перед лечением, если это применимо. у подростков, что должно быть отражено в протоколе.
Руководство для спонсоров по управлению клиническими испытаниями во время пандемии COVID-19
Обновление руководства от 28 апреля 2020 г. доступно здесь
Периоды и группы в периодической таблице пронумерованы.Например, элемент неон (Ne) относится к периоду 2, группе 18. Неон представляет собой инертный газ и поэтому не вступает в реакцию с любым другим элементом. Какой из следующих элементов, вероятно, обладает свойствами, подобными свойствам неона?
- Дом
- Периоды и группы периодической таблицы перенумерованы. Например, элемент неон (Ne) относится к периоду 2, группе 18.
 Неон представляет собой инертный газ и поэтому не вступает в реакцию с любым другим элементом. Какой из следующих элементов, вероятно, обладает свойствами, подобными свойствам неона?
Неон представляет собой инертный газ и поэтому не вступает в реакцию с любым другим элементом. Какой из следующих элементов, вероятно, обладает свойствами, подобными свойствам неона?
Периоды и группы периодической таблицы пронумерованы.Например, элемент неон (Ne) относится к периоду 2, группе 18. Неон представляет собой инертный газ и поэтому не вступает в реакцию с любым другим элементом. Какой из следующих элементов, вероятно, обладает свойствами, подобными свойствам неона?
Это список доступных вариантов ответов:
- литий (Li) в период 2, группа 1
- бор (В) в период 2, группа 13
- железо (Fe) в период 4, группа 8
- криптон (Kr) в период 4, группа 18
Лучший ответ D.криптон (Kr) в периоде 4, группе 18 .
По сообщениям учителей со всего мира. Правильный ответ на ❝Периоды и группы в периодической таблице пронумерованы. Например, элемент неон (Ne) относится к периоду 2, группе 18. Неон представляет собой инертный газ и поэтому не вступает в реакцию с любым другим элементом. Какой из следующих элементов, вероятно, обладает свойствами, подобными свойствам неона? ❞ вопрос — D. криптон (Kr) в периоде 4, группе 18 .
Неон представляет собой инертный газ и поэтому не вступает в реакцию с любым другим элементом. Какой из следующих элементов, вероятно, обладает свойствами, подобными свойствам неона? ❞ вопрос — D. криптон (Kr) в периоде 4, группе 18 .
Рекомендую вам прочитать следующий вопрос и ответ, а именно Пробный баланс составляется как доказательство равенства дебета и кредита в главной книге.с очень точными ответами.
Что такое сайт cp.dhafi.link?
Dhafi Quiz Это образовательный онлайн-сайт для предоставления помощи и информации учащимся, находящимся на этапе обучения. они смогут легко найти ответы на вопросы в школе. Мы стремимся публиковать энциклопедические викторины, полезные для учащихся. Все объекты здесь на 100% бесплатны. Надеюсь, наш сайт может быть очень полезен для вас. Спасибо за посещение.
Определения случаев для эпиднадзора за COVID-19 — ПАОЗ/ВОЗ
1. Определения случаев
Определения случаев Определения случаев и контактов основаны на текущей доступной информации и регулярно пересматриваются по мере накопления новой информации. Странам может потребоваться адаптировать определения случаев в зависимости от местной эпидемиологической ситуации и других факторов. Всем странам рекомендуется публиковать определения, используемые в Интернете и в регулярных отчетах о ситуации, а также документировать периодические обновления определений, которые могут повлиять на интерпретацию данных эпиднадзора.
Случай с подозрением на инфекцию SARS-CoV-2
Три варианта, от A до C:
А.Лицо, соответствующее клиническим и эпидемиологическим критериям:
Клинические критерии:
- Острое начало лихорадки И кашля; или
- Острое начало ЛЮБЫХ ТРЕХ ИЛИ БОЛЕЕ следующих признаков или симптомов: лихорадка, кашель, общая слабость/усталость, 1 головная боль, миалгия, боль в горле, насморк, одышка, анорексия/тошнота/рвота, диарея, изменение психического статуса.

И
Эпидемиологические критерии:
- Проживание или работа в условиях с высоким риском передачи вируса: например, в закрытых жилых помещениях и гуманитарных учреждениях, таких как лагеря и подобные лагеря для перемещенных лиц, в любое время в течение 14 дней до появления симптомов; или
- Проживание или поездка в район с передачей инфекции в любое время в течение 14 дней до появления симптомов; или
- Работа в медицинских учреждениях, в том числе в медицинских учреждениях и в домашнем хозяйстве, в любое время в течение 14 дней до появления симптомов.
B. Пациент с тяжелым острым респираторным заболеванием (ТОРИ: острая респираторная инфекция с лихорадкой в анамнезе или измеренной температурой ≥ 38 C°; и кашлем; с началом в течение последних 10 дней; требуется госпитализация).
C. Бессимптомное лицо, не соответствующее эпидемиологическим критериям, с положительным экспресс-тестом на определение антигена SARS-CoV-2 (Ag-RDT). 2
2
Вероятный случай заражения SARS-CoV-2
Четыре варианта, от A до D:
- Пациент, который соответствует вышеуказанным клиническим критериям И является контактным лицом с вероятным или подтвержденным случаем или связан с кластером COVID-19. 3
- Предполагаемый случай (описанный выше) с визуализацией грудной клетки, показывающей результаты, свидетельствующие о заболевании COVID-19. 4
- Человек с недавним началом аносмии (потеря обоняния) или агевзии (потеря вкуса) при отсутствии какой-либо другой установленной причины.
- Смерть, не объясненная иначе, у взрослого с респираторным дистресс-синдромом, предшествующим смерти, И который был в контакте с вероятным или подтвержденным случаем или был связан с кластером COVID-19 3 .
Подтвержденный случай инфекции SARS-CoV-2
Три варианта, от A до C:
- Человек с положительным результатом теста на амплификацию нуклеиновых кислот (МАНК)
- Человек с положительным тестом на антиген-ДЭТ на SARS-CoV-2 И соответствующий определению вероятного случая или критериям подозрения A ИЛИ B
- Бессимптомное лицо с положительным тестом на SARS-CoV-2 Ag-RDT И контактное лицо с вероятным или подтвержденным случаем.

Примечание. Для определения необходимости дальнейшего исследования у пациентов, которые не полностью соответствуют клиническим или эпидемиологическим критериям, следует использовать клиническую оценку и оценку общественного здравоохранения.Определения случаев эпиднадзора не следует использовать в качестве единственной основы для руководства клиническим ведением.
2. Определение контакта
Контактное лицо — это лицо, подвергшееся любому из следующих воздействий в течение 2 дней до и 14 дней после появления симптомов вероятного или подтвержденного случая:
- личный контакт с вероятным или подтвержденным случаем в пределах 1 метра в течение не менее 15 минут
- прямой физический контакт с вероятным или подтвержденным случаем
- непосредственная помощь пациенту с вероятным или подтвержденным заболеванием COVID-19 без использования рекомендованных средств индивидуальной защиты, или
- других ситуаций, указанных в оценках местных рисков, как указано в таблице 1 в разделе «Отслеживание контактов в контексте COVID19».

Более подробная информация об установлении контактов доступна в разделе «Отслеживание контактов» в контексте COVID-19.
Примечание: для подтвержденных бессимптомных случаев период контакта измеряется от 2 дней до до 14 дней после даты, когда был взят образец, который привел к подтверждению.
3. Определение смерти от COVID-19
Смерть от COVID-19 определяется для целей эпиднадзора как смерть в результате клинически совместимого заболевания в вероятном или подтвержденном случае COVID-19, за исключением случаев, когда существует явная альтернативная причина смерти, которая не может быть связана с заболеванием COVID-19 (e .грамм. травма). Между болезнью и смертью не должно быть периода полного выздоровления.
1 Знаки, разделенные косой чертой (/), считаются за один знак.
2 МАНК требуется для подтверждения, см. Диагностическое тестирование на SARS-CoV-2
3 Группа лиц с симптомами, связанных по времени, географическому местоположению и частым контактам, содержащая не менее одного случая с подтвержденным МАНК или не менее двух эпидемиологически связанные, симптоматические (соответствующие клиническим критериям определения подозрительного случая A или B) лица с положительными Ag-RDT (на основе специфичности теста ≥97% и желаемого >99.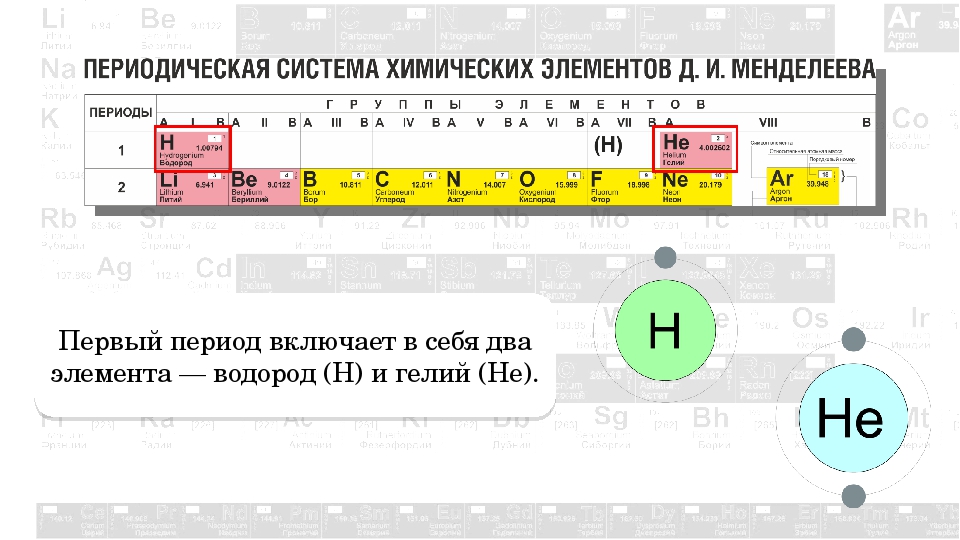



 Французский химик П.Лекок де Буабодран открыл элемент № 31, который
обладал всеми свойствами экаалюминия, он был назван Галлием.
Французский химик П.Лекок де Буабодран открыл элемент № 31, который
обладал всеми свойствами экаалюминия, он был назван Галлием. гр – Элементы 3 и 4 группы.
гр – Элементы 3 и 4 группы.
 Неон представляет собой инертный газ и поэтому не вступает в реакцию с любым другим элементом. Какой из следующих элементов, вероятно, обладает свойствами, подобными свойствам неона?
Неон представляет собой инертный газ и поэтому не вступает в реакцию с любым другим элементом. Какой из следующих элементов, вероятно, обладает свойствами, подобными свойствам неона?