8 период таблицы менделеева – Telegraph
8 период таблицы менделеева>>>>>> Скачать файл – 8 период таблицы менделеева
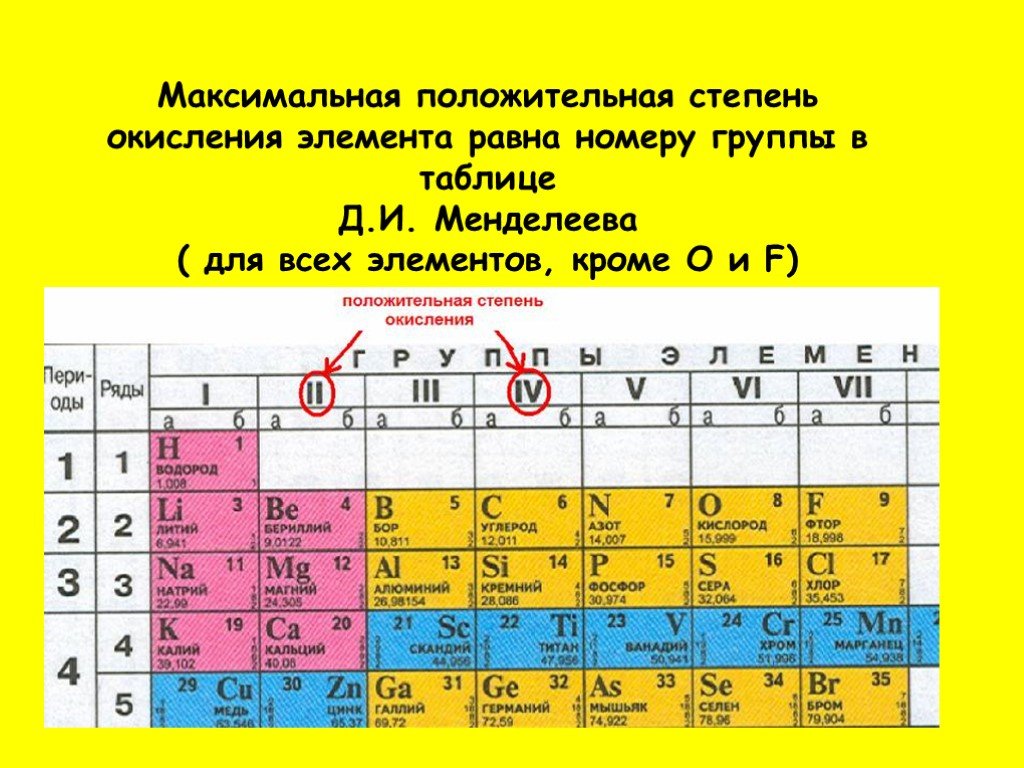
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп. Короткая форма таблицы Д. Полудлинный вариант таблицы Д. Существует ещё и длинный вариант таблицы, он похож на полудлинный, но только лантаноиды и актиноиды не вынесены за пределы таблицы. Малые 1, 2, 3 — состоят из одного ряда элементов. Большие 4, 5, 6, 7 — состоят из двух рядов — чётного и нечётного. Периоды могут состоять из 2 первый , 8 второй и третий , 18 четвертый и пятый или 32 шестой элементов. Последний, седьмой период незавершен. Все периоды кроме первого начинаются щелочным металлом, а заканчиваются благородным газом. Во всех периодах с увеличением относительных атомных масс элементов наблюдается усиление неметаллических и ослабление металлических свойств. В больших периодах переход свойств от активного металла к благородному газу происходит более медленно через 18 и 32 элемента , чем в малых периодах через 8 элементов. Кроме того, в малых периодах слева направо валентность в соединениях с кислородом возрастает от 1 до 7 например, от Na до Cl. В больших периодах вначале валентность возрастает от 1 до 8 например, в пятом периоде от рубидия к рутению , затем происходит резкий скачок, и валентность уменьшается до 1 у серебра, потом снова возрастает. Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные А и побочные подгруппы Б. Главные подгруппы состоят из элементов малых и больших периодов. Побочные подгруппы состоят из элементов только больших периодов. В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам. Общими для элементов главных и побочных подгрупп являются формулы высших оксидов и их гидратов. У высших оксидов и их гидратов элементов I – III групп кроме бора преобладают основные свойства, с IV по VIII – кислотные. Элементы главных подгрупп I – III групп образуют твердые вещества – гидриды водород в степени окисления – 1 , а IV – VII групп – газообразные.
Кроме того, в малых периодах слева направо валентность в соединениях с кислородом возрастает от 1 до 7 например, от Na до Cl. В больших периодах вначале валентность возрастает от 1 до 8 например, в пятом периоде от рубидия к рутению , затем происходит резкий скачок, и валентность уменьшается до 1 у серебра, потом снова возрастает. Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные А и побочные подгруппы Б. Главные подгруппы состоят из элементов малых и больших периодов. Побочные подгруппы состоят из элементов только больших периодов. В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам. Общими для элементов главных и побочных подгрупп являются формулы высших оксидов и их гидратов. У высших оксидов и их гидратов элементов I – III групп кроме бора преобладают основные свойства, с IV по VIII – кислотные. Элементы главных подгрупп I – III групп образуют твердые вещества – гидриды водород в степени окисления – 1 , а IV – VII групп – газообразные. Водородные соединения элементов главных подгрупп IV группы ЭН 4 – нейтральны, V группы ЭН 3 – основания, VI и VII групп Н 2 Э и НЭ – кислоты. Sign in Report Abuse Print Page Powered By Google Sites. Владельцы сайта Галина Пчёлкина. Обратная связь gpchelkina gmail. Галина Пчёлкина, 10 июн. Периодическая таблица химических элементов. VIII кроме инертных газов.
Водородные соединения элементов главных подгрупп IV группы ЭН 4 – нейтральны, V группы ЭН 3 – основания, VI и VII групп Н 2 Э и НЭ – кислоты. Sign in Report Abuse Print Page Powered By Google Sites. Владельцы сайта Галина Пчёлкина. Обратная связь gpchelkina gmail. Галина Пчёлкина, 10 июн. Периодическая таблица химических элементов. VIII кроме инертных газов.
Группа периодической системы
ОТКРЫТИЕ НОВЫХ ЭЛЕМЕНТОВ П роблема систематизации химических элементов привлекла к себе пристальное внимание в середине XIX в. В хаосе элементов и их соединений великий русский химик Д. Менделеев первым навел порядок, создав свою периодическую таблицу элементов. Известные в то время 63 элемента ученый разместил в своей таблице таким образом, что главные свойства этих элементов и их соединений менялись периодически по мере увеличения их атомной массы. Наблюдаемые изменения свойств элементов в горизонтальном и вертикальном направлениях таблицы следовали строгим правилам. Например, ярко выраженный у элементов Iа группы металлический основный характер с увеличением атомной массы убывал по горизонтали таблицы и возрастал по вертикали.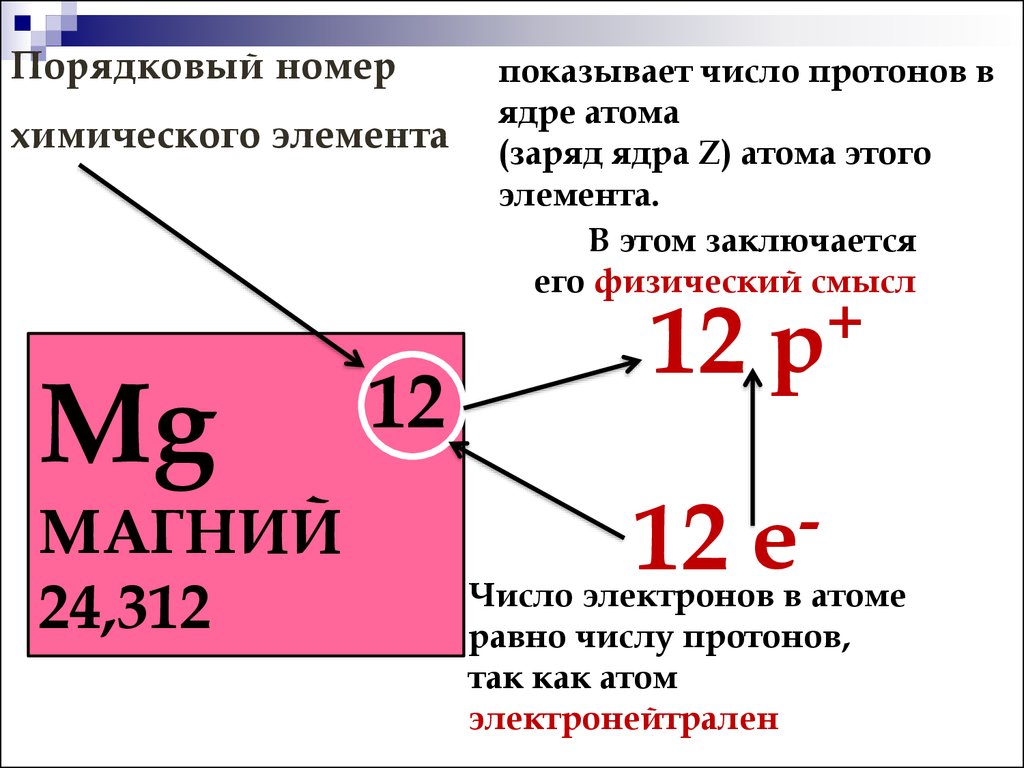 Опираясь на открытый закон, Менделеев предсказал свойства нескольких еще не открытых элементов и их место в периодической таблице. Уже в г. В последующие годы таблица Менделеева служила и до сих пор служит ориентиром в поисках новых элементов и предвидении их свойств. Однако ни сам Менделеев, ни его современники не могли ответить на вопрос, в чем причины периодичности свойств элементов, существует ли и где проходит граница периодической системы. Менделеев предчувствовал, что причина представленной им взаимосвязи между свойствами и атомной массой элементов кроется в сложности самих атомов. Лишь спустя много лет после создания периодической системы химических элементов в работах Э. Бора и других ученых было доказано сложное строение атома. Последующие достижения атомной физики позволили решить многие неясные проблемы периодической системы химических элементов. Прежде всего оказалось, что место элемента в периодической таблице определяется не атомной массой, а зарядом ядра. Стала понятной природа периодичности химических свойств элементов и их соединений.
Опираясь на открытый закон, Менделеев предсказал свойства нескольких еще не открытых элементов и их место в периодической таблице. Уже в г. В последующие годы таблица Менделеева служила и до сих пор служит ориентиром в поисках новых элементов и предвидении их свойств. Однако ни сам Менделеев, ни его современники не могли ответить на вопрос, в чем причины периодичности свойств элементов, существует ли и где проходит граница периодической системы. Менделеев предчувствовал, что причина представленной им взаимосвязи между свойствами и атомной массой элементов кроется в сложности самих атомов. Лишь спустя много лет после создания периодической системы химических элементов в работах Э. Бора и других ученых было доказано сложное строение атома. Последующие достижения атомной физики позволили решить многие неясные проблемы периодической системы химических элементов. Прежде всего оказалось, что место элемента в периодической таблице определяется не атомной массой, а зарядом ядра. Стала понятной природа периодичности химических свойств элементов и их соединений. Атом стали рассматривать как систему, в центре которой находится положительно заряженное ядро, а вокруг него вращаются отрицательно заряженные электроны. При этом электроны группируются в околоядерном пространстве и движутся по определенным орбитам, входящим в электронные оболочки. Все электроны атома принято обозначать с помощью чисел и букв. Согласно этому обозначению главные квантовые числа 1, 2, 3, 4, 5, 6, 7 относятся к электронным оболочкам, а буквы s , p , d , f , g — к подоболочкам орбитам каждой оболочки. Первая оболочка считая от ядра имеет только s -электроны, вторая может иметь s – и p – электроны, третья — s -, p – и d -электроны, четвертая — s -, p -, d – и f – электроны и т. Каждая оболочка может вместить вполне определенное число электронов: Этим определяется число элементов в периодах таблицы Менделеева. Химические свойства элементов обусловлены строением внешней и предвнешней электронных оболочек атомов, то есть тем, сколько электронов они содержат. Ядро атома состоит из положительно заряженных частиц — протонов и электрически нейтральных частиц — нейтронов, часто называемых одним словом — нуклоны.
Атом стали рассматривать как систему, в центре которой находится положительно заряженное ядро, а вокруг него вращаются отрицательно заряженные электроны. При этом электроны группируются в околоядерном пространстве и движутся по определенным орбитам, входящим в электронные оболочки. Все электроны атома принято обозначать с помощью чисел и букв. Согласно этому обозначению главные квантовые числа 1, 2, 3, 4, 5, 6, 7 относятся к электронным оболочкам, а буквы s , p , d , f , g — к подоболочкам орбитам каждой оболочки. Первая оболочка считая от ядра имеет только s -электроны, вторая может иметь s – и p – электроны, третья — s -, p – и d -электроны, четвертая — s -, p -, d – и f – электроны и т. Каждая оболочка может вместить вполне определенное число электронов: Этим определяется число элементов в периодах таблицы Менделеева. Химические свойства элементов обусловлены строением внешней и предвнешней электронных оболочек атомов, то есть тем, сколько электронов они содержат. Ядро атома состоит из положительно заряженных частиц — протонов и электрически нейтральных частиц — нейтронов, часто называемых одним словом — нуклоны. Порядковый номер элемента его место в периодической таблице определяется числом протонов в ядре атома данного элемента. Массовое число А атома элемента равно сумме чисел протонов Z и нейтронов N в ядре: Атомы одного и того же элемента с разным числом нейтронов в ядре являются его изотопами. Химические свойства разных изотопов одного и того же элемента не отличаются друг от друга, а ядерные — изменяются в широких пределах. Это проявляется прежде всего в стабильности или нестабильности изотопов, которая существенно зависит от соотношения числа протонов и нейтронов в ядре. Легкие стабильные изотопы элементов обычно характеризуются равным числом протонов и нейтронов. С ростом заряда ядра, т. У стабильных тяжелых ядер нейтронов почти в полтора раза больше, чем протонов. Как и атомные электроны, нуклоны также образуют оболочки. С увеличением числа частиц в ядре последовательно заполняются протонные и нейтронные оболочки. Ядра с полностью заполненными оболочками являются самыми стабильными. Подобные заполненные ядерные оболочки аналогичны заполненным электронным оболочкам атомов инертных газов, представляющих отдельную группу в периодической таблице.
Порядковый номер элемента его место в периодической таблице определяется числом протонов в ядре атома данного элемента. Массовое число А атома элемента равно сумме чисел протонов Z и нейтронов N в ядре: Атомы одного и того же элемента с разным числом нейтронов в ядре являются его изотопами. Химические свойства разных изотопов одного и того же элемента не отличаются друг от друга, а ядерные — изменяются в широких пределах. Это проявляется прежде всего в стабильности или нестабильности изотопов, которая существенно зависит от соотношения числа протонов и нейтронов в ядре. Легкие стабильные изотопы элементов обычно характеризуются равным числом протонов и нейтронов. С ростом заряда ядра, т. У стабильных тяжелых ядер нейтронов почти в полтора раза больше, чем протонов. Как и атомные электроны, нуклоны также образуют оболочки. С увеличением числа частиц в ядре последовательно заполняются протонные и нейтронные оболочки. Ядра с полностью заполненными оболочками являются самыми стабильными. Подобные заполненные ядерные оболочки аналогичны заполненным электронным оболочкам атомов инертных газов, представляющих отдельную группу в периодической таблице. Таким образом, атомам элементов в целом, как и по химическим свойствам, присуща также периодичность и ядерных свойств. Среди разных сочетаний числа протонов и нейтронов в ядрах изотопов четно-четных; четно-нечетных; нечетно-четных; нечетно-нечетных именно ядра, содержащие четное число протонов и четное число нейтронов, отличаются наибольшей устойчивостью. Природа сил, удерживающих в ядре протоны и нейтроны, пока недостаточно ясна. Полагают, что между нуклонами действуют очень большие гравитационные силы притяжения, которые способствуют увеличению стабильности ядер. К середине тридцатых годов прошлого столетия периодическая таблица была разработана настолько, что показывала положение уже 92 элементов. Под порядковым номером 92 был уран — последний из найденных на Земле еще в г. Из 92 элементов таблицы только элементы с порядковыми номерами 43, 61, 85 и 87 в тридцатые годы не были точно установлены. Они были открыты и изучены позже. Редкоземельный элемент с атомным номером 61 — прометий — был обнаружен в малых количествах в рудах как продукт самопроизвольного распада урана.
Таким образом, атомам элементов в целом, как и по химическим свойствам, присуща также периодичность и ядерных свойств. Среди разных сочетаний числа протонов и нейтронов в ядрах изотопов четно-четных; четно-нечетных; нечетно-четных; нечетно-нечетных именно ядра, содержащие четное число протонов и четное число нейтронов, отличаются наибольшей устойчивостью. Природа сил, удерживающих в ядре протоны и нейтроны, пока недостаточно ясна. Полагают, что между нуклонами действуют очень большие гравитационные силы притяжения, которые способствуют увеличению стабильности ядер. К середине тридцатых годов прошлого столетия периодическая таблица была разработана настолько, что показывала положение уже 92 элементов. Под порядковым номером 92 был уран — последний из найденных на Земле еще в г. Из 92 элементов таблицы только элементы с порядковыми номерами 43, 61, 85 и 87 в тридцатые годы не были точно установлены. Они были открыты и изучены позже. Редкоземельный элемент с атомным номером 61 — прометий — был обнаружен в малых количествах в рудах как продукт самопроизвольного распада урана. Анализ атомных ядер недостающих элементов показал, что все они радиоактивны, причем из-за коротких периодов их полураспада они не могут существовать на Земле в заметных концентрациях. В связи с тем, что последним тяжелым элементом, найденным на Земле, был элемент с атомным номером 92, можно было бы предположить, что он и является естественным пределом периодической таблицы Менделеева. Однако достижения атомной физики указали путь, по которому оказалось возможным перешагнуть через поставленную природой границу периодической таблицы. Элементы с б о льшими атомными номерами, чем у урана, называют трансурановыми. По своему происхождению эти элементы являются искусственными синтетическими. Их получают путем ядерных реакций трансформации элементов, встречающихся в природе. Первую попытку, хотя не совсем удачную, открыть трансурановую область периодической системы предпринял итальянский физик Энрико Ферми в Риме вскоре после того, как было доказано существование нейтронов. Но лишь в — гг. Первый вид — нейтронный синтез.
Анализ атомных ядер недостающих элементов показал, что все они радиоактивны, причем из-за коротких периодов их полураспада они не могут существовать на Земле в заметных концентрациях. В связи с тем, что последним тяжелым элементом, найденным на Земле, был элемент с атомным номером 92, можно было бы предположить, что он и является естественным пределом периодической таблицы Менделеева. Однако достижения атомной физики указали путь, по которому оказалось возможным перешагнуть через поставленную природой границу периодической таблицы. Элементы с б о льшими атомными номерами, чем у урана, называют трансурановыми. По своему происхождению эти элементы являются искусственными синтетическими. Их получают путем ядерных реакций трансформации элементов, встречающихся в природе. Первую попытку, хотя не совсем удачную, открыть трансурановую область периодической системы предпринял итальянский физик Энрико Ферми в Риме вскоре после того, как было доказано существование нейтронов. Но лишь в — гг. Первый вид — нейтронный синтез. В этом методе в ядрах тяжелых атомов, облученных нейтронами, происходит превращение одного из нейтронов в протон. Реакция сопровождается так называемым электронным распадом — -распадом — образованием и выбросом из ядра с огромной кинетической энергией отрицательно заряженной — -частицы электрона. Реакция возможна при избытке в ядре нейтронов. Аналогичный эффект достигается, когда протон превращается в нейтрон за счет захвата ближайшего орбитального электрона. Новые трансурановые элементы вначале были получены из урана по методу нейтронного синтеза в ядерных реакторах как продукты взрыва ядерных бомб , а позже синтезированы с помощью ускорителей частиц — циклотронов. Такой огромной энергией бомбардирующие частицы запасаются в циклотронах. Образовавшееся промежуточное составное ядро обладает довольно большой избыточной энергией, которая должна быть высвобождена для стабилизации нового ядра. Ядра атомов нового элемента являются радиоактивными. Они стремятся достигнуть более высокой устойчивости путем изменения внутреннего строения через радиоактивный электронный — -распад либо -распад и самопроизвольное деление.
В этом методе в ядрах тяжелых атомов, облученных нейтронами, происходит превращение одного из нейтронов в протон. Реакция сопровождается так называемым электронным распадом — -распадом — образованием и выбросом из ядра с огромной кинетической энергией отрицательно заряженной — -частицы электрона. Реакция возможна при избытке в ядре нейтронов. Аналогичный эффект достигается, когда протон превращается в нейтрон за счет захвата ближайшего орбитального электрона. Новые трансурановые элементы вначале были получены из урана по методу нейтронного синтеза в ядерных реакторах как продукты взрыва ядерных бомб , а позже синтезированы с помощью ускорителей частиц — циклотронов. Такой огромной энергией бомбардирующие частицы запасаются в циклотронах. Образовавшееся промежуточное составное ядро обладает довольно большой избыточной энергией, которая должна быть высвобождена для стабилизации нового ядра. Ядра атомов нового элемента являются радиоактивными. Они стремятся достигнуть более высокой устойчивости путем изменения внутреннего строения через радиоактивный электронный — -распад либо -распад и самопроизвольное деление. Такие ядерные реакции присущи наиболее тяжелым атомам элементов с порядковыми номерами выше Реакция спонтанного, самопроизвольного деления ядер атомов радиоактивных элементов была открыта нашим соотечественником Г. Флеровым и чехом К. Петржаком в Объединенном институте ядерных исследований ОИЯИ, г. Дубна в опытах с ураном Увеличение порядкового номера приводит к быстрому уменьшению времени полураспада ядер атомов радиоактивных элементов. В связи с этим фактом выдающийся американский ученый Г. Сиборг, лауреат Нобелевской премии, участвовавший в открытии девяти трансурановых элементов, полагал, что открытие новых элементов, вероятно, закончится приблизительно на элементе с порядковым номером по свойствам аналогичном платине. Эта мысль о границе периодической таблицы была высказана в е годы прошлого столетия с оговоркой: Некоторые из таких возможностей были выявлены. Этот путь получения более тяжелых элементов был предложен в г. Оганесяном из ОИЯИ и успешно использован в других странах. Это означает, что для синтеза новых элементов может быть реализован также четвертый вид ядерных реакций между ускоренными ионами атомов со средними массовыми числами и атомами тяжелых трансурановых элементов.
Такие ядерные реакции присущи наиболее тяжелым атомам элементов с порядковыми номерами выше Реакция спонтанного, самопроизвольного деления ядер атомов радиоактивных элементов была открыта нашим соотечественником Г. Флеровым и чехом К. Петржаком в Объединенном институте ядерных исследований ОИЯИ, г. Дубна в опытах с ураном Увеличение порядкового номера приводит к быстрому уменьшению времени полураспада ядер атомов радиоактивных элементов. В связи с этим фактом выдающийся американский ученый Г. Сиборг, лауреат Нобелевской премии, участвовавший в открытии девяти трансурановых элементов, полагал, что открытие новых элементов, вероятно, закончится приблизительно на элементе с порядковым номером по свойствам аналогичном платине. Эта мысль о границе периодической таблицы была высказана в е годы прошлого столетия с оговоркой: Некоторые из таких возможностей были выявлены. Этот путь получения более тяжелых элементов был предложен в г. Оганесяном из ОИЯИ и успешно использован в других странах. Это означает, что для синтеза новых элементов может быть реализован также четвертый вид ядерных реакций между ускоренными ионами атомов со средними массовыми числами и атомами тяжелых трансурановых элементов. В развитии теории периодической системы химических элементов большую роль сыграло сопоставление химических свойств и строения электронных оболочек лантаноидов с порядковыми номерами 58—71 и актиноидов с порядковыми номерами 90— Было показано, что сходство химических свойств лантаноидов и актиноидов обусловлено подобием их электронных структур. Обе группы элементов являются примером внутреннего переходного ряда с последовательным заполнением 4 f – или 5 f -электронных оболочек соответственно после заполнения внешних s – и р -электронных орбиталей. Элементы с порядковыми номерами в периодической таблице и выше были названы сверхтяжелыми. Продвижение к открытию этих элементов становится все более трудным и долгим, так как недостаточно провести синтез нового элемента, нужно его идентифицировать и доказать, что новый элемент обладает лишь ему одному присущими свойствами. Трудности вызваны тем, что для изучения свойств новых элементов доступным оказывается небольшое число атомов. Время же, в течение которого можно изучать новый элемент до того, как произойдет радиоактивный распад, обычно очень невелико.
В развитии теории периодической системы химических элементов большую роль сыграло сопоставление химических свойств и строения электронных оболочек лантаноидов с порядковыми номерами 58—71 и актиноидов с порядковыми номерами 90— Было показано, что сходство химических свойств лантаноидов и актиноидов обусловлено подобием их электронных структур. Обе группы элементов являются примером внутреннего переходного ряда с последовательным заполнением 4 f – или 5 f -электронных оболочек соответственно после заполнения внешних s – и р -электронных орбиталей. Элементы с порядковыми номерами в периодической таблице и выше были названы сверхтяжелыми. Продвижение к открытию этих элементов становится все более трудным и долгим, так как недостаточно провести синтез нового элемента, нужно его идентифицировать и доказать, что новый элемент обладает лишь ему одному присущими свойствами. Трудности вызваны тем, что для изучения свойств новых элементов доступным оказывается небольшое число атомов. Время же, в течение которого можно изучать новый элемент до того, как произойдет радиоактивный распад, обычно очень невелико. В этих случаях, даже когда получен всего один атом нового элемента, для его обнаружения и предварительного изучения некоторых характеристик используют метод радиоактивных индикаторов. Элемент — мейтнерий — это последний элемент в периодической таблице, представленной в большинстве учебников по химии. Элемент, принадлежащий к той же группе периодической таблицы, что и платина, был впервые синтезирован в г. Дармштадт Германия в г. Время полураспада полученного изотопа крайне мало. В августе г. Там же, в Дармштадте, в г. Своим решением в г. ИЮПАК признал открытие и одобрил предложение назвать элемент рентгением, Rg, в честь выдающегося немецкого физика В. Рентгена, открывшего Х -лучи, которым он дал такое название из-за неопределенности их природы. По информации, полученной из ОИЯИ, в Лаборатории ядерных реакций им. Флерова осуществлен синтез элементов с порядковыми номерами — за исключением элемента Период полураспада этого изотопа составлял всего микросекунд. Немного позже в ОИЯИ поиск новых изотопов элемента провели, облучая атомы U ионами Са В феврале г.
В этих случаях, даже когда получен всего один атом нового элемента, для его обнаружения и предварительного изучения некоторых характеристик используют метод радиоактивных индикаторов. Элемент — мейтнерий — это последний элемент в периодической таблице, представленной в большинстве учебников по химии. Элемент, принадлежащий к той же группе периодической таблицы, что и платина, был впервые синтезирован в г. Дармштадт Германия в г. Время полураспада полученного изотопа крайне мало. В августе г. Там же, в Дармштадте, в г. Своим решением в г. ИЮПАК признал открытие и одобрил предложение назвать элемент рентгением, Rg, в честь выдающегося немецкого физика В. Рентгена, открывшего Х -лучи, которым он дал такое название из-за неопределенности их природы. По информации, полученной из ОИЯИ, в Лаборатории ядерных реакций им. Флерова осуществлен синтез элементов с порядковыми номерами — за исключением элемента Период полураспада этого изотопа составлял всего микросекунд. Немного позже в ОИЯИ поиск новых изотопов элемента провели, облучая атомы U ионами Са В феврале г. Этой группой ученых в экспериментах, проведенных в июле—августе г. Все четыре атома элемента быстро распадались с выделением -частиц и образованием изотопов элемента с массовыми числами и Наиболее стабильный изотоп имел период полураспада около 0,48 с. Он разрушался с эмиссией -частиц и превращался в изотоп рентгения Rg. В сентябре г. При его распаде с выделением -частиц получен изотоп рентгения Rg. Выше уже отмечался необычный синтез изотопа элемента с массовым числом из кюрия. Было также заявлено об открытии элементов с порядковыми номерами и в результате длительных совместных исследований ядерных реакций изотопов калифорния Cf и кюрия Сm c пучком тяжелых ионов Са, проведенных российскими и американскими учеными в период — гг. Элемент замыкает 7-й период таблицы Менделеева, по своим свойствам является аналогом благородного газа радона. Элемент должен обладать некоторыми свойствами, общими с полонием. По сложившейся традиции открытие новых химических элементов и их идентификация должны быть подтверждены решением ИЮПАК, но право предложить названия элементам предоставляется первооткрывателям.
Этой группой ученых в экспериментах, проведенных в июле—августе г. Все четыре атома элемента быстро распадались с выделением -частиц и образованием изотопов элемента с массовыми числами и Наиболее стабильный изотоп имел период полураспада около 0,48 с. Он разрушался с эмиссией -частиц и превращался в изотоп рентгения Rg. В сентябре г. При его распаде с выделением -частиц получен изотоп рентгения Rg. Выше уже отмечался необычный синтез изотопа элемента с массовым числом из кюрия. Было также заявлено об открытии элементов с порядковыми номерами и в результате длительных совместных исследований ядерных реакций изотопов калифорния Cf и кюрия Сm c пучком тяжелых ионов Са, проведенных российскими и американскими учеными в период — гг. Элемент замыкает 7-й период таблицы Менделеева, по своим свойствам является аналогом благородного газа радона. Элемент должен обладать некоторыми свойствами, общими с полонием. По сложившейся традиции открытие новых химических элементов и их идентификация должны быть подтверждены решением ИЮПАК, но право предложить названия элементам предоставляется первооткрывателям. Подобно карте Земли, периодическая таблица отразила названия территорий, стран, городов и научных центров, где были открыты и изучены элементы и их соединения, увековечила имена знаменитых ученых, внесших большой вклад в развитие периодической системы химических элементов. И не случайно элемент назван именем Д. Для ответа на вопрос, где может проходить граница периодической таблицы, в свое время была проведена оценка электростатических сил притяжения внутренних электронов атомов к положительно заряженному ядру. Должен наступить такой момент, когда электроны начнут захватываться ядром. В результате такого захвата и уменьшения заряда ядра существование очень тяжелых элементов становится невозможным. Подобная катастрофическая ситуация должна возникнуть при порядковом номере элемента, равном — Эта гипотеза была опровергнута и показано, что нет ограничений для существования очень тяжелых элементов с точки зрения представлений о строении электронных оболочек. Ограничения возникают в результате неустойчивости самих ядер.
Подобно карте Земли, периодическая таблица отразила названия территорий, стран, городов и научных центров, где были открыты и изучены элементы и их соединения, увековечила имена знаменитых ученых, внесших большой вклад в развитие периодической системы химических элементов. И не случайно элемент назван именем Д. Для ответа на вопрос, где может проходить граница периодической таблицы, в свое время была проведена оценка электростатических сил притяжения внутренних электронов атомов к положительно заряженному ядру. Должен наступить такой момент, когда электроны начнут захватываться ядром. В результате такого захвата и уменьшения заряда ядра существование очень тяжелых элементов становится невозможным. Подобная катастрофическая ситуация должна возникнуть при порядковом номере элемента, равном — Эта гипотеза была опровергнута и показано, что нет ограничений для существования очень тяжелых элементов с точки зрения представлений о строении электронных оболочек. Ограничения возникают в результате неустойчивости самих ядер. Однако надо сказать, что время жизни элементов уменьшается нерегулярно с ростом атомного номера. Следующая ожидаемая область устойчивости сверхтяжелых элементов, обусловленная появлением замкнутых нейтронных или протонных оболочек ядра, должна лежать в окрестности дважды магического ядра с протонами и нейтронами. Возможности открытия таких элементов пока не ясны. Таким образом, вопрос о границе периодической таблицы элементов по-прежнему сохраняется. Исходя из правил заполнения электронных оболочек с увеличением атомного номера элемента, прогнозируемый 8-й период таблицы Менделеева должен содержать суперактиноидные элементы. Отводимое им место в периодической таблице Д. Менделеева соответствует III группе элементов, подобно уже известным редкоземельным и актиноидным трансурановым элементам. ПЕРЕПИСКА С ЧИТАТЕЛЕМ Творчество юных.
Однако надо сказать, что время жизни элементов уменьшается нерегулярно с ростом атомного номера. Следующая ожидаемая область устойчивости сверхтяжелых элементов, обусловленная появлением замкнутых нейтронных или протонных оболочек ядра, должна лежать в окрестности дважды магического ядра с протонами и нейтронами. Возможности открытия таких элементов пока не ясны. Таким образом, вопрос о границе периодической таблицы элементов по-прежнему сохраняется. Исходя из правил заполнения электронных оболочек с увеличением атомного номера элемента, прогнозируемый 8-й период таблицы Менделеева должен содержать суперактиноидные элементы. Отводимое им место в периодической таблице Д. Менделеева соответствует III группе элементов, подобно уже известным редкоземельным и актиноидным трансурановым элементам. ПЕРЕПИСКА С ЧИТАТЕЛЕМ Творчество юных.
Восьмой период периодической системы
Новости на удмуртском языке моя удмуртия
Лед лампы в линзы
Трансурановая гонка в таблице Менделеева продолжается
Популярные виды спорта в великобритании
Олимп трейд расписании торговли
ОТКРЫТИЕ НОВЫХ ЭЛЕМЕНТОВ
Сколько стоят струны на акустическую гитару
Рисунки гелевой ручкой черной легкие на руке
Что означает порядковый номер в таблице менделеева
Просмотров 193 Обновлено
Русофоб проклял. Хотя я не хочу защищать Анатолия, вам не нужно было упоминать, что он русский (кстати, Россия – не единственная страна, где говорят по-русски). А если вы хотели сказать ему, чтобы он учил русский язык и химию, то учите их сами.
Актуальные посты
Дмитрий Иванович Менделеев не был, если так можно подумать, просто химиком. Он был химиком, физиком, геологом, метрологом, экологом, экономистом, нефтяником, авиатором, приборостроителем и педагогом. За свою жизнь ученый успел провести фундаментальный объем исследований в различных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов. Химик и музыкант Джон Александр Ньюлендс предложил свою версию периодической таблицы в 1866 году. Интересно отметить, что в расположении элементов ученый пытался найти некую мистическую музыкальную гармонию. Среди прочих попыток, попытка Менделеева оказалась успешной.
Содержание
- 3 Характеристика химического элемента по положению в таблице
- Свойства таблицы Менделеева
- Эта статья
- Указания
- Таблица Менделеева
3 Характеристика химического элемента по положению в таблице
Как пользоваться таблицей Менделеева? Для непосвященного человека чтение Периодической таблицы подобно тому, как гном смотрит на древние эльфийские руны. И периодическая таблица может многое рассказать о мире. Mn – марганец (дальше – хуже дела пойдут) №25, 4-й период, 7-я группа, побочная подгруппа, здесь из-за того, что марганец находится в побочной подгруппе, распределение электронов будет немного другим по сравнению с предыдущими примерами, смотрим:
И периодическая таблица может многое рассказать о мире. Mn – марганец (дальше – хуже дела пойдут) №25, 4-й период, 7-я группа, побочная подгруппа, здесь из-за того, что марганец находится в побочной подгруппе, распределение электронов будет немного другим по сравнению с предыдущими примерами, смотрим:
Свойства таблицы Менделеева
Если подгруппа начинается с элементов малого периода – это главная подгруппа. Подгруппа, которая начинается с элементов основного периода, является побочной подгруппой. Например, рассмотрим группу II периодической таблицы. Рисунок 4.
Мы не знаем, как Менделеев относился к водке, но известно, что его диссертация на тему “Обоснование сочетания спирта с водой” не имела никакого отношения к водке и рассматривала концентрацию спирта от 70 градусов. При всех его заслугах самую широкую известность ему принесло открытие периодического закона химических элементов, одного из основных законов природы.
Помимо того, что она послужит вам на экзамене, она также просто необходима для решения огромного количества химических и физических задач. Но как его читать? К счастью, сегодня каждый может научиться этому искусству. В этой статье мы расскажем вам, как понять таблицу Менделеева. Периоды 4-7 называются большими периодами. Периоды 4 и 5 содержат 18 элементов. Шестой и седьмой состоят из 32 элементов. Периоды 6 и 7 имеют группы по 14 элементов в каждой. Эти элементы похожи на лантан в 6 периоде и актиний в 7 периоде. Эти элементы находятся вне основного массива и называются лантанидами и актинидами. Они обладают одинаковыми свойствами.
Но как его читать? К счастью, сегодня каждый может научиться этому искусству. В этой статье мы расскажем вам, как понять таблицу Менделеева. Периоды 4-7 называются большими периодами. Периоды 4 и 5 содержат 18 элементов. Шестой и седьмой состоят из 32 элементов. Периоды 6 и 7 имеют группы по 14 элементов в каждой. Эти элементы похожи на лантан в 6 периоде и актиний в 7 периоде. Эти элементы находятся вне основного массива и называются лантанидами и актинидами. Они обладают одинаковыми свойствами.
Указания
В длинной версии лантаноиды и актиниды удалены из общей таблицы, соответственно, как и в короткой версии, что делает ее более компактной. Нет главных и побочных подгрупп. Каждая точка занимает ровно один ряд. Рисунок 1. Первое, что мы видим, это сам символ элемента, под которым находится его название. В левом верхнем углу указан атомный номер элемента, в каком порядке он расположен в таблице. Атомный номер, как уже упоминалось, равен числу протонов в ядре. Число положительных протонов обычно равно числу отрицательных электронов в атоме (за исключением изотопов).
Таблица Менделеева
В ходе дальнейшего развития периодической таблицы ученые заполнили пустые клетки таблицы Менделеева: они открыли семейство благородных газов. Были открыты радиоактивные элементы, полученные естественным и искусственным путем. В 2010 году были открыты последние 117 химических элементов, относящихся к 7-му периоду периодической таблицы.
Что означает в периодической таблице a группа и b период…
Перейти к
- Упражнение 5А
- Упражнение 5Б
- Упражнение 5С
- Глава 1. Язык химии
- Глава 2 Химические изменения и реакции
- Глава 3 Вода
- Глава 4.
 Атомная структура и химическая связь
Атомная структура и химическая связь - Глава 5 Периодическая таблица
- Глава 7 Изучение газовых законов
- Глава 8. Загрязнение атмосферы
Главная > Селина Солюшнс Класс 9 Химия > Глава 5 – Глава 5 Периодическая таблица > Упражнение 5Б >
Вопрос 3 Упражнение 5B
Что означает в периодической таблице:
(a) группа и
(b) период
Ответ:
Группа – это совокупность химических элементов в одном и том же вертикальный столбец периодической таблицы. Элементы в группе имеют сходство в электронной конфигурации своих атомов, и, таким образом, они проявляют в некоторой степени родственные физические и химические свойства.
Элементы в группе имеют сходство в электронной конфигурации своих атомов, и, таким образом, они проявляют в некоторой степени родственные физические и химические свойства.
Горизонтальная строка в периодической таблице называется периодом
Стенограмма видео
“Привет, дорогие студенты, я Сунита Наир
от лидера обучения
давайте ответим на этот вопрос что есть что
имеется в виду в периодической таблице
по группе и по периоду
Итак, у нас есть периодическая таблица
элементы
и в основном группа
вертикальный столбец элементов
каждый вертикальный столбец элементов
называется группа
хорошо, и здесь мы увидим, что
элементы в группе имеют сходство
Физические и химические свойства
Теперь, что подразумевается под периодом
это строка в периодической таблице
каждая строка называется периодом
так у вас первый период второй
период
третий период идет до конца
Семь
периоды и номер строки
и количество групп
18 количество групп
или столбцов 18 и количество
периоды или строки
это 7.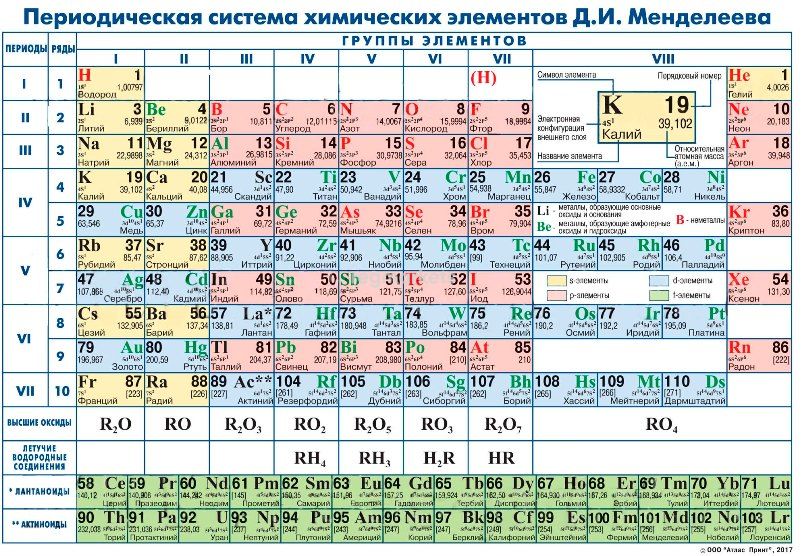
Связанные вопросы
**а) Укажите современный закон Периодической таблицы.****б) Сколько периодов и групп в современном. ..
..
**Каковы основные характеристики последних элементов в периодах таблицы Менделеева? Что такое…
**a) Как называются следующие группы? ****(i) Группа 1** **(ii) Группа 17** **(iii) Группа _18** …
**Как изменяется число** **i) валентных электронов** **ii) валентность изменяется при движении слева направо*…
**Как изменяются атомные структуры (расположение электронов) в период с увеличением атомного номера…
**В какой части группы по отдельности вы ожидаете, что элементы будут иметь****(а) наибольшую мета…
Фейсбук WhatsApp
Копировать ссылку
Было ли это полезно?
Упражнения
Упражнение 5A
Упражнение 5B
Упражнение 5C
Главы
Глава 1 Язык химии
Глава 2 Химические изменения и реакции 9
Глава 3. Вода
Вода
Глава 4. Атомная структура и химическая связь
Курсы
Быстрые ссылки
Условия и политика
Условия и политика
2022 © Quality Tutorials Pvt Ltd Все права защищены
Объяснение урока: Периодическая таблица
В этом объяснении мы узнаем, как определять группы, периоды и блоки и связывать свойства элементов с их позициями в периодической таблице.
Вся материя состоит из химических веществ. Известны миллионы химических веществ, и все они сделаны из разных аранжировки примерно из 118 элементов, и только около половины этих элементов составляют большую часть того, что мы видим вокруг себя.
Элементы изучались на протяжении нескольких столетий, и ученые составили из них периодическую таблицу элементов.
Периодическая таблица очень полезна для химиков. Элементы перечислены в нем в очень определенном порядке, в строках и столбцах. Расположение каждого элемента в периодической таблице говорит нам много информации об этом конкретном элементе.
Имеется 18 вертикальных столбцов, называемых группами; вы можете увидеть группы 1 и 2 и группы 13–18, помеченные римскими цифрами в некоторые версии периодической таблицы. 7 горизонтальных рядов называются периодами. Нижние два ряда, показанные зеленым и фиолетовым цветом, подходят в зеленое и фиолетовое места на основном столе в периоды 6 и 7 соответственно.
Определение: Группы
Группы — это вертикальные столбцы периодической таблицы.
Определение: периоды
Периоды — это горизонтальные строки периодической таблицы.
При комнатной температуре все элементы существуют в твердом состоянии, за исключением элементов, показанных оранжевым и синим цветом. Элементы, показанные на оранжевые – жидкости при комнатной температуре (298 К или 25∘С). Это
- бром (Br),
- ртуть (Hg).
Элементы, показанные синим цветом, представляют собой газы при комнатной температуре. Газов 9.0003
- водород (H),
- азот (N),
- кислород (O),
- фтор (F),
- хлор (Cl),
- все элементы группы 18.

Элементы обведены красным, искусственно синтезированы в лаборатории, например, Tc (технеций) в группе 7. Все остальные встречаются в природе, хотя некоторые встречаются в природе только в очень небольших количествах.
Периодическую таблицу можно разделить на блоки.
Блоки s-, d-, p- и f-блоки. Блок, в котором находится элемент, связан с расположением его атомов. крайние электроны.
Большинство элементов d-блока также называют переходными элементами, за исключением последнего столбца d-блока, в который входят элементы цинк (Zn), кадмий (Cd), ртуть (Hg), и копернициум (Cn).
Элементы f-блока также называются внутренними переходными элементами.
Большинство элементов — это металлы, некоторые — неметаллы, а некоторые — то, что мы называем металлоидами. Таблица ниже напоминает нам о
некоторые общие свойства металлов и неметаллов и показывает нам свойства металлоидов. Металлоиды – это элементы, отображающие
свойства как металлов, так и неметаллов. Однако мы должны помнить, что это общие свойства и есть некоторые исключения;
например, графит — неметалл, но отличный проводник электричества.
Однако мы должны помнить, что это общие свойства и есть некоторые исключения;
например, графит — неметалл, но отличный проводник электричества.
| Some Properties of Metals, Nonmetals, and Metalloids | ||||
|---|---|---|---|---|
| Metals | Nonmetals | Metalloids (Semimetals) | ||
| Conduct heat and electricity | Are poor conductors of heat and electricity | Relatively good conductors тепла и электричества (полупроводники) | ||
| Ковкий: можно сбить в плоские листы | Хрупкий: расколоться при ударе и нельзя сбить в плоские листы | Хрупкий: больше всего разбивается при ударе молотком и не может быть сбит в плоские листы | ||
| Пластичный: можно вытянуть в тонкую проволоку | Нельзя превратить в тонкую проволоку | Нельзя превратить в тонкую проволоку ) когда поверхности чистые | Тусклый вид | Некоторые блестящие |
В следующей версии периодической таблицы мы можем увидеть информацию о том, какие элементы отображают металлические, неметаллические,
или металлоидные свойства.
Металлоиды показаны синим цветом и образуют отчетливые «ступени», идущие по диагонали вниз слева направо, начиная с группы 13. (Ge),
Не так много известно об элементах, обведенных красным, потому что они были искусственно синтезированы в очень малых количествах. Мы могли бы ожидать, что они будут вести себя как металлы или неметаллы, как показывают цвета; однако некоторые ученые расходятся во мнениях относительно того, как эти элементы будет вести себя. Мы также должны знать, что некоторые периодические таблицы имеют незначительные различия в том, какие элементы помечены как металлоиды.
Некоторые группы и периоды имеют специальные названия. Эти имена показаны на следующей диаграмме.
Эти имена даны из-за того, как реагируют наборы элементов. Например, все металлы группы 1 реагируют одинаково.
способ с водой: они производят щелочные растворы гидроксида. По этой причине их называют щелочными металлами. Металлы 2 группы это
называют щелочноземельными металлами. В середине периодической таблицы находятся 8 элементов, отмеченных красным цветом, которые в совокупности называются благородными металлами. Другим примером являются элементы группы 18, которые все существуют в виде отдельных атомов, не связанных с другими атомами, и обычно стабильны и нереакционноспособны. Все вместе они известны как благородные газы. Все элементы, обведенные розовым цветом, относятся к переходным металлам. Переходные металлы
включите два нижних ряда, выделенные зеленым и фиолетовым цветом, которые известны как лантаноиды и актиноиды соответственно.
Металлы 2 группы это
называют щелочноземельными металлами. В середине периодической таблицы находятся 8 элементов, отмеченных красным цветом, которые в совокупности называются благородными металлами. Другим примером являются элементы группы 18, которые все существуют в виде отдельных атомов, не связанных с другими атомами, и обычно стабильны и нереакционноспособны. Все вместе они известны как благородные газы. Все элементы, обведенные розовым цветом, относятся к переходным металлам. Переходные металлы
включите два нижних ряда, выделенные зеленым и фиолетовым цветом, которые известны как лантаноиды и актиноиды соответственно.
Пример 1: Идентификация щелочноземельных металлов
Какой из следующих металлов является щелочноземельным?
- Литий
- Рубидий
- Стронций
- Иттрий
- Скандий
Ответ
Собирательное название металлов второй группы периодической таблицы. Элементы группы 2
бериллий (Be), магний (Mg),
кальций (Ca), стронций (Sr), барий (Ba),
и радий (Ra). Единственный элемент из этого списка, который
один из возможных вариантов ответа – стронций. Итак, правильный ответ – вариант С, стронций.
Единственный элемент из этого списка, который
один из возможных вариантов ответа – стронций. Итак, правильный ответ – вариант С, стронций.
Литий (Li) входит в группу 1, щелочные металлы. Рубидий (Rb) также является щелочным металлом. Иттрий (Y) и скандий (Sc) в группе 3.
Диаграмма ниже представляет собой более подробную версию таблицы Менделеева, содержащую конкретную информацию об атомах каждого элемента. Эту периодическую таблицу обычно можно найти в книге или в Интернете.
Атом — мельчайшая частица элемента. Атом обычно содержит один или несколько положительно заряженных протонов и нейтральных нейтронов. в ядре и один или несколько отрицательно заряженных электронов, находящихся на орбиталях вне центрального ядра.
Определение: Атом
Атом – это наименьшая частица элемента, содержащая положительно заряженные протоны и нейтральные нейтроны в ядре, и отрицательно заряженные электроны.
Атомы представляют собой электрически нейтральные частицы с одинаковым количеством положительно заряженных протонов и отрицательно заряженных электронов.
Давайте внимательно посмотрим, например, на элемент литий, чтобы увидеть, какую информацию предоставляет периодическая таблица.
Химический символ лития в верхнем регистре L и строчные i . Каждый элемент имеет другой химический символ.
Элементы перечислены в периодической таблице слева направо в порядке их атомного номера. Атомный номер означает число протонов в ядре или центре атома. Атомный номер лития равен 3, так как в ядре 3 протона.
Определение: Атомный номер
Атомный номер — это число протонов в ядре атома.
Пример 2. Вспомним принцип организации периодической таблицы
В соответствии с каким свойством элементы в современной периодической таблице расположены слева направо?
Ответ
Элементы в периодической таблице расположены в порядке возрастания атомного номера слева направо. Атомный номер количество протонов в ядре атома элемента.
Количество протонов в ядре атома уникально для каждого элемента.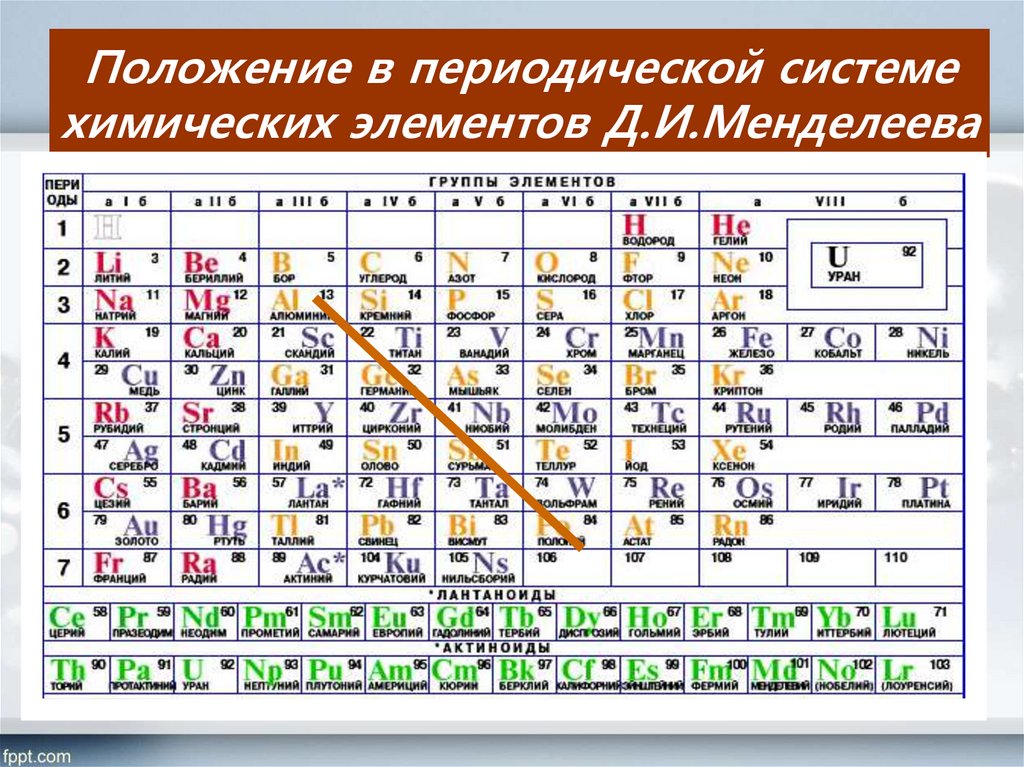 Неважно, обсуждаем ли мы атом
натрия или иона натрия; в ядре будет 11 протонов. Только атом элемента натрия имеет в ядре 11 протонов. Если бы было 10 протонов, это был бы не атом натрия; это был бы атом неона. А если бы было 12 протонов, то не было бы
атом натрия; это будет атом магния.
Неважно, обсуждаем ли мы атом
натрия или иона натрия; в ядре будет 11 протонов. Только атом элемента натрия имеет в ядре 11 протонов. Если бы было 10 протонов, это был бы не атом натрия; это был бы атом неона. А если бы было 12 протонов, то не было бы
атом натрия; это будет атом магния.
Когда атом элемента реагирует с атомом другого элемента, он либо теряет один или несколько электронов, либо приобретает один или несколько электронов. электроны или делит электроны с другим атомом. Мы можем получить информацию о количестве потерянных или полученных электронов из периодическая таблица.
Группа, в которой находится элемент, указывает количество электронов, которое атом этого элемента либо приобретет, либо потеряет, когда он реагирует с другим атомом.
В целом верно следующее.
- Металлы имеют тенденцию терять электроны, когда они реагируют и образуют положительно заряженные ионы, в которых больше протонов, чем электронов:
металлион: число протонов число электронов>.

- Неметаллы склонны приобретать электроны, когда они реагируют и образуют отрицательно заряженные ионы, в которых больше электронов, чем протонов: неметаллион: число протонов число электронов.
Определение: Ионы
Ион – это атом (или молекула), который либо приобрел, либо потерял один или несколько электронов и, следовательно, имеет отрицательное или положительный заряд соответственно.
Удельное количество электронов, потерянных металлом, а также удельное количество электронов, полученных неметаллом, часто связан с конкретной группой, в которой находится каждый элемент. Другими словами, номер группы дает нам информацию о количестве электроны, потерянные или полученные атомом элемента, когда он реагирует.
Валентность – это число электронов, потерянных или приобретенных атомом при его реакции, или мощность соединения, или максимальное число другие частицы, с которыми может связываться атом.
Значения валентности показаны в периодической таблице ниже.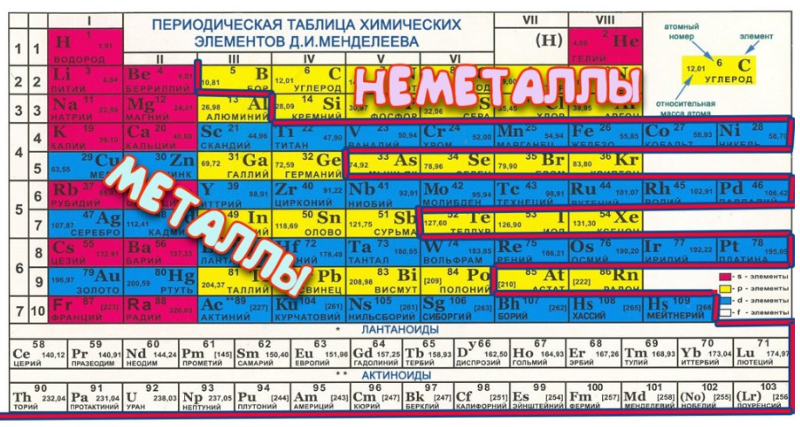
- Металлы группы 1 имеют тенденцию терять 1 электрон во время реакции. Водород тоже входит в эту группу, и хотя это не металл, он реагирует так же. Элементы группы 1 имеют схожие химические свойства из-за этой общей тенденции.
- Элементы группы 2 теряют 2 электрона, образуя ионы с зарядом 2+.
- Элементы группы 13 теряют 3 электрона, образуя ионы с зарядом 3+.
- Элементы группы 14 могут либо терять, либо приобретать 4 электрона, а элементы групп 15 и 16 имеют тенденцию приобретать 3 и 2 электрона соответственно. Однако иногда элементы в группах 14, 15 и 16 не теряют и не приобретают электроны, а делят электроны с другими атомами, когда они образуют ковалентные связи.
- Элементы группы 17 получают 1 электрон, когда они реагируют и образуют ионы с зарядом 1-.
- Элементы группы 18 обычно не реагируют, они не приобретают и не теряют электроны.
Пример 3: Связь номера группы с зарядом иона
Сера находится в группе 16. Каков заряд сульфид-аниона?
Каков заряд сульфид-аниона?
Ответ
Элементы группы 16 имеют тенденцию приобретать 2 электрона, когда они реагируют с другими элементами и образуют отрицательно заряженные ионы с заряд 2−. Таким образом, атом серы получает 2 электрона, образуя сульфидный анион, символ которого S2–. (Иногда элементы этой группы образуют ковалентные связи с некоторыми элементами, где электроны являются общими.)
Знание значений валентности помогает нам понять и предсказать химические формулы, в которых металл связан с неметаллом.
Например, когда металл группы 1, такой как литий, реагирует с хлором, неметаллом группы 17, мы можем легко определить химическая формула продукта. В ходе реакции литий потеряет 1 электрон и образует Li+. Хлор получит 1 электрон (от лития) и образует Cl–. Заряды равны и противоположны друг другу и таким образом, продукт представляет собой хлорид лития с формулой LiCl11, которую мы можем просто написать как LiCl: Li+ClLiClLiCl+–11
Другой пример: магний из группы 2 реагирует с бромом из группы 17. Магний потеряет 2 электрона и станет
Mg2+ и два атома брома получат по 1 электрону (от магния) с образованием двух
ионы Br–. Продукт представляет собой бромид магния с формулой MgBr12. Мы можем записать это просто как MgBr2:
Mg+Br+BrMgBrMgBr2+––122
Магний потеряет 2 электрона и станет
Mg2+ и два атома брома получат по 1 электрону (от магния) с образованием двух
ионы Br–. Продукт представляет собой бромид магния с формулой MgBr12. Мы можем записать это просто как MgBr2:
Mg+Br+BrMgBrMgBr2+––122
Пример 4. Соединение номера группы с нижним индексом в ионной формуле
Рассмотрим приведенное ниже уравнение: 2X+3ClXCl226
В какую из следующих групп может входить X?
- Группа 17
- Группа 2
- Группа 13
- Группа 15
Ответ
Соединение XCl26 содержит хлор. Хлор находится в группе 17 и поэтому имеет валентность 1 и при реакции образует отрицательный ион Cl–. В этом соединении шесть ионов хлора, поэтому шесть отрицательных зарядов.
Это соединение в целом электрически нейтрально, поэтому «X…2» должен нести шесть положительных зарядов, чтобы его можно было нейтрализовать.
шесть отрицательных зарядов от «…Cl6».
Мы можем разделить 6 положительных зарядов на 2, так как есть два иона X. Это даст нам заряд одного иона Х.
Каждый ион X представляет собой X3+. Таким образом, Х должны быть из группы 13, так как элементы группы 13 имеют тенденцию терять электроны, когда они реагируют и образуют положительные ионы, и валентность Элементы группы 13 равны 3, поэтому они теряют 3 электрона.
Правильный ответ — вариант C, группа 13.
Ключевые моменты
- Периодическая таблица состоит из 18 вертикальных столбцов, называемых группами, и 7 горизонтальных рядов, называемых периодами.
- Большинство элементов находятся в твердом состоянии при комнатной температуре, два – в жидком состоянии, а некоторые – в газообразном.
- Большинство элементов встречаются в природе, а некоторые искусственно синтезированы.
- Большинство элементов — это металлы, некоторые — неметаллы и некоторые — металлоиды.
- Металлы отделены от неметаллов «ступенчатым» расположением металлоидов.

- Некоторые группы имеют специальные названия, основанные на реакции их элементов.
- Каждый элемент имеет уникальный символ.
- Элементы перечислены слева направо в периодической таблице в порядке возрастания атомного номера.
- Периодическую таблицу можно разделить на s-, p-, d- и f-блоки.
- Атомный номер — это число протонов в ядре или центре атома.
- Атом – это мельчайшая частица элемента, содержащая положительно заряженные протоны и нейтральные нейтроны в ядре, и отрицательно заряженные электроны. Атомы содержат равное количество протонов и электронов и электрически нейтральны.
- Ионы — это частицы, содержащие неравное количество протонов и электронов и обладающие электрическим зарядом.
- Металлы имеют тенденцию терять электроны, когда они реагируют и образуют положительно заряженные катионы.
- Неметаллы имеют тенденцию приобретать электроны, когда они реагируют и образуют отрицательно заряженные анионы.