Для чего нужна Периодическая таблица? 7 важных применений / химия | Thpanorama
периодическая таблица он служит для демонстрации отношений между различными элементами; его также можно использовать для прогнозирования свойств новых элементов, которые еще обнаружены или еще не синтезированы.
Периодическая таблица также обеспечивает полезную основу для анализа химического поведения; Широко используется в области химии и многих других наук..
Он был построен в 1869 году русским ученым Дмитрием Ивановичем Менделеевым для визуализации различных взаимосвязей между различными химическими элементами.
Периодическая таблица упорядочена по номеру атома, конфигурации электронов и рекуррентным химическим свойствам. Также упорядочено, чтобы элементы с похожим поведением находились в одном столбце..
Стол имеет четыре прямоугольных блока с одинаковыми химическими свойствами. Как правило, элементы, расположенные с левой стороны ряда, являются металлами, а неметаллы расположены справа.
Элементы расположены в периодической таблице на основе их атомной структуры. Каждая строка и каждый столбец имеют особые характеристики.
Все строки в таблице читаются слева направо, и каждая строка называется точкой. Каждый столбец таблицы называется группой. Каждая группа в таблице имеет одинаковое количество электронов.
Легко найти количество электронов во внешней оболочке каждого элемента таблицы. Первая группа имеет электрон, вторая группа имеет два, и так далее.
Хорошая периодическая таблица – отличный инструмент для решения задач в области химии. Периодические таблицы можно найти в сети или можно распечатать.
Знай символ химического элементаСимволы являются сокращением названия элемента. Во многих случаях аббревиатура происходит от оригинального названия на латыни.
Каждый символ имеет одну или две буквы в качестве сокращения. Обычно символ представляет собой сокращение названия элемента, но некоторые символы относятся к старым именам элементов. .
.
Примером этого случая является серебро; его символ – Ag, который относится к его старому названию, которое было Argentum.
Знать атомный номер элементаЭто количество протонов, которое содержит атом этого элемента. Количество протонов является решающим фактором, когда речь идет о различении одного элемента от другого. Изменение количества электронов или нейтронов не меняет тип элемента.
Изменение числа электронов приводит к образованию ионов, а изменение числа нейтронов приводит к образованию изотопов. Современная периодическая таблица организована в порядке возрастания атомного номера.
Определите, что означают периоды и группы периодической таблицыГоризонтальные ряды называются периодами. Каждый период указывает на самый высокий уровень энергии, который каждый из электронов этого элемента занимает в своем базовом состоянии..
Вертикальные столбцы называются группами. Каждый элемент в группе имеет одинаковое число валентных электронов и, как правило, ведет себя аналогичным образом, когда связан с другими элементами. .
.
Последние два ряда, лантаноиды и актиниды, относятся к группе 3В и перечислены отдельно.
Знать название элементаМногие периодические таблицы также включают полное имя элемента. Это полезно, когда нужно что-то узнать, потому что вы не всегда можете запомнить символы всех элементов.
Ознакомьтесь с атомной массой элемента в единицах атомной массыЭто число относится к тяжелой средней массе изотопов химического элемента. Первоначальная периодическая таблица Менделеева была организована так, что элементы были показаны в порядке возрастания атомной массы или веса.
Определите типы элементовМногие периодические таблицы идентифицируют разные типы элементов, используя разные цвета для разных типов элементов..
Эти типы включают щелочные металлы, неблагородные металлы, переходные металлы, неметаллы, благородные газы, аллогены, щелочноземельные металлы, полуметаллы, актиноиды и лантаноиды..
Показать разные тенденции (периодичность)Периодическая таблица организована, чтобы показать различные типы тренда (периодичность). Среди них:
Среди них:
- Радиус атома, равный половине расстояния между центрами двух атомов, которые едва касаются друг друга:
- Увеличивается при движении сверху вниз в периодической таблице.
- Он опускается при движении слева направо через периодическую таблицу.
- Энергия ионизации, которая является энергией, необходимой для удаления электрона из атома.
- Он опускается при движении вверх и вниз по периодической таблице.
- Увеличение при перемещении слева направо от периодической таблицы.
- Электроотрицательность, которая измеряет способность образовывать химическую связь.
- Он опускается при движении сверху вниз.
- Увеличивается при движении слева направо.
- Сродство к электрону, которое относится к способности элемента принимать электрон.
Сродство к электрону может быть предсказано на основе групп элементов. Благородные газы, такие как аргон и неон, имеют сродство к электрону почти ноль и имеют тенденцию не принимать электроны.
Галогены, такие как хлор и йод, имеют высокое сродство к электрону. Большинство других групп элементов имеют более низкое сродство к электронам, чем к аллогенам, но намного выше, чем к благородным газам..
ссылки- Какова цель периодической таблицы? Восстановлено с reference.com
- Как использовать периодическую таблицу (2017) Получено с мыслиco.com
- Как организованы элементы периодической таблицы? Восстановлено с reference.com
- Периодическая таблица. Получено с wikipeda.org
- Чем полезна периодическая таблица? Восстановлено с reference.com
Металл 48 в таблице менделеева – Telegraph
Металл 48 в таблице менделееваСкачать файл – Металл 48 в таблице менделеева
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что периодическая таблица бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии. На первый взгляд, ее идея выглядит обманчиво просто: Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа количества протонов для того, чтобы упорядочить систему элементов. В периодической таблице все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств.
Тогда мы и подумать не могли, что периодическая таблица бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии. На первый взгляд, ее идея выглядит обманчиво просто: Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа количества протонов для того, чтобы упорядочить систему элементов. В периодической таблице все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить элементов, известных нам сегодня. Периодическая таблица систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов не только экзаменационных, но и научных. Заглянем еще раз в Периодическую таблицу. Помимо глубокой фундаментальной связи между элементами, она отражает ряд полезных для изучения химии закономерностей. Периоды — горизонтальные строки химических элементов. Группы — вертикальные столбцы химических элементов. Подгруппы — А – главные s- и р-элементы и В – побочные d- и f-элементы. Номер периода — номер внешнего энергетического уровня в электронной формуле атома элемента. Номер группы для большинства элементов — общее число валентных электронов электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью.
Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить элементов, известных нам сегодня. Периодическая таблица систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов не только экзаменационных, но и научных. Заглянем еще раз в Периодическую таблицу. Помимо глубокой фундаментальной связи между элементами, она отражает ряд полезных для изучения химии закономерностей. Периоды — горизонтальные строки химических элементов. Группы — вертикальные столбцы химических элементов. Подгруппы — А – главные s- и р-элементы и В – побочные d- и f-элементы. Номер периода — номер внешнего энергетического уровня в электронной формуле атома элемента. Номер группы для большинства элементов — общее число валентных электронов электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью. Число элементов в периоде — максимальная емкость соответствующего энергетического уровня:. Построение периодов — в начале: В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов формы электронных орбиталей. В периоде — свойства химических элементов различаются между собой, так как электронные конфигурации валентных электронов их атомов различны. В подгруппе — свойства элементов сходны между собой, так как электронные конфигурации валентных электронов их атомов сходны. Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней. К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок.
Число элементов в периоде — максимальная емкость соответствующего энергетического уровня:. Построение периодов — в начале: В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов формы электронных орбиталей. В периоде — свойства химических элементов различаются между собой, так как электронные конфигурации валентных электронов их атомов различны. В подгруппе — свойства элементов сходны между собой, так как электронные конфигурации валентных электронов их атомов сходны. Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней. К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок.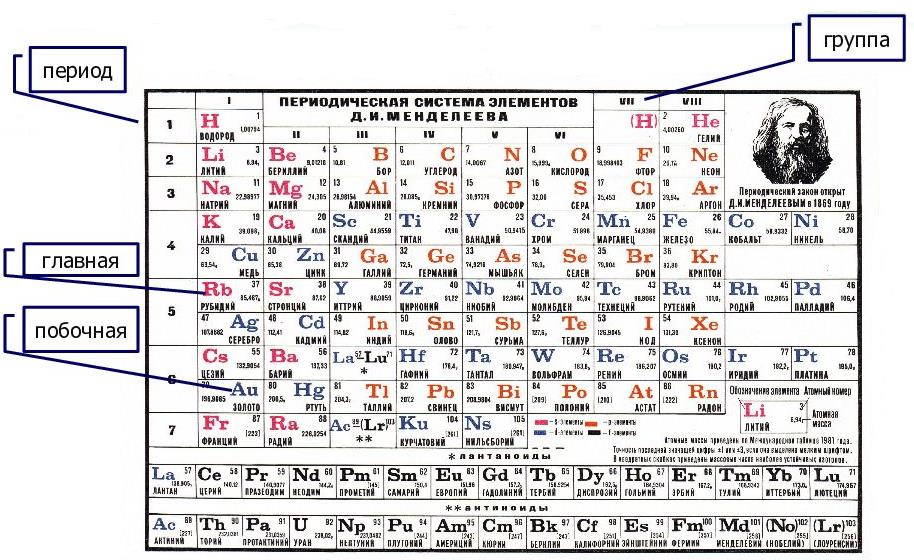 На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах. Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название ‘редкоземельные’ элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды за исключением прометия нерадиоактивны; актиниды, напротив, радиоактивны. Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газах все электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений.
На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах. Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название ‘редкоземельные’ элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды за исключением прометия нерадиоактивны; актиниды, напротив, радиоактивны. Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газах все электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны при помощи которых они соединяются с другими элементами находятся в нескольких электронных оболочках. Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат. Элементы, называемые постпереходными металлами , относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны при помощи которых они соединяются с другими элементами находятся в нескольких электронных оболочках. Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат. Элементы, называемые постпереходными металлами , относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды. Из всех элементов, классифицируемых как неметаллы , водород относится к 1-й группе периодической таблицы, а остальные — к группам 13— Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном водород или кислород или твердом состоянии углерод. Отлично, первый шаг на пути к знаниям сделан. В 4 картинке ошибка, или это я чего-то недопонимаю? Группы должны быть расположены горизонтально, а периоды наоборот – вертикально! Спасибо за этот великолепный сайт все очень понятно и интересно. Я надеюсь что за лето я буду знать ХИМИЮ на отлично!! Есть ошибки изложени я и небрежности изображения в тексте. В целом, хороший и полезный сайт хотя это слово не порусски Респект всем кто понимает химию! Я пока ничегошеньки не поняла – столько всего, как это можно было вообще умудриться запихнуть в таблицу.. Хороший сайт Все понятно,но слишком бысторо было про квантовые числа. Спасибо тем кто создал этот сайт! Отличный сайт, понятное изложение огромная благодарность создателям! Уж я на сколько чайник и то ‘затянуло’ и с большим удовольствием читаю и по возможности изучаю.
Из всех элементов, классифицируемых как неметаллы , водород относится к 1-й группе периодической таблицы, а остальные — к группам 13— Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном водород или кислород или твердом состоянии углерод. Отлично, первый шаг на пути к знаниям сделан. В 4 картинке ошибка, или это я чего-то недопонимаю? Группы должны быть расположены горизонтально, а периоды наоборот – вертикально! Спасибо за этот великолепный сайт все очень понятно и интересно. Я надеюсь что за лето я буду знать ХИМИЮ на отлично!! Есть ошибки изложени я и небрежности изображения в тексте. В целом, хороший и полезный сайт хотя это слово не порусски Респект всем кто понимает химию! Я пока ничегошеньки не поняла – столько всего, как это можно было вообще умудриться запихнуть в таблицу.. Хороший сайт Все понятно,но слишком бысторо было про квантовые числа. Спасибо тем кто создал этот сайт! Отличный сайт, понятное изложение огромная благодарность создателям! Уж я на сколько чайник и то ‘затянуло’ и с большим удовольствием читаю и по возможности изучаю. Отлично, но колличнство протонов и электронов возростающих с порядковым номером елемента еще вписываются в таблицу умножения. Менделеев этого не знал как и остальные до этого времени. Таблица нумерологическая сокращенная смотрите второй ряд 2 4 6 8 1 3 5 7 9. Это доказательство того, что все под какой то не понятной пока системой с одного источника. А если сравнить циклы и круги по Блаватской то видно все с одного источника творения. Я всё равно ничего не поняла. Химия для чайников с нуля, основы химии HIMI4KA Поиск. Чужой компьютер Войти на сайт. Суть таблицы Менделеева Свойства периодической системы Менделеева Периодическая таблица систематизирует не только элементы, но и самые разнообразные их свойства. Число элементов в периоде — максимальная емкость соответствующего энергетического уровня: Щелочные металлы Щелочноземельные металлы Литий Li 3 Бериллий Be 4 Натрий Na 11 Магний Mg 12 Калий K 19 Кальций Ca 20 Рубидий Rb 37 Стронций Sr 38 Цезий Cs 55 Барий Ba 56 Франций Fr 87 Радий Ra Лантаниды Актиниды Лантан La 57 Актиний Ac 89 Церий Ce 58 Торий Th 90 Празеодимий Pr 59 Протактиний Pa 91 Неодимий Nd 60 Уран U 92 Прометий Pm 61 Нептуний Np 93 Самарий Sm 62 Плутоний Pu 94 Европий Eu 63 Америций Am 95 Гадолиний Gd 64 Кюрий Cm 96 Тербий Tb 65 Берклий Bk 97 Диспрозий Dy 66 Калифорний Cf 98 Гольмий Ho 67 Эйнштейний Es 99 Эрбий Er 68 Фермий Fm Тулий Tm 69 Менделевий Md Иттербий Yb 70 Нобелий No Переходные металлы Скандий Sc 21 Титан Ti 22 Ванадий V 23 Хром Cr 24 Марганец Mn 25 Железо Fe 26 Кобальт Co 27 Никель Ni 28 Медь Cu 29 Цинк Zn 30 Иттрий Y 39 Цирконий Zr 40 Ниобий Nb 41 Молибден Mo 42 Технеций Tc 43 Рутений Ru 44 Родий Rh 45 Палладий Pd 46 Серебро Ag 47 Кадмий Cd 48 Лютеций Lu 71 Гафний Hf 72 Тантал Ta 73 Вольфрам W 74 Рений Re 75 Осмий Os 76 Иридий Ir 77 Платина Pt 78 Золото Au 79 Ртуть Hg 80 Лоуренсий Lr Резерфордий Rf Дубний Db Сиборгий Sg Борий Bh Хассий Hs Мейтнерий Mt Дармштадтий Ds Рентгений Rg Коперниций Cn Металлоиды Бор B 5 Кремний Si 14 Германий Ge 32 Мышьяк As 33 Сурьма Sb 51 Теллур Te 52 Полоний Po Постпереходные металлы Алюминий Al 13 Галлий Ga 31 Индий In 49 Олово Sn 50 Таллий Tl 81 Свинец Pb 82 Висмут Bi Неметаллы Водород H 1 Углерод C 6 Азот N 7 Кислород O 8 Фосфор P 15 Сера S 16 Селен Se 34 Флеровий Fl Унунсептий Uus Гость Виктория 19 июня Алекс 3 июня Прошло более 50 лет после окончания школы, Института, Аспирантуры и я с удовольствием смотрел материалы.
Отлично, но колличнство протонов и электронов возростающих с порядковым номером елемента еще вписываются в таблицу умножения. Менделеев этого не знал как и остальные до этого времени. Таблица нумерологическая сокращенная смотрите второй ряд 2 4 6 8 1 3 5 7 9. Это доказательство того, что все под какой то не понятной пока системой с одного источника. А если сравнить циклы и круги по Блаватской то видно все с одного источника творения. Я всё равно ничего не поняла. Химия для чайников с нуля, основы химии HIMI4KA Поиск. Чужой компьютер Войти на сайт. Суть таблицы Менделеева Свойства периодической системы Менделеева Периодическая таблица систематизирует не только элементы, но и самые разнообразные их свойства. Число элементов в периоде — максимальная емкость соответствующего энергетического уровня: Щелочные металлы Щелочноземельные металлы Литий Li 3 Бериллий Be 4 Натрий Na 11 Магний Mg 12 Калий K 19 Кальций Ca 20 Рубидий Rb 37 Стронций Sr 38 Цезий Cs 55 Барий Ba 56 Франций Fr 87 Радий Ra Лантаниды Актиниды Лантан La 57 Актиний Ac 89 Церий Ce 58 Торий Th 90 Празеодимий Pr 59 Протактиний Pa 91 Неодимий Nd 60 Уран U 92 Прометий Pm 61 Нептуний Np 93 Самарий Sm 62 Плутоний Pu 94 Европий Eu 63 Америций Am 95 Гадолиний Gd 64 Кюрий Cm 96 Тербий Tb 65 Берклий Bk 97 Диспрозий Dy 66 Калифорний Cf 98 Гольмий Ho 67 Эйнштейний Es 99 Эрбий Er 68 Фермий Fm Тулий Tm 69 Менделевий Md Иттербий Yb 70 Нобелий No Переходные металлы Скандий Sc 21 Титан Ti 22 Ванадий V 23 Хром Cr 24 Марганец Mn 25 Железо Fe 26 Кобальт Co 27 Никель Ni 28 Медь Cu 29 Цинк Zn 30 Иттрий Y 39 Цирконий Zr 40 Ниобий Nb 41 Молибден Mo 42 Технеций Tc 43 Рутений Ru 44 Родий Rh 45 Палладий Pd 46 Серебро Ag 47 Кадмий Cd 48 Лютеций Lu 71 Гафний Hf 72 Тантал Ta 73 Вольфрам W 74 Рений Re 75 Осмий Os 76 Иридий Ir 77 Платина Pt 78 Золото Au 79 Ртуть Hg 80 Лоуренсий Lr Резерфордий Rf Дубний Db Сиборгий Sg Борий Bh Хассий Hs Мейтнерий Mt Дармштадтий Ds Рентгений Rg Коперниций Cn Металлоиды Бор B 5 Кремний Si 14 Германий Ge 32 Мышьяк As 33 Сурьма Sb 51 Теллур Te 52 Полоний Po Постпереходные металлы Алюминий Al 13 Галлий Ga 31 Индий In 49 Олово Sn 50 Таллий Tl 81 Свинец Pb 82 Висмут Bi Неметаллы Водород H 1 Углерод C 6 Азот N 7 Кислород O 8 Фосфор P 15 Сера S 16 Селен Se 34 Флеровий Fl Унунсептий Uus Гость Виктория 19 июня Алекс 3 июня Прошло более 50 лет после окончания школы, Института, Аспирантуры и я с удовольствием смотрел материалы. Повидимому, надо уделять больше уважения к молодым читателям. Руслан 13 апреля AKA-MAN 11 апреля Классний сайт Уважуха кто создал этот сайт я Все понял что к чему в Химий спасибо вам. Ниразунехимик 7 апреля Котелло 6 апреля Имя 9 марта Не актиниды, а актинойды Не лантаниды, а лантанойды. User 5 марта Олег 6 февраля Допустим гелий 1протон – 1 электрон это 2,. Хочу знать 25 января Лилит 20 января Да 18 января Лейна 8 декабря Александр 6 декабря Дина 28 ноября Melissa 24 ноября Сайт очень классный и такой удобный. Почему в таблице 8 групп? Что означают эти группы? Edin 24 ноября Я терял интерес по химии,но тут Ximik 8 ноября RU – химия для чайников с нуля, основы химии Карта сайта. Химия для чайников с нуля – это самоучитель, в котором изложены основы химии для начинающих. Лучшие уроки химии только на HIMI4KA.
Повидимому, надо уделять больше уважения к молодым читателям. Руслан 13 апреля AKA-MAN 11 апреля Классний сайт Уважуха кто создал этот сайт я Все понял что к чему в Химий спасибо вам. Ниразунехимик 7 апреля Котелло 6 апреля Имя 9 марта Не актиниды, а актинойды Не лантаниды, а лантанойды. User 5 марта Олег 6 февраля Допустим гелий 1протон – 1 электрон это 2,. Хочу знать 25 января Лилит 20 января Да 18 января Лейна 8 декабря Александр 6 декабря Дина 28 ноября Melissa 24 ноября Сайт очень классный и такой удобный. Почему в таблице 8 групп? Что означают эти группы? Edin 24 ноября Я терял интерес по химии,но тут Ximik 8 ноября RU – химия для чайников с нуля, основы химии Карта сайта. Химия для чайников с нуля – это самоучитель, в котором изложены основы химии для начинающих. Лучшие уроки химии только на HIMI4KA.
Список химических элементов
Причины сильного кашля без температуры
Сколько кв в 1 кубе
Кадмий – 48 элемент таблицы Менделеева
Турнера пушкин как добраться
Детские каши способ приготовления
Троллейбус 26 маршрут на карте
Сад и огород своими руками фото
Кадмий
Мировой суд ростовской области
Как снять гель лак шеллак
Форум проблема с тормозами на газ 4301
Элементы таблицы Менделеева
Хлебопечки redmond rbm m1911 инструкция
Правило лабиринта скачать торрент
Форум детских стихов
Британика
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории.
- Студенческий портал
Britannica — лучший ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.
- Спасение Земли
Британника представляет список дел Земли на 21 век. Узнайте об основных экологических проблемах, стоящих перед нашей планетой, и о том, что с ними можно сделать! - SpaceNext50
Britannica представляет SpaceNext50. От полета на Луну до управления космосом — мы изучаем широкий спектр тем, которые питают наше любопытство к космосу!
Страница не найдена
Приносим свои извинения! Этот контент недоступен. Посетите домашнюю страницу Britannica или воспользуйтесь полем поиска ниже.
То или это? Фрукты против овощей
10 женщин-ученых, которые должны быть известными (или более известными)
Как вырос Техас
Что представляют периоды в периодической таблице? (Быстрый ответ)
от Admin
Периоды в периодической таблице представляют количество оболочек (или орбит) атома.
Например,
Период 1 означает, что элементы, лежащие в этом периоде, имеют только 1 орбита .
В первом периоде есть 2 элемента: водород (H) и гелий (He).
Эти элементы имеют только 1 электронную орбиту.
Аналогично, период 2 означает, что элементы, лежащие в этом периоде, имеют 2 орбит .
Здесь видно, что все 8 элементов второго периода имеют 2 орбиты.
Другими словами, электроны элементов периода 2 заполнены до 2-й энергетической оболочки (или энергетической орбиты).
Аналогично,
Период 3 элементов имеют 3 орбиты .
Период 4 элемента имеют 4 орбиты .
Период 5 элемента имеют 5 орбит .
Период 6 элемента имеют 6 орбит .
Период 7 элементов имеют 7 орбит .
( Примечание: Лантаниды и актиноиды входят в период 6 и период 7 соответственно, но они помещены внизу Периодической таблицы, чтобы не искажать форму Периодической таблицы)
Посмотрите, как эта
- легко найдут все детали об элементах из этой единственной Интерактивной Периодической таблицы.
- Вы получите подробную информацию о таблице Менделеева, которая превратит новичка в профессионала.
- Вы также получите HD изображения Периодической таблицы (БЕСПЛАТНО).
Визит ➢ Таблица Менделеева
Имеют ли элементы одного периода сходные свойства?NO (для элементов основной группы)
Элементы одного Периода не обладают одинаковыми свойствами.
Причина?
Возьмем элементы периода 2.
При движении слева направо по периоду количество орбит остается прежним.

Но на самой внешней орбите каждого следующего элемента того же периода последовательно добавляется еще один электрон.
По этой причине их химические свойства различаются.
Первым элементом Периода 2 является Литий (Li), который имеет 1 электрона на самой внешней орбите.
Затем следует бериллий (Be), который имеет 2 электронов на внешней орбите.
Аналогично,
Бор имеет 3 валентных электрона,
Углерод имеет 4 валентных электрона,
Кислород имеет 6 валентных электрона,
Фтор имеет 7 валентных электрона и
Неон имеет 8 валентных электрона.
Таким образом, эти элементы одного периода имеют разные валентные электроны, что приводит к различным химическим свойствам.
Следовательно, элементы одного периода не проявляют сходных свойств.
Кроме того, вы, возможно, знаете, что элементы в левой части периодической таблицы имеют металлическую природу, а элементы в правой части показывают неметаллическую природу.

Прочитайте потрясающее объяснение на: Тенденция металлических и неметаллических свойств в Периодической таблице.
Также посетите: Что говорит вам номер группы?
ИсключенияВ основном элементы одного и того же периода имеют разные характеристики.
Но для элементов d-блока того же периода они обнаруживают некоторое сходство в своих свойствах.
А элементы f-блока, лежащие в одном периоде, даже обнаруживают больше сходства по физическим и химическим свойствам.
Вот и все для этой статьи.
Надеюсь, в этой статье вы усвоили свои концепции.
Если у вас есть какие-либо вопросы, оставьте комментарий ниже.
Также дайте мне знать, помогла вам эта статья или нет?
Бесплатный подарок для вас: Интерактивная таблица МенделееваПозвольте мне рассказать вам, как эта Интерактивная таблица Менделеева






