Урок 7. Относительная молекулярная и относительная формульная массы – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Содержание
- Относительная молекулярная масса
- Относительная формульная масса
- Вычисление массовой доли химического элемента по формуле вещества
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u.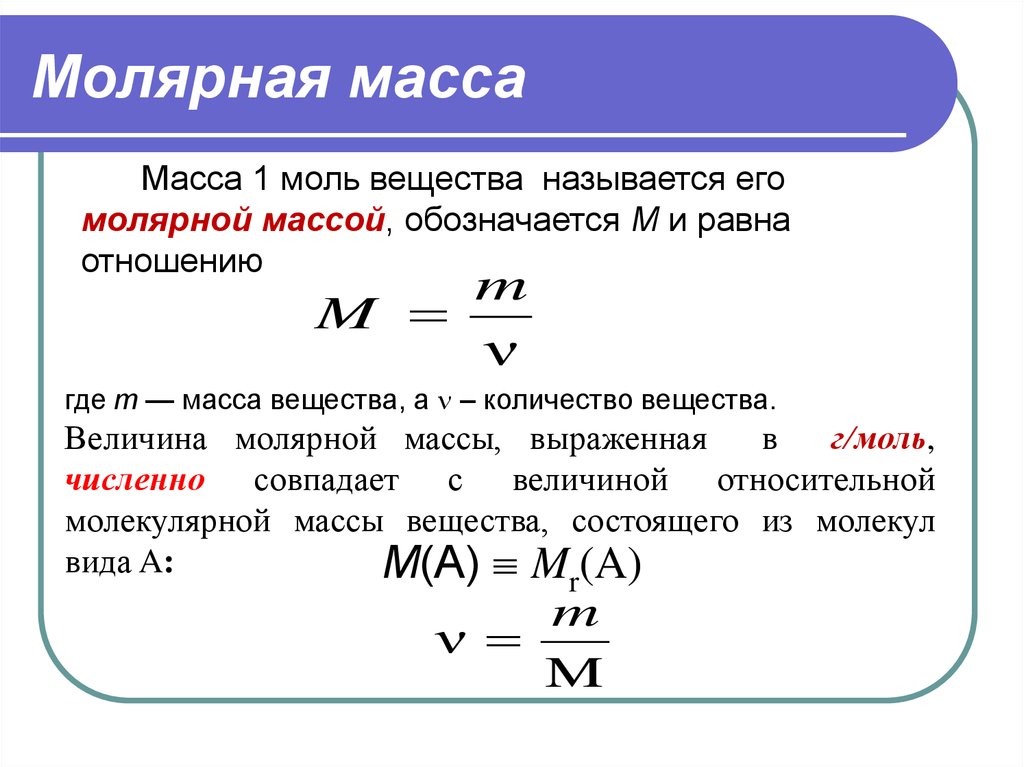 Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А;
Ar(А) — относительная атомная масса элемента А;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Спойлер
[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 8. Химическое количество вещества и моль →
← Урок 6. Валентность
Разработка урока «Относительная молекулярная масса» | Химия
Автор: Куропятник Татьяна Николаевна
Организация: ГОУ АСЭГ
Населенный пункт: Луганская Народная Республика, г. Алчевск
Алчевск
Цель: сформировать понятие относительной молекулярной и относительной формульной массы веществ, научить находить значение относительных молекулярных и относительных формульных масс веществ, решать расчетные задачи и находить формулы неизвестных веществ.
Оборудование и материалы: Периодическая система химических элементов Д.И. Менделеева, индивидуальные карточки различных цветов, фишки.
Базовые понятия и термины: химический элемент, атом, молекула, формульная единица, относительная атомная масса, относительная молекулярная масса, относительная формульная масса.
Тип урока: комбинированный.
Методы обучения: словесные – беседа, рассказ; практические – решение упражнений и задач, самостоятельная работа; репродуктивные, частично-поисковые, исследовательские, интерактивные, создание ситуации успеха.
Ход урока
- Организационный этап
Приветствие, проверка готовности обучающихся к уроку.
- Проверка домашнего задания (устно)
- Актуализация опорных знаний и мотивация учебной деятельности
Беседа
- Из каких частичек состоят сложные вещества?
- Дайте определение химической формуле?
- Какую информацию мы можем взять из химической формулы?
- Что такое индекс, что он обозначает?
- Дайте определение относительной атомной массы.

Учитель сообщает, что по химической формуле вещества можно рассчитать массу молекулы, и называет тему урока. Обучающиеся самостоятельно формулируют цели урока.
- Изучение нового материала
- Относительная молекулярная масса.
Массы молекул, как и массы атомов, очень малы. Поэтому массу молекул, так же как и массу атомов принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой.
Относительная атомная масса – это отношение массы молекулы к 1/12 массы атома углерода.
Относительная атомная масса равна сумме относительных атомных масс всех химических элементов, которые входят в состав молекулы, с учетом числа атомов каждого элемента.
Размерности относительная молекулярная масса не имеет.
Например, Мr (h3) = 1*2=2
Мr (CO2) = 12+16*2=44
Мr (h3SO4) = 1*2+32+16*4 = 98
Мr (Al(NO3)3 = 27+14*3+16*3*3 = 213
Задание
Рассчитайте относительную атомную массу для следующих соединений: HCl, Nh4, SO2, P2O5 (выполняется возле доски).
- Относительная формульная масса.
Для веществ немолекулярного строения вместо термина «относительная молекулярная масса» используют термин «относительная формульная масса». Способ ее нахождения и обозначения такой же, как и для относительной молекулярной массы.
Задание
Рассчитайте относительные формульные массы следующих веществ:
KOH, Na2SO4, Ca3(PO4)2 (выполняется возле доски).
Используя понятие «относительная атомная масса» и «относительная формульная масса», можно решать простейшие задачи и находить формулы неизвестных веществ.
Задача: Относительная молекулярная масса неизвестного трехвалентного элемента с водородом равна 17. Найдите элемент и запишите формулу вещества.
Заслушиваются ответы обучающихся. Учитель корректирует и объясняет правильное оформление и решение задачи.
- Обобщение и систематизация знаний обучающихся
Этот этап урока можно провести как самостоятельную работу с элементами игры под девизом «Понял сам, объясни другому».
I этап
Выполняются задания на индивидуальных карточках синего цвета. Цвет карточек помогает учителю следить, на каком этапе обучающийся. Карточки готовятся для каждого ученика.
Примеры заданий
Рассчитайте относительную формульную или молекулярную массу для следующих веществ:
- Cu2O, NaNO3, C2H5OH
- Nh4, CaSO4, C6h22O6
- Al2O3, Na2SiO3, C6H6
- P2O5, h3CO3, C10h32
- Fe2O3, NaNO2, NaOH
- CaCl2, h4PO4, MgSiO3
- NaCl, K2SO4, KClO3
- AlBr3, Na2SO4, NaClO3
- FeBr3, Na2CO3, HI
- MgF2, Na3PO4, Nh5Cl
Обучающиеся, которые первыми выполнили задание первого этапа, помогают своим одноклассникам. При этом они свободно перемещаются по классу. Учителю необходимо следить за тем, чтобы помощь была как объяснение, а не решение. За каждую консультацию ученик получает фишку. Этот прием создает ситуацию успеха.
II этап
Выполняются задания на индивидуальных карточках зеленого цвета. Карточки готовятся для каждого ученика и раздаются после выполнения заданий первого этапа.
Карточки готовятся для каждого ученика и раздаются после выполнения заданий первого этапа.
Примеры заданий
Рассчитайте относительную формульную массу для следующих веществ:
- Al (OH)3, Ca3(PO4)2
- Ca(NO3)2, Ba(OH)2
- Al2(SO4)3, Mg(OH)2
- Cu(OH)2, Ba(NO3)2
- Mg(NO3)2, Zn3(PO4)2
- Fe(NO3)2, Zn(OH)2
- Ba(NO2)2, Zn3(PO4)2
- Fe2(SO4)3, Cr(OH)2
- Cr(OH)3, Zn(NO3)2
10. Fe(OH)3, Cr2(SO4)3
Ученики, которые первыми выполнили задание второго этапа, помогают одноклассникам и получают дополнительные фишки за консультацию.
III этап
Выполняются задания на индивидуальных карточках желтого цвета. Это задачи на применение знаний. Учащиеся, которые получают карточки на этом этапе, выполняют задания возле доски. Задания, которые выполнены на доске, обсуждаются после завершения самостоятельной работы.
Примеры заданий
- Какая молекула тяжелее С6Н12О6 или С12Н22О11?
- Рассчитайте, что тяжелее 5 молекул Н2О или 2 молекулы СО2?
- Составьте формулы оксида железа (II) и оксида железа (III).

- Рассчитайте во сколько раз молекула угарного газа СО легче или тяжелее кислорода О2?
- Относительная молекулярная масса неизвестного одновалентного элемента с водородом равна 128. Найдите элемент и запишите формулу соединения.
- Формула неизвестного вещества ХО. Относительная молекулярная масса этого вещества 30. Определите элемент Х.
Ученики, которые выполнили задание третьего этапа, помогают одноклассникам, получают дополнительные фишки или выполняют задания следующего этапа.
IV этап
Используются задания на применение знаний в нестандартных ситуациях. Все задания выполняются на индивидуальных карточках красного цвета. Ученик выбирает для выполнения только одно задание. Задания также выполняются возле доски и обсуждаются в классе.
Примеры заданий
- Выведите химическую формулу вещества, если известно, что медь и кислород в оксиде меди соединены в массовом отношении 4:1.

- Составьте химическую формулу сахарозы, если на двенадцать атомов углерода приходится двадцать два атома водорода и одиннадцать атомов кислорода. Рассчитайте относительную молекулярную массу полученного вещества.
Победителем игры считается ученик, который выполнил задания всех этапов и набрал наибольшее число фишек за консультации. Ему присваивается звание «эксперта» и предоставляется право проверять задания других обучающихся по данной теме на следующих уроках.
- Домашнее задание
- Выучить параграф 14 (учебник Г.Е.Рудзитис, Ф.Г.Фельдман. Химия. 8 класс. Москва: Просвещение, 2015).
- Выполнить задание 3, страница 49.
- Подведение итогов урока
Учитель благодарит консультантов за помощь и просит учеников высказаться по поводу достижения целей урока.
Для подведения итогов урока можно использовать интерактивную технологию коллективно-группового обучения «Незаконченное предложение». Учитель предлагает ученикам продолжить предложение «Важнейшим на этом уроке для меня было…» и дает совет говорить свободно, кратко, убедительно.
Список использованной литературы
- Г.Е.Рудзитис, Ф.Г.Фельдман. Химия. 8 класс. Учебник для общеобразовательных организаций/ Г.Е. Рудзитис Ф.Г.Фельдман. – Москва: Просвещение, 2015. – 207 с.
- Н.П. Гаврусейко. Проверочные работы по неорганической химии. Дидактический материал для 8 класса. Книга для учителя.-2-е издание. Москва: Просвещение, 1992. – 64 с.
- Р.П. Суровцева. С.В.Софронов. Задания для самостоятельной работы по химии в 8 классе. Москва: Просвещение, 1993. – 94 с.
Относительная атомная масса и формула массы найти массовое число
Всякий раз, когда вы видите слово «относительный» в химии, это означает массовое число.
Пример
Относительная атомная масса = найти массовое число
Относительная формула массы = найти массовое число
Подумайте обо всех родственниках (родственниках) бульмастифа (массовое число).
Примечание: если вы видите словосочетание «атомная масса» само по себе, оно неверно. Перед ним всегда должно быть слово «родственник».
Примечание для студентов-химиков более высокого уровня
Относительная атомная масса = найти (среднее) массовое число
Относительная атомная масса на самом деле означает, что элемент имеет изотопы. Чтобы найти относительную атомную массу, вам нужно будет определить среднюю массу изотопов.
Относительная атомная масса
Относительная атомная масса элемента равна его массовому числу.
Примеры относительной атомной массы
Массовое число = 1
Атомное число = 1
Относительная атомная масса водорода = 1
Массовый номер = 12
Атомного числа = 6
Относительная атомная масса углерода = 12
Относительная формала.
 масса
массаЧтобы вычислить относительную формульную массу соединения, просто сложите все относительные массы в этой формуле.
Примеры относительной массы формулы
Вода (H
2 O) Массовый номер = 1
Атомный номер = 1
Относительная атомная масса водорода = 1
Массовый номер = 16
Атомный номер = 8
Относительно ат -масса.
Поскольку в молекуле воды 2 атома водорода и 1 атом кислорода, вычисление (2×1) + 16 = 18,
Следовательно, относительная масса формулы H 2 O составляет 18.
Хлорид натрия
Mass Number = 23
AT ATOMIC = 110037
Mass Number = 23
ATMIC = 1100377777777777795 гг. натрий = 23
натрий = 23
Массовое число = 35,5
Атомный номер = 17
Относительная атомная масса хлора = 35,5
Молекулы хлорида натрия состоят из атома натрия и атома хлора. Расчет:
23 + 35,5 = 58,5
, поэтому относительная масса формулы NaCl составляет 58,5
0025
Как объяснялось ранее, для большинства элементов относительная атомная масса равна их массовому числу .
Однако, если вы хотите найти относительную атомную массу элемента с различными изотопами, например хлора, то вам нужно найти среднюю атомную массу его изотопов. Вам также необходимо знать относительное содержание элемента.
Относительное содержание — это количество каждого изотопа по сравнению с общим количеством элемента.
Хлор
Например, существует два изотопа хлора. Один имеет относительную массу 35 (хлор-35), а другой имеет относительную массу 37 (хлор-37). В образце газообразного хлора 75% приходится на хлор-35 и 25% — на хлор-37. Эти проценты представляют собой относительное содержание изотопов.
В образце газообразного хлора 75% приходится на хлор-35 и 25% — на хлор-37. Эти проценты представляют собой относительное содержание изотопов.
Чтобы вычислить относительную атомную массу, умножьте массу каждого изотопа на его относительное содержание. Затем сложите эти числа вместе и разделите на сумму относительного изобилия.
Расчет относительной атомной массы хлора:
(25%x37) + (75%x35) = 9,25 + 26,25
=35,5
2 Следовательно, относительная атомная масса хлор 35,5.
Резюме
Если вы видите слово «относительный», это означает массовое число .
относительная атомная масса элемента – это просто его массовое число , если только элемент не имеет различных изотопов (например, хлор). В этом случае найдите среднее значение массовых чисел изотопов, учитывая их относительное содержание.
Чтобы вычислить относительную формулу массы , прибавьте массовые числа всех элементов в соединении.
Подробнее
Chemguide: Core Chemistry 14–16 Относительная атомная масса, относительная молекулярная масса и относительная формульная масса На этой странице объясняется шкала атомной массы, основанная на массе атома изотопа C-12. Значение изотопа С-12 в химических расчетах Краткий обзор изотопов Число нейтронов в атоме может варьироваться в небольших пределах. Например, существует три вида атомов углерода: 12 C, 13 C и 14 C. Все они имеют одинаковое количество протонов, но количество нейтронов различается.
Эти различные атомы углерода называются изотопами . Тот факт, что они имеют различное число нейтронов, не имеет никакого значения для химических реакций углерода. Изотопы — это атомы с одинаковым атомным номером, но разными массовыми числами. У них одинаковое количество протонов, но разное количество нейтронов. Весы C-12 Массы атомов измеряются относительно массы атома C-12. Вы не можете использовать знакомую единицу массы, такую как грамм, потому что атомы очень малы. Это 600 000 000 000 000 000 000 000 атомов. Взвешивание атомов в стандартных единицах массы, таких как граммы, было бы глупостью! Относительная изотопная масса Большинство людей начинают с относительной атомной массы, но имеет смысл сначала поговорить об относительной массе изотопов.
Для этого есть альтернативная формулировка, которую некоторым людям легче понять.
Например, атом Mg-24 в два раза тяжелее атома C-12, поэтому его относительная изотопная масса равна 24. Используйте то, что кажется вам более очевидным, когда вы пытаетесь понять это, но для целей экзамена изучите то, что есть в вашей программе. Изотопы и относительная атомная масса
(я использую вариант определения, который мне кажется проще!) Относительная атомная масса обозначается символом A r . «Средневзвешенное значение» также называют «средневзвешенным». Пример показывает, как это работает. Пример использования хлора Это пример, когда числа настолько просты, что вполне можно ожидать, что вы их запомните. Хлор имеет два изотопа, Cl-35 и Cl-37, а обычный хлор содержит их в соотношении 3 атома Cl-35 на каждый 1 атом Cl-37 (достаточно хорошее приближение для наших целей). Если у вас есть образец хлора, он будет содержать невероятно большое количество атомов хлора, и полезно иметь возможность дать среднее значение массы атома хлора. Относительная атомная масса представляет собой средневзвешенную (часто называемую средневзвешенной) масс изотопов. Это среднее значение, которое учитывает различные пропорции различных изотопов. Предположим, у вас есть четыре типичных атома хлора — 3 атома Cl-35 и 1 атом Cl-37.
Если вы посмотрите на периодическую таблицу, вы обнаружите, что 35,5 — это число, указанное как относительная атомная масса хлора. Если вас интересуют единицы относительной атомной массы – их нет! Это значение, которое измеряется относительно массы изотопа C-12. Поиск относительных атомных масс Большинство периодических таблиц включают относительные атомные массы, и если они вам понадобятся на экзаменах, вам всегда будут даны любые необходимые значения – либо в таблице Менделеева, либо в вопросе. Если у вас нет бумажной копии Периодической таблицы с относительными атомными массами, вы можете скачать и распечатать ее с этого сайта. Большинство периодических таблиц имеют два числа напротив каждого атома – атомный номер и относительную атомную массу. Относительная атомная масса всегда больше. Вычисление относительных атомных масс из процентов Предположим, вам нужно вычислить относительную атомную массу бора, учитывая следующие данные. Проба бора содержит
Если бы у вас было 100 типичных атомов, 18,7 были бы B-10, а 81,3 были бы B-11. | |||||||||||||||||
Примечание: Если вас беспокоит наличие 0,7 или 0,3 атома, вы всегда можете вместо этого взять 1000 атомов, но это требует дополнительных размышлений! Ответ будет одинаковым в любом случае. | |||||||||||||||||
| |||||||||||||||||
Примечание: Вы не можете указывать в своем ответе более трех значащих цифр, потому что это все, до которых указаны проценты. Вы можете возразить, что массовые числа приведены только до двух значащих цифр, но на самом деле это абсолютно точные числа. Массовые числа подсчитывают количество протонов и нейтронов в атоме. В этом нет ошибки. Вы не должны цитировать ответы точнее, чем ваш наименее точный введенный номер. | |||||||||||||||||
Относительная молекулярная масса и относительная формула массы, М r Относительная молекулярная масса, М r Вы должны быть осторожны с этим термином, потому что он должен применяться только к веществам, которые на самом деле существуют в виде молекул. Молекула состоит из фиксированного числа атомов, соединенных между собой ковалентными связями. Вы не должны использовать этот термин для таких вещей, как хлорид натрия, которые связаны ионами. Расчет относительной молекулярной массы Вы вычисляете относительную молекулярную массу вещества, складывая относительные атомные массы атомов, из которых оно состоит. Так, например, чтобы вычислить относительную молекулярную массу воды H 2 O, нужно сложить относительные атомные массы двух атомов водорода и одного кислорода.
Для определения относительной молекулярной массы CHCl 3 :
Определение относительной молекулярной массы
| |||||||||||||||||
Примечание: Вы можете обнаружить, что многие источники упускают информацию о средневзвешенных значениях, но это следует включить, если только вы не думаете о массе конкретной молекулы с определенной комбинацией изотопов различных атомов.  Например, на примере CHCl 3 выше: Не существует ни одной молекулы CHCl 3 с массой 119,5. Проблема в том, что средний образец этих молекул будет содержать изотопы как хлора-35, так и хлора-37. Это означает, что отдельные молекулы могут иметь следующие массы: 12 + 1 + (3 х 35) = 118 12 + 1 + (2 х 35) + 37 = 120 12 + 1 + 35 + (2 х 37) = 122 12 + 1 + (3 х 37) = 124 Средневзвешенное значение учитывает долю каждой из этих молекул в средней пробе вещества. Не беспокойтесь обо всем этом! Гораздо более вероятно, что вам придется вычислять относительную молекулярную массу путем сложения относительных атомных масс, чем определять ее. | |||||||||||||||||
Масса относительной формулы, М r Обратите внимание, что относительная формула массы имеет тот же символ, M r , что и относительная молекулярная масса. На самом деле относительная формула массы является гораздо более полезным термином, чем относительная молекулярная масса, потому что она включает в себя все, независимо от связи. Я настоятельно рекомендую вам постоянно использовать этот термин и говорить об относительной молекулярной массе только в том случае, если вас конкретно спросят об этом на экзамене. Вычисление относительной формулы массы Запишите формулу, а затем сложите все относительные атомные массы содержащихся в ней атомов. Пример 1
Пример 2 Относительная формула массы кристаллов сульфата меди(II), CuSO 4 .5H 2 O:
Будьте осторожны с вещами, содержащими кристаллизационную воду, такими как кристаллы сульфата меди (II) в этом примере. Сначала добавьте воду, а затем умножьте ее на 5 (или любое другое число, которое вам нужно). | |||||||||||||||||


 Например, для веса 1 г потребуется около 6 x 10 90 240 23 90 241 атомов водорода.
Например, для веса 1 г потребуется около 6 x 10 90 240 23 90 241 атомов водорода.
 В среднем 35 и 37 равно 36, но это не учитывает того факта, что атомов Cl-35 в три раза больше, чем атомов Cl-37.
В среднем 35 и 37 равно 36, но это не учитывает того факта, что атомов Cl-35 в три раза больше, чем атомов Cl-37.

 Он работает так же хорошо для ионных веществ, как и для ковалентных веществ.
Он работает так же хорошо для ионных веществ, как и для ковалентных веществ.