Современная периодическая таблица — группы, периоды, семейства и блоки
написано Адилом Аббасом
Современная периодическая таблица — группы, периоды, семейства и блоки
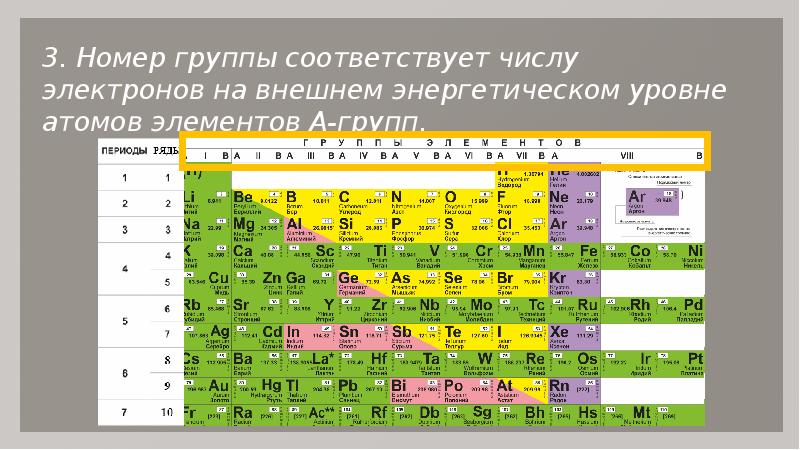
элементы расположены в порядке возрастания их порядкового номера.Следующая таблица представляет собой современную периодическую таблицу.
Современная периодическая таблица Основные характеристики современной периодической таблицыГруппы современной таблицы Менделеева
Элементы со сходными свойствами были помещены в вертикальный столбец, который был назван группами
Читайте также: Развитие и история таблицы Менделеева – Краткий обзор
Посмотрите видеолекцию лучше понять современную периодическую таблицу
youtube.com/embed/7g2lqvYnZLQ?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””> Видеолекция по современной периодической таблице Основные характеристики групп современной периодической таблицыВсего 9 групп, включая группу VIIIA переходных элементов металлов и нулевую группу инертных газов
Группы с I по VII подразделяются на подгруппы A и B. и т. д. Имеют незавершенную внешнюю оболочку, в то время как каждая из их внутренних оболочек завершена. они хорошие металлы.

В таблице Менделеева 7 периодов. давайте обсудим их один за другим.
Период одинПервый период содержит только два элемента: водород и гелий. водород – нормальный элемент, а гелий – инертная пара.
Период 2Второй период содержит 8 элементов. Его называют коротким периодом. Элементы от лития до неона Как указано ниже.
| Ли 3 | Be 4 | B 5 | C 6 | N 7 | O 8 | F 9 | Ne 10 |
Среди этих элементов для двух элементов являются элементы блока S, следующие шесть из элементов блока p, а последний элемент неон принадлежит к блоку P – инертный газ.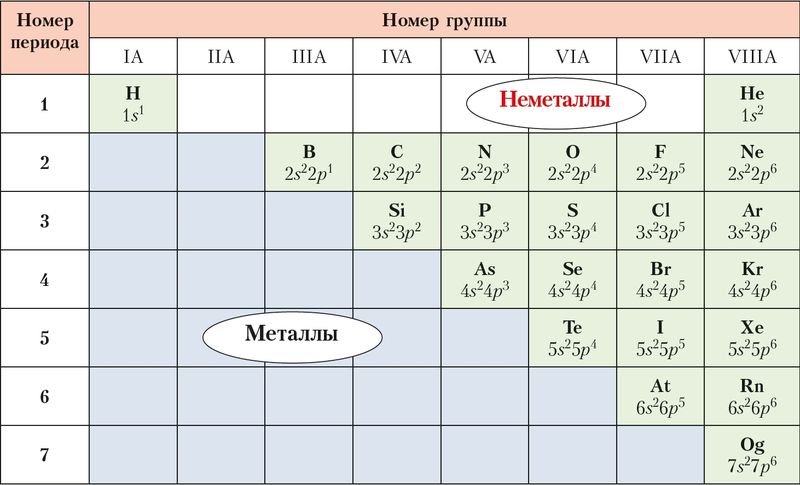 Повтор свойств происходит после 8-го элемента.
Повтор свойств происходит после 8-го элемента.
Этот период также содержит 8 элементов. Его называют коротким периодом. Эти элементы от натрия до аргона.
| Na 11 | Mg 12 | Al 13 | Si 14 | P 15 | S 16 | Cl 17 | Ar 18 |
Первые два элемента относятся к блоку F, следующие 6 элементов относятся к блоку P, а последний элемент — к аргону инертный газ. Повторение происходит после восьми элементов, где литий напоминает натрий, Be с Mg, B с Al и F с Cl. Они также являются подгруппой А.
Период 4 Этот период содержит восемнадцать элементов. Это называется долгим периодом. Элементы от K 19 до Kr 36 .
| К 19 | Ca 20 | Sc 21 | Ti 22 | V 23 | Cr 24 | Mn 25 | Fe 26 | Co 27 |
| Ni 28 | Cu 29 | Zn 30 | Ga 31 | Ge 32 | As 33 | Se 34 | Br 35 | Kr 36 |
Первые два элемента из S-блока. Следующие 10 элементов из d-блока, а следующие шесть элементов из p-блока. Последний элемент Kr относится к нобелевским газам.
Это первый период таблицы Менделеева, который включает элементы d-блока, 3d подоболочка в процессе завершения для элементов d-блока.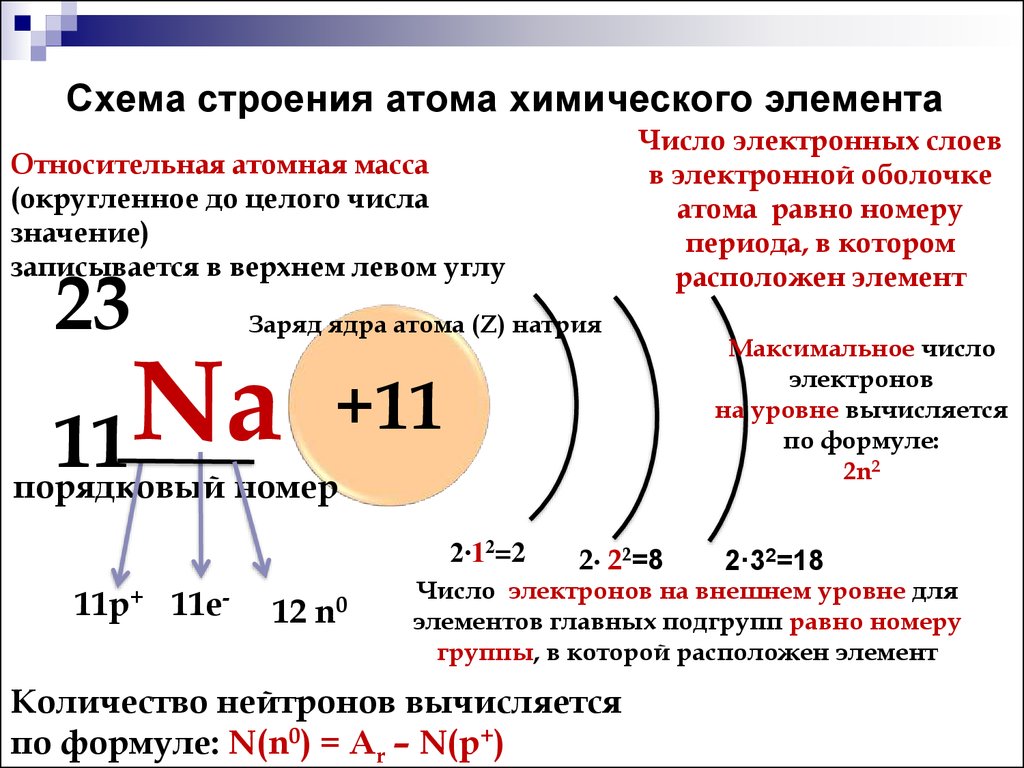 Повтор свойств происходит через 18 элементов. 10 элементов являются переходными элементами и 8 являются репрезентативными.
Повтор свойств происходит через 18 элементов. 10 элементов являются переходными элементами и 8 являются репрезентативными.
Этот период содержит восемнадцать элементов. Это называется вдоль периода. Элементы от Rb 37 до Xe 54 .
| Rb 37 | Sr 38 | Y 39 | Zr 40 | Nb 41 | Mo 42 | TC 43 | Ru 44 | Правая 45 |
| Pd 46 | Ag 47 | Cd 48 | In 49 | Sn 50 | Sb 51 | Te 52 | I 53 | Xe 54 |
Первые два элемента из S-блока. Следующие десять элементов из d-блока, а следующие шесть элементов из p-блока. Оставшийся Xe является нобелевским газом.
Следующие десять элементов из d-блока, а следующие шесть элементов из p-блока. Оставшийся Xe является нобелевским газом.
В этот период также присутствуют элементы d-блока, которые называются переходными элементами. Подоболочка 4d находится в процессе завершения этих элементов d-блока.
Период 6Этот период содержит тридцать два 32 элемента. Его еще называют долгим периодом. Элементы от Cs 55 до Rn 86 .
| Cs 55 | Ba 56 | La 57 | Hf 720079 | Ta 73 | W 74 | Re 75 | Os 76 | Ir 77 |
| Pt 78 | Au 79 | Hg 80 | Tl 81 | Pb 82 | Bi 83 | Po 84 | At 85 | Rn 86 |
Первые два элемента взяты из s-блока. Следующие четырнадцать элементов взяты из f-блока. Следующие 10 элементов взяты из d-блока, а последние шесть — из p-блока. Последний Rn является нобелевским газом.
Следующие четырнадцать элементов взяты из f-блока. Следующие 10 элементов взяты из d-блока, а последние шесть — из p-блока. Последний Rn является нобелевским газом.
14 элементов f-блока называются редкоземельными элементами. Они сразу после Ла 57 . Поэтому их называют лантаноидами. Они варьируются от Ce 58 до Lu 71 . Их 4f-подоболочка находится в процессе достройки или заполнения.
Период 7Это неполный период. В настоящее время он состоит из 24 элементов. Отличие этого периода в том, что все элементы этого периода радиоактивны. Элементы от Fr 87 до элемента с атомным номером 110.
Первые два элемента представляют собой s-блок. Следующие 14 элементов относятся к f-блоку, а следующие восемь элементов — к d-блоку. Нет п-блока и элементов инертных газов.
| Пр 87 | Ра 88 | Ac 89 | unnilquadium104 | unnilpentium 105 | unnilhexium 106 | unnilseptium 107 | unniloctium 108 | unnilennium 109 |
The 14 elements from th от 90 до Lr 103 являются актинидами.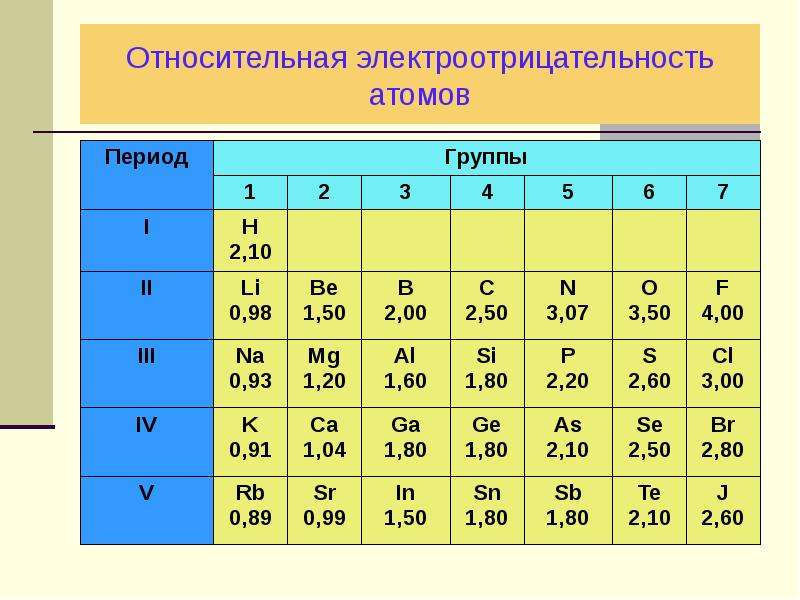 Они идут сразу после Ac 89 , поэтому их называют актинидами. Их подоболочка 5f находится в процессе завершения.
Они идут сразу после Ac 89 , поэтому их называют актинидами. Их подоболочка 5f находится в процессе завершения.
Трансурановые элементы
Элементы после U 92 называются тансурановыми элементами. Они были подготовлены учеными в лабораториях по всему миру. Поэтому их также называют искусственными элементами или синтетическими элементами.
Лантаниды и актиноиды расположены в нижней части периодической таблицы.
Редкоземельные элементы
Лантаниды и актиниды называются редкоземельными элементами, поскольку они редко встречаются на Земле и не встречаются в больших количествах. Таким образом, они, как известно, являются редкоземельными элементами.
Семейства периодической таблицы 1: Щелочные металлы- Элементы группы I-A также называются щелочными металлами.
- У них есть только один электрон на самой внешней s-орбитали.

- Обладают способностью образовывать с водой сильные щелочи.
| Группа I-A | LI 3 | NA 11 | K 19 | RB | 0078 37CS 55 | FR 87 |
| Группа II-A | Be 4 | Mg 12 | Ca 20 | Sr 38 | Ba 56 | Ra 88 |
Элементы этой группы VI-A известны как халькогены. Эти элементы имеют 6 электронов на внешней оболочке. Это электроотрицательные элементы.
Эти элементы имеют 6 электронов на внешней оболочке. Это электроотрицательные элементы.
| Группа VI-A | O 8 | S 16 | Se 34 | Te 52 | Po 84 |
The elements of group VII- А называются галогенами. У них 7 электронов на внешней оболочке. Это электроотрицательные элементы.
| Группа VII-A | F 9 | Класс 17 | BR 35 | I 53 | на 85 |
The Groupi a Groups Antise As Grartie On Antersie As On Sale Arysie On. Ее также называют нулевой группой, потому что эти элементы химически инертны из-за полных внешних оболочек. Элементы этой группы также известны как нобелевские газы.
Элементы этой группы также известны как нобелевские газы.
| Группа VIII-A | Не 2 | Ne 10 | Ar 18 | Kr 36 | Xe 54 | Rn 86 |
Элементы можно разделить на четыре раздела или блока в длинной форме таблицы Менделеева. Для этого деления мы должны принять во внимание крайнюю орбиталь. Их орбиталь не всегда может принадлежать самой внешней оболочке. В современной периодической таблице четыре блока.
(i) s-блок (ii) p-блок
(iii) d-блок (iv) f-блок
Эти блоки были названы на основе самого внешнего электрона, который собирается войти в любой из s, p , d, pr f подоболочка.
Обсудим подробнее…
Элементы групп IA и IIA вместе с газом He входят в s-блок. Их конфигурация валансной оболочки: ns 1 и ns 2 . Здесь n — количество периодов, в которых лежит элемент. Они называются нормальными элементами или репрезентативными элементами.
Их конфигурация валансной оболочки: ns 1 и ns 2 . Здесь n — количество периодов, в которых лежит элемент. Они называются нормальными элементами или репрезентативными элементами.
| I-A | |
| H 1 | II-A |
| Li 3 | B 2 |
| Na 11 | Mg 12 |
| K 19 | Ca2 0 |
| Rb 37 | Sr 38 |
| Cs 55 | BA 56 |
| FR 87 | RA 88 |
 P-элементы в современной периодической таблице Элементы d-блока
P-элементы в современной периодической таблице Элементы d-блока Элементы периодической таблицы, в которых последний электрон входит на d-орбиталь предпоследней оболочки, называются элементами d-блока. предпоследний относится к внутреннему к самому внешнему. Другими словами, последний электрон переходит на (n-1)d-орбиталь. Существует четыре серии элементов D-блока, как показано в следующей таблице.
элементы d-блока в современной таблице Менделеева элементы f-блокаТе элементы периодической таблицы, в которых последний электрон входит на f-орбиталь антипредпоследней оболочки. Антипредпоследний означает внутренний по отношению к предпоследнему. Эти ряды называются лантаноиды и актиноиды. Они присутствуют в шестом и седьмом периодах таблицы Менделеева. Всего в этом f-блоке 28 элементов.
Лантаниды Это четырнадцать элементов от Cs 58 до Lu 71 . Они присутствуют в шестом периоде периодической таблицы. Они размещены под таблицей Менделеева. Их называют лантаноидами, потому что они идут сразу после La57. Их внешняя подоболочка 4 находится в процессе завершения.
Они присутствуют в шестом периоде периодической таблицы. Они размещены под таблицей Менделеева. Их называют лантаноидами, потому что они идут сразу после La57. Их внешняя подоболочка 4 находится в процессе завершения.
| Ce 58 | Pr 59 | Nd 60 | Pm 91 0909 70080 | Sm 62 | Eu 63 | Gd 64 |
| Tb 65 | Dy 66 | Ho 67 | Er 68 | Tm 69 | YB 70 | LU 71 |
.0078 103 . Они присутствуют в седьмом периоде периодической таблицы. Они размещены под таблицей Менделеева. Их называют актинидами, потому что они идут сразу после Ac 89 . Их внешняя подоболочка 5f находится в процессе завершения.
| Th 90 | Pa 91 | U 92 | Np 93 | Pu 94 | Am 95 | Cm 96 |
| Bk 97 | Cf 98 | Es 99 | Fm 100 | Md 101 | No 102 | Lw 103 |
Элементы периодической таблицы можно разделить на категории по-другому. Этот путь основан на способе реактивности этих элементов.
В этой категории есть три типа.
(a) Металлы Элементы группы I-A и II-A являются хорошими металлами. Потому что они имеют большие размеры атомов и слабо прикрепленные внешние электроны. Более того, элементы d- и f-блока также являются металлами по своей природе.
Более того, элементы d- и f-блока также являются металлами по своей природе.
Элементы, которые имеют тенденцию образовывать положительные ионы, теряя электроны, называются металлами.
- Это хорошие проводники тепла.
- Это хорошие проводники электричества.
- Они податливы и пластичны.
- Они образуют основные оксиды и основания с водой.
Неметаллы находятся в верхней правой части периодической таблицы.
Общие свойства неметалловЭлементы, которые имеют тенденцию образовывать отрицательные ионы, приобретая электроны, известны как неметаллы.
- В основном это не очень хорошие проводники тепла и электричества.
- Они образуют кислотные оксиды и дают кислоты при растворении в воде.
Некоторые элементы периодической таблицы, особенно низшие члены групп III-A, IV-A и V-A, обладают свойствами как металлов, так и не- металлы.
- Их способность отдавать и присоединять электроны занимает промежуточное положение между металлами и неметаллами.
- Их электропроводность и теплопроводность также занимают промежуточное положение между металлами и неметаллами.
- Их оксиды амфотерны, что означает, что они могут действовать как кислотные, так и основные оксиды.
Современная периодическая таблица считается действующей версией периодической таблицы.
Сообщите об этом другим
Таблица и электроотрицательность I StudySmarter
Что, если бы, зная положение элемента в таблице Менделеева, вы смогли бы предсказать его свойства?
К счастью для вас, это действительно так. Это потому, что периодическая таблица показывает периодичность . Это означает, что вы найдете определенные тенденции в свойствах элементов, которые повторяются через равные промежутки времени по мере вашего перемещения по таблице. Хотите узнать больше об этих тенденциях? Тогда вы пришли в нужное место!
Хотите узнать больше об этих тенденциях? Тогда вы пришли в нужное место!
- Эта статья о периодических тенденциях в неорганической химии.
- Для начала определим периодичность .
- Затем мы рассмотрим периодические тенденции, когда вы перемещаетесь по периоду периодической таблицы.
- После этого мы будем изучать периодические тенденции по мере продвижения вниз по группе в периодической таблице.
- К концу этой статьи вы должны быть в состоянии описать и объяснить тенденции в электронной конфигурации , атомном радиусе , электроотрицательности , энергии первой ионизации и температурах плавления и кипения . Мы также рассмотрим плотность и электропроводность
Что такое периодические тренды?
Периодическая таблица — замечательная вещь. Версия, которую мы используем сегодня, была создана в 1869 году русским химиком Дмитрием Менделеевым и основана на работах таких ученых, как Джон Ньюлендс. Менделеев упорядочил известные элементы по атомной массе, но заметил, что они проявляют определенные свойства, которые повторяются каждые восемь или около того элементов. Поэтому он также расположил элементы в строках и столбцах, чтобы элементы с одинаковыми свойствами располагались в таблице выше и ниже друг друга. В некоторых случаях свойства не совсем совпадали; здесь Менделеев оставил пробелы в таблице, предполагая, что они будут заполнены неоткрытыми тогда элементами. Его правота была доказана, когда позже были обнаружены эти элементы.
Версия, которую мы используем сегодня, была создана в 1869 году русским химиком Дмитрием Менделеевым и основана на работах таких ученых, как Джон Ньюлендс. Менделеев упорядочил известные элементы по атомной массе, но заметил, что они проявляют определенные свойства, которые повторяются каждые восемь или около того элементов. Поэтому он также расположил элементы в строках и столбцах, чтобы элементы с одинаковыми свойствами располагались в таблице выше и ниже друг друга. В некоторых случаях свойства не совсем совпадали; здесь Менделеев оставил пробелы в таблице, предполагая, что они будут заполнены неоткрытыми тогда элементами. Его правота была доказана, когда позже были обнаружены эти элементы.
Рис. 1 – Таблица Менделеева
В общем, периодическая таблица представляет собой регулярное расположение элементов с атомным номером . Строки называются периодами , а столбцы называются группами . Элементы расположены таким образом, чтобы отображать периодических тренда .
Периодические тренды — это повторяющиеся закономерности, обнаруживаемые в периодической таблице при перемещении по периоду или вниз по группе.
Другое слово, которое вы можете встретить, это периодичность . Периодичность подразумевает повторение через определенный период или промежуток. В случае элементов периодичность означает повторение свойств элементов после определенного промежутка атомного номера. Менделеев заметил периодичность, которая появлялась примерно через каждые восемь элементов, и расположил их соответствующим образом. Давайте теперь посмотрим на некоторые тенденции, которые он заметил, и объясним, почему они возникают.
Мы более подробно рассмотрим структуру периодической таблицы, а также ее историю в периодической таблице 9.0004 .
Тренды периодической таблицы
Как мы видели выше, строки в периодической таблице известны как периода . Столбцы в периодической таблице известны как группы . Всего в периодической таблице семь периодов и восемнадцать групп. Может показаться, что это слишком много, но, как вы увидите, они показывают регулярные периодические тенденции, когда дело доходит до определенных свойств. Сегодня мы рассмотрим следующие свойства:
Всего в периодической таблице семь периодов и восемнадцать групп. Может показаться, что это слишком много, но, как вы увидите, они показывают регулярные периодические тенденции, когда дело доходит до определенных свойств. Сегодня мы рассмотрим следующие свойства:
- Электронная конфигурация
- Атомный радиус
- Электроотрицательность
- Первая энергия ионизации
- Точки плавления и кипения
- Плотность
- Электропроводность
Первая конфигурация электрона вверх.
Периодические тенденции в электронной конфигурации
Что период и группа элемента говорят вам о его электронной конфигурации? К счастью для вас, знание того, где оно находится в периодической таблице, говорит вам, как именно оно устроено. период элемента говорит вам , сколько у него электронных оболочек – например, все элементы периода 2 имеют две электронные оболочки. Группа элемента сообщает вам , сколько электронов у него на внешней оболочке . Например, все элементы группы 3 имеют три электрона на внешней оболочке. Давайте посмотрим, как это меняется в зависимости от периода и группы.
Группа элемента сообщает вам , сколько электронов у него на внешней оболочке . Например, все элементы группы 3 имеют три электрона на внешней оболочке. Давайте посмотрим, как это меняется в зависимости от периода и группы.
Электронная конфигурация за период
Количество электронов увеличивается на один каждый раз, когда вы перемещаетесь по периоду . У каждого элемента ровно на один электрон больше, чем у элемента, находящегося непосредственно слева от него, и ровно на один меньше, чем у элемента справа. Однако все элементы одного и того же периода имеют одинаковое количество электронных оболочек.
Возьмем, к примеру, период 2. Все элементы внутри него имеют только две электронные оболочки. Первый элемент периода, литий, имеет три электрона, а следующий, бериллий, — четыре. Это показано в периодической таблице атомным номером . Атомный номер элемента — это количество его протонов, но в нейтральном атоме он равен количеству его электронов.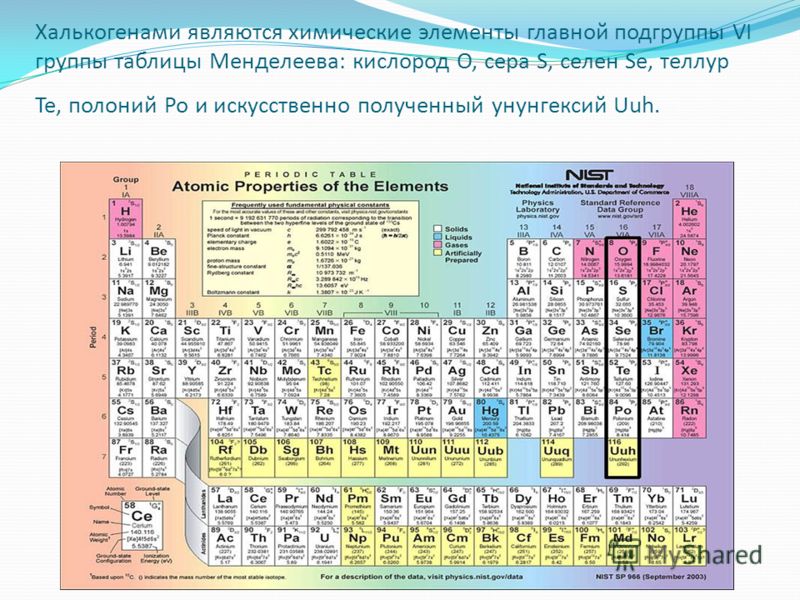 Вы можете видеть на изображении ниже, что атомный номер увеличивается по мере продвижения по периоду.
Вы можете видеть на изображении ниже, что атомный номер увеличивается по мере продвижения по периоду.
Рис. 2. Период 2, показанный с атомным номером вверху слева
Электронная конфигурация вниз по группе
Количество электронных оболочек увеличивается по мере спуска по группе . Однако элементы одной и той же группы имеют абсолютно одинаковое количество электронов на внешней оболочке — разница только в количестве 91 231 внутренних оболочек 91 232 .
Например, все элементы группы 1 имеют только один электрон на внешней оболочке. Но в то время как у водорода всего одна электронная оболочка, у следующего члена — лития — две, а у натрия — три.
Рис. 3. Элементы группы 1, показанные с их электронной конфигурацией в скобках
Тенденция радиуса Периодической таблицы
Радиус атома — это расстояние от центра ядра до самой внешней оболочки, содержащей электроны. Измеряется в пикометрах, пм .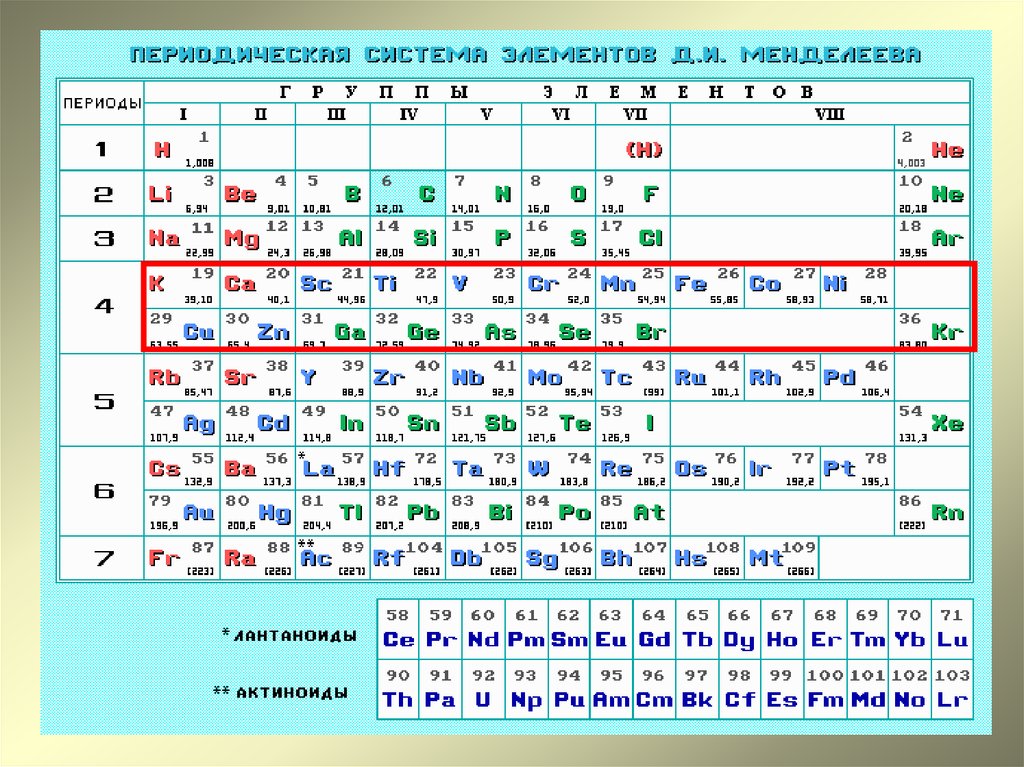
Радиус атома зависит от таких факторов, как заряд ядра и количество электронных оболочек, которые мы сейчас рассмотрим.
Атомный радиус за период
Атомный радиус уменьшается по мере продвижения по периоду периодической таблицы . Но почему это так? Чтобы полностью изучить это, нам нужно взглянуть на атомную структуру элементов в периоде.
В современной периодической таблице элементы расположены по их атомному номеру . Атомный номер — это количество протонов, которые элемент имеет в своем ядре, расположенном в центре атома. Каждый элемент имеет такое же количество протонов, как и электронов, поэтому атомный номер также говорит нам о количестве электронов в элементе. Эти электроны находятся на орбитах ядра в оболочках. Хотя элементы одного и того же периода имеют разное число электронов, они имеют одинаковое количество электронов оболочек . Взгляните на пример ниже. У углерода шесть электронов, а у кислорода восемь. Однако у обоих всего две электронные оболочки.
Однако у обоих всего две электронные оболочки.
Рис. 4 – Электронные конфигурации углерода и кислорода
Электронные оболочки притягиваются к ядру благодаря сильному электростатическому притяжению между положительно заряженным ядром и отрицательно заряженными оболочками. Это определяет атомный радиус.
По мере прохождения периода атомный номер увеличивается — у каждого элемента на один протон и на один электрон больше, чем у предшествующего элемента. Это означает, что заряд ядра увеличивается. Самая внешняя электронная оболочка испытывает более сильное притяжение к положительно заряженному ядру, поэтому отрицательные электроны притягиваются ближе к ядру в центре атома. Это уменьшает атомный радиус.
Рис. 5 – Атомный радиус углерода и кислорода
Атомный радиус вниз по группе
Атомный радиус увеличивается по мере спуска по группе . Вы можете быть удивлены, почему. Когда вы перемещаетесь вниз по таблице Менделеева, атомный номер увеличивается — не означает ли это, что увеличивается и заряд ядра? Но по мере того, как вы спускаетесь по группе, количество электронных оболочек увеличивается, и поэтому внешние электроны находятся в оболочках дальше от ядра. Это увеличивает атомный радиус.
Это увеличивает атомный радиус.
Вот пример. Литий и натрий находятся в группе 1 периодической таблицы. Они оба имеют один электрон на внешней оболочке. Однако натрий имеет больше электронных оболочек, чем литий, и поэтому имеет больший атомный радиус.
Рис. 6 – Электронная конфигурация лития и натрия с указанием атомных радиусов
Периодические тренды электроотрицательности
Теперь давайте посмотрим на тренды электроотрицательности.
Электроотрицательность — это способность атома притягивать общую пару электронов.
Общие пары электронов всегда находятся во внешней оболочке атома. Электроотрицательность связана с силой притяжения между этими связанными электронами и ядром атома. Электроотрицательность зависит от таких факторов, как заряд ядра, количество электронных оболочек и экранирование внутренними электронами.
Электроотрицательность за период
Электроотрицательность увеличивается за период . Мы узнали, что по мере движения по периоду увеличивается не только заряд ядра, но и уменьшается радиус атома. Это приближает связанную пару электронов к ядру. Но мы не можем просто смотреть на общий заряд ядра — нам нужно смотреть на общий заряд ядра, который испытывают связанные электроны благодаря экранированию внутренними электронными оболочками.
Мы узнали, что по мере движения по периоду увеличивается не только заряд ядра, но и уменьшается радиус атома. Это приближает связанную пару электронов к ядру. Но мы не можем просто смотреть на общий заряд ядра — нам нужно смотреть на общий заряд ядра, который испытывают связанные электроны благодаря экранированию внутренними электронными оболочками.
Мы также знаем, что элементы одного и того же периода имеют одинаковое количество электронных оболочек. Это означает, что они имеют одинаковые уровни защиты. Если ядерный заряд увеличивается в течение периода, но экранирование остается прежним, то общий ядерный заряд, ощущаемый связанной парой электронов, должен увеличиваться. Таким образом, электроотрицательность увеличивается.
Давайте снова возьмем углерод и кислород в качестве примера. В ядре углерода шесть протонов. Однако заряд двух из этих протонов экранируется двумя электронами внутренней оболочки. В ядре кислорода восемь протонов. И снова заряд двух протонов экранируется двумя электронами внутренней оболочки.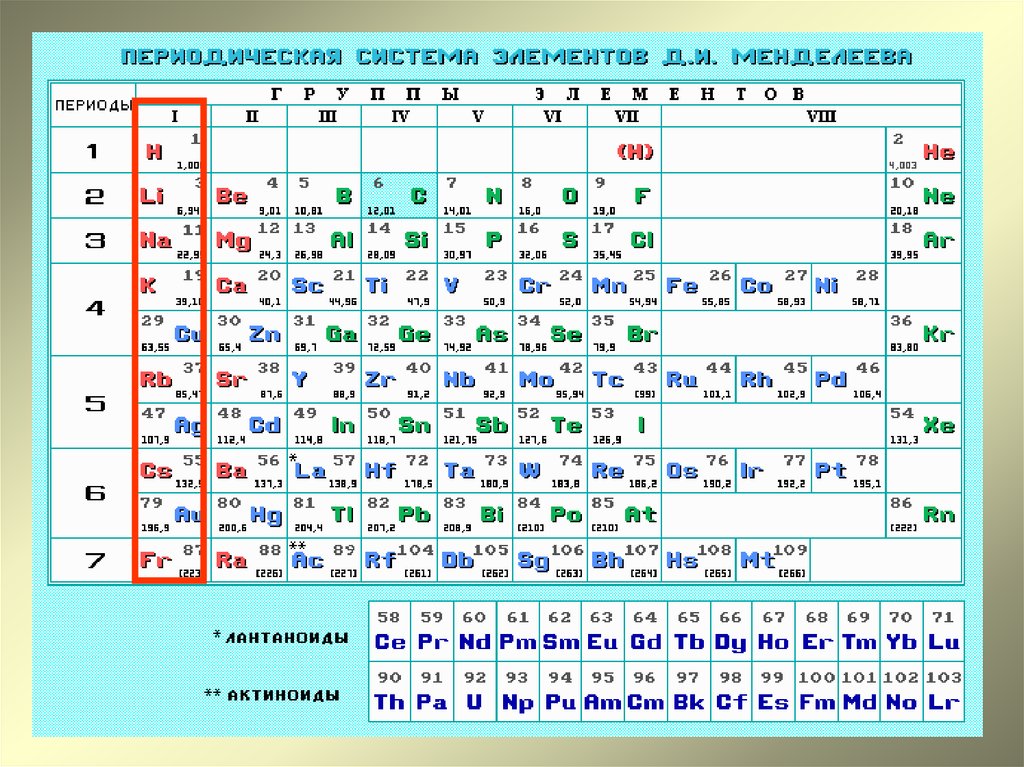 Электроны внешней оболочки в углероде имеют общий эффективный ядерный заряд +4, в то время как электроны в кислороде имеют общий эффективный ядерный заряд +6. Кислород также имеет меньший атомный радиус, чем углерод. Следовательно, он имеет более высокую электроотрицательность.
Электроны внешней оболочки в углероде имеют общий эффективный ядерный заряд +4, в то время как электроны в кислороде имеют общий эффективный ядерный заряд +6. Кислород также имеет меньший атомный радиус, чем углерод. Следовательно, он имеет более высокую электроотрицательность.
Рис. 7 – Как экранирование электронами влияет на электроотрицательность углерода и кислорода
Электроотрицательность вниз по группе
Электроотрицательность уменьшается по группе . Хотя заряд ядра увеличивается, количество внутренних электронных оболочек также увеличивается, и эти внутренние электронные оболочки экранируют заряд дополнительных протонов в ядре. В результате общий ядерный заряд , ощущаемый связанной парой электронов, остается прежним. Но мы также знаем, что атомный радиус увеличивается по мере продвижения вниз по группе, а это означает, что связанная пара электронов находится дальше от ядра. Таким образом, электроотрицательность уменьшается.
Например, ранее мы рассматривали литий и натрий. Литий имеет три протона в ядре, но заряд двух из этих протонов экранирован двумя электронами внутренней оболочки. В ядре натрия одиннадцать протонов, но заряд десяти из этих протонов экранирован десятью электронами внутренней оболочки. Электроны внешней оболочки в обоих элементах имеют общий ядерный заряд +1. Однако натрий имеет больший атомный радиус, чем литий. Следовательно, он имеет более низкую электроотрицательность.
Литий имеет три протона в ядре, но заряд двух из этих протонов экранирован двумя электронами внутренней оболочки. В ядре натрия одиннадцать протонов, но заряд десяти из этих протонов экранирован десятью электронами внутренней оболочки. Электроны внешней оболочки в обоих элементах имеют общий ядерный заряд +1. Однако натрий имеет больший атомный радиус, чем литий. Следовательно, он имеет более низкую электроотрицательность.
Проверьте Электроотрицательность для дальнейшего объяснения.
Рис. 8. Тенденции электроотрицательности в периодической таблице
Периодические тенденции энергии первой ионизации
Как и электроотрицательность, энергия ионизации полностью связана с притяжением между электронами и ядром.
Энергия первой ионизации — это энергия, необходимая для удаления самого внешнего электрона из одного моля атомов газа. Его можно представить уравнением .
Это зависит от таких факторов, как заряд ядра, радиус атома и экранирование внутренними электронными оболочками.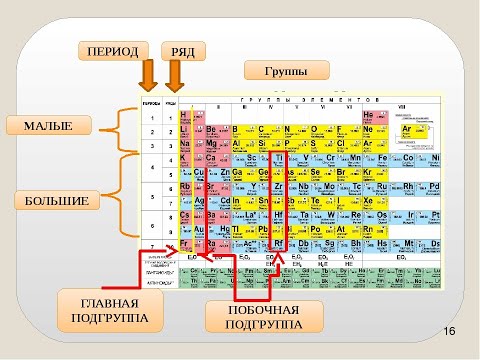
Первая энергия ионизации за период
Энергия ионизации увеличивается за период. Это происходит потому, что заряд ядра увеличивается, а радиус атома уменьшается, но количество внутренних экранирующих электронных оболочек остается прежним. В целом между самым внешним электроном и ядром существует более сильное притяжение, что затрудняет его удаление.
Первая энергия ионизации ниже группы
Энергия ионизации уменьшается вниз по группе. Хотя заряд ядра увеличивается, количество внутренних электронных оболочек также увеличивается. Эти электроны экранируют заряд дополнительных протонов в ядре. Кроме того, атомный радиус увеличивается, а это означает, что самый внешний электрон находится дальше от ядра, и поэтому его легче удалить.
Мы рассмотрим это более подробно в Энергия ионизации . Если вас интересуют два провала на графике ниже, показывающие, что бор и кислород имеют более низкую энергию ионизации, чем ожидалось, посмотрите Тенденции в Энергия ионизации чтобы узнать почему.
Рис. 9. Первые энергии ионизации периода 2
Периодические тренды температур плавления и кипения
Все тренды, которые мы рассматривали до сих пор, демонстрировали четкие закономерности и тренды, увеличиваясь или уменьшаясь по мере продвижения вперед. периода или вниз по группе. Можно сказать, что они показывают периодичность . Однако температуры плавления и кипения не показывают таких четких тенденций.
Температуры плавления и кипения за период
Точки плавления и кипения варьируются в течение периода и зависят от структуры и связи конкретного элемента. В качестве примера возьмем период 3.
Рис. 10 – Точки плавления периода 3
Вы видите, что закономерности нет? Температура плавления повышается и понижается в течение периода. Давайте рассмотрим, почему это так, подробнее.
Во-первых, натрий, магний и алюминий имеют средние температуры плавления . Это потому, что они соединяются с помощью металлической связи, образуя гигантские металлические решетки, удерживаемые вместе электростатическим притяжением. Чтобы расплавить металлы, вам нужно преодолеть эту металлическую связь. Алюминий имеет самую высокую температуру плавления из трех, поскольку он имеет самую сильную металлическую связь. Это связано с тем, что ионы внутри структуры имеют как более высокий заряд, так и меньший атомный радиус, чем ионы внутри натрия и магния: алюминий образует ионы 3+, тогда как натрий и магний образуют ионы 1+ и ионы 2+ соответственно.
Чтобы расплавить металлы, вам нужно преодолеть эту металлическую связь. Алюминий имеет самую высокую температуру плавления из трех, поскольку он имеет самую сильную металлическую связь. Это связано с тем, что ионы внутри структуры имеют как более высокий заряд, так и меньший атомный радиус, чем ионы внутри натрия и магния: алюминий образует ионы 3+, тогда как натрий и магний образуют ионы 1+ и ионы 2+ соответственно.
Во-вторых, кремний имеет высокую температуру плавления . Это потому, что это гигантская ковалентная макромолекула. Все его атомы удерживаются вместе прочными ковалентными связями, для разрыва которых требуется много энергии.
В-третьих, фосфор, сера и хлор имеют низкие температуры плавления . Это потому, что они представляют собой простые ковалентные молекулы. Хотя внутри молекул существуют прочные ковалентные связи , единственными силами между молекулами являются слабые межмолекулярные силы, для разрыва которых не требуется много энергии.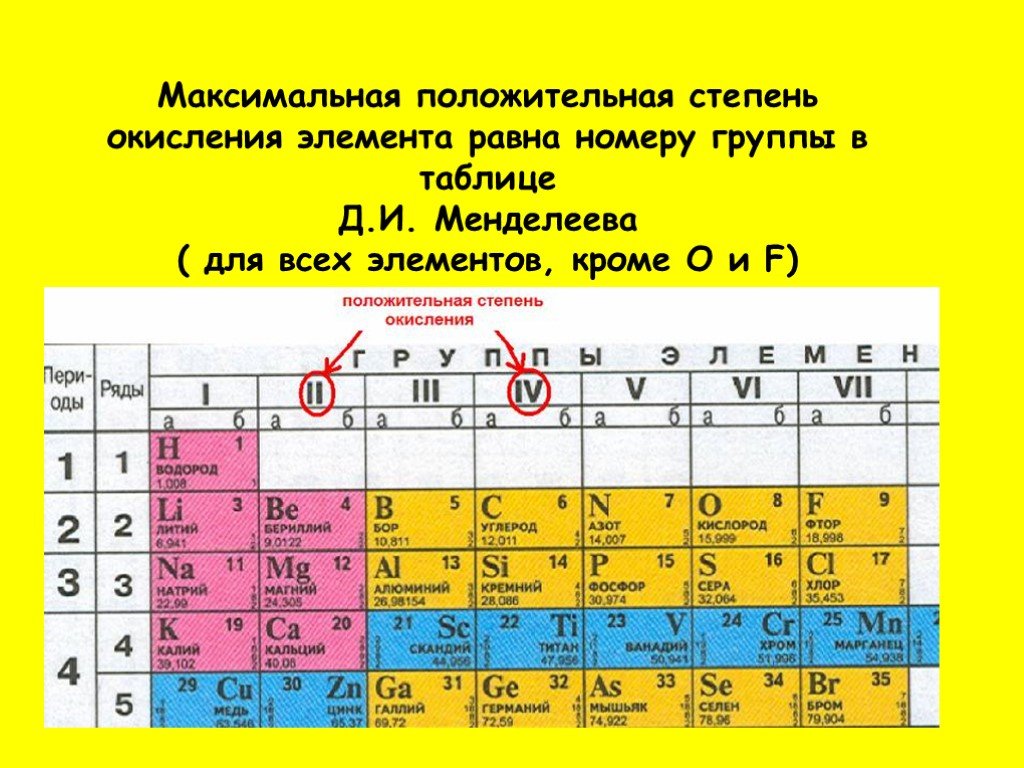 Сера имеет более высокую температуру кипения, чем фосфор и хлор, потому что она образует более крупные молекулы. Это увеличивает силу межмолекулярных сил, обнаруженных между его молекулами.
Сера имеет более высокую температуру кипения, чем фосфор и хлор, потому что она образует более крупные молекулы. Это увеличивает силу межмолекулярных сил, обнаруженных между его молекулами.
Наконец, аргон имеет очень низкую температуру плавления . Это потому, что это одноатомный газ. Он имеет чрезвычайно слабые межмолекулярные силы между атомами, для преодоления которых почти не требуется энергии.
Проверьте Metallic Связывание для получения дополнительной информации и Межмолекулярные силы , чтобы узнать, как размер молекул влияет на силы между молекулами.
Точки плавления и кипения вниз по группе
Точки плавления и кипения также изменяются по мере продвижения вниз по группе. Для некоторых групп, таких как галогены (группа VII), температура плавления увеличивайте по мере продвижения вниз по группе. Но для других групп, таких как щелочные металлы (группа I), точки плавления уменьшаются по мере продвижения вниз по группе. Не существует одной четкой тенденции, которую можно было бы применить ко всем группам — если бы только жизнь была такой простой!
Не существует одной четкой тенденции, которую можно было бы применить ко всем группам — если бы только жизнь была такой простой!
Обзор периодических трендов
Вам нужно знать о множестве различных трендов! Чтобы помочь закрепить ваши знания, мы составили удобную таблицу, в которой обобщены периодические тенденции, которые мы рассмотрели выше.
| Trend | Across a period | Down a group |
| Electron configuration | +1 electron | +1 electron shell |
| Atomic radius | Decreases | Increases |
| Electronegativity | Увеличивается | Уменьшается |
| Первая энергия ионизации | Увеличивается | Уменьшается |
| Температура плавления и кипения | Нет четкой тенденции | Нет четкой тенденции |
В завершение мы углубимся в два других периодических свойства: плотность и электропроводность.
Плотность изначально увеличивается по мере перемещения по периоду периодической таблицы . Однако затем резко падает до , когда вы попадаете в правую часть таблицы. Это связано с тем, что элементы превращаются в газы, и в среднем частицы находятся намного дальше друг от друга. Плотность также увеличивается по мере продвижения вниз по группе. Самый плотный элемент периодической таблицы — осмий, Os.
Рис. 11 – Плотность элементов периодической таблицы
Электрическая проводимость показывает аналогичную тенденцию. Группы I – III , а также элементы d-блока обладают высокой электропроводностью . Это связано с тем, что они связываются с помощью металлической связи и поэтому содержат делокализованные электроны, которые могут свободно двигаться и нести заряд. Напротив, групп IV-VIII, как правило, имеют низкую электропроводность . Это потому, что они связываются с помощью ковалентной связи. Электроны их внешней оболочки образуют часть общей пары электронов и не могут нести заряд.
Электроны их внешней оболочки образуют часть общей пары электронов и не могут нести заряд.
Однако некоторые элементы группы IV удивительно хорошо проводят электричество. Возьмем, к примеру, углерод. Он может образовывать твердое тело, называемое графитом . В графите три из четырех электронов внешней оболочки углерода ковалентно связаны с другими атомами углерода, а четвертый электрон внешней оболочки делокализован. Это означает, что он может свободно перемещаться по веществу и нести заряд. Другие элементы, такие как кремний, являются полупроводниками . Это означает, что они имеют свойства где-то между свойствами проводника и изолятора. Кремний также образует ковалентные связи, но если его достаточно нагреть, некоторые из его электронов могут переместиться в так называемый проводящий слой, оставив после себя электронную дырку. Эти электроны могут свободно перемещаться по всему веществу и нести заряд.
Перейдите на страницу Carbon Structures , чтобы узнать больше о графите.
Периодические тренды — ключевые выводы
- Периодические тренды — это повторяющиеся паттерны, обнаруживаемые в периодической таблице при перемещении по периоду или вниз по группе.
- В периодической таблице строки известны как периоды , а столбцы известны как группы .
- Элементы одного периода имеют одинаковое количество электронных оболочек, но различаются по количеству электронов на внешней оболочке.
- Элементы одной группы имеют одинаковое количество электронов на внешней оболочке, но различаются по количеству электронных оболочек.
- Атомный радиус уменьшается по периоду и увеличивается по группе.
- Электроотрицательность увеличивается по периоду и уменьшается по группе.
- Энергия первой ионизации увеличивается по периоду и уменьшается по группе.
- Температуры плавления и кипения не показывают четкого периодического тренда и зависят от структуры элемента.



