Урок по химии “Периодическая таблица химических элементов. Группы и Периоды” (8 класс)
Разработка урока в 8 классе
По теме : «Периодическая таблица химических элементов. Группы и Периоды.»
Цель урока: закрепить знания об изменении свойств элементов в периодах и группах, формировать и развивать умение пользоваться периодической системой для характеристики химических элементов.
Развивающие задачи: – развивать познавательную активность, умение устанавливать связь между местом элемента в периодической таблице и строением его атома;
– развивать внимание, память, химическую речь, логическое мышление, умение анализировать, сравнивать, делать выводы, самостоятельно добывать знания по теме, работать с компьютером;
– формировать творческую, социальную и информационную компетентность.
Воспитательная цель: воспитывать культуру поведения во время урока, культуру взаимоотношений.
Учащиеся должны знать: – структуру периодической системы;
– технику безопасности работы с компьютером.
Уметь: анализировать информацию, заложенную в периодической системе и использовать её для характеристики химического элемента, составлять схемы строения их атомов, формулы высших оксидов, гидроксидов, определять характер их химических свойств.
Тип урока: повторение усвоенных знаний, усовершенствование умений и навыков.
Метод: проблемно-поисковый.
Формы работы: групповая, парная, решение расчетных задач, работа с учебным диском, беседа, разноуровневая самостоятельная работа.
Оборудование: периодическая система химических элементов Д.И.Менделеева.
План урока
1. Актуализация знаний и умений
2. Повторение пройденного материала
3. Новый материал
4. Обобщение и систематизация знаний
5. Контроль и оценка знаний учащихся
6. Домашнее задание
Домашнее задание
Ход урока
1.Актуализация
Фронтальная беседа:
1. Раскрыть физическую сущность порядкового номера, химического элемента, номера группы, периода.
2. Как изменяются свойства элементов в периодах и группах? Приведите примеры.
3. Чем отличаются между собой электронные конфигурации металлов и неметаллов?
4. Что общего в строении атомов элементов одной подгруппы? Одного периода?
5. Как изменяется радиус атома в периоде, группе? Почему? Приведите примеры.
Химическая игра «Третий лишний», эстафета:
На карточках в вертикальных столбцах написаны формулы элементов, их простых и сложных веществ. Учащиеся вычеркивают ту формулу вещества, которая не принадлежит к данной группе или подгруппе элементов, а также к классу веществ, образованных этими элементами. Учащиеся разделены на команды по 5-6 человек и работают по принципу эстафеты. Побеждает та команда, которая закончит игру.
I группа
1) Li 2)Cl2 3)Mg(OH)2 4)Ne 5)N2
Na Br2 NaOH F O2
Ba H2 KOH Ar S
II группа
1) С 2) Ca 3) S 4)Ca(OH)2 5) F2
P Mg Se Cr(OH)2 O2
Si Cu I Sr(OH)2 Cl2
Ш группа
1)Mg 2)H2SiO3 3) Si 4)Kr 5) H2Se
Cu H3AlO3 B Xe HF
Ag H2CO3 Al Fe H2Te
I группа
1) Li 2)Cl2 3)Mg(OH)2 4)Ne 5)N2
Na Br2 NaOH F O2
Ba H2 KOH Ar S
II группа
1) С 2) Ca 3) S 4)Ca(OH)2 5) F2
P Mg Se Cr(OH)2 O2
Si Cu I Sr(OH)2 Cl2
Ш группа
1)Mg 2)H2SiO3 3) Si 4)Kr 5) H2Se
Cu H3AlO3 B Xe HF
Ag H2CO3 Al Fe H2Te
2. Повторение пройденного материала
Повторение пройденного материала
(индивидуальная работа с предоставленной таблицей)
Мы с вами, ребята, уже достаточно вооружены знаниями о периодическом законе Д.И. Менделеева и теорией о строении атома. Сегодня на уроке мы закрепим наши умения и навыки в использовании периодической системы, а также знания об основных классах неорганических соединений.
Сейчас вы продолжаете работать в парах, учитесь давать характеристику химического элемента самостоятельно по вариантам.
Согласно своему варианту заполните таблицу
I вариант
элемент №11
I вариант элемент №16
I
Название элемента, символ.
II
Положение в периодической системе:
1)порядковый номер;
2)номер периода;
3)номер группы, подгруппы.
III
Строение атома:
1)заряд ядра;
2)количество р, п, е
3)электронная формула;
4)графическая электронная формула внешнего слоя;
5)количество электронов на внешнем слое.
IV
Характер простого вещества (металл или неметалл).Привести пример по одной реакции.
V
Формула высшего оксида, его характер (по одной реакции).
VI
Формула высшего гидроксида, его характер (по одной реакции).
VII
Формула летучего соединения с Гидрогеном.
Согласно своему варианту заполните таблицу
I вариант
элемент №11
I вариант элемент №16
I
Название элемента, символ.
II
Положение в периодической системе:
1)порядковый номер;
2)номер периода;
3)номер группы, подгруппы.
III
Строение атома:
1)заряд ядра;
2)количество эл., нейтр., прот.
3)электронная формула;
4)графическая электронная формула внешнего слоя;
5)количество электронов на внешнем слое.
IV
Характер простого вещества (металл или неметалл).Привести пример по одной реакции.
V
Формула высшего оксида, его характер (по одной реакции).
VI
Формула высшего гидроксида, его характер (по одной реакции).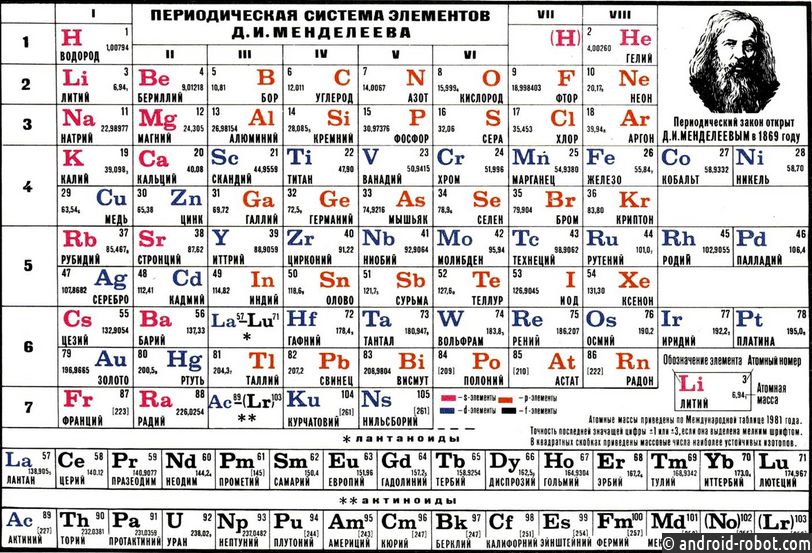
VII
Формула летучего соединения с Гидрогеном.
3. Новый материал
У атомов металлов малых периодов (I—III) на внешнем электронном слое находится от 1 до 3 электронов, а у атомов неметаллов — от 4 до 8. Исключение составляют атомы водорода — 1 электрон
и бора — 3 электрона.
Зная характер изменения радиусов атомов по группам и периодам, а также их электронную структуру, можно объяснить причину изменения металлических и неметаллических свойств атомов элементов, точнее, их простых веществ.
Проявление металлических свойств определяется, прежде всего, способностью атомов данного элемента отдавать электроны с внешнего электронного слоя. Именно наличием у металлов свободных электронов обусловлена их высокая электропроводность.
И наоборот, способность атомов данного элемента присоединять электроны определяет неметаллические свойства его простого вещества.
Усиление металлических свойств щелочных металлов с возрастанием атомного номера элемента связано прежде всего с увеличением радиусов их атомов, т. е. с ростом числа электронных слоев. Электрон на внешнем электронном слое у этих атомов все слабее связан с ядром, поэтому легче отрывается. Одновременно усиливаются основные свойства оксидов и гидроксидов этих элементов, поскольку они определяются металлическими свойствами.
е. с ростом числа электронных слоев. Электрон на внешнем электронном слое у этих атомов все слабее связан с ядром, поэтому легче отрывается. Одновременно усиливаются основные свойства оксидов и гидроксидов этих элементов, поскольку они определяются металлическими свойствами.
В противоположность этому неметаллические свойства элементов группы галогенов ослабевают с увеличением зарядов ядер их атомов, так как растет число электронных слоев. Внешний слой находится все дальше от ядра, поэтому электроны, находящиеся на этом слое, слабее связаны с ядром. Кислотные свойства у оксидов и гидроксидов этих элементов также ослабляются.
Таким образом, в главных группах (группах А) периодической системы с ростом зарядов ядер атомов химических элементов усиливаются металлические свойства их простых веществ и, соответственно, ослабевают неметаллические. Это особенно наглядно проявляется в группе IV (A). В ней свойства простых веществ химических элементов изменяются от неметаллических (у углерода и кремния) к металлическим (у олова и свинца).
Закономерности изменения различных характеристик химических элементов в малых периодах и главных группах периодической системы на примере IVA-группы показаны в таблице ниже.
Номер периода
Символ элемента
Заряд ядра атома
Число электронных слоев
Число электронов на внешнем слое
Валентность в высших оксидах
1
–
–
–
–
–
2
С
6+
2
4
IV
3
Si
14+
3
4
IV
4
Ge
32+
4
4
IV
5
Sn
50+
5
4
IV
6
Pb
82+
6
4
IV
В малых периодах с ростом зарядов ядер атомов увеличивается и число электронов на внешнем слое. Они сильнее притягиваются к ядру, поэтому атомам все труднее отдавать электроны и легче присоединять их. По этой причине в периоде у атомов химических элементов ослабевают металлические и усиливаются неметаллические свойства. Аналогично в периоде с ростом зарядов ядер атомов свойства оксидов и гидроксидов изменяются от основных к кислотным.
Номер периода равен общему числу энергетических уровней, заполняемых электронами, у атомов данного элемента.
В малых периодах и нечётных рядах больших периодов с ростом положительного заряда ядер возрастает число электронов на внешнем энергетическом уровне. С этим связано ослабление металлических и усиление неметаллических свойств элементов слева направо.
Необходимо помнить:
Ядро атома:
занимает большую часть объёма атома
занимает ничтожно малую часть объёма атома
занимает примерно половину объёма атома
не имеет определённых размеров
Химическая активность металлов и неметаллов – простых веществ элементов 2 и 3 периода. Падает металлическая активность, нарастают неметаллические свойства, что связанно с увеличением количества электронов на внешнем энергетическом уровне. Каждый из этих периодов начинается с активного щелочного металла, состоит из 8 элементов, плавно нарастают неметаллические свойства и заканчивается инертным газом.
Рассмотрите таблицу № 6 в учебнике, на странице 188
Какие выводы вы можете сделать применяя эти свойства к элементам 3-го периода натрию, алюминию и сере?
Рассмотрите таблицу № 8 в учебнике, на странице 190
Какие выводы вы можете сделать применяя эти свойства к элементам 3-го периода натрию, алюминию и сере?
4. Обобщение и систематизация знаний
Сегодня на уроке мы закрепили знания об изменении свойств элементов в малых периодах, пользуясь периодической системой для характеристики химических элементов малых периодов.
Ответе на вопросы (фронтальный опрос):
-какие периоды называют «малыми»?почему?
-какими элементами они начинаются и какими заканчиваются?
-как изменяются химические свойства простых в-в этих элементов в периодах?
5. Контроль и оценка знаний учащихся
Решение расчетных задач на нахождение элемента по периодической системе.
Задача 1
Назвать элемент по таким данным: находится в III группе, относительная молекулярная масса высшего оксида 102.
Дано: Решение:
R2O3
Mr(R2O3)=102
Mr(R2O3)=102, Ar(O)=16
2x+16*3=102
2x=102-48
2x=54
x=27 Ответ: Алюминий.
R-?
Задача 2
При взаимодействии 6 г двухвалентного металла с сульфатной кислотой выделилось 5,6 л водорода. Определить металл.
Решение:
6г 5,6 л
X + h3SO4 = XSO4 + h3
n (h3)= n (X) = V/V н.у.= 5,6/22,4 = 0,25 моль
Mr (X)= m/n= 6/ 0,25= 24 г/моль
Металл – Магний
Задача 3
Определите металл, если при разложении 9 г гидроксида металла (II) образуется 7,2 оксида металла (II)
Решение:
9г 7,2
X (OH)2= XO + h3O
n(XO)=n(X(OH)2)=7,2/х+16= 9/х+34
9(х+16)=7,2 (х+34)
9х+144=7,2+244,8
1,8х=100,8
Х=56 Металл – Железо
6. Домашнее задание:
7. Рефлексия.
Периодическая система химических элементов (тест) | Тест (химия, 8 класс) по теме:
Опубликовано 01. 11.2013 – 10:29 – Власенко Мария Владимировна
11.2013 – 10:29 – Власенко Мария Владимировна
Тест для 8-9 лкассов
Скачать:
Предварительный просмотр:
Тест
по теме:
«Строение атома. Периодический закон и периодическая система химических элементов Д.И.Менделеева»
I вариант.
- Верно ли утверждение:
(форма ответа «да» или «нет»)
- Ядро атома химического элемента заряжено отрицательно.
- Сумма числа протонов и нейтронов называется массовым числом атома.
- Электроны заряжены положительно.
- Число протонов в ядре равно числу электронов, вращающихся вокруг ядра.
- Атом любого химического элемента нейтрален.
- В ядре серы 16 протонов.
- Количество нейтронов в ядре равно номеру группы.
- Период – это горизонтальный ряд химических элементов.
- Установите соответствие:
(форма ответа «буква – цифра»)
Химический элемент | Положение химического эл-та в ПСХЭ Д. |
А.литий. Б.медь. В.кальций. Г.железо. Д.марганец. | 1.I группа побочная подгруппа. 2. II группа главная подгруппа 3. VIII группа побочная подгруппа. 4. VII группа побочная подгруппа. 5.I группа главная подгруппа. |
- Составьте и запишите электронную формулу элемента:
натрий.
никель.
- Расшифруйте формулу:
39 19К
32 16S
- Охарактеризуйте химический элемент по его положению в таблице Д.И.Менделеева.
Азот
Тест
по теме:
«Строение атома. Периодический закон и периодическая система химических элементов Д.И.Менделеева»
II вариант.
- Дополните определение:
(форма ответа «цифра – слово»)
- Свойства химических элементов и их соединений находятся в ….. зависимости от величины заряда их атомов.

- Химические элементы, обладающие свойствами металлов и неметаллов называются ……
- ……….. – это вертикальный ряд химических элементов, сходных по строению и свойствам.
- Верно ли утверждение:
(форма ответа «да» или «нет» )
А) Номер химического элемента показывает заряд ядра, количество протонов в ядре и число электронов, вращающихся вокруг ядра.
Б) Нейтроны имеют положительный заряд.
- Выберите верный ответ:
(форма ответа «цифра – буква»)
Протоны заряжены:
А. положительно
Б. отрицательно
В. не имеют заряда
- Составьте и запишите электронную формулу элемента:
фосфор
литий
- Расшифруйте формулу:
4020Са
147Nа
- Рассчитайте и запишите:
Количество протонов в ядре атома меди.
Количество электронов, вращающихся вокруг ядра химического элемента калия.
Количество нейтронов в ядре атома серы.
Количество энергетических уровней у элемента брома.
- Охарактеризуйте элемент по его положению в таблице Менделеева:
элемент № 13.
По теме: методические разработки, презентации и конспекты
«Общая характеристика химических элементов. Периодический закон и периодическая система химических элементов Д.И.Менделеева»
Материал для учителей, работающих по программе О.С.Габриеляна…
Тест по теме: «Строение атома. Периодический закон и периодическая система химических элементов Д.И. Менделеева»
Тест составлен по программе 8 класса Кузнецовой Н.Е., требующий знаний таких тем, как: “Основные законы химии и расчеты на их основе”, “Современные представления о строении атома”, “Периодически…
Разработки уроков для реализации МТО при изучении тем «Важнейшие химические понятия и законы», «Периодический закон и периодическая система химических элементов Д.И.Менделеева на основе учения о строении атома», «Строение вещества» (11 класс).
Представлены методические разработки уроков химии в 11 классе (технология МТО) по следующим темам: «Важнейшие химические понятия и законы» (2 ч), «Периодический закон и п…
Тест по темам: «Строение атома. Периодический закон и Периодическая система химических элементов Д.И. Менделеева»
Представленный тест по темам: «Строение атома. Периодический закон и Периодическая система химических элементов Д.И. Менделеева» можно использовать для контроля или самоконтроля изученного материала.О…
Тест по теме “Периодический закон и периодическая система химических элементов Д.И.Менделеева” 9 класс
Тест составлен в четырех вариантах. Каждый вариант включает две части. Первая часть содержит 14 заданий с выбором ответа (базовый уровень сложности), вторая часть- два задания (В1 и В2) с кратким отве…
Тест по теме: Периодический закон и периодическая система химических элементов Д.И. Менделеева
К каждому из 10 заданий даны 4 варианта ответа, из которых только один правильный. …
…
Проверочный тест по теме: ” Периодический закон и периодическая система химически элементов Д.И. Менделеева”
Тест проверяет знания по теме: ” Периодический закон и периодическая система химически элементов Д.И. Менделеева” в 8 классе к учебнику: О.С Габриелян, И.Г. Остроумов, С.А. Сладков…
Поделиться:
Что такое периоды в периодической таблице? Что понимают под номером периода? Что это означает?
Ответ
Проверено
218,7 тыс.+ просмотров
Подсказка: Чтобы ответить на этот вопрос, мы должны сначала понять некоторые основные понятия о нашей современной периодической таблице. Затем нам нужно оценить его свойства и информацию, связанную с периодами, и записать их очень четко и точно, и только тогда мы сможем сделать правильный ответ.
Полный пошаговый ответ:
Прежде чем мы приступим к решению данного вопроса, давайте сначала разберемся с некоторыми основными сведениями о Периодической таблице:
Периодическая таблица представляет собой табличную форму расположения химических элементов, упорядоченных по атомному номеру, так что периодические свойства элементов (химическая периодичность).
Период: период в периодической таблице представляет собой ряд химических элементов. При таком расположении группы элементов в одном столбце имеют сходные химические и физические свойства, отражающие периодический закон. Все элементы в ряду имеют одинаковое количество электронных оболочек. В периодической таблице семь периодов, каждый из которых начинается в крайнем левом углу.
Периодическое число: также известное как атомный номер или число протонов (символ $Z$) химического элемента — это число протонов, находящихся в ядре каждого атома этого элемента.
Атомный номер однозначно идентифицирует химический элемент. Он идентичен зарядовому числу ядра. В незаряженном атоме атомный номер также равен числу электронов. Атомы с одинаковым атомным номером, но разным числом нейтронов и, следовательно, разными массовыми числами, известны как изотопы.
Примечание: Современная квантовая механика объясняет эти периодические изменения свойств с точки зрения электронных оболочек. По мере увеличения атомного номера оболочки заполняются электронами примерно в порядке, показанном на диаграмме правил упорядочения. Наполнение каждой оболочки соответствует строке в таблице.
По мере увеличения атомного номера оболочки заполняются электронами примерно в порядке, показанном на диаграмме правил упорядочения. Наполнение каждой оболочки соответствует строке в таблице.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класса 12 химии JEE_Main
Какой элемент обладает наибольшим радиусом атомов А класса 11 химии JEE_Main
Получен фосфин из следующей руды Кальций класса 12 химии JEE_Main
В Индии по случаю бракосочетания фейерверк класса 12 химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы класс 12 химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класса 12 химии JEE_Main
Какой элемент обладает наибольшим радиусом атомов А класса 11 химии JEE_Main
Получен фосфин из следующей руды A Кальций класс 12 химия JEE_Main
Тенденции сомнения
a Какие периоды и группы в периодической таблице Дайте две характеристики каждого b В терминах.
 ..
..Перейти к
- Упражнение
- Глава 1 Химические реакции и уравнения
- Глава 2 Кислоты, основания и соли
- Глава 3 Металлы и неметаллы
- Глава 4 Углерод и его соединения
- Глава 5 Периодическая классификация элементов
Главная > Лахмир Сингх Солюшнс Класс 10 Химия > Глава 5 – Глава 5 Периодическая классификация элементов > Упражнение > Вопрос 86
Вопрос 86 Упражнение
(а) Какие периоды и группы в периодической таблице? Назовите две характеристики каждого из них.
(b) С точки зрения электронных конфигураций объясните изменение размеров атомов элементов, принадлежащих к одному и тому же периоду и одной группе.
(c) Данный рядом является частью таблицы Менделеева. Двигаясь вертикально вниз от
Li к Fr:
| Ли | Быть |
| Нет данных | |
| К | |
| Руб | |
| Цз | |
| Пт | Ра |
(i) Что происходит с размером атомов?
(ii) Что происходит с их металлическими свойствами?
(d) Назовите два свойства элементов, величины которых изменяются при переходе сверху вниз в группе периодической таблицы. Каким образом они меняются?
Каким образом они меняются?
(e) Перепишите следующее утверждение после исправления, если это необходимо:
Группы состоят из элементов с последовательными атомными номерами.
Ответ:
(а) Горизонтальные ряды элементов периодической таблицы называются периодами.
Характеристики:
(i) Элементы в периоде имеют последовательные атомные номера.
(ii) №. элементов в период фиксируется максимальным числом. электронов, которые могут быть размещены на различных оболочках.
Вертикальные столбцы периодической таблицы называются группами.
Характеристики:
(i) Элементы в группе не имеют последовательных атомных номеров.
(ii) Все элементы в группе имеют сходные электронные конфигурации и проявляют схожие свойства.
(б) Размер атома увеличивается при движении сверху вниз в одной и той же группе за счет сложения оболочек на каждом шаге.
В период размер атома уменьшается в течение периода, потому что атомный номер увеличивается. Поэтому количество электронов и протонов увеличивается, заряд ядер увеличивается, и электроны будут удерживаться еще крепче.
Поэтому количество электронов и протонов увеличивается, заряд ядер увеличивается, и электроны будут удерживаться еще крепче.
(c)(i) Размер атома увеличивается.
(ii) Металлический характер также усиливается.
(d) При движении вниз по группе размер атома и металлический характер увеличиваются. По мере продвижения сверху вниз размер атома увеличивается от лития до франция.
В щелочных металлах группы 1 литий является наименее металлическим элементом, тогда как франций является наиболее металлическим элементом
Связанные вопросы
**(б) Как определялись позиции кобальта и никеля в современной периодической таблице?**
**(а) Как определялось положение изотопов элемента в современной периодической таблице?**
**(b) Каково значение атомного номера в современной классификации элементов? Объясни с.

 И.Менделеева
И.Менделеева