ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ • Большая российская энциклопедия
ПЕРИОДИ́ЧЕСКАЯ СИСТЕ́МА ХИМИ́ЧЕСКИХ ЭЛЕМЕ́НТОВ, упорядоченное множество химич. элементов и их естеств. классификация. Является табличным представлением периодического закона, открытого Д. И. Менделеевым. Прообразом П. с. х. э. служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленная Менделеевым в 1869 (рис. 1). По мере совершенствования этой таблицы Менделеев развил представления о периодах и группах элементов и о месте каждого элемента в системе. К 1871 в кн. «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классич. короткая форма П. с. х. э. Опираясь на неё, Менделеев выполнил впоследствии оправдавшийся прогноз существования и свойств неизвестных в то время элементов (Ga, Sc, Ge).
Рис. 1. Таблица, составленная Д. И. Менделеевым 1. 3.1869.
Физич. смысл периодичности в свойствах элементов стал ясен после появления планетарной модели атома (Э. Резерфорд, 1911) и было показано (нидерл. физик А. ван ден Брук и Г. Мозли, 1913–14), что порядковый номер элемента в П. с. х. э. равен положительному заряду (Z) ядра атома. Теория П. с. х. э. в осн. создана Н. Бором (1913–21) на базе квантовой модели атома. Бор разработал схему построения электронных конфигураций атомов по мере возрастания Z, опирающуюся на определённую последовательность заполнения электронами оболочек и подоболочек в атомах с ростом числа Z.
Совр. П. с. х. э. включает более ста химич. элементов. Наиболее тяжёлые элементы получены ядерным синтезом. Порядок заполнения электронами уровней в атомах определяется правилами, совокупность которых называют «принципом построения»: заполнение атомных орбиталей (АО) происходит в порядке увеличения энергии орбиталей: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 6d и т.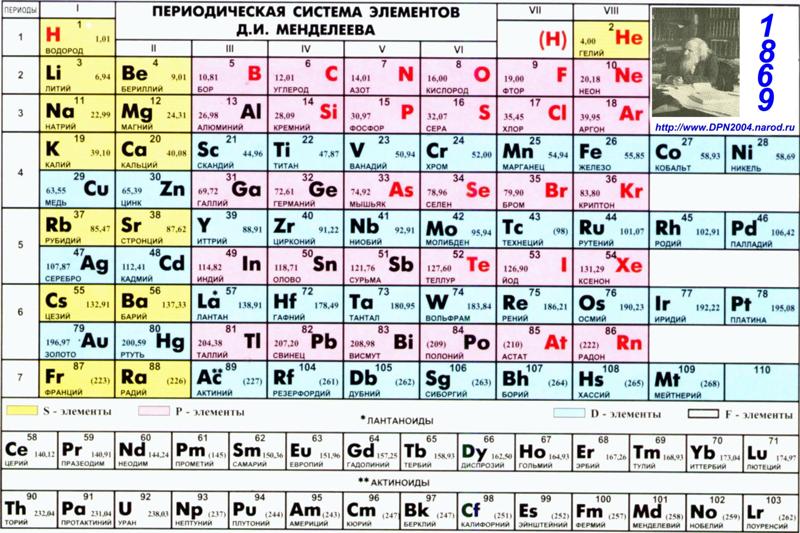 д.; согласно Паули принципу, каждая АО (характеризуется квантовыми числами n, l, m) может содержать не более 2 электронов; АО с одинаковыми l и n заполняются так, чтобы суммарный спин электронов был максимален (т. е. заполняется макс. число АО с разными m по Хунда правилу).
д.; согласно Паули принципу, каждая АО (характеризуется квантовыми числами n, l, m) может содержать не более 2 электронов; АО с одинаковыми l и n заполняются так, чтобы суммарный спин электронов был максимален (т. е. заполняется макс. число АО с разными m по Хунда правилу).
Рис. 2. Короткий вариант периодической системы химических элементов Д. И. Менделеева (в соответствии с данными ИЮПАК на 1973).
Согласно (n+l)-правилу Клечковского, построение электронных конфигураций гл. обр. происходит в соответствии с последовательным увеличением суммы (n+l). При этом в пределах каждой такой суммы сначала заполняются подоболочки с бóльшими l и меньшими n, затем с меньшими l и бóльшими n.
Опубликовано св. 500 вариантов П. с. х. э., что связано с попытками поиска решения некоторых частных проблем её структуры. Наиболее распространены две табличные формы П.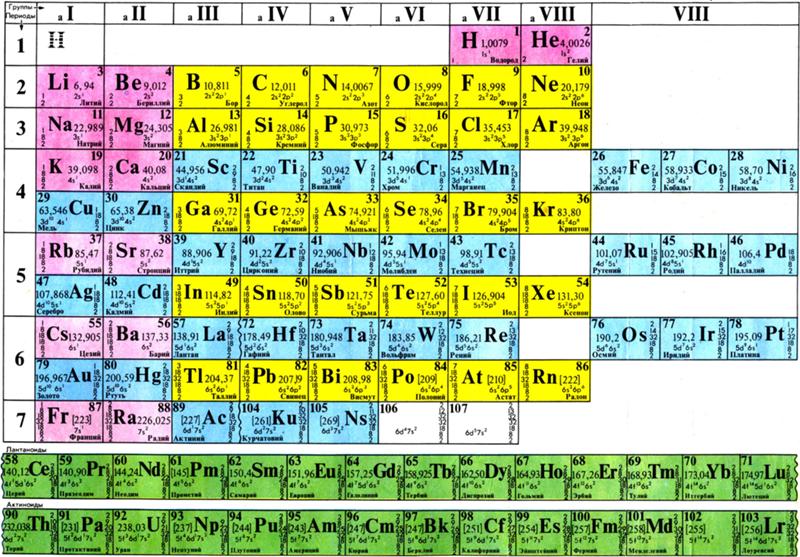 с. х. э.: короткая (рис. 2) и длинная (разрабатывалась Д. И. Менделеевым, усовершенствована в 1905 А. Вернером; рис. 3). В структуре П. с. х. э. выделяют периоды (горизонтальные ряды) и группы (вертикальные столбцы) элементов.
с. х. э.: короткая (рис. 2) и длинная (разрабатывалась Д. И. Менделеевым, усовершенствована в 1905 А. Вернером; рис. 3). В структуре П. с. х. э. выделяют периоды (горизонтальные ряды) и группы (вертикальные столбцы) элементов.
Рис. 3. Длинная форма периодической системы химических элементов (в соответствии с данными ИЮПАК на 2013).
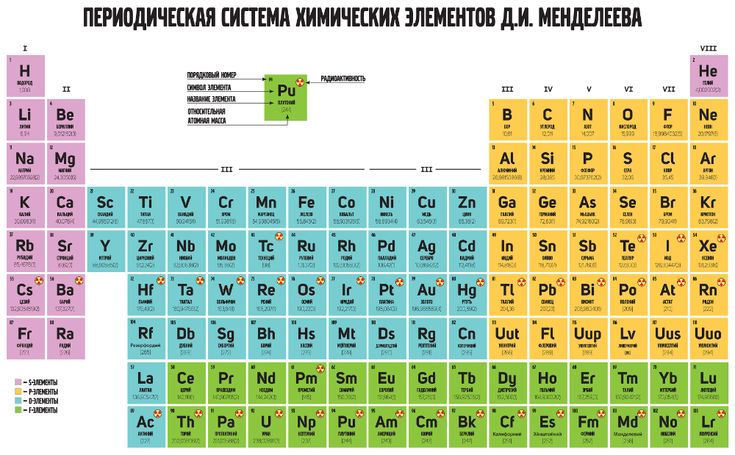
Совр. форма П. с. х. э. (в 1989 ИЮПАК рекомендована длинная форма П. с. х. э.) состоит из 7 периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма П. с. х. э. – из 8 групп. Число элементов в периодах, начиная со второго, попарно повторяется: 8, 8, 18, 18, 32, 32,… (первый период содержит два элемента). Номер группы элементов короткого варианта П.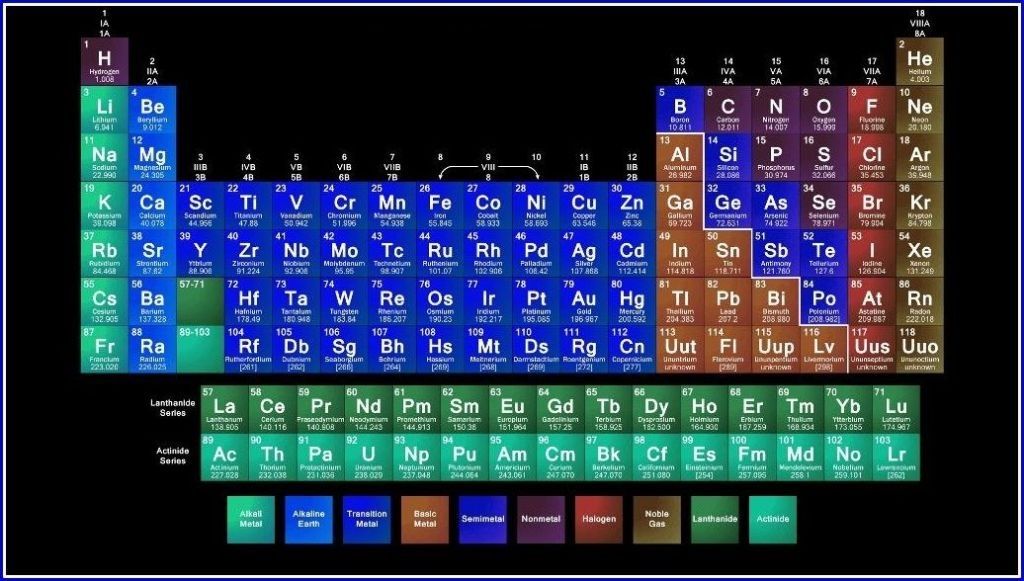 с. х. э. соответствует числу валентных электронов во внешней электронной оболочке атомов. В длиннопериодном варианте П. с. х. э. номер группы в бoльшей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химич. свойствам, их атомы характеризуются одинаковым строением внешних электронных оболочек. Элементы некоторых групп имеют собств. тривиальные названия: щелочные металлы (группа 1 длинной формы П. с. х. э.), щёлочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В П. с. х. э. для каждого элемента указывается его символ, название, порядковый номер и значение относит. атомной массы.
с. х. э. соответствует числу валентных электронов во внешней электронной оболочке атомов. В длиннопериодном варианте П. с. х. э. номер группы в бoльшей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химич. свойствам, их атомы характеризуются одинаковым строением внешних электронных оболочек. Элементы некоторых групп имеют собств. тривиальные названия: щелочные металлы (группа 1 длинной формы П. с. х. э.), щёлочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В П. с. х. э. для каждого элемента указывается его символ, название, порядковый номер и значение относит. атомной массы.
Первый период содержит два элемента – Н и Не. Водород имеет некоторое сходство как со щелочными элементами, так и с галогенами. В связи с этим символ Н помещают либо в подгруппу Iа, либо в подгруппу VIIa короткого варианта П. с. х. э., либо в обе одновременно.
В связи с этим символ Н помещают либо в подгруппу Iа, либо в подгруппу VIIa короткого варианта П. с. х. э., либо в обе одновременно.
Второй и третий периоды (Li – Ne; Na – Ar) содержат по 8 элементов, причём характер изменения химич. свойств вертикальных аналогов во многом близок. Элементы первых трёх периодов относятся к гл. подгруппам короткого варианта периодич. системы химич. элементов.
Элементы групп 1 и 2 длинной формы называются s-элементами, групп 13–18 – p-элементами, групп 3–12 – d-элементами; d-элементы (за исключением цинка, кадмия и ртути) называют также переходными элементами.
Четвёртый период (K–Kr) содержит 18 элементов. После K и Са (s-элементы) следует ряд из десяти (Sc – Zn) 3d-элементов (побочные подгруппы короткого варианта П. с. х. э.). Переходные элементы проявляют высшие степени окисления, в осн. равные номеру группы короткого варианта П. с. х. э. (исключая Co, Ni и Cu). Элементы от Ga до Kr относятся к гл. подгруппам (р-элементы).
с. х. э. (исключая Co, Ni и Cu). Элементы от Ga до Kr относятся к гл. подгруппам (р-элементы).
Пятый период (Rb – Xe) построен аналогично четвёртому; в нём также имеется «вставка» из десяти переходных 4d-элементов (Y – Cd). Особенности изменения свойств в этом периоде: в триаде Ru – Rh – Pd рутений проявляет макс. степень окисления +8, родий +6, палладий +5; все элементы гл. подгрупп, включая Хе, проявляют высшие степени окисления, равные номеру группы.
Шестой период (Сs – Rn) содержит 32 элемента. В него, помимо десяти 5d-элементов (La, Hf – Hg), входит семейство из четырнадцати 4f-элементов – лантаноидов (лантанидов, Ln). В степени окисления +3, +4 они являются химич. аналогами актиноидов, в степени окисления +2 – щёлочноземельных элементов. Лантаноиды размещены в группе 3 длинной формы, клетка La, и для удобства вынесены под таблицу.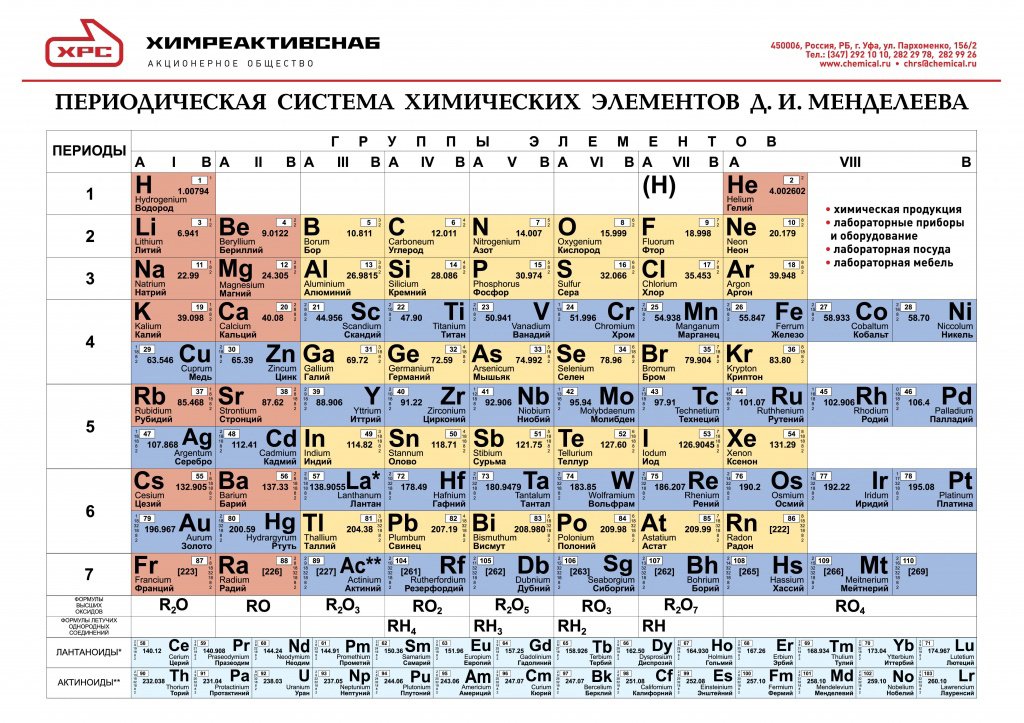 Особенностью элементов шестого периода является то, что в триаде Os – Ir – Pt два элемента – осмий и иридий – проявляют степень окисления +8, платина +6 (для Ir – данные 2010).
Особенностью элементов шестого периода является то, что в триаде Os – Ir – Pt два элемента – осмий и иридий – проявляют степень окисления +8, платина +6 (для Ir – данные 2010).
Седьмой период, подобно шестому, содержит 32 элемента. Актиний – аналог лантана. После Ас следует семейство из четырнадцати 5f-элементов – актиноидов (актинидов, An) (Z= 90–103). В П. с. х. э. их размещают в клетке Ас и, подобно Ln, записывают отд. строкой под таблицей. Этот приём предполагает наличие существенного химич. сходства элементов двух f-семейств. Именно на этом основывалась «актинидная концепция» Г. Сиборга (1944), сыгравшая ведущую роль при разработке методов разделения продуктов деления урана и поиске новых элементов. Однако эта концепция справедлива лишь для трёх- и четырёхвалентных An. Актиноиды же проявляют степени окисления от +2 до +7 (последняя характерна для Np, Pu, Am) и +8 (для плутония). Для наиболее тяжёлых An характерна стабилизация низших степеней окисления (+2 или даже +1 для Md).
Для наиболее тяжёлых An характерна стабилизация низших степеней окисления (+2 или даже +1 для Md).
Эксперим. оценки химии элементов с Z=104 (резерфордий) и Z=105 (дубний) позволили заключить, что они являются аналогами соответственно Hf и Та, т. е. 6d-элементами (должны располагаться в IVб и Vб подгруппах короткой формы). Химич. идентификация элементов с Z=106–118 не проводилась из-за слишком коротких «времён жизни» синтезированных изотопов, но в соответствии со структурой П. с. х. э. можно считать, что элементы Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn относятся к 6d-элементам, элементы c Z=113–118 близки соответственно вертикальным аналогам. Это же следует из совр. квантовохимич. расчётов.
П. с. х. э. является важным звеном эволюции атомно-молекулярного учения, способствует уточнению представлений о простых веществах и соединениях, оказала значит. влияние на разработку теории строения атомов. С П. с. х. э. связана постановка проблемы прогнозирования в химии, что проявилось в предсказании как существования неизвестных элементов и их свойств, так и особенностей химич. поведения известных элементов. П. с. х. э. – основа неорганич. химии; служит задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, в частности сверхпроводников и полупроводников, подбору специфич. катализаторов для разл. химич. процессов и др. П. с. х. э. – науч. база преподавания общей и неорганич. химии, а также некоторых разделов атомной физики.
влияние на разработку теории строения атомов. С П. с. х. э. связана постановка проблемы прогнозирования в химии, что проявилось в предсказании как существования неизвестных элементов и их свойств, так и особенностей химич. поведения известных элементов. П. с. х. э. – основа неорганич. химии; служит задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, в частности сверхпроводников и полупроводников, подбору специфич. катализаторов для разл. химич. процессов и др. П. с. х. э. – науч. база преподавания общей и неорганич. химии, а также некоторых разделов атомной физики.
распечатать периодическую таблицу в хорошем качестве для ЕГЭ
Мы живем в мире химических элементов, которые окружают нас на каждом шагу. Да и наш собственный организм состоит из них. Вот почему так важно знать эти элементы и то, как они связаны между собой.
Периодическая таблица Менделеева явилась величайшим открытием в химии потому, что она доказала единство всех химических элементов и установила периодическую зависимость между ними. Дмитрий Иванович Менделеев на основе своей таблицы смог предсказать существование новых химических элементов, которые и были открыты впоследствии.
Дмитрий Иванович Менделеев на основе своей таблицы смог предсказать существование новых химических элементов, которые и были открыты впоследствии.
Что такое таблица Менделеева
Периодическая система элементов Д. И. Менделеева представляет собой классификацию химических элементов, в которой устанавливается зависимость между зарядом атомного ядра и свойствами элементов. Этот периодический закон имеет графическое изображение – ту самую таблицу, названную именем своего создателя, великого ученого Менделеева.
Периодическая система химических элементов Д.И. МенделееваРаспечатанную таблицу Менделеева можно использовать как шпаргалку при подготовке к контрольным работам и ЕГЭ.
История открытия периодического закона Менделеевым
Активные попытки создания системы химических элементов предпринимались в середине ХIХ века. В это время уже были открыты 63 элемента, поэтому многих ученых интересовал поиск закономерности в их строении и свойствах. Периодическую систему пытались создать такие западные ученые, как И. Деберейнер, А. Э. Шанкуртуа, Д. А. Ньюлендс. Ближе всех к решению этой проблемы подошел Ю. Л. Мейер, который в дальнейшем претендовал на независимое от Менделеева открытие периодической таблицы. Однако его таблица не основывалась на периодическом законе и не позволяла предсказывать неизвестные еще химические элементы и их свойства. Поэтому честь открытия периодической таблицы по праву принадлежит Дмитрию Ивановичу Менделееву.
Деберейнер, А. Э. Шанкуртуа, Д. А. Ньюлендс. Ближе всех к решению этой проблемы подошел Ю. Л. Мейер, который в дальнейшем претендовал на независимое от Менделеева открытие периодической таблицы. Однако его таблица не основывалась на периодическом законе и не позволяла предсказывать неизвестные еще химические элементы и их свойства. Поэтому честь открытия периодической таблицы по праву принадлежит Дмитрию Ивановичу Менделееву.
Существует легенда, что свое открытие периодического закона Д. И. Менделеев сделал во сне. Якобы ему приснилась вся таблица целиком, и наутро ему осталось только зарисовать ее. По поводу этой легенды сам Дмитрий Иванович заявлял, что работал над таблицей в течение 20 лет. «А вы думаете: сидел и вдруг… готово», – писал он.
Свои научные изыскания великий русский химик проводил следующим образом. Он на отдельных карточках написал названия всех известных в то время элементов и их основные свойства. После этого он стал раскладывать карточки, пытаясь найти периодическую закономерность между этими элементами. Такой «химический пасьянс» требовал больших знаний, наблюдательности и кропотливого труда. В 1869 году был завершен первый вариант Периодической системы элементов. В 1871 году Д. И. Менделеев сформулировал периодический закон и создал второй вариант таблицы, усовершенствованный.
Такой «химический пасьянс» требовал больших знаний, наблюдательности и кропотливого труда. В 1869 году был завершен первый вариант Периодической системы элементов. В 1871 году Д. И. Менделеев сформулировал периодический закон и создал второй вариант таблицы, усовершенствованный.
Группы и периоды Периодической системы
Группа Периодической системы химических элементов – это последовательность элементов в таблице Менделеева, расположенных по возрастанию заряда ядра атома и обладающих сходными свойствами. Номер группы зависит от количества электронов на внешней оболочке атома.
В настоящее время в таблице выделяют следующие группы: 1 – щелочные металлы, 2 – щелочноземельные металлы, 3 – подгруппа скандия, 4 – подгруппа титана, 5 – подгруппа ванадия, 6 – подгруппа хрома, 7 – подгруппа марганца, 8 – подгруппа железа, 9 – подгруппа кобальта, 10 – подгруппа никеля, 11 – подгруппа меди, 12 – подгруппа цинка, 13 – подгруппа бора, 14 – подгруппа углерода, 15 – подгруппа азота, 16 – подгруппа кислорода, 17 – галогены, 18 – инертные газы.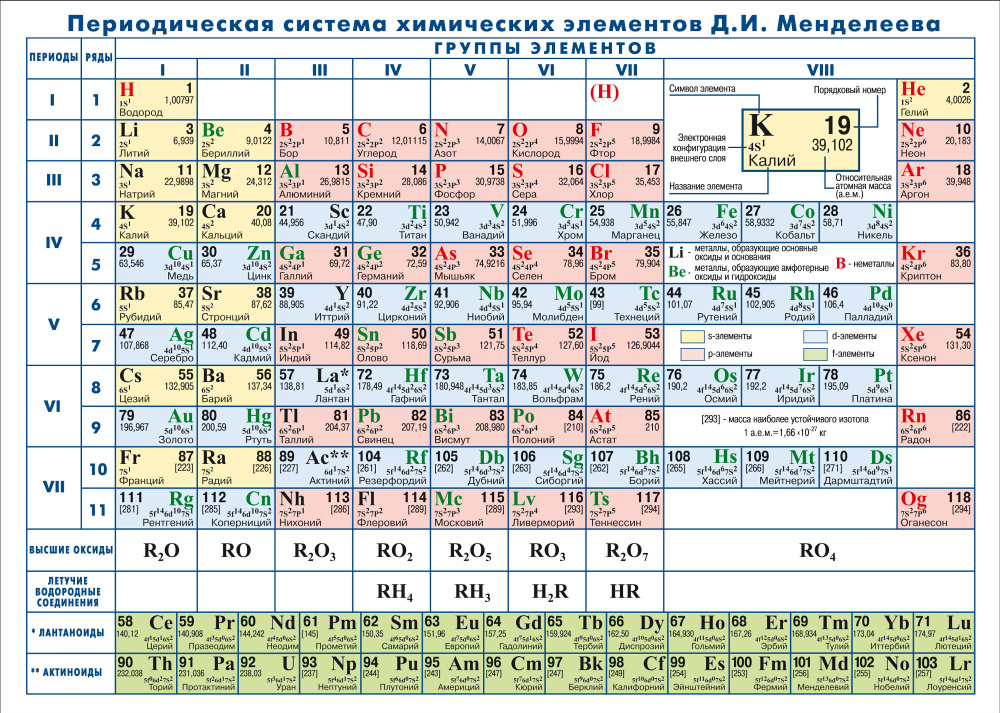
Период – это строка в Периодической таблице, где химические элементы расположены по возрастанию заряда ядра и заполнения электронами внешней электронной оболочки.
Элементы сгруппированы в 7 периодов. К малым периодам относятся первый (содержит 3 элемента), второй и третий (имеющие по 8 элементов). Остальные 4 периода называются большими и содержат по 18 и более элементов. Каждый период, кроме первого, начинается с металла и заканчивается благородным газом.
Расшифровка обозначений в таблице химических элементовСвойства элементов таблицы Менделеева
Периодический закон Д. И. Менделеева гласит: «Свойства химических элементов находятся в периодической зависимости от заряда ядра атома». Исходя из этого закона элементы и расположены в периодической таблице. У атомов элементов одной группы сходное строение внешней электронной оболочки. Поэтому они обладают похожими химическими свойствами. У атомов элементов одного периода одинаковое число энергетических уровней.
Свойства элементов в периодах слева направо изменяются следующим образом: увеличивается заряд ядер атомов, количество электронов на внешнем уровне, степень окисления и электроотрицательность; уменьшается радиус атомов и металлические свойства.
В группе сверху вниз происходят такие изменения свойств элементов: увеличивается заряд ядер атомов, радиус атомов, число электронных слоев, металличность; уменьшается электроотрицательность и прочность связи электронов внешнего уровня с ядром.
это интересно
Валентность
Что это такое, как ее определить и какова ее роль в химии. А также выясним, чем валентность отличается от степени окисления
подробнее
Популярные вопросы и ответы
Отвечает Анастасия Чистякова, старший методист по естественно-научному направлению Домашней школы «ИнтернетУрок».
Сколько элементов в таблице Менделеева?
В настоящее время Периодическая таблица Менделеева содержит 118 химических элементов. Если учесть, что первоначальный вариант таблицы включал всего 63 элемента, то прогресс науки налицо. За последние полвека были открыты 17 новых элементов с порядковыми номерами от 102 до 118. Из них российские ученые открыли девять химических элементов.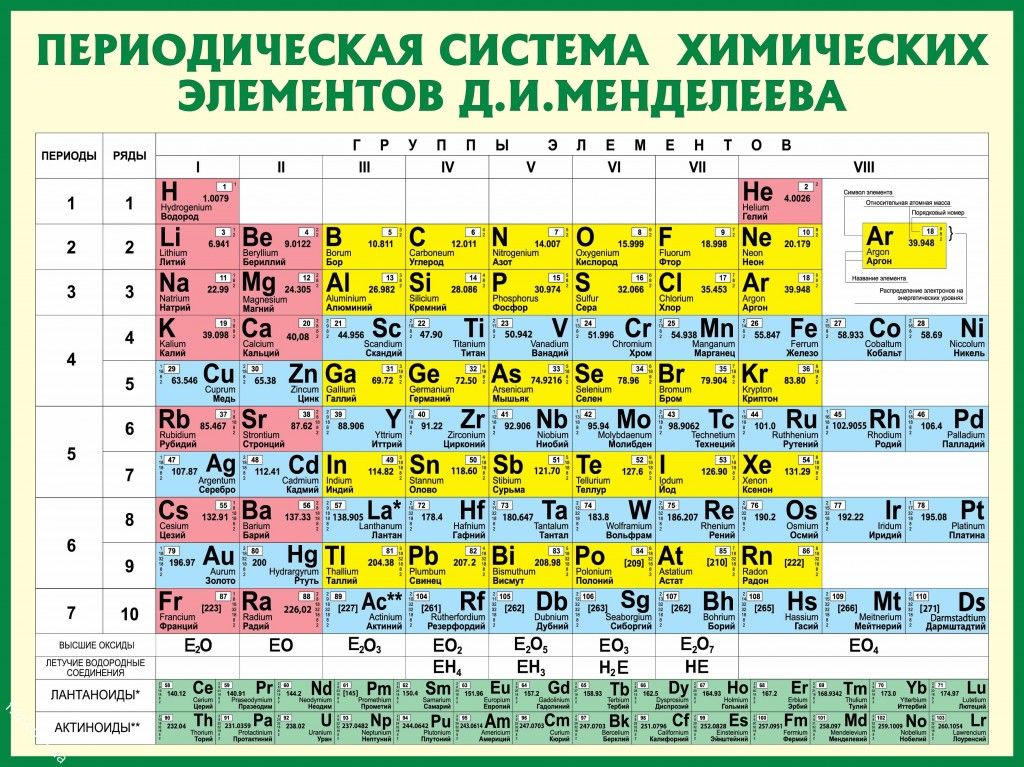 Таким образом, оказался полностью завершенным седьмой ряд Периодической таблицы Менделеева. Сейчас ведутся работы над синтезом 119 и 120 химических элементов. В России этой проблемой занимаются в Объединенном институте ядерных исследований в городе Дубна. Когда эти элементы будут синтезированы, они положат начало восьмому периоду таблицы.
Таким образом, оказался полностью завершенным седьмой ряд Периодической таблицы Менделеева. Сейчас ведутся работы над синтезом 119 и 120 химических элементов. В России этой проблемой занимаются в Объединенном институте ядерных исследований в городе Дубна. Когда эти элементы будут синтезированы, они положат начало восьмому периоду таблицы.
Как быстро выучить таблицу Менделеева?
Можно порекомендовать несколько способов. Желательно распечатать таблицу, чтобы она всегда была под рукой, и заглядывать в нее как можно чаще. Еще лучше – начертить ее своими руками и заполнить все необходимые клеточки.
Самостоятельно разделите таблицу на части и раскрасьте в разные цвета, как вам будет удобно. Постоянно обращайтесь к ее изучению в любое свободное время, например в общественном транспорте.
Ассоциируйте названия химических элементов с известными именами, событиями, фактами. Например, серебро (аргентум) похоже на Аргентину, железо (феррум) – на «Феррари», цезий – на Цезаря, бор – на Борна, карбон – на барона и так далее.
Хорошо зарекомендовало себя игровое обучение, когда для заучивания материала используются настольные и компьютерные игры. Таблица Менделеева может стать полем морского боя, где корабли носят наименования химических элементов.
Наконец, есть специальные стихотворения, которые также помогут запомнить содержание таблицы:
Самый первый — водород.
Это знает весь народ.
Гелий, литий и бериллий,
Бор, а следом — углерод,
Там азот, а за азотом
Двухвалентный Кислород.
Фтор с неоном, натрий, магний,
Алюминий, кремний тут.
Фосфор, сера, хлор с аргоном,
Калий с кальцием идут.
Как правильно пользоваться таблицей Менделеева?
Существует определенный алгоритм, который позволяет с помощью таблицы Менделеева получать необходимую информацию. Для этого лучше придерживаться следующей последовательности.
1. Таблица Менделеева начинается в левом верхнем углу и заканчивается в правом нижнем углу.
2. Каждый элемент обозначается одной или несколькими латинскими буквами. Узнайте полное название химического элемента.
Каждый элемент обозначается одной или несколькими латинскими буквами. Узнайте полное название химического элемента.
3. Найдите атомный номер (от 1 до 118). Он соответствует числу протонов в атоме и чаще всего количеству электронов. Каждый следующий элемент в таблице содержит на один протон больше.
4. Определите элементы со сходными физическими и химическими свойствами. Как правило, они располагаются в соответствующей вертикальной колонке и обозначаются одним цветом.
5. Каждая строка таблицы представляет собой период. Количество орбиталей в атомах соответствует номеру периода.
6. Узнайте, почему в таблице имеются пустые ячейки.
7. Научитесь различать в таблице металлы, неметаллы и металлоиды.
Британника
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет

- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.
- Спасение Земли
- SpaceNext50
Britannica представляет SpaceNext50. От полёта на Луну до управления космосом — мы исследуем широкий спектр тем, которые подпитывают наше любопытство к космосу!
Страница не найдена
Приносим свои извинения! Этот контент недоступен. Посетите домашнюю страницу Britannica или воспользуйтесь полем поиска ниже.
Быстрый тест: Канада
6 картин Мюнхена, которые стоит посетить
Цветные трансгендеры сталкиваются с уникальными проблемами на пересечении гендерной дискриминации и расизма.
Группа | Определение и факты
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.