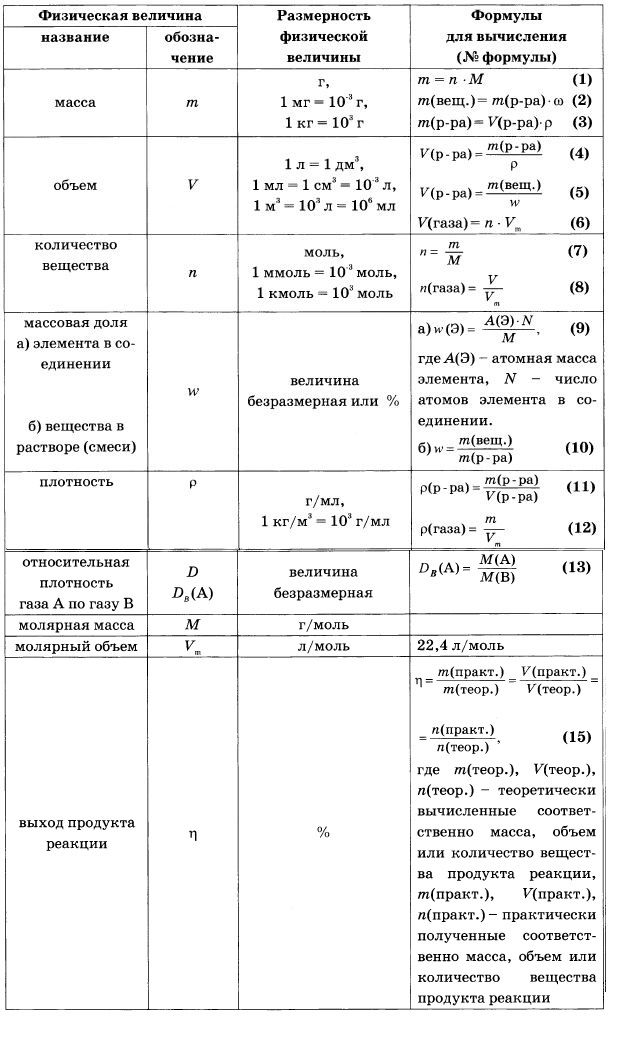
Решение задач с использованием понятия “Массовая доля растворенного вещества”. Растворение и концентрирование растворов
- Корнева Наталья Валентиновна
- Новоселова Юлия Евгеньевна
Разделы: Математика, Химия
На уроках химии достаточно часто приходится
решать задачи, в которых используются
математические методы и приемы, вызывающие
затруднения у учащихся, и учителю химии
приходится брать на себя функции учителя
математики и, в тоже время, задачи с химическим
содержанием, с использованием специальных
терминов сложно объяснить без специальной
подготовки учителю математики. Так родилась идея
подготовить и провести серию факультативных
занятий совместно учителем химии и математики по
решению задач на смеси с учащимися 9 классов.
Так родилась идея
подготовить и провести серию факультативных
занятий совместно учителем химии и математики по
решению задач на смеси с учащимися 9 классов.
ТЕМА: РЕШЕНИЕ ЗАДАЧ С ИСПОЛЬЗОВАНИЕМ ПОНЯТИЯ “МАССОВАЯ ДОЛЯ РАСТВОРЁННОГО ВЕЩЕСТВА. РАЗБАВЛЕНИЕ И КОНЦЕНТРИРОВАНИЕ РАСТВОРОВ” (ИНТЕГРАЦИЯ ХИМИИ И АЛГЕБРЫ)
ЦЕЛИ:
ОБОРУДОВАНИЕ: КОМПЬЮТЕР, МУЛЬТИМЕДИЙНАЯ ПРИСТАВКА, ЭКРАН, ПРЕЗЕНТАЦИЯ.
ХОД УРОКА.
Учитель химии: Количественный состав
раствора выражается его концентрацией, которая
имеет разные формы выражения. Чаще всего
используют массовую концентрацию или массовую
долю растворённого вещества. Вспомним
математическую формулу для выражения массовой
доли растворённого вещества.
Чаще всего
используют массовую концентрацию или массовую
долю растворённого вещества. Вспомним
математическую формулу для выражения массовой
доли растворённого вещества.
Ученик:
- Массовая доля растворённого вещества обозначается – W р.в.
- Массовая доля растворённого вещества – это отношение массы растворённого вещества к массе раствора: W (р.в.) = m (р.в.)/m (р-ра) x 100%.
- Масса раствора складывается из массы растворённого вещества и массы растворителя: m (р-ра) = m (р.в.) + m (р-ля)
- Формула для массовой доли растворённого вещества будет выглядеть следующим образом: W (р.в.) = m (р.в.)/ m (р.в.) + m (р-ля) x 100%
- Преобразуем данную формулу и выразим массу растворённого вещества и массу раствора: m (р.в.) = w (р.в.) x m (р-ра)/100%, m (р-ра) =m (р.в.)/w (р.в.) x 100%
Учитель химии: Предлагаю решить задачу,
используя предложенные формулы.
Задача. Сколько грамм йода и спирта нужно взять для приготовления 500 грамм 5%-ной йодной настойки?
| ДАНО: | РЕШЕНИЕ: |
| M (р-ра)=500 г. | W (р.в.)=m(р.в.)/m(р-ра) |
| W (р.в.)=5%=0,05 | |
| НАЙТИ: | m (I2)=W(р.в.)x m(наст.) |
| m(I2)=? | m(I2)=0,05 x 500 г.=25 г. |
| m(спирта)=? | m(р-ра)=m(I2)+m(спирта) |
| m(спирта)=m(р-ра)-m(I2) | |
| m(спирта)=500 г.-25г.=475 г. |
ОТВЕТ: m (I2)=25 г.
Учитель химии: Очень часто в работе химических лабораторий приходится готовить растворы с определённой массовой долей растворённого вещества смешиванием двух растворов или разбавлением крепкого раствора водой. Перед приготовлением раствора нужно провести определённые арифметические расчёты.
Задача. Смешаны 100 грамм раствора с массовой долей некоторого вещества 20% и 50 грамм раствора с массовой долей этого вещества 32%. Вычислите массовую долю растворённого вещества во вновь полученном растворе.
Учитель химии: Решим эту задачу, используя правило смешения.
Запишем условие задачи в таблицу:
1 раствор |
2 раствор |
3 раствор |
|
| Масса раствора | m1=100 г. |
m2=50 г. |
m3=m1+m2 |
| Массовая доля растворённого вещества % | W1=0,2 |
W2=0,32 |
W3 |
| Масса растворённого в-ва в растворе | m1w1 |
m2w2 |
m3w3 |
Решим задачу, используя правило смешения:
- m1w1+m2w2=m3w3
- m1w1+m2w2=(m1+m2) w3
- m1w1+m2w2=m1w3+m2w3
- m1w1-m1w3=m2w2-m2w2
- m1(w1-w3)=m2(w
- m1/m2=(w3-w2)/(w1-w3)
ВЫВОД.
Отношение массы первого раствора к массе второго равно отношению разности массовых долей смеси и второго раствора к разности массовых долей первого раствора и смеси:
m
1/m2=(w3-w2)/(w1-w3)ОТВЕТ: массовая доля растворённого вещества во вновь полученном растворе составляет 24%.
Учитель математики: Эту задачу можно решить, используя алгебраические преобразования:
РЕШЕНИЕ.
1.Найдём массу растворённого вещества в каждом из растворов:
20% от 100 г 32% от 50 г
0,2х100=20(г) 0,32х50=16(г)
2. Найдём массу растворённого вещества в смеси:
Найдём массу растворённого вещества в смеси:
20+16=36(г)
3.Найдём массу раствора:
100+50=150(г)
4.Пусть концентрация полученного раствора составляет х%, тогда масса растворённого вещества в смеси:
Х% от 150 г
0,01Хх150=1,5Х
5.Составим уравнение и решим его:
1,5Х=36
Х=36:1,5
Х=24
ОТВЕТ: концентрация полученного раствора составляет 24%.
Учитель химии: В курсе химии встречаются задачи, решение которых можно осуществить только методом систем уравнений
Задача: Смешали 30%-ный раствор соляной кислоты с 10%-ным раствором этой же кислоты и получили 600 грамм 15%-ного раствора. Сколько грамм каждого раствора было взято?
ДАНО:
- W1=30%=0,3
- W2=10%=0,1
- W3=15%=0,15
- m3(р-ра)=600 г.

НАЙТИ:
- m1(р-ра)=?
- m2(р-ра)=?
РЕШЕНИЕ:
Учитель математики: Введём обозначения:
Рассчитаем массы растворённых в-в:
- m1=0,3X,
- m2=0,1Y,
- m3=600 г. x 0,15=90 г.
Составим систему уравнений:
Решим подчёркнутое уравнение:
180-0,3Y+0,1Y=90
180-0,2Y=90
180-90=0,2Y
90=0,2Y
Y=450
- если Y=450 г., то X=600 г.-450 г.=150 г.
ОТВЕТ:
- масса 1 р-ра=150 г.
- масса 2 р-ра=450г.
Учитель химии. Решим эту же задачу методом
смешения. Какой ответ у вас получился? (Ответы
сходятся).
Решим эту же задачу методом
смешения. Какой ответ у вас получился? (Ответы
сходятся).
ДОМАШНЕЕ ЗАДАНИЕ.
ЗАДАЧА.
- В каких массовых надо смешать 20%-ный и 5%-ный растворы одного вещества, чтобы получить 10%-ный раствор?
АЛГОРИТМ РЕШЕНИЯ:
- 1.Ввести буквенные обозначения для масс растворов.
- 2.Вычислить массы растворённых веществ в первом, втором растворе и смеси.
- 3.Составить систему уравнений и решить её.
- 4.Записать ответ.
Презентация
Задачи на примеси. Примесь | CHEMEGE.RU
Задачи на примеси — это разновидность задач на материальный баланс (массовую долю). Большинство минералов природного происхождения состоит из смеси разных веществ. Чистые вещества в природе встречаются крайне редко. Образцы породы, минералы и т.д. зачастую содержат основное вещество и примеси.
Чистые вещества в природе встречаются крайне редко. Образцы породы, минералы и т.д. зачастую содержат основное вещество и примеси.
Примеси — это дополнительные вещества, которые содержатся в минерале, помимо основного вещества, и доля которых относительно невелика.
Как правило, в химических задачах не уточняют состав примесей. Такие примеси считаются химически инертными и не вступают в химические реакции. Если указан состав примесей, необходимо проверять, не вступают ли они в химические реакции.
Для решения задач на примеси можем использовать формулу массовой доли примеси:
ωприм. = mприм./m
где
mприм. — масса примеси, г
m — масса образца, г
Например, в образце технического карбоната кальция массой 200 г содержится 5% примесей. Тогда масса примесей:
mприм. = m·ωприм. = 200·0,05 = 10 г
1. Какой объем воздуха (н. у.) необходим для сгорания 10 г серы, содержащей 2% негорючих примесей?
Какой объем воздуха (н. у.) необходим для сгорания 10 г серы, содержащей 2% негорючих примесей?
2. Какой объем углекислого газа (н.у.) выделится при обработке 15 г карбоната натрия, содержащего 15% примесей, избытком соляной кислоты?
3. Из 12 кг цинковой обманки, содержащей 75% cульфида цинка и несульфидные примеси, при действии избытка соляной кислоты, теоретически можно получить _____ л сероводорода.
4. Сколько килограммов фосфора может быть получено из 1 тонны фосфорита Ca3(PO4)2, содержащего 40% нефосфатных примесей?
5.Сколько грамм оксида алюминия, содержащего 8% примесей, потребуется для получения 500 г нитрата алюминия в реакции с азотной кислотой.
6.Сколько кг 96%-ного раствора серной кислоты получится из 10 кг пирита, содержащего 5% примесей?
7.Технический образец сульфида железа (II) массой 25г содержащий 2,5% примесей, обработали избытком разбавленного раствора серной кислоты. Выделившийся газ пропустили через избыток раствора нитрата свинца (II). Вычислите массу выделившегося осадка
Вычислите массу выделившегося осадка
8.Определить массовую долю примесей в образце известняка, если при действии на 1 кг его избытком азотной кислоты выделяется 200 л (н.у.) углекислого газа.
9. Технический цинк массой 150 г обработали избытком соляной кислоты. При этом выделилось 44,8 л газа (н.у.). Определить массовую долю примесей в образце цинка.
10. Чему равна масса пирита, содержащего 10% примесей, если при обжиге этой порции пирита получили 44,8 л сернистого газа?
11. Образец хлорида бария, загрязненный хлоридом натрия обработали в водном растворе избытком сульфита натрия. Выпавший осадок отфильтровали и затем обработали избытком бромоводородной кислоты. Объем выделившегося газа оказался равным 4,09 л (н.у.). Вычислите массовую долю основного вещества в образце, которого взяли 40 г.
12. При обработке избытком хлороводородной кислоты 25 г цинковой руды, содержащей ZnS и нерастворимые в кислотах примеси, выделяется газ. При полном поглощении этого газа раствором сульфата меди (II) образуется осадок, при прокаливании которого в избытке кислорода получается 8 г оксида меди (II). Определите, содержали примесей в руде в массовых процентах.
Определите, содержали примесей в руде в массовых процентах.
13. Образец карбоната кальция массой 20,0 г, загрязненный сульфатными примесями, обработали избытком азотной кислоты. Объем образовавшегося газа, измеренный при 25°С и нормальном давлении, составил 4,66 л. Вычислить массовую долю примесей в исходном образце.
14. При дегидроциклизации технического гептана массой 147,4 г получен толуол массой 128,8 г. Найдите массовую долю примесей в техническом гептане.
15. При действии избытка раствора соляной кислоты на 48 г технического карбида кальция образовалось 13,44 л ацетилена (н.у.). Найдите массовую долю примесей в техническом карбиде кальция.
16. Найдите массовую долю примесей в техническом карбиде кальция, если при пропускании газа, полученного действием воды на 1,6 г карбида, через бромную воду в реакцию вступило 7,2 г брома.
17. Какая масса образца иодида калия, загрязненного примесью нитрата калия (массовая доля его равна 3%) была обработана избытком нитрата серебра, если при этом образовалось 47 г осадка?
18. Фосфор, полученный восстановлением 77,5 т руды, содержащей по массе 80% фосфата кальция и 20 % невосстанавливающихся примесей, использовали для получения ортофосфорной кислоты. Определите массу полученной кислоты, если выход на всех стадиях процесса считать равным 100 %.
Фосфор, полученный восстановлением 77,5 т руды, содержащей по массе 80% фосфата кальция и 20 % невосстанавливающихся примесей, использовали для получения ортофосфорной кислоты. Определите массу полученной кислоты, если выход на всех стадиях процесса считать равным 100 %.
19. Образец сульфида алюминия, загрязненный сульфидом цинка (массовая доля 0,02), обработали избытком воды. Образовавшийся газ полностью прореагировал с хлоридом меди (II) в водном растворе, при этом выпало 5,28 г осадка. Чему была равна масса взятого образца сульфида алюминия?
20. Какой объем ацетилена (н. у.) образуется, если 10 г карбида кальция, содержащего 4% примесей, обработать избытком воды?
Понравилось это:
Нравится Загрузка…
Что означают % об/об, % об/об и % об/об?
15 февраля 2018 г. Люси Белл-Янг
Люси Белл-Янг2020-04-23T13:04:40+01:00
Покупая химические продукты в Интернете, вы заметите, что концентрация обозначена как об. /об., вес./вес. или ж/об. Это общие выражения, так что же они означают именно ?
/об., вес./вес. или ж/об. Это общие выражения, так что же они означают именно ?
В этом посте:
% об./об.Объемная концентрация раствора выражается в % об./об., что означает объем на объем. Это используется, когда оба химических вещества в растворе являются жидкими.
Например, если 50 мл серной кислоты разбавить 50 мл воды, получится 50 мл серной кислоты в общем объеме 100 мл. Следовательно, мы бы выразили концентрацию этого раствора как серную кислоту 50% по объему.
% по массеМассовая концентрация раствора выражена в % по массе. Как и раньше, это означает вес на вес. В этом случае объем каждого химического вещества не учитывается, а используется только вес.
Таким образом, если общая масса 100 г раствора состоит из 30 г соляной кислоты в 70 г воды, то мы выражаем это как 30% соляной кислоты по массе.
% мас./об. Массовая концентрация раствора выражается в % мас. /об. по массе на объем. В качестве альтернативы его можно сократить до m / v для обозначения массы на объем. Это используется, когда твердое химическое вещество растворено в жидкости.
/об. по массе на объем. В качестве альтернативы его можно сократить до m / v для обозначения массы на объем. Это используется, когда твердое химическое вещество растворено в жидкости.
Если 1 г йодида калия используется для получения общего объема 100 мл, то получается раствор йодида калия с концентрацией 1% мас./об.
Расчет процентовКаждый тип процентов можно рассчитать, внеся небольшие изменения в один и тот же метод. Например, чтобы найти % массы/объема раствора, расчет будет следующим:
(масса растворенного вещества (г) / объем раствора (мл)) x 100
Таким образом, чтобы вычислить % вес/объем 100 мл раствора, состоящего из 65 г азотной кислоты, мы должны разделить 65 г на 100 мл, а затем умножьте ответ на 100. Это говорит нам о том, что имеется раствор азотной кислоты с концентрацией 65% вес/объем.
При расчете % об./об. раствора используется тот же метод, за исключением того, что объем растворенного вещества (мл) делится на объем раствора (мл). Например, раствор объемом 1000 мл, содержащий 450 мл метанола, имеет концентрацию метанола 45% по объему (450/1000 x 100).
Например, раствор объемом 1000 мл, содержащий 450 мл метанола, имеет концентрацию метанола 45% по объему (450/1000 x 100).
Опять же, метод расчета % мас./мас. использует те же шаги, вместо этого вес делится на вес.
Важно точно понимать, что вы покупаете. Вот почему у нас в ReAgent есть опытная и преданная своему делу команда, с которой вы можете поговорить по любому вопросу о продукте, который у вас может возникнуть. Свяжитесь с нами сегодня, чтобы узнать, как мы можем помочь.
Заявление об ограничении ответственности
Блог на сайтеchemicals.co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть какие-либо сомнения относительно вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
Если у вас есть какие-либо сомнения относительно вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
Практические задачи по химии
Практические задачи по химииДом > Введение в хим. или орг/биохимия > Проблемы с химией | Контакт
Вступление
Практические тесты
Образцы тестов
Домашнее задание
Рабочие листы для самопомощи по избранным вводным темам химии
Нижняя часть страницы; обратные ссылки и контактная информация
Вступление
Я пишу наборы задач, рабочие листы, учебные пособия в разное время. В каждом случае существует некоторый исходный контекст, который делает конкретный документ «актуальным». Затем все меняется, и я накапливаю вещи. На этой странице перечислены различные вещи, все из которых в общих чертах представляют собой наборы практических задач, с некоторым ограниченным учебным материалом, включенным в некоторых случаях.
Эта страница может быть полезна для людей, которые просто просматривают веб-сайт в поисках практики. Студенты моих текущих курсов могут получить доступ ко всем наборам задач с этой страницы, но обратите внимание, что более полная информация по курсу может быть доступна на странице курса.
Те, кто использует материалы моего веб-сайта для самостоятельного изучения… Мы приветствуем — и поощряем — задавать мне вопросы, когда возникают трудности. (Моя контактная информация указана внизу каждой из моих веб-страниц.) Всегда полезно указать, как бы вы ответили на вопрос и почему. Это позволяет мне ответить на то, что вы думаете, позволяет мне сосредоточить свой ответ на том, где у вас возникли проблемы. Кроме того, это дает мне представление об уровне, на котором вы отвечаете на вопрос, который может варьироваться в зависимости от вашего образования и уровня курса. Уровень дискурса — и ваше изучение предмета — повышается, если вы пытаетесь сосредоточиться на причинах, а не просто на ответах.
В чем разница между различными видами материалов, перечисленных здесь в разных разделах? По каждому разделу есть общий описательный материал. Тем не менее, я предлагаю посетителям посмотреть материалы разных типов и решить, что подходит для их ситуации. «Викторину» можно использовать как «рабочий лист», если вам это подходит, или наоборот; у обоих проблемы с работой и пояснительным материалом, просто в разных аранжировках.
верх страницы
Практика викторины
Введение в химию (X11)
Введение в органическую и биохимию (X402)
верх страницы
Образцы тестов
Это настоящие тесты из предыдущих классов. Они размещены здесь с ключами ответов.
Введение в химию (X11)
Введение в органическую и биохимию (X402)
верх страницы
Домашнее задание
Большинство домашних заданий для уроков химии взято из книги. Тем не менее, в некоторых случаях я предоставляю небольшие дополнительные наборы для дополнения определенных областей. Если не указано иное, они распространяются с соответствующими раздаточными материалами к главам, а также доступны здесь в виде файлов PDF. Они включают ответы.
Если не указано иное, они распространяются с соответствующими раздаточными материалами к главам, а также доступны здесь в виде файлов PDF. Они включают ответы.
Введение в химию (X11)
* Стехиометрия. Небольшой дополнительный набор с несколькими вопросами разной сложности на одну реакцию. Акцент заключается в том, что сбалансированные уравнения дают вам молярные отношения между химическими веществами в реакции.
* Растворы: весовые проценты и разведение. Несколько дополнительных вопросов по паре тем, где набор книг очень ограничен. Задачи на разбавление направлены на то, чтобы вы использовали логический двухэтапный метод расчета разбавлений, как я показываю его в классе.
Введение в органическую и биохимию (X402)
* Горение. Написание сбалансированных уравнений горения органических соединений. Это для главы «алканы» курса орг/био, но также может быть полезно для студентов, изучающих общую химию.
* Реакции ароматического замещения. Этот набор фокусируется на простых одношаговых реакциях. Это для главы «ароматики» курса орг/био.
Этот набор фокусируется на простых одношаговых реакциях. Это для главы «ароматики» курса орг/био.
* Назовите эти химические вещества (веб-страница). Сложное упражнение, основанное на рекламе химической компании. Это лучше всего подходит для поздней части курса, когда учащиеся узнали о большинстве функциональных групп.
верх страницы
Рабочие листы для самопомощи по выбранным вводным темам химии
Перечисленные ниже предметы являются раздаточными материалами для самопомощи; большинство из них доступны в виде файлов Microsoft Word DOC или созданных из них файлов RTF или PDF. Некоторые из них изначально были написаны для самостоятельного курса, в котором различные химические расчеты освещались с помощью таких раздаточных материалов. Общий подход заключается в том, что предполагаются базовые знания по теме (то есть они предназначены для ознакомления и практики), основные вопросы представлены кратко, а практических задач много.
Пожалуйста, дайте мне знать, если у вас возникнут проблемы с доступом к каким-либо файлам; иногда ваш комментарий — это способ, которым я узнаю, что есть проблема.
Размерный анализ Плотность Изучение химии земной коры (элементы, таблица Менделеева) Формулы ионных соединений Именование химических веществ Взаимопревращения масс-молей Решения: Молярность Решения: Процент Решения: разбавления рН; вода Сильные кислоты Слабые кислоты Буферы
Размерный анализ. Скачать диман.pdf.
Содержание файла diman.pdf:
А. Введение
B. Простые преобразования единиц измерения; идея размерного анализа
C. Многоступенчатые преобразования
D. Скорость и плотность как коэффициенты пересчета
Д. Ответы
Скачать “Размерный анализ” (diman.pdf)
Плотность. Скачать плотность.pdf.
Содержание дляdensity.pdf:
А. Введение
B. Рассчитать d
C. Вычислить m
D. Вычислить V
E. Прочие проблемы
F. Больше сложности?
Г. Ответы
Скачать “Плотность” (density.pdf)
Изучение химии земной коры
Практика работы с элементами и таблицей Менделеева. Вам даны некоторые данные о содержании элементов в земной коре и заданы некоторые исследовательские вопросы.
Вам даны некоторые данные о содержании элементов в земной коре и заданы некоторые исследовательские вопросы.
* Рабочий лист: Изучение химии земной коры.
* На прилагаемом графике показаны данные.
* Рабочий лист и график будут открываться в новом окне в виде файла PDF. (Для использования в классе они приложены к раздаточному материалу главы 7.)
* Лист ответов для рабочего листа корки.
* (Электронная таблица включает график и таблицу, на которой он основан.)
Формулы ионных соединений. Скачать ionic.pdf.
Чтобы выяснить формулу ионного соединения, вам нужно 1) идентифицировать ионы, затем 2) создать нейтральное соединение из этих ионов. Этот раздаточный материал посвящен второму шагу. Основная концептуальная проблема заключается в том, что ионные соединения нейтральны. Чтобы помочь вам сосредоточиться на этом втором шаге, ионы даны здесь во всех упражнениях. Часть практики связана с воображаемыми ионами, поэтому вы не отвлекаетесь на попытки выяснить, что это за ионы.
Наименование химических веществ.
Этот рабочий лист касается названий простых неорганических соединений, либо ионных соединений, либо ковалентных соединений двух неметаллов. Чтобы определить название химического вещества, вы должны сначала решить, какой тип этого химического вещества. Этот рабочий лист поможет вам сначала классифицировать химические вещества, а затем назвать их.
Этот рабочий лист доступен как в виде веб-страницы, так и в виде файла PDF. В любом случае ответы есть на веб-странице.
* Веб-страница: Наименование химических веществ. Включает расширенное введение и ответы с пояснениями.
* pdf-файл: Раздаточный материал по присвоению названий химическим веществам. Оригинальный раздаточный материал для занятий с кратким введением и вопросами. Используйте веб-сайт, указанный выше, для получения ответов и пояснений.
Масс-моль взаимопревращений. Скачать gmol.pdf.
Содержание файла gmol.
pdf:
А. Введение
B. Взаимопревращения масс-молей: простые
C. Взаимопревращения масс-молей: сложные
Д. Ответы
Скачать “Взаимопревращения масс-молей” (gmol.pdf)
Решения: Молярность. Скачать моляр.pdf.
Содержание для molar.pdf:
А. Введение
B. Молярность
C. Приготовление «молярных» растворов
D. Использование «молярных» растворов
E. Другие единицы измерения концентрации в молях [факультативно]
Ф. Ответы
Скачать “Решения: Молярность” (molar.pdf)
Решения: Процент. Скачать wtpc.pdf.
Содержание файла wtpc.pdf:
А. Введение
Б. Сравнения; коэффициенты; идея процента
C. Единицы «проценты»
D. Массовая доля, %(мас./мас.)
E. Объемный процент, %(об./об.)
F. Процент массы/объема, %(вес/объем)
г. м.д. и т.д.
H. Преобразование w/w в w/v
I. Аппроксимация разбавленных водных растворов
J.Преобразование масс/масс или масс/объемов в моли или молярность
К. Дополнительные проблемы
Л. Ответы
Скачать “Решения: Процент” (wtpc.pdf)
Растворы: Разведения. Скачать дил.pdf.
Содержание файла dil.pdf:
A. Разведения: введение
B. Уравнение разбавления
C. Логика уравнения разбавления
D. Нужно ли «запоминать» уравнение разбавления? — Внимание студентов X11
E. Практические замечания
F. Разбавления с использованием других единиц концентрации
Г. Проблемы
H. Коэффициент разбавления
I. Многократные разведения; серийные разведения
Дж. Ответы
Скачать “Растворы: Разведения” (dil.pdf)
рН; вода. Скачать вода.pdf.
Оглавление для воды.pdf:
А. Введение
Б. Вода
C. [H + ] и [OH – ] могут варьироваться…
Д. … но не самостоятельно
Е.рН
F. pThis и pThat [опционально]
Г. Ответы
Скачать “pH; вода” (water.pdf)
Сильные кислоты. Скачать acidstr.pdf.
Содержание для acidstr.pdf:
А. Введение
B. Сильные кислоты: пример
C. Сильные кислоты: общие
D. Сильные основания
E. Больше проблем
F. Что, если у вас есть и то, и другое? [по желанию]
G. Нормальность [опционально]
Ч. Ответы
Скачать “Сильные кислоты” (acidstr.pdf)
Слабые кислоты. Скачать acidwk.pdf.
Содержание для acidwk.pdf:
А. Введение
B. Слабые кислоты: обзор
C. Слабые кислоты: пример; найти Ка
D. Учитывая Ka, рассчитайте pH
E. Различные слабые кислоты
F. Какое место в этой картине занимают сильные кислоты?
G. Еще задачи и вопросы
H. Полипротоновые кислоты [кратко указано]
I. Серная кислота [кратко указано]
J.





 pdf:
pdf:  Преобразование масс/масс или масс/объемов в моли или молярность
Преобразование масс/масс или масс/объемов в моли или молярность  рН
рН