Газ хлор, физические свойства хлора, химические свойства хлора.
ПродажаПроизводствоДоставка
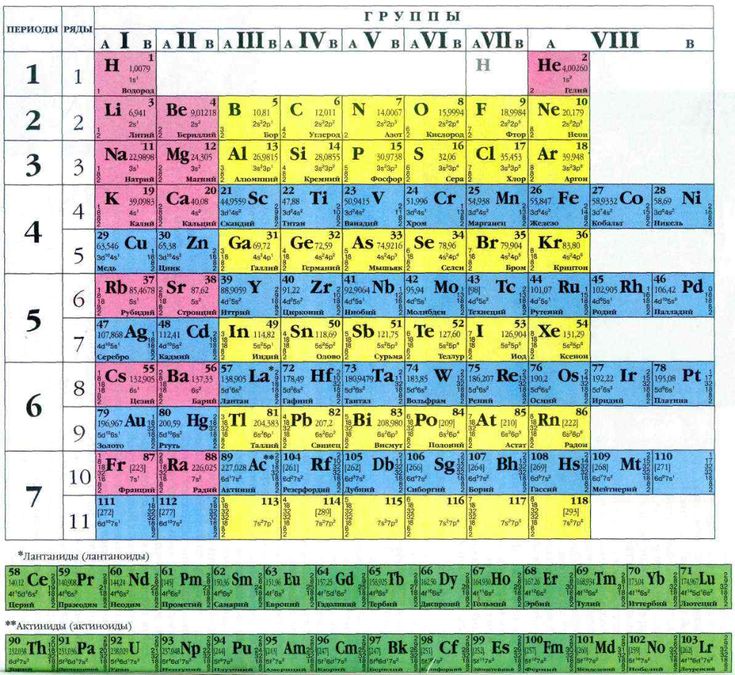
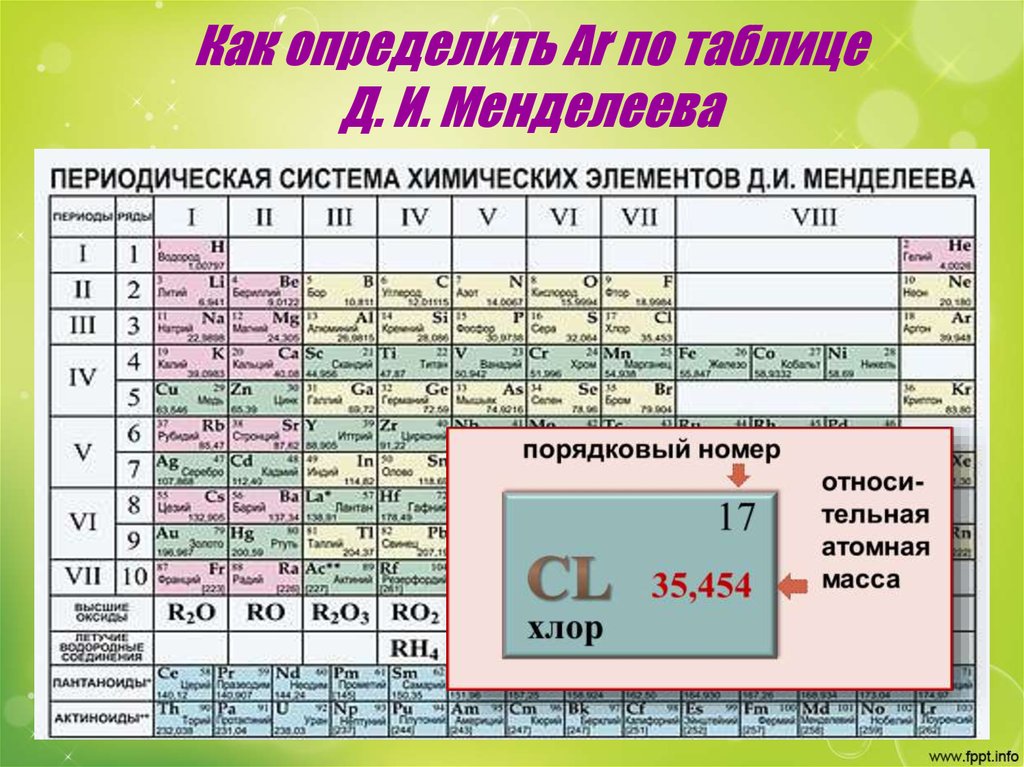
Хлор (от греч. χλωρ?ς — «зелёный») — элемент главной подгруппы седьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 17. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов (первоначально название «галоген» использовал немецкий химик Швейгер для хлора [дословно «галоген» переводится как солерод], но оно не прижилось, и впоследствии стало общим для VII группы элементов, в которую входит и хлор[2]).
Простое вещество хлор (CAS-номер: 7782-50-5) при нормальных условиях — ядовитый газ желтовато-зелёного цвета, с резким запахом. Молекула хлора двухатомная (формула Cl2).
История открытия хлораВпервые газообразный безводный хлороводород собрал Дж. Присли в 1772г. (над жидкой ртутью). Впервые хлор был получен в 1774 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
(над жидкой ртутью). Впервые хлор был получен в 1774 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
- 4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты. Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Распространение в природеВ природе встречаются два изотопа хлора 35Cl и 37Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCI, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6h3O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л[3]). На долю хлора приходится 0,025 % от общего числа атомов земной коры, кларковое число хлора — 0,017 %, а человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCI, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6h3O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л[3]). На долю хлора приходится 0,025 % от общего числа атомов земной коры, кларковое число хлора — 0,017 %, а человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Некоторые его физические свойства представлены в таблице.
Некоторые его физические свойства представлены в таблице.
Некоторые физические свойства хлора
| Свойство |
Значение |
|---|---|
| Цвет (газ) | Жёлто-зелёный |
| Температура кипения | −34 °C |
| Температура плавления | −100 °C |
| Температура разложения (диссоциации на атомы) |
~1400 °C |
| Плотность (газ, н.у.) | 3,214 г/л |
| Сродство к электрону атома | 3,65 эВ |
| Первая энергия ионизации | 12,97 эВ |
| Теплоемкость (298 К, газ) | 34,94 (Дж/моль·K) |
| Критическая температура | 144 °C |
| Критическое давление | 76 атм |
| Стандартная энтальпия образования (298 К, газ) | 0 (кДж/моль) |
| Стандартная энтропия образования (298 К, газ) | 222,9 (Дж/моль·K) |
| Энтальпия плавления | 6,406 (кДж/моль) |
| Энтальпия кипения | 20,41 (кДж/моль) |
| Энергия гомолитического разрыва связи Х-Х | 243 (кДж/моль) |
| Энергия гетеролитического разрыва связи Х-Х | 1150 (кДж/моль) |
| Энергия ионизациии | 1255 (кДж/моль) |
| Энергия сродства к электрону | 349 (кДж/моль) |
| Атомный радиус | 0,073 (нм) |
| Электроотрицательность по Полингу | 3,20 |
| Электроотрицательность по Оллреду-Рохову | 2,83 |
| Устойчивые степени окисления | -1, 0, +1, +3, (+4), +5, (+6), +7 |
Газообразный хлор относительно легко сжижается. Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа.
Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа.
При температуре ниже −101 °C жидкий хлор кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a=6,29 Å b=4,50 Å, c=8,21 Å. Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a=8,56 Å и c=6,12 Å .
| Растворитель | Растворимость г/100 г |
|---|---|
| Бензол | Растворим |
| Вода[8] (0 °C) | 1,48 |
| Вода (20 °C) | 0,96 |
| Вода (25 °C) | 0,65 |
| Вода (40 °C) | 0,46 |
| Вода (60 °C) | 0,38 |
| Вода (80 °C) | 0,22 |
| Тетрахлорметан (0 °C) | 31,4 |
| Тетрахлорметан (19 °C) | 17,61 |
| Тетрахлорметан (40 °C) | 11 |
| Хлороформ | Хорошо растворим |
| TiCl4, SiCl4, SnCl4 | Растворим |
Степень диссоциации молекулы хлора Cl2 → 2Cl. При 1000 К равна 2,07×10−4%, а при 2500 К 0,909 %.
При 1000 К равна 2,07×10−4%, а при 2500 К 0,909 %.
Порог восприятия запаха в воздухе равен 0,003 (мг/л).
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
Химические свойстваСтроение электронной оболочкиНа валентном уровне атома хлора содержится 1 неспаренный электрон: 1s
| Валентность | Возможные степени окисления | Электронное состояние валентного уровня | Пример соединений |
|---|---|---|---|
| I | +1, −1 | 3s2 3p5 | NaCl, NaClO |
| III | +3 | 3s2 3p4 3d1 |
NaClO2 |
| V | +5 | 3s2 3p3 3d2 | KClO3 |
| VII | +7 | 3s1 3p3 3d3 | KClO4 |
Также известны соединения хлора, в которых атом хлора формально проявляет валентность 4 и 6, например ClO2 и Cl2O6. Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
- Cl2 + 2Na → 2NaCl
- 3Cl2 + 2Sb → 2SbCl3
- 3Cl2 + 2Fe → 2FeCl3
C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды.
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованиемхлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C.:
- Cl2 + H2 → 2HCl
- 5Cl2 + 2P → 2PCl5
- 2S + Cl2 → S2Cl2
С кислородом хлор образует оксиды в которых он проявляет степень окисления от +1 до +7: Cl2O, ClO2, Cl2O6, Cl2O7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
При реакции с фтором, образуется не хлорид, а фторид:
- Cl2 + 3F2 (изб.) → 2ClF3
Хлор вытесняет бром и иод из их соединений с водородом и металлами:
- Cl2 + 2HBr → Br2 + 2HCl
- Cl2 + 2NaI → I2 + 2NaCl
При реакции с монооксидом углерода образуется фосген:
- Cl2 + CO → COCl2
При растворении в воде или щелочах, хлор дисмутирует, образуя хлорноватистую (а при нагревании хлорную) и соляную кислоты, либо их соли:
- Cl2 + H2O → HCl + HClO
- 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
Хлорированием сухого гидроксида кальция получают хлорную известь:
- Cl2 + Ca(OH)2 → CaCl(OCl) + H2O
Действие хлора на аммиак можно получить трёххлористый азот:
- 4NH3 + 3Cl2 → NCl3 + 3NH4Cl
Хлор очень сильный окислитель.
- Cl2 + H2S → 2HCl + S
С насыщенными соединениями:
- CH3-CH3 + Cl2 → C2H5Cl + HCl
Присоединяется к ненасыщенным соединениям по кратным связям:
- CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3):
- C6H6 + Cl2 → C6H5Cl + HCl
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:
- MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
- 4HCl + O2 → 2H2O + 2Cl2
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли:
- 2NaCl + 2H2О → H2↑ + Cl2↑ + 2NaOH
- Анод: 2Cl− — 2е− → Cl20↑
- Катод: 2H2O + 2e− → H2↑ + 2OH−
Так как параллельно электролизу хлорида натрия проходит процесс электролиз воды, то суммарное уравнение можно выразить следующим образом:
- 1,80 NaCl + 0,50 H2O → 1,00 Cl2↑ + 1,10 NaOH + 0,03 H2↑
Применяется три варианта электрохимического метода получения хлора. Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути.
В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути.
Полость электролизера разделена пористой асбестовой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом. В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита (раствора NaCl). В результате электрохимического процесса на аноде за счёт разложения галита выделяется хлор, а на катоде за счёт разложения воды — водород. При этом прикатодная зона обогащается гидроксидом натрия.
Мембранный метод по сути, аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной полимерной мембраной.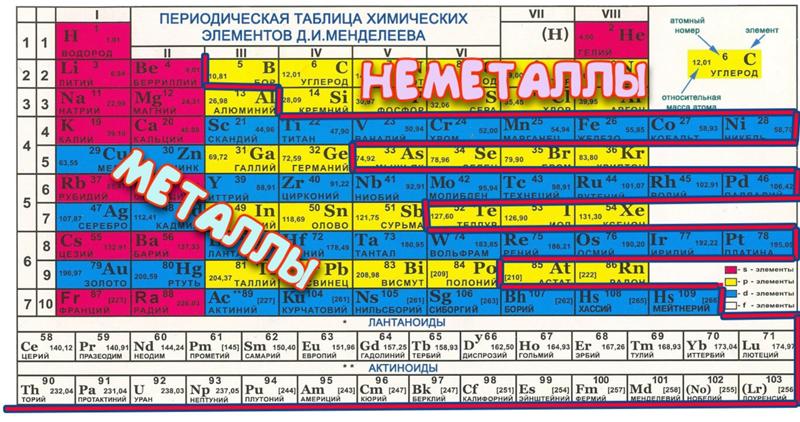 Мембранный метод производства эффективнее, чем диафрагменный, но сложнее в применении.
Мембранный метод производства эффективнее, чем диафрагменный, но сложнее в применении.
Процесс проводят в электролитической ванне, которая состоит из электролизера, разлагателя и ртутного насоса, объединённых между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизёра служит поток ртути. Аноды — графитовые или малоизнашивающиеся. Вместе с ртутью через электролизёр непрерывно течет поток анолита — раствора хлорида натрия. В результате электрохимического разложения хлорида на аноде образуются молекулы хлора, а на катоде выделившийся натрий растворяется в ртути образуя амальгаму.
В лабораториях для получения хлора обычно используют процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия):
- 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
- K2Cr2O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2O
Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Согласно ГОСТ 6718-93 «Хлор жидкий. Технические условия» производятся следующие сорта хлора
| Наименование показателя ГОСТ 6718-93 | Высший сорт | Первый сорт |
|---|---|---|
| Объемная доля хлора, не менее, % | 99,8 | 99,6 |
| Массовая доля воды, не более, % | 0,01 | 0,04 |
| Массовая доля треххлористого азота, не более, % | 0,002 | 0,004 |
| Массовая доля нелетучего остатка, не более, % | 0,015 | 0,10 |
Применение
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:
- В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы.
 Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан.
Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан. - Отбеливающие свойства хлора известны с давних времен, хотя не сам хлор «отбеливает», а атомарный кислород, который образуется при распаде хлорноватистой кислоты: Cl
- Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасные для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов — гексахлорциклогексан (часто называемый гексахлораном). Это вещество впервые синтезировано ещё в 1825 г. Фарадеем, но практическое применение нашло только через 100 с лишним лет — в 30-х годах ХХ столетия.
- Использовался как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт, фосген.

- Для обеззараживания воды — «хлорирования». Наиболее распространённый способ обеззараживания питьевой воды; основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов катализирующие окислительно-восстановительные процессы. Для обеззараживания питьевой воды применяют: хлор, двуокись хлора, хлорамин и хлорную известь. СанПиН 2.1.4.1074-01 [1] устанавливает следующие пределы (коридор)допустимого содержания свободного остаточного хлора в питьевой воде централизованного водоснабжения 0.3 — 0.5 мг/л. Ряд учёных и даже политиков в России критикуют саму концепцию хлорирования водопроводной воды, но альтернативы дезинфицирующему последействию соединений хлора предложить не могут. Материалы, из которых изготовлены водопроводные трубы, по разному взаимодействуют с хлорированной водопроводной водой. Свободный хлор в водопроводной воде существенно сокращает срок службы трубопроводов на основе полиолефинов: полиэтиленовых труб различного вида, в том числе сшитого полиэтилена, большие известного как ПЕКС (PEX, PE-X).

- В пищевой промышленности зарегистрирован в качестве пищевой добавки E925.
- В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.
- В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
- Как индикатор солнечных нейтрино в хлор-аргонных детекторах.
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
Биологическая роль
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов.
У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения черезмембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена. Под воздействием ГАМК (нейромедиатор) ионы хлора оказывают тормозящий эффект на нейроны путём снижения потенциала действия. Вжелудке ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы представлены во многих типах клеток, митохондриальных мембранах и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объёма жидкости, трансэпителиальном транспорте ионов и стабилизации мембранных потенциалов, участвуют в поддержании рН клеток. Хлор накапливается в висцеральной ткани, коже и скелетных мышцах.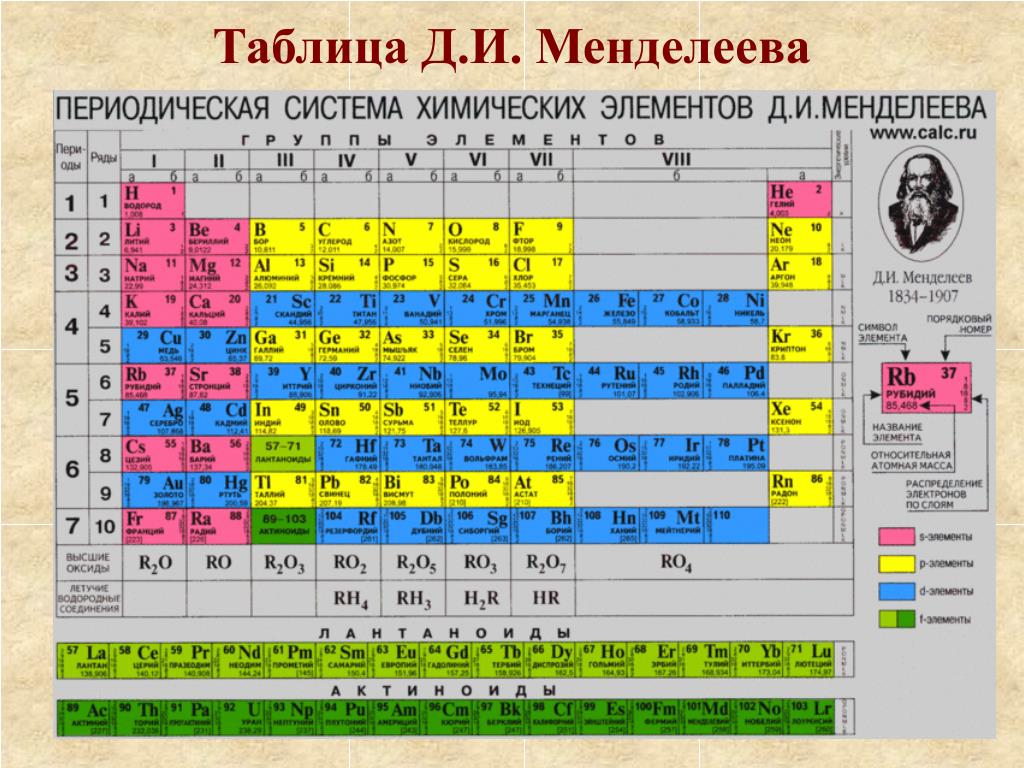 Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na+/K+ — АТФ-азы. В клетках аккумулируется 10-15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90-95 %), калом (4-8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно с HCO3− (кислотно-щелочной баланс).
Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na+/K+ — АТФ-азы. В клетках аккумулируется 10-15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90-95 %), калом (4-8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно с HCO3− (кислотно-щелочной баланс).
Человек потребляет 5-10 г NaCl в сутки. Минимальная потребность человека в хлоре составляет около 800 мг в сутки. Младенец получает необходимое количество хлора через молоко матери, в котором содержится 11 ммоль/л хлора. NaCl необходим для выработки в желудке соляной кислоты, которая способствует пищеварению и уничтожению болезнетворных бактерий. В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований. Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование. Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами, стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Хлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла, уменьшать активность фотосинтеза, задерживать рост и развитие растений.
Но существуют растения, которые в процессе эволюции либо приспособились к засолению почв, либо в борьбе за пространство заняли пустующие солончаки на которых нет конкуренции. Растения произрастающие на засоленных почвах называются — галофиты, они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредствомлистопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду притеняя поверхности от солнечного света.
Растения произрастающие на засоленных почвах называются — галофиты, они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредствомлистопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду притеняя поверхности от солнечного света.
Среди микроорганизмов, так же известны галофилы — галобактерии — которые обитают в сильносоленых водах или почвах.
Особенности работы и меры предосторожности
Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной растворомсульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.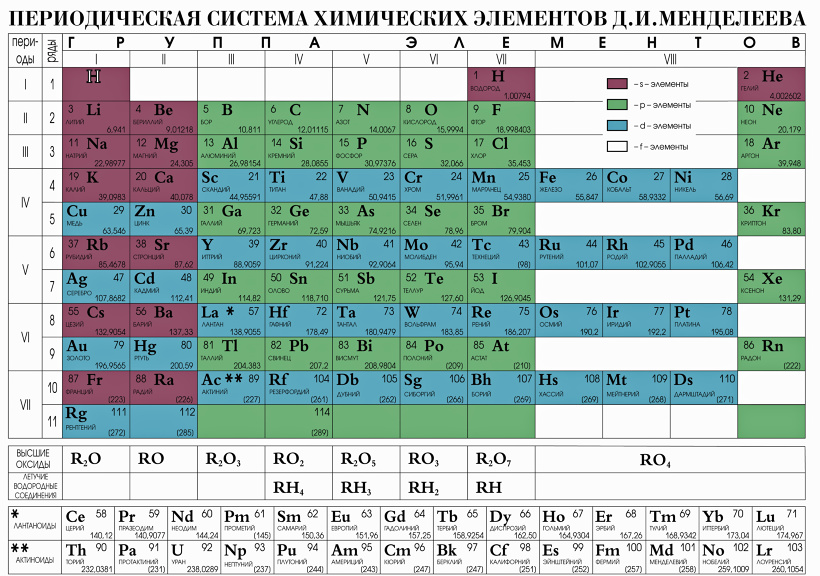
ПДК хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.
Хлор CL
1689 Просмотры 5 Понравилось Опубликовано: May 13th 2020
Всем известный хлор, название которого произошло от греческого слова «жёлто-зелёный», состоит в 17-й группе элементов периодической таблицы Менделеева и определяется условным символом Cl. Данный элемент является неметаллом, обладает химической активностью и принадлежит к группе галогенов. При стандартных условиях хлор представляет собой газ желто-зелёного цвета, обладающий токсическими свойствами. Он имеет массу, большую, чем масса воздуха. Определить наличие хлора в атмосфере можно по его резкому запаху, а также сладковатому привкусу металла, который он издаёт.
История открытия хлора
Впервые о хлоре заговорил британский учёный Джозеф Пристли в 1772 году, когда при опытах с водородом он впервые получил газообразный хлороводород. В «чистом» же виде данный газ был получен уже спустя два года химиком из Швеции Карлом Шееле. Именно он впервые отметил и описал специфический запах хлора, его способность вступать во взаимодействие с киноварью и золотом, а также открыл его легендарные свойства отбеливателя, которые активно используются человечеством и по сей день.
В «чистом» же виде данный газ был получен уже спустя два года химиком из Швеции Карлом Шееле. Именно он впервые отметил и описал специфический запах хлора, его способность вступать во взаимодействие с киноварью и золотом, а также открыл его легендарные свойства отбеливателя, которые активно используются человечеством и по сей день.
Название нового газа – хлорин – впервые было предложено в 1811 году, а уже через год было решено сократить его до слова «хлор». Оно прижилось, наряду с названием «галоген», которым, как уже было упомянуто ранее, стали позже именовать всю группу химических элементов, к которой принадлежал хлор.
Наличие хлора в природе
На земле можно обнаружить два изотопа хлора – это хлор 35Cl и хлор 37Cl. Что же касается состава земной коры, то в ней хлор является наиболее распространённым галогеном. Так как этот элемент очень активен, он так или иначе соединяется практически со всеми элементами периодической таблицы. В природе его можно найти в составе таких минералов, как галит, бишофит, сильвин и др.
Наибольший запас хлора находится в воде морей и океанов. Содержится этот немаловажный биогенный элемент и в организме человека и животных: в основном он присутствует в межклеточных жидкостях и активно участвует в протекании процессов осмотического равновесия и деятельности клеток нервной системы. Также хлор наличествует в желудке, способствуя вырабатыванию в нём соляной кислоты, формируя благостную среду для работы ферментов желудочного сока, поддерживает регулирование объёма жидкости, рН клеток и др.
Как правило, человек потребляет в среднем около 3-9 граммов NaCl в сутки, что покрывает его потребность в этом химическом элементе с избытком, так как необходимый минимум потребления хлора организмом составляет приблизительно 800 мг в сутки. Ионы хлора требуются и для поддержания жизнедеятельности растений. В нужных пропорциях хлор принимает участие в их энергообмене, стимулирует фотосинтез, потребление корнями кислорода и минеральных веществ и т. д.
Токсические свойства хлора
Как уже было сказано, хлор является газом, обладающим сильной токсичностью: при попадании в лёгкие человека он порождает ожог лёгочной ткани и удушье. Не случайно именно хлором пользовалась ещё во времена Первой мировой войны фашистская Германия, применяя этот газ как во время военных сражений, так и при уничтожении пленных. На дыхательные пути хлор оказывает раздражающее влияние уже при концентрации в воздушных массах 1-6 мг/м³. При концентрации 12 мг/м³ хлор переносится тяжело, а содержание этого газа более 100 мг/м³ представляет опасность для жизни. Таким образом, установлено, что предельно допустимой дозой хлора в атмосфере может являться промежуток от 0.03 до 1 мг/м³ (среднесуточная и максимальная в производственных помещениях. При работе с хлором необходимо использовать средства индивидуальной защиты – спецодежду, перчатки, противогаз. В случае краткосрочного контакта органы дыхания можно защитить, приложив к носу ткань, пропитанную раствором сульфита или тиосульфата натрия.
Не случайно именно хлором пользовалась ещё во времена Первой мировой войны фашистская Германия, применяя этот газ как во время военных сражений, так и при уничтожении пленных. На дыхательные пути хлор оказывает раздражающее влияние уже при концентрации в воздушных массах 1-6 мг/м³. При концентрации 12 мг/м³ хлор переносится тяжело, а содержание этого газа более 100 мг/м³ представляет опасность для жизни. Таким образом, установлено, что предельно допустимой дозой хлора в атмосфере может являться промежуток от 0.03 до 1 мг/м³ (среднесуточная и максимальная в производственных помещениях. При работе с хлором необходимо использовать средства индивидуальной защиты – спецодежду, перчатки, противогаз. В случае краткосрочного контакта органы дыхания можно защитить, приложив к носу ткань, пропитанную раствором сульфита или тиосульфата натрия.
Анализаторы содержания хлора
Так как хлор является токсичным, его содержание в атмосфере подлежит обязательному мониторингу. Определить концентрацию данного газа в воздушной среде помогают специализированные газоанализаторы хлора – хлорметры (хлориметры). Датчики хлора делятся на портативные, предназначенные преимущественно для бытового применения, и стационарные, служащие для промышленного мониторинга. Зачастую в совокупности с хлором, данные газоанализаторы способны улавливать критические значения и других опасных газов в воздушной среде. При превышении пороговых концентраций прибор издаёт тревожный сигнал.
Датчики хлора делятся на портативные, предназначенные преимущественно для бытового применения, и стационарные, служащие для промышленного мониторинга. Зачастую в совокупности с хлором, данные газоанализаторы способны улавливать критические значения и других опасных газов в воздушной среде. При превышении пороговых концентраций прибор издаёт тревожный сигнал.
На выявлении концентрации хлора в жидкой среде (свободного и/или общего) специализируются фотометры, принцип действия которых основан на определении коэффициентов пропускания и оптической плотности жидких образцов. Зачастую они обладают вспомогательным измерительным потенциалом рН метров, также широко используемых при оценке качества и безопасности воды и другой жидкой среды. Кроме того, косвенно с измерением количества Сl в составе водной среды связан ОВП метр, так как он определяет, в частности, качество обеззараживания воды хлором, ориентируясь на значения её окислительно-восстановительного потенциала.
Хлор (Cl) — Периодическая таблица
Из Википедии, свободной энциклопедии Хлор — это химический элемент с символом Cl и атомным номером 17. Он также имеет относительную атомную массу 35,5. Хлор относится к группе галогенов (17) и является вторым по легкости галогеном после фтора. Он также имеет относительную атомную массу 35,5. Хлор относится к группе галогенов (17) и является вторым по легкости галогеном после фтора.Подробнее в Википедии | ||||||||||||||||||||||||||||||||||||||||||||||||
Хлор в периодической таблице | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbol | Cl | |||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number | 17 | |||||||||||||||||||||||||||||||||||||||||||||||
| Group | 17 | |||||||||||||||||||||||||||||||||||||||||||||||
| Period | 3 | |||||||||||||||||||||||||||||||||||||||||||||||
| Block | p | |||||||||||||||||||||||||||||||||||||||||||||||
| Element category | Nonmetal | |||||||||||||||||||||||||||||||||||||||||||||||
Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при н.п.п.0083 3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic weight | 35.45 u | |||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 171.6 K -101.55 °C -150.79 °F | |||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 239. 11 K 11 K -34.04 °C – 29,272 ° F | |||||||||||||||||||||||||||||||||||||||||||||||
Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||||||||
| Электронигатирование (Scale Pauling) | 3.16 | |||||||||||||||||||||||||||||||||||||||||||||||
| . Electron Electron.0013 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Степени окисления | −1, +1, +2, +3, +4, +5, +6, +7 (сильнокислотный оксид) | |||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
Electron configuration Elektronkonfiguration (shorthand) | [Ne] 3s 2 3p 5 | Electron configuration | 1s 2 2s 2 2p 6 3s 2 3p 5 | Electrons per shell | 2, 8, 7 | History Discovered | 1774 | Discovered by | Carl Wilhelm Scheele | Факты о хлоре – Хлор Элемент неожиданностиХлор — элемент с уникальными свойствами
Распространен на нашей планете и за ее пределами
Легко сочетается с образованием этих хорошо известных соединений, среди многих других
Откройте для себя все продукты, которые стали возможными благодаря химии хлора, в наших деревьях продуктов хлора и гидроксида натрия. Элемент рабочей лошадки с широким спектром важных примененийНиже приведены некоторые основные области применения хлора:
| |||||||||||||||||||||||||||||||||||||

 Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан.
Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан.

 Широко известный как обычная поваренная соль, хлорид натрия является важным компонентом рациона как людей, так и животных. Хлорид натрия является основным сырьем для получения хлора в химической промышленности.
Широко известный как обычная поваренная соль, хлорид натрия является важным компонентом рациона как людей, так и животных. Хлорид натрия является основным сырьем для получения хлора в химической промышленности. Магний не только используется для создания сплавов для производственных процессов, но также является четвертым наиболее распространенным элементом в организме человека и необходим для питания.
Магний не только используется для создания сплавов для производственных процессов, но также является четвертым наиболее распространенным элементом в организме человека и необходим для питания.